Тромбоцитопоэз и его регуляция – 36. Тромбоцитопоэз. Стадии, факторы и механизм регуляции. Причины и последствия тромбоцитопинии.
36. Тромбоцитопоэз. Стадии, факторы и механизм регуляции. Причины и последствия тромбоцитопинии.
Тромбопоэз, или тромбоцитопоэз — это разновидность гемопоэза, приводящая к образованию тромбоцитов. Тромбоциты являются безъядерными и лишёнными клеточных органелл осколками цитоплазмы мегакариоцитов. Единичный мегакариоцит, способен дать начало тысячам тромбоцитов.
*Попытался изобразить схему
ПСКК-КОЕ-ГЕММ: 1. КОЕ-ГЭ….эритроедный ряд. 2. КОЕ-ГМ…..КОЕ-Г: 1.КОЕ-Б…. 2. КОЕ-Э…. 3. КОЕ-Н…. миелобласты (Базоф., Эозин., Нейтроф.)…..промиелоциты(Базоф.,Эозиноф., Нейтроф.)…..миелоциты….метамиелоциты (юнные) …..палочкоядерные….сегментоядерные.
Тромбопоэтин стимулирует мегакариопоэз (мегакариоцитопоэз), процесс созревания и дифференцировки предшественников мегакариоцитов — CFU-Meg, мегакариобластов и промегакариоцитов. Выделившись, тромбопоэтин связывается со своим рецептором на мембране клеток-предшественников мегакариоцитов, так называемым c-mpl. После связывания тромбопоэтина с рецептором, внутриклеточная передача сигнала приводит к росту клеток-предшественников мегакариоцитов, их созреванию и дифференцировке, стабилизации клеточной мембраны, образованию тромбоцитарных гранул и демаркации цитоплазмы на области, предназначенные затем фрагментироваться, «отшнуроваться» от родительской клетки-мегакариоцита и стать зрелыми тромбоцитами. Эти «предтромбоцитарные области» затем фрагментируются в зрелые тромбоциты и отделяются (отслаиваются, отшнуровываются) от родительской клетки. Этот последний этап тромбоцитопоэза, непосредственное формирование и отшнуровка тромбоцитов от мегакариоцита, как было показано в экспериментах in vitro, не зависим от стимуляции тромбопоэтином, в отличие от процессов мегакариопоэза (размножения, созревания и дифференцировки предшественников мегакариоцитов).
Нормальное число тромбоцитов в крови варьирует от 150 до 400*107л. Широкие пределы колебаний свидетельствуют о том, что их число регулируется не жестко. Тромбоциты разнообразны по размерам, возрасту, плотности и функциональной активности. Число тромбоцитов коррелирует с количеством и плоидностыо мегакариоцитов, а их объем — с объемом мегакариоцитов.
Длительность жизни тромбоцитов составляет 10 дней. Ежедневно тромбоциты продуцируются в количестве 40*107л.
В регуляции мегакариоцитарной системы принимают участие различные факторы в зависимости от уровня дифференцировки клеток. Среди цитокинов, стимулирующих ранние этапы мегакариоцитопоэза, важную роль играют ИЛ-3, ГМ-КСФ и Мег-КСФ, продуцируемые клетками стромального окружения, почек, лимфоцитами и моноцитами. Они увеличивают число колоний мегакариоцитов в культуре и количество клеток в колониях. В то же время эти цитокины могут воздействовать и на зрелые мегакариоциты.
ИЛ-1 и Г-КСФ не являются непосредственными стимуляторами, но влияют на мегакариоцитопоэз синергично с другими цитокинами. Тромбопоэтин(ТРО), ИЛ-6, мегакариоцитарный стимулирующий фактор (MSF) индуцируют дифференцировку преимущественно зрелых морфологически распознаваемых мегакариоцитов, хотя также оказывают некоторое влияние на более ранние клетки.
К ингибиторам тромбоцитопоэза относятся ТРФ и тромбоцитарный ростовой фактор IV, входящие в состав гранул тромбоцитов. Оба эти цитокина усиливают митотическую активность фибробластов, а ТРФ/S является стимулятором коллагенового синтеза в костном мозге. Нарушения регуляции этих цитокинов приводит к тромбоцитопении и развитию фиброза костного мозга.
Тромбоцитопиния.
Тромбоцитопения – патологическое состояние, характеризующееся снижением количества тромбоцитов в кровяном русле до 140 000/мкл и ниже (в норме 150 000 – 400 000/мкл).
Причины развития тромбоцитопении можно разделить на 3 группы:
Уменьшение образования тромбоцитов.
Увеличение потребления или разрушения тромбоцитов.
Повышение захвата циркулирующих тромбоцитов в селезенке.
1.Уменьшение образования тромбоцитов обычно связано с патологией костного мозга. Наиболее частые причины снижения количества тромбоцитов в этом случае
Вирусные инфекции: краснуха, ветряная оспа, вирус Эпштейна – Барра – могут быть причиной тромбоцитопении у детей.
Апластическая анемия – в костном мозге нарушается образование всех клеток.
Ее причинами может быть ВИЧ, прием лекарственных препаратов (вальпроаты, хлорамфеникол).
Химиотерапия – подавляет костный мозг и нарушает образование тромбоцитов
Злокачественные заболевания крови и лимфатических узлов.
Метастазы опухолей другой локализации в костный мозг.
Дефицит витамина В12 и фолиевой кислоты
2. Увеличение потребления или разрушения тромбоцитов может быть связано с иммунными и неиммуными причинами:
Многие лекарства могут вызывать иммунологическую реакцию против тромбоцитов, при которой происходит разрушение тромбоцитов, приводящее к лекарственно – индуцированной тромбоцитопении.
Идиопатическая тромбоцитопеническая пурпура – аутоиммунная тромбоцитопения -состояние, при котором иммунная система атакует тромбоциты и разрушает их.
У детей она может возникнуть после вирусной инфекции.
Системные заболевания соединительной ткани (СКВ).
Переливание компонентов крови иногда вызывает иммунные реакции, приводящие к разрушению тромбоцитов.
Тромботическая тромбоцитопеническая пурпура и гемолитико – уремический синдром – вызывают неиммунную тромбоцитопению потребления.
HELLP – синдром (гемолиз, повышение активности печеночных ферментов и тромбоцитопения) может быть причиной тромбоцитопении при беременности.
ДВС – снндром.
Васкулиты могут вызывать повышенное разрушение тромбоцитов.
Тяжелые инфекции, септические состояния и тяжелые травмы могут быть причиной тромбоцитопении из-за повышенного потребления тромбоцитов.
Симптомы тромбоцитопении появляются при снижении уровня тромбоцитов до 20 000 в микролитре крови.
При этом на коже появляются мелкоточечные подкожные кровоизлияния (петехии). Их появление провоцируют трение одежды, сжатие кожи, незначительные ушибы. Петехии могут сливаться, образовывая более крупные гематомы. Часто они располагаются на ногах, передней стенке живота. Причина такого расположения – воздействие силы тяжести.
Более серьезными симптомами тромбоцитопении являются спонтанные кровотечения и кровоизлияния, возникающие при падении уровня тромбоцитов ниже 20 000 в микролитре крови. Могут быть кровотечения из десен, носа, желудочно–кишечные и маточные кровотечения.
Тромбоцитопения у беременных часто протекает бессимптомно, так как для нее не характерно снижение уровня тромбоцитов ниже 100 000 в микролитре крови. Чаще она возникает в 3 триместре беременности и не требует специального лечения. Опасность для жизни представляет HELLP – синдром. Он возникает как осложнение тяжелого гестоза в 3 триместре беременности и требует проведения неотложного лечения.
studfiles.net
Регуляция тромбоцитопоэза. Мегакариоцитостимулирующий фактор, второй тромбоцитопоэзстимулирующий фактор или тромбоцитопоэтин.
Известно, что тромбоциты образуются в результате фрагментации цитоплазмы мегакариоцитов. После нескольких митозов пролиферирующие мегакариоцитарные предшественники (КОЭ-Мгкц) перестают делиться и вступают в стадию эндомитоза – процесса редупликации ДНК без образования дочерних клеток.
В результате формируются популяции промегакариобластов. В процессе дальнейшей дифференциации с прогрессивным увеличением общего объема происходит созревание ядра и цитоплазмы. В последующем образуются мегакариобласты, промегакариоциты, зрелые гранулярные мегакариоциты и, наконец, мегакариоциты зрелые, способные продуцировать кровяные пластинки.
В настоящее время установлено, что мегакариоцитопоэз регулируется двумя специфичными гуморальными факторами на 2-х разных уровнях – на уровне клеток-предшественников и в фазе эндомитотического развития мегакариоцитов с их конечной дифференцировкой. Первое из указанных соединений носит наименование мегакариоцитостимулирующий фактор, второй тромбоцитопоэзстимулирующий
Тромбоцитопоэтин
по всей видимости, образуется печенью, почками и костным мозгом. По своей структуре это соединение является гликопротеидом с молекулярной массой около 36 кДа. На кафедре нормальной физиологии Читинской медицинской академии тромбоцитопоэтический фактор выделен непосредственно из тромбоцитов. Им оказался комплекс полипептидов с молекулярной массой менее 10 кДа.
Установлено, что тромбоцитопоэтины высвобождаются в циркулирующую кровь при снижении в ней числа кровяных пластинок. Тромбоцитопоэтин усиливает эндомитоз в незрелых мегакариоцитах, но прежде всего он ускоряет созревание цитоплазматических структур мегакариоцитов и синтез белков a-гранул.
Различают прямые и косвенные регуляторы тромбоцитопоэза.
К прямым регуляторам, стимулирующим образование кровяных пластинок, относятся ЛИФ, IL-3, IL-6, IL-7, IL-9, IL-11 и IL-13, эритропоэтин, а также GM-CSF, к косвенным – IL-1 a и b, IL-4, выполняющие функции модуляторов этого процесса. Особенно велика роль в стимуляции тромбоцитопоэза IL-11, который резко увеличивает содержание тромбоцитов в крови, что обусловлено стимуляцией их предшественников.
В отличие от интерлейкинов, интерфероны способны тормозить продукцию тромбоцитов.
На мегакариоцитопоэз оказывают влияние медиаторы и гормоны. Так, адреналин ускоряет образование мегакариоцитов. Гормоны коры надпочечника стимулирует пролиферацию клеток предшественников мегакариоцитов и образование тромбоцитов.
alexmed.info
Структура и функции тромбоцитов. Регуляция Тромбоцитопоэза.
Структура и функции тромбоцитов
text_fields
text_fields
arrow_upward
Кровяные пластинки образуют главную линию обороны организма против внезапных потерь крови. Они аккумулируются почти тотчас в месте повреждения кровеносных сосудов и закупоривают их вначале временной, а затем постоянной тромбоцитарной пробкой, облегчают превращение фибриногена в фибрин в поврежденном участке.
Циркулирующие в крови тромбоциты имеют дисковидную форму, диаметром от 2 до 5 мкм, объемом 5- 10 мкм3. Тромбоциты оказались весьма сложным клеточным комплексом, представленным системами мембран, микротрубочек, микрофиламентом и органелл. Используя технику, позволяющую разрезать распластанный тромбоцит параллельно поверхности, в клетке выделяют несколько зон: периферическую, золя-гель, внутриклеточных органелл (рис.6.4.).
 Рис.6.4. Ультраструктурная организация тромбоцита.
Рис.6.4. Ультраструктурная организация тромбоцита.Сечение параллельное горизонтальной плоскости.
ЕС — периферическая зона тромбоцита,
СМ — трехслойная мем-брана,
SMF — субмембранный филомент,
МТ— микротрубочки,
Gly — гликоген.
Зона органнелл — М — митохондрии,
G — гранулы,
DB — плотные гранулы,
DTS — система плотных трубочек,
CS — система открытых канальцев.
На наружной поверхности периферической зоны располагается покров, толщиной до 50 нм, содержащий плазматические факторы свертывания крови, энзимы, рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеивания к субэндотелию) и агрегации (приклеиванию друг к другу). Так, мембрана тромбоцитов содержит «мембранный фосфолипидный фактор 3» — «фосфолипидную матрицу», формирующую активные коагуляционные комплексы с плазменными факторами свертывания крови. Мембрана богата также арахидоновой кислотой, поэтому важным ее компонентом является фермент — фосфолипаза А,, способная образовывать свободную арахидоновую кислоту для синтеза простагландинов, из метаболитов которых формируется короткоживущий агент — тромбоксан А2, вызывающий мощную агрегацию тромбоцитов. Активация фосфолипазы А2 в мембране тромбоцита осуществляется при ее контакте с коллагеном и фактором Виллебранда — адгезивными белками субэндотелия, обнажающимися при повреждении эндотелия сосудов.
Гликопротеины I, II, III, IV, V.
text_fields
text_fields
arrow_upward
В липидный бислой мембраны тромбоцитов встроены гликопротеины I, II, III, IV, V.
Гликопротеин I состоит из субединиц — Iа, Iв, Iс. Iа — рецептор, ответственный за адгезию тромбоцитов к коллагену субэндотелия. Комплекс «Iв — фактор свертывания крови IX» на поверхности кровяных пластинок выполняет функцию рецептора для фактора Виллебранда, что также необходимо для адгезии пластинок на субэндотелии. Iс обеспечивает связывание с еще одним адгезивным белком субэндотелия — фибронектином, а также распластывание пластинки на субэндотелии.
Гликопротеин II состоит из субединиц IIа и IIв, необходимых для всех видов агрегации тромбоцитов.
Гликопротеин IIа с гликопротеином IIв образуют Са-зависимый комплекс, связывающий на тромбоцитах фибриноген, что обеспечивает дальнейшую агрегацию тромбоцитов и ретракцию (сокращение) сгустка.
Гликопротеин V гидролизируется тромбином, поддерживает агрегацию тромбоцитов. Снижение в мембране тромбоцитов содержания различных субединиц гликопротеинов I-V вызывает повышенную кровоточивость.
К нижнему слою периферической зоны прилегает зона золягеля гиалоплазмы, в свою очередь отделяющая зону внутриклеточных органелл. В указанной зоне вдоль края клетки располагается краевое кольцо микротрубочек, контактирующее с микрофиламентом, представляющим сократительный аппарат тромбоцита. При стимуляции тромбоцита кольцо микротрубочек, сокращаясь, смещает гранулы к центру клетки («централизация гранул»), сжимает их, вызывая секрецию содержимого наружу через систему открытых канальцев. Сокращение кольца микротрубочек позволяет тромбоциту также образовывать псевдоподии, что увеличивает его способность к агрегации.
Альфа-гранулы I и II типа
text_fields
text_fields
arrow_upward
Зона органелл тромбоцитов содержит плотные гранулы, альфа-гранулы I и II типов. В плотных гранулах находятся АДФ, АТФ, кальций, серотонин, норадреналин и адреналин. Кальций участвует в регуляции адгезии, сокращении, секреции тромбоцита, активации его фосфолипаз и, следовательно, продукции эндоперекиси, простагландинов, в ходе дальнейших превращений которых образуется тромбоксан А,. АДФ секретируется в больших количествах при адгезии тромбоцитов к стенке сосуда и способствует прикреплению циркулирующих тромбоцитов к адгезированным, тем самым поддерживая рост тромбоцитарного агрегата. Серотонин (5-гидроксит-риптамин) секретируется тромбоцитом во время «реакции освобождения гранул» и обеспечивает вазоконстрикцию в месте повреждения.
Альфа-гранулы I типа содержат антигепариновый фактор пластинок 4, фактор роста тромбоцитов, тромбоспондин (гликопротеин G) и др. Антигепариновый фактор тромбоцитов 4 секретируется тромбоцитами под влиянием АДФ, тромбина, адреналина, сопровождая агрегацию тромбоцитов. Тромбоспондин образует комплекс с фибриногеном на поверхности активированных тромбоцитов, необходимый для формирования тромбоцитарных агрегатов. Тромбоцитарный ростковый фактор (ТРФ) — полипептид, стимулирующий рост гладких мышц сосудов и фибробластов, восстановление сосудистой стенки и соединительной ткани. Благодаря его свойствам, кровяные пластинки поддерживают целостность сосудистой стенки. Больные с тромбоцитопенией имеют сниженную устойчивость стенки капилляра, поэтому петехии (точечные кровоизлияния в коже) появляются вслед за легкими травмами или изменением давления крови. Петехии вызваны слущиванием эндотелия капилляров. В нормальных условиях возникший дефект устраняется пластинками, секретирующими ТРФ.
Альфа-гранулы II типа содержат лизосомальные энзимы (кислые гидролазы). Большая часть гранул исчезает после адгезии или агрегации тромбоцита. Этот феномен («реакция освобождения гранул») имеет место после активации тромбоцита различными соединениями — тром-боксаном А2, АДФ, адреналином, тромбином, протеолитическими энзимами, бактериальными эндотоксинами, коллагеном и др.
Тромбоцитопоэз и его регуляция
text_fields
text_fields
arrow_upward
Под тромбоцитопоэзом понимают процесс образования тромбоцитов в организме. В основном, он протекает в костном мозге и включает следующие этапы: колониеобразующая единица мегакариоцитарная (КОЕ-мег) -> промега-кариобласт -> мегакариобласт -> промегакариоцит -> зрелый мегака-риоцит -> тромбоцитогенный мегакариоцит -> тромбоциты (рис.6.5.).
 Рис.6.5. Схема дифференцировки клеток мегакариоцитарной серии.
Рис.6.5. Схема дифференцировки клеток мегакариоцитарной серии.СКК — стволовая кроветворная клетка; КОЕгммэ — КОЕгрануло-цитарно-мегакариоцитарно-моноцитарно-эритроцитарная; КОЕэрмег — КОЕэритроцитарно-мегакариоцитарная; КОЕмег — КОЕмегакариоцитарная; КОЕмег-1 — менее диффе-ренцированная; КОЕмег-2 — более дифференцированная клетка; 0.07, 0.48, 0.74 — вероятность вовлечения клетки-предшественни-цы в мегакариоцитарную дифференциацию.
Истинные митозы, т.е. деление клеток, присущи только КОЕ-мег. Для промегакариобластов и мегакариобластов характерен эндомитоз (глава I), т.е. удвоение ДНК в клетке без ее деления. После остановки эндомитоза, в основном после 8, 16, 32, 64-кратного удвоения ДНК, мегакариобласт начинает дифференциацию до тромбоцитарного мегакариоцита, образующего тромбоциты.
В костном мозге тромбоцитогенные мегакариоциты локализованы преимущественно на поверхности синусного эндотелия и их цитоплазматические отростки проникают в просвет синуса через эндотелий.
Одни из них проникают на 1-2 мкм в просвет синуса и фиксируют мегариоцит на эндотелии (функция «якоря»).
Второй тип отростков представлен вытянутыми цитоплазматическими лентами (до 120 мкм в длину), входящими в просвет синуса и получившими название протромбоцитов. Их количество у одного мегакариоцита может достигать 6-8. В просвете синуса цитоплазма протромбоцита после локальных сокращений разрывается, и он образует около 1000 тромбоцитов. В циркулирующее русло поступают и протромбоциты. Вышедшие в кровь протромбоциты достигают микроциркуляторного русла легких, где из них освобождаются тромбоциты. Поэтому количество тромбоцитов оказывается более высоким в легочных венах, чем в легочной артерии. Количество тромбоцитов, образовавшихся в легких, может достигать 7— 17% от массы тромбоцитов в крови.
У человека время полного созревания мегакариоцитов занимает 4-5 дней. Костный мозг человека содержит около 15 x 106 мегакариоцитов/кг веса тела. Дневная продукция тромбоцитов у человека 66000+14600 в 1 мкл крови. В среднем мегакариоцит высвобождает до 3000 тромбоцитов. Количество тромбоцитов в крови взрослого человека достигает 150-375 x 109л; у детей —150-250 x 109/л. Содержание тромбоцитов в крови взрослого ниже 150 x 109/л рассматривается как тромбоцитопения.
Общая популяция тромбоцитов представлена циркулирующими в крови (70%) и находящимися в селезенке (30%). Накопление тромбоцитов в селезенке происходит благодаря более медленному их движению через извилистые селезеночные корды и занимает до 8 минут. Сокращение селезенки (например, вызванное адреналином) освобождает пластинки в общий кровоток. Существование селезеночного депо тромбоцитов объясняет, почему их количество неизменно выше у спленэктомированных (с удаленной селезенкой) людей, чем у нормальных индивидуумов. У пациентов со спленомегалией (увеличенной селезенкой) значительная часть циркулирующих тромбоцитов медленно продвигается через увеличенную селезенку, количество пластинок в крови оказывается сниженным, возникает тяжелая тромбоцитопения.
Продолжительность жизни тромбоцитов человека колеблется от 6,9 до 9,9 дней. Их разрушение происходит, преимущественно, в костном мозге и, в меньшей степени, в селезенке и печени.
В плазме крови людей обнаружен колониестимулируюший фактор мегакариоцитарный (КСФ-мег), стимулирующий митозы и дифференциацию КОЕ- мег. Стимулом для его образования является истощение содержания мегакариоцитов и их предшественников в костном мозге.
Регуляция тромбоцитопоэза в фазу немитотического развития мегакариоцитов осуществляется другим гуморальным фактором — тромбопоэтином. Его количество в плазме повышается при усилении потребления тромбоцитов (воспаление, необратимая агрегация тромбоцитов). Тромбопоэтин необходим для полного созревания цитоплазмы мегакариоцитов, нормального формирования в ней тромбоцитов. Регуляция мегакариоwитопоэза включает и особые вещества — его гуморальные ингибиторы, угнетающие как пролиферативную, так и немитотическую стадии развития мегакариоцитов. Ингибитор деления КОЕ-мег выделен из активированных тромбоцитов. Это гликопротеин, массой в 12-17 кд. Источником ингибитора тромбоцитопоэза является, также, селезенка.
Читайте также:
doctor-v.ru
7.8.2. Лейкопоэз. Тромбоцитопоэз
Лейкоцитопоэз и тромбоцитопоэз менее изучены, чем эритропоэз. Лейкопоэз находится в прямой зависимости от распада лейкоцитов: чем больше их распадается, тем больше образуется. Считается, что все лейкоциты образуются в красном костном мозгу из единой стволовой клетки, между тем родоначальницей миелопоэза (образование гранулоцитов, тромбоцитов и эритроцитов) является клетка—предшественница, или гранулоцитарно—моноцитарная бипотенциальная колониеобразующая единица. Для ее роста и дифференцировки необходим особый колониестимулирующий фактор (КСФ). Вырабатывается он моноцитарно—макрофагальными клетками, лимфоцитами и костным мозгом. Фактор является гликопротеидом и состоит из двух частей — стимулятора продукции эозинофилов и стимулятора продукции нейтрофилов и моноцитов. Оба они относятся к ранним гемопоэтическим ростовым факторам. Содержание их стимулируется Т—хелперами и подавляется Т—супрессорами.
В регуляции лейкопоэза важную роль играют интерлейкины (табл. 7.5). Они не только стимулируют гемопоэз, но, например, ИЛ—3 является фактором роста и развития базофилов, а ИЛ—5 необходим для роста и развития эозинофилов, ИЛ—2, ИЛ—4, ИЛ—6, ИЛ—7 кроме того еще и для дифференцировки Т— и В—лимфоцитов.
Известны два типа агранулоцитарных резервов лейкоцитов — сосудистый и костномозговой. Первый представляет собой большое количество гранулоцитов, расположенных вдоль стенок сосудистого русла, откуда они мобилизуются при повышении тонуса симпатической нервной системы. Число клеток второго, т. е. костномозгового гранулоцитарного резерва примерно в 50 раз превышает их количество в кровотоке. Как известно, лейкоциты являются наиболее «подвижной» частью крови, быстро реагирующей на различные изменения в окружающей среде и организме развитием лейкоцитоза, что и обеспечивается благодаря существованию двух типов клеточного резерва. Стимулирующее влияние на лейкопоэз оказывают нуклеиновые кислоты, гормоны гипофиза. Лейкопоэз возрастает также под влиянием продуктов распада тканей, микроорганизмов и их токсинов (см. рис. 7.9). Полагают, что эти вещества оказывают действие не прямо, а путем стимуляции лейкопоэтинов, которые «вмешиваются» в процесс дифференциации клеток костного мозга. Разрушение и появление новых лейкоцитов происходит непрерывно. Жизненный срок их различен. Они живут часы, дни, недели, часть лейкоцитов не исчезает на протяжении всей жизни
Та б л и ц а 7.5
Специфические гемопоэтические факторы роста
Название | Происхождение | Клетки—мишени |
Тимозин | Тимус | Предшественники Т—лимфоцитов |
Тимопоэтин | Тимус | |
Спленин | Селезенка | Предшественники В—лимфоцитов |
Интерлейкин—1 | Макрофаги | Лимфоциты и их предшественники |
Интерлейкин—2 | Т—индукторы | Т—лимфоциты |
Интерлейкин—3 | Т—лимфокиновые клетки (моноциты?) | Гемопоэтические стволовые клетки |
Факторы роста В—клеток | Т—хелперы | В—лимфоциты |
КСФ (колониестимулирующие факторы) | Лимфоциты, макрофаги и т. д. | Предшественники моноцитов и гранулоцитов |
Эритропоэтин | Почки, печень (макрофаги?) | Предшественники эритроцитов |
Тромбоцитопоэтин | Почки | Предшественники мегакариоцитов |
человека или животного. Местом разрушения лейкоцитов является слизистая оболочка пищеварительного тракта, а также ретикулярная ткань.
Физиологическим регулятором процесса тромбоцитопоэза являются тромбоцитопоэтины (см. табл. 7.5). Химически они связаны с высокомолекулярной белковой фракцией, относящейся к γ—глобулинам. В зависимости от места образования и механизма действия различают тромбоцитопоэтины короткого и длительного действия. Первые образуются в селезенке, усиливают отшнуровку кровяных пластинок от мегакариоцитов и ускоряют их поступление в кровь. Они способствуют переходу предшественников гигантских клеток костного мозга в зрелые мегакариоциты. На активность тромбоцитопоэтинов непосредственное влияние оказывают ИЛ—6, ИЛ—11. Вторые содержатся в плазме крови и стимулируют образование тромбоцитов в костном мозгу. Особенно интенсивно тромбоциты вырабатываются после кровопотерь. Спустя несколько часов число их может удвоиться.
Фактов, свидетельствующих о существовании специализированной системы, регулирующей кроветворение, не существует. Однако обильная иннервация кроветворных тканей, наличие в них большого числа интероцепторов указывают на то, что эти органы включены в систему рефлекторных взаимодействий. Впервые идея нервной регуляции кроветворения и перераспределения форменных элементов крови была высказана С. П. Боткиным. Позднее это положение получило дальнейшее развитие в разнообразных методических условиях и было экспериментально подтверждено В. Н. Черниговским и А. Я. Ярошевским, показавшими наличие двусторонних связей кроветворных органов с центральными структурами нервной системы и возможность условнорефлекторного вызова гемопоэза.
studfiles.net
ТРОМБОЦИТОПОЭТИНЫ — Большая Медицинская Энциклопедия
ТРОМБОЦИТОПОЭТИНЫ (тромбоцит[ы] + греч. poietikos создающий, производящий) — гуморальные вещества, стимулирующие образование тромбоцитов.
Ямамото (Yamamoto) в 1957 г., изучая действие сыворотки крови, взятой у людей после кровопотери, на гемопоэз кроликов, установил, что в крови кроликов наблюдается повышение числа тромбоцитов (см).
Он предположил, что в сыворотке крови людей содержится гуморальный фактор, стимулирующий тромбоцитопоэз (см. Кроветворение). Этот фактор получил название тромбоцитопоэтина.
В дальнейшем присутствие Т. в крови было установлено в эксперименте у животных после введения им антитромбоцитарной сыворотки, после спленэктомии (см.), при тромбоцитаферезе (см. Плазмаферез), асептическом воспалении, воздействии ионизирующего излучения. Т. были обнаружены также в норме в сыворотке и плазме крови, в моче, в экстрактах селезенки, лимф, узлов, печени. В клин, условиях Т. чаще всего обнаруживают у больных с тромбоцитопенией (см.).
Одним из факторов регуляции содержания Т. является количество циркулирующих тромбоцитов (отмечена обратная зависимость Т. от количества циркулирующих тромбоцитов: чем больше количество тромбоцитов, тем ниже содержание Т. и наоборот). В эксперименте было показано, что Т. появляются в крови раньше, чем отхмечаются морфол. изменения клеток тромбоцитопоэза. Интенсивность изменений тромбоцитопоэза находится в прямой зависимости от дозы и продолжительности введения Т. Другие показатели крови и костного мозга при этом существенно не изменяются.
Наличие Т. в организме определяется большинством исследователей косвенно, по увеличению числа тромбоцитов в крови. Чаще всего применяется метод Келемена и соавт. Мышам весом 20 г вводят однократно в хвостовую вену испытуемый материал (сыворотка крови больных тромбоцитопенией) в объеме 0,2 мл\ тромбоциты подсчитывают до его введения и спустя 48 час. Реакция считается положительной, если число тромбоцитов увеличивается на 30% и более. Другой метод исследования Т. основан на определении размеров тромбоцитов. Показано, что вновь образованные тромбоциты имеют большие размеры, чем «старые». Появление тромбоцитов больших размеров является признаком стимуляции тромбоцитопоэза. В наст, время для определения Т. применяют меченые препараты — радиосульфат (85S) и селенометионин (75Se), к-рые вводят внутривенно. Включаясь в развивающиеся мегакариоциты, они появляются во вновь образованных тромбоцитах. При стимуляции тромбоцитопоэза наблюдается увеличение числа меченых тромбоцитов.
Природа Т. изучена недостаточно, в химически чистом виде они не выделены. По данным ряда исследователей, Т.—- вещества белковой природы, не диализируются, перевариваются трипсином, чувствительны к нагреванию, разрушаются при хранении, при электрофорезе мигрируют в глобулиновой фракции. Фракцию, содержащую Т., можно выделить из крови, полученной после кровопускания; она содержит три аминокислоты (аланин, серин, валин), в ее состав входит глицерол и две жирные к-ты. Нек-рые исследователи считают, что Т. относятся к липидам, термостабильны, не теряют активность при pH 5,5. Поэтому не исключено наличие нескольких тромбоцитопоэтически активных факторов, обладающих стимулирующим действием на пролиферативную активность мегакариоцитов, их созревание и выход тромбоцитов из костного мозга в кровь.
Вопрос о месте образования Т. в наст, время окончательно не решен. Однако ряд исследователей считают основным местом их образования селезенку и печень; имеются данные об образовании их в костном мозге.
Т., по-видимому, оказывают влияние на кроветворную ткань. Большинство исследователей считают, что Т. действуют на стволовую клетку костного мозга, чувствительную к Т., стимулируя ее дифференцировку в направлении тромбоцитопоэза.
Библиогр.: Абесадзе А. И., Воробьев О. Я. и Иосава Г. Г. Регуляция тромбоцитопоэза, Тбилиси, 1978; Кахетелидзе М. Г. Эндогенные регуляторы тромбоцитопоэза, Пат. физиол. и эксперим. тер., № 2, с. 84, 1975; Маркосян А. А. и Путин-ц е в а Е. Г. Тромбоцитопоэтины, Усп. физиол. наук, т. 1, № 1, с. 55, 1970; М о-сягина E. Н. и Кахетелид-з е М. Г. Тромбоцитопоэз, в кн.: Нормальное кроветворение и его регуляция, под ред. Н. А. Федорова, с. 489, М., 1976; Цыганкова В. А. и Рудаков И. А. Методы исследования тромбоцитопоэтической активности крови, Ла-борат. дело, № 2, с. 94, 1972; К r i z-s a F., G e r g e 1 у G. a. R a k K. Megakaryocyte response in posthaemorrhegic thrombocytosis o! mice, Acta haemat. (Basel), v. 39, p. 112, 1968; McDonald T. P. The hemagglutination-inhi-bition assay for thrombopoietin, Blood, Y. 41, p. 219, 1973; Odell T. T. Regulation of the megakaryocyte-platelet system, в кн.: Regulation of organ and tissue growth, ed. by R. J. Goss, p. 187, N. Y.— L., 1972; Schulman I. a. o. Studies on thrombopoiesis, II. Assay of human plasma thrombopoietic activity, J. Pediat., v. 66, p. 604, 1965; Steinberg B. a. o. Thrombocytic and thrombopenic factors in normal human serum, Acta haemat. (Basel), v. 33, p. 341, 1965.
Т. А. Пригожина.
xn--90aw5c.xn--c1avg
Лимфоцитопоэз, моноцитопоэз, тромбоцитопоэз, мегакариоцит
На рисунке ниже показано формирование и созревание лимфоцитов, моноцитов и кровяных пластинок. Стрелками указано направление этих преобразований.

ЛИМФОЦИТОПОЭЗ
Из полипотентной гемопоэтической стволовой клетки происходит общая клетка-предшественница лимфоцитопоэза (КПЛ). Как и другие предшественницы, эта клетка не имеет специфических морфологических характеристик, хотя обладает большой способностью к преобразованиям. После деления класс лимфоидных стволовых клеток (СК-Л), определяющих образование популяции Т-лимфоцитов, покидает костный мозг и мигрирует в кору тимуса, где имеется очень специфичная микросреда, в которой СК-Л превращаются в Т-лимфоциты.
Некоторые из лимфоидных стволовых клеток, предназначенных для превращения в В-лимфоциты, остаются в костном мозге, где и возобновляют свою популяцию. Они дифференцируются в большие клетки — В-лимфобласты (Лб). Это слегка базофильные клетки, имеющие крупное округлое ядро и умеренно развитые органеллы. Дальнейшее деление лимфобласта дает начало молодым В-лимфоцитам (В-Ли), которые созревают, превращаясь в маленькие зрелые В-лимфоциты (В-Л). Морфологически В- и Т-лимфоциты напоминают стволовые клетки, и поэтому неудивительно, что оба эти вида лимфоцитов способны к последующей дифференцировке.
Из В-лимфоцитов возникают, пройдя стадию плазмобласта, плазматические клетки (ПК) и В-клетки памяти; из Т-лимфоцитов происходят следующие виды лимфоцитов: супрессоры, хелперы, киллеры и Т-клетки памяти. Большинство В-лимфоцитов циркулирует в крови и заканчивает свою дифференцировку и созревание в селезенке, лимфатических узлах и аналогах сумки Фабриция.
МОНОЦИТОПОЭЗ
Он начинается с образования промонобласта (Пмб) из общей стволовой клетки для гранулоцитопоэза, эритроцитопоэза, моноцитопоэза и мегакариоцитопоэза (КОЕ-С). Промонобласт — это большая, слегка базофильная клетка с крупным круглым ядром и плохо развитыми органеллами. После деления из промонобластов образуются монобласты (Мб) — клетки с почкообразным ядром и несколькими азурофильными гранулами. Из монобластов после деления образуются моноциты (Мц), которые выходят в кровеносное русло.
ТРОМБОЦИТОПОЭЗ
Образование кровяных пластинок начинается с развития мегакариобластов (Мкб) из КОЕ-С. В результате последовательного эндомитотического увеличения ДНК ядра, мегакариобласт превращается в крупную полиплоидную клетку — промегакариоцит (не показан) и в конечном счете в тромбоцитформирующий мегакариоцит (Мкц). Цитоплазма мегакариоцита фрагментируется через отверстия эндотелия (Энд) кровеносного синусоидного капилляра, давая начало примерно 2000 кровяных пластинок (П). Процесс трансформации из стволовой клетки до кровяной пластинки занимает около 10 дней.
 КОЕ-С является общей стволовой клеткой для фанулоцитопоэза, эритроцитопоэза, моноцитопоэза и мегакариоцитопоэза, она также называется некоторыми авторами КОЕ-ГЭММ.
КОЕ-С является общей стволовой клеткой для фанулоцитопоэза, эритроцитопоэза, моноцитопоэза и мегакариоцитопоэза, она также называется некоторыми авторами КОЕ-ГЭММ.
МЕГАКАРИОЦИТ
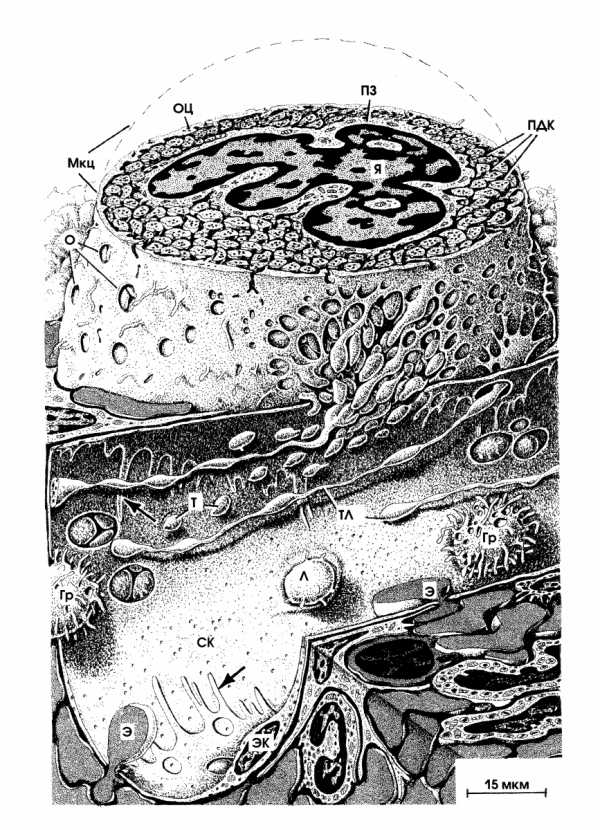
Поперечный срез мегакариоцита (Мкц) на следующем рисунке, позволяет рассмотреть его строение.
Мегакариоцит — это огромная клетка, имеющая диаметр около 100 мкм, с очень большим, сегментированным полиплоидным ядром (Я). Ядро мегакариоцита включает в себя несколько ядрышек. Столь огромная клетка содержит не малое количество цитоплазмы, в которой можно выделить две зоны:
1. Перинуклеарная зона (ПЗ), включающая сложный комплекс Гольджи, множество центриолей, большую часть митохондрий и гранулярную эндоплазматическую сеть;
2. Периферическая зона с многочисленными плотными гранулами. Она делится на сегменты цитоплазмы пластинчатыми демаркационными каналами (ПДК). Сегменты периферической зоны цитоплазмы в будущем становятся тромбоцитами, содержащими несколько плотных гранул. Диаметр будущих клеток около 2—4 мкм.
Через тонкий периферический ободок цитоплазмы (ОЦ) демаркационные каналы достигают периферии клетки, создавая шероховатость на поверхности мегакариоцита. Отверстия (О), образующиеся в некоторых ее участках, позволяют наблюдать за фрагментированной цитоплазмой во внутренней части клетки.
Мегакариоцит тесно прилегает к стенке кровеносного синусоидного капилляра (СК). Через имеющиеся отверстия в эндотелии цитоплазма мегакариоцита фрагментируется на тромбоциты (Т) и длинные тромбоцитарные ленты (ТЛ). Тромбоцитарные ленты затем делятся в кровеносном русле на отдельные кровяные пластинки.
Помимо строения мегакариоцита, рисунок также показывает проникновение в кровоток лимфоцита (Л), двух гранулоцитов (Гр) и двух эритроцитов (Э). Стрелками обозначены границы эндотелиальных клеток (ЭК), образующих кровеносный синус.
tardokanatomy.ru
тромбопоэтин | Патологическая анатомия и гематология
В организме человека процесс образования тромбоцитов — тромбоцитопоэза регулируется по обратному принципу: в организме учитывается именно число клеток тромбоцитов, а не их функциональная активность. Заболевание — тромбоцитопения разного генеза сопровождается возрастанием выработки вещества, которое называется тромбопоэтин – гормона, усиливающего амплификацию предшественников мегакариоцитов и ускоряющего их полиплоидизацию. Предполагают, что основным местом, где продуцируется тромбопоэтин, является печень, однако анализ показал, что некоторое его количество синтезируется в почках, селезенке и в клетках стромы костного мозга. В нормальной сыворотке концентрация тромбопоэтина очень низкая – от 0,5 до 2 пмоль/л (именно поэтому его не удавалось выделить почти 40 лет).
Концентрация тромбопоэтина в сыворотке крови коррелирует с количеством тромбоцитов и активностью мегакариоцитов. При тромбоцитопениях повышенная выработка тромбопоэтина в печени и почках
не обусловлена изменением уровня его транскрипции. Механизмы регуляции уровня экспрессии его в костном мозге пока не ясны. Продукция тромбопоэтина может регулироваться на уровне трансляции, например за счет альтернативного сплайсинга. Сплайсинг – вырезание не кодирующих белок частей РНК, в результате чего РНК приобретает окончательную форму, используемую при синтезе на ней белка. Тромбопоэтин связывается тромбоцитами через рецептор MPL. У мышей, дефицитных по MPL, сильно уменьшено число тромбоцитов и соответственно увеличен уровень тромбопоэтина в сыворотке крови. Есть данные, что у больных с реактивным тромбоцитозом уровень тромбопоэтина в сыворотке крови непропорционально высок для наблюдаемого числа тромбоцитов. Следовательно, можно предположить, что продукция тромбопоэтина может регулироваться независимо от содержания тромбоцитов.
pathanatom.ru
