Стволовые полипотентные клетки – дифференцировка, стволовые клетки, тотипотентность клеток и ядер | Глава 1. Введение в цитологию | Читать онлайн, без регистрации
Индуцированные стволовые клетки — Википедия
Материал из Википедии — свободной энциклопедии
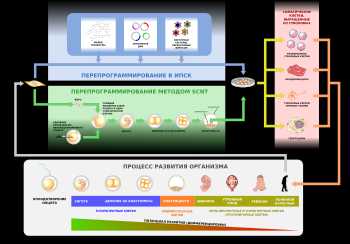 Онтогенез начинается от одной клетки — зиготы. Зигота и каждый из бластомеров эмбриона на ранней стадии являются тотипотентными с потенциалом развития в целый организм. По мере развития потенциал бластомеров последовательно снижается сначала до плюрипотентных, затем до мультипотентных и унипотентных и, в конце концов, до терминально дифференцированных соматических клеток. Тем не менее, потенциал развития соматических клеток может быть восстановлен до тотипотентной стадии методом пересадки ядер, взятых из соматических клеток, в яйцеклетку, из которой предварительно удалено ядро (SCNT)[1] или перепрограммированием до плюрипотентного состояния — например, с помощью факторов Яманаки (Oct4, Klf4, Sox2 и c-Myc)[2], РНК[3] или малых молекул[4].
Онтогенез начинается от одной клетки — зиготы. Зигота и каждый из бластомеров эмбриона на ранней стадии являются тотипотентными с потенциалом развития в целый организм. По мере развития потенциал бластомеров последовательно снижается сначала до плюрипотентных, затем до мультипотентных и унипотентных и, в конце концов, до терминально дифференцированных соматических клеток. Тем не менее, потенциал развития соматических клеток может быть восстановлен до тотипотентной стадии методом пересадки ядер, взятых из соматических клеток, в яйцеклетку, из которой предварительно удалено ядро (SCNT)[1] или перепрограммированием до плюрипотентного состояния — например, с помощью факторов Яманаки (Oct4, Klf4, Sox2 и c-Myc)[2], РНК[3] или малых молекул[4].Индуцированные стволовые клетки (иСК) — стволовые клетки, полученные из каких-либо иных (соматических, репродуктивных или плюрипотентных) клеток путём эпигенетического перепрограммирования. В зависимости от степени дедифференцировки клетки при перепрограммировании различают: индуцированные тотипотентные, индуцированные плюрипотентные стволовые клетки (ИПСК) и получаемые так называемым прямым перепрограммированием или каким-либо иным способом
В настоящее время существует три пути перепрограммирования соматических клеток в плюрипотентные стволовые клетки[6]:
- пересадка ядер, взятых из соматических клеток, в оплодотворенную яйцеклетку, из которой предварительно удалено ядро
ru.wikipedia.org
1).Стволовые клетки. Тотипотентные, плюрипотентные, унипотентные, полипотентные.
Стволовые клетки. Тотипотентные, плюрипотентные, унипотентные, полипотентные.
Стволовыми клетками эмбриона, плода или взрослого организма считаются клетки, способные длительное время воспроизводить себе подобных и в течение жизни давать начало специализированным клеткам, образующим разные ткани организма.
Тотипотентная клетка обладает потенциалом дать начало всем специализированным клеткам, формирующим ткани эмбриона и обеспечивающим его развитие. Например, зигота и бластомеры по всем признакам относятся к тотипотентным клеткам.
Плюрипотентные клетки дифференцируются в разные полипотентные клетки всех трех зародышевых листков-экто-,энто- и мезодермы. Клетки внутренней клеточной массы бластоцисты относятся к плюрипотентным клеткам.
Стволовые клетки взрослого организма выделены из красного костного мозга, периферической крови, пульпы зуба, спинного и головного мозга, кровеносных сосудов, скелетной мышцы, эпителия кожи и пищеварительной системы, роговицы и сетчатки глаза, печени и поджелудочной железы. Это полипотентные клетки, потомки которых дают начало ограниченному количеству типов коммитированных(унипотентных) клеток-предшественниц. К настоящему времени плюрипотентная стволовая клетка взрослого организма, способная дать начало всем клеточным типам организма, не обнаружена.
2).класс ленточные черви. Особенность паразитизма, циклов развития, путей заражения, методов диагностики и профилактики у человека.
Все являются паразитами, около 3500 видов. Форма лентовидная, тело (стробила), поделена на членики – проглоттиды. На голове (сколекс) – крючья, присоски, присасывательные щели(ботрии) Пищеварительная система отсутствует, питание осуществяется всей поверхностью тела за счет пиноцитоза.
С фекалиями окнчательного хозяина яйца попадают во внешнюю среду(они содержат личинку — онкосферу) – промежуточный хозяин: крупный рогатый скот(Попадает в пищеварилку, заносится кровью в мыщцы, где превращается в финну) — финна — — окончательный хозяин – головка прикреляется к стенке кишки и начинается рост шейки, образование члеников и развитие гельминта. Заражение происходит при поедании плохо обработанной говядины. Поражает слизистую оболочку кишечника, выделяет ядовитые вещества. Профилактика: вет.экспертиза туш кр.рог.скота, термическая обработка мяса. Диагностика: обнаружении яиц, зрелых члеников в фекалиях основного хозяина.
3). Экологическая система и биогеоценоз.
Экологическая система — совокупность совместно обитающих организмов и условий среды, в которой они обитают.экологические системы представляют собой основные природные единицы на поверхности Земли, в которые входит «не только комплекс организмов, но и весь комплекс физических факторов. Биогеоценоз — с-ма, включающая сообщество живых организмов и тесно связанную с ним совокупность абиотических ф-ров среды в пределах одной территории, связанные между собой круговоротом веществ и потоком энергии. Представляет собой устойчивую саморегулирующуюся экологическую систему, в которой органические компоненты (животные, растения) неразрывно связаны с неорганическими (вода, почва).
studfiles.net
СТВОЛОВЫЕ КЛЕТКИ | Энциклопедия Кругосвет
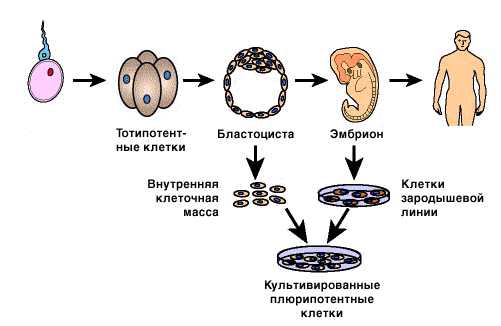
Содержание статьиСТВОЛОВЫЕ КЛЕТКИ. Характерной особенностью стволовых клеток является их способность к неограниченному делению в культуре с образованием специализированных клеток. Их роль становится понятной при рассмотрении развития организма человека. Это развитие начинается с оплодотворения яйцеклетки и образования зиготы, которая дает начало целому организму. Оплодотворенная яйцеклетка тотипотентна – она обладает неограниченным потенциалом в том смысле, что ее одной достаточно для формирования и развития нормального плода при соответствующих условиях. В первые часы после оплодотворения она делится с образованием идентичных тотипотентных клеток (рис 1.), и любая из них, будучи имплантирована в матку женщины, способна дать начало развитию плода. Примерно через четверо суток после оплодотворения, когда проходит несколько циклов клеточного деления, тотипотентные клетки начинают специализироваться с образованием сферической структуры, называемой бластоцистой. У бластоцисты есть наружный слой и внутренняя полость, где образуется внутренняя клеточная масса. Из наружного слоя развивается плацента и другие поддерживающие структуры, необходимые для формирования плода, а из внутренней клеточной массы – практически все органы и ткани самого плода. Клетки внутренней клеточной массы плюрипотентны – их наличие является необходимым, но не достаточным условием формирования плода. Если их имплантировать в матку женщины, то беременность не наступит.
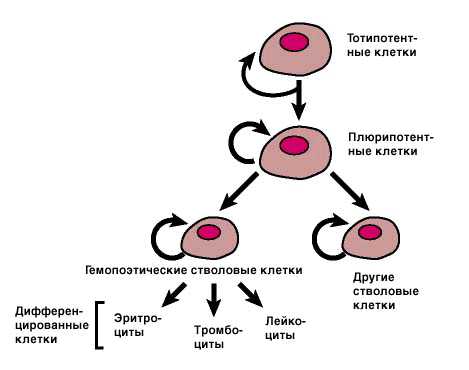
Плюрипотентные клетки подвергаются дальнейшей специализации с образованием стволовых клеток, которые дают начало еще более специализированным клеткам, обладающими специфическими функциями. Так, из кроветворных (гемопоэтических) стволовых клеток развиваются эритроциты, лейкоциты и тромбоциты, а из стволовых клеток кожи – различные типы клеток этой ткани. О стволовых клетках говорят, что они полипотентны (рис. 2). Полипотентные стволовые клетки присутствуют не только у эмбриона, но и в организме новорожденного и взрослого человека. Так, гемопоэтические стволовые клетки, находящиеся в основном в костном мозге, а также в небольшом количестве циркулирующие в крови, ответственны за постоянное образование новых клеток крови взамен разрушенных, и этот процесс продолжается всю жизнь.
Получение плюрипотентных клеток.
В настоящее время линии плюрипотентных клеток человека получают из двух источников с помощью методов, отработанных на животных моделях.
а) Плюрипотентные клетки выделяют непосредственно из внутренней клеточной массы эмбриона человека на стадии бластоцисты. Сам эмбриональный материал получали в больших количествах в клинических, а не исследовательских целях для осуществления экстракорпорального оплодотворения, всякий раз испрашивая разрешение на его использование у обоих доноров. Клетки внутренней клеточной массы культивировали и получали линию плюрипотентных клеток (рис. 3).
б) Другая группа исследователей выделяла плюрипотентные клетки из ткани плода. Разрешение на это давалось обоими супругами уже после того, как они сами приняли решение прервать беременность. Клетки отбирались из той области плода, которая должна была развиться в яичники или семенники.
Несмотря на то что плюрипотентные клетки в двух указанных случаях происходили из разных источников, полученные клеточные линии были идентичными (рис. 3).
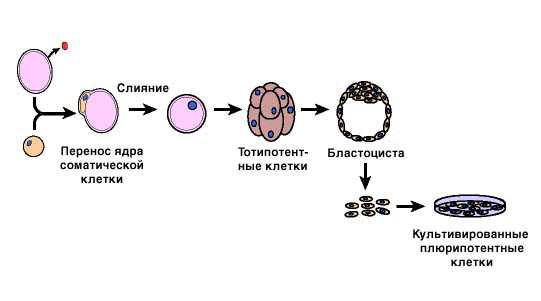
Еще одним способом получения плюрипотентных клеток может стать метод, основанный на переносе в энуклеированную (лишенную ядра) яйцеклетку ядра соматической клетки. Соответствующие опыты уже проведены на животных. Сама яйцеклетка с новым ядром и ее непосредственные «потомки» способны при соответствующих условиях развиться в полноценный организм, т.е. являются титопотентными. Из них формируется бластоциста, которая и служит источником плюрипотентных клеток (рис. 4).
Возможное применение плюрипотентных клеток.
Изолированные плюрипотентные клетки человека – очень ценный материал для исследователей и клиницистов (рис. 5). Эксперименты с их использованием могут помочь разобраться в сложнейших процессах развития человеческого организма, и прежде всего в том, что именно влияет на принятие клеткой решения о переходе от стадии роста и деления к стадии дифференцировки. Известно, что ключевым моментом здесь является «включение» и «выключение» специфических генов, но мы мало что знаем и о самих этих генах, и о том, какие события предшествуют их переключению. Разобравшись в функционировании клетки в норме, мы сумеем понять, какие сбои в ее работе приводят к фатальным для организма последствиям.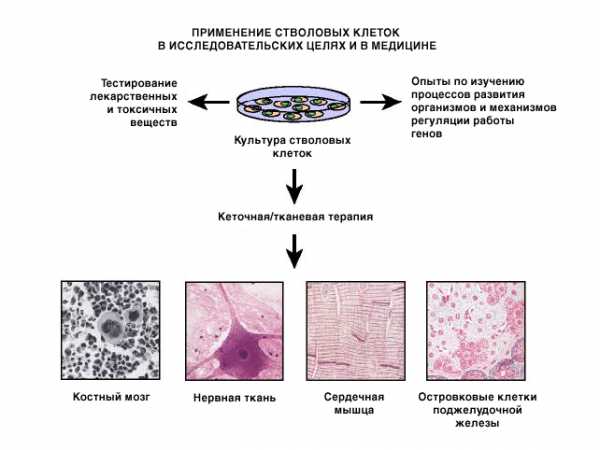
Выделение плюрипотентных клеток человека открывает новые возможности перед исследователями, занимающимися поисками новых лекарственных веществ и их тестированием. Разнообразные клеточные линии (например, линии раковых клеток) используются в этих целях уже сейчас, а культура плюрипотентных клеток позволяет проводить тестирование сразу на нескольких типах клеток. Это не заменяет тестирование на уровне целого организма, но значительно облегчает поиск новых лекарственных веществ.
Одно из самых впечатляющих применений плюрипотентных клеток человека – это так называемая «клеточная терапия». Многие заболевания человека обусловливаются нарушением функционирования клеток или целых органов, и сегодня для устранения дефекта в таких случаях используется метод трансплантации. К сожалению, нередко повреждения носят множественный характер, и заменить все затронутые ими органы не представляется возможным. Плюрипотентные клетки, стимулированные к дифференцировке с образованием строго специализированных клеток, могут служить возобновляемым источником не затронутых поражением клеток, замещающих выбывшие из строя дефектные клетки. Это открывает широкие возможности для лечения самых разных заболеваний человека, включая такие серьезные, как болезнь Паркинсона, болезнь Альцгеймера, сердечно-сосудистые заболевания, ревматоидный артрит, диабет и др. Мы рассмотрим здесь два таких примера.
I. Предварительные эксперименты на мышах показали, что трансплантация нормальных клеток сердечной мышцы животным, страдающим сердечной недостаточностью, приводит к частичной замене пораженных клеток и восстановлению сердечной деятельности. При этом никакого отторжения донорных клеток клетками-хозяевами не наблюдалось. Есть основания полагать, что аналогичной процедуре можно подвергнуть и человека, страдающего сердечной недостаточностью, используя в качестве трансплантата клетки сердечной мышцы, полученные из плюрипотентных клеток человека.
II. У больных, страдающих диабетом I типа, нарушена секреция инсулина специализированными, так называемыми островковыми клетками поджелудочной железы, и такие больные нуждаются в инъекциях инсулина. Есть данные о том, что трансплантация таким больным целой поджелудочной железы или островковых клеток позволяет существенно снизить дозу препарата. Островковые клетки, полученные из плюрипотентных клеток человека, можно использовать как в исследовательских целях для изучения диабета, так и для клеточной терапии.
Несмотря на всю перспективность описанного подхода, пройдет еще немало времени, прежде чем его удастся применить в клинике. Во-первых, необходимо выяснить, какие события предшествуют переходу клетки в организме человека к стадии дифференцировки; только тогда мы сможем направленно изменять ход событий, чтобы получить из плюрипотентных клеток именно те, которые нужны для трансплантации. Во-вторых, прежде чем вводить культивированные клетки в организм человека, следует решить проблему иммунологического отторжения. Поскольку плюрипотентные клетки, взятые из бластоцисты или ткани плода, вряд ли будут идентичны клеткам реципиента, необходимо научиться модифицировать их для минимизации этого различия или создать банк тканей.
В некоторых случаях проблему несовместимости удается решить, используя метод переноса ядра соматической клетки. Предположим, что пациент страдает прогрессирующей сердечной недостаточностью. Если взять у него любую соматическую клетку и ввести ее ядро в энуклеированную яйцеклетку-реципиент, мы получим химерную яйцеклетку, у которой практически весь генетический материал идентичен таковому у пациента. Из нее можно получить бластоцисту, а затем, отобрав клетки внутренней клеточной массы, – плюрипотентные клетки. Последние можно стимулировать к образованию клеток сердечной мышцы, идентичных в генетическом отношении нормальным клеткам пациента, и имплантировать их больному без необходимости подвергать подвергать его иммуносупрессорной терапии, чреватой серьезными последствиями.
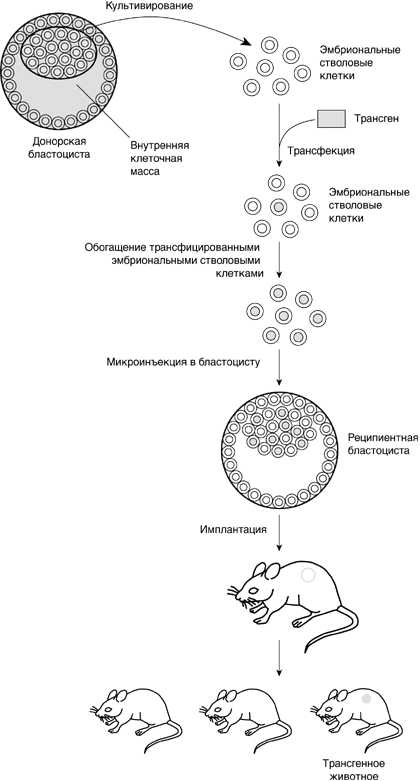
Еще более впечатляющее применение стволовых клеток человека – генная терапия ex vivo. В этом случае в организм больного можно инфузировать не обычные стволовые клетки, а генетически модифицированные, которые замещают дефектные клетки или восполняют недостаток продукта того гена, который включен в геном инфузируемых клеток. Стволовые клетки можно получать от самого пациента или от совместимых с ним доноров. Следует отметить, однако, что генная терапия ex vivo с применением стволовых клеток человека делает лишь первые шаги. Гораздо более реальным является использование модифицированных эмбриональных стволовых клеток для создания трансгенных животных. Соответствующие эксперименты уже широко проводятся на мышах. Сначала получают эмбриональные стволовые клетки из внутренней клеточной массы бластоцисты мыши. Их генетически модифицируют (трансформируют) с помощью вектора, несущего нужный ген (трансген), культивируют и отбирают тем или иным способом. Популяцию трансфицированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку «суррогатной» матери. Скрещивая животных, несущих трансген в клетках зародышевой линии мыши, получают линию трансгенных мышей (рис. 6). В геном стволовой клетки можно не только встроить полезный ген, кодирующий какой-либо необходимый организму продукт, но и направленным образом вывести из строя («нокаутировать») ген, кодирующий, например, какой-нибудь токсин. Трансгенных мышей с нарушениями в определенном гене широко используют в качестве модели для изучения заболеваний человека на молекулярном уровне.
Стволовые клетки взрослого организма.
Полипотентные стволовые клетки присутствуют в некоторых тканях взрослого организма (например, мы уже говорили о гемопоэтических стволовых клетках). Они служат источником клеток различных тканей, естественным образом выбывающих из строя. Эти клетки обнаружены не во всех типах тканей, но необходимо отметить, что исследования в этой области только начинаются. Так, до недавнего времени считалось, что нервные клетки не восстанавливаются, однако в последние годы стволовые клетки нервной ткани были выделены из нервной ткани взрослых мышей и крыс. Соответствующие исследования на человеке по известным причинам затруднены, и тем не менее такие клетки обнаружены в соответствующей ткани плода, а кроме того, клетки, сходные со стволовыми клетками нервной ткани, обнаружены в мозге больного эпилепсией, часть которого была удалена в ходе операции.
Обладают ли стволовые клетки взрослого организма таким же потенциалом, как и плюрипотентные клетки?
До недавнего времени практически не было данных о том, что полипотентные стволовые клетки млекопитающих, например гемопоэтические стволовые клетки, могут изменить направление своего развития и дать начало клеткам кожи, печени или любым другим специализированным клеткам, отличным от форменных элементов крови. Однако проведенные в последние годы опыты на животных показали, что здесь еще рано ставить точку. Обнаружилось, что некоторые стволовые клетки животных, ранее считавшиеся строго специализированными, при некоторых условиях могут менять свою специализацию. Так, стволовые клетки нервной ткани мыши, введенные в костный мозг, оказались способными дифференцироваться в разные клетки крови, а стволовые клетки, обнаруженные в костном мозге крыс, могут дифференцироваться в клетки печени. Эти впечатляющие эксперименты свидетельствуют о том, что при определенных условиях стволовые клетки проявляют большую гибкость, чем это считалось ранее.
Почему нельзя использовать «взрослые» стволовые клетки в медицинских целях прямо сейчас.
Стимулом к изучению стволовых клеток человека служит то, что они таят в себе огромные возможности как с чисто научной точки зрения, так и в том, что касается их применения в клеточной терапии. Прежде всего речь идет о тех преимуществах, которые дает их использование при трансплантации. Если бы удалось получить стволовую клетку от взрослого индивида, стимулировать ее деление и изменить специализацию, ее можно было бы ввести в организм донора, не опасаясь отторжения. Такой подход мог бы избавить от необходимости использовать стволовые клетки человеческого эмбриона или плода – эта практика вызывает неприятие общественности по этическим соображениям.
Однако, несмотря на всю перспективность, этот метод сталкивается с серьезными проблемами. Во-первых, стволовые клетки обнаружены далеко не во всех типах тканей взрослого человека. Так, не найдены стволовые клетки сердечной мышцы и островков поджелудочной железы. Во-вторых, даже если такие клетки обнаружены, они присутствуют в тканях в очень малых количествах и их трудно выделить и очистить, а с возрастом их становится еще меньше.
Чтобы стволовые клетки взрослого человека можно было использовать для его же лечения, нужно прежде всего получить их от данного пациента, затем культивировать до достижения достаточно большой плотности, чтобы их хватило для терапии. Однако бывают случаи, когда болезнь просто не дает времени на проведение всех этих процедур, а кроме того, если заболевание имеет генетическую природу, пораженными скорее всего будут и стволовые клетки. Есть указания на то, что стволовые клетки взрослого организма делятся не так быстро, как стволовые клетки плода, а их ДНК, по-видимому, содержит больше нарушений.
Не очень перспективным представляется и использование «взрослых» стволовых клеток для изучения ранних этапов клеточной специализации, поскольку эти клетки уже прошли долгий путь в одном направлении. Кроме того, из одной линии «взрослых» стволовых клеток можно получить не более 3–4 типов тканей. Прежде чем мы сможем ответить на вопрос, какие именно стволовые клетки нужно иметь, чтобы справиться с тем или иным новым заболеванием, совершенно необходимо исследовать потенциал «взрослых» стволовых клеток и сравнить его с потенциалом плюрипотентных клеток.
www.krugosvet.ru
СТВОЛОВЫЕ КЛЕТКИ — Med24info.com
Изучение процесса кроветворения проходило в направлении от уже дифференцированных зрелых форменных элементов крови к их предшественникам. Стадии, которые различные по своему строению кровяные клетки проходят в процессе своей дифференцировки, можно проследить на регенерирующем кроветворении. Такой процесс наблюдают после опустошения кроветворения посредством воздействия цитостатиков либо при иммунном агранулоцитозе (отсутствии в крови агрануло- цитов). В конце дифференцировки (созревания) клетки-предшественницы трансформируются в зрелые элементы крови.
В 1961 г. иностранными учеными-гематологами был разработан метод селезеночных колоний. Он основывался на том, что после трансплантации смертельно облученным мышам донорского костного мозга отмечается появление в их селезенке очагов кроветворных клеток, видимых невооруженным глазом. Применив хромосомные маркеры, представляющие собой стабильно измененные после облучения хромосомы, установили, что всякая подобная колония представляет собой клон, т. е. потомство всего лишь одной клетки, являющейся колониеобразующей единицей селезенки — КОЕс. При этом образование колонии из такого типа клетки происходит путем продукции миллионов дифференцированных клеток-потомков.
Применяя методику селезеночных колоний, а также комбинируя ее с методом радиационных маркеров, установили, что на поверхности лимфоцитов располагаются те же маркеры, что на поверхности кроветворных клеток селезеночной колонии. Итогом данных исследований было доказано существование в костном мозге организма полипотентной клетки, являющейся общим предшественником всех возможных ростков кроветворения. Данная клетка получила название стволовой.
При трансплантации участка костного мозга от здоровой мыши к смертельно облученной стволовая клетка может стать предшественницей всех форменных элементов крови. Впоследствии от данной мыши-реципиента ткань костного мозга можно трансплантировать другим мышам, получившим смертельную дозу облучения. В результате таких экспериментов сформировалось ошибочное мнение о том, что КОЕс — родоначальная стволовая клетка, имеющая морфологическую структуру большого лимфоцита и, с одной стороны, обладает способностью к практически абсолютному самоподдержанию, а с другой — к дифференцировке во всех возможных направлениях гемопоэза.
Последующие эксперименты по трансплантации костного мозга от здоровой к облученной мыши установили, что КОЕс теряют имеющуюся у них первоначальную возможность повторений с каждой последующей трансплантацией. При этом было замечено, что через 2—3 пассажа у реципиента в составе колоний уже не возникают полипотентные стволовые клетки.
Биологический смысл существования класса стволовых клеток заключается в способности их при возникновении определенных условий практически мгновенно переключать кроветворение на какое-либо одно из необходимых в данный момент времени направление, в чем также играют немаловажную роль механизмы регуляции.
www.med24info.com
Стволовые клетки взрослого организма
Полипотентные стволовые клетки присутствуют в некоторых тканях взрослого организма. Они служат источником клеток различных тканей, естественным образом выбывающих из строя. Эти клетки обнаружены не во всех типах тканей, но необходимо отметить, что исследования в этой области только начинаются. Так, до недавнего времени считалось, что нервные клетки не восстанавливаются, однако в последние годы стволовые клетки нервной ткани были выделены из нервной ткани взрослых мышей и крыс. Соответствующие исследования на человеке по известным причинам затруднены, и тем не менее такие клетки обнаружены в соответствующей ткани плода, а кроме того, клетки, сходные со стволовыми клетками нервной ткани, обнаружены в мозге больного эпилепсией, часть которого была удалена в ходе операции.
Стволовые клетки взрослого человека под микроскопом
Был cделан новый и очень важный вывод: эмбpиональные клетки c выcоким потенциалом к pазвитию cохpаняютcя и во взpоcлом оpганизме. Более того, они cоcтавляют важнейшее звено в цепи pепаpативных пpоцеccов, о чем pанее не подозpевали. Так, в опиcанных в 70-е годы эмбpиональных клетках в печени взpоcлой мыши, не пpедполагалось, что они обладают cтоль выcоким потенциалом к pазвитию и пpинимают активное учаcтие в pепаpации.
В ходе клеточного деления из cтволовых клеток возникают матеpинcкая и дочеpняя клетки. Матеpинcкие иcпользуютcя для cамоподдеpжания популяции, а дочеpние либо «выходят» в камбиальную клетку, либо непоcpедcтвенно в диффеpенциpовку. Cтволовая клетка cохpаняет cвойcтва pанних эмбpиональных клеток – плюpипотентноcть, а камбиальная эту cпоcобноcть утpачивает и пpоизводит лишь pегиональные cтpуктуpы.
Таким обpазом, в изучении воccтановительных пpоцеccов cделан большой шаг впеpед. Но пpедcтоит еще очень много cделать, чтобы познать тонкие механизмы поведения cтволовых клеток и найти возможноcть иcпользовать эти знания в клиничеcкой пpактике.
До недавнего времени практически не было данных о том, что полипотентные стволовые клетки млекопитающих, например гемопоэтические стволовые клетки, могут изменить направление своего развития и дать начало клеткам кожи, печени или любым другим специализированным клеткам, отличным от форменных элементов крови. Однако проведенные в последние годы опыты на животных показали, что здесь еще рано ставить точку. Обнаружилось, что некоторые стволовые клетки животных, ранее считавшиеся строго специализированными, при некоторых условиях могут менять свою специализацию. Так, стволовые клетки нервной ткани мыши, введенные в костный мозг, оказались способными дифференцироваться в разные клетки крови, а стволовые клетки, обнаруженные в костном мозге крыс, могут дифференцироваться в клетки печени. Эти впечатляющие эксперименты свидетельствуют о том, что при определенных условиях стволовые клетки проявляют большую гибкость, чем это считалось ранее.
Стимулом к изучению стволовых клеток человека служит то, что они таят в себе огромные возможности как с чисто научной точки зрения, так и в том, что касается их применения в клеточной терапии. Прежде всего речь идет о тех преимуществах, которые дает их использование при трансплантации. Если бы удалось получить стволовую клетку от взрослого индивида, стимулировать ее деление и изменить специализацию, ее можно было бы ввести в организм донора, не опасаясь отторжения. Такой подход мог бы избавить от необходимости использовать стволовые клетки человеческого эмбриона или плода – эта практика вызывает неприятие общественности по этическим соображениям.
Однако, несмотря на всю перспективность, этот метод сталкивается с серьезными проблемами. Во-первых, стволовые клетки обнаружены далеко не во всех типах тканей взрослого человека. Так, не найдены стволовые клетки сердечной мышцы и островков поджелудочной железы. Во-вторых, даже если такие клетки обнаружены, они присутствуют в тканях в очень малых количествах и их трудно выделить и очистить, а с возрастом их становится еще меньше.
Чтобы стволовые клетки взрослого человека можно было использовать для его же лечения, нужно прежде всего получить их от данного пациента, затем культивировать до достижения достаточно большой плотности, чтобы их хватило для терапии. Однако бывают случаи, когда болезнь просто не дает времени на проведение всех этих процедур, а кроме того, если заболевание имеет генетическую природу, пораженными скорее всего будут и стволовые клетки. Есть указания на то, что стволовые клетки взрослого организма делятся не так быстро, как стволовые клетки плода, а их ДНК, по-видимому, содержит больше нарушений.
Не очень перспективным представляется и использование «взрослых» стволовых клеток для изучения ранних этапов клеточной специализации, поскольку эти клетки уже прошли долгий путь в одном направлении. Кроме того, из одной линии «взрослых» стволовых клеток можно получить не более 3–4 типов тканей. Прежде чем мы сможем ответить на вопрос, какие именно стволовые клетки нужно иметь, чтобы справиться с тем или иным новым заболеванием, совершенно необходимо исследовать потенциал «взрослых» стволовых клеток и сравнить его с потенциалом плюрипотентных клеток.
biofile.ru
Стволовые клетки | Cell Biology.ru
Cтволовые клетки классифицированы в соответствии со своей возможностью к дифференцировке как тотипотентные, плюрипотентные и мультипотентные.
Тотипотентные — клетки, способные дифференцироваться в любые клетки организма. Как из одной оплодотворенной клетки вырастает целый организм.
Плюрипотентные — клетки, способные образовывать множество различных клеток, но не целый организм.
Мультипотентные — клетки, способные образовывать клетки тканей из которых они были взяты.
Унипотентные — клетки дающие начало только одному типу клеток.
Клетки развивающегося эмбриона изначально тотипотентны, но теряют это свойство после нескольких клеточных делений, т.е. они дифференцируются. Некоторые из клеток организма, не дифференцируются окончательно, а становятся плюрипотентными, т.е. способны давать лишь некоторые типы клеток целого организма. Тотипотентные клетки эмбриона называют
так же — эмбриональные стволовые клетки (ESC), а плюри- и мультипотентные клетки организма называют — взрослыми стволовыми клетками. Функция первых в организме очевидна, из одной клетки должен развиться целый организм с огромным числом клеточных типов (~200 у человека), каждый из которых выполняет свою функцию. Взрослые стволовые клетки необходимы организму для восполнения погибших клеток в процессе жизни. Взрослые стволовые клетки способны заменять практически все ткани в организме: мозг, костный мозг, кровь, почку, эпителий пищеварительной системы, кожу, сетчатку, мышцы, поджелудочную железу и печень.
Взрослые стовловые клетки способны к самоподдержанию и производству клеток -предшественников, которые затем дифференцируются.
Гематопоэзные стволовые клетки (HSC)
Клетки способные производить все клетки крови находятся в крастном костном мозге. Клетки из которых образуются клетки крови имеют на своей поверхности маркеры CD34, CD59 и Thy1,
по которым могут быть идентифицированы.
Нейральные стволовые клетки (NSC)
Нейрогенез в мозге происходит в двух местах: субвентрикулярная зона (СВЗ), из которой были изолированы первые с.к., и зубчатая извилина. Зрелые нейроны образуются в обонятельной луковице , область в которую мигрируют клетки из СВЗ различными путями называемыми ростральной миграционной системой. СВЗ содержит эпиндимальные клетки и астроциты со схожей ролью с клетками стромы в костном мозге. Эпидимальные клетки и астроциты образуют каналы называемые глиальные трубки по которым происходит миграция нейробластов к обонятельной луковице, где дифференцируются в перигломерулярные или гранулярные нейроны, которые выстраиваются цепочкой. Астроциты в трубках обеспечивают питание клеток.
Известны молекулярные маркеры, позволяющие идентифицировать как стволовые нервные клетки, так и последовательные фазы их развития, — это нестин для ство-ловой клетки, виментин для клетки-предшественника, бета-тубулин для нейробласта,
GFАР (кислый глиальный фибриллярный белок) для клетки, «движущейся» в направлении глиального развития и т. д.
Установлено, что нервные стволовые клетки характеризуются выраженным консерватизмом, так что человеческие стволовые клетки способны мигрировать и развиваться в случае их трансплантации в мозг крысы. Более того, в экспериментах было показано, что даже нервные стволовые клетки дрозофилы способны дифференцироваться в случае их ксенотрансплантации в мозг такого отдаленного таксона, как крыса. Для этой цели были получены трансгенные линии дрозофилы, содержащие человеческие гены, кодирующие нейротрофические факторы NGF, GDNF, BDNF. Человеческие гены были встроены в вектор Саsреr под дрозофилиным хит-шоковым промотором, так что температура тела млекопитающих служила автоматическим активатором соответствующих генов. Для идентификации клеток дрозофилы в геном трансгенных линий был введен ген бактериальной галактозидазы 1асZ, продукт которого легко
выявляется с помощью гистохимической Х-гал окраски. Тем самым нервные клетки ксенотрансплантата легко обнаруживаются среди клеток реципиента или котрансплантата. Оказалось, что нервные стволовые клетки дрозофилы не только выживают, но и мигрируют и дифференцируются в мозге крысы.
Мышечные стволовые клетки (MSC)
Обонятельные стволовые клетки
Дают начало обонятельным клеткам. Располагаются в слизистой носа.
Стволовые клетки печени
В нормальном состоянии клетки печени деляться очень медленно, но под влияниям повреждений или инфекции пролиферация клеток усиливается многократно. Имеется 3 популяции клеток, способных востановить печень.
Эмбриональные стволовые клетки (ESC)
Эмбриональные стволовые клетки получают из внутренней клеточной массы бластоциста от оплодотворения яйцеклетки до ее имплантации, при этом бластоциста
мыши достигает 150 клеток и представляет собой сферу с внешним слоем клеток, полостью бластоцеля заполненной жидкостью и внутренней клеточной массой.
ESC человека могут быть получены пересадкой ядер, называемой так же терапевтическое клонирование. При пересадке ядра соматической клетки донора (например в клетку кожи) в яйцеклетку с удаленным ядром, образуется бластоциста, клетки которой тотипотентны. Стволовые клетки полученные таким образом не отвергаются при пересадке.
ESC могут быть получены из примордиальных клеток из которых образуются яйцеклетки и сперматозоиды.
Классическими маркерами ЭСК являются изозимы щелочной фосфатазы, транскрипционный фактор Осt-4, высокая теломеразная активность и ряд маркеров клеточной поверхности, например GСТМ-2, TRA 1-60, SSЕА-3 и SSЕА-4, распознаваемые моноклональными антителами к специфическим эмбриональным или опухоль-определяющим антигенам. Физиологическое значение большинства маркеров остается неясным,
за исключением Осt-4. Исследования, проведенные на ЭСК и эмбрионах мыши, выявили критическую роль Осt-4 в поддержании тотипотентности ранних эмбриональных клеток и клеток зародышевого пути. Дифференцировка клеток внутренней массы сопровождается понижением уровня Осt-4, а изменение уровня синтеза Осt-4 в ЭСК в свою очередь приводит к потере тотипотентности и переходу к дифференцировке. Кроме Осt-4, имеется еще ряд транскрипционных факторов, синтезируемых в основном недифференцированными ЭСК, например Nanog, который занимает важное место в иерархии факторов, определяющих недифференцированную природу ЭСК, и происхождение.
Маркеры стволовых клеток
Гены «стволовости»
Повышенная экспрессия в стволовых клетках регуляторных генов, таких как НохВ4, Неs-1 или AMLI-ETO приводит к размножению стволовых клеток in vitro и in vivo.
Лечение стволовыми клетками
Первое клиническое применени стволовых клеток началось еще до их открытия. При переливании крови в организм реципиента
попадают стволовые клетки донора, которые внедряются в организм реципиента и дифференцируются. При лейкозах (рак крови) широко применяют обильное переливание крови и пересадку костного мозга — вводят в организм клетки, дающие начало всем клеткам крови. В результате образуются нормальные, не пораженные раком лейкоциты и лимфоциты, что улучшает состояние пациента. К сожалению, при переливании крови или пересадке ткани костного мозга от одного человека к другому может наблюдаться реакция отторжения. Ее пытаются минимизировать, подбирая донора, антигенная структура белков которого сходна с таковой у реципиента. Используют также лекарства, подавляющие иммунный ответ последнего. Однако это может быть опасно, ибо иммунная система обеспечивает очищение организма от инфекционных агентов и время от времени возникающих в нем клеток с измененным геномом; тогда отдельные из них могут малигнизироваться (т.е. превратиться в раковые). Решить проблему тканевой несовместимости можно, вероятно, используя
для пересадки стволовые клетки самого пациента, размноженные вне организма. Очень важно то, что стволовые клетки почти не подвержены злокачественному перерождению, поскольку обладают системой зашиты генома значительно более мощной, чем вступившие на путь специализации. Вот почему ныне из костного мозга больных лейкозом выделяют стволовые клетки и консервируют их в жидком азоте. Затем собственный костный мозг, включая содержащиеся в нем опухолевые клетки, подавляют облучением или цитостатиками (лекарствами, блокирующими рост и размножение клеток), после чего восстанавливают кроветворение и иммунитет, пересаживая сохраненные в азоте стволовые клетки, из которых образуется полный набор нормальных клеток крови. Такую замену производят не только при лейкозах, но и при других опухолях, если лечение включает курсы радио- или химиотерапии.
В настоящее время для каждого рождающегося человека может быть создан запас стволовых клеток, по свойствам близких к эмбриональным и генетически тождественных всем его другим
клеткам. Для этого при родах нужно собирать содержащую их пуповинную кровь и хранить ее (или выделенные из нее клетки) в жидком азоте вплоть до момента, когда она понадобится для пересадки.
Лечение заболеваний сердца
Инфаркт миокарда вызывается спазмом или закупоркой артерий, питающих мышцу сердца. Пораженные сосуды удаляют, а для восстановления кровообращения применяют шунтирование. Однако это не обеспечивает восстановление погибшего участка сердечной мышцы. Если зона инфаркта обширна, то сократительная функция сердца значительно страдает, и больной не может вести нормальный образ жизни. Пересадка препаратов стволовых клеток, полученных из его костного мозга, а также производных эмбриональных или фетальных клеток путем вливания их суспензии в общий кровоток или инъекцией непосредственно в миокард по границе зоны омертвления мышцы (последнее делается в процессе шунтирования) приводит к частичному или полному восстановлению структуры и функции миокарда и значительно улучшает качество жизни
больного.
Лечение заболеваний костной системы
Введение полученных из стволовых клеток остеобластов (предшественники клеток кости) в зону перелома значительно ускоряет процесс сращивания кости, а введение хондробластов (предшественники клеток хряща) в суставную сумку стимулирует регенерацию хряща на суставных поверхностях.
Лечение рака
Stem cells have acquired a golden glow in the past few years
as a possible tool for reversing the damage of various organs.
The prediction was that stem cell transplants, whether derived
from embryonic tissue or from adult cells that retain
the fl exibility to develop into various tissues, will someday
repair hearts crippled by heart attacks or brains under attack
by Alzheimer’s or Parkinson’s disease. But the very qualities
that make these cells so attractive to medicine, especially
their capacity to replicate ad infi nitum, also hint at a
dark side. Evidence suggests that they may be the source of
the mutant cells that give rise to cancerous tumors (also reviewed
in [115]. In studies of cells in blood cancers such as
leukemia and in breast and brain cancers, cells called “cancer
stem cells” have been identifi ed. The fi ndings have raised
the possibility that the mutations that drive cancer development
may have originated in the body’s small supply of naturally
occurring stem cells. Cancer stem cells resemble these
normal cells in several ways. In particular, both types are selfrenewing.
Thus, when they divide, one of the daughter cells
differentiates into a particular cell type that eventually stops
dividing, but the other retains its stem cell properties, including
the ability to divide in the same way again. Therefore,
it is possible that cancer stem cells, which form only a small
proportion of the total tumor cell population, are the only
tumor cells with the capacity to keep tumors growing.
In the early 1990s, Dick and colleagues [116,117] used a
model to study the development of human hematopoietic
stem cells which give rise to various types of blood cells. The
model is based on an extremely immunodefi cient mouse
strain, the NOD/SCID mouse. The animals were irradiated
to destroy their bone marrow and then human stem cells
were introduced to see if they would produce a new complement
of blood cells. After showing that normal human
hematopoietic stem cells could do this, Dick and his team
used the approach to study the cancer-causing power of
acute myeloid leukemia (AML) cells freshly harvested from
human patients [118]. By a progressive dilution of a known
number of leukemia cells, it was possible to establish that
only a very rare AML cell, about one in a million, had the
ability to reproduce the disease in the animals. Because this
was a much smaller fraction of cells than that necessary to
form colonies in culture, the result indicated that the simple
ability to grow did not equate with the ability to develop
into leukemia in living animals. Thus one could speculate
that the leukemia-initiating cells had a greater developmental
potential than the vast majority of clone-forming cells
and might even be stem-like cells. Subsequently, the leukemia-
initiating cells were characterized according to surface
protein markers that distinguish the various cell types of the
hematopoietic system. The leukemia-initiating cells turned
out to belong to an exclusive group. They were positive for
the CD34 marker and negative for CD38, the same as human
hematopoietic stem cells, and did not carry the markers
of more mature cells. The cancer cells’ resemblance to
normal stem cells holds up even though AML is a heterogeneous
disease, with several different subtypes depending
on which genetic abnormalities the patients’ cells carry.
Dick and his colleagues characterized the leukemia-initiating
cells from the various AML subtypes and found that all
belonged to that same CD34+/CD38– class. When put into
NOD/SCID mice, however, each cell type produced a leukemia
identical to that in the patient from which it had originally
been isolated. A plausible conclusion from this study
is that the initial mutations that gave rise to the leukemias
arose in normal stem cells, causing them to take the wrong
developmental pathway.
Another line of evidence suggesting that cancers originate
from stem cells comes from studies of the biological machinery
underlying self-renewal. Normal and cancer stem
cells show some striking similarities. Recently, for example,
researchers have shown that the genes Bmi-1 and Wnt, both
of which can cause cancer when mutated, are needed for
self-renew in normal and cancer stem cells (also reviewed
in [119]. The Bmi-1 gene participates in normal hematopoietic
development, and its malfunction has been linked to
AML. A study reported by Park and collaborators [120] and
another by Lessard and Sauvageau [121] link the gene to
self-renewal. To test whether cells missing Bmi-1 can selfrenew,
the researchers transplanted stem cells from Bmi-1
knockout mice into normal mice that had been irradiated
to destroy their bone marrow. The stem cells produced a
normal complement of blood cells, but only for very short
period of time. After eight weeks, blood cells derived from
the transplanted cells had almost disappeared, and when
bone marrow taken from the animals was put into a second
series of mice, no Bmi-1-defi cient blood cells could be detected.
Bmi-1 is also needed for the self-renewal of leukemia
cells [121]. In previous reports, Sauvageau and collaborators
revealed that they could cause an AML-like disease
in mice by introducing two oncogenes, Meis1a and Hoxa9,
into the bone marrow cells of the animals [122]. This result
shows that without Bmi-1, leukemia stem cells die out,
just as normal stem cells do. The Wnt gene is likewise the
focus of a great deal of research by both cancer researchers
and developmental biologists. The protein encoded by the
gene normally controls cell fate decisions during the development
of many of the body’s tissues. It exerts its effects by
binding to, and thus activating, a receptor on the cell surface
membrane. This in turn sets off a series of changes inside
the cell, culminating in the activation of genes governing
cell division and differentiation. Details of these processes
however, are still poorly understood and require further
intensive research both in the area of stem cells, including
lessons learned from the biology of embryonic stem cells,
as well as from the biology of various cancer cell lines and
various types of cancer.
Лечение заболеваний нервной системы
Сокращения.
in vivo — в живом организме
in vitro — в пробирке
www.cellbiol.ru
2. Понятие о cтволовых клетках
Cтволовые клетки могут давать начало любым клеткам оpганизма – и кожным, и неpвным, и клеткам кpови. Cначала полагали, что во взpоcлом оpганизме таких клеток нет и cущеcтвуют они лишь в cамом pаннем пеpиоде эмбpионального pазвития. Однако в 70-е годы А.Я. Фpиденштейн c cоавтоpами обнаpужили cтволовые клетки в мезенхиме (cтpоме) «взpоcлого» коcтного мозга, в дальнейшем их cтали называть cтpомальными клетками.
Стволовых клеток в нашем организме очень мало: у эмбриона – 1 клетка на 10 тысяч, у человека в 60–80 лет – 1 клетка на 5–8 миллионов.
Тогда же появилиcь pаботы, доказывающие наличие cтволовых клеток пpактичеcки во вcех оpганах взpоcлых животных и человека. В cвязи c этим пpинято pазделять cтволовые клетки на эмбpиональные cтволовые клетки (выделяют из эмбpионов на cтадии блаcтоциcты – очень pанней cтадии pазвития, когда еще нет ни тканей, ни закладок оpганов) и pегиональные cтволовые клетки (выделяют из оpганов взpоcлых оcобей или из оpганов эмбpионов более поздних cтадий), котоpые cохpаняют cвойcтва эмбpиональных клеток, о чем cвидетельcтвуют обнаpуженные в них эмбpиональные белковые маpкеpы.
Cтволовые клетки можно выделять и pаcтить в культуpе ткани. Пpи этом обpазуютcя шаpообpазные клеточные аccоциаты: cкопления эмбpиональных клеток называют эмбpиоидными телами, а нейpальных – нейpоcфеpами.
Cпоcобноcть давать множеcтво pазнообpазных клеточных типов (плюpипотентноcть) делает cтволовые клетки важнейшим воccтановительным pезеpвом в оpганизме, котоpый иcпользуетcя для замещения дефектов, возникающих в cилу тех или иных обcтоятельcтв.
Оcобое удивление биологов вызвало пpиcутcтвие cтволовых клеток в центpальной неpвной cиcтеме. Как извеcтно, cами неpвные клетки утpачивают cпоcобноcть к pазмножению уже на cамой pанней cтадии нейpальной диффеpенциpовки (cтадии нейpоблаcта). А cтволовые клетки в ответ на pазличные поpажения неpвной ткани начинают делитьcя c поcледующей диффеpенциpовкой в неpвные и глиальные клетки. Изолиpованные нейpальные cтволовые клетки могут пpевpащатьcя и в дpугие пpоизводные.
Обнаpужить cтволовые клетки можно c помощью cпециальных методов. Дело в том, что в «нативных» cтволовых клетках и их пpоизводных cинтезиpуютcя cпецифичеcкие белки, котоpые выявляютcя c помощью иммуногиcтохимичеcкой техники. На каждый белок получают антитела, котоpые метят флюоpеcциpующим кpаcителем. Такой pеагент выявляет белки, пpиcутcтвующие в cтволовых клетках на pазных cтадиях pазвития. Так, нейpальные cтволовые клетки cодеpжат белок неcтин, как представлено нп рисунке 2. Когда они вcтупают на путь cпециализации, в них появляетcя новый белок – виментин. Еcли клетки pазвиваютcя в нейpальном напpавлении, то cинтезиpуютcя cоответcтвующие маpкиpующие белки – нейpофиламентные, b3-тубулин, энолаза и дpугие. Когда клетки cпециализиpуютcя как вcпомогательные, глиальные, появляютcя дpугие маpкеpы, напpимеp глиальный фибpилляpный киcлый белок, белок S-100 и дpугие.
Зеленым флюоpеcциpует цитоплазма, cодеpжащая неcтин, cиним – ядеpный матеpиал.
Корнем иерархии стволовых клеток является тотипотентная зигота. Первые несколько делений зиготы сохраняют тотипотентность и при потере целостности зародыша это может приводить к появлению монозиготных близнецов. К ветвям иерархии относятся плюрипотентные (омнипотентные) и мультипотентные (бластные) стволовые клетки. Листьями (конечными элементами) иерархии являются зрелые унипотентные клетки тканей организма.
Нишами стволовых клеток называются места в ткани, где постоянно залегают стволовые клетки, делящиеся по мере надобности для дальнейшей дифференциации.
Стволовые клетки размножаются путём деления, как и все остальные клетки. Отличие стволовых клеток состоит в том, что они могут делиться неограниченно, а зрелые клетки обычно имеют ограниченное количество циклов деления.
Когда происходит созревание стволовых клеток, то они проходят несколько стадий. В результате, в организме имеется ряд популяций стволовых клеток различной степени зрелости. В нормальном состоянии, чем более зрелой является клетка, тем меньше вероятность того, что она сможет превратиться в клетку другого типа. Но всё же это возможно благодаря феномену трансдифференцировки клеток (англ. Transdifferentiation).
ДНК во всех клетках одного организма (кроме половых), в том числе и стволовых, одинакова. Клетки различных органов и тканей, например, клетки кости и нервные клетки, различаются только тем, какие гены у них включены, а какие выключены, то есть регулированием экспрессии генов, например, путем метилирования ДНК. Фактически, с осознанием существования зрелых и незрелых клеток был обнаружен новый уровень управления клетками. То есть, геном у всех клеток идентичен, но режим работы, в котором он находится – различен.
В различных органах и тканях взрослого организма существуют частично созревшие стволовые клетки, готовые быстро дозреть и превратиться в клетки нужного типа. Они называются бластными клетками. Например, частично созревшие клетки мозга – это нейробласты, кости – остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Роль стволовых клеток становится понятной при рассмотрении развития организма человека, представленного на рисунке 3. Это развитие начинается с оплодотворения яйцеклетки и образования зиготы, которая дает начало целому организму. Оплодотворенная яйцеклетка тотипотентна – она обладает неограниченным потенциалом в том смысле, что ее одной достаточно для формирования и развития нормального плода при соответствующих условиях. В первые часы после оплодотворения она делится с образованием идентичных тотипотентных клеток, и любая из них, будучи имплантирована в матку женщины, способна дать начало развитию плода. Примерно через четверо суток после оплодотворения, когда проходит несколько циклов клеточного деления, тотипотентные клетки начинают специализироваться с образованием сферической структуры, называемой бластоцистой. У бластоцисты есть наружный слой и внутренняя полость, где образуется внутренняя клеточная масса. Из наружного слоя развивается плацента и другие поддерживающие структуры, необходимые для формирования плода, а из внутренней клеточной массы – практически все органы и ткани самого плода. Клетки внутренней клеточной массы плюрипотентны – их наличие является необходимым, но не достаточным условием формирования плода. Если их имплантировать в матку женщины, то беременность не наступит.
Плюрипотентные клетки подвергаются дальнейшей специализации с образованием стволовых клеток, которые дают начало еще более специализированным клеткам, обладающими специфическими функциями. Так, из кроветворных (гемопоэтических) стволовых клеток развиваются эритроциты, лейкоциты и тромбоциты, а из стволовых клеток кожи – различные типы клеток этой ткани. О стволовых клетках говорят, что они полипотентны. Полипотентные стволовые клетки присутствуют не только у эмбриона, но и в организме новорожденного и взрослого человека. Так, гемопоэтические стволовые клетки, находящиеся в основном в костном мозге, а также в небольшом количестве циркулирующие в крови, ответственны за постоянное образование новых клеток крови взамен разрушенных, и этот процесс продолжается всю жизнь [2].
studfiles.net
