Озоновый слой расположен в верхней части стратосферы – Где находится озоновый слой? Что такое озоновый слой и почему его разрушение вредно?
Озоновый слой — Википедия
Материал из Википедии — свободной энциклопедии
 Озоновый слой в атмосфере
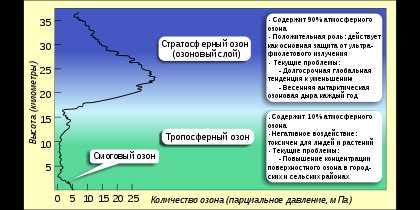
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достат
ru.wikipedia.org
Озоновый слой — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, О3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (О2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жесткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (315—280 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×10
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Механизм Чепмена
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
- О2 + hν → 2О.
- О2 + O → О3.
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
- О3 + hν → О2 + О.
- О3 + O → 2О2.
Пути гибели озона
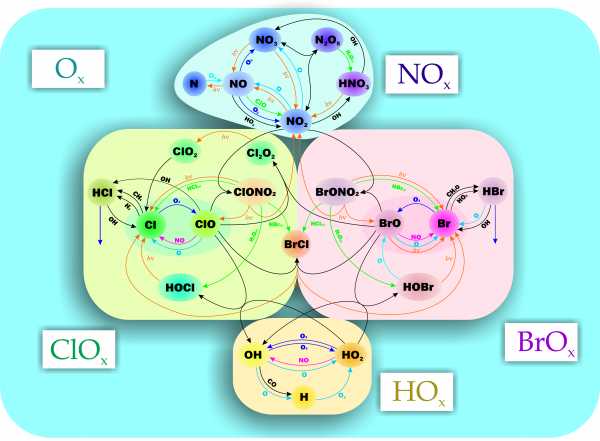
Кроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
- N2O + O(1D) → NO + NO
- О3 + NO → NO2 + О2
- NO2 + О → NO + О2
Водородный цикл (HOx
- Н2O + O → OH + OH
- ОН + О3 → НО2 + О2
- НО2 + О3 → ОН + 2О2
Хлорный цикл (ClOx):
- CFCl3 + hν → CFCl2 + Cl
- Cl + O3 → ClO + O2
- ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств на разных высотах:[4]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,25 | |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Напишите отзыв о статье «Озоновый слой»
Примечания
- ↑ Matsumi Y., Kawasaki M. (2003). «Photolysis of Atmospheric Ozone in the Ultraviolet Region».
- ↑ Gehrels N., Claude M. Laird, Charles H. Jackman, John K.M. Cannizo, Barbara J. Mattson, Wan Chen (2003) Ozone Depletion from Nearby Supernovae. The Astrophysical Journal, 585 : 1169—1176.
- ↑ И.К. Ларин [school-collection.edu.ru/catalog/res/9dc0c883-954f-51e8-e361-182fc14ddfab/view/ Химия озонового слоя и жизнь на Земле] // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10—15.
- ↑ Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000
См. также
Ссылки
- [www.anofdi.narod.ru/ozon.htm Озоновый слой Земли.]
- [redandr.blogspot.com/ Химия озонового слоя.]
Статьи и обзоры
- [www.planet.elcat.kg/?cont=wclim&id=2 Озон в атмосфере. Озоновый слой — ультрафиолетовый щит Земли]
- [nauka.relis.ru/09/0101/09101074.htm Химия и алхимия озонового слоя]
- [www.meteo.lv/public/27108.html Охрана озонового слоя в мире]
Международные соглашения
- [web.archive.org/web/20100210114052/zelenyshluz.narod.ru/conv_air/vienna.htm Венская конвенция об охране озонового слоя]
- [web.archive.org/web/20100209092728/zelenyshluz.narod.ru/conv_air/montreal.htm Монреальский протокол по веществам, разрушающим озоновый слой]
Отрывок, характеризующий Озоновый слой
– А, вот как! – сказал он. – Какими судьбами? Вот не ждал.В то время как он говорил это, в глазах его и выражении всего лица было больше чем сухость – была враждебность, которую тотчас же заметил Пьер. Он подходил к сараю в самом оживленном состоянии духа, но, увидав выражение лица князя Андрея, он почувствовал себя стесненным и неловким.
– Я приехал… так… знаете… приехал… мне интересно, – сказал Пьер, уже столько раз в этот день бессмысленно повторявший это слово «интересно». – Я хотел видеть сражение.
– Да, да, а братья масоны что говорят о войне? Как предотвратить ее? – сказал князь Андрей насмешливо. – Ну что Москва? Что мои? Приехали ли наконец в Москву? – спросил он серьезно.
– Приехали. Жюли Друбецкая говорила мне. Я поехал к ним и не застал. Они уехали в подмосковную.
Офицеры хотели откланяться, но князь Андрей, как будто не желая оставаться с глазу на глаз с своим другом, предложил им посидеть и напиться чаю. Подали скамейки и чай. Офицеры не без удивления смотрели на толстую, громадную фигуру Пьера и слушали его рассказы о Москве и о расположении наших войск, которые ему удалось объездить. Князь Андрей молчал, и лицо его так было неприятно, что Пьер обращался более к добродушному батальонному командиру Тимохину, чем к Болконскому.
– Так ты понял все расположение войск? – перебил его князь Андрей.
– Да, то есть как? – сказал Пьер. – Как невоенный человек, я не могу сказать, чтобы вполне, но все таки понял общее расположение.
– Eh bien, vous etes plus avance que qui cela soit, [Ну, так ты больше знаешь, чем кто бы то ни было.] – сказал князь Андрей.
– A! – сказал Пьер с недоуменьем, через очки глядя на князя Андрея. – Ну, как вы скажете насчет назначения Кутузова? – сказал он.
– Я очень рад был этому назначению, вот все, что я знаю, – сказал князь Андрей.
– Ну, а скажите, какое ваше мнение насчет Барклая де Толли? В Москве бог знает что говорили про него. Как вы судите о нем?
– Спроси вот у них, – сказал князь Андрей, указывая на офицеров.
Пьер с снисходительно вопросительной улыбкой, с которой невольно все обращались к Тимохину, посмотрел на него.
– Свет увидали, ваше сиятельство, как светлейший поступил, – робко и беспрестанно оглядываясь на своего полкового командира, сказал Тимохин.
– Отчего же так? – спросил Пьер.
– Да вот хоть бы насчет дров или кормов, доложу вам. Ведь мы от Свенцян отступали, не смей хворостины тронуть, или сенца там, или что. Ведь мы уходим, ему достается, не так ли, ваше сиятельство? – обратился он к своему князю, – а ты не смей. В нашем полку под суд двух офицеров отдали за этакие дела. Ну, как светлейший поступил, так насчет этого просто стало. Свет увидали…
– Так отчего же он запрещал?
Тимохин сконфуженно оглядывался, не понимая, как и что отвечать на такой вопрос. Пьер с тем же вопросом обратился к князю Андрею.
– А чтобы не разорять край, который мы оставляли неприятелю, – злобно насмешливо сказал князь Андрей. – Это очень основательно; нельзя позволять грабить край и приучаться войскам к мародерству. Ну и в Смоленске он тоже правильно рассудил, что французы могут обойти нас и что у них больше сил. Но он не мог понять того, – вдруг как бы вырвавшимся тонким голосом закричал князь Андрей, – но он не мог понять, что мы в первый раз дрались там за русскую землю, что в войсках был такой дух, какого никогда я не видал, что мы два дня сряду отбивали французов и что этот успех удесятерял наши силы. Он велел отступать, и все усилия и потери пропали даром. Он не думал об измене, он старался все сделать как можно лучше, он все обдумал; но от этого то он и не годится. Он не годится теперь именно потому, что он все обдумывает очень основательно и аккуратно, как и следует всякому немцу. Как бы тебе сказать… Ну, у отца твоего немец лакей, и он прекрасный лакей и удовлетворит всем его нуждам лучше тебя, и пускай он служит; но ежели отец при смерти болен, ты прогонишь лакея и своими непривычными, неловкими руками станешь ходить за отцом и лучше успокоишь его, чем искусный, но чужой человек. Так и сделали с Барклаем. Пока Россия была здорова, ей мог служить чужой, и был прекрасный министр, но как только она в опасности; нужен свой, родной человек. А у вас в клубе выдумали, что он изменник! Тем, что его оклеветали изменником, сделают только то, что потом, устыдившись своего ложного нарекания, из изменников сделают вдруг героем или гением, что еще будет несправедливее. Он честный и очень аккуратный немец…
– Однако, говорят, он искусный полководец, – сказал Пьер.
– Я не понимаю, что такое значит искусный полководец, – с насмешкой сказал князь Андрей.
– Искусный полководец, – сказал Пьер, – ну, тот, который предвидел все случайности… ну, угадал мысли противника.
– Да это невозможно, – сказал князь Андрей, как будто про давно решенное дело.
Пьер с удивлением посмотрел на него.
– Однако, – сказал он, – ведь говорят же, что война подобна шахматной игре.
– Да, – сказал князь Андрей, – только с тою маленькою разницей, что в шахматах над каждым шагом ты можешь думать сколько угодно, что ты там вне условий времени, и еще с той разницей, что конь всегда сильнее пешки и две пешки всегда сильнее одной, a на войне один батальон иногда сильнее дивизии, а иногда слабее роты. Относительная сила войск никому не может быть известна. Поверь мне, – сказал он, – что ежели бы что зависело от распоряжений штабов, то я бы был там и делал бы распоряжения, а вместо того я имею честь служить здесь, в полку вот с этими господами, и считаю, что от нас действительно будет зависеть завтрашний день, а не от них… Успех никогда не зависел и не будет зависеть ни от позиции, ни от вооружения, ни даже от числа; а уж меньше всего от позиции.
– А от чего же?
– От того чувства, которое есть во мне, в нем, – он указал на Тимохина, – в каждом солдате.
Князь Андрей взглянул на Тимохина, который испуганно и недоумевая смотрел на своего командира. В противность своей прежней сдержанной молчаливости князь Андрей казался теперь взволнованным. Он, видимо, не мог удержаться от высказывания тех мыслей, которые неожиданно приходили ему.
– Сражение выиграет тот, кто твердо решил его выиграть. Отчего мы под Аустерлицем проиграли сражение? У нас потеря была почти равная с французами, но мы сказали себе очень рано, что мы проиграли сражение, – и проиграли. А сказали мы это потому, что нам там незачем было драться: поскорее хотелось уйти с поля сражения. «Проиграли – ну так бежать!» – мы и побежали. Ежели бы до вечера мы не говорили этого, бог знает что бы было. А завтра мы этого не скажем. Ты говоришь: наша позиция, левый фланг слаб, правый фланг растянут, – продолжал он, – все это вздор, ничего этого нет. А что нам предстоит завтра? Сто миллионов самых разнообразных случайностей, которые будут решаться мгновенно тем, что побежали или побегут они или наши, что убьют того, убьют другого; а то, что делается теперь, – все это забава. Дело в том, что те, с кем ты ездил по позиции, не только не содействуют общему ходу дел, но мешают ему. Они заняты только своими маленькими интересами.
wiki-org.ru
Озоновый слой — Википедия
 Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)[1].
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Видео по теме
Механизм Чепмена
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
- O2 + hν → 2O.
- O2 + O → O3.
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
- O3 + hν → O2 + O.
- O3 + O → 2O2.
Пути гибели озона
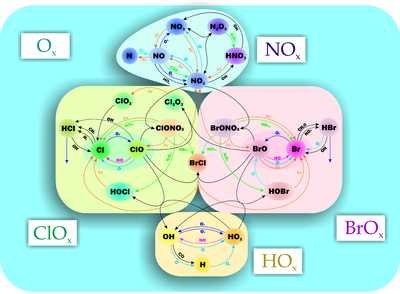 Стратосферная химия озона
Стратосферная химия озонаКроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
- N2O + O(1D) → NO + NO
- O3 + NO → NO2 + O2
- NO2 + O → NO + O2
Водородный цикл (HOx):
- H2O + O → OH + OH
- OH + O3 → HO2 + O2
- HO2 + O3 → OH + 2O2
Хлорный цикл (ClOx):
- CFCl3 + hν → CFCl2 + Cl
- Cl + O3 → ClO + O2
- ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств на разных высотах:[4]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Примечания
- ↑ Matsumi Y., Kawasaki M. (2003). «Photolysis of Atmospheric Ozone in the Ultraviolet Region». Chem. Rev. 103 (12): 4767–4781. DOI:10.1021/cr0205255. PMID 14664632.
- ↑ Gehrels N., Claude M. Laird, Charles H. Jackman, John K.M. Cannizo, Barbara J. Mattson, Wan Chen (2003) Ozone Depletion from Nearby Supernovae. The Astrophysical Journal, 585 : 1169—1176.
- ↑ И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10—15.
- ↑ Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000
См. также
Ссылки
Статьи и обзоры
Международные соглашения
wiki2.red
Где находится озоновый слой? Что такое озоновый слой и почему его разрушение вредно?
Озоносфера — слой атмосферы нашей планеты, задерживающий наиболее жесткую часть ультрафиолетового спектра. Некоторые виды солнечных лучей губительно действуют на живые организмы. Периодически озоносфера истончается, в ней появляются бреши разной величины. Через возникшие отверстия на поверхность Земли могут свободно проникать опасные лучи. Где находится озоновый слой? Что можно сделать для его сохранения? Обсуждению этих проблем географии и экологии Земли посвящена предлагаемая статья.
Что такое озон?
Кислород на Земле существует в виде двух простых газообразных соединений, входит в состав воды и очень большое число других распространенных неорганических и органических веществ (силикатов, карбонатов, сульфатов, белков, углеводов, жиров). Одно из более известных аллотропных видоизменений элемента — простое вещество кислород, его формула — О2. Вторая модификация атомов — О (озон). Формула этого вещества — О3. Трехатомные молекулы образуются при избытке энергии, например, в результате грозовых разрядов в природе. Далее мы выясним, что такое озоновый слой Земли, почему его толщина постоянно изменяется.
Озон при обычных условиях — газ синего цвета, обладающий резким, специфическим ароматом. Молекулярный вес вещества составляет 48 (для сравнения — Mr(возд.) = 29). Запах озона напоминает о грозе, ведь после этого природного явления молекул О3 в воздухе становится больше. Концентрация увеличивается не только там, где находится озоновый слой, но и близко к поверхности Земли. Это химически активное вещество является токсичным для живых организмов, но быстро диссоциирует (распадается). В лаборатории и промышленности созданы специальные приборы — озонаторы — для пропускания электрических разрядов через воздух или кислород.
Молекулы О3 обладают высокой химической и биологической активностью. Присоединение третьего атома к двухатомному кислороду сопровождается повышением запаса энергии и нестабильностью соединения. Озон легко распадается на молекулярный кислород и активную частицу, которая энергично окисляет другие вещества и убивает микроорганизмы. Но чаще вопросы, связанные с пахнущим соединением, касаются его скопления в атмосфере над Землей. Что такое озоновый слой и почему его разрушение вредно?

Непосредственно у поверхности нашей планеты всегда присутствует некоторое количество молекул О3, но с высотой концентрация соединения возрастает. Образование этого вещества происходит в стратосфере благодаря ультрафиолетовому излучению Солнца, несущему большой запас энергии.
Озоносфера
Существует область пространства над Землей, где озона намного больше, чем у поверхности. Но в целом оболочка, состоящая из молекул О3, — тонкая и прерывистая. Где находится озоновый слой Земли или озоносфера нашей планеты? Непостоянство толщины этого экрана не раз приводило в замешательство исследователей.
В атмосфере Земли всегда присутствует некоторое количество озона, наблюдаются значительные колебания его концентрации с высотой и по годам. Разберемся в этих проблемах после того, как выясним точное расположение защитного экрана из молекул О3.
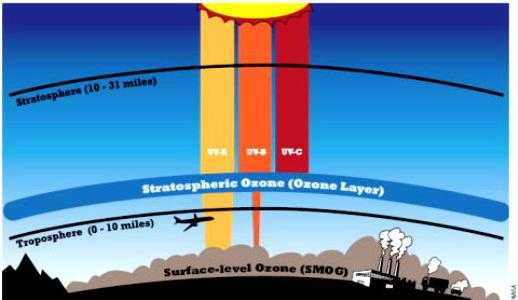
Где находится озоновый слой Земли?
Заметное повышение содержания молекул озона начинается на расстоянии 10 км и сохраняется до 50 км над Землей. Но то количество вещества, которое имеется в тропосфере, — это еще не экран. По мере удаления от земной поверхности возрастает плотность озона. Максимальные значения приходятся на стратосферу, ее область на высоте от 20 до 25 км. Здесь молекул О3 содержится в 10 раз больше, чем у поверхности Земли.
Но почему толщина, целостность слоя озона вызывает беспокойство ученых и простых людей? Бум по поводу состояния защитного экрана разразился в минувшем столетии. Исследователи обнаружили, что озоновый слой атмосферы над Антарктидой стал тоньше. Была установлена основная причина явления — диссоциация молекул О3. Разрушение происходит в результате совместного воздействия ряда факторов, ведущим среди них считается антропогенный, связанный с деятельностью человечества.
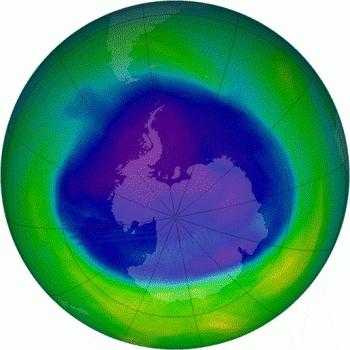
Озоновые дыры
В последние 30–40 лет ученые отмечают появление брешей в защитном экране над поверхностью Земли. Тревогу научного сообщества вызвали сообщения о том, что озоновый слой — щит Земли — интенсивно деградирует. Все СМИ в середине 1980 годов напечатали сообщения о «дыре» над Антарктидой. Исследователи обратили внимание, что эта брешь в слое озона увеличивается в весенний период. Основной причиной роста повреждения были названы искусственные и синтетические вещества — хлорфторуглероды. Наиболее распространенные группы этих соединений — фреоны или хладогены. Известно более 40 веществ, относящихся к данной группе. Они поступают из многих источников, потому что области применения включают в себя пищевую, химическую, парфюмерную и другие отрасли.
В состав фреонов, кроме углерода и водорода, входят галогены: фтор, хлор, иногда бром. Большое количество подобных веществ используется в качестве хладогентов в холодильниках, кондиционерах. Сами по себе фреоны устойчивы, но при высоких температурах и в присутствии активных химических агентов вступают в реакции окисления. Среди продуктов реакции могут быть соединения, токсичные для живых организмов.
Фреоны и озоновый экран
Хлорфторуглероды взаимодействуют с молекулами О3 и разрушают защитный слой над поверхностью Земли. Сначала истончение озоносферы приняли за естественное колебание ее толщины, что происходит постоянно. Но со временем отверстия, подобные «дыре» над Антарктидой, были замечены по всему Северному полушарию. Количество таких брешей увеличилось со времени первого наблюдения, но по размерам они меньше, чем над ледяным материком.
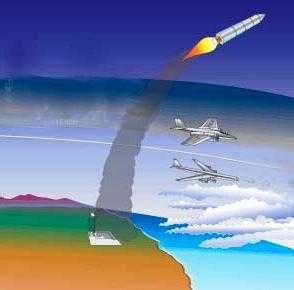
Первоначально ученые сомневались, что именно фреоны вызывают процесс разрушения озона. Это вещества с большой молекулярной массой. Как они могут достичь стратосферы, где находится озоновый слой, если намного тяжелее кислорода, азота и углекислого газа? Наблюдения за восходящими потоками в атмосфере во время грозы, а также проведенные эксперименты доказали возможность проникновения разных частиц с воздухом на высоту 10–20 км над Землей, где находится граница тропосферы и стратосферы.

Многообразие разрушителей озона
В зону озонового экрана также поступают оксиды азота, возникающие в результате сгорания топлива в двигателях сверхзвуковых самолетов и разных типов космических аппаратов. Дополняют список веществ, от которых разрушаются атмосфера, озонный слой, выбросы земных вулканов. Иной раз потоки газов и пыли достигают высоты 10–15 километров и разносятся на сотни тысяч километров.
Смог над крупными промышленными центрами и мегаполисами тоже вносит свою лепту в диссоциацию молекул О3 в атмосфере. Причиной увеличения размеров озоновых дыр также считается возрастание концентраций так называемых парниковых газов в атмосфере, где находится озоновый слой. Таким образом, глобальная экологическая проблема климатических изменений непосредственно связана с вопросами по поводу разрушения озона. Дело в том, что парниковые газы содержат вещества, вступающие в реакцию с молекулами О3. Озон диссоциирует, атом кислорода вызывает окисление других элементов.

Опасность потери озонового щита
Были ли бреши в озоносфере до полетов в космос, появления фреонов и других загрязнителей атмосферы? Перечисленные вопросы являются дискуссионными, но вывод напрашивается один: озоновый слой атмосферы необходимо изучать и сохранять от разрушения. Наша планета без экрана из молекул О3 лишается своей защиты от жестких космических лучей определенной длины, поглощаемых слоем активного вещества. Если озоновый экран тонкий или отсутствует, то основные жизненные процессы на Земле подвергаются опасности. Чрезмерное ультрафиолетовое излучение повышает риск мутаций в клетках живых организмов.
Охрана озонового слоя
Отсутствие данных о толщине защитного экрана в прошлые столетия и тысячелетия затрудняет прогнозы. Что произойдет, если озоносфера разрушится полностью? Несколько десятилетий медики отмечают рост числа людей, пораженных раком кожи. Это одно из заболеваний, к которому приводит чрезмерное ультрафиолетовое облучение.
В 1987 году несколько стран присоединились к Монреальскому протоколу, который предусматривал сокращение и полный запрет на производство хлорфторуглеродов. Это была только одна из мер, которые помогут сохранить озоновый слой — ультрафиолетовый щит Земли. Но фреоны по-прежнему вырабатываются промышленностью и поступают в атмосферу. Тем не менее соблюдение Монреальского протокола привело к сокращению озоновых дыр.
Что может сделать каждый для сохранения озоносферы?
Исследователи предполагают, что на полное восстановление защитного экрана потребуется еще несколько десятилетий. Это в том случае, если прекратится его интенсивное разрушение, что вызывает немало сомнений. Парниковые газы продолжают поступать в атмосферу, производятся запуски ракет и других космических аппаратов, растет парк воздушных судов в разных странах. Это означает, что ученым еще предстоит разработать эффективные пути охраны озонового щита от разрушения.
На бытовом уровне каждый человек тоже может внести свой вклад. Озон меньше будет подвергаться разложению, если воздух станет чище, будет меньше содержать пыли, сажи, токсичных выхлопов автотранспорта. Для охраны тонкой озоносферы необходимо прекратить сжигание отходов, наладить повсеместно их безопасную утилизацию. Транспорт нужно переводить на более экологически чистые виды топлива, повсеместно экономить разные виды энергоресурсов.
fb.ru
Озоновый слой Википедия
 Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)[1].
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Механизм Чепмена
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
- O2 + hν → 2O.
- O2 + O → O3.
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
- O3 + hν → O2 + O.
- O3 + O → 2O2.
Пути гибели озона
 Стратосферная химия озона
Стратосферная химия озонаКроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
- N2O + O(1D) → NO + NO
- O3 + NO → NO2 + O2
- NO2 + O → NO + O2
Водородный цикл (HOx):
- H2O + O → OH + OH
- OH + O3 → HO2 + O2
- HO2 + O3 → OH + 2O2
Хлорный цикл (ClOx):
- CFCl3 + hν → CFCl2 + Cl
- Cl + O3 → ClO + O2
- ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств на разных высотах:[4]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Примечания
- ↑ Matsumi Y., Kawasaki M. (2003). «Photolysis of Atmospheric Ozone in the Ultraviolet Region». Chem. Rev. 103 (12): 4767–4781. DOI:10.1021/cr0205255. PMID 14664632.
- ↑ Gehrels N., Claude M. Laird, Charles H. Jackman, John K.M. Cannizo, Barbara J. Mattson, Wan Chen (2003) Ozone Depletion from Nearby Supernovae. The Astrophysical Journal, 585 : 1169—1176.
- ↑ И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10—15.
- ↑ Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000
См. также
Ссылки
Статьи и обзоры
Международные соглашения
wikiredia.ru
Озоновый слой — Википедия
 Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)[1].
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Видео по теме
Механизм Чепмена
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
- O2 + hν → 2O.
- O2 + O → O3.
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
- O3 + hν → O2 + O.
- O3 + O → 2O2.
Пути гибели озона
 Стратосферная химия озона
Стратосферная химия озонаКроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
- N2O + O(1D) → NO + NO
- O3 + NO → NO2 + O2
- NO2 + O → NO + O2
Водородный цикл (HOx):
- H2O + O → OH + OH
- OH + O3 → HO2 + O2
- HO2 + O3 → OH + 2O2
Хлорный цикл (ClOx):
- CFCl3 + hν → CFCl2 + Cl
- Cl + O3 → ClO + O2
- ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств на разных высотах:[4]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Примечания
- ↑ Matsumi Y., Kawasaki M. (2003). «Photolysis of Atmospheric Ozone in the Ultraviolet Region». Chem. Rev. 103 (12): 4767–4781. DOI:10.1021/cr0205255. PMID 14664632.
- ↑ Gehrels N., Claude M. Laird, Charles H. Jackman, John K.M. Cannizo, Barbara J. Mattson, Wan Chen (2003) Ozone Depletion from Nearby Supernovae. The Astrophysical Journal, 585 : 1169—1176.
- ↑ И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10—15.
- ↑ Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000
См. также
Ссылки
Статьи и обзоры
Международные соглашения
wikipedia.green
Озоновый слой Вики
 Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озоновый слой в атмосфере
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)[1].
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 500—600 млн лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя[ | код]
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Механизм Чепмена[ | код]
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
- O2 + hν → 2O.
- O2 + O → O3.
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
- O3 + hν → O2 + O.
- O3 + O → 2O2.
Пути гибели озона[ | код]
 Стратосферная химия озона
Стратосферная химия озонаКроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
- N2O + O(1D) → NO + NO
- O3 + NO → NO2 + O2
- NO2 + O → NO + O2
Водородный цикл (HOx):
- H2O + O → OH + OH
- OH + O3 → HO2 + O2
- HO2 + O3 → OH + 2O2
Хлорный цикл (ClOx):
- CFCl3 + hν → CFCl2 + Cl
- Cl + O3 → ClO + O2
- ClO + O → Cl + O2
Доля в расходовании озона различных химических семейств на разных высотах:[4]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя[ | код]
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Примечания[ | код]
- ↑ Matsumi Y., Kawasaki M. (2003). «Photolysis of Atmospheric Ozone in the Ultraviolet Region». Chem. Rev. 103 (12): 4767–4781. DOI:10.1021/cr0205255. PMID 14664632.
- ↑ Gehrels N., Claude M. Laird, Charles H. Jackman, John K.M. Cannizo, Barbara J. Mattson, Wan Chen (2003) Ozone Depletion from Nearby Supernovae. The Astrophysical Journal, 585 : 1169—1176.
- ↑ И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10—15.
- ↑ Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press. 2000
См. также[ | код]
Ссылки[ | код]
Статьи и обзоры[ | код]
Международные соглашения[ | код]
ru.wikibedia.ru
