Форма углекислого газа – Транспортные формы, выделение углекислого газа из организма
Диоксид углерода — Википедия
Материал из Википедии — свободной энциклопедии
Перейти к навигации Перейти к поиску| Диоксид углерода | |
|---|---|
| Общие | |
| Систематическое наименование | Диоксид углерода |
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) |
| Хим. формула | CO2 |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 44,01 г/моль |
| Плотность | газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ |
| Динамическая вязкость | 8,5·10−5 Па·с (10°C, 5,7 МПа) |
| Энергия ионизации | 13,77 ± 0,01 эВ[2] |
| Скорость звука в веществе | 269 м/с |
| Термические свойства | |
| −78,5 °C | |
ru.wikipedia.org
На кривую диссоциации оксигемоглобина
1- при низком содержании СО2 , увеличении рН, снижении температуры, снижении концентрации 2-3 ДФГ
2- норма,
3- при высоком содержании СО2 , низком рН, высокой температуре, высокой концентрации 2-3 ДФГ
Транспорт углекислого газа
Перенос СО2 из клеток тканей в кровь тоже происходит путем диффузии, т.е. в силу разности напряжений СО2 по обе стороны гемато-паренхиматозного барьера, поскольку среднее значение СО2 в артериальной крови составляет около 40 мм.рт.ст., в то время как в клетках эта величина достигает 60 мм.рт.ст. Локально парциальное давление углекислого газа, а следовательно и скорость его диффузии, определяются в значительной мере скоростью продукции СО2 в клетках (т.е. интенсивностью окислительных процессов в том или ином органе).
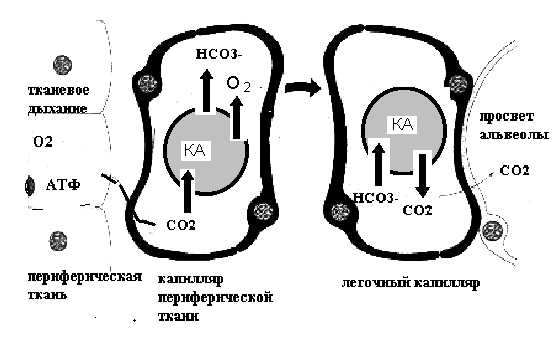
Рисунок 10. Транспорт углекислого газа кровью
КА – карбоангидраза эритроцитов
Поступающий в плазму из тканей углекислый газ диффундирует в эритроциты, где под действием фермента карбоангидразы превращается в угольную кислоту (рис. 10, 11). В плазме этого фермента нет, а в эритроцитах он увеличивает скорость реакции в 20000 раз. Так как при этом происходит освобождение кислорода из оксигемоглобина и образуется гемоглобин, который является более слабой кислотой, чем оксигемоглобин, угольная кислота вытесняет из гемоглобина калий и образуется бикарбонат калия. Избыток бикарбонатного аниона проникает в плазму, соединяется с натрием и образует бикарбонат натрия. Ионное равновесие поддерживается поступлением в эритроцит анионов хлора. В этом процессе важная роль принадлежит мембране эритроцита, обладающей очень слабой проницаемостью для катионов и высокой проницаемостью для анионов.
При прохождении крови через легочные капилляры происходит обратный процесс и двуокись углерода выделяется из крови в полость альвеол – рядом с бикарбонатом калия эритроцитов появляется более сильная, чем угольная, кислота: оксигемоглобин.
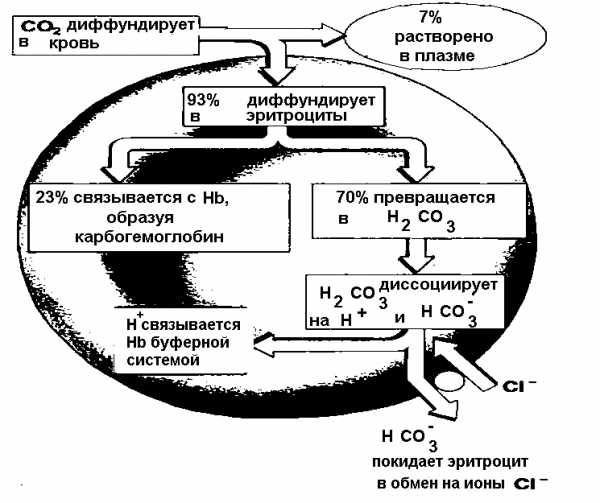
Рисунок 11 Транспортные формы углекислого газа
Часть углекислого газа соединяется в эритроцитах с дезоксигемоглобином через аминогруппы, образуя кардаминовые соединения. Реакция протекает следующим образом:
HbNH2+ CO2 HbNHCOOH HbNHCOO— + H+
Основные транспортные формы углекислого газа:
в виде бикарбонатов калия и натрия в эритроцитах и плазме 80 – 90 %
в виде карбаминовых соединений гемоглобина – 5 – 15 %
в физически растворенном виде – 5 – 10 %
Таким образом,
рассматривая все звенья газотранспортной
цепи в комплексе (рисунки 12 А и Б) можно
увидеть, что парциальные давления
(напряжения) дыхательных газов образуют
своего рода каскады, по которых поток
кислорода движется из атмосферы к
тканям, а поток СО

Р исунок
12А Этапы транспорта кислорода и
углекислого газа
исунок
12А Этапы транспорта кислорода и
углекислого газа
Рисунок 12Б.
Стадии газопереноса Регуляция дыхания
Переходя к обсуждению механизмов регуляции дыхания, необходимо вспомнить о том, что доставка кислорода из атмосферного воздуха к клеткам осуществляется несколькими взаимосвязанными, но относительно самостоятельными процессами. Перечислим эти процессы в соответствии с этапами доставки кислорода клеткам.
Таблица 3
studfiles.net
Формула углекислого газа в химии
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Электронная формула:
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Транспорт углекислого газа кровью | Физиология
В венозной крови содержится около 580 мл / л С02. В крови он содержится в трех формах: связанный в виде угольной кислоты и ее солей, связанный с гемоглобином и в растворенном виде.Химически связанный С02 находится в крови в одной из трех форм:
1) угольная кислота (Н2С03):
3) карбогемоглобин (ННЬС02).
В форме угольной кислоты переносится только 7% СОГ, бикарбонатных ионов — 70%, карбогемоглобин — 23%.
С02, который проникает в кровь, сначала подвергается гидратации с образованием угольной кислоты: С02 + Н20 Н2СОз.
Эта реакция в плазме крови происходит медленно. В эритроците, куда С02 проникает по градиенту концентрации, благодаря специальному ферменту — карбоангидразы — этот процесс ускоряется примерно в 10 000 раз. Поэтому эта реакция происходит в основном в эритроцитах. Создаваемая здесь угольная кислота быстро диссоциирует на Н + и НСО3-, чему способствует постоянное образование угольной кислоты: Н2С03 Н + + НСО3-.
В плазме крови НСО3-«взаимодействуя с катионами, создает соли угольной кислоты. В виде солей угольной кислоты транспортируется около 510 мл / л С02.
Кроме того, СОТ может связываться с белками: частично — с белками плазмы, но главным образом — с гемоглобином эритроцитов. При этом сог взаимодействует с белковой частью гемоглобина — глобина. Гем же остается свободным и сохраняет способность гемоглобина находиться одновременно в связи как с С02, так и 02. Таким образом, одна молекула НЬ может транспортировать оба газа.
В крови альвеолярных капилляров все процессы осуществляются в противоположном направлении. Главная из химических реакций — дегидратация — происходит в эритроцитах при участии той же карбоангидразы: Н + + НСО3 Н2С03 Н20 + С02.
Направление реакции определяется непрерывным выходом С02 с эритроцита в плазму, а из плазмы в альвеолы. В легких в связи с постоянным его выделением происходит реакция диссоциации карбогемоглобин:
ННЬС02 +02 ННЬ02 + С02-> НЬ02 + Н + + С02.
Взаимосвязь транспорта кислорода и диоксида углерода. Выше указывалось, что форма кривой диссоциации оксигемоглобина влияет на содержание С02 в крови. Эта зависимость связана с тем, что дезоксигемоглобином является слабой кислотой, чем оксигемоглобин, и может присоединять более Н + Вследствие этого при уменьшении содержания оксигемоглобина повышается степень диссоциации Н2СОз, а следовательно, увеличивается транспорт С02 кровью. Эта зависимость называется эффектом Холдейна.
Взаимосвязь обмена двуокиси углерода и кислорода ярко обнаруживается в тканях и легких. К тканям поступает оксигенированный кровь. Здесь под влиянием С02 усиливается диссоциация гемоглобина. Поэтому поступление кислорода в ткани способствует ускорению поглощения С02 кровью.
В легких происходят обратные процессы. Поступление 02 снижает сродство крови к С02 и облегчает диффузию С02 в альвеолы. Это, в свою очередь, активизирует ассоциации гемоглобина с кислородом.
fiziologija.vse-zabolevaniya.ru
Основная транспортная форма углекислого газа — КиберПедия
+
образуется с помощью фермента карбоангидразы
+
образуется в эритроцитах
—
— это СО2, растворенный в плазме крови
+
образуется при соединения СО2 с водой
+
— это транспорт в виде НСО3- ионов
##theme 28
##score 6
##type 2
##time 0:02:00
Фермент карбоангидраза:
+
в тканях превращает СО2 в НСО3- ионы
+
находится в эритроцитах
—
связывает СО2 с гемоглобином, приводя к образованию карбгемоглобина
+
в легких превращает НСО3- ионы в СО2
—
транспортирует СО2 в виде воздушных пузырьков
##theme 29
##score 5
##type 1
##time 0:02:00
Рассчитайте кислородную емкость крови, если содержание Нb составляет 100 г/л
+
134 мл/л
—
100 мл/л
—
200 мл/л
—
20 об.%
—
1,34 мл/л
##theme 29
##score 5
##type 1
##time 0:02:00
Рассчитайте кислородную емкость крови, если содержание Нb составляет 150 г/л
+
201 мл/л
—
134 мл/л
—
1,34 мл/л
—
150 мл/л
—
15 об.%
##theme 29
##score 5
##type 1
##time 0:02:00
Рассчитайте кислородную емкость крови, если содержание Нb составляет 130 г/л
+
174 мл/л
—
20 об.%
—
134 мл/л
—
13,4 об.%
—
200 мл/л
##theme 29
##score 5
##type 1
##time 0:02:00
Рассчитайте кислородную емкость крови, если содержание Нb составляет 120 г/л
+
160,8 мл/л
—
20 об.%
—
134 мл/л
—
13,4 об.%
—
200 мл/л
##theme 29
##score 5
##type 1
##time 0:02:00
Рассчитайте кислородную емкость крови, если содержание Нb составляет 90 г/л
+
120 мл/л
—
20 об.%
—
134 мл/л
—
13,4 об.%
—
200 мл/л
##theme 30
##score 5
##type 1
##time 0:02:00
Выберите фактор, который снижает сродство гемоглобина к кислороду:
—
снижение рСО2 крови
+
повышение содержания в эритроцитах 2,3-дифосфоглицерата
—
снижение температуры крови
—
повышение рН крови
##theme 30
##score 5
##type 1
##time 0:02:00
Выберите фактор, который увеличивает диссоциацию оксигемоглобина:
+
повышение рСО2 крови
—
снижение содержания в эритроцитах 2,3-дифосфоглицерата
—
снижение температуры крови
—
повышение рН крови
##theme 30
##score 5
##type 1
##time 0:02:00
К увеличению диссоциации оксигемоглобина приводит:
+
снижение рН
—
снижение рСО2
—
снижение температуры
—
снижение концентрации 2,3-дифосфоглицерата в эритроцитах
##theme 31
##score 5
##type 1
##time 0:01:40
Увеличение концентрации 2,3- дифосфоглицерата в эритроцитах приводит к:
+
сдвигу кривой диссоциации Нb вправо
—
сдвигу кривой диссоциации Нb влево
—
снижению диссоциации оксигемоглобина
—
повышению сродства гемоглобина к кислороду
##theme 31
##score 5
##type 1
##time 0:01:40
Увеличение концентрации водородных ионов в крови (¯ рН) приводит к:
+
сдвигу кривой диссоциации Нb вправо
—
сдвигу кривой диссоциации Нb влево
—
снижению диссоциации оксигемоглобина
—
повышению сродства гемоглобина к кислороду
##theme 31
##score 5
##type 1
##time 0:01:40
Увеличение рСО2 крови приводит к:
+
сдвигу кривой диссоциации Нb вправо
—
сдвигу кривой диссоциации Нb влево
—
снижению диссоциации оксигемоглобина
—
повышению сродства гемоглобина к кислороду
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, сколько процентов HbО2 содержится в крови при рО2=60 мм рт.ст.?
+
90%
—
75%
—
60%
—
40%
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, сколько процентов HbО2 содержится в крови при рО2=40 мм рт.ст.?
—
90%
+
75%
—
60%
—
40%
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, сколько процентов HbО2 содержится в крови при рО2=27 мм рт.ст.?
—
90%
—
75%
+
50%
—
40%
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, при каком значении рО2 в крови содержится 75% HbО2?
+
40 мм рт.ст.
—
90 мм рт.ст.
—
25 мм рт.ст.
—
60 мм рт.ст.
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, при каком значении рО2 в крови содержится 90% HbО2?
—
40 мм рт.ст.
—
90 мм рт.ст.
—
25 мм рт.ст.
+
60 мм рт.ст.
##theme 32
##score 4
##type 1
##time 0:02:00
В соответствии с кривой диссоциации оксигемоглобина, при каком значении рО2 в крови содержится 50% HbО2?
+
27 мм рт.ст.
—
90 мм рт.ст.
—
40 мм рт.ст.
—
60 мм рт.ст.
##theme 33
##score 6
##type 4
##time 0:02:00
При вертикальном положении человека в покое:
в верхних долях легких
в средних долях легких
в нижних долях легких
кровоток максимальный
кровоток минимальный
кровоток средней величины
##theme 33
##score 5
##type 4
##time 0:02:00
При вертикальном положении человека в покое:
в верхних долях легких
в средних долях легких
в нижних долях легких
вентиляция максимальная
вентиляция минимальная
вентиляция средней величины
##theme 34
##score 5
##type 4
##time 0:02:00
Соотношения вентиляции (V) и кровотока (Q) в легких при вертикальном положении человека в покое:
в верхних долях легких
в средних долях легких
в нижних долях легких
V превышает Q
V и Q практически равны
V меньше чем Q
##theme 34
##score 6
##type 4
##time 0:02:00
Отношение V/Q (вентиляция / кровоток):
в верхних долях легких
в средних долях легких
в нижних долях легких
максимальное
минимальное
средней величины
##theme 35
##score 7
##type 1
##time 0:01:30
В ответ на снижение вентиляции альвеол в этих альвеолах происходит:
—
сужение артериол и повышение кровотока
+
сужение артериол и снижение кровотока
—
расширение артериол и повышение кровотока
—
расширение артериол и снижение кровотока
##theme 35
##score 7
##type 1
##time 0:01:30
Механизмом поддержания отношения V/Q (вентиляция / кровоток) в легких является:
—
снижение вентиляции альвеол при повышении кровотока
+
сужение сосудов легких при гипоксии (гиповентиляции)
—
расширение сосудов легких при гипоксии (гиповентиляции)
—
повышение вентиляции альвеол при снижении кровотока
##theme 36
##score 5
##type 2
##time 0:01:45
Активность инспираторного отдела дыхательного центра стимулируют импульсы от:
+
периферических хеморецепторов
+
центральных хеморецепторов
—
рецепторов растяжения легких
+
нейронов симпатических центров гипоталамуса
##theme 36
##score 5
##type 2
##time 0:01:45
Активность экспираторного отдела дыхательного центра повышают импульсы от:
—
периферических хеморецепторов
—
центральных хеморецепторов
+
рецепторов растяжения легких
+
нейронов пневмотаксического центра моста
—
терморецепторов
##theme 37
##score 5
##type 2
##time 0:01:40
Активность дыхательного центра повышают:
+
гипоксия
—
гипокапния
+
гиперкапния
+
ацидоз
+
активация симпатической нервной системы
##theme 37
##score 5
##type 2
##time 0:01:40
Активность дыхательного центра повышают:
+
гипоксия, гиперкапния, ацидоз
—
гипоксия, гипокапния, алкалоз
+
боль, эмоции
+
повышение температуры тела
+
активация симпатической нервной системы
##theme 37
##score 5
##type 2
##time 0:01:40
Активность дыхательного центра СНИЖАЮТ:
—
гипоксия
+
гипокапния
+
алкалоз
—
гиперкапния
—
активация симпатической нервной системы
##theme 37
##score 5
##type 2
##time 0:01:40
Активность инспираторного отдела дыхательного центра повышают:
+
гипоксия
—
алкалоз
+
гиперкапния
+
ацидоз
—
стимуляция рецепторов растяжения легких
##theme 38
##score 4
##type 1
##time 0:02:00
cyberpedia.su
Углекислый газ, он же углекислота, он же двуокись углерода…
- Углекислый газ
- бесцветный газ с едва ощутимым запахом не ядовит, тяжелее воздуха. Углекислый газ широко распространен в природе. Растворяется в воде, образуя угольную кислоту Н2CO3, придает ей кислый вкус. В воздухе содержится около 0,03% углекислого газа. Плотность в 1,524 раза больше плотности воздуха и равна 0,001976 г/см3 (при нулевой температуре и давлении 101,3 кПа). Потенциал ионизации 14,3В. Химическая формула – CO2.
В сварочном производстве используется термин «углекислый газ» см. ГОСТ 2601. В «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением» принят термин «углекислота», а в ГОСТ 8050 — термин «двуокись углерода».
Существует множество способов получения углекислого газа, основные из которых рассмотрены в статье Способы получения углекислого газа.
Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. При атмосферном давлении и температуре -78,5°С углекислый газ, минуя жидкое состояние, превращается в белую снегообразную массу «сухой лед».
Под давлением 528 кПа и при температуре -56,6°С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Двуокись углерода термически устойчива, диссоциирует на окись углерода и кислород только при температуре выше 2000°С.
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 + 2HCl = СО2 + CaCl2 + H2O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3. Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + H2O
- Жидкая двуокись углерода
- бесцветная жидкость без запаха, плотность которой сильно изменяется с изменением температуры. Она существует при комнатной температуре лишь при давлении более 5,85 МПа. Плотность жидкой углекислоты 0,771 г/см3 (20°С). При температуре ниже +11°С она тяжелее воды, а выше +11°С — легче.
Удельная масса жидкой двуокиси углерода значительно изменяется с температурой, поэтому количество углекислоты определяют и продают по массе. Растворимость воды в жидкой двуокиси углерода в интервале температур 5,8-22,9°С не более 0,05%.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При нормальных условиях (20°С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается. При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние. Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода — поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
Впервые жидкую двуокись углерода получили в 1823 г. Гемфри Дэви (Humphry Davy) и Майкл Фарадей (Michael Faraday).
- Твердая двуокись углерода
- «сухой лед», по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое — 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры. Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке металлов;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- для чистки поверхностей сухим льдом.
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Ранее препятствием для применения углекислоты в качестве защитной среды являлись поры в швах. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения оксиси углерода (СО) вследствие недостаточной его раскисленности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
СO2=CO+O
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Мэ + О = МэО
где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом — только в ванне. Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м3) углекислый газ оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией. Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м3 (0,5%).
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы. В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м3 углекислого газа. В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух. Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги
Баллон с двуокисью углерода окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Коэффициенты перевода объема и массы двуокиси углерода при Т=15°С и Р=0,1 МПа
Масса, кг | Объем газа, м3 |
|---|---|
1,848 | 1 |
1 | 0,541 |
Коэффициенты перевода объема и массы двуокиси углерода при Т=0°С и Р=0,1 МПа
Масса, кг | Объем газа, м3 |
|---|---|
1,975 | 1 |
1 | 0,506 |
weldering.com
Транспорт кислорода и углекислого газа кровью, формы анемии.
Транспорт О2 с помощью гемоглобина
Красный пигмент гемоглобин (Нb) состоит из белковой части (глобина) и собственно пигмента (гема). Молекулы составляют четыре белковые субъединицы, каждая из которых присоединяет гем-группу с двухвалентным атомом железа, находящимся в ее центре. В легких каждый атом железа присоединяет одну молекулу кислорода. Кислород переносится в ткани, где он отделяется. Присоединение О2 называется оксигенацией (насыщением кислородом), а его отсоединение – дезоксигенацией.
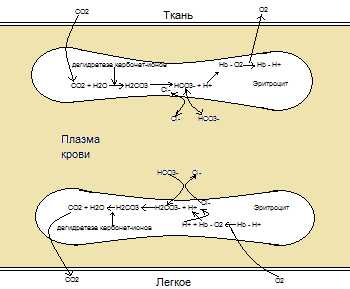
Около 10% углекислого газа (СО2), конечного продукта окислительного метаболизма в клетках тканей, переносится кровью физически растворенным п 90% — в химически связанной форме. Большая часть углекислого газа сначала диффундирует из клеток тканей в плазму, а оттуда в эритроциты. Там молекулы СО2 химически связываются и превращаются с помощью ферментов в намного более растворимые бикарбонат-ионы (НСО3—), которые переносятся в плазме крови. Образование СO2 из НСО3— значительно ускоряется с помощью фермента карбоангидразы, присутствующего в эритроцитах.
Большая часть (около 50-60%) образованных бикарбонат-ионов поступает из эритроцитов обратно в плазму в обмен на хлорид-ионы. Они переносятся в легкие и выделяются в процессе выдоха после превращения в СO2. Оба процесса — образование НСО3— и освобождение СO2, соответственно связаны с оксигенацией и дезоксигенацией гемоглобина. Дезоксигемоглобин — заметно более сильное основание, чем оксигемоглобин, и может присоединить больше ионов Н+ (буферная функция гемоглобина), таким образом способствуя образованию НСО3— в капиллярах тканей. В капиллярах легких НСО3— опять проходит из плазмы крови в эритроциты, соединяется с Н+-ионами и превращается опять в СO2. Этот процесс подтверждается тем фактом, что окисленная кровь выделяет больше протонов Н+. Намного меньшая доля СО2 (около 5-10%) связана непосредственно с гемоглобином и переносится как карбаминогемоглобин.
Гемоглобин и угарный газ
Оксид углерода (угарный газ, СО) является бесцветным газом без запаха, который образуется во время неполного сгорания и, как кислород, может обратимо связываться с гемоглобином. Однако сродство угарного газа к гемоглобину заметно больше, чем у кислорода. Таким образом, даже когда содержание СО во вдыхаемом воздухе составляет 0,3%, 80% гемоглобина связывается с угарным газом (НbСО). Так как угарный газ в 200-300 раз медленней, чем кислород, освобождается от связи с гемоглобином, его токсическое действие определяется тем, что гемоглобин больше не может переносить кислород. У тяжелых курильщиков, например, 5-10% гемоглобина присутствует как НbСО, в то время как при его содержании в 20% появляются симптомы острого отравления (головная боль, головокружение, тошнота), а 65% могут быть смертельным.
Содержание гемоглобина в крови (Нb)
Часто для оценки гемопоэза или для распознавания различных форм анемии определяют среднее содержание гемоглобина в эритроците (СГЭ). Оно вычисляется по формуле:
СГЭ = (содержание гемоглобина (г/100 мл крови) / количество эритроцитов (10ˉ6г/мкл))*10
Значение среднего содержания гемоглобина в эритроците лежит между 38 и 36 пикограммами (пг) (1 пг = 10ˉ¹² г). Эритроциты с нормальным СГЭ называются нормохромными (ортохромными). Если СГЭ низкое (например, из-за постоянной потери крови или дефицита железа), эритроциты называются гипохромными; если СГЭ высокое (например, при пернициозной анемии благодаря дефициту витамина В12), они называются гиперхромными.
Анемия определяется как дефицит (снижение количества) эритроцитов или сниженное содержание гемоглобина в крови. Диагноз анемии обычно ставится по содержанию гемоглобина, нижняя граница нормы достигает 140 г/л у мужчин и 120 г/л у женщин. Почти при всех формах анемии надежным симптомом заболевания является бледный цвет кожи и слизистых оболочек. Часто во время физических нагрузок заметно увеличивается сердечный ритм (увеличивая скорость кровообращения), а уменьшение кислорода в тканях приводит к одышке. Кроме того, встречается головокружение и легкая утомляемость.
Кроме железодефицитной анемии и хронической потери крови, например, из-за кровоточащих язв или опухолей в желудочно-кишечном тракте (гипохромные анемии), анемия может возникать при дефиците витамина В12. фолиевой кислоты или эритропоэтина. Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в незрелых клетках костного мозга и, таким образом, заметно влияют на деление и созревание эритроцитов (эритропоэз). При их нехватке образуется меньше эритроцитов, но они заметно увеличены из-за повышенного содержания гемоглобина (макроциты (мегалоциты), предшественники: мегалобласты), поэтому содержание гемоглобина в крови практически не изменяется (гиперхромная, мегалобластическая, макроцитарная анемия).
Дефицит витамина В12 нередко возникает из-за нарушения всасывания витамина в кишечнике, реже — вследствие недостаточного приема с пищей. Эта так называемая пернициозная анемия наиболее часто является результатом хронического воспаления в слизистой кишечника с уменьшением образования желудочного сока.
Витамин В12 всасывается в кишечнике только в связанном виде с фактором, находящимся в желудочном соке «внутренним фактором (Кастла)», который защищает его от разрушения пищеварительным соком в желудке. Так как печень может запасать большое количество витамина В12, то перед тем, как ухудшение всасывания в кишечнике повлияет на образование эритроцитов, может пройти 2-5 лет. Как и в случае дефицита витамина В12, дефицит фолиевой кислоты, другого витамина группы В, приводит к нарушению эритропоэза в костном мозге.
Есть две другие причины анемии. Одна из них — разрушение костного мозга (аплазия костного мозга) радиоактивным излучением (например, после аварии на атомной электростанции) или в результате токсичных реакций на лекарства (например, цитостатики) (апластическая анемия). Другая причина — это уменьшение продолжительности жизни эритроцитов в результате их разрушения или увеличенного распада (гемолитическая анемия). При сильной форме гемолитической анемии (например, следующей за неудачным переливанием крови), кроме бледности может наблюдаться изменение цвета кожи и слизистых оболочек на желтоватый. Эта желтуха (гемолитическая желтуха) вызвана увеличивающимся разрушением гемоглобина до билирубина (желтого желчного пигмента) в печени. Последнее приводит к увеличению уровня билирубина в плазме и его отложению в тканях.
Примером анемии, возникающей в результате наследственного нарушения синтеза гемоглобина, клинически проявляющейся как гемолитическая, служит серповидноклеточная анемия. При этой болезни, которая практически встречается только у представителей негроидных популяций, имеется молекулярное нарушение, приводящее к замене нормального гемоглобина на другую форму гемоглобина (HbS). В HbS аминокислота валин заменена на глутаминовую кислоту. Эритроцит, содержащий такой неправильный гемоглобин, в дезоксигенированном состоянии принимает форму серпа. Серповидные эритроциты более жесткие и плохо проходят через капилляры.
Наследственное нарушение у гомозигот (доля HbS в суммарном гемоглобине 70-99%) приводит к закупорке небольших сосудов и, таким образом, к постоянному повреждению органов. Пораженные этой болезнью люди обычно достигают зрелости только при интенсивном лечении (например, частичной замене крови, приеме анальгетиков, избегании гипоксии (кислородного голодания) и иногда — пересадке костного мозга). В некоторых регионах тропической Африки с высоким процентом малярии 40% популяции являются гетерозиготными носителями данного гена (когда содержание HbS менее 50%), у них таких симптомов не обнаруживается. Измененный ген обусловливает устойчивость к малярийной инфекции (селективное преимущество).
Регуляция образования эритроцитов
Образование эритроцитов регулируется гормоном почек эритропоэтином. Организм обладает простой, но очень эффективной системой регуляции для поддержания содержания кислорода и вместе с тем количества эритроцитов относительно постоянным. Если содержание кислорода в крови падает ниже определенного уровня, например, после большой потери крови или во время пребывания на больших высотах, постоянно стимулируется образование эритропоэтина. В результате усиливается образование эритроцитов в костном мозге, что увеличивает способность крови к переносу кислорода. Когда дефицит кислорода преодолевается увеличением числа эритроцитов, образование эритропоэтина опять уменьшается. Пациенты, нуждающиеся в диализе (искусственном очищении крови от продуктов обмена веществ), с нарушением функционирования почек (например, с хронической почечной недостаточностью) часто испытывают явный дефицит эритропоэтина и поэтому почти всегда страдают от сопутствующей анемии.
www.sportmassag.ru
