Ферменты участвующие в расщеплении белков – Фермент, расщепляющий белки. Какие функции выполняют белки?
Фермент, расщепляющий белки. Какие функции выполняют белки?
В человеческом организме содержание белка в нужных количествах является естественной необходимостью для нормального его функционирования. Данный компонент обеспечивает рост абсолютно всех клеток тела из-за того, что в нем содержатся в достаточном количестве необходимые аминокислоты. Большую роль играет белок в репликации РНК- и ДНК-молекул. Какие функции выполняют белки в организме? Какие ферменты отвечают за их расщепление? На эти и другие вопросы вы найдете ответы в статье.
Что такое белок
Белки являют собой наиболее важные для людей питательные элементы, содержащиеся в различной еде. По-иному белок в медицине еще называют протеином. Именно этот термин очень часто встречается в рекомендациях опытных врачей.
Какую роль играют белки в человеческом организме
Белок весьма важен для поддержания мышечных объемов тела человека. Полезен он также будет в случае восстановления поврежденных участков ткани, что очень часто происходит при сильных ушибах либо при обморожении и ожогах. Также протеин отлично справляется и с поддержанием здорового состояния волос или ногтей.
Для хорошего и стабильного функционирования иммунной системы белок является фактически незаменимым.
Какие существуют основные функции протеина
Итак, какие функции выполняют белки в организме? Можно выделить следующие:
- каталитическая функция – при помощи нее удается управлять происходящей в биологических системах той или иной химической реакцией;
- транспортная функция – перенос ко всем органам и тканям необходимого им кислорода;
- защитная функция основана на том, что белок в крови имеет склонность к свертыванию, что защищает человеческий организм от чрезмерной потери крови при возможных ранениях;
- сократительная функция отвечает за сокращение мышц тела человека при непосредственном участии белков актина и миозина;
- структурная функция обеспечивает образование биомембранных клеток;
- гормональная функция проводит правильное разделение питательных веществ внутри организма при помощи гормонов;
- питательная функция обеспечивает при помощи протеинов нужное количество калорий для жизнедеятельности человека, и именно это дает ему возможность получить необходимую энергию и физические силы.

Кому положено больше всего употреблять белок
Людям, активно занимающимся тем или иным видом спорта, настоятельно рекомендуется их врачами и тренерами как можно больше употреблять пищу, в которой содержится достаточное количество протеина. В среднем, согласно исследованиям врачей, профессиональным спортсменам необходимо содержанием белка от 2 до 3 грамм на 1 килограмм их тела.
Какие продукты больше всего содержат в своем составе протеина
Больше всего белка содержится в сое – на 100 грамм данного продукта приходится примерно 34 грамма белка. Если взять для примера другие продукты, то здесь примерное его содержание может существенно отличаться. Ниже представлены основные продукты, которые содержат протеин в достаточном количестве, а именно:
- сыр – от 14 до 20 грамм на 100 грамм продукта;
- рыба – от 12 до 16 грамм;
- мясо – от 14 до 20 грамм;
- фасоль и горох – в них этот показатель составляет около 20 грамм.
Но для того, чтобы в организм поступал белок в необходимом количестве, куда эффективнее употреблять мясо и блюда на молочной основе. Дело в том, что именно они содержат в себе полноценные аминокислоты. А вот с фасолью либо горохом, а также практически со всеми продуктами растительного происхождения дело обстоит несколько иначе. Они содержат внутри себя неполный набор аминокислот. Соя, в отличие от всех остальных сельскохозяйственных культур, здесь несколько преуспевает. Белок, который она содержит, обладает наиболее полноценными свойствами. После сои можно выделить также белок чечевицы.
К каким негативным последствиям может привести недостаток и переизбыток протеина в организме
Если организм недостаточно насыщен белком, вполне может наблюдаться нарушение работы печени, тонкой кишки или поджелудочной железы. Также данная проблема способна оказывать негативное воздействие на функционирование нервной системы.
При переизбытке белка он способен постепенно накапливаться в организме. Излишки протеина печень перерабатывает в глюкозу и разнообразные азотистые соединения, что также весьма отрицательно отображается на почках.
Некоторые ферменты, расщепляющие белки
Но что делать для того, чтобы уровень белков в организме не превышал необходимых пределов? Важную роль играют ферменты, расщепляющие данный компонент. К основным ферментам, на которые возлагается эта «миссия», можно отнести сахарозу, лактозу и амилазу. Доля амилазы при этом составляет большую часть, порядка 90% от общего содержания органических веществ. Это фермент, расщепляющий белки, который отлично справляется с протеинами, имеющими в своем химическом составе сложные углеводы.

Расщепление протеинов в желудке
Расщепление белка в желудке — процесс многоступенчатый. Около 97% протеинов, которые подверглись расщеплению, всасывается в виде свободных аминокислот непосредственно в кровь человека.
Желудочно-кишечный тракт благодаря своему ферментному аппарату с легкостью расщепляет белки в так называемые пептидные связи молекул. Все это происходит поэтапно, а также исключительно в избирательном порядке. В случае отсоединения одной аминокислоты от белковой молекулы образуется пептид и аминовая кислота. После этого от пептида через определенное время отщепляется еще одна аминовая кислота, затем следующая. Подобное действие происходит до тех пор, пока молекула полностью, без остатка, не будет расщеплена до аминокислоты.
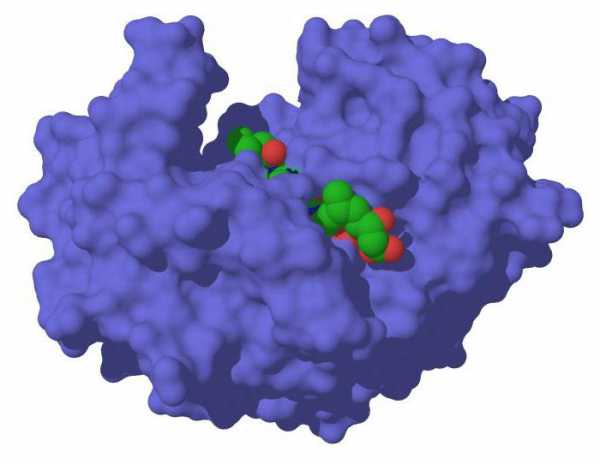
Пепсин: функция и основное действие
Пепсин имеет основное свое предназначение в организме человека, связанное с правильным распределением пищи, а также дальнейшим ее преобразованием в пептиды и различные аминокислоты В желудке образуется в результате естественного синтеза профермента пепсиногена пепсин.
Белок как растительного происхождения (полученный от употребления гороха, фасоли и иных культур), так и из мяса, сыра, молока и иных продуктов, добытых благодаря животным, легко расщепляется с помощью пепсина.
Какими свойствами обладает пепсин? Он имеет интересную функцию. Дело в том, что пепсин способен сворачивать молоко, преобразуя его в казеин и казеиноген. Таким способом зачастую производятся сыры и иные продукты, сделанные на основе молока.
В медицине также широко используется пепсин. Им можно лечить такие заболевания, как язва желудка, гастрит хронической формы, рак желудка. Достаточно эффективен пепсин, функция которого сейчас рассматривается, и при проблемах с пищеварительным трактом. В этом случае его применяют в качестве своеобразной заместительной терапии.
Применяя пепсин (фермент, расщепляющий белки) внутрь, нужно обязательно учитывать его высокую активность в кислой среде. Если кислотность желудка снижена, употреблять данный препарат следует непременно. Если пепсин в виде порошка, то его следует развести в 100 мл воды или в соляной кислоте (1-3% раствор), а если в виде таблетки, то растворить в воде.
Врачами рекомендуется применять пепсин от 2 до 3 раз на сутки. Причем желательно это осуществить перед приемом пищи. Среднестатистическая доза составляет от 0,2 до 0,5 грамм. Однако для ребенка она должна быть существенно снижена — ему достаточно будет употребить от 0,1 до 0,08 граммов этого лекарства.
Человеку, страдающему гастритом или язвой желудка, действие пепсина на пользу не пойдет. В таком случае его употребление строго запрещается.

Трипсин: функция фермента
Что такое трипсин? Это еще один своеобразный фермент, расщепляющий белки и пептиды. При этом он обладает функцией гидролиза сложных эфиров. Основная функция трипсина заключается в том, что он отлично контролирует работу пищеварительного процесса.
Лечит трипсин такие заболевания, как бронхит, пневмония, гайморит. Его можно использовать и при ожогах, при наличии различных гнойных ран, а также после операций. В стоматологии при заболеваниях полости рта данный препарат также весьма полезен.
Побочные эффекты, которые могут проявляться в случае применения трипсина, связаны с повышением температуры тела. Если трипсин был введен ингаляционным путем, может образоваться раздражение слизистой верхней оболочки дыхательных путей.
Применять трипсин, функция которого рассматривается в статье, желательно не более двух раз в день по 0,01 грамм. Детям рекомендуется употреблять его 1 раз в сутки, причем всего 0,0025 грамм.
На рану после ее обработки спиртом или зеленкой также можно наложить пропитанное трипсином полотно. Такое полотно должно находиться на поврежденном месте не менее суток. В данной ситуации трипсин (фермент, расщепляющий белки и пептиды) служит в качестве своеобразного средства защиты от различного рода инфекций.
Протеаза
Протеаза — фермент, точнее целая группа ферментов, которые находятся в желудочном соке. Они в свою очередь вырабатываются поджелудочной железой. Кроме того, протеаза также имеется и в кишечнике. Главная функция протеазы – это эффективное расщепление белка в организме.

Основной протеолитический фермент панкреатин
Существует ряд ферментов, которые активно участвуют в процессе пищеварения, а также успешно снимают любые воспалительные процессы. К ним также относится и панкреатин, который минимизирует негативное воздействие аллергии у человека на те или иные продукты. Также при возникновении внутренних заболеваний панкреатин подойдет для их лечения лучше всего.
Однако людям, которые испытывают ферментную недостаточность, рекомендуется употреблять те препараты, которые содержат в своем составе несколько разных ферментов. Их смело можно классифицировать как активные биологические добавки. Но такие лекарства очень внимательно нужно принимать и соблюдать при этом определенную периодичность. Желательно это все же делать по настоятельной рекомендации лечащего врача согласно его предписаниям. Проявлять собственную инициативу в этой ситуации не стоит. В особенности это делать весьма опасно, если человек не наделен определенными познаниями в области медицины. Помните, самолечение может только усугубить ситуацию, и определить недостаток белка и ферментов в организме невозможно без медицинского вмешательства. Будьте здоровы!
fb.ru
Переваривание белков | Кинезиолог
Переваривание белков в организме включает в себя 2 процесса: 1) денатурацию и 2) протеолиз.
Денатурация белков
Денатурация белка — это нарушение третичной структуры белковой молекулы и изменение её нативной (природной) конформации засчёт разрыва в ней большого количества слабых связей.
Так как разрыв внутримолекулярных химичпеских связей носит случайный характер, то молекулы одного и того же конкретного белка приобретают в водном растворе форму случайно сформировавшихся беспорядочных клубков. Они отличаются друг от друга по своей трёхмерной структуре, но не по аминокислотному составу. Как правило, потеря нативной конформации приводит к утрате специфической функции, характерной для данного белка. Этот процесс как раз и носит название денатурации белков. Важно отметить, что при денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается.
Рисунок: Денатурация молекулы белка
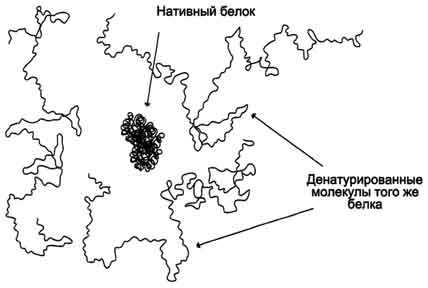
В денатурированном белке гидрофобные радикалы уже не спрятаны внутри гидрофобного ядра, как в нативной молекуле, а оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда такие молекулы могут объединяться друг с другом гидрофобными взаимодействиями. В результате этого растворимость белка снижается и происходит образование осадка. Денатурированные белки осаждаются.
Денатурация белков облегчает их переваривание. Компактная и плотная молекула нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами, которые расщепляют белки.
Термическая обработка мясной пищи перед употреблением не только улучшает её вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке. С медицинской точки зрения также важным является то, что кислая среда желудка оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей, и обезвреживает их, т.к. лишает денатурированные белки специфической активности.
В процессе переваривания белков кислота желудка и щелочь кишечника изменяют рН среды, засчёт чего происходит перераспределение связей в молекуле белка, что и приводит к его денатурации. В свою очередь денатурация белковых молекул облегчает их расщепление ферментами уже по пептидным связям.
Протеолиз (расщепление белка)
Расщепление белка до аминокислот — это основной процесс в переваривании белков в организме. Для расщепления белков нужна соответствующая среда, ферменты и вода. Вода необходима для проведения расщепления путём гидролиза.
Гидролиз — это расщепление вещества при участии воды.
Протеолиз — это гидролиз белков, т.е. расщепление белков при участии воды.
Гидролиз белков осуществляют протеолитические ферменты. Большое разнообразие протеолитических ферментов связано со специфичностью их воздействия на белок. Место приложения или действия протеолитического фермента связано со структурой радикалов, находящихся рядом с пептидной связью.
Ферменты, расщепляющие белки
Эндопептидазы — расщепляют белок изнутри молекулы.
Экзопептидазы – отщепляют аминокислотные остатки с конца белковой молекулы.
Пепсин — расщепляет связь между фенилаланином и тирозином, глутаминовой кислотой и цистином (метионином, глицином), между валином и лейцином.
Трипсин — расщепляет связь между аргинином (лизином) и другими аминокислотами.
Химотрипсин – расщепляет связь между ароматическими аминокислотами (триптофан, тирозин, фенилаланин) и метионином.
Аминопептидазы — действуют со стороны N – концевой аминокислоты.
Карбоксипептидазы — действуют со стороны С – концевой аминокислоты.
Для полного гидролиза белковой молекулы необходим набор большого количества различных протеолитических ферментов.
Гидролиз белка можно представить в виде схемы:
БЕЛКИ → АЛЬБУМОЗЫ → ПОЛИПЕПТИДЫ → ПЕПТИДЫ → ДИПЕПТИДЫ → АМИНОКИСЛОТЫ
Соответственно, осуществляют эти процессы ферменты-протеазы: химотрепсин / аминопептидаза / пепсин / пепсин / трипсин / карбоксипептадаза\ аминопептидаза.
Большинство белков подвергается гидролизу в верхнем (проксимальном, т.е. ближайшем) отделе тонкого кишечника, хотя процесс начинается в желудке.
Пепсин в желудке является неспецифической эндопептидазой, расщепляющей белки на более мелкие пептиды.
Проэнзимы (т.е. предшественники ферментов) секрета поджелудочной железы активируются дуоденальной энтерокиназой при попадании в кишечник, и затем трипсин продолжает активировать самого себя и другие энзимы.
Трипсин и химотрипсин расщепляют белки на более мелкие пептиды.
Карбоксипептидаза А и В отщепляют конечные аминокислоты из этих пептидов.
Конечным результатом такого внутрипросветного пищеварения являются некоторые свободные аминокислоты, но преимущественно мелкие пептиды. Внутренние соединения белков расщепляются эластазой, а нуклеиновые кислоты — некоторыми другими энзимами, такими как рибонуклеаза и дезоксирибонуклеаза.
По завершении процесса протеолиза свободные аминокислоты могут всасываться через тонкий кишечник, в то время как более крупные пептиды подвергаются дальнейшему расщеплению энзимами щеточной каемки, известными как пептидазы. Пока более крупные пептиды расщепляются в щеточной каемке, дипептиды абсорбируются в энтероцит и подвергаются дроблению пептидазой внутри клетки.
Существует семь различных видов пептидазы.
Абсорбция (т.е. всасывание) аминокислот — это энергозависимый активный процесс, тесно связанный с транспортировкой натрия, которая, в свою очередь, как предполагают, тесно связана с механизмами аденозинтрифосфатазы (ATPase), создающими трансэнтероцитный градиент. Для различных классов аминокислот используются разные носители. Из энтероцитов аминокислоты покидают тонкий кишечник через портальное кровообращение. Некоторая часть их используется энтероцитами для восстановления и как источник энергии.
Источники:
Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003. 779 с. ISBN 5-9231-0254-4
http://www.biochemistry.ru/biohimija_severina/B5873Content.html
kineziolog.su
Расщепление белков в пищеварительном тракте
 «Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
«Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
В течение всей жизни в организме происходят одновременно разрушения и биосинтез клеток и тканей. Эти противоположные, но тесно связанные между собой процессы — ассимиляция и диссимиляция — составляют основу жизни. Итак, в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главная роль в этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в образовании основных структурных элементов органов и тканей. Среди различных преобразований, присущих живой материи, основное место занимает белковый обмен.
В связи с тем, что белки являются азотсодержащими веществами, одним из методов, характеризующим состояние белкового обмена в организме, может быть определение баланса азота. У здорового человека при нормальном питании отмечается состояние белкового равновесия, когда поступление азота компенсирует его затраты. При отрицательном азотистом балансе количество выведенного азота превышает его количество, поступающее в составе белков. Такое состояние может наблюдаться при нарушении деятельности пищеварительной системы, белковом голодании и т п.
Положительный азотистый баланс бывает в тех случаях, когда количество выведенного азота меньше того, что поступает в составе белков. Это характерно для растущего организма, при беременности, при повышении активности процессов биосинтеза белка (например, при физических нагрузках).
Для синтеза белков в организме необходимы различные аминокислоты. Некоторые из них, образующиеся в самом организме, называются заменимыми. Аминокислоты, не синтезирующиеся в организме человека, называются незаменимыми. Они должны регулярно поступать с пищей. Белки, в состав которых входят заменимые и незаменимые аминокислоты в соотношениях, приближающихся к таковым в организме, называют полноценными.
Среди пищевых продуктов практически нет белков, которые полностью соответствуют этим требованиям. Наиболее близки к полноценному белки материнского молока, куриного яйца. Итак, для полного обеспечения здорового организма полноценными белками в суточный рацион должны быть включены различные пищевые продукты как животного, так и растительного происхождения.
Для нормальной жизнедеятельности человека необходимо поступление такого количества полноценного белка, которое будет покрывать все потребности организма. Оно зависит от пола, возраста, интенсивности труда и т.д. С учетом этих факторов разработаны нормы белкового питания. Недостаточное потребление белков приводит к нарушению процессов жизнедеятельности, ухудшению здоровья, а длительное белковое голодание неизбежно заканчивается гибелью.
Белки необходимы для организма, прежде всего, как пластический материал, из которого строятся клетки всех тканей, органов и систем. Однако пищевые белки не могут быть использованы без предварительного расщепления в организме, так как они имеют сложную структуру и видовую специфичность.
Расщепление (гидролиз) белков на аминокислоты, которые лишены видовой и тканевой специфичности, происходит в желудочно-кишечном тракте.
Расщепление белков в пищеварительном тракте (ЖКТ).
Переваривание питательных веществ (белков, углеводов, липидов) — это процесс гидролиза соответствующих соединений, входящих в состав продуктов питания, который происходит в пищеварительном тракте и приводит к образованию простых биомолекул. Последние за счет действия специфических механизмов мембранного транспорта всасываются в кровь или лимфу.
Переваривание белков начинается в желудке под действием желудочного сока. В состав желудочного сока входит соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка. Она денатурирует белок, облегчает его последующее расщепление. В состав желудочного сока входят кислые фосфаты и некоторые органические кислоты. Соляная кислота способствует превращению профермента пепсиногена, который секретируется главными клетками слизистой оболочки желудка, в активный протеолитический фермент пепсин.
Оптимальная концентрация водородных ионов для пепсина составляет 1,5 — 2,5, что соответствует кислотности желудочного сока в процессе пищеварения. При увеличении рН среды до 6,0 (в кишечнике) пепсин теряет свою активность. Пепсин относится к однокомпонентным ферментам, то есть к ферментам-протеинам. За сутки в желудке вырабатывается около 2 г пепсина.
Каталитическая активность пепсина желудка очень высока. Он катализирует расщепление пептидных связей в молекуле белка, образованных аминогруппами ароматических и дикарбоновых аминокислот. В результате действия пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты.
Кроме пепсина, в желудочном соке содержится протеолитический фермент гастриксин, оптимальное значение рН которого находятся в пределах 3,5 — 4,5. Гастриксин вступает в действие на последних этапах переваривания пищи в желудке.
В желудке грудных детей обнаружен сычужный фермент — химозин. Оптимум действия этого фермента рН 3,5 — 4,0. Под влиянием химозина в присутствии солей кальция казеиноген молока в ходе гидролиза превращается в казеин и молоко свёртывается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительной ткани (коллаген и эластин) и совсем не расщепляются кератин и протамины.
Частично переваренная полужидкая масса питательных соединений, которая образуется в желудке (химус) периодически поступает через пилорический клапан в двенадцатиперстную кишку. В эту часть пищеварительного канала поступают из поджелудочной железы протеолитические ферменты и пептидазы, которые действуют на пептиды, поступающие из желудка. Каталитическое действие этих ферментов происходит в слабощелочной среде (рН 7,5 — 8,0), которая образуется имеющимися в кишечном соке бикарбонатами.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком. Эта смесь содержит протеолитические ферменты, расщепляющие белки, альбумозы и пептоны до небольших пептидов, а затем до аминокислот. К протеолитическим ферментам относятся трипсин, химотрипсин, карбоксипептидазы, аминопептидазы и большая группа три- и дипептидаз.
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде профермента трипсиногена. Его активация происходит под действием фермента кишечного сока — энтерокиназы. Для процесса активации необходимы ионы Са2+. Процесс преобразования трипсиногена в трипсин осуществляется путем отщепления небольшого пептида с N-конца пептидной цепи фермента.
Трипсин гидролизует как нерасщепленные в желудке белки, так и высокомолекулярные пептиды, действуя главным образом на пептидные связи между аргинином и лизином. Оптимум рН для трипсина составляет 7,0 — 8,0. Трипсин делает сравнительно неглубокий гидролиз белка, образует полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может снижаться под влиянием ряда ингибиторов. К ним относятся основные пептиды с молекулярной массой 9000 ед. Они обнаружены в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеин, содержащийся в сырых яйцах — авидин.
Химотрипсин — второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде химотрипсиногена. Под действием трипсина химотрипсиноген переходит в активный фермент — химотрипсин. Действие химотрипсина подобно действию трипсина. Оптимум рН для обоих ферментов примерно одинаковый, химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты (тирозин, фенилаланин, триптофан), а также на пептидные связи, которые не подвергаются воздействию трипсина (метионин, лейцин).
Пептиды, которые образуютсяся в результате воздействия на белки пепсина, трипсина и химотрипсина в нижних отделах тонкой кишки, подвергаются дальнейшему расщеплению. Этот процесс осуществляют карбоксипептидазы, аминопептидазы. Эти ферменты относятся к металлоферментам. Они активируются двухвалентными ионами: Mg2+, Mn2+, Со2+, которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино- и карбоксипептидаз заключается в отщеплении от пептидов конечных аминокислот, имеющих свободную аминную или карбоксильную группу. Небольшие пептиды, которые остались нерасщепленными и состоят из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди- и триаминопептидазами. В соке поджелудочной железы присутствует фермент эластаза. Эластаза — эндопептидаза, которая также имеет широкую субстратную специфичность, расщепляя пептидные связи, образующиеся остатками аминокислот малого размера — глицина, аланина, серина.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника.
Следующая вторая статья из цикла «Обмен белков в организме человека» — «Обезвреживание продуктов гниения белков в кишечнике». Третья статья «Обмен аминокислот в тканях»
infection-net.ru
Ферменты
|
Пользовательского поиска |
Ферменты
Это вещества белковой природы, которые в качестве органи¬ческих катализаторов ускоряют течение химических реакций в организме и играют очень важную роль в обмене веществ. Все ферменты делятся на несколько классов.
Гидролазы — ферменты, катализирующие расщепление сложных органических соединений при участии воды.
Так, эстераза катализирует расщепление и синтез сложных эфиров.
Липаза участвует в процессе расщепления и синтеза жиров, она содержится не только в организме человека и животного, но и в семенах горчицы, фасоли, гороха, подсолнечника, кукурузе, овсе и т. д.
Xлорофилаза расщепляет хлорофилл до фитола. Она содержится во всех зеленых растениях.
Сульфатазы и фосфатазы расщепляют сложные эфиры, образованные соответственно серной и фосфорной кислотами. К сульфатазам, например, относится фермент, гидролизующий гликозид спнигрин, содержащийся в горчичном семени и др. Фосфатазы широко распространены в животных организмах и растениях. Они находятся в пшенице, картофеле, фасоли и многих других растениях.
Ферменты группы карбогидраз расщепляют гликозиды и полисахариды. Например, эмульсин расщепляет амигдалии, арбутаза — арбутин, мирозиназа — синигрин. Во всех частях растений, богатых углеводами, содержатся полиазы (целлюлаза, амилаза, инулиназа, пектиназа и др.), расщепляющие полисахариды. Во многих растениях встречаются амидазы.
Так, относящаяся к этой группе уреаза (расщепляет мочевину) имеется во многих растениях; нуклеаза (расщепляет нуклеиновые кислоты) находится в бобовых и тыквенных растениях, ячмене и др.; аспарагиназа и глютаминаза (катализируют гидролиз аспарагина и глютамина) встречаются в плесневых грибках, дрожжах, бактериях и высших растениях.
К группе протеаз относятся ферменты, участвующие в расщеплении белков и полипептидов до аминокислот. Типичными протеазами являются пищеварительные ферменты пепсин (выделяется железами слизистой оболочки желудка), трипсин (выделяется поджелудочной железой).
В млечном соке дынного дерева имеется протеолитический фермент папаин. Близкие к нему ферменты содержатся в дрожжах, млечном соке и семенах многих растений.
В растениях встречаются ферменты, относящиеся к классу лиаз, которые участвуют в самых разнообразных реакциях.
К классу оксидоредуктаз относятся ферменты, ускоряющие окислительно-восстановительные реакции. К ним принадлежат оксидаза, пероксидаза и каталазы, участвующие в процессах дыхания.
В настоящее время значительно расширяется применение ферментов в медицине.
Алфавитный указатель русских названий описанных растений
Латинские названия растений
Способы приготовления и применения препаратов в домашних условиях
Специфика овощей и фруктов
Культивируемые овощные и садовые растения, используемые как лекарственные
Указатель лекарственных растений по их лечебному применению в научной и народной медицине
Фитотерапия некоторых заболеваний
Лекарственные растения в диетическом питании
rasten.liferus.ru
Ферменты поджелудочной железы — анализы и симптомы при нехватке
Правильное усвоение питательных веществ и нормальный процесс пищеварения происходит благодаря поступлению в тонкий кишечник ферментов поджелудочной железы. С помощью панкреаса осуществляются обменные процессы в организме, контролируется сахар в крови, выделяются гормональные соединения, которые участвуют при регулировании биохимических механизмов.
Что такое ферменты для пищеварения
При помощи поджелудочной железы вырабатываются натуральные ферменты для пищеварения. Они участвуют при расщеплении основных питательных составляющих: углеводов, белков и жиров. Ферменты поджелудочной железы — вещества, которые разделяют сложные компоненты еды до простых частей, которые далее всасываются в клетки организма. В результате высокой специфичности влияния энзимов, происходит организация и регуляция важных процессов в организме. Выделяют три группы веществ:
- Липазы – ферменты, расщепляющие жиры. Вырабатываются поджелудочной железой, входят в состав желудочного сока.
- Протеазы – эти ферменты расщепляют белок и нормализуют микрофлору ЖКТ.
- Амилазы – вещества необходимы для переработки углеводов.
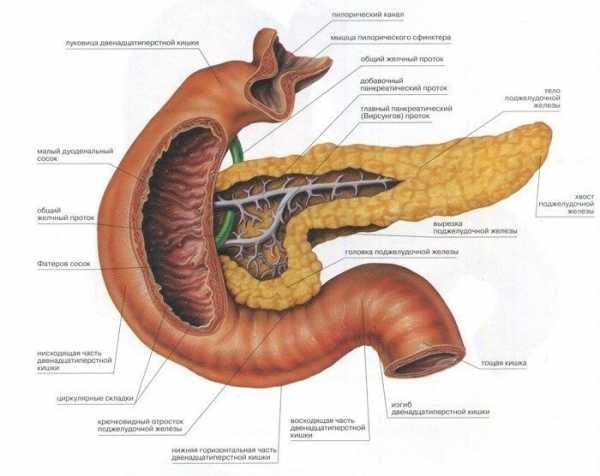
Функция ферментов поджелудочной
Самой большой железой у человека является поджелудочная. Если ее работа нарушается, это приводит к сбою деятельности многих систем. Функциональное предназначение данного органа – осуществлять внешнюю и внутреннюю секрецию, обеспечивающую пищеварение. Без ферментов, вырабатываемых железой, человеческий желудок не может нормально переварить пищу, а питательные вещества становятся неактивными и плохо всасываются в кровь.
Пищеварительные ферменты, вырабатываемые поджелудочной железой
Вследствие высокой специфичности воздействия ферментов, осуществляется тонкая организация важных жизненных процессов в организме. Пищеварительные энзимы высокоактивны, они расщепляют много разнообразных органических веществ, что способствует хорошему усвоению пищи. Перечень всех основных ферментов и их участие в процессе пищеварения представлены в таблице:
Форма секреции | Фермент | Действие |
Активная | Липаза | Гидролиз триглицеридов с образованием жирных кислот |
Активная | Амилаза | Расщепление полисахаридов (гликогена, крахмала) |
Профермент | Трипсин | Расщепляет протеины белка |
Профермент | Химотрипсин | Расщепляет внутренние связи белка |
Проэластаза | Эластаза | Переваривает эластин, протеин соединительной ткани |
Профермент | Карбоксипептидаза А и В | Расщепляет наружные связи белков, |
Протеолитические
Важные для пищеварения протеолитические ферменты разрывают пептидные связи в молекулах белка и расщепляют молекулярные продукты. С возрастом производится все меньше данных ферментов. Кроме того, на их синтез плохо влияют внешние факторы и инфекции. Поэтому данных веществ иногда может не хватать. Если кишечник будет мало содержать протеолитических энзимов, белки не смогут быстро перевариваться.
Липаза
Синтезируемый организмом человека энзим липаза, катализирует гидролиз нерастворимых эстеров и способствует растворению нейтральных жиров. Вместе с желчью данный фермент стимулирует переваривание жирных кислот и растительных витаминов Е, D, А, К, модифицируя их в энергию. Кроме того, липаза участвует при усвоении полиненасыщенных кислот и витаминов. Самым важным ферментом, благодаря которому осуществляется полноценная переработка липидов, считается панкреатическая липаза, которая расщепляет жиры, эмульгированные печеночной желчью.
Амилаза
Под термином амилаза подразумевается целая группа ферментов. Всего выделяют три вида вещества: гамма, альфа, бета. Для организма особое значение есть у альфы-амилазы (название имеет греческое происхождение). Она представляет собой вещество, расщепляющее сложные углеводы. Высокая концентрация данного энзима наблюдается в поджелудочной железе, небольшая – в слюнной железе.
Анализ на ферменты
Существуют специальные анализы, позволяющие определять энзимную активность поджелудочной железы. Исследуется ферментное средство, липаза, амилаза, которые можно обнаружить в сыворотке моче или крови, реже их можно найти в плевральной жидкости. Самый распространенный ферментный анализ – диагностирование сывороточной амилазы. Если амилаза больше 130, то это свидетельствует о возможном панкреатите, показатель от 60 до 130 свидетельствует о проблемах с поджелудочной. Превышение нормы в 3 раза указывает на острый панкреатит или перфорацию кишечника.
По сыворотке крови можно сделать анализ на липазу, он считается чувствительным, если идет речь о поражении поджелудочной. При заболевании липаза повышается на 90%. Если данный энзим не увеличен, и амилаза при этом большая, то стоит задуматься о другой болезни. На основе результатов биохимического анализа крови врач способен поставить точный диагноз, выбрать программу лечения. Исследование крови проводится натощак. Анализ сдавать лучше утром, когда показатели энзимов более объективны. Кроме сдачи крови могут быть проведены следующие анализы:
- Анализ кала.
- Специальные тесты, стимулирующие организм лекарствами и аминокислотами. После них по содержимому кишечника определяют необходимые энзимы.
- Анализ мочи. Собирается только в чистую одноразовую посуду.
- Анализ сыворотки крови.
Что такое ферментная недостаточность поджелудочной железы

Поджелудочная железа, как и любой другой орган, может дать сбой. Самым распространенным заболеванием является его недостаточность. При ферментативной нехватке веществ, которые вырабатываются поджелудочной железой, симптомом болезни становится неполное и затрудненное пищеварение, что за собой влечет нарушение обмена веществ и развитие патологических состояний. Причинами недостаточности могут быть:
- Пищевое отравление.
- Ингибиторы ферментов.
- Недостаток витаминов.
- Поражение тканей поджелудочной железы.
- Неправильное питание. Употребление соленой и жирной пищи.
- Снижение уровня белков.
- Пониженный гемоглобин.
- Плохая наследственность.
Список ферментных препаратов для улучшения пищеварения
Название препарата | Показания | Способ применения |
Абомин | Болезни ЖКТ, двенадцатиперстный кишки | Принимать 3 раза по 1 таблетке, не более 2-х месяцев |
Вестал | Недостаток секреторной способности ЖКТ, панкреатит, гастрит. | Внутрь по 3 таблетки во время еды. |
Мезим-Форте | При недостаточной переваривающей способности кишечника и желудка. | Взрослым пить по 2 таблетки перед едой, не запивая водой. Ребенку можно давать по назначению врача. |
Фестал | Абсолютная или относительная секреторная недостаточность поджелудочной железы. | Внутрь по 2 драже после еды. |
Энзистал | Недостаточность внешнесекреторной функции. | Внутрь по 2 драже после еды |
sovets.net
химическая структура и расщепление белков в организме человека
 Белки, которые также называют протеинами, являются основными структурными элементами человеческого тела
Белки, которые также называют протеинами, являются основными структурными элементами человеческого тела
и очень важными составляющими рациона: регулярное употребление белков необходимо для развития организма, регенерации тканей и процессов метаболизма, от которых зависит наше здоровье.
ХИМИЧЕСКАЯ СТРУКТУРА БЕЛКОВ
Белки состоят из атомов углерода, кислорода, водорода и азота, к которым иногда добавляются другие химические элементы.
В состав белков входят многочисленные основания — аминокислоты, соединенные между собой особым способом, благодаря которому образуются длинные или короткие цепи белков. Говоря о коротких цепях, обычно имеют в виду пептиды, которые
в зависимости от количества аминокислот, входящих в их состав, называются дипептадами, трипептидами. Цепь белков может быть сформирована большим количеством аминокислот: цепи могут состоять из ста аминокислот, а некоторые даже из тысячи.
ВИДЫ АМИНОКИСЛОТ
Все виды белков, существующих в природе, образованы из комбинаций двадцати различных аминокислот, каждая из которых имеет свою химическую структуру. Для формирования собственных белков человеческому организму нужно располагать всеми аминокислотами. Организм человека сам способен вырабатывать некоторые аминокислоты, которые называются неосновными, а другие может получать только извне, с пищей — они называются основными. Поэтому так важно употреблять различные продукты, в состав которых входят все типы аминокислот, особенно продукты, содержащие основные аминокислоты, — большей частью это продукты животного происхождения.
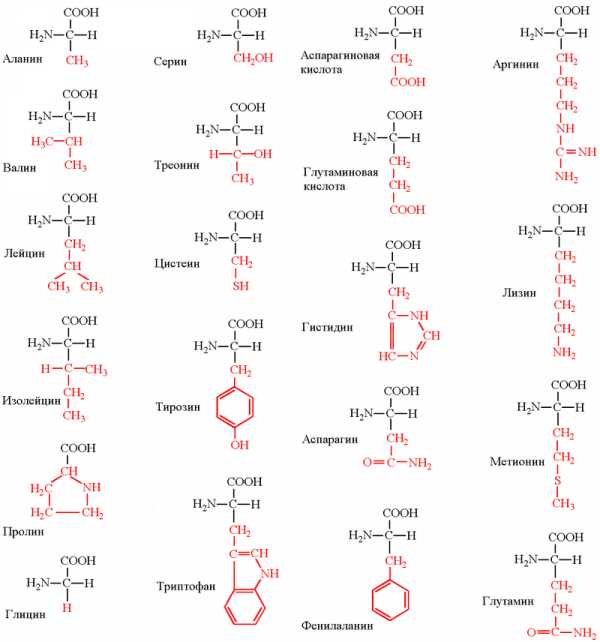
РАСЩЕПЛЕНИЕ БЕЛКОВ В ОРГАНИЗМЕ
Переваривание белков пищи происходит в желудке под действием желудочного сока: соляная кислота, выделяемая слизистой оболочкой желудка, активирует особый фермент — пепсин, который воздействует на белки и разрывает некоторые связи, высвобождая таким образом полипептидные цепи меньших размеров. Когда пища проходит в тонкий кишечник, ферменты поджелудочной железы высвобождают аминокислоты, дипептиды и трипептиды, которые всасываются клетками кишечника.
В клетках кишечника завершается расщепление аминокислот, дипептидов и трипептидов до свободных аминокислот, которые поступают в кровь. После разнесения аминокислот с током крови по организму, они комбинируются между собой, образуя белки.
ФУНКЦИИ БЕЛКОВ
Основная функция белков — строительная, поскольку из белков состоят мембраны клеток и многие ткани и органы человеческого тела; белки присутствуют даже в межклеточной жидкости и клеточном ядре. Кроме того, ферменты, антитела, некоторые гормоны и многие другие элементы, играющие важную роль в регуляции функций организма, также состоят из белков. Белки всегда могут быть использованы как источник энергии.
ПРОДУКТЫ ПИТАНИЯ
Почти все продукты питания содержат белки, исключение составляют лишь те, в состав которых входят только жиры, например масла. Больше всего белков содержится в мясе, рыбе, яйцах, молоке и молочных продуктах, овощах, сухофруктах, злаковых и продуктах из них. Меньшее количество белков содержат корнеплоды и некоторые фрукты.

tardokanatomy.ru
Переваривание белков начинается в желудке
Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Регуляция желудочного пищеварения
Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин.
Гастрин секретируется специфичными G-клетками:
- в ответ на раздражение механорецепторов,
- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков),
- под влиянием n.vagus.
Далее гастрин через системный кровоток достигает и стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он влияет на ECL-клетки и обеспечивает секрецию гистамина.
Гистамин, образующийся в энтерохромаффиноподобных клетках слизистой оболочки желудка (ECL-клетки, фундальные железы), выходит в кровоток и взаимодействует с Н2-рецепторами на обкладочных клетках, увеличивает в них синтез и секрецию соляной кислоты.
Закисление желудочного содержимого (pH 1,0) по механизму обратной отрицательной связи подавляет активность G-клеток, снижает секрецию гастрина и желудочного сока.
Соляная кислота
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии.
Н+,К+-АТФаза (протонная помпа) является мишенью действия лекарственных препаратов «ингибиторов протонной помпы» – омепразол, пантопразол и др., используемых для лечения заболеваний желудочно-кишечного тракта, связанных с повышенной кислотностью (гастриты, язвы желудка и 12-перстной кишки, дуоденит).
При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения.
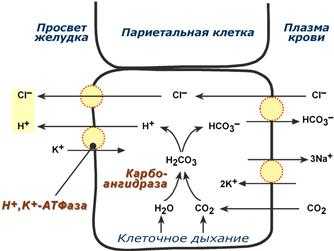
Синтез соляной кислоты
Функции соляной кислоты
- денатурация белков пищи,
- бактерицидное действие,
- высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы,
- высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты — тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться,
- превращение неактивного пепсиногена в активный пепсин,
- снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
- после перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи.
Кислая реакция желудочного сока обусловлена, главным образом, присутствием HCl, гораздо в меньшей степени иона H2PO4—, при патологиях (гипо- и анацидное состояние, онкология) свой вклад может вносить молочная кислота.
Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляет общую кислотность. Соляную кислоту, находящуюся в комплексе с белками, мукополисахаридами слизистой оболочки и продуктами переваривания, называют связанной соляной кислотой, оставшуюся часть — свободной соляной кислотой. Содержание свободной HCl подвержено изменениям, в то же время количество связанной HCl относительно постоянно.
Влияние гастрина и гистамина на обкладочные клетки сводится к усилению работы Н+,К+-АТФазы. Действие гастрина заключается в активации кальций-фосфолипидного механизма передачи сигнала, гистамин действует по аденилатциклазному механизму.
Изменение кислотности в желудке
Гипоацидное состояние развивается при снижении активности и/или количества обкладочных клеток, синтезирующих HCl. В результате могут развиваться самые разнообразные последствия, прямо или косвенно связанные с невыполнением соляной кислотой ее функций:
- снижение переваривания белков как в желудке, так и в кишечнике,
- активация процессов брожения в желудке, запах изо рта,
- активация процесса гниения белков в толстой кишке, бурление в кишечнике и метеоризм,
- проникновение недопереваренных продуктов в кровь и, как следствие, аллергические реакции,
- уменьшение высвобождения от белков и возникновение дефицита минеральных веществ (железо, медь, магний, цинк, йод и др),
- снижение высвобождения и всасывания ряда витаминов – развитие гиповитаминозов (B1, B2, B6, B12, H),
- снижение синтеза обкладочными клетками внутреннего фактора Касла и снижение всасывания витамина B12,
- снижение секреции кишечных гормонов и, как следствие, уменьшение выделения желчи и панкреатического сока,
- нарушение переваривания и всасывания липидов и, как следствие, развитие гиповитаминозов по жирорастворимым витаминам.
Гиперацидное состояние развивается при повышенной активности обкладочных клеток. Может приводить к клиническим проявлениям в виде воспаления стенки желудка, эрозии и язвенной болезни желудка и двенадцатипеперстной кишки.
Пепсин
Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр «прикрыт» N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что «раскрывается» активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
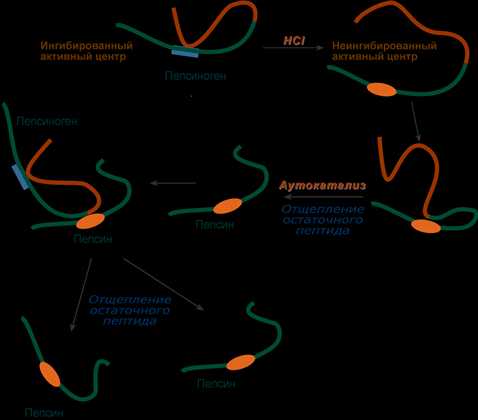
Превращение пепсиногена в пепсин
Оптимум рН для пепсина 1,5-2,0. Пепсин в основном гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д..
Связи, расщепляемые пепсином
В течение суток синтезируется около 2 г пепсина. Объем работы пепсина составляет примерно 10% от всех пептидных связей белков, попадающих в желудок.
Гастриксин
Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде профермента и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3,2-3,5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
Вы можете спросить или оставить свое мнение.
biokhimija.ru
