Агрегатное состояние крови – Диссертация на тему «Агрегатное состояние и кооперативные реакции компонентов цельной крови в норме и патологии» автореферат по специальности ВАК 03.01.02 — Биофизика
6.5. Система регуляции агрегатного состояния крови (раск)
Система РАСК — это система организма, которая обеспечивает: 1) сохранение жидкого состояния крови в норме; 2) свертывание крови в экстремальных состояниях; 3) своевременное восстановление стенок капилляров и других сосудов, которые повреждаются под действием тех или иных факторов. В настоящее время существует много противоречивых определений процессов свертывания крови и системы (систем), обеспечивающих остановку кровотечения, антисвертывание и фибринолиз. Идет дискуссия о целесообразности выделять отдельные системы или подсистемы. С введением понятия «система РАСК» (имеется одна система) существующая проблема решается путем выделения основных механизмов деятельности системы РАСК: 1) механизмы гемостаза обеспечивают остановку кровотечения; 2) механизмы антисвертывания поддерживают жидкое состояние крови; 3) механизмы фибринолиза обеспечивают растворение тромба (кровяного сгустка) и восстановление просвета сосуда (рекана-лизация).
138
139

Сосудисто-тромбоцитарный гемостаз
140
Этот вид гемостаза называют также первичным, он обеспечивает остановку кровотечения из мелких сосудов с низким кровяным давлением, диаметр которых не превышает 100 мкм. В норме кровотечение из мелких сосудов останавливается в течение 2-4 мин. Сосудисто-тромбоцитарный гемостаз осуществляется с помощью образования тромбоцитарной пробки (тромбоцитарного тромба). Он проходит в три стадии (рис. 6.2).1. Первичный спазм сосудов обусловлен выбросом в кровь в ответ на болевое раздражение адреналина и норадреналина и длит ся не более 10-15 с. В дальнейшем наступает вторичный спазм сосудов, обусловленный активацией тромбоцитов и отдачей в кровь сосудосуживающих агентов — адреналина, серотонина. Поврежде ние сосудов сопровождается немедленной активацией тромбоци тов, что обусловлено появлением высоких концентраций АДФ (из разрушающихся эритроцитов и травмированных сосудов), а также с обнажением субэндотелия, коллагеновых и фибриллярных струк тур. В результате создаются условия для адгезии, агрегации и об разования тромбоцитарной пробки.
Образование тромбоцитарной пробки. Адгезия тромбоцитов обусловлена наличием в плазме и тромбоцитах особого белка — фактора Виллебранда (Р\\0. Одновременно с адгезией происходит агрегация тромбоцитов, осуществляемая с помощью фибриногена — белка, содержащегося в плазме и тромбоцитах и образующего между ними связующие мостики, что и приводит к появлению тромбоцитарной пробки. Агрегация тромбоцитов может быть обратимой, что зависит от недостаточной дозы агрегирующего (активирующего) агента. Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются гранулы и содержащиеся в них биологически активные соединения — АДФ, адреналин, норадреналин, серотонин и др., что приводит к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина, резко усиливающего агрегацию и приводящего к появлению сети фибрина, в которой застревают эритроциты и лейкоциты. При этом тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется.
Ретракция тромбоцитарной пробки осуществляется благодаря контрактильному белку тромбостенину.
Существенную роль в сосудисто-тромбоцитарном гемостазе играют производные арахидоновой кислоты.
Коагуляционный механизм гемостаза
Коагуляционный (вторичный) гемостаз осуществляется с помощью свертывания крови (гемокоагуляции). При этом растворимый белок плазмы крови фибриноген переходит в нерастворимое состояние — фибрин, в результате чего образуется студнеобразный сгусток, закрывающий просвет поврежденного сосуда. В свертывании крови принимают участие много факторов свертывания крови. Они содержатся в плазме крови, форменных элементах и в тканях. Как правило, плазменные факторы свертывания крови об-
141
разуются в печени, и для образования большинства из них необходим витамин К. Плазменные факторы обозначаются римскими цифрами. Все факторы свертывания крови — в основном белки, большинство из них являются ферментами, в крови находятся в неактивном состоянии, активируются друг другом в процессе свертывания крови. Активные факторы обозначаются с буквой а, например, 1а, Па и т.д.
Фактор I (фибриноген) — белок плазмы крови, под влиянием тромбина переходит в фибрин, волокна которого составляют основу тромба. Принимает участие в агрегации тромбоцитов.
Фактор III (тромбопластин) входит в состав мембран клеток всех тканей и форменных элементов крови. Активирует фактор VII и, вступая с ним в комплекс, переводит фактор X в Ха. В плазме в физиологических условиях практически не содержится.
Фактор IV (Са2+) участвует в образовании комплексов факторов свертывания крови, входит в состав протромбиназы. Способствует агрегации тромбоцитов, связывает гепарин. Принимает участие в ретракции сгустка и тромбоцитарной пробки, тормозит фибринолиз.
Фактор V (проакцелерин) — глобулин, активируется тромбином. Усиливает действие фактора Ха на протромбин (входит в состав протромбиназы).
Фактор VI исключен из классификации, так как это фактор Уа.
Фактор VII (проконвертин) принимает участие в формировании протромбиназы по внешнему механизму. Активируется факторами III, ХНа, 1Ха, Ха.
Фактор VIII (антигемофилъный глобулин А)
Фактор IX (антигемофилъный глобулин В) активирует факторы X и VII.
Фактор X (Стюарта — Прауэра) является составной частью протромбина.
Фактор XI (предшественник тромбопластина) активируется фактором ХПа. Необходим для активации фактора IX.
Фактор XII (Хагемана, или контакта)
142
Фактор XIII (фибринстабилизирующий фактор, фибри-наза). Содержится практически во всех тканях и форменных элементах. Стабилизирует фибрин.
Фактор XIV (фактор Флетчера — прокалликреин). Участвует в активации факторов XII, IX и плазминогена. Переводит кининоген в кинин. Активируется фактором ХПа.
Фактор XV (фактор Фитцджеральда, Фложек, Вильям-са). Высокомолекулярный кининоген. Образуется в тканях. Активируется калликреином. Принимает участие в активации фактора XII и переводе плазминогена в плазмин.
143
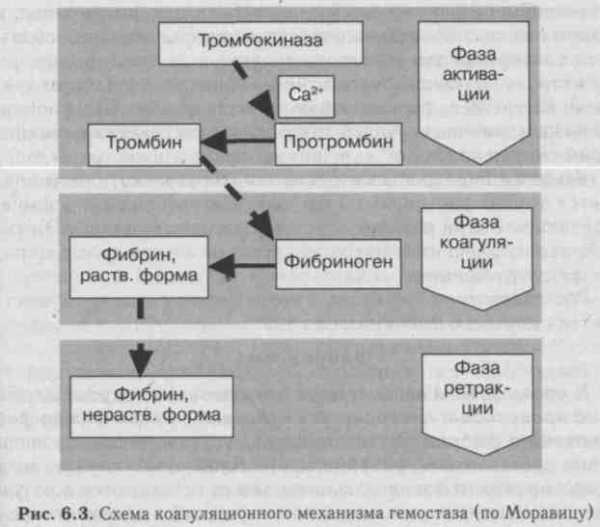
Процесс свертывания крови — это ферментативный, цепной (каскадный), матричный процесс перехода растворимого белка фибриногена в нерастворимый фибрин. Каскадным он называется потому, что в процессе гемокоагуляции происходит последовательная цепная активация факторов свертывания крови. Свертывание крови является матричным
Первая
фаза — образование
протромбиназы — может проходить по
внешнему и внутреннему механизму.
Внешний механизм предполагает
обязательное присутствие тромбопластина
(фактор III),
внутренний
же связан с участием тромбоцитов (фактор
Р3)
или разрушенных
эритроцитов. Вместе с тем внутренний
и внешний пути
образования протромбиназы имеют много
общего, так как активируются
одними и теми же факторами и приводят
в конечном итоге
к появлению одного и того же активного
фермента — фактора Ха,
выполняющего функции протромбиназы.
При этом тромбопла-стин
служит матрицей, на которой в присутствии
ионов Са
Вторая фаза процесса свертывания крови — переход фактора II в фактор Па — осуществляется под влиянием протромбиназы (фактор Ха) в присутствии фактора Уа и сводится к проте-олитическому расщеплению протромбина, благодаря чему появляется активный фермент тромбин.
Третья фаза процесса свертывания крови — переход фибриногена в фибрин — протекает в три этапа. На первом этапе под влиянием фактора Па от фибриногена отщепляются фибринопеп-тиды и образуется фибрин-мономер (фактор 1т). На втором, неферментативном, этапе благодаря процессу полимеризации фибрина-мономера формируются олигомеры и димеры фибрина, из которых за счет продольного и поперечного связывания образуются протофибриллы — легкорастворимый фибрин, или фибрин 5, быстро лизирующийся под влиянием протеаз (плазмина, трипсина). На третьем, ферментативном, этапе фактор XIII (фибрина-за, фибринстабилизирующий фактор) после активации тромбином в присутствии ионов Са2+ «прошивает» фибринополимеры дополнительными перекрестными связями, в результате чего появляется трудно растворимый фибрин, или фибрин 1 0п5о1иЫе). В результате этой реакции сгусток становится резистентным к фибринолитическим (протеолитическим) агентам и плохо поддается разрушению.
Восстановление кровотока в поврежденном сосуде осуществляется с помощью фибринолиза.
studfiles.net
Нейрогуморальная регуляция агрегатного состояния крови
1. Нервная регуляция.
> Основное рецепторно-афферентное звено: хеморецепторы каротидной и аортальной зон, реагирующие на тромбин, плазмин и другие факторы свертывающей и противосвертывающей систем; афферентные волокна IX и X черепных нервов.
> Главные центральные структуры:
• гипоталамус как интегратор вегетативных и эндокринных влияний на систему PACK;
• парасимпатические центры ствола и спинного мозга, симпатические центры спинного мозга.
> Эфферентное звено:
• симпатическая нервная система преимущественно через а-адренорецепторы ускоряет свертывание крови (активация фактора XII, высвобождение из сосудистой стенки и тканей тромбопластина, повышение тромбопластической активности жирных кислот) и усиливает фибринолиз за счет выделения из эндотелия тканевого активатора плазминогена и урокиназы;
• парасимпатическая нервная система ускоряет свертывание крови за счет выброса тромбопластина и усиливает фибринолиз за счет выброса активаторов плазминоге-на из сердца и сосудов, а также гепарина и антитромбина III.
2. Эндокринные влияния. Адреналин, глюкокортикоиды, СТГ, АДГ, кальцитонин, тестостерон, прогестерон первично вызывают гиперкоагуляцию и вторично активируют фибринолиз.
3. Гуморальные факторы. Са2+связывает гепарин и тормозит фибринолиз. Жирные кислоты снижают активность гепарина и выброс активаторов плазминогена из эндотелия. Протеаза адипсин, вырабатываемая в жировой ткани, участвует в тромбообразовании.
42. Дыхание: понятие, значение, основные этапы.
Дыхание — физиологическая функция, обеспечивающая газообмен (О2и СО2) между окружающей средой и организмом в соответствии с его метаболическими потребностями.
Отметим, что кислород (О2) и двуокись углерода (СО2) называютреспираторными илидыхательными газами.
Дыхание — совокупность физиологических процессов, обеспечивающая обмен респираторными газами (О2и СО2) между окружающей средой и клетками организма в соответствии с его метаболическими потребностями.
Обратите внимание, что в определении понятия дыхания необходимо подчеркнуть следующие моменты:
Дыхание — это физиологический процесс (совокупность процессов)
При дыхании рассматривается обмен только респираторных газов (О2и СО2)
При дыхании газообмен происходит между внешней средой (атмосферой или другой средой) и клетками организма. Клеточное дыхание традиционно изучает биохимия.
Дыхание обусловлено и происходит в соответствии с метаболическими потребностями организма (клеток)
Типы дыхания
Человеческая жизнь поддерживается за счёт воздушного непрямого лёгочного дыхания.
При воздушном дыхании внешней средой является воздух.
Может быть ещё водноедыхание. Например у рыб водное жаберное дыхание. Условия дыхания в воде и на суше сильно разнятся друг от друга. При самых благоприятных условиях в литре воды содержится всего 10 кубических сантиметров кислорода, тогда как в литре воздуха его 210, то есть в 20 раз больше . Не случайно, многие рыбы спорадически поднимаются на поверхность водоема и заглатывают воздух, дополняя тем самымводное дыхание воздушным. Для газообмена используется сильно васкуляризированные стенки ротовой полости, глотки, желудка, кишки либо плавательного пузыря (дериват кишечной трубки).
С этих позиций выход животных на сушу можно рассматривать как газовый преферендум (дыхательное поведение).
Дыхание может быть прямым и непрямым .
Для водных беспозвоночных животных — простейших, губок, плоских червей характерно прямое дыхание, т.е. диффузия респираторных газов (О2и СО2) через всю поверхность тела.
С увеличением массы тела в процессе эволюции возникают специальные органы дыхание, имеющие развитую поверхность (жабры, легкое) и вспомогательные образования, обеспечивающие их вентиляцию (непрямое дыхание).
У человека в дыхании принимает участие вся поверхность тела, от самого толстого эпидермиса пяток до покрытой волосами кожи головы. Особенно усиленно дышит кожа на груди, спине и животе. Интересно, что по интенсивности дыхания эти участки кожи значительно превосходят легкие. Так, например, с одинаковой по размеру дыхательной поверхности кислорода здесь может поглощаться на 28 %, а выделяться углекислого газа даже на 54 % больше, чем в легких.
studfiles.net
КАК ТЕОРЕТИЧЕСКАЯ ФИЗИКА ТРАКТУЕТ ЯВЛЕНИЕ СВЕРТЫВАНИЯ КРОВИ
Георгий Гурия, профессор, доктор физико-математических наук
Гематологический научный центр Минздравсоцразвития
Опубликовано: «Коммерсантъ Наука», №9 (9), 05.12.2011.
Тромбы убивают, в том числе и совершенно внезапно, гораздо больше людей, чем какие бы то ни было другие обстоятельства. Поэтому так важно понимать, каким образом тромбы возникают в сосудистом русле. Группа физиков решила проанализировать это с точки зрения законов термодинамики.
После того как в конце 1980-х – начале 1990-х годов свежие идеи в области неравновесной теории самоорганизации и математический аппарат теории двудольных графов были обкатаны на реакции Белоусова-Жаботинского (самоорганизующаяся химическая система из малоновой кислоты, сульфата церия и бромида калия), стало понятно, что мы располагаем инструментарием, который может быть применен и к другим, более значительным для человека системам, в том числе – к системе регуляции агрегатного состояния крови.
Особенность физиологической системы регуляции агрегатного состояния крови – ее способность без промедления давать ответ на нарушение целостности сосудистого русла и вступать в единоборство с мощным макроскопическим потоком крови – за счет формирования тромба в окрестности места повреждения. Кровь переходит из жидкого агрегатного состояния в полимеризированное, обеспечивающее быструю локальную репарацию сосуда. Временная, а тем более стойкая неспособность к эффективной репарации грозит массивной кровопотерей.
У этого замечательного защитного явления есть и оборотная сторона. Формирование внутрисосудистых тромбов и вызванные ими инфаркты и инсульты, например, в Германии – причина смерти граждан в два раза более частая, чем рак. Общая причина неспособности врачей оперативно вмешаться кроется в том, что система свертывания крови действует сверхбыстро: тромб до 12 см длиной и 4 мм диаметром может образоваться за полторы минуты.
Но скоротечность сердечно-сосудистых нарушений, крайне неприятное с медицинской и человеческой точки зрения обстоятельство, открывает принципиальную возможность эффективно использовать физико-математические подходы, так как позволяет выделять быстро протекающие процессы на фоне процессов медленных. Другими словами, можно отделять переменные от параметров, полагая последние несущественно меняющимися в процессе тромбообразования. Это позволяет снижать эффективную размерность рассматриваемой системы до вполне обозримого уровня.
Рис. 1. На схеме овалами обозначены вещества, участвующие в реакциях (показанных прямоугольниками).
Стрелка, направленная из овала в прямоугольник, указывает на то, что данное вещество выступает в качестве реагента,
а стрелка из прямоугольника в овал – что получающееся в ходе конкретной реакции вещество собственно и является продуктом данной реакции.
Смена агрегатного состояния
С физической точки зрения свертывание крови – не что иное, как смена агрегатного состояния, неравновесный фазовый переход. Согласно Джозайе Уилларду Гиббсу, фазовые переходы сводятся к смене устойчивости конкретной фазы при изменении параметров. Естественным языком описания многообразия состояний термодинамических систем, способных к смене агрегатного состояния, являются параметрические диаграммы, на которых выделяются области, соответствующие различным фазовым состояниям. Линии, разграничивающие смежные области, соответствуют границам устойчивости различных фаз.
Конечно, весьма заманчиво было построить аналогичную диаграмму состояний для крови. Эту задачу уже удалось решить для плазменной системы регуляции свертывания [1]. Общая схема молекулярных превращений при тромбообразовании показана на рис. 1.
Из схемы видно, что ключевую роль играет реакция 1, в ходе которой фибриноген (FG) под действием тромбина (IIa) превращается в фибрин-мономер (FM). Последующая полимеризация фибрин-мономеров в конечном счете ведет к образованию фибрин-полимерной сети (FP). Последняя и образует трехмерную нитчатую сетевую структуру, в которой в дальнейшем запутываются клетки крови, формируя тромб (рис.2).
Рис. 2. Структура фибриновых сетей.
Примечательно, что наработка тромбина (IIa) управляется целым каскадом реакций (рис.1). Красным на рис.1 выделены основные петли положительных обратных связей. Нарушения (в том числе генетические), проявляющиеся в отсутствии или дефиците циркулирующих в крови неактивных факторов системы свертывания, как правило, серьезно сказываются на заживлении ран. Скажем, отсутствие (или дефицит) VIII-фактора приводит к известному с древности заболеванию – гемофилии А. Дефицит IX фактора проявляется в виде гемофилии В. И в том, и в другом случае общий коэффициент усиления сигнала значительно меньше, чем был бы в норме в схожей ситуации, так как и VIII, и IX факторы непосредственно задействованы в петлях положительных обратных связей (рис.1).
Зеленым цветом символами А и В выделены каналы активации основного биохимического каскада по так называемому внутреннему (А) и внешнему (В) пути. В первом случае речь идет о соприкосновении с кровью любой отрицательно заряженной поверхности, на которой XII фактор системы свертывания способен трансформироваться в свою активную форму XIIa. Символом В условно обозначены молекулы тканевого фактора, попадание которых в кровоток, скажем, из раневой поверхности, влечет за собой конверсию VII-фактора в его активную форму VIIa с последующим ускорением реакции 10ex, обеспечивающей превращение X-фактора в его активную форму Xa.
Примечательно, что схема, представленная на рис.1 в виде двудольного графа, изоморфно отображается в систему обыкновенных дифференциальных уравнений вида:
где символами Zn и En обозначены концентрации неактивных и активных форм факторов системы свертывания крови.
Рассматриваемая система имеет стационарное решение, отвечает состояниям, когда все факторы свертывания циркулируют в крови в форме своих неактивных зимогенов с концентрацией Zn=Zn0, а все активные факторы отсутствуют En=En0=0. Это решение соответствует жидкому состоянию крови.
Не составляет труда найти и достаточное условие дестабилизации жидкого состояния, выполнение которого с неизбежностью влечет за собой взрывную наработку тромбина. Оно имеет вид:
Условие (2) в частности показывает, что концентрации неактивных факторов II, X, IX, и XI входят в него мультипликативно. Из чего следует, что в принципе дефицит одного из них может компенсироваться избытком любого другого. Другое очевидное следствие: скорости инактивации активных форм вышеперечисленных факторов, определяемые величинами k2, k10, k9, k11, тоже входят в это выражение (2) мультипликативно. А так как процессы инактивации определяются в основном молекулами антитромбина III (ATIII), то в выражении (2) в знаменателе неявно стоит четвертая степень концентрации ATIII. Тем самым из неравенства (2) становится очевидным, что потеря устойчивости жидкого состояния должна с неизбежностью последовать при достаточном уменьшении концентрации ATIII. А поскольку зависимость левой части выражения (2) от концентрации ATIII является степенной с высоким показателем -4, становится понятным, почему на практике коррекция активности ATIII должна производиться максимально нежно (за счет введения инфузоматом гепарина или фраксипарина).
Кровь как взрывчатка
Удалось аналитически провести исследование и для некоторых модифицированных моделей системы свертывания крови. Типичная диаграмма состояния представлена на рис.3. Параметрическая плоскость разбивается двумя кривыми на четыре области. Область I соответствует абсолютной устойчивости жидкого состояния крови (любые возмущения релаксируют). Область II отвечает состояниям, в которых стационарная концентрация тромбина постепенно должна увеличиваться по мере удаления изображающей точки от красной линии. Область III отвечает полностью свернувшейся крови. Самый большой интерес представляет область IV. При значениях параметров системы, принадлежащих данной области, система должна находиться в метастабильном состоянии. Это значит, что при значениях параметров из области IV жидкое состояние крови устойчиво лишь по отношению к возмущениям, не превышающим по амплитуде определенного порогового уровня (для величины последнего найдено явное выражение). Запороговые возмущения способны вызывать взрывную наработку тромбина.
Рис. 3. Диаграмма агрегатного состояния крови [5].
Именно в пределах физиологической нормы состояния системы свертывания крови должны быть метастабильными. То есть кровь должна быть жидкой, но одновременно готовой к свертыванию, если этого потребуют особые обстоятельства.
Рис. 4. На волокне фильтра представлены слипающиеся эритроциты.
Такое заключение незамедлительно ставит кровь не в один ряд с различными по реологии жидкостями, а заставляет смотреть на нее как на субстанцию особого рода [2], аналогичную по свойствам жидкой взрывчатке: всякое закритическое возмущение способно спровоцировать пороговую смену агрегатного состояния. А так как и сама величина порога активации стремится к нулю по мере приближения изображающей точки к красной границе области IV, то класс внешних возмущений, способных спровоцировать тромбообразование, будет расширяться.
Достижение красной границы соответствует абсолютной потере устойчивости регуляции. Аналогичные состояния в теории фазовых переходов лежат на кривых, называемых спинодалями.
С учетом давления
Сама мысль, что в крови может иметь место нечто похожее на спинодальный распад, сильно тонизирует. Открытие этого факта, как и построение диаграммы (рис.3) [1], дало автору основание задуматься более глубоко над тем, какого рода возмущения способны в принципе подрывать систему свертывания крови.
Рис. 5. Эритроциты, запутавшиеся в фибриновой сети.
Обсуждение проблемы с ведущими клиницистами, профессором Зиновием Баркаганом (1925-2006 гг.) и академиком Андреем Воробьевым привело к убеждению, что одного кинетического анализа реакционных превращений в системе свертывания крови совершенно недостаточно для понимания причин внезапного внутрисосудистого тромбообразования у человека.
Различные яды, лекарственные средства и химические агенты могут непосредственно влиять на способность крови к свертыванию. Но все клиницисты в один голос говорят, что внезапное падение артериального давления способно вызвать как внутрисосудистое диссеминированное свертывание, так и инсульт.
Это означает, что давление каким-то образом должно быть вовлечено в процессы регуляции агрегатного состояния крови. А поскольку распределение давления по системе кровообращения весьма прихотливое, то следовало начать с тех сосудов, органов и тканей, где риск тромбообразования наибольший.
Шампанское и метель
Наибольшее внимание, конечно, стоило уделить склерозированным сосудам, то есть сосудам с бляшками. Физическая причина того, почему бляшки представляются тромбогенно опасными, долгое время была неочевидна. Разговоры о турбулентности кровотока и нарушении эластичности сосудистых стенок были всего лишь разговорами. Проблема была сдвинута с мертвой точки благодаря активности двух сотрудников моей лаборатории – Александра Гузеватых [3] и Сергея Шевкопляса [4].
Рис. 6. Крупный тромб, возникший при тромбозе глубоких вен.
Выяснилось, что повышенная тромбогенность внутрисосудистых бляшек непосредственно связана с тем, что в их окрестности в кровотоке возникают вторичные течения, своего рода застойные зоны, способные накапливать тромбогенно опасные факторы свертывания крови. Существенно облегчается нуклеация, ведущая к множественному микротромбообразованию, которое внешне напоминает объемное вскипание шампанского или внезапно налетевшую метель, переходящую в буран.
С помощью ультразвуковых исследований аспиранты Светлана Узлова и Константин Гурия установили, что наблюдаемые акустически структуры в крови действительно обуславливаются появлением в крови фибриновых сгустков [5].
При многих патологиях, например, при мерцательной аритмии, врачам удается наблюдать не только солидные тромбы, но и всевозможные тени и нити в различных отделах системы кровообращения, в том числе в левом желудочке и правом предсердии. В свете полученных результатов эти ранее считавшиеся фантомными явления сегодня следует рассматривать как прогностически значимые, с высокой вероятностью свидетельствующие о развитии прогрессирующего нарушения гемостаза. А поскольку после многих операций на сосудах у врачей есть основания опасаться нежелательных последствий, обусловленных повышенной активированностью системы свертывания крови в лежащих ниже по течению отделах кровообращения, то использование ультразвуковых средств для неинвазивного мониторирования опасных районов представляется необходимым.
Литература
- Г.Т. Гурия. Макроскопическое структурообразование в динамике крови в свете теории неравновесных структур. МГУ 2002 г., диссертация на соискание степени д.ф.-м.н.
- Blut ist ein ganz besonderer Saft [Goethe JW (1906) Faust, Part 1 (trans: Swanwick A). George Routledge & Sons, London, Part I].
- А.П. Гузеватых. Пороговая гидродинамическая активация внутрисосудистого тромбообразования. 2000, диссертация на соискание степени к.ф.-м.н.
- С.С. Шевкопляс. Экспериментальное изучение пространственного тромбообразования в интенсивных потоках in vitro. МФТИ, 2000, магистерская диссертация.
- Uzlova S.G., Guria K.G., Guria G.Th. Acoustic determination of early stages of intravascular blood coagulation. // Philosophical Transactions of Royal Society A 2008; 366(1880), p.3649-3661.
Дополнительно:
- Математика и нелинейная механика. Т.3. Асимптотические методы в теории нелинейных колебаний / Н.Н. Боголюбов, Ю.А. Митропольский. – М.: Наука, 2005.
- E. Schrodinger. What is Life? The Physical Aspect of the Living Cell – Cambridge: University Press, 1944.
- Г. Хакен. Синергетика. М: Мир, 1980.
- Ю.Л. Климонтович Введение в физику открытых систем. М.: Янус-К, 2002.
- Guria G.Th., Herrero M.A., Zlobina K.E. A Mathematical model of blood coagulation induced by activation sources. Discrete and Continuous Dynamic Systems // DCDS-A, 2009, V. 25, N. 1, pp. 175-194; Guria G.Th., Herrero M.A., Zlobina K.E. Ultrasound detection of externally induced microthrombi cloud formatio: a theoretical study. J. Eng. Math. V. 66, N 1-3, pp.293-310.
www.hematology.ru
