Возбудители кишечных инфекций микробиология: Паразитарные заболевания
Гепатиты
По поводу диагностики и лечения данного вида заболеваний
у детей можно обратиться по телефону (8652) 24-13-61 (детское отделение, заведующий Яценко Наталья Александровна) — детский гепатологический центр.
у взрослых — по телефону (8652) 24-44-75 (взрослое отделение, заведующий Костенко Ольга Анатольевна) — взрослый гепатологический центр с амбулаторным приемом.
Что такое гепатит?Вирусные гепатиты — распространенные и опасные инфекционные заболевания. Они могут проявляться различно, но среди основных симптомов выделяют желтуху и боли в правом подреберье. Чтобы поставить диагноз гепатита, нужно сделать анализ крови, мочи, а в сложных случаях — биопсию печени.
Из всех форм вирусных гепатитов гепатит А является наиболее распространенным. От момента заражения до появления первых признаков болезни проходит от 7 до 50 дней. Чаще всего начало заболевания сопровождается подъёмом температуры и может напоминать грипп.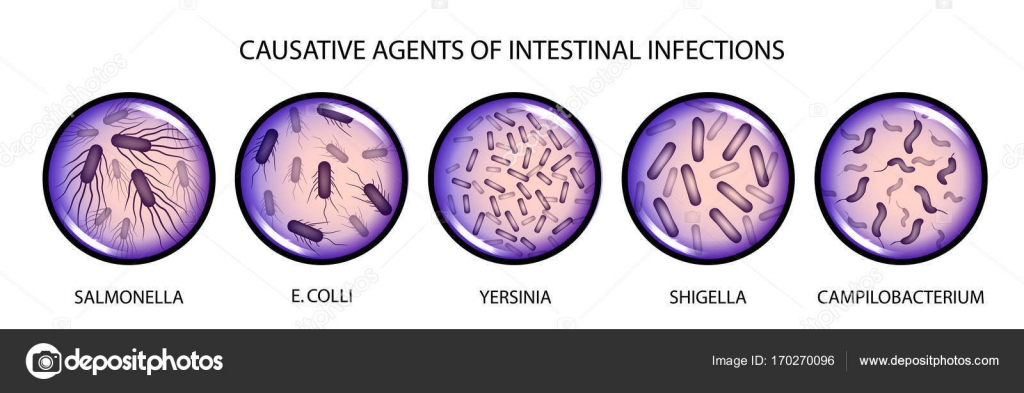
Вирус гепатита В передаётся половым путём, при инъекциях нестерильными шприцами у наркоманов, от матери — плоду. В типичных случаях заболевание начинается с повышения температуры, слабости, болей в суставах, тошноты и рвоты. Иногда появляются высыпания. Происходит увеличение печени и селезёнки. Также может быть потемнение мочи и обесцвечивание кала.
Гепатит С — наиболее тяжёлая форма вирусного гепатита, которую называют ещё посттрансфузионным гепатитом. Это значит, что заболевали им после переливания крови. Это связано с тем, что тестировать донорскую кровь на вирус гепатита С стали всего несколько лет назад. Достаточно часто происходит заражение через шприцы у наркоманов. Возможен половой путь передачи и от матери — плоду. Наибольшую опасность представляет собой хроническая форма этой болезни , которая нередко переходит в цирроз и рак печени. Хроническое течение развивается примерно у 70–80% больных. Сочетание гепатита С с другими формами вирусного гепатита резко утяжеляет заболевание и грозит летальным исходом.
Хроническое течение развивается примерно у 70–80% больных. Сочетание гепатита С с другими формами вирусного гепатита резко утяжеляет заболевание и грозит летальным исходом.
Профилактика гепатитов.
Чтобы уберечься от заражения гепатитами, необходимо соблюдать несложные правила.
Не следует употреблять некипячёную воду, всегда мыть фрукты и овощи, не пренебрегать термической обработкой продуктов. Так можно предотвратить заражение гепатитом А, передача которого связана с загрязнением пищи фекалиями больного человека. Великое правило «Мойте руки перед едой» — залог здоровья и в данном случае.
В целом, необходимо избегать контакта с биологическим жидкостями других людей. Для предохранения от гепатитов В и С — в первую очередь с кровью. В микроскопических количествах кровь может остаться на бритвах, зубных щётках, ножницах для ногтей. Не стоит делить эти предметы с другими людьми.
В медицинских учреждениях принимают меры профилактики заражения гепатитами. Однако, если Вы делали эндоскопию или лечили зубы десять–пятнадцать лет назад, когда борьба с гепатитом ещё не была тщательно организована, необходимо провериться. Небольшой риск заражения есть и сегодня.
Однако, если Вы делали эндоскопию или лечили зубы десять–пятнадцать лет назад, когда борьба с гепатитом ещё не была тщательно организована, необходимо провериться. Небольшой риск заражения есть и сегодня.
Никогда не пользуйтесь общими шприцами и иглами для приёма наркотиков. Никогда не делайте пирсинг и татуировки нестерильными приборами. Помните — вирус гепатита очень живуч и, в противоположность вирусу СПИДа, долго сохраняется во внешней среде (иногда — до нескольких недель). Невидимые следы крови могут остаться даже на соломинках, используемых при употреблении кокаина, так что и в данном случае следует опасаться заражения.
Половым путём чаще всего передаётся гепатит B, но возможно заражение и гепатитом С. Особенно тщательно необходимо принимать меры предосторожности при сексе во время месячных и анальных контактах, однако иногда и оральный секс также может быть опасен.
Гепатит передаётся и так называемым «вертикальным» путём — от матери ребёнку при беременности, в родах, во время кормления грудью.
Однако путь заражения гепатитом очень часто остаётся неизвестен. Чтобы быть совершенно спокойным, необходимо провести вакцинацию.
Платные услуги
Постановление Правительства Российской Федерации от 4 октября 2012 г. N 1006 г. Москва
«Об утверждении Правил предоставления медицинскими организациями платных медицинских услуг»
Для просмотра документа нажмите пожалуйста эту ссылку.
ПОЛОЖЕНИЕ
Рб оказании платных медицинских услуг в ГБУЗ СК КСКИБ
Для просмотра документа нажмите пожалуйста эту ссылку.
Приказ по платным услугам ГБУЗ СК КСКИБ от 03.08.2020г.
Для просмотра документа нажмите пожалуйста эту ссылку.
Приказ по платным услугам ГБУЗ СК КСКИБ от 19. 08.2020г.
08.2020г.
Для просмотра документа нажмите пожалуйста эту ссылку.
Прейскурант:
прейскурант компьютерная томография:
Для просмотра документа нажмите пожалуйста эту ссылку.
прейскурант рентгенологические методы исследования:
Для просмотра документа нажмите пожалуйста эту ссылку.
прейскурант клиническая лаборатория:
Для просмотра документа нажмите пожалуйста эту ссылку.
прейскурант бактериологическая лаборатория:
Для просмотра документа нажмите пожалуйста эту ссылку.
приказ и прейскурант по оказанию платных услуг ГБУЗ СК КСКИБ от 14.07.2021г. :
Для просмотра документа нажмите пожалуйста эту ссылку.
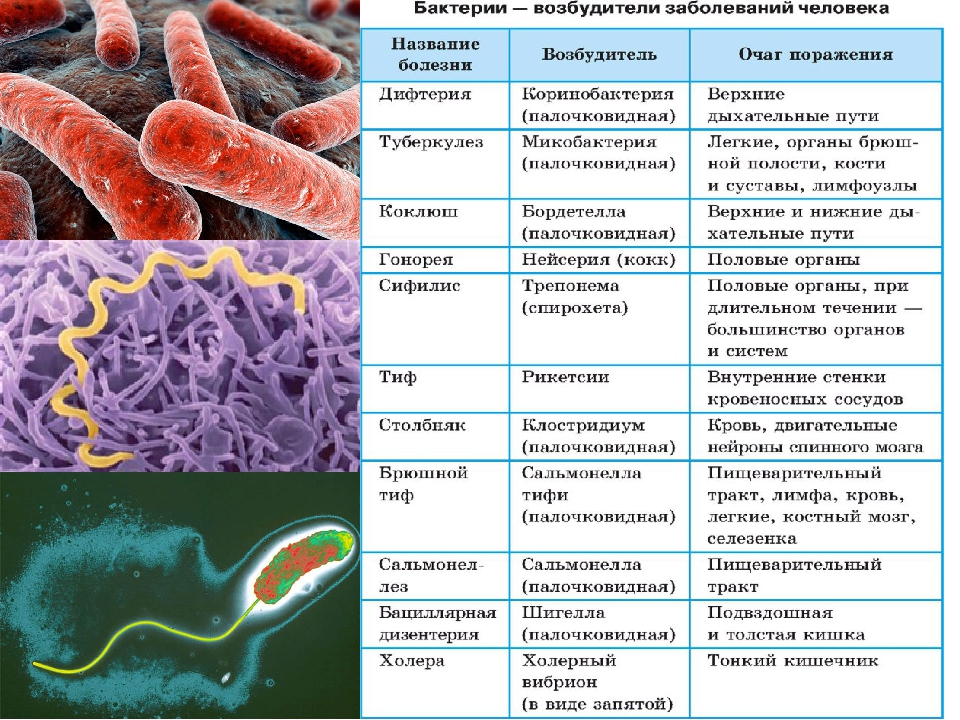
Возбудители бактериальных кишечных инфекций. (Лекция 13)
1. для специальностей: 31.02.01. Лечебное дело 31.02.02. Акушерское дело 34.02.00. Сестринское дело 2 курс 2015 г.
БОУ СПО «ЧЕБОКСАРСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»ДИСЦИПЛИНА : « ОСНОВЫ МИКРОБИОЛОГИИ И
ИММУНОЛОГИИ »
ДЛЯ СПЕЦИАЛЬНОСТЕЙ: 31.02.01. ЛЕЧЕБНОЕ ДЕЛО
31.02.02. АКУШЕРСКОЕ ДЕЛО
2 КУРС
2015 Г.
2. Лекция №13 Тема: «ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ КИШЕЧНЫХ ИНФЕКЦИЙ».
ЛЕКЦИЯ №13ТЕМА: «ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ
КИШЕЧНЫХ ИНФЕКЦИЙ».
3. Входной контроль
ВХОДНОЙ КОНТРОЛЬОтветьте устно на следующие вопросы:
1.
 На какие группы делятся все
На какие группы делятся всепалочковидные микроорганизмы?
бактерии, бациллы, клостридии
2. Характеристика бактерий, примеры.
Палочки не образующие спор (E. coli)
3. Характеристика бацилл, примеры.
аэробные спорообразующие (B. anthracis)
4. Характеристика клостридий, примеры.
анаэробные неспорообразующие (C. botulinum,
C. tetani, C. Perfringens)
Накапливаются внутри клетки, не специфичны
для органов и тканей
6. Экзотоксины, характеристика.
Выделяются из клетки в окружающую среду,
высокотоксичны, избирательно поражают
некоторые органы и ткани
7. Назвать механизмы передачи инфекции
фекально-оральный, респираторный,
контактный, кровяной
8. Для фекально-орального механизма какие пути
передачи инфекции существуют?
пищевой, водный, контактно-бытовой
6. План лекции
ПЛАН ЛЕКЦИИ1. Эшерихии.
2. Шигеллы.
3. Сальмонеллы.
4. Иерсинии.

5. Холерный вибрион.
6. Хеликобактериоз.
7. Ботулизм.
8. Листериоз.
9. Лептоспироз
7. В результате освоения учебного материала вы должны знать:
В РЕЗУЛЬТАТЕ ОСВОЕНИЯ УЧЕБНОГО МАТЕРИАЛА ВЫДОЛЖНЫ ЗНАТЬ:
1. Общую характеристику возбудителей бактериальных
кишечных инфекций.
2. Источник, механизм и пути передачи возбудителей.
3. Устойчивость возбудителей в окружающей среде.
4. Факторы патогенности.
5. Условия культивирования.
6. Роль возбудителей в патологии.
8. 1. Эшерихии.
1. ЭШЕРИХИИ.Род Escherichia — наибольшее значение имеет вид Е.сoli ,
которые по патогенности делятся на:
-патогенные (диарейные) — попадают в организм извне, могут
вызывать экзогенные инфекции: острые кишечные заболевания
— условно-патогенные — являются нормальными обитателями
кишечника человека и теплокровных животных, при снижении
иммунитета и их накоплении могут стать причиной гнойновоспалительных болезней (циститов, холециститов, коли-сепсиса
и др.
 ) — эндогенные инфекции.
) — эндогенные инфекции.Характеристика возбудителя:
Е.сoli – мелкие
грамотрицательные палочки с
закругленными концами. В
мазках они располагаются
беспорядочно, не образуют спор,
подвижны (перитрихи).
Некоторые штаммы имеют
микрокапсулу, пили.
Клиника
12. 2. шигеллы.
2. ШИГЕЛЛЫ.Относятся к роду Shigella. Являются возбудителями
дизентерии (шигеллез).
Дизентерия (шигеллез) — инфекционная болезнь с
преимущественным поражением толстой кишки.
Характеристика возбудителя:
шигеллы — мелкие
грамотрицательные
палочки с закругленными
концами. В мазке из
чистой культуры они
располагаются
беспорядочно, не
образуют спор и не имеют
жгутиков (неподвижны).
Клиника
15. 3. сальмонеллы.
3. САЛЬМОНЕЛЛЫ.Относятся к роду Salmonella.
У человека сальмонеллы могут вызывать две группы заболеваний:
1) антропонозные – брюшной тиф и паратиф А и В; возбудители: S.
typhi, S. paratyphi A, S. paratyphi B;
2) зооантропонозные – сальмонеллезы; возбудители: S. typhimurium, S.
haifa, S. anatum, S. panama, S. infantis.
Характеристика возбудителя:
Сальмонеллы грамотрицательные палочки
с закругленными концами, в
мазках располагаются
беспорядочно, не образуют
споры и капсулы, подвижны
(перитрихи).
Образуют небольшие
прозрачные колонии (на
средах Эндо, Плоскирева,
Левина).
На висмут-сульфитном
агаре — колонии
черного цвета
Клиника брюшного тифа и паратифов А и В:
Клиника сальмонеллеза:
19. 4. иерсинии.
4. ИЕРСИНИИ.Относятся к роду Yersinia, который содержит семь видов, среди
которых встречается Y. enterocolitica – возбудитель кишечного
иерсиниоза.
Кишечный иерсиниоз — острая инфекционная болезнь,
характеризующаяся поражением ЖКТ, с вовлечением в
патологический процесс различных органов и систем.
Характеристика возбудителя:
Y.
 enterocolitica
enterocoliticaхарактеризуется
полиморфизмом: может иметь
форму либо палочки с
закругленными концами, либо
овоидную с биполярным
окрашиванием. Спор не
имеет, иногда образует
капсулу.
Клиника:
22. 5. Холерный вибрион
5. ХОЛЕРНЫЙ ВИБРИОНОтносится к роду Vibrio, который включает 21 вид. Наиболее важны из
них: Vibrio cholerae – возбудители холеры.
Холера — острая инфекционная болезнь, характеризующаяся
поражением тонкой кишки, нарушением водно-солевого обмена и
интоксикацией. Это особо опасная, карантинная инфекция.
Характеристика возбудителя:
Холерный вибрион грамотрицательная изогнутая
палочка, не образует спор, не
имеет капсулы, монотрих и
чрезвычайно подвижен.
Клиника:
25. 6. хеликобактериоз
6. ХЕЛИКОБАКТЕРИОЗХеликобактериоз — хроническая инфекционная болезнь,
характеризующаяся поражением слизистой оболочки желудка и
двенадцатиперстной кишки с формированием стойкого воспаления и
образованием язв.
Возбудители — бактерии рода Helicobacter. Описано восемь видов
хеликобактерий. Наибольшее значение в патологии человека имеет Н.
руlori.
Характеристика возбудителя:
Хеликобактерии — мелкие
неспорообразующие
грамотрицательные бактерии,
имеют изогнутую S-образную.
Подвижны — на одном из
полюсов имеет 4 — 5 жгутиков
(лофотрихи).
Клиника:
28. 7. Ботулизм
7. БОТУЛИЗМБотулизм — Острое инфекционное заболевание, характеризующееся
интоксикацией организма с преимущественным поражением
центральной нервной системы. Болезнь возникает в результате
употребления пищевых продуктов, содержащих токсины бактерий
Clostridium botulinum, которые относятся к роду Clostridium.
Характеристика возбудителя:
С. botulinum грамположительные палочки
с закругленными концами.
Строгий анаэроб. При
неблагоприятных условиях
образуют эндоспоры,
расположенные терминально
и субтерминально (имеют вид
теннисной ракетки или
веретена).
Клиника:
31. 8. листериоз
8. ЛИСТЕРИОЗЛистериоз — инфекционная болезнь, характеризующаяся
различными вариантами, течения, среди которых преобладают
ангинозно-септическая и нервная формы. Возбудителем является
Listeria monocytogenes, относящаяся к роду Listeria.
Характеристика возбудителя:
листерии полиморфны: могут
иметь вид коротких, слегка
изогнутых палочек, а также
кокков, образующих короткие
цепочки из 3 – 5 клеток. Не
образуют спор, могут иметь
капсулу, грамположительны,
подвижны (перитрихи).
Клиника:
34. 9. лептоспироз
9. ЛЕПТОСПИРОЗЛептоспироз — острая инфекционная болезнь, характеризующаяся
волнообразной лихорадкой, интоксикацией, поражением капилляров
печени, почек, центральной нервной системы.
Возбудитель — Leptospira interrogans, относится к роду Leptospira.
Характеристика возбудителя:
Лептоспиры — тонкие
спирохеты с изогнутыми
концами, имеют 20-40
завитков.
 Спор и капсул не
Спор и капсул необразуют. Имеют 2
периплазматических жгутика
(осевые нити), отходящие от
полюсов клетки.
Клиника:
36. Глоссарий
Эшерихиоз
Шигеллез
Сальмонеллез
Иерсиниоз
Среда Эндо
Геморрагия
37. Задание на дом.
ЗАДАНИЕ НА ДОМ.1.
Заполнить глоссарий.
2.
Подготовиться к контрольному тестированию.
3.
Сделать презентации по предложенным темам.
Возбудители кишечных инфекций — презентация онлайн
1. Возбудители кишечных инфекций
Лекция профессора БойченкоМ.Н.
2. c.Enterobacteriaceae
палочки2-не образующие спор
3- могут образовывать капсулу
4. могут быть подвижными
5.оксидаза негативные
6.факультативные анаэробы
7. обладают широким спектром
биохимической активности
1-грамотрицательные
3. c.Enterobacteriaceae
EscherichiaShigella
Salmonella
Биохимическая идентификация возбудителей ОКИ
Биохимически
Escherichia
й признак
Shigella
Salmonella
Продукция
индола
+
+/-
—
Продукция
сероводорода
—
—
+
Утилизация
цитрата
—
—
+
Продукция
лизиндекарбок
силазы
+
—
+
Гидролиз
мочевины
—
—
—
Ферментация
лактозы
+
—
—
кг
к
к(г)
Ферментация
5.
 Рост кишечных бактерий на среде Клиглера
Рост кишечных бактерий на среде Клиглера6. c.Enterobacteriaceae факторы патогенности
1.Эндотоксин2.
пили 4 типа
3.ТТСС
4. белковые энтеро и цитотоксины
7. Диарея
1. СЕКРЕТОРНАЯ(микроб только прикрепляется, продуцирует
энтеротоксин, повышающий уровень ц-АМФ)
2.ВОСПАЛИТЕЛЬНАЯ
(микроб инвазирует эпителий кишечника,
эффекторные молекулы ТТСС стимулируют
воспаление с выбросом простагландинов,
повышающих уровень ц-АМФ)
Тип взаимодействия
Возбудите
ли
Механизм патогенного
действия
Факторы патогенности,
обеспечивающие процесс
1-й тип
ЭТКП
Размножение на
поверхности эпителия
слизистой тонкой
кишки без повреждения
Пили 4 типа (факторы
колонизации)
2-й тип
ЭПКП,
ЭГКП
Размножение на
поверхности эпителия
тонкой и толстой кишок
с разрушением
микроворсиноки
повреждения
апикальной
поверхности (Эффект
прикрепления/сглажива
-ния)
Пили 4 типа (ЭПКП),
продукты генетического
островка патогенности LEE
: белок интимин и
эффекторные белки ТТСС
3-й тип
р.

Shigella
Внедрение и
размножение в
эпителиальных клетках
толстого кишечника,
цитотоксическое
повреждение и гибель
эпителиоцитов
Эффекторные белки ТТСС :
ipa –антигены и белок VirG
4-й тип
Р.Salmo
nella, р.
Yersinia
Трансцитоз эпителия
тонкой кишки через Мклетки с
инфицированием
пейеровых бляшек , с
последующим
размножением в
ТТСС-1 (Salmonella),
продукт гена inv , белок Ail,
(Yersinia)
10. Диагностика
1. Бактериологический метод2.Серологический (вспомогательный)
3. ПЦР( вспомогательный)
возбудитель
заболевание
Материал для
исследования
Диареегенные Кишечный
E.coli
эшерихиоз
испражнения
Шигеллезы
испражнения
Shigella
(бактериальная
дизентерия)
Salmonella
Брюшной тиф, Кровь,желчь,
Typhi,
паратифы
моча костный
S.Paratyphi A,B
мозг,
испражнения
сальмонеллезы
Серовары
Испражнения,
Salmonella
рвотные
13.
 Род Salmonella 21 серовар-среди
Род Salmonella 21 серовар-средихолоднокровных животных
2.S.еnterica 2501серовар-у
теплокровных животных, птиц, человека
S.Typhi
S.Paratyphi A,B,C
S.Enteritidis,S.Typhimurium
1.S.bongori
. Классификация
сальмонелл по антигенной структуре по Кауфману-Уай
Серогруппа
Антиген
Название серовара
О
Н
Фаза 1
Фаза
2
S.Paratyphi A
2(A)
1,2,12
a
—
S.Derby
4(B)
1,4,5,12
f,g
1,2
S.Haifa
1,4,5,12
Z10
1,2
S.Paratyphi B
1,4,5,12
b
1,2
S.Typhimurium
1,4,5,12
i
1,2
6,7
R
1,5
S.Choleraesuis
6,7
c
1,5
S.ParatyphiC
6,7 (vi)
c
1,5
6,8
eh
1,2
1,9,12 (vi)
g,p
—
S.Enteritidis
1,9,12
g,m
—
S.Panama
1,9,12
e,v
1,5
d
—
ch
1,6
S.Infants
S.Newport
S.Dublin
6,7(C1)
6,8(C2)
9(D1)
S.
 Typhi
TyphiS.Anatum
9,12 (vi)
3(E1)
3,10
15. Род Salmonella
1.антропонозы- системные инфекции
: брюшной тиф, паратифы
2. зооантропонозы –сальмонеллезы
(протекают чаще в локальной форме
гастроэнтерита), госпитальный
сальмонеллез (протекать может как в
локальной форме, так и в виде
системного заболевания)
17. Shigella
видЧисло
сероваров
Ферментация
маннита
—
S.dysenteriae
12
S.flexneri
9
+
S.boydii
18
+
S.sonnei
1
+
18. Факторы патогенности
ФакторМеханизм действия Регуляция
Ipa B,C,Dэффекторые
белки ТТСС
Инвазия слизистой
тонкого кишечника
синтеза
Вызывает лизис
распространения мембран клеток,
обеспечивая
межклеточное
распространение
VirG фактор
Шига (ST) и шига
подобные (SL-
Поражает эндотелий
капилляров и гломерулы
почки
Плазмида
140МD
Плазмида
140МD
хромосома
20.
 Вид E.coli 1.
Вид E.coli 1.Условно-патогенные ( входят в
состав микрофлоры кишечника)
2. Патогенные:
А.возбудители парентеральных
эшерихиозов (уропатогенные)
Б. диареегенные
21. Патогенные E.coli
Отличаютсяот условно-патогенных:
1. по антигенной структуре
2. по наличию в геноме «островков
патогенности», локализованных на
хромосоме, плазмидах и в геноме
конверсирующих бактериофагов
тип
Молекулярный патогенез
заболевание
ЭПКП
Разрушая
микроворсинки.уменьшают
поверхность всасывания
Колиэнтерит
детей 1 года
жизни
ЭГКП
1.Разрушая
микроворсинки.уменьшают
поверхность всасывания
2.Продукция шига-подобного
токсина
1.Кровавый
понос
2.Гемолитический
уремический
синдром
ЭТКП
Продуцируют энтеротоксины
Холероподобное
заболевание
ЭИКП
Внедряются и размножаются в
Дизентериеподоб
эпителии толстого кишечника,
ное заболевание
благодаря наличию плазмиды 140
25.
 Холера Vibrio cholerae O1, O139
Холера Vibrio cholerae O1, O139Vibrio cholerae
1. classica (O1)
2.El Tor (O1,O139)
classica
.El Tor
гемолиз
—
+
Агглютинация
куриных
эритроцитов
—
+
полимиксин
чувствителен
резистентен
26. Серовары серогруппы О1
О1ОгаваАВ
Инаба АС
Гикощима
АВС
27. холера
Питательныесреды:
1% щелочная пептонная вода
Тиосульфат цитратный, сахарозожелчесодержащий агар (TCBS)
Щелочной триптон-соевый агар
28. Биохимические свойства
1.оксидаза +
2. сахароза +
3. крвхмал +
4. лизиндекарбоксилаза +
6. индол +
7. сероводород –
8. арабиноза =
29. Холера факторы патогенности
факторМеханизм действия
Холерный токсин
(Синтезируется
конвертирующим фагом СТХ)
Стимулирует синтез ц-АМФ, в
результате нарушается
всасывания Na и Cl , приводящее
выделения в просвет кишечника
воды
Токсинкорегулируемые
пили
1.

нейраминидаза
Гемагглютинин
Прикрепление
2. рецепторы фага СТХ
Обнажает рецептор для
токсина
Открепляет микроб от
Посев на возбудителей кишечной инфекции (сальмонеллы, шигеллы) с определением чувствительности к антибиотикам
Посев (микробиологическое исследование) с точной идентификацией сальмонелл (возбудителей сальмонеллеза) до группы и шигелл (возбудителей дизентерии) до вида. Посев кала проводится на специальные обогащенные питательных среды. Антибиотикограмма ставится диско-диффузионным методом с учетом европейских рекомендаций по определению антибиотикорезистентности возбудителей острых кишечных инфекций к антибактериальным препаратам.
В каких случаях обычно назначают посев на возбудителей кишечных инфекций?
Кишечные инфекции – передаются от человека к человеку через объекты окружающей среды, воду, продукты питания. Механизм передачи фекально-оральный через пищевой, водный путь и грязные руки. Инкубационный период длится от нескольких часов до 2 суток.
Инкубационный период длится от нескольких часов до 2 суток.
При появлении следующих симптомов: тошнота, рвота, частый жидкий стул (в стуле возможна примесь крови), боли в животе и повышенная температура тела необходимо сдать анализ кала на посев для определения вида возбудители инфекции. Исследование проводится до начала антибактериальной терапии.
В эпидемиологических целях анализ используют при проведении профилактических осмотров для приема на работу в сферу обслуживания населения: предприятия общественного питания и медицинские учреждения. Это необходимо для выявления бессимптомного бактерионосительства и при стертых хронических, атипичных формах данных инфекций, когда носитель сам не испытывает симптомов болезни, но может заражать окружающих.
Что именно определяется в процессе анализа?
Выявляется рост возбудителей дизентерии и сальмонеллеза при их наличии. Так как используются специальные селективные среды именно для этих групп микроорганизмов, рост других бактерий в этом исследовании маловероятен.
Другие группы микроорганизмов, способных вызывать острые кишечные инфекции (например: патогенные виды кишечной палочки E.coli) в данном посев не вырастают.
Лабораторный тест “ДНК возбудителей кишечных инфекций в кале: ОКИ-тест (Shigella/Salmonella/Campylobacter/Adenovirus/Rotavirus/Norovirus/Astrovirus)”. позволит наряду с бактериями выявить вирусы, способные вызвать кишечные инфекции.
Также при подозрении на сальмонеллез используется тест “Антитела к сальмонеллам (Salmonella) A, B, C1, C2, D, E” в сыворотке крови.
Что означают результаты теста?
Получение роста возбудителя кишечной инфекции в посеве является основным исследованием для ранней постановки диагнозов: сальмонеллез и дизентерия. Анализ поможет инфекционисту в подборе оптимального антибактериального лечения данных инфекции и разработке эпидемиологических мер по профилактике распространения данных инфекций.
Обычный срок выполнения теста:
до 8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется.
Оптимальные сроки взятия материала —как можно раньше при появлении симптомов, до приёма каких-либо антибактериальных препаратов.
При сдаче анализа для получения медицинской книжки биоматериал можно сдать в любое время.
Посев кала на возбудителей кишечной инф. (сальмонеллы; шигеллы) и определение чувствительности к антибиотикам
Салмонеллы — грамотрицательные, подвижные микроорганизмы, факультативные анаэробы. Салмонеллы могут сохранять жизнеспособность в течение недели вне живого организма. При замораживании салмонеллы не погибают.Основными факторами патогенности салмонелл является продукция эндотоксина и способность проникать и размножаться в пейеровых бляшках и солитарных фолликулах в слизистом слое тонкого кишечника.
Салмонеллы повсеместно распространены, основным источниками являются человек и различные животные. Основными источниками инфекции являются контаминированные салмонеллами мясные и молочные продукты, яйца, мясо птицы.
Основные пути передачи — пищевой и водный.

Салмонеллы являются основными возбудителями токсикопищевой инфекции, основные симптомы которой представлены гастроэнтеритом и диарейным синдром.
Шигеллы (S.dysenteriae, S.flexneri, S.boydii, S.sonnei) относятся к гармотрицательным полочковидным бактериям. Данные микроорганизмы очень похожи на неподвижные, лактозоотрицательные анаэрогенные эшерихии.
Шигеллы — возбудители острых кишечных инфекций человека и бактериальной дизентерии. Распространяются фекально-оральным путем. Симптомы заболевания обычно включают диарею, лихорадку, тошноту, рвоту. Характерный признак дизентерии — диарея с кровью. Однако в 50% случаев шигеллы вызывают острую диарею без крови, которую клинически сложно отличить от диареи, вызванной другими энтерибактериями. Наиболее тяжелое и длительное течение дизентерии связано с инфицированием S.dysenteriae и S.flexneri.
Для всех представителей шигелл характерна высокая частота резистентности к антибактериальныи препаратам.
Определение чувствительности к антибактериальным препаратам (АБП).
Основной целью определения чувствительности микроорганизмов к АБП является прогнозирование их эффективности при лечении инфекций у конкретных пациентов. Определение чувствительности также проводят при наблюдении за распространением резистентности среди микроорганизмов.
Основой для выбора АБП, подлежащих включению в исследование, являются данные о природной чувствительности обнаруженных микроорганизмов или их групп, о распространении среди них приобретенной резистентности, а также клинической эффективности АБП.
В этом исследовании для определения чувствительности к АБП обычно используется 6 различных антибактериальных препаратов.
Определять чувствительность к АБП представителей нормальной микрофлоры человека (при их выделении из естественных мест обитания) не проводится.
Материал для исследования берется до начала антибактериальной терапии или в интервалах между курсами лечения, но не ранее двух недель после ее окончания.
За 3-4 дня отменить прием любых слабительных препаратов, исключить прием алкоголя и бактерийных препаратов.
Сбор кала. В судно или на дно унитаза, без воды, помещают стерильную бумагу или проглаженный плотный лист бумаги. Совершается акт дефекации, при этом исключается попадание в кал мочи. Сразу после акта дефекации посредством специальной ложечки, вмонтированной в крышку стерильного пластикового контейнера отбирается проба кала. При наличии патологических примесей необходимо выбрать участки, содержащие слизь, гной, хлопья, но без следов крови. Полученный материал помещают в стерильный пустой контейнер, объем забираемого материала должен быть не менее 2 г. При оформленном стуле оптимально взятие материала в объеме грецкого ореха, при жидком стуле его слой в контейнере должен быть не менее 2 см. Доставить в лабораторию в течение 2 часов при комнатной температуре или биоматериал должен храниться в холодильнике при +2 — +8оС и доставляться в лабораторию, при указанной температуре, в течение 5-6 часов.
Ректальный соскоб — выполняется медицинским персоналом по инструкции, с использованием зонда и тубы с транспортной средой Кэри Блер. Доставляется в лабораторию в течение не более 24 часов при +8 — +16оС или при +4 — +8оС в течение 48 часов.
Показания к исследованию: острые и хронические кишечные инфекции различной этиологии, диарея, подозрение на бактериальную дизентерию, салмонелез.
Представленные данные не могут быть использованы пациентом для самодиагностики и самолечения. Правильный диагноз ставит только лечащий врач на основании результатов лабораторных исследований, клинической картины заболевания и инструментального обследования. В соответствии с поставленным диагнозом лечащий врач назначает лечение.
Посев на патогенную кишечную флору, определение чувствительности к антимикробным препаратам и бактериофагам
Метод определения Бактериологический, бактериоскопический
Исследуемый материал Кал
Доступен выезд на дом
Определение этиологии ОКИЗ (острого кишечного инфекционного заболевания) и выбор рациональной антибиотикотерапии.
Рациональная терапия дизентерии основана на идентификации её возбудителя — бактерий рода Shigella.
Шигеллы (по имени японского учёного К. Шиги) грамотрицательные неподвижные неспороносные палочки длиной 23 мкм, шириной 0,6 мкм. По типу обмена аэробы и факультативные анаэробы.Они выделяют токсины, повреждающие эпителий кишечника, усиливают секрецию жидкости и солей в просвет кишки. Шигеллы быстро изменяют свою чувствительность к различным антибактериальным препаратам.
Заражение происходит фекально-оральным путём. Для возникновения заболевания достаточно инфицирование менее чем 100 микробными клетками шигелл. Инкубационный период от одних до 7 суток (в среднем 2 — 3 суток), но может сокращаться до 12 и даже до 2 часов. Заболевание начинается остро. Возникает общая интоксикация, повышается температура тела, появляются схваткообразные боли в животе (тенезмы), усиливающиеся перед дефекацией. В последние годы отмечается резкое увеличение количества больных тяжёлой дизентерией и её хроническими формами. Диагноз хронической дизентерии устанавливается в случае, если заболевание продолжается более 3 месяцев.
Диагноз хронической дизентерии устанавливается в случае, если заболевание продолжается более 3 месяцев.
Лабораторное подтверждение дизентерии проводится бактериологическим и серологическим методами. Бактериологический метод (высев шигелл из испражнений) при 3-кратном исследовании обеспечивает подтверждение диагноза у большинства больных. Это обеспечивает дифференциальную диагностику с другими острыми диарейными заболеваниями — сальмонеллёзом, эшерихиозом, кишечным иерсиниозом, холерой, амёбиазом.
Сальмонеллы (по имени американского исследователя D. Salmon) – возбудители энтероколитов или пищевой токсикоинфекции, а также генерализованных тифопаратифозных инфекций. Мелкие грамотрицательные палочки, подвижны за счет жгутиков. По типу метаболизма – факультативные анаэробы. Факторы патогенности – термостабильные эндотоксины, термолабильный энтеротоксин, микрокапсулы, белки наружной мембраны клеточной стенки (способствуют адгезии на энтероцитах тонкой кишки). Сальмонеллезы – зоонозно-антропонозные инфекции, могут быть причиной внутрибольничных инфекций. Сальмонеллы могут размножаться при 4-6 град. С и длительно сохраняться в замороженных продуктах. Брюшной тиф и др. сальмонеллезы являются инфекциями с фекально-оральным механизмом передачи, основной путь передачи — пищевой, главным образом через продукты животного происхождения. Заболевание протекает в форме гастроэнтерита, гастроэнтероколита, гастрита (без диареи), тифоподобной форме и септической форме. После перенесенного заболевания в 20% случаев возникает бактерионосительство, которое может продолжаться пожизненно. Лабораторная диагностика сальмонеллеза основана на выделении возбудителя при посеве различных видов биоматериала от больного (фекалии, рвотные массы, желчь, кровь при септических формах) при микробиологическом исследовании.
Сальмонеллы могут размножаться при 4-6 град. С и длительно сохраняться в замороженных продуктах. Брюшной тиф и др. сальмонеллезы являются инфекциями с фекально-оральным механизмом передачи, основной путь передачи — пищевой, главным образом через продукты животного происхождения. Заболевание протекает в форме гастроэнтерита, гастроэнтероколита, гастрита (без диареи), тифоподобной форме и септической форме. После перенесенного заболевания в 20% случаев возникает бактерионосительство, которое может продолжаться пожизненно. Лабораторная диагностика сальмонеллеза основана на выделении возбудителя при посеве различных видов биоматериала от больного (фекалии, рвотные массы, желчь, кровь при септических формах) при микробиологическом исследовании.
Выделяемые возбудители: шигеллы, сальмонеллы.
Обращаем внимание на необходимость предварительного приобретения стерильной пробирки с питательной средой, используемой при взятии биоматериала, в любом медицинском офисе ИНВИТРО.
Микробиология желудочно-кишечного тракта — Медицинская микробиология
Общие концепции
Состав и распределение микрофлоры кишечника
Микрофлора кишечника представляет собой сложную экосистему, содержащую более 400 бактерий. разновидность. Количество анаэробов превышает количество факультативных анаэробов. Флора в
желудок и верхний отдел кишечника, но больше в нижнем отделе кишечника. Бактерии встречаются
как в просвете, так и прикрепляются к слизистой оболочке, но обычно не проникают в
стенка кишечника.
разновидность. Количество анаэробов превышает количество факультативных анаэробов. Флора в
желудок и верхний отдел кишечника, но больше в нижнем отделе кишечника. Бактерии встречаются
как в просвете, так и прикрепляются к слизистой оболочке, но обычно не проникают в
стенка кишечника.
Метаболическая активность
Кишечные бактерии являются важным компонентом энтерогепатической циркуляции в какие метаболиты конъюгированы в печени и выводятся с желчью: деконъюгируется в кишечнике бактериальными ферментами, затем всасывается через слизистая оболочка и вернулась в печень в портальный кровоток. Многие лекарства и эндогенные соединения подвергаются энтерогепатической циркуляции. Антибиотики, которые подавление флоры может изменить экскрецию фекалий и, следовательно, уровень в крови эти соединения.Флора также играет роль в переваривании клетчатки и синтезирует определенные витамины.
Кишечная микрофлора
Кишечная микрофлора может предотвратить заражение, взаимодействуя с патогенами.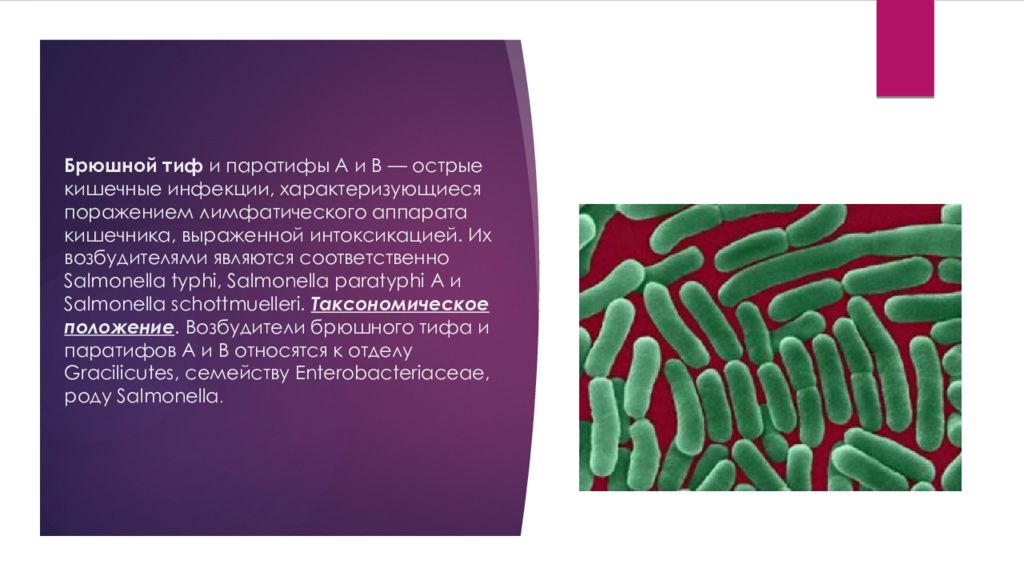 Флора включает небольшие популяции потенциально патогенных организмов, таких как Clostridium difficile . Антибиотики, нарушающие баланс
нормальной флоры может способствовать как заражению экзогенными патогенами, так и
разрастание эндогенными патогенами. Если стенка кишечника нарушена, кишечная
бактерии могут проникать в брюшину и вызывать перитонит и абсцессы.
Флора включает небольшие популяции потенциально патогенных организмов, таких как Clostridium difficile . Антибиотики, нарушающие баланс
нормальной флоры может способствовать как заражению экзогенными патогенами, так и
разрастание эндогенными патогенами. Если стенка кишечника нарушена, кишечная
бактерии могут проникать в брюшину и вызывать перитонит и абсцессы.
Бактериальные диареи
Диареи, опосредованные энтеротоксинами : Энтеротоксигенные бактерии, такие как Холерный вибрион и энтеротоксигенный Escherichia coli , колонизируют верхнюю часть кишечника и вызывают водянистую диарею путем вырабатывает энтеротоксин, который стимулирует клетки слизистой оболочки выделять жидкость через повышение внутриклеточного АМФ.
Инвазивная диарея : Инвазивные бактерии, такие как Shigella и Campylobacter , проникают через слизистая кишечника.Кровянистый слизистый диарейный стул с воспалительным экссудатом произведен.
Вирусные диареи
Ротавирус и калицивирус (бывший вирус Норуолк) являются основными причинами диареи
болезнь. Ротавирусная диарея поражает в основном детей раннего возраста; Калицивирус причины
болезнь во всех возрастных группах
Ротавирусная диарея поражает в основном детей раннего возраста; Калицивирус причины
болезнь во всех возрастных группах
Паразитарные диареи
Некоторые простейшие (особенно Entamoeba histolytica и Giardia lamblia ), а также некоторые кишечные гельминты могут вызвать диарейное заболевание.
Клинический диагноз
Как правило, энтеротоксигенные бактерии и вирусы поражают верхний отдел кишечника, вызывая водянистый понос и околопупочная боль. Инвазивные бактерии действуют в основном в толстой кишки ( Shigella и Campylobacter ) или нижняя подвздошная кишка ( Salmonella ). Стул при этих заболеваниях может содержат кровь. Колит характеризуется болезненным натуживанием во время стула (тенезмами).
Состав и распределение микрофлоры
Бактериальные обитатели желудочно-кишечного тракта человека составляют комплекс
экосистема.Более 400 видов бактерий были идентифицированы в фекалиях
один человек. Преобладают анаэробные бактерии. Верхний отдел желудочно-кишечного тракта (
желудок, двенадцатиперстная кишка, тощая кишка и верхняя подвздошная кишка) обычно содержат редкую микрофлору;
концентрация бактерий менее 10 4 организмов / мл кишечного
выделения (). Большинство из них
организмы происходят из ротоглотки и проходят через кишечник с каждым приемом пищи.
Колонизация верхних отделов кишечника бактериями группы кишечной палочки является аномальным явлением и
характерен для некоторых инфекционных патогенов, таких как Vibrio
cholerae и энтеротоксигенный Escherichia coli .В
напротив, толстый кишечник обычно содержит пышную микрофлору с общим
концентрации 10 11 бактерий / г стула (). Анаэробы, такие как Bacteroides ,
анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как E coli в 1000 раз.
Верхний отдел желудочно-кишечного тракта (
желудок, двенадцатиперстная кишка, тощая кишка и верхняя подвздошная кишка) обычно содержат редкую микрофлору;
концентрация бактерий менее 10 4 организмов / мл кишечного
выделения (). Большинство из них
организмы происходят из ротоглотки и проходят через кишечник с каждым приемом пищи.
Колонизация верхних отделов кишечника бактериями группы кишечной палочки является аномальным явлением и
характерен для некоторых инфекционных патогенов, таких как Vibrio
cholerae и энтеротоксигенный Escherichia coli .В
напротив, толстый кишечник обычно содержит пышную микрофлору с общим
концентрации 10 11 бактерий / г стула (). Анаэробы, такие как Bacteroides ,
анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как E coli в 1000 раз.
Рисунок 95-1
Концентрация бактериальной флоры в регионах желудочно-кишечный тракт.
Характер бактериальной флоры меняется не только по длине
желудочно-кишечный тракт, а также в разрезе слизистой оболочки
поверхность. Бактерии занимают просвет, покрывают эпителиальные клетки и прикрепляются к
слизистая оболочка. Проникновение бактерий через поверхность слизистой оболочки является ненормальным явлением;
патогены, такие как Shigella , Salmonella и Campylobacter вторгаются таким образом.
Бактерии занимают просвет, покрывают эпителиальные клетки и прикрепляются к
слизистая оболочка. Проникновение бактерий через поверхность слизистой оболочки является ненормальным явлением;
патогены, такие как Shigella , Salmonella и Campylobacter вторгаются таким образом.
Те же механизмы, которые контролируют нормальную флору, также защищают кишечник от
вторжение болезнетворными микроорганизмами. Желудочная кислота в желудке убивает большинство организмов, которые
проглотил. Люди с пониженным содержанием желудочного сока или его отсутствием имеют высокую частоту:
бактериальная колонизация в верхних отделах тонкой кишки и более восприимчива к
бактериальная диарейная болезнь.Желчь обладает антибактериальными свойствами и поэтому может быть
еще один фактор контроля флоры. Прямая пропульсивная моторика (перистальтика)
является ключевым элементом подавления флоры верхнего отдела кишечника. Наконец,
микрофлора, производя собственные антибактериальные вещества (например, бактериоцины
и жирные кислоты), стабилизирует нормальные популяции и предотвращает имплантацию
возбудители.
Метаболические активности микрофлоры
Метаболические возможности кишечных бактерий чрезвычайно разнообразны.Бактериальный ферменты могут использовать в качестве субстрата практически любое соединение в просвете кишечника, будь то принимается перорально или попадает в кишечник путем секреции через желчные пути или непосредственно через слизистую.
Энтерогепатическое кровообращение
Ферменты, вырабатываемые кишечными бактериями, играют центральную роль в энтерогепатическом кровотоке.
тираж. Вещества, которые подвергаются энтерогепатической циркуляции, метаболизируются.
в печени, выводится с желчью и попадает в просвет кишечника, где
они реабсорбируются слизистой оболочкой кишечника и возвращаются в печень через
портальное обращение.Энтерогепатическая циркуляция обычно включает:
соединения, которые конъюгированы в печени с полярной группой, такой как глюкуроновая
кислота, сульфат, таурин, глицин или глутатион. Конъюгация увеличивает
растворимость метаболита в желчи, но конъюгированные соединения плохо
всасывается слизистой оболочкой кишечника.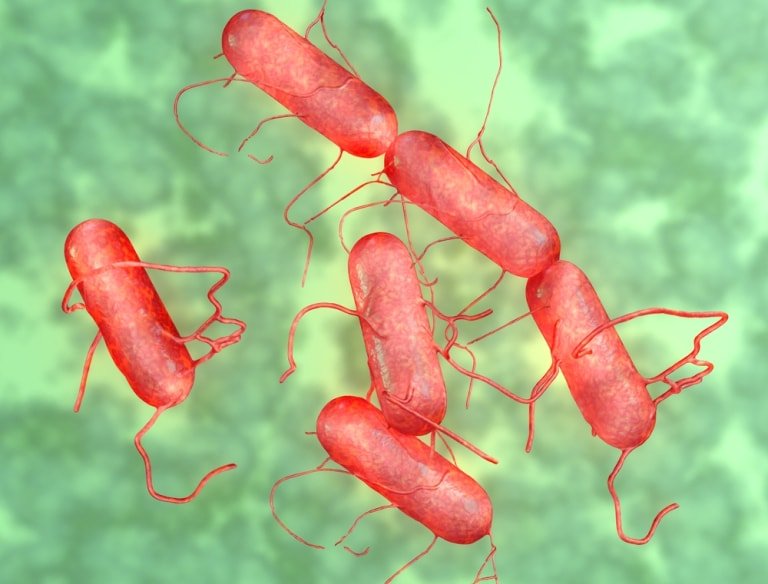 Ферменты, вырабатываемые кишечником
бактерии, такие как ß-глюкуронидаза, сульфатаза и различные
гликозидазы — деконъюгируют эти соединения, высвобождая родительские
соединения, которые легко всасываются через стенку кишечника.Многие эндогенные
соединения подвергаются энтерогепатической циркуляции, включая билирубин, желчные кислоты,
холестерин, эстрогены и метаболиты витамина D. Кроме того, многие лекарства
которые выводятся печенью, включая наперстянку, диэтилстильбестрол,
морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Ферменты, вырабатываемые кишечником
бактерии, такие как ß-глюкуронидаза, сульфатаза и различные
гликозидазы — деконъюгируют эти соединения, высвобождая родительские
соединения, которые легко всасываются через стенку кишечника.Многие эндогенные
соединения подвергаются энтерогепатической циркуляции, включая билирубин, желчные кислоты,
холестерин, эстрогены и метаболиты витамина D. Кроме того, многие лекарства
которые выводятся печенью, включая наперстянку, диэтилстильбестрол,
морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Антибиотики блокируют энтерогепатическое кровообращение, подавляя кишечную
флора и тем самым снижая уровень деконъюгированных ферментов. Если антибиотик
назначается пациенту, который также принимает препарат, вызывающий энтерогепатический
кровообращение, в результате угнетение энтерогепатического кровообращения будет
увеличить фекальную экскрецию препарата и тем самым снизить его уровень в плазме и
период полураспада.Например, уровень эстрогена в крови и период полураспада при рождении
количество противозачаточных таблеток уменьшается при приеме антибиотиков.
Микрофлора и питание
Ферменты, вырабатываемые кишечными бактериями, играют важную роль в метаболизме несколько витаминов. Микрофлора кишечника синтезирует витамин К, который является необходимый кофактор при производстве протромбина и др. свертывания крови факторы. Лечение антибиотиками, особенно у людей, соблюдающих диету низкое содержание витамина К, может привести к снижению уровня протромбина в плазме и склонности к кровоточить.Кишечные бактерии также синтезируют биотин, витамин B 12 , фолиевую кислоту. кислота и тиамин.
Кишечная флора способна сбраживать неперевариваемые углеводы (диетические
волокна) до короткоцепочечных жирных кислот, таких как ацетат, пропионат и бутират. В
основным источником таких ферментируемых углеводов в толстой кишке человека являются растительные клетки.
полисахариды стенок, такие как пектины, целлюлоза и гемицеллюлоза. Кислоты
производимые из этих волокнистых субстратов бактериями, могут быть важным источником энергии
источник для хоста.
У некоторых людей наблюдается дефицит кишечной лактазы, фермента слизистой оболочки. для гидролиза дисахарида лактозы в молоке. У этих людей лактоза не переваривается и не всасывается в кишечнике. Лактоза, достигающая толстый кишечник подвергается интенсивной бактериальной ферментации. Результат может быть вздутие живота, газы и диарея.
Кишечная микрофлора и инфекция
Защитные действия флоры
Как и другие сложные экосистемы, кишечная микрофлора относительно стабильна
со временем поддерживая примерно постоянное количество и типы бактерий в каждом
область кишечника.Стабильность нормальной флоры препятствует инфицированию
экзогенных патогенов и предотвращает чрезмерный рост потенциально патогенных членов.
Новые организмы, попадающие в систему с зараженной пищей или водой, как правило,
подавляется установившейся флорой. Это подавление связано с производством
представителями местной флоры противомикробных веществ, таких как
бактериоцины или короткоцепочечные жирные кислоты, которые подавляют рост чужеродных
микроорганизмы. Антибиотики, убивающие часть кишечной флоры, могут расстроить
его баланс и может открыть дверь для инфекции или патологического разрастания.
Антибиотики, убивающие часть кишечной флоры, могут расстроить
его баланс и может открыть дверь для инфекции или патологического разрастания.
Патогенез пищевого отравления Salmonella иллюстрирует это. явление. Нормальные люди довольно устойчивы к Salmonella , и для инициировать заражение. Если кишечная флора подавляется антибиотиками, однако человек становится гораздо более восприимчивым и может заразиться относительно небольшой посевной материал.
Заболевания, вызванные чрезмерным ростом потенциальных патогенов
Нормальная кишечная флора включает небольшие популяции организмов, вызывающих болезнь, если они зарастают.Например, разрастание Clostridium difficile вызывает тяжелое воспаление толстой кишки с диареей (псевдомембранозный колит). Введение антибиотиков запускает процесс подавляя нормальную флору.
Перитонит
Бактерии кишечной флоры являются основной причиной инфекции в
полость брюшины при нарушении нормальных барьеров стенки кишечника. Стенка кишечника может быть перфорирована травмой (ножевые ранения, огнестрельные ранения,
тупая травма), заболеванием (аппендицит, проникающий рак кишечника) или
хирургические процедуры.Как только барьер слизистой оболочки нарушен, бактерии проникают
через стенку кишечника в обычно стерильную брюшную полость и ее
окружающие конструкции. Плохое кровообращение, снижение подачи кислорода и отмершие ткани
в непосредственной близости от перфорации способствуют образованию абсцесса и
особенно благоприятствуют росту анаэробных бактерий. Культуры брюшины
абсцесс обычно выделяет несколько типов бактерий из кишечника.
микрофлора, особенно виды Bacteroides , Clostridium и Peptostreptococcus и E. coli .
Стенка кишечника может быть перфорирована травмой (ножевые ранения, огнестрельные ранения,
тупая травма), заболеванием (аппендицит, проникающий рак кишечника) или
хирургические процедуры.Как только барьер слизистой оболочки нарушен, бактерии проникают
через стенку кишечника в обычно стерильную брюшную полость и ее
окружающие конструкции. Плохое кровообращение, снижение подачи кислорода и отмершие ткани
в непосредственной близости от перфорации способствуют образованию абсцесса и
особенно благоприятствуют росту анаэробных бактерий. Культуры брюшины
абсцесс обычно выделяет несколько типов бактерий из кишечника.
микрофлора, особенно виды Bacteroides , Clostridium и Peptostreptococcus и E. coli .
Бактериальные диареи
Диарейные заболевания, опосредованные энтеротоксинами
Некоторые бактерии, продуцирующие энтеротоксины, вызывают диарейные заболевания (). Диарейное заболевание
вызванные Vibrio cholerae и энтеротоксигенными штаммами E coli имеет три основных характеристики. Во-первых, есть
потеря кишечной жидкости, связанная с действием энтеротоксина на
эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в
поверхность слизистой оболочки; скорее, он колонизирует верхнюю часть тонкой кишки, прилипая к
эпителиальные клетки и вырабатывающие энтеротоксин.Архитектура слизистой оболочки
остается нетронутым без признаков разрушения клеток. Бактериемия не
происходить. В-третьих, фекальные стоки водянистые и часто объемные, так что
диарея может привести к клиническому обезвоживанию. Жидкость берет начало в верхней части
тонкий кишечник. где энтеротоксин наиболее активен.
Во-первых, есть
потеря кишечной жидкости, связанная с действием энтеротоксина на
эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в
поверхность слизистой оболочки; скорее, он колонизирует верхнюю часть тонкой кишки, прилипая к
эпителиальные клетки и вырабатывающие энтеротоксин.Архитектура слизистой оболочки
остается нетронутым без признаков разрушения клеток. Бактериемия не
происходить. В-третьих, фекальные стоки водянистые и часто объемные, так что
диарея может привести к клиническому обезвоживанию. Жидкость берет начало в верхней части
тонкий кишечник. где энтеротоксин наиболее активен.
Таблица 95-1
Бактерии, продуцирующие токсины, связанные с диарейными заболеваниями.
Холера
Парадигма энтеротоксигенных диарейных болезней — холера (см. Гл.24), при котором объем стула может
превышают 1 л / ч, с ежедневным выходом фекалий от 15 до 20 л, если пациент находится
гидратированный. Холера вызывается V cholerae , которая обычно
попадает в загрязненную воду. Вибрионы, которые выживают при прохождении через желудок
колонизировать поверхность тонкой кишки, размножаться и разрабатывать
энтеротоксин. Токсин холеры действует через аденилатциклазу, стимулируя секрецию
вода и электролиты из клеток эпителия попадают в просвет кишечника. В
двенадцатиперстная кишка и верхняя часть тощей кишки более чувствительны к токсину, чем подвздошная кишка.Ободочная кишка относительно нечувствительна к токсину и может все еще поглощать воду и
электролиты в норме. Таким образом, холера — это «переполнение.
диарея », при которой большие объемы жидкости производятся в верхних
Кишечник подавляет резорбтивную способность нижнего отдела кишечника.
Вибрионы, которые выживают при прохождении через желудок
колонизировать поверхность тонкой кишки, размножаться и разрабатывать
энтеротоксин. Токсин холеры действует через аденилатциклазу, стимулируя секрецию
вода и электролиты из клеток эпителия попадают в просвет кишечника. В
двенадцатиперстная кишка и верхняя часть тощей кишки более чувствительны к токсину, чем подвздошная кишка.Ободочная кишка относительно нечувствительна к токсину и может все еще поглощать воду и
электролиты в норме. Таким образом, холера — это «переполнение.
диарея », при которой большие объемы жидкости производятся в верхних
Кишечник подавляет резорбтивную способность нижнего отдела кишечника.
Стул холеры напоминает рисовую воду — прозрачную жидкость. покрыт слизью и изотоничен плазме. Микроскопия не выявляет воспалительные клетки в фекальных стоках; все, что можно увидеть, это маленькие числа сброшенных клеток слизистой оболочки.
Энтеротоксигенная кишечная палочка Диарея
Определенные штаммы кишечной палочки вызывают диарейное заболевание, вызывая
энтеротоксины (см.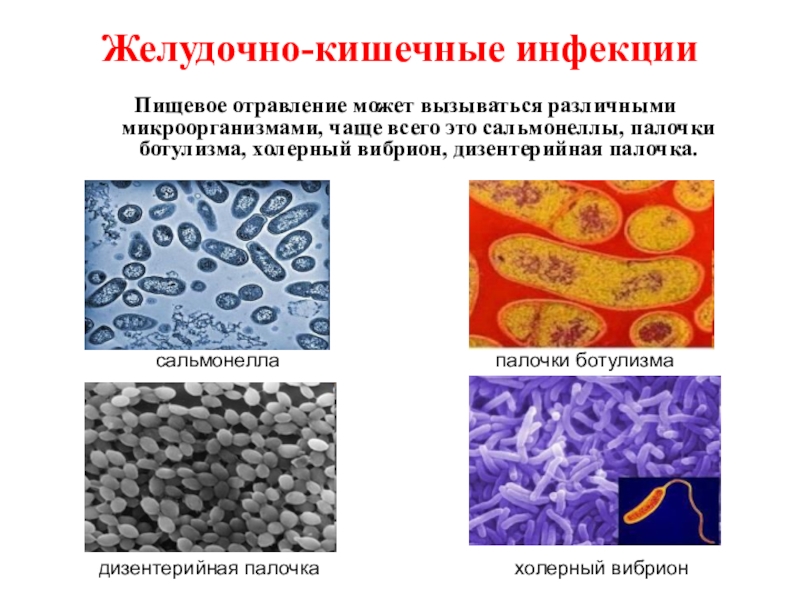 гл. 25). Эти
штаммы продуцируют два типа энтеротоксина. Один из них, называемый термолабильным токсином, — это
По структуре и механизму действия сходен с холерным токсином. Другой,
называемый термостабильным токсином, по-видимому, действует через гуанилатциклазу. Энтеротоксигенный Штаммы кишечной палочки являются наиболее частой причиной болезней путешественников.
диарея
гл. 25). Эти
штаммы продуцируют два типа энтеротоксина. Один из них, называемый термолабильным токсином, — это
По структуре и механизму действия сходен с холерным токсином. Другой,
называемый термостабильным токсином, по-видимому, действует через гуанилатциклазу. Энтеротоксигенный Штаммы кишечной палочки являются наиболее частой причиной болезней путешественников.
диарея
Другие токсины, вызывающие диарею
Многие штаммы Shigella продуцируют энтеротоксин, называемый Shiga
токсин, вызывающий секрецию жидкости из тонкой кишки (см. гл.22). Токсин шига имеет
деструктивное, цитотоксическое действие на эпителий тонкой кишки, вызывая грубое
травма поверхности кишечника. Он не активирует аденилатциклазу. E
coli 0157: H7, организм, связанный с потреблением
недоваренное рубленое мясо также производит токсин, подобный шиге; это вызывает кровавый
диарея и колит. Организм, производящий другой тип цитотоксина, — это Vibrio parahaemolyticus , бактерия, связанная с
морепродукты. Штаммы пищевого отравления Staphylococcus aureus , и Clostridium perfringens вырабатывают энтеротоксины, которые
цитотоксический.Стафилококковый энтеротоксин также оказывает прямое влияние на
рвотный центр в головном мозге.
Штаммы пищевого отравления Staphylococcus aureus , и Clostridium perfringens вырабатывают энтеротоксины, которые
цитотоксический.Стафилококковый энтеротоксин также оказывает прямое влияние на
рвотный центр в головном мозге.
Заболевания желудочно-кишечного тракта, вызванные инвазивными бактериями
В отличие от энтеротоксигенных организмов, инвазивные бактерии оказывают основное влияние на хозяине, вызывая серьезное разрушение эпителиальной архитектуры; гистологические данные включают изъязвление слизистой оболочки и воспалительную реакцию в собственная пластинка. Основными возбудителями этой группы являются: Salmonella, Shigella, Campylobacter , инвазивные E coli и Yersinia .Кишечные вирусы также вторгаются в эпителиальные клетки кишечника, но степень разрушения слизистой оболочки значительно меньше, чем вызвано инвазивными бактериальными патогенами.
Salmonella Enteritis Salmonella видов являются частой причиной пищевых отравлений. В
Основным местом поражения является нижняя подвздошная кишка, где сальмонеллы вызывают поражение слизистой оболочки.
изъязвление. Они быстро пробиваются через эпителиальную поверхность в
lamina propria и попадают в лимфатические сосуды и кровоток.Как минимум две вирулентности
факторы, связанные с кишечной инфекцией: один отвечает за слизистую оболочку
вторжение, а другой вызывает секрецию жидкости и электролитов в
кишечник.
В
Основным местом поражения является нижняя подвздошная кишка, где сальмонеллы вызывают поражение слизистой оболочки.
изъязвление. Они быстро пробиваются через эпителиальную поверхность в
lamina propria и попадают в лимфатические сосуды и кровоток.Как минимум две вирулентности
факторы, связанные с кишечной инфекцией: один отвечает за слизистую оболочку
вторжение, а другой вызывает секрецию жидкости и электролитов в
кишечник.
Shigella Микроорганизмы вызывают бактериальную дизентерию, инвазивную
диарейное заболевание нижнего отдела кишечника, при котором стул содержит воспалительные
экссудат, состоящий из полиморфноядерных лейкоцитов. Бациллы вторгаются в
эпителий толстой кишки и вызывают поверхностные изъязвления.Этот инвазивный процесс
зависит от наличия двух факторов вирулентности. Первый опосредует начальный
проникновение на поверхность слизистой оболочки за счет разрушения щеточной каймы; бактерии
впоследствии поглощаются инвагинацией плазматической мембраны. Секунда
Фактор вирулентности позволяет организму размножаться в ткани слизистой оболочки.
Язвы слизистой оболочки сопровождаются интенсивным воспалительным ответом
собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа
поражение узлов и бактериемия встречаются редко.
Секунда
Фактор вирулентности позволяет организму размножаться в ткани слизистой оболочки.
Язвы слизистой оболочки сопровождаются интенсивным воспалительным ответом
собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа
поражение узлов и бактериемия встречаются редко.
Производство жидкости при инвазивных диарейных заболеваниях
Механизм (ы), посредством которых жидкость, вызывающая водянистую диарею, образуется в
инвазивные диарейные заболевания обсуждаются. Были задействованы три механизма
предложенный. Во-первых, Shigella и, возможно, Штаммы Salmonella , по-видимому, производят энтеротоксин, который
стимулирует слизистую оболочку выделять воду и электролиты. Во-вторых, есть
доказательства того, что инвазивные организмы стимулируют синтез простагландинов на месте
воспаления и простагландины вызывают секрецию жидкости.В
экспериментальные животные, секреция жидкости может быть заблокирована ингибиторами простагландинов
такие как индометацин и аспирин./eColi87296113-56a9c2705f9b58b7d0febf6f.jpg) В-третьих, некоторые данные свидетельствуют о том, что повреждение
эпителий толстой кишки вызывает диарею, предотвращая нормальную резорбцию
жидкость.
В-третьих, некоторые данные свидетельствуют о том, что повреждение
эпителий толстой кишки вызывает диарею, предотвращая нормальную резорбцию
жидкость.
Вирусные диареи
Два вируса — ротавирус (см. Гл. 63) и калицивирус (вирус Норуолк) (см. Главу 65) — были определены как основные кишечные патогены у человека. Ротавирусы — очень важная причина младенческого диарея, которая в неразвитых странах может привести к летальному исходу.Взрослые могут быть инфицированы и распространение вируса, но клиническое заболевание проявляется почти исключительно у детей младше 2 года. Калицивирус, напротив, может вызывать гастроэнтерит во всех возрастных группах и является причиной крупных эпидемий. Первоначальное поражение формируется в проксимальном отделе тонкой кишки. Архитектура слизистой оболочки повреждена с укорочением ворсинок и гиперплазией склепы. Воспалительный экссудат затем появляется в собственной пластинке.
Механизмы, ответственные за секрецию жидкости при вирусных диареях, не изучены. выяснил.Известно, что заражение калицивирусом может вызвать стеаторею и
нарушение всасывания ксилозы и прямое повреждение ферментов щеточной каймы. Активность
аденилатциклазы в эпителиальных клетках не изменяется в остром
болезнь.
выяснил.Известно, что заражение калицивирусом может вызвать стеаторею и
нарушение всасывания ксилозы и прямое повреждение ферментов щеточной каймы. Активность
аденилатциклазы в эпителиальных клетках не изменяется в остром
болезнь.
Паразитарные диареи
Некоторые виды простейших и гельминтов могут вызывать диарейные заболевания. Что-нибудь из этого инфекции могут быть переданы в Соединенных Штатах, хотя при контакте с кишечным паразиты гораздо чаще встречаются в тропических и развивающихся странах.Некоторые из более частыми причинами паразитарной диареи являются Entamoeba histolytica , Giardia lamblia , Strongyloides stercoralis , и кишечные сосальщики.
Клиническая диагностика диарейного заболевания
Понимание патофизиологии может быть использовано для постановки предположительного диагноза в
пациенты с инфекционной диареей (). Пожалуй, самый удобный подход — разделить патогены, которые
вовлекают тонкую кишку из тех, которые атакуют толстую кишку.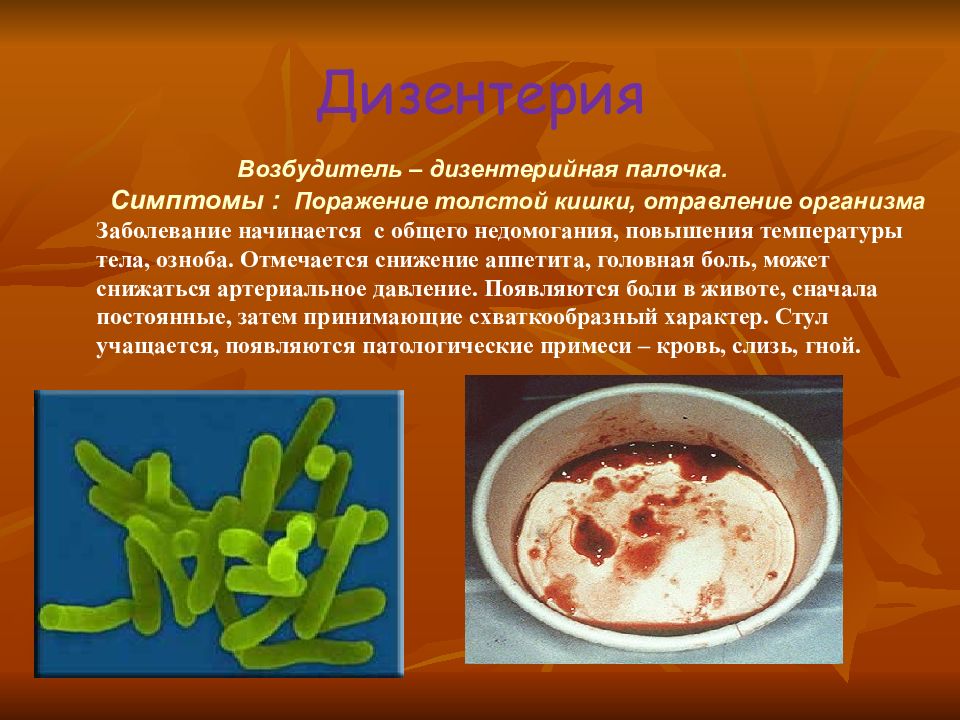 Энтеротоксигенный
бактерии ( E coli, V cholerae ), вирусы и паразиты Лямблии являются примерами патогенов тонкой кишки. Эти организмы
вызывают водянистый понос, который может привести к обезвоживанию. Боль в животе, хотя
часто диффузная и плохо выраженная, обычно околопупочная. Микроскопический
исследование стула не позволяет выявить сформированные клеточные элементы, такие как
эритроциты и лейкоциты.
Энтеротоксигенный
бактерии ( E coli, V cholerae ), вирусы и паразиты Лямблии являются примерами патогенов тонкой кишки. Эти организмы
вызывают водянистый понос, который может привести к обезвоживанию. Боль в животе, хотя
часто диффузная и плохо выраженная, обычно околопупочная. Микроскопический
исследование стула не позволяет выявить сформированные клеточные элементы, такие как
эритроциты и лейкоциты.
Таблица 95-2
Клинические признаки диарейных заболеваний.
Патогены толстой кишки (основными из них являются Shigella и Campylobacter ) являются инвазивными организмами и вызывают клинические
синдром, известный как дизентерия.Вовлечение толстой кишки настоятельно рекомендуется
характерная ректальная боль, известная как тенезмы. Хотя фекальные стоки могут быть
сначала водянистый, ко второму-третьему дню болезни стул скудный и часто
кровянистый или слизистый. Микроскопическое исследование почти всегда выявляет обильные
эритроциты и лейкоциты. Проктоскопия показывает диффузно изъязвленный, геморрагический,
и рыхлая слизистая ободочной кишки.
Проктоскопия показывает диффузно изъязвленный, геморрагический,
и рыхлая слизистая ободочной кишки.
Пищевое отравление сальмонеллой не укладывается в эту простую схему, потому что болезнь может отображать черты, характерные для заболеваний как тонкой, так и толстой кишки.Организм инвазивный для слизистой оболочки тонкой кишки, особенно нижней подвздошной кишки, и может вызвать обильную секрецию жидкости. Кроме того, сепсис и метастатический Иногда происходит распространение возбудителя на другие органы.
Ссылки
- Finegold S (ed): Столетний симпозиум по анаэробам: Памятник Андре Вейону. Clin Infect Dis 18: 5–245, 1994 . [PubMed: 8086570]
Голдин Б.Р., Лихтенштейн А.Х., Горбач С.Л.: роль кишечная флора.п. 500. In Shils ME, Young VR (eds): Современное питание в Здоровье и болезнь. Леа и Фебригер, Филадельфия, 1994.
Горбач С.Л.: Инфекционная диарея и бактериальная пища. отравление. п. 1128 In Sleisenger MH, Fordtran JS (ред.
 ): Желудочно-кишечный тракт.
Болезни. WB Saunders, Philadelphia, 1993.
): Желудочно-кишечный тракт.
Болезни. WB Saunders, Philadelphia, 1993.Simon GL, Gorbach SL: Нормальный пищеварительный тракт. микрофлора. п. 53. In Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL. (ред.): Инфекции желудочно-кишечного тракта, Raven Press, Нью-Йорк, 1995 .
[Микробиологическая диагностика желудочно-кишечных инфекций]
Острые инфекции желудочно-кишечного тракта — одно из самых распространенных инфекционных заболеваний. В настоящем обзоре рассматриваются различные методы диагностики желудочно-кишечных инфекций, вызываемых бактериями, вирусами и паразитами. Посев кала — метод выбора для диагностики бактериальных кишечных инфекций; однако инфекции, вызванные Clostridium difficile, могут быть диагностированы путем обнаружения токсинов A и B в стуле, а инфекции, вызванные диареей Escherichia coli, — с помощью ПЦР-обнаружения генов специфических факторов вирулентности, содержащихся в нескольких E.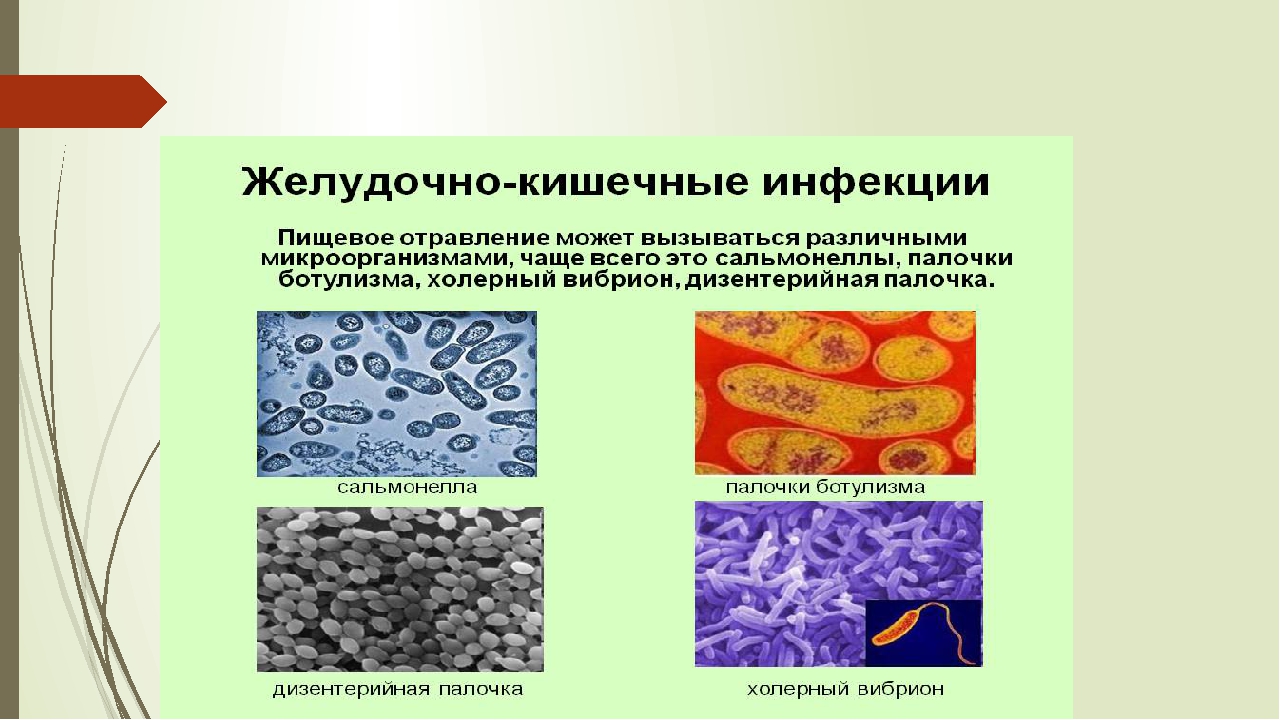 coli патотипы. Методы, используемые для диагностики вирусных желудочно-кишечных инфекций, включают обнаружение вирусных антигенов и нуклеиновых кислот. Наконец, желудочно-кишечные инфекции, вызванные паразитами, могут быть диагностированы путем тестирования на трофозоиты и цисты простейших или личинок и яиц гельминтов в кале путем прямого микроскопического исследования, с помощью методов концентрации или с помощью специальных красителей.
coli патотипы. Методы, используемые для диагностики вирусных желудочно-кишечных инфекций, включают обнаружение вирусных антигенов и нуклеиновых кислот. Наконец, желудочно-кишечные инфекции, вызванные паразитами, могут быть диагностированы путем тестирования на трофозоиты и цисты простейших или личинок и яиц гельминтов в кале путем прямого микроскопического исследования, с помощью методов концентрации или с помощью специальных красителей.
Лас инфекционные агудас дель тракто желудочно-кишечного тракта фигуран энтре лас энфермедадес инфекционистный мас frecuentes.En esta revisión se excinan diversas técnicas para Diagnosticar las gastroenteritis que ocasionan bacterias, virus y parásitos. El coprocultivo es el método de elección para el diagnóstico de las influencciones bacterianas Кишечник, aunque las Infcciones por Clostridium difficile se pueden диагностический прибор mediante la Detección de las toxinas A y B en lasheces porre диагностический агент mediante la Detección por reacción en cadena de la polimerasa de factores de virulencia específicos de los diversos enteropatotipos. Las técnicas utilizadas para el diagnóstico de las gastroenteritis víricas, включая обнаружение антигенос вирусов и обнаружение нуклеиновых кислот. Финализа, Las Infecciones GastrinointeStines Que Canucan Los Parásitos PueDen Diagnosticarse Mediante La Dehiansación de la Presencia de Trofozoitos o de Helmintos en las Heces o Huevos de Helmintos en las Heces Mediante La Utilización Del Examen Microscópico EN Fresco Tras Conctración o Mediante Tinciones Esceptificas.
Las técnicas utilizadas para el diagnóstico de las gastroenteritis víricas, включая обнаружение антигенос вирусов и обнаружение нуклеиновых кислот. Финализа, Las Infecciones GastrinointeStines Que Canucan Los Parásitos PueDen Diagnosticarse Mediante La Dehiansación de la Presencia de Trofozoitos o de Helmintos en las Heces o Huevos de Helmintos en las Heces Mediante La Utilización Del Examen Microscópico EN Fresco Tras Conctración o Mediante Tinciones Esceptificas.
Желудочно-кишечные инфекции, борьба с желудочно-кишечными инфекциями
Желудочно-кишечные инфекции
- > 200 миллионов эпизодов инфекционного гастроэнтерита в год в США 1
- Во всем мире 3-6 миллионов детей ежегодно умирают от инфекционного гастроэнтерита 2
- Вспышки желудочно-кишечных инфекций вызывают серьезную озабоченность в больницах
Определение
Желудочно-кишечные инфекции — это вирусные, бактериальные или паразитарные инфекции, вызывающие гастроэнтерит, воспаление желудочно-кишечного тракта, затрагивающее как желудок, так и тонкий кишечник.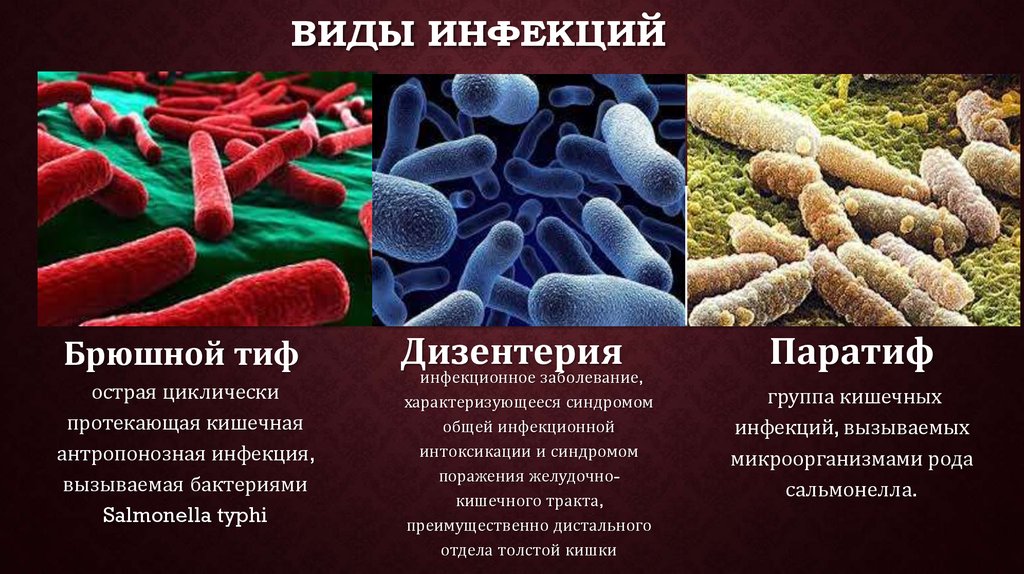 Симптомы включают понос , рвоту и боль в животе . Обезвоживание — основная опасность желудочно-кишечных инфекций, поэтому регидратация важна, но большинство желудочно-кишечных инфекций проходят самостоятельно и проходят в течение нескольких дней. Однако в медицинских учреждениях и в определенных группах населения (новорожденные / младенцы, пациенты с ослабленным иммунитетом или пожилые люди) они потенциально опасны. Быстрая диагностика , соответствующее лечение и Инфекционный контроль, поэтому меры особенно важны в этих контекстах.
Симптомы включают понос , рвоту и боль в животе . Обезвоживание — основная опасность желудочно-кишечных инфекций, поэтому регидратация важна, но большинство желудочно-кишечных инфекций проходят самостоятельно и проходят в течение нескольких дней. Однако в медицинских учреждениях и в определенных группах населения (новорожденные / младенцы, пациенты с ослабленным иммунитетом или пожилые люди) они потенциально опасны. Быстрая диагностика , соответствующее лечение и Инфекционный контроль, поэтому меры особенно важны в этих контекстах.
Инфекции желудочно-кишечного тракта могут быть вызваны большим количеством микроорганизмов, в том числе:
Аденовирус
Аденовирус может вызывать диарею, лихорадку, конъюнктивит, инфекции мочевого пузыря и сыпь, но наиболее частым симптомом является респираторное заболевание. После ротавируса это самая частая причина детской диареи.
Campylobacter
Campylobacter — одна из наиболее частых бактериальных причин гастроэнтерита во всем мире и часто встречается у детей в возрасте до двух лет.Это может вызвать диарею (иногда с кровью), спазмы в животе, рвоту и жар. Обычно он передается с пищей через сырое или недоваренное мясо (особенно из домашней птицы ) или через зараженное молоко.
Clostridium difficile Инфекция вызывает до 25% случаев антибиотико-ассоциированной диареи, наиболее часто возникающих в больницах или медицинских учреждениях 3 . Наибольшему риску подвержены пожилые люди и пациенты с ослабленным иммунитетом.Недавнее появление высокотоксигенных и устойчивых штаммов C. difficile привело к более частым и тяжелых вспышкам , увеличению заболеваемости , и смертности .
кишечная палочка Escherichia coli , часто называемая E. coli , является основной причиной диареи путешественников и основной причиной диарейных заболеваний в развивающихся странах, особенно среди детей.Люди обычно заражаются кишечной палочкой при проглатывании воды, загрязненной фекалиями человека или животных.
coli , является основной причиной диареи путешественников и основной причиной диарейных заболеваний в развивающихся странах, особенно среди детей.Люди обычно заражаются кишечной палочкой при проглатывании воды, загрязненной фекалиями человека или животных.
Escherichia coli O157: H7 представляет собой продуцирующую токсин шига форму бактерий E. coli , которая вызывает желудочно-кишечные инфекции с такими симптомами, как кровавая диарея и рвота. Хотя обычно он проходит через несколько дней, иногда (5-10% 4 инфекций) он может привести к гемолитико-уремическому синдрому (ГУС), который может привести к почечной недостаточности при отсутствии лечения.
Helicobacter pylori Helicobacter pylori , называемый H. pylori , является причиной гастрита и связан с развитием язв желудка и двенадцатиперстной кишки . Это может вызвать боль в животе или тошноту, но во многих случаях симптомы отсутствуют. У инфицированных людей риск развития пептических язв в течение жизни составляет 10-20%, а риск рака желудка — 1-2%. 5 .
Это может вызвать боль в животе или тошноту, но во многих случаях симптомы отсутствуют. У инфицированных людей риск развития пептических язв в течение жизни составляет 10-20%, а риск рака желудка — 1-2%. 5 .
Ротавирус
Ротавирус является наиболее частой причиной диареи у детей младшего и младшего возраста и вызывает самые тяжелые случаи.Вакцина против ротавируса существует, но во всем мире она вызывает более чем ½ миллиона случаев смерти детей в возрасте до пяти лет в год. 6 Большинство из них находится в развивающихся странах.
Сальмонелла и шигелла
Salmonella и Shigella — желудочно-кишечные заболевания пищевого происхождения. Сальмонелла широко распространена и содержится в сыром мясе, птице, морепродуктах и яйцах, а также в молоке и молочных продуктах. Острые симптомы включают тошноту, рвоту, спазмы в животе, диарею, лихорадку и головную боль. Шигелла часто встречается в воде, загрязненной фекалиями человека. Симптомы шигеллеза (бактериальной дизентерии) включают боль в животе, спазмы, диарею, лихорадку, рвоту и кровь, гной или слизь в стуле.
Шигелла часто встречается в воде, загрязненной фекалиями человека. Симптомы шигеллеза (бактериальной дизентерии) включают боль в животе, спазмы, диарею, лихорадку, рвоту и кровь, гной или слизь в стуле.
Staphylococcus aureus — наиболее частая причина пищевой интоксикации, характеризующаяся резким / сильным началом, сильной тошнотой, судорогами, рвотой и диареей при продолжительности действия 1-2 дня. Этот условно-патогенный микроорганизм может быть обнаружен на людях (кожа, инфицированные порезы, носы и горло) и был связан с широким спектром пищевых продуктов, включая мясо и мясные продукты, птицу и яичные продукты, салаты, хлебобулочные и молочные продукты.
Yersinia enterocolitica , называемая Y. enterocolitica , является относительно нечастой причиной диареи и болей в животе. Инфекция чаще всего передается при употреблении в пищу зараженных продуктов, особенно сырых или недоваренных продуктов из свинины, а также мороженого и молока. Общие симптомы — лихорадка, боль в животе и диарея, часто с кровью.
Общие симптомы — лихорадка, боль в животе и диарея, часто с кровью.
Диагностика
Когда симптомы указывают на возможную желудочно-кишечную инфекцию , диагноз может быть подтвержден с помощью лабораторных тестов , используемых для посева или обнаружения антигена в образцах кала.В некоторых случаях (например, для E. coli , Salmonella, C. difficile …), при необходимости, для определения устойчивости микробов к терапии антибиотиками используется тестирование чувствительности к антибиотикам. Быстрая диагностика, в частности, в больницах, дает важную информацию для осуществления мер инфекционного контроля .
Чтобы диагностировать причину диареи, полезно определить контекст: вспышка болезни пищевого происхождения или «диарея путешественников».
Пищевые вспышки :
- Часто местные — группа людей, принимающих пищу вместе, страдает одной и той же болезнью.

- Проблема общественного здравоохранения, когда она широко распространена, затрагивает людей в разных местах и в течение более длительного периода времени.
- Важно выявлять и эпидемиологически отслеживать, чтобы не допустить заражения большего числа людей.
- E. coli , Salmonella , Campylobacter и Staphylococcus являются одними из наиболее распространенных патогенов, вызывающих вспышки болезней пищевого происхождения.
Диарея путешественников :
- Наиболее распространенное заболевание, связанное с путешествиями.
- Заражены людьми, путешествующими в местах, где есть другие патогенные микроорганизмы, чем они привыкли, особенно в регионах, где более распространено заражение продуктов питания / воды.
- Чаще всего передается при приеме пищи или воды, зараженной фекалиями.
- Большинство случаев вызвано бактериями, включая E.
 coli , Salmonella и Shigella .
coli , Salmonella и Shigella .
Профилактика / Лечение
Лучшие способы предотвращения желудочно-кишечных инфекций включают:
- Правильная ручная стирка
- Дезинфекция загрязненных поверхностей отбеливателем
- Стирка загрязненных предметов одежды
- Выявление инфицированных пациентов как можно скорее для внедрения расширенного инфекционного контроля
- Вакцины от большинства желудочно-кишечных инфекций отсутствуют.Исключения:
- Ротавирус
- Аденовирус (ограниченное количество)
- Для C. difficile : избегайте без надобности назначения антибиотиков
Лечение желудочно-кишечных инфекций включает:
- Регидратация — пероральная, иногда внутривенная
- Во многих случаях бактериального гастроэнтерита требуется только симптоматическое лечение (от лихорадки, диареи…).

- Антибиотики обычно не рекомендуются, поскольку они не влияют на вирусные инфекции, могут вызывать побочные эффекты, а чрезмерное употребление увеличивает риск развития устойчивых бактерий.
- Антибиотики могут быть рекомендованы в особо тяжелых случаях гастроэнтерита или если в качестве его причины были определены определенные бактерии.
Руководящие принципы
- Общество эпидемиологии здравоохранения Америки (SHEA) / Общество инфекционных болезней Америки (IDSA)
Руководство по клинической практике для лечения Clostridium difficile у взрослых: обновление 2010 г., подготовленное SHEA / IDSA Infect. Control Hosp. Эпидемиол. 2010; 31 (5): 000-000
http: // www.jstor.org/stable/10.1086/651706
ССЫЛКИ
- Брайан CS. Инфекционные болезни в первичной медико-санитарной помощи. Издание: Сондерс. 2002
- Медицинская онлайн-библиотека Merck — Желудочно-кишечные заболевания www.
 merck.com
merck.com - Bartlett JG. Клиническая практика. Диарея, связанная с приемом антибиотиков. N Engl J Med 2002; 346: 334-349
- Веб-сайт CDC: http://www.cdc.gov/ecoli/
- Clin Microbiol Rev.2006 июль; 19 (3): 449–490. doi: 10.1128 / CMR.00054-05
«Патогенез инфекции Helicobacter pylori», Йоханнес Г.Кустерс, Арно Х. М. ван Влит и Эрнст Дж. Кейперс http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1539101/ - Веб-сайт CDC: http://www.cdc.gov/rotavirus/index.html
Этот сайт не является источником медицинских консультаций
Медицинское содержание этого сайта представлено в краткой форме, носит общий характер и предоставляется только в информационных целях. Он не предназначен и не рекомендуется использовать вместо профессиональных медицинских рекомендаций. Вы не должны использовать Медицинский контент этого Сайта для диагностики проблем или заболеваний, связанных со здоровьем или физической подготовкой.Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг относительно любого заболевания или лечения. Ничто, содержащееся на этом Сайте, не предназначено для медицинской диагностики или лечения. Он не должен использоваться врачами в качестве единственного источника информации для принятия решений о назначении. Никогда не пренебрегайте медицинскими советами и не откладывайте их поиск из-за того, что вы прочитали на этом Сайте.
Ничто, содержащееся на этом Сайте, не предназначено для медицинской диагностики или лечения. Он не должен использоваться врачами в качестве единственного источника информации для принятия решений о назначении. Никогда не пренебрегайте медицинскими советами и не откладывайте их поиск из-за того, что вы прочитали на этом Сайте.
Быстрая диагностика инфекций желудочно-кишечного тракта, вызванных паразитами, вирусами и бактериями
Диагностика паразитов Традиционно для микробиологической диагностики как простейших (амеб, жгутиконосцев, инфузорий, кокцидий и микроспоридий), так и гельминтов (нематоды, цестоды и трематоды) выполняется путем микроскопической идентификации паразитарных форм, которые выделяются с фекалиями пациента.Чтобы увеличить диагностическую ценность, необходимо использовать методы концентрации и, в некоторых случаях, специфические красители. Эти определения позволяют диагностировать только острую и явную инфекцию, требуют взятия серийных образцов, очень трудоемки, требуют специализированного персонала и имеют ограничения с точки зрения чувствительности и специфичности. В скрининговых тестах на паразитарные антигены в фекалиях используются специфические антитела, распознающие секрецию, поверхностные или стеночные молекулы паразитов7. Существуют коммерциализированные системы, позволяющие одновременно обнаруживать 2 или 3 различных вида (таблица 2).Тесты амплификации геномных последовательностей обладают большей чувствительностью и специфичностью, и благодаря постоянной характеристике геномов различных организмов можно разработать протоколы ПЦР для каждого из интересующих паразитов. Однако с помощью этих методов одновременно можно обнаружить только одного или нескольких паразитов, а на рынке их очень мало8.
В скрининговых тестах на паразитарные антигены в фекалиях используются специфические антитела, распознающие секрецию, поверхностные или стеночные молекулы паразитов7. Существуют коммерциализированные системы, позволяющие одновременно обнаруживать 2 или 3 различных вида (таблица 2).Тесты амплификации геномных последовательностей обладают большей чувствительностью и специфичностью, и благодаря постоянной характеристике геномов различных организмов можно разработать протоколы ПЦР для каждого из интересующих паразитов. Однако с помощью этих методов одновременно можно обнаружить только одного или нескольких паразитов, а на рынке их очень мало8.
Entamoeba histolytica вызывает амебную дизентерию и является одной из возможных причин диареи путешественников.Традиционный диагноз амебиаза на протяжении многих лет основывается на микроскопии. Однако микроскопические методы не позволяют дифференцировать E. histolytica от комменсальных амеб Entamoeba dispar и Entamoeba moshkovskii. Методы ПЦР, основанные в основном на амплификации кодирующих областей небольшой рибосомной субъединицы 18S (18S рРНК), позволяют дифференцировать 3 вида морфологически неотличимых Entamoeba и обеспечивают превосходные уровни чувствительности и специфичности.9 С другой стороны, обнаружение E.histolytica с помощью ELISA — хороший вариант, если молекулярные методы недоступны. В настоящее время доступны различные мембранные ИФА и имеющиеся на рынке анализы ICT, которые обнаруживают специфические антигены E. histolytica в фекалиях и содержимом абсцесса.10,11 Эти анализы основаны на обнаружении специфических эпитопов амебного лектина и имеют более высокую чувствительность, чем у микроскопическое исследование.10,12 Некоторые из имеющихся на рынке анализов позволяют использовать только свежий или замороженный стул.
Методы ПЦР, основанные в основном на амплификации кодирующих областей небольшой рибосомной субъединицы 18S (18S рРНК), позволяют дифференцировать 3 вида морфологически неотличимых Entamoeba и обеспечивают превосходные уровни чувствительности и специфичности.9 С другой стороны, обнаружение E.histolytica с помощью ELISA — хороший вариант, если молекулярные методы недоступны. В настоящее время доступны различные мембранные ИФА и имеющиеся на рынке анализы ICT, которые обнаруживают специфические антигены E. histolytica в фекалиях и содержимом абсцесса.10,11 Эти анализы основаны на обнаружении специфических эпитопов амебного лектина и имеют более высокую чувствительность, чем у микроскопическое исследование.10,12 Некоторые из имеющихся на рынке анализов позволяют использовать только свежий или замороженный стул.
Лямблиоз, вызываемый Giardia lamblia, является паразитарным заболеванием, имеющим большое эпидемиологическое и клиническое значение из-за его высокой распространенности и патогенности, в основном среди детей. Для диагностики были проданы различные методы обнаружения антигенов с уровнями чувствительности и специфичности, превосходящими таковые при микроскопическом исследовании. Эти тесты также полезны при скрининге младенцев и в качестве лечебного контроля для подтверждения заживления. В различных предлагаемых на рынке ИФА используются моноклональные или поликлональные антитела для обнаружения мембранных антигенов G. lamblia, таких как GSA 65 или CWP1.11. Это быстрые методы, которые рентабельны и позволяют обрабатывать недавний стул или фекалии, консервированные в формалине.Для G. lamblia также доступны коммерчески доступные анализы ICT. Однако для большинства из них требуется свежий или замороженный стул без консервантов, и они имеют более низкую чувствительность, чем анализы ELISA. Также доступны окраски с прямой иммунофлуоресценцией (DFI) для G. lamblia с использованием антиген-специфических моноклональных антител GSA 65.
Для диагностики были проданы различные методы обнаружения антигенов с уровнями чувствительности и специфичности, превосходящими таковые при микроскопическом исследовании. Эти тесты также полезны при скрининге младенцев и в качестве лечебного контроля для подтверждения заживления. В различных предлагаемых на рынке ИФА используются моноклональные или поликлональные антитела для обнаружения мембранных антигенов G. lamblia, таких как GSA 65 или CWP1.11. Это быстрые методы, которые рентабельны и позволяют обрабатывать недавний стул или фекалии, консервированные в формалине.Для G. lamblia также доступны коммерчески доступные анализы ICT. Однако для большинства из них требуется свежий или замороженный стул без консервантов, и они имеют более низкую чувствительность, чем анализы ELISA. Также доступны окраски с прямой иммунофлуоресценцией (DFI) для G. lamblia с использованием антиген-специфических моноклональных антител GSA 65.
Cryptosporidium hominis и Cryptosporidium parvum — два основных патогенных вида паразитов человека. В основном они поражают пациентов с ослабленным иммунитетом и вызывают тяжелую хроническую диарею.Кокцидиоз традиционно выявляют с помощью микроскопии ооцист после специальных красителей, таких как Киньюн или аурамин-родамин. Существуют различные другие методы обнаружения антигенов, которые являются действительными альтернативами, такие как методы IFD, ELISA или ICT, которые показали значения специфичности и чувствительности выше, чем при микроскопическом наблюдении.7,11,13 Однако ни один из упомянутых методов не позволяет идентифицировать видов, поэтому необходимо прибегать к методам ПЦР.
В основном они поражают пациентов с ослабленным иммунитетом и вызывают тяжелую хроническую диарею.Кокцидиоз традиционно выявляют с помощью микроскопии ооцист после специальных красителей, таких как Киньюн или аурамин-родамин. Существуют различные другие методы обнаружения антигенов, которые являются действительными альтернативами, такие как методы IFD, ELISA или ICT, которые показали значения специфичности и чувствительности выше, чем при микроскопическом наблюдении.7,11,13 Однако ни один из упомянутых методов не позволяет идентифицировать видов, поэтому необходимо прибегать к методам ПЦР.
Существуют 3 группы гельминтов, имеющих важное медицинское значение: нематоды (круглые черви), цестоды (полосатые черви) и трематоды (или палки).Диагностика некоторых цестод основана на наблюдении за проглоттидами или сегментами. Однако при большинстве гельминтозов диагноз ставится путем микроскопической идентификации их яиц или личинок в стуле пациента. Хотя существуют также специальные методы, применимые только для определенных гельминтов, такие как лента Грэма при диагностике Enterobius vermicularis или культивирование Strongyloides stercoralis, успехи в быстрой диагностике кишечных гельминтов не так значительны, как у простейших. Тесты на обнаружение антигенов не получили большого развития, и, хотя было опубликовано несколько исследований, 14 они еще не поступили в продажу. Более частыми являются серологические тесты на специфические антитела, доступные для диагностики эхинококкоза, цистицеркоза, фасциолоза, шистосомоза, токсокароза, анисакиоза, филяриоза и стронгилоидоза. Некоторые из этих анализов продаются, в то время как другие проводятся только в справочных центрах. Все они имеют недостаток, заключающийся в том, что не различают текущую и прошлую инфекцию, поэтому они более полезны в неэндемичных областях и часто имеют проблемы перекрестной реактивности15,16 Что касается молекулярной диагностики, было разработано множество протоколов ПЦР, оба в обычном режиме и в режиме реального времени для диагностики гельминтозов.8 Однако до сих пор ни один из них не поступил в продажу.
Тесты на обнаружение антигенов не получили большого развития, и, хотя было опубликовано несколько исследований, 14 они еще не поступили в продажу. Более частыми являются серологические тесты на специфические антитела, доступные для диагностики эхинококкоза, цистицеркоза, фасциолоза, шистосомоза, токсокароза, анисакиоза, филяриоза и стронгилоидоза. Некоторые из этих анализов продаются, в то время как другие проводятся только в справочных центрах. Все они имеют недостаток, заключающийся в том, что не различают текущую и прошлую инфекцию, поэтому они более полезны в неэндемичных областях и часто имеют проблемы перекрестной реактивности15,16 Что касается молекулярной диагностики, было разработано множество протоколов ПЦР, оба в обычном режиме и в режиме реального времени для диагностики гельминтозов.8 Однако до сих пор ни один из них не поступил в продажу.
Основными вирусами, вызывающими гастроэнтерит у человека, являются ротавирус, астровирус, аденовирус и норовирус. Другие, такие как коронавирусы, торовирусы, пикобирнавирусы и пикорнавирусы (вирус Аичи), также могут вызывать инфекцию желудочно-кишечного тракта, но с гораздо меньшей частотой.16 Быстрая диагностика вирусного гастроэнтерита проводится путем обнаружения вирусных антигенов (таблица 3) или молекулярным методом. методы, основанные на обнаружении специфических генов.
Другие, такие как коронавирусы, торовирусы, пикобирнавирусы и пикорнавирусы (вирус Аичи), также могут вызывать инфекцию желудочно-кишечного тракта, но с гораздо меньшей частотой.16 Быстрая диагностика вирусного гастроэнтерита проводится путем обнаружения вирусных антигенов (таблица 3) или молекулярным методом. методы, основанные на обнаружении специфических генов.
Ротавирусы представляют собой высококонтагиозные РНК-вирусы, которые передаются фекально-оральным путем, фомитами или респираторным путем. По антигенным характеристикам гликопротеина VP6, компонента внутреннего капсида вириона, выделяют 8 серогрупп (A-H). Инфекции человека в основном вызываются ротавирусами серогруппы A и, в меньшей степени, серогруппами B и C.Белок VP4, который составляет спикулы вириона, и гликопротеин VP7, составляющий внешний капсид, определяют существование серотипов P. и G соответственно.17 Диагностика ротавирусных инфекций серогруппы A основана на обнаружении вирусных антигенов в образцах стула, в частности гликопротеина VP6. На данный момент нет коммерчески доступных методов выявления ротавирусов других серогрупп. Доступные форматы очень разнообразны: ELISA, мембранный EIA, ICT и латексная агглютинация.18–20 Мембранный EIA, методы ICT и латексная агглютинация являются подходящими методами для больниц с небольшим количеством или единичными образцами. Однако они менее чувствительны, чем обычные ELISA.Более чувствительные и специфические молекулярные методы основаны на ОТ-ПЦР. Для диагностики ротавируса группы А с помощью ОТ-ПЦР продаваемые системы используют специфические праймеры гена, кодирующего неструктурный белок NSP3. Эта методология также позволяет обнаруживать ротавирусы различных серогрупп.21
На данный момент нет коммерчески доступных методов выявления ротавирусов других серогрупп. Доступные форматы очень разнообразны: ELISA, мембранный EIA, ICT и латексная агглютинация.18–20 Мембранный EIA, методы ICT и латексная агглютинация являются подходящими методами для больниц с небольшим количеством или единичными образцами. Однако они менее чувствительны, чем обычные ELISA.Более чувствительные и специфические молекулярные методы основаны на ОТ-ПЦР. Для диагностики ротавируса группы А с помощью ОТ-ПЦР продаваемые системы используют специфические праймеры гена, кодирующего неструктурный белок NSP3. Эта методология также позволяет обнаруживать ротавирусы различных серогрупп.21
Астровирусы — это вирусы без оболочки с геномом одноцепочечной РНК с положительным смыслом, небольшие (28–41 нм в диаметре) и звездообразные под электронным микроскопом. Существует 8 различных серотипов (1–8), но из-за наличия перекрестных антигенных реакций все они можно обнаружить с помощью группоспецифического антитела под названием MAb8E7, способного распознавать эпитоп, общий для всех серотипов человека. В настоящее время доступно несколько коммерческих наборов для ELISA, позволяющих обнаруживать астровирус человека в фекалиях. Диагноз также можно установить с помощью ОТ-ПЦР22.
В настоящее время доступно несколько коммерческих наборов для ELISA, позволяющих обнаруживать астровирус человека в фекалиях. Диагноз также можно установить с помощью ОТ-ПЦР22.
Кишечные аденовирусы серотипов 40 и 41 чаще всего связаны с детским гастроэнтеритом. Существуют методы конкретных типов, которые обнаруживают только серотипы 40 и 41, и методы других групп, которые обнаруживают все аденовирусы. Диагноз кишечных аденовирусных инфекций обычно устанавливается с помощью ELISA, латексной агглютинации или ICT.Некоторые из этих методов позволяют одновременно обнаруживать аденовирус и ротавирус. Существуют также коммерчески доступные высокочувствительные и специфические методы ПЦР, которые позволяют обнаруживать и характеризовать кишечные аденовирусы.16
Норовирус Норовирусы являются основной причиной небактериального гастроэнтерита у людей любого возраста и наиболее частой причиной вспышек острых заболеваний. гастроэнтерит. Это вирусы без оболочки диаметром примерно 38 нм, чей геном состоит из одноцепочечной РНК с положительным смыслом. Из 5 описанных геногрупп только геногруппы I, II и IV имеют штаммы, которые инфицируют людей. ОТ-ПЦР стала эталонным методом диагностики. Используемые праймеры позволяют амплифицировать ген вирусной РНК-полимеразы или ген, кодирующий белки капсида. ОТ-ПЦР в реальном времени более чувствительна и позволяет быстрее выявлять и различать геногруппы I и II. Кроме того, существует несколько диагностических тестов, основанных на обнаружении антигенов. 23 Некоторые ELISA обладают высокой специфичностью, но умеренной чувствительностью, поэтому они очень полезны при изучении эпидемических вспышек, но не столько при диагностике спорадических случаев.Однако доступные ИКТ и мембранные ИФА обладают высокими значениями чувствительности и специфичности.
Из 5 описанных геногрупп только геногруппы I, II и IV имеют штаммы, которые инфицируют людей. ОТ-ПЦР стала эталонным методом диагностики. Используемые праймеры позволяют амплифицировать ген вирусной РНК-полимеразы или ген, кодирующий белки капсида. ОТ-ПЦР в реальном времени более чувствительна и позволяет быстрее выявлять и различать геногруппы I и II. Кроме того, существует несколько диагностических тестов, основанных на обнаружении антигенов. 23 Некоторые ELISA обладают высокой специфичностью, но умеренной чувствительностью, поэтому они очень полезны при изучении эпидемических вспышек, но не столько при диагностике спорадических случаев.Однако доступные ИКТ и мембранные ИФА обладают высокими значениями чувствительности и специфичности.
Clostridium difficile представляет собой споровую анаэробную грамположительную палочку, обнаруженную в почве и кишечном тракте животных и людей, которая может колонизировать до 50% детей в возрасте до одного года, 3-5% бактерий. здоровые взрослые и более высокий процент госпитализированных взрослых пациентов или находящихся в домах престарелых. C. difficile вызывает диарею, ассоциированную с антибиотиками, но симптомы могут варьироваться от бессимптомного носительства до умеренной или легкой диареи и псевдомембранозного колита.2,24,25 Патогенные штаммы имеют локус патогенности, который кодирует токсин A, энтеротоксин, кодируемый геном TcdA, и токсин B, мощный цитотоксин, кодируемый геном TcdB2,25, хотя они могут не представлять токсин A, а только токсин. B. Гипервирулентный штамм NAP1 / 027 / B1 ассоциирован с повышенной заболеваемостью и смертностью и вызывает большую экспрессию токсина, более эффективную споруляцию и экспрессию бинарного токсина, хотя не все обнаруженные в настоящее время штаммы обладают этими характеристиками вирулентности.2,26
здоровые взрослые и более высокий процент госпитализированных взрослых пациентов или находящихся в домах престарелых. C. difficile вызывает диарею, ассоциированную с антибиотиками, но симптомы могут варьироваться от бессимптомного носительства до умеренной или легкой диареи и псевдомембранозного колита.2,24,25 Патогенные штаммы имеют локус патогенности, который кодирует токсин A, энтеротоксин, кодируемый геном TcdA, и токсин B, мощный цитотоксин, кодируемый геном TcdB2,25, хотя они могут не представлять токсин A, а только токсин. B. Гипервирулентный штамм NAP1 / 027 / B1 ассоциирован с повышенной заболеваемостью и смертностью и вызывает большую экспрессию токсина, более эффективную споруляцию и экспрессию бинарного токсина, хотя не все обнаруженные в настоящее время штаммы обладают этими характеристиками вирулентности.2,26
У пациентов с факторами риска диареи, вызванной C. difficile, как госпитализированных, так и негоспитализированных, следует проводить быстрое обнаружение токсинов A и B, чтобы начать лечение антибиотиками и применить меры контроля для предотвращения их распространения на других пациентов.
Наиболее часто используемые методы:
Обнаружение антигена. Обнаружение глутаматдегидрогеназы (GDH) с помощью EIA или латексных частиц. GDH является очень распространенным антигеном клеточной стенки C. difficile, и его обнаружение очень чувствительно, но не очень специфично, поскольку он присутствует как в токсигенных, так и в нетоксигенных штаммах.2,24,27
Обнаружение токсинов A и / или B. Это может быть выполнено с помощью тестов на цитотоксичность или с помощью методов ICT или EIA. 4,28 Тест на цитотоксичность считается эталонным методом для обнаружения токсина B в фекалиях. с высокой чувствительностью и специфичностью, но он очень трудоемок, к тому же не является экспресс-тестом. Существует множество коммерческих тестов EIA для обнаружения токсинов A, B или обоих. Рекомендуется использовать методы EIA для обнаружения токсина B или обоих из-за штаммов, продуцирующих токсин B.Однако эти коммерческие методы имеют низкую чувствительность по сравнению с культурами клеток, поэтому необходимо использовать методы обнаружения нуклеиновых кислот. 2,28 Выявление токсина из выделения, полученного путем культивирования, не следует использовать как единственный метод, поскольку для этого требуется несколько дней. растут, но его использование, в дополнение к прямому обнаружению токсина, может повысить положительность на 10% .29
2,28 Выявление токсина из выделения, полученного путем культивирования, не следует использовать как единственный метод, поскольку для этого требуется несколько дней. растут, но его использование, в дополнение к прямому обнаружению токсина, может повысить положительность на 10% .29
Обнаружение генов токсина A / B путем амплификации нуклеиновой кислоты. Это метод, который предлагает наибольшую чувствительность и специфичность, хотя и более дорогостоящий.Существуют различные ПЦР в реальном времени, которые позволяют обнаруживать C. difficile, токсин B и бинарный токсин за 90 минут. GeneXpert обеспечивает 98% -ный уровень соответствия эталонному тесту и большую чувствительность, чем ICT4,30. Однако образец может быть положительным по молекулярному методу и отрицательным по ИФА и клеточной культуре, и в результате могут возникнуть сомнения в клинических исследованиях. значение.2,27
Чтобы поставить правильный диагноз и быть экономически эффективным, необходимо использовать один из следующих алгоритмов2,24,25: (1) выполнить GDH EIA и изучить присутствие токсинов с помощью молекулярного метода при положительном результате (2) выполнить комбинацию GDH и токсина A / B EIA одновременно и подтвердить образцы, показывающие несовпадающие результаты, используя молекулярный метод, или (3) выполнить только молекулярный метод для всех образцов.
Escherichia coli может быть частью нормальной кишечной микробиоты, но некоторые разновидности (считающиеся патологическими разновидностями или патотипами) обладают способностью вызывать диарею и являются причиной заболеваемости и смертности во всем мире.31 Они определяются выражением: один или несколько факторов вирулентности: энтеропатоген (EPEC), продуцент токсина шига (STEC), также называемый продуцентом энтерогеморрагического или вероцитотоксина, который включает серотип O157, энтероинвазивный (EIEC), энтеротоксигенный (ETEC), энтероагрегативный (EAEC) и адгезивно-инвазивный (AIEC) .2,31
В большинстве клинических лабораторий и лабораторий общественного здравоохранения изучается только STEC, который определяется по наличию генов токсина шига 1 (stx1) и / или токсина шига 2 (stx2). Культура позволяет обнаруживать только E. coli O157, но независимые от культуры методы обнаруживают как O157, так и другие 2. CDC рекомендует одновременно готовить дифференциальную культуру для обнаружения E. coli O157 и молекулярное исследование для обнаружения stx1 и stx2. в фекалиях пациентов с острой диареей, приобретенной в сообществе, и с возможным гемолитико-уремическим синдромом.32 Если молекулярный метод недоступен, его следует отправить в справочный центр.
coli O157 и молекулярное исследование для обнаружения stx1 и stx2. в фекалиях пациентов с острой диареей, приобретенной в сообществе, и с возможным гемолитико-уремическим синдромом.32 Если молекулярный метод недоступен, его следует отправить в справочный центр.
Можно использовать следующее: (1) EIA Stx, который может обнаруживать и в некоторых случаях различать stx1 и stx2, из обогащенного бульона, инкубированного в течение ночи при 37 ° C, как STEC O157, так и не-O157, и (2 ) молекулярные методы, которые обнаруживают гены stx1 и stx2 непосредственно в фекалиях, и которые являются наиболее чувствительными методами.2 Недавно было опубликовано использование новой ИКТ, выполняемой непосредственно на образцах стула с превосходными результатами.30
Campylobacter Тесты на обнаружение антигена Campylobacter были разработаны на основе образцов стула в формате ELISA, на микролуночном планшете или в формате ICT с боковым потоком. Хотя это более быстрые методы, чем культивирование, они менее чувствительны и не различают Campylobacter jejuni и Campylobacter coli. Существуют молекулярные методы, которые можно выполнять непосредственно с фекалиями, которые являются наиболее чувствительными, но недостаточно валидированы.2
Существуют молекулярные методы, которые можно выполнять непосредственно с фекалиями, которые являются наиболее чувствительными, но недостаточно валидированы.2
Быстрый тест (ICT, тест-полоска) выявляет Shigella из колоний, и непосредственно с фекалиями или ректальным экссудатом благодаря моноклональным антителам против липополисахаридов.4 Энтеротоксины Staphylococcus aureus, Bacillus cereus и Clostridium perfringens могут быть обнаружены в продуктах питания, фекалиях или в штаммах, культивируемых коммерческими методами, с помощью метода обратной пассивной латексной агглютинации или метода EIA.33
Helicobacter pyloriДля быстрой диагностики При инфекции H. pylori использовались разные методы, поскольку культивирование биопсии происходит медленно и требует больших усилий.34
На основе уреазы H. pylori. H. pylori обладает сильнодействующей уреазой, и эта характеристика использовалась с момента открытия H. pylori, для его диагностики, с помощью 2 типов тестов: экспресс-уреаза из биопсии и анализ дыхания.
pylori, для его диагностики, с помощью 2 типов тестов: экспресс-уреаза из биопсии и анализ дыхания.
Если кусочек ткани биопсии добавить в бульон или гель мочевины, цвет изменится на розовый через несколько минут. Тест на уреазу можно использовать для идентификации бактерий, полученных путем посева, но в основном он используется в качестве стандартной практики в отделениях эндоскопии. Первым, который был продан для этой цели, был CLO-тест, с которым положительные результаты были получены между 30 мин и 3 часами, хотя его можно было отложить до 24 часов, что привело к потере специфичности из-за других уреазоположительных бактерий.В настоящее время существуют различные торговые марки, которые стремятся сократить время получения результата.35
Для выполнения дыхательного теста на мочевину (UBT) пациент принимает внутрь помеченную мочевину, и образцы дыхания собираются до и через 30 минут после приема. Если H. pylori попадает в желудок, он гидролизует мочевину и выделяется отмеченный CO2. Можно использовать радиоактивный изотоп 14C или нерадиоактивный изотоп 13C, который является наиболее широко используемым и может быть измерен с помощью масс-спектрометра или инфракрасного спектрометра.35 Это неинвазивный тест выбора для диагностики и последующего наблюдения за пациентами с H. pylori из-за их высокой чувствительности и специфичности (95–100%) для выявления активной инфекции. 35,36
Можно использовать радиоактивный изотоп 14C или нерадиоактивный изотоп 13C, который является наиболее широко используемым и может быть измерен с помощью масс-спектрометра или инфракрасного спектрометра.35 Это неинвазивный тест выбора для диагностики и последующего наблюдения за пациентами с H. pylori из-за их высокой чувствительности и специфичности (95–100%) для выявления активной инфекции. 35,36
На основе обнаружения антител. Существует множество серологических тестов для выявления анти-H. pylori IgG-антитела в сыворотке крови пациента. Основное ограничение заключается в том, что они не позволяют дифференцировать активную инфекцию от прошлой инфекции, и используемый набор должен быть валидирован на местном уровне35. Он полезен для эпидемиологических исследований, а также при желудочно-кишечном кровотечении, атрофическом гастрите, раке желудка или лимфоме MALT (слизистая оболочка). ассоциированная лимфоидная ткань), поскольку она может вызвать низкую бактериальную нагрузку в желудке и снизит чувствительность других диагностических тестов. 36,37 Существуют также тесты для обнаружения антител к H. pylori в моче или слюне с различными результатами, поэтому в настоящее время их не рекомендуется использовать при ведении пациентов. 35,38,39
36,37 Существуют также тесты для обнаружения антител к H. pylori в моче или слюне с различными результатами, поэтому в настоящее время их не рекомендуется использовать при ведении пациентов. 35,38,39
На основе обнаружения антигенов в фекалиях. Тест на антиген в стуле — это неинвазивный и качественный тест, который выявляет антиген H. pylori, который был выведен с фекалиями. Их можно использовать: (1) как тест для первоначального диагноза инфекции; (2) для контроля лечения (не менее 4 недель после окончания лечения) и (3) для эпидемиологических исследований.
Первым набором, который был разработан, был ИФА с поликлональными антителами, 39 хотя в настоящее время он не рекомендуется из-за его более низкой чувствительности и специфичности по сравнению с теми, которые используют моноклональные антитела.35,39 Из множества имеющихся на рынке методов, в которых используются моноклональные антитела, EIA или ICT демонстрируют различную диагностическую точность. Лучшие результаты получаются с наборами, основанными на ИФА в формате микролунок39, и в Маастрихтском консенсусном отчете они считаются эквивалентными UBT. 34,35 Существует также автоматический хемилюминесцентный иммуноанализ с результатами, сопоставимыми с ИФА.34
34,35 Существует также автоматический хемилюминесцентный иммуноанализ с результатами, сопоставимыми с ИФА.34
Чувствительность 93% и 95% и специфичность 89% и 87% для диагностики до лечения и чувствительность 94% и 100% и специфичность 97% и 91% для последующего наблюдения после лечения наблюдались в 2 исследованиях. оценка ИКТ.35 В недавнем исследовании сравнивались 3 коммерческих ИКТ, и RAPID Hp StAR (Oxoid) оказался наиболее чувствительным (91–92%), но менее специфичным (77–85%), тогда как для Uni-Gold ™ Антиген H.pylori (Trinity Biotech) и для ImmunoCard STAT! Наблюдались HpSA (меридиан), чувствительность 83% и специфичность 90% (87–89%).40 В других исследованиях также наблюдались более низкие значения чувствительности и / или специфичности, поэтому считается, что ИКТ должны быть улучшены, чтобы быть надежными.40
На основе молекулярных методов (ПЦР). В течение многих лет домашние молекулярные методы использовались для диагностики инфекции H. pylori на основе различных образцов, таких как биопсия желудка, фекалии, слюна, желудочный сок и т. Д. Кроме того, они позволяют изучать мутации устойчивости к макролидам, такие как кларитромицин. (Ген 23S рРНК), фторхинолоны (ген gyrA), тетрациклины (ген 16S рРНК), рифабутин (ген rpoB) и амоксициллин (ген pbp-1a), 41,42 и обладают преимуществами скорости, большей чувствительности, чем культивирование с фенотипическими методами чувствительности к антибиотикам, и они обнаруживают гетерогенную резистентность, которую может быть трудно получить культивированием.39,43
Д. Кроме того, они позволяют изучать мутации устойчивости к макролидам, такие как кларитромицин. (Ген 23S рРНК), фторхинолоны (ген gyrA), тетрациклины (ген 16S рРНК), рифабутин (ген rpoB) и амоксициллин (ген pbp-1a), 41,42 и обладают преимуществами скорости, большей чувствительности, чем культивирование с фенотипическими методами чувствительности к антибиотикам, и они обнаруживают гетерогенную резистентность, которую может быть трудно получить культивированием.39,43
В последнем Маастрихтском консенсусе, исследования чувствительности к кларитромицину рассматриваются, если этот антибиотик будет использоваться в качестве первой линии лечения в регионах с уровнем резистентности более 15%, как по культуре и антибиотикограмме, так и по молекулярный метод непосредственно из биопсии.36
Существует несколько коммерческих наборов, основанных на ПЦР в реальном времени, которые выявляют H. pylori непосредственно на биопсии; другие методы, помимо H. pylori, выявляют основные мутации, придающие устойчивость к кларитромицину 44–47 (таблица 4). Существует также коммерческий набор, основанный на ПЦР с последующей гибридизацией с обратным линейным блоттингом (GenoType HelicoDR), который определяет устойчивость к кларитромицину и фторхинолонам. Сообщалось о чувствительности от 94% до 100% и специфичности от 86% до 99% для обнаружения устойчивости к кларитромицину и чувствительности от 83% до 87% и специфичности от 95% до 98,5% для устойчивости к фторхинолонам 39,48, хотя и в других случаях. в исследованиях наблюдались более низкие уровни как кларитромицина, так и фторхинолонов.39,49 Некоторые из имеющихся в продаже наборов могут обнаруживать H.pylori и его устойчивость к кларитромицину из образцов кала (Amplidiag H. pylori + ClariR, Mobidiag или ClariRes для ПЦР в реальном времени, Ingenetix), хотя статьи еще не опубликованы.
Существует также коммерческий набор, основанный на ПЦР с последующей гибридизацией с обратным линейным блоттингом (GenoType HelicoDR), который определяет устойчивость к кларитромицину и фторхинолонам. Сообщалось о чувствительности от 94% до 100% и специфичности от 86% до 99% для обнаружения устойчивости к кларитромицину и чувствительности от 83% до 87% и специфичности от 95% до 98,5% для устойчивости к фторхинолонам 39,48, хотя и в других случаях. в исследованиях наблюдались более низкие уровни как кларитромицина, так и фторхинолонов.39,49 Некоторые из имеющихся в продаже наборов могут обнаруживать H.pylori и его устойчивость к кларитромицину из образцов кала (Amplidiag H. pylori + ClariR, Mobidiag или ClariRes для ПЦР в реальном времени, Ingenetix), хотя статьи еще не опубликованы.
Пробиотики и желудочно-кишечные инфекции
Желудочно-кишечные инфекции являются основной причиной заболеваемости и смертности
во всем мире, особенно в развивающихся странах.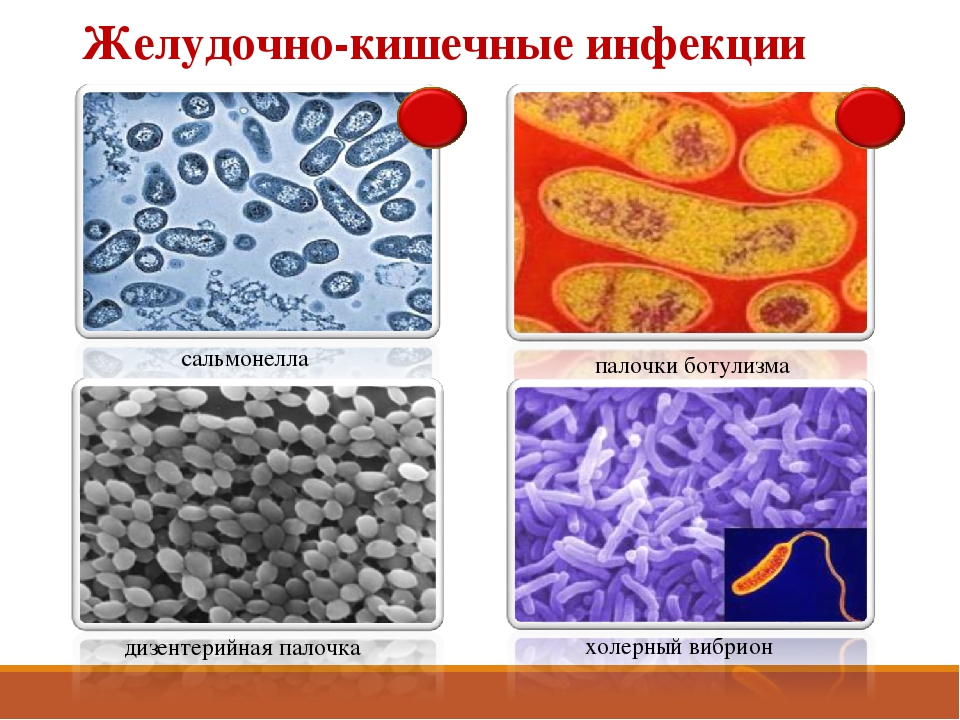 Использование пробиотиков для предотвращения и
лечить различные диарейные заболевания приобрело популярность в последние годы.Примеры, где
пробиотики положительно повлияли на гастроэнтерит. Однако в целом
эффективность этих методов лечения и механизмы, с помощью которых пробиотики улучшают состояние желудочно-кишечного тракта.
инфекции в основном неизвестны. Мы обсудим возможные механизмы, с помощью которых пробиотики могут
положительное воздействие за счет усиления профилактики или
лечение диарейных заболеваний.
Использование пробиотиков для предотвращения и
лечить различные диарейные заболевания приобрело популярность в последние годы.Примеры, где
пробиотики положительно повлияли на гастроэнтерит. Однако в целом
эффективность этих методов лечения и механизмы, с помощью которых пробиотики улучшают состояние желудочно-кишечного тракта.
инфекции в основном неизвестны. Мы обсудим возможные механизмы, с помощью которых пробиотики могут
положительное воздействие за счет усиления профилактики или
лечение диарейных заболеваний.
1. Введение
Внутри микробиоты индивидуальные
бактерии, содержащие важные гены, могут принести пользу хозяину по-разному. В виде
можно рассматривать огромное сообщество комменсальных микробов, подмножества этих
организмы могут иметь важные физиологические преимущества для хозяина в контексте
питания человека и хозяина: взаимодействия микробов. Пробиотики могут стимулировать
иммунитет, регулируют иммунные сигнальные пути, продуцируют антипатогенные факторы,
или побудить хозяина продуцировать антипатогенные факторы.Пробиотики могут производить
секретируемые факторы, которые стимулируют или подавляют цитокины и клеточно-опосредованные
иммунитет. Эти факторы также могут влиять на ключевые иммунные сигнальные пути.
такие как каскады киназ и MAP. Пробиотики могут продуцировать факторы, которые
подавляют патогены и другие комменсальные бактерии, эффективно позволяя им
микробы, чтобы эффективно конкурировать за питательные вещества в сложных сообществах. Микробы
которые продуцируют антипатогенные факторы, могут представлять собой источники новых классов
противомикробные соединения, и эти факторы могут регулироваться мастером
регуляторные гены в определенных классах бактерий.Микробы также могут регулировать
сигнальные пути в иммунных клетках, которые приводят к выработке
противомикробные факторы клетками млекопитающих, эффективно приводящие к ремоделированию
кишечных сообществ и профилактика или лечение инфекций.
Пробиотики могут стимулировать
иммунитет, регулируют иммунные сигнальные пути, продуцируют антипатогенные факторы,
или побудить хозяина продуцировать антипатогенные факторы.Пробиотики могут производить
секретируемые факторы, которые стимулируют или подавляют цитокины и клеточно-опосредованные
иммунитет. Эти факторы также могут влиять на ключевые иммунные сигнальные пути.
такие как каскады киназ и MAP. Пробиотики могут продуцировать факторы, которые
подавляют патогены и другие комменсальные бактерии, эффективно позволяя им
микробы, чтобы эффективно конкурировать за питательные вещества в сложных сообществах. Микробы
которые продуцируют антипатогенные факторы, могут представлять собой источники новых классов
противомикробные соединения, и эти факторы могут регулироваться мастером
регуляторные гены в определенных классах бактерий.Микробы также могут регулировать
сигнальные пути в иммунных клетках, которые приводят к выработке
противомикробные факторы клетками млекопитающих, эффективно приводящие к ремоделированию
кишечных сообществ и профилактика или лечение инфекций.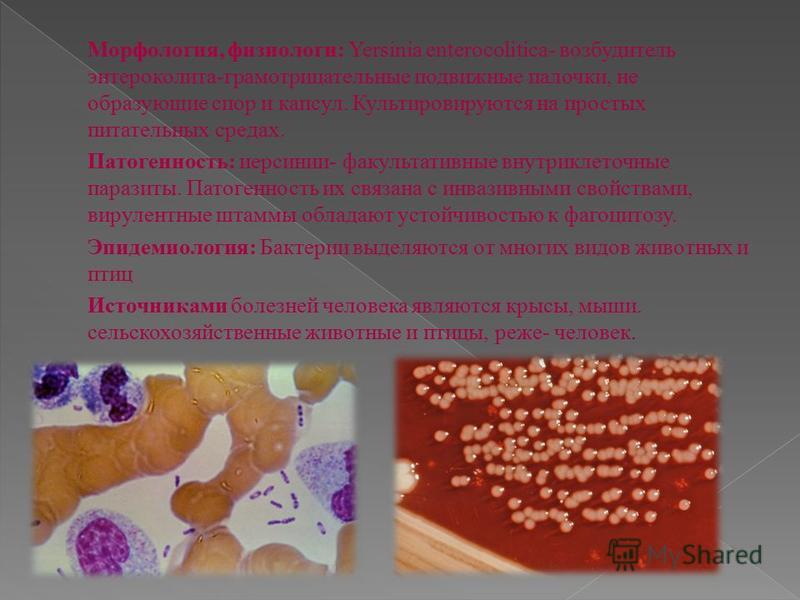
Желудочно-кишечный тракт
инфекции являются основной причиной заболеваемости и смертности во всем мире. Исследования
проведенное в 2006 г., показало, что во всем мире тяжелая диарея и обезвоживание
ежегодно несет ответственность за смерть 1 575 000 детей в возрасте до
пять.Это составляет 15% из 10,5 миллионов смертей детей в год в
эта возрастная группа [1]. Согласно недавним
по оценкам, острый гастроэнтерит вызывает до 770 000 госпитализаций на
год в США [2]. Кишечные возбудители включают:
вирусы (ротавирусы, норовирусы) и бактерии, такие как различные штаммы
патогенный Escherichia coli ,
toxigenic Clostridium difficile , Campylobacter jejuni и Vibrio cholerae .Эти
патогены производят различные типы токсинов, которые могут вызывать тяжелые или
опасное для жизни обезвоживание и диарея. Несмотря на медицинские достижения в
диагностика и лечение, процент и количество госпитализированных педиатрических
пациенты младше 5 лет с тяжелой ротавирусной инфекцией значительно
увеличилась, если сравнивать недавний период времени (2001–2003 гг.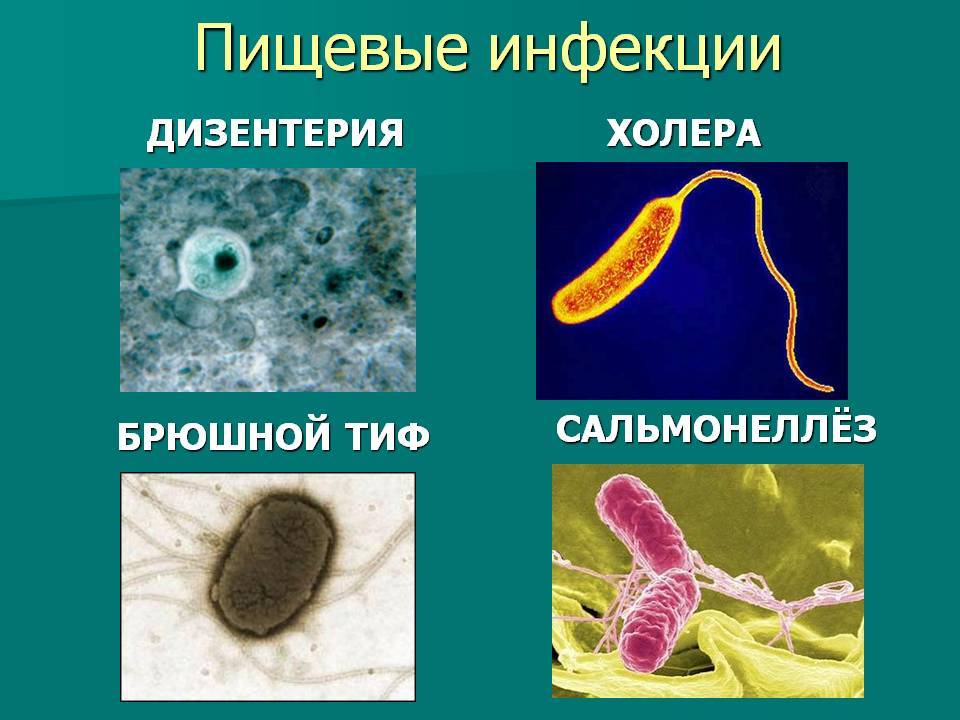 ) с более ранним
период времени (1993–1995) [3]. Помимо типичного
картина острого гастроэнтерита, инфекционные агенты, такие как энтеропатогенные E.coli (EPEC) может вызывать стойкие,
хроническая диарея у детей продолжительностью более 1 недели [4]. Такие стойкие инфекции могут увеличить риск обезвоживания.
и хронические заболевания. Важно отметить, что относительный вклад EPEC и
Другие бактериальные возбудители болезней остаются в некоторой степени спорными. Недавний
исследование показало, что повышенный относительный риск желудочно-кишечных заболеваний у
детей можно было продемонстрировать только на кишечные вирусы [5].
) с более ранним
период времени (1993–1995) [3]. Помимо типичного
картина острого гастроэнтерита, инфекционные агенты, такие как энтеропатогенные E.coli (EPEC) может вызывать стойкие,
хроническая диарея у детей продолжительностью более 1 недели [4]. Такие стойкие инфекции могут увеличить риск обезвоживания.
и хронические заболевания. Важно отметить, что относительный вклад EPEC и
Другие бактериальные возбудители болезней остаются в некоторой степени спорными. Недавний
исследование показало, что повышенный относительный риск желудочно-кишечных заболеваний у
детей можно было продемонстрировать только на кишечные вирусы [5].
Недавние исследования выявили
хронические заболевания, связанные с гастроэнтеритом.Понос в раннем детстве
предрасполагает детей к длительным нарушениям здоровья, включая нарушение физической формы,
задержка роста, нарушение познания и школьной успеваемости [6].
Наряду с этими данными, новое исследование недоедания матери и ребенка
сообщается в The Lancet в январе
2008 связывает плохое питание с повышенным риском кишечных инфекций в
дети.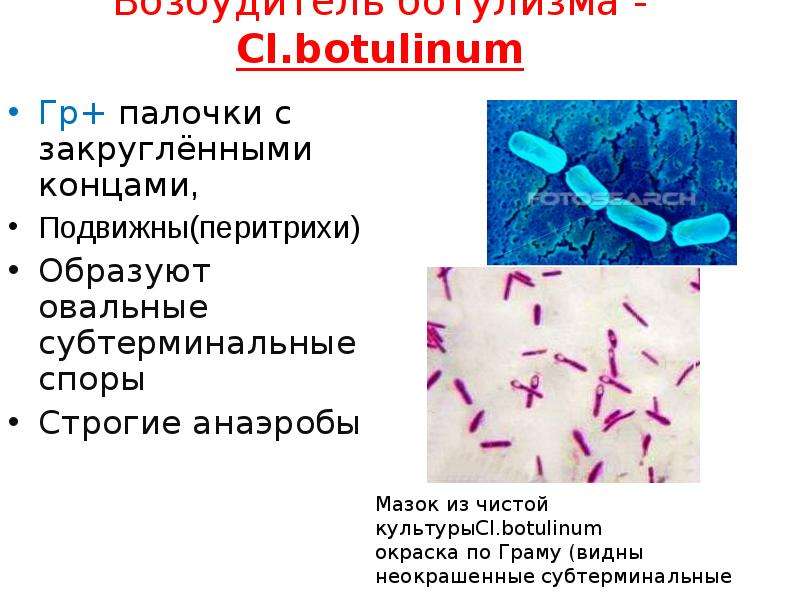 Кроме того, синдром раздраженного кишечника (СРК), дорогостоящий и сложный
для лечения состояния, которым страдает 20% населения США [7], требует медицинских затрат до
30 миллиардов долларов в год, не считая затрат на лекарства, отпускаемые по рецепту и без рецепта [8].СРК вызывается
эпизод острого гастроэнтерита в 30% случаев в предыдущих исследованиях [9]. Следовательно, предотвращение или
лечение острого гастроэнтерита до развития отдаленных последствий
резко сократить количество госпитализаций, количество лет жизни с поправкой на инвалидность и то и другое
прямые и косвенные медицинские расходы.
Кроме того, синдром раздраженного кишечника (СРК), дорогостоящий и сложный
для лечения состояния, которым страдает 20% населения США [7], требует медицинских затрат до
30 миллиардов долларов в год, не считая затрат на лекарства, отпускаемые по рецепту и без рецепта [8].СРК вызывается
эпизод острого гастроэнтерита в 30% случаев в предыдущих исследованиях [9]. Следовательно, предотвращение или
лечение острого гастроэнтерита до развития отдаленных последствий
резко сократить количество госпитализаций, количество лет жизни с поправкой на инвалидность и то и другое
прямые и косвенные медицинские расходы.
Точная диагностика острой
гастроэнтерит — постоянная проблема даже в сложных академических медицинских учреждениях.
центры. В популяции педиатрических пациентов, превышающей 4700 детей, менее
50% образцов стула, которые прошли полную микробиологическую оценку, дали
специфический диагноз [10].Кишечные вирусы представляют собой преобладающие этиологические агенты острого гастроэнтерита. у детей младше 3 лет, и бактерии вызвали большинство случаев
острого гастроэнтерита у детей старше 3 лет [10]. Диагностические проблемы
с энтеросолюбильными вирусами включают относительную нехватку молекулярных или
тесты на вирусный антиген и невозможность легко культивировать большинство кишечных вирусов.
Бактериальные патогены может быть трудно идентифицировать (например, большинство штаммов
болезнетворные E.coli ) из-за отсутствия специальных анализов
для этих инфекций. Относительная нечувствительность анализов на токсины в стуле
для обнаружения токсигенных C.
difficile не позволяет поставить точный диагноз. В условиях детской больницы,
Комбинированный токсин-антиген показал чувствительность ниже 40% в педиатрической практике.
пациенты (J. Versalovic, неопубликованные данные). Внедрение новых молекулярных
анализы для определения генов токсинов непосредственно в стуле с помощью ПЦР в реальном времени
заметно улучшили способность диагностировать диарею, ассоциированную с антимикробными препаратами, и
колит, вызванный токсигенным C.
у детей младше 3 лет, и бактерии вызвали большинство случаев
острого гастроэнтерита у детей старше 3 лет [10]. Диагностические проблемы
с энтеросолюбильными вирусами включают относительную нехватку молекулярных или
тесты на вирусный антиген и невозможность легко культивировать большинство кишечных вирусов.
Бактериальные патогены может быть трудно идентифицировать (например, большинство штаммов
болезнетворные E.coli ) из-за отсутствия специальных анализов
для этих инфекций. Относительная нечувствительность анализов на токсины в стуле
для обнаружения токсигенных C.
difficile не позволяет поставить точный диагноз. В условиях детской больницы,
Комбинированный токсин-антиген показал чувствительность ниже 40% в педиатрической практике.
пациенты (J. Versalovic, неопубликованные данные). Внедрение новых молекулярных
анализы для определения генов токсинов непосредственно в стуле с помощью ПЦР в реальном времени
заметно улучшили способность диагностировать диарею, ассоциированную с антимикробными препаратами, и
колит, вызванный токсигенным C. difficile [11]. Кроме того,
примерно 15–25% случаев диареи, связанной с антимикробными препаратами, вызваны
Автор: C. difficile . Распространенность
диарея, связанная с антимикробными препаратами, и желудочно-кишечные заболевания подчеркивают
важность альтернатив стратегии лечения антибиотиками. Более того,
антибиотики имеют ограниченное применение для лечения гастроэнтерита у
Общее. Противомикробные препараты обычно не рекомендуются в качестве профилактики.
стратегии из-за проблем устойчивости к антибиотикам и
антимикробное заболевание.Таким образом, вместо подавления бактериального
популяций, принимающих антибиотики, можно ли использовать пробиотики для ремоделирования или изменения микробной
сообщества к здоровому состоянию [12]?
difficile [11]. Кроме того,
примерно 15–25% случаев диареи, связанной с антимикробными препаратами, вызваны
Автор: C. difficile . Распространенность
диарея, связанная с антимикробными препаратами, и желудочно-кишечные заболевания подчеркивают
важность альтернатив стратегии лечения антибиотиками. Более того,
антибиотики имеют ограниченное применение для лечения гастроэнтерита у
Общее. Противомикробные препараты обычно не рекомендуются в качестве профилактики.
стратегии из-за проблем устойчивости к антибиотикам и
антимикробное заболевание.Таким образом, вместо подавления бактериального
популяций, принимающих антибиотики, можно ли использовать пробиотики для ремоделирования или изменения микробной
сообщества к здоровому состоянию [12]?
2. Пробиотики
2.1. Необходимость в механических деталях действия пробиотиков
Использование
пробиотиков для профилактики и лечения широкого спектра заболеваний.
пользу в последнее десятилетие. Отчасти это связано с необходимостью поиска альтернатив
традиционные методы лечения, такие как антибиотики, а также отсутствие хороших
лечение заболеваний желудочно-кишечного тракта. Хотя есть все больше сообщений об эффективности
пробиотиков при лечении таких заболеваний, как поучит [13, 14],
диарея [15–17],
и синдром раздраженного кишечника [18], научная основа для
использование пробиотиков только начинает изучаться. Мы сосредоточимся на
потенциальные применения пробиотиков в лечении диарейных заболеваний. Несколько
примеры покажут, как пробиотики могут быть выбраны и использованы против
возбудители гастроэнтерита.
Хотя есть все больше сообщений об эффективности
пробиотиков при лечении таких заболеваний, как поучит [13, 14],
диарея [15–17],
и синдром раздраженного кишечника [18], научная основа для
использование пробиотиков только начинает изучаться. Мы сосредоточимся на
потенциальные применения пробиотиков в лечении диарейных заболеваний. Несколько
примеры покажут, как пробиотики могут быть выбраны и использованы против
возбудители гастроэнтерита.
Концепция использования пробиотиков
микроорганизмов для профилактики и лечения различных заболеваний человека.
более 100 лет [19].
С ростом числа патогенов с множественной лекарственной устойчивостью и
признание роли микробиоты человека в здоровье и болезнях,
В последнее время наблюдается рост интереса к пробиотикам. Этот
Этот феномен проявляется в количестве пробиотических продуктов, продаваемых на рынке.
потребителям, а также увеличение количества проводимых научных исследований
в пробиотиках.Хотя многие механизмы, благодаря которым пробиотики приносят пользу,
человеческие существа остаются неясными, пробиотические бактерии используются больше
обычно для лечения конкретных заболеваний.
Несколько определений того, что составляет «пробиотик» в литературе. Для этого обзора, мы используем определение, полученное в 2001 г. Организация (ФАО) и Всемирная организация здравоохранения (ВОЗ) — «Пробиотики живые микроорганизмы, которые при введении в достаточном количестве приносят здоровье выгода для хозяина.»[20]. Это определение в настоящее время принято Международным Научная ассоциация пробиотиков и пребиотиков (ISAPP) (http://www.isapp.net/).
2.2. Антипатогенная активность
Возможно
самый важный научный вопрос относительно использования пробиотиков в
медицина — это определение механизмов воздействия пробиотиков на человека.
здоровье. Было задействовано несколько механизмов, но большинство из них не были задействованы.
экспериментально доказано (рисунок 1).Здесь мы обсуждаем возможные механизмы, которые
актуален для лечения диарейных заболеваний. Выделим исследования
примеры, которые поддерживают эти предполагаемые механизмы, когда это возможно.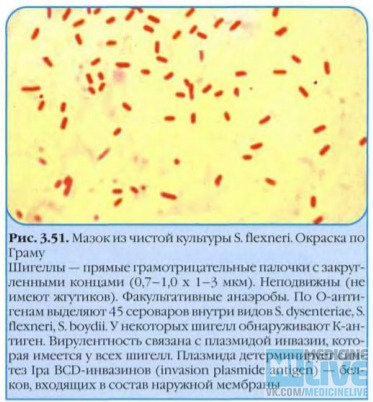
2.3. Стимуляция противомикробной защиты хозяина
Было показано, что многие пробиотики производят антипатогенные соединения от небольших молекул до биоактивных антимикробные пептиды. Большинство этих исследований были сосредоточены на in vitro восприимчивость патогенов к продуктам, выделяемым пробиотическими бактериями.В большинстве случаях способность противомикробного соединения, секретируемого пробиотиком Организм для подавления роста патогена in vivo не было продемонстрировано. По идее, противомикробное соединение, вырабатываемое организмом, должно быть производиться на достаточно высоком уровне и в нужном месте в кишечнике тракт, чтобы оказать сильное действие на возбудителя in vivo.
Элегантное доказательство принципа
прямое действие противомикробного препарата, продуцируемого пробиотиками, против патогена было
недавно сообщил Corr et al.кто продемонстрировал, что производство бактериоцина
Abp118 по Lactobacillus salivarius был
Достаточно для защиты мышей от болезней, вызванных инфицированием Listeria monocytogenes [21]. Чтобы доказать, что действие бактериоцина непосредственно отвечает за
защиты мышей, они создали L.
salivarius , который был неспособен продуцировать Abp118, и показал, что этот
мутант был неспособен защитить от L.
monocytogenes инфекция.Примечательно, что они смогли экспрессировать ген, который
придает иммунитет к бактериоцину Abp118 в пределах L. monocytogenes и показал, что этот штамм теперь устойчив к
пробиотический эффект L. salivarius в пределах
мышь. Это исследование предоставило четкие доказательства того, что производные пробиотиков
бактериоцин может действовать непосредственно на патогене in vivo.
Чтобы доказать, что действие бактериоцина непосредственно отвечает за
защиты мышей, они создали L.
salivarius , который был неспособен продуцировать Abp118, и показал, что этот
мутант был неспособен защитить от L.
monocytogenes инфекция.Примечательно, что они смогли экспрессировать ген, который
придает иммунитет к бактериоцину Abp118 в пределах L. monocytogenes и показал, что этот штамм теперь устойчив к
пробиотический эффект L. salivarius в пределах
мышь. Это исследование предоставило четкие доказательства того, что производные пробиотиков
бактериоцин может действовать непосредственно на патогене in vivo.
2.4. Исключение патогенов с помощью непрямых механизмов
В дополнение к
производство антимикробных соединений, которые действуют непосредственно на патогены, пробиотики
может стимулировать пути антимикробной защиты хозяина.Кишечный тракт имеет
ряд механизмов противодействия воздействию патогенов, включая
производство дефенсинов [22]. Дефенсины — это катионные антимикробные пептиды, которые производятся в ряде
типы клеток, включая клетки Панета в криптах тонкой кишки и
кишечные эпителиальные клетки. Был отмечен дефицит продукции альфа-дефенсина.
коррелирует с болезнью Крона подвздошной кишки [23, 24]. Ткань
образцы от пациентов с болезнью Крона показали более низкий уровень
продукция альфа-дефенсина и экстракты из этих образцов показали снижение
способность подавлять рост бактерий in vitro.Более того, некоторые патогенные
бактерии разработали механизмы, препятствующие производству или механизму
действие дефензинов (см. обзор [25]).
Дефенсины — это катионные антимикробные пептиды, которые производятся в ряде
типы клеток, включая клетки Панета в криптах тонкой кишки и
кишечные эпителиальные клетки. Был отмечен дефицит продукции альфа-дефенсина.
коррелирует с болезнью Крона подвздошной кишки [23, 24]. Ткань
образцы от пациентов с болезнью Крона показали более низкий уровень
продукция альфа-дефенсина и экстракты из этих образцов показали снижение
способность подавлять рост бактерий in vitro.Более того, некоторые патогенные
бактерии разработали механизмы, препятствующие производству или механизму
действие дефензинов (см. обзор [25]).
Пробиотики могут стимулировать
активность дефенсина, по крайней мере, через два механизма. Во-первых, пробиотики могут стимулировать
синтез экспрессии дефенсина. Это было продемонстрировано на примере бета-тестирования человека.
дефенсин 2 (hBD-2), экспрессия которого повышается за счет присутствия нескольких
пробиотические бактерии через фактор транскрипции [26, 27]. В
подразумевается, что пробиотические штаммы с этой способностью могут усилить
защита кишечника за счет повышения уровня дефенсина. Этот эффект также наблюдается
с некоторыми патогенными бактериями и, следовательно, не является специфическим свойством
пробиотические бактерии. Во-вторых, многие дефенсины производятся в форме пропептида.
которые должны активироваться под действием протеаз. Один хорошо охарактеризованный пример
активация мышиного дефенсина криптдина (альфа-дефенсина,
продуцируется клетками Панета) под действием матриксной металлопротеиназы 7 (ММП-7) [28].мышей
дефектные по MMP-7, более восприимчивы к уничтожению Salmonella . Имеющиеся данные указывают на то, что бактерии могут стимулировать
продукция ММП-7 в кишечнике [29]. Таким образом,
одним из механизмов, в котором пробиотики могут участвовать в активации дефенсинов, является
за счет стимуляции выработки ММП в кишечном тракте. В качестве альтернативы,
пробиотики могут продуцировать протеазы, которые сами активируют дефенсины в
просвет кишечника.
В
подразумевается, что пробиотические штаммы с этой способностью могут усилить
защита кишечника за счет повышения уровня дефенсина. Этот эффект также наблюдается
с некоторыми патогенными бактериями и, следовательно, не является специфическим свойством
пробиотические бактерии. Во-вторых, многие дефенсины производятся в форме пропептида.
которые должны активироваться под действием протеаз. Один хорошо охарактеризованный пример
активация мышиного дефенсина криптдина (альфа-дефенсина,
продуцируется клетками Панета) под действием матриксной металлопротеиназы 7 (ММП-7) [28].мышей
дефектные по MMP-7, более восприимчивы к уничтожению Salmonella . Имеющиеся данные указывают на то, что бактерии могут стимулировать
продукция ММП-7 в кишечнике [29]. Таким образом,
одним из механизмов, в котором пробиотики могут участвовать в активации дефенсинов, является
за счет стимуляции выработки ММП в кишечном тракте. В качестве альтернативы,
пробиотики могут продуцировать протеазы, которые сами активируют дефенсины в
просвет кишечника.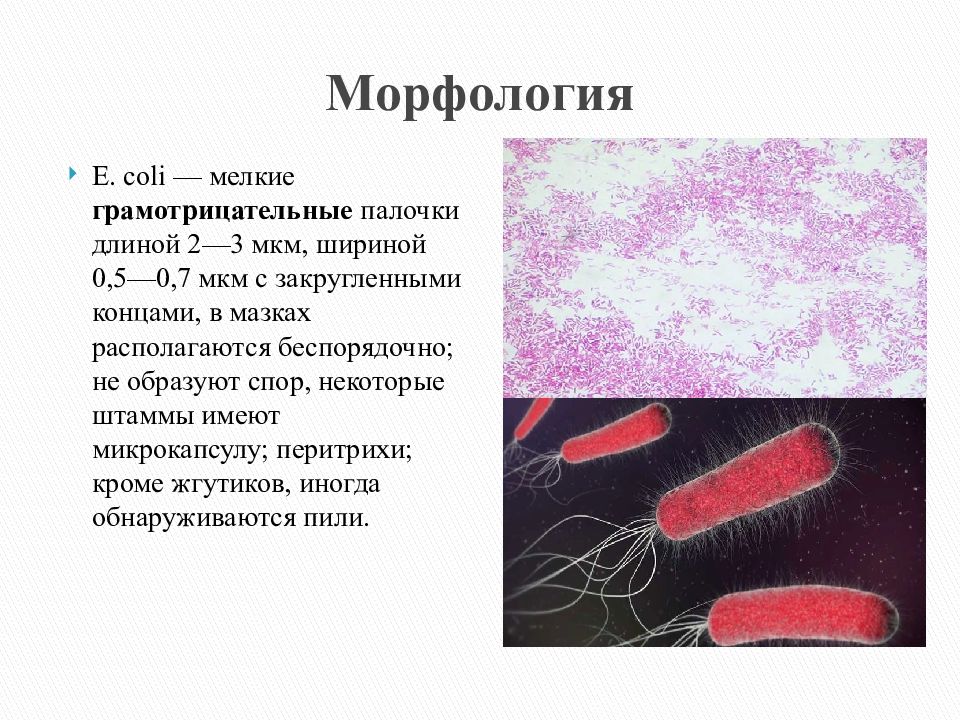 Хотя пока нет доказательств в поддержку этого механизма,
подмножество лактобацилл и стрептококков кодируют MMP-подобные белки в своих
геномы (R.Бриттон, неопубликованное наблюдение). Эти MMP не встречаются ни в одном
другие бактерии, и поэтому будет интересно определить, какое влияние они
влияют на функцию клетки-хозяина.
Хотя пока нет доказательств в поддержку этого механизма,
подмножество лактобацилл и стрептококков кодируют MMP-подобные белки в своих
геномы (R.Бриттон, неопубликованное наблюдение). Эти MMP не встречаются ни в одном
другие бактерии, и поэтому будет интересно определить, какое влияние они
влияют на функцию клетки-хозяина.
2,5. Иммуномодуляция
Вместо прямого подавления роста или
жизнеспособность патогена, пробиотики могут конкурировать за экологическую нишу или,
в противном случае создать условия, неблагоприятные для распространения возбудителя.
в кишечном тракте. Есть много возможных механизмов того, как возбудитель
исключение может иметь место.Во-первых, было продемонстрировано, что несколько пробиотиков
изменить способность патогенов прилипать к эпителиальным клеткам толстой кишки или вторгаться в них
in vitro, например, см. [30, 31]. Во-вторых, пробиотики могут изолировать жизненно важные
питательные вещества от вторгшихся патогенов и ухудшают их способность к колонизации.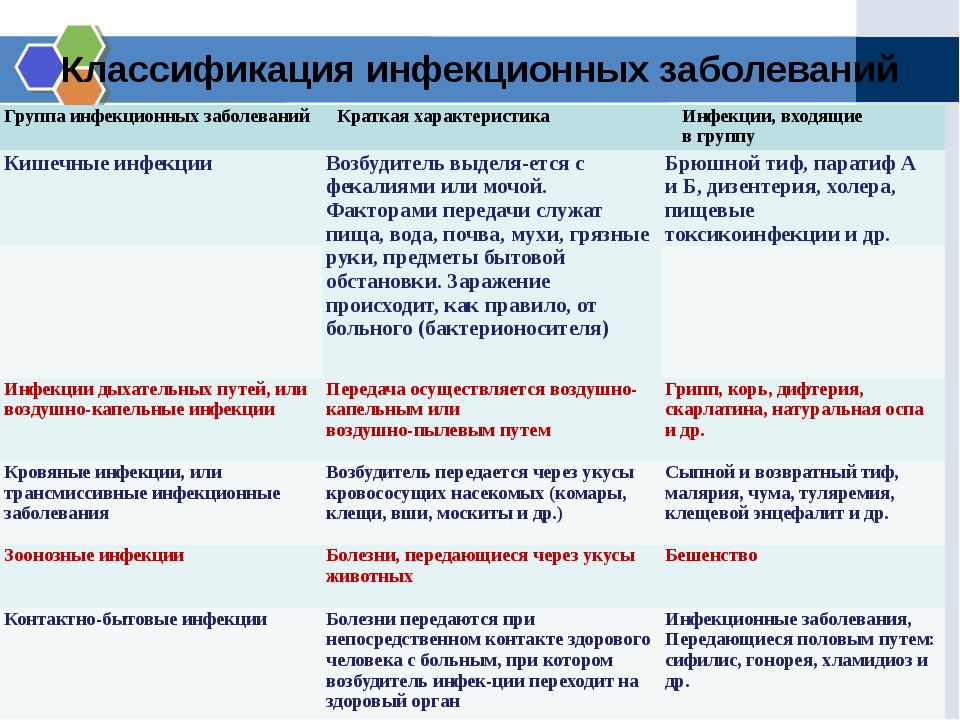 Третий,
пробиотики могут изменять программу экспрессии генов патогенов таким образом, как
для подавления выражения функций вирулентности [32].
Наконец, пробиотики могут создать неблагоприятную среду для патогена.
колонизация путем изменения pH, слоя слизи и других факторов в локальном
окружение.Важно отметить, что хотя многие из этих возможных
эффекты были продемонстрированы в
vitro способность пробиотиков исключать патогены in vivo остается
быть доказанным.
Третий,
пробиотики могут изменять программу экспрессии генов патогенов таким образом, как
для подавления выражения функций вирулентности [32].
Наконец, пробиотики могут создать неблагоприятную среду для патогена.
колонизация путем изменения pH, слоя слизи и других факторов в локальном
окружение.Важно отметить, что хотя многие из этих возможных
эффекты были продемонстрированы в
vitro способность пробиотиков исключать патогены in vivo остается
быть доказанным.
2.6. Повышение барьерной функции кишечника
Пробиотики могут оказывать штамм-зависимое действие на иммунную систему. Разные
штаммы, представляющие различные виды Lactobacillus , продемонстрировали противоположные эффекты в отношении провоспалительного
продукция цитокинов дендритными клетками костного мозга мышей [33].Определенные штаммы пробиотиков нейтрализовали иммуностимулирующее действие других
штаммы, так что пробиотики могут давать аддитивные или антагонистические
Результаты. Интересно, что в этом исследовании противовоспалительный цитокин IL-10 был
сохраняется на аналогичных уровнях [31]. Различные штаммы пробиотиков Lactobacillus одного и того же вида могут также давать противоположные эффекты по отношению к
иммуномодуляция. Lactobacillus, происходящие из грудного молока человека
reuteri либо стимулировали ключевой провоспалительный цитокин человека
фактор некроза опухоли (TNF) или подавляет его производство миелоидом человека
клетки [34].Неудивительно, что механизмы действия могут быть связаны с противоположными эффектами.
о ключевых сигнальных путях в клетках млекопитающих. Штаммы пробиотиков, такие как Lactobacillus rhamnosus GG (LGG), могут
активировать и преобразователь сигнала, и активатор транскрипции (STAT)
сигнальные пути в макрофагах человека [35]. В
Напротив, пробиотические штаммы Lactobacillus могут подавлять
передача сигналов [36, 37] или передача сигналов, опосредованная MAP-киназой / c-Jun [34].
Стимуляция ключевых сигнальных путей и усиление провоспалительного
выработка цитокинов может иметь важное значение для «подготовки» иммунной системы к защите
против желудочно-кишечных инфекций.
Различные штаммы пробиотиков Lactobacillus одного и того же вида могут также давать противоположные эффекты по отношению к
иммуномодуляция. Lactobacillus, происходящие из грудного молока человека
reuteri либо стимулировали ключевой провоспалительный цитокин человека
фактор некроза опухоли (TNF) или подавляет его производство миелоидом человека
клетки [34].Неудивительно, что механизмы действия могут быть связаны с противоположными эффектами.
о ключевых сигнальных путях в клетках млекопитающих. Штаммы пробиотиков, такие как Lactobacillus rhamnosus GG (LGG), могут
активировать и преобразователь сигнала, и активатор транскрипции (STAT)
сигнальные пути в макрофагах человека [35]. В
Напротив, пробиотические штаммы Lactobacillus могут подавлять
передача сигналов [36, 37] или передача сигналов, опосредованная MAP-киназой / c-Jun [34].
Стимуляция ключевых сигнальных путей и усиление провоспалительного
выработка цитокинов может иметь важное значение для «подготовки» иммунной системы к защите
против желудочно-кишечных инфекций. И наоборот, подавление иммунной
передача сигналов может быть важным механизмом, способствующим гомеостазу и толерантности к
микробные сообщества со многими потенциальными антигенами, и эти иммуносупрессивные
функции могут способствовать заживлению или разрешению инфекций.
И наоборот, подавление иммунной
передача сигналов может быть важным механизмом, способствующим гомеостазу и толерантности к
микробные сообщества со многими потенциальными антигенами, и эти иммуносупрессивные
функции могут способствовать заживлению или разрешению инфекций.
2.7. Почему важно понимание механизмов?
Нарушение
функция эпителиального барьера и потеря образования плотных стыков в
кишечный эпителий может способствовать патофизиологии и развитию диарейных симптомов
наблюдается при заражении определенными возбудителями [38, 39].Утрата
плотные соединения могут привести к увеличению межклеточного транспорта, что может привести к
потеря жидкости и проникновение патогенов в подслизистую основу. Патогены могут выделять
факторы, такие как энтеротоксины, которые могут способствовать чрезмерному апоптозу или некрозу
эпителиальных клеток кишечника, тем самым нарушая кишечный барьер.
Кишечные патогены также могут вызывать размывающие поражения на поверхности слизистой оболочки из-за:
прямая адгезия с эпителиальными клетками кишечника (например, EPEC). В отличие,
Сообщалось, что пробиотики способствуют образованию плотных стыков и
барьерная функция кишечника [40, 41].Несмотря на то что
механизмы обеспечения целостности барьера не совсем понятны,
пробиотики могут противодействовать разрушению кишечного эпителиального барьера
несмотря на наличие болезнетворных микроорганизмов. Пробиотики также могут подавлять токсины.
производство или вмешательство в способность определенных патогенов прилипать
непосредственно на поверхность кишечника. В результате патогены могут иметь
снижение способности нарушать барьерную функцию кишечника.
В отличие,
Сообщалось, что пробиотики способствуют образованию плотных стыков и
барьерная функция кишечника [40, 41].Несмотря на то что
механизмы обеспечения целостности барьера не совсем понятны,
пробиотики могут противодействовать разрушению кишечного эпителиального барьера
несмотря на наличие болезнетворных микроорганизмов. Пробиотики также могут подавлять токсины.
производство или вмешательство в способность определенных патогенов прилипать
непосредственно на поверхность кишечника. В результате патогены могут иметь
снижение способности нарушать барьерную функцию кишечника.
2,8. Важные соображения по использованию пробиотиков: выбор штамма и физиология микробов
Важный
проблемой в области пробиотиков является идентификация генов и
механизмы, ответственные за полезные функции, выполняемые этими микробами.Успешное выявление механистических деталей функционирования пробиотиков
будет иметь как минимум три важных преимущества. Во-первых, понимание механизмов
действие обеспечит научную основу для положительных эффектов, обеспечиваемых
специфические микробы.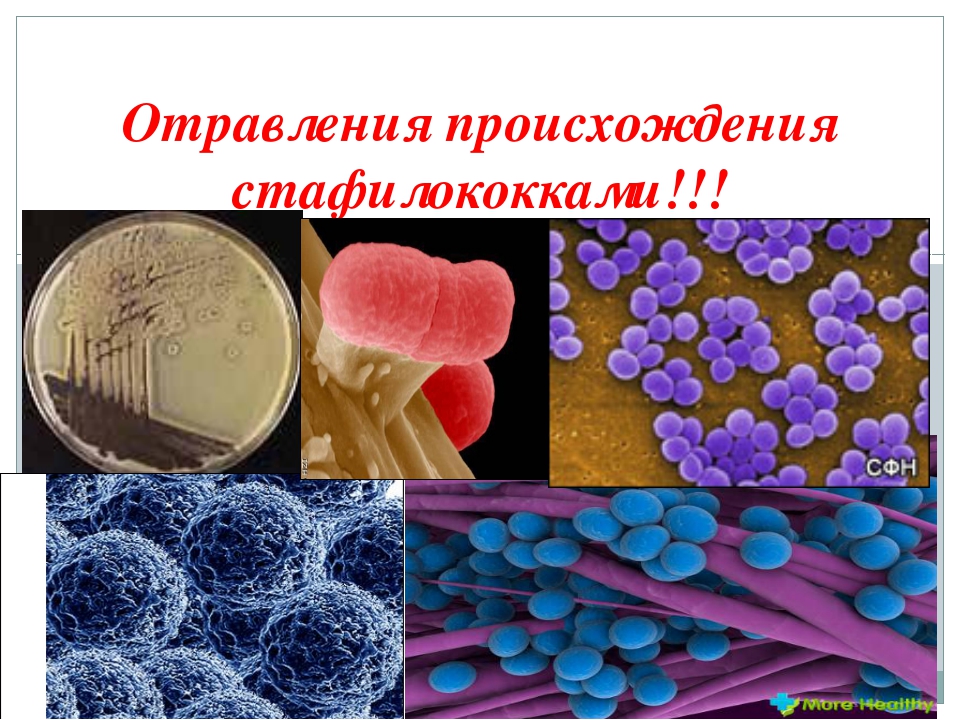 Эти революционные исследования помогут продвинуть пробиотики
от статуса диетических добавок к терапевтическим средствам. Во-вторых, понимание
механизмы пробиоза и генные продукты, продуцируемые пробиотиками, позволят
для выявления более сильнодействующих пробиотиков или развития
биоинженерная терапия.Например, противовоспалительный цитокин IL-10
был постулирован как потенциальное терапевтическое средство для лечения воспалительного
заболевание кишечника. Чтобы проверить эту гипотезу, был разработан штамм Lactococcus lactis , сконструированный для производства и секреции IL-10.
сконструированы и продемонстрированы для уменьшения колита на мышиной модели [42].
Ранние клинические испытания у пациентов с воспалительными заболеваниями кишечника указывают на некоторые
облегчение симптомов при лечении штаммом, чрезмерно продуцирующим ИЛ-10.Третий,
идентификация продуктов генов, ответственных за улучшение
болезнь позволит исследователям, промышленности и клиницистам следить за производством
этих продуктов в качестве важных биомаркеров при приготовлении пробиотиков.
Эти революционные исследования помогут продвинуть пробиотики
от статуса диетических добавок к терапевтическим средствам. Во-вторых, понимание
механизмы пробиоза и генные продукты, продуцируемые пробиотиками, позволят
для выявления более сильнодействующих пробиотиков или развития
биоинженерная терапия.Например, противовоспалительный цитокин IL-10
был постулирован как потенциальное терапевтическое средство для лечения воспалительного
заболевание кишечника. Чтобы проверить эту гипотезу, был разработан штамм Lactococcus lactis , сконструированный для производства и секреции IL-10.
сконструированы и продемонстрированы для уменьшения колита на мышиной модели [42].
Ранние клинические испытания у пациентов с воспалительными заболеваниями кишечника указывают на некоторые
облегчение симптомов при лечении штаммом, чрезмерно продуцирующим ИЛ-10.Третий,
идентификация продуктов генов, ответственных за улучшение
болезнь позволит исследователям, промышленности и клиницистам следить за производством
этих продуктов в качестве важных биомаркеров при приготовлении пробиотиков. В виде
обсуждается ниже, физиологическое состояние микробов может иметь решающее значение для
функции пробиотиков. Таким образом, будет важно иметь возможность следить за
производство важных биоактивных молекул при культивировании и переработке
пробиотики для животных и людей.
В виде
обсуждается ниже, физиологическое состояние микробов может иметь решающее значение для
функции пробиотиков. Таким образом, будет важно иметь возможность следить за
производство важных биоактивных молекул при культивировании и переработке
пробиотики для животных и людей.
2.9. Пробиотики и диарея
Пробиотики
считаются живыми или жизнеспособными микроорганизмами по определению. в отличие
небольшие молекулы, которые являются стабильными объектами, пробиотики — это динамические микроорганизмы
и изменит паттерны экспрессии генов при воздействии различных
условия окружающей среды. Эта реальность имеет два важных значения для тех, кто
которые решили использовать эти организмы для борьбы с болезнями человека или животных. Первый,
пробиоз — это специфическое для штамма явление.Поскольку определение вида бактерий
сложная задача в наш век полного секвенирования генома, ясно, что пробиотики
эффекты, наблюдаемые in vitro и in vivo,
штамм специфический. Например, модуляция продукции TNF штаммами Lactobacillus reuteri идентифицированных штаммов
которые были иммуностимулирующими, иммунонейтральными и иммуносупрессивными в отношении TNF
производство [34, 43].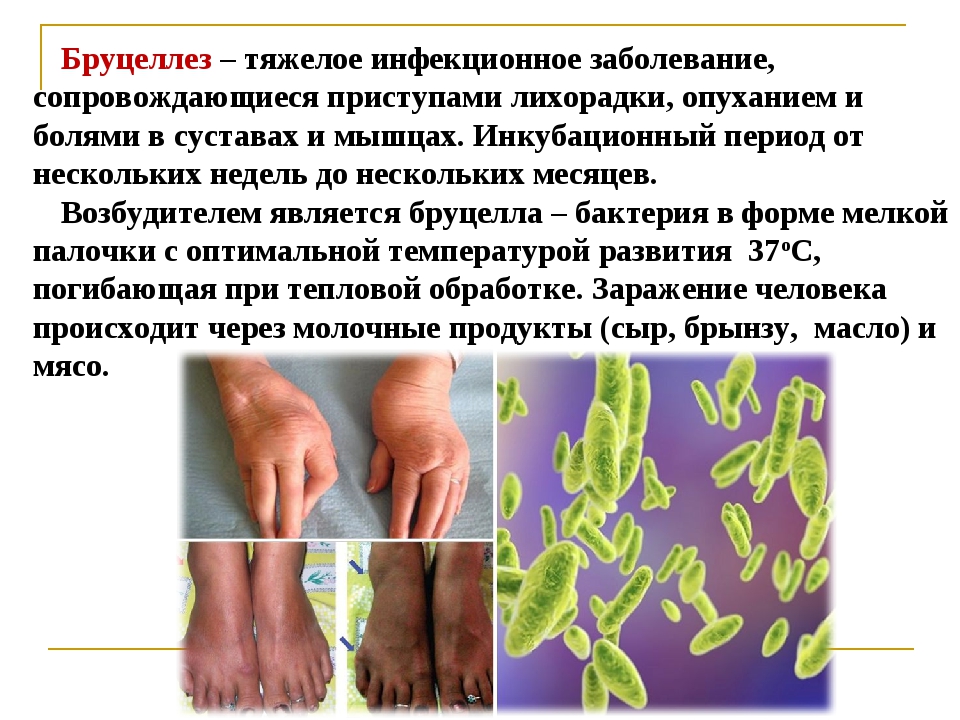 Эти результаты подчеркивают штаммоспецифический характер пробиотических эффектов.
вызвано бактериями.Таким образом, для исследовательских групп и промышленности важно
будьте осторожны с обработкой и отслеживанием деформации, чтобы включить правильные
штаммы проверяются до введения в клинических испытаниях.
Эти результаты подчеркивают штаммоспецифический характер пробиотических эффектов.
вызвано бактериями.Таким образом, для исследовательских групп и промышленности важно
будьте осторожны с обработкой и отслеживанием деформации, чтобы включить правильные
штаммы проверяются до введения в клинических испытаниях.
Второй ключевой момент заключается в том, что
физиология пробиотического штамма является важным фактором. Быть живым
микроорганизмы, белки и вторичные метаболиты, которые производятся
будет меняться в зависимости от фазы роста. Эта функция вызывает ряд
важные вопросы для стабильности и эффективности пробиотических штаммов.Первый,
пробиотики подвергаются многочисленным воздействиям окружающей среды во время производства
и после проглатывания хозяином. В частности, пробиотики, используемые для лечения
кишечные заболевания или механизм действия которых, как предполагается, проявляется в
Кишечный тракт должен выдерживать как кислотный, так и желчный стресс во время
транзитом через кишечник. Физиологическое состояние микроба является важным
характеристика, которая определяет, будут ли клетки восприимчивы к разным
типы экологического стресса [44, 45].За
Например, экспоненциально растущие клетки л.
reuteri гораздо более восприимчивы к уничтожению желчными солями, чем клетки в
стационарная фаза [45].
Таким образом, важно рассматривать физиологическое состояние клеток с точки зрения
адаптации к стрессу не только для выживания в хозяине, но и во время
производство. Во-вторых, экспрессия биоактивных молекул, которые чаще всего
ответственный за пользу для здоровья, оказываемую пробиотиками, часто зависит от фазы роста.Например, наши группы исследовали производство
иммуномодулирующие соединения и противомикробные средства штаммами L. reuteri . В обоих случаях эти
соединения более выражены при входе и во время стационарного
фаза (неопубликованное наблюдение).
Физиологическое состояние микроба является важным
характеристика, которая определяет, будут ли клетки восприимчивы к разным
типы экологического стресса [44, 45].За
Например, экспоненциально растущие клетки л.
reuteri гораздо более восприимчивы к уничтожению желчными солями, чем клетки в
стационарная фаза [45].
Таким образом, важно рассматривать физиологическое состояние клеток с точки зрения
адаптации к стрессу не только для выживания в хозяине, но и во время
производство. Во-вторых, экспрессия биоактивных молекул, которые чаще всего
ответственный за пользу для здоровья, оказываемую пробиотиками, часто зависит от фазы роста.Например, наши группы исследовали производство
иммуномодулирующие соединения и противомикробные средства штаммами L. reuteri . В обоих случаях эти
соединения более выражены при входе и во время стационарного
фаза (неопубликованное наблюдение).
3. Пробиотики, профилактика и лечение гастроэнтерита — примеры
Пробиотик, полученный из комменсала
бактерии используются для лечения целого ряда заболеваний пищеварительной системы,
в том числе колит, связанный с антибиотиками, Helicobacter
pylori гастрит и диарея путешественника [46]. Составы пробиотиков могут включать отдельные штаммы или комбинации
штаммы. L. reuteri происходит из
желудочно-кишечного тракта человека, широко присутствует у млекопитающих и никогда не был
показано, что вызывает заболевание. В
испытания на людях, обработка пробиотиками L.
reuteri у маленьких детей с ротавирусным гастроэнтеритом уменьшил
продолжительность заболевания и способствовала выздоровлению пациента [15, 16], в то время как в другом исследовании это предотвращало
диарея у младенцев [17].Несмотря на многообещающие данные клинических испытаний, первичный молекулярный
Механизмы, лежащие в основе антипатогенных свойств L. reuteri , остаются неизвестными.
Составы пробиотиков могут включать отдельные штаммы или комбинации
штаммы. L. reuteri происходит из
желудочно-кишечного тракта человека, широко присутствует у млекопитающих и никогда не был
показано, что вызывает заболевание. В
испытания на людях, обработка пробиотиками L.
reuteri у маленьких детей с ротавирусным гастроэнтеритом уменьшил
продолжительность заболевания и способствовала выздоровлению пациента [15, 16], в то время как в другом исследовании это предотвращало
диарея у младенцев [17].Несмотря на многообещающие данные клинических испытаний, первичный молекулярный
Механизмы, лежащие в основе антипатогенных свойств L. reuteri , остаются неизвестными.
Пробиотики могут быть эффективны при профилактика или лечение инфекционного гастроэнтерита. В контексте профилактика заболеваний, несколько исследований с различными пробиотическими штаммами документально подтверждено, что эти бактерии могут снизить частоту возникновения острой диареи на 15–75%. в зависимости от исследования [17, 47–50].Несмотря на то что относительное влияние на заболеваемость варьируется в зависимости от конкретных пробиотический штамм и популяция пациентов, стабильная польза от болезни профилактика была продемонстрирована в многочисленных клинических исследованиях. В одной болезни профилактическое исследование [49], добавление Bifidobacterium lactis значительно снизил заболеваемость острой диареей и ротавирусом. линька у младенцев. Исследования, в которых изучалась потенциальная польза пробиотиков для: предотвращение диареи, связанной с антимикробными препаратами, дало неоднозначные результаты [51–54].Один профилактическое исследование сообщило о снижении числа случаев заболевания, связанного с антимикробными препаратами. диарея у младенцев на 48% [52].
Пробиотики также могут быть включены в схемы лечения инфекционного гастроэнтерита. Несколько метаанализов многочисленные клинические испытания с различными пробиотиками документально подтвердили снижение Течение гастроэнтерита составляло от 17 до 30 часов [49, 50, 55]. Обследован с другой стороны, метаанализ пробиотиков, используемых в клинических испытаниях при гастроэнтерите отмечено значительное снижение частоты продолжительной диареи. более 3 дней (длительный понос).Частота продолжительной диареи уменьшилось на 30% или 60%, соответственно, в зависимости от исследования [50, 56] (резюмировано в [55]). Пробиотический агент LGG внес свой вклад к значительному сокращению ротавирусной диареи к 3 дням лечения, когда назначают детям в составе пероральной регидратационной терапии [57]. Кокрановские сборники последних данных большой серии испытаний пробиотиков. База данных систематических обзоров (http://www.cochrane.org/) дала многообещающие выводы.По состоянию на 2008 г. пробиотики оказались эффективными для предотвращения острого гастроэнтерита у детям и может сократить продолжительность острого заболевания. Кроме того, пробиотики перспективные средства для профилактики и лечения диареи, связанной с антимикробными препаратами, хотя анализы намерения лечить не продемонстрировали положительных результатов.
3.1.
Clostridium difficile и диарея, связанная с антибиотикамиВ дальнейшем мы выделить некоторые возможные механизмы, с помощью которых пробиотики могут использоваться для улучшить гастроэнтерит.Поскольку ряд инфекционных агентов вызывают диарея, колит и гастроэнтерит, мы остановимся только на нескольких примерах с идеей, что многие из обсуждаемых механизмов могут быть распространены на другие бактериальные или вирусные причины диареи.
3.1.1. Возможная роль пробиотиков в лечении CDAD
An приблизительно 500 000–3 000 000 случаев Clostridium difficile- ассоциированная диарея (CDAD) возникает ежегодно с сопутствующим здоровьем затраты на уход превышают 1 миллиард долларов в год [58–60].CDAD возникает в основном у пациентов, перенесших антибактериальная терапия в медицинских учреждениях, что указывает на изменения в кишечная микробиота важна для инициации CDAD. В небольшом, но при увеличении числа случаев возникнут более серьезные осложнения, в том числе: псевдомембранозный колит и токсический мегаколон. Более того, появление метронидазол-резистентных штаммы C. difficile имеют снижает эффективность метронидазола, ванкомицина и Цецит, вызванный метронидазолом, усиливает потребность в новых методах лечения лечение и профилактика CDAD [61, 62].
Примерно У 10–40% пациентов, получавших лечение от начального приступа CDAD, наблюдается рецидив заболевание, часто с множественными эпизодами [63]. Такие рецидивы часто невосприимчивы к существующим терапии, включая терапию антибиотиками. Пациенты с рецидивирующим CDAD имели заметное уменьшение разнообразия организмов в их фекальной микробиоте, в то время как пациенты, у которых не было рецидива заболевания, имели нормальную микробиоту [64]. Таким образом, методы лечения, восстанавливающие нормальную микробиоту или подавить C.difficile рост, в то время как возможность повторного заселения кишечника благоприятной микробиотой может быть важно для лечения инфекций и поддержания здоровья кишечника.
3.1.2. Ликвидация
C. difficile посредством производства противомикробных соединенийПробиотические организмы использовались для лечения рецидивирующих C. difficile в прошлом и в некоторых случаях. случаи показали умеренный эффект в облегчении рецидивов заболевания [63]. Это приложение было несколько спорным и на на этот раз не рекомендуется использовать пробиотики для облегчения CDAD [65].Однако протестированные организмы специально не изолированы для лечения CDAD и, следовательно, не могли быть соответствующие штаммы, которые следует использовать для предотвращения рецидива CDAD. В дальнейшем мы обрисовать потенциальные механизмы, в которых тщательно отобранные или спроектированные пробиотики могут быть использованы для лечения C. difficile и искоренения этого патогена.
3.1.3. Конкурентное исключение
C. difficile с использованием пробиотиковCDAD в настоящее время лечится с помощью противомикробных средств, эффективных против C.difficile , чаще всего ванкомицин или метранидазол. Потому что эти лекарства являются антибиотиками широкого спектра действия, они, вероятно, играют роль в рецидивирующих болезнь, подавляя нормальную микробиоту кишечника. Использование противомикробного соединения, которые нацелены на C. difficile , в то время как разрешение на восстановление постоянных организмов было бы одним из возможных механизмов предотвратить повторный CDAD.
3.1.4. Пробиотики и
C. difficile Прорастание спорКак упоминалось выше, CDAD обычно инфекция, полученная в больнице или другом медицинском учреждении.
Следовательно, a пробиотик, который может исключить C. difficile можно вводить до поступления в больницу. К сожалению, мало что известно о том, как и где C. difficile колонизирует кишечник. Как только эта информация Известно, что могут быть разработаны стратегии блокирования колонизации пробиотиками.
Тем не менее, многообещающий пробиотик описан подход с использованием нетоксигенного препарата C. difficile .Используя модель хомяка инфекции C. difficile , Gerding et al. продемонстрировал защитный эффект заселения хомяка штаммами C. difficile , которые не способны продуцировать токсин до заражения с вирулентным штаммом-продуцентом токсина [66]. Колонизация кишечного тракта нетоксигенным штаммом оказалась требуется для защиты. В настоящее время этот пробиотический подход находится под исследование для использования на людях (http: //www.viropharma.com /).
3.2. Энтерогеморрагический
E. coliA вероятно усложняет устранение C. difficile из кишечника способность организма развиваться. стрессоустойчивые споры. Идентификация пробиотических штаммов, которые могут предотвратить образование спор или их прорастание в кишечнике трактат открывает многообещающие возможности для борьбы с CDAD. Последние работы по споре прорастание обеспечило анализы in vitro, в которых ингибирующая активность пробиотиков можно тестировать [67].
Для прорастания спор в лаборатории необходимо наличие желчные кислоты, при этом наибольшую активность проявляют таурохолат и холат [67]. Таким образом, желчные кислоты могут играть роль в передаче сигнала C. difficile о том, что споры находятся в правильном месте кишечника, чтобы прорастают. Зорг и Соненшейн недавно предложили механизм, с помощью которого уменьшение кишечной микробиоты может привести к появлению эффективных спор всхожесть и разрастание С.difficile [67]. Они обнаружили, что дезоксихолат желчной кислоты (DOC) способен вызывать образование спор. прорастание, но этот последующий рост тормозился из-за токсического воздействия DOC по вегетативным C. difficile . Их работа предлагает модель, в которой снижение концентрации DOC в кишечник из-за нарушения нормальной микробиоты удаляет этот ключевой ингибитор роста C. difficile . DOC вторичная желчная кислота, образующаяся при дегидроксилировании холата ферментом -дегидроксилаза, активность, которая вырабатывается членами кишечника микробиота.Пока неясно, снижает ли терапия антибиотиками уровень DOC в кишечнике, можно предположить, что обеспечение пробиотические бактерии, способные продуцировать -дегидроксилазу, могут предотвращать кишечные разрастание C. difficile , в то время как восстанавливается нормальная микробиота.
3.2.1. Секвестрация и удаление токсинов
Энтерогеморрагические E. coli (EHEC) инфекции вызывают спорадические вспышки геморрагического колита во всем мире (100 000 случаев в год в США) [68].Большинство инфекций приводят к развитию кровавой диареи, но в некоторых случаях. (5–10%) пациентов с EHEC (в основном дети) разовьются опасные для жизни состояние гемолитико-уремического синдрома (ГУС) [69, 70]. ГУС — основная причина почечной недостаточности у детей. EHEC, что, вероятно, произошел от штамма EPEC [71], также вызывает прикрепление и стирание поражений на эпителиальных клетках хозяина и снижает барьерную функцию кишечного эпителия. Кроме того, штаммы EHEC являются характеризуются экспрессией генов токсина шига (Stx), и, таким образом, они могут быть обозначенным как продуцирующий шига-токсин E.coli (STEC). В настоящее время проводится только поддерживающая терапия инфекции EHEC. доступны, так как терапия антибиотиками может увеличить риск развития ГУС, и поэтому необходимо разработать новые методы лечения. Одна многообещающая альтернатива терапевтическим может быть использование пробиотиков для лечения инфекций EHEC.
3.2.2. Ингибирование продукции токсинов с помощью EHEC — Идентификация штаммов, которые подавляют литические функции лямбда.
Шига-токсины: белки, инактивирующие рибосомы, которые ингибируют синтез белка, удаляя специфический остаток аденина из 28S рРНК большой субъединицы рибосомы [72].Токсин шига необходим для развития ГУС, и недавние исследования указали, что штаммы EHEC, мутировавшие в отношении продукции токсина шига, не вызывают болезнь на модели стерильных мышей [73]. Действительно, инъекции токсина Шига с ЛПС непосредственно мышам достаточно для вызывают HUS-подобное заболевание в почках мышей [74]. Таким образом, токсин шига является важным медиатором ГУС и терапии, направленной на нейтрализация его активности, как ожидается, уменьшит или устранит это опасное для жизни осложнение, хотя текущие попытки нейтрализации токсина шига были неудачный [75].
Как возможный механизм лечения Болезнь EHEC и снижение заболеваемости HUS, Paton et al. имеют сгенерированы «дизайнерские пробиотики», в которых рецептор олигосахаридов (Gb 3 ) для Stx экспрессируется на клеточной поверхности штамм E. coli [76–78]. Этот Было показано, что пробиотический штамм способен нейтрализовать Stx in vitro. Как доказательство концепции, мыши, которых заражали штаммом STEC, были защищены путем введения пробиотика, экспрессирующего рецептор Gb 3 [79].Защитный эффект наблюдался даже тогда, когда штаммы были убиты формалином. перед использованием, подтверждая гипотезу о том, что секвестрация и удаление токсинов был механизмом защиты мышей. Подобные результаты были полученные с использованием рецепторов, экспрессирующих бактерии, для токсинов, продуцируемых другими диарейные патогены, включая энтеротоксигенные E. coli (наиболее частая причина диареи путешественников) и Vibrio cholerae .
3.2.3. Ингибирование прилипания патогенов и усиление барьерных функций кишечника
Stx-гены переносятся на лямбдоидных профагах и обычно расположен в области вируса с поздней транскрипцией, рядом с литическими генами [80].Поскольку механизм секреции токсина не был идентифицирован, расположение Stx рядом с литическими генами предполагает что активация фага и лизис клеток ответственны за продукцию Stx и выпуск. Это генетическое сопоставление предполагает, что терапевтические средства, подавляющие литическое решение лямбда in vivo значительно уменьшит или устранит осложнения вызвано системным высвобождением Stx.
3.3. Ротавирус
Ключ взаимодействие EHEC, как и EPEC, с кишечным эпителием образование прикрепляющихся и стирающихся высыпаний на поверхности эпителия [81].Это взаимодействие вызывается факторами, секретируемыми непосредственно из бактерии. в клетку-хозяин, где происходит перераспределение актинового цитоскелета. Инфекция EHEC и EPEC также вызывает потерю образования плотных стыков и снижение кишечного эпителиального барьера за счет перестройки ключевые белки плотных контактов, включая окклюдин [82, 83]. Терапии, которые нарушили бы это взаимодействие EHEC / EPEC с кишечного эпителия или подавления потери барьерной функции должно улучшаться болезнь.
Пробиотики показали некоторый успех ингибирование адгезии, образование поражений A / E и усиление барьерной функции в ответ на инфекцию EHEC in vitro. Джонсон-Генри и др. протестировали способность Lactobacillus rhamnosus GG для предотвращения потери целостности барьера и образования A / E поражения, вызванные EHEC-инфекцией клеточной культуры in vitro [40]. Они обнаружили, что предварительная обработка эпителиальных клеток кишечника in vitro с помощью LGG было достаточно, чтобы уменьшить количество поражений A / E и предотвратить потерю барьерная функция, измеряемая по трансэпителиальному сопротивлению, локализация белки плотных контактов и анализы проницаемости барьера.Что немаловажно, live LGG был необходим для этих эффектов, поскольку убитые нагреванием бактерии не были эффективны в предотвращение воздействия EHEC на эпителиальные клетки.
Кишечные вирусы, включая норовирусы и ротавирус представляют собой основные причины гастроэнтерита, особенно у молодых дети. Ротавирусная инфекция приводит к развитию острого гастроэнтерита с сопутствующие обезвоживание и рвота, в основном у детей в возрасте 3–24 месяцев. Ротавирус человека в первую очередь поражает эпителиальные клетки кишечника дистального отдела тонкой кишки. кишечник, что приводит к опосредованному энтеротоксином повреждению кишечного барьера функция.Недавние исследования показывают, что пробиотики могут сократить продолжительность и облегчить течение болезни, вызванной ротавирусной инфекцией ([84]; Г. Прейдис и Дж. Версалович, неопубликованные данные). Пробиотики продвигают кишечник выработка иммуноглобулина и, по-видимому, снижает тяжесть кишечной поражения из-за ротавирусной инфекции на мышиной модели. Эти выводы и связанные с ними исследования показывают, что пробиотики могут уменьшить тяжесть и продолжительность желудочно-кишечных инфекций по механизмам, не зависящим от прямого возбудителя антагонизм.Пробиотики также могут способствовать заживлению и гомеостазу, регулируя производство цитокинов и облегчение функции кишечного барьера.
Пробиотики могут стратегия профилактики и лечения желудочно-кишечных инфекций. Конкретные бактерии, происходящие из микробных сообществ человека, могут иметь ключевые особенности, которые делают эти микробы основными кандидатами на пробиотики. терапии. Эти полезные микробы могут по-разному влиять на хозяина. такие как предотвращение распространения и функции патогенов.Пробиотики также могут стимулировать иммунную функцию хозяина и целостность слизистого барьера. Работая через различные механизмы пробиоза пробиотики могут оказывать воздействие на различные этапы процесса. Пробиотики могут предотвратить заболевание при профилактическом применении. Пробиотики также могут подавлять или уменьшать тяжесть или продолжительность заболевания в контексте лечения. Как наши знания достижений микробиома человека, рационального выбора пробиотиков на основе известные механизмы действия и механизмы заболевания облегчат оптимизация стратегий терапевтической микробиологии.В конечном итоге мы ожидаем, что пробиотики помогут продвинуть стабильные, разнообразные и полезные микробные сообщества, которые укрепляют здоровье человека и предотвращают болезни.
Благодарности
Исследования в лаборатории Бриттона поддержаны грантом от Фонд Гербера, Центр микробных исследований Университета штата Мичиган Патогенез, Центр возобновляемых органических Ресурсы и Отделение микробиологических исследований в штате Мичиган по контракту Национальным институтом здоровья (NIH N01-AI-30058).J. Versalovic поддерживается за счет средств NIH (NIDDK R01 DK065075; NCCAM R21 AT003482; NCCAM R01 AT004326; NIDDK P30 DK56338, который финансирует Центр болезней пищеварения Техасского медицинского центра), Управления военно-морских исследований и перспективных исследовательских проектов Министерства обороны США. Агентство (DARPA).
Бактериальные заболевания пищеварительной системы
Пищеварительная система состоит из желудочно-кишечного тракта, который включает ротовую полость, глотку, пищевод, желудок и кишечник, а также ряд связанных структур и желез, таких как зубы, слюнные железы, печень и поджелудочная железа.Эти органы потребляют пищу, переваривают ее, поглощают питательные вещества и удаляют отходы, которые не усваиваются.
Кариес зубов. Кариес зубов , или кариес, является универсальной микробиологической проблемой. Большинство случаев вызвано Streptococcus mutans, который прилипает к зубной эмали и производит глюканы, которые представляют собой сеть молекул глюкозы. Вместе с бактериями и мусором глюканы составляют зубной налет . Бактерии сбраживают углеводы в рационе и производят молочную кислоту, уксусную кислоту, масляную кислоту и другие кислоты, которые повреждают эмаль.Восприимчивость к кариесу можно уменьшить путем тщательной чистки зубов щеткой и зубной нитью для удаления S. mutans и снижения потребления сахара.
Заболевания пародонта. Заболевание пародонта № включает повреждение тканей, окружающих и поддерживающих зубы. Десна также поражается, как и костная впадина, в которую внедряется зуб. Среди многих причин заболеваний пародонта — Bacteroides gingivalis, анаэробный грамотрицательный стержень. Спирохеты, такие как виды Treponema, также играют роль.
Шигеллез. Шигеллез также известен как бациллярная дизентерия . Это вызвано четырьмя видами грамотрицательной палочки Shigella: S. dysenteriae, S. boydii, S. sonnei и S. flexneri. Большинство случаев происходит у детей раннего возраста, и передача происходит орально-фекальным путем. Заболевание очень заразно и вызывается небольшим количеством бактерий по сравнению с другими инфекциями. Бактерии производят мощный токсин (шигоподобный токсин ), который вызывает поражения и воспаление слизистой оболочки кишечника и испражнения с прожилками крови и слизи.Обезвоживание представляет собой угрозу, и регидратация необходима для предотвращения смерти. Также доступна противомикробная терапия с использованием ряда антибиотиков, включая хинолоны.
Сальмонеллез. Сальмонеллез относится к ряду инфекций, передаваемых через пищу и воду, вызываемых видами Salmonella. Микроорганизмы представляют собой грамотрицательные палочки и включают S. enteritidis и S. choleraesuis. Они передаются фекально-оральным путем, и пациенты испытывают обширную диарею с лихорадкой, спазмами в животе и тошнотой.Инфекция обычно ограничивается сама собой, и антибактериальная терапия не применяется, если нет серьезных осложнений. Курица, яйца и продукты из птицы часто используются, потому что штаммы Salmonella обитают у домашней птицы.
Брюшной тиф. Брюшной тиф вызывается грамотрицательной аэробной палочкой Salmonella typhi. Заболевание передается через зараженную пищу и воду и начинается с высокой температуры, которая сохраняется в течение нескольких дней или недель. Кожная сыпь, называемая розовыми пятнами, связана с этим заболеванием.Пациенты устали, сбиты с толку и находятся в бреду, а уровень смертности без антибактериальной терапии высок. Возможно кишечное кровотечение и перфорация стенки. В терапии используется хлорамфеникол. Состояние носительства существует у выздоровевших. Эти люди выделяют бактерии с фекалиями и являются источником инфекции для других людей.
Холера. Холера , вызываемая холерным вибрионом, — это заболевание, передающееся в основном через загрязненную воду. Этиологический агент представляет собой короткий изогнутый грамотрицательный стержень с одним полярным жгутиком.Его экзотоксин связывается с клетками-хозяевами, и эпителиальные клетки хозяина выделяют большое количество хлорида в просвет кишечника, за которым следуют большие количества воды, натрия и других электролитов. Болезнь сопровождает массивный понос, а обезвоживание часто приводит к летальному исходу. Единственное эффективное лечение — регидратация, осуществляемая с помощью растворов для внутривенной и пероральной регидратации.
Escherichia coli инфекций . Escherichia coli — это грамотрицательный стержень, который обычно используется в исследованиях и промышленной микробиологии, потому что он, как правило, безвреден.Однако некоторые штаммы продуцируют токсины или обладают способностью проникать в ткани, и эти штаммы могут вызывать инфекции у людей. Одно заболевание, приписываемое E. coli , — это диарея путешественников , инфекция, развивающаяся, в частности, у путешественников в страны Карибского бассейна и Центральной Америки. Детская диарея и Инфекции мочевыводящих путей также вызываются E. coli . E. coli 0157: H7 в последние годы был замешан в многочисленных вспышках болезней пищевого происхождения.Пациенты страдают кровотечением, особенно в почках, и инфекции могут быть серьезными.
Кампилобактериоз. Кампилобактериоз вызывается Campylobacter jejuni, изогнутой грамотрицательной палочкой, которая часто передается через зараженное молоко. Пациенты испытывают кровавый понос, а также боли в животе и лихорадку. Большинство инфекций ограничиваются сами собой, но антибактериальная терапия эритромицином ускоряет выздоровление.
Язвенная болезнь желудка. В последние годы язв желудка были связаны с грамотрицательной палочкой Helicobacter pylori.Этот организм выживает в слизистой оболочке желудка, вырабатывая ферменты, превращающие мочевину в аммиак, тем самым повышая pH. Далее следует проникновение в слизистую оболочку желудка. Антибиотики, такие как тетрациклин, используются для ограничения размножения бактерий.
Стафилококковое пищевое отравление. Стафилококковое пищевое отравление — наиболее часто регистрируемый вид пищевого отравления в Соединенных Штатах. Это вызвано токсин-продуцирующими штаммами Staphylococcusaureus. Токсин, энтеротоксин , вырабатывается с пищей и поражает желудочно-кишечный тракт, вызывая рвоту, диарею и спазмы в животе.Инкубационный период длится несколько часов, и болезнь ограничивается после короткого, но интенсивного периода. Антибактериальная терапия не применяется. При сильной диарее может потребоваться восполнение жидкости. Тщательное обращение с продуктами питания, особенно с остатками пищи, имеет первостепенное значение для предотвращения этого заболевания.
Клостридиальное пищевое отравление. Клостридиальное пищевое отравление вызвано Clostridium perfringens, спорообразующим анаэробным стержнем. Этот организм производит свой токсин в мясе, а употребление зараженного мяса приводит к легкому гастроэнтериту с диареей.Инфекция проходит самостоятельно и редко требует антибактериальной терапии. Clostridium botulinum также передается с зараженной пищей. Его токсин влияет на нервную систему.
Лептоспироз. Лептоспироз — это заболевание животных (например, собак), а также человека, при котором поражаются печень и почки. Возбудитель — Leptospira interrogans, спирохета. Люди обычно заражаются при контакте с мочой животных, когда спирохеты проникают в ссадины на коже.Пациенты страдают от болей в мышцах, лихорадки и инфекции печени. Также может возникнуть почечная недостаточность. Для терапии используются пенициллиновые антибиотики.
Другие бактериальные болезни. Легкая форма желудочно-кишечного заболевания вызывается Vibrio parahaemolyticus. Этот грамотрицательный изогнутый стержень часто заражает рыбу, и вызываемая им диарея может быть легкой или взрывной. Болезнь сопровождают субфебрильная температура, судороги и рвота. Организм обитает в соленой воде, особенно в районе рядом с Японией.
Тип колита вызывается Yersinia enterocolitica, грамотрицательной палочкой, имеющей биполярное окрашивание. Этот организм прикрепляется к эпителию кишечника и вырабатывает энтеротоксин. Инфекция сопровождается сильной болью в животе. Организм связан с остатками пищи, особенно с теми, что хранятся в холодильнике. Молоко и продукты животного происхождения передают бактерии человеку.
Тип пищевого отравления вызывается Bacillus cereus, аэробной спорообразующей палочкой.Споры этого организма часто выживают в процессе приготовления, а его токсины накапливаются в овощных и рисовых блюдах. Инфекция сопровождается рвотой или диареей, или и тем, и другим.
Борьба с кишечными инфекциями с помощью собственных эндоканнабиноидов организма — ScienceDaily
Эндоканнабиноиды, сигнальные молекулы, вырабатываемые в организме и имеющие общие черты с химическими веществами, содержащимися в марихуане, могут отключать гены, необходимые для колонизации, размножения и возникновения болезней некоторых патогенных кишечных бактерий. Новое исследование, проведенное учеными UT Southwestern, показывает.
Результаты, опубликованные сегодня в сети Cell , могут помочь объяснить, почему растение каннабис, наиболее сильнодействующим компонентом которого является марихуана, может уменьшать симптомы различных заболеваний кишечника и в конечном итоге может привести к новым способам борьбы с желудочно-кишечными инфекциями. .
Эндоканнабиноиды, открытые в 1992 году, представляют собой нейромедиаторы на основе липидов, которые играют в организме различные роли, включая регулирование иммунитета, аппетита и настроения. Каннабис и его производные уже давно используются для облегчения хронических желудочно-кишечных заболеваний, включая синдром раздраженного кишечника и воспалительные заболевания кишечника.Исследования показали, что нарушение регуляции эндоканнабиноидной системы организма может привести к воспалению кишечника и повлиять на состав микробиоты кишечника, популяции различных видов бактерий, населяющих пищеварительный тракт.
Однако руководитель исследования Ванесса Сперандио, доктор философии, профессор микробиологии и биохимии в UTSW, говорит, что неизвестно, влияют ли эндоканнабиноиды на восприимчивость к патогенным желудочно-кишечным инфекциям.
Чтобы ответить на этот вопрос, Сперандио и ее коллеги работали с мышами, генетически измененными, чтобы чрезмерно продуцировать мощный эндоканнабиноид 2-арахидоноилглицерин (2-AG) млекопитающих в различных органах, включая кишечник.Когда исследователи заразили этих животных и их немодифицированных однопометников Citrobacter rodentium, бактериальным патогеном, который атакует толстую кишку и вызывает выраженное воспаление и диарею, у мутантных мышей развились только легкие симптомы по сравнению с более тяжелым желудочно-кишечным расстройством, которое проявляли их однопометники. Исследование толстой кишки мутантных животных показало гораздо меньшее воспаление и признаки инфекции. У этих мышей также было значительно меньшее количество бактерий C. rodentium в фекалиях, и они избавлялись от инфекции быстрее, чем их немодифицированные однопометники.Лечение генетически немодифицированных животных препаратом, повышающим уровень 2-AG в кишечнике, дало аналогичные положительные эффекты.
КомандаСперандио обнаружила, что повышенные уровни 2-AG могут также ослаблять инфекции Salmonella typhimurium у мышей и препятствовать энтерогеморрагической кишечной палочке — особенно опасным желудочно-кишечным бактериям, поражающим людей, — чтобы проявить черты вирулентности, необходимые для успешного заражения.
И наоборот, когда исследователи обрабатывали клетки млекопитающих в чашках Петри тетрагидролипстатином, соединением, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, коммерчески продаваемым как Alli и ингибирующим выработку 2-AG, они стали более восприимчивыми к бактериальным патогенам.
Дальнейшие эксперименты показали, что 2-AG оказывает эти эффекты на C. rodentium, S. typhimurium и E. coli, блокируя бактериальный рецептор, известный как QseC. Когда этот рецептор воспринимает сигнальные молекулы адреналина и норадреналина хозяина, он запускает молекулярный каскад, необходимый для установления инфекции. Сперандио объясняет, что соединение этого рецептора с 2-AG предотвращает активацию этой программы вирулентности, что помогает защитить от инфекции.
Сперандио отмечает, что эти результаты могут помочь объяснить некоторые эффекты употребления каннабиса на воспалительные заболевания кишечника.Хотя исследования показали, что каннабис может снизить воспаление, недавние исследования показали, что эти состояния также имеют бактериальный компонент, на который могут положительно влиять растительные каннабиноиды.
Кроме того, соединения каннабиса или синтетические производные могут в конечном итоге помочь пациентам избавиться от кишечных бактериальных инфекций без антибиотиков. По словам Сперандио, это может быть особенно полезно при инфекциях, вызванных энтерогеморрагической кишечной палочкой, которая вырабатывает смертельный токсин при лечении антибиотиками, что делает эти препараты не только контрпродуктивными, но и чрезвычайно опасными.Поскольку многие вирулентные бактерии, которые колонизируют участки в других частях тела, также имеют рецептор QseC, добавляет она, эту стратегию можно использовать более широко для борьбы с различными инфекциями.
«Используя силу природных соединений, вырабатываемых в организме и в растениях, — говорит она, — мы со временем сможем лечить инфекции совершенно новым способом».
История Источник:
Материалы предоставлены Юго-Западным медицинским центром UT . Примечание. Содержимое можно редактировать по стилю и длине.
.
 ): Желудочно-кишечный тракт.
Болезни. WB Saunders, Philadelphia, 1993.
): Желудочно-кишечный тракт.
Болезни. WB Saunders, Philadelphia, 1993.
 coli , Salmonella и Shigella .
coli , Salmonella и Shigella . 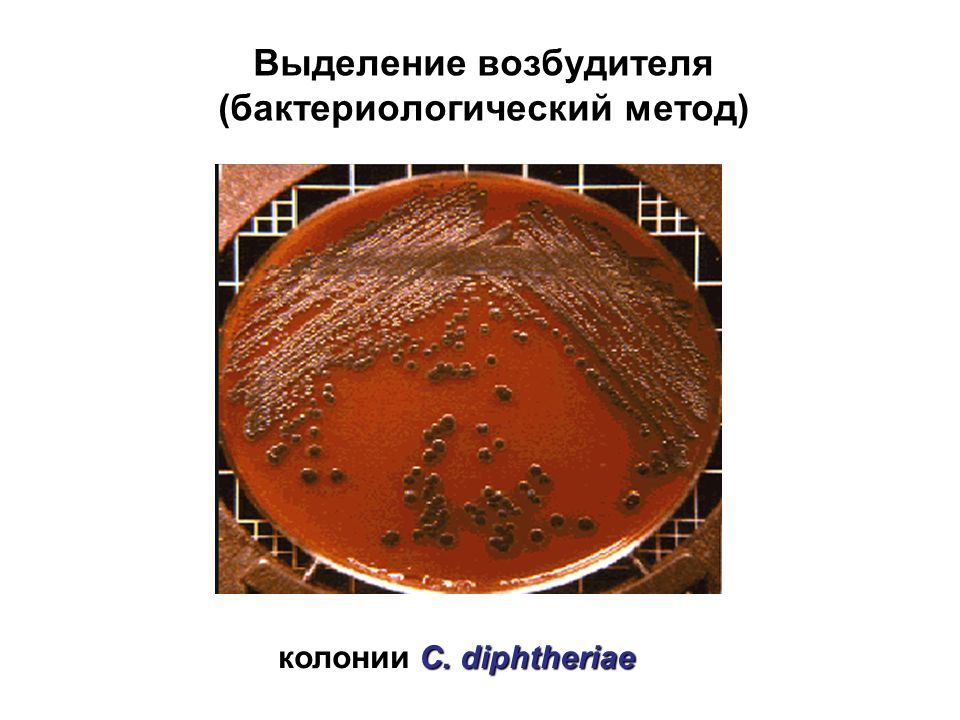
 merck.com
merck.com