Во внутриклеточном транспорте веществ участвует: органоиды: а)лизосома б)ядро в)митохондрия г)рибосома д)аппарат — Школьные Знания.com
Тест «Строение клеток» (9 класс)
Биология
9 класс
ТЕСТ
1. Биологические мембраны состоят из
а) белков и липидов
б) аминокислот и ДНК
в) липидов и углеводов
г) нуклеотидов и минеральных солей
2. Процессами, происходящими в клетке, управляет
а) цитоплазма
б) ядро
в) хлоропласт
г) митохондрия
3. Неклеточной формой жизни является
а) холерный вибрион
б) хлорелла
в) цианобактерия
г) бактериофаг
4. Из цистерн, трубчатых структур, вакуолей и транспортных пузырьков состоит
а) эндоплазматическая сеть
б) аппарат (комплекс) Гольджи
в) лизосома
г) митохондрия
5. На рисунке изображена (-о)
а) пластида
б) митохондрия
в) ядро
г) лизосома
6. Установите соответствие
Строение и функции Органоид
А) внутренняя мембрана образует складки — кристы 1) митохондрия
Б) участвует в процессах клеточного кислородного дыхания 2) хлоропласт
В) содержит пигмент хлорофилл
Г) осуществляет процесс фотосинтеза
Д) содержит граны
7. Каковы особенности строения и функций рибосом? Выберите три верных ответа
Каковы особенности строения и функций рибосом? Выберите три верных ответа
а) состоят из двух субъединиц – большой и малой
б) ограничены от цитоплазмы мембраной
в) участвуют в синтезе белка
г) участвуют в реакциях окисления
д) состоят из молекул РНК и молекул белков
е) размещаются в аппарате (комплексе) Гольджи
8. Какие слова пропущены в тексте? Впишите на месте пропусков соответствующие буквы (форма слов изменена)
(1) Внутренняя полужидкая среда клетки – это … . (2) Внутренняя зона этой среды пронизана … в виде многочисленных мелких каналов, полостей, окруженных мембранами. (3) В растительных клетках, в отличие от животных клеток, расположены … . (4) Маленькие округлые тельца, отвечающие за внутриклеточное пищеварение, называются … . (5) Они содержат …, расщепляющие органические вещества.
а) ферменты д) эндоплазматическая сеть
б) гормоны е) клеточный сок
в) цитоплазма ж) пластиды
г) лизосомы з) аппарат (комплекс) Гольджи
 Клеточная стенка отсутствует в клетках
Клеточная стенка отсутствует в клеткаха) грибов
б) растений
в) бактерий
г) животных
2. Что является основной функцией цитоплазмы?
а) отделяет содержимое клетки от внешней среды
б) осуществляет процесс фотосинтеза
в) обеспечивает прохождение процессов обмена веществ
г) осуществляет взаимодействие между клетками
3. Во внутриклеточном транспорте веществ участвует
а) лизосома
б) эндоплазматическая сеть
в) рибосома
г) митохондрия
4. В удалении клеток, органов и их частей участвует
а) лизосома
б) ядро
в) пластида
г) рибосома
5. На рисунке изображен (-а)
а) аппарат (комплекс) Гольджи
б) лизосома
в) митохондрия
г) рибосома
6. Установите соответствие
Характеристика Часть клетки
А) содержит кариоплазму 1) ядро
Б) обладает способностью к росту 2) цитоплазма
В) составляет внутреннюю среду клетки
Г) обеспечивает хранение наследственной информации
Д) содержит органоиды, обеспечивающие жизнедеятельность клетки
7. Каковы функции и особенности строения аппарата (комплекса) Гольджи? Выберите
Каковы функции и особенности строения аппарата (комплекса) Гольджи? Выберите
а) является мембранным органоидом
б) является немембранным органоидом
в) накапливает и «упаковывает» химические соединения
г) синтезирует АТФ
д) внутренняя мембрана образует кристы
е) представляет собой стопку цистерн, трубочек и вакуолей
8. Какие слова пропущены в тексте? Впишите на месте пропусков соответствующие буквы (форма слов изменена)
(1) Энергетическими станциями клетки называют … . (2) Их внутренняя мембрана образует складки — … . (3) В клетках зеленых листьев содержатся … . (4) Их внутренняя мембрана образует выросты — … . (5) Важную роль в образовании веретена деления играет … .
а) клеточный центр д) кристы
б) хромопласты е) граны
в) митохондрии ж) вакуоль
г) хлоропласты з) аппарат (комплекс) Гольджи
Тестовые задания — Урок 39 — Клеточная теория — ОБЩАЯ БИОЛОГИЯ
Задание 1: выберите один правильный ответ.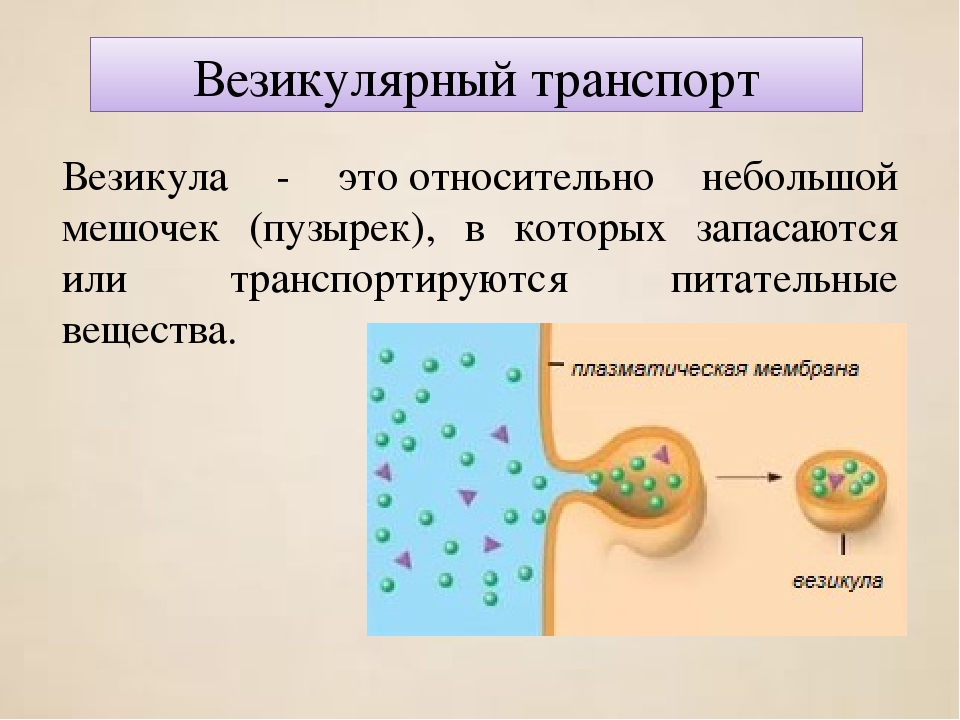
1. В клетках растений, грибов и бактерий клеточная стенка состоит
1) только из белков
2) только из липидов
3) из белков и липидов
4) из полисахаридов
2. Гликокаликс — это наружный слой клеток
1) животных
2) всех прокариот
3) всех эукариот
4) грибов
3. Двумембранное строение имеют
1) митохондрии
2) лизосомы
3) рибосомы
4) центриоли
4. Пластиды имеются в клетках
1) всех растений
2) только животных
3) всех эукариот
4) во всех клетках
5. Хлоропласты — это органоиды клетки, в которых
1) происходит клеточное дыхание
2) осуществляется процесс фотосинтеза
3) находятся пигменты красного и желтого цвета
4) накапливается вторичный крахмал
6. В митохондриях происходит
1) накопление синтезируемых клеткой веществ
2) клеточное дыхание с запасанием энергии
3) формирование третичной структуры белка
4) темновая фаза фотосинтеза
7.
1) митохондрий
2) лизосом
3) рибосом
4) лейкопластов
8. На мембранах агранулярной эндоплазматической сети происходит синтез
1) АТФ
2) углеводов
3) нуклеиновых кислот
4) белков
9. Функция комплекса Гольджи заключается в
1) накоплении белков для последующего выведения
2) синтезе белков и последующем их выведении
3) накоплении белков для последующего расщепления
4) синтезе белков и последующем их расщеплении
1) рибосомах
2) лизосомах
3) митохондриях
4) лейкопластах
11. Лизосомы участвуют в
1) транспорте веществ, синтезированных в клетке
2) накоплении, химической модификации и упаковке синтезированных в клетке веществ
3) синтезе белков
4) удалении отживших органоидов клетки
12. Клеточный центр участвует в
Клеточный центр участвует в
1) синтезе АТФ
2) хранении генетической информации
3) формировании веретена деления
4) синтезе рибосом
13. Основными структурами клеточного центра являются
1) тилакоиды
2) граны
3) центриоли
4) мембранные пузырьки
14. Ядрышко участвует в
1) энергетическом обмене
2) синтезе рибосом
3) организации деления клетки
4) транспорте синтезированных в клетке веществ
15. Хромосомы состоят из
1) ДНК
2) ДНК и белков
3) РНК
4) РНК и белков
Задание 2: выберите три правильных ответа.
16. Мембранными клеточными органоидами являются
1) лизосомы
2) рибосомы
3) эндоплазматическая сеть
4) центриоли
5) комплекс Гольджи
6) микротрубочки цитоскелета
17. Эндоплазматическая сеть
1) является источником клеточных лизосом
2) участвует в синтезе органических соединений
3) обеспечивает транспорт веществ
4) делит клетку на отдельные отсеки
5) формирует рибосомы
6) обеспечивает удаление отмирающих органоидов клетки
18. Плазмалемма
Плазмалемма
1) является барьером между цитоплазмой клетки и внешней средой
2) обеспечивает транспорт аминокислот к месту синтеза белка
3) обеспечивает избирательный транспорт веществ в клетку
4) участвует в межклеточных взаимодействиях
5) служит депо запасных питательных веществ
6) участвует в накоплении и химической модификации веществ, синтезированных в клетке
19. Рибосомы
1) окружены двойной мембраной
2) находятся на поверхности шероховатой эндоплазматической сети
3) состоят из двух субъединиц
4) осуществляют внутриклеточное пищеварение
5) формируют веретено деления
6) участвуют в синтезе белка
20. Ядерная оболочка
1) имеет толщину около 30 нм
2) отделяет ядро от цитоплазмы
3) является непроницаемой для молекул нуклеиновых кислот
4) состоит из двух мембран
5) пронизана порами
6) не содержит фосфолипидов
Задание 3: установите соответствие между органоидом клетки и функцией, которую он выполняет.
Функции |
Органоиды клетки |
1) обеспечивает рост и обновление клеточных мембран 2) участвует в синтезе белков 3) участвует в организации цитоскелета 4) является источником клеточных лизосом 5) участвует в химической модификации веществ, синтезированных в клетке 6) формирует веретено деления |
А) аппарат Гольджи Б) эндоплазматический ретикулум В) клеточный центр |
Ключи к тестовым заданиям
Задания 1 и 2
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
ответ |
4 |
1 |
1 |
1 |
2 |
2 |
3 |
2 |
1 |
2 |
№ вопроса |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
ответ |
4 |
3 |
3 |
2 |
2 |
1, 3, 5 |
2, 3, 4 |
1, 3, 4 |
2, 3, 6 |
2, 4, 5 |
Задание 3
1 |
2 |
3 |
4 |
5 |
6 |
А |
Б |
В |
А |
А |
В |
Страница не найдена — Школа №5 г.
 Дубна
Дубна28.04.2021
В связи с объявленными нерабочими днями с 4 по 7 мая 2021 года внесены изменения в годовой календарный график на 2020-2021 учебный год и рабочие программы по предметам учебного плана.
Ознакомиться с приказом можно на странице Локальные акты
15.04.2021
Уважаемые родители! С 15 апреля 2021 начинается приемная компания в образовательные организации на обучение по программам дополнительного образования.
Более подробную информацию вы можете посмотреть на странице ЗАПИСЬ В КРУЖКИ
10.04.2021
13 апреля в нашей школе проводится акция «ОГЭ для родителей». Пригалашаем окунуться в атмосферу итоговой аттестации учащихся 9х классов и их родителей.
09.04.2021
Внимание учащихся 9 классов и их родителей!
Изменен порядок подачи заявлений на участие в основном государственном экзамене (ОГЭ).
Более подробную информацию можно посмотреть по ссылке
28.
 03.2021
03.2021Выпускникам 9 и 11 классов
Минпросвещения и Рособрнадзор объявили о решениях, которые приняты в отношении порядка проведения ЕГЭ и государственной итоговой аттестации выпускников 9 и 11 классов в 2021 году. >>
Уважаемые родители!
Как освободить ребенка от посещения школы или детского сада, и каким образом ученики будут получать знания вне учебного заведения, читайте в материале портала Правительства Московской области
Уважаемые родители!
Информируем вас о том, что записаться на «Родительский контроль» — проект по оценке качества питания в школах — в Подмосковье теперь можно в режиме онлайн. Сделать это можно на Школьном портале региона. Регистрация проходит быстро — вся процедура займет не более трех минут.
— Нужно перейти во вкладку «Родительская»;
— Перейти в раздел «Школьное питание»;
— Выбрать желаемую дату и время;
— Нажать кнопку «Записаться».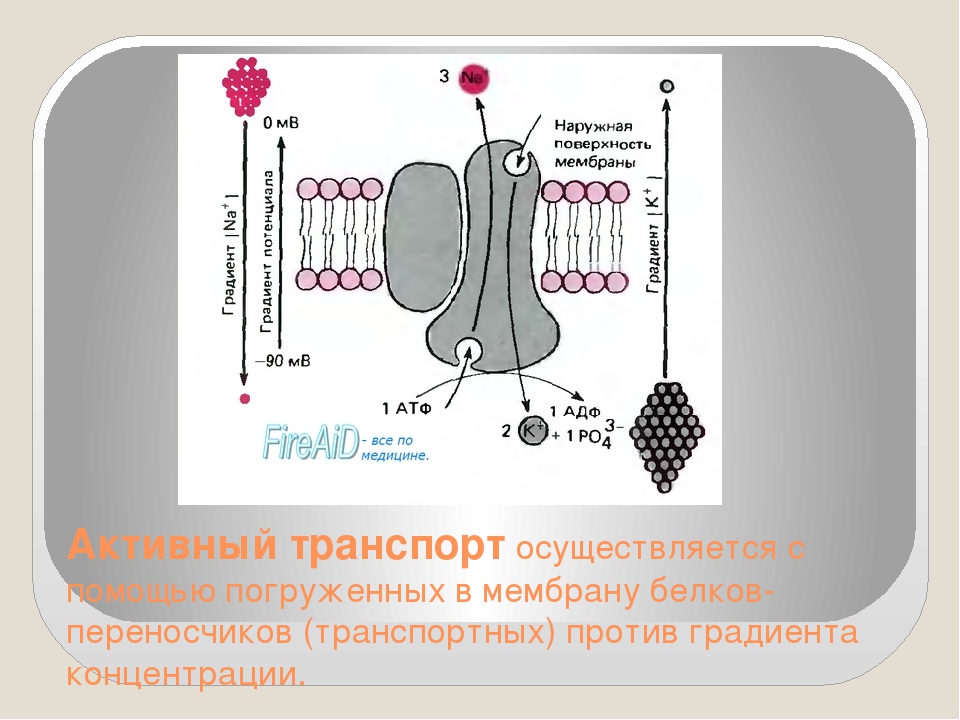
Школа автоматически получит заявку и в назначенное время родителя будет ожидать классный руководитель или ответственный за питание.
Уважаемые родители!
Уважаемые родители !
В связи с тем, что порог заболеваемости учащихся гриппом и ОРВИ не превышает 20 %,
ШКОЛА РАБОТАЕТ В ШТАТНОМ РЕЖИМЕ.
Предстоящие каникулы начнутся в соответствии с годовым календарным графиком 31 октября 2020 года.
Берегите себя и наших детей, соблюдайте меры безопасности! Будьте здоровы!
Директор В. И. Стенгач
График вакцинации от гриппа
Внутриклеточный транспорт веществ. — Студопедия
В нервных клетках, в силу их высокой функциональной активности, постоянно происходит физиологическая регенерация структурных и метаболических белков перикариона и цитоплазмы отростков.
Перемещение по аксону различных веществ и органелл называется аксоплазматическим током. Причем он осуществляется как от тела клетки (антероградный транспорт), так и к телу (ретроградный транспорт). Основными структурами, обеспечивающими аксоток, являются микротрубочки и связанные с ними моторные белки – кинезины и динеины.
Причем он осуществляется как от тела клетки (антероградный транспорт), так и к телу (ретроградный транспорт). Основными структурами, обеспечивающими аксоток, являются микротрубочки и связанные с ними моторные белки – кинезины и динеины.
Антероградный ток подразделяется на медленный (скорость – 1-5 мм/сутки) и быстрый (100-500 мм/сут.)
Медленный – переносит компоненты гиалоплазмы, ферменты и элементы цитоскелета. Быстрый ток осуществляет перенос митохондрий, пузырьков, содержащих медиаторы.
Ретроградный транспорт осуществляет перенос и удаление веществ из терминальных частей к телу клетки, происходит со скоростью 100-200 мм/сут.
Плазмолемма (аксолемма) — это плазматическая мембрана нейроцита. Она имеет такое же строение, как в других клетках, но в функциональном отношении имеет особенности: обладает повышенной способностью пропускать ионы, которые перемещаются за счет работы энергозависимого калий-натриевого насоса (энергозависимые ионные каналы). Он создает внутри клетки более высокую концентрацию ионов калия и более низкую концентрацию натрия по сравнению с внеклеточной средой. В покое происходит постепенная утечка калия во внеклеточную среду, что создает потенциал покоя в -70 мВ. При раздражении мембрана быстро пропускает натрий внутрь клетки, а калий — наружу. Возникает потенциал действия,или нервный импульс.Его генерация происходит в области аксонного холмика.
Он создает внутри клетки более высокую концентрацию ионов калия и более низкую концентрацию натрия по сравнению с внеклеточной средой. В покое происходит постепенная утечка калия во внеклеточную среду, что создает потенциал покоя в -70 мВ. При раздражении мембрана быстро пропускает натрий внутрь клетки, а калий — наружу. Возникает потенциал действия,или нервный импульс.Его генерация происходит в области аксонного холмика.
Классификация нервных клеток.
В основе морфологической классификации лежит число отростков нервной клетки. По этому признаку все нервные клетки подразделяются на:
— униполярные – имеющие один отросток. В нервной системе человека они встречаются крайне редко.
— Биполярные нейроны имеют два отростка, один из которых аксон, другой – дендрит. В нервной системе человека редки: нейроциты сетчатки, спирального и вестибулярного ганглиев.
— Их разновидностью являются псевдоуниполярные нервные клетки. Они имеют аксон и дендрит, отходящие от общего основания. Эти клетки образуют спинно-мозговые и черепно-мозговые узлы.
Они имеют аксон и дендрит, отходящие от общего основания. Эти клетки образуют спинно-мозговые и черепно-мозговые узлы.
— Мультиполярные нейроны имеют три или более отростков, один из которых аксон, а остальные – дендриты. Эти клетки наиболее многочисленные и разнообразные по форме.
В основе функциональной классификации нервных клеток лежит характер выполняемой ими функции (в соответствии с их расположением в рефлекторной дуге). По этому признаку они подразделяются на чувствительные, двигательные, вставочные.
— Чувствительные (афферентные) – это нейроциты, дендриты которых заканчиваются рецепторами и воспринимают изменения внешней среды, генерируя импульс.
— Двигательные (эфферентные) – передают нервный импульс на рабочий орган, где заканчиваются двигательным нервным окончанием.
— Вставочные (ассоциативные) – осуществляют связь между чувствительными и двигательными нейроцитами.
Помимо морфологической и функциональной классификаций нервных клеток существует классификация по химическому строению нейромедиаторов – химических соединений, для передачи нервного импульса. В соответствии с этим нейроциты подразделяются на:
В соответствии с этим нейроциты подразделяются на:
— Холинергические – медиатор ацетилхолин.
— Адренергические – норадреналин.
— Дофаминэргические –дофамин.
— Пуринэргические –АТФ и т.д.
Регенерация. Нервные клетки – высокоспециализированные, терминальной дифференцировки подвергаются в эмбриогенезе, постнатально камбий отсутствует. Поэтому регенерация на клеточном уровне невозможна.
Регенерация осуществляется исключительно на внутриклеточном уровне, протекает очень интенсивно.
Наука: Наука и техника: Lenta.ru
Нобелевскую премию по физиологии и медицине в этом году получили три американских ученых за «исследование механизмов, регулирующих везикулярный транспорт». Ренди Шекман, Джеймс Ротман и Томас Зюдоф в своих работах объяснили, как различные вещества двигаются внутри клеток в мембранных пузырьках: работа каких генов для этого необходима, как на молекулярном уровне происходит слияние везикул и как этот процесс регулируется в нейронах, где особенно важно, чтобы слияние происходило только в нужное время и в нужном месте.
Эукариотическая, то есть содержащая ядро клетка, с точки зрения биохимии, очень велика. Хотя рассмотреть ее обычно можно только в микроскоп (яйца и волокна апельсинов — не в счет), даже самая маленькая эукариотическая клетка больше клетки бактерий в сотни и тысячи раз. Как бы ни была сложна бактерия, она, в конечном счете, не далеко ушла от пробирки с (очень сложным) раствором, но клетки эукариот от безъядерных микробов в этом смысле очень сильно отличаются. Они всегда поделены на множество отделов, которые выполняют разные функции и часто содержат совершенно непохожие, несовместимые вещества.
Это означает, что перед эукариотами, в отличие от бактерий, в какой-то момент эволюции появилась проблема внутриклеточной логистики. До того, как возникли ядерные организмы, такой проблемы не существовало: то, что синтезировалось в одной части бактериальной клетки, немедленно диффундировало в другую ее часть. Если же какое-либо вещество требовалось выбросить в окружающую среду, его обычно синтезировали на мембране, одновременно протаскивая наружу как нитку через игольное ушко.
Однако для большой и сложной клетки эукариот, даже если она представляет собой совершенно самостоятельный организм, без системы внутриклеточного транспорта обойтись нельзя. И уж тем более такая система необходима многоклеточным, некоторые клетки которых специализируются на выработке разных веществ: гормонов, пищеварительных ферментов или нейромедиаторов. Именно поэтому у эукариот, наряду с ядром и митохондриями, появилась другая принципиальная инновация — развитая система транспорта веществ в мембранных пузырьках.
Следует сразу оговориться, что нынешняя Нобелевская премия присуждена не за открытие везикулярного транспорта как такового, а за выяснение механизма его работы. То, что некоторые вещества могут транспортироваться внутри клеток в пузырьках-контейнерах, стало ясно практически тогда же, когда получил распространение электронный микроскоп — такие пузырьки были ясно видны на снимках. Один из «логистических узлов», где они формируются, аппарат Гольджи, был открыт итальянским ученым Камилло Гольджи еще в конце XIX века, даже до изобретения электронного микроскопа.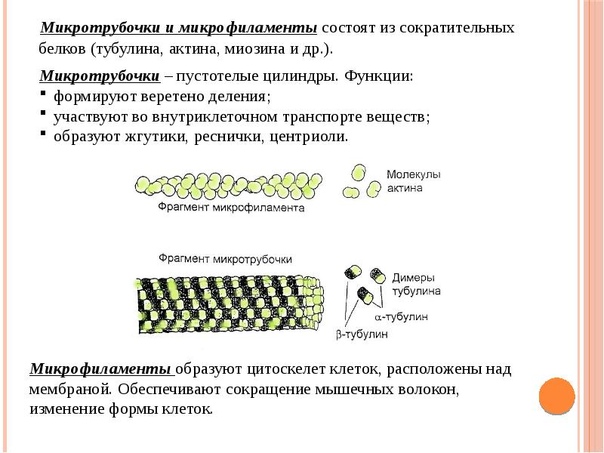 Второй главный «клеточный хаб», эндоплазматический ретикулум (ЭПР), был открыт несколько позже Альбертом Клодом, за что ученый наряду с двумя коллегами получил Нобелевскую премию по физиологии и медицине в 1974 году. И, наконец, тот факт, что именно мембранные пузырьки с нейромедиаторами передают сигналы от одного нейрона к другому в синапсах, был установлен Катцем, фон Эйлером и Аксельродом, благодаря чему они также стали нобелевскими лауреатами в 1970 году.
Второй главный «клеточный хаб», эндоплазматический ретикулум (ЭПР), был открыт несколько позже Альбертом Клодом, за что ученый наряду с двумя коллегами получил Нобелевскую премию по физиологии и медицине в 1974 году. И, наконец, тот факт, что именно мембранные пузырьки с нейромедиаторами передают сигналы от одного нейрона к другому в синапсах, был установлен Катцем, фон Эйлером и Аксельродом, благодаря чему они также стали нобелевскими лауреатами в 1970 году.
Ренди Шекман
Фото: Uwe Dettmar / GBM / AFP
Тем не менее, что именно управляет мембранными пузырьками, за счет чего они транспортируются в нужные части клетки, как они сливаются с клеточной мембраной, оставалось непонятным вплоть до конца семидесятых годов прошлого века, когда к этому вопросу обратился сотрудник Университета Беркли Ренди Шекман.
Научным руководителем Шекмана в университете стал Артур Корнберг, нобелевский лауреат и знаменитый биохимик (а также отец нобелевского лауреата Роджера Корнберга, который сейчас вместе с Жоресом Алферовым возглавляет научный совет Сколково).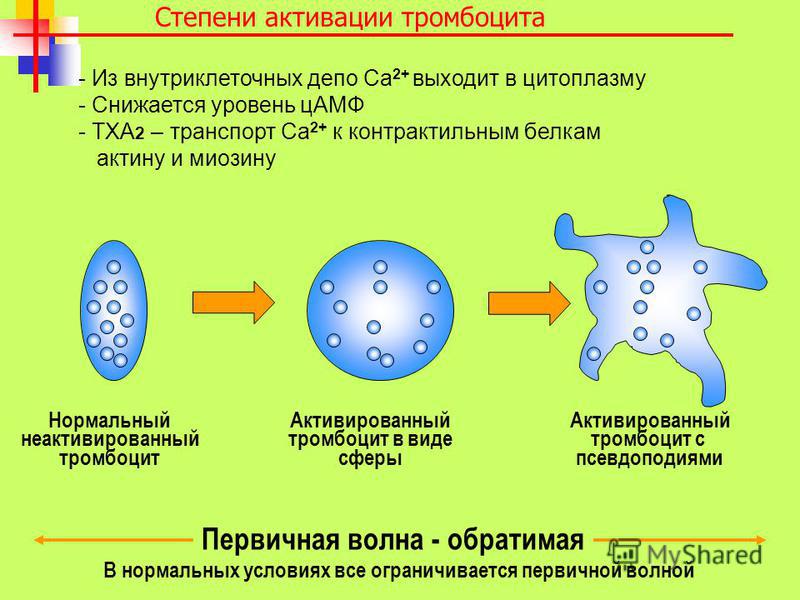
Несмотря на биохимическую школу, для того чтобы разобраться с везикулярным транспортом, Шекман обратился не к биохимическому, а к генетическому методу исследования. Он решил использовать наиболее простой эукариотический модельный организм, и занялся получением мутантов дрожжей, у которых проявляются те или иные дефекты везикулярного транспорта.
В серии работ, выполненных совместно с Петером Новиком (именно он значится первым автором ключевых статей Шекмана), ученый обнаружил у дрожжей 23 гена, работа которых необходима для нормальной секреции гликопротеинов. Когда мутантные дрожжи переносили в термостат с высокой температурой (там мутации начинали проявлять свое действие), клетки переставали делиться. Под электронным микроскопом по краям таких клеток можно было заметить тысячи маленьких пузырьков, которые не могли слиться с мембраной и выбросить наружу свое содержимое. Испорченные у этих мутантов гены получили названия sec1, sec2, sec3 и так далее. Они стали своего рода библиотекой, на которую ориентировались последующие ученые, когда родственные гены начали искать у высших эукариот. Однако как на молекулярном уровне работают белки, кодирующиеся этими генами, выяснить удалось уже не Шекману, а его независимо работавшему коллеге, Джеймсу Ротману.
Однако как на молекулярном уровне работают белки, кодирующиеся этими генами, выяснить удалось уже не Шекману, а его независимо работавшему коллеге, Джеймсу Ротману.
У Джеймса Ротмана, который всего на два года младше Шекмана и примерно в то же время работал над внутриклеточным транспортом в Стенфорде, был принципиально иной подход к исследованиям. Во-первых, он работал не на дрожжах, а на культурах клеток млекопитающих. Точнее говоря, даже не на самих клетках, а на их экстрактах. Во-вторых, он занимался не поиском мутантов, а классической биохимической работой — выделением белков. В каком-то смысле можно сказать, что Ротман стал «копать тоннель с другого конца» и, к счастью, в 1992 году эти два направления исследований сошлись в одной совместной работе.
box#1427496
Главной моделью Ротмана стал вирус везикулярного стоматита (VSV), один из белков которого при созревании гликозилируется, то есть модифицируется различными сахарами. По мере того как этот белок после синтеза на мембране ЭПР двигается вдоль транспортного «конвейера» клетки, он сначала получает, а потом теряет некоторые сахара. Эти сахара оказались для Ротмана очень удобными маркерами, благодаря которым можно было отследить, на какой стадии остановился транспорт при добавлении тех или иных клеточных экстрактов.
По мере того как этот белок после синтеза на мембране ЭПР двигается вдоль транспортного «конвейера» клетки, он сначала получает, а потом теряет некоторые сахара. Эти сахара оказались для Ротмана очень удобными маркерами, благодаря которым можно было отследить, на какой стадии остановился транспорт при добавлении тех или иных клеточных экстрактов.
Работая с этой биохимической системой, Ротман выделил сначала один (NSF), а затем множество белков, работа которых была необходима для слияния и деления мембранных пузырьков. И в этот момент работы Шекмана и Ротмана, генетический и биохимический подход, сошлись: оказалось, что один из белков, выделенных из экстрактов клеток (SNAP), является близким родственником того, чья последовательность закодирована геном sec17 из дрожжей. Открытие было опубликовано в первой совместной работе нынешних нобелевских лауреатов, которые до этого момента работали совершенно независимо друг от друга. Помимо прочего, из этого совпадения следовало, что система везикулярного транспорта у дрожжей и млекопитающих работает благодаря одним и тем же общим механизмам.
Дальнейшие биохимические опыты Ротмана позволили установить состав целого комплекса белков, которые участвуют в слиянии молекулярных пузырьков. Для поиска этих молекул ученый использовал уже не экстракты клеточных культур (материала в них обычно довольно мало), а препараты бычьих мозгов, ведь именно в нервной ткани очень много синапсов, где везикулы с нейромедиаторами должны сливаться по команде электрического возбуждения.
Работы Ротмана позволили сформировать так называемую SNARE-гипотезу — модель, которая объясняет, почему везикулы сливаются с клеточными мембранами именно в тех местах, где это необходимо. Согласно этой модели, слияние регулируется двумя группами рецепторов: t-(target)-SNARE (синтаксины) и v-(vesicle)-SNARE (синаптобревины), то есть молекулами, находящимися на мембране и на везикулах соответственно. Определенные рецепторы v-SNARE способны взаимодействовать с рецепторами t-SNARE только строго соответствующего типа (а их известно не менее 35 разновидностей), поэтому слияние проходит специфически, хотя его механизм в общих чертах остается тем же самым.
Ключевым моментом слияния является переплетение находящихся на разных мембранах белков в своеобразные косы из четырех альфа-спиралей (в англоязычной литературе их принято называть «застежками-молниями»). Это переплетение дает энергию, необходимую для слияния липидных слоев, которые в норме достаточно сильно отталкиваются друг от друга из-за отрицательного заряда фосфатов.
После того как молекулярный механизм слияния мембранных пузырьков был выяснен, остался вопрос временнóй регуляции этого процесса. Ведь в нервных клетках везикулы с нейромедиатором должны выбрасываться в синаптическую щель тогда и только тогда, когда клетка возбуждается. Электрическая деполяризация нейрона всегда сопровождает вход в клетки ионов кальция и именно они оказались ключевыми для всего процесса.
Томас Зюдоф
Фото: vanderbilt.edu
Установить детали кальциевой регуляции удалось Томасу Зюдофу, биохимику из Геттингена, который свои основные работы выполнил уже в США, в Техасском университете.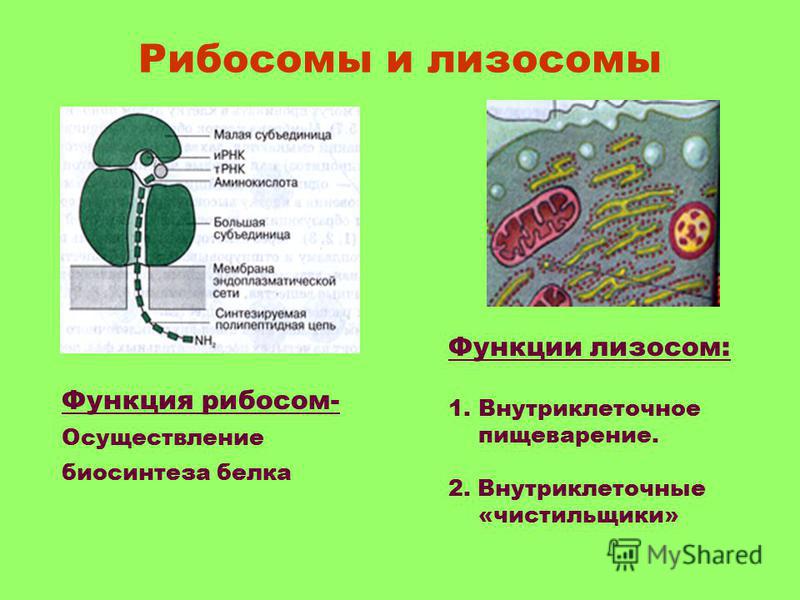 Он обнаружил, что помимо рецепторов SNARE в процессе слияния мембранных пузырьков важную роль в синапсах играют еще несколько белков, ключевыми из которых оказались комплексин и синаптотагмин.
Он обнаружил, что помимо рецепторов SNARE в процессе слияния мембранных пузырьков важную роль в синапсах играют еще несколько белков, ключевыми из которых оказались комплексин и синаптотагмин.
Работая на так называемых нокаутных мышах — животных, у которых искусственно выключен один из генов, Зюдоф показал, что удаление комплексина приводит к сильному снижению активности всех без исключения синапсов. Непосредственно связывание ионов кальция проводит другой белок, синаптотагмин. Кроме того, Зюдофом с коллегами был найден и третий белок, который соответствовал тому самому мутанту sec-1, который первым попался Шекману в его исследованиях в конце 70-х.
SNARE комплекс формируется в результате сплетения четырех альфа-спиралей белков синаптобревина (v-SNARE), синтаксина (t-SNARE) и SNAP-25. Синаптотагмин служит кальциевым сенсором.
Изображение: Danko Dimchev Georgiev, M.D.
Интересно, что в ходе этих опытов Зюдофу удалось даже получить линию нокаутных мышей, у которых из-за отсутствия одного из белков во всей нервной системе не работал ни один (!) синапс. Самым удивительным было то, что у таких грызунов формировался практически нормальный мозг, нейроны которого все-таки умирают, но очень поздно — только после его полного созревания. Таким образом, попутно с прояснением деталей регуляции везикулярного транспорта удалось установить, что работа синапсов нужна мозгу для того, чтобы поддерживать свое существование, но не требуется, пока он еще не созрел.
Самым удивительным было то, что у таких грызунов формировался практически нормальный мозг, нейроны которого все-таки умирают, но очень поздно — только после его полного созревания. Таким образом, попутно с прояснением деталей регуляции везикулярного транспорта удалось установить, что работа синапсов нужна мозгу для того, чтобы поддерживать свое существование, но не требуется, пока он еще не созрел.
Прошлогодняя Нобелевская премия по медицине Джону Гардону и Синья Яманаке была вручена за открытие механизма перепрограммирования, который позволяет практически из любых зрелых клеток получить стволовые. Работы двух этих ученых оказались сильно разнесены во времени — ключевые опыты Гардон провел в 70-х годах, а Яманака получил первые перепрограммированные стволовые клетки в 2004 году. Сказать, что этого последнего открытия очень ждали, значит ничего не сказать: оно позволило, наконец, работать со стволовыми клетками без использования эмбрионов и, что еще более важно, научило биологов получать стволовые клетки, которые генетически идентичны донорам материала. Сегодня такие клетки уже вовсю используются для получения искусственных органов. Из них, как недавно показали ученые, даже формируются напоминающие мозг органоиды, а произведенные in situ, такие клетки обладают полной тотипотентностью — они способны даже образовывать внутри тела эмбрионы.
Сегодня такие клетки уже вовсю используются для получения искусственных органов. Из них, как недавно показали ученые, даже формируются напоминающие мозг органоиды, а произведенные in situ, такие клетки обладают полной тотипотентностью — они способны даже образовывать внутри тела эмбрионы.
Выделение нейромедиатора из пресинаптической щели, 3D-рендер.
Везикулярный транспорт по сравнению с клеточным перепрограммированием кажется темой существенно менее «модной». Возможно, такое чередование модных и не слишком модных тем — это осознанная политика Нобелевского комитета, а может быть, просто результат случайности. В любом случае, стокгольмские эксперты по-прежнему остаются непредсказуемыми: ни одна из тематик, которым сулили премию по медицине в этом году, так и не выиграла. А ведь среди них была и такая важная тема, как эпигенетическое метилирование — именно на нее «ставили» очень многие в молекулярно-биологическом сообществе.
Нобелевский комитет, как мы видим, далеко не всегда следует моде. И это хорошо: на длинной дистанции ценность открытия определяется не его немедленной применимостью, а фундаментальностью, то есть тем, насколько глубинные процессы оно может объяснить.
И это хорошо: на длинной дистанции ценность открытия определяется не его немедленной применимостью, а фундаментальностью, то есть тем, насколько глубинные процессы оно может объяснить.
Если же кому-то очень хочется придать нынешней премии модный флер, то сделать это проще простого. Помните такую косметическую процедуру, как «ботокс», инъекцию ботулотоксина? Так вот, ботулотоксин разрезает как раз те самые открытые Ротманом белки (а именно SNAP-25) в комплексе SNARE-рецепторов в месте слияния везикул, что приводит к выключению данного синапса.
Органоиды клетки, подготовка к ЕГЭ по биологии
Органоиды (органеллы) клетки — специализированные структуры клетки, выполняющие различные жизненно необходимые функции. Особенно сложно устроены клетки простейших, где одна клетка составляет весь организм и выполняет функции дыхания, выделения, пищеварения и многие другие.
Органоиды клетки подразделяются на:
- Немембранные — рибосомы, клеточный центр, микротрубочки, органоиды движения (жгутики, реснички)
- Одномембранные — ЭПС, комплекс (аппарат) Гольджи, лизосомы и вакуоли
- Двумембранные — ядро, пластиды, митохондрии
Прежде чем говорить об органоидах клетки, без которых невозможна ее жизнедеятельность, необходимо
упомянуть о том, без чего вообще не существует клетки — о клеточной мембране. Клеточная мембрана ограничивает клетку
от окружающего мира и формирует ее внутреннюю среду.
Клеточная мембрана ограничивает клетку
от окружающего мира и формирует ее внутреннюю среду.
Клеточная мембрана (оболочка)
Запомните, что в отличие от клеточной стенки, которая есть только у растительных клеток и у клеток грибов (она придает им плотную, жесткую форму) клеточная мембрана есть у всех клеток без исключения! Этот важный момент объясню еще раз 🙂 У клеток животных имеется только клеточная мембрана, а у клеток растений и грибов есть и клеточная стенка, и клеточная мембрана.
Клеточная мембрана представляет собой билипидный слой (лат. bi — двойной + греч. lipos — жир), который пронизывают молекулы белков.
Билипидный слой представлен двумя слоями фосфолипидов. Обратите внимание, что их гидрофобные концы обращены внутрь мембраны, а
гидрофильные «головки» смотрят наружу. Билипидный слой насквозь пронизывают интегральные белки, частично — погруженные белки,
имеются также поверхностно лежащие белки — периферические.
Билипидный слой насквозь пронизывают интегральные белки, частично — погруженные белки,
имеются также поверхностно лежащие белки — периферические.
Белки принимают участие в:
- Поддержании постоянства структуры мембраны
- Рецепции сигналов из окружающей среды (химического раздражения)
- Транспорте веществ через мембрану
- Ускорении (катализе) реакций, которые ассоциированы с мембраной
Интегральные (пронизывающие) белки образуют каналы, по которым молекулы различных веществ могут поступать в клетку или удаляться из нее. «Заякоренные» молекулы олигосахаридов на поверхности клетки образуют гликокаликс, который выполняет рецепторную функцию, участвует в избирательном транспорте веществ через мембрану.
Теперь вы знаете, что гликокаликс — надмембранный комплекс, совокупность клеточных рецепторов, которые нужны клетке для восприятия регуляторных
сигналов биологически активных веществ (гормонов, гормоноподобных веществ). Гормон избирателен, специфичен и присоединяется
только к своему рецептору: меняется конформация молекулы рецептора и обмен веществ в клетке. Так гормоны
регулируют жизнедеятельность клеток.
Гормон избирателен, специфичен и присоединяется
только к своему рецептору: меняется конформация молекулы рецептора и обмен веществ в клетке. Так гормоны
регулируют жизнедеятельность клеток.
Вирусы и бактерии не являются исключением: они взаимодействуют только с теми клетками, на которых есть подходящие к ним рецепторы. Так, вирус гриппа поражает преимущественно клетки слизистой верхних дыхательных путей. Однако, если рецепторов нет, то вирус не может проникнуть в клетку, и организм приобретает невосприимчивость к инфекции. Вспомните врожденный иммунитет: именно по причине отсутствия рецепторов человек не восприимчив ко многим болезням животных.
Итак, вернемся к клеточной мембране. Ее можно сравнить со стенами помещения, в котором, вероятно, вы находитесь. Стены дома защищают
его от ветра, дождя, снега и прочих факторов внешней среды.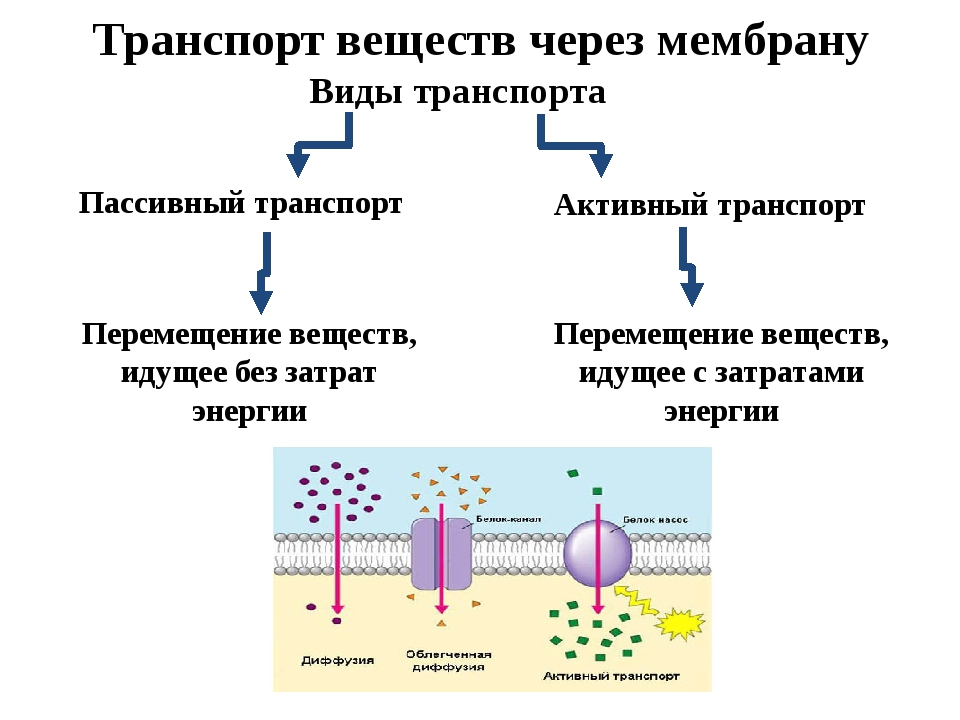 Рискну предположить, что в вашем доме есть окна и двери, которые
по мере необходимости открываются и закрываются 🙂 Так и клеточная мембрана может сообщать внутреннюю среду клетки с внешней средой:
через мембрану вещества поступают в клетку и удаляются из нее.
Рискну предположить, что в вашем доме есть окна и двери, которые
по мере необходимости открываются и закрываются 🙂 Так и клеточная мембрана может сообщать внутреннюю среду клетки с внешней средой:
через мембрану вещества поступают в клетку и удаляются из нее.
Подведем итоги. Клеточная мембрана выполняет ряд важнейших функций:
- Разделительная (барьерная) — образует барьер между внешней средой и внутренней средой клетки (цитоплазмой с органоидами)
- Поддержание обмена веществ между внешней средой и цитоплазмой
- Транспортная
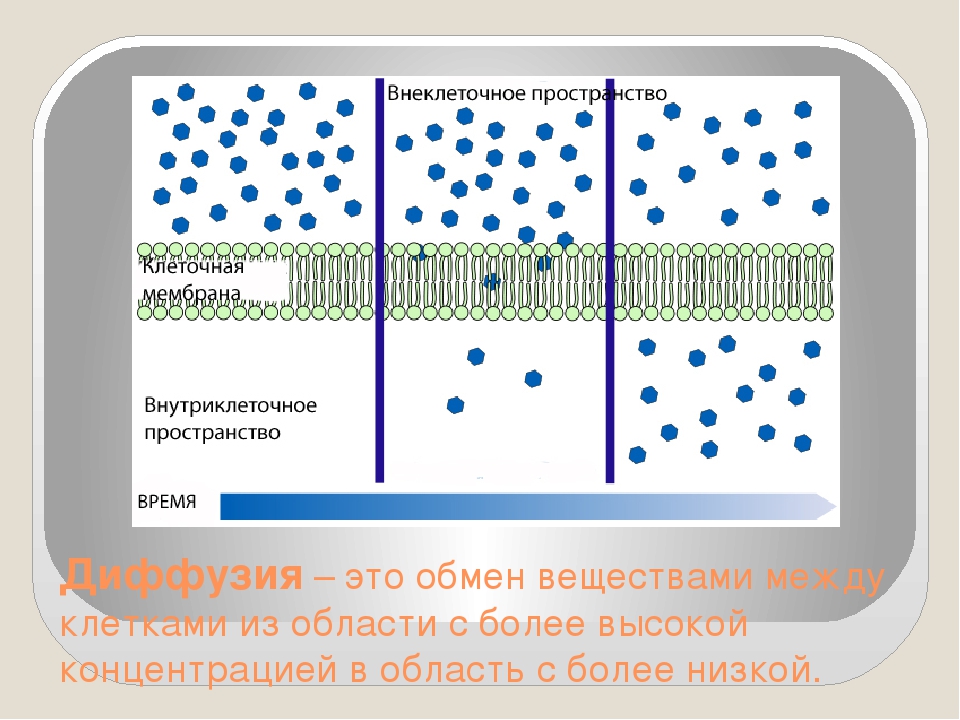
- Пассивный — часто идет по градиенту концентрации, без затрат АТФ (энергии). Возможен путем осмоса, простой диффузии или облегченной (с участием белка-переносчика) диффузии.
- Активный
Через мембрану по каналам кислород и питательные вещества поступают в клетку, а продукты жизнедеятельности — мочевина — удаляются из клетки во внешнюю среду.
Тесно связана с обменом веществ, однако здесь мне особенно хочется подчеркнуть варианты транспорта веществ через клетку.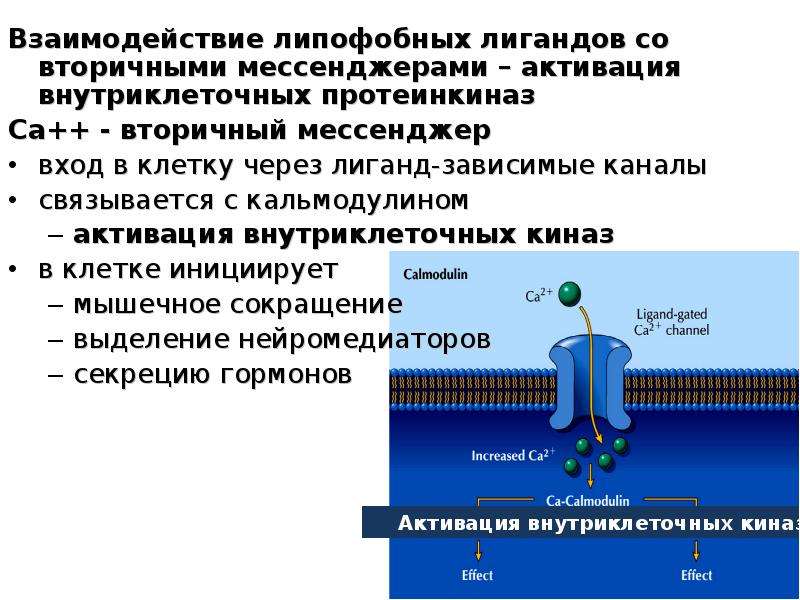 Выделяется два вида транспорта:
Выделяется два вида транспорта:
Внутрь клетки с помощью осмоса поступает вода. Путем простой диффузии в клетку попадают O2, H2O, CO2, мочевина. Облегченная диффузия характерна для транспорта глюкозы, аминокислот.
Активный транспорт чаще происходит против градиента концентрации, в ходе него используются белки-переносчики и
энергия АТФ. Ярким примером является натрий-калиевый насос, который накачивает ионы калия внутрь клетки, а ионы
натрия выводит наружу. Это происходит против градиента концентрации, поэтому без затрат энергии (АТФ) не обойтись.
Внутрь клетки крупные молекулы попадают путем эндоцитоза (греч. endo — внутрь) двумя путями:
- Фагоцитоз (греч. phago — ем + cytos — клетка) — поглощение твердых пищевых частиц и бактерий фагоцитами
- Пиноцитоз (греч. pino — пью) — поглощение клеткой жидкости, захват жидкости клеточной поверхностью
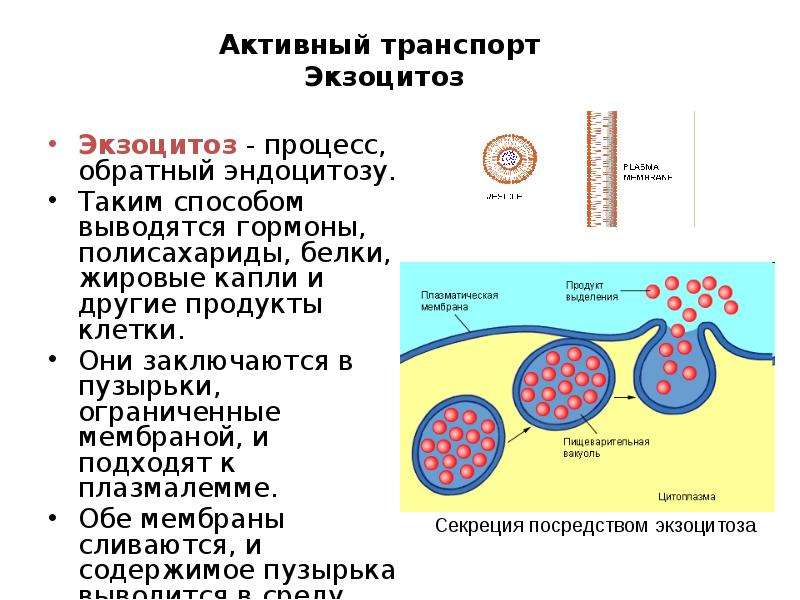
Фагоцитоз был открыт И.И. Мечниковым, который создал фагоцитарную теорию иммунитета. Это теория гласит, что в основе иммунной системы нашего организма лежит явление фагоцитоза: попавшие в организм бактерии уничтожаются фагоцитами (T-лимфоцитами), которые переваривают их.
В ходе эндоцитоза мембрана сильно прогибается внутрь клетки, ее края смыкаются, захватывая бактерию, пищевые частицы или жидкость внутрь клетки. Образуется везикула (пузырек), который движется к пищеварительной вакуоли или лизосоме, где происходит внутриклеточное пищеварение.
Клетки многих органов, к частности эндокринных желез, которые выделяют в кровь гормоны, транспортируют синтезированные вещества к мембране и удаляют их из клетки с помощью экзоцитоза (от др.-греч. ἔξω — вне, снаружи). Таким образом, процессы экзоцитоза и эндоцитоза противоположны.
Клеточная стенка
Расположена снаружи клеточной мембраны. Присутствует только в клетках бактерий, растений и грибов, у животных отсутствует. Придает клетке определенную форму, направляет ее рост, придавая характерное строение всему организму. Клеточная стенка бактерий состоит из полимера муреина, у грибов — из хитина, у растений — из целлюлозы.
Цитоплазма
Органоиды клетки расположены в цитоплазме, которая состоит из воды, питательных веществ и продуктов обмена. В цитоплазме происходит постоянный ток веществ: поступившие в клетку вещества для расщепления необходимо доставить к органоидам, а побочные продукты — удалить из клетки.
Постоянное движение цитоплазмы поддерживает связь между органоидами клетки и обеспечивает ее целостность.
Прокариоты и эукариоты
Прокариоты (греч. πρό — перед и κάρυον — ядро) или доядерные — одноклеточные организмы, не обладающие в отличие от эукариот оформленным ядром и мембранными органоидами. У прокариот могут обнаруживаться только немембранные органоиды. Их генетический материал представлен в виде кольцевой молекулы ДНК — нуклеоида. К прокариотам относятся бактерии, в их числе цианобактерии (цианобактерий по-другому называют — сине-зеленые водоросли).
Эукариоты (греч. εὖ — хорошо + κάρυον — ядро) или ядерные — домен живых организмов, клетки которых содержат оформленное ядро. Растения, животные, грибы — относятся к эукариотам.
Немембранные органоиды
- Рибосома
- Микротрубочки и микрофиламенты
- Клеточный центр (центросома, от греч. soma — тело)
- Реснички и жгутики
Очень мелкая органелла (около 20 нм), которая была открыта после появления электронного микроскопа. Состоит из двух субъединиц: большой и малой, в состав которых входят белки и рРНК (рибосомальная РНК), синтезируемая в ядрышке.
Запомните ассоциацию: «Рибосома — фабрика белка». Именно здесь в ходе матричного биосинтеза — трансляции, с которой подробнее мы познакомимся в следующих статьях, на базе иРНК (информационной РНК) синтезируется белок — последовательность соединенных аминокислот в заданном иРНК порядке.
Микротрубочки являются внутриклеточными белковыми производными, входящими в состав цитоскелета. Они поддерживают определенную форму клетки, участвуют во внутриклеточном транспорте и процессе деления путем образования нитей веретена деления. Микротрубочки также образуют основу органоидов движения: жгутиков (у бактерий жгутик состоит из сократительного белка — флагеллина) и ресничек.
Микрофиламенты — тонкие длинные нитевидные структуры, состоящие из белка актина. Встречаются во всей цитоплазме, служат для создания тока цитоплазмы, принимают участие в движении клетки, в процессах эндо- и экзоцитоза.
Этот органоид характерен только для животной клетки, в клетках грибов и высших растений отсутствует. Клеточный центр состоит из 9 триплетов микротрубочек (триплет — три соединенных вместе). Участвует в образовании нитей веретена деления, располагается на полюсах клетки.
Это органоиды движения, которые выступают над поверхностью клетки и имеют в основе пучок микротрубочек. Реснички встречаются только в клетках животных, жгутики можно обнаружить у животных, растений и бактерий.
Одномембранные органоиды
- Эндоплазматическая сеть (ЭПС), эндоплазматический ретикулум (лат. reticulum — сеть)
- Комплекс (аппарат) Гольджи
- Лизосома (греч. lisis — растворение + soma — тело)
- Пероксисомы (лат. per — сверх, греч. oxys — кислый и soma — тело)
- Вакуоли
ЭПС представляет собой систему мембран, пронизывающих всю клетку и разделяющих ее на отдельные изолированные части (компартменты). Это крайне важно, так как в разных частях клетки идут реакции, которые могут помешать друг другу, что нарушит процессы жизнедеятельности.
Выделяют гладкую ЭПС и шероховатую ЭПС. Обе они выполняют функцию внутриклеточного транспорта веществ, однако между ними имеются различия. На мембранах гладкой ЭПС происходит синтез липидов, обезвреживаются вредные вещества. Шероховатая ЭПС синтезирует белок, так как имеет на мембранах многочисленные рибосомы (потому и называется шероховатой).
Комплекс Гольджи состоит из трубочек, сети уплощенных канальцев (цистерн) и связанных с ними пузырьков. Располагается вокруг ядра клетки, внешне напоминает стопку блинов. Это — «клеточный склад». В нем запасаются жиры и углеводы, с которыми здесь происходят химические видоизменения.
Модифицированные вещества упаковываются в пузырьки и могут перемещаться к мембране клетки, соединяясь с ней, они изливают свое содержимое во внешнюю среду. Можно догадаться, что комплекс Гольджи хорошо развит в клетках эндокринных желез, которые в большом количестве синтезируют и выделяют в кровь гормоны.
В комплексе Гольджи появляются первичные лизосомы, которые содержат ферменты в неактивном состоянии.
Представляет собой мембранный пузырек, содержащий внутри ферменты (энзимы) — липазы, протеазы, фосфатазы. Лизосому можно ассоциировать с «клеточным желудком».
Лизосома участвует во внутриклеточном пищеварении поступивших в клетку веществ. Сливаясь с фагосомой, первичная лизосома превращается во вторичную, ферменты активируются. После расщепления веществ образуется остаточное тельце — вторичная лизосома с непереваренными остатками, которые удаляются из клетки.
Лизосома может переварить содержимое фагосомы (самое безобидное), переварить часть клетки или всю клетку целиком. В норме у каждой клетки жизненный цикл заканчивается апоптозом — запрограммированным процессом клеточной гибели.
В ходе апоптоза ферменты лизосомы изливаются внутрь клетки, ее содержимое переваривается. Предполагают, что нарушение апоптоза в раковых клетках ведет к бесконтрольному росту опухоли.
Пероксисомы (микротельца) содержат окислительно-восстановительные ферменты, которые разлагают H2O2 (пероксид водорода) на воду и кислород. Если бы пероксид водорода оставался неразрушенными, это приводило бы к серьезным повреждениям клетки.
Вакуоли характерны для растительных клеток, однако встречаются и у животных (у одноклеточных — сократительные вакуоли). У растений вакуоли выполняют другие функции и имеют иное строение: они заполняются клеточным соком, в котором содержится запас питательных веществ. Снаружи вакуоль окружена тонопластом.
Трудно переоценить значение вакуолей в жизнедеятельности растительной клетки. Вакуоли создают осмотическое давление, придают клетке форму.
Примечательно, что по размеру вакуолей можно судить о возрасте клетки: молодые клетки имеют вакуоли небольшого размера, а в старых клетках вакуоли могут настолько увеличиваться, что оттесняют ядро и остальные органоиды на периферию.
Двумембранные органоиды
- Ядро («ядро» по лат. — nucleus, по греч. — karyon)
- Митохондрия
- Пластиды (др.-греч. πλαστός — вылепленный)
- Хлоропласт (греч. chlōros — зелёный)
- Хромопласты (греч. chromos – краска)
- Лейкопласты (др.-греч. λευκός — белый )
Важнейший компонент эукариотической клетки — оформленное ядро, которое у прокариот отсутствует. Внутренняя часть ядра представлена кариоплазмой, в которой расположен хроматин — комплекс ДНК, РНК и белков, и одно или несколько ядрышек.
Ядрышко — место в ядре, где активно идет процесс матричного биосинтеза — транскрипция, с которым мы познакомимся подробнее в следующих статьях. В течение дня, наблюдая за одной и той же клеткой, можно увидеть разное количество ядрышек или не найти ни одного.
Оболочка ядра состоит из двух мембран и пронизана большим количеством ядерных пор, через которые происходит сообщение между кариоплазмой и цитоплазмой. Главными функциями ядра является хранение, защита и передача наследственного материала дочерним клеткам.
Замечу, что хромосомы видны только в момент деления клетки. Хромосомы представляют собой сильно спирализованные молекулы ДНК, связанные с белками.
Я всегда рекомендую ученикам ассоциировать хромосому с мотком ниток: если все нитки обмотать вокруг одной оси, то они становятся мотком и хорошо видны (хромосомы — во время деления, спирализованное ДНК), если же клетка не делится, то нитки размотаны и разбросаны в один слой, хромосом не видно (хроматин — деспирализованное ДНК).
Хромосомы отличаются друг от друга по строению, форме, размерам. Совокупность всех признаков (форма, число, размер) хромосом называется кариотип. Кариотип может быть представлен по-разному: существует кариотип вида, особи, клетки.
Изучая кариотип человека, врач-генетик может обнаружить различные наследственные заболевания, к примеру, синдром Дауна — трисомия по 21-ой паре хромосом (должно быть 2 хромосомы, однако при синдроме Дауна их три).
Органоид палочковидной формы. Митохондрию можно сравнить с «энергетической станцией». Если в цитоплазме происходит анаэробный этап дыхания (бескислородный), то в митохондрии идет более совершенный — аэробный этап (кислородный). В результате кислородного этапа (цикла Кребса) из двух молекул пировиноградной кислоты (образовавшихся из 1 глюкозы) получаются 36 молекул АТФ.
Митохондрия окружена двумя мембранами. Внутренняя ее мембрана образует выпячивания внутрь — кристы, на которых имеется большое скопление окислительных ферментов, участвующих в кислородном этапе дыхания. Внутри митохондрия заполнена матриксом.
Запомните, что особенностью этого органоида является наличие кольцевой молекулы ДНК — нуклеоида, и рибосом. То есть митохондрия обладает собственным генетическим материалом и возможностью синтеза белка, почти как отдельный организм.
В связи с этим, митохондрия считается полуавтономным органоидом. Вероятнее всего, изначально митохондрии были самостоятельными организмами, однако со временем вступили в симбиоз с эукариотами и стали частью клетки.
Митохондрий особенно много в клетках мышц, в том числе — в сердечной мышечной ткани. Эти клетки выполняют активную работу и нуждаются в большом количестве энергии.
Двумембранные органоиды, встречающиеся только в клетках высших растений, водорослей и некоторых простейших. У подавляющего большинства животных пластиды отсутствуют. Подразделяются на три типа:
Получил свое название за счет содержащегося в нем зеленого пигмента — хлорофилла (греч. chloros — зеленый и phyllon — лист). Под двойной мембраной расположены тилакоиды, которые собраны в стопки — граны. Внутреннее пространство между тилакоидами и мембраной называется стромой.
Запомните, что светозависимая (световая) фаза фотосинтеза происходит на мембранах тилакоидов, а темновая (светонезависимая) фаза — в строме хлоропласта за счет цикла Кальвина. Это очень пригодится при изучении фотосинтеза в дальнейшем.
Так же, как и митохондрии, пластиды относятся к полуавтономным органоидам: в них имеется кольцевидная ДНК — нуклеоид, рибосомы.
Пластиды, которые содержат пигменты каратиноиды в различных сочетаниях. Сочетание пигментов обуславливает красную, оранжевую или желтую окраску. Находятся в плодах, листьях, лепестках цветков.
Хромопласты могут развиваться из хлоропластов: во время созревания плодов хлоропласты теряют хлорофилл и крахмал, в них активируется биосинтез каротиноидов.
Не содержат пигментов, образуются в запасающих частях растения (клубни, корневища). В лейкопластах накапливается крахмал, липиды (жиры), пептиды (белки). На свету лейкопласты могут превращаться в хлоропласты и запускать процесс фотосинтеза.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Роль минеральных веществ в обменных процессах и их влияние на здоровье человека
Минеральные вещества оказывают многообразное воздействие на жизнедеятельность организма. Они входят в состав ферментов и гормонов, участвуют во всех видах обмена веществ, активизируют действие витаминов, используются в качестве пластического материала в опорных тканях (костях, хрящах, зубах), участвуют в процессах кроветворения и свертывания крови, в регуляции вводно-солевого обмена, обеспечивают нормальное функционирование мышечной, сердечно-сосудистой и пищеварительной систем.
Минеральные вещества, встречающиеся в пищевых продуктах, можно разделить на две группы.
Макроэлементы — минеральные вещества, содержащиеся в пищевых продуктах в значительных количествах. Основными макроэлементами в продуктах питания человека являются кальций, фосфор, магний, натрий, хлор, калий, сера.
Микроэлементы — минеральные вещества, содержащиеся в пищевых продуктах в очень малых количествах. К ним относятся: железо, кобальт, медь, йод, фтор, цинк, марганец, бром, алюминий, силиций, хром, никель, литий и др.
Высокое содержание в продуктах кальция, калия и натрия определяет их щелочную ориентацию (молочные продукты, овощи, фрукты, ягоды, бобовые), а мясо, рыба, яйца, хлеб, крупы, содержащие фосфор, серу и хлор -кислую.
В зависимости от содержания минеральных веществ в организме человека и потребности в них также различают микроэлементы и макроэлементы. За исключением кальция, фосфора, железа и йода организм человека не располагает запасами минеральных элементов. Эти элементы незаменимы, так как не образуются в организме.
Каждый из минеральных элементов имеет определенное функциональное значение.
Макроэлементы
Кальций входит в состав минерального компонента костной ткани — оксиапатита, микрокристаллы которого образуют жесткую структуру костной ткани, выполняющей защитно-опорную функцию. Кальций придает стабильность клеточным мембранам — наружной оболочке клеток; обеспечивает прочность межклеточных связей. Кальций необходим для нормальной возбудимости нервной системы и сократимости мышц, является важнейшим компонентом свертывающей системы крови.
Всасывание кальция происходит в тонкой кишке с участием особых транспортных механизмов, обеспечивающих возможность его переноса из просвета кишечника в кровоток. При этом всасывание кальция зависит от обеспеченности организма витамином D, который необходим для нормального функционирования систем транспорта кальция в тонкой кишке.
Кальций относится к трудноусвояемым минеральным элементам, что обусловлено его содержанием в пищевых продуктах совместно с другими минеральными компонентами — фосфором, магнием, а также с белками и жирами. Всасыванию кальция способствуют белки пищи, лимонная кислота и лактоза (молочный сахар). К факторам, затрудняющим всасывание кальция и способным нарушить его утилизацию, относится избыточное содержание в пище фитиновой кислоты (ею богаты рожь, пшеница, овес и пищевые продукты, полученные из этих злаков), фосфатов (продукты с очень высоким содержанием фосфора: шоколад, икра, мясо, рыба морская), жиров, щавелевой кислоты (некоторые овощи, фрукты).
Основными источниками кальция являются молоко и молочные продукты, яичные желтки, овощи, фрукты.
Фосфор участвует в построении всех клеточных элементов организма человека, особенно костной и мозговой тканей, участвует в процессах обмена белков, жиров и углеводов. Фосфор незаменим в деятельности мозга, скелетной и сердечной мускулатуры, в образовании ряда гормонов и ферментов.
Основными источниками фосфора служат молочные продукты, особенно сыры, а также яйца, рыба, мясо, бобовые.
Магний принимает участие в процессах углеводного, белкового и фосфорного обмена. Соединения магния обладают антиспастическими и сосудорасширяющими свойствами, понижают возбудимость центральной нервной системы, а также усиливают желчеотделение и моторную деятельность кишечника.
Основными источниками магния в питании являются хлеб (особенно грубого помола), крупы, бобовые.
Натрий необходим для протекания процессов внутриклеточного и межклеточного обмена, для обеспечения электролитного и кислотно-щелочного равновесия. Известно, что увеличение содержания в пище хлористого натрия (поваренной соли) ведет к задержке воды в организме и отекам. Пищевые продукты, особенно растительные, бедны натрием. Поступление натрия в организм в основном осуществляется за счет поваренной соли, добавляемой к пище.
Хлор играет важную роль в жизнедеятельности человеческого организма, особенно в регуляции водного обмена. Хлориды являются источником образования железами желудка соляной кислоты. В пищевых продуктах, особенно растительных, хлор содержится в незначительных количествах. У человека потребность в хлоридах удовлетворяется в основном за счет поваренной соли, добавляемой к пище.
Калий участвует в ферментативных процессах организма. Калий является преимущественно внутриклеточным ионом. Взаимодействие его с внеклеточными ионами натрия имеет большое значение в регуляции водного обмена. Организм очень чувствителен к уменьшению концентрации калия в крови (гипокалиемия). Оно вызывает сонливость, мышечную слабость, потерю аппетита, тошноту, рвоту, уменьшение мочеотделения, расширение сердца, нарушение сердечного ритма, снижение кровяного давления и другие изменения. Источником калия в пище являются в основном продукты растительного происхождения: хлеб, бобовые, картофель, капуста, морковь, фрукты. Максимальное содержание калия — в кондитерских изделиях, какао, миндале, земляных орехах (арахисе), изюме, кураге, черносливе.
Сера входит в состав некоторых аминокислот — основного структурного материала для синтеза белков, ферментов, гормонов (инсулина), витаминов (В1). Она играет важную роль в процессах окисления и восстановления, а также в обезвреживании токсических продуктов обмена путем образования с ними в печени неядовитых химических соединений. Источником серы в пище служат мясо, рыба, сыры, яйца, бобовые, хлеб, крупы.
Микроэлементы
Железо является составной частью гемоглобина, сложных железо-белковых комплексов и ряда ферментов, усиливающих процессы дыхания в клетках. Железо стимулирует кроветворение.
Основным источником железа служат зерновые продукты, бобовые, яйца, творог, печень. В овощах, фруктах, ягодах железа сравнительно мало, но они служат ценным источником этого минерала, так как содержащееся в них железо легко усваивается организмом человека.
Всасыванию железа из пищевых продуктов способствуют лимонная и аскорбиновая кислоты и фруктоза, которые содержатся во фруктах, ягодах, соках. Так, при питье фруктового сока увеличивается усвоение железа из яиц и хлеба. В зерновых и бобовых продуктах и некоторых овощах содержатся фосфаты, фитины и щавелевая кислота, препятствующие всасыванию железа. При добавлении мяса или рыбы к этим продуктам усвоение железа улучшается, при добавлении молочных продуктов — не меняется, при добавлении яиц — ухудшается. Подавляет усвоение железа крепкий чай.
Кобальт — неизменная составляющая растительных и животных организмов. Он оказывает существенное влияние на процессы кроветворения. Это воздействие кобальта наиболее ярко выражено при достаточно высоком содержании в организме железа и меди. Кобальт активирует ряд ферментов, усиливает синтез белков, участвует в выработке витамина В12 и в образовании инсулина. Содержание кобальта в различных пищевых продуктах незначительно. Однако обычно смешанные пищевые рационы вполне удовлетворяют потребность организма в кобальте. Кобальт содержится в незначительных количествах в мясе, рыбе, яйцах, молочных продуктах, картофеле, воде. Более богаты кобальтом печень, почки, свекла, горох, земляника, клубника.
Медь входит в состав окислительных ферментов, участвующих в тканевом дыхании, в обмене белков, жиров и углеводов. Она влияет на функциональное состояние печени, щитовидной и других эндокринных желез, на иммунные процессы.
Йод участвует в образовании гормона щитовидной железы — тироксина. При недостаточном поступлении в организм йода нарушаются функции щитовидной железы, а впоследствии меняется и ее структура — вплоть до развития так называемого эндемического зоба. В организм йод поступает с пищей, водой и воздухом, однако он присутствует в них в очень небольших количествах. Больше всего йода содержится в морской воде, в растительных и животных продуктах моря.
Фтор – участвует в костеобразовании, формировании твердых тканей зубов и зубной эмали. Фтор поступает в организм человека в основном с питьевой водой. Оптимальной концентрацией фтора в питьевой воде является 0,5-1,2 мг на литр. При значительном снижении его уровня в воде (менее 0,5 мг на литр) развиваются явления недостаточности фтора, выражающиеся в резком учащении заболеваний зубным кариесом. В целях профилактики в соответствующих случаях фторирование питьевой воды с доведением содержания в ней фтора до 0,7-1,2мг на литр.
Цинк содержится во всех органах и тканях человека. Наибольшая его концентрация выявлена в клетках поджелудочной железы, вырабатывающих гормон инсулин. Цинк участвует также в жировом, белковом и витаминном обмене, в процессах кроветворения и синтезе ряда гормонов.
Обычный набор пищевых продуктов, включающий достаточное количество овощей, фруктов, хлеба и молока, удовлетворяет потребности организма человека во всех необходимых ему минеральных веществах.
Внутриклеточный транспорт — обзор
Цитоскелет определяет положение органелл внутри клетки
Внутриклеточный транспорт молекул и органелл отвечает за их доставку в места назначения. Поскольку транспорт происходит в основном по микротрубочкам, важно, чтобы свободный (положительный) конец микротрубочек находил правильное место назначения. Микротрубочки — это динамические полимеры, которые постоянно растут или укорачиваются в длину, чтобы исследовать и исследовать многие области клетки случайным образом.Эта динамическая структура сохраняется во всем живом мире. У одноклеточных это позволяет клеткам адаптировать свою форму и формировать придатки (псевдоподы, реснички и жгутики), а у многоклеточных — определять форму от десятков до сотен различных типов клеток в процессе дифференцировки клеток. Интересно отметить, что в одноклеточных клетках с постоянной формой клеток деполимеризующие препараты оказывают незначительное влияние на микротрубочки (Heidemann et al., 1985). При необходимости эти клетки могут в значительной степени стабилизировать полимерную структуру своих микротрубочек.Процесс дифференциальной стабилизации их структуры известен как избирательная стабилизация (Kirschner, Mitchison, 1986; Mitchison, Kirschner, 1985).
Расположение органелл в клетке зависит от вида и поддерживается в различных внутренних и внешних условиях. Это означает, что за строгое определение расположения органелл в клетке отвечает какая-то информация. У делящихся дрожжей положение митохондрий зависит от динамики микротрубочек, а не от моторных белков (Pon, 2011), и даже морфология митохондрий и аппарата Гольджи зависит от микротрубочек (Höög, 2003).Положение аппарата Гольджи в клетках растений определяется организацией актинового цитоскелета (Akkerman et al., 2011). Похоже, что микротрубочки каким-то образом ищут и находят подходящее место для транспортировки и размещения молекул, супрамолекулярных компонентов и органелл. Напр., Актиновые филаменты ответственны за основанный на миозине транспорт мембранных органелл, и динамика этих филаментов важна для их транспорта (Semenova et al., 2008) и для определения их предназначения.Микротрубочки тесно связаны с транспортом пероксисом, а деполимеризация микротрубочек вызывает накопление пероксисом в середине клетки, предотвращая их транспорт (Rapp et al., 1996), тогда как актиновый цитоскелет может участвовать в определении размера пероксисом, формы , число и кластеризация (Schollenberger et al., 2010). У дрожжей актиновый цитоскелет регулирует разделение органелл и их перемещение к почке (Catlett and Weisman, 2000). В случае меланосом — гранулы пигмента, в которых меланин синтезируется и хранится (Wasmeier et al., 2008), их дисперсия связана с расширением микротрубочек, которые посредством кинезинов перемещают меланосомы от ядра по всей клетке; и обратное происходит, когда микротрубочки сокращаются (Ikeda et al., 2011). Недавние доказательства показывают, что дисперсия и агрегация меланосом связаны с увеличением и уменьшением (соответственно) количества микротрубочек, зарождающихся в центросомах (Lomakin et al., 2011). Об этом свидетельствует тот факт, что экспериментальное ингибирование роста микротрубочек предотвращает агрегацию меланосом в перицентриолярной области (Lomakin et al., 2009). Во время агрегации пигментов наблюдается, что растущие (плюс) концы микротрубочек захватывают меланосомы (Lomakin et al., 2009).
Микротрубочки участвуют в экзоцитозе и транспорте гормонов, нейротрансмиттеров и нейротрофинов через везикулы от аппарата Гольджи к актиновому цитоскелету в месте клеточных мембран, где эти вещества выделяются (Park and Loh, 2008) (рис. 1.15) .
Рисунок 1.15. Этапы для транспорта везикул, регулируемых пост-Гольджи секреторным путем (RSP), к месту высвобождения.В транспортировку гормоносодержащих везикул от места биогенеза в сети транс-Гольджи (TGN) к месту высвобождения в RSP участвуют несколько этапов. (а) почкование пузырьков; (б) транспорт на основе микротрубочек; (c) транспорт на основе актина; (d) связывание пузырьков; (e) стыковка; и (f) слияние с плазматической мембраной. Эти шаги имеют некоторые общие черты с движением конститутивных секреторных пузырьков, но также есть различия (Park and Loh, 2008).
Изучение механизма регуляции жизненно важных функций клетки и отдельных органелл может помочь пролить некоторый свет на смутную в настоящее время картину системы контроля одноклеточных.Адекватные данные наблюдений показывают, что все стадии клеточного цикла, как в одноклеточных, так и в многоклеточных, находятся под контролем и регуляцией цитоскелета (см. Ниже и главу 2, раздел «Регулирование длины микротрубочек — ключ к транспорту материнских детерминант в организме»). Ооцит »).
Эндоплазматическая сеть, аппарат Гольджи и лизосомы
Мембраны и составляющие их белки собираются в ER. Эта органелла содержит ферменты, участвующие в синтезе липидов, и, поскольку липиды производятся в ER, они вставляются в собственные мембраны органелл.Отчасти это происходит потому, что липиды слишком гидрофобны, чтобы растворяться в цитоплазме.
Точно так же трансмембранные белки имеют достаточно гидрофобных поверхностей, чтобы они также встраивались в мембрану ER, пока они все еще синтезируются. Здесь будущие мембранные белки попадают в мембрану ЭР с помощью сигнальной последовательности во вновь транслированном белке. Сигнальная последовательность останавливает трансляцию и направляет рибосомы, несущие незавершенные белки, на стыковку с белками ER до завершения своей работы.Затем трансляция возобновляется после стыковки сигнальной последовательности с ER и происходит внутри мембраны ER. Таким образом, к тому времени, когда белок достигает своей окончательной формы, он уже вставлен в мембрану (рис. 1).
Белки, которые будут секретироваться клеткой, также направляются в ER во время трансляции, где они попадают в просвет , во внутреннюю полость , где они затем упаковываются для везикулярного высвобождения из клетки. Гормоны инсулин и эритропоэтин (ЭПО) являются примерами везикулярных белков.
Рисунок 1: Ко-трансляционный синтез
Сигнальная последовательность на растущем белке будет связываться с частицей распознавания сигнала (SRP). Это замедляет синтез белка. Затем SRP связывается с местом на поверхности ближайшего ER. Затем SRP высвобождается, и комплекс белок-рибосома оказывается в правильном месте для движения белка через канал транслокации.
Как моторные белки транспортируют груз по цитоскелету?
Наряду с обеспечением структурной поддержки клетки и передачей сигналов силы цитоскелетные филаменты также обеспечивают клетки сетью «треков», по которым могут следовать специфические белки для направленной доставки везикул и их субклеточного «груза». Этот процесс важен для обеспечения адекватной концентрации требуемых компонентов в участках, подвергающихся быстрой или модуляции, или там, где осуществляется определенный субклеточный процесс.Например, расширение филоподий во время миграции клеток требует множества компонентов и происходит быстро, но имеет ограниченный доступ к цитоплазме и любым растворимым компонентам.
Cargo, который может быть доставлен или с помощью цитоскелетно-зависимых механизмов внутриклеточного транспорта, может включать другие белки и сложные компоненты. Этот процесс доставки аналогичен грузовому поезду, перевозящему груз в определенные места, что продиктовано наличием железнодорожных путей. Как и в случае с грузовым поездом, моторные белки, способные перевозить грузы, также сталкиваются с ограничениями в отношении направления, в котором они могут двигаться, скорости, с которой они движутся, и вероятности возникновения пробок на маршруте.
Миозин-X транспортирует груз по актиновым филаментам
Известно, что специфические члены суперсемейства моторных белков Myosin транспортируют груз по актиновым филаментам. Миозин-V и миозин-X — два примера. Хотя специфика их движения различна, концепция та же, и ее можно понять, если рассмотреть, как Myosin-X транспортирует компоненты по длине растущих филоподий.
Размер шага миозина-X соответствует одному витку спирали актинового филамента.Сайты связывания представлены мономерами актина красного и синего цвета. На этом рисунке мы видим, как Myosin-X может шагать вперед и назад (A), а также горизонтально между нитями (B)
Транспорт компонентов по филоподиальным стержням является критическим для непрерывного роста актиновых филаментов и образования спаек на концах филоподий. Миозин-X облегчает транспортировку компонентов из тела клетки к кончикам филоподий, что приводит к их интеграции в клеточную мембрану в качестве рецепторов / адгезий или их использованию в росте актиновых нитей и филоподий [1] [2] [3] [4] ] [5].
Движение миозина-X управляется гидролизом АТФ по уникальному механизму, напоминающему ходьбу или шаг. Это движение, как известно, происходит преимущественно на актиновых пучках, а не на отдельных актиновых филаментах [6] [7]. Хотя это, по сути, движение вперед, данные указывают на то, что белок также может совершать побочные действия. Это может быть выполнено как средство преодоления препятствий или дефектов на пути [7].
Механизм ходьбы миозина-X, как известно, отличается от других ходячих миозинов, таких как миозин-V ;.Это особенно важно для размера шага и предпочтения специфических связывающих актин белков [7]. В то время как миозин-V принимает шаги по 36 нм и следует за отдельными филаментами, а не по сторонам вдоль параллельных филаментов пучка, миозин-X принимает более короткие шаги, которые были измерены при длине волны 17,5 нм [6] [7]. Это более короткое шаговое расстояние может объяснить, почему миозин-X использует сайты связывания на параллельных филаментах, поскольку короткий шаг на одиночном филаменте может привести к вращению белка вокруг естественного скручивания филамента [7].
Крепление груза
Myosin-X способен переносить различные грузы до кончиков филоподий [1] [2] [3] [4]. Хотя точный механизм, с помощью которого миозин-X выбирает груз, остается неясным, хорошо известно, что распознавание и связывание груза является результатом присутствия доменов с гомологией 4 миозинового хвоста (MyTh5) и доменов эзрин / радиксин / моэзин (FERM) — вместе они известны. как кассета MyTh5-FERM [8].
Ряд компонентов, необходимых для роста и функционирования филоподий, переносится миозином-X, включая β-интегрин [3].β-интегрин необходим для формирования очаговой адгезии и связывается с миозином-X через домен FERM. Было показано, что нокдаун миозина-X siRNA нарушает образование адгезии к коллагену I, особенно в ранние моменты времени, без разрушения через 60 минут. Это подчеркивает важность миозина-X на начальных стадиях формирования адгезии, опосредованной интегрином [3].
Другой груз, переносимый миозином-X, включает неогенин и «удаленный при колоректальном раке» (DCC), которые функционируют как рецепторы нетрина.Кроме того, DCC прикрепляет механизм трансляции, такой как рибосомы, к мембранам конусов роста нейронов и дендритов [8] [4].
Кинезин транспортирует груз по микротрубочкам
В то время как семейство белков миозина транспортирует груз вдоль актиновых филаментов, другая группа белков использует микротрубочки для облегчения аналогичного процесса. Здесь мы рассматриваем суперсемейство кинезинов.
Белок кинезина содержит головной домен, который связывается с микротрубочками, стеблевую область, где два мономера кинезина взаимодействуют и димеризуются, и домен связывания груза, который позволяет белку облегчать цитоскелет-зависимый внутриклеточный транспорт.
Суперсемейство белков кинезинов представляет собой большой класс моторных белков, которые переносят груз по микротрубочкам. Семейство кинезинов включает по меньшей мере 45 изоформ только у человека. Эти белки функционально подобны членам семейства миозина, таким как миозин V или миозин-X, которые транспортируют материал по актиновым филаментам. Микротрубочки обычно намного длиннее актиновых филаментов, и поэтому кинезин может транспортировать груз на значительно большие расстояния, чем миозины [9].В неактивном состоянии кинезины существуют в виде мономеров, каждый из которых обладает N-концевой головкой (моторной областью), шейным линкером и глобулярным хвостовым доменом. Между шейным линкером и хвостовым доменом находится длинная спиральная спираль, которая служит сайтом димеризации, который будет скручиваться вместе с соответствующим сайтом другого мономера с образованием активного димера кинезина [9].
Кинезин Powerstroke
Обычные кинезины перемещаются по филаментам микротрубочек способом, напоминающим ходьбу человека.Это было описано как асимметричный «переключаемый» механизм, при котором одна область головки смещается вперед на ~ 16,2 нм, в то время как другая головка остается неподвижной.
Головной домен кинезина связывается с микротрубочками. Каждый шаг включает перемещение задней головки к сайту связывания на 16 нм впереди предыдущего сайта. Тогда он считается ведущим.
Для каждого шага, предпринимаемого головными доменами, груз перемещается на 8,1 нм по длине нити [10] [11], и единственная молекула АТФ гидролизуется.Сообщается, что скорость движения кинезинов составляет до 800 нм в секунду, гидролизуя примерно 100 молекул АТФ в секунду, то есть 1 молекулу АТФ на 8,1 нм, в течение которых транспортируется груз [9]. Хотя микротрубочки содержат до 13 протофиламентов, обычные кинезины проходят только по одиночным филаментам и избегают сайтов связывания, которые теоретически находятся в пределах досягаемости на соседних протофиламентах — связывание с этими сайтами может потребовать дополнительного растяжения шейной линкерной области.
На начальной стадии цикла powerstroke шейный линкер ведущей головы привязан к голове, но вытянут назад и не взаимодействует с сайтом стыковки (A) После связывания АТФ и последующего конформационного изменения шейный линкер стыкуется со своим стыковочный узел в головной головке.Это потянет заднюю головку вперед (B). Задняя головка продолжает движение вперед до тех пор, пока шейный соединитель задней головки не отсоединит стыковочный узел. Эта головка находит следующий участок связывания и становится ведущей головкой (C). Цикл продолжается, позволяя кинезину «пройти» по филаменту микротрубочек.
Молекулярное моделирование недавно было использовано для описания кинетики цикла силовых ударов кинезина. В этом исследовании были описаны 3 стадии, которые определяют размер шага и направление белка кинезина.На первой стадии шейный линкер претерпевает конформационное изменение при связывании АТФ, при котором он «стыкуется» с ведущей головкой [12] [13] [14] [15]. Это по существу включает выравнивание и связывание большой части шейного линкера с определенными остатками на ведущей головке. В исходном положении, когда две головки кинезина (задняя и ведущая) связаны с микротрубочкой, шейный линкер, привязанный к ведущей головке, вытянут назад и, таким образом, не взаимодействует с сайтом стыковки на ведущей головке [16]. .В начале поэтапного процесса происходит «стыковка», которая изменяет гибкость линкерной области, чтобы гарантировать, что движение задней головки следует по той же линии и в том же направлении, что и ведущая головка [10] [17].
Важность шейного линкера в силовом ударе кинезина была подчеркнута исследованиями, которые ингибировали, удаляли или заменяли эту область и сообщали о ряде последствий, от нарушения размера шага до полного ингибирования механизма ходьбы [16] [18]. ] [19].Можно также сказать, что стыковка линкера регулирует вторую стадию шага, на котором задняя головка движется вперед за счет «связанной диффузии». На этом втором этапе задняя головка, которая теперь связана с ADP, будет покрывать большую часть 16-нанометрового расстояния до следующего сайта связывания. Это происходит посредством анизотропного поступательного движения (то есть в определенном направлении вдоль микротрубочки) и с помощью изотропного вращательного движения (то есть с равномерным вращением). На этом этапе ведомая головка ищет оптимальное место привязки.Во время стадии 3 происходят взаимодействия между задней головкой и сайтом связывания микротрубочек [10]. После связывания АДФ диффундирует из сайта связывания нуклеотидов на задней головке, и шейный линкер расслабляется вдали от сайта стыковки. Другая молекула АТФ теперь свяжется с ведущей головкой, и цикл powerstroke продолжит повторяться. Приблизительно 6 пН силы генерируется одним сильным ударом кинезина [9].
Внутриклеточный транспорт и секреция калуменина-1/2 в живых клетках
Abstract
Изоформы 1 и 2 калуменина (calu-1/2), кодируемые геном CALU , относятся к семейству белков CREC.Белки Calu-1/2 секретируются во внеклеточное пространство, но секреторный процесс и регуляторный механизм в значительной степени неизвестны. Здесь, используя систему покадровой визуализации, мы визуализировали внутриклеточный транспорт и секреторный процесс calu-1/2-EGFP после их транслокации в просвет ER. Интересно, что мы наблюдали, что изобилие calu-1/2-EGFP накапливалось в клеточных процессах перед высвобождением во внеклеточное пространство, тогда как только часть белков calu-1/2-EGFP секретировалась непосредственно после прикрепления к периферии клетки.Более того, мы обнаружили, что секреция calu-1/2-EGFP требует целостности микротрубочек, и что везикулы, содержащие calu-1/2-EGFP, транспортируются моторными белками Kif5b и цитоплазматическим динеином. Наконец, мы определили экспортный сигнал calu-1/2-EGFP (положения аминокислот 20–46) и предоставили доказательства того, что аспарагин в сайте 131 был незаменим для стабилизации calu-1/2-EGFP. Взятые вместе, мы предоставляем подробную картину внутриклеточного транспорта calu-1/2-EGFP, которая облегчает наше понимание секреторного механизма calu-1/2.
Образец цитирования: Wang Q, Feng H, Zheng P, Shen B, Chen L, Liu L, et al. (2012) Внутриклеточный транспорт и секреция калуменина-1/2 в живых клетках. PLoS ONE 7 (4): e35344. https://doi.org/10.1371/journal.pone.0035344
Редактор: Сара Салинас, CNRS, Франция
Поступила: 16 августа 2011 г .; Принята к печати: 14 марта 2012 г .; Опубликован: 13 апреля 2012 г.
Авторские права: © 2012 Wang et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Крупной государственной программой развития фундаментальных исследований Китая (программа 973) (2010CB833705) и Национальным фондом естественных наук Китая (30971433, 31071177). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Калуменин человека (calu), член семейства белков CREC, кодируется геном CALU (NCBI GeneID: 813) [1], [2], который картирован на хромосоме 7q32 [3]. Два альтернативных сплайсинговых варианта гена CALU идентифицированы как calu-1 и calu-2 (также известные как крокальбин) [4]. Две изоформы имеют равную длину (315 аминокислот), экзоны 3 и 4 заменены [5], и повсеместно экспрессируются в тканях человека [6].И calu-1, и -2 содержат N-концевую сигнальную последовательность (19 аминокислот) и семь EF-доменов для связывания Ca 2+ [7]. Предыдущие сообщения показывают, что они локализуются в секреторном пути и секретируются во внеклеточное пространство [8] — [10], в то время как некоторые исследования настаивают на том, что calu-1/2 содержит на С-конце сигнал HDEF, удерживающий ER, и сохраняется в просвете ER [11] — [13]. Кроме того, пролин в положении +2 от предсказанного сайта расщепления сигнального пептида calu-1/2 [6] действует как экспортный сигнал, опосредующий секрецию calu-1/2 [14].
Сообщается, что внеклеточно calu-1 взаимодействует с сывороточным амилоидным P-компонентом в присутствии Ca 2+ , что указывает на его возможную роль в амилоидозе [15]. Calu-1 может также участвовать в аутокринной и паракринной передаче сигналов, поскольку он снижает уровень экспрессии септина 2 и фрагментов актина, а также регулирует клеточный цикл в фибробластах [16]. Недавно сообщалось, что тромбоспондин-1, секретируемый гликопротеин, образует комплекс с калу-1, предполагая, что калу-1/2 играет потенциальную роль в гемостазе и тромбозе [2].
Несмотря на первоначальную характеристику calu-1/2, многие аспекты все еще остаются неуловимыми, включая их внутриклеточный транспорт и секреторный процесс. Здесь мы использовали calu-1/2-EGFP, в котором EGFP, возможно, маскировал бы сигнал удерживания C-терминального HDEF, чтобы изучить процесс его секреции. Мы сообщили о транслокации calu-1/2-EGFP в просвет эндоплазматического ретикулума (ER), визуализировали их внутриклеточный транспорт в везикулах и показали секрецию calu-1/2-EGFP посредством «секреции после прикрепления» или «секреция после накопления».Чтобы исследовать основной транспортный механизм, мы определили роль сети цитоскелета и моторных белков во внутриклеточном транспорте и секреции calu-1/2-EGFP. Более того, мы определили, что Kif5b и цитоплазматический динеин являются двигателями, которые ответственны за их микротрубочко-зависимый транспорт. Наконец, мутационный анализ выявил экспортный сигнал calu-1/2-EGFP и аминокислотную точку, критически важную для стабильности calu-1/2-EGFP.
Результаты
Calu-1/2 перемещаются в просвет ER и секретируются
С помощью полученных нами антител, которые распознают изоформы calu-1 и calu-2 (данные не показаны), мы обнаружили, что большое количество calu-1/2 было обнаружено в культуральной среде (рис. 1A).Однако иммунофлуоресцентный анализ показал, что calu-1/2 локализуется по всей клетке ER-подобным образом, а не накапливается в аппарате Гольджи как в клетках HeLa, так и в клетках HEK293T (рисунок S1). Чтобы конкретно изучить секреторный процесс calu-1/2, мы использовали calu-1/2-EGFP, в котором сигнал HDEF, удерживающий C-концевой ER, был нарушен тегом EGFP. Большинство слитых белков calu-1/2-EGFP были обнаружены в культуральной среде, как и ожидалось (рис. 1B). Между тем, calu-1/2-EGFP накапливается в аппарате Гольджи как в клетках HeLa, так и в клетках HEK293T (рис. 1C и 1D), что позволяет предположить, что путь сохранения ER был заблокирован.
Рисунок 1. Calu-1/2 перемещаются в просвет и секретируются.
(A) Вестерн-блоттинг-анализ эндогенного calu-1/2 из общего клеточного лизата (TCL) и культуральной среды (CM) клеток HeLa. (B) Вестерн-блоттинг сверхэкспрессии calu-1/2-EGFP клеток HeLa. Образцы TCL и CM разделяли с помощью SDS-PAGE и зондировали антителами против EGFP и против тубулина. Окрашивание кумасси синим (Co.St.) использовали в качестве контроля загрузки CM. (C) Иммунофлуоресценция клеток HeLa, сверхэкспрессирующих EGFP или Calu-1/2-EGFP, зондированных антителом против гиганта.Пруток, 10 мкм. (D) Иммунофлуоресценция клеток HEK293T, сверхэкспрессирующих EGFP или Calu-2-EGFP, зондированных антителом против гигантина. Пруток, 10 мкм. (E) Клетки HeLa иммунофлуоресцентно метили указанными антителами после их проницаемости дигитонином. Масштабная линейка 10 мкм. (F) Субклеточная локализация 11 EGFP-слитых белков транскриптов calu-2 в клетках HeLa, которые были котрансфицированы GRIP-mRFP и проницаемы с помощью Triton X-100 после фиксации. Цифры указывают положения аминокислот в calu-2.На рисунке транскрипты, локализованные на секреторном пути, отмечены зелеными галочками. Красные крестики указывают на транскрипты, размазанные в клетках HeLa. Масштабная линейка 10 мкм.
https://doi.org/10.1371/journal.pone.0035344.g001
Затем мы использовали дигитонин, который избирательно проникает через плазматическую мембрану, но не через внутриклеточные мембраны [17], для обработки клеток после фиксации. При такой обработке GM130, который периферически прикрепляется к цитоплазматической поверхности аппарата Гольджи, был обнаружен его антителом, тогда как белок просвета ER PDI не мог быть распознан его собственным антителом (рис. S2).Точно так же цитозольная метка EGFP слитого белка APP-EGFP была иммуномечена антителом против EGFP, тогда как β4GalT-1-EGFP, EGFP которого находится на просветной стороне ER и аппарата Гольджи, не был иммуномечен (рис. 1E). Кроме того, антитело против EGFP не метило сверхэкспрессируемый calu-1/2-EGFP с помощью иммунофлуоресценции после обработки дигитонином (рис. 1E), что позволяет предположить, что calu-1/2 локализован в просвете ER и аппарата Гольджи. Кроме того, чтобы определить сигнал, ответственный за попадание calu-1/2 в просвет, мы создали несколько конструкций calu-2 и визуализировали их субклеточную локализацию и обнаружили, что 19 аминокислот на N-конце были необходимыми и достаточными. для локализации Гольджи calu-2-EGFP (Рисунок 1F).Эти результаты вместе с предыдущим сообщением о том, что N-концевые 19 аминокислот calu-1 расщепляются [14], предполагают, что calu-1/2-EGFP секретируется во внеклеточное пространство и что N-концевые 19 аминокислот кислоты действуют как сигнальный пептид, который присоединяет calu-1/2-EGFP к ER, а затем перемещает их в просвет эндомембранной системы.
Внутриклеточный транспорт калу-1/2-EGFP
Для мониторинга внутриклеточного транспорта и секреторного процесса calu-1/2-EGFP, мы наблюдали за распределением и динамическим поведением calu-1/2-EGFP в живых клетках HeLa (≥30 клеток) с помощью конфокальной микроскопической системы с вращающимся диском Andor. .И calu-1-EGFP, и calu-2-EGFP локализованы в секреторном пути, включая сеть ER и аппарат Гольджи (рис. 2A). Везикулы, содержащие Calu-1/2-EGFP, наблюдались по всей цитоплазме (рис. 2А). Некоторые из них были сферическими (рис. 2В), а другие — стержневидными и трубчатыми (рис. 2С). Эти везикулы, содержащие calu-1/2-EGFP, переносились внутриклеточно (рис. 2A – C; фильмы S1 и S2).
Рисунок 2. Покадровая визуализация внутриклеточного транспорта calu-1/2-EGFP.
(A) Типичные изображения клеток HeLa, сверхэкспрессирующих calu-1/2-EGFP. Слитые белки Calu-1/2-EGFP локализуются в аппарате Гольджи и сетях ER с указанными ядрами. Пузырьки обозначены стрелками. Масштабная линейка 10 мкм. (B – C) Репрезентативные изображения внутриклеточного транспорта calu-1/2-EGFP. (B) Движения одиночных пузырьков (обозначены одной стрелкой) отслеживались, а движения палочковидных пузырьков (обозначены двумя стрелками) показаны на (C). Масштабная линейка, 1 мкм.
https://doi.org/10.1371/journal.pone.0035344.g002
Кроме того, чтобы визуализировать детали внутриклеточного транспорта calu-1/2-EGFP, мы совместно экспрессировали calu-1/2-EGFP и GRIP- mRFP (маркер Гольджи) в клетках HeLa и наблюдали движение in vivo calu-1/2-EGFP (≥5 клеток). Эти везикулы, содержащие calu-1/2-EGFP, входят или выходят из аппарата Гольджи (Figure 3A-D). Взятые вместе, calu-1/2-EGFP распределяются по секреторному пути и широко транспортируются внутри клетки.
Рис. 3. Calu-1/2-EGFP входят или выходят из аппарата Гольджи.
(A – D) Репрезентативные клетки HeLa, трансфицированные calu-1-EGFP (A и B) и calu-2-EGFP (C и D), визуализированы системой конфокального микроскопа с вращающимся диском Andor. Прямоугольниками показаны увеличенные области. Стрелки указывают на те пузырьки, которые входят (A и C) и выходят (B и D) из аппарата Гольджи. Временной интервал между двумя отдельными кадрами составляет 0,48 секунды. Масштабная линейка, 1 мкм.
https: // doi.org / 10.1371 / journal.pone.0035344.g003
Два типа секреции calu-1/2-EGFP
Для дальнейшей визуализации секреторного процесса calu-1/2-EGFP мы более подробно наблюдали поведение in vivo calu-1/2-EGFP на периферии клеток и обнаружили два основных типа секреции. Некоторые везикулы, содержащие калу-1/2-EGFP, перемещаются к периферии клетки (рис. 4А; фильмы S1 и S2). Через одну или две секунды сигнал calu-1/2-EGFP быстро исчез и, наконец, исчез, предполагая, что белки calu-1/2-EGFP секретировались во внеклеточное пространство.Интересно, что мы отметили другой секреторный способ, при котором везикулы транспортируются к периферии клетки и накапливаются в клеточных процессах (рис. 4B; фильмы S1 и S2). Мы также отметили, что эти везикулы на концах клеток, по-видимому, сливаются друг с другом перед тем, как секретироваться вместе (рис. 4C), что указывает на то, что белки calu-1/2-EGFP секретировались коллективно после их накопления на кончиках клеток.
Рис. 4. Calu-1/2-EGFP секретируются двумя разными типами.
(A) Покадровое наблюдение секреции calu-1-EGFP (слева) и calu-2-EGFP (справа) в режиме «секреция после прикрепления». Масштабная линейка, 4 мкм. (B) Пузырьки везикул в клетках HeLa, экспрессирующих calu-1-EGFP. Изображения были получены с интервалом 0,188 секунды. Эти последовательные кадры были наложены как временные проекции, чтобы проиллюстрировать пути пузырьков. Прямоугольники представляют собой увеличенные области, показывающие накопление calu-1-EGFP в клеточных процессах. Масштабная линейка 10 мкм. (C) Покадровое наблюдение секреции calu-1-EGFP в режиме «секреция после накопления».Обратите внимание, что острие стрелки указывает на точки калу-1-EGFP, которые переместились в точку с указателем стрелки, а точка с указателем стрелки окончательно исчезла. Масштабная линейка, 4 мкм.
https://doi.org/10.1371/journal.pone.0035344.g004
Везикулы, содержащие Calu-1/2-EGFP, транспортируются Kif5b и цитоплазматическим динеином по микротрубочкам
Визуализировав внутриклеточный транспорт и секрецию calu-1/2-EGFP, мы затем исследовали молекулярный механизм транспорта calu-1/2.Чтобы определить, зависит ли секреция calu-1/2-EGFP от цитоскелета, мы обрабатывали сверхэкспрессирующие calu-1/2-EGFP клетки различными лекарствами, чтобы препятствовать полимеризации микротрубочек или актиновых филаментов. Нокодазол связывается с β-тубулином и блокирует самосборку тубулина, препятствуя полимеризации микротрубочек [18]. Цитохалазин блокирует сборку и разборку отдельных мономеров актина путем связывания с плюс-концами микрофиламентов, таким образом ингибируя нормальную полимеризацию и удлинение актиновых филаментов [19].После обработки нокодазолом уровень белка calu-2-EGFP заметно снизился в культуральной среде, в то время как немного повысился в клеточном лизате (рис. 5А). Напротив, обработка цитохалазином не изменяла секреторный уровень (рис. 5А). Кроме того, с помощью иммунофлуоресцентного анализа мы обнаружили зеленые точки calu-1/2-EGFP, локализованные вдоль микротрубочек в клеточных процессах (рис. 5B и S3). Следовательно, секреция calu-1/2-EGFP зависит от микротрубочек, но не зависит от целостности актинового филамента.
Рисунок 5. Транспорт везикул, содержащих калу-1/2-EGFP, зависит от микротрубочек, но не зависит от актина.
(A) Вестерн-блоттинг в TCL и CM клеток, трансфицированных calu-2-EGFP, обработанных ДМСО, нокодазолом или цитохалазином. (B) Иммунофлуоресценция клеток HeLa, экспрессирующих calu-2-EGFP, с использованием антитела против α-тубулина. Стрелки указывают на точки калу-2-EGFP, распространяющиеся вдоль микротрубочек к клеточным процессам. Прямоугольные области были усилены. Масштабная линейка 10 мкм.
https://doi.org/10.1371/journal.pone.0035344.g005
Чтобы определить, какой моторный белок опосредует транспорт calu-1/2-EGFP, мы измерили скорости везикул, содержащих calu-1/2-EGFP. Мы рассчитали скорости более 2000 точек (≥10 клеток) и обнаружили, что везикулы, содержащие calu-1-EGFP, движутся со средней скоростью 1,15 ± 0,55 мкм / с (рис. 6A), что аналогично средней скорости везикулы, содержащие калу-2-EGFP (1,12 ± 0,56 мкм / с) (рис. 6В).Хотя некоторые везикулы перемещались быстро, достигая 3 мкм / с, частотный анализ показал, что большинство везикул как calu-1-EGFP, так и calu-2-EGFP перемещались со скоростью 0,7–1 мкм / с или 1,1–1,5 мкм / с (рис. 6A). и 6Б). Эти два пика указывают на то, что везикулы, содержащие калу-1/2-EGFP, транспортируются двумя двигателями с разной подвижностью.
Рисунок 6. Везикулы, содержащие Calu-1/2-EGFP, переносятся Kif5b и цитоплазматическим динеином.
(A – B) Гистограммы показывают распределение скоростей везикул, содержащих calu-1/2-EGFP, в клетках HeLa.Пунктирные линии показывают, что большинство пузырьков движутся со скоростью 0,7–1 мкм / с и 1,1–1,5 мкм / с. Приблизительно 2000 точек (≥10 клеток) были измерены для каждой группы. (C) Скорость внутрь и наружу пузырьков, содержащих калу-1/2-EGFP. (D) Вестерн-блоттинг-анализ секреторного уровня calu-2-EGFP в клетках HeLa, котрансфицированных указанными доминантно-отрицательными векторами. (E) Вестерн-блоттинг-анализ секреторного уровня calu-2-EGFP в клетках HEK293T, котрансфицированных указанными доминантно-отрицательными векторами. (F) Вестерн-блоттинг-анализ секреторного уровня calu-2-EGFP Kif5b или цитоплазматических клеток HeLa с нокдауном динеина.(G) GST-анализ клеток, трансфицированных calu-2-EGFP, с использованием GST или GST-Kif5b-CBD. (H) Анализ иммунопреципитации клеток HEK293T, сверхэкспрессирующих calu-2-EGFP и myc-p150, с использованием нормального IgG или антитела против myc.
https://doi.org/10.1371/journal.pone.0035344.g006
У эукариот существует два типа моторных белков микротрубочек, кинезин и динеин, которые широко участвуют в транспорте везикул [20], [21]. Скорость мотора тяжелой цепи кинезина (Kif5b) и цитоплазматического динеина сильно различалась в предыдущих отчетах, но многие исследования показали, что и Kif5b, и цитоплазматический динеин перемещаются со скоростью ~ 1 мкм / с in vivo [22] — [27].Учитывая, что Kif5b и цитоплазматический динеин двигались в разных направлениях, мы измерили внутреннюю и внешнюю скорость везикул, содержащих calu-1/2-EGFP, отдельно. Мы обнаружили, что везикулы, содержащие калу-1/2-EGFP, возглавляющие аппарат Гольджи, перемещались со скоростью ~ 0,9 мкм / с, в то время как те, которые движутся к периферии клетки, перемещались со скоростью ~ 1,2 мкм / с (Рисунок 6C). Эти две скорости хорошо согласуются с двумя пиками и аналогичны скоростям, о которых сообщалось ранее, для Kif5b и цитоплазматического динеина, что позволяет предположить, что везикулы, содержащие калу-1/2-EGFP, транспортируются Kif5b и цитоплазматическим динеином с разной скоростью.
Для дальнейшего подтверждения нашей гипотезы мы провели доминирующие отрицательные эксперименты. Сверхэкспрессия p50, одной из субъединиц динактинового комплекса, действует как доминантно-отрицательный ингибитор динеин-динактина и нарушает движение цитоплазматических динеин-зависимых органелл [28]. Kif5b взаимодействует со своими грузами через легкую цепь кинезина через домен связывания кинезин-легкая цепь (KLCBD, аминокислоты 760-830) или через домен связывания груза (CBD, аминокислоты 831-964). Сверхэкспрессия KLCBD и CBD Kif5b вызывает доминантный негативный фенотип Kif5b за счет их конкурентного эффекта связывания грузов [29], [30].В клетках, трансфицированных p50, Kif5b-CBD или Kif5b-KLCBD и CBD, уровень белка calu-2-EGFP в культуральной среде значительно снизился (Фигуры 6D и 6E). Кроме того, сверхэкспрессия Kif5b-KLCBD не изменяла уровень секреции (фиг. 6D), предполагая, что CBD, но не KLCBD Kif5b, участвует в распознавании везикул, содержащих calu-1/2-EGFP. Однако мы не могли исключить возможность того, что сверхэкспрессированный Kif5b-CBD напрямую ингибировал активность эндогенного Kif5b через связывание с его моторным доменом [31].Таким образом, мы отключили Kif5b, обнаружили сниженный уровень секреции calu-2-EGFP (рис. 6F), что дополнительно предполагает, что Kif5b участвует в транспортировке calu-1/2-EGFP. Точно так же нокдаун цитоплазматического динеина также снижает уровень секреции clau-2-EGFP (рис. 6F). В совокупности эти данные предполагают, что цитоплазматический динеин и Kif5b участвуют в транспорте везикул, содержащих calu-1/2-EGFP.
Чтобы еще больше продемонстрировать автомобильно-грузовую ассоциацию, мы выполнили анализ методом «pull-down» и иммунопреципитации.Calu-2-EGFP был разрушен GST-Kif5b-CBD (рис. 6G). Анализ иммунопреципитации также подтвердил связь между цитоплазматическим динеиновым комплексом и калу-2-EGFP (рис. 6H). Между тем, сверхэкспрессия Kif5b-CBD резко снижает количество движущихся пузырьков calu-1/2-EGFP (фигура 7; фильмы S3, S4, S5, S6). Взятые вместе, везикулы, содержащие калу-1/2-EGFP, транспортируются с помощью Kif5b и цитоплазматического динеина, а Kif5b-CBD и динактин необходимы для секреции калу-1/2-EGFP.
Рисунок 7.Доминирующие негативные эффекты Kif5b на перенос везикул, содержащих calu-1/2-EGFP, в клетках HeLa.
(A) Репрезентативное изображение показывает следы движущихся везикул, содержащих calu-1-EGFP в присутствии mRFP или mRFP-Kif5b-CBD. Эти треки движущихся пузырьков представляют собой проекции отдельных кадров в реальном времени за 3 минуты. (B) Количество движущихся везикул, содержащих калу-1-EGFP, в минуту, соответствующее (A), было подсчитано вручную (≥10 клеток в каждой группе). (C) Репрезентативное изображение показывает следы движущихся везикул, содержащих calu-2-EGFP в присутствии mRFP или mRFP-Kif5b-CBD.Эти треки движущихся пузырьков представляют собой проекции отдельных кадров в реальном времени за 3 минуты. (D) Количество движущихся везикул, содержащих калу-2-EGFP, в минуту, соответствующее (C), было подсчитано вручную (≥10 клеток в каждой группе). Масштабная линейка 10 мкм.
https://doi.org/10.1371/journal.pone.0035344.g007
Экспорт сигнала calu-1/2-EGFP
Растворимые грузовые белки во внутриклеточном просвете экспортируются либо объемным потоком, либо опосредованным рецептором транспортом [32] — [37].Чтобы выяснить, экспортируется ли calu-1/2-EGFP пассивно или активно во внеклеточное пространство, мы экспрессировали слитые белки SP19-EGFP, которые представляют собой меченные EGFP N-концевые 19 аминокислот calu-1/2 (рис. 8A). ). Если секреция calu-1/2-EGFP происходит через объемный поток, SP19-EGFP должен иметь такой же процент секреции, как и полноразмерный calu-1/2-EGFP. Однако мы обнаружили, что процент секреции SP19-EGFP резко снизился по сравнению с calu-2-EGFP (рис. 8A). Чтобы исключить возможность того, что N-концевое расщепление сигнальным пептидом SP19-EGFP было нарушено, что привело к его удержанию, мы дополнительно изучили SP22-EGFP.SP22-EGFP показал аналогичный процент секреции с SP19-EGFP (фиг. 8A), что позволяет предположить, что calu-1/2 может секретироваться не через объемный поток, а через секреторный путь, опосредованный рецептором .
Рисунок 8. Сигнал экспорта для calu-1/2-EGFP.
(A) Процент секреции различных усеченных конструкций calu-2. Правый столбец показывает процент секреции девяти конструкций, показанных в левом столбце. Эти секреторные скорости были рассчитаны согласно результатам вестерн-блоттинга (данные не показаны, три независимых эксперимента).(B) Эффекты точечной мутации на секрецию calu-2-EGFP. Вестерн-блоттинг показал секреторный уровень calu-2-EGFP двух точечных мутаций. Образцы зондировали антителами против EGFP и против тубулина. Стоимость. использовался в качестве контроля загрузки CM. (C) Процент секреции мутационных конструкций calu-2-EGFP, показанный в (B) (три независимых эксперимента).
https://doi.org/10.1371/journal.pone.0035344.g008
Затем, чтобы идентифицировать экспортный сигнал для секреции calu-1/2, мы сконструировали транскрипты calu-2 (Δ1 – Δ6) -EGFP ( Рисунок 8A).Процент секреции calu-2 (Δ1 – Δ3) -EGFP был почти таким же, как у calu-2-EGFP; напротив, calu-2 (Δ4 – Δ6) -EGFP демонстрирует значительное снижение секреторного уровня (фиг. 8A). Эти данные свидетельствуют о том, что сигнал сортировки, который имеет решающее значение для опосредованного рецептором экспорта calu-1/2-EGFP, находится между положениями аминокислот 20 и 46. Кроме того, в сигнале сортировки мы отметили, что пролин в сайт 21, как сообщается, является сигналом экспорта ER [14]. Чтобы определить, играет ли только этот сайт жизненно важную роль в секреции calu-1/2-EGFP, мы мутировали его на аланин и измерили процент секреции.Процент секреции calu-2-P21A-EGFP был лишь незначительно снижен по сравнению с контролем (Фигуры 8B и 8C), предполагая, что пролин в сайте 21 не является единственным ключевым элементом для секреции calu-1/2-EGFP, но может вносят вклад в целостность сигнала сортировки между аминокислотами 20–46.
Аспарагин на участке 131 важен для стабильности calu-1/2-EGFP
Предполагается, что аспарагин в сайте 131 является сайтом N-гликозилирования [8], [11]. Чтобы проверить эту гипотезу, мы исследовали, влияет ли этот сайт на секрецию calu-1/2-EGFP.Неожиданно мы обнаружили, что, когда аспарагин в положении 131 был мутирован в аланин, calu-2 (N131A) -EGFP сильно разлагался как во внутриклеточном, так и во внеклеточном пространстве (рис. 8B), что позволяет предположить, что N-гликозилирование в этом сайте играет роль играет важную роль в стабильности calu-1/2-EGFP, что требует дальнейшего изучения.
Обсуждение
В этом исследовании мы показали, что calu-1/2-EGFP перемещаются в просвет с помощью своего сигнального пептида, транспортируются внутриклеточно в везикулах и, наконец, секретируются во внеклеточное пространство (Рисунок 9), в течение которых сигнал сортировки на calu-1/2 незаменим.Мы исследовали скорость везикул, содержащих калу-1/2-EGFP, и идентифицировали моторные белки, которые участвуют в приведении в действие везикул, содержащих калу-1/2-EGFP. Наиболее интересно то, что помимо традиционного способа секреции, мы также наблюдали другой тип секреции, при котором везикулы, содержащие calu-1/2-EGFP, накапливались в клеточных процессах и секретировались коллективно.
Рисунок 9. Схематическая диаграмма, иллюстрирующая внутриклеточный транспорт и секреторный процесс calu-1/2-EGFP.
(A) В эукариотической клетке calu-1/2-EGFP одновременно синтезируются и транслоцируются в просвет эндоплазматического ретикулума, а затем выходят из ER с помощью цитоплазматического динеина моторного белка, заключенного в пузырьки ( шаг I). После попадания в аппарат Гольджи calu-1/2-EGFP гликозилируются и затем транспортируются внутри секреторных пузырьков по микротрубочкам с помощью Kif5b к периферии клетки (стадия II). Затем calu-1/2-EGFP секретируются во внеклеточное пространство либо непосредственно после прикрепления к клеточной мембране (стадия III), либо сначала накапливаются в клеточных процессах, а затем высвобождаются вместе (стадия IV).(B) Модель «секреции после привязанности». (C) Модель «секреции после накопления».
https://doi.org/10.1371/journal.pone.0035344.g009
Во время секреторного процесса белок с N-концевым сигнальным пептидом синтезируется в грубо связанных рибосомах, связанных с ER, а затем перемещается в просвет ER. После правильной укладки и модификации белок доставляется в аппарат Гольджи для дальнейшей модификации и, наконец, высвобождается во внеклеточное пространство посредством везикулярного транспорта [38].Среди различных моторных белков, ответственных за внутриклеточный транспорт различных грузов, моторный белок микротрубочек цитоплазматический динеин перемещается к минус-концу микротрубочек, участвуя в антероградном транспорте от ER к аппарату Гольджи [21], [39] и Kif5b. , микротрубочка плюс направленный на конец мотор, отвечает за трафик после Гольджи [20], [40]. Предыдущие сообщения о скоростях Kif5b и цитоплазматического динеина in vivo сильно варьировались от 0,2 мкм / с до более 3 мкм / с [22] — [27], [41] — [44].В наших экспериментах везикулы, содержащие калу-1/2-EGFP, также перемещались с разной скоростью, при этом некоторые из них двигались со скоростью 0,3-0,5 мкм / с, в то время как некоторые быстрые везикулы достигли 3 мкм / с. Это согласуется с предыдущими отчетами. Кроме того, мы обнаружили, что везикулы, содержащие калу-1/2-EGFP, перемещались со скоростью ~ 0,9 мкм / с внутрь и ~ 1,2 мкм / с наружу. Мы предположили, что цитоплазматический динеин и Kif5b были ответственны за внутриклеточный транспорт calu-1/2-EGFP с разной скоростью. Используя методы доминантно-отрицательных и РНКи, мы обнаружили, что блокирование Kif5b или цитоплазматического динеина значительно ингибирует секрецию calu-1/2-EGFP (рис. 6D-F).Более того, анализ GST и иммунопреципитация дополнительно подтвердили связь между Kif5b / цитоплазматическим динеином и везикулами, содержащими calu-1/2-EGFP (Рисунок 6G – H). Следовательно, возможно, что цитоплазматический динеин опосредует транспорт calu-1/2-EGFP из ER-Golgi с относительно меньшей скоростью ∼0,9 мкм / с, в то время как Kif5b выполняет транспорт calu-1/2-EGFP- содержащие везикулы со скоростью ~ 1,2 мкм / с во время переноса после Гольджи (рис. 9). Кроме того, мы не исключаем возможность того, что везикулы, содержащие calu-1/2-EGFP, двунаправленно транспортируются посредством пространственно-временной регуляции кооперации Kif5b и динеина [45], [46], а некоторые другие моторные белки также могут участвовать в транспорт калу-2-EGFP.
В наших экспериментах мы обнаружили два типа секреции калу-1/2-EGFP. В модели «секреции после прикрепления» (рис. 9B), о которой обычно сообщают [42], высвобождение секреторного продукта, как полагают, регулируется сетью актиновых филаментов. Было высказано предположение, что секреторные везикулы, перемещающиеся к периферии клетки, препятствуют слиянию друг с другом и плазматической мембраной плотной сетью микрофиламентов, а стимуляция быстрой деполимеризации этих актиновых филаментов приводит к следующему слиянию везикул и секреция [47], [48].Однако наши результаты показывают, что нарушение сети актиновых филаментов не увеличивает секреторный уровень calu-2-EGFP (рис. 5A), предполагая, что большая часть calu-1/2-EGFP может не использовать этот секреторный режим, но секретируется через модель «секреции после накопления» (рис. 9C), которая также наблюдается при переносе мРНК [49]. Более того, проекция зеленых флуоресцентных точек (Рис. 4B) не только обозначает пути транспортировки везикул, содержащих calu-1/2-EGFP, но также может представлять дорожки микротрубочек.Это дополнительно подтверждается данными иммуноокрашивания, в которых микротрубочки указывают на клеточные процессы с точками calu-2-EGFP, выстраивающимися вдоль них (рис. 5B и S3). Таким образом, мы предполагаем, что именно микротрубочки, направленные на клеточные процессы, способствуют накоплению везикул, содержащих калу-1/2-EGFP. Предыдущие сообщения показывают, что экзоцитотические везикулы нацелены на участки, содержащие ELKS, к которым прикрепляются MT плюс концы [42], [50]. Таким образом, возможно, что клеточные отростки изобилуют ELKS и привлекают везикулы, содержащие калу-1/2-EGFP.
Растворимые белки с сигналами выхода ER распознаются трансмембранными рецепторами, которые рекрутируют белки оболочки и обеспечивают транспорт из ER в аппарат Гольджи и, наконец, на периферию клетки [32], [33], [35]. Кроме того, некоторые белки без сигналов выхода из ER также проникают в секреторные пузырьки и секретируются [34], [37]. Наши данные показывают, что calu-1/2-EGFP секретируются через рецептор-опосредованный путь, при этом их выходной сигнал расположен в положениях аминокислот 20–46.
Кроме того, мы идентифицировали аспарагин в положении 131, который, как предполагалось, является сайтом гликозилирования [8], [11], важным для стабильности calu-1/2-EGFP.Мутация аспарагина в аланин приводит к обширной деградации calu-2-EGFP как внутриклеточно, так и внеклеточно. Это можно объяснить двумя возможностями: либо гликозилирование в этом сайте стабилизирует calu-2-EGFP, защищая его от расщепления протеазой, либо сама мутация приводит к неправильной укладке calu-2 (N131A) -EGFP, которая застревает в ER и последующая деградация через путь ERAD. Необходимы дальнейшие эксперименты, чтобы раскрыть подробный механизм.
Материалы и методы
Культура клеток и трансфекция
КлеткиHeLa [30] и HEK293T [51] культивировали в среде Игла, модифицированной Дульбекко (DMEM) (GIBCO BRL) с добавлением 10% FBS при 37 ° C с 5% CO. 2 , как описано ранее [30], [52] ].Осаждение фосфатом кальция или jetPEI (Polyplus) использовали для временной трансфекции клеток HeLa и HEK293T согласно предыдущим сообщениям [53].
Антитела
Мышиные поликлональные антитела против человеческого calu-2 (pAb) и кроличьи анти-EGFP pAb были разработаны с использованием прокариотически экспрессированного и очищенного белка GST-calu-2. Мышиные pAb против человеческого calu-2 распознают как изоформы calu-1, так и -2 (данные не показаны). Антитело против Kif5b было получено ранее [54]. Анти-PDI (ab2792), анти-GAPDH (ab8245), анти-GM130 (ab1299) и анти-Giantin (ab24586) были от Abcam.Анти-α-тубулин (DM1α) был от Sigma. Антитело против myc (M047-3) было от MBL. Вторичные антитела, конъюгированные с Alexa Fluor 488- / 568, козьи антитела против IgG мыши / кролика (Invitrogen) и антитела, конъюгированные с HRP (Invitrogen), использовали в иммунофлуоресцентном и вестерн-блоттинг-анализе в соответствии с инструкциями производителей.
Конструкция вектора
транскриптов Calu-1/2 амплифицировали из кДНК HeLa и вставляли в сайт Eco RI / Sal I в векторе pEGFP-N3 (Clontech).Две точечные мутации calu-2, P21A и N131A, также были сконструированы в векторе pEGFP-N3 (информацию о праймерах см. В таблице дополнительных материалов S1). Вектор APP-EGFP был получен путем клонирования APP в сайт Xho I / Sal I в векторе pEGFP-N3. Β4GalT-1-EYFP кодирует слитый белок, меченный EYFP, содержащий 81 N-концевую аминокислоту β4GalT-1 человека. GRIP-mRFP кодирует слитый белок, маркирующий аппарат Гольджи, как сообщалось ранее [55]. Вектор p50-EGFP был получен от проф.CM Zhang (Пекинский университет), а затем p50 амплифицировали и вставляли в сайт Eco RI / Sal I на pmRFP-C1 (Clontech). Kif5b-CBD (аминокислоты 831–964), Kif5b-KLCBD (аминокислоты 760–830) и Kif5b-KLCBD и CBD были амплифицированы из кДНК клеток HeLa и вставлены в сайт Eco RI / Sal I на pmRFP. -C1 (Клонтех). Myc-p150 [56] был встроен в сайт BamHI / XhoI вектора pcDNA3.1. См. Таблицу S1 для информации о грунтовках.
Иммуноблоттинг и процент секреции
Белки разделяли с помощью SDS-PAGE и затем переносили на PVDF-мембраны (Millipore) в ячейке для полусухого переноса (Bio-Rad).Мембраны были заблокированы и впоследствии зондированы первичными и вторичными антителами, как сообщалось ранее [57].
Для определения уровня белка в культуральной среде клеток HeLa мы заменили среду бессывороточной DMEM через 24 часа после трансфекции и собрали общий клеточный лизат (TCL) и соответствующую бессывороточную культуральную среду (CM) из каждая чашка для культивирования клеток через 48 часов после трансфекции. Что касается экспериментов с клетками HEK293T, мы заменили среду бессывороточной средой через 12 часов после трансфекции и собрали в течение 24 часов.И TCL, и CM были сжаты до 50 мкл, а пятая часть всего образца (10 мкл) была загружена и подвергнута вестерн-блоттингу. Интенсивность каждой целевой полосы определяли количественно с использованием программного обеспечения для анализа Image J (NIH). Процент секреции — это отношение интенсивности полосы в CM к общей интенсивности целевой полосы как в TCL, так и в CM. Кроме того, в некоторых экспериментах клетки обрабатывали ДМСО, нокодазолом (2 мкг / мл) и цитохалазином B (1 мкг / мл) в бессывороточной среде, а TCL и CM собирали через 24 часа для Вестерн-блоттинга.
Флуоресцентная микроскопия и
покадровая съемка визуализацияТрансфицированные клетки HeLa фиксировали свежеприготовленным 4% параформальдегидом в PBS, а затем подвергали прямому наблюдению под флуоресцентным микроскопом (Olympus) или конфокальным микроскопом (Leica). Для иммунофлуоресценции фиксированные клетки инкубировали с антителами после пермеабилизации (0,15% Triton X-100 в PBS) и блокирования. Для обработки дигитонином клетки пермеабилизировали 25 мкг / мл дигитонина в буфере KHM на льду, как сообщалось ранее [17], а затем фиксировали 4% параформальдегидом.Для визуализации живых клеток трансфицированные клетки подвергали лазерной микроскопии с вращающимся диском (Andor) через 24 часа после трансфекции. Изображения были собраны с помощью программного обеспечения Andor.
РНК-интерференция
Для эксперимента по нокдауну в клетках HeLa были синтезированы миРНК, нацеленные на Kif5b и цитоплазматический динеин, и трансфицированы в клетки HeLa с использованием липофектамина 2000 (Invitrogen) в качестве инструкции производителя. Последовательность контрольного скремблирования была разработана GenePharma Co., ООО
Понижение и иммунопреципитация
Для анализа методом pull down слитый белок GST-Kif5b-CBD прокариотически экспрессировался и присоединялся к гранулам глутатион-сефароза 4B (Amersham). Общий лизат клеток HEK293T, трансфицированных calu-2-EGFP, затем собирали и инкубировали с аффинной колонкой в буфере для лизиса (20 мМ HEPES, 120 мМ NaCl, 5 мМ EGTA, 2 мМ MgCl2 и 1 мМ DTT, pH 7,4) при 4 ° C в течение ночи. Комбинированный белок собирали и тестировали вестерн-блоттингом.
Для иммунопреципитации клетки HEK293T, трансфицированные calu-2-EGFP и myc-p150, лизировали в IP-буфере (20 мМ HEPES, 250 мМ сахароза, 10 мМ KCl, 1 мМ EGTA, 1 мМ EDTA, 1,5 мМ MgCl2 и 1 мМ DTT, pH 7,4), содержащий коктейль ингибиторов протеаз (Roche). Затем ядра удаляли центрифугированием при 3000 об / мин в течение 5 минут. Затем супернатант центрифугировали при 8000 об / мин в течение 15 минут для удаления митохондрий. Оставшуюся цитозольную и мембранную фракции затем инкубировали с антителом против myc при 4 ° C в течение ночи.Образцы белка, которые объединились с протеином А-сефарозой (Amersham), были собраны и подвергнуты вестерн-блоттингу.
Статистический анализ
Изображения проанализированы с использованием программного обеспечения Andor и Image J (NIH). Подвижность везикул (со скоростью более 0,3 мкм / с), относительная интенсивность флуоресценции и проекция пути везикул были получены, как сообщалось ранее [24], [42]. Скорости движущихся везикул измеряли с помощью программного обеспечения Image J (NIH). Расстояние, на которое перемещалась одна точка за каждые два кадра, рассчитывалось, при этом точки отслеживались вручную, и соответствующая скорость измерялась в соответствии с интервалом времени (0.376 секунд). Приблизительно 2000 точек (≥10 клеток) были измерены для каждой группы. Что касается расчета количества движущихся пузырьков, мы вручную подсчитали количество движущихся точек в каждой ячейке за одну минуту (≥10 ячеек в каждой группе).
Результаты представлены как среднее ± стандартное отклонение. Сравнения были проанализированы с помощью непарного двустороннего независимого t-критерия Стьюдента с допущением о равной дисперсии или без него в соответствии с результатом F-теста. * означает p <0,05, ** означает p <0,01, *** означает p <0.001.
Благодарности
Мы благодарим LQ Tang из Andor Co. за совет по работе с данными покадровой съемки. Вектор p50-EGFP был щедрым подарком профессора CM Zhang из Пекинского университета. Мы также благодарим IC Bruce за доработку рукописи.
Вклад авторов
Задумал и спроектировал эксперименты: QW HF PZ JC JT. Проведены эксперименты: QW HF PZ BS LC LL XL QH SW. Проанализированы данные: QW HF PZ BS LC JC JT. Написал статью: QW PZ HF JT.
Ссылки
- 1. Honore B, Vorum H (2000) Семейство CREC, новое семейство из нескольких EF-hand, низкоаффинных Ca (2 +) — связывающих белков, локализованных в секреторном пути клеток млекопитающих. FEBS Lett 466: 11–18.
- 2. Hansen GA, Vorum H, Jacobsen C, Honore B (2009) Калуменин, но не ретикулокальбин, образует Ca2 + -зависимый комплекс с тромбоспондином-1. Возможная роль в гемостазе и тромбозе. Mol Cell Biochem 320: 25–33.
- 3.Ябе Д., Таниваки М., Накамура Т., Канадзава Н., Таширо К. и др. (1998) Ген калуменина человека (CALU): выделение кДНК и картирование хромосом на 7q32. Геномика 49: 331–333.
- 4. Hseu MJ, Yen CH, Tzeng MC (1999) Крокальбин: новый кальций-связывающий белок, который также является связывающим белком для кротоксина, нейротоксической фосфолипазы A2. FEBS Lett 445: 440–444.
- 5. Jung DH, Mo SH, Kim DH (2006) Калуменин, Ca2 + -связывающий белок с множественными EF-руками, взаимодействует с рианодиновым рецептором-1 в саркоплазматическом ретикулуме скелета кролика.Biochem Biophys Res Commun 343: 34–42.
- 6. Vorum H, Liu X, Madsen P, Rasmussen HH, Honore B (1998) Молекулярное клонирование кДНК, кодирующей калуменин человека, экспрессия в Escherichia coli и анализ ее Ca2 + -связывающей активности. Biochim Biophys Acta 1386: 121–131.
- 7. Оноре Б. (2009) Быстро расширяющееся семейство белков CREC: члены, локализация, функция и роль в заболевании. Биологические исследования 31: 262–277.
- 8. Vorum H, Hager H, Christensen BM, Nielsen S, Honore B (1999) Человеческий калуменин локализуется в секреторном пути и секретируется в среду.Exp Cell Res 248: 473–481.
- 9. Vorum H, Jacobsen C, Honore B (2000) Калуменин взаимодействует с амилоидным P-компонентом сыворотки. Febs Letters 465: 129–134.
- 10. Honore B, Hansen GAW, Vorum H, Jacobsen C (2009) Калуменин, но не ретикулокальбин, образует Ca (2 +) — зависимый комплекс с тромбоспондином-1. Возможная роль в гемостазе и тромбозе. Молекулярная и клеточная биохимия 320: 25–33.
- 11. Ябе Д., Накамура Т., Канадзава Н., Таширо К., Хондзё Т. (1997) Калуменин, Са2 + -связывающий белок, сохраняющийся в эндоплазматическом ретикулуме с новой карбоксиконцевой последовательностью, HDEF.J Biol Chem 272: 18232–18239.
- 12. Wajih N, Sane DC, Hutson SM, Wallin R (2004) Ингибирующее действие калуменина на витамин K-зависимую систему гамма-карбоксилирования — характеристика системы у нормальных и устойчивых к варфарину крыс. Журнал биологической химии 279: 25276–25283.
- 13. Kim DH, Sahoo SK (2008) Калуменин взаимодействует с SERCA2 в сердечном саркоплазматическом ретикулуме крысы. Молекулы и клетки 26: 265–269.
- 14. Tsukumo Y, Tsukahara S, Saito S, Tsuruo T, Tomida A (2009) Новый сигнал экспорта эндоплазматического ретикулума: пролин в положении + 2 от сайта расщепления сигнального пептида.J Biol Chem 284: 27500–27510.
- 15. Vorum H, Jacobsen C, Honore B (2000) Калуменин взаимодействует с амилоидным P-компонентом сыворотки. FEBS Lett 465: 129–134.
- 16. Ostergaard M, Hansen GA, Vorum H, Honore B (2006) Протеомное профилирование фибробластов показывает модулирующий эффект внеклеточного калуменина на организацию актинового цитоскелета. Протеомика 6: 3509–3519.
- 17. Сайто К., Чен М., Бард Ф, Чен С., Чжоу Х. и др. (2009) TANGO1 облегчает погрузку грузов в местах выхода эндоплазматического ретикулума.Ячейка 136: 891–902.
- 18. Samson F, Donoso JA, Hellerbettinger I, Watson D, Himes RH (1979) Действие нокодазола на сборку тубулина, ультраструктуру аксонов и быстрый перенос аксоплазмы. Журнал фармакологии и экспериментальной терапии 208: 411–417.
- 19. Купер Дж. А. (1987) Эффекты цитохалазина и фаллоидина на актин. Журнал клеточной биологии 105: 1473–1478.
- 20. Hirokawa N, Noda Y, Tanaka Y, Niwa S (2009) Моторные белки суперсемейства кинезинов и внутриклеточный транспорт.Nat Rev Mol Cell Biol 10: 682–696.
- 21. Кардон Дж. Р., Вейл Р. Д. (2009) Регуляторы цитоплазматического динеинового двигателя. Nat Rev Mol Cell Biol 10: 854–865.
- 22. Хиршберг К., Миллер С.М., Элленберг Дж., Пресли Дж. Ф., Сиггиа Э.Д. и др. (1998) Кинетический анализ трафика секреторных белков и характеристика гольджи к промежуточным продуктам транспорта плазматической мембраны в живых клетках. J Cell Biol 143: 1485–1503.
- 23. Араки Ю., Кавано Т., Тару Х., Сайто Ю., Вада С. и др.(2007) Новый карго-алькадеин индуцирует ассоциацию везикул с моторными компонентами кинезина-1 и активирует аксональный транспорт. Embo J 26: 1475–1486.
- 24. Jaulin F, Xue X, Rodriguez-Boulan E, Kreitzer G (2007) Зависимый от поляризации селективный транспорт к апикальной мембране с помощью KIF5B в клетках MDCK. Dev Cell 13: 511–522.
- 25. Пресли Дж. Ф., Коул Н. Б., Шроер Т. А., Хиршберг К., Заал К. Дж. И др. (1997) Визуализация транспорта ER-to-Golgi в живых клетках. Природа 389: 81–85.
- 26. Kapitein LC, Schlager MA, Kuijpers M, Wulf PS, van Spronsen M, et al. (2010) Смешанные микротрубочки направляют транспорт груза в дендриты, управляемый динеином. Curr Biol 20: 290–299.
- 27. ван дер Воет М., Берендс К.В., Перро А., Нгуен-Нгок Т., Гончи П. и др. (2009) Связанные с NuMA LIN-5, ASPM-1, кальмодулин и динеин способствуют вращению мейотического веретена независимо от кортикального LIN-5 / GPR / Galpha. Nat Cell Biol 11: 269–277.
- 28. Burkhardt JK, Echeverri CJ, Nilsson T, Vallee RB (1997) Сверхэкспрессия субъединицы динамитина (p50) динактинового комплекса нарушает динеин-зависимое поддержание распределения мембранных органелл.J Cell Biol 139: 469–484.
- 29. Хирокава Н., Такемура Р. (2005) Молекулярные двигатели и механизмы направленного транспорта в нейронах. Nat Rev Neurosci 6: 201–214.
- 30. Ван Кью, Тенг Дж., Шен Б., Чжан В., Го Й и др. (2010) Характеристика кинезиноподобных белков в клетках заднего шелкопряда тутового шелкопряда. Cell Res 20: 713–727.
- 31. Возняк М.Дж., Аллан В.Дж. (2006) Выбор груза по конкретным изоформам легкой цепи 1 кинезина. Embo Journal 25: 5457–5468.
- 32. Belden WJ, Barlowe C (2001) Роль Erv29p в сборе растворимых секреторных белков в транспортные везикулы, полученные из ER. Наука 294: 1528–1531.
- 33. Kuehn MJ, Herrmann JM, Schekman R (1998) Взаимодействия COPII-груза направляют сортировку белков в транспортные везикулы, производные от ER. Nature 391: 187–190.
- 34. Wieland FT, Gleason ML, Serafini TA, Rothman JE (1987) Скорость объемного потока от эндоплазматического ретикулума к поверхности клетки.Ячейка 50: 289–300.
- 35. Martinez-Menarguez JA, Geuze HJ, Slot JW, Klumperman J (1999) Везикулярные тубулярные кластеры между ER и Гольджи опосредуют концентрацию растворимых секреторных белков путем исключения из везикул, покрытых COPI. Ячейка 98: 81–90.
- 36. Malkus P, Jiang F, Schekman R (2002) Концентрированная сортировка секреторных грузовых белков в везикулах, покрытых COPII. J Cell Biol 159: 915–921.
- 37. Полищук Е.В., Ди Пентима А., Луини А., Полищук Р.С. (2003) Механизм конститутивного экспорта из Гольджи: объемный поток через образование, выпячивание и расщепление единым блоком больших трубчатых доменов сети транс-Гольджи.Mol Biol Cell 14: 4470–4485.
- 38. Kelly RB (1985) Пути секреции белка у эукариот. Наука 230: 25–32.
- 39. Watson P, Forster R, Palmer KJ, Pepperkok R, Stephens DJ (2005) Сцепление выхода ER с микротрубочками посредством прямого взаимодействия COPII с динактином. Nat Cell Biol 7: 48–55.
- 40. Kreitzer G, Marmorstein A, Okamoto P, Vallee R, Rodriguez-Boulan E (2000) Кинезин и динамин необходимы для транспорта плазматической мембраны после Гольджи.Nat Cell Biol 2: 125–127.
- 41. Kanai Y, Dohmae N, Hirokawa N (2004) Кинезин транспортирует РНК: выделение и характеристика гранулы, транспортирующей РНК. Нейрон 43: 513–525.
- 42. Григорьев И., Сплинтер Д., Кейзер Н., Вульф П.С., Деммерс Дж. И др. (2007) Rab6 регулирует транспорт и нацеливание экзоцитотических носителей. Dev Cell 13: 305–314.
- 43. Григорьев И., Гувейя С.М., ван дер Ваарт Б., Деммерс Дж., Смит Дж. Т. и др. (2008) STIM1 — это белок, отслеживающий MT-плюс-конец, участвующий в ремоделировании ER.Curr Biol 18: 177–182.
- 44. Возняк MJ, Bola B, Brownhill K, Yang YC, Levakova V, et al. (2009) Роль кинезина-1 и цитоплазматического динеина в движении эндоплазматического ретикулума в клетках VERO. J Cell Sci 122: 1979–1989.
- 45. Курал С., Ким Х., Сайед С., Гошима Г., Гельфанд В.И. и др. (2005) Кинезин и динеин перемещают пероксисому in vivo: перетягивание каната или скоординированное движение? Science 308: 1469–1472.
- 46. Hendricks AG, Perlson E, Ross JL, Schroeder HW 3rd, Tokito M и др.(2010) Моторная координация с помощью механизма перетягивания каната управляет двунаправленным транспортом пузырьков. Curr Biol.
- 47. Мейер Д.И., Бургер М.М. (1979) Поверхность хромаффинных гранул: присутствие актина и характер его взаимодействия с мембраной. FEBS Lett 101: 129–133.
- 48. Burgoyne RD, Cheek TR (1987) Реорганизация периферических актиновых филаментов как прелюдия к экзоцитозу. Biosci Rep 7: 281–288.
- 49. Mili S, Moissoglu K, Macara IG (2008) Полногеномный скрининг выявляет APC-ассоциированные РНК, обогащенные клеточными выступами.Природа 453: 115–119.
- 50. Лансберген Г., Григорьев И., Мимори-Кийосуэ Ю., Оцука Т., Хига С. и др. (2006) CLASPs присоединяют плюс концы микротрубочек к коре клетки посредством комплекса с LL5beta. Dev Cell 11: 21–32.
- 51. Фу В., Тао В., Чжэн П., Фу Дж., Биан М. и др. Клатрин привлекает фосфорилированный TACC3 к полюсам веретена для сборки биполярного веретена и выравнивания хромосом. J Cell Sci 123: 3645–3651.
- 52. Ван X, Сонг X, Zhuo W, Fu Y, Shi H и др.(2009) Механизм регуляции секреции Hsp90alpha и его функция при злокачественных новообразованиях опухолей. Proc Natl Acad Sci U S A 106: 21288–21293.
- 53. Ли Х. Х., Го Й., Тэн Дж. Л., Дин М.Х., Ю-АЧ и др. (2006) 14-3-3 гамма влияет на динамику и целостность глиальных филаментов, связываясь с фосфорилированным GFAP. Журнал клеточной науки 119: 4452–4461.
- 54. Ван Кью, Тенг Дж., Шен Б., Чжан В., Го Й и др. (2010) Характеристика кинезиноподобных белков в клетках заднего шелкопряда Silkgland.Cell Res.
- 55. Setou M, Seog DH, Tanaka Y, Kanai Y, Takei Y и др. (2002) Белок GRIP1, взаимодействующий с глутаматным рецептором, напрямую направляет кинезин к дендритам. Nature 417: 83–87.
- 56. Ding C, Liang X, Ma L, Yuan X, Zhu X (2009) Противоположные эффекты Ndel1 и alpha1 или alpha2 на цитоплазматический динеин посредством конкурентного связывания с Lis1. J Cell Sci 122: 2820–2827.
- 57. Ван Ц., Шен Б., Чжэн П., Фенг Х., Чен Л. и др. (2010) Покровители тутового шелкопряда и их роль в расширении трубки заднего шелкопряда.PLoS ONE 5: e13252.
Органелл | Безграничная анатомия и физиология
Плазменная мембрана и цитоплазма
Плазматическая мембрана состоит из фосфолипидного бислоя, который регулирует концентрацию веществ, которые могут проникать в клетку.
Цели обучения
Объясните структуру и назначение плазматической мембраны клетки
Ключевые выводы
Ключевые моменты
- Все эукариотические клетки имеют окружающую плазматическую мембрану, также известную как клеточная мембрана.
- Плазматическая мембрана состоит из фосфолипидного бислоя со встроенными белками, который отделяет внутреннее содержимое клетки от окружающей среды.
- Только относительно небольшие неполярные материалы могут легко перемещаться через липидный бислой плазматической мембраны.
- Пассивный транспорт — это движение веществ через мембрану, которое не требует использования энергии, в то время как активный транспорт — это перемещение веществ через мембрану с использованием энергии.
- Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации; это происходит, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки.
Ключевые термины
- фосфолипид : любой липид, состоящий из диглицерида в сочетании с фосфатной группой и простой органической молекулой, такой как холин или этаноламин; они являются важными составляющими биологических мембран
- гипертонический : имеющий большее осмотическое давление, чем другой
- гипотонический : имеющий более низкое осмотическое давление, чем другое; клетка в этой среде заставляет воду попадать в клетку, вызывая ее набухание.
Плазменная мембрана
Несмотря на различия в структуре и функциях, все живые клетки в многоклеточных организмах имеют окружающую плазматическую мембрану (также известную как клеточная мембрана). Поскольку внешний слой вашей кожи отделяет ваше тело от окружающей среды, плазматическая мембрана отделяет внутреннее содержимое клетки от внешней среды. Плазматическая мембрана может быть описана как бислой фосфолипидов со встроенными белками, которые контролируют прохождение органических молекул, ионов, воды и кислорода в клетку и из нее.Отходы (такие как углекислый газ и аммиак) также покидают клетку, проходя через мембрану.
Плазматическая мембрана эукариот : Плазматическая мембрана эукариот представляет собой фосфолипидный бислой, в который встроены белки и холестерин.
Клеточная мембрана представляет собой чрезвычайно гибкую структуру, состоящую в основном из двух соседних листов фосфолипидов. Холестерин, который также присутствует, способствует текучести мембраны. Одиночная молекула фосфолипида состоит из полярной фосфатной «головы», которая является гидрофильной, и неполярного липидного «хвоста», которая является гидрофобной.Ненасыщенные жирные кислоты приводят к изгибам гидрофобных хвостов. Фосфолипидный бислой состоит из двух фосфолипидов, расположенных хвост к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны. Полярные головки контактируют с жидкостью внутри и снаружи ячейки.
Фосфолипидный бислой : фосфолипидный бислой состоит из двух смежных листов фосфолипидов, расположенных хвостом к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны.Полярные головки контактируют с жидкостью внутри и снаружи ячейки.
Основная функция плазматической мембраны — регулировать концентрацию веществ внутри клетки. Эти вещества включают ионы, такие как Ca ++ , Na + , K + и Cl — ; питательные вещества, включая сахара, жирные кислоты и аминокислоты; и продукты жизнедеятельности, особенно диоксид углерода (CO 2 ), которые должны покинуть ячейку.
Двухслойная липидная структура мембраны обеспечивает клетке контроль доступа за счет проницаемости.Фосфолипиды плотно упакованы вместе, в то время как мембрана имеет гидрофобную внутреннюю часть. Эта структура делает мембрану избирательно проницаемой. Мембрана, обладающая избирательной проницаемостью, позволяет без посторонней помощи проходить через нее только веществам, отвечающим определенным критериям. В случае плазматической мембраны только относительно небольшие неполярные материалы могут перемещаться через липидный бислой (помните, липидные хвосты мембраны неполярны). Некоторыми примерами этих материалов являются другие липиды, кислород и углекислый газ, а также спирт.Однако водорастворимые материалы, такие как глюкоза, аминокислоты и электролиты, нуждаются в некоторой помощи для прохождения через мембрану, потому что они отталкиваются гидрофобными хвостами фосфолипидного бислоя.
Транспортировка через мембрану
Все вещества, которые проходят через мембрану, делают это одним из двух общих методов, которые классифицируются в зависимости от того, требуется ли энергия. Пассивный (не требующий энергии) транспорт — это перемещение веществ через мембрану без затрат клеточной энергии.Во время этого типа транспорта материалы перемещаются за счет простой диффузии или облегченной диффузии через мембрану вниз по градиенту их концентрации. Вода проходит через мембрану в процессе диффузии, называемом осмосом. Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Это происходит, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки. Раствор с более высокой концентрацией растворенных веществ называется гипертоническим, а раствор с более низкой концентрацией растворенных веществ — гипотоническим.Молекулы воды будут диффундировать из гипотонического раствора в гипертонический раствор (если на них не действуют гидростатические силы).
Осмос : Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Если мембрана проницаема для воды, но не для растворенного вещества, вода выровняет свою концентрацию, диффундируя в сторону более низкой концентрации воды (и, следовательно, в сторону более высокой концентрации растворенного вещества). В стакане слева раствор с правой стороны мембраны гипертонический.
В отличие от пассивного транспорта, активный (требующий энергии) транспорт — это перемещение веществ через мембрану с использованием энергии аденозинтрифосфата (АТФ). Энергия расходуется, чтобы способствовать движению материала через мембрану в направлении против градиента их концентрации. Активный транспорт может происходить с помощью протеиновых насосов или везикул. Другой формой этого типа транспорта является эндоцитоз, при котором клетка окружает внеклеточные материалы, используя свою клеточную мембрану.Противоположный процесс известен как экзоцитоз. Здесь клетка экспортирует материал с помощью везикулярного транспорта.
Цитоплазма
Плазматическая мембрана клетки также помогает удерживать цитоплазму клетки, которая обеспечивает гелеобразную среду для органелл клетки. В цитоплазме происходит большинство клеточных процессов, включая метаболизм, сворачивание белков и внутреннюю транспортировку.
Эндоплазматическая сеть
Эндоплазматический ретикулум — это органелла, отвечающая за синтез липидов и модификацию белков.
Цели обучения
Опишите структуру эндоплазматического ретикулума и его роль в синтезе и метаболизме
Ключевые выводы
Ключевые моменты
- Если к эндоплазматическому ретикулуму (ER) прикреплены рибосомы, это называется грубым ER; в противном случае это называется гладкой ER.
- Белки, производимые грубым эндоплазматическим ретикулумом, предназначены для использования вне клетки.
- Функции гладкой эндоплазматической сети включают синтез углеводов, липидов и стероидных гормонов; детоксикация лекарств и ядов; и хранение ионов кальция.
Ключевые термины
- просвет : полость или канал внутри трубки или трубчатого органа.
- ретикулум : сеть
Эндоплазматическая сеть
Эндоплазматический ретикулум (ЭР) представляет собой серию взаимосвязанных мембранных мешочков и канальцев, которые в совокупности модифицируют белки и синтезируют липиды. Однако эти две функции выполняются в отдельных областях ER: грубая ER и гладкая ER. Полая часть канальцев ER называется просветом или цистернальным пространством.Мембрана ER, представляющая собой бислой фосфолипидов, залитый белками, непрерывна с ядерной оболочкой.
Черновая ER
Шероховатый эндоплазматический ретикулум : На этой микрофотографии, полученной с помощью просвечивающего электронного микроскопа, показан грубый эндоплазматический ретикулум и другие органеллы в клетке поджелудочной железы.
Шероховатый эндоплазматический ретикулум (RER) назван так потому, что рибосомы, прикрепленные к его цитоплазматической поверхности, придают ему вид шипов при просмотре в электронный микроскоп.Рибосомы переносят свои недавно синтезированные белки в просвет RER, где они претерпевают структурные модификации, такие как сворачивание или приобретение боковых цепей. Эти модифицированные белки будут включены в клеточные мембраны — мембраны ER или мембраны других органелл — или секретироваться из клетки (например, белковые гормоны, ферменты). RER также производит фосфолипиды для клеточных мембран. Если фосфолипиды или модифицированные белки не предназначены для того, чтобы оставаться в RER, они достигнут своего назначения через транспортные везикулы, которые отпочковываются от мембраны RER.Поскольку RER участвует в модификации белков (например, ферментов), которые будут секретироваться из клетки, RER в изобилии присутствует в клетках, которые секретируют белки. Это, например, случай с клетками печени.
Гладкая ER
Гладкая эндоплазматическая сеть (ГЭР) является продолжением RER, но на ее цитоплазматической поверхности мало или совсем нет рибосом. Функции SER включают синтез углеводов, липидов и стероидных гормонов; детоксикация лекарств и ядов; и хранение ионов кальция.В мышечных клетках специальный SER, называемый саркоплазматической сетью, отвечает за хранение ионов кальция, необходимых для запуска скоординированных сокращений мышечных клеток.
Аппарат Гольджи
Аппарат Гольджи сортирует и упаковывает материалы перед тем, как они покинут камеру, чтобы гарантировать, что они прибудут в нужное место назначения.
Цели обучения
Описать структуру аппарата Гольджи и его роль в модификации и секреции белков
Ключевые выводы
Ключевые моменты
- Аппарат Гольджи представляет собой серию уплощенных мешочков, которые сортируют и упаковывают клеточные материалы.
- Аппарат Гольджи имеет цис-грань на стороне ER и трансфокацию, противоположную ER.
- Лицо trans выделяет материалы в пузырьки, которые затем сливаются с клеточной мембраной для высвобождения из клетки.
Ключевые термины
- везикула : мембраносвязанный компартмент в клетке.
Аппарат Гольджи
Мы уже упоминали, что пузырьки могут отпочковываться из ER и транспортировать свое содержимое в другое место, но куда они деваются? Прежде чем добраться до конечного пункта назначения, липиды или белки в транспортных пузырьках все еще необходимо отсортировать, упаковать и пометить, чтобы они оказались в нужном месте.Сортировка, маркировка, упаковка и распределение липидов и белков происходит в аппарате Гольджи (также называемом телом Гольджи), в серии уплощенных мембран.
Аппарат Гольджи сортирует и упаковывает клеточные продукты. : Аппарат Гольджи в этом лейкоците виден как стопка полукруглых сплющенных колец в нижней части изображения. Рядом с аппаратом Гольджи можно увидеть несколько пузырьков.
Приемная сторона аппарата Гольджи называется цис-гранью.Противоположная сторона называется трансфайсом. Транспортные везикулы, сформированные из ER, перемещаются к цис-лицу, сливаются с ней и выводят свое содержимое в просвет аппарата Гольджи. Когда белки и липиды проходят через Гольджи, они претерпевают дальнейшие модификации, которые позволяют их сортировать. Наиболее частая модификация — добавление коротких цепочек молекул сахара. Эти недавно модифицированные белки и липиды затем маркируются фосфатными группами или другими небольшими молекулами, чтобы их можно было направить по назначению.
Наконец, модифицированные и помеченные белки упаковываются в секреторные пузырьки, которые отпочковываются из транс-поверхности Гольджи. В то время как некоторые из этих везикул откладывают свое содержимое в другие части клетки, где они будут использоваться, другие секреторные везикулы сливаются с плазматической мембраной и высвобождают свое содержимое за пределы клетки.
В другом примере формы, следующей за функцией, клетки, которые участвуют в большой секреторной активности (например, клетки слюнных желез, которые секретируют пищеварительные ферменты, или клетки иммунной системы, которые секретируют антитела), имеют большое количество Гольджи.В клетках растений аппарат Гольджи выполняет дополнительную роль в синтезе полисахаридов, некоторые из которых встраиваются в клеточную стенку, а некоторые используются в других частях клетки.
Лизосомы
Лизосомы — это органеллы, которые переваривают макромолекулы, восстанавливают клеточные мембраны и реагируют на чужеродные вещества, попадающие в клетку.
Цели обучения
Опишите, как лизосомы функционируют как система утилизации клеточных отходов.
Ключевые выводы
Ключевые моменты
- Лизосомы расщепляют / переваривают макромолекулы (углеводы, липиды, белки и нуклеиновые кислоты), восстанавливают клеточные мембраны и реагируют на чужеродные вещества, такие как бактерии, вирусы и другие антигены.
- Лизосомы содержат ферменты, разрушающие макромолекулы и чужеродных захватчиков.
- Лизосомы состоят из липидов и белков с единственной мембраной, покрывающей внутренние ферменты, чтобы не дать лизосомам переваривать саму клетку.
- Лизосомы находятся во всех клетках животных, но редко встречаются в клетках растений из-за прочной клеточной стенки, окружающей растительную клетку, которая не пропускает посторонние вещества.
Ключевые термины
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию
- лизосома : органелла, обнаруженная во всех типах клеток животных, которая содержит широкий спектр пищеварительных ферментов, способных расщеплять большинство биологических макромолекул.
Лизосома выполняет три основные функции: расщепление / переваривание макромолекул (углеводов, липидов, белков и нуклеиновых кислот), восстановление клеточной мембраны и реакция на чужеродные вещества, такие как бактерии, вирусы и другие антигены. Когда пища съедается или поглощается клеткой, лизосома высвобождает свои ферменты для расщепления сложных молекул, включая сахара и белки, в полезную энергию, необходимую клетке для выживания. Если пища не предоставляется, ферменты лизосомы переваривают другие органеллы внутри клетки, чтобы получить необходимые питательные вещества.
В дополнение к их роли в качестве пищеварительного компонента и средства рециркуляции органелл в клетках животных, лизосомы считаются частью эндомембранной системы. Лизосомы также используют свои гидролитические ферменты для уничтожения патогенов (болезнетворных организмов), которые могут проникнуть в клетку. Хороший пример этого — группа белых кровяных телец, называемых макрофагами, которые являются частью иммунной системы вашего тела. В процессе, известном как фагоцитоз или эндоцитоз, часть плазматической мембраны макрофага инвагинирует (складывается) и поглощает патоген.Инвагинированный участок с патогеном внутри затем отщепляется от плазматической мембраны и становится пузырьком. Везикула сливается с лизосомой. Затем гидролитические ферменты лизосомы уничтожают патоген.
Лизосомы переваривают чужеродные вещества, которые могут нанести вред клетке. : Макрофаг поглотил (фагоцитировал) потенциально патогенную бактерию, а затем сливается с лизосомами внутри клетки, чтобы уничтожить патоген. Другие органеллы присутствуют в клетке, но для простоты не показаны.
Лизосома состоит из липидов, составляющих мембрану, и белков, составляющих ферменты внутри мембраны. Обычно лизосомы имеют размер от 0,1 до 1,2 мкм, но размер варьируется в зависимости от типа клеток. Общая структура лизосомы состоит из набора ферментов, окруженных однослойной мембраной. Мембрана является важным аспектом ее структуры, потому что без нее ферменты в лизосоме, которые используются для разрушения чужеродных веществ, просочились бы и переварили всю клетку, вызывая ее гибель.
Лизосомы находятся почти в каждой животной эукариотической клетке. Они настолько распространены в клетках животных, потому что, когда клетки животных поглощают или поглощают пищу, им необходимы ферменты, содержащиеся в лизосомах, чтобы переваривать и использовать пищу для получения энергии. С другой стороны, лизосомы не часто встречаются в растительных клетках. Лизосомы не нужны растительным клеткам, потому что их клеточные стенки достаточно жесткие, чтобы удерживать крупные / чужеродные вещества, которые лизосомы обычно переваривают, из клетки.
Пероксисомы
Пероксисомы нейтрализуют вредные токсины и осуществляют липидный обмен и реакции окисления, расщепляющие жирные кислоты и аминокислоты.
Цели обучения
Назовите различные функции, которые пероксисомы выполняют внутри клетки.
Ключевые выводы
Ключевые моменты
- Липидный обмен и химическая детоксикация — важные функции пероксисом.
- Пероксисомы отвечают за реакции окисления, расщепляющие жирные кислоты и аминокислоты.
- Пероксисомы контролируют реакции, которые нейтрализуют свободные радикалы, вызывающие повреждение и гибель клеток.
- Пероксисомы химически нейтрализуют яды посредством процесса, в результате которого образуется большое количество токсичного H 2 O 2 , который затем превращается в воду и кислород.
- Печень — это орган, который в первую очередь отвечает за детоксикацию крови перед ее распространением по телу; в результате клетки печени содержат большое количество пероксисом.
Ключевые термины
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию
- свободный радикал : Любая молекула, ион или атом, имеющий один или несколько неспаренных электронов; они, как правило, обладают высокой реакционной способностью и часто встречаются только как временные частицы.
Пероксисомы
Тип органелл, обнаруженный как в клетках животных, так и в клетках растений, пероксисома представляет собой мембраносвязанную клеточную органеллу, которая в основном содержит ферменты. Пероксисомы выполняют важные функции, включая метаболизм липидов и химическую детоксикацию. Они также проводят реакции окисления, расщепляющие жирные кислоты и аминокислоты.
Пероксисомы : Пероксисомы представляют собой мембраносвязанные органеллы, которые содержат множество ферментов для детоксикации вредных веществ и метаболизма липидов.
В отличие от пищеварительных ферментов, содержащихся в лизосомах, ферменты в пероксисомах служат для переноса атомов водорода от различных молекул к кислороду, производя перекись водорода (H 2 O 2 ). Таким образом, пероксисомы нейтрализуют попадающие в организм яды, такие как алкоголь. Чтобы понять важность пероксисом, необходимо понять концепцию активных форм кислорода.
Активные формы кислорода (АФК), такие как пероксиды и свободные радикалы, являются высокореактивными продуктами многих нормальных клеточных процессов, включая митохондриальные реакции, которые производят АТФ и метаболизм кислорода.Примеры ROS включают гидроксильный радикал ОН, H 2 O 2 и супероксид (O -2 ). Некоторые АФК важны для определенных клеточных функций, таких как клеточные сигнальные процессы и иммунные ответы против чужеродных веществ. Однако многие АФК вредны для организма. Свободные радикалы реактивны, потому что они содержат свободные неспаренные электроны; они могут легко окислять другие молекулы по всей клетке, вызывая клеточное повреждение и даже смерть клетки. Считается, что свободные радикалы играют роль во многих деструктивных процессах в организме, от рака до ишемической болезни сердца.
Пероксисомы контролируют реакции, нейтрализующие свободные радикалы. В процессе они производят большое количество токсичного H 2 O 2 , но содержат ферменты, которые превращают H 2 O 2 в воду и кислород. Эти побочные продукты затем безопасно попадают в цитоплазму. Как и миниатюрные очистные сооружения, пероксисомы нейтрализуют вредные токсины, поэтому они не наносят вред клеткам. Печень — это орган, который в первую очередь отвечает за детоксикацию крови перед ее распространением по телу; клетки печени содержат исключительно большое количество пероксисом.
Митохондрии
Митохондрии — это органеллы, которые отвечают за выработку аденозинтрифосфата (АТФ), основной молекулы, переносящей энергию в клетке.
Цели обучения
Объясните роль митохондрий.
Ключевые выводы
Ключевые моменты
- Митохондрии содержат собственные рибосомы и ДНК; В сочетании с их двойной мембраной эти особенности предполагают, что когда-то они могли быть свободноживущими прокариотами, которые были поглощены более крупной клеткой.
- Митохондрии играют важную роль в клеточном дыхании за счет производства АТФ с использованием химической энергии, содержащейся в глюкозе и других питательных веществах.
- Митохондрии также ответственны за образование кластеров железа и серы, которые являются важными кофакторами многих ферментов.
Ключевые термины
- альфа-протеобактерии : таксономический класс внутри филума Proteobacteria — фототропные протеобактерии.
- аденозинтрифосфат : многофункциональный нуклеозидтрифосфат, используемый в клетках в качестве кофермента, часто называемый «молекулярной единицей энергетической валюты» при внутриклеточном переносе энергии
- кофактор : неорганическая молекула, необходимая для функционирования фермента
Одним из основных отличий прокариот от эукариот является наличие митохондрий.Митохондрии — это двухмембранные органеллы, содержащие собственные рибосомы и ДНК. Каждая мембрана представляет собой бислой фосфолипидов, залитый белками. Эукариотические клетки могут содержать от одной до нескольких тысяч митохондрий, в зависимости от уровня потребления энергии клеткой. Каждая митохондрия имеет длину от 1 до 10 микрометров (или больше) и существует в клетке в виде органеллы, которая может быть яйцевидной, червеобразной или сложно разветвленной.
Структура митохондрий
Большинство митохондрий окружены двумя мембранами, что могло бы произойти, когда один мембраносвязанный организм был поглощен вакуолью другим мембраносвязанным организмом.Внутренняя мембрана митохондрий обширна и включает значительные складки, называемые кристами, которые напоминают текстурированную внешнюю поверхность альфа-протеобактерий. Матрикс и внутренняя мембрана богаты ферментами, необходимыми для аэробного дыхания.
Структура митохондрий : На этой электронной микрофотографии показана митохондрия в просвечивающем электронном микроскопе. Эта органелла имеет внешнюю мембрану и внутреннюю мембрану. Внутренняя мембрана содержит складки, называемые кристами, которые увеличивают площадь ее поверхности.Пространство между двумя мембранами называется межмембранным пространством, а пространство внутри внутренней мембраны называется митохондриальным матриксом. Синтез АТФ происходит на внутренней мембране.
Митохондрии имеют собственную (обычно) кольцевую хромосому ДНК, которая стабилизируется за счет прикрепления к внутренней мембране и несет гены, аналогичные генам, экспрессируемым альфа-протеобактериями. Митохондрии также имеют особые рибосомы и транспортные РНК, которые напоминают эти компоненты у прокариот.Все эти особенности подтверждают гипотезу о том, что митохондрии когда-то были свободноживущими прокариотами.
Функция митохондрий
Митохондрии часто называют «электростанциями» или «энергетическими фабриками» клетки, потому что они отвечают за выработку аденозинтрифосфата (АТФ), основной молекулы, несущей энергию в клетке. АТФ представляет собой кратковременную запасенную энергию клетки. Клеточное дыхание — это процесс производства АТФ с использованием химической энергии, содержащейся в глюкозе и других питательных веществах.В митохондриях этот процесс использует кислород и производит углекислый газ в качестве побочного продукта. Фактически, углекислый газ, который вы выдыхаете при каждом вдохе, возникает в результате клеточных реакций, которые производят углекислый газ в качестве побочного продукта.
Важно отметить, что в мышечных клетках очень высокая концентрация митохондрий, производящих АТФ. Вашим мышечным клеткам нужно много энергии, чтобы ваше тело двигалось. Когда ваши клетки не получают достаточно кислорода, они не производят много АТФ. Вместо этого небольшое количество АТФ, которое они производят в отсутствие кислорода, сопровождается образованием молочной кислоты.
Помимо аэробной генерации АТФ, митохондрии выполняют несколько других метаболических функций. Одна из этих функций — генерировать кластеры железа и серы, которые являются важными кофакторами многих ферментов. Такие функции часто связаны с уменьшением происходящих из митохондрий органелл анаэробных эукариот.
Происхождение митохондрий
Существует две гипотезы о происхождении митохондрий: эндосимбиотическая и аутогенная, но наиболее признанной в настоящее время является эндосимбиоз.Эндосимбиотическая гипотеза предполагает, что митохондрии изначально были прокариотическими клетками, способными реализовывать окислительные механизмы. Эти прокариотические клетки могли быть поглощены эукариотом и стали эндосимбионтами, живущими внутри эукариота.
Специфический для клеточной линии дефект во внутриклеточном транспорте и высвобождении собранных ретровирусных капсидов
РЕФЕРАТ
Сборка ретровируса включает сложную серию событий, в которых большое количество белков должно быть нацелено на точку на плазматической мембране, где незрелые вирусы распускаются из клетки.Полипротеины Gag большинства ретровирусов собирают незрелый капсид на цитоплазматической стороне плазматической мембраны во время процесса почкования (сборка C-типа), но некоторые собирают незрелые капсиды глубоко в цитоплазме и затем транспортируются к плазматической мембране (B- или D-образная сборка), куда они обертываются. При обоих фенотипах сборки полипротеины Gag должны транспортироваться к месту образования почки вируса либо в относительно несобранной форме (тип C), либо в полностью собранной форме (типы B и D).Молекулярная природа этого транспортного процесса и задействованные факторы клетки-хозяина остаются неясными. Во время разработки рекомбинантной системы клеток бакуловируса / насекомых для экспрессии полипротеинов Gag C-типа и D-типа мы обнаружили линию клеток насекомых (High Five) с двумя отчетливыми дефектами, которые привели к уменьшенному высвобождению вирусоподобных частицы. Первым из них был выраженный дефект транспорта полипротеинов Gag D-типа, но не C-типа к плазматической мембране.Клетки High Five, экспрессирующие вирус обезьяны Mason-Pfizer дикого типа (M-PMV). Предшественники Gag накапливают собранные незрелые капсиды в больших цитоплазматических агрегатах, подобных мутанту с дефектом транспорта (MA-A18V). Напротив, большая часть молекул Gag, кодируемых мутантом морфогенеза M-PMV C-типа (MA-R55W) и молекулами вируса иммунодефицита человека, транспортировалась к плазматической мембране для сборки и образования почки вирионов. Когда меченные импульсами предшественники Gag из клеток High Five фракционировали по градиентам скорости, они оседали быстрее, что указывает на то, что они изолированы в комплексе с более высокой молекулярной массой.По сравнению с клетками насекомых Sf9, клетки High Five также демонстрируют дефект в высвобождении вирусных частиц C-типа. Эти данные подтверждают гипотезу о том, что факторы клетки-хозяина важны в процессе транспорта Gag и высвобождении оболочечных вирусных частиц.
Для сборки инфекционного ретровируса требуется скоординированная экспрессия минимум трех открытых рамок считывания, обнаруженных во всех ретровирусных геномах: gag , pol и env (55).Сборка ретровирусного капсида направляется продуктом гена gag , и экспрессии одного продукта гена gag достаточно для сборки ретровирусного незрелого капсида в цитоплазме с последующим почкованием и высвобождением оболочечных вирусоподобных частиц (VLP) из плазматическая мембрана (10, 17, 22, 23, 28, 39, 44, 48, 59). Ретровирусные полипротеины Gag, продукт экспрессии гена gag , синтезируются в цитоплазме и самоассоциируются друг с другом с помощью неопределенных молекулярных механизмов с образованием сферического незрелого капсида, содержащего геномную РНК.Полипротеины Gag содержат ряд основных аминокислот около аминоконца, и большинство из них модифицируются котрансляционным аминоконцевым миристоилированием, способствуя ассоциации с клеточными мембранами (21). В большинстве ретровирусов полипротеины Gag специфически взаимодействуют с плазматической мембраной, чтобы инициировать процесс почкования вируса, кульминацией которого является высвобождение внеклеточных незрелых VLP (см. Ссылку 25). Во время или сразу после вирусного почкования полипротеины Gag расщепляются вирусной протеиназой на структурные белки, которые составляют зрелый инфекционный вирион, и сферический незрелый капсид конденсируется с образованием асимметричного зрелого вирусного ядра (см. Ссылку 56).Во всех ретровирусах эти зрелые структурные белки включают матричный белок, связанный с вирусной мембраной; основной белок капсида, образующий асимметричное вирусное ядро; и белок нуклеокапсида, связанный с вирусной геномной РНК в ядре (26).
Дифференциальное время и клеточная локализация сборки полипротеина Gag относительно события почкования вируса разделяют ретровирусный морфогенез на два типа. Для ретровирусов C-типа, таких как вирус иммунодефицита человека типа 1 (ВИЧ-1) и вирус мышиного лейкоза Молони, полипротеины Gag транспортируются в виде мономеров или небольших олигомеров к плазматической мембране, где начинается сборка капсида и завершается одновременно с процессом почкования вируса. (16).Для ретровирусов B- и D-типа, таких как вирус опухоли молочной железы мыши и вирус обезьяны Mason-Pfizer (M-PMV), соответственно, незрелые капсиды полностью собираются в цитоплазме вдали от плазматической мембраны (13). Собранные капсиды должны затем мигрировать к плазматической мембране для отпочкования и высвобождения. Несмотря на эти различия, есть доказательства того, что фундаментальный механизм сборки всех ретровирусов одинаков: единичная точечная мутация в матричном белке M-PMV (R55W) преобразует сборку частиц из морфогенеза D-типа в C-тип (42).Таким образом, различия в процессе сборки ретровирусов C-типа и D-типа могут быть связаны только с нацеливанием полипротеина Gag на сайт сборки на клеточной мембране по сравнению с сайтом, расположенным глубже в цитоплазме клетки. Однако экспрессия полипротеинов Gag in vitro демонстрирует, что, хотя полипротеины Gag C- и D-типа могут собираться in vitro (2, 3, 19, 51, 53), M-PMV Gag является гораздо более эффективным субстратом для in vitro. реакция сборки (45). Сборка вдали от клеточных мембран наблюдалась, когда полипротеины Gag C-типа сверхэкспрессируются в клетках насекомых (9, 44), но для эффективной сборки ретровируса C-типа может потребоваться взаимодействие с мембранами клеток-хозяев или мембраносвязанными факторами.
Молекулярно-генетические исследования генов ретровирусов C- и D-типа gag показывают, что аминоконцевой матричный домен важен в направлении полипротеинов Gag к плазматической мембране. Матричный домен находится на периферии собранного или частично собранного незрелого капсида и тесно связан с клеточной мембраной во время и после события почкования вируса (15, 36). Удаление миристиновой кислоты или многоосновной области около аминоконца ослабляет аффинность связывания Gag-мембраны ВИЧ-1, а также препятствует активному транспорту полипротеинов Gag к клеточной мембране (29, 32, 52, 62).Кроме того, изменения в матричном домене ВИЧ-1 могут перенаправлять полипротеины Gag на альтернативные сайты (4, 12, 25). Подобные исследования M-PMV, прототипа ретровируса D-типа, также демонстрируют, что амино-концевое миристоилирование необходимо для направления полипротеинов Gag в форме собранных капсидов к плазматической мембране (41). Делеции в матричном домене M-PMV приводят к нестабильному полипротеину Gag, который быстро деградирует, и транспортные характеристики не могут быть оценены (43). Однако, когда точечные мутации, такие как A18V, вводятся в многоосновную область матричного домена M-PMV, миристоилированные и собранные капсиды не транспортируются к плазматической мембране, а вместо этого накапливаются в цитоплазме в месте их сборки (40).
Поскольку сборка C-типа редко наблюдается при экспрессии Gag M-PMV дикого типа, предполагается, что несобранные или частично собранные полипротеины Gag M-PMV исключены из процесса клеточного транспорта, который направляет собранные капсиды к плазматической мембране. . Только после завершения сборки незрелого капсида мотив матричного домена отображается для взаимодействия с клеточными транспортными элементами. Также было высказано предположение, что полипротеины Gag M-PMV содержат цитоплазматический сигнал нацеливания или удерживания (CTRS), который ограничивает транспорт к плазматической мембране до тех пор, пока не завершится сборка незрелого капсида (6, 42).Однако исключение несобранных полипротеинов Gag M-PMV из процесса транспорта может быть преодолено введением точечной мутации R55W, описанной выше, которая подвергается почкованию вируса C-типа на плазматической мембране. Таким образом, точечная мутация R55W должна либо изменять сигнал мембранного транспорта, так что он активен в несобранном полипротеине Gag, либо она должна ослаблять функцию CTRS. Альтернативные объяснения фенотипа R55W включают изменение характеристик сборки, так что мембраны необходимы для сборки или что сборка цитоплазмы менее эффективна, и тогда свободные мономеры Gag или небольшие мультимеры становятся доступными для транспорта к плазматической мембране.Однако анализ сборки M-PMV Gag R55W in vitro показывает, что измененный матричный домен не влияет на формирование капсида в отсутствие мембран, и подтверждает, что процесс сборки C-типа обусловлен изменением транспортных характеристик (46). Таким образом, для M-PMV фенотип сборки ретровируса C-типа по сравнению с D-типом зависит только от функциональной активности CTRS и / или способности клеточного транспортного аппарата распознавать несобранные полипротеины Gag по сравнению с собранными незрелыми капсидами.
Хотя некоторые из доменов Gag ретровирусов C-типа и D-типа, которые влияют на транспорт к плазматической мембране, были охарактеризованы, элементы клеточного транспортного аппарата, которые взаимодействуют с полипротеинами Gag, изучены недостаточно. Экспрессия ретровирусных полипротеинов Gag в различных линиях эукариотических клеток, включая клетки насекомых, приводит к сборке и высвобождению внеклеточных VLP с ультраструктурными характеристиками, идентичными характеристикам вирионов, полученных из инфицированных клеточных линий (9, 17, 49, 54, 60). ).В этом случае факторы клетки-хозяина, необходимые для транспорта Gag и высвобождения внеклеточных частиц, должны быть хорошо законсервированы. Линии клеток-хозяев, полностью дефектные в отношении активного транспорта ретровирусных незрелых капсидов или несобранных полипротеинов Gag, не описаны. Здесь мы сообщаем о линии клеток насекомых с выраженным дефектом транспорта полипротеинов Gag D-типа, но не C-типа к плазматической мембране.
МАТЕРИАЛЫ И МЕТОДЫ
Конструкции плазмидной ДНК. Все методы клонирования рекомбинантной ДНК следовали установленным методам, описанным в другом месте (47).Ферменты рестрикции и модификации были приобретены в New England Biolabs (Беверли, Массачусетс). Часть генома M-PMV (50), содержащая открытые рамки считывания M-PMV gag , pro и pol , была удалена из pSHRMX, модификации геномного клона pSHRM15 (39), с использованием сайта Hha I на нуклеотиде 486 и сайта Xho I, сконструированного в геном в конце рамки считывания pol , где нуклеотиды 5816 и 5817 (CT) были преобразованы в TC.Сайт Hha I был затуплен фрагментом Кленова (New England BioLabs), а геномный фрагмент был лигирован с вектором pSP73 (Promega, Мэдисон, Висконсин) с использованием Eco RI (затупленный конец фрагментом Кленова). и Sal I сайтов для создания плазмиды pSP73GX. Фрагмент Ssp I (нуклеотид pSP73 2012) — Sph I (нуклеотид 26) из полилинкера pSP73 и фланкирующей области затем лигировали с сайтами pSP73GX Sph I и Xho I (тупые концы с фрагментом Кленова). создать pSP73GXS.Затем последовательность M-PMV была удалена из pSP73GXS с Eco RI сайтов, затуплена фрагментом Кленова и лигирована с вектором переноса бакуловируса pBacPAK1 (Clontech, Пало-Альто, Калифорния) с использованием сайта Bam HI, затупленный закончился фрагментом Кленова, чтобы создать pBKMGXS. Вектор pBKMGXS был создан с матричным доменом M-PMV дикого типа, а также с точечными мутациями матрицы A18V, R55W и обеих A18V и R55W. Вирусная протеиназа была инактивирована ранее описанной точечной мутацией (D26N) в активном сайте во всех экспрессионных векторах M-PMV gag-pro-pol (49).Открытые рамки считывания ВИЧ-1 gag-pro-pol были удалены из провирусного клона (HXB2Dgpt) (14) путем конструирования сайта Xba I рядом с инициирующим кодоном gag и последующего удаления последовательности между Xba. Сайт I и сайт Nde I на нуклеотиде 5122. Сайт Nde I был затуплен фрагментом Кленова, а последовательность gag-pro-pol была лигирована с вектором pSP72 (Promega) с использованием Xba. I и фрагмент Кленова затупляли сайты Xho I для создания плазмиды pSP72HXBgag.Последовательность gag-pro-pol была удалена из pSP72HXBgag с сайтами Bam HI и Nde I (тупые концы с фрагментом Кленова) и лигированы с сайтами Bam HI и Stu I в векторе переноса бакуловируса. pBacPAK9 (Clontech) для создания плазмиды pBKHXBgag. Активный в отношении протеиназы ВИЧ-1 сайт был инактивирован точечной мутацией D25N, как и в случае векторов для переноса M-PMV gag .
Культура клеток насекомых. Образец линии клеток насекомых Spodoptera frugiperda (Sf9) был приобретен из Американской коллекции типов тканей.Клетки Sf9 выращивали при 27 ° C в стандартных колбах для тканевых культур с добавленной средой Грейса (JRH Biosciences, Lenexa, Kans.) С 10% фетальной бычьей сывороткой (Gibco BRL, Gaithersburg, MD). Клетки насекомых High Five ( Trichoplusia ni ) (Invitrogen, Carlsbad, CA) выращивали при 27 ° C в среде EX-CELL 405 от JRH без сыворотки.
Получение рекомбинантного бакуловируса. Векторы для переноса плазмид бакуловируса и предварительно расщепленная геномная ДНК бакуловируса были приобретены у Clontech (система BacPAK).Векторы для переноса, содержащие открытые рамки считывания M-PMV или HIV-1 gag-pro-pol , котрансфицировали предварительно переваренной геномной ДНК бакуловируса в клетки Sf9 с липофектином (Clontech), как указано производителем. Рекомбинантные бакуловирусы очищали, следуя ранее описанному протоколу для анализов конечного разведения, и проверяли на экспрессию M-PMV или HIV-1 Gag с помощью вестерн-блот-анализа клеточных лизатов (30).
Вестерн-блот-анализ клеточных лизатов и клеточных супернатантов.Клетки Sf9 и High Five были инфицированы рекомбинантным бакуловирусом с множественностью инфицирования 5. Через 40 часов после инфицирования клетки лизировали в буфере для загрузки белкового геля (47) и среду для культивирования клеток центрифугировали через 35% (масс. / об.) сахарозную подушку в роторе Beckman TLA 100.3 при 100000 об / мин в течение 30 мин для осаждения VLP. Осадки ресуспендировали в буфере для загрузки белкового геля. Затем 2% каждого клеточного лизата и осадка VLP анализировали электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и переносили на нитроцеллюлозную мембрану Protran BA85 (Schleicher & Schuell, Dassel, Германия).Блоты исследовали с помощью M-PMV и ВИЧ-1 Gag-специфической антисыворотки и вторичных антител, меченных пероксидазой хрена, а затем проявляли с помощью хемилюминесцентных реагентов SuperSignal (Pierce, Rockford, IL).
ЭМ инфицированных клеток насекомых. Через 48 часов после инфицирования при множественности инфицирования 5 рекомбинантным бакуловирусом, экспрессирующим гены M-PMV или ВИЧ-1 gag , клетки насекомых Sf9 и High Five промывали фосфатно-солевым буфером ( PBS) (pH 7,1) и ресуспендировали в 1% глутаровом альдегиде (Sigma-Aldrich Corp., Сент-Луис, Миссури) в PBS с 10 мг дубильной кислоты (Sigma) на мл в течение 1 ч на льду. Затем фиксированные клетки промывали PBS, ресуспендировали в 2% тетроксиде осмия в PBS с 5 мг дубильной кислоты на мл и обрабатывали для электронной микроскопии (EM), как описано ранее (7).
Метаболическое мечение клеток насекомых и анализ клеточных лизатов. Через 36 часов после заражения 60-мм планшетов с клетками Sf9 или High Five рекомбинантным бакуловирусом, экспрессирующим гены M-PMV или ВИЧ-1 gag , клетки промывали и голодали. в среде для культивирования клеток насекомых Grace’s без метионина (Gibco BRL) в течение 30 минут, а затем инкубировали в течение 30 минут в смеси для мечения белков 35 S (EXPRE 35 S 35 S; NEN Life Science Products, Бостон, Массачусетс .) при 100 мкКи / 300 мкл на планшет. Для импульсного мечения клетки затем лизировали на льду в 500 мкл буфера для экстракции капсида (1% [об. / Об.] Triton X-100 [Sigma], 10 мМ Трис [pH 7,6], 1 мМ EDTA, 500 мМ NaCl. ) в течение 30 мин. Для экспериментов с преследованием клетки инкубировали в течение 14 ч в полной ростовой среде после импульсного мечения, а затем лизировали, как указано выше. После лизиса клеток лизаты центрифугировали в охлаждаемой микроцентрифуге в течение 3 минут при 14000 об / мин и 4 ° C. Супернатант наносили на градиенты скорости сахарозы, содержащие от 5 до 20% (вес / объем) сахарозы с 10 мМ Трис (pH 7.6), 500 мМ NaCl и 1% (об. / Об.) Triton X-100 в пробирке Beckman SW41. Градиенты центрифугировали в роторе Beckman SW41 при 25000 об / мин в течение 30 минут при 4 ° C, и фракции объемом 1 мл собирали вручную сверху градиентов. Каждую фракцию градиента и среду для культивирования клеток иммунопреципитировали кроличьей анти-M-PMV Pr78 Gag или поликлональной антисывороткой человека против ВИЧ-1 и анализировали с помощью SDS-PAGE, как описано ранее (1). Белки M-PMV или HIV-1 Gag были количественно определены на высушенных гелях с помощью Storm 860 PhosphorImager, и данные были проанализированы с помощью программного обеспечения ImageQuant (Molecular Dynamics Inc., Саннивейл, Калифорния).
Временная экспрессия провирусного гена в клетках млекопитающих. Человеческие клетки 293T (11) выращивали при 37 ° C в атмосфере 5% CO 2 в модифицированной Дульбекко среде Игла (Gibco) с добавлением 10% фетальной бычьей сыворотки (Gibco). Клетки трансфицировали ДНК провирусной плазмиды M-PMV (pSHRM15 [описано выше]) с помощью ранее описанных методик (5). Через 36 часов после трансфекции клетки инкубировали в не содержащей метионина среде Игла, модифицированной Дульбекко (Sigma), в течение 30 минут, а затем в течение 30 минут подвергали импульсной метке с 250 мкКи смеси для мечения белка 35 S в 200 мкл метионин-метионина. свободная среда.После импульсного мечения клетки лизировали в буфере для экстракции капсида на льду в течение 30 мин и центрифугировали в микроцентрифуге, как описано выше. Для последовательных экспериментов среду для мечения удаляли и добавляли полную среду на 4 часа, после чего клетки лизировали, как указано выше. Супернатант каждого клеточного лизата центрифугировали в градиенте скорости сахарозы, как описано выше для лизатов клеток насекомых. Фракции градиента скорости сахарозы и среду для культивирования клеток подвергали иммунопреципитации и анализировали, как описано выше для клеток насекомых.
РЕЗУЛЬТАТЫ
SDS-PAGE и вестерн-блот-анализ экспрессии M-PMV и HIV-1 gag в клетках насекомых Sf9 и High Five. Сравнение относительных количеств M-PMV и HIV-1 Gag в инфицированной клетке лизаты и клеточные супернатанты, 2% каждого лизата клеток Sf9 и High Five и 2% осадка каждой клеточной среды анализировали с помощью SDS-PAGE с последующим вестерн-блоттингом и детектированием полипротеинов Gag с помощью Gag-специфической антисыворотки. Результаты (фиг.1) показывают почти равные количества Gag в клеточном лизате и супернатанте клеток Sf9 как для M-PMV, так и для ВИЧ-1.Напротив, M-PMV Gag отсутствовал в клеточном супернатанте клеток High Five, и уровни Gag ВИЧ-1 в супернатанте были заметно снижены по сравнению с таковыми в клетках Sf9. Хотя этот анализ не обеспечивает количественного измерения высвобождения Gag из инфицированных клеток, результаты ясно демонстрируют неэффективность высвобождения Gag как ВИЧ-1, так и M-PMV из клеток High Five. В случае M-PMV высвобождение Gag было заблокировано ниже уровня обнаружения в этом эксперименте, тогда как эффект на высвобождение HIV-1 Gag был менее значительным.
Рис. 1.SDS-PAGE и вестерн-блот-анализ лизатов клеток насекомых и сред для культивирования клеток. После экспрессии M-PMV Gag в клетках Sf9, Pr78 Gag можно увидеть как в клеточном лизате (дорожка 1), так и в среде для культивирования клеток (дорожка 2). ВИЧ Pr55 Gag также можно увидеть в клеточном лизате (дорожка 3) и культуральной среде (дорожка 4) клеток Sf9. Напротив, после экспрессии M-PMV Gag в клетках High Five, Pr78 Gag наблюдается в клеточном лизате (дорожка 5), но отсутствует в среде для культивирования клеток (дорожка 6).ВИЧ Pr55 Gag наблюдается в лизате High Five (дорожка 7) и среде для культивирования клеток (дорожка 8), но количество Pr55 Gag в культуральной среде заметно снижено по сравнению с таковым в клетках Sf9.
ЭМ-анализ инфицированных бакуловирусом клеток насекомых, экспрессирующих продукты гена ретровируса gag . Для дальнейшего изучения сборки и транспортных характеристик полипротеинов M-PMV и HIV Gag в клеточных линиях насекомых, как в клетках Sf9, так и в клетках High Five, инфицированных рекомбинантным бакуловирусом — экспрессирующие ретровирусные продукты гена gag были зафиксированы и визуализированы с помощью тонких срезов ЭМ.В клетках Sf9 полипротеины Gag M-PMV имели характеристики сборки и транспорта, очень похожие на ранее описанные результаты, полученные при экспрессии провирусного генома в клеточных линиях млекопитающих (рис. 2) (40, 42). Полипротеины Gag M-PMV с матричным доменом дикого типа (рис. 2A и B) собираются в цитоплазме клеток Sf9, и за этим следует транспорт интактных капсидов к плазматической мембране для отпочкования и высвобождения заключенных в оболочку VLP. Когда точечная мутация A18V была введена в матричный домен (рис.2C) сборка капсида не была затронута, но транспорт к плазматической мембране был полностью недостаточным, и вирусные капсиды накапливались в цитоплазме инфицированной клетки. Этот фенотип идентичен фенотипу, описанному ранее в клетках млекопитающих (40). С точечной мутацией матрицы R55W были доказательства сборки D-типа с относительно небольшими коллекциями частиц, оставшихся в цитоплазме (рис. 2E), а также отростка как D-типа, так и C-типа на плазматической мембране (рис. 2D). В клетках млекопитающих экспрессия Gag R55W приводит в первую очередь к сборке Gag C-типа на плазматической мембране с редкими скоплениями частиц в цитоплазме (39).ЭМ-изображения клеток насекомых, экспрессирующих полипротеины Gag с точечными мутациями как A18V, так и R55W (рис. 2F), идентичны изображениям клеток, экспрессирующих Gag A18V, и на поверхности клеток не наблюдали зачатков вирусов C- или D-типа. Поведение этого двойного мутанта в клетках млекопитающих было таким же, как и в клетках насекомых (данные не показаны). Таким образом, мутация A18V эффективно блокирует транспорт интактных капсидов M-PMV, а также отдельных несобранных или частично собранных полипротеинов Gag на поверхность клетки и является доминантным цис при совместной экспрессии с точечной мутацией матрицы R55W.
Рис. 2.Тонкий срез ЭМ клеток Sf9, экспрессирующих гены M-PMV gag . (A и B) Экспрессия Gag M-PMV дикого типа показывает полностью собранные незрелые капсиды, отпочковывающиеся от плазматической мембраны (стрелки) и внеклеточные псевдовирионы (ECV). (C) Экспрессия Gag A18V показывает собранные незрелые капсиды, накапливающиеся в цитоплазме (стрелка), без признаков образования почки вируса на плазматической мембране. (D и E) Экспрессия Gag R55W (D) показывает как сборку C-типа на плазматической мембране (стрелка обозначена C), так и отпочкование полностью собранных незрелых капсидов (стрелки обозначены как D), внеклеточных псевдовирионов (стрелка обозначена ECV) и редкие скопления собранных частиц остаются в цитоплазме (E).(F) Gag с точечными мутациями A18V и R55W показывает незрелые цитоплазматические капсиды (стрелка) без признаков образования почки вируса.
В клетках насекомых High Five, полипротеины Gag M-PMV дикого типа собирались в незрелые капсиды, но при этом имел место поразительный блок для внутриклеточного транспорта (рис. 3A). Незрелые капсиды дикого типа накапливались в цитоплазме в виде крупных включений, но не транспортировались к плазматической мембране. Этот фенотип аналогичен фенотипу точечной мутации A18V в этих клетках (рис.3Б), а также в клетках млекопитающих и насекомых Sf9. Напротив, некоторые из полипротеинов Gag M-PMV с мутацией матрикса R55W были транспортированы к плазматической мембране клеток High Five для инициации зачатия вируса C-типа (фиг. 3C-E). R55W Gag также собирается в цитоплазме в виде незрелых капсидов D-типа, и задержка частиц D-типа в цитоплазме очевидна. Хотя есть некоторые свидетельства отрастания завершенных капсидов на плазматической мембране, это может представлять завершение сборки C-типа перед экструзией мембраны, так как не было замечено никаких капсидов, проходящих к плазматической мембране.M-PMV Gag с точечными мутациями A18V и R55W (рис. 3F), собранными в цитоплазме клеток High Five, и на плазматической мембране не наблюдалось почкования C- или D-типа, что согласуется с доминантной природой мутации A18V. обсуждалось выше. Таким образом, клетки High Five имеют дефект в цитоплазматическом транспорте M-PMV Gag в виде собранных незрелых капсидов, который менее выражен для несобранных полипротеинов Gag.
Рис. 3.ЭМ тонких срезов клеток High Five, экспрессирующих гены gag M-PMV .(A и B) Экспрессия Gag M-PMV (A) дикого типа (A) и Gag M-PMV A18V (B) показывает собранные незрелые капсиды, накапливающиеся в цитоплазме без признаков зачатия вируса на плазматической мембране. (C — E) Экспрессия Gag R55W показывает сборку и удерживание D-типа в цитоплазме (стрелка обозначена как D), а также зарастание вируса C-типа на плазматической мембране (стрелки обозначены C) и внеклеточных VLP (стрелки обозначены ECV). (F) Gag с точечными мутациями A18V и R55W показывает накопление незрелых капсидов в цитоплазме без образования почки вируса на плазматической мембране.
полипротеинов Gag ВИЧ-1 собраны по типу C на плазматической мембране клеток млекопитающих, и аналогичные характеристики транспорта и сборки наблюдались в клетках насекомых Sf9 (фиг. 4A и B), включая высвобождение окруженных внеклеточных VLP. В отличие от M-PMV дикого типа, были четкие доказательства наличия полипротеинов Gag ВИЧ-1 в форме многочисленных почкующихся структур С-типа на плазматической мембране клеток High Five (рис. 4C). Уровень активности почкования вируса С-типа на плазматической мембране в клетках High Five (рис.4D) выглядел так же, как в клетках Sf9; однако, как показано на рис. 1 и рассматривается ниже, выпуск этих сборочных конструкций был значительно сокращен. Доказательства образования почкования C-типа полипротеинов Gag HIV-1 и M-PMV R55W на плазматической мембране клеток High Five предполагают, что в обоих случаях задействован общий транспортный механизм.
Рис. 4.ЭМ в тонком срезе экспрессии гена HIV-1 gag в линиях клеток Sf9 (A и B) и High Five (C и D). В обеих клеточных линиях события почкования C-типа наблюдаются на плазматической мембране (стрелки, обозначенные C), а внеклеточные VLP (стрелки, обозначенные ECV) видны в пространствах между соседними клетками.
Метаболическое мечение клеток насекомых Sf9 и High Five, экспрессирующих продукты гена ретровируса gag . Для количественного сравнения кинетики ретровирусной сборки и высвобождения внеклеточных псевдовирионов в двух различных клеточных линиях насекомых были проведены исследования метаболического мечения. Сразу после 30-минутного периода мечения или 14-часового периода преследования клетки Sf9 и High Five лизировали в неионогенном детергенте в условиях, которые, как известно, сохраняют интактность внутриклеточных незрелых капсидов (40).Лизаты клеток фракционировали с помощью скоростной седиментации в градиенте сахарозы, и каждую фракцию анализировали вместе с ресуспендированием осадка градиента и среды для культивирования клеток с помощью иммунопреципитации и SDS-PAGE. После импульсного мечения клеток Sf9 растворимые, несобранные полипротеины Gag M-PMV дикого типа оставались во фракциях на самом верху градиента скорости сахарозы от 5 до 20%, и не было дискретного пика в градиенте, предполагающего накопление сборочные промежуточные звенья (рис.5A и B, панели 1). Напротив, после 14-часового периода погони примерно 35% Pr78 Gag было обнаружено в собранных незрелых капсидах, которые осаждались в более низкие фракции (фракции 4, 5 и 6) в пределах градиента (рис. 5A и B). , панели 2). Кроме того, примерно 20% от общего количества Pr78 Gag было высвобождено в культуральную среду (фиг. 5C).
Рис. 5.SDS-PAGE анализ и количественное определение M-PMV Gag дикого типа в лизатах клеток насекомых и млекопитающих и среде для культивирования клеток.После метаболического мечения клеточные лизаты центрифугировали в градиенте сахарозы, и фракции собирали из верхней части градиентных пробирок, начиная с фракции 1 и заканчивая ресуспендированием градиентного осадка. (A) Каждую фракцию градиента и среду для культивирования клеток (обозначенную supn.) Из чейза разделяли с помощью SDS-PAGE, и показаны авторадиограммы экспрессии клеток насекомых. (B) Интенсивность полосы Gag в каждой фракции градиента скорости представлена в виде графика как процент от общей суммы всех полос из одного и того же импульсного или преследовательного эксперимента, включая культуральную среду для экспериментов с преследованием.(C) Интенсивность полосы Gag, представляющей каждую культуральную среду с преследованием клеток, графически изображена как процент от общего количества всех полос Gag (фракции клеточного лизата и культуральная среда) из того же эксперимента с преследованием.
Чтобы сравнить экспрессию в клетках млекопитающих с экспрессией в клетках насекомых, человеческие клетки 293T трансфицировали провирусной ДНК M-PMV, метили импульсами или импульсами, а затем преследовали в течение 4 часов. Лизаты клеток фракционировали по градиентам скорости сахарозы, как указано выше. В клетках 293T с импульсной меткой M-PMV Gag оставался в разобранном виде на вершине градиента, как это было видно с клетками Sf9, тогда как после 4-часовой погони было обнаружено примерно 30% меченого Gag M-PMV. в виде собранных капсидов (рис.5Б, панель 2, фракции 3, 4 и 5). Приблизительно 35% Pr78, оставшегося после погони, высвобождались в виде VLP в культуральной среде клеток (фиг. 5C). Профиль седиментации капсидов M-PMV, собранных в клетках насекомых, был подтвержден фракционированием очищенных капсидов M-PMV из клеток насекомых, инфицированных бакуловирусом, в параллельных градиентах. Эти капсиды также были локализованы во фракциях 4, 5 и 6 (данные не показаны). Таким образом, сборка, внутриклеточный транспорт и высвобождение M-PMV Gag в клетках насекомых Sf9 и в клетках млекопитающих сходны.
Результаты, полученные с клетками High Five, экспрессирующими Gag M-PMV дикого типа, значительно различались. В то время как M-PMV Gag из лизатов клеток Sf9 с импульсной меткой оставался на вершине градиента, полипротеины M-PMV Gag из лизатов клеток High Five с импульсной меткой оседали в градиенте до фракций 3, 4 и 5 (рис. 5A, панель 3 и рис. 5B, панель 1). Это может отражать ускоренную сборку частичных капсидов, которые теперь оседают в градиенте, или, что более вероятно, ассоциацию полипротеинов Gag с клеточными элементами с образованием комплексов с большей массой.После периода преследования полипротеины Gag M-PMV из лизатов клеток High Five осаждались в виде собранных капсидов с максимальными значениями во фракциях 5 и 6 (фиг. 5B, панель 2). Однако пик Pr78 заметно переходил в более плотную часть градиента, и в грануле было обнаружено значительно больше материала, возможно, как следствие ассоциации с клеточными элементами. Очень мало (<2%) M-PMV Pr78 можно было обнаружить в культуральной среде клеток High Five, экспрессирующих M-PMV Gag, после погони (рис.5С).
Экспрессия Gag ВИЧ-1 в клетках SF9 дала результаты, очень похожие на результаты, описанные выше для M-PMV Gag. В ячейках с импульсной меткой основная часть Pr55 Gag была разобрана и была обнаружена в двух верхних фракциях градиента (фиг. 6A и B, панели 1). После 14-часовой погони примерно 20% Pr55 Gag оставалось растворимым, в то время как примерно 15-20% оседало во фракции 7, 8 и 9 (фиг. 6B, панель 2). Предположительно это представляет собранные незрелые капсиды, которые остаются связанными с клетками даже после 14-часовой погони.Одна треть Gag ВИЧ-1 из клеток SF9 высвобождалась в среду для культивирования клеток в виде VLP после 14-часовой погони (фиг. 6C).
Рис. 6. АнализSDS-PAGE и количественное определение Gag ВИЧ-1 в лизатах клеток насекомых и в среде для культивирования клеток. После метаболического мечения клеточные лизаты центрифугировали в градиенте сахарозы, и фракции собирали из верхней части градиентных пробирок, начиная с фракции 1 и заканчивая ресуспендированием градиентного осадка. (A) Каждая фракция градиента и среда для культивирования клеток (помечены supn.) от погони были отделены с помощью SDS-PAGE, и показаны авторадиограммы. (B) Интенсивность полосы Gag в каждой фракции градиента скорости Sf9 и High Five (H5) представлена в виде графика как процент от общей суммы всех полос из одного и того же импульсного или преследовательного эксперимента, включая культуральную среду для экспериментов с преследованием. (C) Интенсивность полосы Gag, представляющей каждую культуральную среду с преследованием клеток, графически изображена как процент от общего количества всех полос Gag (фракции клеточного лизата и культуральная среда) из того же эксперимента с преследованием.
В отличие от M-PMV, основная масса полипротеина Gag ВИЧ-1 из лизатов клеток High Five с импульсной меткой оставалась в первых двух фракциях градиента (фиг. 6A, панель 3 и фиг. 6B, панель 1). Однако примерно 20% оседали во фракции 3, 4, 5 и 6, что повышает вероятность того, что часть Gag ВИЧ-1 также ассоциируется с клеточным компонентом в клетках High Five. После 14-часового периода погони примерно 30% Pr55 было обнаружено во фракциях 8 и 9 (фиг. 6B, панель 2), снова предположительно представляя собранные, но ассоциированные с клетками полипротеины Gag ВИЧ.Однако в отличие от клеток Sf9 примерно 30% Gag ВИЧ-1 было обнаружено во фракции осадка, а растворимый Pr55 в верхней части градиента содержал <2%. Это открытие может быть следствием ассоциации Pr55 с клеточными элементами в клетках High Five, как обсуждалось выше с M-PMV Gag. Хотя внеклеточные VLP были обнаружены с помощью EM, менее 6% Pr55 было высвобождено в культуральную среду High Five (фиг. 6C). Сниженные уровни как ВИЧ, так и M-PMV R55W (см. Ниже) внеклеточных VLP из клеток High Five, несмотря на данные EM, представленные выше, предполагают, что эти клетки также в некоторой степени дефектны в высвобождении VLP C-типа.
Как обсуждалось выше, мутация матрикса A18V блокирует транспорт незрелых капсидов M-PMV во всех клеточных линиях, изученных на сегодняшний день. Фракции градиента скорости из лизатов клеток Sf9 с A18V M-PMV Gag имели профиль, аналогичный профилю экспрессии M-PMV Gag дикого типа, за исключением увеличения количества незрелых внутриклеточных капсидов в преследующей клетке Sf9. лизат (рис. 7А, панель 2, фракции 4, 5 и 6). В отличие от M-PMV Gag дикого типа, менее 1% A18V Pr78 Gag было высвобождено в культуральную среду (рис.7B), демонстрируя эффект внутриклеточного транспортного блока, наблюдаемый в EM-анализе (см. Выше). Профили градиента скорости R55W Gag во фракциях лизата клеток Pulse и Chase Sf9 существенно не отличались от профилей M-PMV Gag дикого типа, но наблюдалось увеличение фракции R55W Pr78 Gag , высвобожденной в культуральную среду. после 14-часовой погони (высвобождено 30% R55W Pr78 [Рис. 7B]). Фракция R55W Pr78 Gag C-типа, высвобожденная из клеток Sf9, была аналогична фракции, наблюдаемой с Pr55 Gag ВИЧ-1 C-типа (см. Выше).
Рис. 7. АнализSDS-PAGE и количественное определение M-PMV Gag с матричными мутациями (A18V, R55W и двойной мутант A18V / R55W) в лизатах клеток Sf9 и High Five (H5) и в среде для культивирования клеток. После метаболического мечения клеточные лизаты центрифугировали в градиенте сахарозы, и фракции собирали из верхней части градиентных пробирок, начиная с фракции 1 и заканчивая ресуспендированием градиентного осадка. (A) Каждая фракция градиента и среда для культивирования клеток из чейза были разделены с помощью SDS-PAGE, и относительная интенсивность полосы Gag в каждой фракции градиента скорости представлена в виде графика как процент от общего количества всех полос от одного и того же импульса или чейз-эксперимент, включая питательную среду для чейз-экспериментов.(B) Интенсивность Gag-полосы, представляющей каждый супернатант клеточного преследования, графически изображена как процент от общего количества Gag-полос (фракции клеточного лизата и культуральная среда) из того же эксперимента с преследованием.
Экспрессия матричных мутантных полипротеинов Gag M-PMV A18V и R55W в клетках High Five дала результаты, аналогичные тем, которые наблюдались с Gag M-PMV дикого типа в этих клетках. В клетках High Five с импульсной меткой и R55W, и Gag A18V осаждались во фракции 3, 4 и 5 (фиг. 7A, панель 3).Хотя M-PMV R55W Gag и HIV-1 Gag продемонстрировали сборку C-типа на плазматической мембране в клетках High Five, профили градиента скорости, меченные импульсами, сильно различались (рис. 6B, панель 1 и рис. 7A, панель 3). ). Если взаимодействие с клеточным элементом (ами) отвечает за меченный импульсами M-PMV профиль градиента скорости в клетках High Five, это взаимодействие не должно полностью мешать транспорту M-PMV R55W Gag к плазматической мембране. В то время как почкующиеся структуры C-типа наблюдались с M-PMV R55W Gag в клетках High Five (см. ЭМ-анализ выше), менее 1% R55W Pr78 высвобождалось в среду для культивирования клеток High Five (рис.7Б). Как обсуждалось выше, клетки High Five могут иметь дефект высвобождения внеклеточных VLP, который не зависит от дефекта транспорта Gag M-PMV.
Экспрессия Gag M-PMV с двойным матричным мутантом (A18V и R55W) дала результаты, очень похожие на результаты, наблюдаемые с одним матричным мутантом A18V (фиг. 7). Таким образом, мутация A18V действует как доминантный негативный транспортный блок, что подтверждает результаты проведенного выше EM-анализа.
ОБСУЖДЕНИЕ
Для большинства ретровирусов (спумавирусы являются заметным исключением) высвобождение оболочечной внеклеточной вирусной частицы требует, чтобы полипротеины Gag специфически взаимодействовали с плазматической мембраной во время процесса почкования вируса.Тот факт, что почкование вируса ограничивается только плазматической мембраной, свидетельствует о том, что механизмы клеточного транспорта должны активно направлять ретровирусные полипротеины Gag исключительно в это место в клетке. Существуют и другие доказательства того, что факторы клетки-хозяина участвуют в транспорте полипротеина Gag. Исследования клеточного истощения АТФ демонстрируют, что АТФ необходим для транспорта M-PMV Gag, что предполагает активное участие клеточных белков с активностью АТФазы в этом процессе (57). HIV-1 Gag взаимодействует как с микротрубочками, так и с микрофиламентами как возможный механизм процесса активного транспорта (24, 27, 38, 58).Кроме того, рецептор Gag, находящийся исключительно на плазматической мембране, может потребоваться для вставки и закрепления матричного домена Gag в плазматической мембране (предложено в ссылке 59). Направленное почкование и секреция вирионов ВИЧ-1, наблюдаемые, когда инфицированные моноциты прикрепляются к монослоям эпителиальных клеток, также предполагают, что взаимодействие факторов клетки-хозяина с ретровирусными полипротеинами Gag необходимо для координации сборки и высвобождения окруженных внеклеточных VLP (35). Хотя сообщалось о линиях Т-клеток и моноцитов, в которых полипротеины Gag ВИЧ-1 транспортируются к альтернативным клеточным мембранам для образования почки вируса (18, 31, 34), линии клеток-хозяев полностью дефектны в отношении активного транспорта ретровирусных незрелых капсидов или в несобранном виде. Полипротеины Gag не описаны.
В клетках насекомых Sf9 экспрессия продуктов гена M-PMV или HIV gag приводит к сборке незрелого капсида D- или C-типа, соответственно, с последующим почкованием вируса и высвобождением внеклеточных VLP (17, 49). Таким образом, эти клетки насекомых обладают способностью транспортировать полипротеины Gag как C-, так и D-типа к плазматической мембране и позволяют завершить процесс почкования вируса даже при наличии цитопатического эффекта бакуловируса. По сравнению с клетками Sf9, клетки насекомых High Five имеют дефект в транспортировке собранных капсидов к плазматической мембране, что препятствует высвобождению внеклеточных VLP.Визуализация клеток насекомых High Five с помощью тонкого среза EM показывает, что незрелые капсиды M-PMV дикого типа собираются в цитоплазме, но не транспортируются к плазматической мембране. Напротив, подобное количество почкующихся структур наблюдали в исследованиях с помощью ЭМ как линий клеток Sf9 и High Five, экспрессирующих Gag ВИЧ-1, так и в клетках, экспрессирующих Gag M-PMV R55W. Хотя эти наблюдения не являются количественными, они предполагают, что предшественники Gag, которые собираются на плазматической мембране, могут транспортироваться туда с одинаковой эффективностью в обоих типах клеток.Мутация R55W позволяет по крайней мере части несобранных полипротеинов Gag M-PMV избежать транспортного дефекта в клетках High Five, но не транспортного дефекта, вызванного мутацией A18V, что позволяет предположить, что для каждого дефекта задействован свой механизм. Если эффект мутации A18V заключается в отсутствии активного транспорта к плазматической мембране, дефект клеток High Five может быть следствием рестриктивного механизма удержания цитоплазмы, который может быть устранен мутацией R55W. В качестве альтернативы могут существовать отдельные и независимые механизмы для транспорта собранных капсидов и несобранных полипротеинов Gag.В этом случае клетки High Five могут иметь селективный дефект в макромолекулярном транспорте собранных капсидов M-PMV, в то время как транспорт несобранных полипротеинов Gag остается неизменным. В любом случае ясно, что клетки High Five имеют отсутствующий или измененный фактор (факторы) клетки-хозяина, который участвует в транспорте частиц D-типа, но менее важен в транспорте несобранных полипротеинов Gag.
Эксперименты по метаболическому мечению клеток насекомых, экспрессирующих продуктов гена gag , демонстрируют еще один дефект в высвобождении внеклеточных VLP из клеток High Five.Количественный анализ количества M-PMV и HIV Gag в культуральной среде клеток Sf9 показывает, что значительная часть полипротеинов Gag C- и D-типа завершает процесс почкования вируса и высвобождается в виде внеклеточных псевдовирионов. Тот же анализ клеток High Five показывает заметное снижение высвобождения VLP как C-, так и D-типа. В то время как отсутствие Gag M-PMV D-типа в культуральной среде клеток High Five объясняется дефектом транспорта, наблюдаемым с помощью ЭМ тонких срезов, заметного снижения полипротеинов C-типа нет.Эксперименты по метаболическому мечению предлагают более количественное измерение высвобождения внеклеточных частиц, и они предполагают, в сочетании с данными ЭМ, что, хотя полипротеины Gag C-типа транспортируются к плазматической мембране клеток High Five и инициируют почкование вируса, существует дефект завершения вирусного почкования и высвобождения оболочечных VLP. Этот второй клеточно-зависимый дефект согласуется с рядом предыдущих исследований, которые предположили роль факторов клетки-хозяина в завершении события почкования вируса (8, 20, 33, 37, 61).
Лизаты клеток насекомых, меченных Pulse-chase, фракционировали с помощью седиментации с градиентом скорости сахарозы для измерения доли полипротеинов Gag, которые собрались в незрелые капсиды в течение периода преследования. Как последовательный, но неожиданный результат, полипротеины M-PMV и, в меньшей степени, Gag ВИЧ в лизатах клеток High Five с импульсной меткой оседают в градиенте несколькими фракциями. Напротив, и M-PMV, и Gag ВИЧ-1 в лизатах клеток Sf9 с импульсной меткой остаются в верхних фракциях градиента, как и ожидалось, после короткого периода мечения с недостаточным временем, отведенным для сборки капсида.Сборка капсида M-PMV в течение короткого периода мечения несовместима с предыдущей характеристикой кинетики сборки M-PMV в клетках млекопитающих (40) и является маловероятным объяснением седиментационных характеристик Gag M-PMV в лизате клеток High Five с импульсной меткой. градиенты скорости. Клетки High Five имеют умеренное увеличение (в два-три раза [данные не показаны]) уровней экспрессии Gag по сравнению с клетками Sf9, но это различие вряд ли приведет к ускоренной сборке незрелого капсида.Более правдоподобным объяснением является то, что M-PMV Gag и, в меньшей степени, HIV-1 Gag могут связываться с клеточными структурами с образованием комплекса с более высоким значением S вскоре после синтеза в клетках High Five, и что эта ассоциация может сохраняться во время клеточного лизис и седиментация в градиенте скорости. Связывание Gag M-PMV с импульсной меткой с клеточными структурами может быть следствием рестриктивной системы удержания цитоплазмы и может объяснять дефект транспорта D-типа, наблюдаемый в клетках High Five. Хотя C-тип M-PMV Gag (R55W) способен транспортироваться к плазматической мембране в клетках High Five, значительное количество частиц также сохраняется в цитоплазме, что может объяснить сходный внешний вид M-PMV дикого типа и R55W M -PMV Gag в анализе градиента скорости клеточного лизата High Five.
В заключение, линия клеток насекомых High Five имеет отдельные дефекты, включающие транспорт ретровирусных полипротеинов Gag к плазматической мембране и завершение процесса почкования вируса. Дефект транспорта наиболее выражен для полипротеинов Gag M-PMV D-типа, предполагая, что эффективность транспорта Gag D-типа чувствительна к изменениям в факторах клетки-хозяина, которые менее важны для транспорта Gag C-типа. Дефект почкования и высвобождения, наблюдаемый с полипротеинами Gag C-типа, свидетельствует о том, что факторы клетки-хозяина могут способствовать или мешать эффективному завершению процесса почкования вируса и высвобождению внеклеточных VLP.Линии клеток-хозяев со специфическими и серьезными дефектами на этих поздних стадиях жизненного цикла ретровирусов не были описаны на сегодняшний день, и представленные здесь данные предоставляют убедительные доказательства участия клеточных факторов во время транспорта Gag и образования почки вируса. Клеточная линия High Five может оказаться полезным инструментом в поиске специфических факторов клетки-хозяина, которые помогают или мешают эффективному внутриклеточному транспорту полипротеинов Gag и продукции внеклеточной вирусной частицы.
БЛАГОДАРНОСТИ
Мы благодарим Юджина Армса и центр электронной микроскопии UAB Comprehensive Cancer Center за помощь в проведении электронно-микроскопического анализа.
Эта работа была поддержана грантом AI01263 Службы общественного здравоохранения США S.D.P. и CA27834 на имя E.H.
СНОСКИ
- Получено 15 июля 1999 г.
- Принято 12 октября 1999 г.
- Авторское право © 2000 Американское общество микробиологии, 2000 г.
Везикула — определение, типы и функции
Определение везикулы
Везикулы представляют собой компартменты, образованные липидным бислоем, отделяющим его содержимое от цитоплазмы или внеклеточной среды на основе жидкости.Они могут содержать жидкости или газы и выполнять широкий спектр функций в клетках всего живого мира от регулирования плавучести до секреции гормонов.
Слово «пузырь» происходит от латинского слова vesicula , означающего «маленький мочевой пузырь», и может также относиться к волдырям в теле или пузырькам газа в вулканических породах.
Примеры везикул
Пузырьки встречаются у бактерий, архей и растений, а также у животных. В каждой клетке они выполняют различную функцию, и одна и та же клетка может иметь разные типы везикул, участвующих в различных ролях
Вакуоли
Почти все клетки растений, а также многие простейшие и грибы имеют заполненный жидкостью центральный отсек, называемый вакуолью.Он содержит ионы, сахара, аминокислоты, некоторые белки, ферменты и продукты жизнедеятельности. Мембрана, окружающая вакуоль, называется тонопластом, и этот термин является показателем ее роли в поддержании тургорного давления внутри клетки. Тургорное давление имеет решающее значение для того, чтобы растение оставалось в вертикальном положении. Тонопласт может регулировать концентрацию ионов в цитоплазме и, таким образом, изменять ее pH. Низкий уровень pH внутри вакуоли помогает активировать ферменты, разрушающие биологические материалы. Вакуоль также играет роль в улавливании отходов и защите остальной части клетки от повреждений.
Размер и количество вакуолей могут варьироваться в зависимости от потребностей клетки. Вакуоли животных обычно являются частью более крупных движений внутри клетки, таких как экзоцитоз или эндоцитоз.
Сократительные вакуоли
Сократительные вакуоли — это органеллы, которые подвергаются периодическому росту и сокращению, чтобы регулировать содержание воды и ионов в клетке, особенно у одноклеточных организмов, не имеющих клеточной стенки. Большинство клеток имеют более высокую концентрацию ионов, чем внеклеточная область, особенно в пресноводной среде.В таких условиях вода может проникать через небольшие поры в клеточной мембране и в конечном итоге вызывать взрыв клетки из-за избыточного давления воды. Сократительная вакуоль защищает от этого за счет использования протонных насосов на своей мембране для втягивания воды в себя во время фазы роста или диастолы. Периодически вакуоль сжимается и снова выталкивает воду во внеклеточную область. Хотя точный состав мембраны или даже сократительный механизм этих вакуолей неизвестны, они наблюдались как пульсирующие органеллы у многих видов, особенно у протистов, таких как амеба и парамеций.
Синаптические пузырьки
Синаптические пузырьки находятся на терминальном конце аксонов в нервных клетках (нейронах) и содержат нейротрансмиттеры — небольшие молекулы, участвующие в передаче электрохимических сигналов от одной клетки к другой. Эти структуры сливаются с плазматической мембраной нейрона в ответ на быстрое изменение электрического мембранного потенциала. Это высвобождает нейротрансмиттеры в синаптическую щель, узкую область, разделяющую два нейрона. Затем нейротрансмиттеры связываются и активируют рецепторы в следующем или постсинаптическом нейроне, генерируя потенциал действия, который затем передается по длине этого нейрона.
Синаптические везикулы маленькие, около 40 нм в диаметре, и содержат на своих мембранах два типа белков. Первые — это протонные насосы, которые позволяют избирательно поглощать нейротрансмиттеры. Другая группа участвует в транспортировке везикул к мембране и рециркуляции нейромедиаторов.
Типы везикул
Везикулы можно классифицировать на основе множества факторов, от функции до местоположения и характера их груза. В зависимости от их функции их можно разделить на те, которые участвуют в транспорте, пищеварении, защите, секреции или осморегуляции.Их также можно классифицировать как внутриклеточные или внеклеточные везикулы в зависимости от того, где они находятся. Наконец, хотя большинство из них содержат жидкости, некоторые микроорганизмы также используют пузырьки газа для оптимизации фотосинтеза и регулирования плавучести.
Газовые пузырьки
Газовые пузырьки — это структуры, которые наблюдаются у архей и многих водных видов и, возможно, позволяют микробам подниматься или опускаться в толще воды, чтобы найти оптимальные условия для выживания и фотосинтеза. Газовая везикула также позволяет клетке располагать фотосинтетические пигменты близко к поверхности клетки, рядом с мембраной.Эти структуры необычны, потому что они образованы исключительно мембраной на основе белка, которая не имеет липидного компонента. Однако эти белки чрезвычайно гидрофобны и поэтому могут создавать барьер между содержимым цитоплазмы и секвестрированными газами.
Также известные как экзосомы, эти структуры обнаружены во внеклеточной жидкости почти всех эукариот. Они участвуют в межклеточной передаче сигналов и содержат большие биополимеры, а иногда даже генетический материал.Фактически, они используются в сигнальных путях всего живого мира, от бактерий, использующих экзосомы, для передачи генетического материала млекопитающим, использующим его для презентации антигена и созревания иммунных клеток. Они играют роль в росте и развитии клеток, а также в контролируемой гибели клеток, также известной как апоптоз. Экзосомы также имеют решающее значение для удаления продуктов жизнедеятельности цитоплазмы и удаления белков плазматической мембраны.
Внутриклеточные пузырьки, участвующие в пищеварении
Лизосомы — это небольшие структуры, наблюдаемые в клетках животных, которые заполнены пищеварительными ферментами.Они могут сливаться с другими мембранными структурами, и комбинированный пузырек может действовать как пищеварительная органелла. Лизосомы могут сливаться с пищевыми вакуолями одноклеточных организмов, таких как амеба, или эндоцитарными пузырьками, содержащими патогены, которые поглощаются клетками иммунной системы.
Лизосома содержит впечатляющий арсенал ферментов, все из которых действуют как гидролазы — они катализируют распад макромолекул за счет добавления воды. Эти ферменты работают при более низком pH, чем цитоплазма, и могут гидролизовать нуклеиновые кислоты, белки, углеводы и липиды, все из которых являются полимерами, образованными в результате реакции дегидратации.Интересно, что сама лизосома защищена от собственных мощных ферментов, потому что большинство ее мембранных белков сильно гликозилировано с добавлением нескольких молекул сахара. В случае случайного разрыва лизосомы нейтральный pH цитоплазмы замедляет действие этих ферментов и защищает клетку от длительного повреждения.
На изображении показана бактерия, захваченная амебой, которая затем переваривает ее и использует аминокислоты и простые углеводы для подпитки своей деятельности.Отходы выводятся путем экзоцитоза, когда везикула сливается с клеточной мембраной.
На этом изображении показан фагоцитоз иммунной клетки. Первоначально патоген распознается и поглощается с образованием структуры, называемой фагосомой. Лизосома сливается с фагосомой, и ферменты лизосомы переваривают микроб. Макрофаги — это специализированные фагоциты иммунной системы, которые могут поглощать и переваривать все, от клеточного мусора и мелких патогенов до крупных раковых клеток с аномальными антигенами на их поверхности.
Внутриклеточные транспортные везикулы
Везикулы также участвуют в массовом переносе материалов из одной части клетки в другую. Например, белки, синтезируемые в шероховатом эндоплазматическом ретикулуме, выборочно отправляются в пузырьки, которые становятся частью обширной сети Гольджи.
Попадая в сеть Гольджи, эти белки модифицируются и отправляются по назначению на основе сигналов в их аминокислотной последовательности. Некоторые гидролитические ферменты переносятся в лизосомы, в то время как другие везикулы сливаются с плазматической мембраной и доставляют мембранные белки.Эти транспортные везикулы также важны для транспортировки гидрофобных липидных частиц через водную цитоплазму.
Внутриклеточные секреторные пузырьки
Другой класс пузырьков создается в сети Гольджи, и это пузырьки, несущие груз, который необходимо секретировать. Это могут быть белки и углеводы, необходимые для образования внеклеточного матрикса или ферментов, кофакторы, гормоны и пептиды, которые работают вне клетки и переносятся кровью или лимфой.Например, секреторные везикулы из клеток фибробластов высвобождают гликопротеины, коллагены и другие волокнистые материалы, составляющие внеклеточный матрикс. Клетки костей секретируют минералы и белки матрикса, в то время как хрящевые клетки (хондроциты) участвуют в секреции гликозаминогликанов и протеогликанов. Эти выделения продолжаются постоянно, без каких-либо внешних сигналов. Однако синаптические везикулы являются примерами везикул, которые сливаются с плазматической мембраной в ответ на сигнал потенциала действия.Другими примерами являются клетки, выделяющие гормоны, ферменты или слизь.
Функции везикул
Как видно из различных типов везикул, они могут участвовать в плавучести и оптимизации фотосинтеза (газовые везикулы), межклеточной передаче сигналов и материальном обмене (экзосомы), внутриклеточном пищеварении (лизосомы), транспорте и секреции (везикулы, возникающие из сети Гольджи). . Он может перевозить любой тип груза, от больших апоптотических пузырьков и патогенов до биополимеров, а также отходов.Они необходимы для образования и поддержания плазматической мембраны, внеклеточного матрикса и внутренней цитоплазматической структуры. Везикулы также имеют решающее значение для функционирования клеток, участвующих во внеклеточном пищеварении, например, выстилающих органы пищеварения, такие как слюнные железы. Наконец, организм поддерживает гомеостаз, координируя действия различных органов через свою нервную и эндокринную системы. Обе эти системы органов нуждаются в правильном функционировании везикулярной сети для выполнения своих задач.
- Апоптоз — Контролируемая запрограммированная гибель клеток, которая является нормальной частью роста и созревания организма.
- Презентация антигена — Процесс, с помощью которого клетки иммунной системы захватывают антигены и представляют их Т-клеткам, позволяя организму различать патогены и собственные клетки.
- Эндоцитоз — Массовое поглощение материала клеткой через инвагинацию плазматической мембраны.
- Экзоцитоз — Высвобождение большого количества материала из клетки, когда вакуоль или везикула сливаются с плазматической мембраной.
Тест
1. Какие из этих пузырьков участвуют в осморегуляции?
A. Газовый пузырек
B. Сократительная вакуоль
C. Лизосома
D. Синаптический пузырек
Ответ на вопрос № 1
B правильный. Сократительные вакуоли особенно важны для осморегуляции одноклеточных животных в пресноводной среде. Они забирают лишнюю воду из цитоплазмы и периодически изгоняют ее, тем самым защищая клетку от осмотического стресса.Газовая везикула участвует в оптимизации фотосинтеза и регулировании плавучести, тогда как лизосома в первую очередь является органеллой, участвующей во внутриклеточном пищеварении. Синаптические везикулы находятся в основном в нейронах и участвуют в передаче сигналов от одной нервной клетки к другой. 2. Какова роль синаптического пузырька в передаче сигналов по нейрону?
A. Секвестрирует нейротрансмиттеры и высвобождает их в синаптической щели
B. Переработка нейромедиаторов
C. Селективное поглощение нейротрансмиттеров с помощью протонных насосов
D. Все вышеперечисленное
Ответ на вопрос № 2
D правильный. Все это функции синаптических пузырьков. Они содержат протонные насосы на своей мембране, которые позволяют им избирательно концентрировать внутри себя нейротрансмиттеры, и участвуют как в высвобождении нейротрансмиттеров в синаптическую щель, так и в их обратном захвате и рециркуляции.
3. Какие из этих клеток выделяют материал исключительно в ответ на внешний раздражитель?
А. Хондроциты, секретирующие материал для образования хрящевого матрикса
B. Остеобласты, секретирующие минералы и белки
C. Слюнные железы, секретирующие ферменты
D. Ни один из вышеперечисленных
Ответ на вопрос № 3
C правильный.
