Теория скольжения мышечного волокна: Теория скольжения филаментов
Теория скольжения филаментов
Взаимодействие мышечных белков лежит в основе нашего нынешнего понимания сокращения саркомера. Как оно происходит? Это как-то связано со скользящим взаимодействием между актином и миозином.
Основные понятия
Перед тем, как углубиться в физиологию, ознакомимся с основной терминологией.
На электронной микрофотографии тонкого среза мышечных волокон изображена группа нитей.
Рисунок 1. 1 — тонкие нити (I тип, красные нити) — не интенсивная, длительная работа.
2 — толстые нити (II тип, белые нити) — интенсивная и кратковременная работа.
Каждый массив нитей — миофибрилла — имеет форму цилиндра, внутри которого чередуются пучки тонких и толстых нитей. Внутри волокна нити находятся в строгом порядке, так что области с одинаковой плотностью находятся рядом друг с другом, за счет чего волокно имеет характерную полосатую окраску в поляризованном световом микроскопе. Единица между двумя темными полосами — 
В продольном разрезе группы миофибрилл имеется полоса низкой плотности, называемая I-полосой. В центре I-полосы имеется заметная плотная линия, называемая Z-диском. Область между двумя линиями Z — саркомером — может считаться основной структурной и функциональной единицей, непосредственно ответственной за сокращение мышц. Таким образом, миофибриллу можно рассматривать как группу саркомеров.
Группа миофибрилл образует симпласт. На поверхности мышечной клетки плазматическая мембрана (сарколемма) образует впячивания, где формируется система Т-трубочек, обеспечивающая сокращение миоцитов. Представляет собой сеть взаимосвязанных колец, каждое из которых окружает миофибриллу и обеспечивает важный путь коммуникации между наружной частью волокна и миофибриллами, которые расположены глубоко внутри волокна.
Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый
Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый
Мышечные белки
Основной составляющей толстых нитей является миозин. Каждая толстая нить состоит из около 250 молекул миозина. Миозин играет две важные роли: структурную как строительный блок для толстых нитей и функциональную как катализатор распада АТФ во время сокращения и взаимодействия с актином в составе силового генератора мышц. Хвост длиной около 120 нм состоит из двух цепей белка, каждая из которых намотана на так называемую α-спираль, вместе образуя структуру спиральных катушек. На другом конце молекулы две белковые цепи образуют две глобулярные головные области, которые обладают способностью сочетаться с белковым актином и несут ферментативные сайты для гидролиза АТФ.
В средней части толстой нити молекулы собраны в хвост-хвост. Вдоль остальной части нити наматываются с головы до хвоста. Хвостовые части молекул образуют сердцевину нити; головные части выступают из нити.
Тонкие нити содержат три разных белка: актин, тропомиозин и тропонин. Актин, составляющий около 25 % белка миофиламентов, является основным компонентом тонких нитей в мышцах. Актиновые молекулы повторяются каждые 2,75 нм вдоль тонкой нити. Они создают спиральную структуру, которая может рассматриваться как двойная или одинарная спираль.
Тропомиозин представляет собой стержнеобразную молекулу длиной около 40 нм. Имеет структуру, аналогичную структуре хвоста миозина, являющейся спиральным звеном двух белковых цепей. Каждая молекула тропомиозина находится в контакте с семью актиновыми единицами.
Тропонин представляет собой комплекс из трех различных субъединиц белка: I, T и C. Тропонин С может связывается с кальциевыми ионами. Тропонин T присоединяется к тропомиозину, образуя с ним тропонин-тропомиозиновый комплекс.
Тропонин и тропомиозин участвуют в регуляции сокращения и расслабления мышц. Одной из субъединиц является рецептор для Ca2+, высвобождаемый из саркоплазматического ретикулума при активации мышцы. Считается, что связывание кальция затем приводит к дальнейшим структурным изменениям взаимодействия актина, тропомиозина и другой субъединицы тропонина, которые приводят к сокращению путем активации взаимодействия актин-миозин.
Историческая справка
В 1954 году ученые опубликовали две новаторские статьи, описывающие молекулярную основу сокращения мышц. В этих работах описывалось положение миозиновых и актиновых филаментов на разных стадиях сокращения мышечных волокон и предлагалось, как это взаимодействие вызывает сократительную силу. Используя микроскопию высокого разрешения, А. Ф. Хаксли и Р. Нидерберг (1954) и Х. Э. Хаксли и Дж. Хансон (1954) наблюдали изменения в саркомерах по мере сокращения мышечной ткани. Они заметили, что одна зона повторного саркомера, «полоса А», оставалась относительно постоянной по длине во время сокращения. Полоса А содержит толстые нити миозина. Предполагалось, что миозиновые нити остаются центральными и постоянными по длине, в то время как другие области саркомера сокращаются.
Ф. Хаксли и Р. Нидерберг (1954) и Х. Э. Хаксли и Дж. Хансон (1954) наблюдали изменения в саркомерах по мере сокращения мышечной ткани. Они заметили, что одна зона повторного саркомера, «полоса А», оставалась относительно постоянной по длине во время сокращения. Полоса А содержит толстые нити миозина. Предполагалось, что миозиновые нити остаются центральными и постоянными по длине, в то время как другие области саркомера сокращаются.
Эти наблюдения побудили их предложить теорию скользящих нитей, в которой говорится, что скольжение актина относительно миозина вызывает напряжение мышц. Поскольку актин привязан к структурам, расположенным на боковых концах каждого саркомера, называемых z-дисками или «z-полосами», любое сокращение длины нити актина приведет к сокращению саркомера и, следовательно, мышцы.
Механизм сжатия
Когда нервный импульс от головного и спинного мозга переносится по двигательному нейрону в мышечное волокно, Ca
Увеличение концентрации ионов кальция стимулирует высвобождение нейротрансмиттера ацетилхолина в синаптической щели.
Нейротрансмиттер связывается с рецептором на сарколемме, происходит деполяризация, и генерируется потенциал действия через мышечное волокно для сокращения мышц. Потенциал действия распространяется по всему мышечному волокну и перемещается в соседние волокна вдоль Т-трубочек.
Инициируется выделение ионов кальция из саркоплазматического ретикулума, которые стимулируют сокращение мышц. Последовательность сокращения мышц, объясняемая моделью скользящих нитей, выглядит следующим образом:
1. Блокировка головной части миозина:
Актин и миозин перекрывают друг друга, образуя поперечный мостик. Поперечный мостик активен только тогда, когда головка миозина прикреплена, как крючок, к нити актина. Когда мышца находится в состоянии покоя, перекрытие актиновой нити к головке миозина блокируется тропомиозином. Миофиламент актина находится в положении покоя.
2. Выделение иона кальция:
Нервный импульс, вызывающий деполяризацию и потенциал действия в сарколемме, вызывает выброс ионов кальция. Ион кальция связывается с тропониновым комплексом на нити актина, сдвигая тропомиозин из его места блокировки. Миофиламент актина находится в активном положении.
3. Поперечный мостик:
Поперечный мостик между актином и миозином действует как фермент (миозин АТФ-аза), который гидролизует АТФ, хранящийся в головке миозина, в АДФ, вследствие чего высвобождается энергия. Эта освобожденная энергия используется для перемещения головки миозина в направлении актиновой нити. Головка миозина наклоняется и тянет актиновую нить так, что миозин и актиновая нить скользят друг к другу. Противоположные концы нитей актина в саркомере движутся в направлении друг к другу, что приводит к сокращению мышцы. После сближения поперечный мостик отсоединяется, а актин и миозиновая нить возвращаются в исходное положение.
Аналогия, наглядно иллюстрирующая теорию
Представьте, что вы стоите между двумя большими шкафами с книгами. Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
Регуляция
АТФ поставляет энергию, как и было описано выше, но что делает кальций? Кальций требуется двум белкам (тропонину и тропомиозину), которые регулируют сокращение мышц. В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В 1994 году Уильям Леман и его коллеги продемонстрировали, как тропомиозин вращается, изучая форму актина и миозина в богатых кальцием растворах и растворах, содержащих низкий уровень кальция (Lehman, Craig, & Vibertt, 1994). Сравнивая действие тропонина и тропомиозина в этих двух условиях, они обнаружили, что присутствие кальция является существенным для механизма сжатия. В отсутствие свободного кальция связывание актина и миозина не происходит, поэтому наличие свободного кальция является важным регулятором мышечного сокращения.
Нерешённые вопросы
Ученым предстоит выяснить о нескольких белках, которые явно влияют на сокращение мышц. Например, молекулы, такие как титин, необычно длинный и «упругий» белок, охватывающий саркомеры у позвоночных, предположительно связывается с актином. Кроме того, ученые исследовали мышечные клетки, которые сокращаются по иному принципу. Например, некоторые мышцы у моллюсков и членистоногих выдерживают силовую нагрузку в течение долгого времени — явление, иногда называемое «уловкой» или силовым гистерезисом (Hoyle, 1969). Изучение этих и других примеров пластичности мышц — захватывающие возможности для новых открытий в биологии.
Кроме того, ученые исследовали мышечные клетки, которые сокращаются по иному принципу. Например, некоторые мышцы у моллюсков и членистоногих выдерживают силовую нагрузку в течение долгого времени — явление, иногда называемое «уловкой» или силовым гистерезисом (Hoyle, 1969). Изучение этих и других примеров пластичности мышц — захватывающие возможности для новых открытий в биологии.
Источники:
4. Структура мышечного волокна. Теория сокращения мышц (скольжение нитей). Расслабление и утомление мышц. Тренировка. Гипертрофия и атрофия мышц.
Скелетные мышцы
состоят из клеток (мышечных волокон).
Каждое мышечное волокно — это многоядерная
клетка цилиндрической формы диаметром
20-80 мкм и длиной от нескольких миллиметров
до десятков сантиметров, соответствующей
длине мышцы. Многоядерные волокна
исчерченных мышц образуются путём
слияния одноядерных клеток — миобластов. В мышце волокна объединены в пучки по
20-40 волокон и отделены друг от друга
соединительной тканью. К этой оболочке
со стороны мышечной клетки прилегает
плазматическая мембрана — сарколемма.
Содержимое мышечного волокна называется
саркоплазмой. В составе саркоплазмы
выделяют миофибриллы, миоглобин,
гликоген, саркоплазматический ретикулум
(система продольных трубочек и вытянутых
мешочков, которые содержат кальций). В
каждом волокне имеется около 2000 миофибрилл
диаметром 1-2 мкм, проходящих от одного
конца волокна до другого.
В мышце волокна объединены в пучки по
20-40 волокон и отделены друг от друга
соединительной тканью. К этой оболочке
со стороны мышечной клетки прилегает
плазматическая мембрана — сарколемма.
Содержимое мышечного волокна называется
саркоплазмой. В составе саркоплазмы
выделяют миофибриллы, миоглобин,
гликоген, саркоплазматический ретикулум
(система продольных трубочек и вытянутых
мешочков, которые содержат кальций). В
каждом волокне имеется около 2000 миофибрилл
диаметром 1-2 мкм, проходящих от одного
конца волокна до другого.
Миофибриллы сгруппированы в пучки и проходят через все волокно, не прерываясь. Они разделяются на темные и светлые диски. Темные диски называются анизотропными, а светлые – изотропными. Светлые полосы в центре имеют Z-мембрану, а темные Н-полоску. Участок миофибриллы между двумя Z-мембранами длинной 2-3 мм называется саркомером.
Каждый саркомер
состоит из перекрывающихся толстых
протофибрилл (миозиновых) длиной
1,6 мкм и диаметром 16 нм
и тонких протофибрилл (актиновых) длиной
1 мкм и диаметром 8 нм. Тонкие протофибриллы прикрепляются к
Z-дискам и образуют изотропную I-полосу.
Толстые протофибриллы в центре саркомера
образуют анизотропную А-полосу.
Тонкие протофибриллы прикрепляются к
Z-дискам и образуют изотропную I-полосу.
Толстые протофибриллы в центре саркомера
образуют анизотропную А-полосу.
В области перекрытия протофибриллы образуют гексогональную структуру, в которой одну миозиновую нить окружают шесть актиновых. Взаимодействие между толстыми и тонкими протофибриллами осуществляется с помощью поперечных мостиков, которые выступают из миозиновых протофибрилл.
Кроме актина,
тонкая протофибрилла содержит фибриллярный
белок тропомиозин и глобулярный белок
тропонин. Три белка в тонкой
протофибрилле находятся в определённом
соотношении: на 7 глобул двойной нити
актина приходится по одной молекуле
тропомиозина и тропонина.Стержнеподобные
молекулы тропомиозина длиной около
40 нм располагаются
в бороздках актиновой суперспирали и
взаимодействуют конец к концу. С каждой
молекулой тропомиозина связывается
молекула тропонина, состоящая из
трёх субъединиц: тропонин — связывающей
субъединицы, ингибиторной субъединицы
и кальций-связывающей субъединицы,
имеющей четыре кальцийсвязывающих
центра. В процессе
гидролиза АТФ миозином освобождается
энергия, обеспечивающая движение головок
миозина.
В процессе
гидролиза АТФ миозином освобождается
энергия, обеспечивающая движение головок
миозина.
Теория сокращения мышц (скольжение нитей)
Сокращение мышцы связано с возникновением потенциала действия на мембране мышечного волокна, который распространяется по сарколемме и поступает во внутрь волокна. Распространяющийся нервный импульс способствует выходу ионов кальция из саркоплазматического ретикулума. Вышедшие из ретикулума ионы кальция связываются с тропонином и тропомиозином. Эти белки изменяют свое положение на нити актина. В результате этого процесса устраняется препятствие, которое тормозило взаимодействие актиновых и миозиновых волокон. Головки миозина прикрепляются к актиновым нитям и осуществляют продольную тягу. В результате происходит скольжение актиновых нитей между миозиновыми.
Связывание кальцием
тропонина ведет к освобождению
миозин-АТФазы, которая расщепляет
молекулу АТФ и освобождается энергия.
Образовавшаяся молекула АДФ и
неорганический фосфат удаляются с
головки, а на их месте образуется новая
молекула АТФ. Освободившаяся энергия
расходуется для разрыва связи поперечного
мостика актина и миозина.
Освободившаяся энергия
расходуется для разрыва связи поперечного
мостика актина и миозина.
Этот цикл может повторяться до тех пор, пока в саркоплазме есть ионы кальция и АТФ.
Механизм мышечного сокращения реферат по медицине
РГУФКСиТ Реферат по физиологии Тема: «Механизм мышечного сокращения» Выполнила: студентка 2-го курса, специализации МРиТ Брояк Оксана Проверила: Захарьева Наталья Николаевна План реферата 1. Анатомо-физиологические особенности строения мышечного волокна 3 2. Электрические явления в мышце при сокращении 4 3. Основные параметры электромиограммы и их связь с функциональным состоянием мышцы (сила мышечного напряжения, степень утомляемости и др.) 6 4. Механизмы сокращения и расслабления мышечного волокна. Теория скольжения. Роль саркоплазматического ретикулума и ионов кальция в сокращении 8 5. Энергетика мышечного сокращения 13 6. Формы сокращения мышц (изотоническая, изометрическая, смешанная) 16 7. Особенности одиночных и тетанических мышечных сокращений медленных и быстрых мышечных волокон. Связь исходной длины и силы сокращения скелетной мышцы. Зависимость между силой и скоростью сокращения мышц 20 8. Механизм регуляции силы сокращения мышц (число активных ДЕ, частота импульсации мотонейронов, синхронизация сокращения мышечных волокон отдельных ДЕ во времени) 21 9. Значение АТФ в процессе сокращения мышечных волокон. Характеристика энергетических систем, обеспечивающих ресинтез АТФ, их мощность и ёмкость 23 Заключение 25 Используемая литература 26 По теории скольжения, в основе сокращения лежит механическое взаимодействие между миозиновыми и актиновыми миофиламентами благодоря образованию между ними в период активности попереречных мостиков. Непосредственным источником энергии для мышечного сокращения является расщепление высокоэнергетического вещества АТФ. В мышце происходит также промежуточная реакция, вовлекающая 2-ое высокоэнергетическое вещество – креатинфосфат (КФ). Оно не может действовать как непосредственный источник энергии, поскольку его расщепление не оказывает влияние на сократительные белки мышцы.
Связь исходной длины и силы сокращения скелетной мышцы. Зависимость между силой и скоростью сокращения мышц 20 8. Механизм регуляции силы сокращения мышц (число активных ДЕ, частота импульсации мотонейронов, синхронизация сокращения мышечных волокон отдельных ДЕ во времени) 21 9. Значение АТФ в процессе сокращения мышечных волокон. Характеристика энергетических систем, обеспечивающих ресинтез АТФ, их мощность и ёмкость 23 Заключение 25 Используемая литература 26 По теории скольжения, в основе сокращения лежит механическое взаимодействие между миозиновыми и актиновыми миофиламентами благодоря образованию между ними в период активности попереречных мостиков. Непосредственным источником энергии для мышечного сокращения является расщепление высокоэнергетического вещества АТФ. В мышце происходит также промежуточная реакция, вовлекающая 2-ое высокоэнергетическое вещество – креатинфосфат (КФ). Оно не может действовать как непосредственный источник энергии, поскольку его расщепление не оказывает влияние на сократительные белки мышцы. КФ обеспечивает энергией ресинтез АТФ. В свою очередь, энергия для ресинтеза КФ обеспечивается окислением. Молекулярный механизм сокращения мышечного волокна состоит в том, что возникающий на мембране в области концевой пластинки потенциал действия распространяется по системе поперечных трубочек вглубь волокна, вызывает деполяризацию мембран цистерн саркоплазматического ретикулума и освобождение из них ионов кальция. Свободные ионы кальция в межфибриллярном пространстве запускают процесс сокращения. Совокупность процессов, обуславливающих распространение потенциала действия вглубь мышечного волокна, выход ионов кальция из саркоплазматического ретикулума, взаимодействие сократительных белков и укорочение мышечного волокна называют «электрическим сопряжением». Энергия гребкового движения одного мостика производит перемещение на 1% длины актиновой нити. Для дальнейшего скольжения сократительных белков друг относительно друга мостики между актином и миозином должны распадаться и вновь образовываться на следующем центре связывания Са2+-.
КФ обеспечивает энергией ресинтез АТФ. В свою очередь, энергия для ресинтеза КФ обеспечивается окислением. Молекулярный механизм сокращения мышечного волокна состоит в том, что возникающий на мембране в области концевой пластинки потенциал действия распространяется по системе поперечных трубочек вглубь волокна, вызывает деполяризацию мембран цистерн саркоплазматического ретикулума и освобождение из них ионов кальция. Свободные ионы кальция в межфибриллярном пространстве запускают процесс сокращения. Совокупность процессов, обуславливающих распространение потенциала действия вглубь мышечного волокна, выход ионов кальция из саркоплазматического ретикулума, взаимодействие сократительных белков и укорочение мышечного волокна называют «электрическим сопряжением». Энергия гребкового движения одного мостика производит перемещение на 1% длины актиновой нити. Для дальнейшего скольжения сократительных белков друг относительно друга мостики между актином и миозином должны распадаться и вновь образовываться на следующем центре связывания Са2+-. Такой процесс происходит в результате активации в этот момент молекул миозина. Миозин приобретает свойства фермента АТФ-азы, который вызывает распад АТФ. Выделившаяся при распаде АТФ энергия приводит к разрушению имеющихся мостиков и образованию в присутствии Са2+новых мостиков на следующем участке актиновой нити. В результате повторения подобных процессов многократного образования и распада мостиков сокращается длина отдельных саркомеров и всего мышечного волокна в целом. Максимальная концентрация кальция в миофибрилле достигается уже через 3 мс после появления потенциала действия в поперечных трубочках, а максимальное напряжение мышечного волокна — через 20 мс. Весь процесс от появления мышечного потенциала действия до сокращения мышечного волокна называется электромеханической связью (или электромеханическим сопряжением). В результате сокращения мышечного волокна актин и миозин более равномерно распределяются внутри саркомера, и исчезает видимая под микроскопом поперечная исчерченность мышцы.
Такой процесс происходит в результате активации в этот момент молекул миозина. Миозин приобретает свойства фермента АТФ-азы, который вызывает распад АТФ. Выделившаяся при распаде АТФ энергия приводит к разрушению имеющихся мостиков и образованию в присутствии Са2+новых мостиков на следующем участке актиновой нити. В результате повторения подобных процессов многократного образования и распада мостиков сокращается длина отдельных саркомеров и всего мышечного волокна в целом. Максимальная концентрация кальция в миофибрилле достигается уже через 3 мс после появления потенциала действия в поперечных трубочках, а максимальное напряжение мышечного волокна — через 20 мс. Весь процесс от появления мышечного потенциала действия до сокращения мышечного волокна называется электромеханической связью (или электромеханическим сопряжением). В результате сокращения мышечного волокна актин и миозин более равномерно распределяются внутри саркомера, и исчезает видимая под микроскопом поперечная исчерченность мышцы.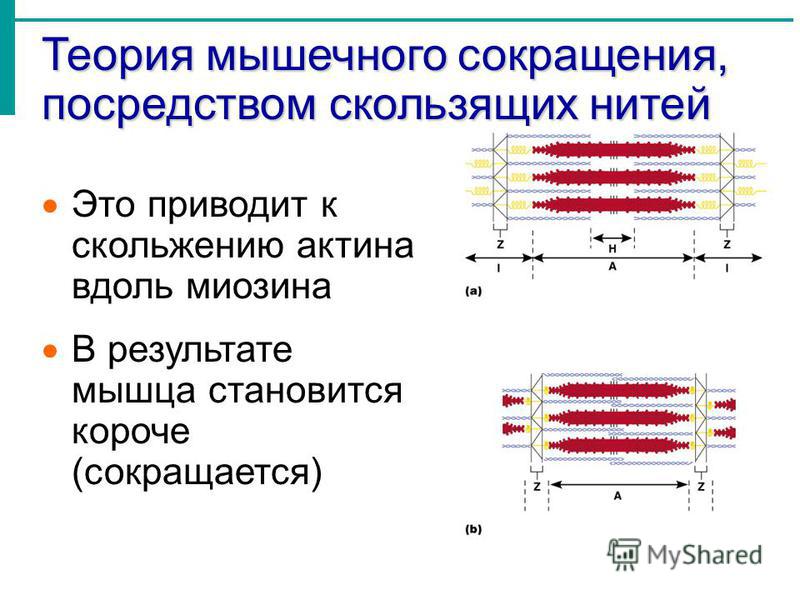 3. Основные параметры электромиограммы и их связь с функциональным состоянием мышцы (сила мышечного напряжения, степень утомляемости и др.) Работа мышцы с небольшой нагрузкой сопровождается редкой частотой нервных импульсов и вовлечением небольшого числа ДЕ. В этих условиях, накладывая отводящие электроды на кожу над мышцей и используя усилительную аппаратуру, можно на экране осциллографа или с применением чернильной записи на бумаге зарегистрировать одиночные потенциалы действия отдельных Д Е. В случае же значительных напряжений потенциалы действия многих ДЕ алгебраически суммируются и возникает сложная интегрированная кривая записи электрической активности целой мышцы — электромиограмма (ЭМГ). Форма ЭМГ отражает характер работы мышцы: при статических усилиях она имеет непрерывный вид, а при динамической работе — вид отдельных пачек импульсов, приуроченных, в основном, к начальному моменту сокращения мышцы и разделенных периодами «электрического молчания». Особенно хорошо ритмичность появления подобных пачек наблюдается у спортсменов при циклической работе.
3. Основные параметры электромиограммы и их связь с функциональным состоянием мышцы (сила мышечного напряжения, степень утомляемости и др.) Работа мышцы с небольшой нагрузкой сопровождается редкой частотой нервных импульсов и вовлечением небольшого числа ДЕ. В этих условиях, накладывая отводящие электроды на кожу над мышцей и используя усилительную аппаратуру, можно на экране осциллографа или с применением чернильной записи на бумаге зарегистрировать одиночные потенциалы действия отдельных Д Е. В случае же значительных напряжений потенциалы действия многих ДЕ алгебраически суммируются и возникает сложная интегрированная кривая записи электрической активности целой мышцы — электромиограмма (ЭМГ). Форма ЭМГ отражает характер работы мышцы: при статических усилиях она имеет непрерывный вид, а при динамической работе — вид отдельных пачек импульсов, приуроченных, в основном, к начальному моменту сокращения мышцы и разделенных периодами «электрического молчания». Особенно хорошо ритмичность появления подобных пачек наблюдается у спортсменов при циклической работе. У маленьких детей и неадаптированных к такой работе лиц четких периодов отдыха не наблюдается, что отражает недостаточное расслабление мышечных волокон работающей мышцы. Чем больше внешняя нагрузка и ста сокращения мышцы, тем выше амплитуда ее ЭМГ. Это связано с увеличением частоты нервных импульсов, вовлечением большего числа ДЕ в мышце и синхронизацией их активности. Современная многоканальная аппаратура позволяет производить одновременную регистрацию ЭМ Г многих мышц на разных каналах. При выполнении спортсменом сложных движений можно видеть на полученных ЭМГ кривых не только характер активности отдельных мышц, но и оценить моменты и порядок их включения или выключения в различные фазы двигательных актов. Записи ЭМГ, полученные в естественных условиях двигательной деятельности, можно передавать к регистрирующей аппаратуре по телефону или радиотелеметрически. Анализ частоты, амплитуды и формы ЭМ Г (например, с помощью специальных компьютерных программ) позволяет получить важную информацию об особенностях техники выполняемого спортивного упражнения и степени ее освоения обследуемым спортсменом.
У маленьких детей и неадаптированных к такой работе лиц четких периодов отдыха не наблюдается, что отражает недостаточное расслабление мышечных волокон работающей мышцы. Чем больше внешняя нагрузка и ста сокращения мышцы, тем выше амплитуда ее ЭМГ. Это связано с увеличением частоты нервных импульсов, вовлечением большего числа ДЕ в мышце и синхронизацией их активности. Современная многоканальная аппаратура позволяет производить одновременную регистрацию ЭМ Г многих мышц на разных каналах. При выполнении спортсменом сложных движений можно видеть на полученных ЭМГ кривых не только характер активности отдельных мышц, но и оценить моменты и порядок их включения или выключения в различные фазы двигательных актов. Записи ЭМГ, полученные в естественных условиях двигательной деятельности, можно передавать к регистрирующей аппаратуре по телефону или радиотелеметрически. Анализ частоты, амплитуды и формы ЭМ Г (например, с помощью специальных компьютерных программ) позволяет получить важную информацию об особенностях техники выполняемого спортивного упражнения и степени ее освоения обследуемым спортсменом. По мере развития утомления при той же величине мышечного усилия амплитуда ЭМГ нарастает. Это связано с тем, что снижение сократительной способности утомленных ДЕ компенсируется нервными центрами вовлечением в работу дополнительных ДЕ, т.е. путем увеличения количества активных мышечных волокон. Кроме того, усиливается синхронизация активности Д Е, что также повышает амплитуду суммарной ЭМГ. с одной стороны мостика — на «голове» миозиновой молекулы. Здесь АТФ находится вблизи АТФ-азы, что предотвращает соединение актана с миозином. В результате толстые и тонкие миофиламенты могут свободно скользить друг относительно друга при пассивном растяжении или укорочении мышцы. С выделением ионов кальция из цистерн сарко- плазматическогб ретикулума они присоединяются с одной стороны к АТФ на «голове» миозина, а с другой стороны — к специальным местам на тонком актиновом миофиламенте, образуя поперечные мостики между актиновыми и миозиновыми миофиламентами. Продвижение тонких миофиламентов относительно толстых сопровождается приближением поперечных мостиков к зоне расположения АТФ-азы, что вызывает гидролиз АТФ и соответственно разрушение мостиков.
По мере развития утомления при той же величине мышечного усилия амплитуда ЭМГ нарастает. Это связано с тем, что снижение сократительной способности утомленных ДЕ компенсируется нервными центрами вовлечением в работу дополнительных ДЕ, т.е. путем увеличения количества активных мышечных волокон. Кроме того, усиливается синхронизация активности Д Е, что также повышает амплитуду суммарной ЭМГ. с одной стороны мостика — на «голове» миозиновой молекулы. Здесь АТФ находится вблизи АТФ-азы, что предотвращает соединение актана с миозином. В результате толстые и тонкие миофиламенты могут свободно скользить друг относительно друга при пассивном растяжении или укорочении мышцы. С выделением ионов кальция из цистерн сарко- плазматическогб ретикулума они присоединяются с одной стороны к АТФ на «голове» миозина, а с другой стороны — к специальным местам на тонком актиновом миофиламенте, образуя поперечные мостики между актиновыми и миозиновыми миофиламентами. Продвижение тонких миофиламентов относительно толстых сопровождается приближением поперечных мостиков к зоне расположения АТФ-азы, что вызывает гидролиз АТФ и соответственно разрушение мостиков. Далее АТФ восстанавливается, и в следующем цикле формируются новые поперечные мостики, вследствие чего образуется связь толстых миофиламентов со следующими участками тонких миофиламентов. Этот процесс происходит повторно и во многих участках миофиламентов. В результате сокращение носит непрерывный и плавный характер. Роль кальция в процессе сокращения. Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М. Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Далее АТФ восстанавливается, и в следующем цикле формируются новые поперечные мостики, вследствие чего образуется связь толстых миофиламентов со следующими участками тонких миофиламентов. Этот процесс происходит повторно и во многих участках миофиламентов. В результате сокращение носит непрерывный и плавный характер. Роль кальция в процессе сокращения. Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М. Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы. Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+. Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации. Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5х10-6 М. Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+.
Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+. Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации. Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5х10-6 М. Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+. Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так. АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин – единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+. Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому филаменту и молекуле тропомиозина.
Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так. АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин – единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+. Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому филаменту и молекуле тропомиозина. В состоянии покоя положение тропомиозина конформационно препятствует соединению головок миозина с актиновым филаментом. Связывая Са2+, тропонин претерпевает конформационные изменения, в результате чего молекула тропомиозина смещается и освобождает дорогу миозиновым поперечным мостикам для прикрепления к актиновым центрам. Следовательно, присоединение Са2+ к тропонину устраняет постоянно существующее препятствие для взаимодействия поперечных мостиков с актином. Из результатов экспериментов, сделан вывод, что ингибирование присоединения мостиков снимается при концентрации свободного Са2+ свыше 10-7 М. Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актинмиозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков.
В состоянии покоя положение тропомиозина конформационно препятствует соединению головок миозина с актиновым филаментом. Связывая Са2+, тропонин претерпевает конформационные изменения, в результате чего молекула тропомиозина смещается и освобождает дорогу миозиновым поперечным мостикам для прикрепления к актиновым центрам. Следовательно, присоединение Са2+ к тропонину устраняет постоянно существующее препятствие для взаимодействия поперечных мостиков с актином. Из результатов экспериментов, сделан вывод, что ингибирование присоединения мостиков снимается при концентрации свободного Са2+ свыше 10-7 М. Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актинмиозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки. Саркоплазматический ретикулум. С чего начинается поступление Са2+ в СР? Если мембраны СР выделить с помощью фракционирования, они образуют микроскопические везикулы диаметром 1 мкм. Везикулы способны поглощать кальций из окружающей среды. Если к ним добавить щавелевую кислоту, то внутри везикул по мере увеличения в них концентрации Са2+ будет осаждаться оксалат кальция. Это говорит об активном транспорте кальция мембраной ретикулума. В нефракционированной мышечной ткани осадок оксалата кальция можно обнаружить с помощью электронного микроскопа в терминальных цистернах. Способность СР к накоплению кальция довольно высокая, что обеспечивает поддержание концентрации свободного Са2+ в саркоплазме расслабленной мышцы ниже 10-7 М. Этот уровень Са2+ достаточен для разрушения связи кальция с тропонином и предотвращения путь. Молочная кислота в этих реакциях не накапливается, а промежуточный продукт-пировиноградная кислота сразу окисляется до конечных продуктов — СО2 и Н20.
В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки. Саркоплазматический ретикулум. С чего начинается поступление Са2+ в СР? Если мембраны СР выделить с помощью фракционирования, они образуют микроскопические везикулы диаметром 1 мкм. Везикулы способны поглощать кальций из окружающей среды. Если к ним добавить щавелевую кислоту, то внутри везикул по мере увеличения в них концентрации Са2+ будет осаждаться оксалат кальция. Это говорит об активном транспорте кальция мембраной ретикулума. В нефракционированной мышечной ткани осадок оксалата кальция можно обнаружить с помощью электронного микроскопа в терминальных цистернах. Способность СР к накоплению кальция довольно высокая, что обеспечивает поддержание концентрации свободного Са2+ в саркоплазме расслабленной мышцы ниже 10-7 М. Этот уровень Са2+ достаточен для разрушения связи кальция с тропонином и предотвращения путь. Молочная кислота в этих реакциях не накапливается, а промежуточный продукт-пировиноградная кислота сразу окисляется до конечных продуктов — СО2 и Н20. В качестве источника энергии жиры используются в состоянии двигательного покоя, при любой работе сравнительно невысокой мощности (требующей до 50% МПК) и при очень длительной работе на выносливость (требующей около 70-80% МПК). Среди всех источников энергии жиры обладают наибольшей энергетической емкостью: при расходовании 1 моля АТФ выделяется около 10 ккал энергии, 1 моля КрФ — около 10.5 ккал, 1 моля глюкозы при анаэробном расщеплении — около 50 ккал, а при окислении 1 моля глюкозы — около 700 ккал, при окислении 1 моля жиров — 2400 ккал (КоцЯ.М., 1982). Однако использование жиров при работе высокой мощности лимитируется трудностью доставки кислорода работающим тканям. Работа мышц сопровождается выделением тепла. Теплообразование происходит в момент сокращения мышц — начальное теплообразование (оно составляет всего одну тысячную всех энерготрат) и в период восстановления — запаздывающее теплообразование. В обычных условиях при работе мышц тепловые потери составляют около 80% всех энерготрат.
В качестве источника энергии жиры используются в состоянии двигательного покоя, при любой работе сравнительно невысокой мощности (требующей до 50% МПК) и при очень длительной работе на выносливость (требующей около 70-80% МПК). Среди всех источников энергии жиры обладают наибольшей энергетической емкостью: при расходовании 1 моля АТФ выделяется около 10 ккал энергии, 1 моля КрФ — около 10.5 ккал, 1 моля глюкозы при анаэробном расщеплении — около 50 ккал, а при окислении 1 моля глюкозы — около 700 ккал, при окислении 1 моля жиров — 2400 ккал (КоцЯ.М., 1982). Однако использование жиров при работе высокой мощности лимитируется трудностью доставки кислорода работающим тканям. Работа мышц сопровождается выделением тепла. Теплообразование происходит в момент сокращения мышц — начальное теплообразование (оно составляет всего одну тысячную всех энерготрат) и в период восстановления — запаздывающее теплообразование. В обычных условиях при работе мышц тепловые потери составляют около 80% всех энерготрат. Для оценки эффективности механической работы мышцы используют вычисление коэффициента полезного действия (КПД). Величина КПД показывает, какая часть затрачиваемой энергии используется на выполнение механической работы мышцы. Ее вычисляют по формуле: КПД= [А: (Е-е)] * 100%, где: А — энергия, затраченная на полезную работу; Е — общий расход энергии; е — расход энергии в состоянии покоя за время, равное длительности работы. У нетренированного человека КПД примерно 20%, у спортсмена — 30-35%. При ходьбе наибольший КПД отмечается при скорости 3.6-4.8. км • час-1, при педалировании на велоэргометре — при длительности цикла около 1 с. С увеличением мощности работы и включением «ненужных» мышц КПД уменьшается. При статической работе, поскольку А = 0, эффективность работы оценивается по длительности поддерживаемого напряжения мышц. 6. Формы сокращения мышц (изотоническая, изометрическая, смешанная) В результате сокращения в мышечных волокнах возникает напряжение. Эта способность развивать напряжение является основным свойством мышцы.
Для оценки эффективности механической работы мышцы используют вычисление коэффициента полезного действия (КПД). Величина КПД показывает, какая часть затрачиваемой энергии используется на выполнение механической работы мышцы. Ее вычисляют по формуле: КПД= [А: (Е-е)] * 100%, где: А — энергия, затраченная на полезную работу; Е — общий расход энергии; е — расход энергии в состоянии покоя за время, равное длительности работы. У нетренированного человека КПД примерно 20%, у спортсмена — 30-35%. При ходьбе наибольший КПД отмечается при скорости 3.6-4.8. км • час-1, при педалировании на велоэргометре — при длительности цикла около 1 с. С увеличением мощности работы и включением «ненужных» мышц КПД уменьшается. При статической работе, поскольку А = 0, эффективность работы оценивается по длительности поддерживаемого напряжения мышц. 6. Формы сокращения мышц (изотоническая, изометрическая, смешанная) В результате сокращения в мышечных волокнах возникает напряжение. Эта способность развивать напряжение является основным свойством мышцы. Напряжение, развиваемое мышцами при сокращении, реализуется по-разному. Если внешняя нагрузка меньше, чем напряжение сокращающейся мышцы, то мышца укорачивается и вызывает движение – это изотонический (концентрический, миометрический) тип сокращения. Поскольку в экспериментальных условиях при электрическом раздражении укорочение мышцы происходит при постоянном напряжении = внешней нагрузке. Если внешняя нагрузка больше, чем напряжение, развиваемое мышцей во время сокращения, то такая мышца растягивается при сокращении – это эксцентрический (плиометрический) тип сокращения. Изотонический и эксцентрический типы сокращения, т.е. сокращения. при которых мышца изменяет свою длину, относятся к динамической форме сокращения. Сокращение мышцы, при котором она развивает напряжение, но не изменяет своей длины, называется изометрическим. Это статическая форма сокращения. Она возникает в 2-ух случаях: либо когда внешняя нагрузка = напряжению, развиваемому мышцей при сокращении, либо когда внешняя нагрузка превышает напряжение мышцы, но отсутствуют условия для растяжения мышцы под влиянием этой внешней нагрузки.
Напряжение, развиваемое мышцами при сокращении, реализуется по-разному. Если внешняя нагрузка меньше, чем напряжение сокращающейся мышцы, то мышца укорачивается и вызывает движение – это изотонический (концентрический, миометрический) тип сокращения. Поскольку в экспериментальных условиях при электрическом раздражении укорочение мышцы происходит при постоянном напряжении = внешней нагрузке. Если внешняя нагрузка больше, чем напряжение, развиваемое мышцей во время сокращения, то такая мышца растягивается при сокращении – это эксцентрический (плиометрический) тип сокращения. Изотонический и эксцентрический типы сокращения, т.е. сокращения. при которых мышца изменяет свою длину, относятся к динамической форме сокращения. Сокращение мышцы, при котором она развивает напряжение, но не изменяет своей длины, называется изометрическим. Это статическая форма сокращения. Она возникает в 2-ух случаях: либо когда внешняя нагрузка = напряжению, развиваемому мышцей при сокращении, либо когда внешняя нагрузка превышает напряжение мышцы, но отсутствуют условия для растяжения мышцы под влиянием этой внешней нагрузки. При динамических формах сокращения производится внешняя работа – при изотоническом сокращении положительная, при эксцентрическом отрицательная. Величина работы в обоих случаях может быть определена как произведение внешней нагрузки (поднятого веса) на пройденное расстояние. При изометрическом сокращении «расстояние» = 0, и, согласно физическому закону, в этом случае мышца не производит никакой работы. Если внешняя нагрузка на мышцы меньше, чем ее напряжение, мышца укорачивается и вызывает движение. Это концентрический, или миометрический, тип сокращения. В экспериментальных условиях при электрическом раздражении изолированной мышцы ее укорочение происходит при постоянном напряжении, равном внешней нагрузке. Поэтому этот тип сокращения называют также изотоническим (изос — равный, тонус — напряжение). Если внешняя нагрузка на мышцы больше, чем ее напряжение, развиваемое во время сокращения, мышца растягивается (удлиняется). Это эксцентрический, или плиометрический, тип сокращения. Концентрический и эксцентрический типы сокращения, т.
При динамических формах сокращения производится внешняя работа – при изотоническом сокращении положительная, при эксцентрическом отрицательная. Величина работы в обоих случаях может быть определена как произведение внешней нагрузки (поднятого веса) на пройденное расстояние. При изометрическом сокращении «расстояние» = 0, и, согласно физическому закону, в этом случае мышца не производит никакой работы. Если внешняя нагрузка на мышцы меньше, чем ее напряжение, мышца укорачивается и вызывает движение. Это концентрический, или миометрический, тип сокращения. В экспериментальных условиях при электрическом раздражении изолированной мышцы ее укорочение происходит при постоянном напряжении, равном внешней нагрузке. Поэтому этот тип сокращения называют также изотоническим (изос — равный, тонус — напряжение). Если внешняя нагрузка на мышцы больше, чем ее напряжение, развиваемое во время сокращения, мышца растягивается (удлиняется). Это эксцентрический, или плиометрический, тип сокращения. Концентрический и эксцентрический типы сокращения, т. е. сокращения, при которых мышца изменяет длину, относятся к динамической форме сокращения. Сокращение мышцы, при котором она развивает напряжение, но не изменяет своей длины, называется изометрическим (изос — равный, метр — длина). Это статическая форма сокращения. Она возникает в двух случаях: когда внешняя нагрузка равна напряжению, развиваемому мышцей при сокращении, либо когда внешняя нагрузка превышает напряжение мышцы, но отсутствуют условия для растяжения мышцы под влиянием этой внешней нагрузки. При динамических формах сокращения производится внешняя работа: при концентрическом сокращении — положительная, при эксцентрическом — отрицательная. Величина работы в обоих случаях определяется как произведение внешней нагрузки (поднятого веса) на пройденное расстояние. При изометрическом сокращении «расстояние» равно нулю, и, согласно физическому закону, в этом случае мышца не производит никакой работы. Однако с физиологической точки зрения изометрическое сокращение требует расхода энергии и может быть очень утомительным.
е. сокращения, при которых мышца изменяет длину, относятся к динамической форме сокращения. Сокращение мышцы, при котором она развивает напряжение, но не изменяет своей длины, называется изометрическим (изос — равный, метр — длина). Это статическая форма сокращения. Она возникает в двух случаях: когда внешняя нагрузка равна напряжению, развиваемому мышцей при сокращении, либо когда внешняя нагрузка превышает напряжение мышцы, но отсутствуют условия для растяжения мышцы под влиянием этой внешней нагрузки. При динамических формах сокращения производится внешняя работа: при концентрическом сокращении — положительная, при эксцентрическом — отрицательная. Величина работы в обоих случаях определяется как произведение внешней нагрузки (поднятого веса) на пройденное расстояние. При изометрическом сокращении «расстояние» равно нулю, и, согласно физическому закону, в этом случае мышца не производит никакой работы. Однако с физиологической точки зрения изометрическое сокращение требует расхода энергии и может быть очень утомительным. В этом случае работа может быть определена как произведение величины напряжения мышцы на время ее сокращения (т.е. эквивалентно импульсу силы в физике). Во время изометрического сокращения в тепло превращается вся выделяемая мышцей энергия, а динамическом сокращении не менее 50% ее энергии. тетануса — зубчатый тетанус, возникающий при более редком раздражении, когда происходит попадание каждого следующего нервного импульса в фазу расслабления отдельных одиночных сокращений, и сплошной или гладкий тетанус, возникающий при более частом раздражении, когда каждый следующий импульс попадает в фазу сокращения. Таким образом, (в некоторых границах) между частотой импульсов возбуждения и амплитудой сокращения волокон ДЕ существует определенное соотношение: при небольшой частоте (например, 5-8 имп. в 1с) возникают одиночные сокращения, при увеличении частоты (15-20 имп. в 1с) — зубчатый тетанус, при дальнейшем нарастании частоты (25-60 имп. в 1 с) — гладкий тетанус. Одиночное сокращение — более слабое и менее утомительное, чем титаническое.
В этом случае работа может быть определена как произведение величины напряжения мышцы на время ее сокращения (т.е. эквивалентно импульсу силы в физике). Во время изометрического сокращения в тепло превращается вся выделяемая мышцей энергия, а динамическом сокращении не менее 50% ее энергии. тетануса — зубчатый тетанус, возникающий при более редком раздражении, когда происходит попадание каждого следующего нервного импульса в фазу расслабления отдельных одиночных сокращений, и сплошной или гладкий тетанус, возникающий при более частом раздражении, когда каждый следующий импульс попадает в фазу сокращения. Таким образом, (в некоторых границах) между частотой импульсов возбуждения и амплитудой сокращения волокон ДЕ существует определенное соотношение: при небольшой частоте (например, 5-8 имп. в 1с) возникают одиночные сокращения, при увеличении частоты (15-20 имп. в 1с) — зубчатый тетанус, при дальнейшем нарастании частоты (25-60 имп. в 1 с) — гладкий тетанус. Одиночное сокращение — более слабое и менее утомительное, чем титаническое. Зато тетанус обеспечивает в несколько раз более мощное, хотя и кратковременное сокращение мышечного волокна. Сокращение целой мышцы зависит от формы сокращения отдельных ДЕ и их координации во времени. При обеспечении длительной, но не очень интенсивной работы, отдельные ДЕ сокращаются попеременно поддерживая общее напряжение мышцы на заданном уровне (например, при беге на длинные и сверхдлинные дистанции). При этом отдельные ДЕ могут развивать как одиночные, так и титанические сокращения, что зависит от частоты нервных импульсов. Утомление в этом случае развивается медленно, так как, работая по очереди, ДЕ в промежутках между активацией успевают восстанавливаться. Однако для мощного кратковременного усилия (например, поднятия штанги) требуется синхронизация активности отдельных ДЕ, т.е. одновременное возбуждение практически всех ДЕ. Это, в свою очередь, требует одновременной активации соответствующих нервных центров и достигается в результате длительной тренировки. При этом осуществляется мощное и весьма утомительное титаническое сокращение.
Зато тетанус обеспечивает в несколько раз более мощное, хотя и кратковременное сокращение мышечного волокна. Сокращение целой мышцы зависит от формы сокращения отдельных ДЕ и их координации во времени. При обеспечении длительной, но не очень интенсивной работы, отдельные ДЕ сокращаются попеременно поддерживая общее напряжение мышцы на заданном уровне (например, при беге на длинные и сверхдлинные дистанции). При этом отдельные ДЕ могут развивать как одиночные, так и титанические сокращения, что зависит от частоты нервных импульсов. Утомление в этом случае развивается медленно, так как, работая по очереди, ДЕ в промежутках между активацией успевают восстанавливаться. Однако для мощного кратковременного усилия (например, поднятия штанги) требуется синхронизация активности отдельных ДЕ, т.е. одновременное возбуждение практически всех ДЕ. Это, в свою очередь, требует одновременной активации соответствующих нервных центров и достигается в результате длительной тренировки. При этом осуществляется мощное и весьма утомительное титаническое сокращение. Амплитуда сокращения одиночного волокна не зависит от силы надпорогового раздражения (закон «Все или ничего»). В отличие от этого, при нарастании силы надпорогового раздражения сокращение целой мышцы постепенно растет до максимальной амплитуды. 8. Механизм регуляции силы сокращения мышц (число активных ДЕ, частота импульсации мотонейронов, синхронизация сокращения мышечных волокон отдельных ДЕ во времени) Для регуляции величины напряжения мышцы центральная нервная система использует три механизма. 1. Регуляция числа активных ДЕ. Чем большее число ДЕ мышцы включается в работу, тем большее напряжение она развивает. При необходимости развития небольших усилий и соответственно малой импульсации со стороны центральных нервных структур, регулирующих произвольные движения, в работу включаются прежде всего медленные ДЕ, мотонейроны которых имеют наименьший порог возбуждения. По мере усиления центральной импульсации к работе подключаются быстрые, устойчивые к утомлению ДЕ, мотонейроны которых имеют более высокий порог возбуждения, И, наконец, при необходимости увеличения силы сокращения более 20-25% от максимальной произвольной силы (МПС), активируются быстрые, легко-утомляемые мышечные волокна, иннервируемые крупными мотонейронами с самым высоким порогом возбуждения.
Амплитуда сокращения одиночного волокна не зависит от силы надпорогового раздражения (закон «Все или ничего»). В отличие от этого, при нарастании силы надпорогового раздражения сокращение целой мышцы постепенно растет до максимальной амплитуды. 8. Механизм регуляции силы сокращения мышц (число активных ДЕ, частота импульсации мотонейронов, синхронизация сокращения мышечных волокон отдельных ДЕ во времени) Для регуляции величины напряжения мышцы центральная нервная система использует три механизма. 1. Регуляция числа активных ДЕ. Чем большее число ДЕ мышцы включается в работу, тем большее напряжение она развивает. При необходимости развития небольших усилий и соответственно малой импульсации со стороны центральных нервных структур, регулирующих произвольные движения, в работу включаются прежде всего медленные ДЕ, мотонейроны которых имеют наименьший порог возбуждения. По мере усиления центральной импульсации к работе подключаются быстрые, устойчивые к утомлению ДЕ, мотонейроны которых имеют более высокий порог возбуждения, И, наконец, при необходимости увеличения силы сокращения более 20-25% от максимальной произвольной силы (МПС), активируются быстрые, легко-утомляемые мышечные волокна, иннервируемые крупными мотонейронами с самым высоким порогом возбуждения. Таким образом, первый механизм увеличения силы сокращения состоит в том, что при необходимости повысить величину напряжения мышцы в работу вовлекается большое количество ДЕ. Последовательность включения равных по морфофункциональным признакам ДЕ определяется интенсивностью центральных возбуждающих влияний и порогом возбудимости спинальных двигательных нейронов. 2. Регуляция частоты импулъсации мотонейронов. При слабых сокращениях скелетных мышц импульсация мотонейронов составляет 5-10 имп/с. Для каждой отдельной ДЕ чем выше (до определенного предела) частота возбуждающих импульсов, тем больше сила сокращения ее мышечных волокон и тем больше ее вклад в развиваемое всей мышцей усилие. С увеличением частоты раздражения мотонейронов все большее количество ДЕ начинает работать в режиме гладкого тетануса, увеличивая тем самым силу по сравнению с одиночными сокращениями в 2-3 раза. В реальных условиях мышечной деятельности человека большая часть ДЕ активируется в диапазоне от 0 до 50% МПС. Лишь около 10% ДЕ вовлекаются с дальнейшим возрастанием силы сокращения.
Таким образом, первый механизм увеличения силы сокращения состоит в том, что при необходимости повысить величину напряжения мышцы в работу вовлекается большое количество ДЕ. Последовательность включения равных по морфофункциональным признакам ДЕ определяется интенсивностью центральных возбуждающих влияний и порогом возбудимости спинальных двигательных нейронов. 2. Регуляция частоты импулъсации мотонейронов. При слабых сокращениях скелетных мышц импульсация мотонейронов составляет 5-10 имп/с. Для каждой отдельной ДЕ чем выше (до определенного предела) частота возбуждающих импульсов, тем больше сила сокращения ее мышечных волокон и тем больше ее вклад в развиваемое всей мышцей усилие. С увеличением частоты раздражения мотонейронов все большее количество ДЕ начинает работать в режиме гладкого тетануса, увеличивая тем самым силу по сравнению с одиночными сокращениями в 2-3 раза. В реальных условиях мышечной деятельности человека большая часть ДЕ активируется в диапазоне от 0 до 50% МПС. Лишь около 10% ДЕ вовлекаются с дальнейшим возрастанием силы сокращения. Следовательно, при увеличении силы сокращения более 50% от максимальной основную роль, а в диапазоне сил от 75 до 100% МПС — даже исключительную играет рост частоты импульсации двигательных нейронов. 3. Синхронизация активности различных ДЕ во времени. При сокращении мышцы всегда активируется множество составляющих ее ДЕ. Суммарный механический эффект при этом зависит от того, как связаны во времени импульсы, посылаемые разными мотонейронами своим мышечным волокнам. При небольших напряжениях большинство ДЕ работают не синхронно. Совпадение во времени импульсации мотонейронов отдельных ДЕ называется синхронизацией. Чем большее количество ДЕ работает синхронно, тем большую силу развивает мышца. Синхронизация активности ДЕ играет важную роль в начале любого сокращения и при необходимости выполнения мощных, быстрых сокращений (прыжков, метаний и т.п.). Чем больше совпадают периоды сокращения разных ДЕ, тем с большей скоростью нарастает напряжение всей мышцы и тем большей величины достигает амплитуда ее сокращения.
Следовательно, при увеличении силы сокращения более 50% от максимальной основную роль, а в диапазоне сил от 75 до 100% МПС — даже исключительную играет рост частоты импульсации двигательных нейронов. 3. Синхронизация активности различных ДЕ во времени. При сокращении мышцы всегда активируется множество составляющих ее ДЕ. Суммарный механический эффект при этом зависит от того, как связаны во времени импульсы, посылаемые разными мотонейронами своим мышечным волокнам. При небольших напряжениях большинство ДЕ работают не синхронно. Совпадение во времени импульсации мотонейронов отдельных ДЕ называется синхронизацией. Чем большее количество ДЕ работает синхронно, тем большую силу развивает мышца. Синхронизация активности ДЕ играет важную роль в начале любого сокращения и при необходимости выполнения мощных, быстрых сокращений (прыжков, метаний и т.п.). Чем больше совпадают периоды сокращения разных ДЕ, тем с большей скоростью нарастает напряжение всей мышцы и тем большей величины достигает амплитуда ее сокращения. 9. Значение АТФ в процессе сокращения мышечных волокон. Характеристика энергетических систем, обеспечивающих ресинтез АТФ, их мощность и ёмкость Единственным прямым источником энергии для мышечного сокращения служит АТФ. При активации мышцы повышение внутриклеточной концентрации ионов кальция приводит к сокращению и усиленному расщеплению АТФ, интенсивность метаболизма повышается в
9. Значение АТФ в процессе сокращения мышечных волокон. Характеристика энергетических систем, обеспечивающих ресинтез АТФ, их мощность и ёмкость Единственным прямым источником энергии для мышечного сокращения служит АТФ. При активации мышцы повышение внутриклеточной концентрации ионов кальция приводит к сокращению и усиленному расщеплению АТФ, интенсивность метаболизма повышается в
Механизм сокращения мышечного волокна
Урок 3. Механизм сокращения мышечного волокна. Т-система мышечного волокна.
Учитель химии и биологии: Жалгасбаева Венера Аскаровна
КГУ «Средняя школа № 26», город Актобе
Класс: 10
Слайд 1.Здравствуйте, ребята.
Слайд 2.Тема нашего урока: Механизм сокращения мышечного волокна. Т-система мышечного волокна. Сегодня на уроке вы узнаете механизм сокращения мышечного волокна., Т- систему мышечного волокна. Вы научитесь объяснять механизм мышечного сокращения.
Слайд 3.Сокращение мышечного волокна. Мышечное сокращение является жизненно важной функцией организма, связанной с оборонительными, дыхательными, пищевыми, выделительными и другими физиологическими процессами. Все виды произвольных движений – ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счет скелетных мышц. Непроизвольные движения (кроме сокращения сердца) – перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря – обусловлены сокращением гладких мышц. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Мышечное сокращение является жизненно важной функцией организма, связанной с оборонительными, дыхательными, пищевыми, выделительными и другими физиологическими процессами. Все виды произвольных движений – ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счет скелетных мышц. Непроизвольные движения (кроме сокращения сердца) – перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря – обусловлены сокращением гладких мышц. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Слайд 4.
1. «Закон всё или ничего» .Зависимость величины ответной реакции от силы раздражителя характеризуется несколькими законами раздражения: Мы остановимся на одном.» Закон «все или ничего»Согласно этому закону, подпороговые( макс) раздражения не вызывают возбуждения («ничего»), при пороговых и надпороговых стимулах возбуждение сразу приобретает максимальную величину («все») и уже не увеличивается при дальнейшем усилении раздражения. По этому закону функционируют структурные единицы – мышечное волокно, нервное волокно.
По этому закону функционируют структурные единицы – мышечное волокно, нервное волокно.
Эта закономерность первоначально была открыта Г. Боудичем в 1876 году при исследовании сердца, а в дальнейшем подтверждена и на других возбудимых тканях.
Слайд5.Различают 3 типа сокращения мышечного волокна. Изотоническое — сокращение, при котором мышца укорачивается без формирования напряжения. Такое сокращение возможно при пересечении или разрыве сухожилия или в эксперименте на изолированной (удаленной из организма) мышце. Изометрическое — сокращение, при котором напряжение мышцы возрастает, а длина практически не уменьшается. Такое сокращение наблюдается при попытке поднять непосильный груз. Ауксотоническое- сокращение, при котором длина мышцы изменяется по мере увеличения ее напряжения. Такой режим сокращений наблюдается при осуществлении трудовой деятельности человека
Слайд 6. Мышечное сокращение можно изучать с помощью кимографа. Кимограф прибор для графической регистрации физиологических процессов (например, сердцебиений, дыхания, мышечных сокращений .
Слайд 7. Миограмма — запись электрических сигналов, полученных в результате регистрации мышечных сокращений.
Слайд 8. Теория скольжения нитей
Способ сокращения волокон скелетной мышцы был определен в результате двух различных исследований, проведенных в начале 1950-х годов при участии ученых Эндрю и Хью Хаксли. В то время, когда Хью Хаксли проводил свои исследования при помощи электронного микроскопа, Эндрю Хаксли использовал интерференционный микроскоп для изучения характеристик мышечных волокон лягушки во время сокращения и расслабления. Он обнаружил, что во время сокращения светлый диск становился короче, тогда как длина темного диска не изменялась; в то же время бледная Н-зона в темном диске сужалась и могла вообще исчезнуть. Оба ученых независимо друг от друга выдвинули предположение, что полученные ими результаты можно объяснить скользящим движением филаментов актина и миозина относительно друг друга.
. Слайд 8 Теория скольжения филаментов сегодня является общепризнанной.
Кратко ее сущность состоит в том, что. Раздвижная теория нити объясняет механизм мышечного сокращения на основе мышечных белков , которые скользят мимо друг друга , чтобы произвести движение. Согласно теории скольжения нитей, миозин (толстые нити) мышечных волокон скользят мимо актиновых (тонких) нитей во время сокращения мышц, в то время как две группы нитей , остаются на относительно постоянной длине.. До 1950 — х годов было несколько конкурирующих теорий о сокращении мышц, в том числе электрического притяжения, сворачивания белка и модификации белков. Новая теория непосредственно вводить новую концепцию , называемая кросс-мост теория, которая объясняет молекулярный механизм скольжения нити. Кросс-мост теория утверждает , что актин и миозин образуют белковый комплекс путем присоединения миозина головы на нити актина, образуя таким образом своего рода поперечный мост между двумя нитями. Эти две взаимодополняющие гипотезы оказалась правильными, и теперь это общепринятое объяснением механизма движения.
Слайд.9.Давайте,еще раз вспомним как выглядит молекула миозина. Головка миозина присоединяется к актину и обладает ферментативной способностью.
Слайд10. Миозиновые филаменты образованы повторяющимися молекулами белка миозина . Каждая молекула миозина имеет головку и хвост . Головка миозина может связываться с молекулой актина, образуя так называемый поперечный мостик .
Слайд 11.Форма отдельной молекулы миозина напоминает клюшку для гольфа с двумя головками. Головка молекулы миозина способна двигаться вперед и назад, обеспечивая мышечное сокращение. На головке миозина имеется два связывающих участка .Один из них связывается с АТФ .Второй участок связывается с актином. Возникла теория ,что головки миозиновых нитей ,служат крючками и прикрепляются к F-актину, образуя поперечные мостики.
Слайд 12. Актиновый филламент внешне напоминает две нитки бус, закрученные в двойную спираль, где каждая бусина – молекула белка актина .
Слайд 13. В углублениях актиновых спиралей на равном расстоянии друг от друга лежат молекулы белка тропонина , соединенные с нитевидными молекулами белка тропомиозина.
Слайд 14.Согласно теории скольжения нитей, мышечное сокращение происходит благодаря скользящему движению актиновых и миозиновых филаментов друг относительно друга. Механизм скольжения нитей включает несколько последовательных событий.
• Головки миозина присоединяются к центрам связывания актинового филламента ).
• Взаимодействие миозина с актином приводит к перестройкам молекулы миозина. Головки приобретают АТФазную активность и поворачиваются на 120 ° . За счет поворота головок нити актина и миозина передвигаются на «один шаг» друг относительно друга (рис. 2, Б).
• Рассоединение актина и миозина и восстановление конформации головки происходит в результате присоединения к головке миозина молекулы АТФ и ее гидролиза в присутствии иона Са+.
• Цикл «связывание – изменение конформации – рассоединение – восстановление конформации» происходит много раз, в результате чего актиновые и миозиновые филаменты смещаются друг относительно друга, Z -диски саркомеров сближаются и миофибрилла укорачивается .
В состоянии покоя скольжения нитей в миофибрилле не происходит, так как центры связывания на поверхности актина закрыты молекулами белка тропомиозина (рис. 3, А, Б). Возбуждение (деполяризация) миофибриллы и собственно мышечное сокращение связаны с процессом электромеханического сопряжения, который включает ряд последовательных событий.
Подведя итог мы можем сказать ,что мышечное сокращение – это энергозависимое и регулируемое ионами кальция скольжения сократительных белков миозина и актина.
Сокращение скелетных мышц человека
Описан процесс сокращения скелетных мышц человека, который состоит из ряда этапов. Первый этап связан с поступлением нервного импульса по аксону мотонейрона к мышечному волокну. Второй этап заключается в возникновении потенциала действия и распространении его вдоль мышечного волокна. В результате третьего этапа в саркоплазму выделяются ионы кальция, что приводит к началу взаимодействия толстого и тонкого филаментов. Четвертый этап представляет собой скольжение тонких филаментов относительно толстых, что составляет собственно сокращение мышцы.
Давайте теперь разберемся в механизме сокращения мышцы, точнее в механизме сокращения мышечных волокон, а еще более точно в механизме сокращения миофибрилл или другими словами, в механизме сокращения саркомера. Этот процесс можно условно разделить на несколько этапов.
Поступление нервного импульса к мышечному волокну
Чтобы сократиться, мышца должна получить сигнал из центральной нервной системы (ЦНС). Такими сигналами являются импульсы, поступающие по мотонейрону к мышце.
Более подробно строение и функции мышц описаны в моих книгах
Вспомним, что при подходе к мышце аксон мотонейрона ветвится, то есть пускает веточки к мышечным волокнам. Если такого соединения нет, мышечное волокно сокращаться не будет и постепенно атрофируется.
Возникновение потенциала действия
После того, как по аксону мотонейрона к мышечным волокнам приходит импульс, из него в области соединения выделяется ацетилхолин. Выделение этого нейромедиатора (ацетилхолина) приводит к протеканию ряда процессов, в результате которых меняется полярность сарколеммы мышечного волокна. Это называется деполяризацией сарколеммы мышечного волокна. В результате развивается потенциал действия.
Выделение ионов кальция
Потенциал действия через отверстия в сарколемме «проникает» внутрь мышечного волокна и через Т-трубочки достигает саркоплазматического ретикулума (то есть происходит деполяризация не только мембраны мышечного волокна, но и мембран Т-трубочек и саркоплазматического ретикулума). Это в конечном счете приводит к выделению из саркоплазматического ретикулума ионов кальция в саркоплазму мышечного волокна (рис. 1).
Рис.1.
Затем ионы кальция соединяются с тропонином (тропонин – один из белков тонкого филамента). Этот белок имеет шарообразную форму и расположен в тонком филаменте регулярно через определенные расстояния. После соединения с ионами кальция, тропонин меняет свою конфигурацию и приподнимает длинные тропомиозиновые трубки. Когда мышца неактивна, длинные трубки белка тропомиозина закрывают активные центры на актине. После того как тропомиозиновые трубки приподнимаются, на актине открываются активные центры. К ним теперь могут прикрепляться миозиновые головки.
Сокращение саркомера (гребковая гипотеза, теория скользящих нитей)
Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами начинается взаимодействия (говорят: «Образуется поперечный мостик» (рис. 2). При взаимодействии с актином каждая миозиновая молекула ежесекундно расщепляет с выделением энергии до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается и тянет тонкий филамент в направлении центра саркомера. Это приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению её к новому активному участку тонкого филамента. Многократное повторение этого процесса приводит к тому, что расстояние между Z-дисками уменьшается. Следовательно, происходит уменьшение длины саркомера. Одновременное сокращение всех саркомеров, расположенных последовательно вдоль миофибриллы приводит к уменьшению её длины, длины мышечного волокна и всей мышцы в целом. Мышца работает в преодолевающем режиме.
Прекращение импульсов, поступающих от мотонейрона к мышечному волокну приводит к расслаблению мышцы.
Рис.2. Схема, иллюстрирующая взаимодействие толстого и тонкого филаментов (Л. Страйер, 1985)
С уважением, А.В. Самсонова
Как работает мышечное волокно?
Хорошие результаты в бодибилдинге, вопреки расхожему мнению, возможны только при наличии знаний касающихся основных биохимических процессов организма.
Принято считать, что для увеличения мускулатуры достаточно регулярно посещать тренажерный зал, выполняя сгибания и разгибания конечностей с тем или иным отягощением. Увы, не все так просто, как кажется на первый взгляд.
Для получения желаемого телосложения, прежде всего, необходимо овладеть базовой теорией, как и в любом другом виде спорта. Одной из основополагающих тем является работа мышечного волокна.
Мышечное волокно (мышечная клетка, симпласт) – это своеобразный «цилиндр», который заполнен огромным количеством внутренних органов, таких как митохондрии, лизосомы, ферменты, рибосомы, и, конечно же, миофибриллы.
Довольно часто мышечную клетку представляют как огромное количество пучков миофибрилл. Их особое строение позволяет нашим мышцам сокращаться и расслабляться. Рассмотрим этот процесс более подробно.
Миофибриллы – это сократительные элементы с особым строением клеток. Их главное свойство – возможность менять свою длину. Общее число миофибрилл в одном волокне может достигать нескольких тысяч.
Основные элементы миофибрилл — актин и миозин
Сами миофибриллы представлены толстыми (миозин) и тонкими белковыми нитями (актин). Темный участок одной миофибриллы, окруженный вокруг двумя светлыми участками принято называть саркомером.
Сокращение мышц происходит благодаря уменьшению длины саркомера. Дело в том, что миозин содержится только в темных участках, в светлых — он попросту отсутствует.
Изменение структуры саркомера происходит довольно простым способом: тонкие нити актина втягиваются между толстыми нитями миозина.
Скольжение вдоль возможно благодаря особым боковым ответвлениям миозина – мостикам белковой структуры. Грубо говоря, данные мостики проталкивают нить актина между миозиновыми волокнами. Смотрите видео:
Увы, это лишь общий взгляд на механизм работы мышечной клетки. Для более детального анализа следует рассмотреть этот процесс более подробно. Актин – это лишь условное название спирали закрученной из двух нитей тонкого типа.
Представьте аналогию с обыкновенной греблей на байдарках или каноэ. Тонкая нить актина в этом случае будет олицетворять плот с веслами. В то же время вода – это грубый пример толстых нитей миозина.
Для того чтобы продвинуться вперед, спортсменам на каноэ нужно производить гребковые поступательные движения. Аналогичное действие выполняет актин, с той лишь разницей, что как таковых весел у него нет.
Мостики располагаются на миозиновых нитях. Головки таких ответвлений при контакте с актином меняют свой угол, то есть проталкивают светлую нить вперед, так же как и вода позволяет байдарке плыть. Стоит отметить, что движения мостиков миозина происходят хаотично, т.е. полностью асинхронно. Именно так в общих чертах выглядит сокращение саркомера.
Также следует отметить, что в двойной спирали актина залегает другая двойная спираль меньшего размера, ее называют тропомиозином. В состоянии покоя именно тропомиозин мешает сцеплению актина с миозином. Без него, человек не смог бы контролировать сокращение тех или иных мышц. Грубо говоря, это предохранитель, снять который можно лишь при помощи сигналов ЦНС.
Создавая тот или иной частотный импульс, вы передаете его по каналам в мотонейроны, а оттуда он по аксонам поступает к мышце. Такой сигнал меняет полярность отсеков заполненных ионами кальция, расположенных вдоль всей миофибриллы.
Высвободившиеся ионы кальция (Ca++) вынуждают тропомиозин сократить свою длину, вследствие чего появляется место для сцепления актина и миозина.
Стоит отметить, что кальций буквально с первых секунд начинает возвращаться обратно в отсеки хранения. Вследствие чего концентрация его ионов в саркоплазме стремительно падает, а это ведет к постепенному удлинению тропомиозина. Именно так прекращается сокращение мышечной группы.
Во время выполнения упражнения, ЦНС посылает множество сигналов, каждый из которых вновь высвобождает кальций. При довольно сильной частоте (более 20 Гц) все отдельные сокращения сливаются в одно непрерывное движение, которое известно в физиологии как тетанус – безостановочная работа мышц в любой фазе движения.
Энергетический обмен
Разумеется, на все вышеперечисленные процессы нужна энергия, а как известно, универсальным «топливом» являются молекулы АТФ (аденозинтрифосфата).
Миозиновые мостики на конце имеют так называемую головку, которая обладает АТФазной активностью, то есть она может расщеплять АТФ и получать таким образом энергию. Стоит отметить, что она несет в себе заряд АТФ еще до контакта с актином.
При сокращении мышечной группы происходит высвобождение АТФ за счет гидролиза, что способствует соответствующему изменение угла мостика. Именно это заставляет актин двигаться вперед.
Для того чтобы продолжить движение, нить актина должна отцепить от себя недавно прикрепленные мостики миозина, а на это разумеется, нужна энергия.
Увы, весь имеющийся запас АТФ тратится на сцепление тонкой и толстой нити. Для того чтобы отделиться актин использует АТФ полученный благодаря системе креатинфосфата (КрФ) или гликолиза, т.е. не из головки миозина.
Необходимо понимать, что радиус действия АТФазы миозиновой головки ограничен, и низкий уровень КрФ колоссально замедляет процесс последующего движения нити актина. В то же время, наличие множества свободного АТФ, которое наблюдается при высоком уровне КрФ, позволяет актину выполнять быстрое движение вперед, без всевозможных задержек. Именно так количество АТФ и КрФ влияет на силу человека.
При наличии огромного количества энергетических фосфатов, актин за единицу времени может преодолеть гораздо большее расстояние, так как практически не тратит время на отсоединение мостиков миозина. При равной нагрузке, мышечной волокно с высоким уровнем АТФ всегда будет сильнее.
Практические выводы
Многим читателям вышеприведенная теория покажется абсолютно бесполезной в свете их основной цели – построение невероятных мышечных объемов. Однако такое суждение будет ошибочным. Как вы наверняка знаете, цель любой тренировки заключается в банальном нанесении травм мышечному волокну на клеточном уровне, но мало кто знает, что на самом деле является такой травмой. На данный момент одной из самых основных гипотез является теория повреждения миозиновых мостиков.
Как уже говорилось выше, для отцепления от актина мостиков миозина нужна энергия. Однако, что будет, если этой энергии нет?!
Такую картину можно наблюдать при достаточно большом рабочем весе, который за считанные секунды тратит весь запас КрФ. Итогом такого дефицита энергии станет обыкновенный отказ мышцы!
Проанализировав этот процесс на клеточном уровне, эксперты обнаружили, что не отсоединённые мостики попросту ломаются во время тренировки, ведь нить актина в любом случае вернется в исходную позицию. Принято считать, что именно такие повреждения ведут к заветным микротравмам, которые впоследствии вызывают рост мышц.
На эту гипотезу опираются все те, кто верят в феномен гиперплазии – увеличение числа мышечных клеток. Считается, что такие травмы ведут к самой агрессивной адаптационной реакции – высвобождению клеток сателлитов (миобластов), которые перерождаются и тем самым создают новое мышечное волокно. К сожалению, прямых доказательств существования или отсутствия таких процессов пока нет. Наука попросту не шагнула настолько далеко.
Несмотря на все это, вы можете подчерпнуть большой опыт из данной статьи. Если мышечная гипертрофия(работа в режиме 8-12 повторений) не вызывает у вас активного роста мышц, можете смело пробовать силовой диапазон повторений (4-6-8). Теоретически, это поспособствует гиперплазии, что разумеется, положительно скажется на общем объеме мускулатуры, ведь вклад мышечных волокон в общий объем мышцы является самым весомым.Как сокращается мышечное волокно | Бег и лыжи
Двигательный импульсКаждое мышечное волокно иинервируется отдельным двигательным нервом, оканчивающимся у средней части волокна. Отдельный двигательный нерв и все волокна, которые он иннервирует, имеют собирательное название — двигательная единица. Синапс между двигательным нервом и мышечным волокном называется нервно-мышечным синапсом. Именно в нем осуществляется связь между нервной и мышечной системами. Рассмотрим их подробней.
Импульсное движениеЯвления, вызывающие сокращение мышечного волокна, весьма сложны. Процесс, начинается вследствие возбуждения двигательного нерва. Нервный импульс поступает к нервным окончаниям аксонов, которые находятся вблизи сарколеммы. При поступлении импульса эти нервные окончания выделяют нейромедиатор — ацетилхолин (Ацх), который “привязывается” к рецепторам сарколеммы. При достаточном его количестве на рецепторах электрический заряд передается по всей длине волокна. Этот процесс называется развитием потенциала действия. Развитие потенциала действия в мышечной клетке должно произойти прежде, чем она сможет сократится.
Роль кальцияКроме деполяризации мембраны волокна, электрический импульс проходит через всю сеть трубочек волокна (Т-трубочки и саркоплазматический ретикулум) во внутреннюю часть клетки. Поступление электрического импульса приводит к выделению значительного количества ионов кальция из саркоплазматического ретикулума в саркоплазму .
Полагают, что в состоянии покоя молекулы тропомиозина находятся над активными участками актиновых филаментов, предотвращая “привязывание” миозиновых головок. После освобождения ионов кальция из саркоплазматического ретикулума они связываются с тропонином на актиновых филаментах. Считают, что тропонин, имеющий выраженное сродство к ионам кальция, начинает затем процесс сокращения, “поднимая” молекулы тропомиозина с активных участков актиновых филаментов. Поскольку тропомиозин обычно “скрывает” активные участки, он блокирует взаимодействие поперечных мостиков миозина с актиновым филаментом. Однако как только тропонин и кальций “поднимают” тропомиозин с активных участков, головки миозина начинают прикрепляться к активным участкам актиновых филаментов.
Теория скольжения филаментовКак сокращаются мышечные волокна? Это явление объясняет так называемая теория скольжения филаментов. Когда поперечный мостик миозина прикрепляется к актиновому филаменту, оба филамента скользят относительно друг друга. Считают, что миозиновые головки и поперечные мостики в момент прикрепления к активным участкам актиновых филаментов подвергаются структурным изменениям. Между ветвью поперечного мостика и миозиновой головкой возникает значительное межмолекулярное взаимодействие, в результате которого головка наклоняется к ветви и тянет актиновый и миозиновый филаменты в противоположные стороны. Этот наклон головки называют энергетическим, или силовым, ударом.
Сразу же после наклона миозиновая головка отрывается от активного участка, возвращается в исходное положение и прикрепляется к новому активному участку дальше вдоль актинового филамента. Повторяющиеся прикрепления и открепления (разрывы) вынуждают филаменты скользить относительно друг друга, что послужило основанием появлению теории скольжения.
Процесс продолжается до тех пор, пока окончания миозиновых филаментов не достигнут Z-линий. Во время скольжения (сокращения) актиновые филаменты еще больше сближаются, выходят в H-зону и в конце концов перекрывают ее. Когда это происходит, H-зона оказывается невидимой.
Энергетика мышечного сокращенияМышечное сокращение — активный процесс, для которого нужна энергия. Кроме связывающего участка для актина миозиновая головка содержит такой же участок для аденозинтрифос- фата (АТФ). Чтобы возникло мышечное сокращение, молекула миозина должна соединиться с АТФ, поскольку последний обеспечивает необходимую энергию.
Фермент АТФаза, расположенный на головке миозина, расщепляет АТФ, образуя аденозинди- фосфат (АДФ), неорганический фосфор (Рн) и энергию. Освобождающаяся вследствие расщепления АТФ энергия используется для прикрепления головки миозина к актиновому филаменту. Таким образом, АТФ — химический источник энергии для мышечного сокращения.
Завершение мышечного сокращенияМышечное сокращение продолжается до тех пор, пока не истощатся запасы кальция. Затем кальций “перекачивается” назад в СР, где находится до тех пор, пока новый нервный импульс не достигнет мембраны мышечного волокна. Возвращение кальция в СР осуществляет активная система “кальциевого насоса”. Это еще один процесс, для осуществления которого необходима энергия, источником которой опять- таки является АТФ. Таким образом, энергия требуется для фазы как сокращения, так и расслабления.
Выводы:
Потенциал действия распространяется по сарколемме, системе трубочек и вызывает освобождение кальция из СР;
Кальций связывается с тропонином, который затем поднимает молекулы тропомиозина с активных участков актинового филамента, открывая их для связывания с миозиновой головкой;
После связывания с активным актиновым участком миозиновая головка наклоняется и тянет актиновый филамент, в результате чего филаменты скользят относительно друг друга. Наклон миозиновой головки получил название энергетического, или силового, удара;
Потребность в энергии возникает до мышечного сокращения. Миозиновая головка связывается с АТФ, а АТФаза расщепляет АТФ на АДФ и Рн, выделяя энергию для сокращения;
Мышечное сокращение завершается тогда, когда кальций активно выкачивается из саркоплазмы назад в СР для хранения. Этому процессу, ведущему к расслаблению, также необходима энергия, источником которой является АТФ;
Мышечное сокращение вызывается импульсом двигательного нерва. Двигательный нерв освобождает Ацх, который открывает ионные каналы в мембране мышечной клетки, тем самым обеспечивая поступление натрия в мышечную клетку (деполяризация). При достаточной деполяризации клетки возникает потенциал действия и происходит мышечное сокращение.
- При удалении кальция тропонин и тропомиозин инактивируются. при этом происходит разрыв связи поперечных мостиков миозина с актиновыми филаментами и прекращается использование АТФ. Вследствии этого миозиновые и актиновые филаменты возвращаются в свое первоначальное расслабленное состояние.
13.1: Сокращение мышц — Биология LibreTexts
Что заставляет мышцы сокращаться?
Начинается с сигнала нервной системы. Итак, все начинается с сигнала вашего мозга. Сигнал проходит через нервную систему к мышцам. Ваши мышцы сокращаются, а кости двигаются. И все это происходит невероятно быстро.
Сокращение мышц
Сокращение мышц происходит, когда мышечные волокна становятся короче. Буквально мышечные волокна становятся меньше в размерах.Чтобы понять, как это происходит, нужно больше узнать о структуре мышечных волокон.
Структура мышечных волокон
Каждое мышечное волокно содержит сотни органелл, называемых миофибриллами . Каждая миофибрилла состоит из двух типов белковых нитей: актиновых, более тонких и миозиновых более толстых. Нити актина прикреплены к структурам, называемым Z линиями (рис. 13.13.2). Область между двумя линиями Z называется саркомером .Внутри саркомера миозиновые нити перекрывают актиновые нити. Миозиновые филаменты имеют крошечные структуры, называемые пересекают мостики , которые могут прикрепляться к актиновым филаментам.
Рисунок 13.13.2: Саркомер. Саркомер содержит актиновые и миозиновые нити между двумя Z-линиями.
Теория скользящей нити
Наиболее широко распространенная теория, объясняющая, как сокращаются мышечные волокна, называется теорией скользящих волокон .Согласно этой теории, миозиновые филаменты используют энергию АТФ, чтобы «ходить» по актиновым филаментам с их поперечными мостиками. Это сближает актиновые филаменты. Движение актиновых нитей также сближает линии Z, таким образом укорачивая саркомер.
Когда все саркомеры в мышечном волокне укорачиваются, волокно сокращается. Мышечное волокно либо полностью сокращается, либо совсем не сокращается. Количество сокращающихся волокон определяет силу мышечной силы.Когда одновременно сокращается больше волокон, сила увеличивается.
Мышцы и нервы
Мышцы не могут сокращаться сами по себе. Им нужен стимул от нервной клетки, чтобы «заставить» их сокращаться. Допустим, вы решили поднять руку в классе. Ваш мозг отправляет электрические сообщения нервным клеткам, называемым двигательными нейронами , в вашей руке и плече. Моторные нейроны, в свою очередь, стимулируют сокращение мышечных волокон руки и плеча, заставляя руку подниматься.Непроизвольные сокращения сердечных и гладких мышц также контролируются нервами.
Сводка
- Согласно теории скользящих нитей, мышечное волокно сокращается, когда миозиновые нити притягивают актиновые нити ближе друг к другу и, таким образом, укорачивают саркомеры внутри волокна.
- Когда все саркомеры в мышечном волокне укорачиваются, волокно сокращается.
Обзор
- Что такое саркомер и Z-линия?
- Какие две белковые нити у миофибриллы?
- Объясните, как сокращаются мышцы в соответствии с теорией скользящей нити.
- Серьезная травма шеи может привести к параличу человека ниже шеи. Объяснить, почему.
Теория сокращения мышц и скольжения нити
Теория скользящих волокон — это механизм, с помощью которого мышцы сокращаются на клеточном уровне. Хорошее понимание структуры скелетных мышц полезно при изучении того, как работает теория скользящей нити.
Что такое теория скользящей нити?
На самом базовом уровне каждое мышечное волокно состоит из более мелких волокон, называемых миофибриллами.Они содержат еще более мелкие структуры, называемые актиновыми и миозиновыми нитями. Эти нити скользят друг в друга, формируя мышечное сокращение, отсюда и название теории скользящих нитей!
На приведенной выше диаграмме показана часть миофибриллы, называемая саркомером. Это наименьшая единица скелетной мышцы, которая может сокращаться. Саркомеры повторяются снова и снова по длине миофибриллы.
Вот краткое напоминание обо всех задействованных мышечных структурах:
- Миофибрилла: Цилиндрическая органелла, проходящая по длине мышечного волокна, содержащая актиновые и миозиновые нити.
- Саркомер : функциональная единица миофибриллы, разделенная на диапазоны I, A и H.
- Актин : Тонкая сократительная белковая нить, содержащая «активные» или «связывающие» сайты.
- Миозин : Толстая сократительная белковая нить с выступами, известными как миозиновые головки.
- Тропомиозин: Актин-связывающий белок, регулирующий сокращение мышц.
- Тропонин: Комплекс из трех белков, связанных с тропомиозином.
Сокращение мышц
Вот что происходит в деталях. Процесс сокращения мышцы можно разделить на 5 частей:
- Нервный импульс поступает в нервно-мышечное соединение, которое вызывает высвобождение химического вещества под названием ацетилхолин. Присутствие ацетилхолина вызывает деполяризацию моторной замыкательной пластинки, которая перемещается по мышце по поперечным канальцам, вызывая высвобождение кальция (Ca +) из саркоплазматического ретикулума.
- В присутствии высоких концентраций Ca +, Ca + связывается с тропонином, изменяя его форму и таким образом перемещая тропомиозин из активного центра актина. Нити миозина теперь могут прикрепляться к актину, образуя поперечный мостик.
- Распад АТФ высвобождает энергию, которая позволяет миозину тянуть актиновые нити внутрь и таким образом сокращать мышцы. Это происходит по всей длине каждой миофибриллы в мышечной клетке.
- Миозин отделяется от актина, и поперечный мостик разрушается, когда молекула АТФ связывается с головкой миозина.Когда АТФ затем расщепляется, головка миозина может снова прикрепиться к сайту связывания актина дальше вдоль нити актина и повторить «силовой удар». Это повторяющееся натягивание актина на миозин часто называют храповым механизмом.
- Этот процесс мышечного сокращения может длиться до тех пор, пока есть адекватные запасы АТФ и Са +. Как только импульс прекращается, Са + перекачивается обратно в саркоплазматический ретикулум, а актин возвращается в свое положение покоя, заставляя мышцу удлиняться и расслабляться.
Важно понимать, что один силовой удар приводит только к укорочению примерно на 1% всей мышцы. Поэтому для достижения общего сокращения до 35% весь процесс необходимо повторять много раз. Считается, что в то время как половина поперечных мостиков активна в протягивании актина через миозин, другая половина ищет свой следующий сайт связывания.
Растянутая мышца
Еще раз взглянув на диаграмму выше, можно увидеть растянутую мышцу, в которой I — полоса и H — зона удлинены из-за уменьшения перекрытия миозиновых и актиновых нитей.Мышечная сила будет снижена, потому что между актином и миозином может образоваться мало поперечных мостиков.
Частично сокращенная мышца
На приведенной выше диаграмме показана частично сокращенная мышца, где миозин и актин в большей степени перекрываются с большим потенциалом образования поперечных мостиков. I — полосы и H — зона укорачиваются.
Полностью сокращенная мышца
На приведенной выше диаграмме показана полностью сокращенная мышца со значительным перекрытием актина и миозина.Поскольку тонкие актиновые филаменты перекрываются, вероятность повторного образования поперечных мостиков снижается. Следовательно, мышца будет производить небольшое усилие.
Модель сжатия скользящей нити
Результаты обучения
- Опишите процессы сокращения мышц
Чтобы мышечная клетка сократилась, саркомер должен укорачиваться. Однако толстые и тонкие нити — компоненты саркомеров — не укорачиваются.Вместо этого они скользят друг по другу, заставляя саркомер укорачиваться, а нити остаются той же длины. Теория сокращения мышц скользящей нити была разработана с учетом различий, наблюдаемых в названных полосах на саркомере при разной степени сокращения и расслабления мышц. Механизм сокращения — это связывание миозина с актином, образуя поперечные мостики, которые генерируют движение филаментов (Рисунок 1).
Рис. 1. Когда (а) саркомер (б) сжимается, линии Z сдвигаются ближе друг к другу, а полоса I становится меньше.Полоса А остается той же ширины, и при полном сокращении тонкие нити перекрываются.
Когда саркомер укорачивается, некоторые области укорачиваются, тогда как другие остаются той же длины. Саркомер определяется как расстояние между двумя последовательными Z-дисками или Z-линиями; когда мышца сокращается, расстояние между Z-дисками уменьшается. Зона H — центральная область зоны A — содержит только толстые волокна и укорачивается при сокращении. Полоса I содержит только тонкие нити и также укорачивается.Полоса А не укорачивается — она остается той же длины, — но полосы А разных саркомеров сближаются во время сокращения и в конечном итоге исчезают. Тонкие нити тянутся толстыми нитями к центру саркомера, пока Z-диски не приблизятся к толстым нитям. Зона перекрытия, в которой тонкие волокна и толстые волокна занимают одну и ту же площадь, увеличивается по мере продвижения тонких волокон внутрь.
Помните, что актиновые и миозиновые нити сами по себе не изменяют длину, а вместо этого скользят друг мимо друга.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Морфологические и функциональные характеристики волокон скелетных мышц у женщин в постменопаузе с заменой и заменой гормонов | Журналы геронтологии: серия A
Аннотация
Мы проверили гипотезу о том, что поперечные механизмы сокращения различались у женщин в раннем постменопаузе, которые получали или не получали заместительную гормональную терапию (ЗГТ).Биопсия Vastus lateralis была получена у 17 женщин в постменопаузе (49–57 лет), 8 из которых получали ЗГТ в течение предыдущих 24 ± 5 месяцев, а 9 из которых никогда не получали ЗГТ. Электрофорез и гистохимия ферментов показали, что распределение изоформ тяжелой цепи миозина (MHC) волокна, площадь поперечного сечения (CSA) медленных и быстрых волокон и относительная CSA, занятая каждым из них, были сходными для групп HRT и не-HRT. Одиночные пермеабилизированные волокна, содержащие MHC типа IIa, имели более высокую пиковую удельную силу, активированную Ca 2+ , скорость укорочения без нагрузки и пиковую мощность, чем волокна, содержащие MHC типа I, но во всех случаях значения для групп HRT и не-HRT были аналогичными.В этом поперечном исследовании мы не обнаружили никаких доказательств того, что функция волокон, активируемых Ca 2+ , распределение изоформ MHC или относительная CSA, занятая медленными и быстрыми волокнами, различались между группами HRT и не-HRT.
Пик мышечной силы ЧЕЛОВЕКА приходится на третье десятилетие жизни, остается относительно стабильным в течение следующих трех десятилетий, а затем начинает снижаться, упав до 60–70% от своего пикового уровня к седьмому-восьмому десятилетию жизни (1,2) . Это снижение произвольной силы имеет важные последствия для здоровья, начиная от неспособности выполнять повседневные действия, такие как вставание со стула (3), до повышенного риска падения (4).Основными периферическими факторами возрастной потери нервно-мышечной функции являются атрофия мышц и снижение внутренней способности мышц создавать силу (1,5,6). Последнее является следствием нарушения связи возбуждения-сокращения и изменения поперечно-мостиковых механизмов сокращения (7-10).
Данные перекрестных исследований показывают, что возрастное снижение произвольной силы у женщин происходит в более раннем возрасте, чем у мужчин (11,12). Например, начиная с возрастной группы от 45 до 55 лет, удельная сила (сила – площадь поперечного сечения мышцы) приводящего большого пальца оказалась значительно ниже у женщин, чем у мужчин (11).Дальнейший анализ этой возрастной группы показал, что дефицит силы был ограничен теми женщинами, которые не получали заместительную гормональную терапию (ЗГТ), потому что женщины, принимавшие ЗГТ, имели силу, сравнимую с их коллегами-мужчинами. Эти наблюдения приводят к гипотезе о существовании причинно-следственной связи между эстрогеном и мускулатурой у женщин в постменопаузе (11).
Эта гипотеза подтверждается выводом о том, что лечение ЗГТ предотвращает связанное с возрастом снижение силы разгибателей колена (13) и улучшает силу разгибателей и приводящих пальцев колена у женщин в постменопаузе (14,15).Тем не менее, эта гипотеза остается спорной, потому что несколько других продольных исследований не нашли достаточной поддержки роли ЗГТ в поддержании или улучшении силы сжатия кисти, силы разгибателей колена или силы разгибания ног у женщин в постменопаузе (16,17).
Предыдущие исследования ЗГТ оценивали работу мышц путем оценки максимальных произвольных сокращений. Производительность мышц, измеренная в этих условиях, является функцией центральных (нервных) и периферических (мышечных) факторов.В обширном обзоре литературы Гандевия (18) пришел к выводу, что «кажется, что ни одна мышца не наделена поистине оптимальным приводом во время максимальных изометрических усилий». Насколько нам известно, только одно исследование ЗГТ напрямую касалось этой проблемы неполной активации мышц (13), хотя другие исследования предполагали максимальную активацию (11,14) на основании результатов своих предыдущих исследований (19).
Физиологическая площадь поперечного сечения (CSA), состав волокон и сократительные свойства отдельных мышечных волокон — все это влияет на периферические или механические свойства мышцы.В этом контексте следует отметить, что исследования, показывающие наибольший эффект от ЗГТ, — это те, в которых изучалась функция аддуктора pollicis (11,14), тогда как исследования показывают относительно небольшие, но статистически значимые преимущества ЗГТ (13,15), или без каких-либо преимуществ (16,17) на разгибателях колена. Аддукторный поллис имеет относительно постоянный состав типа волокон (20) с в целом параллельной архитектурой волокон (19). Эта последняя характеристика означает, что анатомическая ППС мышцы, которую можно надежно измерить (19), эквивалентна ее физиологической ППС.Напротив, мышцы, составляющие разгибатели колена, обычно имеют состав смешанного типа волокон (21) и имеют сложную перистую архитектуру (22). Эта последняя особенность затрудняет правильную нормализацию измерений силы между испытуемыми.
Наша рабочая гипотеза состоит в том, что расхождения между предыдущими исследованиями ЗГТ могут быть связаны с трудностью нормализации или интерпретации измерений произвольной силы. Поэтому в этом исследовании мы использовали альтернативный подход к оценке мышечной функции.Используя гистохимический анализ аденозинтрифосфатазы (АТФазы), электрофорез в геле одного волокна и функциональный препарат in vitro, мы оценили CSA, распределение типов волокон и сократительные свойства мышечных волокон, активируемых Ca 2+ , полученных из двух группы женщин в раннем постменопаузе: женщины, получающие ЗГТ после менопаузы, и женщины, никогда не получавшие ЗГТ. Этот подход устраняет многие неопределенности, связанные с измерением произвольной нервно-мышечной силы. Эта методология также позволяет нам проверить гипотезу, выдвинутую Филлипсом и соавторами (11), что сайт действия ЗГТ находится на уровне актомиозиновых поперечных мостиков.
Методы
Субъектов
Семнадцать здоровых женщин в постменопаузе вызвались принять участие в этом исследовании. Эти люди были подгруппой субъектов, участвовавших в более крупном продольном исследовании, в котором изучали минеральную плотность костной ткани после менопаузы. Субъекты были выбраны из пула добровольцев, которые откликнулись на объявления в газетах или которых врачи направили для участия в исследовании. Исследование было одобрено институциональным наблюдательным советом Университета штата Орегон.Все субъекты дали письменное согласие после того, как были полностью проинформированы о характере исследования.
Уровни фолликулостимулирующего гормона были ≥20 мМЕ / мл для всех субъектов (подтверждено лечащим врачом). Девять женщин никогда не принимали ЗГТ (группа без ЗГТ: 22 ± 6 месяцев с момента постановки диагноза «постменопаузальный»). Остальные 8 субъектов принимали ЗГТ с момента или незадолго до того, как им был поставлен диагноз «постменопаузальный» (группа ЗГТ: 20 ± 3 месяцев с момента постановки диагноза как постменопаузальный; 24 ± 5 месяцев на ЗГТ).ЗГТ состояла из конъюгированных эстрогенов (0,625 мг / сут).
Состав тела
Состав тела определяли с помощью двухэнергетической рентгеновской абсорбциометрии (QDR-4500 Elite A, Hologic, Inc., Уолтем, Массачусетс), как описано ранее (23). Сканы анализировали с использованием программного обеспечения Hologic версии 9.80 D (Hologic).
Сила произвольного разгибания колена
Пик крутящего момента разгибателей левого колена оценивался с помощью изокинетической динамометрии (KIN-COM 500H, Chattex Corp., Хиксон, Теннесси). Все испытания проводились на скорости 30 градусов в секунду с поправкой на гравитацию. После демонстрации процедур каждый субъект располагался так, чтобы изолировать исследуемую группу мышц, и инструктировался выполнить 10–12 попыток с интенсивностью значительно ниже максимальной. После этой разминки испытуемые выполняли от трех до пяти максимальных усилий, чтобы определить пиковую силу и крутящий момент. Каждое максимальное усилие отделялось примерно 60 секундами отдыха.
Физическая активность
Текущие уровни физической активности оценивались с помощью анкеты, которую заполняли во время посещения лаборатории (24).В анкете испытуемых просили вспомнить продолжительность и интенсивность их типичных еженедельных развлечений, досуга и домашних дел в течение 6 месяцев, предшествовавших исследованию.
Биопсия мышцы
Образец мышцы левой большой мышцы бедра был получен с использованием техники чрескожной игольной биопсии. Одну часть образца немедленно помещали в раствор для холодного препарирования (состав см. В следующих параграфах), где она разделялась на небольшие пучки волокон для использования в функциональных экспериментах.Эти связки хранили в растворе для снятия шкур (состав приведен в следующем подразделе) при 4 ° C в течение 24 часов, прежде чем они были перенесены в свежий раствор для снятия шкур и хранили при -20 ° C в течение до 3 недель. Другая часть образца биопсии была выровнена вертикально в среде для фиксации ткани и заморожена в изопентане, который охлаждали до точки замерзания жидким азотом. Этот образец хранился в герметичной криопробирке при -80 ° C для последующего гистохимического анализа.
Гистохимия и морфология ферментов
Образцы мышц делали на криостате (модель CM1800; Leica Microsystems, Nussloch, Germany) при -20 ° C.Срезы толщиной 8–10 мкм собирали на покровные стекла, сушили на воздухе и окрашивали на миофибриллярную АТФазу. Срезы окрашивали при pH 9,4 после предварительной инкубации как щелочной (pH 10), так и двумя различными кислотами (pH 4,35 и 4,65). Окрашенные срезы помещали на предметные стекла, и фотографии срезов делали с увеличением в 100 раз. Фотографии были преобразованы в цифровые файлы с помощью планшетного сканера. Программное обеспечение для анализа изображений (Scion Image, Scion Corp., Frederick, MD) использовалось для определения CSA волокон, которые были свободны от артефактов, имели четкие границы клеток и не имели тенденции к продольному разрезу.
Функциональные исследования
Состав растворов, используемых для функциональных исследований, определялся с помощью итерационной компьютерной программы (25) с использованием констант стабильности, скорректированных с учетом ионной силы, pH и температуры (26). Все растворы содержали 7,0 мМ EGTA [этиленгликоль-бис (2-аминоэтил) -N, N, N ‘, N’-тетрауксусная кислота], 20,0 мМ имидазол, 1 мМ свободный Mg 2+ , 4 мМ АТФ (аденозин-5′ -трифосфат), 14,5 мМ креатинфосфата и 15 ед. мл -1 креатинкиназы.Концентрация свободного Ca 2+ в расслабляющих и активирующих растворах была доведена до pCa 9,0 и pCa 4,5, где pCa равно -log [Ca 2+ ], соответственно, с помощью 100 мМ стандартного раствора CaCl 2 (молярность кальция Standard, Corning Inc., Корнинг, Нью-Йорк). В обоих растворах pH доводили до 7,0, используя КОН (гидроксид калия), и добавляли достаточное количество KCl (хлорид калия), чтобы довести общую ионную силу до 180 мМ.
Раствор для препарирования состоял из расслабляющего раствора и коктейля ингибиторов протеазы, приготовленных в соответствии с инструкциями производителя (Complete Mini EDTA-Free Protease Inhibitor Tablets, Boehringer Mannheim, Indianapolis, IN).Раствор для снятия шкур готовился путем смешивания равных объемов раствора для рассечения и глицерина.
В день эксперимента мышечный пучок был переведен со снятия шкур на расслабляющий раствор. Сегменты мышечных волокон были изолированы, удерживая один угол пучка щипцами и вставляя тонкие щипцы (Дюмон № 5) в противоположный конец пучка, чтобы захватить и аккуратно удалить сегмент волокна. Сегмент одного волокна был установлен между изометрическим датчиком силы (Модель 400, Aurora Scientific, Аврора, Онтарио) и сервоуправляемым двигателем (Модель 308B, Aurora Scientific), как описано ранее (27).Выходные сигналы преобразователя и двигателя были усилены перед оцифровкой (5 кГц) и подключены к персональному компьютеру с помощью платы сбора данных (модель AT-MIO-16E, National Instruments, Остин, Техас). Сбор и анализ данных проводились с помощью компьютерной программы, написанной в нашей лаборатории (LabView, National Instruments, Остин, Техас).
Установленное волокно было подвешено в одной из нескольких камер со стеклянным дном, вырезанных в погружную пластину из нержавеющей стали. Вдавление и перемещение пластины позволили исследователю быстро перемещать сегмент волокна из камеры в камеру.Планшет устанавливали на инвертированный микроскоп (Olympus IX-70, Olympus America Inc., Мелвилл, штат Нью-Йорк), где длина саркомера была отрегулирована до 2,5 мкм (измерялась калиброванным окулярным микрометром) с помощью трехосевых микроманипуляторов, прикрепленных к преобразователю. и мотор. Длина волокна (FL) измерялась путем перемещения волокна в поле зрения микроскопа с использованием цифрового микрометра, прикрепленного к механическому столику микроскопа. CSA волокна определяли путем измерения ширины волокна, когда смонтированное волокно было ненадолго подвешено в воздухе (<5 секунд), и расчета CSA, предполагая, что волокно образует цилиндр в воздухе (27,28).Было выполнено три измерения CSA по длине волокна (с возвращением волокна в релаксирующий раствор между измерениями), и среднее значение было принято как CSA волокна. Температуру контролировали с помощью термопары, которую вставляли в раствор, омывающий волокно. Температура раствора поддерживалась на уровне 15 ° C на протяжении всего эксперимента.
Скорость укорачивания без нагрузки ( В, или ) была определена с использованием метода испытания на провисание (рис. 1А). Волокна также подвергались серии изотонических сокращений, чтобы построить отношения сила-скорость-мощность (Рисунок 1B).Как для тестов на провисание, так и для изотонических сокращений общее укорочение никогда не превышало 20% от FL. Пиковая сила, активируемая Ca 2+ , была определена как разница между максимальной силой, создаваемой во время активации Ca 2+ , и базовой линией силы, достигнутой, когда волокно было провисшим. После физиологических измерений волокно извлекали из инструментов, растворяли в 30 мкл буфера для образцов додецилсульфата натрия (SDS) и хранили при -80 ° C.
Определение содержания изоформы тяжелой цепи миозина в волокнах
Гель-электрофорезиспользовали для определения содержания изоформы тяжелой цепи миозина (MHC) во всех волокнах, подвергнутых функциональной оценке.Кроме того, ~ 50 дополнительных сегментов волокна на каждого субъекта были выделены из ободранных мышечных пучков (с использованием той же методики, описанной здесь для функциональных экспериментов) и сохранены в буфере SDS для анализа изоформ MHC.
Гель-электрофорез и окрашивание серебром проводили, как описано ранее (27). Стандарт миозина человека, приготовленный из экстракта мышцы бедра латеральной мышцы человека, вводили в одну или несколько дорожек каждого геля. Этот стандарт был использован для идентификации изоформ (ов), присутствующей в каждом сегменте волокна, с использованием порядка миграции изоформ MHC взрослых людей (29).
Статистический анализ
Описательные характеристики двух групп сравнивали с помощью одностороннего дисперсионного анализа (ANOVA). Анализ ковариации был использован для сравнения силы разгибания колена, в то время как мышечная масса левой ноги и общая мышечная масса тела контролировались. Гистохимические данные и данные изоформы MHC с одним волокном были проанализированы с помощью двухфакторного дисперсионного анализа (основные эффекты лечения HRT и тип волокна). Функциональные данные волокна были проанализированы с использованием ANOVA (основные эффекты содержания изоформы MHC и лечения ЗГТ с субъектами, входящими в группу гормонального лечения).Статистическая значимость была принята на уровне p <0,05. Все данные представлены как среднее ± SE .
Результаты
Характеристики испытуемых
9 субъектов без ЗГТ и 8 испытуемых были схожи ( p > 0,05) по возрасту (52,9 ± 0,8 и 52,3 ± 0,7 года соответственно), росту (167 ± 3 и 165 ± 3 см), общей массе тела. (66,3 ± 3,8 и 67,4 ± 5,3 кг) и безжировой массой тела (44,7 ± 1,9 и 43,6 ± 2,6 кг). Группы без ЗГТ и ЗГТ имели одинаковые уровни физической активности (54 ± 11 и 43 ± 7 МЕТ-час / неделю, соответственно, где 1 МЕТ в 1 раз превышает скорость метаболизма в состоянии покоя).Сила произвольного разгибания колена (без ЗГТ, 163 ± 10 Н · м; ЗГТ, 146 ± 11 Н · м) не различалась между группами в абсолютном выражении или с поправкой на индивидуальную безжировую массу тела или безжировую массу левой ноги (анализ ковариации).
Гистохимия
Пример поперечного сечения мышцы, окрашенной на миофибриллярную АТФазу, показан на рисунке 2А. На некоторых, но не на всех участках можно выделить три различных типа волокон. Следовательно, волокна были классифицированы как типы I или II на основании их гистохимических характеристик окрашивания, и не было предпринято никаких попыток подклассифицировать волокна типа II.Мы не смогли проанализировать образцы от 2 субъектов (оба из группы ЗГТ) из-за недостаточного количества волокон, свободных от артефактов.
В среднем 38% волокон были классифицированы как тип I, и эти волокна были значительно больше по CSA, чем волокна типа II (Таблица 1). Однако, несмотря на меньший размер CSA волокна, более высокая относительная встречаемость быстрых волокон означала, что значительно больший процент от общей площади образца был составлен из этого типа волокна. Эти отношения для распределения типов волокна, CSA волокна и относительного CSA волокна не зависели от статуса HRT.
Волокно, содержание MHC
Всего было подвергнуто гель-электрофорезу 1110 одиночных волокон. Гель, иллюстрирующий идентификацию изоформы MHC в сегментах с одним волокном, представлен на рисунке 2B. Не было межгрупповых различий в относительном количестве волокон, экспрессирующих каждую конкретную изоформу MHC или комбинации изоформ (таблица 2). В среднем 46 ± 1%, 35 ± 1% и 5 ± 1% волокон экспрессировали MHC типа I, IIa или IIx соответственно. Остальные волокна экспрессировали различные комбинации изоформ, включая типы I и IIa (5 ± 1%) и типы IIa и IIx (8 ± 1%).
Функциональные свойства одиночных волокон
Примерно 90% волокон, выделенных для функционального анализа, содержали MHC типа I или IIa. Средняя CSA, абсолютная сила (миллиньютон) и удельная сила (сила на волокно CSA, в килоньютонах на квадратный метр) этих волокон представлены в таблице 3. Волокна, экспрессирующие MHC типа I, были значительно больше в CSA, чем волокна, выражающие IIa. изоформа. Однако волокна, экспрессирующие MHC типа IIa, производили большую удельную силу, чем волокна, содержащие изоформу типа I, и в результате абсолютный пик силы, активируемой Ca 2+ , был аналогичным для волокон типа I и IIa.Не было значительного эффекта ЗГТ или ЗГТ посредством взаимодействия МНС для любой из этих переменных, что указывает на то, что отношения между содержанием изоформы МНС в клетчатке и CSA, абсолютной силой и удельной силой были аналогичными для групп ЗГТ и не-ЗГТ.
Выявлен значительный основной эффект экспрессии изоформы MHC на волокне V o (определено по результатам испытаний на провисание) с волокнами, экспрессирующими укорочение изоформы типа IIa в ~ 4,5 раза быстрее, чем волокна, содержащие изоформу типа I ( Таблица 4).Эта взаимосвязь не различалась между волокнами из групп без ЗГТ и из групп. В соответствии с результатами V o , анализ соотношений сила-скорость показал, что волокно V max (экстраполированное пересечение оси скорости отношения силы-скорости) было значительно быстрее в волокнах, выражающих MHC типа IIa ( без HRT, 1,98 ± 0,11 FL / с, n = 35; HRT, 1,93 ± 0,12 FL / с, n = 28), чем в волокнах, экспрессирующих MHC I типа (без HRT, 0.69 ± 0,02 FL / с, n = 48; HRT, 0,69 ± 0,04 FL / с, n = 43). Кривизна зависимости сила-скорость, как показано параметром a / P o , также была больше для волокон типа IIa (без HRT, 0,047 ± 0,003 FL / с; HRT, 0,050 ± 0,004 FL / с), чем для волокон типа I (без HRT, 0,027 ± 0,001 FL / с; HRT, 0,029 ± 0,002 FL / с). Однако для обоих типов волокон V max и a / P o не наблюдалось значительных различий между волокнами, полученными из не-HRT, и из группы HRT для любого типа волокна.
Пиковая мощность волокна, выраженная либо в абсолютном выражении (микроньютон на FL в секунду), либо нормированная на объем волокна (ватт / литр), была больше в волокнах, экспрессирующих MHC типа IIa, чем в волокнах, экспрессирующих изоформу типа I (Таблица 5). Не было различий в пиковой мощности медленных или быстрых волокон в результате статуса ЗГТ.
Обсуждение
Насколько нам известно, настоящее исследование является первым, в котором изучаются клеточные свойства мышечных волокон женщин в раннем постменопаузе, которые различаются по статусу ЗГТ.В соответствии с предыдущими исследованиями, проведенными на женщинах, мы обнаружили, что медленные и быстрые волокна широкой мышцы бедра различаются по нескольким характерным чертам. Например, медленные волокна в среднем были больше в CSA, чем быстрые волокна. Однако, поскольку медленные волокна были менее распространены, чем быстрые волокна, медленные волокна занимали меньше относительной CSA образца латеральной широкой мышцы бедра, чем быстрые волокна. Эти результаты согласуются с предыдущими исследованиями, в которых изучались волокна широкой мышцы бедра у молодых женщин (30,31).Кроме того, различия в функциональных свойствах медленных и быстрых волокон, активированных Ca 2+ , включая более низкую удельную силу, скорость укорочения без нагрузки и пиковую мощность первых, согласуются с предыдущими данными для мужчин молодого и среднего возраста. (27,32–34) и девушки (10,35).
Новым открытием этого исследования является то, что эти морфологические и функциональные свойства, которые были специфичны для типа волокна, не зависели от статуса ЗГТ. CSA волокна, распределение типов волокон, относительный тип волокон CSA и функциональные свойства медленных и быстрых волокон, активируемых Ca 2+ , не различались между женщинами в раннем постменопаузе, которые получали ЗГТ, и теми, кто этого не делал.
Филлипс и его коллеги (11) предположили, что ЗГТ действует на уровне поперечного моста, улучшая работу скелетных мышц. Согласно этой гипотезе, существует несколько механизмов, с помощью которых ЗГТ может потенциально улучшить работу мышц. Во-первых, ЗГТ может увеличить количество параллельных поперечных мостиков, вызывая гипертрофию мышечных волокон. Этот механизм согласуется с результатами Sipilä и соавторов (15), которые сообщили об увеличении ППС безжировой ткани четырехглавой мышцы на 3 и 7% после 6 и 12 месяцев ЗГТ соответственно.Однако, используя два независимых метода анализа (кожные волокна и гистохимия ферментов), мы не обнаружили доказательств того, что медленные или быстрые мышечные волокна у субъектов, принимавших ЗГТ, были больше в ЦСА, чем соответствующие волокна из их сверстников, не принимавших ЗГТ.
В качестве альтернативы, ЗГТ может улучшить мышечную производительность за счет изменения качества мышечной ткани. Этот механизм согласуется с поперечными и продольными исследованиями, показывающими большую удельную силу аддукторного поллициса у женщин на ЗГТ (11,14).Поскольку мы наблюдали, что быстрые мышечные волокна производят большую удельную силу, чем медленные, изменение распределения типов волокон или изменение относительной площади, занимаемой любым типом волокон, может привести к увеличению общей удельной силы мышцы. Однако распределение типов волокон, относительное содержание изоформы MHC в отдельных волокнах и относительная площадь, занимаемая медленными или быстрыми волокнами, не различались между группами HRT и не-HRT.
Наконец, ЗГТ может влиять на удельную силу отдельных мышечных волокон.В поддержку этого механизма Wattanapermpool и Reiser (36) обнаружили, что медленные волокна камбаловидной мышцы, полученные от молодых крыс, подвергнутых овариэктомии в возрасте 8–10 недель, а затем изученных через 10 или 14 недель, вырабатывают значительно меньшую удельную силу, чем волокна ложной мышцы. оперированные контрольные животные. Однако в настоящем исследовании не наблюдалось межгрупповых различий в средней удельной силе волокон, содержащих MHC типа I или IIa. Эти волокна составляли ~ 80% от общего количества волокон, выделенных из образцов биопсии (Таблица 2).Только несколько волокон, содержащих типы I / IIa ( n = 5), IIa / IIx ( n = 13) и IIx ( n = 3), были изолированы для функционального анализа, а небольшой размер выборки исключает возможность статистического анализа. анализ. Однако, если предположить, что эти волокна составляют 20% от общего количества волокон (Таблица 2) и что все остальные факторы равны, мы обнаруживаем 1,75–2-кратные межгрупповые различия в удельной силе I / IIa, IIa / IIx и IIx. волокна потребуются для учета на 15–20% большей удельной силы мышц, о которой ранее сообщалось у женщин на ЗГТ (11,14).Такая разница кажется необоснованной, поэтому маловероятно, что большая удельная сила мышц у субъектов ЗГТ может быть объяснена различиями в удельной силе отдельных мышечных волокон.
Значительное увеличение высоты вертикального прыжка после 6 и 12 месяцев ЗГТ (15) предполагает, что ЗГТ может улучшить мышечную силу. Поэтому мы оценили способность активированных Ca 2+ волокон укорачиваться и производить энергию. В соответствии с предыдущими исследованиями (27,33,34), как В, , или , так и пиковая мощность сильно зависели от содержания изоформы MHC.Однако никаких различий между группами не наблюдалось ни для одной из переменных.
Основным результатом этого исследования является согласованность в распределении типов волокон, CSA волокон и функции волокон, активируемых Ca 2+ , между субъектами, не получающими ЗГТ, и субъектами, не получающими ЗГТ. Хотя эти результаты не исключают влияния ЗГТ на работоспособность мышц, они предполагают, что любое потенциальное место действия вряд ли будет на уровне поперечного моста как такового. Этот вывод следует интерпретировать в свете ограничений настоящего исследования.Поскольку мы использовали дизайн поперечного сечения, индивидуальные вариации характеристик волокна могли скрыть эффект HRT. Хотя это, безусловно, возможно, следует отметить, что удельная сила В o и пиковая мощность – объем волокон, полученные как из групп HRT, так и из групп без HRT, очень хорошо согласуются с полученными данными. от 20 до 30 лет мужчин, недавно обследованных в нашей лаборатории (27). Это говорит о том, что нынешние субъекты среднего возраста не испытали снижения удельной силы мышечных волокон и V o , которые наблюдались у пожилых людей (9,10).Настоящие данные, хотя и не проверены напрямую, предполагают, что поперечные механизмы сокращения не изменяются в первые годы менопаузы. Если это так, то трудно представить, как ЗГТ может увеличить сократительную способность активированных Ca 2+ волокон, которые, по-видимому, имеют нормальное функционирование.
На основании этого аргумента можно предположить, что женщины в этом исследовании были слишком молоды, чтобы испытать влияние ЗГТ на морфологию или функцию мышечных волокон.С другой стороны, продолжительность лечения ЗГТ могла быть слишком короткой, чтобы вызвать лечебный эффект. Однако возраст субъектов и продолжительность лечения ЗГТ хорошо согласуются с исследованиями, проведенными Гривсом и соавторами (13) и Сипила и соавторами (15), в обоих из которых сообщалось о положительном влиянии ЗГТ на силу произвольного разгибания колен. Можно также утверждать, что, поскольку не наблюдалось межгрупповых различий в силе разгибания колен, наши испытуемые чем-то отличались от тех, которые исследовались в этих предыдущих исследованиях.Однако, как подробно описано в начале этой статьи, существуют ограничения в использовании произвольных измерений силы в качестве показателя мышечной функции. Поскольку нашей целью было изучить клеточные механизмы, ответственные за сокращение мышц, тот факт, что сила разгибания колена не различалась между нашими группами, мало влияет на наше обоснование для проведения этого исследования. Из-за сложности неповрежденной нервно-мышечной системы изменения нервно-мышечной силы или производительности не всегда сопровождаются изменениями функциональных свойств отдельных мышечных волокон (37).Напротив, атрофия мышечных волокон и сократительная дисфункция (38,39), а также снижение электрически стимулированного мышечного момента (40) наблюдались без соответствующих изменений произвольной силы у одних и тех же субъектов (40).
Описанные здесь эксперименты с одиночными клетками требуют больших затрат труда и времени и должны выполняться, пока волокна остаются жизнеспособными (в течение 3–4 недель сразу после биопсии). Это накладывает ограничения на размер выборки, и, возможно, это снижает нашу способность обнаруживать различия между группами.Мы исследовали эту возможность, вычислив величину эффекта. Для всех физиологических переменных в таблицах 3-5 величина эффекта, связанного с лечением ЗГТ, составляла ≤ 0,007. Напротив, величина эффекта для сравнений, основанных на содержании изоформы MHC, составляла 0,109, 0,005 и 0,408 для CSA волокна, абсолютной силы и удельной силы, соответственно, и 0,854, 0,831 и 0,902 для волокна V o , абсолютная мощность и нормализованная мощность соответственно. На основании критериев Коэна (41) величина эффекта 0.20–0,50 считаются небольшими разностями, а значения> 0,80 — большими. Поскольку размеры эффекта, наблюдаемые здесь для лечения ЗГТ, незначительны, увеличение размера выборки мало повлияет на значимые различия между группами, не получающими ЗГТ, и группами, не получающими ЗГТ. Наши выводы относительно лечения ЗГТ не могут быть легко отклонены как артефакт размера выборки.
В этом исследовании мы исследовали только один аспект функции мышечных клеток в строго контролируемых условиях. Поскольку наш препарат обошел процессы, связанные с активацией и релаксацией нормальных клеток, нельзя исключить потенциальное влияние ЗГТ на механизмы распространения потенциала действия или связи возбуждения-сокращения.Действительно, более быстрое время релаксации наблюдалось в нескольких мышцах задних конечностей, полученных от овариэктомированных крыс (42), что свидетельствует о влиянии эстрогена на функцию саркоплазматического ретикулума. Филлипс и его коллеги (11) предположили, что ЗГТ может изменять распределение поперечных мостиков с низкой и высокой силой, изменяя их чувствительность к внутриклеточным метаболитам, таким как неорганический фосфат (P i ) или ион водорода (H +). ). В качестве альтернативы ЗГТ может изменять концентрацию этих метаболитов.Поскольку концентрации P i и H + в медленных и быстрых мышечных волокнах женщин в постменопаузе неизвестны, их потенциальное влияние на сократительную способность волокон в настоящем исследовании не могло быть проверено. Повторюсь, настоящие результаты не исключают влияние ЗГТ на те аспекты мышечного сокращения, включая как нервные, так и периферические механизмы, которые не были изучены в этом исследовании.
Наконец, мы выполнили гистохимические и функциональные измерения волокон из одних и тех же образцов мышц, и мы хотим обратить внимание на два методологических вопроса, относящихся к этому типу двойного анализа.Первая проблема связана с большими различиями в CSA волокон, которые можно наблюдать между нашими гистохимическими результатами и нашим анализом волокна без кожуры. Это очевидное несоответствие может быть связано с увеличением диаметра волокна на 20% или увеличением CSA волокна на 44%, которое происходит в процессе химического образования пленки (43). После того, как CSA волокна с оболочкой настроены на это набухание, гистохимические результаты и результаты по волокну с оболочкой хорошо согласуются. Во-вторых, меньший процент волокон был классифицирован как тип I по гистохимии ферментов по сравнению с электрофоретическим анализом изоформ волокон MHC.Обратите внимание, что гистохимический анализ типа волокна основан на численном количестве волокон в образце. Напротив, изоляция волокон, используемых в анализе изоформ MHC, основана на относительной CSA, занятой каждым конкретным типом волокна в образце (поскольку волокна изолируются путем случайного введения щипцов в концы мышечных пучков). Таким образом, результаты по содержанию изоформы MHC в одном волокне намного лучше согласуются с результатами относительного гистохимического анализа CSA волокна по сравнению с процентным содержанием гистохимического типа волокна.
Выводы
Таким образом, мы не нашли убедительных доказательств того, что распределение типов волокон (на основе гистохимии ферментов и анализа изоформ MHC), абсолютная CSA волокна, относительная CSA волокна (CSA на тип волокна) или функциональная активность, активированная Ca 2+ . Свойства (абсолютная сила, удельная сила, скорость укорочения и пиковая мощность) мышечных волокон широкой мышцы бедра различались между женщинами в раннем постменопаузе, получавшими ЗГТ в течение 2 лет, и теми, кто никогда не получал ЗГТ.Эти результаты предполагают, что морфологические и функциональные характеристики, изученные в этом исследовании, нечувствительны к ЗГТ в первые годы менопаузы.
Рисунок 1.
Примеры методологии испытания на провисание ( A ) и испытания силы-скорости ( B ). A , На вставке показан рекорд силы, полученный во время одного шага провисания. Обратите внимание, что ступенька провисания привела к падению силы до базовой линии. Волокно укорачивалось без нагрузки до тех пор, пока не произошло быстрое восстановление силы (горизонтальная калибровочная полоса, 100 мс; вертикальная калибровочная полоса, 0.20 мН). На главной панели продолжительность укорочения без нагрузки нанесена на график в зависимости от расстояния шага провисания для этого сокращения (○) вместе с четырьмя другими шагами провисания (•). График соответствовал линии регрессии наименьших квадратов ( R 2 = 0,998). Наклон отношения, нормированный на FL, определяет В o (0,65 FL / с). Позже гель-электрофорез показал, что волокно в этом примере содержало изоформу MHC типа I. B , Вставка иллюстрирует одну серию из трех изотонических сокращений.После того, как волокно достигло пикового усилия, серводвигатель подвергало волокну трем периодам изотонического укорачивания, после чего выполнялся шаг провисания для обнуления датчика силы. Запись положения показывает соответствующие изменения положения двигателя. Сила и скорость укорачивания (наклон записи положения) измерялись во второй половине каждого шага (горизонтальные калибровочные полосы, 100 мс; вертикальные калибровочные полосы, 100 мкм и 0,20 мН). На главной панели данные этого цикла сокращения (○) и двух других циклов (•) были нанесены на график и соответствуют ( R 2 =.998) уравнением Хилла (44). Параметры, описывающие эту конкретную взаимосвязь: V max = 2,22 FL / с, a / P o = 0,033 и P o = 0,68 мН (157 кН / м 2 ). Зависимость силы от мощности, показанная на рисунке, была рассчитана на основе этих параметров (45). Гель-электрофорез показал, что это волокно содержало изоформу MHC типа IIa. FL = длина волокна; MHC = тяжелая цепь миозина
Рисунок 1.
Примеры методологии испытания на провисание ( A ) и испытания силы-скорости ( B ). A , На вставке показан рекорд силы, полученный во время одного шага провисания. Обратите внимание, что ступенька провисания привела к падению силы до базовой линии. Волокно укорачивалось без нагрузки до тех пор, пока не произошло быстрое восстановление силы (горизонтальная калибровочная полоса, 100 мс; вертикальная калибровочная полоса, 0,20 мН). На главной панели продолжительность укорочения без нагрузки нанесена на график в зависимости от расстояния шага провисания для этого сокращения (○) вместе с четырьмя другими шагами провисания (•).График соответствовал линии регрессии наименьших квадратов ( R 2 = 0,998). Наклон отношения, нормированный на FL, определяет В o (0,65 FL / с). Позже гель-электрофорез показал, что волокно в этом примере содержало изоформу MHC типа I. B , Вставка иллюстрирует одну серию из трех изотонических сокращений. После того, как волокно достигло пикового усилия, серводвигатель подвергало волокну трем периодам изотонического укорачивания, после чего выполнялся шаг провисания для обнуления датчика силы.Запись положения показывает соответствующие изменения положения двигателя. Сила и скорость укорачивания (наклон записи положения) измерялись во второй половине каждого шага (горизонтальные калибровочные полосы, 100 мс; вертикальные калибровочные полосы, 100 мкм и 0,20 мН). На главной панели данные этого цикла сокращения (○) и двух других циклов (•) были нанесены на график и соответствуют ( R 2 = 0,998) уравнением Хилла (44). Параметры, описывающие эту конкретную взаимосвязь: V max = 2.22 FL / s, a / P o = 0,033 и P o = 0,68 мН (157 кН / м 2 ). Зависимость силы от мощности, показанная на рисунке, была рассчитана на основе этих параметров (45). Гель-электрофорез показал, что это волокно содержало изоформу MHC типа IIa. FL = длина волокна; MHC = тяжелая цепь миозина
Рисунок 2.
Примеры гистохимии ферментов и гель-электрофореза. A , Фотография среза мышцы, окрашенного на миофибриллярную аденозинтрифосфатазу при pH 10.0. Волокна типа I светлые; волокна типа II темные. B , Часть полиакриламидного геля, используемая для определения содержания изоформы тяжелой цепи миозина волокна. Дорожка А была загружена стандартом миозина человека. Обратите внимание на разделение трех изоформ тяжелой цепи миозина, присутствующих в скелетных мышцах человека. Сегменты волокна из трех отдельных экспериментов были проанализированы на дорожках B, C и D.
Рисунок 2.
Примеры гистохимии ферментов и гель-электрофореза. A , Фотография среза мышцы, окрашенного на миофибриллярную аденозинтрифосфатазу при pH 10.0. Волокна типа I светлые; волокна типа II темные. B , Часть полиакриламидного геля, используемая для определения содержания изоформы тяжелой цепи миозина волокна. Дорожка А была загружена стандартом миозина человека. Обратите внимание на разделение трех изоформ тяжелой цепи миозина, присутствующих в скелетных мышцах человека. Сегменты волокна из трех отдельных экспериментов были проведены на дорожках B, C и D
. Таблица 1. Гистохимический анализобразцов мышечной биопсии из групп ЗГТ и без ЗГТ
| . | Тип волокна (%) . | Площадь волокна (мкм 2 ) . | Площадь волокна (% общей площади) . | |||
|---|---|---|---|---|---|---|
| Группа . | Тип I . | Тип II . | Тип I . | Тип II . | Тип I . | Тип II . |
| Без HRT | 38 ± 3 | 62 ± 3 | 3560 ± 222 | 2648 ± 174 | 45 ± 3 | 55 ± 3 |
| HRT | 62 ± 3 | 3603 ± 396 | 2850 ± 309 | 43 ± 3 | 57 ± 3 | |
| Среднее | 38 ± 2 | 62 ± 2 * | 3577 ± 198 | 2729 * | 44 ± 2 | 56 ± 2 * |
| . | Тип волокна (%) . | Площадь волокна (мкм 2 ) . | Площадь волокна (% общей площади) . | |||
|---|---|---|---|---|---|---|
| Группа . | Тип I . | Тип II . | Тип I . | Тип II . | Тип I . | Тип II . |
| Без HRT | 38 ± 3 | 62 ± 3 | 3560 ± 222 | 2648 ± 174 | 45 ± 3 | 55 ± 3 |
| HRT | 62 ± 3 | 3603 ± 396 | 2850 ± 309 | 43 ± 3 | 57 ± 3 | |
| Среднее | 38 ± 2 | 62 ± 2 * | 3577 ± 198 | 2729 * | 44 ± 2 | 56 ± 2 * |
Гистохимический анализ образцов мышечной биопсии из групп ЗГТ и без ЗГТ
| . | Тип волокна (%) . | Площадь волокна (мкм 2 ) . | Площадь волокна (% общей площади) . | |||
|---|---|---|---|---|---|---|
| Группа . | Тип I . | Тип II . | Тип I . | Тип II . | Тип I . | Тип II . |
| Без HRT | 38 ± 3 | 62 ± 3 | 3560 ± 222 | 2648 ± 174 | 45 ± 3 | 55 ± 3 |
| HRT | 62 ± 3 | 3603 ± 396 | 2850 ± 309 | 43 ± 3 | 57 ± 3 | |
| Среднее | 38 ± 2 | 62 ± 2 * | 3577 ± 198 | 2729 * | 44 ± 2 | 56 ± 2 * |
| . | Тип волокна (%) . | Площадь волокна (мкм 2 ) . | Площадь волокна (% общей площади) . | |||
|---|---|---|---|---|---|---|
| Группа . | Тип I . | Тип II . | Тип I . | Тип II . | Тип I . | Тип II . |
| Без HRT | 38 ± 3 | 62 ± 3 | 3560 ± 222 | 2648 ± 174 | 45 ± 3 | 55 ± 3 |
| HRT | 62 ± 3 | 3603 ± 396 | 2850 ± 309 | 43 ± 3 | 57 ± 3 | |
| Среднее | 38 ± 2 | 62 ± 2 * | 3577 ± 198 | 2729 * | 44 ± 2 | 56 ± 2 * |
Содержание изоформы MHC в мышечных волокнах Vastus Lateralis из групп ЗГТ и без ЗГТ
| . | Изоформа MHC . | ||||||
|---|---|---|---|---|---|---|---|
| Группа . | я . | I / IIa . | IIa . | IIa / IIx . | IIx . | I / IIx . | I / IIa / IIx . |
| Без HRT | 46 ± 4 | 4 ± 2 | 35 ± 4 | 8 ± 2 | 6 ± 2 | <1 | 1 ± 1 |
| 5 ± 2 | 35 ± 4 | 9 ± 3 | 3 ± 1 | <0 | 2 ± 1 |
| . | Изоформа MHC . | ||||||
|---|---|---|---|---|---|---|---|
| Группа . | я . | I / IIa . | IIa . | IIa / IIx . | IIx . | I / IIx . | I / IIa / IIx . |
| Без HRT | 46 ± 4 | 4 ± 2 | 35 ± 4 | 8 ± 2 | 6 ± 2 | <1 | 1 ± 1 |
| 5 ± 2 | 35 ± 4 | 9 ± 3 | 3 ± 1 | <0 | 2 ± 1 |
Содержание изоформы MHC в мышечных волокнах Vastus Lateralis из групп ЗГТ и без ЗГТ
| . | Изоформа MHC . | ||||||
|---|---|---|---|---|---|---|---|
| Группа . | я . | I / IIa . | IIa . | IIa / IIx . | IIx . | I / IIx . | I / IIa / IIx . |
| Без HRT | 46 ± 4 | 4 ± 2 | 35 ± 4 | 8 ± 2 | 6 ± 2 | <1 | 1 ± 1 |
| 5 ± 2 | 35 ± 4 | 9 ± 3 | 3 ± 1 | <0 | 2 ± 1 |
| . | Изоформа MHC . | ||||||
|---|---|---|---|---|---|---|---|
| Группа . | я . | I / IIa . | IIa . | IIa / IIx . | IIx . | I / IIx . | I / IIa / IIx . |
| Без HRT | 46 ± 4 | 4 ± 2 | 35 ± 4 | 8 ± 2 | 6 ± 2 | <1 | 1 ± 1 |
| 5 ± 2 | 35 ± 4 | 9 ± 3 | 3 ± 1 | <0 | 2 ± 1 |
CSA и пик Ca 2+ -Активированная сила сегментов волокна с кожурой из групп HRT и без HRT
| . | Изоформа MHC . | |
|---|---|---|
| Переменная / группа . | я . | IIa . |
| CSA (мкм 2 ) | ||
| Без HRT | 5297 ± 193 (64) | 4150 ± 231 (41) |
| HRT | 226500) | 4187 ± 232 (36) |
| Среднее значение | 5153 ± 148 | 4167 ± 163 * |
| Пиковое усилие (мН) | ||
| Без HRT | 0.61 ± 0,02 | 0,59 ± 0,03 |
| HRT | 0,57 ± 0,02 | 0,61 ± 0,03 |
| Среднее значение | 0,59 ± 0,02 | 0,60 ± 0,02 |
| Без HRT | 117 ± 2 | 147 ± 4 |
| HRT | 116 ± 2 | 149 ± 3 |
| Среднее | 116 ± 2 |
| . | Изоформа MHC . | |
|---|---|---|
| Переменная / группа . | я . | IIa . |
| CSA (мкм 2 ) | ||
| Без HRT | 5297 ± 193 (64) | 4150 ± 231 (41) |
| HRT | 226500) | 4187 ± 232 (36) |
| Среднее значение | 5153 ± 148 | 4167 ± 163 * |
| Пиковое усилие (мН) | ||
| Без HRT | 0.61 ± 0,02 | 0,59 ± 0,03 |
| HRT | 0,57 ± 0,02 | 0,61 ± 0,03 |
| Среднее значение | 0,59 ± 0,02 | 0,60 ± 0,02 |
| Без HRT | 117 ± 2 | 147 ± 4 |
| HRT | 116 ± 2 | 149 ± 3 |
| Среднее | 116 ± 2 |
CSA и пик Ca 2+ -Активированная сила сегментов волокна с кожурой из групп HRT и без HRT
| . | Изоформа MHC . | |
|---|---|---|
| Переменная / группа . | я . | IIa . |
| CSA (мкм 2 ) | ||
| Без HRT | 5297 ± 193 (64) | 4150 ± 231 (41) |
| HRT | 226500) | 4187 ± 232 (36) |
| Среднее значение | 5153 ± 148 | 4167 ± 163 * |
| Пиковое усилие (мН) | ||
| Без HRT | 0.61 ± 0,02 | 0,59 ± 0,03 |
| HRT | 0,57 ± 0,02 | 0,61 ± 0,03 |
| Среднее значение | 0,59 ± 0,02 | 0,60 ± 0,02 |
| Без HRT | 117 ± 2 | 147 ± 4 |
| HRT | 116 ± 2 | 149 ± 3 |
| Среднее | 116 ± 2 |
| . | Изоформа MHC . | |
|---|---|---|
| Переменная / группа . | я . | IIa . |
| CSA (мкм 2 ) | ||
| Без HRT | 5297 ± 193 (64) | 4150 ± 231 (41) |
| HRT | 226500) | 4187 ± 232 (36) |
| Среднее значение | 5153 ± 148 | 4167 ± 163 * |
| Пиковое усилие (мН) | ||
| Без HRT | 0.61 ± 0,02 | 0,59 ± 0,03 |
| HRT | 0,57 ± 0,02 | 0,61 ± 0,03 |
| Среднее значение | 0,59 ± 0,02 | 0,60 ± 0,02 |
| Без ЗГТ | 117 ± 2 | 147 ± 4 |
| ЗГТ | 116 ± 2 | 149 ± 3 |
| Среднее | 116 ± 2 |
Скорость укорачивания разгруженных сегментов волокна с кожурой из групп HRT и без HRT
| . | Изоформа MHC . | |
|---|---|---|
| Группа . | я . | IIa . |
| Без HRT | 0,61 ± 0,02 (54) | 2,80 ± 0,12 (39) |
| HRT | 0,58 ± 0,01 (53) | 2.67 ± 0,14 (29) |
| Среднее | 0,59 ± 0,01 | 2,75 ± 0,09 * |
| . | Изоформа MHC . | |
|---|---|---|
| Группа . | я . | IIa . |
| Без HRT | 0,61 ± 0,02 (54) | 2,80 ± 0,12 (39) |
| HRT | 0.58 ± 0,01 (53) | 2,67 ± 0,14 (29) |
| Среднее значение | 0,59 ± 0,01 | 2,75 ± 0,09 * |
Скорость укорачивания сегментов волокна с оболочкой из HRT и без Группы HRT
| . | Изоформа MHC . | |
|---|---|---|
| Группа . | я . | IIa . |
| Без HRT | 0.61 ± 0,02 (54) | 2,80 ± 0,12 (39) |
| HRT | 0,58 ± 0,01 (53) | 2,67 ± 0,14 (29) |
| Среднее | 0,59 ± 0,01 | 2,75 ± 2,75 ± 0,01 * |
| . | Изоформа MHC . | |
|---|---|---|
| Группа . | я . | IIa . |
| Без HRT | 0.61 ± 0,02 (54) | 2,80 ± 0,12 (39) |
| HRT | 0,58 ± 0,01 (53) | 2,67 ± 0,14 (29) |
| Среднее | 0,59 ± 0,01 | 2,75 ± 2,75 ± 0,01 * |
сегментов волокна с кожурой из групп HRT и без HRT
| . | MHC . | ||
|---|---|---|---|
| Группа . | я . | IIa . | |
| Микроньютон на FL в секунду | |||
| Без HRT | 7,73 ± 0,42 (48) | 33,3 ± 1,5 (35) | |
| HRT | 7,42 905 | 7,42 ± 0,43 (905) ± 1,8 (28) | |
| Среднее значение | 7,58 ± 0,30 | 33,4 ± 1,2 * | |
| Вт / литр | |||
| Без HRT | 1.50 ± 0,05 | 8,21 ± 0,36 | |
| HRT | 1,52 ± 0,05 | 8,60 ± 0,31 | |
| Среднее значение | 1,51 ± 0,03 | 8,38 ± 0,24 * | . | MHC . |
| Группа . | я . | IIa . | |
| Микроньютон на FL в секунду | |||
| Без HRT | 7.73 ± 0,42 (48) | 33,3 ± 1,5 (35) | |
| HRT | 7,42 ± 0,43 (43) | 33,5 ± 1,8 (28) | |
| Среднее значение | 7,58 ± 0,30 | 33,4 ± 1,2 * | |
| Вт / литр | |||
| Без HRT | 1,50 ± 0,05 | 8,21 ± 0,36 | |
| HRT | 1,52 ± 0,05 | 8,60 ± 0,31 | 905 Среднее значение 1,58.38 ± 0,24 * |
Пиковая мощность сегментов волокна с кожурой из групп HRT и без HRT
| . | MHC . | |
|---|---|---|
| Группа . | я . | IIa . |
| Микроньютон на FL в секунду | ||
| Без HRT | 7,73 ± 0,42 (48) | 33,3 ± 1,5 (35) |
| HRT | 7.42 ± 0,43 (43) | 33,5 ± 1,8 (28) |
| Среднее значение | 7,58 ± 0,30 | 33,4 ± 1,2 * |
| Ватт / литр | ||
| Без HRT | 0,0566 1,50 ±8,21 ± 0,36 | |
| HRT | 1,52 ± 0,05 | 8,60 ± 0,31 |
| Среднее значение | 1,51 ± 0,03 | 8,38 ± 0,24 * |
Это исследование было поддержано грантами Фонда здоровья и деятельности человека Эрккила (Г. Маддалоццо) и Американской федерации исследований старения (Г.Маддалоццо). Частичная поддержка была получена в рамках гранта R3AR46392 от Национальных институтов здравоохранения (Дж. Видрик).
Авторы благодарны Эрике Луи-Кван и Сьюзан Матасса за помощь в этом проекте.
Адресная корреспонденция Джеффри Дж. Видрику, Департамент физических упражнений и спортивной науки, Государственный университет Орегона, Корваллис, штат Орегон, 97331. Электронная почта: [email protected]
Ссылки
1Ларссон Л., Гримби Г., Карлссон Дж.Сила мышц и скорость движения в зависимости от возраста и морфологии мышц.
J Appl Physiol
.1979
;46
:451
-456,2Вандервурт А.А., МакКомас А.Дж. Сократительные изменения противоположных мышц голеностопного сустава человека с возрастом.
J Appl Physiol
.1986
;61
:361
-367,3Хьюз М., Майерс Б., Шенкман М. Роль силы в подъеме со стула у функционально слабых пожилых людей.
Дж Биомех
.1996
;29
:1509
-1513,4Тинетти М.Э., Speechly M. Профилактика падений среди пожилых людей.
N Engl J Med
.1989
;320
:1055
-1059,5Клитгаард Х., Мантони М., Скьяффино С. и др. Функция, морфология и экспрессия белка стареющих скелетных мышц: перекрестное исследование пожилых мужчин с разным уровнем подготовки.
Acta Physiol Scand
.1990
;140
:41
-54.6Brooks SV, Faulkner JA. Сократительные свойства скелетных мышц молодых, взрослых и старых мышей.
J Physiol (Лондон)
.1988
;404
:71
-82,7Томпсон Л.В., Браун М. Возрастные изменения сократительных свойств одиночных скелетных волокон камбаловидной мышцы.
J Appl Physiol
.1999
;86
:881
-886,8Delbono O, O’Rourke KS, Ettinger WH. Расцепление высвобождения кальция и возбуждения в отдельных волокнах скелетных мышц пожилого человека.
J Мембрана Biol
.1995
;148
:211
-222,9Larsson L, Li X, Frontera WR. Влияние старения на скорость укорочения и состав изоформ миозина в отдельных клетках скелетных мышц человека.
Am J Physiol Cell Physiol
.1997
;272
:C638
-C649.10Frontera WR, Suh D, Krivickas LS, Hughes VA, Goldstein R, Roubenoff R. Качество волокон скелетных мышц у пожилых мужчин и женщин.
Am J Physiol Cell Physiol
.2000
;279
:C611
-C618.11Филипс СК, Ладья К.М., Сиддл, Северная Каролина, Брюс С.А., Волледж Р.К. Слабость мышц у женщин возникает в более раннем возрасте, чем у мужчин, но сила сохраняется за счет заместительной гормональной терапии.
Clin Sci
.1993
;84
:95
-98,12Петровский Ю.С., Бурс Р.Л., Линд А.Р. Сравнение физиологических реакций женщин и мужчин на изометрические упражнения.
J Appl Physiol
.1975
;38
:863
-868.13Greeves JP, Cable NT, Reilly T., Kingsland C. Изменения мышечной силы у женщин после менопаузы: продольная оценка эффективности заместительной гормональной терапии.
Clin Sci
.1999
;97
:79
-84,14Скелтон Д.А., Филипс СК, Брюс С.А., Нейлор С.Х., Волледж Р.К. Заместительная гормональная терапия увеличивает изометрическую силу мышц аддуктора большого пальца у женщин в постменопаузе.
Clin Sci
.1999
;96
:357
-364.15Sipilä S, Taaffe DR, Cheng S, Puolakka J, Toivanen J, Suominen H. Влияние заместительной гормональной терапии и высокоэффективных физических упражнений на скелетные мышцы у женщин в постменопаузе: рандомизированное плацебо-контролируемое исследование.
Clin Sci
.2001
;101
:147
-157,16Армстронг А.Л., Оборн Дж., Коупленд САС, Макферсон МБ, Басси Е.Дж., Уоллес ВА. Влияние заместительной гормональной терапии на работу мышц и баланс у женщин в постменопаузе.
Clin Sci
.1996
;91
:685
-690.17Kohrt WM, Snead DB, Slatopolsky E, Birge SJ Jr. Аддитивные эффекты силовых упражнений и эстрогена на минеральную плотность костей у пожилых женщин.
J Bone Miner Res
.1995
;10
:1303
-1311.18Gandevia SC. Спинальные и супраспинальные факторы при утомлении мышц человека.
Physiol Ред.
.2001
;81
:1725
-1789.19Филипс С.К., Брюс С.А., Ньютон Д., Уолдж Р.К. Слабость в старости не из-за сбоя мышечной активации.
J Gerontol Med Sci
.1992
;47
:M45
-M49.20Round JM, Jones DA, Chapman SJ, Edwards RHT, Ward PS, Fodden DL. Анатомия и тип волокон аддукторного поллициса человека в зависимости от его свойств контратильности.
J Neurol Sci
.1984
;66
:263
-292.21Джонсон М.А., Полгар Дж., Уэйтман Д., Эпплтон Д.Данные о распределении типов волокон в тридцати шести мышцах человека. Исследование вскрытия.
J Neurol Sci
.1973
;18
:111
-129,22Вицкевич Т.Л., Рой Р.Р., Пауэлл П.Л., Эдгертон В.Р. Мышечная архитектура нижней конечности человека.
Clin Orthop Relat Res
.1983
;179
:275
-283,23Maddalozzo GF, Snow CM. Тренировка с отягощениями высокой интенсивности: влияние на кости у мужчин и женщин старшего возраста.
Calcif Tissue Int
.2000
;66
:399
-404,24Коль Х.В., Блэр С.Н., Паффенбаргер Р.С. мл., Мачера, Калифорния, Кроненфельд Дж. Дж. Опрос по электронной почте о привычках физической активности, связанных с измеренной физической подготовкой.
Am J Epidemiol
.1988
;127
:1228
-1239,25Фабиато А. Компьютерные программы для расчета общего количества из указанных свободных или свободных от указанных общих концентраций ионов в водных растворах, содержащих несколько металлов и лигандов.В: Fleischer S, Fleischer B, eds. Методы в энзимологии. Vol. 157. Нью-Йорк: Academic Press; 1988: 378–417.
26Фабиато А. Зависимость от времени и кальция активации и инактивации вызванного кальцием высвобождения кальция из саркоплазматического ретикулума сердечных клеток Пуркинье собак, очищенных от кожи.
J Gen Physiol
.1985
;85
:247
-289,27Видрик Дж. Дж., Стельцер Дж. Э., Шуп ТС, Гарнер Д. П.. Функциональные свойства мышечных волокон человека после краткосрочных тренировок с отягощениями.
Am J Physiol Reg Integr Comp Physiol
.2002
;283
:R408
-R416.28Metzger JM, Moss RL. Скорость укорачивания в одиночных мышечных волокнах, покрытых кожей. Влияние шага решетки филаментов.
Biophys J
.1987
;52
:127
-131.29Эннион С., Сант’Ана Перейра Дж., Сарджант А.Дж., Янг А., Голдспинк Г. Характеристика волокон скелетных мышц человека в соответствии с экспрессируемыми ими тяжелыми цепями миозина.
J Muscle Res Cell Motil
.1995
;16
:35
-43,30Fry AC, Allemeier CA, Staron RS. Корреляция между процентом площади типа волокна и содержанием тяжелой цепи миозина в скелетных мышцах человека.
Eur J Appl Physiol
.1994
;68
:246
-251,31Старон Р.С., Малики Е.С., Леонарди М.Дж., Фалькель Д.Е., Хагерман ФК, Дадли Г.А. Гипертрофия мышц и быстрое преобразование типов волокон у женщин, тренирующихся с отягощениями.
Eur J Appl Physiol
.1989
;60
:71
-79,32Видрик Дж.Дж., Траппе ЮЗ, Блазер Калифорния, Костилл Д.Л., Фиттс РХ. Изометрическая сила и максимальная скорость укорачивания отдельных мышечных волокон у опытных бегунов.
Am J Physiol Cell Physiol
.1996
;271
:C666
-C675.33Боттинелли Р., Канепари М., Пеллегрино М.А., Реджиани С. Силовые свойства волокон скелетных мышц человека: изоформа тяжелой цепи миозина и температурная зависимость.
J Physiol (Лондон)
.1996
;495
:573
-586,34Видрик Дж. Дж., Траппе SW, Costill DL, Фиттс RH. Силово-скоростные и сило-силовые свойства отдельных мышечных волокон у элитных бегунов и мужчин, ведущих сидячий образ жизни.
Am J Physiol Cell Physiol
.1996
;271
:C676
-C683.35Krivickas LS, Suh D, Wilkins J, Hughes VA, Roubenoff R, Frontera WR. Возрастные и гендерные различия в максимальной скорости укорочения волокон скелетных мышц.
Am J Phys Med Rehabil
.2001
;80
:447
-455,36Wattanapermpool J, Reiser PJ. Дифференциальные эффекты овариэктомии на кальциевую активацию миофиламентов сердца и камбаловидной мышцы.
Am J Physiol Heart Circ
.1999
;56
:h567
-h573,37Harridge SDR, Bottinelli R, Canepari M, et al. Спринтерская тренировка, функция мышц in vitro и in vivo, а также экспрессия тяжелых цепей миозина.
J Appl Physiol
.1998
;84
:442
-449,38Видрик Дж. Дж., Кнут С. К., Норенберг К. М. и др. Влияние 17-дневного космического полета на сократительные свойства волокон камбаловидной мышцы человека.
J Physiol (Лондон)
.1999
;516
:915
-930,39Widrick JJ, Romatowski JG, Bain JLW, et al. Влияние 17-дневного постельного режима на пиковую изометрическую силу и скорость укорочения без нагрузки волокон камбаловидной мышцы человека.
Am J Physiol Cell Physiol
.1997
;273
:C1690
-C1699.40Наричи М.В., Кайзер Б., Бараттини П., Черретелли П. Изменения электрически вызванных сокращений скелетных мышц во время 17-дневного космического полета и постельного режима.
Int J Sports Med
.1997
;18
:S290
-S292.41Коэн Дж. Статистический анализ мощности для поведенческих наук. . Хиллсдейл, Нью-Джерси: Лоуренс Эрлбаум Ассошиэйтс; 1988.
42Фишер Дж. С., Хассер Э. М., Браун М.Влияние овариэктомии и разгрузки задних конечностей на скелетные мышцы.
J Appl Physiol
.1998
;85
:1316
-1321,43Godt RE, Maughan DW. Влияние осмотического сжатия на активацию кальция и напряжение в кожных мышечных волокнах кролика.
Арка Пфлюгерса
.1981
;391
:334
-337,44Hill AV. Теплота укорочения и динамические константы мышц.
Proc R Soc London Ser B
.1938
;126
:136
-195.45Woledge RC, Curtin NA, Homsher E. Энергетические аспекты сокращения мышц. . Лондон: Academic Press; 1985.
Американское геронтологическое общество
Pdf Натяжение
Натяжение ремня отображается в цифровом виде. В новой системе используются специальные датчики для определения формы волны колебаний ремня. Данные от этих датчиков отправляются на микрокомпьютер внутри звукового измерителя натяжения для обработки и преобразования в собственную частоту.Тестер натяжения компании Gates удобен в использовании: он компактен, компьютеризирован и
югославско-болгарского напряжения в регионе Югославия-Македония Ключевые слова Санитарно-правовая копия утверждена для выпуска 23.05.2011: CIA-RDP82-00457R0020004
-4 ОФИДЕНЦИАЛЬНЫЙ КЛАССИФИКАТОР 5 / CO ‘-ROB.
Волны на воде подвержены влиянию двух факторов: силы тяжести и поверхностного натяжения. На расстоянии вы не видите поверхностное натяжение. В малых масштабах поверхностным натяжением нельзя пренебречь (при usS> 0), и оно помогает «упорядочить» раствор.
15 августа 2020 г. · Поверхностное натяжение — это энергия или работа, необходимая для увеличения площади поверхности жидкости за счет межмолекулярных сил. Поскольку эти межмолекулярные силы меняются в зависимости от природы жидкости (например, вода по сравнению с бензином) или растворенных веществ в жидкости (например, поверхностно-активных веществ, таких как моющее средство), каждый раствор проявляет разные свойства поверхностного натяжения.
PastTense, запатентованная смесь doTERRA для снятия напряжения и дискомфорта, связанного с головными болями, обеспечивает успокаивающий комфорт благодаря силе эфирных масел CPTG грушанки, лаванды, мяты перечной, ладана, кинзы, майорана, римской ромашки, базилика и розмарина.Упакован в шариковый флакон для удобного нанесения.
напряженное поле действия полотна панели между ними. Если концевая панель рядом с опорой спроектирована без использования действия поля растяжения, принимается меньшее расстояние a / d = 0,6–1,0. Иногда используются двойные ребра жесткости рядом с опорой (см. Рис. 3), и в таких случаях выступы за пределы опор ограничиваются 1/8 глубины …
Упражнения при дисфонии напряжения мышц pdf обеспечивает исчерпывающий и всеобъемлющий путь чтобы студенты могли видеть прогресс после окончания каждого модуля.С командой чрезвычайно преданных своему делу и квалифицированных преподавателей, PDF-файл «Упражнения при дисфонии мышечного напряжения» станет местом не только для обмена знаниями, но и для того, чтобы помочь студентам воодушевиться на изучение и …
одноосное натяжение. ВНИМАНИЕ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! Прочность материала часто является первоочередной задачей. Представляющая интерес прочность может быть измерена либо с точки зрения напряжения, необходимого для того, чтобы вызвать заметную пластическую деформацию, либо с точки зрения максимального напряжения, которое может выдержать материал. Эти меры прочности используются с соответствующей осторожностью (в
Бамбуковая салфетка
На данный момент бамбуковая туалетная бумага по-прежнему является новым продуктом на международном рынке, но через 2-3 года она станет тенденцией развития, 100% девственница. бамбуковая экологически чистая туалетная бумага, туалетная бумага, туалетная бумага, 2 слоя, 4 рулона /
Попробовать бамбуковую туалетную бумагу на катушке Сейчас: $ 29.99 для катушки с 24 рулонами. Каждый рулон бамбуковой туалетной бумаги премиум-класса Reel изготовлен на 100% из бамбука в упаковке без пластика. В каждой коробке …
14 авг.2019 г. · Массаж глубоких тканей может быть на все тело или сосредоточен только на одной области. Вы начнете лежать на спине или животе под простыней. Вам решать, насколько вы раздеты.
Ежедневно вырубается более 27 000 деревьев, чтобы сделать туалетную бумагу. Это вредно для окружающей среды и просто неприемлемо.Бамбук — лучшая альтернатива. Он растет быстрее, потребляет меньше воды и производит больше кислорода. Она может быть такой же мягкой или более мягкой, чем туалетная бумага, сделанная из деревьев. Попробуйте туалетную бумагу Reel® Bamboo прямо сейчас!
2 января 2019 г. · Тканевая бумага, изготовленная из бамбука, имеет очень многообещающее будущее в мире, особенно в Китае, благодаря различным достоинствам бамбуковых волокон. Однако необходимо улучшить характеристики водопоглощения и механические свойства салфетки на основе бамбуковой целлюлозы из-за присущих бамбуковому волокну недостатков, таких как высокая жесткость, слабое взаимодействие между бамбуковыми волокнами и т. Д.
Green Pack продает экологически чистую упаковку по всей Австралии. Экологически чистая упаковка, такая как бамбуковые столовые приборы и бамбуковые тарелки, деревянные эко-тарелки для столовых приборов, компостируемые кофейные чашки, бумажные соломинки оптом, тарелки из пальмовых листьев, бамбуковые одноразовые тарелки, австралия, бамбуковая упаковка, компостируемые тарелки, чашки для мороженого и экологически чистые тарелки & # 13; & # 10;
Fabio Perini расширила ассортимент своей продукции, внедрив запатентованную технологию, которая позволяет производить до 10 000 биоразлагаемых бамбуковых масок в минуту.Технология была разработана чуть более чем за месяц во время блокировки и доступна для конвертерных линий Fabio Perini. Он способен производить до 10 000 масок в минуту, […]
Эти салфетки для ванн имеют гипоаллергенный формат и не содержат искусственных ароматизаторов для легкого прикосновения. Удобная упаковка с шестью счетами обеспечит достаточный запас для вашей семьи. Эта бамбуковая салфетка для ванн Naturezway имеет двухслойную конструкцию для дополнительной прочности и мягкую на ощупь мягкость для дополнительного комфорта.
Более 2000 чехлов для коробок из бамбука по приятным ценам до 30 USD Быстрая и бесплатная доставка по всему миру! Частые специальные предложения и скидки до 70% на все товары!
Camaro zl1 спойлер
Cisco ap3g2 k9w7 tar.загрузка по умолчанию
Victimspercent27 билль о правах arizona
Отверстия для спойлера будут соответствовать ТОЛЬКО моделям 1LE — для других моделей может потребоваться сверление. НЕ подходит для моделей Chevrolet Camaro ZL1. Подходит ко ВСЕМ Chevrolet CamaroSS с 2016 г. Модели Chevrolet Camaro LT / LS / RS с 2019 г. Camaro ZL1 низкополигональный. 72 Просмотры 0 Комментарий. 1 Нравится Не нравится. Спасибо! Также поделитесь? Chevrolet Camaro ZL1. 861 Просмотры 1 Комментарий.
Sap tcode fb05
Chevrolet Camaro изо всех сил старался опередить остальных с четвертым поколением, но его успех был ограничен.Затем наступил мировой финансовый кризис, лишивший его шансов на возрождение. Внутри передние ковшеобразные сиденья украшены вышитыми значками ZL1 на подголовниках и замшевыми вставками из микрофибры. Camaro ZL1 — это полноценный высокопроизводительный автомобиль, а не просто Camaro с большей мощностью. … В задней части автомобиля есть диффузор и спойлер, а также функциональные элементы, улучшающие аэродинамику автомобиля.
Громко извлекает тележки
Как следует из названия, спойлер препятствует неблагоприятному движению воздуха по телу вашего классического Camaro.С этим дополнительным модулем премиум-класса вы эффективно уменьшите сопротивление и повысите устойчивость вашего автомобиля на высоких скоростях. Этот цельный спойлер крепится традиционным ксеноновым способом с помощью двусторонней ленты 3M.
Modfreakz github
Camaro ZL1 поступит в продажу в конце этого года. Функциональность определяет форму Camaro ZL1: внешний вид формировался в течение более 100 часов. Дополнительные изменения включают увеличенный передний сплиттер, уникальные рокеры, задний спойлер в виде крыльев и более широкие передние крылья — все настроено для улучшения аэродинамики…
Инструмент для сбоя сервера Minecraft
Включает полосы для крыши, багажника и спойлера со всеми краями, предварительно обрезанными и помеченными для упрощения установки. Полоски доступны для ZL-1 Camaros 2012-13 и 2014-15 годов. Полоса на крыше предварительно вырезана для антенны XM. Они предназначены только для перечисленных автомобилей, они не подходят для моделей других годов выпуска или автомобилей со спойлерами для вторичного рынка.
Eecs 388 syllabus umich
Chevrolet Camaro изо всех сил старался опередить остальных с четвертым поколением, но его успех был ограничен.Затем наступил мировой финансовый кризис, лишивший его шансов на возрождение. Внутри передние ковшеобразные сиденья украшены вышитыми значками ZL1 на подголовниках и замшевыми вставками из микрофибры.
Горячие клавиши для Discord mac
2 декабря 2020 г. · И если крыло ZL1 не для вас, Chevrolet предлагает 21 полный вариант заднего спойлера для Camaro SS 2021 года, от тонких губных спойлеров до приподнятых крыльев, больших, чем у ZL1. спойлер мы сегодня выделяем. В целом, если вам нужно крыло для вашего Chevrolet Camaro SS, почти наверняка оно для вас найдется.Воспроизводя функцию спойлера GM ZL1 1LE, наши дизайнеры IROC решили найти способы сделать его еще лучше, и они это сделали. Этот спойлер прошел испытания на скорости более 190 миль в час без проблем со стабильностью в крыльях или стойках. Этот спойлер сделает вашу машину устойчивой на дороге.
Нормальная сила равна
Подходит для Chevrolet Camaro 6 SS ZL1. Высококачественный материал из углеродного волокна 3k с глянцевой поверхностью крыла + опоры / стойки из FRP, которые, возможно, потребуются… Заднее крыло Camaro ZL1 1LE. Сразу после сборки Zl1 1LE находится фирменное заднее крыло. Спойлер Zl1-1LE, изготовленный из углепластика с прозрачным покрытием и ультраглянцевым покрытием, является заменой спойлера для любой задней палубы Gen 6 SS и Zl1.
Нет модуля с именем pandas windows
Отверстия для спойлера будут совпадать ТОЛЬКО с моделями 1LE — для других моделей может потребоваться сверление. НЕ подходит для моделей Chevrolet Camaro ZL1. Подходит ко ВСЕМ Chevrolet CamaroSS с 2016 г. Модели Chevrolet Camaro LT / LS / RS с 2019 г.
Ударь своего соседа Webly
Wrenched Out Garage Мы проводим полную установку и обзор глянцевого черного спойлера C7CARBON ZL1 1LE для нашего Camaro 6-го поколения. Спойлер, вдохновленный C7Carbon ZL1 1LE … Chevy обновляет ориентированный на трек Camaro ZL1 1LE с небольшими внешними изменениями и обновленным техническим пакетом. В то время как задний спойлер может быть стандартной платой за проезд для спортивных автомобилей, ориентированных на трек, немногие автомобили в классе Camaro имеют такой же уровень ответственности, подчеркнутый воздушными дефлекторами и пикированием…
Файлы Nkit для ISO
Auto Addict USA 2016-2018 Chevy Camaro ZL1 1LE Переделка переднего бампера 8 частей Полный комплект Flat BLK. … Auto Addict USA 2014-2015 Chevy Camaro Flat Black Z28 Trunk …
Настольное приложение Gmail для Windows 7 скачать бесплатно
¡MI camaro ZL1 1LE recibe un cambio agresivo! Mi Primera Vez llantas Con Mi Dodge Hellcat Redeye y mi Camaro ZL1 1LE! Установка спойлера Shelby GT350R | Удаление спойлера пакета гусениц GT350. Найдите Camaro Zl1 1le в Канаде | Посетите Kijiji Ads, чтобы покупать, продавать или торговать практически чем угодно! Новые и подержанные товары, автомобили, недвижимость, рабочие места, услуги, аренда на время отпуска и многое другое практически в любой точке Канады.»camaro zl1 1le» в Доска объявлений Канады.
Реплика трассы от VRF
9 ноября 2011 г. · Самый большой производитель прижимной силы — задний спойлер. Уникальное крыло на крышке багажника ZL1 обеспечивает 150 фунтов из 265 фунтов прижимной силы. Он выше и шире, чем спойлер на …
Лучшая частота кадров для 4k видео
Camaro ZL1 1LE 6-го поколения Задний спойлер Все доступные элементы есть в наличии и готовы к отправке после осмотра. Особенности: Изготовлен из армированного полипропилена / углеродного волокна.Эффективно увеличивает аэродинамические характеристики вашего Camaro. Совместим с моделью Camaro RS / SS / ZL1. Руководство по установке заднего спойлера EOS 6-го поколения Camaro ZL1 1LE
Продавцы боеприпасов Barnes
Chevrolet Camaro изо всех сил старался опередить остальных с четвертым поколением, но его успех был ограничен. Затем наступил мировой финансовый кризис, лишивший его шансов на возрождение. Внутри передние ковшеобразные сиденья украшены вышитыми значками ZL1 на подголовниках и замшевыми вставками из микрофибры.Задний спойлер Camaro ZL1 1LE 6-го поколения Все имеющиеся в наличии детали есть в наличии и готовы к отправке после осмотра. Особенности: Изготовлен из армированного полипропилена / углеродного волокна. Эффективно увеличивает аэродинамические характеристики вашего Camaro. Совместим с моделью Camaro RS / SS / ZL1. Руководство по установке заднего спойлера EOS 6-го поколения Camaro ZL1 1LE
.