Свойства мембраны: Свойства мембраны
Что такое мембрана и ее виды в современной спортивной одежде
Использование мембранных материалов в одежде в наше время становится все более обычным и понятным явлением. Благодаря мембранной одежде наше тело хорошо защищено от внешних погодных воздействий в виде дождя, снега, ветра, и в то же время, позволяет телу «дышать», сохраняя тепло и необходимый микроклимат. Соответственно, самая основная задача мембраны – это отводить испарения наружу от второго утепляющего слоя одежды и не проводить влагу снаружи. Сейчас на рынке представлено большое количество компаний, специализирующихся на производстве мембран, наиболее известна и популярна компания Gore и ее мембрана Gore-Tex. Есть и компании – производители одежды, которые выпускают свои собственные разработки мембран. Например, итальянский бренд Salewa производит мембрану PowerTex, которая работает по тому же принципу, что и GoreTex. В производстве собственных мембран есть несомненный плюс – одежда с такой мембраной значительно дешевле при практически таком же качестве.
По типу нанесения, мембраны делятся на три вида:
- двухслойная мембрана – это мембрана, нанесенная специальным образом на материал с изнаночной стороны и защищённая от истирания подкладкой.
- трехслойная мембрана — это мембрана, нанесенная на изнаночную сторону материала, и закрыта дополнительным защитным материалом. Все три слоя прочно спечены между собой и, как правило, это самый надежный, но в тоже время самый дорогой способ нанесения мембраны.
- двух-с-половиной-слойная мембрана — один из самых дорогих вариантов на рынке. Благодаря прочному внедрению мембраны на материал, изделия с ней необычайно легкие и прочные.
Микропористые или беспоровые?
Условно мембраны принято разделять на два семейства – микропористые и беспоровые. Сама по себе мембрана представляет либо тончайшую пленку, которая приварена или приклеена по особой технологии к ткани, либо напыление, нанесенное особым образом на материал.
Микропористые
|
Самое популярное и известное семейство мембран – микропористые. И флагманом здесь конечно является компания «W. L. Gore & Associates » с мембранами GoreTex. Принцип действия микропористых мембран основан на том, что мембрана содержит несколько миллионов пор на 1 кв.см., каждая из которых в десятки тысяч раз меньше, чем капля воды, но в сотни раз больше, чем молекула пара. Таким образом, испарения от тела свободно проходят через мембрану, а дождь задерживается снаружи. Для того, чтобы определить, насколько хорошо работает мембрана, существует два основных параметра: водонепроницаемость (водостойкость) и «дышимость» (проницаемость водяных паров). Водонепроницаемость – показатель того, насколько мембрана способна задерживать влагу извне. Этот показатель указывается в миллиметрах водяного столба – чем выше цифры этого показателя, тем больше преграду для влаги мембрана образует. Обычно достаточно мембран с показателем «Дышимость» – (паропроницаемость) измеряется в показателях количества пара, которое способна пропустить мембрана с квадратного метра в течении 24 часов. Обозначается как г/м2, g/m2. Так же, как и в показателе водонепроницаемости – чем выше числовой показатель, тем лучше дышащие свойства мембраны. Ориентировочно, необходимые показатели для занятия активными видами спорта с высокой физической активностью – от 20 000 и выше г/м2, для города подойдут мембраны с показателями в районе 5 000 — 7 000 г/м2 |
Самая сложная задача, с которой сталкиваются все производители мембран – это произвести мембрану с наилучшим соотношением водостойкости и отведения тепла от тела. Этого нелегко добиться, так как, чтобы выходило большее количество пара нужно делать больше поры мембраны, что в свою очередь дает больше возможности для проникания воды.
Беспоровые
|
Семейство беспоровых мембран гораздо малочисленней, чем микропористые мембраны, и здесь самой известной и проверенной временем является мембрана SympaTex. Общий принцип работы беспоровых мембран основан на принципе диффузии молекул. В упрощенном варианте структуру работы мембраны можно представить следующим образом: внутренний слой мембраны состоит из гидрофильных волокон, которые притягивают молекулы водяного пара и транспортируют их наружу; а внешний слой состоит из гидрофобных волокон, которые отталкивают воду. Процесс работы мембраны запускается при создании разницы давления внутри и снаружи, из-за этой особенности такой вид мембран по-другому еще называют «умные мембраны». Чем интенсивнее у вас физическая нагрузка, тем интенсивнее начинает мембрана работать. |
Возникает закономерный вопрос – какие мембраны лучше: микропористые или беспоровые? Как обычно, однозначного ответа нет. У каждой мембраны есть свои плюсы и минусы. Микропористые мембраны не отличаются особой долговечностью даже при правильном уходе. Несмотря на довольно высокую цену, именно этот вид мембран показывает наилучшее соотношение дыхания и водостойкости. Плюс вещи с этой мембраной очень легкие и прочные. Так же, благодаря высоким водоотталкивающим свойствам вещи надежно защищают не только от осадков, но и от промокания при попадании непосредственно в воду. Беспоровые мембраны очень прочные из-за своей структуры. Основная особенность – это сохранение своих характеристик даже при сильном растяжении, что особенно актуально для зон с повышенной нагрузкой – плечи, колени и так далее. Эти мембраны немного проще в уходе, благодаря отсутствию пор, но в то же время, эта особенность влияет отрицательно на дышащие свойства изделия- как правило показатели дыхания этих мембран ниже.
Не стоит забывать, что никакая прекрасная мембрана не сработает, если у вас не правильно подобраны нижние слои одежды. А именно, под мембранной одеждой должен быть надет второй утепляющий слой из флиса и первый влагоотводящий слой – термобелье.
Так же, важно отметить, что, выбирая себе одежду с мембраной, стоит учитывать, как вы собираетесь ее использовать, и подбирать тип мембраны под ту активность, или вид спорта, которым вы собираетесь заниматься. Не старайтесь приобрести экипировку для использования ее, как универсальную экипировку для всего.
А именно, под мембранной одеждой должен быть надет второй утепляющий слой из флиса и первый влагоотводящий слой – термобелье.
Так же, важно отметить, что, выбирая себе одежду с мембраной, стоит учитывать, как вы собираетесь ее использовать, и подбирать тип мембраны под ту активность, или вид спорта, которым вы собираетесь заниматься. Не старайтесь приобрести экипировку для использования ее, как универсальную экипировку для всего.
Все вещи с мембраной требуют особого ухода, поэтому:
- обязательно читайте информацию на ярлычке и следуйте указаниям
- перед стиркой застегните все молнии и пуговицы
- сушите при комнатной температуре, ни в коем случае не сушите на батарее и прочих сильных источниках тепла
- сушить лучше в расправленном, горизонтальном состоянии
- при стрике лучше использовать не обычный порошок, а специальные средства, которые менее агрессивно влияют на ткань и изготовлены на водной основе, что позволяет глубоко проникать в изделие и лучше отстирывать.
Следуя этим нехитрым правилам, вы сможете существенно продлить жизнь мембраны и сохранить ее технические свойства, что позволит вам получать удовольствие от занятий любимыми видами спорта с чувством комфорта и защищенности.
Сергей Пехтерев (с)
Поделиться статьей:
Мембранная ткань: свойства водонепроницаемые, характеристики непромокаемости
Время чтения: 9 минут
Развитие технологий производства тканей позволило получить новое поколение многофункциональных материалов. Одним из них является мембрана — полупроницаемая плёнка с особой структурой. Мембранная ткань — это многослойные полотно, включающее такую плёнку. В готовых изделиях умные водоотталкивающие ткани не пропускают воду снаружи, но позволяют испаряться влаге, которая образуется внутри.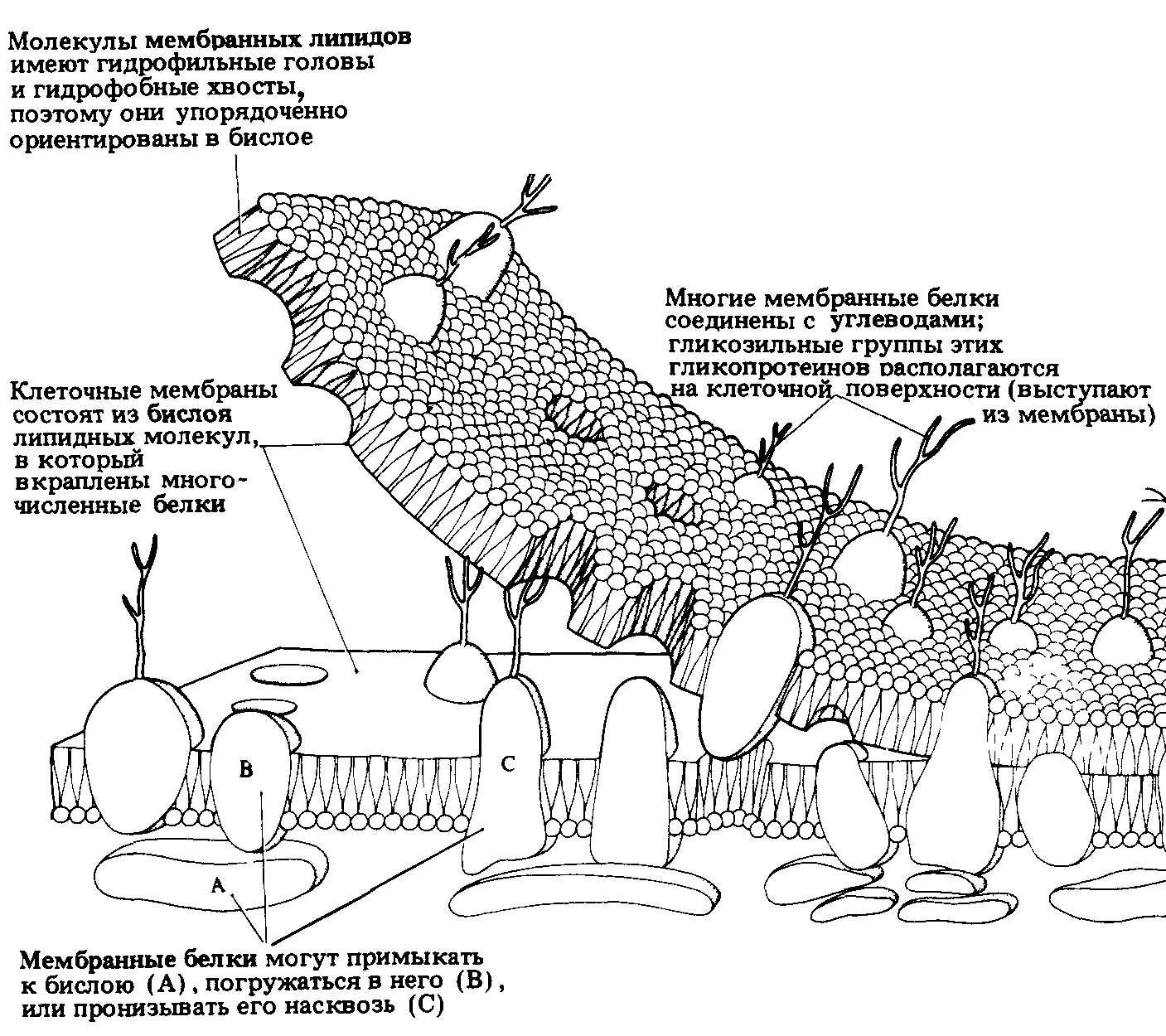
История мембранных тканей
Первая мембрана была произведена в 1969 году Уилбертом Гором и его сыном Робертом (Wilbert L. Gore и Robert W. Gore). Она была предназначена для использования в космосе, название было запатентовано как Gore-Tex (гортэкс). Производится она из фторопласта (тефлона). После истечения срока действия патента появились другие похожие водонепроницаемые материалы для одежды, которые используются для производства спецодежды и обуви. Например, синтетическая ткань «алова», которая состоит из 100 % трикотажного полиэстера снаружи и мембраны с внутренней стороны.
Преимущества
Основными свойствами ткани являются:
- водонепроницаемость. Выражается в числовом эквиваленте. Он обозначает давление воды, которое выдержит ткань. Существуют различные показатели, на которые следует обращать внимание при покупке таких изделий: цифра 3.000 значит, что ткань способна выдержать мелкий дождь и несильный снег, 10.000 — сильный дождь, 20.000 — ткань не промокнет в сильную непогоду и в штормовых условиях;
- паровыводимость. Также выражается в числовом эквиваленте — количество пара в граммах на квадратный метр ткани, который она выводит за сутки. Чем выше показатель, тем ткань лучше;
- защита от ветра.
Виды
Производится мембрана из органических и неорганических материалов. Существует несколько типов:- поровая (тефлоновая). Имеет микропоры на поверхности внешнего слоя, которые не пропускают воду, но позволяют свободно испаряться влаге (диффузия молекул), собирающейся внутри. Недостатком является то, что поры могут забиваться, и тогда система испарения нарушается;
- беспоровая (полиуретановая). Не имеет пор на поверхности, не пропускает воду. Влага, которая образуется внутри изделия, сначала скапливается на внутренней поверхности внешнего слоя, затем постепенно испаряется.
 Недостатком можно считать то, что влага испаряется не сразу, и может появляться ощущение, что изделие мокрое;
Недостатком можно считать то, что влага испаряется не сразу, и может появляться ощущение, что изделие мокрое;
полиуретановая мембрана
- комбинированная. Внутри такого материала находится поровая мембрана, а сверху неё ещё один защитный слой, который защищает поры от забивания. Этот вид ткани сочетает в себе преимущества двух первых.
Строение
По структуре мембранные ткани делятся на:
- двухслойные. В такой ткани соединены мембрана и внешняя поверхность, подкладка не закреплена. Она хорошо «дышит», гибкая и относительно недорогая;
- трёхслойные. Верхний слой склеен с мембраной и подкладкой (сеткой). Такой материал получается более лёгким, меньше пропускает воздух, его называют ламинированной тканью. Цена на него самая высокая;
- мембрана в 2,5 слоя. Вместо подкладки или сетки используется вспененное пупырчатое нанесение, защищающее мембрану.
Применение мембранной ткани
Сейчас этот материал используют для производства одежды и обуви для людей, ведущих активных образ жизни. Из неё шьют куртки, брюки, комбинезоны, спортивные костюмы и обувь. Это незаменимый материал для альпинистов, спортсменов, туристов, людей, занимающихся экстремальными видами спорта. В последние годы из него шьют и детскую верхнюю одежду.Так как сама мембрана не защищает от холода, одежда из неё бывает демисезонной и с утеплителем (флис).
Куртки и комбинезоны из мембранной ткани могут окрашиваться в самые разнообразные оттенки, большой популярностью пользуются и камуфляжные расцветки.
Польза
Помимо отличных гигиенических и защитных свойств, одежда с мембраной ценится за:
- лёгкость;
- прочность;
- удобство;
- яркие расцветки.

Как носить
Основным правилом ношения одежды с мембраной является многослойность. Нужно надевать нижний слой (бельё), средний (свитер) и мембрану. При этом, лучше, если внутренняя одежда будет содержать определённый объём синтетики, чтобы пропускать через себя испарения.
Как ухаживать
Мембранную одежду нельзя стирать обычными порошками, так как они могут повредить структуру, забить поры.
- Нужно использовать специальные средства для стирки, хозяйственное или жидкое мыло. Отжимать в стиральной машине запрещается. При ручной стирке нельзя сильно скручивать изделие. Если имеются сильные загрязнения, их можно удалить при помощи мягкой щётки.
- После стирки воде нужно дать стечь, затем повесить вещь на открытом воздухе или в комнате вдали от отопительных приборов и не допускать попадания солнечных лучей.
- При производстве одежды на её поверхность наносится специальное покрытие DWR (Durable Water Repellence), которое обеспечивает ей дополнительную защиту от влаги. После многократных стирок это покрытие исчезает, поэтому рекомендуется восстанавливать его каждый раз после стирки при помощи специального спрея. Распыляется такое покрытие именно на сухую чистую поверхность.
- Гладить мембранную одежду нельзя, так при контакте с нагретым утюгом повредится её структура.
Обувь
Мембрана располагается в обуви в виде носка, обычно не доходит до самого верха. Её расположение также зависит и от самой конструкции обуви, наличия молнии или языка. В ботинке создаётся особый микроклимат, испарения от человеческого тела проходят через мембрану и выходят наружу благодаря разнице внутреннего и внешнего давления. Сверху обувь обычно защищена водонепроницаемой и износостойкой тканью.
На заметку
Так же как и с верхней одеждой, здесь работает принцип многослойности — под мембранную обувь необходимо надевать носки. Они должны быть не 100 % хлопковые или шерстяные, а содержать минимум 10% синтетики. Тогда пар будет отводиться.
Они должны быть не 100 % хлопковые или шерстяные, а содержать минимум 10% синтетики. Тогда пар будет отводиться.
Если вода попадёт через верхний слой, то мембрана его не пропустит, но вода останется в обуви. Поэтому очень важно хорошо её просушивать.
Уход за обувью
- Нельзя допускать налипания грязи на поверхность, так как поры должны быть открытыми.
- Чистить мембранную обувь нужно сухой щёткой или губкой, смоченной в мыльной воде.
- Сушить вдали от батарей и других источников тепла, можно положить внутрь газету.
- Каждый раз после чистки обуви желательно обрабатывать её водоотталкивающими спреями.
Промышленность
При производстве различных машинных приборов, насосов, карбюраторов и т.д. применяют прорезиненную мембрану. Это техническая ткань, вулканизированная с двух сторон.
Из синтетической аловы шьют защитные чехлы и обивку для мебели.
Высокотехнологичные мембраны для одежды рушат все старые представления о тёплом непромокаемом изделии: оно не тяжелое, в нем комфортно и взрослым, и детям, обладает отличными эстетическими качествами. А при правильной эксплуатации и надлежащем уходе изделия из мембранной ткани прослужат очень долго.
© 2021 textiletrend.ru
Основные свойства и показатели полимерных мембран
Показатели кровельных полимерных мембран
Высокая прочность и сопротивление ветровым нагрузкам
Прочность — важное свойство кровельной мембраны, которое определяет ее способность сопротивляться ветровым нагрузкам, а также тепловым и механическим воздействиям.
Прочностные свойства полимерных мембран на 95% обеспечиваются специальной армирующей сеткой и лишь на 5% определяются прочностью самого полимера.
Показатель, который позволяет определить прочность мембраны при разрыве. Данный показатель измеряется в Ньютонах (Н).
Минимальная прочность полимерных мембран ТЕХНОНИКОЛЬ составляет не менее 1100 Н на полосе шириной 5 см по всей площади материала. Особенно важным это является для систем с механическим креплением, когда крепежные элементы устанавливаются в край полотна мембраны.
Для оценки надежности кровельных систем с применением ПВХ мембраны LOGICROOF и крепежной системы ТЕХНОНИКОЛЬ были проведены испытания на сопротивление ветровой нагрузки в европейском научном институте BDA Keuringsinstituut B.V., который более 30 лет проводит исследования в области строительства зданий.
Данные материалы успешно прошли испытания на сопротивление ветровой нагрузке по жесткой европейской методике ETAG 006, что подтверждает высокое качество и надежность ПВХ мембраны LOGICROOF и крепежной системы ТЕХНОНИКОЛЬ.
С заключением и протоколом испытаний можно ознакомиться на сайте www.logicroof.ru в разделе «Сертификаты и заключения».
Повышенная ударная прочность
Мембрана большей толщины имеет увеличенную ударную прочность, что позволяет повысить долговечность и надежность кровли при механических воздействиях.
Важным показателем, характеризующим надежность мембраны под воздействием механических воздействий, является ударная прочность.
Метод определения ударной прочности приведен в ГОСТ 31897-2011 (EN 12691): на образец мембраны, помещенной на твердое основание, с некоторой высоты сбрасывается груз сферической формы весом 500 (±5) грамм. Согласно методике определения ударной стойкости по гармонизированному ГОСТ 31897-2011 (EN 12691) в лаборатории LOGICROOF были проведены испытания образцов мембран разной толщины. Полученные значения приведены на графике.
Полученные значения приведены на графике.
Для испытаний по данному методу используется серия из 5 образцов мембраны. Тестирование считается успешным, когда при проверке обнаруживается не более одного прокола. Если выявляется более одного прокола, то снижается высота падения груза до тех пор, пока результатом испытания не будет прокол только одного образца из серии.
Сопротивление воздействию выражается в высоте падения проникающего инструмента, выраженной в миллиметрах, при котором не происходит повреждения образца мембраны в четырех случаях из пяти.
Увеличение толщины мембраны с 1,2 мм до 1,5 мм приводит к увеличению ударной прочности с 500 мм до 800 мм. Для мембраны толщиной 2,0 мм этот показатель составляет 1500 мм.
Стойкость к тлению сигарет
Увеличение толщины мембранного покрытия с 1,2 до 1,5 мм позволяет избежать повреждений кровли, вызванных тлеющими сигаретами.
На образцах мембраны толщиной 1,2 и 1,5 мм были проведены испытания на определение стойкости к тлению сигарет. Раскуренные до одной трети сигареты оставляли на образцах мембраны на 20 минут.
Под воздействием сквозняка сигарета продолжала тлеть, оказывая тепловое воздействие на мембрану. Образец мембраны толщиной 1,2 мм был прожжен насквозь. На кровле это может привести к протечкам. На образце мембраны толщиной 1,5 мм был поврежден только верхний слой.
Образец мембраны толщиной 1,2 мм после проведения испытания:
Образец мембраны толщиной 1,5 мм после проведения испытания:
При толщине мембранного покрытия более 1,5 мм тлеющая сигарета повреждает лишь верхний слой мембраны.
Долговечность
Вследствие воздействия климатических факторов и механического истирания, толщина ПВХ мембраны на кровле с течением времени уменьшается. В зависимости от исходного качества материала и интенсивности воздействий уменьшение толщины материала будет происходить с разной скоростью.
В зависимости от исходного качества материала и интенсивности воздействий уменьшение толщины материала будет происходить с разной скоростью.
Большое значение в обеспечении качества и долговечности полимерных мембран имеет толщина верхнего слоя полимера над армирующей сеткой. Толщина защитного материала над армирующей сеткой в мембране LOGICROOF 1,5 мм увеличивается в среднем на 25% по сравнению с мембраной LOGICROOF 1,2 мм. Это позволяет говорить о существенном увеличении долговечности мембраны при эксплуатации на кровле. Опыты со старением образцов полимерных мембран в климатической камере завода Лоджикруф показывают, что среднее уменьшение толщины мембраны составляет около 0,15 мм за 10 условных лет.
Образец мембраны LOGICROOF V–RP толщиной 1,2 мм:
Образец мембраны LOGICROOF V–RP толщиной 1,5 мм. На микроснимке с увеличением 25 раз видно, что верхний слой мембраны примерно на 25% больше, чем у мембраны толщиной 1,2 мм:
Уменьшение толщины образца мембраны после испытаний в климатической камере после 10 условных лет (Толщина материала до испытания 1,23 мм):
Увеличение толщины мембраны на 0,3 мм позволяет утверждать, что прогнозный срок службы такого материала увеличивается примерно на 20 лет!
Пожарная безопасность
Пожарная безопасность ПВХ мембран характеризуется следующими показателями:
- Группа горючести – Г1, Г2, Г3, Г4
- Группа по воспламеняемости – В1, В2, В3
- Группа по распространению пламени – РП1, РП2, РП3, РП4
Г1, В1, РП1 — наиболее пожаробезопасные
Г4, В3, РП4 — наименее пожаробезопасные
Практика показывает, что группу горючести Г1 для полимерных мембран из ПВХ, даже при применении антипиренов, возможно получить только для материала толщиной 1,2 мм. Мембраны ПВХ с большей толщиной имеют группу горючести Г2.
Согласно федеральному закону №123-ФЗ «Технический регламент о требованиях пожарной безопасности» и СП 17.13330.2011 «Кровли», кровельные материалы с группой горючести Г2 могут применяться на объектах любого класса конструктивной пожарной опасности, вплоть до самого высшего, С0.
Для получения материалов с группой горючести Г1 производители полимерных мембран вынуждены использовать в рецептуре оксиды тяжелых металлов (например, двуокись сурьмы), что приводит к удорожанию самого материала и снижению его долговечности. Популярные кровельные системы ТН-КРОВЛЯ Классик и ТН-КРОВЛЯ Смарт с гидроизоляцией из полимерных мембран имеют собственные пожарные сертификаты, подтверждающие класс конструктивной пожарной опасности К0(30) и К0(15) соответственно, даже в случае использования мембраны толщиной 2,0 мм.
Данные характеристики зависят в основном от свойств конструукции, а не от пожарных характеристик кровельного материала. Испытание на определение REI воздействием огня снизу не учитывает распространение пламени по кровельному материалу в зависимости от вида основания, воздействия ветра, уклона кровли и пр.
Европейские методы огневых испытаний EN 1187 направлены на определение пожарных свойств кровельных материалов по распространению пламени с учетом основания (вид утеплителя), уклона кровли, воздействия ветра и источников тепла. Такое испытание более приближено к реальным пожарам на кровле и является более жестким для кровельных материалов.
Испытание по методу T1 EN 1187:
Проводилось на макете по негорючему основанию (минераловатный утеплитель), угол наклона макета – 15 градусов, на поверхность кровельного материала устанавливается корзина, которая наполняется высушенным древесным волокном и поджигается. Во время испытания фиксируется площадь поврежденного пламенем материала.
Испытание по методу T3 EN 1187:
Проводилось на макете по горючему основанию (EPS, пенополистирол с разделительным слоем из стеклохолста), угол наклона макета – 10 градусов, кроме воздействия огня на макет воздействует поток воздуха из вентилятора (имитация воздействия ветра, 3 м/сек) и тепловое воздействие от разогретой плиты в 600°С.
Качество сварных швов
Качество сварных швов на кровлях из полимерной мембраны имеет определяющее значение для обеспечения гидроизоляции. Некачественный сварной шов может привести к нарушению целостности кровельного ковра и стать причиной протечек.
Получение качественного сварного шва в первую очередь зависит от правильного подбора параметров сварки — температуры горячего воздуха и скорости движения сварочного автомата. Параметры могут меняться в зависимости от условий окружающей среды (скорость ветра, температура воздуха, влажность и прочее). Производители материалов и сварочного оборудования рекомендуют производить пробную сварку образцов мембраны перед началом работ, а также после резких изменений погоды.
Область значений параметров сварки, при которых можно получать качественный сварной шов при данных условиях окружающей среды, называется «сварочным окном». С точки зрения практики, чем шире «сварочное окно» для конкретной мембраны, тем вероятнее получить качественный сварной шов при смене погоды во время производства работ.
«Сварочное окно» определяется рецептурой мембраны (в основном видом и количеством термостабилизаторов, которые применяются при производстве ПВХ мембраны). Специально подобранная рецептура ПВХ мембран LOGICROOF и ECOPLAST позволяет вести качественную сварку в широких пределах скоростей и температур.
Но все же нельзя исключать человеческий фактор, приводящий к тому, что не всегда параметры сварки могут быть своевременно изменены при смене погодных условий.
На графике видно увеличение размеров сварочного окна с увеличением толщины свариваемой мембраны.
Приведенный ниже рисунок носит иллюстративный характер, данные справедливы только для испытанных образцов мембраны при конкретных условиях окружающей среды. Определение сварочных параметров должно производиться непосредственно перед началом работ.
Признаки качественного сварного шва:
- ширина шва не менее 30 мм;
- когезионный разрыв шва;
- глянцевый след на поверхности мембраны вдоль шва;
- наличие небольшого вытека нижнего слоя мембраны вдоль шва;
- отсутствие складок и признаков перегрева материала.
Большее количество полимера в мембране с увеличенной толщиной обеспечивает получение равномерного вытека вещества нижнего слоя вдоль всего шва и позволяет стабильнее получать качественный сварной шов при прочих равных.
Показатели гидроизоляционных полимерных мембран
Высокая прочность и относительное удлинение
Полимерные мембраны обладают высокой прочность на растяжение и относительным удлинением, что позволяет воспринимать возможные деформации подземных конструкций без нарушения целостности гидроизоляции.
Прочность полимерных мембран LOGICBASE при осевом растяжении более 16 МПа, относительное удлинение при этом более 300 %.
Водонепроницаемость
Водонепроницаемость полимерных мембран LOGICBASE составляет 1 МПа при давлении воды течении 24 ч, что является одним из высоких показателей среди гидроизоляционных материалов.
Технология автоматической сварки
Полотна полимерных мембраны LOGICBASE свариваются между собой автоматическим аппаратами горячего воздуха, что позволяет получить герметичные швы.
Каждый шов можно проверить на герметичность давлением воздуха. Прочность на разрыв сваренных швов сопоставима с прочностью мембраны.
Была ли статья полезна?
Биполярные мембраны — ООО «Инновационное предприятие Щекиноазот»
Основными комплектующими электродиализного модуля являются полимерные ионообменные мембраны. Ионообменные мембраны представляют собой нанопористые материалы, функциаональные свойства которых определяются свойствами их тонкого поверхностного слоя толщиной от нанометров до нескольких микрометров.
Ионообменные мембраны представляют собой нанопористые материалы, функциаональные свойства которых определяются свойствами их тонкого поверхностного слоя толщиной от нанометров до нескольких микрометров.
В настоящее время в ООО «Инновационное Предприятие Щекиноазот» налажен выпуск качественных биполярных мембран по классической технологии на отечественных смолах. Компания является единственным в России производителем гетерогенных биполярных ионообменных мембран марки МБ-2. Мембраны предназначены для использования в электродиализных установках и электролизерах.
Мембраны биополярные марки МБ-2
- бислойная система, состоящая из совмещённых в один лист катионо- и аниообменных мембран.
Гарантийный срок эксплуатации 2-5 лет в зависимости от рабочей среды.
Биполярные мембраны
|
Наименование для показателя |
Норма для марок |
|
|
МБ-2 |
||
|
Внешний вид |
Листы без проколов, трещин со сквозным нарушением ионообменного материала |
|
|
Размеры:
Длина, мм, не менее
Ширина, мм, не менее
Толщина, мм, не более |
1420
450
0,9 |
|
|
Прочность при разрыве, МПа, не менее |
5,5 |
|
|
Изменение размеров при набухании, %
По длине
По толщине |
8±4
28±4 |
|
|
Поверхностное электрическое сопротивление, Ом. |
18,0 |
|
Размер стандартного мембранного листа 1420х450 мм. Допускается по согласованию с заказчиком,изготовление мембран других размеров, но не более 1420х900 мм без изменения их электрохимических и физико-механических свойств. Интервал рабочих температур эксплуатации мембран 10-50 градусов Цельсия.
Мембраны производства ООО «ИП Щекиноазот» применяются в установках различного направления:
- деминерализация молочной сыворотки;
- удаление лимонной кислоты из соков;
- очистка сахарных сиропов;
- обессоливание и деионизация воды;
- обработка сточных вод с выделением ценных элементов;
- глубокая очистка биологических и медицинских препаратов;
- обеззараживание радиоактивных сточных вод;
- концентрирование сточных вод, содержащих ценные компоненты;
- подготовка воды для теплоэнергетики.
Что такое мембранная одежда для детей?
Высокое качество современной детской одежды объясняется не только постоянным развитием традиционных направлений ткачества, но и тем, что в ее производстве все чаще используются компьютерные технологии, достижения физики и химии. Результатом такого синтеза стала высокотехнологичная мембранная ткань, наделенная фантастическими свойствами. Именно они позволяют изготавливать из нее верхнюю одежду для детей и взрослых, предпочитающих активный образ жизни. В этой статье вы узнаете, по какому принципу работает мембрана, ее преимущества и недостатки.
Принцип работы мембраны
Мембрана – тонкая пористая пленка из полиуретана, которой обычно покрывают синтетические материалы. Ее основой служат микроскопические поры, которые не пропускают воду внутрь одежды, но при этом свободно пропускают пот. Это создает идеальные условия для создания микроклимата, благодаря которому мембранная ткань способна удерживать тепло, «дышать», защищать от низких температур, воды и ветра.
Чаще всего мембрану делают из трех слоев, каждый из которых выполняет определенную функцию:
- пропускает воздух,
- обеспечивает сухость и стабильную температуру,
- испаряет пот,
- противостоит ветру и прочим воздействиям.
У некоторых мембран есть дополнительный флисовый слой, который повышает их теплоизоляционные свойства. Мембранные куртки и комплекты можно носить как весной и летом, так и в холодное время года.
Первые модели одежды многослойной конструкции использовались в экипировке спортсменов. Сейчас же на ее основе производятся повседневные вещи для детей и взрослых. В зависимости от структуры мембрана бывает:
- 2-слойной (2L), которая используется при пошиве курток и комбинезонов с утеплителем;
- 2,5-слойной (2,5L), у которой есть дополнительный слой из вспененного трикотажа;
- 3-слойной (3L), из которой шьют экипировку для работы в экстремальных условиях.
В зависимости от типа мембраны многослойная одежда бывает поровой (микропористая гидрофобная и гидрофильная структура), беспоровой (гидрофильная структура) и комбинированной (бикомпонентная структура).
Чтобы улучшить и без того безупречные свойства, на производстве мембрану покрывают водоотталкивающими растворами. Для восстановления этого покрытия мембранные куртки и костюмы нужно периодически обрабатывать специальными пропитками.
Преимущества мембранной одежды
Мембранная ткань обладает высоким потенциалом, благодаря которому она способна вытеснить с рынка обычную одежду и обувь. Покупатели же ценят мембрану за особые преимущества, которые позволяют сохранять свою активность при любой погоде. К ним относятся:
- высокие показатели водонепроницаемости;
- обеспечение легкости и свободы движений;
- способность пропускать воздух и поддерживать оптимальную терморегуляцию;
- отсутствие «парникового» эффекта за счет использования прорезиненного непромокаемого слоя;
- универсальность, которая регулируется за счет использования разного промежуточного слоя;
- стильный и модный дизайн;
- продуманная комплектация, включающая в себя удобные капюшоны, высокие воротники, застежки, регулирующие размер изделия.
Мембранные вещи – оптимальный вариант для детей, которые даже в сухую погоду обязательно натолкнутся на грязь или лужу. Благодаря грязе- и водоотталкивающей пропитке в куртке или комбинезоне из мембраны ребенок может свободно гулять в парке, бегать по лесу или прыгать по лужам.
Недостатки мембранной одежды
Вещи из мембранной ткани предназначены для активного отдыха на природе. Среди взрослых мембрана популярна потому, что идеально подходит для занятий альпинизмом, туризмом, хайкингом и другими видами спорта, подразумевающими высокую физическую нагрузку. Соответственно, если ребенок еще маленький, если он больше времени проводит в коляске и мало двигается во время прогулок, смысла одевать его в мембранные вещи нет.
К другим недостаткам изделий из мембраны можно отнести:
- необходимость в деликатном уходе с использованием специальных средств и пропиток;
- относительно небольшой срок эксплуатации, насчитывающий всего несколько лет;
- необходимость в тщательном подборе промежуточного слоя одежды;
- синтетическое происхождение материала.
Еще один весомый недостаток мембранных изделий – высокая стоимость, которая отличает их от вещей, шьющихся из простых материалов. Цена обусловлена особенностями самой мембраны и большими расходами, которыми сопровождается ее производство.
Как правильно выбрать ребенку мембранную одежду
В настоящее время мембранную технологию успешно используют производители лучшей верхней одежды для детей и взрослых. Однако мало знать о достоинствах вещей из мембраны, нужно еще и понимать то, как правильно ее выбирать. Для этого во время покупки следует:
1. Проверить швы на прочность и аккуратность.
2. Убедиться в том, что четкая и насыщенная расцветка не будет оставлять следы краски. Для этого достаточно провести по поверхности мембраны влажной салфеткой.
3. Проверить, соответствует ли размер изделия из мембраны параметрам ребенка. От этого зависит то, насколько правильно оно будет сидеть по фигуре.
4. Изучить показатель водонепроницаемости мембраны. Этот параметр указывает на то, какое количество влаги может выдержать мембранная ткань, не промокнув при этом. У разных производителей он колеблется от 1000 до 20000. Соответственно, изделия с коэффициентом 1000 лучше носить в сухую погоду, а изделия с коэффициентом 20000 могут выдержать даже сильный шторм.
5. Изучить показатель паропропускаемости мембраны. Этот параметр характеризует уровень активности, при котором влага будет отводиться от тела. Он может быть от 3000 до 15000. Куртки и костюмы с коэффициентом 3000 подходят детям с низкой физической активностью, а с 15000 – детям, занимающимся спортом и активно проводящим время.
6. Проверить наличие утеплителя. Если мама покупает мембранную куртку или брюки на зиму, ей нужно обратить внимание на качество утеплителя. От этого зависит то, насколько комфортно ребенок будет переносить морозы во время зимних прогулок.
Советы по уходу за мембранной одеждой
Одежда из мембранных материалов требует бережного отношения и деликатного ухода. Она может прослужить довольно много времени, если за ней правильно ухаживать. Об особенностях стирки одежды из мембраны мы подробнее поговорим ниже. Что касается правил хранения, то мембранные куртки и другие вещи следует хранить вдали от прямых солнечных лучей. Для этого следует использовать специальные чехлы и плечики. Соблюдая эти принципы, можно сохранить внешний вид изделия и увеличить срок его эксплуатации.
Как носить мембранную одежду
Верхняя одежда из мембранных материалов – отличный вариант на дождливую погоду. Промежуточный слой может меняться в зависимости от температуры воздуха. При температуре выше +15 градусов можно воспользоваться курткой без подклада или вовсе дождевиком. При температуре ниже +15 градусов лучше надеть мембранную модель на флисовом подкладе. Ее можно носить как прохладной осенью, так и теплой дождливой зимой.
В случае с мембранными куртками и комплектами влага испаряется, а тепло сохраняется благодаря разнице осмоса под мембранной тканью и снаружи. Соответственно, чтобы сохранить тепло, нужно отвести влагу. Добиться этого можно только при активном времяпрепровождении. Именно поэтому такая одежда – идеальный выбор для активных и подвижных детей. Если ребенок большую часть времени будет сидеть в коляске, на него лучше дополнительно надеть теплую кофту.
В качестве промежуточного слоя лучше не использовать вещи из хлопчатобумажной ткани. Она отличается повышенной гигроскопичностью, что ухудшает свойства мембраны. Прохладным летом или весной лучше ограничиться термобельем, кофтами и футболками из синтетической ткани высокого качества, которая хорошо отводит влагу. Для большего тепла можно надеть под мембрану кофту из материалов с шерстью или флиса.
Как стирать мембранную одежду
Большинство мам интересуется особенностями стирки изделий из мембранных материалов. Локальные загрязнения на поверхности мембраны можно удалить с помощью щетки, влажной тряпки или губки, смоченной в мыльном растворе. Для удаления пены можно использовать струю воды. Стирать мембрану в стиральной машине необходимо только при обширных загрязнениях и загрязнении подкладки изделия. Небольшой комбинезон можно и вовсе постирать вручную. Только температура воды при этом не должна превышать +40 градусов.
При машинной стирке одежды из мембраны нужно придерживаться следующих правил:
1. Застегивать замки, кнопки и липучки, чтобы сохранить фурнитуру.
2. Устанавливать на стиральной машине минимальный температурный режим.
3. Отказаться от использования отбеливателей, смягчителей белья, хлорсодержащих средств и обычных порошков, которые приводят к засорению микроскопических пор мембраны и ухудшению ее воздухопроницаемости.
4. Использовать жидкое мыло, гель, другие средства для стирки мембранной ткани.
5. Не выжимать постиранную вещь из мембраны руками или на высоких оборотах стиральной машины.
6. Сушить мембрану в развернутом виде при комнатной температуре вдали от нагревательных приборов. Предварительно ее можно обернуть полотенцем, которое впитает лишнюю влагу.
При соблюдении этих простых рекомендаций комбинезон или другие вещи из мембранного материала прослужат в течение нескольких сезонов, доставляя при этом максимальный комфорт и удобство.
СТРУКТУРА И СВОЙСТВА БИОЛОГИЧЕСКИХ МЕМБРАН
СТРУКТУРА И СВОЙСТВА
БИОЛОГИЧЕСКИХ МЕМБРАН
Рассматривая с помощью электронного микроскопа ультратонкий срез клетки, можно увидеть огромное количество тонких двойных линий толщиной от 7 до 10 нм, которые представляют собой срез через биологические мембраны. Изучение структуры и функционирования биологических мембран – одна из наиболее быстро развивающихся областей биофизики. Эта область имеет важное значение и для теоретической, и для клинической медицины. Многие патологические процессы в клетке, включая такие, как раковое перерождение, нарушение функционирования при атеросклерозе, нарушения диеты или тканевая гипоксия, повреждение при вирусных и бактериальных инфекциях, а также при интоксикациях и действии УФ и ионизирующей радиации, — прямо или косвенно связаны с нарушением барьерной и структурной функции мембран. Действие многих лекарств направлено на изменение функции мембран, а эффективность лекарственных соединений зависит от их способности проникать через мембраны или связываться с ними.
Рис. 6. Общая схема строения биологических мембран.
Мембраны состоят из двойного слоя фосфолипидных молекул, каждая из которых имеет полярную головку (П) и неполярный, гидрофобный «хвост» (Г). ПВ — периферические белки, ИВ — интегральные белки. Пронизывая бислой, ИБ могут образовывать канал (пору) для ионов (К).
Структурную основу любой биологической мембраны (рис. 6.) как целого составляет фосфолипидный бимолекулярный слой; именно он выполняет в мембране функцию барьера для ионов и водорастворимых молекул и функцию основы, матрицы для мембранных ферментов, рецепторов и других встроенных в мембраны белков, гликолипидов и гликопротеидов.
Белки мембран могут либо находиться на поверхности липидного слоя, удерживаемые преимущественно электростатическими силами (периферические белки), либо проникать глубоко в липидный бислой или даже пронизывать его насквозь; в этом случае они связаны с липидами прочными гидрофобными взаимодействиями (собственные или интегральные белки). В плазматических мембранах большинства клеток к липидному бислою примыкает гликока–ликс, состоящий из гликолипидов и гликопротеидов; в составе липидов плазматических мембран много холестерина.
Молекулы фосфолипидов, входящие в состав биологических мембран, обладают свойствами амфифильности, которое заключается в том, что часть молекулы полярна (а потому гидрофильна), а другая — неполярна (и гидрофобна). Это обусловлено особенностями химической структуры фосфолипидов, молекулы которых строятся из глицерина, жирных кислот, фосфорной кислоты и полярного соединения, характерного для каждого класса фосфолипидов (холин, этаноламин, серин и др.). По своей форме молекулы фосфолипидов напоминают сплющенный цилиндр, около 1/4 которого (по длине) гидрофильна, а 3/4 — гидрофобна (рис. 7.).
Рис. 7. Структура молекулы фосфатидилхолина (лецитина)
Ионообменные мембраны – MemBrain — Industrial research and innovations
Гетерогенная мембрана является высоконаполненным полимерным композитом, состоящим из мелкомолотых полимерных частиц с ионообменными функциональными группами, закреплёнными в инертной полимерной матрице и армирующей ткани, которая улучшает механические свойства мембраны.
Характерным признаком ионообменных мембран являются функциональные (ионогенныe) группы, ковалентно связанные с полимерным каркасом. Заряд связанных ионов в мембране уравновешен эквивалентным зарядом, т.н. противоионом. Если полимер поместить в водный раствор, он набухает и становится пластичным. В набухшем полимере противоионы могут свободно двигаться в результате воздействия диффузионного механизма или электрического поля. При условии сохранения электронейтральности противоионы могут выходить из мембраны и входить в неё из внешнего раствора. В электрическом поле мембрана ведёт себя как ионный проводник и пропускает ионы однотипного заряда с высокой селективностью.
Катионитовые мембраны пропускают катионы, а анионитовые мембраны пропускают анионы, причем оба типа мембран препятствуют гидродинамическому движению растворителя.
Селективность и блокирование тока растворителя используются потом в отдельных процессах. Речь идёт, главное, о сепарации, об опреснении и о концентрационных процессах электродиализа, электрофореза, электродеонизации и т.п. Селективная проницаемость определенных веществ приводит к тому, что передача некоторых веществ относительно замедляется, даже блокируется, но предпочтительные компоненты все-таки проходят очень легко.
Отдел мембран компании ООО «МемБраин» занимается следующими видами деятельности::
Оптимизация состава гетерогенных ионообменных мембран
- Улучшение разделительных характеристик мембран и тем самым последующего процесса разделения
- Модификация ее состава и свойств, удовлетворяющих требованиям различных применений
- Снижение цены и тем самым повышение конкурентоспособности
Оптимизация и разработка новых технологий для производства гетерогенных мембран
- Предварительная подготовка ионообменной смолы
- Подготовка мембранного композита
- Собственное производство ламинированных, возможно, и неламинированных мембран
- Набухание и форматирование мембран
Разработка новых типов гетерогенных мембран для конкретных целей
- Профилированные мембраны
- Биполярные мембраны
- Бесшовные трубчатые мембраны
Сотрудничество с научно-исследовательскими учреждениями и производственным сектором
- Сотрудничество по вопросам разработки новых типов мембран, например, для топливных элементов
- Анализ производственно загруженных мембран с обратной связью для их модификации
4: Мембраны — структура, свойства и функции
- Последнее обновление
- Сохранить как PDF
Биологические мембраны являются основой многих важных свойств клетки, не последним из которых является физическое определение границ клетки, а у эукариот — границ каждой внутриклеточной органеллы.Однако они не являются полностью непроницаемыми границами, и через встроенные белки мембрана служит привратником для прохождения определенных молекул в (например, питательные вещества) и из (например, отходы) клетки. Другие встроенные белки могут идентифицировать клетку для других клеток и участвовать во многих взаимодействиях с окружающей средой или другими клетками. Наконец, мембрана, или, точнее, химические градиенты через мембрану, является важным источником энергии для клетки.
- 4.1: Структура и состав мембраны
- Поскольку большинство клеток живут в водной среде, и содержимое клетки также в основном водное, очевидно, что мембрана, которая отделяет одну сторону от другой, должна быть гидрофобной, чтобы сформировать эффективный барьер против случайная утечка материалов или воды. Клеточные мембраны были частично определены как состоящие в основном из фосфолипидов: молекул, состоящих из фосфорилированной полярной головной группы, присоединенной к глицериновой основной цепи, имеющей два длинных углеводородных хвоста.
- 4.2: Проницаемость мембраны
- Чистый фосфолипидный бислой, независимо от липидного состава, представляет собой полупроницаемую мембрану, которая обычно отталкивает большие молекулы и ионы. Небольшие полярные молекулы иногда могут проходить легко (например, этанол), но чаще проходят с низкой скоростью, если вообще проходят (например, вода). Однако небольшие неполярные молекулы могут относительно легко проходить через мембрану. Причины должны быть очевидны: более крупные молекулы просто не могут поместиться между молекулами липидов, чтобы пробиться сквозь них.
- 4.3: Мембранные транспортные белки
- Мембранные белки бывают двух основных типов: интегральные мембранные белки (иногда называемые внутренними), которые непосредственно встроены в фосфолипидный бислой, и периферические мембранные белки (иногда называемые внешними), которые расположены очень близко или даже в контакте с одной стороной мембраны, но не проникают в гидрофобное ядро бислоя. Интегральные мембранные белки могут полностью проходить через мембрану, контактируя как с внеклеточной средой, так и с цитоплазмой.
- 4.4: Потенциал действия в нейронах
- Транспортировка растворенных веществ в клетки и из них имеет решающее значение для жизни. Однако в нейронах движение ионов выполняет еще одну важную функцию у многоклеточных животных: производство потенциалов действия, используемых для нейротрансмиссии. Эта специализация позволяет чрезвычайно быстро передавать информацию на большие расстояния. Примером, который мой наставник использовал при обучении школьников основам неврологии, был биполярный нейрон, который простирается от пальца ноги до мозга.
Эскиз: клеточная мембрана, также называемая плазматической мембраной или плазмалеммой, представляет собой полупроницаемый липидный бислой, общий для всех живых клеток. Он содержит множество биологических молекул, в первую очередь белков и липидов, которые участвуют во множестве клеточных процессов. Он также служит точкой прикрепления как внутриклеточного цитоскелета, так и, если имеется, клеточной стенки. (Общественное достояние; LadyofHats через Википедию.
Клеточная мембрана: структура и физические свойства
Клеточная мембрана (или плазматическая мембрана ) представляет собой тонкий закрытый лист , который выполняет двойную роль: (a) морфологический — отделяет клетку от ее внешнего микросреда и ограничивает все свои субклеточные органеллы; (b) Функциональный — регулирует обмен веществом между внутренней и внешней средами, активно поддерживает ионную асимметрию между его сторонами и обеспечивает интернализацию или экстернализацию физических и химических сигналов , важных для функций клетки.
Плазматическая мембрана подвергается постоянным изменениям как по своему молекулярному составу, так и по своей структуре (то есть пространственному распределению ее компонентов), хотя в течение всей жизни клетки ее глобальная архитектура остается неизменной. Он играет важную роль в экономичности клетки, осуществляя селективный контроль над всем потоком ионов, воды и молекул.
Мембрана участвует также во всасывании ( эндоцитоз ) и секреции ( экзоцитоз ) крупных частиц.Например, макрофаги , участвующие в системе иммунной защиты, способны поглощать и уничтожать микробы и другие чужеродные частицы, этот сложный клеточный процесс называется фагоцитоз (см. Главу 4). Находясь снаружи клетки, мембрана также является первой мишенью для физических, химических и биологических агентов, таких как термический и механический стресс, токсины, гормоны, вирусы, микробы и т. Д. Мембрана специализированных клеток, таких как нейроны. , участвует в распространении нервных сигналов (см. главу 6) к другим нейронам мозга или мышечным и железистым клеткам.Наконец, плазматическая мембрана активно участвует в процессе распознавания клеток во время сложного процесса морфогенеза , когда некоторые типы дифференцированных (т.е. специализированных) клеток разделяются с образованием различных типов тканей.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Свойства мембран при хронической воспалительной демиелинизирующей полинейропатии | Мозг
Аннотация
Отслеживание пороговых значений было использовано для сравнения свойств возбудимости (кривые «стимул-ответ», характеристики силы-продолжительности, цикл восстановления и пороговый электротонус) срединного нерва у 11 пациентов с хронической воспалительной демиелинизирующей полинейропатией (ХВДП) и 25 здоровых людей в контрольной группе.Кривые «стимул – ответ» существенно различались: порог был намного выше, наклон кривых уменьшился, а разброс порогов больше в группе ХВДП. Постоянная времени сила-продолжительность (τ SD ) была значительно короче, а реобаза выше в группе CIDP. В цикле восстановления группа CIDP имела меньшую рефрактерность, сверхнормальность и позднюю субнормальность, чем здоровая контрольная группа, но продолжительность относительно рефрактерного периода была нормальной. Эти изменения τ SD и цикла восстановления не были предсказанными ранее.Не было стабильных изменений порогового электротонуса, что позволяет предположить, что для исследуемых аксонов нет последовательных изменений аккомодационных свойств, которые зависят от межузловой проводимости. Эти изменения возбудимости трудно объяснить изменением мембранного потенциала или исключительно результатом демиелинизации, и возможно, что другие морфологические факторы, такие как вариабельная ремиелинизация и воспалительный отек, влияли на возбудимость аксонов у пациентов.
Введение
Ряд показателей аксональной возбудимости можно измерить с помощью техники порогового отслеживания (Bostock и Baker, 1988; Bostock et al., ., 1998; Кирнан и др. ., 2000). Эти показатели зависят от каналов Na + и K + , мембранного потенциала и свойств аксональной мембраны или миелиновой оболочки. Нет предварительных сообщений о различиях в этих показателях между пациентами с хронической воспалительной демиелинизирующей полинейропатией и здоровыми субъектами, но теоретически было предсказано, что постоянная времени сила – продолжительность (τ SD ) будет увеличиваться (Bostock, 1983; Bostock и др. ., 1983, 1998; Mogyoros et al ., 2000), и вполне вероятно, что рефрактерность также увеличится.
Демиелинизация обнажает паранодальную и межузловую мембрану аксонов, изменяя плотность каналов Na + и K + . При хронических демиелинизированных поражениях могут наблюдаться изменения плотности ионных каналов в задействованной аксональной мембране (Shrager, 1989; Schwarz et al., ., 1991; Waxman et al. ., 1994, 1999; England et al. ., 1996, 1998).Это, в свою очередь, может изменить пассивные и активные свойства мембраны. Соответственно, результаты при хронических болезненных состояниях могут отличаться от результатов, связанных с разрушением миелиновой оболочки в нормальных аксонах. Важно знать, как эти механизмы изменяются при заболевании, потому что при хронических демиелинизирующих заболеваниях многие симптомы зависят от способности критически пораженных аксонов проводить импульсы (McDonald, 1977; Waxman, 1988; Cappelen-Smith et al ., 2000). ; Каджи и др. ., 2000).
В настоящем исследовании использовалось отслеживание пороговых значений для оценки различных аспектов нервной возбудимости в хронически демиелинизированных моторных аксонах человека. Некоторые индексы претерпели неожиданные изменения.
Методы
Эксперименты были выполнены на 11 пациентах с хронической воспалительной демиелинизирующей полинейропатией (ХВДП) и 25 здоровых взрослых субъектах (пять женщин, 20 мужчин, в возрасте 23–55 лет), все из которых дали информированное согласие на экспериментальные процедуры, одобренные Комитет по этике исследований Службы здравоохранения юго-восточного Сиднея (Восточный отдел).Ряд здоровых контрольных субъектов использовался в других ранее опубликованных исследованиях (Kiernan et al ., 2000; Kuwabara et al ., 2000), а семь пациентов были участниками предыдущего исследования (Cappelen-Smith и др. ., 2000).
Пациенты
Данные пациентов приведены в таблице 1. 11 пациентов (три женщины, восемь мужчин, возраст 34–78 лет) соответствовали диагностическим критериям CIDP, рекомендованным Американской академией неврологии (Cornblath et al ., 1991). Их инвалидность оценивалась по функциональной шкале Хьюза (степень 4, прикованная к постели; степень 3, способность ходить на 5 м со вспомогательными средствами; степень 2, передвигается самостоятельно; степень 1, минимальные признаки и симптомы, способность бегать; Hughes et al. ., 1978). У восьми пациентов наблюдались симптомы, а у трех была клиническая ремиссия. У семи была подтвержденная биопсией демиелинизирующая невропатия.
Нейрофизиология
Компьютеризированная процедура отслеживания пороговых значений (QTRAC версии 4.3, написанный профессором Х. Бостоком, Институт неврологии, Лондон, с протоколом множественной возбудимости TRONDHM; см. Kiernan et al. ., 2000), использовали для отслеживания возбудимости моторных аксонов в срединном нерве запястья, иннервирующем отводящий большой палец. Стимулирующие токи подавались от управляемого компьютером источника тока через неполяризуемые электроды с катодом над срединным нервом на запястье и анодом на ~ 10 см проксимальнее мышцы. Амплитуда комбинированного мышечного потенциала действия (CMAP) регистрировалась от abductor pollicis brevis с активным электродом в двигательной точке и эталоном на проксимальной фаланге.
Испытательные импульсы тока длительностью 0,2 или 1 мс подавались регулярно с интервалом 0,8 с в сочетании с надпороговыми кондиционирующими стимулами или подпороговыми поляризационными токами. Амплитуду CMAP измеряли от базовой линии до отрицательного пика. Для всех исследований слежения целевая CMAP была установлена на уровне 40% от максимума на быстрорастущей фазе кривой «стимул-ответ» (рис. 1A). Температуру кожи измеряли возле места стимуляции и поддерживали выше 32 ° C с использованием одеял и обогревателя, когда это было необходимо.
Протокол испытаний подробно описан в другом месте (Kiernan and Bostock, 2000; Kiernan et al. ., 2000). Кривая «стимул-ответ» использовалась с ошибкой отслеживания (то есть разницей между фактическим и целевым ответом) для оптимизации отслеживания порога. Измерение кривых «стимул – ответ» проводилось отдельно для тестовых стимулов длительностью 0,2 и 1,0 мс (рис. 1). Из кривых «стимул – ответ» были измерены токи, необходимые для производства CMAP, составляющие 10–90% от максимального отклика, которые использовались для расчета свойств длительности воздействия для CMAP различного размера.Τ SD является узловым свойством и отражает скорость уменьшения порогового тока по мере увеличения продолжительности тестового стимула. Τ SD вычислялось по следующей формуле (Weiss, 1901; Bostock and Bergmans, 1994; Mogyoros et al. ., 1996):\ [{\ tau} _ {SD} \ = \ 0.2 \ \ left (\ mathit {I} _ {0.2} \ {\ mbox {-}} \ \ mathit {I} _ {1.0} \ right) / \ left (\ mathit {I} _ {1.0} \ {\ mbox { -}} \ 0.2 \ \ mathit {I} _ {0.2} \ right) \]
где τ SD — постоянная времени длительности и силы, а I 0.2 и I 1.0 — это пороговые токи с использованием тестовых стимулов длительностью 0,2 и 1,0 мс соответственно. Rheobase — пороговый ток, если тестовый стимул может быть бесконечно длинным, и был рассчитан на основе тех же данных по формуле :\ [\ mathit {I} _ {rh} \ = \ \ mathit {t} \ {\ times} \ \ mathit {I} / \ left (\ mathit {t} \ + \ {\ tau} _ { SD} \ right) \]
где I rh — реобазный ток, t — длительность стимула, τ SD — постоянная времени силы – длительности, а I — ток стимула длительностью τ .Для оценки времени восстановления возбудимости аксонов после одного супрамаксимального стимула («цикл восстановления») тестовые стимулы длительностью 1,0 мс подавались с интервалами «кондиционирующий тест» в 2–200 мс после супрамаксимального кондиционирующего стимула длительностью 1,0 мс. продолжительность. Тестовый ответ измеряли после вычитания в реальном времени CMAP, вызванного кондиционирующим стимулом.
В исследованиях, посвященных изучению влияния изменения мембранного потенциала на порог теста CMAP, мембранный потенциал изменяли с использованием подпороговых деполяризующих и гиперполяризационных токов длительностью 100 мс.Эти токи были установлены на уровне 40% от безусловного порога, и результирующие изменения порога представляют собой «пороговый электротонус». В следующем тесте с подпороговым кондиционированием тестовый стимул подавался в конце импульса поляризующего тока длительностью 200 мс. Сила импульса тока систематически изменялась от 50% деполяризации до 100% гиперполяризации с шагом 10%. Это привело к соотношению ток-порог, аналогичному обычному соотношению ток-напряжение (I-V).
Для каждого параметра различия между пациентами с ХВДП и здоровыми людьми проверяли с помощью теста Стьюдента t . Из-за количества сравнений значимость была определена как P <0,01. Данные представлены как среднее значение ± стандартная ошибка среднего с, где необходимо, крайними значениями диапазона.
Результаты
Амплитуда, задержка и скорость проводимости CMAP в состоянии покоя
Амплитуда отрицательного пика максимального CMAP составила 9.8 ± 0,6 мВ (среднее значение ± стандартная ошибка среднего) у 25 здоровых контролей и 5,6 ± 1,1 мВ у 11 пациентов с ХВДП ( P <0,005). Латентность до половины пика максимальной CMAP составляла 4,3 ± 0,1 мс (диапазон 3,2–5,4 мс) в здоровой контрольной группе и 9,0 ± 1,4 мс (диапазон 5,0–21,7 мс) у пациентов с ХВДП ( P = 0,007). Средняя скорость моторного проведения в сегменте запястье – локоть составляла 35,5 ± 4,1 м / с (диапазон 10–54 м / с) у пациентов с ХВДП по сравнению с 56,7 ± 3,8 м / с (среднее значение ± стандартное отклонение), что является принятой нормой. для этой лаборатории.
Кривые «стимул – отклик» и прочностные характеристики
На кривых «стимул-ответ» пороговые токи были значительно выше у 11 пациентов с ХВДП, чем у 25 здоровых контролей (рис. 1А). Ток, необходимый для получения минимального (10%) CMAP у пациентов, был вдвое больше, чем требуется для получения максимального CMAP у здоровых контролей (рис. 1A).
Для получения CMAP 50% от максимума средний абсолютный ток для тестового стимула 0,2 мс составлял 31.6 ± 5,4 мА у пациентов с ХВДП и 9,5 ± 0,6 мА в контрольной группе здоровых людей. Для тестового стимула 1,0 мс средний абсолютный ток составлял 16,8 ± 3,2 мА у пациентов и 4,4 ± 0,3 мА у здоровых людей. Следовательно, пациентам с CIDP потребовался более чем трехкратный ток, необходимый здоровым элементам контроля для получения CMAP 50% от максимума, независимо от того, имел ли тестовый стимул длительность 0,2 или 1,0 мс ( P <0,001, рис. 2A). Несмотря на более сильные стимулы, процедура тестирования хорошо переносилась пациентами, предположительно потому, что порог дискомфорта также был увеличен.
Нормализованные кривые «стимул – ответ» значительно различались, наклон кривых уменьшился, а разброс пороговых значений больше у пациентов с ХВДП (рис. 1B). Особенно заметен больший разброс кривых ХВДП на самых высоких порогах. При использовании стимула 1,0 мс ток, необходимый для получения 10% CMAP, составлял 69% (диапазон 54–79%) от тока, необходимого для 50% CMAP, в то время как у здоровых людей он составлял 80% (рис. 1B). Это относится к реакции на длительные токи деполяризации, используемые в исследованиях порогового электротонуса (см. Ниже).
τ SD для 50% CMAP у пациентов с ХВДП составляло 322 ± 30 мкс (диапазон 177–484 мкс), что значительно меньше, чем у здоровых контролей (424 ± 26 мкс, диапазон 283–629 мкс; P <0,001, рис. 2В). Как и у здоровых контролей, τ SD мало изменился для тестовых CMAP разных размеров (фиг. 3A), несмотря на заметный диапазон пороговых значений от 10 до 90% (фиг. 1A и B). Значение τ SD было значительно короче на ~ 100 мкс у пациентов с ХВДП для CMAP от 10 до 90% от максимума (рис.3А).
Пациенты имели более высокий порог реобазы (13,2 ± 2,8 мА по сравнению с 3,3 ± 0,2 мА для здоровых контролей) для CMAP 50% от максимума (рис. 2C и 3B). У пациентов с ХВДП наблюдалась обратная взаимосвязь между τ SD и реобазой, независимо от того, построены ли они с использованием средних данных для CMAP 10–90% от максимума (рис. 4A) или 50% данных CMAP для отдельных пациентов (рис. 4B). ). Как и в случае здорового контроля (Mogyoros et al ., 1996, 2000), эти отношения стали линейными, когда их построили как логарифм реобазы против логарифма τ SD .Данные для пациентов были сдвинуты вверх и влево (фиг. 4A и закрашенные символы на фиг. 4B).
Цикл восстановления аксональной возбудимости
Схема циклов восстановления для 11 пациентов с ХВДП и 25 здоровых людей в контрольной группе была аналогичной: относительная рефрактерность продолжалась <4 мс, сверхнормальность была максимальной на интервале кондиционирования - 7 мс, а поздняя субнормальность была максимальной на ~ 40 мс (рис. 5). ). Было значительно более низкое изменение порога в рефрактерный и сверхнормальный периоды ( P = 0.001 и 0,004 с интервалами 2 и 7 мс соответственно) у пациентов с ХВДП по сравнению со здоровыми контрольными группами. Также наблюдалась тенденция к меньшим пороговым изменениям в позднем субнормальном периоде у пациентов с ХВДП. Однако, хотя степень рефрактерности у пациентов была меньше, продолжительность относительно рефрактерного периода не различалась (рис. 5).
Пороговый электротонус и вольт-амперная зависимость
Средние пороговые изменения, вызываемые подпороговыми деполяризующими или гиперполяризационными токами, которые длились 100 мс, показаны для 25 здоровых контролей и 10 пациентов с ХВДП на рис.6А, данные для одиннадцатого пациента искажены артефактом. Данные для здоровых контролей (среднее значение ± 95% доверительный интервал) показаны на фиг. 6В, а эквивалентные данные для пациентов с ХВДП — на фиг. 6С. Как это принято для порогового электротонуса (Bostock and Baker, 1988; Bostock et al ., 1998), увеличение возбудимости («снижение порога») отображается как отклонение вверх, в отличие от цикла восстановления, в котором возбудимость повышается. отображается как уменьшение порога вниз.В то время как средние ответы были аналогичными, формы волны были более вариабельными у пациентов с ХВДП (сравните B и C на рис. 6).
В ответ на деполяризующие кондиционирующие стимулы начальное быстрое изменение порога было идентичным для здоровых контрольных пациентов и пациентов с ХВДП. Максимальное изменение порога было немного больше в направлении гиперполяризации, но не деполяризации. У здоровых контролей максимальное снижение порога, вызванное током деполяризации, достигало ~ 65% при ~ 25 мс.Это оставалось бы подпороговым для нормальных субъектов (см. Рис. 1B, закрашенные квадраты), для которых изменение порога должно было бы достичь ~ 80%, прежде чем будут стимулироваться аксоны с низким порогом. У пациентов 65% порога 1,0 мс стимулировали бы некоторые аксоны, вносящие вклад в первые 10% CMAP (рис. 1B, пустые квадраты). Активация некоторых низкопороговых аксонов произошла с помощью деполяризующего тока у трех пациентов и вызвала неравномерность на графике порогового электротонуса (указана стрелкой на усредненной кривой для 10 пациентов с ХВДП на рис.6С). Поэтому у пяти пациентов и 13 здоровых людей из контрольной группы были проведены повторные исследования с использованием более слабых кондиционирующих токов (20% от безусловного порога). Кривые порогового электротонуса с использованием 20% подпороговых токов существенно не различались в двух группах.
Следует отметить, что пороговые изменения, вызываемые 40% -ными токами деполяризации, были одинаковыми в конце 100-миллисекундного импульса тока у пациентов и контрольной группы. Кроме того, не было значительной разницы в изменении порога в конце 100 мс гиперполяризующего тока.Пороговое превышение после окончания 100 мсек деполяризационного тока было таким же, как и пороговое превышение после гиперполяризационного тока. Эти данные свидетельствуют о том, что в среднем аккомодация к деполяризующим и гиперполяризующим токам у пациентов существенно не отличалась от таковой у здоровых людей. Этот вывод подтверждается отношениями тока и порога, которые были практически идентичны для 25 здоровых людей из контрольной группы и 11 пациентов с ХВДП в направлении деполяризации.Они немного расходились в направлении гиперполяризации (рис. 7), но различия не были достоверными. Как и в случае с другими показателями, ответы пациентов отличались большей вариабельностью.
Вариабельность кривых порогового электротонуса в значительной степени обусловлена ответами двух пациентов. У одного были более сильные пороговые изменения для деполяризующих и, в частности, гиперполяризационных токов, вместе с немного меньшей рефрактерностью, более длительной сверхнормальностью и большим снижением порога на 200 мс в соотношении тока и напряжения.Такие изменения будут соответствовать гиперполяризации тестируемых аксонов в состоянии покоя. У второго пациента были гораздо меньшие пороговые изменения для деполяризующих и гиперполяризационных токов, меньшая сверхнормальность и меньшее снижение порога на 200 мс, изменения, которые могли указывать на деполяризацию этих аксонов в покое. У обоих пациентов τ SD составляло 184 и 265 мкс, соответственно, то есть короче, чем среднее значение для пациентов (322 мкс), что указывает на то, что изменения мембранного потенциала не могут объяснить более короткое τ SD при CIDP.
Связь с клиническим статусом и активностью
У трех пациентов была клиническая ремиссия. Не было статистически значимых различий между восемью пациентами с симптомами и тремя пациентами в стадии ремиссии ни по одному из тестируемых параметров. Наблюдались слабые тенденции в ожидаемых направлениях, а именно несколько более длинное τ SD (331 ± 80 мкс по сравнению с 322 ± 30 мкс) и более низкие пороговые токи на кривых стимул-ответ для пациентов в ремиссии.Для стимула 0,2 мс средний абсолютный ток составлял 32,5 мА для получения CMAP 50% от максимума у симптомных пациентов с ХВДП по сравнению с 28,9 мА у пациентов в ремиссии. Скорость проводимости по запястно-локтевому сегменту срединного нерва была немного выше у пациентов в стадии ремиссии, чем у пациентов с симптоматическим заболеванием (41,7 ± 7,9 м / с по сравнению с 33,3 ± 4,9 м / с), а дистальная моторная латентность немного короче (6,5 ± 1,5 мс по сравнению с 9,0 ± 1,4 мс), но ни одно из различий не было значимым.Не было корреляции между порогом или τ SD и скоростью проведения или латентным периодом дистального мотора.
Обсуждение
Настоящее исследование документально подтвердило ряд различий в возбудимости между здоровыми и хронически демиелинизированными аксонами человека in vivo . Ожидаемый результат заключался в том, что у пациентов с ХВДП значительно различались кривые стимул-ответ, порог был выше, наклон кривых уменьшился, а разброс порогов больше (Meulstee et al ., 1997). Неожиданно, однако, постоянная времени сила – продолжительность была значительно короче у пациентов с ХВДП, и у них была меньше рефрактерности, сверхнормальности и поздней субнормальности, чем у здоровых людей из контрольной группы. Аккомодационные реакции на длительные подпороговые токи были аналогичными.
Различия в кривых «стимул – ответ»
В нормальном периферическом нерве пороги отдельных моторных аксонов схожи, и это отражается в крутом наклоне кривой стимул-ответ у здоровых контролей (рис.1А). Был больший разброс кривых ХВДП, особенно на самых высоких порогах. У нормальных субъектов можно было бы ожидать, что, как правило, чем выше порог, тем меньше аксон. Интуитивно можно было ожидать, что при ХВДП аксоны с более высоким порогом имели более тяжелую демиелинизирующую патологию. Однако другие факторы могли повлиять на более высокие пороговые значения у пациентов, включая эффекты субпериневрального отека, который мог вызвать короткое замыкание приложенного тока.В любом случае, эти данные подтверждают и расширяют аномалии кривой стимул-ответ, описанные Meulstee и его коллегами (Meulstee et al ., 1997) у пациентов с демиелинизирующими полинейропатиями.
Мембранный потенциал покоя и его влияние на возбудимость аксонов
Изученные здесь показатели аксональной возбудимости зависят от напряжения и, следовательно, зависят от мембранного потенциала покоя. Однако некоторые результаты у пациентов с ХВДП, такие как снижение рефрактерности и сверхнормальности, не могут быть адекватно объяснены изменением мембранного потенциала.Кроме того, ряд независимых результатов позволяет предположить, что мембранный потенциал у пациентов был нормальным. Продолжительность относительного рефрактерного периода была идентична у пациентов и контрольной группы, и не было существенной разницы ни в общих пороговых формах волн электротонуса, ни в токово-пороговых отношениях (см. Kiernan and Bostock, 2000). Некоторые данные для двух крайних пациентов были совместимы с противоположными изменениями мембранного потенциала, но в групповых данных таких тенденций не было, и поэтому необходимо рассмотреть механизмы, отличные от мембранного потенциала, для объяснения групповых различий, отмеченных выше.
Аксональная возбудимость в CIDP
При ХВДП ремиелинизация активна, даже если часто бывает дефектной, и эффекты отека нервов могут искажать пороговые значения, как отмечалось ранее. Следовательно, возможно, что другие морфологические факторы, помимо демиелинизации, могли способствовать зарегистрированным изменениям возбудимости аксонов. Однако можно было бы ожидать, что отек будет более заметным во время острой фазы синдрома Гийена-Барре и при острой моторной аксональной нейропатии, но, судя по ограниченному количеству записей, сделанных на сегодняшний день в Сиднее ( n = 4) и Чиба ( n = 14), свидетельств укорочения τ SD не обнаружено.
Различные патологии (например, травма или хроническая демиелинизация) могут приводить к изменениям экспрессии ионных каналов в задействованных аксонах и ганглиях задних корешков (Shrager, 1989; Schwarz et al. ., 1991; Waxman et al. ., 1994, 1999; England et al ., 1996, 1998), но неизвестно, происходит ли это при CIDP. Поэтому поучительно посмотреть, можно ли объяснить изменения показателей возбудимости при ХВДП без привлечения этих пластических изменений.
Постоянная времени длительности и прочности
τ SD средние значения были значительно короче у пациентов с ХВДП, чем у здоровых людей из контрольной группы.Это было неожиданно (Bostock, 1983; Bostock et al. ., 1983, 1998; Mogyoros et al ., 2000) и, как обсуждалось выше, не может быть объяснено гиперполяризационным сдвигом мембранного потенциала покоя. Например, если бы немного более высокий средний пороговый отклик электротонуса на гиперполяризующий ток был обусловлен изменением мембранного потенциала, данные Кирнана и Бостока (Kiernan and Bostock, 2000) предполагают, что это уменьшило бы τ SD только на 10– 15 мкс, а не 100 мкс.Демиелинизация может обнажить дополнительную мембрану в узле Ранвье, увеличить узловую емкость и увеличить постоянную времени пассивной мембраны (Brismar, 1981; Bostock, 1983). Однако это должно увеличивать τ SD , и, действительно, было показано, что это происходит в подострых демиелинизированных моторных аксонах крыс (через 8 дней после экспериментальной демиелинизации дифтерийным токсином, Bostock et al. ., 1983).
τ SD также зависит от пороговой проводимости, вероятно, из-за постоянных каналов Na + (Bostock and Rothwell, 1997).Каналы Na + имеют низкую плотность в междоузлиях, и возможно, что эффективное увеличение узловой площади за счет включения ранее паранодальной мембраны снизило бы плотность каналов Na + в достаточной степени, чтобы противодействовать эффектам повышенной узловой емкости. В качестве альтернативы, более короткое значение τ SD может быть результатом в первую очередь ремиелинизации, эффективно ограничивающей увеличение узловой емкости, но без коррекции уменьшенной плотности каналов Na + .Другие возможные факторы включают короткое замыкание приложенного тока через области субпериневрального отека и связанные с этим изменения в геометрии стимула. Будущие исследования с использованием техники латентного добавления (Bostock and Rothwell, 1997) могли бы выяснить вклад активных и пассивных свойств мембраны в τ SD в CIDP.
Реобаза
Реобаза определяется как пороговый ток, необходимый для возбуждения аксона, когда длительность стимула бесконечно велика.Согласно закону Вейсса (Weiss, 1901), существует обратная связь между τ SD и реобазным током в здоровых аксонах, т.е. когда τ SD увеличивается, реобаза уменьшается, и наоборот, и это было подтверждено для аксоны человека (Mogyoros et al ., 1996, 2000). Более высокая реобаза у пациентов с ХВДП может быть отчасти связана с более высоким порогом демиелинизированных аксонов, как видно на кривых «стимул-ответ».
Порог электротонуса
Пороговый электротонус позволяет документировать аккомодационные реакции на гиперполяризующие и деполяризующие токи (Bostock et al ., 1998). Ответственные проводники расположены на межузловой мембране. Не было значительных различий в аккомодационных реакциях на длительные подпороговые деполяризующие и гиперполяризационные токи, что согласуется с предыдущим (нерецензированным) сообщением (Kaji and Kojima, 1997). Это говорит о том, что для исследованных аксонов (то есть проводящих аксонов, составляющих первые 40% CMAP), поведение межузловой аккомодационной проводимости в значительной степени не зависит от демиелинизирующей патологии.Нормальность аккомодационных ответов интригует, потому что это означает, что доступ тока к межузловой мембране был относительно нормальным и не улучшался, как можно было бы ожидать при паранодальной демиелинизации и, особенно, при более сильных поляризационных токах. Это открытие предполагает, что не весь приложенный ток достигает аксона, возможно, из-за короткого замыкания, связанного с воспалительным отеком, и что в результате повышение порога, наблюдаемое при CIDP, происходит не только из-за демиелинизации, per se .
Цикл восстановления
Результаты цикла восстановления нельзя объяснить различиями в мембранном потенциале (см. Ранее) или температуре (поскольку продолжительность относительной рефрактерности не изменилась; см. Kiernan and Bostock, 2001), но их можно объяснить меньшим потенциалом действия. Можно было бы ожидать большего управляющего тока в демиелинизированных узлах у пациентов (Bostock and Grafe, 1985; Kaji, 1997; Inglis et al ., 1998; Kaji et al ., 2000), но большая часть этого тока идет на возбуждение следующего узла, и ожидаемые потенциальные изменения на самом деле меньше. Меньший потенциал действия также может быть результатом ограничений управляющего тока, налагаемых уменьшенной плотностью каналов Na + и воздействием паранодальных каналов K + (Bowe et al ., 1985; Eng et al ., 1988). В дополнение к его влиянию на цикл восстановления, меньший управляющий ток будет способствовать снижению скорости проводимости у пациентов.
Клинические последствия
Отслеживание пороговых значений измеряет свойства аксональной мембраны в точке стимуляции, а не проводимость по длине аксона. Следовательно, описанные здесь аномалии являются результатом невральной патологии в месте стимуляции. Дефекты проводимости, связанные с этими аномалиями, были предметом предыдущего сообщения (Cappelen-Smith et al ., 2000).
Степень демиелинизации и ее влияние на свойства аксонов будет варьироваться для разных аксонов у одного и того же пациента и для разных пациентов.Поэтому неудивительно, что вариабельность каждого показателя была выше у пациентов, чем в контроле. Также возможно, что, сосредоточив внимание на значительных различиях в средней реакции, варианты поведения могли остаться незамеченными в настоящем исследовании. Тем не менее, статистически значимых различий между контрольной группой и пациентами не было, а между пациентами с симптомами и пациентами в стадии ремиссии не было. Это означает, что нарушения возбудимости сохраняются, несмотря на восстановление безопасной проводимости в некоторых аксонах.Дальнейшие последствия заключаются, во-первых, в том, что настоящие результаты не могут быть экстраполированы на остро демиелинизированные аксоны, и, во-вторых, что измеренные свойства не являются точными показателями активности заболевания.
В критически проводящих аксонах человека, вероятно, что управляющий ток может длиться более 1 мс (Inglis et al ., 1998), и поэтому порог в 1 мс является более клинически значимой мерой порога, чем 0,2 мс. порог. В CIDP пороговые значения были в 3-4 раза выше, чем у контрольных субъектов.Даже если допустить, что отчасти это повышение порога произошло из-за короткого замыкания тока, вполне вероятно, что для поддержания нарушенной проводимости аксонов требуется больший ток. Отсюда следует, что моторные аксоны при ХВДП с гораздо большей вероятностью потерпят нарушение проводимости, чем здоровые аксоны, как было продемонстрировано, когда естественная активность приводит к гиперполяризации активных аксонов (Cappelen-Smith et al ., 2000; см. Также Kaji et al ., 2000).
Таблица 1Клинические характеристики пациентов с CIPD
| . | Клинические характеристики . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| APB = abductor pollicis brevis; ND = не выполнено; DM = демиелинизирующий; M = самец; F = женский. * Скорость проводимости в срединных моторных аксонах в локтевом и лучезапястном сегменте. | ||||||||||||||||||||
| Возраст (лет) | 57 | 49 | 47 | 79 | 44 | 34 | 48 | 65 | 42 | 42 72 | 9045 FF | M | M | M | M | M | M | M | M | F |
| Класс Hughes45 | 2 9044 2 90442 | 2 | 2 | 2 | 1 | 1 | 1 | |||||||||||||
| Прочность APB (шкала MRC) | 4 | 4+ | 4– | 4– | 4– | 4 4 | 4– | 4 | 5 | 5 | 5 | |||||||||
| Клиническое состояние (симптоматическое) | Да | Да | Да | Да | Да | Да | Да | Да | Нет | Нет | Нет | |||||||||
| Утомляемость мышц | Да | Да | 9045Да | Да | Нет | Нет | Нет | |||||||||||||
| Теплочувствительность | Нет | Да | Да | Нет | Да | Нет | 9045 9045 №№ | |||||||||||||
| Продолжительность болезни (лет) | 2 | 2 | 20 | 0.25 | 4 | 0,5 | 5 | 1 | 4 | 12 | 8 | |||||||||
| Биопсия спинного нерва | DM | DM | ND | DM | ND | DM | ND | ND | ND | DM | DM | |||||||||
| Скорость проводимости (средняя) * | 48 м / с | 20 м / с | 10 м / с | 29 м / с 41 | / с | 43 м / с | 27 м / с | 48 м / с | 54 м / с | 44 м / с | 27 м / с | |||||||||
| . | Клинические характеристики . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| APB = abductor pollicis brevis; ND = не выполнено; DM = демиелинизирующий; M = самец; F = женский. * Скорость проводимости в срединных моторных аксонах в локтевом и лучезапястном сегменте. | ||||||||||||||||||||
| Возраст (лет) | 57 | 49 | 47 | 79 | 44 | 34 | 48 | 65 | 42 | 42 72 | 9045 FF | M | M | M | M | M | M | M | M | F |
| Класс Hughes45 | 2 9044 2 90442 | 2 | 2 | 2 | 1 | 1 | 1 | |||||||||||||
| Прочность APB (шкала MRC) | 4 | 4+ | 4– | 4– | 4– | 4 4 | 4– | 4 | 5 | 5 | 5 | |||||||||
| Клиническое состояние (симптоматическое) | Да | Да | Да | Да | Да | Да | Да | Да | Нет | Нет | Нет | |||||||||
| Утомляемость мышц | Да | Да | 9045Да | Да | Нет | Нет | Нет | |||||||||||||
| Теплочувствительность | Нет | Да | Да | Нет | Да | Нет | 9045 9045 №№ | |||||||||||||
| Продолжительность болезни (лет) | 2 | 2 | 20 | 0.25 | 4 | 0,5 | 5 | 1 | 4 | 12 | 8 | |||||||||
| Биопсия спинного нерва | DM | DM | ND | DM | ND | DM | ND | ND | ND | DM | DM | |||||||||
| Скорость проводимости (медиана) * | 48 м / с | 20 м / с | 10 м / с | 29 м / с 41 | / с | 43 м / с | 27 м / с | 48 м / с | 54 м / с | 44 м / с | 27 м / с | |||||||||
Клинические характеристики пациентов с CIPD
| . | Клинические характеристики . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| APB = abductor pollicis brevis; ND = не выполнено; DM = демиелинизирующий; M = самец; F = женский. * Скорость проводимости в срединных моторных аксонах в локтевом и лучезапястном сегменте. | ||||||||||||||||||||
| Возраст (лет) | 57 | 49 | 47 | 79 | 44 | 34 | 48 | 65 | 42 | 42 72 | 9045 FF | M | M | M | M | M | M | M | M | F |
| Класс Hughes45 | 2 9044 2 90442 | 2 | 2 | 2 | 1 | 1 | 1 | |||||||||||||
| Прочность APB (шкала MRC) | 4 | 4+ | 4– | 4– | 4– | 4 4 | 4– | 4 | 5 | 5 | 5 | |||||||||
| Клиническое состояние (симптоматическое) | Да | Да | Да | Да | Да | Да | Да | Да | Нет | Нет | Нет | |||||||||
| Утомляемость мышц | Да | Да | 9045Да | Да | Нет | Нет | Нет | |||||||||||||
| Теплочувствительность | Нет | Да | Да | Нет | Да | Нет | 9045 9045 №№ | |||||||||||||
| Продолжительность болезни (лет) | 2 | 2 | 20 | 0.25 | 4 | 0,5 | 5 | 1 | 4 | 12 | 8 | |||||||||
| Биопсия спинного нерва | DM | DM | ND | DM | ND | DM | ND | ND | ND | DM | DM | |||||||||
| Скорость проводимости (средняя) * | 48 м / с | 20 м / с | 10 м / с | 29 м / с 41 | / с | 43 м / с | 27 м / с | 48 м / с | 54 м / с | 44 м / с | 27 м / с | |||||||||
| . | Клинические характеристики . | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| APB = abductor pollicis brevis; ND = не выполнено; DM = демиелинизирующий; M = самец; F = женский. * Скорость проводимости в срединных моторных аксонах в локтевом и лучезапястном сегменте. | ||||||||||||||||||||
| Возраст (лет) | 57 | 49 | 47 | 79 | 44 | 34 | 48 | 65 | 42 | 42 72 | 9045 FF | M | M | M | M | M | M | M | M | F |
| Класс Hughes45 | 2 9044 2 90442 | 2 | 2 | 2 | 1 | 1 | 1 | |||||||||||||
| Прочность APB (шкала MRC) | 4 | 4+ | 4– | 4– | 4– | 4 4 | 4– | 4 | 5 | 5 | 5 | |||||||||
| Клиническое состояние (симптоматическое) | Да | Да | Да | Да | Да | Да | Да | Да | Нет | Нет | Нет | |||||||||
| Утомляемость мышц | Да | Да | 9045Да | Да | Нет | Нет | Нет | |||||||||||||
| Теплочувствительность | Нет | Да | Да | Нет | Да | Нет | 9045 9045 №№ | |||||||||||||
| Продолжительность болезни (лет) | 2 | 2 | 20 | 0.25 | 4 | 0,5 | 5 | 1 | 4 | 12 | 8 | |||||||||
| Биопсия спинного нерва | DM | DM | ND | DM | ND | DM | ND | ND | ND | DM | DM | |||||||||
| Скорость проводимости (средняя) * | 48 м / с | 20 м / с | 10 м / с | 29 м / с 41 | / с | 43 м / с | 27 м / с | 48 м / с | 54 м / с | 44 м / с | 27 м / с | |||||||||
Фиг.1
Кривые стимул – реакция. ( A ) Абсолютные данные (среднее ± стандартная ошибка среднего) и ( B ) нормализованные кривые (среднее) медианы моторных аксонов на запястье у 25 здоровых людей контрольной группы и 11 пациентов с ХВДП для двух длительностей стимула (0,2 и 1,0 РС). В B данные были нормализованы так, чтобы пороговый ток для 50% CMAP был равен 1,0. Пороговые токи намного выше, наклон кривых уменьшен, а разброс пороговых значений больше у пациентов ( B ).
Рис. 1
Кривые стимул – реакция. ( A ) Абсолютные данные (среднее ± стандартная ошибка среднего) и ( B ) нормализованные кривые (среднее) медианы моторных аксонов на запястье у 25 здоровых людей контрольной группы и 11 пациентов с ХВДП для двух длительностей стимула (0,2 и 1,0 РС). В B данные были нормализованы так, чтобы пороговый ток для 50% CMAP был равен 1,0. Пороговые токи намного выше, наклон кривых уменьшен, а разброс пороговых значений больше у пациентов ( B ).
Рис. 2
Данные «стимул – реакция» и «сила – продолжительность» для CMAP 50% от максимума (среднее ± стандартная ошибка среднего). ( A ) Абсолютный ток, необходимый для получения 50% CMAP для тестового стимула 0,2 и 1,0 мс у 11 пациентов с ХВДП, был примерно в 3 раза выше, чем у 25 здоровых контролей. ( B ) Среднее значение τ SD для 50% CMAP было на ~ 100 мкс больше у 25 здоровых контролей, чем у 11 пациентов ( P <0.001). ( C ) Средняя реобаза для 50% CMAP была намного ниже для 25 здоровых контролей, чем для 11 пациентов ( P = 0,004).
Рис. 2
Данные «стимул – реакция» и «сила – продолжительность» для CMAP 50% от максимума (среднее ± стандартная ошибка среднего). ( A ) Абсолютный ток, необходимый для получения 50% CMAP для тестового стимула 0,2 и 1,0 мс у 11 пациентов с ХВДП, был примерно в 3 раза выше, чем у 25 здоровых контролей. ( B ) Среднее значение τ SD для 50% CMAP было на ~ 100 мкс больше у 25 здоровых контролей, чем у 11 пациентов ( P <0.001). ( C ) Средняя реобаза для 50% CMAP была намного ниже для 25 здоровых контролей, чем для 11 пациентов ( P = 0,004).
Рис. 3
Прочностные характеристики. ( A ) τ SD и ( B ) реобаза для тестовых CMAP разного размера (10–90% от максимума) у 25 здоровых контролей и 11 пациентов (среднее ± стандартная ошибка среднего; в B , полосы ошибок меньше символов для контрольных данных).Τ SD был значительно короче на ~ 100 мкс у пациентов независимо от размера CMAP. Реобаза была значительно выше у пациентов независимо от размера CMAP. Обратите внимание на логарифмический масштаб реобазовых данных в B .
Рис. 3
Прочностные свойства. ( A ) τ SD и ( B ) реобаза для тестовых CMAP разного размера (10–90% от максимума) у 25 здоровых контролей и 11 пациентов (среднее ± стандартная ошибка среднего; в B , полосы ошибок меньше символов для контрольных данных).Τ SD был значительно короче на ~ 100 мкс у пациентов независимо от размера CMAP. Реобаза была значительно выше у пациентов независимо от размера CMAP. Обратите внимание на логарифмический масштаб реобазовых данных в B .
Рис. 4
Соотношение между логарифмом реобазы и логарифмом τ SD . ( A ) Средние данные для 10–90% CMAP для 11 пациентов с CIDP и 25 контрольных. Отношения в каждой группе сопоставимы, что указывает на поддержание обычных реципрокных отношений, наблюдаемых между τ SD и реобазой в нормальных аксонах.( B ) Данные для 50% CMAP у каждого из 11 пациентов ( R 2 = 0,56). Средние данные для 11 пациентов и 25 контрольных пациентов показаны закрашенным кружком и закрашенным квадратом соответственно. Средние значения для пациентов смещены вверх и влево по сравнению со значениями для контрольных субъектов.
Рис. 4
Связь между логарифмом реобазы и логарифмом τ SD . ( A ) Средние данные для 10–90% CMAP для 11 пациентов с CIDP и 25 контрольных.Отношения в каждой группе сопоставимы, что указывает на поддержание обычных реципрокных отношений, наблюдаемых между τ SD и реобазой в нормальных аксонах. ( B ) Данные для 50% CMAP у каждого из 11 пациентов ( R 2 = 0,56). Средние данные для 11 пациентов и 25 контрольных пациентов показаны закрашенным кружком и закрашенным квадратом соответственно. Средние значения для пациентов смещены вверх и влево по сравнению со значениями для контрольных субъектов.
Фиг.5
Цикл восстановления аксональной возбудимости после единственного кондиционирующего стимула (среднее значение ± стандартная ошибка среднего) для пациентов (белые кружки) и контрольных субъектов (темные кружки). Обратите внимание, что относительно рефрактерный период имел одинаковую продолжительность в обеих группах, но пороговые изменения были меньше у пациентов. На этом рисунке увеличение порога (то есть снижение возбудимости) нанесено вверх. Для элементов управления точка данных 2 мс (звездочка) основана на 23 объектах ( P = 0.001 в 2 мс; 0,03 при 2,5 мс).
Рис. 5
Цикл восстановления аксональной возбудимости после единственного кондиционирующего стимула (среднее значение ± стандартная ошибка среднего) для пациентов (белые кружки) и контрольных субъектов (темные кружки). Обратите внимание, что относительно рефрактерный период имел одинаковую продолжительность в обеих группах, но пороговые изменения были меньше у пациентов. На этом рисунке увеличение порога (то есть снижение возбудимости) нанесено вверх. Для элементов управления точка данных 2 мс (звездочка) основана на 23 объектах ( P = 0.001 в 2 мс; 0,03 при 2,5 мс).
Рис. 6
Пороговый электротонус с токами кондиционирования 100 мс (± 40% от безусловного порога). ( A ) Средние пороговые изменения, вызываемые подпороговыми деполяризующими или гиперполяризационными токами для 25 здоровых контролей и 10 пациентов с ХВДП. ( B ) Данные для 25 здоровых контролей (среднее значение ± 95% доверительный интервал). ( C ) Данные для 10 пациентов (среднее значение ± 95% доверительный интервал).В C стрелка указывает на нерегулярность на графике, потому что у трех пациентов 40% -ный деполяризующий ток превысил порог для наиболее возбудимых аксонов. На этом рисунке снижение порога (то есть увеличение возбудимости) нанесено вверх.
Рис. 6
Пороговый электротонус с токами кондиционирования 100 мс (± 40% от безусловного порога). ( A ) Средние пороговые изменения, вызываемые подпороговыми деполяризующими или гиперполяризационными токами для 25 здоровых контролей и 10 пациентов с ХВДП.( B ) Данные для 25 здоровых контролей (среднее значение ± 95% доверительный интервал). ( C ) Данные для 10 пациентов (среднее значение ± 95% доверительный интервал). В C стрелка указывает на нерегулярность на графике, потому что у трех пациентов 40% -ный деполяризующий ток превысил порог для наиболее возбудимых аксонов. На этом рисунке снижение порога (то есть увеличение возбудимости) нанесено вверх.
Рис. 7
Соотношения между током и порогом с использованием кондиционирующих токов длительностью 200 мс для здоровых людей ( A ) и пациентов ( B ).Интенсивность кондиционирующего тока систематически изменяли от 50% (деполяризация) до –100% (гиперполяризация) с шагом 10% (среднее значение ± 95% доверительные интервалы). Эти графики не показывают различий в приспособлении к токам деполяризации (верхние данные справа от кривых) или гиперполяризационным токам (нижние данные слева от кривых).
Рис. 7
Взаимосвязь между током и порогом с использованием кондиционирующих токов длительностью 200 мс для здоровых людей ( A ) и пациентов ( B ).Интенсивность кондиционирующего тока систематически изменяли от 50% (деполяризация) до –100% (гиперполяризация) с шагом 10% (среднее значение ± 95% доверительные интервалы). Эти графики не показывают различий в приспособлении к токам деполяризации (верхние данные справа от кривых) или гиперполяризационным токам (нижние данные слева от кривых).
Мы хотим поблагодарить профессора Дж. Д. Полларда и доктора Л. Дэвиса за доступ к пациентам в этом исследовании. Это исследование было поддержано Австралийским фондом рассеянного склероза, Национальным советом по здравоохранению и медицинским исследованиям Австралии и Мемориальным фондом Уэхара в Японии.
Список литературы
Bostock H. Зависимость силы от продолжительности возбуждения миелинизированного нерва: расчетная зависимость от параметров мембраны.
J. Physiol
(Лондон)1983
;341
:59
–74.Bostock H, Baker M. Доказательства двух типов калиевых каналов в моторных аксонах человека in vivo.
Brain Res
1988
;462
:354
–58.Bostock H, Bergmans J.Посттетанические изменения возбудимости и эктопические разряды в моторном аксоне человека.
Мозг
1994
;117
:913
–28.Bostock H, Grafe P. Зависимые от активности изменения возбудимости нормальных и демиелинизированных аксонов спинномозговых корешков крыс.
J. Physiol
(Лондон)1985
;365
:239
–57.Bostock H, Rothwell JC. Скрытое сложение моторных и сенсорных волокон периферического нерва человека.
J. Physiol
(Лондон)1997
;498
:277
–94.Bostock H, Sears TA, Sherratt RM. Пространственное распределение возбудимости и мембранного тока в нормальных и демиелинизированных нервных волокнах млекопитающих.
J. Physiol
(Лондон)1983
;341
:41
–58.Bostock H, Cikurel K, Burke D. Методы порогового отслеживания в исследовании периферических нервов человека. [Рассмотрение].
Мышечный нерв
1998
;21
:137
–58.Bowe CM, Kocsis JD, Waxman SG. Различия между вентральными и дорсальными спинными корешками млекопитающих в ответ на блокаду калиевых каналов во время созревания.
Proc R Soc Lond B Biol Sci
1985
;224
:355
–66.Брисмар Т. Электрические свойства изолированных демиелинизированных нервных волокон крысы.
Acta Physiol Scand
1981
;113
:161
–6.Cappelen-Smith C, Kuwabara S, Lin CS-Y, Mogyoros I, Burke D. Активно-зависимая гиперполяризация и блокировка проводимости при хронической воспалительной демиелинизирующей полинейропатии.
Ann Neurol
2000
;48
:826
–32.Cornblath DR, Asbury AK, Albers JW, Feasby TE, Hahn AF, McLeod JG и др. Критерии исследования для диагностики хронической воспалительной демиелинизирующей полинейропатии (ХВДП).
Неврология
1991
;41
:617
–18.Eng DL, Gordon TR, Kocsis JD, Waxman SG. Развитие чувствительности к 4-AP и TEA в миелинизированных нервных волокнах млекопитающих.
J Нейрофизиол
1988
;60
:2168
–79.England JD, Levinson SR, Shrager P.Иммуноцитохимические исследования натриевых каналов вдоль узловых и межузловых участков демиелинизированных аксонов. [Рассмотрение].
Microsc Res Tech
1996
;34
:445
–51.England JD, Happel LT, Liu ZP, Thouron CL, Kline DG. Аномальное распределение калиевых каналов в невромах человека.
Neurosci Lett
1998
;255
:37
–40.Хьюз Р.А., Ньюсом-Дэвис Дж. М., Перкин Г. Д., Пирс Дж. М.. Контролируемое исследование преднизолона при острой полинейропатии.
Ланцет
1978
;2
:750
–3.Inglis JT, Leeper JB, Wilson LR, Gandevia SC, Burke D. Развитие блока проводимости в отдельных аксонах человека после повреждения фокального нерва.
J. Physiol
(Лондон)1998
;513
:127
–33.Каджи Р. Физиолого-технические основы тестирования периферических нервов и мотонейронов. В: Кимура Дж., Кадзи Р., редакторы. Физиология БАС и родственных заболеваний. Амстердам: Эльзевир; 1997 г.п. 85–98.
Кадзи Р., Кодзима Ю. Патофизиология и клинические варианты мультифокальной моторной невропатии. В: Кимура Дж., Кадзи Р., редакторы. Физиология БАС и родственных заболеваний. Амстердам: Эльзевир; 1997. стр. 85–98.
Каджи Р., Босток Н., Кохара Н., Мурас Н., Кимура Дж. Активно-зависимый блок проводимости при мультифокальной моторной невропатии.
Мозг
2000
;123
:1602
–11.Кирнан М.К., Босток Х. Влияние поляризации мембраны и ишемии на возбудимость моторных аксонов человека.
Мозг
2000
;123
:2542
–51.Кирнан М.К., Бурк Д., Андерсен К.В., Босток Х. Множественные меры аксональной возбудимости: новый подход в клинических испытаниях.
Мышечный нерв
2000
;23
:399
–409.Кирнан М.К., Цикурел К., Босток Х. Влияние температуры на возбудимость моторных аксонов человека.
Мозг
2001
;124
:816
–25.Kuwabara S, Cappelen-Smith C, Lin CS-Y, Mogyoros I, Bostock H, Burke D. Свойства возбудимости срединных и малоберцовых моторных аксонов.
Мышечный нерв
2000
;23
:1365
–73.McDonald WI. Патофизиология проводимости центральных нервных волокон. В: Desmedt JE, редактор. Зрительные вызванные потенциалы человека: новые разработки. Оксфорд: Clarendon Press; 1977. с. 427–37.
Meulstee J, Darbas A, van Doorn PA, van Briemen L, van der Meché FG.Снижение электрической возбудимости периферических нервов при демиелинизирующих полинейропатиях.
J Neurol Neurosurg Psychiatry
1997
;62
:398
–400.Mogyoros I, Kiernan MC, Burke D. Прочностно-длительные свойства периферического нерва человека.
Мозг
1996
;119
:439
–47.Mogyoros I, Lin CS-Y, Kuwabara S, Cappelen-Smith C, Burke D. Силовые свойства и их зависимость от напряжения как меры пороговой проводимости в узле Ранвье одиночных моторных аксонов.
Мышечный нерв
2000
;23
:1719
–26.Schwarz JR, Corrette BJ, Mann K, Wiethölter H. Изменения распределения ионных каналов в миелинизированных нервных волокнах крыс с экспериментальным аллергическим невритом.
Neurosci Lett
1991
;122
:205
–9.Шрагер П. Натриевые каналы в отдельных демиелинизированных аксонах млекопитающих.
Brain Res
1989
;483
:149
–54.Ваксман SG. Клиническое течение и электрофизиология рассеянного склероза. В: Ваксман С.Г., редактор. Функциональное восстановление при неврологических заболеваниях. Adv Neurol, Vol. 47. Нью-Йорк: Raven Press; 1988. с. 157–84.
Waxman SG, Kocsis JD, Black JA. МРНК натриевых каналов III типа экспрессируется в сенсорных нейронах спинного мозга эмбриона, но не взрослых, и повторно экспрессируется после аксотомии.
J нейрофизиол
1994
;72
:466
–70.Waxman SG, Cummins TR, Dib-Hajj S, Fjell J, Black JA.Натриевые каналы, возбудимость первичных сенсорных нейронов и молекулярные основы боли. [Рассмотрение].
Мышечный нерв
1999
;22
:1177
–87.Weiss C. Sur la possible de rendre comparebles entre eux les appareils à servant l’excitation électrique.
Arch Ital Biol
1901
;35
:418
–46.© Издательство Оксфордского университета 2001
Свойства мембраны, участвующие в стимулированном кальцием высвобождении микрочастиц из плазматических мембран клеток лимфомы S49
Это исследование ответило на вопрос о том, применимы ли биофизические механизмы выделения микрочастиц, обнаруженные в тромбоцитах и эритроцитах, к ядросодержащим клеткам: нарушение цитоскелета, отток калия, трансбилирование миграция фосфолипидов и разупорядочение мембран.Ионофор кальция, иономицин, разрушает актиновый цитоскелет клеток лимфомы S49 и вызывает быстрое высвобождение микрочастиц. Это высвобождение было значительно подавлено вмешательствами, которые нарушали ток калия, активируемого кальцием. Высвобождение микрочастиц также было значительно снижено в линии лимфоцитов, дефицитной по экспрессии скрамблазы, фермента, ответственного за стимулируемое кальцием разрушение нормальной асимметрии трансбислоя фосфолипидов. Спасение функции скремблирования при высокой концентрации ионофора также привело к усиленному улавливанию частиц.Влияние физических свойств мембран было устранено путем изменения экспериментальной температуры (32–42 ° C). Наблюдалась значительная положительная тенденция скорости высвобождения микрочастиц в зависимости от температуры. Эксперименты по флуоресценции с триметиламмонийдифенилгексатриеном и Патманом показали значительное снижение уровня видимого порядка мембран в этом температурном диапазоне. Эти результаты продемонстрировали, что биофизические механизмы, участвующие в высвобождении микрочастиц из тромбоцитов и эритроцитов, применимы также к лимфоцитам.
1. Введение
Микрочастицы представляют собой небольшие везикулярные структуры (0,1–1 мкм в диаметре м), образующиеся и высвобождаемые экзоцитарным блеббированием плазматической мембраны клетки из различных типов клеток, включая тромбоциты, эритроциты, лейкоциты, эндотелиальные клетки, фибробласты. , эпителиальные и опухолевые клетки [1–4]. Микрочастицы обнаруживаются в основном в крови здоровых людей [5], и дополнительные количества могут выделяться из клеток в результате сигналов активации и / или во время апоптоза [3, 6].Микрочастицы, по-видимому, действуют как посредники межклеточной коммуникации. Например, они могут вызывать активацию клеток или апоптоз в зависимости от мишени [7–10]. Кроме того, они участвуют в регуляции воспаления, коагуляции и презентации антигена [3, 4, 6]. Следовательно, они могут играть роль в патогенезе аутоиммунных заболеваний и воспалительных расстройств. Более того, повышенные уровни микрочастиц обычно наблюдаются в крови пациентов с различными болезненными состояниями, такими как различные сердечно-сосудистые заболевания, включая атеросклероз, диабет, некоторые инфекционные заболевания, такие как ВИЧ, лихорадка Эбола и церебральная малярия, а также при некоторых формах рака [2, 3 , 6, 9, 11, 12].
Хотя маленькие микрочастицы (менее 100 нм), по-видимому, имеют эндосомное происхождение, большинство из них крупнее (100–1000 нм) и отслаиваются в процессе «обратного почкования» [13]. В последнем случае высвобождение инициируется устойчивым повышением внутриклеточного кальция [1–3, 6]. Механизм стимулируемого кальцием высвобождения микрочастиц наиболее широко изучался на тромбоцитах и эритроцитах, где высвобождение требует реорганизации цитоскелета, транслокации фосфатидилсерина (PS) и других фосфолипидов на внешнюю поверхность клеточной мембраны и повышенной проницаемости для калия с ассоциированной осмотические эффекты [14–28].Кроме того, недавняя работа с эритроцитами продемонстрировала, что отделение везикул также зависит от физических характеристик клеточной мембраны, которые могут быть обнаружены с помощью флуоресцентных мембранных зондов, чувствительных к порядку и организации фосфолипидов в бислое [29].
Степень, в которой эти различные механизмы применимы к ядросодержащим клеткам, еще недостаточно изучена [3]. Существуют некоторые доказательства, чтобы предположить, что изменения цитоскелета необходимы во всех клетках, которые высвобождают микрочастицы [24-27], и разумно предположить, что прикрепления цитоскелета должны быть разрушены для того, чтобы части мембраны были оторваны.Остается неизвестным, необходимы ли другие механизмы (воздействие ФС, трансмембранный поток калия и благоприятные биофизические свойства). Это исследование было разработано для устранения этого дефицита с использованием клеток лимфомы S49 в качестве экспериментальной модели.
2. Материалы и методы
2.1. Реагенты
Иономицин, 1- (триметиламмонийфенил) -6-фенил-1,3,5-гексатриен п-толуолсульфонат (TMA-DPH), конъюгат фаллоидина Alexa Fluor 488 и 6-гексадеканоил-2 — (((2- ( триметиламмоний) этил) метил) амино) нафталин хлорид (патман) получали от Life Technologies (Гранд-Айленд, Нью-Йорк, США).Иономицин и MC540 растворяли в диметилсульфоксиде (ДМСО) в качестве исходных растворов, а ТМА-DPH суспендировали в диметилформамиде. Хинин был приобретен у Sigma (Сент-Луис, Миссури, США).
2.2. Клеточный препарат
Клетки лимфомы мыши S49 культивировали в DMEM (10% лошадиной сыворотки) при 37 ° C в увлажненном воздухе (10% CO 2 ). Клетки лимфомы Беркитта человека Raji выращивали при 5% CO 2 в RPMI (10% фетальная бычья сыворотка и L-глутамин). Перед экспериментами, если не указано иное, клетки выделяли центрифугированием, затем промывали и суспендировали в MBSS (134 мМ NaCl, 6.2 мМ KCl, 1,6 мМ CaCl 2 , 18,0 мМ Hepes, 13,6 мМ глюкозы и pH 7,4 при 37 ° C) при плотности 0,4–3,0 × 10 6 клеток / мл. Если не указано иное, эксперименты проводились при 37 ° C.
2.3. Флуоресцентная спектроскопия и светорассеяние
Промытые образцы клеток (2 мл) уравновешивали в течение 5 минут в ячейках для образцов кварцевого флуориметра либо в Fluoromax 3 (Horiba, Эдисон, Нью-Джерси, США), либо в PC-1 (ISS, Champaign, IL, USA, измерения анизотропии) спектрофлуорометра перед сбором данных.Однородность образцов поддерживалась магнитным перемешиванием, а температуру регулировали с помощью циркуляционных водяных бань.
Высвобождение микрочастиц определяли по светорассеянию при 500 нм [15]. После начала сбора данных добавляли иономицин (300 нМ) и определяли скорость высвобождения микрочастиц как наклон увеличения интенсивности светорассеяния. То, что эта процедура оценивает высвобождаемые из клеток микрочастицы, было установлено ранее для клеток S49 с помощью дифференциального центрифугирования и анализа липидов [30].Обратите внимание, что обычно многие из высвобождаемых микрочастиц имеют размер более 500 нм и, следовательно, вызывают повышение интенсивности светорассеяния. Однако в редких случаях размер микрочастиц всегда меньше 500 нм, и в этих случаях выпадение частиц приводит к отрицательному отклонению светорассеяния из-за сжатия клеток после высвобождения.
Флуоресцентное излучение патмана наблюдали при 435 и 500 нм (конечная 250 нМ, возбуждение = 350 нм) при быстром (разрешение 3 с) слипании зеркала эмиссионного монохроматора.Зонд добавляли к образцам клеток после измерения интенсивности фона в течение 100 с, а затем отслеживали интенсивность флуоресценции в течение нескольких сотен секунд до достижения устойчивого состояния. Полярность среды Патмана оценивалась путем вычисления обобщенной поляризации (GP) следующим образом [31]: где и — интенсивности излучения при 435 и 500 нм. Данные по интенсивности были сглажены нелинейной регрессией до произвольной функции (суммы двух экспонент) до расчета GP.
Стационарная анизотропия ТМА-DPH (конечная концентрация 250 нМ, возбуждение = 350, испускание = 452) оценивалась с использованием поляризаторов Глана-Томпсона. Зонд уравновешивали образцами клеток в течение 10 мин до сбора данных с поляризаторами возбуждения и излучения, попеременно ориентированными параллельно, а затем перпендикулярно друг другу. Анизотропия была рассчитана, как описано ранее, и по крайней мере 20 точек были усреднены при определении значений для фигур и статистического анализа [32].
2.4. Флуоресцентная визуализация актинового цитоскелета
Клетки промывали и обрабатывали иономицином, как в других экспериментах. Обработанные клетки затем одновременно фиксировали, пермеабилизировали и окрашивали флуоресцентным фаллоидином (Alexa Fluor © 488) в соответствии с протоколом производителя (Life Technologies). После размещения на предметных стеклах для микроскопии клетки окрашивали раствором, содержащим 165 нМ фаллоидина, 3,7% формальдегида, 1% бычьего сывороточного альбумина и 0,1 мг / мл лизо-ПК (1-пальмитоил-2-гидрокси-sn-глицеро-3. -фосфохолин) в течение 20 мин при 4 ° C.Затем предметные стекла промывали буфером перед установкой покровных стекол. Изображения были получены на конфокальном лазерном сканирующем микроскопе Olympus FluoView FV 300 с использованием линзы объектива с масляной иммерсией 60x. Также был применен 3-кратный цифровой зум. Источником возбуждающего света служил аргоновый лазер 488 нм, а на эмиссионном детекторе использовался полосовой фильтр 505–525 нм.
3. Результаты
На рис. 1 представлены флуоресцентные изображения актинового цитоскелета клеток лимфомы S49 до (рис. 1 (а)) и после (рис. 1 (b)) инкубации с ионофором кальция (иономицин).Как и ожидалось, основываясь на наблюдениях с другими типами клеток [21-27], цитоскелет разрушался быстро (в течение 10 минут), на что указывало сокращение протяженных параллельных волокон и увеличение рассеянных ярко окрашенных агрегатов актина. Как показано на рисунке 2, это разрушительное действие иономицина сопровождалось увеличением интенсивности света, рассеянного образцом. Это повышение интенсивности началось через 50 с после добавления иономицина и продолжалось еще 100 с. Предыдущая работа показала, что изменение светорассеяния отражает высвобождение мембранных частиц [15, 30].Фигура 3 демонстрирует, что разница в интенсивности светорассеяния до и после обработки иономицином была воспроизводимой и статистически значимой (тест на одном образце с). Более того, повторение эксперимента в присутствии хелатора кальция (EGTA) подавляло ответ на иономицин и, таким образом, продемонстрировало, что высвобождение микрочастиц зависит от кальция и, следовательно, не является артефактом самого ионофора (рис. 3).
3.1. Роль калиевых каналов
Чтобы определить, требуется ли клеткам S49 активированный кальцием поток калия для высвобождения микрочастиц, аналогичный тромбоцитам и эритроцитам, эксперимент, показанный на фиг. 2, был повторен в присутствии пониженного градиента калия.Кроме того, эксперимент был повторен с нормальной концентрацией калия в присутствии блокатора кальциевых каналов хинина [14–16]. Рисунок 3 показывает, что оба вмешательства привели к снижению количества микрочастиц, выделяемых из клеток, примерно на 80%. Эти результаты показали, что ток калия, активированного кальцием, был необходимым компонентом высвобождения частиц. Предположительно, этот ток необходим для осмотического уменьшения объема клетки, чтобы приспособиться к уменьшенной площади поверхности мембраны, связанной с отрывом микрочастиц [33, 34].
3.2. Потеря мембранной липидной асимметрии
Предыдущие генетические данные и эксперименты с фармакологическим ингибитором скрамблазы (R5421, [35]) продемонстрировали на эритроцитах и тромбоцитах, что активность этого фермента важна для выделения микрочастиц [19, 29, 36]. Поскольку ингибитор скрамблазы больше не доступен, потребность в миграции PS от внутреннего к внешнему листку клеточной мембраны была протестирована здесь для клеток лимфомы с использованием линии лимфомы Raji, которая недостаточна по активности скрамблазы [37-40] .Белая полоса на фиг. 3 показывает ответ на иономицин в клетках Raji. Стимулированное иономицином изменение интенсивности светорассеяния в клетках Raji составляло только 16% от наблюдаемого в клетках S49. Более того, инкубация клеток Raji с более высокой дозой иономицина, достаточной для восстановления некоторой способности клеток перемещать PS [40], приводила к двукратному увеличению кажущейся скорости высвобождения микрочастиц (,,). Эти данные доказывают, что воздействие PS также важно для высвобождения микрочастиц в ядросодержащих клетках.
3.3. Membrane Lipid Order
Недавние исследования показали роль порядка и текучести мембранных липидов в определении способности эритроцитов высвобождать микровезикулы в ответ на кальций [29]. Чтобы изучить эту возможность для клеток S49, были проведены эксперименты при различных температурах от 32 до 42 ° C. Как показано на рисунке 4 (а), скорость высвобождения микрочастиц монотонно возрастает с температурой. Линейный регрессионный анализ показал, что эта тенденция была статистически значимой (см. Легенду).Контрольные эксперименты по оценке других известных эффектов иономицина (нарушение цитоскелета, чувствительность к фосфолипазе) продемонстрировали, что препарат был одинаково эффективен во всем этом температурном диапазоне (не показан). Следовательно, влияние температуры, по-видимому, было скорее на процесс высвобождения, чем на эффективность лекарства.
Относительный уровень порядка мембран также оценивали при этих температурах с помощью флуоресцентной спектроскопии с использованием анизотропии патмана GP и TMA-DPH. Данные с обоими зондами (Рисунки 4 (b) и 4 (c)) показали значительное уменьшение видимого порядка мембран.Соответственно, наблюдалась сильная корреляция между уровнем порядка, обнаруживаемым этими зондами, и скоростью высвобождения везикул (,, температуры, по линейной регрессии, значения применимы как к GP Патмана, так и к анизотропии TMA-DPH). В целом, рисунок 4 поддерживает гипотезу о том, что физические свойства мембран играют роль в высвобождении микрочастиц как для ядерных, так и для неядерных клеток.
4. Обсуждение
Похоже, что основные механизмы, управляющие выделением микрочастиц в тромбоцитах и эритроцитах, могут широко применяться ко всем типам клеток.Это открытие означает, что высвобождение микрочастиц может быть просто следствием снижения стабильности клеточной мембраны. Следовательно, факторы, регулирующие процесс высвобождения, имеют биофизическую природу и представляют собой изъятие элементов, которые обычно поддерживают стабильность. Основываясь на этом исследовании и исследованиях, посвященных тромбоцитам и эритроцитам, эти критические элементы включают осмотический баланс клеток, прикрепления цитоскелета, асимметричное распределение фосфолипидов по двум сторонам мембраны и эластичные свойства бислоя [14–27, 29 , 41, 42].
Важность осмотического баланса очевидна из-за сопутствующего воздействия на объем клеток. Для компенсации потери площади поверхности плазматической мембраны по мере высвобождения микрочастиц потребуется уменьшение объема клетки. Более того, изменение объема предположительно будет способствовать отрастанию мембран из-за стресса, вызванного несоответствием площади поверхности. В случае высвобождения частиц, вызванного кальцием, уменьшение объема, по-видимому, связано с оттоком калия.
Как показано на Рисунке 1, изменения в актиновом цитоскелете сопровождают приток кальция, как и ожидалось [21-27].Попытки проверить важность этого события посредством фармакологического ингибирования изменений цитоскелета (например, ингибирования кальпаина) не увенчались успехом, вероятно, из-за дублирующих механизмов действия кальция [3]. В эритроцитах и тромбоцитах, где механизмы регуляции проще, ингибирования кальпаина достаточно, чтобы нарушить высвобождение микрочастиц [15, 22, 23, 28]. В той степени, в которой эти находки широко применимы ко всем типам клеток [24-27], они подразумевают, что одна важная роль ассоциированного с мембраной цитоскелета состоит в поддержании стабильности и предотвращении высвобождения частиц.
Роль трансбислойной асимметрии видов фосфолипидов в поддержании стабильности мембран кажется менее очевидной. Потеря этой асимметрии во время внутреннего накопления кальция приводит к обнажению ФС на внешней поверхности. Этому воздействию уделялось много внимания из-за роли PS как сигнального механизма в гемостазе и распознавании апоптотических клеток макрофагами [43]. Почему внешнее воздействие этого липида допустимо для высвобождения пузырьков, неясно. Фактически, может оказаться, что на самом деле критической проблемой является снижение PS внутри мембраны.Поскольку некоторые белки с C2-подобными доменами участвуют в закреплении цитоскелета и мембраны [44], снижение PS на поверхности внутриклеточной мембраны может приводить к потере критических взаимодействий белков, что приводит к снижению стабильности мембраны. Это объяснение могло бы объяснить, почему движение такого второстепенного компонента может иметь такое большое влияние на мембрану. Более того, возможно, что PS не является решающим или единственным участником в разрешении высвобождения микрочастиц, поскольку нагрузка кальцием также будет приводить к внешнему воздействию фосфатидилэтаноламина и внутриклеточному накоплению фосфатидилхолина через ингибирование транслоказы аминофосфолипидов и активацию скрамблазы [3].
Роль порядка мембран отличается от роли калиевого тока, разрушения цитоскелета и активации скрамблазы. Кажется, что каждый из последних трех необходим, хотя по отдельности недостаточен для высвобождения микрочастиц. Напротив, порядок мембран, по крайней мере, на уровне, доступном для экспериментальных манипуляций в живых клетках, функционировал только как модулятор скорости высвобождения. Только минимальная тенденция в видимом количестве выделяемых мембранных частиц наблюдалась во всем диапазоне температур, что позволяет предположить, что существует предел того, сколько выделяется или может быть высвобождено (по линейной регрессии, –15 на температуру, 83 балла).
Кажется вероятным, что вклад порядка мембраны связан с эластичностью мембраны. Предположительно, снижение эластичности при повышении температуры создает гибкость мембраны, допускающую деформацию, достаточную для прорастания и высвобождения микрочастиц [41, 42]. Кажущаяся верхняя граница количества выделяемых частиц может определяться величиной осмотически индуцированного изменения объема и / или степенью цитоскелетного изменения. Предел может быть ключевым для выживания клеток, поскольку не все события, приводящие к отщеплению микрочастиц, связаны с гибелью клеток [3].
5. Выводы
Результаты этого исследования демонстрируют, что биофизические механизмы, участвующие в высвобождении микрочастиц в эритроцитах и тромбоцитах, вероятно, широко применимы ко всем типам клеток. К ним относятся отток ионов калия (предположительно с сопутствующими осмотическими эффектами), потеря асимметрии мембранных фосфолипидов и нарушение цитоскелета. Более того, уровень липидного порядка мембраны, по-видимому, модулирует процесс высвобождения, при этом более высокие скорости высвобождения происходят из более жидкой мембраны.Этот очевидный эффект порядка мембран предполагает, что условия, в которых эти физические свойства изменяются, могут способствовать усиленному или несоответствующему отрыву микрочастиц. Очевидный пример — во время апоптоза, когда клеточная мембрана становится неупорядоченной и более жидкой до образования пузырей на мембране и отрыва микрочастиц [45]. В качестве второго примера недавние исследования уровней микрочастиц в крови глубоководных дайверов показали, что частицы поднимаются вверх после декомпрессии после погружения [46].Это снижение давления, несомненно, повлияет на физические свойства клеточной мембраны, аналогично повышению температуры на Рисунке 4. Кроме того, в нескольких отчетах указывалось, что плазматическая мембрана некоторых опухолевых клеток более неупорядочена, чем у соответствующих нетрансформированных. клетки [47–50]. Это повышает вероятность того, что частицы, выделяемые этими клетками в большем количестве, могут распространять сигналы от опухоли, которые могут повлиять на патогенез заболевания.
Конфликт интересов
Конфликт интересов относительно публикации данной статьи отсутствует.
Взаимосвязь между твином и свойствами мембраны и устойчивостью к высокому давлению Lactobacillus plantarum | BMC Microbiology
Бактерии и условия культивирования
Lactobacillus plantarum Штамм TMW 1.708 хранился при -80 ° C в смеси 1: 1 80% глицерина и модифицированной среды MRS (mMRS) (10 г L — 1 пептон из казеина, 5 г L — 1 мясной экстракт, 5 г L — 1 дрожжевой экстракт, 4 г L — 1 KH 2 PO 4 , 2.6 г л -1 K 2 HPO 4 * 3 H 2 O, 3 г л -1 NH 4 Cl, 0,5 г л -1 цистеин-HCl, 1 г л -1 Твин 80, 7,5 г л -1 глюкоза, 7,5 г л -1 фруктоза, 0,1 г л -1 MgSO 4 * 7 H 2 O, 0,05 г л -1 MnSO 4 * 4 H 2 O, pH 6,2) [22]. Глюкозу и фруктозу автоклавировали отдельно. Исходный раствор 1000 × MgSO 4 * 7 H 2 O и MnSO 4 * 4 H 2 O стерилизовали фильтрованием (0.Размер пор 2 мкм, Зарштедт, Нюрнбрехт, Германия). Оба раствора добавляли в среду после автоклавирования. Для активации штамма полную петлю криокультуры переносили в среду mMRS, из которой исключили Tween 80 (mMRS-). Культуру инкубировали при 30 ° C в течение ночи. Ночная культура использовалась в качестве инокулята в экспериментах.
Среда mMRS, содержащая разные типы твинов
Lactobacillus plantarum выращивалась либо в mMRS-, либо в mMRS, содержащей 1 г L -1 Tween 20 (mMRST20), Tween 40 (mMRST40), Tween 60 (mMRST60) или Tween 80 (мМРСТ80).Все типы твинов были приобретены в компании Merck (Дармштадт, Германия). Различные типы Твина солюбилизировали в mMRS- в концентрации 10 г L -1 , стерилизовали фильтрованием (размер пор 0,2 мкм, Sarstedt, Nürnbrecht, Германия) и, наконец, добавляли к mMRS-, чтобы получить концентрацию 1 г. Л — 1 .
Среда mMRS, содержащая свободные жирные кислоты
Свободные жирные кислоты, т.е. стеариновая кислота (Merck Schuchard, Hohenbrunn, Германия), олеиновая кислота (Merck Darmstadt, Германия), линолевая кислота (Sigma, Steinheim, Германия), линоленовая кислота (Sigma, Steinheim, Германия), пальмитиновая кислота (Merck Schuchard, Hohenbrunn, Германия), пальмитолеиновая кислота (Fluka Sigma-Aldrich, St Louis, MO, USA), миристиновая кислота (Merck Schuchard, Hohenbrunn, Германия) или лауриновая кислота (Merck, Дармштадт, США). Германия) солюбилизировали в 95% этаноле до концентрации 50 мМ.Любой из этих исходных растворов добавляли 1: 1000 к mMRS-, чтобы получить конечную концентрацию жирных кислот 50 мкМ.
Транскриптомный анализ
Чтобы исследовать влияние Твина 80 на метаболизм L. plantarum TMW 1.708, оценивали транскриптомный ответ на добавление в среду твина 80. Для этого стерильный mMRS- инокулировали (1% ( v / v)) ночной культурой TMW 1.708 и инкубировали при 30 ° C в течение 24 часов. Еще 9 мл mMRS- инокулировали 1% (об. / Об.) Этой 24-часовой культуры и выращивали при 30 ° C в течение 4 часов с последующим добавлением 1 мл mMRS- или mMRS, содержащих 10 г L -1. Твин 80.Транскрипцию останавливали через 0,5 ч инкубации при 30 ° C добавлением к культуре реагента RNAprotect Bacteria Reagent (Qiagen, Hilden, Германия). После этого мРНК выделяли и очищали с использованием мини-набора RNeasy (Qiagen, Hilden, Германия) в соответствии с протоколом производителя. Конечную концентрацию РНК определяли с помощью спектрометрии поглощения света с использованием устройства NanoDrop ™ (Wilmington, DE, USA). Затем образцы отправляли в GATC Biotech (Констанс, Германия) для секвенирования РНК. Данные секвенирования анализировали с помощью программы Rockhopper на основе генома L.plantarum TMW 1.708 (биопробы: SAMN05805046 [23]) [24, 25]. Считалось, что гены с скорректированными значениями p ниже 0,05 демонстрируют значительно разные уровни экспрессии. Квантили 2,5% с наибольшим увеличением и снижением уровня экспрессии рассматривались для дальнейшего исследования.
Исследование параметров роста
Чтобы оценить влияние Твина 80 на характерные параметры роста L. plantarum TMW 1.708, были записаны кривые роста с помощью измерения OD 600 .В дополнение к Tween 80, в исследование были включены три дополнительных типа Tween, а именно Tween 20, Tween 40 и Tween 60, которые характеризуются лауриновой кислотой, пальмитиновой кислотой и стеариновой кислотой в качестве их специфической жирной кислоты соответственно. Для этого mMRS-, mMRST20, mMRST40, mMRST60 и mMRST80 инокулировали (1% ( v / v)) 24-часовой культурой TMW 1,708 в mMRS-. Затем аликвоту каждой инокулированной среды (150 мкл на лунку) переносили в 96-луночный планшет (стерильный, прозрачный, F-дно, Sarstedt, Nürnbrecht, Германия).Каждую лунку покрывали 50 мкл стерильного парафинового масла, чтобы избежать испарения. Планшет инкубировали при 30 ° C в планшет-ридере FLUOStar Omega (BMG Labtech, Ортенберг, Германия) в течение 30 часов. Оптическую плотность при 600 нм (OD 600 ) измеряли каждые 30 мин после перемешивания при 200 об / мин в течение 30 с.
Определение состава мембранных жирных кислот
Для определения профилей клеточных жирных кислот стерильный mMRS- инокулировали 1% ( v / v) ночной культуры TMW 1.708 и инкубировали при 30 ° C в течение 24 часов. Свежий mMRS- или mMRST20 / 40/60/80 инокулировали (1% (об. / Об.)) 24-часовой культурой и инкубировали при 30 ° C в течение еще 24 часов, чтобы получить плотность клеток приблизительно 10 9 образующих колонию ед. (КОЕ) мл — 1 . Клетки собирали центрифугированием (5000 × g, 25 ° C, 5 мин), трижды промывали раствором Рингера-крепости и, наконец, сушили вымораживанием с использованием системы сублимационной сушки FreeZone Plus 2,5 л (Labonco, Канзас-Сити, Миссури, США. ). Лиофилизат хранили в атмосфере N 2 .Анализы жирных кислот были выполнены Службой идентификации DSMZ (Брауншвейг, Германия).
Обработка HHP
Для обработок HHP клетки, выращенные в соответствующей среде при 30 ° C в течение 24 ч, центрифугировали (5.000 × g, 25 ° C, 5 мин), промывали один раз в имидазол / фосфатном буфере (IPB, 0,1 г L -1 KH 2 PO 4 , 4,45 г L -1 NA 2 HPO 4 * 2 H 2 O, 1,7 г L -1 имидазол, pH 7,0) и , наконец, ресуспендировали в IPB, чтобы получить 10 7 –10 8 КОЕ мл — 1 для экспериментов по инактивации и 10 8 –10 9 КОЕ мл — 1 для экспериментов, исследующих метаболическую активность, белок высвобождение и проницаемость мембраны для обеспечения достаточной силы сигнала во время измерений.Аликвоту 600 мкл клеточной суспензии переносили в криохвосты (флаконы Nunc CryoTube ™ емкостью 0,5 мл, внутренняя резьба, Thermo Fisher Scientific, Уолтем, Массачусетс, США). Были приняты меры, чтобы избежать попадания пузырьков воздуха. Образцы находились под давлением в двух параллельно соединенных емкостях под давлением объемом 7 мл, снабженных термостатирующими рубашками (установка высокого давления TMW-RB, описанная ранее [26, 27]). В качестве жидкости, передающей давление, использовали смесь 70% полиэтиленгликоля 400 (Roth, Карлсруэ, Германия) и 30% деионизированной воды.Температуру сосуда поддерживали постоянной на уровне 25 ° C (FC 600; JULABO, Зельбах, Германия). Перед началом линейного изменения давления образцы инкубировали в течение 5 минут в сосуде высокого давления для достижения желаемой начальной температуры. Скорость сжатия и декомпрессии поддерживалась постоянной и составляла 200 МПа мин. — 1 . Комбинации целевого давления / времени выдержки были выбраны с учетом их способности инактивировать значительную часть клеток L. plantarum в популяции и указаны индивидуально для каждого эксперимента в разделе результатов.
Влияние HHP на жизнеспособность клеток
Контрольные образцы под давлением и без давления разбавляли изотоническим раствором триптона с добавлением Antifoam B (145 мМ NaCl, 14 г L — 1 триптон, 0,01% ( v / v) Antifoam B Эмульсия). Серийные разведения наносили на чашки с mMRS с добавлением 15 г агара L -1 с использованием стеклянных шариков. Для определения сублетального повреждения в агар добавляли 7% NaCl ( w / против ), а максимальная неингибирующая концентрация, согласно литературным данным [28], была определена для L.plantarum TMW 1.708 в отдельном эксперименте (данные не показаны). Планшеты инкубировали в течение 72 часов при 30 ° C для восстановления клеток и образования колоний. Эксперименты по инактивации под высоким давлением проводили, по крайней мере, в трех независимых повторах.
Влияние HHP на метаболическую активность
Для определения метаболической активности после обработки HHP готовили исходный раствор (70 мМ) соли резазурин-Na (Serva, Heidelberg, Германия) в IPB, разбавленный до 1 мкМ в IPB, содержащем 15 г L -1 глюкозы и 15 г L -1 фруктозы, стерилизованные на фильтре (0.2 мкм, Sarstedt, Nürnbrecht, Germany), давая использованный рабочий раствор резазурина. Для измерения метаболической активности 100 мкл рабочего раствора резазурина смешивали с 100 мкл обработанной давлением или необработанной клеточной суспензии на белых 96-луночных микротитрационных планшетах (F-bottom, Nunc, Thermo Fisher Scientific, Waltham, MA, USA) и определяли интенсивность флуоресценции. (ex / em: 544/590 нм) измеряли во время инкубации при 30 ° C на считывающем устройстве для микропланшетов Omega FLUOStar (BMG Labtech, Ортенберг, Германия) каждые 120 с в течение 30 мин.Анализ основан на том факте, что синий краситель резазурин восстанавливается клеточными ферментами до красного флуоресцентного резоруфина. Реакция протекает быстрее, чем больше метаболически активных клеток присутствует в образце, поэтому метаболическую активность можно определить по наклону увеличения флуоресценции. Увеличение интенсивности флуоресценции с течением времени, выраженное в процентах от количества необработанных клеток, использовали для оценки индуцированных HHP изменений метаболической активности клеток L. plantarum .
Влияние HHP на высвобождение белка
Для определения высвобождения белка при обработке под высоким давлением использовали аликвоту 500 мкл обработанного давлением образца (10 8 –10 9 КОЕ мл — 1 ). переносили в стерильную реакционную пробирку и центрифугировали (2800 × g, 5 ° C, 15 мин). Супернатант стерилизовали фильтрованием (размер пор 0,2 мкм, Sarstedt, Nürnbrecht, Германия), и концентрацию белка измеряли на черных 96-луночных микротитровальных планшетах (F-дно, Greiner bio-one, Frickenhausen, Германия) с использованием Pierce ™ Набор для анализа Coomassie Plus (Bradford) (ThermoFisher, Waltham, MA, USA) в соответствии с протоколом микро MTP, предоставленным производителем.Образцы инкубировали при 25 ° C в темноте в течение 10 минут и оптическую плотность при 595 нм измеряли в планшет-ридере FLUOStar Omega (BMG LABTECH GmbH, Ортенберг, Германия). Бычий сывороточный альбумин, входящий в комплект, использовали для построения стандартной кривой для концентраций белка от 0 до 25 мкг / мл -1 .
Влияние HHP на проницаемость мембраны
Проницаемость мембраны определяли с использованием флуоресценции пропидия иодида (PI), как описано ранее [29]. Для определения временной проницаемости мембраны суспензии клеток (10 8 –10 9 КОЕ мл — 1 ) в IPB смешивали с PI (Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA) до конечной концентрации. 3 мкМ перед обработкой HHP.После сброса давления образцы дважды промывали IPB (10000 × g, 5 мин, 25 ° C) и, наконец, ресуспендировали в двойном исходном объеме IPB. Постоянную проницаемость мембраны определяли окрашиванием PI сразу после обработки HHP с последующей инкубацией в течение не менее 15 минут в темноте и последующей очисткой, как описано выше. Суспензии необработанных и инактивированных нагреванием (100 ° C, 15 мин) клеток смешивали с PI параллельно с образцами, обработанными давлением, и использовали в качестве отрицательного и положительного контроля, представляя популяции без повреждения мембраны и, следовательно, с минимальной интенсивностью флуоресценции или с полностью разрушенные мембраны, приводящие к максимально достижимому сигналу флуоресценции соответственно.Проницаемость мембраны определяли путем измерения интенсивности флуоресценции (возбуждение / испускание: 485/620 нм) на черных 96-луночных планшетах (F-bottom, Greiner bio-one, Frickenhausen, Германия) с использованием считывающего устройства для микропланшетов FLUOStar Omega (BMG Labtech). , Ортенберг, Германия). В целях нормализации OD 600 измеряли параллельно (U-образное дно, нестерильно, Sarstedt, Nürnbrecht, Германия). Для микроскопического анализа образцы обрабатывали, как описано выше, за исключением того, что окрашивание проводили с использованием набора LIVE / DEAD BacLight Bacterial Viability (Thermo Fisher Scientific, Waltham, MA, USA), содержащего SYTO®9 и PI.Конечная концентрация каждого красителя в образце составляла 3 мкМ. Аликвоту 5 мкл окрашенного образца наносили на предметное стекло микроскопа (Roth, Карлсруэ, Германия), накрывали покровным стеклом и исследовали под микроскопом Axiostar plus (Carl Zeiss Microscopy GmbH, Йена, Германия), оборудованным эпифлуоресцентным устройством. Окрашенные клетки визуализировали с использованием эпифлуоресцентного света с соответствующими фильтрами (SYTO®9: Excitation BP 475/40, Emission BP 530/50; иодид пропидия: Excitation BP 546/12, Emission LP 590).Во всех случаях использовался 100-кратный объектив, что давало общее увеличение в 1000 раз. Изображения были получены с помощью камеры RGB с разрешением 1,388 × 1,038 пикселей (AxioCam ICc1) и обработаны с помощью программного обеспечения AxioVS40 V 4.8.2.0 (Carl Zeiss MicroImaging, Йена, Германия).
Анализ данных
Для определения значимости различий между измеренными значениями использовался t-критерий Стьюдента для сравнения двух значений и дисперсионный анализ (ANOVA) для сравнения большего количества значений. Если значения ANOVA были значительными, за анализом ANOVA следовали апостериорный тест Стьюдента-Ньюмана-Кеулса для парного сравнения.Статистический анализ проводился с использованием программного обеспечения Sigmaplot. Результаты считались значимыми, когда значения p были <0,05.
Нелинейные свойства мембраны в звездчатых клетках энторинального кортикального слоя уменьшают модуляцию реакции ввода-вывода колебаниями напряжения
Цитирование: Fernandez FR, Malerba P, White JA (2015) Нелинейные свойства мембраны в звездчатых клетках энторинального кортикального слоя уменьшаются Модуляция откликов ввода-вывода колебаниями напряжения.PLoS Comput Biol 11 (4): e1004188. https://doi.org/10.1371/journal.pcbi.1004188
Редактор: Альдо А. Фейсал, Имперский колледж Лондона, СОЕДИНЕННОЕ КОРОЛЕВСТВО
Поступила: 26 июня 2014 г .; Одобрена: 10 февраля 2015 г .; Опубликован: 24 апреля 2015 г.
Авторские права: © 2015 Fernandez et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все данные, лежащие в основе выводов рукописи доступен по этой ссылке Dropbox: https: // www.dropbox.com/sh/sqf3cmnqj9f9jk2/AAAp-RrMe_OFgOtrXGTuF1Hka?dl=0
Финансирование: Эта работа была поддержана грантами Национальных институтов здравоохранения (R01MH085074 (JAW)). Финансирующие агентства не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Напряжение мембраны в корковых нейронах определяется флуктуациями, опосредованными случайной синаптической активностью [1–4].Поскольку вероятностные переходы через пороговые значения, связанные с колебаниями, снижают порог спайков, обеспечивая спайковую реакцию на подпороговые входные сигналы [5,6], была выдвинута гипотеза, что фоновая активность усиливает чувствительность нейронов и тем самым позволяет флуктуациям изменять функции ввода-вывода. нейронов [7–12]. В соответствии с этой гипотезой, записи in vivo часто показывают большие различия в интервалах между спайками [13,14]. Спектральные свойства колебаний напряжения также коррелируют с различными когнитивными состояниями, подтверждая идею о том, что флуктуации играют важную роль в модуляции выброса импульсов [4,15-17].Наконец, вычислительные модели предполагают, что нейроны чувствительны к переходным входам и модулируют свою функцию вход-выход в ответ на изменения размера флуктуаций мембранного напряжения [10,18–20].
Однако по двум причинам неясно, справедливы ли в целом результаты сильного воздействия флуктуаций мембранного потенциала на отношения ввода-вывода. Во-первых, данные, подтверждающие сильную взаимосвязь, поступают только от нескольких типов нейронов [8,11,21–23]. Во-вторых, даже эти ограниченные исследования показали значительные различия в величине эффекта [21,23–25].Эти наблюдения указывают на возможную сложную взаимосвязь между флуктуациями мембранного напряжения и модуляцией ввода-вывода нейронов. Модуляция ответов ввода-вывода, вероятно, зависит от множества факторов, включая подпороговые свойства, зависящие от напряжения, присутствующие в нейронах. Например, отрицательная наклонная проводимость, связанная с током Na + , который увеличивает сопротивление мембраны в непосредственной близости от порога спайков [26], как было показано, снижает чувствительность нейронов к высокочастотным колебаниям напряжения в модельных нейронах [27].
Чтобы изучить, как нелинейные свойства мембраны определяют степень модуляции входных-выходных ответов в нейронах на основе флуктуаций, мы записали данные со звездчатых клеток MEC. Эти нейроны проявляют сильные нелинейные мембранные свойства при подпороговых напряжениях и характеризуются зависимым от напряжения изменением сопротивления мембраны [28–30]. Подобно другим кортикальным нейронам, in vivo записи звездчатых клеток установили наличие больших флуктуаций мембранного напряжения, которые могут влиять на реакции ввода-вывода [31,32].
Используя стандартные измерения выходного сигнала пиков в виде кривых частота-ток и вероятность пиков, а также анализ генерации пиков в модели экспоненциальной утечки, интеграции и возгорания, мы исследовали биофизические факторы, регулирующие способность к колебаниям напряжения. модифицировать меры ввода-вывода звездчатых клеток. Мы обнаружили, что нелинейные свойства мембраны, связанные с повышенным сопротивлением мембраны при суб- и перипороговых напряжениях, уменьшают модуляцию входных-выходных сигналов на основе флуктуаций.В целом, наши результаты показывают, что модуляция нейронных входов-выходов на основе флуктуаций может быть очень низкой, с ограниченным масштабированием выходных импульсов за счет изменений уровней шума и проводимости.
Результаты
Функции ввода-вывода звездчатых клеток слабо модулируются колебаниями мембранного напряжения
Чтобы исследовать модуляцию ответов ввода-вывода флуктуациями мембранного напряжения в звездчатых клетках MEC, мы начали с количественной оценки вызванных флуктуацией изменений в обычно используемых показателях нейронных ответов ввода-вывода.К ним относятся: наклон (усиление) и реобаза частоты-тока ( f-I ) и кривые вероятности выброса. Колебания напряжения генерировались с помощью колебаний на основе тока, которые были построены с использованием белого шума, отфильтрованного с помощью фильтра нижних частот (см. Методы). Для каждой ячейки мы записали короткий испытательный период, в течение которого амплитуда колебаний входного тока регулировалась для поддержания стандартного отклонения (SD) выходного напряжения в состоянии покоя (-75 мВ с поправкой на потенциал перехода электрода) примерно в 2 раза.5 мВ (2,41 ± 0,1 мВ), обычно наблюдаемое значение in vivo [33]. Контроль SD флуктуаций напряжения был важен, поскольку внутренние свойства нейронов зависят от напряжения, и справедливое сравнение различных клеток, условий и моделей требует, чтобы SD мембранного напряжения было постоянным. Кроме того, в предыдущей работе, направленной на решение аналогичных проблем, контролировались размеры флуктуации с точки зрения SD мембранного напряжения и использовались аналогичные значения [8,9,19,23,24,34,35],
Для кривых f-I частота всплесков была определена с использованием только первых трех интервалов между всплесками, чтобы избежать осложнений, возникающих из-за взаимодействия между временной шкалой колебаний напряжения и адаптацией частоты всплесков [21,23].Усиление рассчитывалось индивидуально для каждой ячейки с использованием наклона линейной аппроксимации (r 2 : от 0,64 до 0,96, среднее значение: 0,89 ± 0,02) к соотношению fI , в то время как реобаза измерялась как ток, необходимый для выявления минимум 3 интервала между всплесками от напряжения удержания -75 мВ.
Как показано на рис. 1B, на кривые f-I звездчатой ячейки влияние флуктуаций мембранного напряжения незначительно. Добавление флуктуаций вызвало небольшой, но незначительный сдвиг реобазы влево (рис. 1Ci; 199 ± 20 пА vs.158 ± 20 пА, p = 0,11, n = 20, 18). Как и в случае с реобазой, добавление флуктуаций напряжения не привело к значительному снижению усиления кривой fI (рис. 1Cii; 0,161 ± 0,10 пиков / пА с. Против 0,148 ± 0,08 пиков / пА с, P = 0,31, n = 20, 18). Для более точной количественной оценки потенциальных изменений на кривой f-I мы также измерили влияние колебаний напряжения на скорость зажигания в отдельных областях кривой f-I (рис. 1D; низкий, средний и высокий). Предыдущие моделирование и экспериментальные работы показали, что случайные колебания напряжения вызывают наибольшее увеличение скорости срабатывания в области с низкой частотой пиков кривой f-I , около перехода между режимом покоя и срабатыванием [8–10,19,20,24].Для наших данных нижняя область была определена индивидуально для каждой ячейки как частота всплесков разряда на реобазе, в то время как средняя и высокая области соответствовали значениям тока, вызывающим на 15 всплесков / с и 25 всплесков / с больше, чем исходная частота, соответственно. Для каждой ячейки мы измерили изменение скорости воспламенения, вызванное колебаниями напряжения для областей с низким, средним и высоким входным током, относительно кривой f-I той же ячейки, полученной без колебаний. Различия в частоте всплесков были небольшими, но значительно изменились в нижней и средней частях кривой f-I .Для нижней области кривой fI флуктуации вызывали увеличение на 3,3 ± 0,34 пика / с (рис. 1D; P <0,001, n = 18), в то время как в средней области эти значения составляли 3,2 ± 1,4 пика / с. (P = 0,03, n = 18).
Рис. 1. Отношения между входом и выходом звездчатых клеток MEC выражают низкую чувствительность к колебаниям напряжения на мембране.
(A) Типичные примеры реакции напряжения звездчатых клеток на скачки тока длительностью 1 с с (правая панель) и без (левая панель) флуктуациями мембранного напряжения.(B) График средних соотношений f-I в условиях, обозначенных в A. (C) Средние сдвиги влево реобазы (i) и усиления (ii) на кривых f-I в результате введения флуктуаций мембранного напряжения. (D) Изменение скорости воспламенения в результате колебаний мембранного напряжения для областей с низкой, средней и высокой частотой всплесков отношения f-I . Для каждой области изменения в скорости стрельбы были рассчитаны с использованием разницы в скорости стрельбы отдельной ячейки в результате введения колебаний входного тока.(E) Репрезентативные примеры реакции напряжения звездчатых клеток на 100 мс длительные шаги тока различной амплитуды с колебаниями мембранного напряжения и без них. (F) Средняя кривая вероятности выброса в присутствии колебаний мембранного напряжения. Вертикальная линия указывает среднюю реобазу при отсутствии колебаний напряжения для каждого условия.
https://doi.org/10.1371/journal.pcbi.1004188.g001
Затем мы измерили влияние колебаний напряжения на кривые вероятности выброса.В отличие от кривой f-I , которая требует повторяющейся генерации пиков при каждом текущем размере шага, кривая вероятности пиков количественно определяет вероятность генерации только одного пика в пределах заданного временного окна (100 мс в нашем случае, рис. 1E и 1F). В отсутствие флуктуаций напряжения на мембране переход от нуля к единице в спайковом разряде почти всегда происходил в пределах одного шага тока (рис. 1F; вертикальная линия). Для экспериментов без искусственных колебаний напряжения амплитуда тока, связанная с этой точкой перехода, была определена как реобаза.Добавление флуктуаций напряжения сгладило взаимосвязь между вероятностями всплесков и шагами тока, так что точки данных могли соответствовать сигмовидной функции (рис. 1F; подгонка Больцмана, r 2 > 0,96). При наличии колебаний напряжения реобаза определялась как ток, необходимый для установления вероятности 0,2 (P 0,2 ) генерации одиночного всплеска, в то время как наклон был определен количественно с использованием члена « k » в функции Больцмана (см. Методы). Как показано, колебания напряжения вызывали сдвиг реобазы влево относительно условий без колебаний (рис. 1F; 56 ± 5.6 pA, P <0,001, t-критерий Стьюдента, n = 20) и привели к кривым вероятности пика со средним наклоном 26 ± 8,4 pA (среднее ± s.e.m).
В целом, модификации кривых звездчатых клеток fI флуктуациями напряжения были небольшими по сравнению с предыдущими работами на других нейронах [8,9,23,24,35], без значительной модуляции прироста кривой fI в популяции и относительно небольшие изменения начальной скорости стрельбы. Для сравнения, в прошлых исследованиях с использованием колебаний напряжения аналогичной величины сообщалось о снижении усиления до 50% [8,9].Тем не менее, звездчатые клетки действительно демонстрируют некоторую степень модуляции входных-выходных реакций, опосредованной флуктуациями, на что указывает сдвиг и сглаживание кривой вероятности пика.
Звездчатые клетки проявляют значительные нелинейные мембранные свойства, приводящие к порогу спайков
Учитывая как теоретические, так и экспериментальные работы, подтверждающие сильную модулирующую роль флуктуаций мембранного напряжения, нас интересовало, какие факторы контролируют и ограничивают основанные на флуктуациях изменения откликов ввода-вывода в звездчатых клетках.В качестве потенциальной причины ограниченной модуляции входных-выходных сигналов на основе флуктуаций мы рассматривали роль нелинейных свойств мембраны, приводящих к порогу всплеска. В простых моделях было показано, что реалистичная динамика генерации пиков снижает вероятность реакции пиков на быстрые колебания напряжения [27,36]. Мы предположили, что распространение этого эффекта на гораздо большую область подпорогового напряжения, чем считалось ранее, могло бы значительно уменьшить модуляцию входных-выходных сигналов, основанную на флуктуациях.
Чтобы сначала установить наличие подпороговых нелинейных свойств мембраны в звездчатых клетках, мы количественно определили входное сопротивление мембраны между -85 мВ и -65 мВ. При каждом удерживающем напряжении сопротивление мембраны измеряли в режиме фиксации напряжения с шагом напряжения 5 мВ длительностью 100 мс. Деполяризация звездчатых клеток привела к прогрессивному увеличению входного сопротивления мембраны в стационарном состоянии (рис. 2А; односторонний дисперсионный анализ, P <0,001, n = 12). Сопротивление мембраны почти утроилось в диапазоне 20 мВ, увеличившись с 51.От 8 ± 3,9 МОм при -85 мВ до 151,4 ± 15,5 МОм при -65 мВ (рис. 2A). Следует отметить, что сопротивление также продолжало увеличиваться с дополнительной деполяризацией до такой степени, что очень маленькие скачки напряжения (~ 1 мВ) часто вызывали всплески на уровнях более деполяризованных, чем -65 мВ, и не позволяли точно измерить сопротивление мембраны при этих значениях напряжения.
Рис. 2. Звездчатые клетки проявляют нелинейные мембранные свойства, которые формируют траекторию напряжения, ведущую к порогу всплеска.
(A) Среднее входное сопротивление в установившемся режиме как функция мембранного напряжения.Измерения проводились в режиме фиксации напряжения с шагом 5 мВ длительностью 100 мс. (B) Средняя траектория мембранного напряжения (серые линии обозначают SEM), связанная с приближением от состояния покоя к первому всплеску. Для сравнения также показано экспоненциальное приближение с использованием измерений постоянной времени мембраны при -75 мВ. (C) Средняя траектория мембранного напряжения (серые линии обозначают SEM), связанная с межспайковым интервалом. (D) Типичный пример кривой f-V из звездчатой ячейки (сплошная линия).Линия указывает соответствие степенной функции формы, показанной на вставке панели. На вставке также показан график среднего показателя степени ( p ) для аппроксимации степенной функции.
https://doi.org/10.1371/journal.pcbi.1004188.g002
Затем мы проанализировали средние траектории мембранного напряжения, ведущие к порогу всплеска. Для токовых входов, вызывающих небольшие изменения напряжения (5 мВ), полученная траектория напряжения точно соответствовала экспоненциальной функции и использовалась для извлечения постоянной времени мембраны около -75 мВ (12.0 ± 0,9 мс, n = 19). Напротив, траектория мембранного напряжения до первого всплеска (для задержки первого всплеска 50 мс) при удерживающем напряжении -75 мВ (диапазон ~ 15 мВ) не может соответствовать экспоненциальной функции из-за более линейного профиля траектория (рис 2Б). Точно так же средняя траектория напряжения между минимумом постгиперполяризации (AHP) и порогом всплеска во время непрерывного срабатывания (~ 4 Гц) не была экспоненциальной (рис. 2C). Таким образом, траектории напряжения до порогового значения всплеска, начинающиеся либо с напряжений покоя, либо с минимума AHP, были относительно линейными по сравнению с ожидаемыми из наших измерений постоянной времени мембраны при -75 мВ.
Чтобы оценить, как изменения в частоте всплесков соотносятся с изменениями среднего напряжения, связанного с траекториями всплесков при различных частотах всплесков, мы количественно оценили взаимосвязь между частотой всплесков и средним напряжением ( f-V ). Как и в случае кривых f-I , частота выбросов для кривой f-V была взята из первых трех интервалов между спайками, при этом значения мембранного напряжения рассчитывались как среднее значение за тот же период времени. Неожиданно мы обнаружили, что кривые f-V были нелинейными и могли соответствовать степенной функции (рис. 2D; среднее значение r 2 = 0.95 ± 0,02, диапазон: 0,7–0,99) с использованием показателя степени ( p ) 1,45 ± 0,08 (рис. 2D; n = 19, диапазон: 0,45–2,0, 17/19 имели p значений> 1). Кривые ячейки f-V также были неглубокими, со средним наклоном в диапазоне выстрела 4,5 ± 0,4 пиков / мВ · с (n = 19). Вопреки предыдущим предположениям [12,37], поэтому нейронные кривые f-V могут выражать значительное степенное масштабирование в отсутствие какого-либо сглаживания на основе флуктуаций. Таким образом, наши измерения сопротивления мембраны, траектории напряжения и кривые f-V показывают, что звездчатые клетки выражают значительные суб- и перипороговые нелинейности.
Постепенное увеличение сопротивления мембраны имеет решающее значение для уменьшения модуляции входных-выходных сигналов на основе флуктуаций в модели eLIF
Чтобы понять биофизические механизмы и последствия зависящего от напряжения сопротивления мембраны в большой области подпорогового напряжения, мы начали с изучения эффектов флуктуационной модуляции поведения ввода-вывода в упрощенной модели генерации спайков в форма экспоненциальной модели с утечкой, интегрированной и пожарной (eLIF) [27].Эта модель имеет преимущество включения важных нелинейных свойств мембраны, связанных с порогом спайков, с использованием небольшого набора параметров, которые связаны с физиологическими показателями (например, зависимое от напряжения подпороговое сопротивление мембраны).
Коэффициент наклона спайка (Δ T ) в eLIF определяет изменение наклона кривой напряжение-ток мембраны ( IV ), когда напряжение на мембране приближается к порогу всплеска (V T — Рис. .Экспоненциальный член моделирует увеличение сопротивления мембраны, связанное с увеличением активации проводимости Na + и генерации спайков. При малых значениях Δ T наклон кривой I-V (сопротивление мембраны) резко изменяется по мере приближения системы к V T (рис. 3A). И наоборот, при больших значениях Δ T изменение наклона более плавное. Таким образом, для небольшого значения Δ T (т.е.грамм. 2 мВ) кривая I-V в основном линейна, за исключением небольшого диапазона напряжений в непосредственной близости от V T . Однако по мере увеличения Δ T сопротивление мембраны постепенно увеличивается в относительно большом диапазоне подпороговых значений напряжения мембраны. Мы обнаружили, что значение Δ T , равное 15 мВ, лучше всего соответствует экспериментальным значениям устойчивого входного сопротивления мембраны, наблюдаемого в звездчатых клетках (рис. 3B).Следует отметить, что значение 15 мВ для Δ T является большим по сравнению с тем, что было реализовано в предыдущей работе (от 0,8 мВ до 6 мВ) с использованием модели eLIF для изучения корковых нейронов [27,38,39].
Рис. 3. Модель eLIF с большим значением Δ T точно отражает свойства мембранного напряжения, наблюдаемые в звездчатых клетках.
(A) График кривых I-V для моделей eLIF с использованием различных значений Δ T (2, 5, 15 мВ), а также полностью пассивной модели.(B) График входного сопротивления как функции мембранного напряжения для моделей, указанных в A . Обратите внимание, что средние значения звездчатых ячеек лучше всего соответствуют eLIF, используя значение Δ T , равное 15 мВ. (C) Траектории напряжения для начального приближения спайков (i) и интервала между спайками (ii) для моделей, представленных в A. Для сравнения также показаны средние траектории звездчатых ячеек. (D) f-V кривые для моделей, обозначенных в A. (F) График сравнения экспериментальных значений показателя степенной функции в звездчатых клетках и модели eLIF с использованием Δ T 15 мВ.
https://doi.org/10.1371/journal.pcbi.1004188.g003
Мы начали со сравнения траекторий напряжения на мембране звездчатых клеток с траекториями, полученными в модели eLIF, используя Δ T значения 2, 5 и 15 мВ. . Для сравнения мы также включили полностью пассивную модель (т. Е. Стандартную модель утечки интегрирования и возгорания — LIF), состоящую из члена линейной проводимости (15 нСм, -75 мВ реверсирование) и искусственного порога (-55 мВ). Для всех моделей напряжение мембраны было сброшено (V r ) до -65 мВ после превышения порога.
Модель eLIF с Δ T , равным 15 мВ, значительно лучше воспроизводит более линейный подход, связанный с начальным подходом к пиковому значению от -75 мВ (рис. 3Ci). Аналогичным образом, для траектории напряжения интервала между спайками между впадиной AHP и порогом спайка во время повторяющегося спайкового разряда (~ 4 Гц) значение Δ T 15 мВ наилучшим образом отражает линейную траекторию, ведущую к порогу всплеска, наблюдаемому в звездчатых клетках. (Рис. 3Cii).По мере уменьшения Δ T траектории напряжения, приближающиеся к порогу всплеска, становятся более экспоненциальными и качественно более похожими на пассивную модель (рис. 3C).
Учитывая различия в траекториях напряжения как в первоначальном подходе к пиковому напряжению, так и в траекториях между пиковыми напряжениями, нас интересовало, как среднее мембранное напряжение масштабируется со скоростью пикового напряжения ( f-V ) в каждой из моделей. Для пассивной модели кривая f-V крутая и имеет отрицательный наклон.В активных моделях наклон и форма значительно меняются при разных значениях Δ T . Когда значение Δ T увеличивается с 2 мВ до 15 мВ, наклон кривой f-V изменяется от отрицательного и крутого до мелкого и положительного (Рис. 3D). Кроме того, в диапазоне 1–60 пиков / с кривая f-V eLIF с использованием значения Δ T , равного 15 мВ, может быть точно согласована с степенной функцией с показателем степени 1.78, что находится в пределах диапазона значений, наблюдаемых экспериментально для звездчатых клеток (рис. 3F).
Чтобы количественно оценить модуляцию откликов ввода-вывода колебаниями напряжения в моделях, мы сравнили результаты в модели eLIF, используя Δ T значения 2 мВ и 15 мВ. Мы обеспечивали те же колебания входного тока, что и в звездчатых ячейках, и поддерживали колебания напряжения со стандартным отклонением 2,5 мВ при -75 мВ. Предыдущие исследования также установили, что увеличение проводимости мембраны с помощью различных механизмов, которые включают подавление шунтирования, сбалансированные синаптические проводимости или просто увеличение утечки через мембрану, облегчает модуляцию кривой f-I с использованием флуктуаций напряжения аналогичной величины [8-10,22].Кроме того, в результате разного наклона экспоненциальных членов модели eLIF с использованием Δ T значений 2 мВ и 15 мВ имеют разные значения входного сопротивления при -75 мВ (рис. 3B), свойство, которое может учитывать потенциальные различия в модуляции входных-выходных сигналов на основе флуктуаций. По этим причинам в каждую из моделей был введен отдельный шунт или проводимость утечки ( г L ) 15 нСм для проверки влияния увеличения проводимости мембраны на модуляцию ввода-вывода.
Модуляция на основе флуктуаций как для f-I , так и для кривых вероятности пиков существенно больше при использовании значения для Δ T , равного 2 мВ, чем при 15 мВ (рис. 4). В соответствии с предыдущими расчетными и экспериментальными результатами [7–10], увеличение проводимости мембраны с помощью подавления шунтирования увеличивает вызванную флуктуацией модуляцию входных-выходных ответов в обеих моделях, хотя эффект намного больше, когда Δ T = 2 мВ ( Рис 4).При Δ T = 2 мВ, вызванное флуктуациями увеличение начальной частоты спайков составляет 23 спайка / с и 30 спайков / с ниже базового уровня и с повышенной проводимостью мембраны, соответственно (Рис. 4Bii – 4D). Для сравнения, с Δ T = 15 мВ, это значение составляет всего 4,2 пиков / с и 5,8 пиков / с (рис. 4Bi – 4D). Аналогично, для кривых вероятности выброса флуктуации напряжения приводят к большим сдвигам влево и сглаживанию в обоих условиях проводимости с Δ T = 2 мВ (рис. 4C – 4E).В результате изменения скорости возбуждения, реобазы и усиления, вызванные флуктуациями мембранного напряжения, более точно соответствуют тем, которые наблюдаются в звездчатых клетках, когда Δ T установлено на 15 мВ (рис. 4D и 4E).
Рис. 4. Модель eLIF, использующая значение Δ T , равное 15 мВ, генерирует ограниченную модуляцию входных-выходных характеристик флуктуациями мембранного напряжения.
(A) Примеры графиков моделей eLIF, реализованных с Δ T = 15 мВ (i) и 2 мВ (ii).(B) fI кривые в моделях eLIF с Δ T = 15 мВ (i) и 2 мВ (ii) с или без колебаний напряжения мембраны ниже базовой линии (черный) или повышенной проводимости мембраны ( г шунт -серый). (C) Кривые вероятности всплеска в моделях eLIF с Δ T = 15 мВ (i) и 2 мВ (ii) с или без колебаний мембранного напряжения ниже базовой линии (черный) или повышенной проводимости мембраны ( г шунт -серый).(D) Изменения в скорости воспламенения, вызванные колебаниями мембранного напряжения для низких, средних и высоких областей кривых f-I для каждой модели. Для сравнения также показаны средние значения звездчатых клеток. (E) Графики изменений реобазы (i) и фактора наклона сигмовидной кишки (ii) в мерах вероятности всплеска, связанных с введением флуктуаций мембранного напряжения для каждой модели.
https://doi.org/10.1371/journal.pcbi.1004188.g004
Уменьшение Δ T также приводит к увеличению усиления кривой f-I (рис. 4B).Следовательно, увеличение вызванной флуктуацией модуляции кривых f-I с более низкими значениями Δ T может быть результатом внутреннего более высокого значения усиления, которое обеспечивает большую чувствительность к изменениям колебаний входного тока. Предыдущие исследования установили, что уменьшение значения V r имеет делительный эффект на усиление [40]. Поэтому, чтобы устранить влияние более высоких значений усиления, мы постепенно уменьшали значение V r , чтобы уменьшить усиление, когда Δ T было небольшим (рис. 5A).Используя этот подход, мы могли бы поддерживать примерно одинаковое усиление для разных значений Δ T и проверить, полностью ли вызваны флуктуациями сглаживание кривой f-I из-за изменений внутреннего усиления (рис. 5A и 5B). Хотя компенсация усиления за счет изменений в V r уменьшает модуляцию на основе флуктуаций кривой fI , более низкие значения Δ T по-прежнему приводят к большему сглаживанию и увеличению начальной скорости стрельбы из fI кривая (рис. 5С).
Рис. 5. Уменьшение Δ T в модели eLIF постепенно увеличивает модуляцию входных-выходных характеристик флуктуациями мембранного напряжения.
(A) Модель eLIF f-I Кривая усиления уменьшается с более отрицательным значением V r . (B) Сравнение кривых f-I для различных значений Δ T с (сплошные линии) и без (пунктирные линии) колебаниями мембранного напряжения. Обратите внимание, что более отрицательные значения V r использовались для сохранения того же усиления с меньшими значениями Δ T .(C) Изменения начальной скорости срабатывания кривых f-I , вызванные колебаниями мембранного напряжения для модели eLIF с использованием значений Δ T . (D) Сравнение кривых вероятности всплеска для различных значений Δ T с (сплошные линии) и без (пунктирные линии) колебаниями мембранного напряжения. (E) Графики изменений реобазы (i) и фактора наклона сигмовидной кишки (ii) при измерении вероятности всплеска, связанных с введением флуктуаций мембранного напряжения для моделей eLIF с использованием различных значений Δ T .
https://doi.org/10.1371/journal.pcbi.1004188.g005
Для полноты картины мы также количественно оценили изменения в реобазе и наклоне кривых вероятности всплесков, вызванные введением флуктуаций напряжения (рис. 5D). Для этих мер выбор V r не имеет значения. Как показано, постепенное уменьшение Δ T с 15 мВ до 1 мВ приводит к постепенному увеличению как способности флуктуаций сдвигать реобазу, так и сглаживания кривых вероятности пика (рис. 5E).
Ограниченная модуляция входных-выходных сигналов на основе флуктуаций может быть воспроизведена в модели на основе проводимости с использованием формулизма Ходжкина и Хаксли.
Хотя модель eLIF с большим Δ T дает очень хорошее соответствие экспериментальным результатам, полученным на звездчатых клетках, нас интересовало, может ли более биологически правдоподобная модель, использующая стандартный формулизм Ходжкина и Хаксли (HH), также воспроизвести наш результаты экспериментов. Для нашей модели на основе H-H мы начали с неинактивирующей проводимости Na + (I Nap ), которая генерирует постепенное увеличение входного сопротивления мембраны при подпороговых мембранных напряжениях, наблюдаемых в звездчатых клетках (рис. 6A).Для пиковых токов мы использовали стандартный переходный ток Na + в сочетании с более медленным током K + (см. Методы). Обратите внимание, что значения реобаз в модели на основе проводимости отличались от модели eLIF, потому что порог напряжения для пиков был более деполяризован, чем для eLIF.
Рис. 6. Уменьшение постоянного тока Na + в модели проводимости, основанной на формулировке H-H, увеличивает модуляцию входных-выходных характеристик флуктуациями напряжения.
(A, B) График стационарного входного сопротивления мембраны (A) и частоты всплесков (B) как функции мембранного напряжения в модели для 3 различных уровней I Nap (150 нСм, 75 нСм и 0 нС).(C) f-I отношения в модели на основе H-H с использованием 150 нСм (красный), 75 нСм (черный) и 0 нСм (голубой) с (сплошная линия) или без (пунктирная линия) колебаниями мембранного напряжения. (D) Изменение скорости воспламенения в результате колебаний мембранного напряжения для областей с низкой, средней и высокой частотой всплесков отношения f-I . (E) Кривые вероятности выброса в модели на основе H-H с использованием 150 нСм (красный), 75 нСм (черный) и 0 нСм (голубой) с (сплошная линия) или без (пунктирная линия) флуктуациями мембранного напряжения.(F) Графики изменений реобазы (i) и фактора наклона сигмовидной кишки (ii) на мерах вероятности всплеска в результате введения флуктуаций мембранного напряжения для модели на основе H-H с использованием различных уровней I Nap .
https://doi.org/10.1371/journal.pcbi.1004188.g006
Как и ожидалось, уменьшение величины I Nap снижает постепенное увеличение подпорогового входного сопротивления мембраны (рис. 6A). Кроме того, уменьшение I Nap увеличивает наклон кривой f-V (рис. 6B).Следовательно, присутствие I Nap заставляет модельный нейрон генерировать fV , более похожее на модель eLIF с Δ T = 15 мВ, в то время как без I Nap кривая fV имеет вид больше похоже на то, когда Δ T = 2 мВ.
Чтобы оценить роль подпорогового сопротивления в модуляции на основе флуктуаций, мы изменили величину проводимости I Nap . Как и раньше, мы добавили колебания входного тока, чтобы генерировать колебания напряжения с 2.5 мВ STD при -75 мВ. Как для измерений f-I (рис. 6C и 6D), так и для измерения вероятности всплеска (рис. 6E и 6F) снижение I Nap приводит к постепенному увеличению способности колебаний мембранного напряжения модулировать отклики ввода-вывода. Таким образом, стандартная модель на основе H-H проводимости может воспроизводить экспериментальные результаты и наблюдения модели eLIF.
Большие значения Δ
T уменьшают модуляцию входных-выходных характеристик из-за колебаний напряжения за счет снижения напряжения мембраныЧтобы лучше понять, как значения Δ T определяют траекторию мембранного напряжения, связанную как с начальным, так и с межспайковым интервалом всплеска, мы использовали графики фазовой плоскости для анализа модели eLIF с использованием значений Δ T , равных 2 мВ. и 15 мВ.На графике на фазовой плоскости пунктирные линии указывают функцию производной мембраны ( d V / d t). Чем дальше значение пунктирной линии от оси абсцисс в нуле, тем быстрее изменяется напряжение на мембране. За счет своего влияния на форму линии d V / d t параметр Δ T определяет скорость, с которой мембранное напряжение достигает порогового значения всплеска (рис. 7A и 7B). При Δ T = 15 мВ функция d V / d t является неглубокой и генерирует небольшие значения, на что указывает близость к нулевой оси x, для большой части опережения траектории. до порога шипа; это приводит к тому, что траектория изменяется медленнее и занимает небольшую часть времени в непосредственной близости от порога выброса (рис. 7A).Уменьшение Δ T увеличивает значения d V / d t для всех напряжений, ведущих к пороговому значению. В этих условиях траектория напряжения начинает замедляться только в непосредственной близости от порога всплеска и, следовательно, проводит большую часть интервала между всплесками в непосредственной близости от порога (рис. 7A и 7B; вставки).
Рис. 7. Значение Δ T определяет чувствительность к колебаниям мембранного напряжения в модели eLIF путем установки скорости изменения мембранного напряжения и вероятности выброса разряда во время приближения к пороговому значению выброса.
(A, B) Графики в фазовой плоскости для модели eLIF с использованием Δ T значений 15 мВ (A) и 2 мВ (B). Пунктирные линии указывают значение производной мембранного напряжения ( d, В, / d t), проданные линии и стрелки указывают траекторию и относительную скорость изменения (расстояние между стрелками). Меньшее значение Δ T приводит к более высокой скорости изменения мембранного напряжения во время приближения к пороговому значению напряжения (минимум d V / d t line, V T ).На вставках показана траектория мембранного напряжения, связанная с графиками фазовой плоскости в A и B . (C) График вероятности всплеска в ответ на колебания мембранного напряжения во время интервала между всплесками ~ 4 Гц для модели eLIF с использованием значения Δ T , равного 15 мВ (красный) и 2 мВ (синий). (D) График кривых f-V для модели eLIF с использованием значения Δ T 15 мВ (красный) и 2 мВ (синий) с (сплошные линии) и без (пунктирные линии) колебаний напряжения мембраны.(E) График траектории напряжения для различных уровней приложенного тока для модели eLIF с использованием Δ T значений 15 мВ (вверху) и 2 мВ (внизу). Модель была решена с использованием начального условия -65 мВ и остановлена, когда было достигнуто значение -35 мВ. Цветные точки указывают среднее значение для каждой траектории напряжения. (F) График задержки 1 / первого всплеска в зависимости от среднего мембранного напряжения (среднее значение траекторий, показанных на F).
https://doi.org/10.1371/journal.pcbi.1004188.g007
Приведенный выше анализ предполагает, что Δ T влияет на основанную на флуктуации модуляцию функций ввода-вывода при заданном значении интервала между всплесками, устанавливая долю времени, в течение которой напряжение находится в непосредственной близости от порогового значения всплеска. По мере того, как Δ T становится меньше, траектории напряжения проводят все большую часть времени вблизи порога напряжения для всплеска, в результате чего небольшие флуктуации могут привести к всплескам на очень ранней стадии развития траектории.И наоборот, путем линеаризации траектории большие значения Δ T ограничивают вызванные флуктуацией всплески временными точками на более позднем этапе развития траектории напряжения. Чтобы проиллюстрировать это, мы количественно оценили вероятность того, что колебания напряжения вызывают всплески в разные моменты времени и напряжения в течение одной траектории интервала между всплесками (рис. 7C). Таким образом, каждая точка на траектории обеспечивала начальные условия, исходя из которых можно было вычислить вероятность генерации всплеска в данный момент напряжения и времени.Для каждой из этих точек мы запускали модели в течение периода времени 50 мс и рассчитывали вероятность всплесков разряда в ответ на колебания напряжения (SD = 2,5 мВ) в течение этого периода времени, используя 1000 испытаний (см. Методы). Как показано на фиг. 7C, для большей части интервала вероятность генерации всплеска в ответ на колебания напряжения существенно выше для Δ T = 2 мВ, чем для Δ T = 15 мВ. Хотя значение Δ T = 15 мВ приводит к более высокой вероятности всплесков разряда к концу траектории межспайкового интервала, эффект ограничен во времени и проявляется в конце цикла, в результате чего влияние на частоту всплесков по сравнению с Детерминированный случай мал.
Влияние Δ T на линию d V / d t также изменяет масштабирование между средним мембранным напряжением и частотой всплесков. Как указано выше, изменения в Δ T изменяют линию d V / d t с большим значением Δ T , генерируя более мелкую линию d V / d t. При добавлении положительного (деполяризующего) тока линия d V / d t перемещается вверх и от оси x, что приводит к более быстрой траектории напряжения (т.е.е. более короткие межспайковые интервалы).
Когда Δ T = 2 мВ, траектория напряжения приближается к значениям, близким к пороговому ( В, T ), быстрее, чем при Δ T = 15 мВ. При Δ T = 2 мВ производная мембраны замедляется только вблизи точки перегиба линии d V / d t. Следовательно, когда линия d V / d t сдвигается вверх, среднее значение траектории напряжения остается в значительной степени неизменным, поскольку большая часть траектории представлена значением около точки перегиба линии d V / d. Линия т (рис. 7E и 7F).По сути, Δ T = 2 мВ сжимает траекторию напряжения до значения, приблизительно равного В T . При Δ T = 15 мВ, однако, сдвиг вверх по линии d V / d t значительно ускоряет переменную напряжения для гораздо большей части профиля траектории, особенно для моментов времени на ранней стадии. траектории, удаленные от точки перегиба линии d V / d t.В результате среднее значение переменной напряжения деполяризуется по мере увеличения величины приложенного тока, и линия d V / d t смещается вверх (рис. 7E и 7F). Создавая неглубокий f-V , большой Δ T ограничивает возможность изменения напряжения, вызванного случайными колебаниями, для увеличения частоты всплесков. И наоборот, когда Δ T мало, а соотношение f-V крутое, колебания напряжения могут привести к значительному изменению частоты возникновения всплесков (рис. 7D).
При больших значениях Δ T увеличение сопротивления мембраны и, как следствие, увеличение флуктуаций напряжения потенциально может преодолеть уменьшение модуляции на основе флуктуаций, установленное неглубоким соотношением f-V . Хотя стандартное отклонение флуктуаций мембранного напряжения больше в околопороговой области с Δ T = 15 мВ по сравнению с Δ T = 2 мВ , , разница мала по сравнению с изменениями в Соотношение fV устанавливают путем увеличения значения Δ T (фиг.8A).Таким образом, при среднем напряжении, когда колебания сначала вызывают пики в обеих моделях (~ -68 мВ), стандартное отклонение колебаний напряжения увеличивается только с 2,64 мВ до 3,06 мВ, когда Δ T изменяется с 2 мВ до 15 мВ. Для сравнения, изменения в соотношении f-V намного больше. При Δ T = 2 мВ диапазон 60 пиков / с происходит полностью в пределах диапазона 0,5 мВ, но увеличивается до диапазона 10 мВ, когда Δ T = 15 мВ (рис. 7D). В результате увеличение Δ T с 2 мВ до 15 мВ оказывает гораздо большее влияние на масштабирование соотношения f-V , чем размер колебаний мембранного напряжения.Даже в условиях, когда стандартное отклонение колебаний мембранного напряжения увеличивается до 3,6 мВ или 7,2 мВ (за счет увеличения колебаний входного тока), значения намного больше, чем те, которые используются с Δ T = 2 мВ, модуляция Соотношения fV и fI все еще значительно меньше при Δ T = 15 мВ, чем при Δ T = 2 мВ (рис. 8B и 8C).
Рис. 8. Увеличение Δ T оказывает большее влияние на масштабирование соотношения f-V , чем размер колебаний мембранного напряжения.
(A) График SD колебаний мембранного напряжения как функции среднего напряжения с использованием модели eLIF с Δ T = 2 мВ и Δ T = 15 мВ. SD флуктуаций мембранного напряжения больше с Δ T = 15 мВ для значений напряжения, более деполяризованных, чем -70 мВ, из-за увеличения сопротивления мембраны. Гистограмма колебаний мембранного напряжения (Aii) в модели eLIF с использованием Δ T = 2 мВ и Δ T = 15 мВ при средних напряжениях -71.5 мВ и -68 мВ. Как показано, при -68 мВ SD колебаний мембранного напряжения больше (более широкое распределение), когда Δ T установлено на -15 мВ. (B, C) Мелкая взаимосвязь fV с Δ T = 15 мВ уменьшает модуляцию кривой fI на основе флуктуаций, даже когда колебания мембранного напряжения значительно больше, чем при Δ T = 2 мВ. (B) График отношений f-V , созданных с колебаниями мембранного напряжения со значениями SD, равными 2.3 мВ, 3,6 мВ и 7,5 мВ (измерено при -75 мВ). На вставке показана гистограмма колебаний мембранного напряжения для трех значений SD. Чтобы увеличить размер колебаний напряжения, коэффициент колебаний входного тока был увеличен с 90 до 140 и 280. (C) Увеличение SD колебаний мембранного напряжения до 3,6 мВ и 7,5 мВ при Δ T = 15 мВ генерирует меньшие изменения в скорости воспламенения по сравнению с Δ T = 2 мВ, используя колебания напряжения со стандартным отклонением 2.6 мВ. На вставке показан график изменения скорости воспламенения, вызванный колебаниями напряжения для низких, средних и высоких областей (определенных, как и раньше) отношения f-I . Пунктирными черными линиями обозначены соотношения f-V (B) и f-I (C) при отсутствии колебаний мембранного напряжения.
https://doi.org/10.1371/journal.pcbi.1004188.g008
Таким образом, большой Δ T генерирует траектории напряжения, которые проводят меньшую часть времени в непосредственной близости от порога всплеска и среднее значение которых изменяется значительно с частотой всплесков.Обе характеристики являются результатом постепенного увеличения входного сопротивления мембраны и помогают уменьшить модуляцию входных-выходных характеристик колебаниями напряжения.
Снижение зависимости сопротивления мембраны от напряжения снижает модуляцию кривых ввода-вывода в звездчатых ячейках на основе флуктуаций
Наши измерения входного сопротивления, траектории напряжения и анализ модели eLIF позволили сформировать две проверяемые гипотезы относительно чувствительности выброса звездчатых клеток к колебаниям напряжения.Уменьшение увеличения входного сопротивления, связанного с деполяризацией в подпороговой области, должно привести к увеличению модуляции входных-выходных сигналов на основе флуктуаций. Эта манипуляция сродни уменьшению значения Δ T . Во-вторых, манипуляции с сопротивлением мембраны с использованием отрицательной и положительной наклонных проводимостей должны приводить к снижению и увеличению, соответственно, флуктуационной модуляции входных-выходных откликов, манипулируя влиянием эндогенной отрицательной наклонной проводимости и изменяя траектории напряжения, связанные с приближение к шиповому порогу.
Предыдущая работа с другими нейронами установила, что стационарная проводимость Na + , опосредованная либо оконным током, либо постоянной проводимостью Na + , может существенно увеличивать сопротивление мембраны с деполяризацией [26,41]. Чтобы установить роль проводимости Na + в определении подпорогового входного сопротивления в звездчатых клетках, мы использовали небольшую концентрацию ТТХ (10 нМ), которая была способна значительно изменять подпороговое сопротивление мембраны, но также сохраняла способность генерировать хотя бы один шип.Применение TTX значительно снизило постепенное увеличение входного сопротивления при различных напряжениях (2-сторонний дисперсионный анализ, P <0,001, n = 12). При -65 мВ TTX снизил входное сопротивление с 151,4 ± 15,5 МОм до 65,9 ± 4,8 МОм (рис. 9A; P <0,001), не влияя на входное сопротивление ниже -70 мВ (рис. 9A; P> 0,32).
Рис. 9. Блок потенциалзависимой проводимости Na + увеличивает чувствительность к колебаниям мембранного напряжения в звездчатых клетках.
(A) Измерение входного сопротивления мембраны в установившемся режиме для различных контролируемых напряжений (черные квадраты) и с применением ТТХ ванны 10 нМ (серые кружки).(B) Пример кривых напряжения звездчатой ячейки в ответ на шаг деполяризации 100 мс (i), а также среднее значение за первые 50 мс (ii) под контролем (черный) и с TTX (серый). На вставке (Bi) показана средняя доля времени, в течение которого траектория напряжения находилась выше средней точки для управления и под ТТХ с применением ванны. (C) Репрезентативные примеры ответа напряжения звездчатой ячейки на 100 мс длительные шаги тока различной амплитуды с и без колебаний мембранного напряжения под ванной, применяемой TTX.(D) Кривые средней вероятности всплеска при наличии колебаний мембранного напряжения под контролем (черный) и 10 нМ TTX (серый). Вертикальные линии указывают на реобазу при отсутствии колебаний напряжения для каждого условия. (E) Графики среднего сдвига влево (i) и коэффициента наклона сигмовидной кишки (ii) для контроля (черные квадраты) и TTX (серые круги).
https://doi.org/10.1371/journal.pcbi.1004188.g009
Затем мы оценили влияние активации проводимости Na + и зависящего от напряжения увеличения входного сопротивления на траектории мембранного напряжения, приводящей к шип.Поскольку траектория мембранного напряжения до первого всплеска от удерживающего напряжения -75 мВ не может быть описана экспоненциальной функцией (рис. 2B и рис. 9B), мы количественно оценили изменения траектории первого всплеска напряжения, измерив долю времени, затраченного выше середина траектории. Траектория с большой долей выше средней точки больше похожа на экспоненциальный подход. Среднее значение порога вычислялось для реакции каждой отдельной ячейки на квадратный текущий шаг, вызывающий задержку ~ 50 мс до первого всплеска.В присутствии TTX траектория напряжения находилась значительно больше времени выше средней точки по сравнению с контролем (рис. 9B; TTX: 0,84 ± 0,03 по сравнению с контролем: 0,68 ± 0,01, P <0,001, n = 6–18). ). К сожалению, 10 нМ TTX исключили возможность генерировать непрерывный импульсный разряд, который требуется для измерений кривой f-I . Как следствие, мы ограничили наш анализ выхода клеток в присутствии TTX кривыми вероятности пика. Как указано, колебания мембранного напряжения были более эффективными при сдвиге реобазы и сглаживании кривой вероятности пика в присутствии ТТХ (рис. 9D и 9E).Сдвиг реобазы влево увеличился с 64,4 ± 7,7 пА до 134 ± 25 пА (рис. 9Ei; парный t-критерий Стьюдента, P = 0,001, n = 10), а коэффициент наклона увеличился с 18,0 ± 1,3 пА до 29,6 ± 4,7 пА. (Рис. 9Eii; парный t-критерий Стьюдента, P = 0,02, n = 10). Эти результаты показывают, что уменьшение величины подпороговой проводимости Na + приводит к появлению более экспоненциально-подобных траекторий, что приводит к усилению модуляции кривых вероятности всплеска на основе флуктуаций.
Манипулирование проводимостью мембраны с помощью динамического зажима изменяет траектории напряжения и модуляцию входных-выходных характеристик колебаниями напряжения
Для дальнейшего исследования роли сопротивления мембраны и проводимости с отрицательным наклоном в формировании модуляции отклика ввода-вывода за счет колебаний напряжения, мы манипулировали сопротивлением мембраны в звездчатых клетках с помощью динамического зажима, вводя искусственные проводимости с отрицательным или положительным наклоном.В частности, нас интересовали эффекты отрицательного наклона проводимости, поскольку способность проводимости Na + увеличивать входное сопротивление и замедлять скорость изменения напряжения мембраны связана с отрицательным наклоном, связанным с Na + IV. отношения [26]. Следовательно, введение искусственной проводимости с отрицательным наклоном должно еще больше уменьшить основанную на флуктуации модуляцию входных-выходных сигналов. И наоборот, добавление положительной наклонной проводимости должно увеличивать модуляцию посредством флуктуаций напряжения за счет уменьшения влияния эндогенно выраженной отрицательной наклонной проводимости.
Для отрицательной наклонной проводимости мы использовали значение -5 нСм, которое было максимальным значением, которое можно было добавить без возникновения нестабильности, и которое увеличило сопротивление мембраны, измеренное при -75 мВ, с 68,9 ± 8,9 МОм до 102 ± 13 МОм. Положительная проводимость была установлена на 15 нСм, а сопротивление мембраны снизилось до 34,1 ± 2,7 МОм. Для положительной проводимости значения более 15 нСм приводили к потере непрерывного всплеска, аналогично тому, что сообщалось в пирамидных клетках CA1 с использованием этой манипуляции [42,43].И отрицательная, и положительная проводимость были линейными с реверсивным потенциалом -75 мВ.
Как и в случае с экспериментами TTX, мы количественно оценили изменения траекторий первого всплеска напряжения, используя долю времени выше средней точки. Изменения в проводимости мембраны оказали значительное влияние на траекторию, ведущую к порогу спайков (рис. 10А; односторонний дисперсионный анализ, P <0,001, n = 8–18). Отрицательная проводимость уменьшила долю времени выше средней до 0,59 ± 0,02, а добавление положительной проводимости увеличило это значение до 0.82 ± 0,02 (рис. 10В; P <0,001, тест Тьюки).
Рис. 10. Изменения траектории напряжения начального пика и межспайкового интервала при использовании динамического фиксатора.
(A) Средние траектории мембранного напряжения для начального приближения к спайку в звездчатых клетках при -5 нСм (красный), контрольный (черный) и 15 нСм искусственной проводимости мембраны, добавленные с динамическим зажимом. Более тонкие линии обозначают сем. (B) График средней доли выше средней точки для начальных траекторий пикового напряжения с использованием -5 нСм, контроля и 15 нСм уровней искусственной проводимости мембраны.(C) Средние траектории мембранного напряжения в звездчатых клетках с использованием динамического зажима с -5 нСм (красный), контроль (черный) и 15 нСм (синий) искусственной проводимости мембраны. (D) График средней полупериод продолжительности AHP для траекторий межспайкового интервала напряжения при -5 нСм, контроле и 15 нСм искусственной проводимости мембраны.
https://doi.org/10.1371/journal.pcbi.1004188.g010
Изменение проводимости мембраны также оказало значительное влияние на продолжительность AHP, связанного с непрерывным возбуждением на частоте ~ 4 Гц (рис. 10C; односторонний дисперсионный анализ ANOVA, Р <0.001, n = 9–12). Отрицательная проводимость привела к значительному увеличению полупериода AHP (время от минимума до средней точки напряжения между минимальным и импульсным порогом, рис. 10D; 98,1 ± 5,3 мс, P <0,001, тест Тьюки). Хотя положительная проводимость не приводила к значительному изменению полупериода AHP по сравнению с контролем при принятии во внимание повторных измерений, наблюдалось снижение средних значений (43,4 ± 4,5 мс, P = 0,07, критерий Тьюки). Следовательно, в целом, изменения в проводимости мембраны изменили продолжительность траекторий мембранного напряжения, приводящего к порогу всплеска, в форме, соответствующей нашему анализу модели eLIF.
Затем мы количественно оценили влияние отрицательных и положительных изменений в проводимости мембраны на модуляцию на основе флуктуаций кривых входа-выхода звездчатых клеток. Для каждого уровня проводимости мы сравнили изменения наклона и реобазы f-I и кривые вероятностей пиков, вызванные введением флуктуаций мембранного напряжения. Как и раньше, колебания мембран поддерживались на уровне SD ~ 2,5 мВ (-5 нСм, 2,3 ± 0,1 мВ, контроль: 2,41 ± 0,1 мВ; 15 нСм: 2,35 ± 0,01 мВ, n = 5, 19, 18).Анализ кривых fI показал, что усиление в значительной степени модулировалось изменениями проводимости мембраны, но не введением флуктуаций мембранного напряжения (рис. 11A и 11B; двухфакторный дисперсионный анализ ANOVA, P <0,001 для проводимости, P = 0,36 для колебаний напряжения. ). Вопреки ожиданиям [8,9,44,45], усиление кривой f-I можно модулировать, хотя и умеренно, только путем изменения проводимости мембраны. Что еще более важно, кривые звездчатых ячеек f-I поддерживали низкую степень модуляции на основе флуктуаций на всех трех уровнях проводимости.Следует отметить, что модель eLIF, использующая Δ T = 15 мВ, но не Δ T = 2 мВ, также дает небольшое уменьшение усиления при увеличении проводимости мембраны. Этот результат связан с изменениями в среднем межспайковом интервале мембранного напряжения, вызванными изменениями проводимости, когда Δ T = 15 мВ, но не Δ T = 2 мВ.
Рис. 11. Модуляция входных-выходных сигналов звездчатых клеток с искусственным изменением проводимости мембраны, реализованная с помощью динамического зажима.
(A) График средних кривых звездчатой ячейки f-I с использованием уровней искусственной проводимости -5 нс (красный), контрольный (черный) и 15 нс (синий), а также при наличии и отсутствии колебаний напряжения на мембране. (B) График среднего усиления, измеренного с использованием линейной регрессии с использованием -5 нСм, контроль и 15 нСм с (открытые символы) и без (закрытые символы) колебаниями мембранного напряжения. (C) Изменение реобазы (i) и начальной скорости всплеска (ii) в кривых звездчатых клеток f-I в результате введения флуктуаций мембранного напряжения с -5 нСм, контроль и 15 нСм дополнительной проводимости.( D ) График средних кривых вероятности спайков звездчатых клеток при -5 нс (красный), контрольный (черный) и 15 нс (синий) с флуктуациями мембранного напряжения и без них. (E) Изменение реобазы (i) и фактора наклона сигмовидной кишки (ii) на кривых вероятности спайков звездчатых клеток ниже -5 нСм, контроль и 15 нСм в результате введения флуктуаций мембранного напряжения.
https://doi.org/10.1371/journal.pcbi.1004188.g011
Мы приступили к измерению изменений реобазы и начальной скорости воспламенения, связанных с кривыми f-I в результате колебаний напряжения при каждом из условий проводимости.Изменения проводимости мембраны значительно повлияли на способность искусственных колебаний изменять реобазу (рис. 11Ci; P <0,02, однофакторный дисперсионный анализ ANOVA, P = 0,01, тест Тьюки). Кроме того, колебания напряжения не смогли значительно снизить значения реобазы в присутствии -5 нСм проводимости (рис. 11Di; t-критерий Стьюдента для одного образца, P = 0,58), тогда как при 15 нСм реобаза значительно увеличилась (рис. 11Di; один образец Стьюдента). t-критерий, P <0,001). Как и в случае с реобазой, изменения в начальной скорости стрельбы спайков также были значительно изменены проводимостью мембраны (рис. 11Dii; P = 0.001, однофакторный дисперсионный анализ), при этом каждый уровень проводимости генерирует значительные различия в начальных скоростях возникновения спайков (рис. 11Cii; P <0,01, критерий Тьюки). При -5 нСм флуктуации напряжения проводимости не смогли значительно увеличить скорость срабатывания от нуля (рис. 11Cii; t-критерий Стьюдента для одного образца, P = 0,79), в то время как эти изменения были значительными под контролем и с 15 нСм (рис. 11Cii; один образец T-критерий Стьюдента, P <0,001).
Изменения, вызванные флуктуациями в кривых вероятности пиков, отражали изменения, наблюдаемые на кривых f-I (рис. 11D и 11E).Как для реобазы, так и для фактора наклона проводимость оказала значительное влияние (рис. 11Ei и 11Eii; P <0,001, однофакторный дисперсионный анализ). Увеличение проводимости мембраны на 15 нСм привело как к увеличению способности флуктуаций напряжения сдвигать реобазу, так и к сглаживанию кривых вероятности пика (рис. 11E). При уменьшении проводимости мембраны (-5 нСм) изменения и сглаживание реобаз были менее выраженными (рис. 11D и 11E).
В целом, эти результаты согласуются с нашей гипотезой и указывают на то, что более медленная и более линейная траектория напряжения, установленная увеличением сопротивления мембраны за счет отрицательной крутизны проводимости, снижает модуляцию отклика ввода-вывода колебаниями напряжения.Кроме того, линеаризация траекторий напряжения фундаментально связана с отрицательной крутизной проводимости, связанной с активацией тока Na + . Наши данные показывают, что нелинейные свойства мембраны формируют потенциал для колебаний напряжения, чтобы модулировать реакции ввода-вывода нейронов.
Обсуждение
Наше исследование демонстрирует результаты, которые имеют важное значение для модуляции ввода-вывода отдельных ячеек через изменения проводимости мембраны и колебания напряжения.Во-первых, реакции ввода-вывода звездчатых клеток модулируются в небольшой степени флуктуациями мембранного напряжения в контролируемых условиях, а также повышенной проводимостью мембраны. Во-вторых, как в моделях, так и в звездчатых клетках, зависящий от напряжения внутренний ток, возникающий в результате отрицательной наклонной проводимости, которая активируется в значительной подпороговой и перипороговой областях, отвечает за низкие уровни модуляции входных-выходных сигналов, опосредованной флуктуациями. Наконец, отрицательная крутизна проводимости уменьшила вызванные флуктуацией изменения в отклике ввода-вывода за счет линеаризации и замедления траекторий мембранного напряжения, что также привело к образованию неглубокой и нелинейной кривой f-V .
Управление выбросом нервных импульсов с помощью колебаний мембранного напряжения и изменений проводимости мембраны
Колебания мембранного напряжения и изменения проводимости мембраны (например, ингибирование шунтирования) считаются ключевыми факторами, которые контролируют масштабирование нейронального ввода-вывода [7–9,11,45]. Общепринятая роль колебаний напряжения заключается в снижении порога выброса и усилении слабых входных сигналов [5,6]. Таким образом, размер и спектральный состав колебаний напряжения можно использовать для потенциально стробирующих входов, как это предлагается некоторыми сетевыми моделями [46].Кроме того, флуктуирующий ток на входе может раздельно масштабировать кривую f-I за счет непропорционального увеличения частоты срабатывания импульсов вблизи порогового значения [5,7–10]. Более того, было показано, что в условиях спайков, вызванных флуктуациями, частота спайков может масштабироваться с подпороговым мембранным напряжением для значимой части динамического диапазона клетки [9,10]. По этой причине при наличии значительных колебаний напряжения ожидается, что изменения в подпороговом соотношении IV , вызванные подавлением шунтирования, уравновешиванием возбуждающей и тормозной проводимости или просто введением проводимости утечки, приведут к дальнейшему снижению наклон кривой fI .Считается, что изменения наклона кривой fI имеют решающее значение для настройки кривой настройки отдельных клеток, и было предложено сыграть решающую роль в сенсорной обработке, особенно в зрительной системе, в отношении настройки спайкового ответа нейронов на контраст [3,12,37,45]. Таким образом, синаптические колебания напряжения участвуют в установке как порогового значения нейрональных импульсов, так и общего масштабирования отношений ввода-вывода.
Данные гранулярных клеток мозжечка [9] и моделирование на основе компартментных моделей [10] убедительно продемонстрировали, что частота спайков действительно может масштабироваться с подпороговым мембранным напряжением после добавления колебаний напряжения.В гранулярных ячейках, например, флуктуации позволяют генерировать всплески в диапазоне более 100 всплесков в секунду при том, что в противном случае было бы подпороговыми значениями напряжения при отсутствии флуктуаций. Наши данные, однако, предполагают, что этот сценарий нельзя обобщать, по крайней мере, в пределах физиологических колебаний напряжения. В случае звездчатых клеток и нашей модели eLIF (Δ T = 15 мВ) масштабирование частоты всплесков с подпороговым мембранным напряжением сильно ограничено из-за очень мелкого соотношения фВ и , которое ограничивает диапазон частот всплеска. в котором колебания напряжения могут вызывать всплески.В соответствии с нашей интерпретацией, гранулярные клетки имеют очень крутые кривые f-V в отсутствие значительных флуктуаций напряжения на мембране, с диапазоном 250 пиков / с, возникающим при менее чем 2,5 мВ [9]. Аналогичным образом, моделирование, поддерживающее этот механизм [10], было выполнено в компартментальной модели, также выражающей крутое соотношение f-V (80 пиков / с более ~ 2,5 мВ). Напротив, звездчатые клетки и модель eLIF (Δ T = 15 мВ) генерируют кривые f-V с наклоном в диапазоне 4–5 пиков / мВ.Таким образом, представленные здесь результаты показывают, что характеристики кривой f-V и ее связь с траекториями напряжения, ведущими к всплескам, имеют решающее значение для понимания того, в какой степени нейронные функции ввода-вывода модулируются колебаниями напряжения.
Степенное масштабирование кривой f-V звездчатой ячейки без колебаний напряжения
В зрительной системе степенное масштабирование между частотой импульсов импульсов и мембранным напряжением пирамидных нейронов слоя II является критическим для контроля усиления и инвариантности контраста [12,37].Моделирование показало, что степенное масштабирование с показателем, близким к 2, между частотой возникновения пиков и напряжением может возникнуть в результате комбинации внутреннего, крутого и линейного соотношения fV и сглаживания колебаний напряжения, распределенных по Гауссу [3,19, 34,47]. В отличие от прошлых предположений, наши данные показывают, что кривая f-V плохо аппроксимируется крутой линейной функцией, и что часть нелинейного масштабирования между частотой всплесков и напряжением может быть результатом внутренних свойств мембраны, зависящих от напряжения.
Для модели eLIF, использующей Δ T = 15, постепенная активация отрицательной наклонной проводимости играет решающую роль в настройке неглубокой нелинейной кривой f-V . При постепенной активации деполяризация приводит к изменению среднего напряжения при различных скоростях разряда пиков. Это связано с тем, что на скорость изменения напряжения сильно влияет активация отрицательной крутизны проводимости. По мере того, как постепенно активируются все большие значения отрицательной крутизны проводимости, форма и среднее значение траектории напряжения между импульсами значительно изменяются.Это не относится к Δ T = 2 мВ, потому что траектория напряжения на разных частотах в значительной степени определяется пассивными свойствами мембраны, что приводит к экспоненциальному подходу, который не претерпевает изменения среднего с увеличением уровня. деполяризации и скорострельности.
Значение для функции сети MEC
Звездчатые клетки участвуют в пространственной навигации через их сетчатые пространственные поля запуска [48]. Возможно, что низкая степень модуляции откликов ввода-вывода флуктуациями мембранного напряжения в звездчатых клетках помогает поддерживать стабильные схемы возбуждения по отношению к пространственному положению.Уменьшая влияние быстрых колебаний напряжения на скорость возбуждения и реакции ввода-вывода, поведение звездчатых клеток, вероятно, способствует повышению надежности входов, непосредственно связанных с соответствующей сетевой активностью [31,32]. В соответствии с этой интерпретацией, наша предыдущая работа по синхронизации спайк-фазы в звездчатых клетках продемонстрировала очень высокую степень синхронизации спайк-фазы для медленных (1–10 Гц) колебательных входов в присутствии случайных флуктуаций напряжения и повышенной проводимости мембраны [49]. .
Роль Na
+ проводимости и пороговой динамики в определении модуляции ввода-вывода колебаниями напряженияКлючевым фактором в уменьшении модуляции ввода-вывода флуктуациями мембранного напряжения в звездчатых клетках является постепенная активация проводимости Na + . При замедлении приближения к порогу выброса постепенная активация проводимости Na + приводит к тому, что напряжение на мембране оказывается дальше от порогового значения для большой части траектории.Ввод тока, связанный с измерениями кривой f-I , приводит к постепенному изменению среднего напряжения и небольшому постепенному увеличению скорости стрельбы, что приводит к неглубокому соотношению f-V . И модель LIF, и модель eLIF, реализованные с небольшими значениями Δ T , выражают линейные подпороговые свойства мембраны. Это приводит к экспоненциальному приближению к пороговому значению, при котором напряжение на мембране рано выходит на плато, и большая часть времени тратится около порога всплеска.В результате небольшие изменения входного тока и напряжения мембраны приводят к большим изменениям скорости стрельбы.
Помимо звездчатых клеток, кортикальные нейроны в зрительной коре [39], клетки Пуркинье мозжечка [50] и интернейроны полосатого тела [51] демонстрируют постепенное увеличение сопротивления мембраны с деполяризацией, которая опосредуется током Na + . Следовательно, поведение, наблюдаемое в звездчатых клетках, вероятно, применимо к широкому кругу различных нейронов.
С точки зрения нелинейной динамики, увеличение сопротивления мембраны, которое приводит к области отрицательной наклонной проводимости вблизи порога, согласуется с бифуркацией седло-узел.Эта бифуркация часто связана с характеристиками типа I, присутствующими в корковых пирамидных клетках [52]. С другой стороны, быстродействующие интернейроны коры головного мозга были классифицированы как тип II, с пороговым поведением, часто моделируемым с использованием бифуркации Хопфа и, следовательно, не требующим увеличения сопротивления мембраны [52,53]. Предыдущие моделирование и экспериментальные исследования показали, что поведение типа I способствует высокой чувствительности к колебаниям мембранного напряжения [18,52,54]. К сожалению, выявить четкую взаимосвязь между степенью модуляции входных-выходных характеристик флуктуациями напряжения и типом пороговой бифуркации затруднительно.Наш механизм требует постепенного увеличения удельного сопротивления мембраны в диапазоне 20 мВ, в то время как определение между седло-узлом и бифуркацией Хопфа устанавливается в непосредственной близости от порога спайка, который часто меньше 1 мВ. Однако флуктуации напряжения in vivo могут охватывать диапазон более 10 мВ, так что интегральное поведение клетки в больших областях подпорогового напряжения, которые находятся далеко за пределами непосредственной близости от порогового значения всплеска, становится решающим для понимания того, как клетка реагирует на колебания напряжения.По этим причинам мы полагаем, что любая форма и тип бифуркации могут привести к низкой или высокой чувствительности реакции ввода-вывода к случайным колебаниям напряжения.
Материалы и методы
Заявление об этике
Все экспериментальные протоколы были одобрены Комитетом по институциональному уходу и использованию животных Университета Юты.
Препарат ткани
Горизонтальные срезы гиппокампа и энторинальной коры получали от 25-50-дневных крыс Long-Evans любого пола.Все химические вещества были получены от Sigma-Aldrich (Сент-Луис, Миссури), если не указано иное. После анестезии изофлураном и декапитации мозг извлекали и погружали в раствор искусственной спинномозговой жидкости (ACSF) при 0 ° C, состоящий из следующего: (в мМ): NaCl (125), NaHCO 3 (25), D-глюкоза ( 25), KCl (2), CaCl 2 (2), NaH 2 PO 4 (1,25), MgCl 2 (1) и забуференный до pH 7,4 с 95/5% O 2 / CO 2 газ. Горизонтальные срезы нарезали толщиной 400 мкм (Leica VT 1200, Leica Microsystems; Wetzlar, Германия).После процедуры нарезки срезы инкубировали в ACSF при 30 ° C в течение 20 минут перед охлаждением до комнатной температуры (20 ° C). После инкубационного периода срезы переносили на предметный столик инфракрасного дифференциального интерференционного контрастного микроскопа (Axioscope 2+; Zeiss, Оберкохен, Германия). Все записи проводились при температуре от 32 до 34 ° C.
Электрофизиология
Электроды вытягивали на горизонтальном съемнике (P97; Sutter Instruments, Novato, CA) и заполняли внутриклеточным раствором, состоящим из следующих веществ (в мМ): K-глюконат (120), KCl (20), HEPES (10), diTrisPhCr (7), Na 2 ATP (4), MgCl 2 (2), Tris-GTP (0.3), EGTA (0,2) и забуференный КОН до pH 7,3. Сопротивление конечных электродов составляло от 2 до 5 МОм, а значения сопротивления доступа составляли от 5 до 16 МОм. Компенсация баланса моста использовалась для всех записей. Значения сопротивления уплотнения всегда превышали 1 ГОм. Электрофизиологические записи выполнялись с помощью усилителя с токовыми фиксаторами (Axoclamp 2B; Molecular Devices, Юнион-Сити, Калифорния), а данные были получены с использованием специального программного обеспечения, разработанного в Matlab (v.2011, Mathworks, Натик, Массачусетс) с использованием набора инструментов для сбора данных.Расчетный потенциал перехода в 10 мВ был вычтен для анализа данных. Таким образом, средний потенциал покоя, описанный здесь (-75 мВ), на 10 мВ более гиперполяризован, чем описанный в других местах для звездчатых клеток [55,56].
Идентичность звездчатых клеток была установлена с использованием следующих критериев: 1) наличие провала мембранного напряжения, обусловленного гиперполяризацией, 2) измерения импеданса и резонанса, указывающие на установившееся входное сопротивление в состоянии покоя между 35 МОм и 80 МОм и наличие ~ Пик резонанса 5 Гц, определенный с использованием методов, описанных ранее [49] и 3) расположение и морфология клеток с помощью оптики DIC-IR (т.е.е. во II слое МЭК и с непирамидальной формой тела клетки).
Для экспериментов с ограничением напряжения мы держали ячейки при каждом соответствующем напряжении (от -85 до -65 мВ), использовали небольшой шаг (5 мВ) и измеряли изменение тока. Отношение изменения напряжения и тока использовалось для измерения входного сопротивления при каждом соответствующем удерживающем напряжении.
Для экспериментов с динамическими зажимами усилитель с токовыми фиксаторами управлялся аналоговым сигналом от персонального компьютера x86, работающего под управлением прикладного интерфейса реального времени Linux и экспериментального интерфейса реального времени (RTXI) [57,58].Ингибирование шунтирования ( I дюйм ) было реализовано с использованием RTXI по следующему уравнению: Для этих экспериментов E дюйм и г дюйм были установлены на -75 мВ и 15 нс, соответственно. В случае отрицательной проводимости (рис. 10 и 11) член г дюйм был установлен на -5 нСм. Для всех экспериментов частота дискретизации динамического зажима была установлена на 10 кГц. Измеренный потенциал перехода приблизительно 10 мВ был вычтен из всех записей.Данные собирали при 10 кГц и фильтровали при 3 кГц. Колебания входного тока были реализованы с помощью фильтрованного белого шума с использованием фильтра нижних частот ( f срез = 100 Гц). Текущий сигнал был построен в частотной области с использованием масштабирования амплитуды частоты ( A ( f )) A ( f ) = 1 / (1+ ( f / f cut )). Функция Matlab ifft использовалась для реализации обратного преобразования Фурье и генерации временных рядов из сигналов, построенных в частотной области.Для каждой ячейки мы записали короткий испытательный период, в течение которого колебания входного тока регулировались для поддержания стандартного отклонения (SD) колебаний мембранного напряжения в состоянии покоя (-75 мВ) на уровне ~ 2,5 мВ.
Для блока каналов Na + применяли ванну с тетродотоксином (TTX, Tocris, Бристоль, Великобритания) в концентрации 10 нМ. Записи с ТТХ проводились примерно через 15 минут после нанесения препарата в ванне.
Симуляции и модели
Для модели экспоненциальной утечки, интегрирования и возгорания (eLIF) [27], динамика мембранного напряжения регулируется следующим дифференциальным уравнением: где C = 170 пФ , V T = -60 мВ , g L = 25 нСм, E L = -75 мВ и Δ T = 15 мВ (по умолчанию).Обратите внимание, что для пассивной версии модели (т. Е. Стандартной утечки интегрировать и воспламенять) первый член г L был установлен на ноль, а отдельный член утечки использовался с тем же обратным потенциалом и с использованием значение проводимости 15 нСм. Это значение проводимости создает пассивную модель с тем же входным сопротивлением, что и модель eLIF при -75 мВ. Из-за экспоненциального члена в eLIF, напряжение на мембране расходится до бесконечности при пересечении V T .Для моделирования eLIF напряжение мембраны было сброшено до V R (-65 мВ) при достижении значения 0 мВ. В пассивной модели отсутствуют истинные пороговые явления, поэтому искусственный порог был установлен на -55 мВ, а напряжение на мембране было сброшено до -65 мВ после пересечения этого порогового значения. Все модели были смоделированы в Matlab и решены прямым методом Эйлера с шагом по времени 0,01 мс. Мы также протестировали модельные решения с шагом по времени 0,001 мс и получили те же результаты.
Для модели, основанной на формулировке H-H (рис. 6), мембранное напряжение определялось следующими уравнениями: где C = 170 пФ, τ n = 3 мс, E Na = 50 мВ, E K = -90 мВ, E L = -80 мВ, г Na = 170 нСм, г K = 90 нс, г Nap = 150 нС и г течь = 20 нСм.Чтобы уменьшить размерность модели, мы использовали приближение, что h ≈ 1-n и что m и p мгновенно уравновешиваются с мембранным напряжением, поскольку их постоянные времени меньше постоянной времени мембраны.
Как и в экспериментах, колебания тока генерировались с использованием фильтрованного белого шума, генерируемого с использованием того же уравнения и частоты отсечки (100 Гц), что и в экспериментах. Чтобы гарантировать стандартное отклонение 2,5 мВ при напряжении -75 мВ, каждая модель испытывалась с постепенно увеличивающимися коэффициентами шума до стандартного отклонения 2.5 мВ было надежно измерено в небольшой области значений коэффициента при -75 мВ в течение 15 с. Колебания тока были добавлены к члену постоянного тока ( I e ) в приведенном выше уравнении (т. Е. Аддитивный шум). Чтобы увеличить модельную проводимость мембраны, был добавлен отдельный член г L с использованием реверсивного потенциала -75 мВ.
Анализ и статистика
Все анализы проводились в Matlab с использованием специального программного обеспечения и / или встроенных функций.Для аппроксимации степенного закона и соответствия Больцмана мы также подтвердили соответствие в Origin 8.5 (OriginLab, Нортгемптон, Массачусетс). Время всплеска определяли с использованием порогового значения для мембранного напряжения. Частоту всплесков определяли с использованием среднего значения, обратного первым трем интервалам между всплесками, полученным из одной или двух секундных шагов тока. Средние значения усиления были определены путем усреднения отдельных значений наклона, полученных с использованием линейного регрессионного анализа отношения f-I . Значения реобазы рассчитывались как минимальный ток, необходимый для вызова 4 пиков от удерживающего напряжения -75 мВ.Для иллюстрации средних кривых f-I , показанных на рис. 1 и 8, мы откалибровали начальную точку кривой f-I таким образом, чтобы начальное значение каждой ячейки было близко к средней реобазе, рассчитанной для данного условия. Для кривых вероятности всплеска текущая длительность шага составляла 100 мс, и каждый текущий размер шага повторялся от 15 до 25 раз, при этом вероятность всплеска определялась как количество шагов, вызвавших всплески, деленное на общее количество шагов. Индивидуальные кривые вероятности выброса ( P ( I )) были подогнаны с помощью функции Больцмана следующим образом: где P — вероятность выброса пика, I половина — текущее значение размера шага, необходимое для выявления 0.Вероятность 5 ( P, 0,5 ) пиковой разрядки и k — наклон (большие значения обозначают меньший наклон) кривой. Подгонки использовались для расчета коэффициента наклона ( k ), в то время как реобаза для кривых вероятности была определена как текущий размер шага, необходимый для выявления P 0,2 в импульсном разряде.
Для кривой f-V результаты экспериментов и моделирования были подобраны с использованием степенной функции: где f — интенсивность стрельбы, p — показатель степени соответствия, указанный в разделе результатов, a и b — положительные константы, а V C — минимальное напряжение, необходимое для выявления генерация шипа.Обратите внимание, что член a был ограничен так, что были возможны только значения 1 или больше. Все аппроксимации использовали метод наименьших квадратов.
Чтобы количественно оценить влияние флуктуаций мембранного напряжения на импульсный разряд в моделях во время непрерывного выброса (рис. 7C), мы сначала рассмотрели периодический выброс модельного элемента в отсутствие случайных колебаний (с периодом ~ 270 мс) и определили долю интервала как время интервала между всплесками, деленное на общий период. В каждой заданной части интервала мы брали детерминированное состояние модели (значение для напряжения и всех других переменных) и использовали его в качестве начального условия для набора из 1000 тестовых имитаций, каждые 50 мс длительностью, в которые затем добавлялись флуктуации.

 Недостатком можно считать то, что влага испаряется не сразу, и может появляться ощущение, что изделие мокрое;
Недостатком можно считать то, что влага испаряется не сразу, и может появляться ощущение, что изделие мокрое; см², не более
см², не более