Скелетные мышцы регулируются только: Дополните предложения 1. Биохимические реакции в клетке происходят при участии
3. Согласованная работа мышц. Роль нервной системы в регуляции деятельности мышц
Регуляция деятельности скелетных мышц
Сокращение мышц приводит в движение определенную часть тела и обусловливает перемещение организма в пространстве или поддержание определенной позы тела. Сокращение мышцы складывается из суммы сокращений отдельных мышечных волокон.
К каждой мышце подходят кровеносные сосуды и нервы, содержащие чувствительные и двигательные волокна.
По отросткам чувствительных нейронов нервные импульсы от рецепторов кожи, мышц, сухожилий, суставов передаются в центральную нервную систему.
По отросткам двигательных нейронов импульсы проводятся из головного и спинного мозга к мышце. Нервные импульсы, пришедшие из спинного мозга, заставляют мышцу сокращаться. Таким образом, сокращение мышц в организме совершается рефлекторно.
Обрати внимание!
Мышечное волокно возбуждается нервными импульсами, поступающими от двигательных нейронов (мотонейронов).
Передача возбуждения происходит в нервно-мышечном синапсе.
Любые движения, происходящие по желанию человека, называют произвольными. Они контролируются головным мозгом.
Непроизвольные движения осуществляются рефлекторно, например в ответ на укол острым предметом или прикосновение к горячему предмету, и могут быть вызваны механическим раздражением нервных окончаний, находящихся в коже.
Согласованная работа мышц
Работа всех групп скелетных мышц, обслуживающих какой-либо сустав происходит согласованно, так как находится под контролем головного мозга.
Согласованная деятельность мышц сгибателей и разгибателей суставов возможна благодаря чередованию процессов возбуждения и торможения в нервных клетках спинного мозга.
Сгибание в суставе осуществляется при сокращении мышц сгибателей и одновременном расслаблении мышц разгибателей.
Пример:
Сокращение мышц сгибателей руки вызывается возбуждением двигательных нейронов спинного мозга. Одновременно расслабляются мышцы разгибатели. Это связано с торможением других двигательных нейронов, связанных с мышцами разгибателями.
Мышцы сгибатели и мышцы разгибатели сустава могут одновременно находиться в расслабленном состоянии. Так, мышцы свободно висящей вдоль тела руки находятся в состоянии расслабления.
При удержании тяжелого предмета (гири или гантели) в горизонтально вытянутой руке наблюдается одновременное сокращение и сгибателей, и разгибателей сустава.
Утомление мышц — временное понижение работоспособности органа.
Утомление мышц связано с накоплением в них молочной кислоты. Кроме того, при утомлении расходуются запасы гликогена и снижается интенсивность синтеза АТФ.
Работоспособность мышц быстрее восстанавливается при чередовании их сокращения и расслабления (т.е. выполнении ритмичных движений), так как в промежутках между сокращениями работоспособность мышц частично восстанавливается.
Работа скелетной мускулатуры может регулироваться не только нервной системой, но и гуморальным путём (с помощью различных биологически активных веществ, приносимых к мышцам системой кровообращения).
Источники:
Пасечник В.В., Каменский А.А., Швецов Г.Г./Под ред. Пасечника В.В. Биология. 8 класс.– М.: Просвещение
Любимова З.В., Маринова К.В. Биология. Человек и его здоровье. 8 класс – М.: Владос
Колесов Д.В., Маш Р.Д., Беляев И.Н. Биология 8 М.: Дрофа
Драгомилов А. Г., Маш Р. Д. Биология 8 М.: ВЕНТАНА-ГРАФ
Лернер Г.И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель
http://school-collection.edu.ru
Физические упражнения защитили мышцы от вызванной воспалением дистрофии
Zhaowei Chen et al. / Science Advances, 2021
/ Science Advances, 2021
Ученые подтвердили, что физические упражнения предупреждают потерю мышечной массы, слабость и дисфункцию мышц, вызванную хроническим воспалением. Например, хроническими обструктивными заболеваниями, ревматоидным артритом, перенесенным гриппом или вследствие цитокинового шторма в течение ковида. Проведенное исследование также доказало, что разработанная учеными 3D-модель мышечной ткани может использоваться и в дальнейшем для изучения воспалительных заболеваний мышц
Скелетные мышцы составляют около 45 процентов массы тела человека, и их способность сокращаться необходима для поддержания жизнеспособности. Здоровые мышцы могут регенерировать после незначительных травм с помощью мышечных стволовых клеток. Этот процесс запускается вследствие местного и системного воспалительного ответа, в частности, цитокин интерферон-гамма (IFN-γ) регулирует процесс формирования мышечной ткани. И если воспаление, возникшее вследствие травмы, побуждает мышцы к регенерации, то нерегулируемые воспалительные процессы, которые характерны для некоторых заболеваний, приводят к потере мышечной массы и мышечной слабости. К таким заболеваниям относятся, например, хронические обструктивные легочные заболевания, ревматоидный артрит и дерматомиозит. Кроме того, повышенный уровень IFN-γ в крови обычно наблюдается после гриппа или цитокинового шторма вследствие тяжелого течения ковида.
Связь хронического воспаления и мышечной дистрофии была подтверждена экспериментами на грызунах и клиническими исследованиями. Соответствующих исследований in vitro проведено не было из-за отсутствия подходящих моделей: обычная культура мышечных клеток не воспроизводит многих свойств мышечной ткани.
Ранее группа исследователей из Дюкского университета (США) под руководством Ненада Бурсака (Nenad Bursac) разработала 3D-модель человеческих скелетных мышц («мышечные пучки»). Тогда ученые показывали, что мышечные пучки отвечают на электрическую стимуляцию, имитирующую физические упражнения, соответствующими изменениями в метаболизме и приростом в размере и силе. В новой работе эта же группа ученых описала механизм прямого влияния IFN-γ на структуру и функцию скелетных мышц, а также показала положительный эффект физических упражнений.
Ученые исследовали влияние IFN-γ на мышечные пучки, культивированные из клеток трех независимых доноров. На пучки воздействовали интерфероном в дозировке 20 нанограмм на миллилитр в течение недели, а затем проверяли, есть ли изменения в их структуре, биохимических и функциональных свойствах и в выделении сигнальных молекул цитокинов. При этом часть клеток в ходе эксперимента получала не только дозы интерферона, но подвергалась электрическому воздействию, который имитировал физические упражнения. Еще часть только «занималась спортом».
Мышечные пучки, которые получали IFN-γ, ослабли по сравнению с контрольной группой. Например, интерферон снизил амплитуду тетануса, длительного сокращения мышцы, на 68 процентов. Электрическая стимуляция улучшила показатели клеток, приблизив их к показателям контрольной группы, которая не подвергалась воздействию интерферона.
Само по себе воздействие интерферона к потере мышечной массы не привело. Однако те клетки, которые только «занимались физическими упражнениями», набрали больше массы, чем те, которые получали электрическую стимуляцию одновременно с дозами интерферона. Интерферон же снизил диаметр мышечных трубочек (8,8 микрометров против 11,3 микрометров у клеток из контрольной группы), а электрическая стимуляция обратила этот эффект. Схожая тенденция наблюдалась при измерении длины клеток.
Воздействие интерфероном также повлияло на состав сигнальных молекул, выделяемых клетками: в среде повысилось содержание некоторых провоспалительных цитокинов. И этот эффект оказался обратим электрической стимуляцией клеток.
Электрическая стимуляция частично (на 50 процентов) ослабила активацию сигнального пути JAK/STAT в мышечных пучках. Это доказывает, что вдобавок к прямой пользе физических упражнений, существует определенный молекулярный механизм, обеспечивающий противовоспалительный эффект «физкультуры», который предотвращает ослабление мышц. Кроме того, существующие препараты-ингибиторы янус-киназы (JAK) тофацитиниб и барицитиниб в клинических дозах также предотвратили структурные и функциональные потери в мышечных клетках.
Таким образом, авторы работы показали, что физические упражнения напрямую препятствуют вызванной хроническими воспалительными процессами мышечной атрофии, и возможно сами по себе являются противовоспалительной терапией таких заболеваний. Кроме того, ученые отмечают, что добавление немышечных клеток в их модель, а также использование различных провоспалительных цитокинов и имитирующих упражнения режимов позволит и дальше исследовать механизмы воспалений человеческих мышц и разрабатывать эффективное лечение мышечных дистрофий.
О пользе физических упражнений для восстановления функций мышц после болезней ученые и медики говорили и ранее. Так, было показано, что утрата мышечного тонуса после травм или болезней обратима.
Вера Сысоева
РОЛЬ МИОКИНОВ В МЕЖТКАНЕВОМ ВЗАИМОДЕЙСТВИИ И РЕГУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ: ОБЗОР ЛИТЕРАТУРЫ | Цориев
1. Pedersen BK, Åkerström TC, Nielsen AR, et al. Role of myokines in exercise and metabolism. J Appl Physiol (1985). 2007 Sep;103(3): 1093-1098. doi: 10.1152/ japplphysiol.00080.2007. Epub 2007 Mar 8.
Pedersen BK, Åkerström TC, Nielsen AR, et al. Role of myokines in exercise and metabolism. J Appl Physiol (1985). 2007 Sep;103(3): 1093-1098. doi: 10.1152/ japplphysiol.00080.2007. Epub 2007 Mar 8.
2. Гребенникова Т.А., Белая Ж.Е., Цориев Т.Т., и др. Эндокринная функция костной ткани // Остеопороз и остеопатии. — 2015. — №1. — С. 28-37. [Grebennikova TA, Belaya ZhE, Tsoriev TT, et al. Endocrine function of bone tissue. Osteoporoz i osteopatii. 2015;(1):28-37. (In Russ)]
3. Белая Ж. Е., Смирнова О. М., Дедов И. И. Роль физических нагрузок в норме и при сахарном диабете // Проблемы эндокринологии. — 2005. — Т.51. — №2. — С. 28-37. [Belaya ZhE, Smirnova OM, Dedov II. Rol’ fizicheskikh nagruzok v norme i pri sakharnom diabete. (Role of exercise in health and in diabetes mellitus.) Problemy endokrinologii. 2005;51(2):28-37. (In Russ)]
4. Pedersen BK, Febbraio MA. Muscle as an endocrine organ: focus on muscle-derived interleukin-6. Physiol Rev. 2008;88:1379-1406. doi:10.1152/physrev.90100.2007.
5. Pedersen BK. The diseasome of physical inactivity and the role of myokines in muscle-fat cross talk. J Physiol. 2009;587(Pt 23):5559-5568. doi: 10.1113/jphysiol.2009.179515. Epub 2009 Sep 14. Review.
6. Borg SA, Kerry KE, Baxter L, et al. Expression of interleukin-6 and its effects on growth of HP75 pituitary tumour cells. J Clin Endocrinol Metab. 2003;88:4938-4944. doi: 10.1210/jc.2002-022044.
7. van Hall G, Steensberg A, Sacchetti M, et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. J Clin Endocrinol Metab. 2003;88:3005-3010. doi: 10.1210/ jc.2002-021687.
J Clin Endocrinol Metab. 2003;88:3005-3010. doi: 10.1210/ jc.2002-021687.
9. Wallenius V, Wallenius K, Ahrén B, et al. Interleukin- 6-deficient mice develop mature-onset obesity. Nat Med. 2002;8:75-79. doi: 10.1038/nm0102-75.
10. Febbraio MA, Hiscock N, Sacchetti M, et al. Interleukin-6 is a novel factor mediating glucose homeostasis during skeletal muscle contraction. Diabetes. 2004;53:1643-1648.
11. Banzet S, Koulmann N, Simler N, et al. Control of gluconeogenic genes during intense/prolonged exercise: hormone-independent effect of muscle-derived IL-6 on hepatic tissue and PEPCK mRNA. J Appl Physiol. 2009; 107: 1830-1839. doi:10.1152/japplphysiol.00739.2009.
12. Bouzakri K, Plomgaard P, Berney T, et al. Bimodal effect on pancreatic β-cells of secretory products from normal or insulin-resistant human skeletal muscle. Diabetes. 2011;60:1111-1121. doi:10.2337/db10-1178.
13. Gopurappilly R, Bhonde R. Can multiple intramuscular injections of mesenchymal stromal cells overcome insulin resistance offering an alternative mode of cell therapy for type 2 diabetes? Med Hypotheses. 2012;78:393-395. doi:10.1016/j. mehy.2011.11.021.
14. Ellingsgaard H, Hauselmann I, Schuler B, et al. Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells. Nat Med. 2011;17:1481-1489. doi:10.1038/nm.2513.
Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells. Nat Med. 2011;17:1481-1489. doi:10.1038/nm.2513.
15. Nehlsen-Cannarella SL, Fagoaga OR, Nieman DC, et al. Carbohydrate and the cytokine response to 2.5 h of running. J Appl Physiol. 1997;82:1662-1667.
16. Pedersen BK, Steensberg A, Fischer C, et al. Searching for the exercise factor: is IL-6 a candidate? J Muscle Res Cell Motil. 2003;24:113-119.
17. Pedersen L, Pilegaard H, Hansen J, et al. Exercise-induced liver chemokine CXCL-1 expression is linked to muscle-derived interleukin-6 expression. J Physiol. 2011;589:1409-1420. doi:10.1113/jphysiol.2010.200733.
18. Boström P, Wu J, Jedrychowski MP, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012;481:463-468. doi:10.1038/nature10777.
19. Uldry M, Yang W, St-Pierre J, et al. Complementary action of the PGC-1 coactivators in mitochondrial biogenesis and brown fat differentiation. CellMetab. 2006 May;3(5):333-341. doi: 10.1016/j.cmet.2006.04.002.
20. Arany Z, He H, Lin J, et al. Transcriptional coactivator PGC-1 alpha controls the energy state and contractile function of cardiac muscle. Cell Metab. 2005 Apr;1(4):259-271. doi: 10.1016/j.cmet.2005.03.002.
21. Lin J, Wu PH, Tarr PT, et al. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice. Cell. 2004 Oct 1;119(1): 121-135. doi: 10.1016/j. cell.2004.09.013.
Cell. 2004 Oct 1;119(1): 121-135. doi: 10.1016/j. cell.2004.09.013.
22. Cui S, Tanabe O, Lim KC, et al. PGC-1 coactivator activity is required for murine erythropoiesis. Mol Cell Biol. 2014 Jun;34(11): 1956-1965. doi: 10.1128/MCB.00247-14. Epub 2014 Mar 24.
23. Ma D, Li S, Lucas EK, et al. Neuronal inactivation of peroxisome proliferator-activated receptor y coactivator 1a (PGC-1 a) protects mice from diet-induced obesity and leads to degenerative lesions. JBiolChem. 2010 Dec 10;285(50):39087-39095. doi: 10.1074/jbc.M110.151688. Epub 2010 Oct 13.
24. Rana KS, Arif M, Hill EJ, et al. Plasma irisin levels predict telomere length in healthy adults. Age (Dordr). 2014 Apr;36(2):995-1001. doi: 10.1007/s 11357-014-9620-9. Epub 2014 Jan 29.
25. Gaussin V, Depre C. Myostatin, the cardiac chalone of insulin-like growth factor-1. Cardiovasc Res. 2005;68:347-349. doi: 10.1016/j.cardiores.2005.09.007.
26. Shyu KG, Ko WH, Yang WS, et al. Insulin-like growth factor-1 mediates stretch-induced upregulation of myostatin expression in neonatal rat cardiomyocytes. Cardiovasc Res. 2005;68:405-414. doi: 10.1016/j.cardiores.2005.06.028.
27. McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature. 1997;387:83-90. doi: 10.1038/387083a0.
28. Sharma M, Kambadur R, Matthews K, et al. Myostatin, a transforming growth factor-beta superfamily member, is expressed in heart muscle and is upregulated in cardiomyocytes after infarct. J Cell Physiol. 1999;180:1-9. doi: 10.1002/ (SICI)1097-4652(199907)180:1<1::AID-JCP1>3.0.CO;2-V.
J Cell Physiol. 1999;180:1-9. doi: 10.1002/ (SICI)1097-4652(199907)180:1<1::AID-JCP1>3.0.CO;2-V.
29. Kanzleiter T, Rath M, Görgens SW, et al. The myokine decorin is regulated by contraction and involved in muscle hypertrophy. Biochem Biophys Res Commun. 2014 Jul 25;450(2): 1089-1094. doi: 10.1016/j.bbrc.2014.06.123. Epub 2014 Jul 1.
30. Karstoft K, Pedersen BK. Skeletal muscle as a gene regulatory endocrine organ. Curr Opin Clin Nutr Metab Care. 2016 Jul;19(4):270-275. doi: 10.1097/ MCO.0000000000000283.
31. Seidler DG, Mohamed NA, Bocian C, et al. The role for decorin in delayed-type hypersensitivity. J Immunol. 2011 Dec 1 ;187(11):6108-6119. doi: 10.4049/jimmunol. 1100373. Epub 2011 Oct 31.
32. Kalamajski S, Oldberg A. The role of small leucine-rich proteoglycans in collagen fibrillogenesis. Matrix Biol. 2010 May;29(4):248-253. doi: 10.1016/j.matbio.2010.01.001. Epub 2010 Jan 18.
33. Järveläinen H, Puolakkainen P, Pakkanen S, et al. A role for decorin in cutaneous wound healing and angiogenesis. Wound Repair Regen. 2006 Jul-Aug; 14(4):443-452. doi: 10.1111/j.1743-6109.2006.00150.x
34. Merline R, Lazaroski S, Babelova A, et al. Decorin deficiency in diabetic mice: aggravation of nephropathy due to overexpression of profibrotic factors, enhanced apoptosis and mononuclear cell infiltration. J Physiol Pharmacol. 2009 Oct;60 Suppl 4:5-13.
35. Rentz TJ, Poobalarahi F, Bornstein P, et al. SPARC regulates processing of procollagen I and collagen fibrillogenesis in dermal fibroblasts. J Biol Chem. 2007 Jul 27;282(30):22062-22071. Epub 2007 May 23.
SPARC regulates processing of procollagen I and collagen fibrillogenesis in dermal fibroblasts. J Biol Chem. 2007 Jul 27;282(30):22062-22071. Epub 2007 May 23.
36. Delany AM, Kalajzic I, Bradshaw AD, et al. Osteonectin-null mutation compromises osteoblast formation, maturation, and survival. Endocrinology. 2003 Jun;144(6):2588-2596. doi: 10.1210/en.2002-221044
37. Machado do Reis L, Kessler CB, Adams DJ, et al. Accentuated osteoclastic response to parathyroid hormone undermines bone mass acquisition in osteonectin-null mice. Bone. 2008 Aug;43(2):264-273. doi: 10.1016/j. bone.2008.03.024. Epub 2008 Apr 13.
38. Boskey AL, Moore dJ, Amling M, et al. Infrared analysis of the mineral and matrix in bones of osteonectin-null mice and their wildtype controls. J Bone Miner Res. 2003 Jun;18(6):1005-1011. doi: 10.1359/jbmr.2003.18.6.1005
39. Mendoza-Londono R, Fahiminiya S, Majewski J, et al. Recessive osteogenesis imperfecta caused by missense mutations in SPARC. Am J Hum Genet. 2015 Jun 4;96(6):979-985. doi: 10.1016/j.ajhg.2015.04.021. Epub 2015 May 28.
40. Kapinas K, Lowther KM, Kessler CB, et al. Bone matrix osteonectin limits prostate cancer cell growth and survival. Matrix Biol. 2012 Jun;31(5):299-307. doi: 10.1016/j. matbio.2012.03.002. Epub 2012 Apr 16.
41. Aoi W, Naito Y, Takagi T, et al. A novel myokine, secreted protein acidic and rich in cysteine (SPARC), suppresses colon tumorigenesis via regular exercise. Gut. 2013 Jun;62(6):882-889. doi: 10.1136/gutjnl-2011-300776. Epub 2012 Jul 31.
doi: 10.1136/gutjnl-2011-300776. Epub 2012 Jul 31.
42. Шишкин А.Н., Кирилюк Д.В. Дисфункция эндотелия у пациентов с прогрессирующими заболеваниями почек // Нефрология. — 2005. — Т. 9. — №2. — С. 16-22. [Shishkin AN, Kirilyuk DV. Endothelial dysfunction in patients with progressive renal disease. Nephrology. 2005;9(2): 16-22. (In Russ)
43. Nielsen AR, Pedersen BK. The biological roles of exercise-induced cytokines: IL-6, IL-8, and IL-15. Appl Physiol Nutr Metab. 2007 Oct;32(5):833-839. doi: 10.1139/H07-054. Review.
44. Nielsen AR, Mounier R, Plomgaard P, et al. Expression of interleukin-15 in human skeletal muscle effect of exercise and muscle fibre type composition. J Physiol. 2007 Oct 1;584(Pt 1):305-312. doi: 10.1113/jphysiol.2007.139618. Epub 2007 Aug 9.
45. Nielsen AR, Hojman P, Erikstrup C, et al. Association between interleukin-15 and obesity: interleukin-15 as a potential regulator of fat mass. J Clin Endocrinol Metab. 2008 Nov;93(11):4486-93. doi: 10.1210/jc.2007-2561. Epub 2008 Aug 12.
46. Quinn LS, Anderson BG, Strait-Bodey L, et al. Oversecretion of interleukin-15 from skeletal muscle reduces adiposity. Am J PhysiolEndocrinolMetab. 2009 Jan;296(1):191-202. doi: 10.1152/ajpendo.90506.2008. Epub 2008 Nov 11.
47. Mattson MP, Maudsley S, Martin B. BDNF and 5-HT: a dynamic duo in age-related neuronal plasticity and neurodegenerative disorders. Trends Neurosci. 2004 Oct;27(10):589-594. doi: 10.1016/j.tins.2004.08.001
48. Tyler WJ, Alonso M, Bramham CR, et al. From acquisition to consolidation: on the role of brain-derived neurotrophic factor signaling in hippocampal-dependent learning. Learn Mem. 2002 Sep-Oct;9(5):224-237. doi: 10.1101/lm.51202. Review.
Tyler WJ, Alonso M, Bramham CR, et al. From acquisition to consolidation: on the role of brain-derived neurotrophic factor signaling in hippocampal-dependent learning. Learn Mem. 2002 Sep-Oct;9(5):224-237. doi: 10.1101/lm.51202. Review.
49. Connor B, Young D, Yan Q, et al. Brain-derived neurotrophic factor is reduced in Alzheimer’s disease. Brain Res Mol Brain Res. 1997 Oct 3;49(1-2):71-81.
50. Laske C, Stransky E, Leyhe T, et al. Stage-dependent BDNF serum concentrations in Alzheimer’s disease. J Neural Transm (Vienna). 2006 Sep; 113(9): 1217-1224. doi: 10.1007/ s00702-005-0397-y. Epub 2005 Dec 16.
51. Manni L, Nikolova V, Vyagova D. Reduced plasma levels of NGF and BDNF in patients with acute coronary syndromes. Int J Cardiol. 2005;102:169-171. doi: 10.1016/j. ijcard.2004.10.041.
52. Krabbe KS, Nielsen AR, Krogh-Madsen R, et al. Brain-derived neurotrophic factor (BDNF) and type 2 diabetes. Diabetologia. 2007;50:431-438. doi: 10.1007/s00125-006-0537-4. Epub 2006 Dec 7.
53. Karege F, Perret G, Bondolfi G, et al. Decreased serum brain-derived neurotrophic factor levels in major depressed patients. Psychiatry Res. 2002;109:143-148.
54. Matthews VB, Aström MB, Chan MH, et al. Brain-derived neurotrophic factor is produced by skeletal muscle cells in response to contraction and enhances fat oxidation via activation of AMP-activated protein kinase. Diabetologia. 2009;52:1409-1418. doi: 10.1007/s00125-009-1364-1. Epub 2009 Apr 22.
55. Nieman DC, Henson DA, Smith LL, et al. Cytokine changes after marathon race. J Appl Physiol. 2001;91:109-114.
Nieman DC, Henson DA, Smith LL, et al. Cytokine changes after marathon race. J Appl Physiol. 2001;91:109-114.
56. Akerström TC, Steensberg A, Keller P, et al. Exercise induces interleukin-8 expression in human skeletal muscle. J Physiol. 2005;563:507-516. doi: 10.1113/ jphysiol.2004.077610. Epub 2004 Dec 23.
57. Brandt C, Pedersen BK. The role of exercise-induced myokines in muscle homeostasis and the defense against chronic diseases. J Biomed Biotechnol. 2010;2010:520258. doi:10.1155/2010/520258. Epub 2010 Mar 9.
58. Гребенникова ТА., Белая Ж.Е., Рожинская Л.Я., и др. Эпигенетические аспекты остеопороза // Вестник РАМН. -2015. — Т. 5. — С. 541-548. [Grebennikova TA, Belaya ZhE, Rozhinskaya LYa, et al. Epigenetic Aspects of Osteoporosis. Vestnik RAMN. 2015;5:541-548. (In Russ)]. doi:10.15690/ vramn.v70.i5.1440.
Мышцы человеческого тела | NORTHWAY Вильнюс
Тело человека состоит из различных групп мышц. Мы должны быть благодарны нашим мышцам за возможность дышать, двигаться, жевать, видеть, разговаривать, смеяться, плакать и делать еще множество других вещей. Побеседуем подробнее на эту тему с семейным врачом, доктором медицинских наук Астой Маставичюте из медицинского центра Northway.
Что такое мышцы?
Движение – это основное свойство живых организмов, а мышцы тела играют самую главную роль. Движение, в независимости от его амплитуды, является характерной функцией организма, которое осуществляется с помощью сокращения и расслабления мышц. Мышцы составляют около 40% массы тела мужчин и около 23% массы тела женщин. Если мышцы оценивать с точки зрения единого целого, то они являются самым большим образованием из всех внутренних органов тела человека.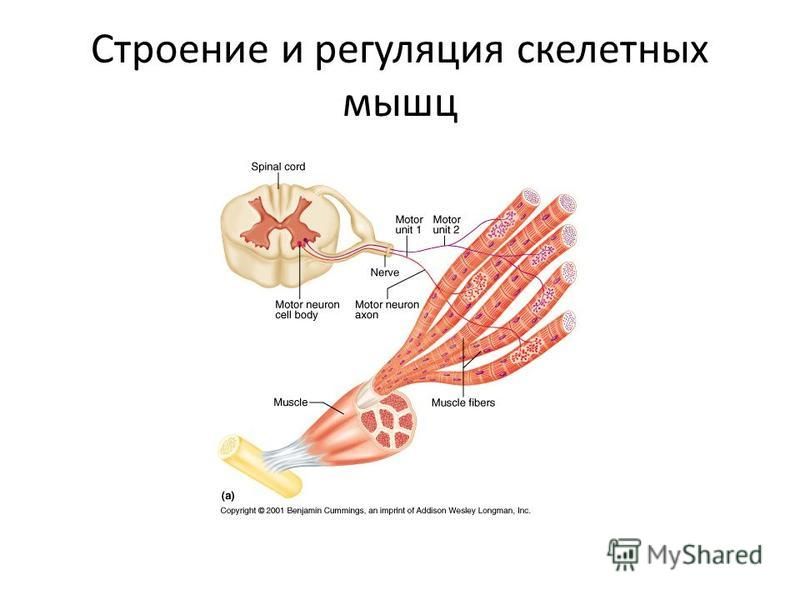 Не будь у нас мышц, было бы сложно сделать что-либо. Абсолютно все, что мы осознаем разумом, выражено в движении мышц. Любое движение совершается, благодаря передаче нервных импульсов в мышечное волокно. Вместе с нервной системой мышцы потребляют наибольшее количество энергии тела, поскольку выполняют механическую работу. Мышечная масса на 70-80% состоит из воды, на 17-21% из белков и на 3-4% из других веществ.
Не будь у нас мышц, было бы сложно сделать что-либо. Абсолютно все, что мы осознаем разумом, выражено в движении мышц. Любое движение совершается, благодаря передаче нервных импульсов в мышечное волокно. Вместе с нервной системой мышцы потребляют наибольшее количество энергии тела, поскольку выполняют механическую работу. Мышечная масса на 70-80% состоит из воды, на 17-21% из белков и на 3-4% из других веществ.
Самая большая мышца – это широкая мышца спины, самая крепкая – жевательная или челюстная мышца, а к наиболее активным относится глазная мышца.
Какие бывают типы мышц?
В теле каждого здорового человека есть около 850 мышц, но большинство людей, говоря о мышцах, думают лишь о тех, которые можно увидеть. Например, многие из нас знают, что в руках есть бицепсы.
Мышцы подразделяют на три типа: поперечнополосатые, гладкие мышцы и сердечные поперечнополосатые мышцы. Мышцы различных типов выполняют разные функции: поперечнополосатые мышцы связаны с активным движением человека и зависят от воли человека. Это мышцы, которые мы видим и чувствуем. Культуристы, стремящиеся нарастить мышечную массу, тренируют именно эти мышцы. Все мышцы тела работают в паре. Мышцы, которые при сокращении выполняют движение в одном направлении, называются синергистами, а те, которые совершают движения в обратном направлении – антагонистами. Работа мышц зависит от координированной работы мышц-синергистов и антагонистов, которую регулирует нервная система. Поперечнополосатые мышцы двигаются по воле человека, посылая сознательный сигнал в мозг. Эти сигналы передаются по соматическим нервам. Поперечнополосатые мышцы крепятся с помощью суставов и связок, и поэтому человек может двигаться. Гладкие мышцы путем сокращений помогают выполнять такие «внутренние» функции человека, как пищеварение, дыхание, удаление и т.д. Гладкие мышцы выполняют различные движения внутренних органов, и расположены, как правило, в стенках таких органов, включая и стенки кровеносных сосудов. Гладкие мышцы двигаются непроизвольно, повинуясь автоматическим импульсам, исходящим из центральной нервной системы и посылаемым через вегетативную нервную систему, не думая об этом сознательно. Гладкие мышцы присутствуют в стенках внутренних органов: кровеносных сосудах, кишечнике, бронхах, в коже, глазах и пр. Функция сердечной мышцы практически не зависит от воли человека. Сердечная мышца присутствует только в сердце, а ее основными свойствами являются выносливость и последовательность. Это одна из самых сильных мышц у человека, безустанно качающая кровь и обеспечивающая весь организм жизненно важным кислородом и питательными веществами.
Гладкие мышцы двигаются непроизвольно, повинуясь автоматическим импульсам, исходящим из центральной нервной системы и посылаемым через вегетативную нервную систему, не думая об этом сознательно. Гладкие мышцы присутствуют в стенках внутренних органов: кровеносных сосудах, кишечнике, бронхах, в коже, глазах и пр. Функция сердечной мышцы практически не зависит от воли человека. Сердечная мышца присутствует только в сердце, а ее основными свойствами являются выносливость и последовательность. Это одна из самых сильных мышц у человека, безустанно качающая кровь и обеспечивающая весь организм жизненно важным кислородом и питательными веществами.
Какие функции выполняют мышцы? Мышцы, как и автомобили, состоят из множества мелких компонентов – деталей, работающих вместе и зависящих друг от друга, и не дающих пользы по отдельности. Основной структурной единицей мышц является мышечная клетка, или иначе говоря, мышечное волокно. Мышечные волокна образуют мышечные ткани, формируя целую мышцу, а их количество зависит от размера мышцы и выполняемой функции. Мышцы выполняют следующие функции: поддерживают тело и внутренние органы, дают возможность двигаться телу, его отдельным частям и органам, защищают внутренние органы. Мышцы напрягаются вокруг поврежденного (перегруженного) участка тела, так защищая ее от еще больших нагрузок. Около 70% боли в теле исходит от мышц и связок. Мышцы принимают участие в кровотоке. Сокращаясь, мышцы толкают кровь по венам вверх, в сторону сердца. Работающие мышцы выделяют тепло, которое помогает поддерживать температуру тела.
Что вызывает мышечные спазмы?
Как правило, мышечные спазмы вызывает чрезмерная нагрузка, растяжение, ушиб или разрыв мышц, возникшие в результате различных травм. Боль охватывает конкретные мышцы в одной области. Она начинается во время нагрузки или сразу после нее. Как правило, бывает понятно, какая деятельность вызывает мышечную боль. Мышечная боль также является признаком заболевания всего организма, например, при различных вирусных заболеваниях (включая грипп), неполноценного питания, которое влияет на соединительные ткани всего организма. К наиболее распространенным причинам мышечной боли относятся:
К наиболее распространенным причинам мышечной боли относятся:
- напряжение или стресс;
- чрезмерное напряжение: слишком интенсивное, частое или неподходящее использование мышц;
- ушиб или травма;
- неправильная осанка;
- употребление лекарств;
- инфекции или воспаления;
- аутоиммунные или ревматоидные заболевания.
При какой мышечной боли стоит забеспокоиться и обратиться к врачу?
Степень мышечной боли может меняться от несильной до невыносимой, даже в независимости от заболевания. Если мышечная боль не связана с другим заболеванием и длится более 2-3 дней, в таком случае нужно обратиться к врачу. Это очень важно еще и в том случае, если вокруг мышцы наблюдается отек, покраснение, она вызывает боль при прикосновении, в ней ощущается тепло или даже жар. Общее правило заключается в том, что, если болят мышцы и температура держится более двух-трех дней, необходимо проконсультироваться с врачом.
В чем заключается профилактика мышечной боли?
Для предупреждения возникновения мышечной боли или травм необходимо чаще заниматься спортом, делать разминку перед тренировками, а после тренировок дать мышцам остыть. Перед и после тренировки рекомендуется сделать упражнения на растяжку мышц. После разминки, физическую нагрузку надо увеличивать постепенно, шаг за шагом. Делая физическую работу или тренируясь, не стоит делать резких и быстрых движений. Тем, кто большую часть дня проводит в одном положении (например, сидя за компьютером), рекомендуется делать перерывы и упражнения на растяжку. Кроме того, необходимо избегать резких изменений температуры и сквозняков.
Isolation of Human Myoblasts, Assessment of Myogenic Differentiation, and Store-operated Calcium Entry Measurement
Человеческие скелетные мышцы состоят из групп сократительных, многоядерных мышечных волокон, полученных в результате слияния миогенных клеток-предшественников. Скелетные мышцы способны регенерировать после травмы благодаря наличию SC, стволовых клеток скелетных мышц, расположенных между плазматической мембраной myofibers (сарколеммой) и базальной пластинкой. В неповрежденной мышце SCs в основном присутствуют в спокойном состоянии. В ответ на механические стрессы или травмы SC активируются (миобласты), размножаются и подвергаются либо дифференцировке, либо формируют новые миофибры или самообновление для пополнения пула SC 1,2 . На протяжении многих лет были разработаны несколько методов для выделения SC и их потомства, миобластов, из биопсий скелетных мышц. С большим пониманием маркеров клеточной поверхности, экспрессируемых на этих клетках, и методологии сортировки клеток, активированной флуоресценцией (FACS) 3,4,5 , теперь можно выделить чистые популяции миобластов человека из образцов мышц.
Скелетные мышцы способны регенерировать после травмы благодаря наличию SC, стволовых клеток скелетных мышц, расположенных между плазматической мембраной myofibers (сарколеммой) и базальной пластинкой. В неповрежденной мышце SCs в основном присутствуют в спокойном состоянии. В ответ на механические стрессы или травмы SC активируются (миобласты), размножаются и подвергаются либо дифференцировке, либо формируют новые миофибры или самообновление для пополнения пула SC 1,2 . На протяжении многих лет были разработаны несколько методов для выделения SC и их потомства, миобластов, из биопсий скелетных мышц. С большим пониманием маркеров клеточной поверхности, экспрессируемых на этих клетках, и методологии сортировки клеток, активированной флуоресценцией (FACS) 3,4,5 , теперь можно выделить чистые популяции миобластов человека из образцов мышц.
Кальциевая сигнализация регулирует развитие скелетных мышц, гомеостаз и регенерацию. В частности, вход Са 2+ , который активируется следующим внутриклеточным истощением магазина, называется SOCE, имеет большое значения 6 для этих процессов. При стимуляции клеток, уровень Са 2+ в эндо / саркоплазматического ретикулума (ER / SR) уменьшается, что , в свою очередь , активирует плазматической мембраны Ca 2+ каналы , которые позволяют вход Ca 2+ для пополнения ER / SR 7. Двумя основными белками, участвующими в СОСЭ, являются белок ERR / SR Ca 2+ -центрирующего стромального взаимодействия 1 (STIM1) и канал Ca 2+ плазматической мембраны Orai1. Скелетные мышцы обильно выражают эти два белка, а также другие белки одних и тех же семейств (STIM2 aNd Orai2-Orai3) 8,9 и несколько Ca 2+ -проницаемых каналов карионического (TRPC) транзиторного рецепторного семейства 10,11,12,13 . Ca 2+ через канал SOCE имеет большое значение для мышечного образования / регенерации 14 . Мутации протеинов STIM1 или Orai1 оказывают вредное воздействие на функцию мышц, что в основном ведет к мышечной гипотонии 15 . Модели животных с ухудшением состояния окружающей среды также демонстрируют снижение мышечной массы и силы вместе с повышенной утомляемостью 6,16,17 . Как уже упоминалось, другие белки STIM и Orai, а также многие каналы TRPC выражены в скелетных мышцах, и их соответствующие роли пока не определены. Сбив dВладеют своим уровнем экспрессии, поэтому можно исследовать их последствия в SOCE и их роли во время дифференциации скелетных мышц человека.
Ca 2+ через канал SOCE имеет большое значение для мышечного образования / регенерации 14 . Мутации протеинов STIM1 или Orai1 оказывают вредное воздействие на функцию мышц, что в основном ведет к мышечной гипотонии 15 . Модели животных с ухудшением состояния окружающей среды также демонстрируют снижение мышечной массы и силы вместе с повышенной утомляемостью 6,16,17 . Как уже упоминалось, другие белки STIM и Orai, а также многие каналы TRPC выражены в скелетных мышцах, и их соответствующие роли пока не определены. Сбив dВладеют своим уровнем экспрессии, поэтому можно исследовать их последствия в SOCE и их роли во время дифференциации скелетных мышц человека.
Измерение SOCE может быть выполнено с использованием двух разных подходов: электрофизиологических записей тока и измерений Ca 2+ . Электрофизиология, безусловно, является более прямым методом, поскольку она измеряет текущий интерес и связанную с ним электрофизиологическую подпись. Однако эту технику очень трудно применять к мышечным клеткам, главным образом из-за большого размера мышечных клеток и небольшого размера эндогенного тока СОЭ. Цитозолическое изображение Ca 2+ технически очень доступно, но эта мера более косвенная, так как уровень Ca 2+, измеренный в цитозоле, отражает как вход Ca 2+, так и повторное прокачивание клетки или во внутренних хранилищах.
Методология, которая включает выделение миобластов из мелких кусочков человеческого скеляЭтальной мышцы после ферментативного расщепления, амплификации и FACS объясняется в этой статье. Процесс дифференцировки мышц и протокол иммунофлюоресценции , чтобы следить за экспрессией маркеров дифференцировки с течением времени описаны 18. Наконец, объясняются измерения SOCE и роли различных ионных каналов в передаче сигналов Ca 2+ и дифференцировке скелетных мышц.
Subscription Required. Please recommend JoVE to your librarian.
Содержание белков в мышце во время тренировок регулируется на различных уровнях
Регулярные аэробные упражнения низкой интенсивности (аэробная тренировка) улучшают чувствительность к инсулину, углеводно-жировой обмен и предотвращают опасные нарушения метаболизма, такие как метаболический синдром и диабет второго типа. Частично это связано с тем, что упражнения увеличивают в скелетных мышцах объем и количество митохондрий и активность митохондриальных ферментов, что увеличивает способность мышц окислять углеводы и жиры. Большой интерес представляют молекулярные механизмы, лежащие в основе этих эффектов, в частности, та роль, которую играет увеличение активности генов в увеличении содержания митохондриальных белков. Помимо этого, скелетные мышцы человека — одна из немногих тканей, доступных для многократного взятия биопсических проб, что делает ее удобной моделью.
Сотрудники Института медико-биологических проблем РАН, факультета фундаментальной медицины МГУ, Института фундаментальной медицины и биологии КФУ из Казани и их коллеги исследовали изменения протеома и транскриптома в скелетной мышце у нетренированных мужчин после двух месяцев аэробных тренировок на велотренажере — по часу в день, пять дней в неделю. Пробы мышечной ткани из наружной головки четырехглавой мышцы бедра брали с помощью игольчатой биопсии, изменения транскриптома и протеома исследовали методами РНК-секвенирования и масс-спектрометрии.
В общей сложности было детектировано около 800 белков (14% протеома мышц, представленного в базе данных Human Protein Atlas). Главным образом это были высокопредставленные (с высокой массовой концентрацией) белки — окислительно-восстановительные ферменты, белки, связывающие нуклеиновые кислоты (преимущественно РНК), белки цитоскелета и теплового шока (шапероны), тогда как регуляторные белки — факторы транскрипции, сигнальные молекулы, рецепторы и транспортеры, были детектированы в малом количестве.
Сопоставление увеличения содержания белков, вызванное аэробными тренировками, с изменением уровня активности их генов позволило выяснить, что белки с различными функциями регулируются разными способами. Например, рост количества белков, внеклеточного матрикса сопровождается увеличением количества мРНК (активацией их генов), тогда как увеличение количества митохондриальных белков происходит без изменений количества их мРНК. Оказалось, что митохондриальные белки регулируются на другом уровне: увеличение содержания митохондриальных белков происходило на фоне увеличения содержания шаперонов — белков, ответственных за поддержание и восстановление правильной конформации других белков. Эти данные и биоинформатический анализ позволили авторам предположить, что содержание митохондриальных белков в мышцах возрастает за счет увеличения их стабильности. С точки зрения энергетических затрат, такая регуляция высокопредставленных белков значительно экономичнее, чем регуляция на уровне транскрипции: выгоднее продлевать жизнь белков с помощью шаперонов и регуляторов деградации, чем постоянно синтезировать новые белки.
Авторы также упоминают другие возможные механизмы увеличения количества белков, не связанные с увеличением экспрессии мРНК, например, кэп-независимую регуляцию трансляции, которая позволяет увеличивать синтез белка только для специфичных мРНК.
На вопросы PCR.news отвечает ведущий автор статьи Даниил Попов (Институт медико-биологических проблем РАН, факультет фундаментальной медицины МГУ).
Эта работа имеет отношение к MUSCLE-FANTOM, о котором нам рассказывал Олег Гусев?
Это исследование было выполнено вместе с нашими коллегами из Казанского федерального университета — Олегом Гусевым и другими, — которые активно работают над проектом MUSCLE-FANTOM. Этот проект направлен на исследование работы регуляторных элементов генома в скелетных мышцах. Для этого используется специальный метод — CAGE (кэп-анализ экспрессии генов). В настоящем исследовании изменения транскриптома оценивались с помощью метода РНК-секвенирования, т.е. полученные данные напрямую к MUSCLE-FANTOM не относятся. Однако сейчас вместе с нашими казанскими коллегами мы проводим несколько исследований (в которых используем CAGE), результаты которых войдут в MUSCLE-FANTOM.
В настоящем исследовании изменения транскриптома оценивались с помощью метода РНК-секвенирования, т.е. полученные данные напрямую к MUSCLE-FANTOM не относятся. Однако сейчас вместе с нашими казанскими коллегами мы проводим несколько исследований (в которых используем CAGE), результаты которых войдут в MUSCLE-FANTOM.
Какие практические возможности даст информация о протеоме и транскриптоме работающих мышц?
Прежде всего, скелетная мышца человека — это очень удобная модель для изучения фундаментальных механизмов регуляции генной экспрессии и содержания белков в тканях человека. Во-первых, скелетная мышца очень пластична, то есть она относительно быстро меняет свои функциональные характеристики при увеличении или при снижении уровня двигательной активности; во-вторых, ее клетки легко «стрессировать», например, с помощью дозированной физической нагрузки. Наконец, скелетная мышца человека доступна для многократного взятия проб ткани; это относительно малотравматичная процедура, которая выполняется с помощью игольчатой биопсии. Если мы будем понимать, как в скелетной мышце регулируется генная экспрессия и содержание белков (что определяет функциональные возможности мышцы), то мы сможем найти подходы для целенаправленного влияния на эти процессы. Это, безусловно, найдет практический выход, прежде всего, для профилактики и борьбы с различными метаболическими нарушениями, с последствиями гипокинезии, от которых страдают жители развитых стран, и т.д.
Мышцы внутренней секреции
Наталья Резник,
кандидат биологических наук
«Химия и жизнь» №9, 2016
В движенье — жизнь
Помните, как у Жванецкого: «Может быть, большой спорт — это плохо. Но элементарная физическая подготовка…» Да, она необходима, причем не только для того, чтобы без труда догнать отъезжающий автобус или классно выглядеть на пляже. Физическая активность — залог активного долголетия, и это не лозунг, а экспериментально установленный факт. Доказывать его начали, как обычно, на грызунах. Например, у крыс, которые могли в свое удовольствие бегать в колесе, выживаемость, то есть количество особей, достигших определенного возраста, достоверно выше, чем у животных, лишенных возможности тренироваться. У мышей упражнения улучшают работу нервной системы, в том числе нервно-мышечных синапсов, снижают уровень гипергликемии и нормализуют содержание холестерина. Физическая активность благотворно влияет на сердце, почки, мозг и печень разных животных. Данные эпидемиологических исследований подтверждают, что и людям она продлевает здоровье и жизнь. И напротив, при сидячем образе жизни часто развиваются сахарный диабет 2-го типа, сердечно-сосудистые заболевания, ожирение, рак молочной железы (в постменопаузе) и другие злокачественные опухоли, а также слабоумие, депрессия и нейродегенеративные заболевания, такие, как болезнь Альцгеймера.
Доказывать его начали, как обычно, на грызунах. Например, у крыс, которые могли в свое удовольствие бегать в колесе, выживаемость, то есть количество особей, достигших определенного возраста, достоверно выше, чем у животных, лишенных возможности тренироваться. У мышей упражнения улучшают работу нервной системы, в том числе нервно-мышечных синапсов, снижают уровень гипергликемии и нормализуют содержание холестерина. Физическая активность благотворно влияет на сердце, почки, мозг и печень разных животных. Данные эпидемиологических исследований подтверждают, что и людям она продлевает здоровье и жизнь. И напротив, при сидячем образе жизни часто развиваются сахарный диабет 2-го типа, сердечно-сосудистые заболевания, ожирение, рак молочной железы (в постменопаузе) и другие злокачественные опухоли, а также слабоумие, депрессия и нейродегенеративные заболевания, такие, как болезнь Альцгеймера.
Есть несколько гипотез, объясняющих связь здоровья и движения. Замечено, например, что занятия физкультурой стимулируют выделение адреналина, кортизола, гормона роста, пролактина и других молекул, регулирующих работу иммунной системы. Длительные систематические тренировки снижают уровень стрессовых гормонов. Кроме того, и это отмечают многие исследователи, физическая активность позволяет избавиться от причины многих болезней — хронического системного стерильного воспаления. Названо оно так потому, что развивается в отсутствие инфекции — в результате аутоиммунных процессов или других событий. Хроническое стерильное воспаление — частый спутник малоподвижного образа жизни. Это очень опасное явление, чреватое развитием инсулиновой резистентности, атеросклероза, нейродегенеративных заболеваний и злокачественных опухолей (см. «Химию и жизнь» № 7, 2013). Цитокины воспаления выделяют разросшаяся адипозная ткань, а также печень и малоактивная скелетная мускулатура. Изменить ситуацию могут физические упражнения, они прекрасно помогают даже людям, которые начали заниматься уже в преклонном возрасте, чтобы предотвратить или остановить развитие каких-либо недугов. Но тут важно не переусердствовать, потому что чрезмерная физическая активность также провоцирует воспаление, ослабляет иммунную систему и повышает риск развития инфекционных заболеваний. Мышечная работа и воспаление связаны друг с другом сложным образом, и упражнения могут как помочь, так и навредить, в зависимости от амплитуды, частоты и других переменных. Серьезные занятия спортом без инструктора сродни самолечению.
Но тут важно не переусердствовать, потому что чрезмерная физическая активность также провоцирует воспаление, ослабляет иммунную систему и повышает риск развития инфекционных заболеваний. Мышечная работа и воспаление связаны друг с другом сложным образом, и упражнения могут как помочь, так и навредить, в зависимости от амплитуды, частоты и других переменных. Серьезные занятия спортом без инструктора сродни самолечению.
Мышцы и PGC-1α
Движение человеческого тела обеспечивают около 600 скелетных мышц, которые составляют примерно 40–50% массы тела. Они состоят из миофибрилл, сформированных слившимися клетками-миобластами, а миофибриллы — из нитей актина и миозина, организованных в повторяющиеся блоки-саркомеры. Движение этих нитей друг относительно друга вызывает сокращение мышц. В отличие от гладкой и сердечной мускулатуры скелетные мышцы сокращаются произвольно по сигналу нейромедиатора ацетилхолина.
Работа требует энергии. При динамических сокращениях, для которых нужна выносливость (длительный бег, плаванье), и при поддержании позы энергию обеспечивает АТФ, получаемая за счет окислительного фосфорилирования, происходящего в митохондриях. Окисляются в первую очередь глюкоза и гликоген. При движениях, требующих большой силы и скорости (спринтерский бег, поднятие тяжестей), мышечные волокна расщепляют гликоген анаэробным путем в процессе гликолиза. При этом АТФ образуется в два-три раза быстрее, а механическая энергия, производимая мышцей, в два-три раза больше, чем при окислительном фосфорилировании. Но и усталость в этом случае наступает значительно быстрее.
В зависимости от типа совершаемой работы мышечные волокна синтезируют разные регуляторы транскрипции, ростовые факторы и другие молекулы, которые позволяют им адаптироваться к тому или иному виду нагрузки. Силовые тренировки приводят к преимущественному развитию так называемых быстрых волокон, которые используют гликолиз для синтеза АТФ. При соответствующих нагрузках увеличиваются их количество и площадь поперечного сечения. Волокна, которые совершают динамическую работу, называются медленными. Им нужны много митохондрий, развитая капиллярная сеть для снабжения кислородом, противодействие деградации белков, апоптозу и воспалению. Значительную роль в обеспечении этих потребностей играет регулятор транскрипции PGC-1α (коактиватор рецептора пролиферации пероксисом), который синтезируется при сокращении медленных волокон. Запомним этот белок, это один из главных персонажей нашего рассказа. Пожалуй, его роль в миофибриллах не меньше, чем у актина с миозином. У мышей он регулирует экспрессию более полутора тысяч генов: активность одних подавляет, других стимулирует, сколько у людей — пока не посчитали. У PGC-1α много функций, в том числе он стимулирует образование митохондрий, окисление жирных кислот и устойчивость к мышечной атрофии. Трансгенные мыши с избытком PGC-1α накачаны и мускулисты, а животные с неактивным геном обладают очень слабой выносливостью. Во время физических упражнений выделяются клеточные факторы, которые модифицируют белок PGC-1α, делая его более стабильным, а следовательно, и активным. По окончании тренировки уровень PGC-1α возвращается к норме в течение часа.
При длительных, систематических тренировках на выносливость доля медленных волокон возрастает за счет быстрых, и существенную роль в этих превращениях играет опять-таки PGC-1α (рис. 1). В тренированных мышцах уровень PGC-1α выше, чем в нетренированных, даже в состоянии покоя, а поскольку он регулирует метаболизм и работу многих генов в миофибриллах, то физическая нагрузка может быть полезна при некоторых заболеваниях, связанных с нарушением мышечной активности. Исследования на мышах подтвердили, что PGC-1α действительно смягчает последствия миопатии Дюшенна и митохондриальной миопатии (истощении мышц при нарушении работы митохондрий).
А еще PGC-1α подавляет активность фактора NFκB, основного регулятора экспрессии провоспалительных генов. Следовательно, сидячий образ жизни провоцирует синтез провоспалительных цитокинов и развитие местных и системных воспалений, прискорбные последствия которых мы уже обсуждали.
Все мы слышали, что в здоровом теле здоровый дух. И это действительно так, потому что PGC-1α оберегает и от депрессии. Эта болезнь отравляет жизнь миллионам людей во всем мире. Депрессия связана с образованием кинуренина — продукта деградации триптофана — под действием стресса и воспаления. Синтез кинуренина происходит главным образом в почках, печени и клетках иммунной системы, но оттуда вещество попадает в кровь и мозг. Кинуренин вызывает гибель нейронов и воспаление нервной ткани, приводит к депрессии. Специалисты Каролинского университета (Швеция), экспериментируя с мышами, обнаружили, что PGC-1α усиливает синтез фермента кинуренин-аминотрансферазы в скелетных мышцах (Cell, 2014, 159, 33–45, doi: 10.1016/j.cell.2014.07.051). Этот фермент тоже попадает в кровь и превращает кинуренин в кинуреновую кислоту, которая не может преодолеть гематоэнцефалический барьер. Содержание кинуренина в плазме сокращается, что защищает мозг от повреждений и стресс-индуцированной депрессии. Исследователи не исключают, что PGC-1α можно использовать в терапевтических целях, но не полезнее ли заняться физкультурой?
Итак, физическая активность, в основном тренировки на выносливость, повышает уровень и активность PGC-1α, который благотворно влияет на многие жизненно важные процессы или уберегает нас от проблем со здоровьем. Кроме того, мышечные сокращения и PGC-1α активизируют синтез белков, которые влияют на процессы, происходящие как в мышечной ткани, так и в других органах, поэтому скелетную мускулатуру можно с полным правом считать органом внутренней секреции (рис. 2). Эти регуляторные белки называют миокинами. Список миокинов постоянно растет, причем в него нередко попадают соединения, уже известные нам в другом качестве, например интерлейкины — продукт синтеза лейкоцитов и непременные участники иммунного ответа.
Интерлейкины
В списке миокинов пока три интерлейкина: ИЛ-6, ИЛ-8 и ИЛ-15. ИЛ-6 и ИЛ-15 известны как факторы воспаления, кроме того, ИЛ-6 вызывает инсулиновую резистентность, а также при определенных условиях повышает уровень противовоспалительных цитокинов. ИЛ-8 отвечает за привлечение нейтрофилов и ангиогенез. В мышечных клетках у них другие задачи. Все три белка — типичные миокины, их синтез в скелетной мускулатуре и концентрация в плазме крови возрастают после физической нагрузки, причем на ИЛ-8 влияют в основном упражнения, при которых нагруженная мышца удлиняется.
ИЛ-6 действует на разные ткани. Он запускает каскады биохимических реакций, в результате чего мышечные клетки потребляют больше глюкозы и активно окисляют жирные кислоты, в жировой ткани усиливается липолиз, в печени — расщепление гликогена и образование глюкозы, в поджелудочной железе — секреция инсулина. Образование глюкозы в печени и выделение жирных кислот из адипозной ткани обеспечивают энергией работающие мышцы.
Роль ИЛ-8 в скелетной мускулатуре пока неизвестна, но есть основания полагать, что этот фактор стимулирует рост новых сосудов.
ИЛ-15 изначально известен как мышечный анаболик, он также вызывает синтез сократительных белков, способствует поглощению глюкозы и окислению жирных кислот, у крыс противодействует раковой кахексии (истощению). Чем выше концентрация этого миокина в плазме у людей, тем меньше у них белого жира, а у крыс он усиливает термогенез.
Нейротрофические факторы
Эти белки, как следует из названия, синтезируются в нервных клетках и регулируют их развитие и деятельность. Например, нейротрофический фактор мозга BDNF влияет на обучение и память, его нехватка связана с ожирением и диабетом 2-го типа. Однако после физических упражнений уровень BDNF в крови существенно возрастает, причем 70–80% этого количества потребляет мозг. В скелетной мускулатуре BDNF усиливает окисление жиров и регулирует регенерацию клеток.
Другой белок, цилиарный нейротрофический фактор CNTF, отвечает за работу остеобластов — клеток, которые строят костную ткань. У мышей, дефицитных по этому гену, кости массивные и плохо минерализованные. У граждан, ведущих малоподвижный образ жизни, при нехватке CNTF часто развивается остеопороз (нарушение метаболизма костной ткани, влекущее за собой их хрупкость). При кальцификации мышц и разрастании надкостницы физическая активность, напротив, вредна, потому что усиленный синтез CNTF только усугубит эти признаки.
Факторы роста
Фактор роста эндотелия сосудов VEGF действительно регулирует рост эндотелия и стимулирует ангиогенез. Его синтез в мышечных волокнах находится под контролем PGC-1α и скоординирован с синтезом другого миокина, SPP1. Этот белок стимулирует активность макрофагов, клеток эндотелия и гладкой мускулатуры, чем тоже способствует образованию капилляров. (О том, как синтез VEGF помогает при ишемии нижних конечностей, см. в статье «Гены против ампутации», «Химия и жизнь» № 7, 2016.)
Факторы роста фибробластов регулируют деление, рост и дифференцировку клеток и клеточный метаболизм. Один из них, FGF21, синтезируется преимущественно в печени, а также в жировой ткани, поджелудочной железе и скелетной мускулатуре. В зависимости от места синтеза FGF21 выполняет разные функции. Печеночный стимулирует экспрессию PGC-1α, которая, в свою очередь, активирует окисление жирных кислот и синтез глюкозы в печени. В жировой ткани FGF21 увеличивает потребление глюкозы, а трансгенных мышей избыток FGF21 защищает от развития ожирения. Этот белок снижает у грызунов-диабетиков уровень сахара и триглицеридов в крови, то есть теоретически может быть лекарством.
Синтез FGF21 в скелетной мускулатуре зависит не от мышечной нагрузки, а от избытка инсулина или низкой температуры. В первом случае FGF21 регулирует уровень инсулина, во втором стимулирует термогенез в клетках бурого жира.
Три миокина и термогенез
Недавно в списке миокинов появились три новых члена: иризин, метеорин-подобный белок Metrnl и β-аминоизомасляная кислота (BAIBA). Все три миокина стимулируют термогенез в клетках бурого жира.
Иризин образуется при сокращении и дрожании скелетной мускулатуры, он участвует в преобразовании белого жира в бурый и усиливает термогенез, не давая разрастаться жировой ткани. Под влиянием физической нагрузки и PGC-1α иризин синтезируется также в гиппокампе, стимулируя синтез BDNF и нейрогенез в этой области мозга. У мышей иризин ускоряет метаболизм скелетных мышц и увеличивает расход энергии в мышечных клетках, а как обстоит дело у людей, еще предстоит выяснить.
Metrnl — гормон, синтез которого усиливается в клетках скелетной мускулатуры при упражнениях и в белой жировой ткани на холоде. В отличие от иризина синтез Metrnl зависит не от РGC-1α, а от его сплайсированной формы РGC-1α4, которая образуется при силовых тренировках и регулирует работу другого набора генов. Metrnl увеличивает расход энергии, увеличивает толерантность к глюкозе при ожирении и диабете и способствует побурению белого жира.
BAIBA, хотя и не белок, ведет себя как классический миокин: синтезируется в активных мышцах по сигналу РGC-1α, активирует термогенез и побурение белого жира и усиливает окисление жирных кислот в клетках печени. Содержание BAIBA в крови обратно пропорционально факторам риска сердечно-сосудистых и метаболических расстройств, и ученые предполагают, что он защищает от метаболического синдрома.
Все три миокина активно вызывают побурение белой адипозной ткани, стимулируя таким образом выделение энергии. Возможно, скелетные мышцы регулируют и координируют оба вида термогенеза: дрожательный, происходящий при сокращении скелетной мускулатуры, и недрожательный, протекающий в бурой жировой ткани (о превращении белого жира в белый и недрожательном термогенезе см. «Химию и жизнь» № 7, 2016). Действительно, иризин, как и FGF2, синтезируется в ответ на холод, и его секреция тесно связана с интенсивностью дрожания.
Двое против рака
Активный образ жизни не только снижает риск развития метаболических расстройств, но, возможно, защищает от некоторых типов злокачественных опухолей. Так, по данным Всемирного фонда исследования рака, физические упражнения снижают вероятность развития рака молочной железы и толстого кишечника на 25–30%. Ученые по-разному объясняют это влияние. В частности, два недавно обнаруженных миокина, SPARC и OSM, подавляют деление раковых клеток в толстом кишечнике и молочной железе и вызывают их апоптоз. Какую роль выполняют эти белки в здоровом теле, пока неясно. Возможно, они регулируют деление и апоптоз клеток в сокращающихся мышечных волокнах, но не исключено, что действие SPARC и OSM на нераковые клетки вообще не связано с их делением и гибелью.
Список миокинов получился длинным и, возможно, утомил читателя. Однако он был бы неполным без миостатина, который можно назвать антимиокином: мышечные сокращения не стимулируют, а подавляют его синтез.
Мутация Геракла
Миостатин (MSTN) относится к группе факторов роста. Он синтезируется в неактивных мышцах и препятствует образованию мышечной ткани: горы мускулов, если ими не пользоваться, только напрасно поглощают энергию. Регулярные физические тренировки, как силовые, так и аэробные на выносливость, подавляют синтез миостатина, что способствует образованию рельефной мускулатуры. Ген MSTN очень консервативен, его последовательность у всех позвоночных практически одинакова. У лабораторных мышей, лишенных гена MSTN, масса мышечной ткани в два-три раза больше, чем у грызунов дикого типа. Мутации MSTN, нарушающие синтез белка, приводят к появлению чрезвычайно мясистых коров и овец с гипертрофированной мускулатурой. У всех миостатиновых мутантов понижено содержание жировой ткани. По-видимому, жировая масса уменьшилась главным образом вследствие увеличения мышечной, а не из-за отсутствия миостатина.
Недавно американские и британские исследователи обнаружили небольшую делецию MSTN в геноме гончих собак уиппетов (PLoS Genetics 2007, 3: e79, doi: 10.1371/journal. pgen.0030079, см. также «Химию и жизнь» № 1, 2012). Мутация получила название mh. Согласно стандарту породы, уиппет должен быть мощным, сильным животным при гармоничном, элегантном строении. Мутантные собаки мощь и гармонию сохранили, но элегантность утратили, особенно гомозиготы (рис. 3). Бегают они быстрее обычных уиппетов. Интересно, что у других пород мутация mh пока не обнаружена.
Исследователи планировали поискать подобную мутацию у других видов. А медики из Германии и Соединенных Штатов несколькими годами ранее наблюдали чрезвычайно мускулистого мальчика, родившегося в берлинской клинике Шарите (The New England Journal of Medicine, 2004, 350, 2682-8, doi: 10.1056/NEJMoa040933). Новорожденный поразил специалистов развитой мускулатурой рук и ног, к четырем с половиной годам мальчик продолжал наращивать мышечную массу и мог держать на вытянутой руке трехкилограммовую гантель (рис. 4). Мальчик пока здоров.
В гене миостатина у малыша нашли мутацию, но не такую, как у собак; это замена одного нуклеотида, которая нарушает сплайсинг РНК и приводит к образованию неактивного белка. Эту мутацию мальчик, очевидно, получил по наследству. Хотя исследователи не смогли проанализировать ДНК его родных, известно, что брат, отец и дед матери отличались необыкновенной силой. Как тут не вспомнить Геракла, который в первый же день жизни задушил голыми руками двух змей одновременно, может, и он был мутантом?
Проводя жизнь в кресле, мы лишаем себя множества полезных белков, которые могли бы синтезировать наши мышцы. Время не упущено — заняться физкультурой никогда не поздно. Мы даже не можем себе представить в полной мере, насколько это полезно, потому что исследования миокинов продолжаются.
По материалам статьи
Schnyder S., Handschin Ch. Skeletal muscle as an endocrine organ: PGC-1α, myokines and exercise // Bone, 2015, 80, 115–125, doi: 10.1016/j.bone.2015.02.008
типов мышечной ткани | Биология I
Мышечные клетки специализируются на сокращении. Мышцы позволяют совершать движения, такие как ходьба, а также облегчают такие телесные процессы, как дыхание и пищеварение. Тело состоит из трех типов мышечной ткани: скелетных мышц, сердечных мышц и гладких мышц (рис. 1).
Рис. 1. Тело состоит из трех типов мышечной ткани: скелетных мышц, гладких мышц и сердечных мышц, визуализированных здесь с помощью светового микроскопа.Гладкомышечные клетки короткие, суженные на каждом конце и имеют только одно пухлое ядро на каждом. Клетки сердечной мышцы разветвленные и поперечно-полосатые, но короткие. Цитоплазма может ветвиться, и у них есть одно ядро в центре клетки. (кредит: модификация работы NCI, NIH; данные шкалы от Мэтта Рассела)
Ткань скелетных мышц образует скелетные мышцы, которые прикрепляются к костям или коже и контролируют передвижение и любое движение, которое можно контролировать сознательно. Скелетную мышцу также называют произвольной мышцей, поскольку ею можно управлять с помощью мысли.Скелетные мышцы длинные и цилиндрические на вид; при рассмотрении под микроскопом ткань скелетных мышц имеет полосатый или полосатый вид. Строчки вызваны регулярным расположением сократительных белков (актина и миозина). Актин представляет собой глобулярный сократительный белок, который взаимодействует с миозином для сокращения мышц. Скелетная мышца также имеет несколько ядер, присутствующих в одной клетке.
Гладкая мышечная ткань встречается в стенках полых органов, таких как кишечник, желудок и мочевой пузырь, а также вокруг проходов, таких как дыхательные пути и кровеносные сосуды.Гладкая мышца не имеет бороздок, не находится под произвольным контролем, имеет только одно ядро на клетку, сужается с обоих концов и называется непроизвольной мышцей.
Ткань сердечной мышцы находится только в сердце, и сердечные сокращения перекачивают кровь по всему телу и поддерживают кровяное давление. Как и скелетная мышца, сердечная мышца имеет поперечнополосатую форму, но в отличие от скелетных мышц, сердечная мышца не может контролироваться сознательно и называется непроизвольной мышцей. Он имеет одно ядро на клетку, разветвлен и отличается наличием вставочных дисков.
Структура волокон скелетных мышц
Каждое волокно скелетных мышц представляет собой клетку скелетных мышц. Эти клетки невероятно большие, диаметром до 100 мкм и длиной до 30 см. Плазматическая мембрана волокна скелетных мышц называется сарколеммой . Сарколемма — это место проведения потенциала действия, которое вызывает сокращение мышц. Внутри каждого мышечного волокна находится миофибрилл — длинные цилиндрические структуры, расположенные параллельно мышечному волокну.Миофибриллы проходят по всей длине мышечного волокна, и, поскольку их диаметр составляет всего около 1,2 мкм, внутри одного мышечного волокна можно найти от сотен до тысяч. Они прикрепляются к сарколемме своими концами, так что по мере укорачивания миофибрилл сокращается вся мышечная клетка (рис. 2).
Рис. 2. Клетка скелетных мышц окружена плазматической мембраной, называемой сарколеммой, с цитоплазмой, называемой саркоплазмой. Мышечное волокно состоит из множества фибрилл, собранных в упорядоченные единицы.
Поперечно-полосатый вид ткани скелетных мышц является результатом повторяющихся полос белков актина и миозина, которые присутствуют по длине миофибрилл. Темные полосы A и светлые полосы I повторяются вдоль миофибрилл, а выравнивание миофибрилл в клетке приводит к тому, что вся клетка выглядит полосатой или полосчатой.
Рис. 3. Саркомер — это область от одной Z-линии до следующей Z-линии. Многие саркомеры присутствуют в миофибриллах, что приводит к полосатости, характерной для скелетных мышц.
Каждая полоса I имеет плотную линию, проходящую вертикально через середину, называемую диском Z или линией Z. Z-диски отмечают границу единиц, называемых саркомеров , которые являются функциональными единицами скелетных мышц. Один саркомер — это пространство между двумя последовательными Z-дисками и содержит одну целую полосу А и две половины полосы I. Миофибриллы состоят из множества саркомеров, расположенных по ее длине, и когда саркомеры индивидуально сокращаются, миофибриллы и мышечные клетки укорачиваются (рис. 3).
Миофибриллы состоят из более мелких структур, называемых миофиламентами . Существует два основных типа волокон: толстые волокна и тонкие волокна; у каждого свой состав и расположение. Толстые нити встречаются только в полосе А миофибриллы. Тонкие нити прикрепляются к белку в Z-диске, называемому альфа-актинином, и встречаются по всей длине I-полосы и частично в A-полосе. Область, в которой перекрываются толстые и тонкие волокна, имеет более плотный вид, так как между ними мало места.В середине темной полосы есть вертикальная линия, называемая М-линией, на которой дополнительные белки удерживают вместе толстые нити. И Z-диск, и линия M удерживают миофиламенты на месте, чтобы поддерживать структурное расположение и наслоение миофибрилл.
Толстые и тонкие нити сами состоят из белков. Толстые нити состоят из белкового миозина. Хвост молекулы миозина соединяется с другими молекулами миозина, образуя центральную область толстой нити около линии M, тогда как головки выравниваются по обе стороны от толстой нити, где тонкие нити перекрываются.Основным компонентом тонких филаментов является белок актин. Два других компонента тонкой нити — тропомиозин и тропонин. Актин имеет сайты связывания для прикрепления миозина. Нити тропомиозина блокируют сайты связывания и предотвращают актин-миозиновые взаимодействия, когда мышцы находятся в состоянии покоя. Тропонин состоит из трех глобулярных субъединиц. Одна субъединица связывается с тропомиозином, одна субъединица связывается с актином, а одна субъединица связывает ионы Ca 2+ .
Посмотрите это видео, демонстрирующее организацию мышечных волокон.
Регуляция сокращения толстыми волокнами скелетных мышц
Abstract
Сокращение клеток скелетных мышц инициируется хорошо известным сигнальным путем. Потенциал действия в двигательном нерве запускает потенциал действия в мембране мышечных клеток, временное повышение внутриклеточной концентрации кальция, связывание кальция с тропонином в тонких нитях, содержащих актин, и структурные изменения в тонких нитях, которые позволяют двигать миозин. из толстых волокон, чтобы связываться с актином и генерировать силу.Этот путь, опосредованный кальцием / тонкими филаментами, обеспечивает сигнал «СТАРТ» для сокращения, но утверждается, что функциональный ответ мышечной клетки, включая скорость ее сокращения и расслабления, адаптацию к внешней нагрузке и метаболические затраты на сокращение во многом определяется дополнительными механизмами. В этом обзоре рассматривается роль толстых филаментов в этих механизмах и предлагается парадигма контроля сокращения скелетных мышц, в которой как толстые, так и тонкие филаменты выполняют регулирующую функцию.Выключенное состояние толстого филамента характеризуется спиральной упаковкой большей части миозиновых головок или моторных доменов на поверхности толстых филаментов в такой конформации, которая делает их недоступными для связывания актина или гидролиза АТФ, хотя небольшая часть миозиновых головок является конститутивно НА. Доступность большей части миозиновых головок для сокращения частично контролируется внешней нагрузкой на мышцу, так что эти головки прикрепляются к актину и гидролизуют АТФ только тогда, когда это необходимо.Это явление, по-видимому, является основным фактором, определяющим хорошо известное соотношение силы и скорости в мышцах, и контролирует метаболические издержки сокращения. Регуляторное состояние толстой нити также, по-видимому, контролирует динамику активации и расслабления мышц.
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию© 2017 Biophysical Society.
Рекомендуемые статьи
Ссылки на статьи
сердечная мышца | Определение, функции и структура
Сердечная мышца , также называемая миокардом , у позвоночных, один из трех основных типов мышц, обнаруживаемых только в сердце.Сердечная мышца похожа на скелетную мышцу, другой основной тип мышц, тем, что она обладает сократительными единицами, известными как саркомеры; эта особенность, однако, также отличает его от гладких мышц, третьего типа мышц. Сердечная мышца отличается от скелетной мышцы тем, что она демонстрирует ритмические сокращения и не находится под произвольным контролем. Ритмическое сокращение сердечной мышцы регулируется синоатриальным узлом сердца, который служит кардиостимулятором сердца.
сердце млекопитающегоПоперечный разрез четырехкамерного сердца млекопитающего.
Британская энциклопедия, Inc.Подробнее по этой теме
мышца: Сердечная мышца
Сердце — это насос, который поддерживает циркуляцию крови по всему телу и тем самым транспортирует питательные вещества, продукты распада, антитела и т. Д.
Сердце состоит в основном из клеток сердечной мышцы (или миокарда). Выдающимися характеристиками работы сердца являются его сократимость, которая является основой его насосного действия, и ритмичность сокращений.Количество крови, перекачиваемой сердцем в минуту (сердечный выброс), варьируется в зависимости от метаболических потребностей периферических тканей, особенно скелетных мышц, почек, мозга, кожи, печени, сердца и желудочно-кишечного тракта. Сердечный выброс определяется сократительной силой, развиваемой клетками сердечной мышцы, а также частотой их активации (ритмичностью). Факторы, влияющие на частоту и силу сокращения сердечной мышцы, имеют решающее значение для определения нормальной насосной работы сердца и его реакции на изменения потребности.
Клетки сердечной мышцы образуют в сердце сильно разветвленную клеточную сеть. Они соединены встык вставными дисками и организованы в слои миокардиальной ткани, которые обернуты вокруг камер сердца. Сокращение отдельных клеток сердечной мышцы вызывает силу и сокращение в этих мышечных связях, что приводит к уменьшению размера камеры сердца и последующему выбросу крови в легочные и системные сосуды. Важными компонентами каждой клетки сердечной мышцы, участвующей в процессах возбуждения и метаболического восстановления, являются плазматическая мембрана и поперечные канальцы, совпадающие с линиями Z, продольный саркоплазматический ретикулум и терминальные цистерны, а также митохондрии.Толстые (миозин) и тонкие (актин, тропонин и тропомиозин) белковые нити расположены в сократительные единицы, при этом саркомер простирается от линии Z до линии Z, которые имеют характерный поперечно-полосатый рисунок, подобный тому, который наблюдается в скелетных мышцах.
Скорость, с которой сокращается сердце, и синхронизация сокращений предсердий и желудочков, необходимые для эффективного перекачивания крови, зависят от электрических свойств клеток сердечной мышцы и от передачи электрической информации от одной области сердца к другой.Потенциал действия (активация мышцы) разделен на пять фаз. Каждая из фаз потенциала действия вызвана зависящими от времени изменениями проницаемости плазматической мембраны для ионов калия (K + ), ионов натрия (Na + ) и ионов кальция (Ca 2+ ). ).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасSWELL1 регулирует размер клеток скелетных мышц, внутриклеточную передачу сигналов, ожирение и метаболизм глюкозы
Наши данные показывают, что комплекс каналов LRRC8A регулирует опосредованную инсулином / растяжением передачу сигналов AKT-AS160-GLUT4, MAP-киназы и mTOR в дифференцированных культурах миобластов с последующим влиянием на миогенную дифференцировку, инсулино-стимулированный метаболизм глюкозы и потребление кислорода.In vivo, мыши Lrrc8a KO, нацеленные на скелетные мышцы, имеют меньшие клетки скелетных мышц, нарушенную мышечную выносливость и выработку силы, а также предрасположены к ожирению, непереносимости глюкозы и инсулинорезистентности. Инсулин / опосредованная растяжением передача сигналов PI3K-AKT, mTOR, как хорошо известно, являются важными регуляторами миогенной дифференцировки (Rotwein and Wilson, 2009; Héron-Milhavet et al., 2008), метаболизма и функции мышц (Schiaffino et al., 2013) предполагая, что нарушение передачи сигналов LRRC8A-AKT-mTOR может лежать в основе дефекта миогенной дифференцировки.Действительно, в соответствии с нашими предыдущими результатами и предложенной моделью в адипоцитах, в которой LRRC8A опосредует взаимодействие GRB2 с IRS1 для регулирования передачи сигналов инсулин-AKT (Zhang et al., 2017; Gunasekar et al., 2019), LRRC8A также ассоциируется с GRB2. в скелетных мышечных трубках, а нокдаун GRB2 восстанавливает нарушенную миогенную дифференцировку в мышечных клетках Lrrc8a KO. Таким образом, наша рабочая модель LRRC8A-опосредованной регуляции insuln-PI3K-AKT и нижестоящей передачи сигналов в адипоцитах (Gunasekar et al., 2019), по-видимому, сохраняется в скелетных мышечных трубках. Фенотип in vitro, который мы наблюдаем в миотрубках Lrrc8a KO C2C12, опосредованных CRISPR / cas9, и в первичных мышечных трубках Lrrc8a KO , согласуется с наблюдениями Chen et al., 2019, которые использовали siRNA-опосредованный LRRC8A нокдаун. что комплекс каналов LRRC8A необходим для миогенной дифференцировки. Однако способность GRB2 KD и LRRC8A O / E восстанавливать миогенную дифференцировку и увеличивать передачу сигналов инсулин-AKT, MAP-киназы и mTOR в миотрубках Lrrc8a KO задействует неканонические, непроводящие механизмы передачи сигналов.На основании нашей работы, а также предыдущих исследований (Voss et al., 2014; Qiu et al., 2014), LRRC8A O / E не увеличивает I, Cl, SWELL / VRAC до сверхнормальных уровней в плазматической мембране. Однако уровни pAKT, pERK1 / 2 и mTOR увеличиваются на от двух до трех раз выше эндогенных уровней при двукратном O / E LRRC8A в мышечных трубках C2C12. Эти данные предполагают, что альтернативные / неканонические механизмы передачи сигналов лежат в основе передачи сигналов LRRC8A, в противоположность каноническим / проводящим механизмам передачи сигналов.
Другое открытие, которое требует дальнейшего изучения, — это потребность в LRRC8A в индуцированной растяжением передаче сигналов AKT и MAP киназы в мышечных трубках C2C12 при статическом растяжении. Известно, что механическое растяжение регулирует пролиферацию и дифференцировку миобластов и гипертрофию миофибрилл посредством передачи сигналов PI3K-AKT-MAPK (Schiaffino et al., 2013; Ma et al., 2017; Fu et al., 2018). Кроме того, есть многочисленные сообщения о том, что VRAC и, предположительно, LRRC8A, обладают механической чувствительностью (Browe and Baumgarten, 2003; Browe and Baumgarten, 2006; Osei-Owusu et al., 2018; Баракат и др., 1999; Nakao et al., 1999; Нилиус и Друкманс, 2001; Романенко и др., 2002; Strange et al., 2019). Следовательно, неудивительно, что комплексы LRRC8A совместно регулируют как инсулин, так и опосредованную растяжением передачу сигналов PI3K-AKT, ERK1 / 2 в скелетных мышечных трубках — потенциально объединяя механические и гормональные стимулы для настройки передачи сигналов ниже по течению. Действительно, концепция механонастройки передачи сигналов инсулина была предложена и продемонстрирована в других клеточных системах (Chen and Chalfie, 2014; Kim et al., 2018), которые предполагают передачу сигналов интегрина (Kim et al., 2018) как механо-сенсорный механизм. Любопытно, что сообщалось, что VRAC может быть активирован в клетках сердечной мышцы путем приложения механического напряжения к β1-интегринам (Browe and Baumgarten, 2003; Browe and Baumgarten, 2006), что подтверждает идею о том, что в поперечно-полосатых мышцах интегрин-LRRC8A может действительно участвуют в механонастройке insulin-AKT и передаче сигналов ниже по течению. Необходимы дальнейшие исследования для более полного определения предполагаемых молекулярных механизмов.
Также примечательно, что глубокий блок миогенной дифференцировки, наблюдаемый при абляции Lrrc8a как в мышечных трубках C2C12, так и в первичных мышечных трубках in vitro, значительно мягче in vivo, где наблюдается только 30% уменьшение площади поперечного сечения скелетных миоцитов без изменение общей мышечной массы или безжировой массы у мышей Skm KO. Это несоответствие фенотипа может отражать фундаментальные различия в биологии дифференцировки скелетных мышц in vitro по сравнению с средой in vivo.В качестве альтернативы может случиться так, что, хотя и на ранней стадии, временной интервал между экспрессией Myf5-Cre на ранней стадии миогенеза и окончательным сокращением белка LRRC8A (потенциально ~ 3 дня) может выходить за пределы критического периода, в течение которого LRRC8A требуется для миогенной дифференцировки. . Непосредственная проверка этой гипотезы потребует исследования мышей, экспрессирующих Cre-рекомбиназу на стадии предшественника в сателлитных клетках скелетных мышц, таких как промоторы Pax3 или Pax7 (Relaix et al., 2006; Buckingham et al., 2006) — эти эксперименты в настоящее время продолжаются.
Несмотря на то, что общее развитие мышц практически не нарушено в скелетных мышцах LRRC8A KO ( Myl1 Cre / Lrrc8a fl / fl и Myf5 Cre / Lrrc8a fl / fl ) мышей, наблюдается последовательное сокращение в способности выполнять упражнения, выносливости мышц и формировании силы, а также в склонности к увеличению ожирения с течением времени по сравнению с контрольной группой, соответствующей возрасту и полу. Нарушение способности к физической нагрузке, наблюдаемое у мышей Lrrc8a KO со скелетными мышцами, согласуется с некоторым уровнем инсулинорезистентности, как у мышей db / db (Ostler et al., 2014) и у людей (Reusch et al., 2013), что может быть связано с нарушением гликолиза скелетных мышц и потребления кислорода скелетными мышцами, обедненными LRRC8A. Кроме того, повышенное ожирение гонад с сохраненной толерантностью к глюкозе и инсулину наблюдается в LRRC8A скелетных мышцах KO ( Myl1 Cre / Lrrc8a fl / fl и Myf5 Cre / Lrrc8a fl / fl ) мышей. фенокопия у мышей KO, специфичных для инсулиновых рецепторов скелетных мышц (MIRKO) (Brüning et al., 1998) и трансгенных мышей, экспрессирующих мутант по доминантно-отрицательному рецептору инсулина в скелетных мышцах (Moller et al., 1996), где специфическая для скелетных мышц инсулинорезистентность компенсируется перераспределением глюкозы из скелетных мышц в жировую ткань, чтобы способствовать ожирение (Kim et al., 2000). В случае мышей LRRC8A со скелетными мышцами KO переедание и кормление HFD разоблачают лежащую в основе легкую инсулинорезистентность и непереносимость глюкозы, поскольку также начинает проявляться инсулинорезистентность жировой ткани.Недавние данные, полученные на мышах AKT1 / AKT2 с двойной нокаутом, специфичных для скелетных мышц, показывают, что эти эффекты не могут быть связаны исключительно с передачей сигналов AKT в мышцах (Jaiswal et al., 2019), но потенциально связаны с другими чувствительными к инсулину сигнальными путями.
Таким образом, мы показываем, что LRRC8A регулирует миогенную дифференцировку и передачу сигналов инсулин-PI3K-AKT-AS160, ERK1 / 2 и mTOR в мышечных трубках посредством передачи сигналов, опосредованной GRB2. In vivo LRRC8A необходим для поддержания нормальной физической работоспособности, мышечной выносливости, ожирения в базовых условиях и системной гликемии в условиях переедания.Эти находки способствуют дальнейшему пониманию комплексов каналов LRRC8A в регуляции системного метаболизма.
Редокс-регуляция при старении скелетных мышц и физических упражнениях
Скелетная мышца представляет собой самый большой орган человеческого тела и составляет около 40% от общей массы тела человека. Даже у людей, которые «стареют хорошо», наблюдается заметная потеря мышечной силы и функций, которая резко ускоряется после 60 лет, что является основным фактором снижения качества жизни для…
Скелетная мышца представляет собой самый большой орган человеческого тела и составляет около 40% от общей массы тела человека. Даже у людей, которые «стареют», наблюдается заметная потеря мышечной силы и функций, которая резко ускоряется после 60 лет, что является основным фактором снижения качества жизни стареющего населения. Скелетная мышца генерирует реактивный кислород и реактивный азот (ROS / RNS) в ответ на мышечные сокращения.Концентрация и вид генерируемых ROS / RNS могут зависеть от возраста и физической формы человека, типа мышечных волокон и интенсивности мышечных сокращений. АФК / РНС генерируют уникальные сигнальные каскады, которые не только необходимы для сокращения и адаптации скелетных мышц, но также играют роль в широком спектре клеточных процессов, включая пролиферацию клеток, синтез / деградацию белка, иммунный ответ и антиоксидантную защиту. АФК / РНС, генерируемые сокращениями, не являются тупыми инструментами окисления, участвующими в неспецифическом окислении клеточных компонентов, они участвуют в скоординированной локальной реакции, которая жестко контролируется на всех уровнях от поколения до детоксикации.В этой теме особенно приветствуются статьи, описывающие новые методы анализа окислительно-восстановительной регуляции белков, факторов транскрипции или miRNA в скелетных мышцах.
Эта тема дает возможность собрать воедино последние достижения в нашем понимании окислительно-восстановительной регуляции в скелетных мышцах. Вклады детализирующих окислительно-восстановительные методы применяются для скелетных мышц или костно-мышечной системы моделей включения протеомики, геномика, метаболомика и визуализация особенно приветствуется.Коллекция интегрированных подходов к окислительно-восстановительной регуляции в скелетных мышцах будет уникальной, поскольку она предоставит точную информацию о генерации видов ROS / RNS и идентификации их конкретных молекулярных мишеней. В конечном итоге это позволит по-новому взглянуть на роль окислительно-восстановительного регулирования во время сокращений скелетных мышц и на то, сохраняет ли окислительно-восстановительный ответ стареющей мышечной ткани способность адаптироваться к упражнениям. Авторам рекомендуется присылать обзоры, мини-обзоры, обзоры, исследовательские статьи и короткие сообщения.
Важное примечание : Все материалы по данной теме исследования должны находиться в рамках того раздела и журнала, в который они были отправлены, как это определено в их заявлениях о миссии. Frontiers оставляет за собой право направить рукопись, выходящую за рамки объема, в более подходящий раздел или журнал на любом этапе рецензирования.
4.1: Мышечная физиология — Медицина LibreTexts
Мышцы очень специализированы, чтобы сокращаться с силой.Мышцы питаются от мышечных клеток, которые индивидуально сокращаются внутри мышцы для создания силы. Эта сила нужна для создания движения.
В человеческом теле более 600 мускулов; они несут ответственность за каждое наше движение, от прокачки крови через сердце и перемещения пищи через пищеварительную систему до моргания и жевания. Без мышечных клеток мы не смогли бы стоять, ходить, говорить или выполнять повседневные задачи.
Типы мышц
Есть три типа мышц:
- Скелетная мышца
Отвечает за движения тела. - Сердечная мышца
Отвечает за сокращение сердца. - Smooth Muscle
Отвечает за многие задачи, включая движение пищи по кишечнику, расширение и сокращение кровеносных сосудов, размер зрачков и многие другие сокращения.
Структура и функция скелетных мышц
Скелетные мышцы прикреплены к скелету и отвечают за движение наших конечностей, туловища и головы.Они находятся под сознательным контролем, что означает, что мы можем сознательно выбрать сокращение мышцы и можем регулировать, насколько сильным является сокращение на самом деле. Скелетные мышцы состоят из мышечных волокон. Каждое мышечное волокно представляет собой отдельную мышечную клетку и может иметь длину от 1 мм до 4 см. Когда мы решаем сократить мышечное волокно — например, мы сокращаем бицепс, чтобы согнуть руку вверх, — из нашего мозга через спинной мозг посылается сигнал в мышцу. Это дает сигнал мышечным волокнам сокращаться.Каждый нерв будет контролировать определенное количество мышечных волокон. Нерв и волокна, которые он контролирует, называются двигательной единицей . Только небольшое количество мышечных волокон будет сокращаться, чтобы согнуть одну из наших конечностей, но если мы хотим поднять тяжелый вес, для выполнения этого действия будет задействовано гораздо больше мышечных волокон. Это называется набор мышечных волокон .
Каждое мышечное волокно окружено соединительной тканью, называемой внешней пластинкой . Группа мышечных волокон заключена в соединительную ткань, называемую эндомизием .Группа мышечных волокон и эндомизий окружены соединительной тканью, называемой перимизием . Группа мышечных волокон, окруженная перимизием, называется мышца фасцикулюс . Мышца состоит из множества мышечных пучков, которые окружены толстым коллагеновым слоем соединительной ткани, называемым эпимизием . Эпимизий покрывает всю поверхность мышцы.
Мышечные волокна также содержат множество митохондрий, которые являются источниками энергии, отвечающими за аэробное производство молекул энергии, или АТФ молекул .Мышечные волокна также содержат гранулы гликогена в качестве запасенного источника энергии и миофибрилл , которые представляют собой нитевидные структуры, проходящие по длине мышечного волокна. Миофибриллы состоят из двух типов белков: 1) актиновых миофиламентов и 2) миозиновых миофиламентов . Актиновые и миозиновые нити образуют сократительную часть мышцы, которая называется
саркомером . Филаменты миозина толстые и темные по сравнению с филаментами актина, которые намного тоньше и светлее.Нити актина и миозина лежат друг на друге; именно такое расположение нитей придает мышцам полосатый или полосатый вид. Когда группы актиновых и миозиновых нитей связаны соединительной тканью, они образуют миофибриллы. Когда группы миофибрилл связаны соединительной тканью, они образуют мышечные волокна.
Концы мышцы соединяются с костью через сухожилие. Мышца соединена с двумя костями, чтобы обеспечить движение через сустав.Когда мышца сокращается, только одна из этих костей будет двигаться. Точка, где мышца прикрепляется к движущейся кости, называется прикреплением . Точка, где мышца прикрепляется к кости, которая остается в фиксированном положении, называется исходной точкой .
Как сокращаются мышцы
Считается, что мышцы сокращаются в результате процесса, называемого теорией скользящей нити . Согласно этой теории, мышцы сокращаются, когда актиновые филаменты скользят по миозиновым филаментам, что приводит к сокращению длины саркомеров и, следовательно, к укорочению мышечных волокон.Во время этого процесса актиновые и миозиновые нити не изменяют длину при сокращении мышц, а вместо этого скользят друг мимо друга.
Во время этого процесса мышечные волокна становятся короче и толще. Когда несколько мышечных волокон укорачиваются одновременно, вся мышца сокращается и заставляет сухожилие тянуть за кость, к которой оно прикрепляется. Это создает движение, которое происходит в точке вставки.
Для того, чтобы мышца вернулась в нормальное состояние (т. Е. Чтобы удлиняться), к мышце должна быть приложена сила, которая заставит мышечные волокна удлиниться.Эта сила может быть вызвана силой тяжести или сокращением противоположной группы мышц.
Скелетные мышцы сокращаются в ответ на электрический сигнал, называемый потенциалом действия . Потенциалы действия передаются по нервным клеткам до достижения мышечных волокон. Нервные клетки регулируют функцию скелетных мышц, контролируя количество производимых потенциалов действия. Потенциалы действия запускают серию химических реакций, которые приводят к сокращению мышцы.
Когда нервный импульс стимулирует двигательную единицу в мышце, все мышечные волокна, контролируемые этой двигательной единицей, сокращаются. При стимуляции эти мышечные волокна сокращаются по принципу «все или ничего». Принцип «все или ничего» означает, что мышечные волокна либо максимально сокращаются по своей длине, либо вообще не сокращаются. Следовательно, при стимуляции мышечные волокна сокращаются до максимального уровня, а при отсутствии стимуляции сокращения не происходит. Таким образом, сила, создаваемая мышцей, регулируется не уровнем сокращения отдельных волокон, а скорее количеством мышечных волокон, которые задействованы для сокращения.Это называется набором мышечных волокон . При поднятии легкого предмета, например книги, задействуется лишь небольшое количество мышечных волокон. Однако те, кого наняли, будут сокращены до своего максимального уровня. При поднятии более тяжелого веса задействуется гораздо больше мышечных волокон для максимального сокращения.
Когда одна мышца сокращается, другая противоположная мышца расслабляется. Таким образом мышцы располагаются попарно. Например, когда вы сгибаете руку в локте, вы сокращаете мышцу двуглавой мышцы и расслабляете мышцу трицепса.Это то же самое для каждого движения тела. Всегда будет одна сокращающаяся мышца и одна расслабляющая. Если вы на минутку поразмышляете об этих простых движениях, вскоре станет очевидно, что если противоположная мышца не будет расслаблена, это отрицательно повлияет на силу, создаваемую сокращающейся мышцей.
Мышца, которая сокращается и является основной группой мышц, отвечающей за движение, называется агонистом или первичным двигателем . Расслабляющая мышца называется антагонистом .Одним из эффектов регулярных силовых тренировок является улучшение уровня расслабления в противоположной группе мышц. Хотя отношения агонистов и антагонистов меняются, в зависимости от того, какая мышца отвечает за движение, каждая группа мышц имеет противоположную группу мышц.
Ниже приведены примеры сочетаний групп мышц-агонистов и антагонистов:
Мышцы меньшего размера также могут помочь агонисту во время определенного движения. Меньшая мышца называется синергистом .Примером синергиста может служить дельтовидная (плечевая) мышца во время отжимания. Передняя часть дельтовидной мышцы обеспечивает дополнительную силу во время отжимания; однако большая часть силы прилагается большой грудной мышцей (грудной клеткой). Другие группы мышц также могут способствовать движению, помогая поддерживать фиксированную позу и предотвращать нежелательные движения. Эти группы мышц называются фиксаторами . Примером фиксатора является мышца плеча во время сгибания бицепса или разгибания трицепса.
Типы мышечных сокращений
- Изометрический
Это статическое сокращение, при котором длина мышцы или угол сустава не изменяется.Примером может служить толчок к неподвижному объекту, например стене. Известно, что этот тип сокращения приводит к быстрому повышению артериального давления. - Изотонический
Это движущееся сокращение, также известное как динамическое сокращение . Во время этого сокращения мышцы наполняются жиром, и суставы двигаются.
Типы изотонического сокращения
- Концентрический
Это когда мышца сокращается и укорачивается, преодолевая сопротивление.Это можно назвать подъемной или положительной фазой. Примером может служить подъемная фаза сгибания рук на бицепс. - Эксцентрический
Это происходит, когда мышца все еще сокращается и удлиняется одновременно. Это может быть названо фазой понижения или отрицательной фазой.
Типы мышечных волокон
Не все мышечные волокна одинаковы. На самом деле существует два основных типа мышечных волокон:
- Тип I
Часто называемые медленными или высокоокислительными мышечными волокнами - Тип II
Часто называемые быстро сокращающимися или низкоокислительными мышечными волокнами
Кроме того, мышечные волокна типа II можно разделить на типа IIa и типа IIb .Волокна типа IIb являются действительно быстросокращающимися волокнами, тогда как волокна типа IIa находятся между медленными и быстрыми сокращениями. Удивительно, но характеристики волокон типа IIa могут сильно зависеть от типа проводимой тренировки. После периода тренировки на выносливость они начнут сильно напоминать волокна типа I, но после периода силовых тренировок они начнут сильно напоминать волокна типа IIb. Фактически, после нескольких лет тренировок на выносливость они могут оказаться почти идентичными медленно сокращающимся мышечным волокнам.
Тип I (волокна медленно сокращающихся мышц)
Медленно сокращающиеся мышечные волокна содержат более митохондрий, — органелл, производящих аэробную энергию. Они также меньше по размеру, имеют лучшее кровоснабжение, сокращаются медленнее и более устойчивы к усталости, чем их быстросокращающиеся собратья. Медленно сокращающиеся мышечные волокна производят энергию, прежде всего, за счет аэробного метаболизма жиров и углеводов. Ускоренный аэробный метаболизм усиливается большим количеством митохондрий и улучшенным кровоснабжением.Они также содержат большое количество миоглобина , пигмента, похожего на гемоглобин, который также накапливает кислород. Миоглобин обеспечивает дополнительный запас кислорода, когда подача кислорода ограничена. Этот дополнительный кислород, наряду с медленной скоростью сокращения медленно сокращающихся мышечных волокон, увеличивает их выносливость и повышает сопротивляемость усталости. Медленно сокращающиеся мышечные волокна задействуются во время непрерывных упражнений от низкого до среднего уровня.
Тип IIb (быстро сокращающиеся низкоокислительные мышечные волокна)
Эти волокна больше по размеру, имеют пониженное кровоснабжение, имеют меньшие митохондрии и меньшее их количество, сокращаются быстрее и более приспособлены для производства энергии анаэробно (без потребности в кислороде), чем медленно сокращающиеся мышечные волокна.Их пониженная скорость кровоснабжения вместе с их большим размером и меньшим количеством митохондрий делает их менее способными производить энергию в аэробных условиях, и поэтому они не очень подходят для длительных упражнений. Однако их более высокая скорость сокращения, более высокий уровень гликогена и способность производить гораздо большее количество энергии анаэробно делают их более подходящими для коротких всплесков энергии. Из-за большей скорости сокращения и уменьшения кровоснабжения они гораздо менее устойчивы к утомлению, чем медленно сокращающиеся волокна, и быстро утомляются во время упражнений.
Количество медленных и быстро сокращающихся волокон
Количество медленных и быстро сокращающихся волокон, содержащихся в организме, сильно различается у разных людей и определяется генетикой человека. Люди, которые хорошо справляются со спортом на выносливость, как правило, имеют большее количество медленно сокращающихся волокон, тогда как люди, которые лучше справляются с спринтерскими соревнованиями, как правило, имеют большее количество быстро сокращающихся мышечных волокон. Тренировка влияет как на медленные, так и на быстро сокращающиеся волокна. С помощью спринтерских тренировок можно улучшить мощность, генерируемую медленными сокращающимися волокнами, а с помощью тренировок на выносливость можно повысить уровень выносливости быстро сокращающихся волокон.Уровень улучшения варьируется в зависимости от человека, и тренировка никогда не может сделать медленно сокращающиеся волокна такими же мощными, как быстро сокращающиеся, и тренировка не может сделать быстро сокращающиеся волокна такими же устойчивыми к усталости, как медленно сокращающиеся волокна.
Структура и функция сердечной мышцы
Клетки сердечной мышцы находятся только в сердце. Они имеют удлиненную форму и содержат актиновые и миозиновые филаменты, которые образуют саркомеров ; они соединяются встык с образованием миофибрилл .Актиновые и миозиновые нити придают сердечной мышце полосатый вид. Штрихи менее многочисленны, чем в скелетных мышцах. Сердечные мышцы содержат большое количество митохондрий, которые производят энергию за счет аэробного метаболизма. Обширная капиллярная сеть крошечных кровеносных сосудов снабжает кислородом клетки сердечной мышцы. В отличие от клеток скелетных мышц, все сердечные клетки работают как одно целое, сокращаясь одновременно. Короче говоря, синоатриальный узел в верхней части сердца посылает импульс атриовентрикулярному узлу, который посылает волну поляризации, которая распространяется от одной сердечной клетки к другой, заставляя их все сокращаться одновременно.
Структура и функция гладких мышц
Гладкомышечные клетки различаются по функциям и выполняют множество функций в организме. Они имеют форму веретена, меньше скелетных мышц и содержат меньше актиновых и миозиновых нитей. Актиновые и миозиновые нити не организованы в саркомеры, поэтому гладкие мышцы не имеют полосатой формы. В отличие от других типов мышц, гладкие мышцы могут оказывать постоянное напряжение. Это называется тонус гладких мышц .Гладкомышечные клетки имеют такой же метаболизм, как и скелетные мышцы, вырабатывая большую часть своей энергии аэробно. Таким образом, они не очень хорошо приспособлены к анаэробному производству энергии. 1
Для получения дополнительной информации о физиологии мышц щелкните по ссылкам ниже:
Физиология скелетных мышц
Быстрое сокращение против медленного
Актин и миозин: Ромео и Джульетта мышечных клеток
Скелетные мышцы
Согласованная регуляция сократимости скелетных мышц за счет напряжения кислорода и эндогенного оксида азота
Реферат
Принято считать, что ингибирование синтазы оксида азота (NOS) облегчает и, следовательно, ингибирует оксид азота (NO), сократимость скелетных мышц.Однако стандартные оценки сократимости выполняются при нефизиологическом давлении кислорода [парциальное давление кислорода (pO 2 )], которое может мешать передаче сигналов NO (95% O 2 ). Поэтому мы исследовали на нормальных мышах и мышах с дефицитом нейрональной NOS (nNOS) влияние pO 2 на сократимость всей мышцы, а также на приток кальция в миоциты и укорочение саркомера. Здесь мы демонстрируем значительное улучшение этих показателей мышечной деятельности при низком физиологическом pO 2 и ингибирующее влияние при более высоком физиологическом pO 2 , которые зависят от эндогенного nNOS.При 95% O 2 (который вызывает окислительный стресс; ядро мышцы pO 2 ≈400 мм рт. Ст.) Производство силы усиливается, но контроль сократимости с помощью NO / нитрозилирования значительно ослабляется. Кроме того, чувствительность к pO 2 значительно изменяется в мутантной мышце nNOS. Эти результаты показывают фундаментальную роль согласованного действия NO и O 2 в физиологической регуляции сократимости скелетных мышц и предполагают новые молекулярные аспекты миопатического заболевания.Они также предполагают, что роль NO в некоторых клеточных системах может потребовать повторного изучения.
Недавно было признано, что регуляция функции белков на основе окислительно-восстановительного потенциала служит не только для опосредования компенсаторных ответов на окислительный или нитрозативный стресс, но также модулирует трансдукцию по основным сигнальным путям в клетках млекопитающих (1). Кроме того, накапливающиеся данные указывают на то, что модификации белков на основе оксида азота (NO) являются критическими эффекторами окислительно-восстановительной регуляции, что может быть связано на молекулярном уровне с парциальным давлением кислорода (pO 2 ) (1).Соответственно, функциональный вклад окислительно-восстановительных механизмов остается, по большей части, непроверенным и потенциально замаскированным практически во всех исследованиях ex vivo , которые проводились при сверхнормальном давлении кислорода (обычно 21% O 2 для клеток и 95 % O 2 для ткани, тогда как pO 2 in vivo намного ниже).
Скелетные мышцы млекопитающих работают в диапазоне pO 2 , который определяется местным кровотоком и мышечной активностью, и содержит эндогенные источники NO.Μ-изоформа типа I или нейрональная NO-синтаза (nNOS) локализуется на плазматической мембране (сарколемме) волокон скелетных мышц посредством взаимодействия с комплексом дистрофина (2–4). У многих млекопитающих nNOS либо ограничена, либо особенно в изобилии в быстро сокращающихся волокнах, хотя у людей быстросокращающиеся и медленные волокна обеспечены более равномерно (2, 5, 6). Потеря nNOS из сарколеммы мышей mdx (у которых быстро сокращающиеся волокна непропорционально нарушены) и пациентов с мышечной дистрофией Дюшенна или Беккера привлекла внимание к возможности того, что NO, продуцируемый мышечными волокнами, может играть роль в возбуждении. связь сокращения (E – C) и дефицит NO может способствовать нарушению сократимости при мышечных заболеваниях (2–6).Однако, хотя у мышей с дефицитом nNOS обнаруживаются незначительные нарушения мышечного кровотока (7), явных изменений сократительной функции не описано.
Исследования изолированных скелетных мышц обычно проводились при крайне нефизиологическом давлении кислорода, обычно 95% O 2 , тогда как pO скелетных мышц находится в диапазоне от 4 до 20 мм рт.ст. (0,5–2,5% O 2 ), а в рабочей мышце еще ниже (8, 9). Было показано, что супранормальные концентрации O 2 in vitro нарушают регуляцию NO рецептора рианодина / канала высвобождения кальция (RyR1) саркоплазматического ретикулума скелетных мышц (SR) (10).Таким образом, чтобы выявить физиологическую роль O 2 / NO в регуляции мышечной функции, мы исследовали в диапазоне pO 2 сократительные свойства и сокращение потока кальция / саркомера, соответственно, изолированных преимущественно быстро сокращающихся цельномышечные [длинный разгибатель пальцев (EDL)] и одиночные миоциты [flexor digitorum brevis (FDB)], полученные от нормальных мышей и мышей с генетическим нокаутом, у которых выборочно отсутствует nNOS ( nNOS — / — ) (11).
Экспериментальные процедуры
Мышечный биотест. EDL-мышц были получены от мышей-самцов в возрасте 6-8 недель ( nNOS — / — и C57BL / 6, Лаборатория Джексона). В каждом эксперименте использовали левую и правую EDL от одной мыши, которые удаляли и подвешивали к проксимальным и дистальным сухожилиям, последовательно с датчиками силы, в ваннах для органов при 37 ° C, содержащих раствор Кребса с добавлением d-тубокурарина (25 мкМ; для устранения любого влияния нервно-мышечной передачи). Мышцам давали уравновеситься в течение ≈15 минут при 5% CO 2 и либо 1-2% O 2 , 20% O 2 ‘, либо 95% O 2 .Напряжение кислорода в ванне контролировали с помощью кислородного электрода (WPI Instruments, Waltham, MA). При использовании метиловый эфир 1-нитроаргинина (l-NAME) (1 мМ) добавляли в ванну в начале периода уравновешивания. Все измерения мышечных пар проводились параллельно. Сокращения вызывали стимуляцией прямоугольным импульсом постоянного напряжения (50–80 В) длительностью 2 мс через платиновые электроды шириной 7,0 мм, расположенные параллельно длинной оси мышцы. Перед тестированием каждую мышцу отрегулировали до длины, при которой генерирование изометрической силы сокращения было максимальным (оптимальная длина мышцы, L o ).Между стимулами одинарного сокращения и между последовательностями тетанических стимулов проходит не менее 2 минут, и тетанический тест всегда следует за завершением измерений одиночных сокращений. Тетаническая стимуляция состояла из серии импульсов продолжительностью 75 мсек, а амплитуда индивидуальных стимулов была установлена на уровне, равном полумаксимальной или максимальной одинарной стимуляции. Для каждой мышцы измеряли L o после последней тетанической стимуляции, мышцу взвешивали во влажном состоянии и рассчитывали эффективную площадь поперечного сечения, аппроксимируя мышцу как цилиндр длиной L o , и плотность 1.06 г / см -3 (12). Поскольку L o существенно не различались между WT и nNOS — / — EDL (1,35 ± 0,06 см против 1,36 ± 0,06 см, P = 0,77), различия в эффективной площади поперечного сечения были в значительной степени результат различий в мышечной массе. Межгрупповые анализы одного или нескольких параметров были выполнены, соответственно, с помощью теста Стьюдента t и ANOVA.
Измерение мышц pO 2 . EDL-мышцы фиксировали горизонтально в растворе Кребса, в который непрерывно барботировали 20% O 2 /5% CO 2 . Поляграфический кислородный электрод (стеклянная микропипетка; диаметр наконечника ≈10 мкм), калиброванный после каждого использования, использовали для измерения pO 2 после проникновения в ядро мышцы (13). Состав барботажного газа изменяли последовательно с 20% O 2 до 95% O 2 и 1% O 2 после уравновешивания на каждом pO 2 (≈10 мин).
Миоцит Ca 2+ Переходные процессы и укорочение саркомера. мышц FDB, полученных от C57BL / 6 и nNOS — / — мышей инкубировали с 2% коллагеназой типа 2 (лаборатория Worthington) в течение 18 ч при 37 ° C и 95% O 2 /5% CO 2 перед тем, как миоциты диспергировали и хранили до использования в растворе Тиродеса, содержащем 1,8 мМ Ca 2+ , при комнатной температуре. Для экспериментальных наблюдений миоциты были перенесены в герметичный отсек предметного столика микроскопа и непрерывно слиты при комнатной температуре с раствором Тиродеса, содержащим 1.8 мМ Ca 2+ и 0,5 мМ пробенецид. Наблюдения были получены сначала при 20% O 2 до корректировки на 1% O 2 . Деполяризующая стимуляция (стимуляция) осуществлялась непрерывно с частотой 0,5 Гц. Измерение внутриклеточного Ca 2+ и длины саркомера было, как описано (14). Для измерения Ca 2+ использовали Fura-2 / AM (5 мкМ) и двухволновой спектрофотометр с попеременным возбуждением на 365 и 380 нм. Длину саркомера непрерывно контролировали с помощью камеры устройства с зарядовой связью, а изменения длины саркомера определяли с помощью быстрого преобразования Фурье кривой плотности Z-линии.
Результаты
Сначала мы сравнили сократительные свойства EDL при физиологически экстремальном давлении кислорода в ванне 20–21% O 2 (pO 2 ≈150 мм рт. и при 1-2% O 2 (pO 2 ≈10 мм рт. ст.), что характерно для нормальной поперечно-полосатой мышцы млекопитающих in vivo (8, 9). Прямые измерения в ядре мышцы (см. Экспериментальные процедуры и таблицу 1) показали, что среднее мышечное pO 2 составляло ≈40 мм рт. Ст. (Медиана 36.7 мм рт. Ст.) В ванне 20% O 2 и ≈3,5 мм рт. градиент в скелетных мышцах (8, 9). Кроме того, чтобы позволить прямое сравнение с предыдущими результатами, мы исследовали производительность EDL при 95% ванне O 2 (pO 2 ≈700 мм рт. Ст.), В которой мы измерили pO 2 ≈ 400 мм рт. физиологический градиент O 2 (таблица 1).Некоторые измерения производительности мышц были получены последовательно при разном кислородном напряжении для изучения динамики и обратимости pO 2 -зависимых изменений сократимости (см. Фиг. 2 A ).
Рис.2.Обратимость и NO / O 2 регулирование подергивания и тетанической силы левым и правым EDL от индивидуального WT и индивидуального nNOS — / — мыши. ( A ) Записи тензометрических датчиков из пары одновременно проанализированных EDL дикого типа демонстрируют быстрые и двунаправленные изменения напряжения тетанического подергивания после переключения между 20% и 95% O 2 [максимальное усилие при 95% O 2 (слева EDL) = 36 М / см 2 ].( B ) Записи из пары одновременно проанализированных nNOS — / — EDL показывают, что ни полумаксимальное, ни максимальное напряжение сокращений не различается на 1% по сравнению с 20% O 2 , тогда как генерация тетанической силы существенно больше при 20% O 2 , чем при 1% O 2 (см. также рис. 1 B и 3 D ).
Таблица 1. EDL мышечное ядро pO 2 в тканевых ваннах, барботированных O 2Мы оценили основные показатели сцепления E – C и производства силы, изометрического и тетанического напряжения сокращений для мышц, скорректированных по их кривой длины-напряжения для оптимизации генерирования силы.Измерения силы, вызванной одноимпульсной стимуляцией, показали, что при стимулах, производящих примерно половину максимального напряжения сокращений, сила, генерируемая EDL, увеличивалась на ≈45% при 1% по сравнению с 20% O 2 , и даже для стимулов, производящих максимальное напряжение сокращений, амплитуда напряжения сокращений была на ≈20% больше при низком pO 2 ( P <0,05; рис. 1 A ). Эти наблюдения показывают зависимую от pO 2 регуляцию связывания E – C, и недавние открытия обеспечивают вероятный механизм: NO модифицирует с помощью S-нитрозилирования единственный остаток цистеина (Cys-3635) в RyR1 и тем самым существенно увеличивает Ca 2+ поток через RyR1, который управляет активным сокращением (10, 15).Примечательно, что NO действует на этот критический тиол только при физиологических концентрациях O 2 (≈10 мм рт. Ст. Или меньше), где pO 2 -зависимое окислительно-восстановительное состояние небольшой подгруппы тиолов RyR1 (представляющих собой датчик O 2 ) снижается, тем самым создавая NO-чувствительную конформацию в канале (10). Напротив, NO не действует при сверхнормальном pO 2 , где эти аллостерические эффекторные тиолы окисляются. Таким образом, механистический анализ эффектов NO на RyR1 показывает, что NO должен способствовать сократимости при низком физиологическом pO 2 .Напротив, первоначальный анализ мышц диафрагмы (5, 16) и последующие исследования (рассмотренные в ссылке 6), проведенные на супрафизиологическом pO 2 , неизменно сообщали, что фармакологическое ингибирование NOS увеличивает выработку силы скелетными мышцами ex vivo (т.е. NO является ингибирующим).
Рис.1.Изометрическое напряжение подергивания, вызванное максимальной или приблизительно половиной максимальной стимуляции EDL однократным сокращением от мышей WT ( A ) или nNOS — / — ( B ) мышей при 1% или 20% O 2 , и в присутствии или в отсутствие ингибитора NOS, l-NAME.Гистограммы показывают производство силы, нормализованное для площади поперечного сечения EDL (M / cm 2 ). Каждая полоса представляет измерения, полученные для 8–10 отдельных мышц EDL. ( A ) Для субмаксимальной стимуляции значимость была достигнута ( P <0,05) увеличением силы подергивания на 1% по сравнению с 20% O 2 в отсутствие l-NAME ( * ) путем уменьшение силы сокращений при 1% O 2 в присутствии по сравнению с отсутствием l-NAME ( ** ) и увеличение силы сокращения при 20% O 2 в присутствии vs.отсутствие l-NAME ( *** ). При максимальном напряжении сокращений индуцированное l-NAME снижение силы сокращений при 1% O 2 было значительным. ( B ) Сила подергивания не зависела от pO 2 в EDL от мышей nNOS — / — . Обратите внимание, что максимальная сила сокращения была значительно больше в nNOS — / — EDL ( B ) по сравнению с WT EDL ( A ) как при 1%, так и при 20% O 2 , и что это увеличение также было значительным для субмаксимальных сила сокращения при 20% O 2 ( P <0.05).
Мы непосредственно переоценили роль эндогенного NO в pO 2 -зависимой регуляции сократимости с использованием мышей nNOS — / — и острого ингибирования NOS с l-NAME. Изометрические напряжения сокращений, разработанные EDL у мышей nNOS — / — , были неотличимы при 1% или 20% O 2 , либо при субмаксимальной, либо при максимальной стимуляции (Фигуры 1 B и 2 B ). Таким образом, в отсутствие продукции эндогенного NO с помощью nNOS, влияние pO 2 на напряжение сокращений полностью устраняется.Этот результат в сочетании с увеличением напряжения подергивания при низком и высоком pO 2 в WT EDL (рис.1 A ) указывает на согласованное влияние pO 2 и NO, что приводит к усилению за счет эндогенного NO связи E – C и производство силы при физиологическом напряжении кислорода. Кроме того, мы наблюдали, что nNOS — / — EDL генерировал большую силу сокращения, чем EDL WT (нормализованный для площади поперечного сечения), как при низком, так и при высоком pO 2 (рис.1). При 1% O 2 это увеличение было незначительным для полумаксимального напряжения сокращения, но максимальная сила сокращения была увеличена на ≈22%, а при 20% O 2 сила сокращения увеличилась на ≈54% как для субмаксимального, так и для субмаксимального значения. максимальное напряжение сокращений ( P <0,05). Эти наблюдения указывают на работу отдельных NO-независимых механизмов увеличения компенсаторной силы, которые регулируются с помощью O 2 в быстро сокращающихся мышцах, хронически лишенных активности nNOS.
Влияние острого ингибирования NOS на напряжение сокращений предоставило дополнительные доказательства согласованной регуляции NO и O 2 функции EDL (рис.1 А ). При физиологической концентрации O 2 , равной 1% O 2 (характеристика активной мышцы), обработка l-NAME (1 мМ) снижала полумаксимальную и максимальную силу сокращения на 30% и 42% соответственно ( P <0,05), что близко сравнимо с разницей между напряжением сокращений, полученным при 1% и 20% O 2 . Таким образом, в соответствии с результатами EDL у мышей nNOS — / — , величина NO-зависимого повышения сократимости, выявленная l-NAME, полностью объясняет потенцирующие эффекты на напряжение сокращений низкого по сравнению свысокий pO 2 . Поразительно контрастирует, но согласуется с предыдущими наблюдениями (5, 6, 16), сила сокращений была увеличена l-NAME при 20% O 2 , что привело к увеличению на 43% и 24% для субмаксимального и максимального напряжения сокращений соответственно. ( P <0,05; рис.1 A ). Увеличение производства силы за счет ингибирования NOS в условиях окружающего воздуха (≈40 мм рт. Ст.) Указывает на то, что при более высоком физиологическом pO 2 (связанном с относительной неактивностью мышц) NO оказывает тормозящее влияние на сократительный аппарат.Механизм действия вряд ли будет включать прямую модуляцию высвобождения Ca 2+ из SR, потому что RyR1 не модифицируется NO при сверхнормальном pO 2 (10, 15).
Мы также исследовали реакцию EDL на серию стимулов, которые вызывают тетанические (слитные) сокращения и которые, по сравнению с стимуляцией одиночных сокращений, вызывают значительное и устойчивое повышение уровней цитозольного Ca 2+ и продукции NO (6 ). Мы использовали последовательности импульсов, состоящие из отдельных импульсов с амплитудами, соответствующими либо полумаксимальной, либо максимальной одинарной стимуляции, и ни в одном случае амплитуда стимула не влияла на сообщаемые эффекты pO 2 или NO.Кроме того, следует отметить, что, хотя максимальное тетаническое напряжение развивалось при скорости стимулирования 200–250 ударов в секунду во всех условиях (рис. 2 и 3), наблюдения у интактных, ведущих себя грызунов показывают, что физиологический диапазон устойчивой разрядки двигательной активности нейроны, снабжающие быстро сокращающиеся мышцы конечности, распространяются только на ≈100 в секунду (17, 18), что фактически охватывает диапазон, в котором мы наблюдали самые большие NO / O 2 -зависимые различия в сократимости ( см. ниже ). ).
Рис.3.Сила сокращения, вызванная тетанической стимуляцией (40–250 Гц) EDL от мышей WT ( A — D ) и nNOS — / — ( E — H ) мышей при 1%, 20 % или 95% O 2 , и в присутствии или в отсутствие ингибитора NOS, l-NAME. Все значимые различия ( P <0,05) отмечены звездочками. ( A ) Кривые частоты нормализованной силы показывают, что у мышей WT l-NAME вызывает сдвиг влево (способствующий) при 20% O 2 и сдвиг вправо (ингибирующий) при 1% O 2 .Значительные различия были получены между кривыми при 1% и 20% O 2 в присутствии l-NAME в диапазоне стимуляции 40–120 Гц (SE указывается только для измерений в присутствии l-NAME). ( B ) Графики создания силы в зависимости от частоты стимуляции показывают, что производство силы значительно увеличивается при 20% O 2 в присутствии по сравнению с отсутствием l-NAME в диапазоне стимуляции 40–120 Гц. Не было значительных различий между кривыми создания силы / частоты стимуляции, полученными при 20% O 2 в отсутствие l-NAME, 1% O 2 в отсутствии l-NAME и 1% O 2 в присутствии l-NAME, и для ясности усредненная кривая для 1% O 2 в отсутствие и в присутствии l-NAME показана красным.( C ) При 95% O 2 обработка l-NAME не оказывает значительного влияния на силу, создаваемую последовательностями тетанических импульсов, но приводит к сдвигу влево (способствующему) сдвигу нормализованных частотно-силовых кривых при 70–120 Гц ( D). ). ( E — H ) EDL от nNOS — / — мышей. Кривые нормированной частоты силы практически неотличимы при 1% и 20% O 2 ( E ), но создание силы значительно увеличивается при 20% против 20%.1% O 2 в диапазоне стимуляции 70–250 Гц ( F ). l-NAME не оказывает значительного влияния на сократительную способность nNOS — / — EDL, что проиллюстрировано результатами, полученными при 95% O 2 ( G и H ). Обратите внимание, что, как и для WT EDL, создание силы с помощью nNOS — / — EDL больше при 95% O 2 , чем при 20% или 1% O 2 , но это вызывает выработку WT EDL и nNOS — / — EDL сопоставим при 95% O 2 .
Кривые частоты нормализованной силы, полученные из WT EDL при 1% против 20% O 2 не различались значительно в измеренном диапазоне тетанических частот 40–250 Гц. (Рис. 3A). Однако, в соответствии с зависимыми от pO 2 эффектами острого ингибирования NOS на напряжение сокращений (рис. 1 A ), лечение l-NAME приводило к сдвигу влево отношения частоты силы при 20% O 2 и сдвиг вправо на 1% O 2 (рис.3 А ). Разница между кривыми нормализованной частоты силы при 1% O 2 и 20% O 2 после обработки l-NAME была значительной в физиологически значимом диапазоне 40–120 Гц ( P <0,05). Более поразительно то, что графики зависимости абсолютной силы от частоты стимуляции показали, что острое ингибирование NOS приводит к существенному увеличению тетанической силы при 20% O 2 (рис. 3 B ), что в среднем составляет 68% и является значимым в диапазоне частот 40–120 Гц vs.как 20% O 2 в отсутствие l-NAME ( P <0,05; рис.3 B ), так и 1% O 2 в присутствии или в отсутствие l-NAME ( P <0,05 ; Рис.3 B ). Кривые генерирования силы / частоты стимуляции, полученные при 20% O 2 в отсутствие l-NAME, существенно не отличались от 1% O 2 в присутствии l-NAME и 1% O 2 в отсутствие l-NAME (рис.3 B ). Тетаническая сила, создаваемая WT EDL при 95% O 2 , была значительно больше, чем при 1% O 2 или 20% O 2 (с пиковым напряжением ≈35-40 М / см 2 , что эквивалентно до ≈20 г; рис.2 A и 3 B и C ), но, в то время как обработка l-NAME дала небольшой, но значительный сдвиг влево на кривых нормализованной частоты силы при более низких частотах стимула (в соответствии с предыдущими результатами при 95% O 2 ; ссылки 5, 6 и 12), не было получено никаких существенных различий между кривыми абсолютной силы и частоты при 95% O 2 в присутствии и в отсутствие l-NAME (фиг. 3 C и D ). Таким образом, ингибирующее влияние NO на производство силы, очевидное при 20% O 2 (≈40 мм рт. Ст.), Больше не проявляется в экстремально окислительно-восстановительной среде, созданной <95% O 2 (≈400 мм рт. Ст.).Взятые вместе, эффекты ингибирования NOS на сократительные ответы на повторяющуюся стимуляцию указывают на то, что влияние NO варьируется в зависимости от pO 2 и активации мышц, которые совместно определяют окислительно-восстановительную среду критических субклеточных компартментов (19, 20).
Нормированные кривые «сила-частота» для EDL nNOS — / — мышей были практически неразличимы при 1%, 20% и 95% O 2 (рис. 3 E и H ).Таким образом, при хроническом отсутствии NO, происходящего из nNOS, pO 2 не оказывает никакого влияния на форму соотношения сила-частота, полученную при повторной стимуляции. Кроме того, l-NAME не оказывал значительного влияния ни на нормализованные, ни на абсолютные кривые частоты силы у мышей nNOS — / — (фиг. 3 G и H ). Однако, в соответствии с увеличением силы сокращений, вызванной EDL, на nNOS — / — по сравнению с WT (рис.1 B ), выработка тетанической силы EDL на nNOS — / — мышей в возрасте 20 лет. % O 2 (рис.2 B и 3 F ) было больше, чем при 1% O 2 и превышало создание силы WT EDL на 1% или 20% O 2 ( P <0,05; тетаническое создание силы не отличалось значительно между nNOS — / — EDL при 1% O 2 , EDL WT при 1% O 2 и EDL WT при 20% O 2 ). Таким образом, pO 2 -зависимые различия в генерации силы были выявлены как при отсутствии nNOS, так и при остром ингибировании NOS (рис.3 A и B ). Кроме того, зависящая от pO 2 разница в генерировании силы EDL у мышей nNOS — / — увеличивалась с увеличением частоты тетанического стимула (фиг. 2 B и 3 F ). Что касается WT EDL, создание силы nNOS — / — EDL было больше при 95% O 2 , чем при 1% O 2 и 20% O 2 (рис. 3 F и G ). Следует отметить, что при 95% O 2 , создание силы nNOS — / — EDL и WT EDL было одинаковым (рис.3 C и G ), то есть повышенная сократительная способность nNOS — / — EDL при низком и среднем pO 2 гораздо менее очевидна при явно сверхнормальном давлении кислорода. Эти наблюдения устанавливают, что генерация тетанической силы увеличивается в мышце nNOS — / — при более высоком физиологическом pO 2 , и предполагают, что механизмы, действующие для увеличения выработки силы, могут включать повышенную генерацию или чувствительность к факторам увеличения силы, таким как активные формы кислорода (АФК, которые могут продуцироваться в больших количествах при увеличении pO 2 и активации мышц), и что патологические количества АФК могут скрывать передачу сигналов окислительно-восстановительного потенциала (19, 20).Мы наблюдали лишь минимальные эффекты Cu / Zn-супероксиддисмутазы, примененной к неповрежденной мышце (19), на выработку силы EDL (неопубликованные результаты), но роль АФК, генерируемых и действующих внутриклеточно, еще предстоит изучить.
Прямая демонстрация согласованной регуляции с помощью pO 2 и NO как потока Ca 2+ , так и сократительной функции была обеспечена анализом вызванных деполяризацией изменений в цитоплазматических уровнях Ca 2+ и длине саркомера в миоцитах, выделенных из FDB. (мышей WT и nNOS — / — и исследованы при 1% O 2 и 20% O 2 (14) (рис.4). И переходные процессы кальция, и укорочение саркомера, вызванное кратковременной электростимуляцией, были значительно выше при 1% O 2 , чем при 20% O 2 в миоцитах, полученных из WT FDB ( P <0,05), тогда как pO 2 не имел влияние на любую меру в nNOS — / — миоцитов. Кроме того, как амплитуда переходных процессов Ca 2+ , так и величина укорочения саркомера были значительно больше при 20% O 2 , но не при 1% O 2 , в nNOS — / — vs. .Миоциты WT ( P <0,05). Таким образом, эти наблюдения подтверждают на уровне отдельных мышечных клеток как облегчающее действие NO на сократительную способность при низком физиологическом pO 2 , так и регулируемое с помощью pO 2 компенсаторное усиление сократительной функции в nNOS — / — мышц. . На молекулярном уровне зависимое от pO 2 влияние NO на переходные процессы Ca 2+ , которые, как известно, отражают главным образом высвобождение Ca 2+ через RyR1 (21), поддерживает роль RyR1 как основного локуса. действия в согласованной окислительно-восстановительной регуляции с помощью pO 2 и NO (10, 15).
Рис.4.Ca 2+ переходные процессы ( A ) и укорочение саркомера ( B ), индуцированное деполяризацией миоцитов, полученных из FDB мышей WT или nNOS — / — мышей и стимулированных 1% или 20% O 2 . Оба показателя значительно выше при 1% по сравнению с 20% O 2 в миоцитах мышей WT ( * ), но нет эффекта pO 2 ни на один из показателей в nNOS — / — миоцитов. .Также обратите внимание, что величина переходных процессов Ca 2+ и укорочения саркомера значительно больше при 20% O 2 , но не при 1% O 2 , в миоцитах из nNOS — / — vs. Мыши WT ( ** ). ( C ) Репрезентативные записи цитозольного Ca 2+ и длины саркомера для отдельного миоцита WT и отдельного миоцита nNOS — / — . Обратите внимание, что амплитуды переходных процессов Ca 2+ и укорочения саркомера не зависят от pO 2 в миоците nNOS — / — .
Обсуждение
Наши результаты показывают, что сократимость скелетных мышц зависит от напряжения кислорода и что эта зависимая от pO 2 модуляция осуществляется в значительной степени за счет действия NO, генерируемого nNOS in situ . Согласованное регулирование с помощью NO и O 2 соединения E – C и создания силы работает как при низком, так и при высоком кислородном напряжении. Влияние NO при низком физиологическом pO 2 облегчает, тогда как NO ингибирует сократительную способность при более высоком физиологическом pO 2 .Только ингибирующее влияние было описано в предыдущих исследованиях (6) поперечнополосатых мышц млекопитающих, которые проводились исключительно при полностью нефизиологическом давлении кислорода (95% O 2 ). Кроме того, поскольку эти результаты (полученные с фармакологическими ингибиторами) не соответствовали сообщениям об отсутствии измененной функции мышц у мышей nNOS — / — или nNOS-дефицитных мышей mdx (2, 3, 22), важность NO в сочетании E – C и его потенциальное патофизиологическое значение при дистрофических заболеваниях остаются под вопросом.
Облегчающее действие NO на pO нормальной мышцы 2 подтверждает физиологическую важность NO-зависимого увеличения высвобождения кальция из SR скелетных мышц посредством S -нитрозилирования RyR1 при физиологическом, но не наднормальном pO 2 , наблюдаемом в витро (10). Кроме того, недавно было показано, что эндогенный NO усиливает RyR-опосредованное высвобождение Ca 2+ из SR сердечных миоцитов (23), действие, специфически опосредованное nNOS (14).Ингибирующее действие NO на сократительную способность при более высоком pO 2 может отражать действие различных молекулярных механизмов, которые наиболее ярко проявляются в условиях окислительного стресса. Редокс-чувствительные мышечные белки, которые, как сообщается, модифицируются NO или S-нитрозоглутатионом (GSNO), включают Ca 2+ -зависимую АТФазу SR (24, 25), которая регулирует гомеостаз SR-цитозоля Ca 2+ , и составляющие миофиламентов (26, 27), которые непосредственно поддерживают сократительную функцию.Кроме того, активация гуанилатциклазы была вовлечена в снижение мышечной силы NO / GSNO в предыдущих исследованиях (5, 28), проведенных на супрафизиологическом pO 2 .
Независимо от идентичности полного спектра белков, на которые действует NO / нитрозилирование в мышечных клетках, наши экспериментальные результаты подтверждают модель, согласно которой цели, механизмы действия и функциональные эффекты эндогенного NO будут непрерывно изменяться в зависимости от окислительно-восстановительного статуса мышц. связано с напряжением кислорода (и, предположительно, с производством АФК).Условные эффекты NO, таким образом, будут связывать модуляцию сократимости с продолжающейся мышечной активностью и метаболической потребностью. Низкое pO 2 в работающей мышце повысит сократимость, а повышение pO 2 в мышце в состоянии покоя ослабит сократимость, что аналогично pO 2 -зависимой регуляции вазоактивности NO, происходящей из красных кровяных телец, которая объединяет периферический кровоток. к местной метаболической потребности (например, гипоксическая вазодилатация и гипероксическая вазоконстрикция; исх.29 и 30). Соответственно, сигналы на основе NO / S-нитрозотиола, регулируемые O 2 , будут координированно регулировать как кровоток, так и сократимость в поперечно-полосатом мышечном ложе. Эта модель может применяться в более общем плане для разных типов клеток и субклеточных компартментов, в которых проявляется биоактивность, производная от NO, и, таким образом, может обеспечить основу для выяснения роли NO в регуляции функции белков и клеточной физиологии на основе окислительно-восстановительного потенциала (1), которая имеет в значительной степени замаскированы в исследованиях, проведенных на сегодняшний день по супрафизиологическому pO 2 .
Повышенное производство силы в результате окислительного воздействия (см. 95% O 2 на рис. 2 и 3) или дефицита NOS (рис. 1, 2 и 3 F и G ) может обеспечить компенсаторный механизм для поддержания работоспособности травмированной или больной (дистрофической) мышцы. В самом деле, может случиться так, что хроническая депривация NO приводит к окислительному стрессу. Однако это большее производство силы имеет свою цену: NO и O 2 больше не осуществляют координационный контроль (активность RyR не регулируется нитрозилированием S по супрафизиологическому pO 2 ).Эта более широкая перспектива может обеспечить новую молекулярную основу для различных миопатий, которые связаны с измененной экспрессией, распределением или активностью NOS и / или нарушением оксигенации или кровотока, которые ранее относились к категории окислительного / нитрозативного стресса, но здесь рассматриваются как симптом дисбаланса в передаче сигналов на основе NO / O 2 , которая необходима для нормальной регулируемой кальцием функции мышц. То есть, вместо того, чтобы рассматривать окислительный / нитрозативный стресс просто с точки зрения окислительного повреждения мышц, наши результаты предполагают, что ухудшение работы мышц может быть результатом физиологических изменений баланса NO / O 2 , которые нарушают передачу сигналов на основе нитрозилирования / окислительно-восстановительного потенциала.
Благодарности
Эта работа была поддержана грантами Национального института здравоохранения HL-59130 (для J.S.S.), HL-04053 (для J.P.E.) и AR-18687 (для G.M.).
Сноски
↵ ** Кому корреспонденцию следует направлять по адресу: Department of Medicine, Box 2612, Duke University Medical Center, Durham, NC 27710. Электронная почта: staml001 {at} mc.duke.edu.
↵ ‡ J.M.H., D.T.H. и M.S. внес равный вклад в эту работу.
Этот документ был отправлен напрямую (Трек II) в офис PNAS.
Сокращения: NOS, NO синтаза; nNOS — нейрональная БДУ; pO 2 , парциальное давление кислорода; E – C, возбуждение – сокращение; SR, саркоплазматический ретикулум; RyR1, рианодиновый рецептор / канал высвобождения кальция; EDL, длинный разгибатель пальцев; FDB, brevis сгибателя пальцев; l-NAME, метиловый эфир l-нитроаргинина.
