Сердечную деятельность регулируют ионы: 2.2. Регуляция сердечной деятельности и сосудистого тонуса
2.2. Регуляция сердечной деятельности и сосудистого тонуса
1. механизмы базисной миогенной регуляции сердечной деятельности
гетерометрический
гомеометрический
местные метасимпатические рефлексы
экстракардиальная нейрогенная регуляция
экстракардиальная гуморальная регуляция
2. Основной закон миогенной саморегуляции сердечной деятельности
закон Анрепа
закон Боудича
закон «все или ничего»
закон Франка-Старлинга
3. Закон Франка-Старлинга
Чем больше растягивается миокард во время диастолы, тем сильнее он сокращается во время систолы
Повышение давления в аорте вызывает увеличение силы сердечных сокращений
Чем выше частота, тем больше сила сокращений сердца
4. основной
закон миогенной саморегуляции сердца
основной
закон миогенной саморегуляции сердца
Чем больше растягивается миокард во время диастолы, тем сильнее он сокращается во время систолы
Повышение давления в аорте вызывает увеличение силы сердечных сокращений
Чем выше частота, тем больше сила сокращений сердца
5. гетерометрический механизм регуляции сердечной деятельности отражает зависимость
силы сокращения сердца от давления в аорте
между частотой и силой сердечных сокращений
между степенью растяжения миокарда во время диастолы и силой его последующего сокращения в систолу
6. Эффект Боудича отражает зависимость
силы сокращения сердца от давления в аорте
между частотой и силой сердечных сокращений
между степенью растяжения миокарда во время диастолы и силой его последующего сокращения в систолу
7. Эффект
Анрепа отражает зависимость
Эффект
Анрепа отражает зависимость
силы сокращения сердца от давления в аорте
между частотой и силой сердечных сокращений
между степенью растяжения миокарда во время диастолы и силой его последующего сокращения в систолу
8. Закон Анрепа
Чем больше растягивается миокард во время диастолы, тем сильнее он сокращается во время систолы
Повышение давления в аорте вызывает увеличение силы сердечных сокращений
Чем выше частота, тем больше сила сокращений сердца
9. Закон Боудича
Чем больше растягивается миокард во время диастолы, тем сильнее он сокращается во время систолы
Повышение давления в аорте вызывает увеличение силы сердечных сокращений
Чем выше частота, тем больше сила сокращений сердца
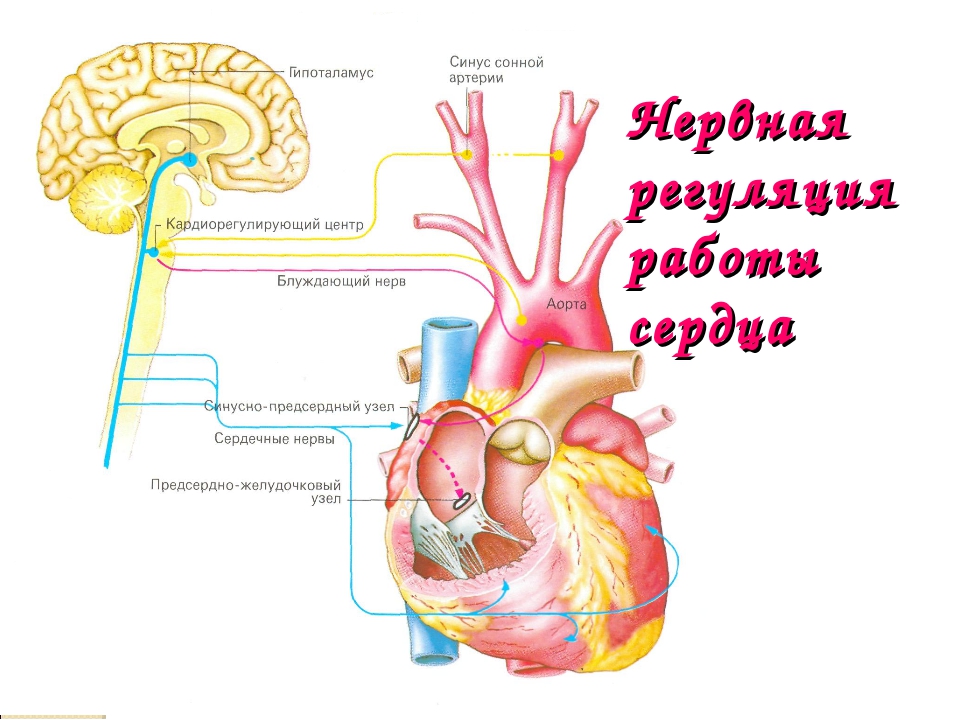
10. Интракардиальная
нейрогенная регуляция обеспечивается
Интракардиальная
нейрогенная регуляция обеспечивается
симпатической нервной системой
парасимпатической нервной системой
метасимпатической нервной системой
11. ведущую роль в экстакардиальной регуляции сердечной деятельности играет
соматический
симпатический
парасимпатический
метасимпатический
отдел нервной системы
12. При слабом раздражении блуждающего нерва
частота сердечных сокращений уменьшится
сила сердечных сокращений увеличится
сила сердечных сокращений уменьшится
частота и сила сердечных сокращений не изменяются
13. При
сИЛЬНОМ раздражении блуждающего нерва
При
сИЛЬНОМ раздражении блуждающего нерва
частота сердечных сокращений увеличится
частота сердечных сокращений уменьшится
сила сердечных сокращений увеличится
сила сердечных сокращений уменьшится
частота и сила сердечных сокращений не изменяются
14. Из окончаний ганглионарных парасимпатических нейронов при сильном раздражении блуждающего нерва выделяется
серотонин
адреналин
ацетилхолин
норадреналин
гамма-аминомасляная кислота (ГАМК)
15. Кардиотропные эффекты ацетилхолина
+инотропный
-инотропный
-хронотропный
+батмотропный
-батмотропный
-дромотропный
16. Из
окончаний ганглионарных симпатических
нейронов выделяются
Из
окончаний ганглионарных симпатических
нейронов выделяются
серотонин
адреналин
ацетилхолин
норадреналин
гамма-аминомасляная кислота (ГАМК)
+инотропный
-инотропный
+хронотропный
-хронотропный
+батмотропный
-батмотропный
+дромотропный
18. Кардиотропные эффекты норадреналина
+инотропный
-инотропный
+хронотропный
-хронотропный
+батмотропный
-батмотропный
+дромотропный
19. При
раздражении симпатических сердечных
нервов
При
раздражении симпатических сердечных
нервов
частота и сила сердечных сокращений могут только увеличиться
частота и сила сердечных сокращений могут только уменьшиться
частота и сила сердечных сокращений изменятся в зависимости от силы раздражения
симпатические сердечные нервы не оказывают влияния на частоту и силу сердечных сокращений
20. жизненно важная часть центра регуляции сердечной деятельности располагается в
среднем мозге
продолговатом мозге
промежуточном мозге
1-5 грудных сегментах спинного мозга
коре больших полушарий головного мозга
21. центры симпатической нервной системы, регулирующие деятельность сердца, располагаются В
мозжечке
среднем мозге
продолговатом мозге
промежуточном мозге
1-5 грудных сегментах спинного мозга
коре больших полушарий головного мозга
22. собственные
сердечные рефлексы
собственные
сердечные рефлексы
Даньини-Ашнера
Циона-Людвига
Бейнбриджа
Геринга
Гольца
23. Рефлексогенные зоны собственных сердечных рефлексов
барорецепторы дуги аорты
механорецепторы глазных яблок
барорецепторы каротидной зоны
механорецепеторы органов брюшной полости
волюморецепторы, расположенные в устьях полых вен
24. рефлекс Бейнбриджа возникает при раздражении
барорецепторов дуги аорты
механорецепторов глазных яблок
барорецепторов каротидной зоны
механорецепеторов органов брюшной полости
волюморецепторов, расположенных в устьях полых вен
25. сопряженные
сердечные рефлексы
сопряженные
сердечные рефлексы
Даньини-Ашнера
Циона-Людвига
Бейнбриджа
Геринга
Гольца
26. рефлекс Даньини-Ашнера возникает при раздражении
барорецепторов дуги аорты
механорецепторов глазных яблок
барорецепторов каротидной зоны
механорецепеторов органов брюшной полости
волюморецепторов, расположенных в устьях полых вен
27. рефлекс Гольца возникает при раздражении
барорецепторов дуги аорты
механорецепторов глазных яблок
барорецепторов каротидной зоны
механорецепеторов органов брюшной полости
волюморецепторов, расположенных в устьях полых вен
28. химическиЕ
веществА, регулирующиЕ сердечную
деятельность гуморальным путем
химическиЕ
веществА, регулирующиЕ сердечную
деятельность гуморальным путем
ионы
гормоны
метаболиты
медиаторы
эйкозаноиды
29. При увеличении концентрации во внеклеточной среде ионов
K+
Na+
Ca2+
Cl—
СЕРДЕЧНАЯ ДЕЯТЕЛЬНОСТЬ УГНЕТАЕТСЯ
30. При увеличении концентрации во внеклеточной среде ионов
K+
Ca2+
Н+
НСО3—
СЕРДЕЧНАЯ ДЕЯТЕЛЬНОСТЬ СТИМУЛИРУЕТСЯ
31. При
значительном избытке в межклеточной
жидкости ионов K+
При
значительном избытке в межклеточной
жидкости ионов K+
сердце может остановиться во время систолы
сердце может остановиться во время диастолы
частота и сила сердечных сокращений повышаются
32. кислые метаболиты
повышают сократительную активность миокарда
повышают частоту сердечных сокращений (ЧСС)
снижают сократительную активность миокарда
не влияют на сердечную деятельность
снижают ЧСС
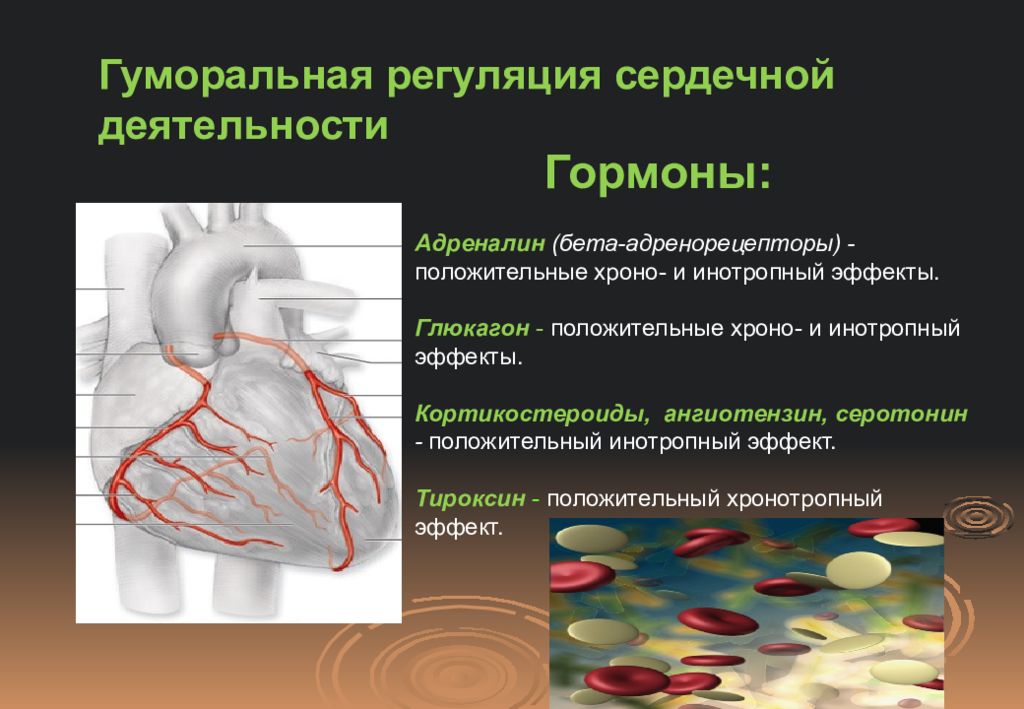
33. Гормоны мозгового слоя надпочечников
не оказывают влияния на сердечную деятельность
повышают частоту сердечных сокращений
увеличивают силу сердечных сокращений
снижают частоту сердечных сокращений
снижают силу сердечных сокращений
34. Тироксин
Тироксин
не оказывает влияния на сердечную деятельность
повышает частоту сердечных сокращений
увеличивают силу сердечных сокращений
снижают частоту сердечных сокращений
снижают силу сердечных сокращений
35. Кортикостероиды
не оказывают влияния на сердечную деятельность
повышают частоту сердечных сокращений
увеличивают силу сердечных сокращений
снижают частоту сердечных сокращений
снижают силу сердечных сокращений
36. Глюкагон
не оказывает влияния на сердечную деятельность
повышает частоту сердечных сокращений
увеличивает силу сердечных сокращений
снижает частоту сердечных сокращений
снижает силу сердечных сокращений
37. механизмы
управления, играЮЩИе ведущую роль в
регуляции тонуса кровеносных сосудов
механизмы
управления, играЮЩИе ведущую роль в
регуляции тонуса кровеносных сосудов
нервные
гуморальные
местные миогенные
местные нейрогенные
38. ведущую роль в нейрогенной регуляции тонуса кровеносных сосудов играет
симпатический
парасимпатический
метасимпатический
ОТДЕЛ АВТОНОМНОЙ НЕРВНОЙ СИСТЕМЫ
39. симпатические сосудосуживающие центры располагаются
с 8 шейного по 3 поясничный сегменты спинного мозга
в коре больших полушарий
в продолговатом мозге
в среднем мозге
в мозжечке
40. жизненно
важная часть сосудодвигательного центра
располагается в
жизненно
важная часть сосудодвигательного центра
располагается в
мозжечке
среднем мозге
спинном мозге
продолговатом мозге
промежуточном мозге
коре больших полушарий
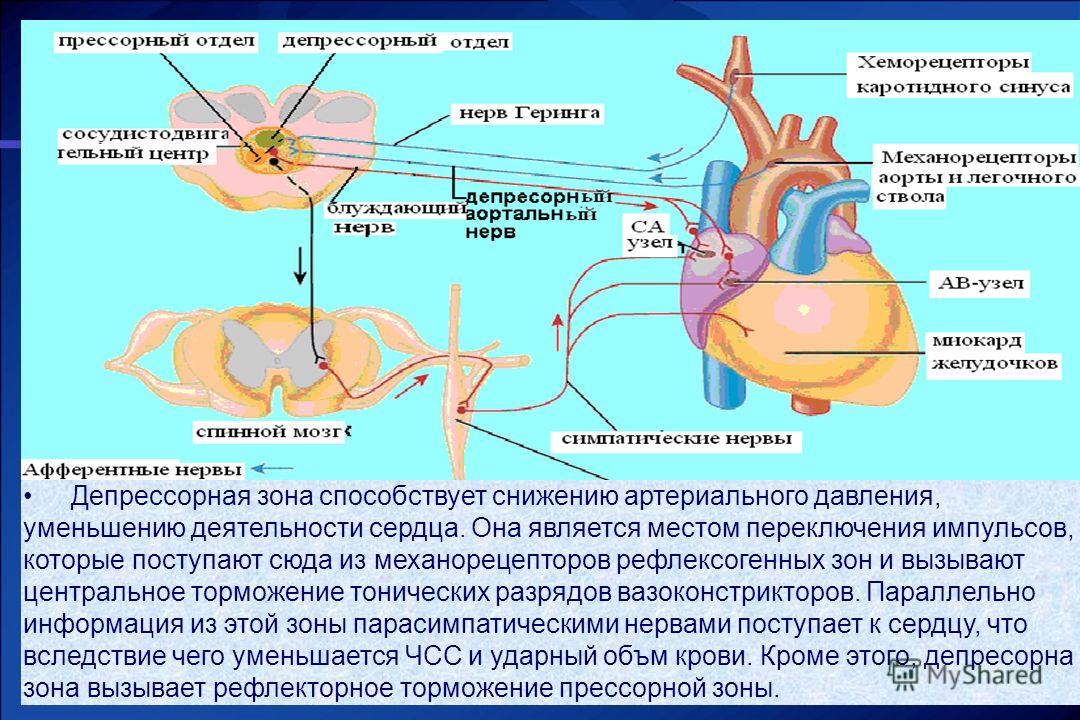
41. основная рефлексогенная зона сосудистого депрессорного рефлекса
зона Бейнбриджа
зона Даньини-Ашнера
зона Циона-Людвига
зона Геринга
зона Гольца
42. Основная рефлексогенная зона сосудистого депрессорного рефлекса представлена
барорецепторами дуги аорты
хеморецепторами дуги аорты
барорецепторами каротидной зоны
хеморецепторами каротидной зоны
волюморецепторами устьев полых вен
43. основная
рефлексогенная зона сосудистого
прессорного рефлекса
основная
рефлексогенная зона сосудистого
прессорного рефлекса
зона Бейнбриджа
зона Даньини-Ашнера
зона Циона-Людвига
зона Геринга
зона Гольца
44. Основная рефлексогенная зона сосудистого прессорного рефлекса представлена
барорецепторами дуги аорты
хеморецепторами дуги аорты
барорецепторами каротидной зоны
хеморецепторами каротидной зоны
волюморецепторами устьев полых вен
45. химические вещества, регулирующие тонус кровеносных сосудов гуморальным путем
ионы
гормоны
медиаторы
метаболиты
эйкозаноиды
46. Катехоламины
расширяют артерии
Катехоламины
расширяют артерии
кожи
легких
головного мозга
скелетных мышц
слизистых оболочек
органов брюшной полости
47. Катехоламины суживают артерии
кожи
легких
головного мозга
скелетных мышц
слизистых оболочек
органов брюшной полости
48. Артерии скелетных мышц расширяются под влиянием
вазопрессина
катехоламинов
кислых метаболитов
недостатка кислорода
повышения содержания СО2
Тестовая работа «Химический состав клетки»
ХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ
Открытые тесты.
1.Водные оболочки вокруг макромолекул называются ……..
2. В состав хлорофилла и многих ферментов входит ион ………..
3. Фосфор входит преимущественно в состав ДНК, РНК и ………………
4. Разнообразие белковых молекул обеспечивается: …….., составом и последовательностью аминокислот.
5. Химические связи, обусловливающие первичную структуру белковой молекулы, ковалентные ………………………
6. Светочувствительный белок, регулирующий фотопериодические реакции растений, называется ………. …………………….
7. Белки, сывороточный альбумин, гемоглобин, пермеазы и порины выполняют функцию ………………..
8. Восстановление структуры белковых молекул при возвращении их в нормальные условия среды, если сохранена первичная структура, называется…………….
9. Неорганические соединения, входящие в состав ферментов, называются ……. .
.
10. Молекулы углеводов, содержащие от двух до десяти моносахаридных остатков, называются ………
………………
11. В состав костей, хрящей, сухожилий и связок входят сложные углеводы-………………
12. Молекула липида — это сложный эфир ………. и высших жирных кислот.
13. Если в жирных кислотах, входящих в состав липидов, имеются двойные связи (С=С), то такие кислоты и липиды называются ………..
14. Желчные кислоты, половые гормоны и витамин D относятся к группе липидов, которые называются ………………
15. ДНК в клетке содержат структуры: ядро, пластиды и ……………….
16. Две цепочки ДНК соединяются ………….. связями между азотистыми основаниями.
17. Расположение комплементарных цепей в молекуле ДНК в противоположные стороны называется ………..
18. Фермент ДНК-полимераза двигается вдоль цепи ДНК только в направлении . ……
……
19. Отдельные фрагменты «дочерней» молекулы ДНК, синтезирующиеся на отстающей «материнской» цепочке, сшиваются ферментом……………..
20. Пространственное взаиморасположение иРНК и тРНК обеспечивает … РНК.
Тесты с одним вариантом ответа.
21. Микроэлементы клетки: 1) цинк, серебро, медь и водород 2) углерод, сера, кислород и азот
3) железо, йод и кобальт 4) железо, натрий и фосфор.
22. Углерод как элемент входит в состав: 1) только липидов и углеводов 2) только неорганических соединений 3) только белков и нуклеиновых кислот 4) всех органических соединений клетки.
23. Сера и азот входят в состав большинства молекул:
1) белков 2) жиров 3) углеводов 4) нуклеиновых кислот.
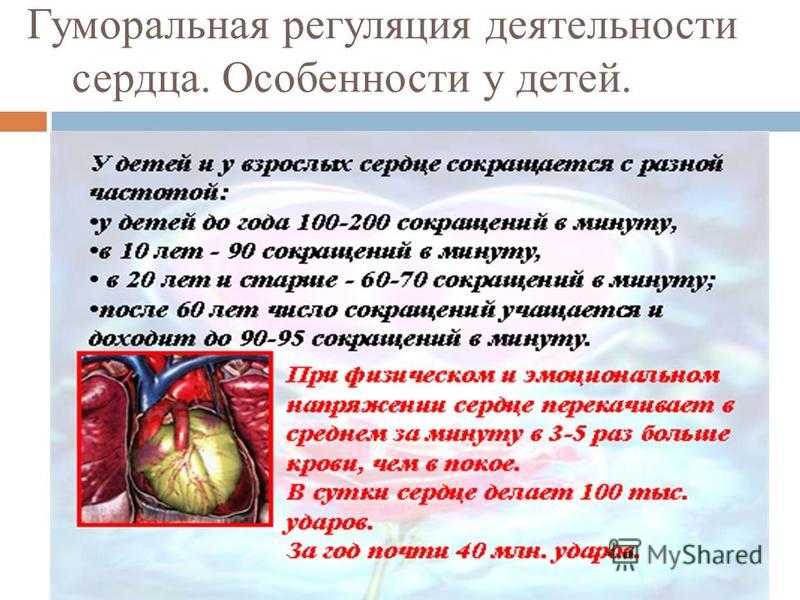
24. Сердечную деятельность регулируют ионы:
1) фосфора, меди и железа 2) кальция и калия 3) серы, фосфора и натрия 4) хлора, натрия и йода.
25. Раздражимость клеток обеспечивают ионы:
1) меди и никеля 2) натрия, калия и кальция 3) калия, серы и фосфора 4) железа, меди и цинка.
26. Вещества, частично растворимые в воде, называются:
1) амфифильными 2) амфотерными 3) гидрофобными 4) гидрофильными.
27. Биополимерами являются:1) липиды, липоиды и белки 2) ДНК, РНК, полисахариды и белки
3) полисахариды, вода и минеральные соли 4) белки, моносахариды и минеральные соли.
28. Основные аминокислоты имеют: 1) более одной карбоксильной группы 2) только одну карбоксильную группу 3) одну аминогруппу и одну карбоксильную группу 4) более одной аминогруппы.
29. Вторичная структура белковых молекул обусловлена связям
1) ковалентными пептидными 2) дисульфидными и электростатическими взаимодействиями
3) водородными 4) ковалентными фосфодиэфирными.
30. Фибриллярными белками, функционирующими в виде а-спирали, являются:
1) альбумин, глобулин, коллаген и фибриноген 2) фиброин, альбумин, миозин и актин
3) альбумин, глобулин, гемоглобин и миозин 4) кератин, фибриноген, миозин и актин.
31.Специфичность ферментов обусловлена наличием:
1) активных центров 2) апофермента 3) кофермента 4) кофактора.
32.Защитную функцию выполняют белки:1) альбумины и глобулины 2) иммуноглобулины и фибриноген
3) тубулины и гемоглобин 4) актин и миозин.
33.Полисахаридами являются:1) крахмал, гликоген, хитин и целлюлоза 2) рибоза и дезоксирибоза
3) лактоза и сахароза 4) глюкоза и галактоза.
34.Липопротеины — это комплекс: 1) белков и липидов 2) углеводов и белков 3) углеводов и липидов
4) остатков фосфорной кислоты и липидов.
35. В состав нуклеотидов ДНК входят: 1) рибоза и остаток фосфорной кислоты 2) дезоксирибоза и остаток азотистой кислоты 3) азотистые основания — аденин, гуанин, цитозин и тимин
4) азотистые основания — аденин, гуанин, цитозин и урацил.
36.Какую функцию выполняют белки, ускоряющие химические реакции в клетке
1) гормональную 2) сигнальную 3) ферментативную 4) информационную
37.Липиды в организме человека образуются из
1) глицерина и жирных кислот 2) аминокислот 3) глюкозы и фруктозы 4) углекислого газа и воды
38.Вещества, содержащие азот, образуются при биологическом окислении
1) белков 2) жиров 3) углеводов 4) глицерина
39.Только белки выполняют функцию: 1) защитную 2) энергетическую 3) запасающую 4) двигательную
40.Основным источником энергии в организме являются:1) витамины 2) ферменты 3) гормоны 4) углеводы
41.Функция простых углеводов в клетке — 1) каталитическая 2) энергетическая 3) хранение наследственной информации 4) участие в биосинтезе белка
43.Входят в состав ферментов и влияют на обмен веществ: 1) гормоны 2) жиры 3) витамины 4) углеводы
44.На рисунке показана химическая формула молекулы
1) нуклеотида рибонуклеотида 2) нуклеотида дезоксирибонуклеотида 3) аминокислоты 4) АТФ
45.Что изображено на рисунке?
1) молекула белка в первичной структуре
2) молекула ДНК во вторичной структуре
3) молекула белка во вторичной структуре
4) молекула белка в четвертичной структур
46.Гидрофобные и гидрофильные свойства фосфолипидов лежат в основе
1) их участия в образовании плазматической мембраны 2) выполнения ими энергетической функции3) взаимодействия молекул липидов с углеводами
4) их регуляторной функции
47. Избыточное количество углеводов в организме приводит к
1) отравлению организма 2) их превращению в белки 3) их превращению в жиры
4) расщеплению на более простые вещества
48.Чтобы выяснить влияние низкой температуры на активность ферментов желудочного сока, следует налить в две пробирки немного желудочного сока и добавить к нему тонкие хлопья белка полусваренного яйца. Затем 1) одну пробирку поставить в снег, а вторую — в тёплую воду
2) обе пробирки поставить в снег и добавить в одну раствор соляной кислоты 3) одну пробирку поставить в снег, а вторую — в кипящую воду 4) обе пробирки поставить в снег и добавить в одну раствор щелочи
49.При расщеплении нуклеиновых кислот образуются молекулы
1) глюкозы 2) жирных кислот и глицерина 3) аминокислот 4) нуклеотидов
50.Информация о последовательности расположения аминокислот в молекуле белка переписывается в ядре с молекулы ДНК на молекулу 1) АТФ 2) рРНК 3) тРНК 4) иРНК
51.Участок ДНК, содержащий информацию об одной полипептидной цепи, называют
1) хромосомой 2) триплетом 3) геном 4) кодом
52.Для молекул ДНК характерна функция
1) самоудвоения 2) денатурации 3) ферментативная 4) гормональная
53.Молекулы иРНК, в отличие от тРНК: 1) служат матрицей для синтеза белка 2) служат матрицей для синтеза тРНК 3) доставляют аминокислоты к рибосоме 4) переносят ферменты к рибосоме
54.Молекулы РНК, в отличие от ДНК, содержат азотистое основание
1) аденин 2) гуанин 3) урацил 4) цитозин
55.Рибоза, в отличие от дезоксирибозы, входит в состав: 1) ДНК 2) и-РНК 3) белков 4) полисахаридов
56.Процесс денатурации белковой молекулы обратим, если не разрушены связи
1) водородные 2) пептидные 3) гидрофобные 4) дисульфидные
57.Отличие ферментов от других белков заключается в том, что они
1) не денатурируют 2) обладают только двумя пространственными конфигурациями
3) активны при любых условиях 4) ускоряют химические реакции
58.Не является нуклеотидом ДНК 1) аденин 2) тимин 3) цитозин 4) урацил
59.В молекуле ДНК количество нуклеотидов с гуанином составляет 20% от общего числа. Доля нуклеотидов с тимином в этой молекуле составляет 1) 20% 2) 30% 3) 40% 4) 60%
60.В состав молекулы ДНК не входит 1) цитозин 2) фосфорная кислота 3) рибоза 4) тимин
61.В состав нуклеотидов молекулы ДНК не входит азотистое основание
1) цитозин 2) урацил 3) аденин 4) гуанин
62.Структуру, напоминающую по форме лист клевера, имеет молекула
1) гемоглобина 2) тРНК 3) хлорофилла 4) иРНК
63.В молекуле ДНК количество нуклеотидов с гуанином составляет 25% от общего числа. Какой процент нуклеотидов с аденином в этой молекуле?
1) 25% 2) 45% 3) 50% 4) 75%
64.Схема строения какой молекулы изображена на рисунке?
1) вторичная структура белка 2) вторичная структура ДНК
3) третичная структура белка 4) четвертичная структура ДНК
65.В молекуле ДНК количество нуклеотидов с гуанином составляет 30% от общего числа. Какой процент нуклеотидов с аденином содержится в этой молекуле? 1) 20% 2) 30% 3) 60% 4) 40%
66.В молекуле ДНК количество нуклеотидов с гуанином составляет 15% от общего числа. Доля нуклеотидов с тимином в этой молекуле составит: 1) 15% 2) 35% 3) 45% 4) 85%
67.Хорошо растворяется(-ются) в воде
1) жирные кислоты 2) металлы 3) фосфолипиды 4) простые углеводы
68.В каком из перечисленных процессов участвуют ионы кальция? 1) транспорт газов 2) образование связей между аминокислотами 3) синтез белков 4) процесс свёртывания крови
69.Инородные белки, попавшие в организм человека, связываются, образуя комплексы с
1) антигенами 2) тромбоцитами 3) антителами 4) антибиотиками
70.В молекуле ДНК количество нуклеотидов с гуанином составляет 30% от общего числа. Сколько нуклеотидов с тимином в этой молекуле? 1) 20% 2) 40% 3) 60% 4) 70%
71.Гидрофобными соединениями являются 1) ферменты 2) белки 3) полисахариды 4) липиды
72.Какие вещества синтезируются в клетках человека из аминокислот
1) фосфолипиды 2) углеводы 3) витамины 4) белки
73.Синтез каких простых органических веществ в лаборатории подтвердил возможность абиогенного возникновения белков 1) аминокислот 2) сахаров 3) жиров 4) жирных кислот
74.Назовите молекулу, входящую в состав клетки и имеющую карбоксильную и амино — группы
1) Глюкоза 2) ДНК 3) Аминокислота 4) Клетчатка
75.Липиды растворяются в эфире, но не растворяются в воде, так как
1) состоят из мономеров 2) гидрофобны 3) гидрофильны 4) являются полимерами
76.Водородные связи между СО — и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры 1) первичной 2) вторичной 3) третичной 4) четвертичной
77.Молекулы АТФ выполняют в клетке функцию
1) защитную 2) каталитическую 3) аккумулятора энергии 4) транспорта веществ
78.Какие связи определяют первичную структуру молекул белка
1) гидрофобные между радикалами аминокислот 2) водородные между полипептидными нитями
3) пептидные между аминокислотами 4) водородные между — NH — и — СО — группами
79.Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S 2) нескольких полипептидных нитей, образующих клубок 3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
80.В клетке липиды выполняют функцию
1) каталитическую 2) транспортную 3) информационную 4) энергетическую
81.Какую функцию выполняют белки, вырабатываемые в организме при проникновении в него бактерий или вирусов 1) регуляторную 2) сигнальную 3) защитную 4) ферментативную
82.Разнообразные функции в клетке выполняют молекулы 1) ДНК 2) белков 3) иРНК 4) АТФ
83.Фосфолипиды — это
1) ферменты, отвечающие за расщепление жиров 2) нейромедиаторы, синтезируемые нервными клетками
3) структурный компонент клеточных мембран 4) запасное вещество клетки
84.Сколько водородных связей связывают аденин с тимином в молекуле ДНК? 1) 1 2) 2 3) 3 4) 4
85.Сигнальную, двигательную, транспортную и защитную функции в клетке выполняют
1) белки 2) углеводы 3) липиды 4) ДНК
86.Богатые энергией связи между остатками фосфорной кислоты имеются в молекуле
1) АТФ 2) ДНК 3) иРНК 4) белка
87.В процессе фотосинтеза энергия света идёт на синтез молекул 1) ДНК 2) белков 3) жиров 4) АТФ
88.А31.По принципу комплементарности происходит соединение
1) двух цепей в молекуле ДНК 2) аминокислот в молекуле белка 3) нуклеотидов в полинуклеотидной цепи 4) тРНК с определённой аминокислотой
89.Вода, играющая большую роль в поступлении веществ в клетку и удалении из нее отработанных продуктов, выполняет функцию
1) растворителя 2) строительную 3) каталитическую 4) защитную
90.Значительную часть содержимого клетки составляет вода, которая 1) образует веретено деления
2) образует глобулы белка 3) растворяет жиры 4) придает клетке упругость
91.Живые организмы нуждаются в азоте, так как он служит 1) главным составным компонентом белков и нуклеиновых кислот 2) основным источником энергии 3) главным структурным компонентом жиров и углеводов 4) основным переносчиком кислорода
92.Минеральные вещества в организме НЕ участвуют в 1) построении скелета
2) освобождении энергии за счет биологического окисления 3) регуляции сердечной деятельности
4) поддержании кислотно-щелочного равновесия
93.Вода участвует в теплорегуляции благодаря 1) полярности молекул 2) низкой теплоемкости
3) высокой теплоемкости 4) небольшим размерам молекул
94.Какое свойство воды делает её хорошим растворителем в биологических системах?
1) высокая теплопроводность 2) медленный нагрев и остывание 3) высокая теплоемкость
4) полярность молекул
95.Одним из элементов, обуславливающих активный ионный транспорт через клеточные мембраны, является 1) калий 2) фосфор 3) железо 4) азот
96. На каком рис. представлена схема строения вещества, которое доставляет аминокислоты к рибосоме?
1) 2) 3) 4)
Тесты с несколькими ответами.
97. Роль воды в клетке: 1) блокирует биохимические реакции 2) образует сольватные оболочки вокруг макромолекул 3) связывает кислород и двуокись углерода 4) регулирует тепловой режим
5) является универсальным растворителем.
98.Третичная структура белков обусловлена связями:1) водородными 2) ковалентными пептидными
3) гидрофобными взаимодействиями 4) электростатическими 5) дисульфидными.
99. Двигательную функцию выполняют белки: 1) гистоны и иммуноглобулины 2) тубулин и цитокератин
3) актин и миозин 4) альбумины и глобулины 5) гемоглобин и антитела.
100. Свойства белков-ферментов:1) специфичность 2) действие при определенном рН среды
3) высокая активность при 0 °С 4) высокая активность при 37 °С 5) отсутствие активных центров.
101.Гликоген — это: 1) моносахарид 2) дисахарид 3) полисахарид 4) запасное питательное вещество растительной клетки 5) запасное питательное вещество животной клетки.
102.Функции углеводов: 1) строительная 2) транспортная 3) каталитическая и регуляторная
4) энергетическая и запасающая 5) рецепторная.
103. Молекула жира состоит из остатков:
1) нуклеотидов 2) глицерола 3) аминокислот 4) жирных кислот 5) моносахаридов.
104.В состав нуклеотидов РНК входят: 1) пентоза дезоксирибоза 2) пентоза рибоза 3) остаток фосфорной кислоты 4) азотистые основания — цитозин и тимин 5) азотистые основания — гуанин и урацил.
105. Функции ДНК: 1) хранение генетической информации 2) доставка аминокислот в рибосому
3) передача генетической информации иРНК 4) передача генетической информации дочерним молекулам ДНК 5) непосредственная сборка белковых молекул.
106.Биологическая роль железа:1) входит в состав белков и полисахаридов 2) входит в состав гемоглобина и миоглобина 3) входит в состав витамина В12 4) входит в состав зубной эмали
5) входит в состав многих ферментов.
Тесты на соответствие.
107. Найдите соответствие между химическими элементами и их ролью в клетках и организмах:
A) входит в состав гормонов щитовидной железы 1) йод
Б) входит в состав многих белков 2) хлор
B) входит в состав всех органических соединений 3) сера
Г) входит в состав желудочного сока 4) углерод
108. Найдите соответствие между химическими элементами и их ролью в клетках и организмах:A) инициирует сокращение мышц 1) водород
Б) важнейший компонент гемоглобина 2) кальций
B) определяет рН среды 3) магний
Г) входит в состав хлорофилла 4) железо
109. Найдите соответствие между химическими элементами и их ролью в клетках и организмах:A) входит в состав хлорофилла и некоторых ферментов 1) кальций
Б) входит в состав белков и нуклеиновых кислот 2) магний
B) участвует в свертывании крови и сокращении мышечных волокон 3) азот
Г) участвует в кроветворении 4) кобальт
110. Найдите соответствие между строением молекул ДНК и РНК:A) состоит из одной цепи 1) ДНК
Б) состоит из двух цепей 2) РНК
B) в нуклеотиды входит дезоксирибоза
Г) молекула не способна к репликации
Д) в нуклеотиды входит рибоза.
111. Найдите соответствие между классами органических соединений, и выполняемыми ими функциями:A) каталитическая 1) липиды
Б) двигательная 2) углеводы
B) теплоизоляционная 3) белки
Г) хранение и передача наследственной информации 4) нуклеиновые кислоты.
Д) главный источник энергии
Работа сердца — урок. Биология, Человек (8 класс).
Работа сердца
Функция сердца заключается в перекачивании крови по кровеносным сосудам. Сердце сокращается ритмически. Стенки сердца образованы мышечной тканью, особенно хорошо развиты мышечные стенки желудочков. Сокращаясь, желудочки выталкивают кровь с большой силой в сосуды кругов кровообращения. Из левого желудочка кровь попадает в аорту, затем поступает в сосуды большого круга кровообращения и разносится по всему телу. Поэтому стенки левого желудочка более толстые по сравнению со стенками правого желудочка.
При каждом сокращении левого желудочка кровь с силой ударяется об упругие стенки аорты и растягивает их. Волна упругих колебаний, возникающая при этом, быстро распространяется по стенкам артерий. Такие ритмические колебания стенок сосудов называются пульсом. Каждый удар пульса соответствует одному сердечному сокращению. Путём подсчёта пульса можно определить количество сокращений сердца в \(1\) мин. Средняя частота сердечных сокращений (ЧСС) у человека в состоянии покоя составляет около \(75\) ударов в минуту.
Пульс можно прощупывать на поверхности тела в тех местах, где крупные сосуды лежат близко к поверхности тела: на висках, на внутренней стороне запястья, по бокам шеи.
Работа сердца по перекачиванию крови протекает циклически. Сокращение сердца называется систолой, а расслабление — диастолой.
Один сердечный цикл (последовательность процессов, происходящих за одно сокращение сердца (систола) и его последующее расслабление (диастола)) длится \(0,8\) с. (три фазы):
- \(0,1\) с. занимает сокращение (систола) предсердий (\(I\) фаза),
- \(0,3\) с. — сокращение (систола) желудочков (\(II\) фаза),
- \(0,4\) с. — общее расслабление (диастола) всего сердца — общая пауза (\(III\) фаза).
Во время систолы предсердий давление в них увеличиваются и кровь поступает через расслабленные створчатые клапаны в желудочки.
Далее следует сокращение желудочков. Створчатые клапаны закрываются и препятствуют обратному движению крови в предсердия. Поэтому кровь из желудочков поступает через открытые полулунные клапаны в сосуды кругов кровообращения. Из левого желудочка кровь поступает через аорту в большой круг кровообращения, а из правого — через лёгочную артерию в лёгочный (малый) круг кровообращения.
Затем желудочки расслабляются, полулунные клапаны закрываются и перекрывают ток крови обратно из сосудов в желудочки.
При сокращении предсердий и желудочков возникают шумы или тоны сердца.
Нарушение работы сердца приводит к изменению этих тонов. Врачи прослушивают сердце и по его тонам могут определить диагноз.
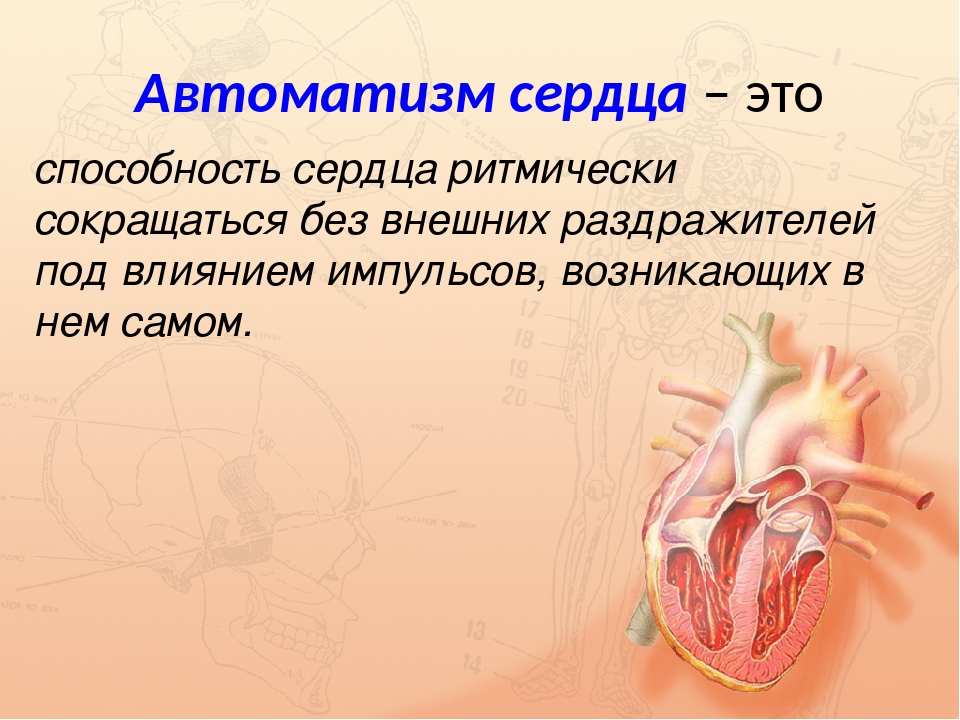
Автоматия сердца
Автоматия — это способность сердца сокращаться независимо от внешних условий под влияний импульсов, возникающих в нём самом.
Сердце сокращается под действием импульсов, которые возникают в узлах автоматии — в группах особых мышечных клеток. Главный узел автоматии расположен в правом предсердии. Именно здесь возникают импульсы, определяющие ритм сердечных сокращений.
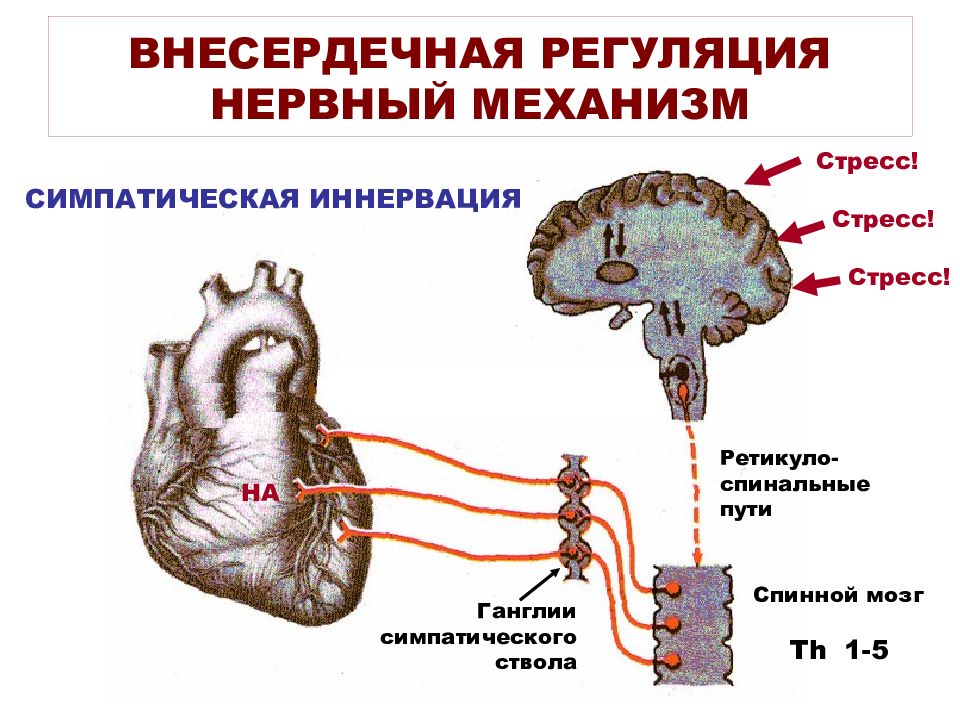
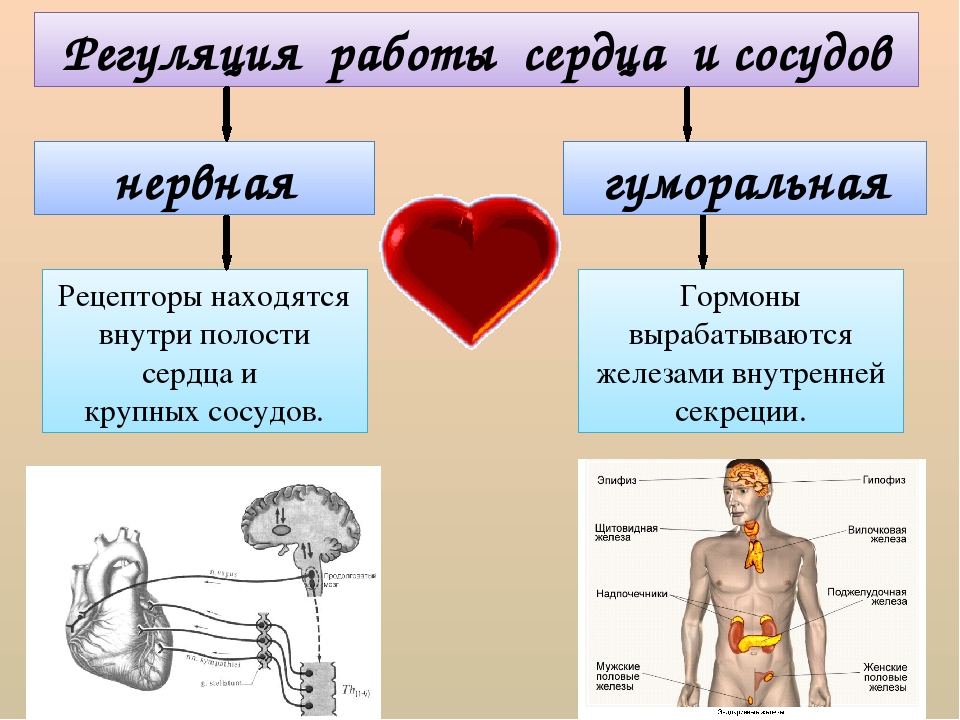
Регуляция работы сердечно-сосудистой системы
Существует два способа регуляции работа сердца и сосудов: нервный и гуморальный.
- В нервной регуляции главную роль играет автономная нервная система.
- Гуморальная регуляция осуществляется веществами, поступающими в кровь. Так, работа сердца ускоряется под действием гормона адреналин и избытка ионов кальция, а избыток ионов калия, наоборот, замедляет его работу.
Источники:
http://biolicey2vrn.ru/index/rabota_serdca/0-346
http://galactic.org.ua/clovo/f_c3.htm
Аспаркам при сердечной недостаточности, ишемии, инфаркте миокарда
Повышенная чувствительность к препарату, нарушение обмена аминокислот, артериальная гипотензия, острая и хроническая почечная недостаточность, гиперкалиемия, гипермагниемия, нарушение атриовентрикулярной проводимости (атриовентрикулярная блокада I-III степени), тяжелая миастения, гемолиз, недостаточность коры надпочечников, возраст до 18 лет (эффективность и безопасность не установлены).
Побочное действиеВозможны тошнота, рвота, диарея, неприятные ощущения или жжение в эпигастральной области (у больных анацидным гастритом или холециститом), гиперкалиемия (тошнота, рвота, диарея, парастезии), гипермагниемия (покраснение лица, чувство жажды, снижение артериального давления, гипорефлексия, мышечная слабость, парез, кома, арефлексия, угнетение дыхания, судороги).
С осторожностьюПри беременности и в период грудного вскармливания, лактации.
Передозировка
Симптомы: нарушение проводимости (особенно при предшествующей патологии проводящей системы сердца).
Лечение: внутривенное введение кальция хлорида; при необходимости – гемодиализ и перитонеальный диализ.
Совместное применение с калийсберегающими диуретиками (триамтерен, спиронолактон), бета-адреноблокаторами, циклоспорином, гепарином, ингибиторами ангиотензинпревращающего фермента, нестероидными противовоспалительными препаратами повышает риск развития гиперкалиемии вплоть до развития аритмии и асистолии. Применение препаратов калия совместно с глюкокортикостероидами устраняет гипокалиемию, вызываемую последними. За счёт содержания ионов калия уменьшаются нежелательные эффекты сердечных гликозидов. За счёт содержания ионов магния снижает эффект неомицина, полимиксина В, тетрациклина и стрептомицина.
*смотрите подробнее в инструкции по медицинскому применению лекарственного препарата ЛС-002168
Лечение в Германии и Швейцарии
Если сердце выходит из данного ритма, говорят о нарушениях сердечного ритма или аритмии. В зависимости от степени тяжести и вида нарушения ритма делятся на несколько групп. Если сердце бьется слишком медленно (ниже 60 ударов в мин.), это называется брадикардия. Слишком быстрое сердцебиение называется тахикардией (100 ударов в мин. в покое). Кроме того, существует дополнительные удары (аритмии) или блокирование проведения возбуждения в сердце.
Что такое аритмия?
Человеческое сердце бьется ритмично с частотой от 60 до 100 ударов в минуту. Сердцебиение возникает, в то время как клетки сердечной мышцы возбуждаются электрическим импульсом и это возбуждение передается каждой клетке сердца. Возбуждение начинается в небольшом участке правого предсердия, называемым синусовым узлом. Он генерирует свой собственный ритм и передает его по определенным путям к остальной части сердца. Эта частота может зависеть от различных параметров (например, состояния симпатической нервной системы, парасимпатической, возбуждения/напряжения/ физической активности и напротив расслабления/пищеварения).
Не все виды сердечных аритмий имеют патологическое значение. Например, эпизодичные экстрасистолы могут возникать и у здоровых людей.
Каковы причины нарушения сердечных ритмов?
Нарушения ритма сердца могут иметь различные причины. Большинство из них также являются и симптомами.
К причинам относятся прямые нарушения в сердце. Они могут быть врожденными, как некоторые виды пороков сердца, нарушения проводимости электрического импульса или дефекты ионных каналов. Также приобретенные повреждения сердечной мышцы вследствие воспаления сердца (миокардит), сердечного приступа или болезней клапанов сердца могут привести к нарушениям ритма сердца.
Кроме того, к аритмии могут привести нарушения за пределами сердца. Поскольку проводимость электрического импульса в сердце осуществляется за счет обмена ионами (например, калий и магний) между клеткой и ее внешней средой, электролитные нарушения, проблемы со щитовидной железой и лекарственные средства могут привести к сердечной аритмии.
Кроме того, стресс, недостаток кислорода или алкоголь могут привести к сбоям в работе сердца. Так, например, алкоголь у некоторых людей может вызвать фибрилляцию предсердий, которая также известна как синдром праздничного сердца, так как она возникает часто при чрезмерном употреблении алкоголя на отдыхе или в выходные дни.
Тем не менее, бывают случаи нарушений сердечного ритма, при которых даже после продолжительных поисков причину найти не удается.
Каковы симптомы данного заболевания?
В зависимости от вида аритмии появляются различные симптомы. Например, дополнительные сокращения сердца, как правило, приводят к перебою следующего удара, что иногда является явной экстрасистолией. Сердцебиение представляет собой нерегулярную или напряженную сердечную деятельность. Если сердце сокращается слишком быстро, неважно регулярно или нерегулярно, ощущается своего рода тревожное сердцебиение. Иногда человек может почувствовать его в шее.
Кроме того, могут возникать боли в сердце (стенокардия), при этом следует обратиться к терапевту или кардиологу в связи с риском сердечного приступа.
Поскольку нарушение сердечного ритма может в некоторых случаях привести к массовому снижению сердечной функции, существует риск слишком низкого мозгового кровотока. В таком случае начинаются головокружения, судороги, нарушения речи или зрения. В этом случае возбуждение сердечной мышцы нерегулярное, так что рациональное сокращение мышц и выброс крови больше не возможны. В данном случае аритмии также могут привести к обмороку (синкопа), недостаточности кровообращения и в худшем случае к смерти.
Кроме того, основное заболевание, например, сердечная недостаточность , может значительно ухудшиться из-за нарушений сердечного ритма. Это приводит к одышке даже в покое и накоплению жидкости в легких (отек легких), изменению уровня давления кругов кровообращения, которое сердце больше не в состоянии поддерживать.
Каковы диагностические методы?
Обычно симптомы приводят пациента к врачу общей практики или терапевту, который после сбора анамнеза (история болезни) и физического обследование (в том числе пульса и измерения артериального давления, прослушивания сердца и легких), выполняет ЭКГ (электрокардиография).
При проведении ЭКГ устанавливают до 12 электродов на тело пациента. Тогда можно исследовать ток в сердце, определить, есть ли нарушения, и даже обнаружить первые данные о причине аритмии.
Поскольку единичное измерение ЭКГ, как правило, не показывает всю картину заболевания (обычное ЭКГ), может понадобиться ЭКГ с нагрузкой (на велосипеде). Здесь можно видеть аритмии, которые не проявляются в покое. Кроме того, может быть проведен долгосрочный мониторинг ЭКГ. Пациенту, как правило, к телу прикрепляют электроды и небольшое измерительное устройство на 24 часа. После 24 часов результаты ЭКГ оценивает кардиолог .
Поскольку электролитный дисбаланс или нарушения работы щитовидной железы также могут привести к сердечной аритмии, делают анализ крови для проверки конкретных показателей.
Другой метод исследования – это эхокардиография. Это разновидность ультразвука, при которой может быть измерена как структура и движение стенок и клапанов сердца, так и кровоток в главной мышце человеческого организма. Эхокардиография может быть выполнена в покое и при движении (с нагрузкой). Кроме того, существует ультразвуковое исследование сердца через пищевод (чреспищеводная эхокардиография), которое помогает осмотреть сердце с различных сторон.
Далее существуют инвазивные электрофизиологические исследования. Это особый вид сердечной катетеризации. Данный метод дает возможность с помощью небольшой трубки, которая вводится через вену или артерию в сердце, исследовать электрические токи и место происхождения аритмий и, при необходимости, провести терапию с помощью импульсов тока (в зависимости от причины).
Как лечить аритмию?
Некоторые виды сердечных аритмий не представляют никакой угрозы и не требуют лечения. Тем не менее, существуют и другие виды, которые могут быть чрезвычайно опасны и даже смертельны. В связи с чем всем людям следует, по крайней мере, один раз проверить наличие аритмии у кардиолога или терапевта .
В любом случае всегда необходимо лечить основное заболевание. Это, как правило, заболевания щитовидной железы, отравления или нарушения электролитного баланса. Некоторые причины не поддаются консервативному лечению и требуют более инвазивной терапии (кардиохирургия), например замену клапанов или коронарное шунтирование при ишемической болезни сердца .
Иногда пациент (особенно в пожилом возрасте) может обойтись без хирургического вмешательства, пройдя медикаментозное лечение. Для этого существует ряд так называемых антиаритмиков. Это препараты, которые (в зависимости от способа действия) по-разному регулируют сердечные сокращения.
Если данные меры не помогают, следующим шагом является установка кардиостимулятора . В случае наличия риска внезапной смерти от сердечно-сосудистого заболевания (часто при ишемической болезни сердца ) может быть имплантирован дефибриллятор.
Каковы прогнозы и вероятность прогрессирования заболевания при сердечных аритмиях?
Многие виды нарушений сердечного ритма могут быть причиной летального исхода, поэтому должны восприниматься всерьез. Здесь лечение обязательно. Если после выявления причины следует целенаправленная терапия, у пациента имеются хорошие шансы вернуться к нормальной жизни.
Конечно, любая терапия включает в себя свои риски, как медикаментозная, так и хирургическая. Тем не менее, лечащий кардиолог или терапевт должен обсудить с пациентом все варианты и рассмотреть их преимущества и недостатки перед началом любой терапии. Если у пациента есть какие-либо вопросы, ему необходимо проконсультироваться с врачом. Чем лучше пациент осведомлен о своей проблеме, тем лучше он может справиться с ней.
Лечение дает возможность снова жить нормальной жизнью, без обмороков и потери сознания из-за нарушения ритма сердца, – при таких симптомах вождение транспортными средствами запрещено.
Если человек страдаете от сердечной аритмии или обнаруживает у себя соответствующие симптомы, ему необходимо связаться со специалистом.
Источники:
Герольд, Герд: Внутренняя медицина. Кельн, самиздат 2012.
Арашее, K .; Бэнклер, Х.-В. ; Бибер, C .; и др:. Внутренняя медицина. Штутгарт, Изд. Георг Тиме KG 2009.
Адреналин на сердечную мышцу — Справочник химика 21
Катехоламины обладают разносторонним физиологическим действием, например, адреналин усиливает работу сердечной мышцы, снижает кровяное давление, регулирует углеводный обмен. [c.15]Токсическое действие. Обладает наркозным действием, повышает чувствительность сердечной мышцы к адреналину. [c.80]
Токсическое действие. Общий характер. Относительно мало токсичен, но при соответствующих концентрациях поражает ЦНС (вплоть до развития наркоза), сердечную мышцу, вызывая нарушения метаболизма и резко повышая ее чувствительность к адреналину. Интоксикация обусловлена развитием гипоксии вследствие угнетения тканевого дыхания 5 % концентрация Б. оказывает действие, сходное с действием СОа в концентрации 40—50 %. [c.625]
Адреналин быстро разрушается в желудочно-кишечном тракте и поэтому вводится обычно подкожно или внутримышечно, а в экстренных случаях — внутривенно или прямо в сердечную мышцу, так как сердечно-сосудистый эффект адреналина обусловлен главным образом непосредственным воздействием на миокард. [c.191]
Свежий воздух. Искусственное дыхание. Кислород с 5% двуокиси углерода. Внутривенно — 2 л физиологического раствора, нагретого до 41°. Согревание. Кофеин, камфора. Адреналин —в сердечную мышцу. Массаж сердца [c.209]
Настоящая работа была начата с целью выяснить, имеют ли место нарушения анаэробного обмена углеводов в сердечной мышце в условиях экспериментального миокардита кроликов, вызывавшегося однократными инъекциями адреналина и теофиллина [1] . [c.118]
Весьма вероятно, что реакции фосфорилирования— дефосфорилирования играют роль в регуляции таких процессов, как мышечное сокращение, секреция, транспорт веществ через мембраны, передача нервных импульсов и сенсорное восприятие, рост и дифференци-ровка, индукция синтеза белков и их деградация. Исследования соответствующих регуляторных механизмов осложняются отсутствием достаточно полных данных о молекулярной природе самих процессов. Однако важная роль сАМР-ПК была показана в ряде случаев, например при регуляции адреналином сокращений сердечной мышцы. [c.93]
Иммобилизованные на Сефарозе катехоламины (например, адреналин) при наличии соответствующей вставки могут специфически взаимодействовать с солюбилизированным белком р-адренорецептора сердечной мышцы, что было показано методом афинной хроматографии. Следовательно, иммобилизованные катехоламины сохраняют возможность принять конфигурацию, необходимую для взаимодействия с рецептором. Реализация этой возможности зависит от типа функциональных групп катехоламинов, использованных для присоединения к полимеру, [c.80]
Справедливость приведенной схемы была доказана экспериментально не только для скелетной мускулатуры, но и для других тканей. Стимуляция гликолиза адреналином в сердечной мышце также связана с активацией КФ [37, 38]. Добавление адреналина [c.60]
Влияние адреналина на работоспособность связано не только с мобилизацией гликогена. Адреналин стимулирует также мобилизацию жиров. Кроме того, адреналин увеличивает частоту и силу сокращений сердечной мышцы, а значит, и скорость кровотока. В результате увеличивается доставка в мышцы кислорода, а также глюкозы и других веществ, служащих источниками энергии. [c.273]
Из всех гормонов наиболее полно изучен адреналин. Его хорошо известный механизм действия используется в качестве модели при исследовании других гормонов. Органы-мишени адреналина-печень и скелетные мышцы, а также сердце и сердечно-сосудистая система. [c.787]
Адреналин усиливает выброс глюкозы в кровь из печени, в мышцах — специфический путь распада глюкозы. При этом потребление кислорода растет примерно на 30%. В результате мобилизации жира в крови повышаются уровни холестерина и фосфолипидов. Адреналин действует на сердечно-сосудистую систему, повышая силу и частоту сердечных сокращений, артериальное давление, расширяя мелкие артериолы, а также вызывает расслабление гладких мышц кишечника, бронхов, матки. [c.394]
Мозговое вещество надпочечников Адреналин (эпинефрин) Увеличение силы и частоты сердечных сокращений сужение капилляров кожи и пищеварительного тракта. Расщирение артериол сердца и скелетных мышц, повышение уровня глюкозы в крови Симпатическая нервная система [c.335]
Биологическое действие в организме отдельных классов допингов разнообразно. Так, психостимуляторы повышают спортивную деятельность путем активации деятельности ЦНС, сердечно-сосудистой и дыхательной систем, что улучшает энергетику и сократительную активность скелетных мышц, а также снимают усталость, придают уверенность в своих силах, однако могут привести к предельному напряжению функций этих систем и исчерпанию энергетических ресурсов. Наркотические вещества подавляют болевую чувствительность, так как являются сильными анальгетиками, и отдаляют чувство утомления. Анаболические стероиды усиливают процессы синтеза белка и уменьшают их распад, поэтому стимулируют рост мышц, количества эритроцитов, способствуя ускорению адаптации организма к мышечной деятельности и процессов восстановления, улучшению композиционного состава тела. Бета-блокаторы противодействуют эффектам адреналина и норадреналина, что как бы успокаивает спортсмена, повышает адаптацию к физическим нагрузкам на выносливость. Диуретики, или мочегонные средства усиливают выведение из организма солей, воды и некоторых химических веществ, что способствует снижению массы тела, выведению запрещенных препаратов. [c.482]
Как и инсулин, глюкагон образуется в поджелудочной железе, но уже в А-клетках островков Лангерганса. Глюкагон, как и адреналин, является антагонистом инсулина и стимулирует гликогенолиз, повышая содержание сахара в крови. Кроме того, он обладает липолитическими свойствами. Действие протекает через аденилатцнклазную систему. Глюкагон также увеличивает сокращение сердечной мышцы и повышает частоту ударов сердца. [c.270]
Субстратами протеинкиназ являются разнообразные белки, фосфорилирование которых изменяет их активность. Например, активация протеинкиназы А со стороны цАМФ приводит к фосфорилированию гликогенсинтазы и гликогенфосфорилазы. При этом активность первого фермента подавляется, а второго усиливается (см. главу 10). Таким образом, появление в кровяном русле адреналина, активирующего аденилатциклазу миоци-тов, улучшает энергетическое обеспечение сокращений сердечной мышцы. [c.318]
Классификация медиаторов как стимуляторных или ингибиторных нецелесообразна, так как их функция зависит от конкретного синапса и постсинаптического рецептора. Ацетилхолин, например, является стимулирующим медиатором в нейромышечной концевой пластинке, и в то же время проявляет ингибирующее действие в синапсе между блуждающим нервом и волокном сердечной мышцы. Мы уже упоминали о различии между никотиновыми и мускариновыми ацетилхолиновыми рецепторами. Однако на примере Aplysia было показано, что функция медиатора может оказаться еще более сложной. У этого организма имеется по крайней мере три типа холинэргических синапсов, или ацетилхолиновых рецепторов два ингибиторных и один возбуждающий. Ингибиторные синапсы различаются по ионной специфичности на одной постсинаптической мембране ацетилхолин увеличивает проницаемость для ионов калия, а на другой — для ионов хлора, в обоих случаях вызывая гиперполяризацию мембраны. На возбуждающем синапсе ацетилхолин вызывает деполяризацию, открывая натриевые каналы. Аналогичная двойная функция описана для медиаторов допамина и серотонина. Поэтому можно сказать только то, что ацетилхолин и глутамат, как правило, являются стимулирующими медиаторами, а глицин, 7-аминомасляная кислота и нор-адреналин — ингибиторными. [c.214]
Р. Изопреналин активнее адреналина, примерно равного нор-адреналину Жировая ткань (мобилизация жирных кнслот), стимуляция сердечной мышцы Дифференциация на подтипы связана с узнаванием лигандов и 1, и Рг стимулируют аденилатциклазу [c.270]
Повышенное артериальное давление становится раздражителем рецепторов аортальной, а также каротидной зон, что приводит к возбуждению ядер блуждающих нервов и вагусному торможению сердечно-сосудистой деятельности (бра-дикардия). Характер реакции на адреналин во многом зависит от предцгествующего состояния сердечно-сосудистой системы и видовых особенностей организма тем более, что он повышает потребность сердечной мышцы в кислороде. [c.174]
Острое отравление. Наркоз, вызванный веществом, наступает без стадии возбуждения. Вызывает повышение артериального давления, вызывает замедление пульса и аритмрпо, повышает чувствительтность сердечной мышцы к адреналину. [c.541]
Токсическое действие. Действует сходно с ДДТ, но гора5до слабее. Поражает центральную и вегетативную нервные системы. Не вызывает судорог. Накапливается в жирах, но в меньших количествах. Вызывает угнетение коры надпочечников и угнетает ее функции. Увеличивает секрецию адреналина, что повышает чувствительность сердечной мышцы к действию вещества. [c.578]
Вегетативная нервная система иннервирует гладкие мышцы, сердечную мышцу и железы. Она, следовательно, управляет функциями, в которые не вторгается сознание. Вегетативная нервная система имеет два отдела — симпатический и парасимпатический, со взаимно дополняющими или антагонистическими функциями. Так, возбуждение парасимпатической системы заставляет зрачки сокращаться, сердце — биться медленнее и т. д. Си.мпатическая система вызывает обратный эффект. На концах парасимпатических нервных волокон выделяется АХ, тогда как на концах симпатических волокон выделяется адреналин (АД) или норадреналин (см. рис, 3). Поскольку нервный газ обладает антихолинэстеразным действием, он возбуждает парасимпатическую систему, ПОЭТО1МУ его относят к парасимпатическим агентам. Когда усиление парасимпатической активности достаточно велико, животное умирает. Действие ацетилхолина на окончания постганглионарного парасимпатического волокна напоминает действие мускарина (М, см. рис. 3). [c.536]
Для ее работы характерно постоянное ритмическое чередование процессов сокращения и расслабления. Хотя при некоторых обстоятельствах сердце должно работать сильнее и быстрее, чем обычно, например при повышении потребности организма в кислороде или при стимуляции адреналином (гл. 25), все же диапазон, в котором может меняться количество совершаемой сердцем работы, не так широк, как в случае скелетньк мышц. Кроме того, сердцу свойствен постоянно идущий полностью аэробный обмен, тогда как скелетные мышцы в течение короткого времени могут функционировать за счет анаэробных процессов. В сердечной мышце по сравнению со скелетной намного больше митохондрий они занимают почти половину объема клетки (рис. 24-13). В качестве топлива сердце использует смесь глюкозы, свободных жирных кислот и кетоновых тел. [c.758]
Токсическое действие. По общему характеру действия сходны с алканами, но наркозный эффект у Ц. более выражен, чем у соответствующих алканов. Многие Ц. вызывают тетанические судороги, которые могут привести к смерти в результате остановки дыхания и падения кровяного давления. При высоких концентрациях у животных оглушение, боковое положение, исчезновение рефлексов, смерть при постепенном замедлении дыхания. Ряд Ц. повышают чувствительность сердечной мышцы к адреналину. Биохимические сдвиги в крови во время наркоза незначительны. Даже после повторной наркотизации животных Ц. гистологическая картина в тканях мало изменяется (умеренное полнокровие легких). Начиная с циклопентана, вызывают воспалительную реакцию кожных покровов эта реакция нарастает с увеличением числа углеродных атомов в кольце Ц. j -> С12 (Brown, Box). [c.77]
Токсическое действие. Обладает наркозным действием, повышает чувствительность сердечной мышцы к адреналину. Минимальная концентрация Ц., вызывающая у мышей боковое положение, наркоз и смерть, составляет 110 ООО мг/м [соответствующая концентрация метилциклопентана 95 ООО— 120 ООО мг/м (характерны тетанические судороги) этилциклопентана 45 ООО мг/м (перед смертью судороги) ]. Как циклогексан (см.) и метилциклогексан (см.) и в отличие от гексана, Ц. не приводит к поражению периферических нервных волокон (Egan et al.) или оказывает на них умеренное действие (Опо et al.). Гомологи Ц. в дозах 50, 100 и 150 мг/кг увеличивают проницаемость эритроцитов у крыс по отношению к 0,1 % раствору флуоресцеина или к 0,5 % раствору мочевины (Омаров). [c.81]
Считают, что реакция сердечной мышцы на действие адреналина происходит с помощью р-рецепторов, так как только последние два лекарства, но не феноксибензамин, угнетают это действие адреналина. Сложность состоит в том, что некоторые ткани, например ткани кишечника кролика, нуждаются в предварительной обработке веществами, блокирующими как а-, так и Р-рецепторы до того, как влияние адреналина может быть угнетено следовательно, предполагают, что эти ткани содержат как а-, так и р-рецепторы. Считается, что изопропилнорадреналин специфически действует на Р-рецепторы, вызывающие торможение. [c.362]
Эта интерпретация подтверждается тем фактом, что потеря глюкозы или введение метаболических ядов приводят к тому, что мембранный потенциал становится нестабильным и, таким образом, действие адреналина снимается. В этих условиях адреналин оказывает прямое деполяризующее действие, вызывающее сокращение мышцы. Бьюдинг [55] показал, что адреналин расслаблял гладкую мышцу морских свинок (taenia oli) еще до того, как наблюдалась активация фосфорилазы. Возможно, стимуляция метаболизма может облегчать сокращения, вызванные адреналином. Вероятно, лучше всего рассматривать -рецепторы как структуры, непосредственно контролирующие расслабление мышц (или сокращение сердечной мышцы). Имеющиеся данные [c.365]
Обобщая, можно считать, что адреналин, по-видимому, непосредственно стимулирует сокращение сердечной мышцы, а также одновременно стимулирует циклазную систему, удовлетворяя дополнительную потребность в АТФ для мышечной деятельности. Термин рецептор употребляется здесь для обозначения места действия адреналина при активации фосфорилазы. Однако для бесклеточных систем термин рецептор энзимологами обычно не применяется. [c.366]
Первая помощь при остром отравлении, как при отравлении бензином. Так как при отравлении Б. наблюдается сенсибилизация сердечной мышцы к адреналину (инъекция его часто вызывает трепетание сердца), применение последнего категорически противопоказано (Дотребанд). При хроническом отравлении лечение, после освобождения от работы с Б., состоит в усиленном питании пищей, богатой витаминами (особенно витамином С), приеме препаратов печени, железа стимуляторов лейкопоэза (нуклеиновокислый натрий, аденин, метацил). При очень тяжелых анемиях — немедленное переливание крови (не менее 300— 500 мл), в случае надобности — повторное. При лечении случая бензольной анемии с лихорадкой указывается на успешное применение сульфаниламидных препаратов. Предлагается также лечение хронических отравлений тиосульфатом натрия, метионином, пенициллином (Дювуар и др.). В особенно угрожающих случаях, при недостаточно быстрой эффективности антианемического лечения, с успехом применялась экстирпация селезенки. [c.93]
Фармакология Сложные эфиры вератровых алкалоидов замедляют дыхание, и летальный эффект больших доз в значительной степени вызывается этим действием. Де11ствие, оказываемое на изолированную сердечную мышцу, сходно с действием сердечных глюкозидов. Алкалоиды влияют также на кровообращение при малых дозах это частично связано с рефлекторным расширением сосудов, при больших дозах до некоторой степени обусловлено способностью этих соединений вызывать выделение адреналина. Они вызывают также сокращение скелетных мышц. Одно время эти алкалоиды применялись как ослабляющие сердечную деятельность, но в настоящее время мало используются в клинической практике. Сравнительные средние летальные дозы некоторых алкалоидов приведены в таблице 55. [c.582]
Адреналин. Поступая в кровь, гормон в очень малых количествах (0,0001—0,00001 мг на кг веса) вызывает сильную реакцию организма усиливается сердечная деятельность, резко сокращаются периферические кровеносные сосуды, повышается кровяное давление, расширяются сосуды сердечной мышцы. Однако действие адреналина на сосуды кратковременно, так как он быстро теряет активность под влиянием фермента аминоксидазы, содержащегося в крови. [c.62]
Поскольку адреналин обладает способностью повышать содержание сахара в крови, этот гормон часто впрыскивают больным с целью нейтрализации инсулинового шока. Его часто используют в виде смеси с ане-стезируюш,им агентом местного действия такую смесь инъецируют вокруг оперируемого места с целью вызвать сужение мелких кровеносных сосудов и тем самым уменьшить потерю крови. Вызывая временное повышение кровяного давления, адреналин служит также хорошим средством против шока. Иногда его вводят непосредственно в сердечную мышцу в тех случаях, когда при хирургической анестезии прекращает-ся деятельность сердца. Таким же способом можно заставить биться сердце новорожденного ребенка. Адреналин часто применяют в малых дозах, чтобы снять спазм при бронхиальной астме путем расслабления мышц бронхов. [c.355]
Адреналин, как известно, увеличивает силу и частоту сердечных сокращений, а также скорость расслабления. Эти эффекты связаны с изменением концентрации Са + в цитозоле и фосфорилированием, осуществляемым сАМР-ПК [62, 63]. Фосфорилирование TN-I в мышце сердца снижает сродство TN- к ионам Са +, фосфорилирование фосфоламбана в саркоплаз-матическом ретикулуме сердечной мышцы увеличивает скорость поглощения Са + пузырьками ретикулума, а фосфорилирование Са +-АТРазы в плазматической мембране приводит к увеличению выхода кальция из цитозоля во внеклеточное пространство. Эти три реакции, по-видимому, лежат в основе увеличения скорости расслабления сердечной мышцы под влиянием адреналина. [c.93]
Из иммобилизованных катехоламинов первоначально были описаны водонерастворимые соединения [1]. Оказалось, что /.-адреналин либо изопротеренол, связанные азо-связью с поверхностью стеклянных шариков диаметром 20—300 мкм (4.1 и 4.2), при контакте с сердечной мышцей в эксперименте сохраняют физиологическую активность, например учащают ее сокращения и повышают уровень ц-АМФ в глиальных клетках. Антагонист р-адренорецепторов пропранолол, широко применяемый в медицине, будучи иммобилизован на стеклянных шариках (4.3) замедляет сокращения сердечной мышцы. Действие иммобилизованных ФАВ длится дольше, чем действие тех же ФАВ в растворе. Одновременно было показано, что адреналин и пропранолол оказывают действие именно в связанном состоянии, а не в результате перехода в раствор после отщепления от носителя. [c.80]
Нерастворимые полимерные производные катехоламинов (в первую очередь на стеклянных щариках) могут быть применены для создания нового типа лекарств аппликационного действия [I]. В эксперименте на препарате сердечной мышцы стеклянная палочка, имеющая на поверхности химически связанные катехоламины или пропранолол, соответственно ускоряла или замедляла частоту сокращений сердца. Тесный контакт между иммобилизованными катехоламинами и живой тканью необходим для проявления их действия [6, 7], что позволяет сделать эффект мгновенно обратимым, а при желании достаточно длительным. Было строго доказано, что высвобождение катехоламинов (изопротеренола и адреналина) с поверхности стеклянных шариков, с которыми они связаны азо-связью, происходит с ничтожной скоростью (0,008 7о/ч при 37 °С и 10 %/ч при хранении при 4 °С) [4]. Следовательно, не только макромолекулы (иммобилизованные ферменты), но и низкомолекулярные соединения способны сохранять свою физиологическую активность, будучи прочно связанными с нерастворимым носителем. Одновременно могут возникать совершенно новые фармакологические эффекты, обусловленные доступностью только части рецепторов. Эти эффекты нельзя объяснить исключительно свойствами иммобилизованных ФАВ, и в определенном смысле прививочные ФАП, действующие по негилролитическому механизму, т. е. в полимерном состоянии, напоминают ФАП с собственной активностью. [c.81]
Особую роль в организме играет циклический аденозин-3, 5 -монофосфат (цАМФ, 303), который образуется ферментативно внутри клетки из АТФ после воздействия соответствующего гормона на клеточные рецепторы (см разд. 2 5 1). Например, повышение содержания гормона адреналина (первичного сигнала) в крови приводит к синтезу внутриклеточного цАМФ (вторичного сигнала, регулятора и усилителя гормонального сигнала), который вызывает ингибирование синтеза запасного топлива — гликогена и готовит клетку к выработке энергии Так, скелетные мышцы, печень и другие ткаии в условиях стресса мобилизуются адреналином и цАМФ к массированной переработке энергетических резервов для синтеза высокоэнергетических молекул АТФ. Полагают, что алкалоиды чая и кофе (см разд. 5.4.9) связывают фермент, который гидролизует цАМФ после передачи сигнапа. Это обстоятельство приводит к увеличению концентрации цАМФ в клетке и активированию ею фосфорилазы, стимулирующей сердечную деятельность и глико-генолиз в печени, т.е. к появлению тонизирующего эффекта [c.167]
Адреналин может играть роль как возбуждающего, так и тормозного медиатора (табл. 8.3), но это двойное действие не имеет ничего общего с подразделением на а- и р-рецепторы. Так, адреналин, вызывая сокращение мышечных волокон сердца, ускоряет частоту сердечных сокращений. Участвующий в этом процессе рецептор был идентифицирован как Ргрецептор. Однако адреналин действует и на рг-рецепторы радужной оболочки глаза, гладких мышц бронхов и сосудов крови, приводя к их-расслаблению. В общем случае а-рецепторы участвуют в сокращении гладких мышц, исключение составляют гладкие мышцы пищеварительного тракта, где эффект заключается в их расслаблении. [c.221]
Острое отравление. Животные. Для всех видов высших животных симптомы одни и те же первоначальное учащение дыхания, переходящее в затруднение и остановку его, паралич, боковое положение, судороги, кратковременное возобновление дыхательных движений, вторичная остановка дыхания, смерть. У кошек, собак и обезьян обычно наблюдается рвота. Сердце останавливается на 5—10 мин позже, чем дыхание. Вследствие блокады цитохромоксидазы миокарда наступает острая сердечная недостаточность. Повышается тонус парасимпатической нервной системы при одновременном повышении чувствительности мышцы сердца к влияниям блуждающего нерва резко падает общий тонус симпатической нервной системы. Прогрессивно увеличивается уровень глютатиона крови, возрастает секреция гипертепзивных гормонов и адреналина. Если животное не погибает от острого отравления, отмечаются симптомы поражения ЦНС. При вскрытии кроликов, кошек, собак, погибших в первые минуты, нет никаких изменений, кроме светлой окраски жидкой крови, розовой окраски органов и запаха горького миндаля. В случае смерти через 5—15 мин отмечается, кррме этого, полнокровие. и отек слизистой трахеи, пенистая, иногда кровянистая жидкость в полости трахеи, нередко кровоизлияния под плеврой, реже в самих легких, под эндокардом и перикардом. В мозгу животных, переживших острое отравление, наблюдались общее диффузное поражение нервных клеток и симметричные некрозы в коре головного мозга. [c.333]
Калий
Описание
Калий – внутриклеточный элемент, регулирующий кислотно-щелочное равновесие крови. Считают, что калий обладает защитными свойствами против нежелательного действия избытка натрия и нормализует давление крови. Элемент играет важную роль во внутриклеточном обмене, в регуляции водно-солевого обмена, осмотического давления, кислотно-щелочного состояния организма. Он необходим для нормальной деятельности мышц, в частности сердца, участвуя в проведении нервных импульсов к мышцам. Одним из важнейших свойств является выведение из организма воды и натрия. Он также активирует ряд ферментов и участвует в важнейших обменных реакциях. Калий активирует такие ферменты, как ацетилтрансфераза, гексокиназа, аминоацилтрансфераза. В ферментативных системах, где калий выступает как активатор, натрий является ингибитором.
Источники
Наиболее богаты калием белокочанная капуста, фасоль, клубни картофеля, редька, редис, лук, морковь, свекла, сельдерей, зелень укропа и петрушки, плоды томатов и черной смородины, листья одуванчика лекарственного, корни солодки голой.
Свойства и применение
Ионы калия играют существенную роль в регулировании функций организма. Сердечная мышца реагирует на повышение содержания калия уменьшением возбудимости и проводимости. Большие дозы угнетают автоматизм и сократительную способность миокарда. Снижение содержания калия в сыворотке крове повышает опасность развития аритмий, рост концентрации калия уменьшает опасность токсического действия сердечных гликозидов в отношении влияния на ритм сердца, калий в то же время не противодействует их положительному инотропному действию.
Калий участвует в процессе проведения нервных импульсов и передачи их на иннервируемые органы. Его введение в организм сопровождается повышением содержания ацетилхолина и возбуждением симпатического отдела нервной системы. Он необходим также для сокращения скелетных мышц, улучшает сокращение мышц при мышечной дистрофии, миастении, участвует в процессах, обеспечивающих проведение нервных импульсов, коррегирует щелочной баланс крови и тканевых жидкостей, участвует в реакциях обмена веществ, например, в превращении глюкозы в гликоген, принимает участие в регуляции ритма сердца, регулирует концентрацию желудочного сока.
Увеличение концентрации калия в организме влечет за собой уменьшение концентрации натрия и усиление выведения последнего из организма. Богатая калием пища, вызывая повышенное выделение натрия из организма, приводит к увеличению потребности в натрии. В то же время потребление большого количества натрия приводит к потере организмом калия. Таким образом, в обмене натрия и калия отмечается некоторый физиологический антагонизим. При преимущественном потреблении продуктов животного происхождения человек получает с пищей почти сбалансированное количество ионов натрия и калия. При высоком содержании в пище растительных продуктов в ней преобладают ионы калия.
Соединения калия оказывают влияние на коллоидное состояние тканей. Путем снижения гидратации тканевых белков они способствуют выведению жидкости из организма. Повышение экскреции калия сопровождается усилением удаления из организма воды. Избыточное количество калия быстро выводится почками одновременно с водой. Диеты с высоким содержанием калия служат эффективным средством при необходимости повысить диурез и усилить выведение натрия.
Входит в состав следующих препаратов:
Адренергическая регуляция ионных каналов сердца: роль микродоменов мембран в регуляции каналов kv4
Основные моменты
- •
Норадреналин регулирует ионные токи, участвующие в реполяризации сердца.
- •
α1- и β-AR регулируют экспрессию и функцию сердечных ионных каналов.
- •
В одном сердечном миоците существуют две разные популяции каналов Kv4.
- •
Только каналы, расположенные в кавеолах, регулируются α1-адренорецепторами.
- •
Они позволяют более высокое значение Ca 2 + при меньшем риске сердечных аритмий.
Реферат
Сердце должно постоянно адаптировать свою деятельность к потребностям организма. В любой потенциально опасной или физически сложной ситуации активированная симпатическая нервная система вызывает очень быструю сердечную реакцию. В этих условиях α1-адренорецепторы активируют внутриклеточные сигнальные пути, которые в конечном итоге фосфорилируют субпопуляцию Kv4 каналов, локализованную в кавеолах, и уменьшают временную амплитуду выходящего наружу тока K + (I –).Это снижение изменяет форму сердечного потенциала действия и заставляет фазу плато начинаться при более высоких напряжениях. Это означает, что в миоцит поступает больше ионов кальция, и в результате увеличивается сила сокращения. Однако чрезмерное снижение I до может опасно продлить продолжительность потенциала действия и вызвать аритмию при высокой частоте сердечных сокращений. Это чрезмерное снижение тока не происходит, потому что существует вторая популяция каналов I –, расположенных в некавеолярных мембранных рафтах, которые недоступны для опосредованной α1-AR регуляции.Таким образом, расположение компонентов данного сигнального пути трансдукции в мембранных доменах определяет правильное и безопасное поведение сердца. Эта статья является частью специального выпуска, озаглавленного: Взаимные влияния клеточного цитоскелета и мембранных каналов, рецепторов и переносчиков. Эта статья является частью специального выпуска, озаглавленного: Взаимные влияния клеточного цитоскелета и мембранных каналов, рецепторов и переносчиков. Приглашенный редактор: Жан Клод Эрве.
Ключевые слова
Raft
K + канал
Сердце
Аритмия
Отсек
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотациюCopyright © 2013 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Ионные каналы гарантируют, что сердце держит время — ScienceDaily
Электрические сигналы регулируют ритмические сокращения сердечной мышцы и, таким образом, контролируют сердцебиение. Если сигналы будут неверными, последствия могут быть смертельными. Исследователи LMU определили, как определенные ионные каналы в мембранах кардиомиоцитов обеспечивают своевременное и своевременное сердцебиение.
Сердцебиение является результатом ритмических сокращений сердечной мышцы, которые, в свою очередь, регулируются электрическими сигналами, называемыми потенциалами действия.Потенциалы действия возникают в результате контролируемого потока ионов в клетки сердечной мышцы (деполяризации) через каналы в их мембранах, за которыми следует компенсирующий обратный ионный ток (реполяризация), который восстанавливает исходное состояние. Если продолжительность фазы реполяризации не подходит, риск желудочковой аритмии и внезапной сердечной смерти значительно возрастает.
Исследовательские группы под руководством профессоров Мартина Биля и Кристиана Валь-Шотта из фармацевтического факультета LMU в Мюнхене описали новую функцию так называемых каналов HCN в сердце.Известно четыре подтипа каналов HCN, которые необходимы для фазы реполяризации. Ионный ток, который проходит через эти каналы, часто называют током кардиостимулятора, потому что он играет важную роль в контроле сердцебиения.
«В течение долгого времени было известно, что члены этого семейства ионных каналов присутствуют в клетках водителя ритма в синоатриальном узле сердца. Эти клетки проявляют спонтанную электрическую активность, и было известно, что их каналы HCN вносят вклад в увеличение частоты сердечных сокращений при определенных условиях », — говорит Валь-Шотт.«Однако роль каналов HCN в нормальной сократительной функции сердечной мышцы остается неясной».
Используя новую модель на животных, в которой отсутствует один из подтипов белков канала HCN (HCN3), исследователи наблюдали значительное сокращение продолжительности фазы реполяризации, которая следует за потенциалом действия в той части миокарда, которая подвергается активному действию. схватки.
«Наши результаты показывают, что каналы HCN важны для нормальной реполяризации», — говорит Биль.«И это совершенно новая физиологическая концепция, которая подчеркивает биомедицинское значение этих каналов — и, возможно, может быть использована терапевтически».
История Источник:
Материалы предоставлены Ludwig-Maximilians-Universitaet Muenchen (LMU) . Примечание. Содержимое можно редактировать по стилю и длине.
Изучение ионов в помощь сердцу
Архив
10 ноября 2005 г.
У пациента случился сердечный приступ, и его срочно доставили в больницу для лечения.Его вылечили и отпустили, вроде бы нормально.
Но затем, два дня спустя, случается второе сердечное событие, и мужчина находится в гораздо худшей форме, чем раньше. Лечащие врачи обнаружили, что у него сердечная аритмия или нерегулярное сердцебиение.
Такой сценарий иногда случается с сердечными пациентами — через один-два дня после инфаркта миокарда или сердечного приступа у пациента может возникнуть серьезная аритмия, которая может остановить его сердце.
Секрет нерегулярного сердцебиения кроется в ионных каналах калия и кальция, которые управляют электрическими импульсами, которые приводят в движение сердечную мышцу.Д-р Луис Фернандо Сантана, доцент физиологии и биофизики в UW, изучает эти ионные каналы.
Сантана и другие исследователи теперь знают, что аритмия после сердечного приступа возникает из-за того, что электрическая импульсная система сердца резко вышла из синхронизации. В нормальном сердце существует баланс между уровнями ионов кальция и калия как на внешней, так и на внутренней стенках сердца. Этот баланс поддерживает правильное прохождение электрической энергии через сердце и позволяет сердечной мышце расширяться и сокращаться при биении сердца.
Но после сердечного приступа уровень ионов кальция в сердце может резко возрасти, что существенно изменит баланс уровней ионов. Это сбивает сердечный ритм с катастрофическими последствиями — пациенты с тяжелой сердечной аритмией вскоре после сердечного приступа могут умереть без предупреждения.
Более внимательно изучив эти ионные каналы в сердце, Сантана и его коллеги определили, почему уровни ионов выходят из равновесия после сердечного приступа — клеточный сигнальный путь, известный как путь транскрипции кальциневрин / NFAT.После сердечного приступа этот сигнальный путь активируется почти в пять раз чаще, чем обычно. Это приводит к снижению экспрессии и функции каналов ионов калия, что косвенно нарушает баланс внутриклеточных уровней ионов кальция, нарушая ритм сердца.
К счастью, бета-блокаторы, которые часто назначают после сердечного приступа, могут подавить этот путь, предотвращая потенциально смертельную сердечную аритмию.
По мере того как Сантана продолжал изучать путь транскрипции кальциневрин / NFAT, он обнаружил, что тот же самый путь играет роль в контроле действия сосудистых клеток, которые обнаруживаются в артериях и венах.Подобный дисбаланс уровня ионов кальция в этих клетках может привести к постоянному сужению стенок сосудов с течением времени, например, к постоянному повышению артериального давления.
Фактически, Сантана надеется показать, что транскрипционный путь кальциневрин / NFAT представляет собой управляемый кальцием сигнальный путь, который может участвовать в модуляции других процессов в организме, которые включают электрические импульсы.
«Мы думаем, что это может быть моделью для тонкой настройки возбуждения в клетках по всему телу, включая нейроны», — сказал Сантана.«Поскольку этот путь является самоподдерживающимся — увеличение кальция приводит к изменениям функции калия, что, в свою очередь, еще больше увеличивает кальций — он может, например, быть частью фундаментального процесса построения памяти на клеточном уровне».
Сантана обсудит свою работу по ионным каналам на лекции New Investigator Science in Medicine с полудня до 13:00. в четверг, 17 ноября, в комнате T-625 здания медицинских наук UW.
Получив степень бакалавра морской биологии в Университете Пуэрто-Рико, Сантана поступил в Мэрилендский университет, где в 1996 году защитил докторскую диссертацию по физиологии.
Он присоединился к кафедре физиологии и биофизики Университета штата Вашингтон в 2001 году после работы над докторской диссертацией в Университете Мэриленда и Университете Вермонта.
Кардиологическая физиология | Анатомия и физиология II
Цели обучения
К концу этого раздела вы сможете:
- Связать частоту сердечных сокращений с сердечным выбросом
- Опишите влияние упражнений на частоту сердечных сокращений
- Определите сердечно-сосудистые центры и сердечные рефлексы, регулирующие работу сердца
- Опишите факторы, влияющие на частоту сердечных сокращений
- Различать положительные и отрицательные факторы, влияющие на сократимость сердца
- Обобщить факторы, влияющие на ударный объем и сердечный выброс
- Опишите реакцию сердца на изменения кровотока и давления
Ауритмичность, присущая клеткам сердца, поддерживает ритм сердца; однако сердце также регулируется и реагирует на внешние воздействия.Нервный и эндокринный контроль жизненно важен для регуляции сердечной функции. Кроме того, сердце чувствительно к нескольким факторам окружающей среды, в том числе к электролитам.
Сердечный выброс в покое
Сердечный выброс (СО) — это измерение количества крови, перекачиваемой каждым желудочком за одну минуту. Чтобы вычислить это значение, умножьте ударного объема (SV) , количество крови, прокачиваемой каждым желудочком, на пульса (HR) в сокращениях в минуту (или ударах в минуту, ударов в минуту).Математически это может быть представлено следующим уравнением:
CO = HR × SV
SV обычно измеряется с помощью эхокардиограммы для записи EDV и ESV и вычисления разницы: SV = EDV — ESV. SV также можно измерить с помощью специального катетера, но это инвазивная процедура и гораздо более опасна для пациента. Средняя SV для отдыхающего человека весом 70 кг (150 фунтов) будет примерно 70 мл. Существует несколько важных переменных, включая размер сердца, физическое и психическое состояние человека, пол, сократимость, продолжительность сокращения, предварительную нагрузку или EDV, а также постнагрузку или сопротивление.Нормальный диапазон для SV составляет 55–100 мл. Средняя ЧСС в состоянии покоя составляет примерно 75 ударов в минуту, но у некоторых людей может колебаться в пределах 60–100.
Используя эти числа, среднее значение CO составляет 5,25 л / мин с диапазоном 4,0–8,0 л / мин. Однако помните, что эти числа относятся к CO от каждого желудочка в отдельности, а не к общему показателю для сердца. Факторы, влияющие на CO, показаны на изображении ниже.
Рис. 1. Сердечный выброс зависит от частоты сердечных сокращений и ударного объема, которые также являются переменными.
SV также используются для расчета фракции выброса , которая представляет собой часть крови, которая перекачивается или выбрасывается из сердца при каждом сокращении. Для расчета фракции выброса SV делится на EDV. Несмотря на название, фракция выброса обычно выражается в процентах. Фракция выброса составляет примерно 55–70 процентов, в среднем 58 процентов.
Физические упражнения и максимальный сердечный выброс
У здоровых молодых людей ЧСС может увеличиваться до 150 ударов в минуту во время упражнений.SV также может увеличиваться с 70 до 130 мл из-за увеличения силы сокращения. Это увеличит CO примерно до 19,5 л / мин, что в 4–5 раз больше, чем в состоянии покоя. Лучшие спортсмены с сердечно-сосудистыми заболеваниями могут достичь еще более высоких уровней. При максимальной производительности они могут увеличить уровень CO в состоянии покоя в 7-8 раз.
Поскольку сердце — это мышца, тренировка увеличивает его эффективность. Разница между максимальным уровнем СО и СО в состоянии покоя известна как сердечного резерва . Он измеряет остаточную способность сердца перекачивать кровь.
пульса
ЧСС значительно различаются не только в зависимости от уровня физической активности и физической подготовки, но и в зависимости от возраста. ЧСС новорожденного в состоянии покоя может составлять 120 ударов в минуту. ЧСС постепенно снижается до достижения юношеского возраста, а затем снова постепенно увеличивается с возрастом.
Максимальное ЧСС обычно находится в диапазоне 200–220 ударов в минуту, хотя в некоторых крайних случаях они могут достигать более высоких уровней. С возрастом способность генерировать максимальные ставки снижается. Это можно оценить, взяв максимальное значение 220 ударов в минуту и вычтя возраст человека.Таким образом, можно ожидать, что 40-летний человек достигнет максимальной скорости примерно 180, а 60-летний человек достигнет ЧСС 160.
Болезни сердца: аномальная частота сердечных сокращений
Для взрослого нормальная ЧСС в состоянии покоя находится в диапазоне 60–100 ударов в минуту. Брадикардия — это состояние, при котором частота покоя падает ниже 60 ударов в минуту, а тахикардия — это состояние, при котором частота покоя превышает 100 ударов в минуту. У тренированных спортсменов обычно очень низкий ЧСС. Если у пациента нет других симптомов, таких как слабость, утомляемость, головокружение, обморок, дискомфорт в груди, учащенное сердцебиение или респираторный дистресс, брадикардия не считается клинически значимой.Однако если какой-либо из этих симптомов присутствует, они могут указывать на то, что сердце не обеспечивает ткани достаточным количеством насыщенной кислородом крови. Термин «относительная брадикардия» может использоваться в отношении пациента, у которого ЧСС находится в пределах нормы, но все еще страдает этими симптомами. Большинство пациентов остаются бессимптомными до тех пор, пока ЧСС остается выше 50 ударов в минуту.
Брадикардия может быть вызвана как внутренними факторами, так и причинами, не связанными с сердцем. Хотя заболевание может передаваться по наследству, обычно оно передается пожилым людям.Неотъемлемые причины включают аномалии СА или АВ-узла. Если состояние серьезное, может потребоваться кардиостимулятор. Другие причины включают ишемию сердечной мышцы или заболевания сердечных сосудов или клапанов. Внешние причины включают метаболические нарушения, патологии эндокринной системы, часто связанные с щитовидной железой, электролитный дисбаланс, неврологические расстройства, включая несоответствующие вегетативные реакции, аутоиммунные патологии, чрезмерное назначение бета-блокаторов, снижающих ЧСС, употребление рекреационных наркотиков или даже длительный постельный режим.Лечение зависит от установления основной причины расстройства и может потребовать дополнительного кислорода.
Тахикардия не является нормальным явлением у пациента в состоянии покоя, но может быть обнаружена у беременных женщин или людей, испытывающих сильный стресс. В последнем случае это, вероятно, будет вызвано стимуляцией лимбической системы или расстройствами вегетативной нервной системы. В некоторых случаях тахикардия может поражать только предсердия. У некоторых людей симптомы могут оставаться бессимптомными, но при их наличии симптомы могут включать головокружение, одышку, головокружение, учащенный пульс, пальпацию сердца, боль в груди или обморок (обморок).В то время как тахикардия определяется как ЧСС выше 100 ударов в минуту, между людьми существуют значительные различия. Кроме того, нормальная ЧСС в покое у детей часто превышает 100 ударов в минуту, но это не считается тахикардией. Многие причины тахикардии могут быть доброкачественными, но это состояние также может быть коррелировано с лихорадкой, анемией, гипоксией, гипертиреозом, гиперсекрецией катехоламинов, некоторые кардиомиопатии, некоторые заболевания клапанов и острое облучение. Повышенная частота у пациентов, выполняющих упражнения или отдыхающих, — это нормально и ожидаемо.Норма отдыха всегда следует принимать после восстановления после упражнений. Лечение зависит от основной причины, но может включать в себя лекарства, имплантируемые кардиовертер-дефибрилляторы, абляцию или хирургическое вмешательство.
Корреляция между частотой сердечных сокращений и сердечным выбросом
Первоначально физиологические условия, вызывающие увеличение ЧСС, также вызывают увеличение SV. Во время упражнений скорость возврата крови к сердцу увеличивается. Однако по мере увеличения ЧСС сокращается время диастолы и, следовательно, меньше времени для наполнения желудочков кровью.Несмотря на то, что время наполнения меньше, SV изначально останется высоким. Однако по мере того, как HR продолжает увеличиваться, SV постепенно уменьшается из-за уменьшения времени наполнения. CO сначала стабилизируется, поскольку увеличение HR компенсирует уменьшение SV, но при очень высоких скоростях CO в конечном итоге будет уменьшаться, поскольку увеличивающиеся скорости больше не могут компенсировать уменьшение SV. Рассмотрим это явление у здорового молодого человека. Первоначально, когда ЧСС увеличивается от состояния покоя до примерно 120 ударов в минуту, CO будет расти.Когда ЧСС увеличивается со 120 до 160 ударов в минуту, CO остается стабильным, поскольку увеличение частоты компенсируется уменьшением времени наполнения желудочков и, следовательно, SV. Поскольку ЧСС продолжает повышаться выше 160 ударов в минуту, СО фактически снижается, поскольку УЗ падает быстрее, чем увеличивается ЧСС. Таким образом, хотя аэробные упражнения имеют решающее значение для поддержания здоровья сердца, людям рекомендуется следить за своим пульсом, чтобы убедиться, что они находятся в пределах целевого диапазона пульса от 120 до 160 ударов в минуту, чтобы поддерживать уровень CO. Целевой ЧСС примерно определяется как диапазон, в котором сердце и легкие получают максимальную пользу от аэробной тренировки, и зависит от возраста.
Сердечно-сосудистые центры
Рис. 2. Кардиоускорительная и кардиоингибиторная области являются компонентами парных сердечных центров, расположенных в продолговатом мозге головного мозга. Они иннервируют сердце через симпатические сердечные нервы, которые увеличивают сердечную деятельность, и блуждающие (парасимпатические) нервы, замедляющие сердечную деятельность.
Нервный контроль над ЧСС сосредоточен в двух парных сердечно-сосудистых центрах продолговатого мозга (рис. 2). Кардиоускорительные области стимулируют активность посредством симпатической стимуляции сердечно-ускорительных нервов, а кардиоингибиторные центры снижают сердечную активность посредством парасимпатической стимуляции в качестве одного из компонентов блуждающего нерва, черепного нерва X.Во время отдыха оба центра обеспечивают легкую стимуляцию сердца, способствуя вегетативному тонусу . Это похоже на тонус скелетных мышц. Обычно преобладает стимуляция блуждающего нерва, поскольку, если он не регулируется, узел SA инициирует синусовый ритм приблизительно 100 ударов в минуту.
Как симпатическая, так и парасимпатическая стимуляции проходят через сложную парную сеть нервных волокон, известную как сердечное сплетение , возле основания сердца. Кардиоускорительный центр также отправляет дополнительные волокна, формирующие сердечные нервы через симпатические ганглии (шейные ганглии плюс верхние грудные ганглии T1 – T4) к SA и AV узлам, а также дополнительные волокна к предсердиям и желудочкам.Желудочки в большей степени иннервируются симпатическими волокнами, чем парасимпатическими. Симпатическая стимуляция вызывает высвобождение нейромедиатора норадреналина (NE) в нервно-мышечном соединении сердечных нервов. NE укорачивает период реполяризации, тем самым ускоряя скорость деполяризации и сокращения, что приводит к увеличению ЧСС. Он открывает каналы для ионов натрия и кальция, управляемые химическими веществами или лигандами, обеспечивая приток положительно заряженных ионов.
NE связывается с рецептором бета-1.Некоторые сердечные препараты (например, бета-блокаторы) действуют, блокируя эти рецепторы, тем самым замедляя ЧСС, и являются одним из возможных способов лечения гипертонии. Избыточный прием этих препаратов может привести к брадикардии и даже к остановке сердца.
Парасимпатическая стимуляция исходит из кардиоингибиторной области с импульсами, проходящими через блуждающий нерв (черепной нерв X). Блуждающий нерв посылает ветви как к SA, так и к AV узлам, а также к частям как предсердий, так и желудочков.Парасимпатическая стимуляция высвобождает нейромедиатор ацетилхолин (ACh) в нервно-мышечном соединении. ACh замедляет ЧСС, открывая каналы иона калия, управляемые химическими веществами или лигандами, чтобы замедлить скорость спонтанной деполяризации, которая продлевает реполяризацию и увеличивает время до следующей спонтанной деполяризации. Без какой-либо нервной стимуляции узел SA установил бы синусовый ритм примерно со скоростью 100 ударов в минуту. Поскольку частота покоя значительно меньше, становится очевидным, что парасимпатическая стимуляция обычно замедляет ЧСС.Это похоже на управление автомобилем с одной ногой на педали тормоза. Чтобы ускориться, нужно просто убрать ногу с тормоза и дать двигателю увеличить обороты. В случае сердца уменьшение парасимпатической стимуляции снижает выброс ACh, что позволяет увеличить ЧСС примерно до 100 ударов в минуту. Любое увеличение сверх этого уровня потребует симпатической стимуляции. На рисунке 3 показано влияние парасимпатической и симпатической стимуляции на нормальный синусовый ритм.
Рис. 3. Волна деполяризации при нормальном синусовом ритме показывает стабильную ЧСС покоя. После парасимпатической стимуляции ЧСС замедляется. После симпатической стимуляции ЧСС увеличивается.
Вход в сердечно-сосудистый центр
Сердечно-сосудистый центр получает сигнал от ряда висцеральных рецепторов с импульсами, проходящими через висцеральные сенсорные волокна внутри блуждающего нерва и симпатические нервы через сердечное сплетение. Среди этих рецепторов есть различные проприорецепторы, барорецепторы и хеморецепторы, а также стимулы от лимбической системы.В совокупности эти входные данные обычно позволяют сердечно-сосудистым центрам точно регулировать работу сердца — процесс, известный как сердечные рефлексы . Повышенная физическая активность приводит к увеличению скорости возбуждения различных проприорецепторов, расположенных в мышцах, суставных капсулах и сухожилиях. Любое такое увеличение физической активности логически оправдывает усиление кровотока. Сердечные центры контролируют эту повышенную частоту возбуждения и подавляют парасимпатическую стимуляцию и увеличивают симпатическую стимуляцию по мере необходимости, чтобы увеличить кровоток.
Точно так же барорецепторы — это рецепторы растяжения, расположенные в синусе аорты, каротидных телах, полых венах и других местах, включая легочные сосуды и правую часть сердца. Скорость возбуждения барорецепторов отражает артериальное давление, уровень физической активности и относительное распределение крови. Сердечные центры контролируют активацию барорецепторов для поддержания сердечного гомеостаза, механизм, называемый рефлексом барорецепторов . При увеличении давления и растяжения увеличивается скорость активации барорецепторов, а сердечные центры уменьшают симпатическую стимуляцию и увеличивают парасимпатическую стимуляцию.По мере уменьшения давления и растяжения скорость активации барорецепторов снижается, а сердечные центры усиливают симпатическую стимуляцию и уменьшают парасимпатическую стимуляцию.
Существует аналогичный рефлекс, называемый предсердным рефлексом или рефлексом Бейнбриджа , связанный с различной скоростью кровотока в предсердиях. Повышенный венозный возврат растягивает стенки предсердий, в которых расположены специализированные барорецепторы. Однако по мере того, как предсердные барорецепторы увеличивают частоту возбуждения и растягиваются из-за повышенного кровяного давления, сердечный центр реагирует усилением симпатической стимуляции и подавлением парасимпатической стимуляции для увеличения ЧСС.Обратное тоже верно.
Повышенное количество побочных продуктов метаболизма, связанных с повышенной активностью, таких как углекислый газ, ионы водорода и молочная кислота, а также падение уровня кислорода, обнаруживаются набором хеморецепторов, иннервируемых языкоглоточным и блуждающим нервами. Эти хеморецепторы обеспечивают обратную связь с сердечно-сосудистыми центрами о необходимости увеличения или уменьшения кровотока в зависимости от относительных уровней этих веществ.
Лимбическая система также может значительно влиять на ЧСС, связанную с эмоциональным состоянием.В периоды стресса нередко можно определить ЧСС выше нормы, что часто сопровождается резким повышением уровня гормона стресса кортизола. У людей, испытывающих крайнюю тревогу, могут проявляться приступы паники с симптомами, напоминающими симптомы сердечного приступа. Эти события обычно временны и поддаются лечению. Методы медитации были разработаны для облегчения беспокойства и, как было показано, эффективно снижают ЧСС. Выполнение простых упражнений на глубокое и медленное дыхание с закрытыми глазами также может значительно снизить тревожность и частоту сердечных сокращений.
Болезни сердца: синдром разбитого сердца
Экстремальный стресс от таких жизненных событий, как смерть любимого человека, эмоциональный разрыв, потеря дохода или потеря права выкупа дома, может привести к состоянию, обычно называемому синдромом разбитого сердца. Это состояние также может называться кардиомиопатией Такоцубо, синдромом преходящего апикального баллона, кардиомиопатией с апикальным баллоном, кардиомиопатией, вызванной стрессом, синдромом Геброчена-Герца и стрессовой кардиомиопатией.
Признанные эффекты на сердце включают застойную сердечную недостаточность из-за сильного ослабления миокарда, не связанного с недостатком кислорода.Это может привести к острой сердечной недостаточности, летальной аритмии или даже к разрыву желудочка. Точная этиология неизвестна, но было предложено несколько факторов, включая преходящий спазм сосудов, дисфункцию сердечных капилляров или утолщение миокарда, особенно в левом желудочке, которые могут привести к критическому кровообращению в этой области. Хотя многие пациенты переживают первоначальное острое событие с помощью лечения для восстановления нормальной функции, существует сильная корреляция со смертью.Тщательный статистический анализ Cass Business School, престижного учреждения, расположенного в Лондоне, опубликованный в 2008 году, показал, что в течение одного года после смерти любимого человека вероятность смерти женщин более чем в два раза выше, а вероятность смерти мужчин в шесть раз выше. умереть, как и следовало ожидать.
Другие факторы, влияющие на частоту сердечных сокращений
Используя сочетание ауторитмичности и иннервации, сердечно-сосудистый центр может обеспечивать относительно точный контроль над ЧСС. Однако есть ряд других факторов, которые также влияют на ЧСС, включая адреналин, NE и гормоны щитовидной железы; уровни различных ионов, включая кальций, калий и натрий; температура тела; гипоксия; и баланс pH.В таблицах 1 и 2 показано влияние каждого фактора на частоту сердечных сокращений. После прочтения этого раздела важность поддержания гомеостаза должна стать еще более очевидной.
| Таблица 1. Основные факторы, повышающие частоту сердечных сокращений и силу сокращения | |
|---|---|
| Фактор | Эффект |
| Кардиоускорительные нервы | Выпуск норадреналина |
| Проприорецепторы | Повышенная скорострельность во время учений |
| Хеморецепторы | Пониженные уровни O 2 ; повышенный уровень H + , CO 2 и молочной кислоты |
| Барорецепторы | Пониженная частота стрельбы, указывающая на падение объема / давления крови |
| Лимбическая система | Ожидание физических упражнений или сильных эмоций |
| Катехоламины | Повышенный уровень адреналина и норадреналина |
| Гормоны щитовидной железы | Увеличенный T 3 и T 4 |
| Кальций | Повышенный Ca 2+ |
| Калий | Пониженный K + |
| Натрий | Пониженный Na + |
| Температура тела | Повышение температуры тела |
| Никотин и кофеин | Стимуляторы, повышающие частоту сердечных сокращений |
| Таблица 2.Факторы, снижающие частоту сердечных сокращений и силу сокращения | |
|---|---|
| Фактор | Эффект |
| Кардиоингибиторные нервы (блуждающий нерв) | Выпуск ацетилхолина |
| Проприорецепторы | Снижение темпов стрельбы после учений |
| Хеморецепторы | Повышенные уровни O 2 ; пониженные уровни H + и CO 2 |
| Барорецепторы | Повышенная частота стрельбы, указывающая на более высокий объем / давление крови |
| Лимбическая система | Ожидание релаксации |
| Катехоламины | Снижение адреналина и норадреналина |
| Гормоны щитовидной железы | Пониженные T 3 и T 4 |
| Кальций | Снижение Ca 2+ |
| Калий | Увеличенный K + |
| Натрий | Повышенный Na + |
| Температура тела | Снижение температуры тела |
Адреналин и норэпинефрин
Катехоламины, адреналин и NE, секретируемые мозговым веществом надпочечников, образуют один из компонентов расширенного механизма борьбы или бегства.Другой компонент — симпатическая стимуляция. Адреналин и NE имеют сходные эффекты: связывание с рецепторами бета-1 и открытие каналов, управляемых химическими или лигандными ионами натрия и кальция. Скорость деполяризации увеличивается за счет этого дополнительного притока положительно заряженных ионов, поэтому порог достигается быстрее и период реполяризации сокращается. Однако массовое высвобождение этих гормонов в сочетании с симпатической стимуляцией может на самом деле привести к аритмиям. Парасимпатическая стимуляция мозгового вещества надпочечников отсутствует.
Гормоны щитовидной железы
Как правило, повышенный уровень гормона щитовидной железы или тироксина увеличивает частоту сердечных сокращений и сократительную способность. Воздействие гормона щитовидной железы обычно длится намного дольше, чем действие катехоламинов. Было показано, что физиологически активная форма гормона щитовидной железы Т 3 или трийодтиронин непосредственно проникает в кардиомиоциты и изменяет активность на уровне генома. Он также влияет на бета-адренергический ответ, аналогичный описанному выше адреналину и NE.Чрезмерный уровень тироксина может вызвать тахикардию.
Кальций
Уровни ионов кальция имеют большое влияние как на ЧСС, так и на сократительную способность; по мере увеличения уровня ионов кальция увеличиваются ЧСС и сократимость. Высокий уровень ионов кальция (гиперкальциемия) может быть связан с коротким интервалом QT и расширенным зубцом T на ЭКГ. Интервал QT представляет собой время от начала деполяризации до реполяризации желудочков и включает период систолы желудочков. Чрезвычайно высокий уровень кальция может вызвать остановку сердца.Препараты, известные как блокаторы кальциевых каналов, замедляют ЧСС, связываясь с этими каналами и блокируя или замедляя движение ионов кальция внутрь.
Кофеин и никотин
Кофеин и никотин не встречаются в организме естественным образом. Оба этих нерегулируемых препарата оказывают возбуждающее действие на мембраны нейронов в целом и оказывают стимулирующее действие, в частности, на сердечные центры, вызывая увеличение ЧСС. Кофеин работает за счет увеличения скорости деполяризации в узле SA, тогда как никотин стимулирует активность симпатических нейронов, которые доставляют импульсы к сердцу.
Хотя кофеин является наиболее широко употребляемым психоактивным наркотиком в мире, он является законным и не регулируется. Хотя точные количества не установлены, «нормальное» потребление не считается вредным для большинства людей, хотя оно может вызывать нарушения сна и действовать как мочегонное средство. Его употребление беременными женщинами не рекомендуется, хотя никаких доказательств его отрицательных эффектов подтверждено не было. Толерантность и даже физическая и психическая зависимость от наркотика приводят к тому, что люди регулярно употребляют это вещество.
Никотин также является стимулятором и вызывает привыкание. Хотя закон и не регулируется, опасения по поводу безопасности никотина и документально подтвержденные связи с респираторными и сердечными заболеваниями привели к появлению предупреждающих этикеток на пачках сигарет.
Факторы, снижающие частоту сердечных сокращений
ЧСС может замедляться, когда у человека изменяются уровни натрия и калия, гипоксия, ацидоз, алкалоз и гипотермия. Взаимосвязь между электролитами и ЧСС сложна, но поддержание баланса электролитов имеет решающее значение для нормальной волны деполяризации.Из двух ионов калий имеет большее клиническое значение. Первоначально как гипонатриемия (низкий уровень натрия), так и гипернатриемия (высокий уровень натрия) могут привести к тахикардии. Очень высокая гипернатриемия может привести к фибрилляции, которая может вызвать прекращение угарного газа. Тяжелая гипонатриемия приводит как к брадикардии, так и к другим аритмиям. Гипокалиемия (низкий уровень калия) также приводит к аритмиям, тогда как гиперкалиемия (высокий уровень калия) вызывает ослабление и вялость сердца и, в конечном итоге, его отказ.
Сердечная мышца получает энергию исключительно за счет аэробного метаболизма. Гипоксия (недостаточное поступление кислорода) приводит к снижению ЧСС, поскольку метаболические реакции, вызывающие сокращение сердца, ограничены.
Ацидоз — это состояние, при котором присутствуют избыточные ионы водорода, а кровь пациента имеет низкое значение pH. Алкалоз — это состояние, при котором ионов водорода слишком мало, а в крови пациента повышен pH. В норме pH крови находится в диапазоне 7,35–7.45, поэтому число ниже этого диапазона представляет ацидоз, а большее число — алкалоз. Напомним, что ферменты являются регуляторами или катализаторами практически всех биохимических реакций; они чувствительны к pH и немного изменят форму, если значения выходят за пределы их нормального диапазона. Эти вариации pH и сопровождающие их небольшие физические изменения в активном центре фермента снижают скорость образования комплекса фермент-субстрат, впоследствии снижая скорость многих ферментативных реакций, которые могут иметь комплексное влияние на HR.Сильные изменения pH приведут к денатурации фермента.
Последняя переменная — температура тела. Повышенная температура тела называется гипертермией, а пониженная температура тела — гипотермией. Небольшая гипертермия приводит к увеличению ЧСС и силы сокращения. Гипотермия замедляет частоту и силу сердечных сокращений. Это отчетливое замедление работы сердца является одним из компонентов более крупного рефлекса ныряния, который направляет кровь к важным органам, находясь под водой. При достаточном охлаждении сердце перестанет биться — метод, который можно использовать во время операции на открытом сердце.В этом случае кровь пациента обычно направляется в аппарат искусственного сердца-легких, чтобы поддерживать кровоснабжение организма и газообмен до завершения операции, и можно восстановить синусовый ритм. Чрезмерная гипертермия и переохлаждение приводят к смерти, поскольку ферменты заставляют системы организма прекращать нормальное функционирование, начиная с центральной нервной системы.
Ходовой объем
Многие из тех же факторов, которые регулируют ЧСС, также влияют на сердечную функцию, изменяя SV.Хотя задействован ряд переменных, SV в конечном итоге зависит от разницы между EDV и ESV. Три основных фактора, которые следует учитывать, — это предварительная нагрузка или растяжение желудочков перед сокращением; сократимость, или сила или сила самого сокращения; и постнагрузка, сила, которую желудочки должны создавать, чтобы перекачивать кровь, преодолевая сопротивление в сосудах.
Предварительная нагрузка
Preload — это еще один способ выражения EDV. Следовательно, чем больше EDV, тем больше предварительная нагрузка.Одним из основных факторов, которые следует учитывать, является время наполнения или продолжительность желудочковой диастолы, во время которой происходит наполнение. Чем быстрее сокращается сердце, тем короче становится время наполнения и тем ниже EDV и предварительная нагрузка. Этот эффект можно частично преодолеть за счет увеличения второй переменной, сократимости и повышения SV, но со временем сердце не может компенсировать уменьшение времени наполнения, и предварительная нагрузка также уменьшается.
С увеличением наполнения желудочков увеличивается как КДО, так и преднагрузка, а сама сердечная мышца растягивается в большей степени.В состоянии покоя мышца желудочка немного растягивается, а саркомеры остаются короткими. При увеличении наполнения желудочков мышца желудочка все больше растягивается и длина саркомера увеличивается. По мере того, как саркомеры достигают своей оптимальной длины, они будут сокращаться сильнее, потому что большее количество миозиновых головок может связываться с актином на тонких филаментах, образуя поперечные мостики и увеличивая силу сокращения и SV. Если бы этот процесс продолжился и саркомеры вытянулись за пределы своей оптимальной длины, сила сжатия уменьшилась бы.Однако из-за физических ограничений расположения сердца это чрезмерное растяжение не вызывает беспокойства.
Взаимосвязь между растяжением и сокращением желудочков установлена в хорошо известном механизме Франка-Старлинга или просто в законе сердца Старлинга. Этот принцип гласит, что в физиологических пределах сила сердечного сокращения прямо пропорциональна начальной длине мышечного волокна. Это означает, что чем сильнее растягивается мышца желудочка (в определенных пределах), тем сильнее сокращение, которое, в свою очередь, увеличивает SV.Следовательно, увеличивая предварительную нагрузку, вы увеличиваете вторую переменную, сократимость.
Отто Франк (1865–1944) был немецким физиологом; Среди его многочисленных опубликованных работ есть подробные исследования этой важной сердечной взаимосвязи. Эрнест Старлинг (1866–1927) был крупным английским физиологом, который также изучал сердце. Хотя они работали в основном независимо, их совместные усилия и аналогичные выводы были признаны под названием «механизм Франка-Старлинга».
Любая симпатическая стимуляция венозной системы увеличивает венозный возврат к сердцу, что способствует наполнению желудочков, EDV и преднагрузке.Хотя большая часть наполнения желудочков происходит, когда предсердия и желудочки находятся в диастоле, сокращение предсердий, толчок предсердий, играет решающую роль, обеспечивая последние 20–30 процентов наполнения желудочков.
Сократимость
Практически невозможно рассматривать предварительную нагрузку или ESV без предварительного упоминания концепции сократимости. Действительно, эти два параметра тесно связаны. Сократимость относится к силе сокращения сердечной мышцы, которая контролирует SV, и является основным параметром для воздействия на ESV.Чем сильнее сокращение, тем больше SV и меньше ESV. Менее сильные сокращения приводят к меньшим SV и большим ESV. Факторы, которые увеличивают сократительную способность, описываются как положительных инотропных факторов , а факторы, снижающие сократимость, описываются как отрицательные инотропные факторы , (ино- = «волокно;» -тропный = «поворот к»).
Неудивительно, что симпатическая стимуляция является положительным инотропом, тогда как парасимпатическая стимуляция — отрицательным инотропом.Симпатическая стимуляция запускает высвобождение NE в нервно-мышечном соединении сердечных нервов, а также стимулирует мозговое вещество надпочечников к секреции адреналина и NE. Помимо своего стимулирующего действия на ЧСС, они также связываются как с альфа-, так и с бета-рецепторами на клеточной мембране сердечной мышцы, чтобы увеличить скорость метаболизма и силу сокращения. Эта комбинация действий имеет чистый эффект увеличения SV и меньшего остаточного ESV в желудочках. Для сравнения, парасимпатическая стимуляция высвобождает ACh в нервно-мышечном соединении блуждающего нерва.Мембрана гиперполяризует и препятствует сокращению, чтобы уменьшить силу сокращения и SV, а также повысить ESV. Поскольку парасимпатические волокна более широко распространены в предсердиях, чем в желудочках, основное действие происходит в верхних камерах. Парасимпатическая стимуляция в предсердиях уменьшает толчок предсердий и снижает EDV, что снижает растяжение желудочков и преднагрузку, тем самым дополнительно ограничивая силу сокращения желудочков. Более сильная парасимпатическая стимуляция также напрямую снижает силу сокращения желудочков.
Было разработано несколько синтетических препаратов, включая дофамин и изопротеренол, которые имитируют эффекты адреналина и NE, стимулируя приток ионов кальция из внеклеточной жидкости. Более высокие концентрации внутриклеточных ионов кальция увеличивают силу сокращения. Избыток кальция (гиперкальциемия) также действует как положительный инотропный агент. Препарат наперстянки снижает ЧСС и увеличивает силу сокращения, действуя как положительный инотропный агент, блокируя связывание ионов кальция в саркоплазматическом ретикулуме.Это приводит к более высокому уровню внутриклеточного кальция и большей силе сокращения. Помимо катехоламинов мозгового вещества надпочечников, положительные инотропные эффекты проявляют и другие гормоны. К ним относятся гормоны щитовидной железы и глюкагон из поджелудочной железы.
Отрицательные инотропные агенты включают гипоксию, ацидоз, гиперкалиемию и различные синтетические препараты. К ним относятся многочисленные бета-блокаторы и блокаторы кальциевых каналов. Ранние бета-блокаторы включают пропранолол и пронеталол, и им приписывают революцию в лечении кардиологических пациентов, страдающих стенокардией.Существует также большой класс блокаторов кальциевых каналов дигидропиридина, фенилалкиламина и бензотиазепина, которые можно вводить, уменьшая силу сокращения и SV.
Afterload
Постнагрузка относится к напряжению, которое желудочки должны развивать, чтобы эффективно перекачивать кровь, преодолевая сопротивление в сосудистой системе. Любое состояние, которое увеличивает сопротивление, требует большей постнагрузки, чтобы открыть полулунные клапаны и перекачивать кровь. Повреждение клапанов, например стеноз, из-за которого их труднее открывать, также увеличивает постнагрузку.Любое уменьшение сопротивления снижает постнагрузку.
Резюме: Факторы, влияющие на ударный объем (SV)
Множественные факторы, влияющие на предварительную нагрузку, постнагрузку и сократительную способность, являются основными факторами, влияющими на SV.
Предварительная нагрузка
Предварительная нагрузка повышена из-за
- быстрое время заполнения
- увеличение венозного возврата
Повышенная предварительная нагрузка увеличивает конечный диастолический объем, а увеличивает ударный объем .
Предварительная нагрузка снижена из-за
- снижение гормонов щитовидной железы
- уменьшил ионы кальция
- высокий или низкий ионы калия
- с высоким или низким содержанием натрия
- низкая температура тела
- гипоксия
- нарушение баланса pH
- лекарств (т.е., блокаторы кальциевых каналов)
Пониженный предварительный натяг уменьшает конечный диастолический объем, а уменьшает ударный объем .
Сократимость
Сократимость повышена за счет
- симпатическая стимуляция
- адреналин и норадреналин
- высокие ионы внутриклеточного кальция
- высокий уровень кальция в крови
- гормоны щитовидной железы
- глюкагон
Повышенная сократимость снижает конечный систолический объем, а увеличивает ударный объем .
Сократимость снижена из-за
- парасимпатическая стимуляция
- ацетилхолин
- гипоксия
- гиперкалиемия
Пониженная сократимость увеличивает конечный систолический объем, а уменьшает ударный объем .
Afterload
Постнагрузка повышена из-за
- повышенное сопротивление сосудов
- полулунное повреждение клапана
Повышенная постнагрузка увеличивает конечный систолический объем, а уменьшает ударный объем .
Остаточная нагрузка снижена из-за
- снижение сосудистого сопротивления
Пониженная постнагрузка уменьшает конечный систолический объем, а увеличивает ударный объем .
Рис. 4. Основные факторы, влияющие на ЧСС, включают вегетативную иннервацию и эндокринный контроль. Не показаны факторы окружающей среды, такие как электролиты, продукты обмена веществ и температура. Основными факторами, контролирующими SV, являются преднагрузка, сократимость и постнагрузка. Другие факторы, такие как электролиты, можно классифицировать как положительные или отрицательные инотропные агенты.
| Таблица 3. Реакция сердца на снижение кровотока и давления из-за снижения сердечного выброса | ||
|---|---|---|
| Барорецепторы (аорта, сонные артерии, полые вены и предсердия) | Хеморецепторы (как центральной нервной системы, так и в непосредственной близости от барорецепторов) | |
| Чувствительность к | Уменьшение растяжения | Уменьшение O 2 и увеличение CO 2 , H + и молочная кислота |
| Цель | Подавление парасимпатической стимуляции | Повышенная симпатическая стимуляция |
| Отклик сердца | Учащение пульса и увеличение ударного объема | Учащение пульса и увеличение ударного объема |
| Общий эффект | Увеличение кровотока и давления из-за увеличения сердечного выброса; гемостаз восстановлен | Увеличение кровотока и давления из-за увеличения сердечного выброса; гемостаз восстановлен |
| Таблица 4.Сердечный ответ на увеличение кровотока и давления из-за увеличения сердечного выброса | ||
|---|---|---|
| Барорецепторы (аорта, сонные артерии, полые вены и предсердия) | Хеморецепторы (как центральной нервной системы, так и в непосредственной близости от барорецепторов) | |
| Чувствительность к | Увеличивающая растяжка | Увеличение O 2 и уменьшение CO 2 , H + и молочная кислота |
| Цель | Парасимпатическая стимуляция усилена | Симпатическая стимуляция подавлена |
| Отклик сердца | Уменьшение частоты пульса и уменьшение ударного объема | Уменьшение частоты пульса и уменьшение ударного объема |
| Общий эффект | Снижение кровотока и давления из-за уменьшения сердечного выброса; гемостаз восстановлен | Снижение кровотока и давления из-за уменьшения сердечного выброса; гемостаз восстановлен |
Обзор главы
Многие факторы влияют на ЧСС и SV, и вместе они влияют на сердечную функцию.ЧСС в значительной степени определяется и регулируется вегетативной стимуляцией и гормонами. Существует несколько петель обратной связи, которые способствуют поддержанию гомеостаза в зависимости от уровня активности, например предсердного рефлекса, который определяется венозным возвратом.
SV регулируется вегетативной иннервацией и гормонами, а также временем наполнения и венозным возвратом. Венозный возврат определяется активностью скелетных мышц, объемом крови и изменениями периферического кровообращения. Венозный возврат определяет преднагрузку и предсердный рефлекс.Время заполнения, непосредственно связанное с HR, также определяет предварительную нагрузку. Затем предварительная нагрузка влияет как на EDV, так и на ESV. Вегетативная иннервация и гормоны в значительной степени регулируют сократимость. Сократимость влияет на EDV, как и постнагрузка. CO — это произведение HR, умноженного на SV. SV — это разница между EDV и ESV.
Самопроверка
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы о критическом мышлении
- Почему увеличение EDV увеличивает сократимость?
- Почему постнагрузка важна для сердечной деятельности?
- Увеличение EDV увеличивает длину саркомеров в клетках сердечной мышцы, позволяя формировать больше поперечных мостиков между миозином и актином и обеспечивая более сильное сокращение.Эта взаимосвязь описана в механизме Франка-Старлинга.
- Постнагрузка представляет собой сопротивление внутри артерий потоку крови, выбрасываемой из желудочков. Если некомпенсировать, если постнагрузка увеличивается, поток будет уменьшаться. Чтобы сердце могло поддерживать адекватный кровоток и преодолевать возрастающую постнагрузку, оно должно работать с большей силой. Это одно из негативных последствий повышенного артериального давления или гипертонии.
Глоссарий
постнагрузка: сила, которую желудочки должны развивать, чтобы эффективно перекачивать кровь, преодолевая сопротивление в сосудах
вегетативный тонус: Сократительное состояние во время сердечной деятельности в покое, вызванное мягкой симпатической и парасимпатической стимуляцией
предсердный рефлекс: (также называемый рефлексом Бейнбриджа) вегетативный рефлекс, который отвечает на рецепторы растяжения в предсердиях, которые посылают импульсы в область кардиоускорителя для увеличения ЧСС при увеличении венозного кровотока в предсердия
Рефлекс Бейнбриджа: (также называемый предсердным рефлексом) вегетативный рефлекс, который отвечает на рецепторы растяжения в предсердиях, которые посылают импульсы в область кардиоускорителя для увеличения ЧСС при увеличении венозного кровотока в предсердия
барорецепторный рефлекс: вегетативный рефлекс, при котором сердечные центры контролируют сигналы от рецепторов растяжения барорецепторов и регулируют работу сердца на основе кровотока
сердечный выброс (СО): количество крови, перекачиваемое каждым желудочком в течение одной минуты; равно HR, умноженному на SV
сердечное сплетение: парная сложная сеть нервных волокон у основания сердца, которые получают симпатическую и парасимпатическую стимуляцию для регулирования ЧСС
сердечные рефлексы: серия вегетативных рефлексов, которые позволяют сердечно-сосудистым центрам регулировать работу сердца на основе сенсорной информации от различных висцеральных датчиков
сердечный резерв: разница между максимальным и СО в состоянии покоя
фракция выброса: порция крови, которая перекачивается или выбрасывается из сердца при каждом сокращении; математически представлено как SV, разделенное на EDV
время наполнения: продолжительность диастолы желудочков, во время которой происходит наполнение
Механизм Франка-Старлинга: взаимосвязь между растяжением и сокращением желудочков, при которой сила сокращения сердца прямо пропорциональна начальной длине мышечного волокна
частота сердечных сокращений (ЧСС): количество сокращений (ударов) сердца в минуту
отрицательные инотропные факторы: факторов, отрицательно влияющих или снижающих сократимость сердца
положительные инотропные факторы: факторов, которые положительно влияют или увеличивают сократимость сердца
Ударный объем (SV): количества крови, перекачиваемой каждым желудочком за сокращение; также разница между EDV и ESV
целевая частота пульса: диапазон, в котором сердце и легкие получают максимальную пользу от аэробной тренировки
Участие липидных рафтов и кавеол в функции ионных каналов сердца | Сердечно-сосудистые исследования
Аннотация
Было показано, что различные липидные микродомены, включая кавеолы, играют важную роль как в нацеливании на белки, так и в контроле межбелковых взаимодействий.Появляется все больше доказательств значительной локализации ионных каналов в липидных рафтах. Субъединицы сердечного канала, которые, как известно, локализуются в липидных рафтах, включают Kv1.4, Kv1.5, Kv2.1, Kv4, Kir2, Kir3, K ATP , субъединицы Nav и Cav. В этой статье приводится обзор того, что известно о возникновении и функциональном значении взаимодействий сердечного ионного канала и липидного рафта. Еще многое предстоит узнать об этой области, потенциально имеющей огромное значение для сердечной функции при здоровье и болезнях.
1.Введение
Ионные каналы играют критическую роль в формировании сердечного потенциала действия (AP), который регулирует региональную электрическую активность [1]. На физиологическую функцию ионных каналов влияют взаимодействия с белками, которые модулируют их активность и / или локализацию.
Жидко-мозаичная модель Сингера и Николсона (1972) рассматривала мембрану как жидкий бислой с однородным распределением липидов [2]. Клеточная мембрана содержит> 2000 видов липидов [3], некоторые из которых ассоциируются, тогда как другие являются исключительными [4].Такое поведение приводит к образованию отчетливых липидных структур, что приводит к «разделению фаз» [5]. Фосфолипиды с относительно длинными насыщенными ацильными цепями и холестерином упаковываются вместе, образуя жидкую упорядоченную фазу (Lo), а основная масса фосфолипидов, состоящая из фосфоглицеролипидов с полиненасыщенными жирными кислотами, составляет более жидкую жидкую неупорядоченную фазу (Ld) [5]. Микродомены Lo, называемые «липидными плотами», плавают в фазе Ld, как айсберги в океане, и революционизировали наши представления о нацеливании и организации мембранных белков [4,6].Посттрансляционные модификации белков, такие как пальмитоилирование и миристоилирование, способствуют локализации белка в липидных рафтах [7]. Фрагменты гликозилфосфатидилинозита, известные как «GPI-якоря», также способствуют локализации липидного рафта [8]. Остатки специфических трансмембранных доменов регулируют локализацию в обогащенных холестерином доменах и мембранах [9]. Нацеливание белков на липидные рафты может быть результатом специфических нацеленных сигналов липидных рафтов, а также посредством взаимодействий с другими белками.
Присутствие белков в липидных рафтах зависит от содержания липидов и белков.Современные мембранные модели включают кластеры белков и липидов и рассматривают динамическое ремоделирование отдельных микродоменов с включением или исключением белков и липидов с последующим слиянием микродоменов (Fig. 1). Липидные рафты активно участвуют в передаче сигналов и клеточной адаптации к изменяющимся условиям окружающей среды.
Рис. 1
Схематическое изображение структур липидного рафта в плазматической мембране. Липидные рафты плавают в мембране, составляя отдельные сигнальные платформы в зависимости от подтипа и состава липидных рафтов.Некоторые из них представляют собой инвагинированные структуры (кавеолы), другие представляют собой плоские бляшки. Липидные рафты могут сливаться, способствуя взаимодействию между составляющими белками. Также показаны комплексы, регулирующие ионные каналы в кардиомиоцитах. DAPCs (Dystrophin Associated Protein Complexes) закрепляются в кавеолах и стабилизируют структуры, взаимодействующие с актиновым цитоскелетом, тогда как другие липидные рафты, локализованные на интеркалированных дисках, преимущественно взаимодействуют с комплексами кадгерина для закрепления в актиновом цитоскелете.В обоих случаях белки MAGUK способствуют кластеризации отдельных белков, которые регулируют функцию каналов. Для обсуждения конкретных белков в комплексах см. Текст.
Рис. 1
Схематическое изображение структур липидного рафта в плазматической мембране. Липидные рафты плавают в мембране, составляя отдельные сигнальные платформы в зависимости от подтипа и состава липидных рафтов. Некоторые из них представляют собой инвагинированные структуры (кавеолы), другие представляют собой плоские бляшки. Липидные рафты могут сливаться, способствуя взаимодействию между составляющими белками.Также показаны комплексы, регулирующие ионные каналы в кардиомиоцитах. DAPCs (Dystrophin Associated Protein Complexes) закрепляются в кавеолах и стабилизируют структуры, взаимодействующие с актиновым цитоскелетом, тогда как другие липидные рафты, локализованные на интеркалированных дисках, преимущественно взаимодействуют с комплексами кадгерина для закрепления в актиновом цитоскелете. В обоих случаях белки MAGUK способствуют кластеризации отдельных белков, которые регулируют функцию каналов. Для обсуждения конкретных белков в комплексах см. Текст.
Маленькие инвагинированные мембранные структуры, называемые «кавеолами», являются наиболее охарактеризованными липидными рафтами (Рис. 1). Эти инвагинированные мембранные структуры, впервые обнаруженные в начале 1950-х с помощью электронной микроскопии [10], обогащены холестерином и сфинголипидами, а также небольшим (21-25 кДа) холестерин-связывающим белком «кавеолином» [11]. Кавеолин имеет несколько изоформ [12], но кавеолин-1 и кавеолин-3 охарактеризованы лучше всего. Кавеолин-3 экспрессируется исключительно в миоцитах [13]. Кавеолины содержат высокогидрофобное ядро из 33 аминокислот, охватывающее мембрану.Инвагинированная кавеолярная структура является результатом стержневой шпильки в кавеолине [11]. Кавеолин-3 миокарда обнаружен в t-канальцах кардиомиоцитов и сарколемме, но отсутствует на вставочных дисках [14]. Хотя исследования микродоменов кардиомиоцитов были сосредоточены на кавеолах, все больше данных указывает на гетерогенность структур сердечных липидных плотин [4,15].
2 Технические характеристики
2.1 Биохимические подходы
Липидные рафты не растворяются в неионных детергентах [4].Холестерин и сфинголипиды настолько плотно упакованы вместе в липидных рафтах, что детергенты, как правило, недостаточно сильны, чтобы дестабилизировать их или солюбилизировать закрепленные в них белки. Микродомены липидного рафта можно разделить в соответствии с их плавучей плотностью с помощью градиентов сахарозы или Optiprep. Различные детергенты обладают селективностью для экстракции определенных липидных рафтов. Triton X-100 и CHAPS более селективны, чем Tween-20 и Brij58 (таблица 1) [16]. Некоторые детергенты лишь частично солюбилизируют липиды и белки, что дает неполное представление о составе рафта [17].Некоторые детергенты могут спровоцировать слияние липидных плотностей, способствуя нефизиологическим взаимодействиям белков [17]. Чтобы избежать этих артефактов, были разработаны методы изоляции без использования детергентов [18], включающие механическое разрушение с последующим разделением в градиенте плавучей плотности. Недавние модификации избегают артефактов, связанных с ассоциированными белками нелипидных рафтов [18].
Таблица 1 Профиль селективностимоющего средства в ячейках MDCK
| Моющее средство . | Избирательность . | Соотношение холестерин DRM / GPL . | Соотношение сфинголипидов DRM / GPL . |
|---|---|---|---|
| Triton X-100 | +++ | 4,6 | 3,2 |
| CHAPS | +++ | 4 | 3,5 |
| Bri | 2,3 | ||
| Brij 96 | ++ | 1.7 | 1,7 |
| Brij 58 | ++ | 1,3 | 1,3 |
| Lubrol | ++ | 1,3 | 1,4 |
| Моющее средство . | Избирательность . | Соотношение холестерин DRM / GPL . | Соотношение сфинголипидов DRM / GPL . |
|---|---|---|---|
| Triton X-100 | +++ | 4,6 | 3,2 |
| CHAPS | +++ | 4 | 3,5 |
| Bri | 2,3 | ||
| Brij 96 | ++ | 1,7 | 1,7 |
| Brij 58 | ++ | 1,3 | 1,3 |
| Lubrol3 | 1,4 | ||
| Tween 20 | + | 0,8 | 0,8 |
Профиль селективности моющего средства в ячейках MDCK
| Моющее средство . | Избирательность . | Соотношение холестерин DRM / GPL . | Соотношение сфинголипидов DRM / GPL . | |
|---|---|---|---|---|
| Triton X-100 | +++ | 4.6 | 3,2 | |
| CHAPS | +++ | 4 | 3,5 | |
| Brij 98 | ++ | 2,3 | 2,3 | 96268|
| 1,7 | ||||
| Brij 58 | ++ | 1,3 | 1,3 | |
| Lubrol | ++ | 1,3 | 1,4 | |
| + | + | Tween 20 | 8 | 0,8 |
| Моющее средство . | Избирательность . | Соотношение холестерин DRM / GPL . | Соотношение сфинголипидов DRM / GPL . |
|---|---|---|---|
| Triton X-100 | +++ | 4,6 | 3,2 |
| CHAPS | +++ | 4 | 3,5 |
| Bri .3 | 2,3 | ||
| Brij 96 | ++ | 1,7 | 1,7 |
| Brij 58 | ++ | 1,3 | 1,3 |
| Lubrol2 1,4 | |||
| Tween 20 | + | 0,8 | 0,8 |
2.2 Подходы к визуализации
Локализацию ионных каналов и регуляторных партнеров можно наблюдать с помощью методов иммунофлуоресценции [19].Одним из ограничений использования конститутивно локализованных белков в качестве маркеров липидных рафтов является частичное мечение популяции липидных рафтов. Новые инструменты позволяют маркировать всю популяцию липидных рафтов [19–22]. Восстановление флуоресценции после фотообесцвечивания (FRAP) широко используется для определения трансляционной подвижности ионных каналов. Раннее исследование показало, что связанный с мембраной гуанилаткиназа (MAGUK) белок PSD-95 иммобилизует каналы Kv1.4 на плазматической мембране [23]. Все больше данных свидетельствует о том, что подвижность зависит от локализации ионных каналов [24,25].Кавеолы - очень неподвижные микродомены [26]. Хотя липидные рафты обнаруживают различные скорости латеральной диффузии, диффузионная подвижность больше коррелирует с закреплением мембраны, чем с ассоциацией рафтов [27].
2.3 Функциональные подходы
Другой способ изучения нацеливания на ионный канал липидного рафта — это анализ функции ионного канала после разрушения структуры рафта. Было использовано несколько реагентов (таблица 2). Часто используемый метод — это истощение мембранного холестерина с помощью метил-β-циклодекстрина (MCD) [28].MCD обладает высоким сродством к холестерину, удаляя его из мембран и вызывая разрушение липидного рафта [29].
Таблица 2Химические вещества, используемые для разрушения структуры липидного рафта
| Молекула . | Эффект . | Комментарии . | Список литературы . | ||
|---|---|---|---|---|---|
| 5-метил-β-циклодекстрин | Истощение холестерина | Нарушение липидного рафа | [24] | ||
| 2-гидроксипропил-β-циклодекстрин | Распад липидного эфира | Распад липидного эфира | 24] | ||
| Фумонизин В | Ингибитор биосинтеза шинголипидов | Нарушение липидного рафа | [24] | ||
| Сфингомиелиназа | Нарушение сфинголипидов | Деструкция липидолипидов | Деструкция липидолипидов | Кавеоловый эндоцитоз | [26] |
| Колцемид | Нарушение цитоскелета | Кавеоловый эндоцитоз | [35] |
| Молекула . | Эффект . | Комментарии . | Список литературы . | ||
|---|---|---|---|---|---|
| 5-метил-β-циклодекстрин | Истощение холестерина | Нарушение липидного рафа | [24] | ||
| 2-гидроксипропил-β-циклодекстрин | Распад липидного эфира | Распад липидного эфира | 24] | ||
| Фумонизин В | Ингибитор биосинтеза шинголипидов | Нарушение липидного рафа | [24] | ||
| Сфингомиелиназа | Нарушение сфинголипидов | Деструкция липидолипидов | Деструкция липидолипидов | Кавеоловый эндоцитоз | [26] |
| Колцемид | Нарушение цитоскелета | Кавеоловый эндоцитоз | [35] |
| Молекула . | Эффект . | Комментарии . | Список литературы . | ||
|---|---|---|---|---|---|
| 5-метил-β-циклодекстрин | Истощение холестерина | Нарушение липидного рафа | [24] | ||
| 2-гидроксипропил-β-циклодекстрин | Распад липидного эфира | Распад липидного эфира | 24] | ||
| Фумонизин В | Ингибитор биосинтеза шинголипидов | Нарушение липидного рафа | [24] | ||
| Сфингомиелиназа | Нарушение сфинголипидов | Деструкция липидолипидов | Деструкция липидолипидов | Кавеоловый эндоцитоз | [26] |
| Колцемид | Нарушение цитоскелета | Кавеоловый эндоцитоз | [35] |
3 3 Доказательства локализации ионных каналов 9 в липолах
Широкий спектр субъединиц ионных каналов сердца был локализован на липидных рафтах, как подробно описано ниже.Рис. 2 иллюстрирует роль этих субъединиц в сердечных AP.
Рис. 2
Иллюстрация сердечных ионных каналов, которые, как известно, локализуются в липидных рафтах, и их участие в различных фазах AP кардиомиоцитов. Все еще существуют ограниченные знания о локализации липидных рафтов субъединиц (таких как HERG, KvLQT1 и minK), которые контролируют реполяризацию фазы 3 (обозначены?).
Рис. 2
Иллюстрация сердечных ионных каналов, которые, как известно, локализуются в липидных рафтах, и их участие в различных фазах AP кардиомиоцитов.Все еще существуют ограниченные знания о локализации липидных рафтов субъединиц (таких как HERG, KvLQT1 и minK), которые контролируют реполяризацию фазы 3 (обозначены?).
3,1 К
+ каналовK + каналы являются ключевыми регуляторами мембранного потенциала покоя, который регулирует возбудимость, диастолической проводимости, которая влияет на функцию кардиостимуляции, и реполяризации АД, которая определяет продолжительность АД и восприимчивость к различным механизмам аритмии.
3.1.1 Шаб-семья (Kv2)
Первое сообщение о компартментализации кардиальных липидно-микродоменных ионных каналов было для каналов Kv2.1. Kv2.1 локализуется преимущественно во фракции сарколеммы с низкой плавучестью после холодной экстракции 1% Triton X-100, что указывает на закрепление в микродоменах, обогащенных холестерином [30]. Отчетливые паттерны локализации caveolin-1 и Kv2.1 предполагают закрепление в некавеолярных липидных рафтах [30]. Колцемид, который разрушает микротрубочки и вызывает интернализацию кавеолина, не влияет на Kv2.1 локализация, но резко измененная локализация кавеолина-1 [30]. В β-клетках поджелудочной железы разрушение липидного рафта вызывает гиперполяризационный сдвиг инактивации Kv2.1 [31].
3.1.2 Семейство шейкеров (Kv1)
Kv1.5-субъединиц лежат в основе важного реполяризующего тока (I Kur ) в миоцитах предсердий [32]. Функция Kv1.5 регулируется различными ассоциированными белками, включая субъединицы Kvβ [33], белки MAGUK [34,35] и протеинкиназы [36]. Как Kv2.1, Kv1.В нерастворимых фракциях Тритона Х-100 с низкой плотностью обнаружено 5 каналов [24]. В отличие от Kv2.1, локализация Kv1.5 следует за caveolin-1 после индуцированной нарушением микротрубочек кавеолярной интернализации [24]. Обработка MCD немного сдвигает потенциал-зависимую активацию и инактивацию Kv1.5 [24]. Ассоциация белка MAGUK SAP97 с каналами Kv1.5 в липидных рафтах ускоряет инактивацию C-типа. Ускорение инактивации отменяется разрушением липидного рафта с помощью MCD и восстанавливается с помощью замещения холестерина [37].SAP97 действует как каркасный белок, способствуя взаимодействию Kv1.5 с регуляторными белками липидных микродоменов. Комплекс SAP97-кавеолин-3 в клетках COS-7 рекрутирует Kv1.5-субъединицы посредством множественных межбелковых взаимодействий [38]. В миокарде предсердий каналы Kv1.5 локализуются в интеркалированных дисках, в которых отсутствует кавеолин-3. Каналы Kv1.4 также были обнаружены в обогащенных холестерином нерастворимых фракциях Triton X-100 в нейронах и клетках HEK [39], но не в β-клетках поджелудочной железы [31]. Это может быть связано с потребностью в другом белке MAGUK, PSD-95, для Kv1.4 микролокализация [39].
3.1.3 Шал-семья (Kv4)
Kv4.2 / 4.3 является молекулярной основой для Ca 2+ -независимого переходного внешнего тока K + (I — ), который активируется сразу после сердечного АД вверх. Имеются данные о локализации липидного рафта Kv4.2 в головном мозге крыс и трансфицированных клетках HEK 293 [39]. Kv4.2 требует PSD-95 для нацеливания на нерастворимую фракцию Triton X-100. Удаление предполагаемой последовательности, взаимодействующей с PDZ, которая позволяет каналу связываться с белками MAGUK, снижает Kv4.2-канальная локализация липидного рафта [39]. Т.о., др. Белки PDZ-домена могут быть необходимы для локализации липидного рафта Kv4.2. KChIP — хороший кандидат, поскольку KChIP глубоко влияет на внутриклеточный трафик и функцию Kv4.2 [40]. Пальмитоилирование, необходимое для эффективного взаимодействия Kv4.3-KChIP [41], также способствует локализации липидного рафта [4].
3.1.4 Внутреннее выпрямление K
+ каналов3.1.4.1 Kir2
Kir2-субъединиц необходимы для первичной проводимости внутреннего выпрямителя, контролирующей мембранный потенциал покоя в рабочем миокарде.В настоящее время нет биохимических доказательств локализации Kir2 в нерастворимых мембранных фракциях Triton X-100. Однако содержание холестерина в мембране модулирует ток Kir2.1 в эндотелиальных клетках аорты [42]. Повышенный холестерин плазматической мембраны снижает плотность тока Kir2.1, тогда как истощение холестерина увеличивает плотность тока [42]. Одноканальные свойства Kir2.1 не изменяются, это указывает на то, что холестерин модулирует количество активных мембранных каналов Kir2.1 [42].
3.1.4.2 Kir3
субъединиц Kir3 лежат в основе ацетилхолин-зависимого тока, связанного с G-белками, который является ключевым модулятором частоты сердечных сокращений. Субъединицы Kir3.1 совместно преципитируют с Gβγ, PKAc, PP1c и PP2A [43]. Большинство из них локализуются в липидных рафтах [44]. В нейронах и клетках СНО каналы Kir3.1 локализуются во фракциях с низкой плавучестью после экстракции 1% Triton X-100 и разделения в градиенте сахарозы [45].
3.1.4.3 ATP-чувствительный K
+ ток (K ATP )K Каналы ATP служат эндогенными гомеостатическими преобразователями, уравновешивая клеточные ресурсы и метаболические потребности.Сердечные каналы K ATP защищают от метаболического нарушения ишемии и способствуют адаптивным ответам на метаболический стресс [46]. Каналы K ATP регулируют доставку метаболических ресурсов в сосуды [47]. В то время как АТФ-чувствительные каналы K + во взрослом сердце классически состоят из субъединиц Kir6.2 и SUR2A, субъединицы Kir6.1, SUR1 и SUR2B также экспрессируются в сердцах взрослых мышей [48].
β-клетки поджелудочной железы Kir6.2 и SUR1-субъединицы локализуются в объеме плазматической мембраны после экстракции без детергентов и разделения на ступенчатых градиентах сахарозы [31].В гладкомышечных клетках аорты крыс Kir 6.1 совместно локализуется с вышестоящим сигнальным партнером, аденилилциклазой, во фракциях с низкой плавучестью, обогащенных кавеолином, после экстракции без детергентов и разделения в градиенте сахарозы [49]. Кавеолин коиммунопреципитирует с Kir6.1 из артериальных гомогенатов, поддерживая совместную локализацию Kir6.1-кавеолина. Нарушение структуры липидного рафта снижает cAMP-зависимый, протеин-киназный A (PKA) -чувствительный компонент тока K ATP , указывая тем самым, что целостность липидного рафта важна для модуляции каналов, опосредованной аденилилциклазой [49].
3.1.5 Ca
2+ -активированный K + каналовНедавно было показано, что каналы K + с высокой проводимостью, активированные Ca 2+ (K Ca ), вносят вклад в ишемическое прекондиционирование [50,51], прежде всего в ранней триггерной фазе [51]. Нет прямых доказательств локализации канала K Ca в липидных рафтах мембран кардиомиоцитов. PKC ингибирует [52], тогда как PKA активирует [53] каналы K Ca .И PKA, и PKC, по-видимому, локализуются в кавеолах [54,55]. Содержание холестерина в мембране модулирует активацию высокой проводимости K Ca в эпителии толстой кишки [56]. Канал h Slo , молекулярный эквивалент K Ca , обнаружен в нерастворимых фракциях Triton X-100 трансфицированных клеток MDCK [57].
3.1.6 Резюме
Компартментализация сердечных каналов K + иллюстрирует гетерогенность липидного рафта. В то время как некоторые каналы локализуются в кавеолах, другие ассоциируют с др. Подтипами липидных рафтов (Table 3).Эти результаты также указывают на дифференцированное нацеливание функции канала и регулирования. Наконец, некоторые каналы требуют взаимодействия с другими белками, такими как MAGUK, для локализации в микродоменах мембраны.
Таблица 3Сводка по признанной в настоящее время локализации сердечного ионного канала в структурах липидного рафта
| Канал-субъединица . | Расположение мембраны . | Тип клеток изучен . | Список литературы . | ||||
|---|---|---|---|---|---|---|---|
| Kv1.4 | Некавеолярный липидный рафт | НЕК-клетки | [39] | ||||
| Kv1.4 | Объемная плазматическая мембрана | -клетки поджелудочной железы | |||||
| Kv1.5 | Caveolae | L-клетки, кардиомиоциты желудочков | [24,38] | ||||
| Kv1,5 | Некавеолярный липидный слой | Предсердные кардиомиоциты | Kv2.1 | Некавеолярный липидный рафт | L-клетки | [30] | |
| Kv4.2 | Подтип липидных рафтов | HEK-клетки | [39] | ||||
| Kir2.1 обогащенный липидный рафт | Эндотелиальные клетки аорты | [42] | |||||
| Kir3.1 | Подтип липидных рафтов | СНО клетки, нейроны | [45] | ||||
| Kir6.1 липидный рафт | SMC аорты крысы | [49] | |||||
| Kir6.2 | Объемная плазматическая мембрана | Бета-клетки поджелудочной железы | [31] | ||||
| K Ca канал | Подтип липидных рафтов | клетки MDCK | [57] | ||||
| Nav267 Caveolae | Желудочковые миоциты | [14] | |||||
| Cav1.2 | Caveolae | Кардиомиоциты, SMC, бета-клетки поджелудочной железы | [25,31,68,69] | IP-рецептор | Кавеолы | Разные | [77] |
| HCN4 | Кавеолы | Кардиомиоциты синусового узла | [80] | ||||
| Коннексин-43 | клеточныеКаве268 трансфецированные клетки [25,81,82] |
| Канал-подблок . | Расположение мембраны . | Тип клеток изучен . | Список литературы . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Kv1.4 | Некавеолярный липидный рафт | НЕК-клетки | [39] | |||||||
| Kv1.4 | Объемная плазматическая мембрана | -клетки поджелудочной железы | ||||||||
| Kv1.5 | Caveolae | L-клетки, кардиомиоциты желудочков | [24,38] | |||||||
| Kv1.5 | Некавеолярный липидный слой | Кардиомиоциты предсердий | [37] | |||||||
| Kv2.1 | Некавеолярный липидный слой | L-клетки | [30] | |||||||
| НЕК-клетки | [39] | |||||||||
| Kir2.1 | Липидный рафт, обогащенный холестерином | Эндотелиальные клетки аорты | [42] | липид Kir3.1СНО клетки, нейроны | [45] | |||||
| Kir6.1 | Липидные рафты, обогащенные холестерином | SMC аорты крысы | [49] | |||||||
| Kir6.2 | Объемная плазматическая мембрана | Бета-клетки поджелудочной железы | [31] | |||||||
| Подтип липидных рафтов | клеток MDCK | [57] | ||||||||
| Nav1.5 | Caveolae | Желудочковые миоциты | [14] | |||||||
| Cav1.2 | Caveolae | Кардиомиоциты, SMC, бета-клетки поджелудочной железы | [25,31,68,69] | |||||||
| IP3-рецептор | Caveolae | Различный | [77] | Caveolae | Кардиомиоциты синусового узла | [80] | ||||
| Коннексин-43 | Caveolae | Альвеолярные эпителиальные клетки, различные типы трансфицированных клеток | [25,81,82] | 5 Сводная таблица 9355 Сводная таблица
| Канал-субъединица . | Расположение мембраны . | Тип клеток изучен . | Список литературы . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Kv1.4 | Некавеолярный липидный рафт | НЕК-клетки | [39] | |||||||
| Kv1.4 | Объемная плазматическая мембрана | -клетки поджелудочной железы | ||||||||
| Kv1.5 | Caveolae | L-клетки, кардиомиоциты желудочков | [24,38] | |||||||
| Kv1.5 | Некавеолярный липидный слой | Кардиомиоциты предсердий | [37] | |||||||
| Kv2.1 | Некавеолярный липидный слой | L-клетки | [30] | |||||||
| НЕК-клетки | [39] | |||||||||
| Kir2.1 | Липидный рафт, обогащенный холестерином | Эндотелиальные клетки аорты | [42] | липид Kir3.1СНО клетки, нейроны | [45] | |||||
| Kir6.1 | Липидные рафты, обогащенные холестерином | SMC аорты крысы | [49] | |||||||
| Kir6.2 | Объемная плазматическая мембрана | Бета-клетки поджелудочной железы | [31] | |||||||
| Подтип липидных рафтов | клеток MDCK | [57] | ||||||||
| Nav1.5 | Caveolae | Желудочковые миоциты | [14] | |||||||
| Cav1.2 | Caveolae | Кардиомиоциты, SMC, бета-клетки поджелудочной железы | [25,31,68,69] | |||||||
| IP3-рецептор | Caveolae | Различный | [77] | Кавеолы | Кардиомиоциты синусного узла | [80] | ||||
| Коннексин-43 | Кавеолы | Альвеолярные эпителиальные клетки, различные типы трансфицированных клеток | [25,81,82] | -субъединица .Расположение мембраны . | Тип клеток изучен . | Список литературы . | ||||
| Kv1.4 | Некавеолярный липидный рафт | НЕК-клетки | [39] | |||||||
| Kv1.4 | Объемная плазматическая мембрана | -клетки поджелудочной железы | ||||||||
| Kv1.5 | Caveolae | L-клетки, кардиомиоциты желудочков | [24,38] | |||||||
| Kv1.5 | Некавеолярный липидный слой | Кардиомиоциты предсердий | [37] | |||||||
| Kv2.1 | Некавеолярный липидный слой | L-клетки | [30] | |||||||
| НЕК-клетки | [39] | |||||||||
| Kir2.1 | Липидный рафт, обогащенный холестерином | Эндотелиальные клетки аорты | [42] | липид Kir3.1СНО клетки, нейроны | [45] | |||||
| Kir6.1 | Липидные рафты, обогащенные холестерином | SMC аорты крысы | [49] | |||||||
| Kir6.2 | Объемная плазматическая мембрана | Бета-клетки поджелудочной железы | [31] | |||||||
| Подтип липидных рафтов | клеток MDCK | [57] | ||||||||
| Nav1.5 | Caveolae | Желудочковые миоциты | [14] | |||||||
| Cav1.2 | Caveolae | Кардиомиоциты, SMC, бета-клетки поджелудочной железы | [25,31,68,69] | |||||||
| IP3-рецептор | Caveolae | Различный | [77] | Caveolae | Кардиомиоциты синусового узла | [80] | ||||
| Коннексин-43 | Caveolae | Альвеолярные эпителиальные клетки, различные типы трансфицированных клеток | [25,81,82] |
Фаза 0 Na + -поток через потенциалзависимые каналы Na + вызывает активацию и проведение электроимпульсов. Мутации натриевого канала Nav1.5 приводят к аритмическим каннелопатиям, таким как врожденный синдром удлиненного интервала QT, синдром Бругада, нарушения проводимости и внезапная смерть [58].
Симпатическая нервная система модулирует функцию сердечного канала Na + через β-адренергические (βAR) пути [59]. Встречаются как непрямая, PKA-зависимая модуляция, так и прямая модуляция G-белка [60,61].Повышение уровня I Na происходит без изменений характеристик одного канала или зависимой от напряжения активации [59,62], предполагая, что увеличение плотности тока может быть связано с увеличением количества функциональных каналов в сарколемме [59]. Короткие временные рамки увеличения I Na подразумевают быстрое рекрутирование в мембрану каналов Na + , что указывает на субсарколеммальный резервуар. Локализация βARs в сердечных кавеолах [63] и роль липидных рафтов в переносе белков делают их кандидатами на расположение «рекрутируемых» каналов Na + [14].Диализ антител к кавеолину-3 в предсердные миоциты устраняет «прямое» Gαs-индуцированное увеличение I Na , каналы Na + совместно локализуются с Gα во фракции, обогащенной кавеолином-3, и кавеолин-3 соосажден и совместно локализуется с Na + каналами и Gαs-субъединицами [14]. Эти результаты предполагают, что трехкомпонентные кавеолярные комплексы кавеолина-3, каналов Na + и Gαs составляют резервуар функциональных каналов Na + , рекрутируемых активацией βAR, и сайт фосфорилирования каналов Na + с помощью активированной PKA.
3,3 Ca
2+ канала3.3.1 L-тип Ca
2+ каналов и Ca 2+ -выпускных каналовИндуцированное деполяризацией вход Ca 2+ через каналы Ca 2+ L-типа (LTCC) поддерживает плато AP и активирует близлежащие каналы высвобождения Ca 2+ или «рианодиновые рецепторы» (RyRs) в саркоплазматических reticulum (SR), высвобождая Ca 2+ посредством «Ca 2+ -индуцированного высвобождения Ca 2+ » (CICR) [64] и создавая связь возбуждения-сокращения.В кардиомиоцитах LTCC в основном локализованы в сети t-канальцев. Эта локализация глубоко изменена у caveolin-3 null-мышей [65]. Некоторые исследования подтверждают, что кавеолы ответственны за совместную локализацию LTCC / RyR, которая лежит в основе CICR. Эта функция может быть особенно важной в кардиомиоцитах предсердий, у которых тубулярная система менее развита, чем в клетках желудочков. Наиболее эффективным сигналом Ca 2+ для высвобождения SR Ca 2+ может быть временный микродомен высокого [Ca 2+ ] i под отдельными открытыми LTCC [66].Домены с высоким содержанием [Ca 2+ ] и могут быть более легко получены с инвагинированными структурами, такими как кавеолы [67,68], хотя точная роль микродоменной структуры в динамике Ca 2+ требует разъяснения. Истощение холестерина в кардиомиоцитах снижает частоту, амплитуду и ширину Ca 2+ -искр [68]. В β-клетках поджелудочной железы Cav1.2, порообразующая субъединица LTCCs, обнаруживается в мембранных фракциях с низкой плавучестью, обогащенных кавеолином [31]. Более того, α1-цепь предпочтительно обнаруживается в богатых кавеолином нерастворимых детергентом фракциях гладкомышечных клеток и кардиомиоцитов [25,69].
3.3.2 IP
3 рецепторовИнозитол-1,4,5-трифосфатные рецепторы (IP 3 -рецепторы) представляют собой внутриклеточные каналы Ca 2+ , высвобождающие Ca 2+ из саркоплазматического ретикулума. Типы 1 и 2 IP 3 -рецепторы находятся в сердце, преимущественно в предсердиях [70]. Их роль противоречива [71]. IP 3 -зависимый высвобождение Ca 2+ , вероятно, усиливает предсердную сигнализацию Ca 2+ , оказывая положительные инотропные эффекты, и может способствовать развитию Ca 2+ -зависимых предсердных аритмий [72].
IP 3 рецептора взаимодействуют с анкирином-B [73]. Анкирины представляют собой связанные с мембраной адаптерные белки [74], которые связывают другие белки через мембранно-связывающие домены. Мыши с нокаутом Ankyrin-B обнаруживают неправильную локализацию сердечных IP 3 -рецепторов, подтверждая важную роль ankyrin-B в их нацеливании [75]. Мутации анкирина-B вызывают аритмию с синдромом удлиненного QT и внезапную смерть, чему может способствовать дисфункция IP3-рецепторов [76].
IP 3 -рецепторы локализуются в нерастворимых обогащенных кавеолином фракциях Тритона Х-100, а электронная микроскопия локализует IP3-рецепторы в кавеолоподобных инвагинированных структурах [77].Связь между анкирином-B и локализацией липид-микродоменов IP 3 -рецепторов подтверждается следующими данными [78]: в эндотелиальных клетках аорты гиалуронан увеличивает количество рецепторов CD44 в нерастворимых кавеолин-богатых Тритоном X-100 доля. Иммунопреципитация богатой кавеолином фракции приводит к соосаждению анкирин-B, IP 3 -рецепторов и CD44, но в отсутствие гиалуронана ни анкирин-B, ни IP 3 -рецепторы не осаждаются совместно с CD44.Нарушение липидного рафта за счет истощения холестерина ингибирует ассоциацию рецептора IP 3 с кавеолами и подавляет передачу сигналов Ca 2+ . Таким образом, физическая ассоциация между CD44-содержащими липидными рафтами и IP 3 -рецепторами может быть важной для запуска высвобождения Ca 2+ из внутренних хранилищ.
3.4 Активируемые гиперполяризацией каналы связывания циклических нуклеотидов (HCN)
Неселективный катионный ток, активируемый гиперполяризацией, сначала названный «смешным током» или I f , как полагают, играет важную роль в автоматизме сердца.I f переносится субъединицами HCN, при этом HCN4 особенно важен в сердце [1]. Функция субъединицы HCN4 точно контролируется βAR и мускарино-холинергической регуляцией. Большинство белков βAR-пути локализованы в липидных рафтах, а кардиомиоциты синусового узла богаты кавеолами [79]. Субъединицы HCN4 обнаруживаются во фракциях низкой плотности кардиомиоцитов синусового узла, содержащих флотилин и кавеолин [80]. Нарушение липидного рафта изменяет локализацию субъединицы HCN4, сдвигает I f -активацию в направлении деполяризации и снижает дезактивацию, ускоряя диастолическую деполяризацию и частоту сердечных сокращений [80].
3,5 Коннексины
Миоциты связаны щелевыми контактами, образуя электрически непрерывный синцитий, который обеспечивает распространение AP. Щелевые соединения содержат белки коннексина гемиканалов, которые поддерживают их электрическую функцию. Кардиомиоциты активно регулируют свое сцепление путем изменения экспрессии коннексина, регуляции транспорта и оборота коннексина, а также модуляции свойств канала коннексина [81].
Коннексин-43, основная сердечная изоформа, совместно локализуется с кавеолином-1 в нерастворимых фракциях Тритона Х-100 с низкой плавучестью и коиммунопреципитатах с кавеолином-1 [25,81,82].Кавеолин не обнаруживается в интеркалированных дисках миокарда, поэтому другие структуры липидного рафта могут продуцировать локализацию коннексина-43 в микродоменах интеркалированного диска in vivo [83,84]. Белок MAGUK ZO-1, главный белок, взаимодействующий с коннексином, обеспечивает доставку коннексина-43 из доменов липидного рафта в пластинки щелевых соединений [85]. Существует повышенная ассоциация ZO-1 с коннексином-43 во время ремоделирования сердечного щелевого соединения [86].
4 липидных рафта как каркас для регуляции ионных каналов
Биофизические свойства ионных каналов определяются их трехмерной структурой и связанными взаимодействиями с регуляторными белками.Структуры, которые включают субъединицы каналов и регуляторные белки, получили название «каннелосомы». Структура каннелосомы зависит от микродоменов, в которые входят белковые составляющие. Белки MAGUK, по-видимому, имеют решающее значение в формировании каннелосом. В то время как PSD-95 необходим для локализации Kv1.4 в липидных рафтах, SAP-97 выполняет аналогичную роль для Kv1.5 [37-39]. SAP-97 и PSD-95 также входят в состав Kir2-содержащих комплексов. [87]. Эти белки могут связываться с другими каркасными белками, такими как CASK, Veli и Mint, образуя каркас архитектуры каннелосом [88–90].CASK присутствует в липидных рафтах, и мультипротеиновый комплекс SAP97 / CASK / Veli / Mint1 важен для транспортировки и локализации на плазматической мембране каналов Kir2 [87,91]. CASK взаимодействует с каналом Ca 2+ N-типа [92]. Такие белки связываются непосредственно с ионными каналами, предлагая белковые связывающие поверхности, такие как PDZ-домены, и рекрутируя регуляторные белки во внутриклеточные сайты [93]. Напр., SAP-97 способствует ассоциации Kvβ-Kv1.5 в липидных рафтах, увеличивая инактивацию C-типа [37]. Kvβ может также рекрутировать PKC в комплекс каналов, взаимодействуя с PKCζ-взаимодействующим (ZIP) белком [94].SAP-97 и PSD95 также связывают активированную Ca 2+ кальмодулин-киназу типа II (CAMKII) [95,96], которая регулирует многочисленные ионные каналы в зависимости от внутриклеточной концентрации Ca 2+ . Большинство каналов, регулируемых с помощью CAMKII, локализуются в липидных рафтах, включая каналы Kv1.5, Na + , LTCCs и IP 3 -рецепторы [97-102], а CAMKII локализуется в липидных рафтах [103,104].
PSD-95 и SAP-97 также связывают заякоренные белки А-киназы (AKAP), которые локализуют PKA в непосредственной близости от ионных каналов.PKA обнаруживается в липидных рафтах [105,106]. KCNQ1, порообразующая субъединица сердечного реполяризующего тока I Ks , ассоциирует как с PKA, так и с протеин-фосфатазой 1 (PP1) через белок yotiao, способствуя симпатической регуляции [107]. Взаимодействие AKAP с PKA необходимо для цАМФ-зависимой регуляции LTCC [108]. AKAPs взаимодействуют с β 2 AR, способствуя локализации β 2 -адренергического пути в каннелосомах [109]. Стимуляция АР β 2 увеличивает сократительную способность сердца без глобального увеличения цАМФ [110], предполагая, что LTCC и путь трансдукции АР β 2 разделяют привилегированное сигнальное микроокружение.LTCCs совместно собираются с β 2 ARs, G αs , аденилилциклазой, PKA и фосфатазой – PP2A [111]. Во взрослых кардиомиоцитах β 2 AR обнаруживаются исключительно во фракциях с низкой плавучестью, обогащенных кавеолином-3, вместе с Gα и аденилилциклазой [112].
5 Взаимодействие с белками цитоскелета
каналов Kir2 связаны с дистрофин-ассоциированным белковым комплексом (DAPC) [87]. DAPC образует структурную связь между актиновым цитоскелетом и внеклеточным матриксом и особенно распространен в мышечных клетках [113].Caveolin-3 нулевые мыши обнаруживают важные изменения в распределении DAPC и аномалии t-канальцев [65]. Кавеолин-3 связывается с дистрофином и взаимодействует непосредственно с С-концевым хвостом β-дистрогликана, части DAPC [114]. Дистрогликан также регулирует распределение кавеолина-3 [115]. У мышей mdx , дефицитных по дистрофину [116], мини-дистрофин восстанавливает ток LTCC в миоцитах скелетных мышц, предполагая, что дистрофин влияет на LTCC [117]. Дистрофин и α-актинин регулируют кавеолы, прикрепляя их к актиновому цитоскелету.Каналы Na + , которые локализуются в кавеолах t-канальцев кардиомиоцитов, специфически взаимодействуют с синтрофином, другим конститутивным белком DAPC [118].
N-кадгерин и катенины в основном обнаруживаются во фракциях с низкой плавучестью плазматических мембран миобластов [119]. SAP97, который локализуется совместно с каналами Kv1.5 на интеркалированном диске, также связывает кадгерин [34,37]. Коннексин-43, который обнаружен в липидных рафтах интеркалированного диска, также связан с мультибелковым комплексом N-кадгерин.Экспрессия коннексина-43 на клеточной поверхности требует N-кадгерина и наоборот [120].
6 Патофизиологические последствия
Структурное ремоделирование кавеол происходит при сердечных патологиях. Распределение кавеолина-3 в сердце резко изменяется при сердечной недостаточности с увеличением доли кавеолина-3 во фракции, растворимой в детергенте [121]. Мыши с нокаутом по Caveolin-3 обнаруживают прогрессирующую кардиомиопатию с гипертрофией, дилатацией и сниженным фракционным укорочением [122].Сверхэкспрессия кавеолина-3 вызывает сердечную дегенерацию, фиброз и нарушение сердечной функции, наряду с подавлением DAPC [123]. ПНП обнаружен в кавеолах кардиомиоцитов крысы [124]. ANP модулирует гипертрофию и ремоделирование сердца; Дефицит ANP усиливает гипертрофию и ремоделирование после перегрузки давлением [125]. ANP связывается с кавеолярными рецепторами ANP B-типа, которые обладают гуанилилциклазной активностью. Образование цГМФ приводит к активации цГМФ-зависимой киназы, которая может ингибировать активность LTCC и тем самым снижать сократительную способность [124].Кроме того, ANP модулирует I f в кардиомиоцитах предсердий человека [126]. Таким образом, целостность кавеол может быть важна для адаптации миокарда к механической перегрузке. Липидные рафты и кавеолы сильно подвержены механическим воздействиям. Механическая перегрузка также может вызывать слияние мембран кавеол [127].
Статины, которые непосредственно действуют на путь синтеза холестерина, широко используются для профилактики сердечно-сосудистых заболеваний. Недавние исследования показали, что терапия статинами влияет на оборот кавеол, ограничивая их эндоцитоз [128].Также было показано, что аторвастатин модулирует обогащение холестерина липидными рафтами [129]. Таким образом, многие эффекты этих молекул могут быть связаны с модификацией липидного рафта.
Учитывая данные о локализации ионных каналов в липидных рафтах, патологические изменения в структурах и распределении липидных рафтов могут лежать в основе дисфункции ионных каналов и связанных с ними аритмий при таких состояниях, как гипертония, диабет, ишемическая болезнь сердца и сердечная недостаточность.
7 Выводы
Липидные рафты представляют собой динамические платформы, которые плавают в мембранах кардиомиоцитов.Обогащенные сигнальными молекулами и регуляторными белками ионных каналов, различные формы липидных рафтов демонстрируют различные белковые популяции и механизмы прикрепления к мембране. Таким образом, они могут активно участвовать в дифференциальном нацеливании и регуляции ионных каналов кардиомиоцитов. В настоящее время мало что известно о роли липидных рафтов в сердечной дисфункции и аритмии. Последние технические достижения помогут глубже понять эти важные мембранные структуры и их роль в сердечном здоровье и болезнях.
Благодарности
При поддержке Канадских институтов исследований в области здравоохранения.
Список литературы
[1]Дисфункция синусового узла и ремоделирование субъединиц канала, активируемого гиперполяризацией (HCN) в модели сердечной недостаточности у собак
Cardiovasc Res
2005
66
472
481
[2]Структура и происхождение упорядоченных липидных доменов в биологических мембранах
J Membr Biol
1998
164
103
114
[3]Липосомология
Prog Lipid Res
2000
39
1
2
[4]Липидные рафты: неоднородность в открытом море
Biochem J
2004
378
281
292
[5]Домены и рафты в липидных мембранах
Angew Chem Int Ed Engl
2003
42
5802
5827
[6]Ассоциация липидных рафтов и белков и регуляция активности белка
Arch Biochem Biophys
2004
426
208
224
[7]Разделение модифицированных липидами мономерных GFP на мембранные микродомены живых клеток
Наука
2002
296
913
916
[8]Плацентарная щелочная фосфатаза эффективно нацеливается на рафты в поддерживаемых липидных бислоях
Дж Biol Chem
2002
277
26966
26970
[9]Сравнение трансмембранных доменов белков Гольджи и плазматической мембраны
Biochem Soc Trans
1995
23
527
530
[10]Исследование структуры митохондрий с помощью электронного микроскопа
J Histochem Cytochem
1953
1
188
211
[11]VIP21 / кавеолин представляет собой холестерин-связывающий белок
Proc Natl Acad Sci U S A
1995
92
10339
10343
[12]и другие.
Молекулярное клонирование кавеолина-3, нового члена семейства генов кавеолина, экспрессируемого преимущественно в мышцах
Дж Biol Chem
1996
271
2255
2261
[13]и другие.
Экспрессия кавеолина-3 в клетках скелета, сердца и гладких мышц. Кавеолин-3 является компонентом сарколеммы и совместно фракционируется с дистрофином и гликопротеинами, ассоциированными с дистрофином
Дж Biol Chem
1996
271
15160
15165
[14]Локализация сердечных натриевых каналов в богатых кавеолином мембранных доменах: регуляция амплитуды натриевого тока
Circ Res
2002
90
443
449
[15]и другие.
Фосфатидилинозитол-4,5-бисфосфат индуцирует основанное на актине движение везикул, обогащенных рафтом, через WASP-Arp2 / 3
Curr Biol
2000
10
311
320
[16]Устойчивость клеточных мембран к разным детергентам
Proc Natl Acad Sci U S A
2003
100
5795
5800
[17]Использование моющих средств для изучения мембранных плотов: хорошее, плохое и уродливое
Biol Chem
2003
384
1259
1263
[18]Упрощенный способ приготовления липидных рафтов без детергентов
J Lipid Res
2005
46
1061
1067
[19]Мониторинг организации холестерина в мембранах при низких концентрациях с использованием метода селективной по длине волны флуоресценции
Химическая физика липидов
2005
134
79
84
[20]и другие.
Распределение и транспорт богатых холестерином мембранных доменов, контролируемых непроницаемым для мембран флуоресцентным холестерином, дериватизированным полиэтиленгликолем
Дж Biol Chem
2004
279
23790
23796
[21]Лисенин: новый инструмент для исследования липидной организации мембран
Anat Sci Int
2004
79
184
190
[22]Липидные домены, обогащенные холестерином, могут быть визуализированы с помощью ди-4-ANEPPDHQ с помощью линейной и нелинейной оптики
Biophys J
2005
89
L04
L06
[23]Четкие структурные требования для кластеризации и иммобилизации K + каналов с помощью PSD-95
J Gen Physiol
1999
113
71
80
[24]Специфическая для изоформы локализация потенциал-управляемых K + -каналов в различных популяциях липидных рафтов.Нацеливание Kv1.5 на кавеолы
Дж Biol Chem
2001
276
8409
8414
[25]Локализация ионных каналов в доменах липидного рафта в сердечно-сосудистой системе
Trends Cardiovasc Med
2004
14
37
42
[26]Кавеолы представляют собой крайне неподвижные микродомены плазматической мембраны, которые не участвуют в конститутивном эндоцитарном переносе
Клетка Mol Biol
2002
13
238
250
[27]и другие.
Динамика предполагаемых raft-ассоциированных белков на поверхности клетки
J Cell Biol
2004
165
735
746
[28]и другие.
Отток холестерина из клеток, опосредованный циклодекстринами
Дж Biol Chem
1995
270
17250
17256
[29]Кавеолы, DIG и динамика сфинголипид-холестериновых микродоменов
Curr Opin Cell Biol
1997
9
534
542
[30]и другие.
Дифференциальное нацеливание шейкерных калиевых каналов на липидные рафты
Дж Biol Chem
2000
275
7443
7446
[31]и другие.
Разрушение липидных рафтов бета-клеток поджелудочной железы изменяет закрытие канала Kv2.1 и экзоцитоз инсулина
Дж Biol Chem
2004
279
24685
24691
[32]Антисмысловые олигодезоксинуклеотиды, направленные против Kv1.5 мРНК специфически ингибирует сверхбыстрый ток K + выпрямителя замедленного действия в культивируемых миоцитах предсердий взрослого человека
Circ Res
1997
80
572
579
[33]Функциональные различия в токах Kv1.5, экспрессируемых в линиях клеток млекопитающих, обусловлены присутствием эндогенных субъединиц Kv beta 2.1
Дж Biol Chem
1996
271
2406
2412
[34]и другие.
Экспрессия, регуляция и роль белка MAGUK SAP-97 в миокарде предсердий человека
Cardiovasc Res
2002
56
433
442
[35]Различные изоформы синапс-ассоциированного белка SAP97 экспрессируются в сердце и оказывают различное влияние на потенциал-зависимый K + канал Kv1.5
Дж Biol Chem
2003
278
47046
47052
[36]Модуляция человеческого Kv1.5 канал активации протеинкиназы C: роль субъединицы Kvbeta1.2
J Pharmacol Exp Ther
2002
302
545
550
[37]Целостность микродомена липидного рафта важна для свойств тока калия в миокарде предсердий
Тираж
2004
110
61
[38]Caveolin-3 и SAP97 образуют каркасный белковый комплекс, который регулирует потенциал-зависимый калиевый канал Kv1.5
Am J Physiol Heart Circ Physiol
2004
287
H681
H690
[39]Дифференциальное привлечение Kv1.4 и Kv4.2 к липидным рафтам с помощью PSD-95
Дж Biol Chem
2004
279
444
452
[40]и другие.
Фундаментальная роль KChIPs в определении молекулярных свойств и транспортировки Kv4.2 калиевых канала
Дж Biol Chem
2003
278
36445
36454
[41]Пальмитоилирование вариантов сплайсинга KChIP необходимо для эффективной экспрессии на клеточной поверхности каналов Kv4.3
Дж Biol Chem
2002
277
26904
26911
[42]Модуляция тока K + эндотелиального внутреннего выпрямителя оптическими изомерами холестерина
Biophys J
2002
83
3211
3222
[43]Координация возбудимости мембраны с помощью сигнального комплекса GIRK1 в предсердиях
Дж Biol Chem
2004
279
23630
23636
[44]и другие.
Кавеолы и липидные рафты: сигнальные микродомены g-белковых рецепторов в сердечных миоцитах
Ann NY Acad Sci
2005
1047
166
172
[45]и другие.
Молекула адгезии нервных клеток регулирует доставку на клеточную поверхность активированного G-белком, вовнутрь выпрямляющих калиевые каналы через липидные рафты
J Neurosci
2002
22
7154
7164
[46]Сарколеммальный КАТФ-канал запускает отсроченное ишемическое прекондиционирование у крыс
Am J Physiol Heart Circ Physiol
2005
288
х545
h547
[47]Физиологическая и патофизиологическая роль АТФ-чувствительных K + каналов
Прог Биофиз Мол Биол
2003
81
133
176
[48] и другие.
Иммунолокализация субъединиц канала КАТФ в сердечных миоцитах мышей и крыс и в коронарной сосудистой сети
BMC Physiol
2005
5
1
[49]Кавеолы локализуют передачу сигналов протеинкиназы А в артериальные АТФ-чувствительные калиевые каналы
Circ Res
2004
95
1012
1018
[50]Калиевый канал, активируемый кальцием, запускает кардиопротекцию ишемического прекондиционирования
J Pharmacol Exp Ther
2005
312
644
650
[51]и другие.
Открытие Са2 + -активированных K + каналов участвует в ишемическом прекондиционировании в сердцах собак
J Mol Cell Cardiol
2004
37
1213
1218
[52]Протеинкиназа C снижает ток KCa гладкомышечных клеток хвостовой артерии крысы
Am J Physiol
1999
276
C648
C658
[53]Регулирование Ca (2 +) — активированных K + каналов с помощью протеинкиназы A и ингибиторов фосфатазы
Am J Physiol
1991
261
C387
C392
[54]Истощение запасов холестерина разрушает липидные рафты и модулирует активность множества сигнальных путей в Т-лимфоцитах
евро J Immunol
2000
30
954
963
[55]Два различных домена кавеолина-1 опосредуют функциональное взаимодействие кавеолина-1 с протеинкиназой А
Am J Physiol Cell Physiol
2001
281 ‘
C1241
C1250
[56]Содержание холестерина в мембране модулирует активацию BK-каналов в эпителии толстой кишки
Biochim Biophys Acta
2004
1667
241
248
[57]и другие.
Апикальная сортировка потенциал- и Ca2 + -активированной альфа-субъединицы K + канала в клетках почек собак Madin – Darby не зависит от N-гликозилирования
Proc Natl Acad Sci U S A
2000
97
13114
13119
[58]Генетический контроль функции натриевых каналов
Cardiovasc Res
2003
57
961
973
[59]Модуляция сердечного натриевого канала крысы с помощью стимулирующей альфа-субъединицы G-белка
J Physiol
1999
518
Пт 2
371
384
[60]Механизм цАМФ-зависимой модуляции кинетики тока натриевых каналов сердца
Circ Res
1993
72
807
815
[61]Активация протеинкиназы А модулирует трафик сердечного натриевого канала человека в ооцитах Xenopus
Circ Res
2000
87
33
38
[62]Усиление натриевых каналов сердца кроликов с помощью бета-адренергической стимуляции
Circ Res
1992
70
199
207
[63]Дифференциальное нацеливание подтипов бета-адренергических рецепторов и аденилатциклазы на кавеолы кардиомиоцитов.Механизм функциональной регуляции сигнального пути цАМФ
Дж Biol Chem
2000
275
41447
41457
[64]Макромолекулярные комплексы, регулирующие функцию сердечных рецепторов рианодина
J Mol Cell Cardiol
2004
37
417
429
[65]и другие.
Нулевые по Caveolin-3 мыши демонстрируют потерю кавеол, изменения в распределении микродоменов комплекса дистрофингликопротеинов и аномалии t-канальцев
Дж Biol Chem
2001
276
21425
21433
[66]Локальные переходные процессы кальция, вызванные одиночным током кальциевого канала L-типа в сердечных клетках
Наука
1995
268
1042
1045
[67]и другие.
Утрата кавеол, сосудистая дисфункция и легочные дефекты у мышей с нарушенным геном кавеолина-1
Наука
2001
293
2449
2452
[68]и другие.
Воспламенение кальциевых искр в артериальной и сердечной мышце через кавеолы
Circ Res
2001
87
1034
1039
[69]Кавеолы из гладкой мускулатуры дыхательных путей собаки содержат компоненты, необходимые для обработки Ca (2+)
Am J Physiol Lung Cell Mol Physiol
2000
279
L1226
L1235
[70]и другие.
Функциональные рецепторы InsP3, которые могут модулировать связь возбуждения и сокращения в сердце
Curr Biol
2000
10
939
942
[71]Локальные градиенты кальция во время взаимодействия возбуждения и сокращения и альтернативы в миоцитах предсердий
J Physiol
2003
546
19
31
[72]и другие.
Повышающая регуляция экспрессии инозитол-1,4,5-трифосфатного рецептора в ткани предсердий у пациентов с хронической фибрилляцией предсердий
Дж Кардиол
2002
39
57
58
[73]Для локализации и стабильности инозитол-1,4,5-трифосфатного рецептора в кардиомиоцитах новорожденных необходимо взаимодействие с анкирином-B
Дж Biol Chem
2004
279
12980
12987
[74]Анкирины и клеточное нацеливание различных мембранных белков на физиологические участки
Curr Opin Cell Biol
2001
13
61
67
[75]Анкирин-B необходим для внутриклеточной сортировки структурно разнообразных белков гомеостаза Ca2 +
J Cell Biol
1999
147
995
1008
[76]и другие.
Мутация анкирина-B вызывает сердечную аритмию с длинным QT типа 4 и внезапную сердечную смерть
Природа
2003
421
634
639
[77]Инозитол-1,4,5-трифосфатный рецептор-подобный белок в кавеолах плазмалеммы связан с актиновыми филаментами
J Cell Sci
1995
108
Пт 1
7
15
[78]Взаимодействие CD44 с анкирином и рецептором IP3 в липидных рафтах способствует передаче сигналов Са2 +, опосредованной гиалуронаном, что приводит к продукции оксида азота, адгезии и пролиферации эндотелиальных клеток
Exp Cell Res
2004
295
102
118
[79]Пиноцитотическая функция мембранных везикул или кавеол в клетках сердечной мышцы
Adv миокардиол
1980
1
23
31
[80]Локализация пейсмекерных каналов в липидных рафтах регулирует кинетику каналов
Circ Res
2004
94
1325
1331
[81]Члены семейства коннексинов нацелены на домены липидного рафта и взаимодействуют с кавеолином-1
Биохимия
2002
41
5754
5764
[82]и другие.
Распределение кавеолина-1 и коннексина 43 в нормальных и поврежденных клетках альвеолярного эпителия R3 / 1
Histochem Cell Biol
2005
123
239
247
[83]Биохимическое рассечение интеркалированного диска сердца: выделение субклеточных фракций, содержащих адгезивные фасции и щелевые соединения
J Cell Sci
1981
52
313
325
[84]Холестерин плазматических мембран в мышцах миокарда и эндотелиальных клетках капилляров.Распределение деформаций, вызванных филиппинами, при замораживании-переломе
евро J Cell Biol
1981
25
289
299
[85]ZO-1 изменяет локализацию плазматической мембраны и функцию Сх43 в остеобластических клетках
J Cell Sci
2005
118
2167
2176
[86]Повышенная совместная локализация коннексина 43 и ZO-1 в диссоциированных взрослых миоцитах
Cell Commun Adhes
2001
8
205
208
[87]и другие.
Белковые комплексы переноса и якоря, выявленные протеомным анализом белков, ассоциированных с внутренним выпрямительным калиевым каналом (Kir2.x)
Дж Biol Chem
2004
279
22331
22346
[88]Новый и консервативный домен белок-белкового взаимодействия Lin-2 / CASK млекопитающих связывает и рекрутирует SAP97 на латеральную поверхность эпителия
Mol Cell Biol
2002
22
1778
1791
[89]и другие.
Специфичное для типа клеток рекрутирование Drosophila Lin-7 в отдельные белковые комплексы на основе MAGUK определяет новые роли для Sdt и Dlg-S97
J Cell Sci
2004
117
1899
1909
[90]CASK и Dlg образуют белковый комплекс PDZ в нервно-мышечном соединении у млекопитающих
Мышечный нерв
2004
30
164
171
[91]Мультибелковый транспортный комплекс, состоящий из SAP97, CASK, Veli и Mint1, связан с внутренними калиевыми каналами выпрямителя Kir2
Дж Biol Chem
2004
279
19051
19063
[92]Ассоциация нейронных кальциевых каналов с модульными адапторными белками
Дж Biol Chem
1999
274
24453
24456
[93]PDZ-содержащие белки: альтернативный сплайсинг как источник функционального разнообразия
Brain Res Brain Res Rev
2004
47
105
115
[94]ZIP3, новый вариант сплайсинга семейства PKC-zetaintecting белков, связывается с рецепторами GABAC, PKC-zeta и Kv beta 2
Дж Biol Chem
2003
278
6128
6135
[95]Идентификация белковых субстратов Ca (2 +) / кальмодулин-зависимой протеинкиназы II по постсинаптической плотности с помощью секвенирования белков и масс-спектрометрии
Biochem Biophys Res Commun
2002
290
948
954
[96]Фосфорилирование кальций / кальмодулин-зависимой протеинкиназы II направляет связанный с синапсом белок 97 в шипы
Дж Biol Chem
2004
279
23813
23821
[97]и другие.
Регулирование транзиторного наружного тока K (+) с помощью Ca (2 +) / кальмодулин-зависимых протеинкиназ II в миоцитах предсердий человека
Circ Res
1999
85
810
819
[98]Регулирование каналов Na (+) кальмодулинкиназой II в гранулярных клетках мозжечка крыс
Biochem Biophys Res Commun
2000
274
394
399
[99]Фосфорилирование Са2 + / кальмодулин-зависимой протеинкиназы II регулирует сердечные рианодиновые рецепторы
Circ Res
2004
94
e61
e70
[100]Сердечный инозитол-1,4,5-трифосфатный рецептор 2 типа: взаимодействие и модуляция кальций / кальмодулин-зависимой протеинкиназой II
Дж Biol Chem
2005
280
15912
15920
[101]и другие.
Регулирование токов Kv4.3 Ca2 + / кальмодулин-зависимой протеинкиназой II
Am J Physiol Cell Physiol
2005
288
C304
C313
[102]и другие.
Стимуляция альфа1-адренорецепторов усиливает ток Ca2 + L-типа за счет активации Ca2 + / кальмодулин-зависимой PK II (CaMKII) в миоцитах желудочков крыс
Proc Natl Acad Sci U S A
2005
102
9400
9405
[103]Кальций / кальмодулин-зависимая протеинкиназа II (CaMKII) действует совместно с нацеливанием на субстрат, создавая пространственное ограничение для фосфорилирования
Дж Biol Chem
2005
280
9210
9216
[104]и другие.
Белок BAALC 1-6-8 нацелен на постсинаптические липидные рафты за счет своего N-концевого миристоилирования и пальмитоилирования и взаимодействует с альфа, но не с бета субъединицей Са / кальмодулин-зависимой протеинкиназы II
J Neurochem
2005
92
647
659
[105]Нацеливание PKA на рецепторы глутамата через комплекс MAGUK-AKAP
Нейрон
2000
27
107
119
[106]Локальные эффекты цАМФ, опосредованные различными путями протеинкиназы A
Physiol Ред.
2004
84
137
167
[107]Фосфорилирование AKAP Yotiao способствует регуляции PKA калиевого канала сердца
Дж Biol Chem
2005
[108]и другие.
цАМФ-зависимая регуляция сердечных Са2 + -каналов L-типа требует нацеливания на мембрану PKA и фосфорилирования субъединиц канала
Нейрон
1997
19
185
196
[109]и другие.
Новый заякоренный липидом белок, заякоренный А-киназой, способствует цАМФ-чувствительным мембранным событиям
EMBO J
1998
17
2261
2272
[110]Муфта возбуждения-сокращения сердца
Природа
2002
415
198
205
[111]Белковая фосфатаза 2A связана с кальциевыми каналами L-типа класса C (Cav1.2) и противодействует фосфорилированию каналов цАМФ-зависимой протеинкиназой
Дж Biol Chem
2000
275
39710
39717
[112]и другие.
Компоненты передачи сигналов рецептора, сопряженного с G-белком, локализуются как в сарколеммальных, так и в внутриклеточных микродоменах, связанных с кавеолин-3, в сердечных миоцитах взрослых
Дж Biol Chem
2005
280
31036
31044
[113]Сборка дистрофин-ассоциированного белкового комплекса не требует концевого домена COOH дистрофина
J Cell Biol
2000
150
1399
1410
[114]и другие.
Кавеолин-3 напрямую взаимодействует с С-концевым хвостом бета-дистрогликана. Идентификация центрального WW-подобного домена у членов семейства кавеолинов
Дж Biol Chem
2000
275
38048
38058
[115]Дистрогликан не требуется для локализации дистрофина, синтрофина и нейрональной синтазы оксида азота в сарколемме, но регулирует экспрессию интегрина альфа 7B и распределение кавеолина-3
Дж Biol Chem
2002
277
4672
4679
[116]и другие.
Диафрагма мыши MDX воспроизводит дегенеративные изменения мышечной дистрофии Дюшенна
Природа
1991
352
536
539
[117]Мини-дистрофин восстанавливает токи кальция L-типа в скелетных мышцах трансгенных мышей MDX
J Physiol
2004
555
251
265
[118]и другие.
Специфические взаимодействия между PDZ-доменом синтрофина и потенциал-зависимыми натриевыми каналами
Nat Struct Biol
1998
5
19
24
[119]Ассоциация N-кадгерина с липидными рафтами регулирует его динамическую сборку на межклеточных соединениях в миобластах C2C12
Клетка Mol Biol
2005
16
2168
2180
[120]Коннексин 43, связанный с N-кадгерин-содержащим мультибелковым комплексом, необходим для образования щелевых соединений в клетках NIh4T3
Дж Biol Chem
2005
280
19925
19936
[121]и другие.
Диссоциация кавеолин-1 и -3 от кавеол до цитозоля в сердце во время старения и после инфаркта миокарда у крыс
Cardiovasc Res
2003
57
358
369
[122]и другие.
У мышей с нокаутом Caveolin-3 развивается прогрессирующая кардиомиопатия и наблюдается гиперактивация каскада p42 / 44 MAPK
Дж Biol Chem
2002
277
38988
38997
[123]и другие.
Трансгенная сверхэкспрессия кавеолина-3 в сердце индуцирует кардиомиопатический фенотип
Hum Mol Genet
2003
12
2777
2788
[124]Рецептор предсердного натрийуретического пептида типа B в кавеолах сердечных миоцитов
Circ Res
1997
81
86
91
[125]и другие.
Предсердный натрийуретический пептид дозозависимо подавляет ремоделирование сердца, вызванное перегрузкой давлением
Гипертония
2004
44
746
750
[126]и другие.
Натрийуретический пептид предсердий модулирует ток, активируемый гиперполяризацией (If) в миоцитах предсердий человека
Cardiovasc Res
2004
63
528
536
[127]Влияние манипуляции острым желудочковым объемом на конфигурацию клеточной мембраны кардиомиоцитов in situ
Прог Биофиз Мол Биол
2003
82
221
227
[128]и другие.
Повышение экспрессии и активации фосфолипазы d при гипертрофии желудочкового давления с перегрузкой
J Pharmacol Sci
2005
98
244
254
[129]Аторвастатин влияет на передачу сигналов интерлейкина-2, изменяя обогащение липидным рафтом бета-цепи рецептора интерлейкина-2
J Investig Med
2005
53
322
328
Заметки автора
Авторские права © 2005, Европейское общество кардиологов
Функциональная геномика генов сердечных ионных каналов | Сердечно-сосудистые исследования
Аннотация
Ионные каналы представляют собой совокупность специализированных мембранных белков, которые действуют согласованно, создавая и модулируя электрическую активность многих возбудимых клеток, включая сердечные миоциты.После завершения секвенирования различных геномов, в том числе человеческого, был выяснен полный репертуар генов ионных каналов для различных видов. То, как транскрипты, полученные из этой коллекции генов, экспрессируются и модулируются в зависимости от различных физиологических и патологических ситуаций, является предметом функциональной или физиологической геномики. Специализированные микрочипы (IonChips), содержащие зонды для ансамбля ионных каналов и регуляторных генов, были разработаны в качестве альтернативы чипам полногеномной ДНК.Физиологическая геномика генов сердечных ионных каналов — это растущая область, которая, в сочетании с генетикой, должна значительно улучшить наше понимание молекулярных механизмов, ведущих к аритмиям.
1. Введение
Завершение секвенирования различных геномов, включая человеческий и мышиный, привело к выяснению полного репертуара генов ионных каналов. Клеточные электрофизиологи теперь осведомлены об ансамбле белков ионных каналов, которые взаимодействуют друг с другом, чтобы создать электрическую активность — центральную функцию возбудимых клеток.Таким образом, они достигли своего стремления понять систему с помощью познаваемого ядра информации.
Развивающаяся область геномики основана на нашей способности получать большие комплексные наборы данных о генах (влажные лабораторные исследования) и компьютерно анализировать эту информацию (сухие лабораторные исследования) в поисках тонких взаимосвязей между генами. Экспрессионная геномика описывает исследование транскрипции для всего генома и включает исследование регуляции генов [1]. Функциональная или физиологическая геномика стремится связать экспрессию транскрипта с функцией. Включение или выключение гена в другое время или в другом месте — это адаптивный и скоординированный ответ организма на новую физиологическую или патологическую среду. Геномика экспрессии возникла на основе недавно изобретенной технологии, генного чипа или ДНК-микрочипа, которая позволяет изучать экспрессию тысяч генов одновременно. По своей сути, микроматрица ДНК использует уникальную особенность ДНК, известную как комплементарная гибридизация.По сути, он не отличается от саузерн-блоттинга или Нозерн-блоттинга, за тем исключением, что он позволяет профилировать экспрессию всего генома человека в одном эксперименте по гибридизации.
Применение геномики к области ионных каналов, набора функционально связанных белков, уже предоставило важную информацию о том, как их транскрипты регионально экспрессируются и как они регулируются лекарствами или болезнями в контексте хорошо зарекомендовавшей себя клеточной функция.Дальнейшие исследования, безусловно, позволят изучить, как эта генная сеть динамически регулируется в кластерах. В конечном итоге геномика экспрессии ионных каналов должна быть интегрирована в математические модели электрической активности клетки [2]. Затем профиль экспрессии сердечных ионных каналов можно интерпретировать по отношению к ЭКГ на поверхности тела с помощью математических моделей сердца, которые включают пространственное распределение сердечных ионных каналов по миокарду для каждого из примерно 70 типов ионных каналов, которые, как известно, экспрессируются. в сердце.
2. Пангеномные и специализированные микроматрицы
2.1. Пангеномные микрочипы
ДНК-чип или микроматрица — это прочная подложка, на которой с помощью роботов наносятся (или синтезируются in situ) на сетке фрагменты кДНК различных генов (называемые зондами). Принцип экспериментов с ДНК-чипами основан на гибридизации между этими зондами и сложной смесью комплементарных последовательностей кДНК (называемых мишенями; помеченных флуоресцентными зондами, обычно Cy3 и Cy5), представляющих транскрипты РНК, выделенные из образца ткани.Интенсивность гибридизационного сигнала, измеренная в каждой точке, связана с соответствующим содержанием транскриптов РНК в образце ткани. Стандартный эксперимент с ДНК-чипом направлен на определение того, одинаково или по-разному экспрессируются гены в тестируемых и контрольных образцах РНК. Обычно две мишени (например, одна помечена Cy3, другая — Cy5) конкурентно когибридизируются на одном и том же чипе, чтобы обеспечить набор относительных соотношений экспрессии (соотношения флуоресценции Cy3 / Cy5). Различные источники экспериментального шума присутствуют на разных этапах экспериментов с ДНК-чипами и могут привести к обнаружению ложных знаний.Технические шумы возникают из-за неконтролируемых изменений качества и маркировки РНК, а также из-за механических или оптических искажений держателя и сканера чипа. Биологические шумы могут возникать из многих источников, включая загрязнение, условия хранения и неоднородность образцов ткани. Следует проводить выделение реплик для каждого гена в одном чипе и гибридизацию экспериментов с репликами на чипе с одним и тем же экстрактом РНК и с разными экстрактами одного и того же биологического образца.Повторяющиеся значения позволяют статистически оценить «истинный» биологический сигнал среди множества экспериментальных шумов. Они также позволяют идентифицировать значения выбросов и вычислять дисперсию значения экспрессии для каждого гена. Анализ мощности показывает, что требуется по крайней мере восемь истинных повторных значений для значительного обнаружения 20% вариаций экспрессии между двумя различными биологическими образцами [3].
Геном человека содержит примерно 25–30 000 генов. Альтернативный сплайсинг должен производить как минимум в 3 раза больше видов транскриптов мРНК.Однако специализированная ячейка, например кардиомиоцит, экспрессирует только часть всего генома. Последовательный анализ экспрессии генов (SAGE) выявил в общей сложности 10 000 экспрессируемых генов в сердечных клетках человека [4]. Таким образом, ожидается, что специализированная клетка будет экспрессировать только 1/3 всего генома, хотя эта пропорция может не быть фиксированной, но, наоборот, может меняться в зависимости от развития. Полногеномные микрочипы (например, Affymetrix® GeneChip U133 Plus 2.0 или Applied® Human Genome Survey Microarray) предназначены для получения данных экспрессии для всех возможно экспрессируемых генов.Этот подход может рассматриваться как руководство для выявления новых генов, которые, как предполагается, не изменяются в данном физиологическом или патологическом процессе (нецелевой подход), и направлять исследователей в неожиданные новые направления. Следует помнить об ограничении видов для микрочипов полного генома. Среди млекопитающих такие инструменты в настоящее время доступны для человека и мыши, а в последнее время — для крысы, собаки и свиньи.
Микроматрицы полного генома дали важные результаты в контексте сердечных заболеваний.Например, Ян и др. [5] идентифицировали снижение экспрессии SLIM1 (кодирующего белок, который функционирует ниже активации интегрина, способствуя распространению и миграции клеток) и повышенную экспрессию гельсолина (который регулирует сборку и оборот тонких филаментов) в сердечной недостаточности человека. Тот же подход может также предоставить молекулярные отпечатки пальцев, которые могут быть полезными индикаторами этиологии сердечной недостаточности [6] или степени тяжести [7]. Наконец, пангеномический подход может идентифицировать смешанные факторы, такие как возраст и пол, которые могут мешать сердечной недостаточности ремоделировать транскриптом [8].Таким образом, микроматрицы полного генома предоставляют огромный набор данных и указывают на новые патофизиологические механизмы.
В области экспрессионной геномики другая стратегия состоит в том, чтобы сосредоточить исследования на наборе генов, участвующих в четко определенной клеточной функции: например, апоптоз, регуляция транскрипции, ионные каналы… Пангеномные микрочипы не подходят для этой цели из-за их высокой стоимости и потому, что они обычно не содержат реплик. Кроме того, 80% генов на микрочипе с интерпретируемыми данными экспрессии среди, скажем, 30 000 генов считается отличным показателем для микрочипов всего генома.Это больше неприемлемо, когда рассматривается небольшой набор генов. Очевидно, что данные геномики сердечных ионных каналов представляли бы ограниченный интерес, если бы в них не было информации о ключевых генах ионных каналов, таких как SCN5A (основной ген, кодирующий α-субъединицу Na + канала), CANCA1C (кодирующий Cav1 .2, главный ген канала Ca 2+ L-типа в сердце), KCNQ1 (KvLQT1 или Kv7.1, ген отложенного выпрямителя K + канала) и KCND3 (Kv4.3, переходный исходящий ток K + гена канала).
2.2. Микромассивы ионных каналов
Альтернативная стратегия микрочипам полного генома заключалась в разработке специализированных микрочипов. Эти чипы могут быть предназначены для органа (например, CardioChips, MyoChips, NeuroChips…) или функции (например, IonChips, ApoptosisChips…). Мы разработали специализированный ДНК-микрочип, содержащий ПЦР-амплифицированные зонды для большинства потенциал-управляемых Na + , Ca 2+ , Cl — и K + каналов α- и β-субъединиц, внутреннего выпрямителя и 2- поры K + каналов, эпителиальные субъединицы Na + каналов и коннексины [9].Поскольку ионные каналы обладают сильным структурным сходством, мы использовали последовательности 3′-нетранслируемой области (3’UTR), специфичные для каждого гена канала, в качестве зондов. Поскольку 3’UTR плохо консервативен среди видов, были разработаны две разные коллекции зондов для человека и мыши. Наши наборы также содержали дополнительную популяцию зондов, соответствующих 3’UTR-амплифицированным с помощью ПЦР фрагментам, кодирующим человеческие и мышиные белки, участвующие в гомеостазе Ca 2+ . Геномы человека и мыши содержат около 230–250 генов, кодирующих α-субъединицы и β-субъединицы ионных каналов (за исключением каналов, управляемых рецепторами; источники: www.celera.com, www.ncbi.nih.gov/entrez, www.informatics.jax.org). Однако, как указано выше, сердце не экспрессирует всю совокупность генов ионных каналов, а только часть (≈70 генов ионных каналов в сердце человека или мыши; источник: www.ncbi.nih.gov/entrez (Geo profiles), www.informatics.jax.org). Наши человеческие IonChips включают 148 зондов ионных каналов, тогда как мыши IonChips включают 147 зондов ионных каналов, каждый из которых нанесен в трех экземплярах. Используя стандартные эксперименты с ОТ-ПЦР и праймеры, разработанные для создания наших зондов ионных каналов, мы первоначально проверили список генов ионных каналов со значительной экспрессией у взрослых мышей (56/147) и сердца человека (61/148; SD, неопубликованные результаты ).Набор из 3000 кардиоспецифических зондов также добавлен на чипы для нормализации флуоресцентных сигналов Cy3 и Cy5.
2.3. Ремоделирование транскриптов ионных каналов гормонами щитовидной железы
В первоначальном исследовании [9] мы использовали IonChips для изучения ремоделирования ионных каналов, вызванного состояниями гипо- и гипертиреоза у мышей. Гормоны щитовидной железы регулируют транскрипцию генов в основном через форму триодтиронина (Т3), которая связывается с ядерными рецепторами, кодируемыми генами Trα и TRβ [10].Рецепторы тироидных гормонов представляют собой факторы транскрипции с лиганд-регулируемой активностью. Инбредных мышей лечили либо 5′-пропил-2-тиоурацилом в пище с низким содержанием йода в течение 5 недель, либо ежедневной инъекцией гормона Т3 в течение 8 дней. В конце периода лечения сердца собирали и дополнительно анализировали на экспрессию ионных каналов с помощью нашего инструмента IonChip. Это исследование демонстрирует, что не каждое семейство генов ионных каналов нарушается нарушением регуляции тироидных гормонов и что гены внутреннего выпрямительного канала K + и Na + и Cl — не связаны с ремоделированием сердца.Давно известно, что гипотиреоз замедляет реполяризацию сердца и увеличивает потенциал действия в связи со снижением экспрессии потенциал-зависимых каналов K + [11]. При гипотиреозе мы наблюдали, что ремоделирование генов сердечных каналов K + на самом деле является более сложным и включает не только понижающую регуляцию (например, Kv1.5, Kv2.1 и Kv4.2), но также повышающую регуляцию (например, KvLQT1 и KCNE1) генов каналов K + . Транскрипты сарколеммального канала Ca 2+ L-типа, Cav1.2, а для теплообменника Na + –Ca 2+ NCX1 заметно повышена. Эти изменения на уровне мРНК сопровождаются последовательными изменениями экспрессии соответствующих белков (по оценке с помощью вестерн-блоттинга) и, что наиболее важно, с последовательными изменениями на функциональном уровне амплитуды ионного тока (по оценке с помощью патч-зажима) и глобальных изменений. активность сердца (по данным поверхностной ЭКГ). Большинство изменений, вызванных гипертиреозом, отражают профиль, вызванный гипотиреозом, за исключением нескольких генов (например,грамм. Kv4.2 и Cx43), которые не показали существенных изменений. Этот подход к геномике демонстрирует, что гормон щитовидной железы избирательно и дифференцированно регулирует экспрессию гена кластера по меньшей мере из 9 α- и β-субъединиц ионных каналов. Данные также предполагают, что влияние гормонов щитовидной железы на интегральную электрическую активность сердца является результатом ремоделирования экспрессии генов ионных каналов со степенью сложности, ранее не предусмотренной в исследованиях по генам. Полученные данные не означают, что все 9 генов ионных каналов обладают регулирующими элементами гормонов щитовидной железы, поскольку часть ремоделирования ионных каналов может косвенно быть результатом воздействия гормонов щитовидной железы на сердечный ритм или их эффектов на внутриклеточный гомеостаз Ca 2+ [12]. .
2.4. Фармакогеномика хронического амиодарона
Одним из важных мотивов для разработки IonChips была новая возможность, которую он предлагал для исследования ремоделирования ионных каналов как возможного фармакологического действия лекарств. В этом контексте мы подумали, что препарат амиодарон может быть прототипом. Хотя амиодарон обладает замечательной антиаритмической эффективностью, основа его уникальной эффективности при длительном приеме все еще плохо изучена. Фармакологический профиль препарата сложен и включает прямую модуляцию функции ионного канала в клеточной мембране.Также известно, что препарат значительно изменяет функцию щитовидной железы из-за своей йодированной природы [13]. Возник вопрос, могут ли долгосрочные эффекты амиодарона быть результатом его молекулярного взаимодействия с рецепторами тироидных гормонов или других механизмов, включая модуляцию экспрессии генов в дополнение к его прямому влиянию на каналы клеточной мембраны [14]. Выбирая амиодарон для этой первоначальной работы, мы исходили из того, что если окажется, что лекарство не влияет на экспрессию ионных каналов в сердце, то вероятность того, что это повлияет на другое лекарство, будет небольшой.Взрослых мышей из той же инбредной линии (C57BL / 6), которая использовалась для исследования гормонов щитовидной железы, лечили пероральным амиодароном в течение 6 недель [15]. Поскольку мыши плохо абсорбируют амиодарон, требовались очень высокие суточные дозы для получения плазменных концентраций исходного соединения и его основного метаболита N -дезэтиламиодарон (DEA), совместимых с терапевтическими уровнями, полученными у пациентов. Как и ожидалось, пероральный амиодарон последовательно снижал уровни циркулирующего Т3 и увеличивал уровни обратного Т3 у обработанных мышей, а также дозозависимо увеличивал реполяризацию сердца и замедлял проводимость.Действие препарата на транскрипты сердечных ионных каналов было комплексным с подавлением экспрессии генов, кодирующих каналы Na + (Nav1.5, Nav1.4, Navβ1), Ca 2+ каналов (Cav1.2, Cavβ1, Cavβ2 ), Ca 2+ регуляторных белков (кальсеквестрин типа 2, кальмодулин типа 3, NCX1) и коннексинов (Сх43). В репертуаре генов каналов K + амиодарон продуцирует как повышающую регуляцию большого количества генов (например, Kv1.4, Kvβ1, MirP1, MirP2, TWIK-1, TASK-2), так и понижающую регуляцию других генов. (е.грамм. Kv1.5, Kv2.1, Kv4.2, Kir6.2, SUR2). Эта сложная перестройка была по природе сравнима с перестройкой, вызванной тироидным гормоном, хотя и отличалась по задействованным генам (рис. 1). Как и в случае гормонов щитовидной железы, изменения на уровне мРНК коррелируют с функциональными изменениями в соответствующих ионных токах и с общей электрической активностью сердца. Наиболее важно то, что ремоделирование экспрессии ионных каналов, вызванное амиодароном, было дозозависимым и коррелировало с дозозависимыми эффектами препарата на ЭКГ.Примечательно, что эффекты амиодарона на коллекцию генов сердечного ионного канала были совместимы с фармакологическим профилем препарата, который связывает снижение проводимости (снижение экспрессии канала Na + и генов коннексина) и длительную реполяризацию (снижение канала K + ). выражение), тем самым исключая возможность того, что реконструкция была исключительно компенсаторной. Различные неисключительные гипотезы могут объяснить ионное ремоделирование, включая: (i) синдром гипотиреоза, вызванный амиодароном; (ii) прямое действие амиодарона / DEA на промоторы генов [16]; (iii) влияние амиодарона / DEA на факторы транскрипции [17]; и (iv) первичное физиологическое изменение, вызванное прямым воздействием лекарства на мембранные белки.Наши совместные исследования влияния гипотиреоза и амиодарона на геномику сердечных ионных каналов показывают, что амиодарон влияет на транскрипты ионных каналов иначе, чем гипотиреоз (рис. 1). Общий профиль касается только понижающей экспрессии генов потенциал-управляемых каналов K + , таких как Kv4.2, Kv2.1 и Kv1.5. Эти каналы, однако, являются основными детерминантами кинетики реполяризации желудочков у мышей [18]. Bosch et al. [19] ранее показали на функциональном уровне, что амиодарон и гипотиреоз по-разному влияют на сердечные ионные каналы в желудочковых миоцитах морских свинок.
Рис. 1
Сравнительные профили экспрессии эффектов гипотиреоза (желтые столбцы) и хронического лечения амиодароном (красные столбцы) в сердце мыши. Гистограммы изображены в зависимости от различных фаз желудочкового потенциала действия мыши. Данные выражены как среднее ± S.E.M. взяты из экспериментов, представленных в [5]. [4,10]. В различных случаях шкала ошибок слишком мала, чтобы ее можно было увидеть. Звездочки обозначают значительные изменения по сравнению с контрольными мышами.
Рис. 1
Сравнительные профили экспрессии эффектов гипотиреоза (желтые столбцы) и хронического лечения амиодароном (красные столбцы) в сердце мыши. Гистограммы изображены в зависимости от различных фаз желудочкового потенциала действия мыши. Данные выражены как среднее ± S.E.M. взяты из экспериментов, представленных в [5]. [4,10]. В различных случаях шкала ошибок слишком мала, чтобы ее можно было увидеть. Звездочки обозначают значительные изменения по сравнению с контрольными мышами.
Обычным эффектом лечения амиодароном и гипотиреоза является умеренная брадикардия.Таким образом, в последующем исследовании мы решили изучить, будет ли умеренная брадикардия сама по себе ремоделировать экспрессию ионных каналов в желудочке мыши. С этой целью инбредных мышей лечили в течение 3 недель пероральным ивабрадином, специфическим блокатором каналов кардиостимулятора, чтобы добиться снижения частоты сердечных сокращений на 15%. Это исследование (неопубликованное) показало очень ограниченное ремоделирование ионных каналов в желудочке, которое заметно отличалось от ситуации с гипотиреозом или амиодароном. Поэтому маловероятно, что брадикардия участвует в ионном ремоделировании, вызванном гипотиреозом или хроническим лечением амиодароном.
3. От микрочипов до высокопроизводительных TaqMan
Технически подход ДНК-чипа имеет множество недостатков и ограничений. Этот метод требует большого количества РНК (около 10 мкг общей РНК), что предотвращает индивидуальную обработку образцов небольшого размера и, таким образом, требует этапов объединения или амплификации тканей. Чувствительность метода низкая, а соотношение шум / отношение неблагоприятное для генов с низким уровнем экспрессии (например, гены ионных каналов). Данные, полученные с помощью ДНК-чипов, обладают внутренней изменчивостью, особенно для генов с низкой экспрессией.Это требует обработки нескольких микросхем для каждой отдельной ситуации и определения зондов в нескольких местах на микросхеме. Нормализация флуоресцентного сигнала Cy3 – Cy5 все еще является источником систематической ошибки, даже если используется большой набор контрольных генов. Стоимость метода высока не только из-за оборудования, но и из-за затрат на реагенты и рабочую силу. Сила этого метода заключается в его очень большом масштабе, позволяющем измерять сопутствующую экспрессию нескольких тысяч генов (полногеномный подход).Если рассматривать коллекцию генов ограниченного размера, такую как ансамбль генов ионных каналов (<250 генов), альтернативные методы, такие как ОТ-ПЦР, могут быть более подходящими. TaqMan для ПЦР в реальном времени требует менее ценных образцов РНК (около 200 нг, т. Е. В 50 раз меньше, чем ДНК-чипы) и демонстрирует лучшую чувствительность и меньшую вариабельность, чем ДНК-чипы, при обнаружении низкоэкспрессируемых генов. Однако подход «ген за геном» не может быть предусмотрен для коллекций из нескольких сотен генов. Совсем недавно тесты TaqMan стали доступны в виде предварительно разработанного теста с низкой пропускной способностью (microfluidic cards®; www.applicationbiosystems.com) хорошо адаптирован для генных коллекций, состоящих менее чем из 384 генов. Анализ TaqMan не обеспечивает абсолютной количественной оценки. Однако было установлено, что для 100% эффективности ПЦР значение 30 C T соответствует примерно 1000 копий транскрипта и что эта связь является линейной между значениями C T от 10 до 36 [20]. Таким образом, в отличие от ДНК-чипов, тесты TaqMan предоставляют важную информацию об относительных уровнях экспрессии генов в образце при условии, что эффективность ПЦР близка к 100%.
3.1. Региональное распределение экспрессии гена ионного канала
Мы использовали высокопроизводительный анализ TaqMan для исследования регионального распределения экспрессии ионных каналов в сердце мыши [20]. Наши микрофлюидные карты содержат праймеры для 71 субъединицы α- и β-ионного канала. Давно известно, что экспрессия экспрессии ионных каналов неоднородна в сердечной мышце и что эта гетерогенность является ключом к специализации областей сердца, включая узлы.Двусторонняя иерархическая агломеративная кластеризация была применена к данным экспрессии генов 71 гена и 24 образцов [6 желудочков, 6 предсердий, 6 атриовентрикулярных узлов (AVN) и 6 синоатриальных узлов (SAN)]. Этот компьютерный анализ выявил четкое разделение каждой области сердца (SAN, AVN, A и V), что указывает на то, что профиль экспрессии транскриптов, участвующих в передаче электрических сигналов, характеризует каждый отдельный образец. Иерархическая кластеризация также продемонстрировала подклассификацию внутри сердечных областей: пулы SAN и AVN были частями одной ветви дерева, тогда как предсердные и желудочковые пулы сгруппированы в разных ветвях.Таким образом, кластеризация демонстрирует, что паттерны экспрессии ионных каналов точно позволяют отличить специализированные области от сердца мыши и отличает автоматическую ткань от рабочего миокарда. Замечательный портрет узловых тканей является результатом увеличения экспрессии большой панели генов ионных каналов, а не снижения экспрессии. Среди каналов Ca 2+ каналы L-типа Cav1.3 и T-типа Cav3.1 Ca 2+ преимущественно экспрессируются в узлах, хотя и не специфически.Cavα2δ2 — единственные транскрипты, которые проявляют высокую экспрессию в узловых тканях и почти не экспрессируются в рабочих миоцитах. Мы предполагаем, что транскрипты Cavα2δ2 представляют собой маркеры узловой функции. Среди каналов кардиостимуляторов в сети SAN преобладают HCN1 и HCN4. Среди α- и β-субъединиц потенциалзависимых натриевых каналов ткани водителя ритма различаются по преобладающей экспрессии Navβ1 и Navβ3. Функциональная экспрессия этих субъединиц in vitro показала, что как Navβ1 [21], так и Navβ3 [22] ускоряют кинетику инактивации I Na .Нейрональные Kv1.1 и Kv1.6 (вместе с субъединицами Kvβ1) нацелены на узловые клетки, даже если уровень их экспрессии остается низким по сравнению с другими каналами K + . Замечательный портрет рабочего миокарда характеризуется преимущественной экспрессией каналов K + , Kv4.2 (вместе с KChip2) и Cx43. Экспрессия генов, участвующих в гомеостазе кальция, не однозначно характеризует ткань с внутренним автоматизмом, за исключением рецептора рианодина, RYR2, который экспрессируется на более низком уровне в SAN, чем в других областях сердца.
3.2. Влияние генетического фона на транскрипты ионных каналов
Мы решили оценить, зависит ли профиль экспрессии генов ионных каналов в нормальном сердце мыши от генетического фона. Мы наблюдали стойкие различия между инбредными линиями мышей. Иерархическая кластеризация, показанная на фиг. 2, демонстрирует, что отдельные мыши из трех разных штаммов (129 / Sv, FVB и C57BL / 6) группируются отдельно, указывая на штамм-специфичность в профиле экспрессии их ионных каналов.Рис. 3, 4 и 5 более подробно описывают эти различия. Примечательно, что штамм FVB экспрессирует меньше транскриптов Nav1.5, но больше транскриптов Nav1.4, Nav1.3 и Navβ, чем другие штаммы. Точно так же мыши FVB имеют меньше транскриптов Cx43 в желудочке, но больше транскриптов Cx40. Вдобавок у них меньше Kv1.4, но больше Kv4.3. MinK (или KCNE1) практически отсутствует в FVB, тогда как согласованные уровни экспрессии обнаруживаются в 129 / Sv и C57BL / 6. Штамм-специфичность экспрессии ионных каналов может объяснять ранее описанные различия в характеристиках ЭКГ и восприимчивости к желудочковым аритмиям, вызванным ПЭС [23].
Рис. 5
Профиль экспрессии регуляторов внутриклеточного кальция в желудочках мышей от трех различных инбредных линий. Те же символы, что и на рис. 3 и 4. Спокойствие указывает на кальмодулин; NCX1, Na + / Ca 2+ теплообменник типа 1; PLB, фоспохоламбан; RIP3, рецептор IP3; RYR, рецептор рианодина и SERCA, сарко (эндо) плазматический ретикулум Ca 2+ АТФаза.
Рис. 5
Профиль экспрессии регуляторов внутриклеточного кальция в желудочках мышей от трех различных инбредных линий.Те же символы, что и на рис. 3 и 4. Спокойствие указывает на кальмодулин; NCX1, Na + / Ca 2+ теплообменник типа 1; PLB, фоспохоламбан; RIP3, рецептор IP3; RYR, рецептор рианодина и SERCA, сарко (эндо) плазматический ретикулум Ca 2+ АТФаза.
Рис. 4
Профиль экспрессии каналов K + и катионных каналов HCN, активируемых гиперполяризацией, в желудочках мышей от трех различных инбредных линий. Обозначения те же, что и на рис.3.
Рис. 4
Профиль экспрессии каналов K + и катионных каналов HCN, активируемых гиперполяризацией, в желудочках мышей от трех различных инбредных линий. Обозначения те же, что и на рис. 3.
Рис. 3
Профиль экспрессии канальных генов Na + , Ca 2+ , Cx и Cl — в желудочках мышей от трех инбредных линий. Гистограммы показывают относительную количественную оценку по сравнению с внутренним контролем (ось y ) генов, отобранных по их сердечной экспрессии (ось x ) в 3 различных линиях мышей.Нижняя панель содержит гены с низкой экспрессией. Данные представляют собой средние значения ± S.E.M. от 5 до 10 мышей. * p <0,05, # p <0,01, § p <0,001 по сравнению с двумя другими штаммами. Cx обозначает коннексин; Cl — ch, хлоридные каналы.
Рис. 3
Профиль экспрессии канальных генов Na + , Ca 2+ , Cx и Cl — в желудочках мышей от трех инбредных линий. Гистограммы показывают относительную количественную оценку по сравнению с внутренним контролем (ось y ) генов, отобранных по их сердечной экспрессии (ось x ) в 3 различных линиях мышей.Нижняя панель содержит гены с низкой экспрессией. Данные представляют собой средние значения ± S.E.M. от 5 до 10 мышей. * p <0,05, # p <0,01, § p <0,001 по сравнению с двумя другими штаммами. Cx обозначает коннексин; Cl — ch, хлоридные каналы.
Рис. 2
Двусторонняя иерархическая агломеративная кластеризация, примененная к 57 выбранным генам (по вертикали) и к 21 желудочковой пробе от мышей 129 / Sv, C57BL / 6 и FVB. Входные данные представляли собой соотношение для каждого пула и гена по сравнению с внутренним эталоном.Каждый ген представлен одним рядом цветных прямоугольников, а каждая мышь — одним столбцом. Три выбранных кластера генов, показанные справа (A, B, C), содержат гены с активированной регуляцией в 129 / SV (A), C57BL / 6 (B) и FVB (C). Каждое цветовое пятно на полученной визуальной карте представляет уровень экспрессии гена с континуумом уровней экспрессии от темно-зеленого (самый низкий) до ярко-красного (самый высокий). Недостающие значения обозначаются серебристым.
Рис. 2
Двусторонняя иерархическая агломеративная кластеризация, примененная к 57 выбранным генам (по вертикали) и к 21 желудочковой выборке от 129 / Sv, C57BL / 6 и мышей FVB.Входные данные представляли собой соотношение для каждого пула и гена по сравнению с внутренним эталоном. Каждый ген представлен одним рядом цветных прямоугольников, а каждая мышь — одним столбцом. Три выбранных кластера генов, показанные справа (A, B, C), содержат гены с активированной регуляцией в 129 / SV (A), C57BL / 6 (B) и FVB (C). Каждое цветовое пятно на полученной визуальной карте представляет уровень экспрессии гена с континуумом уровней экспрессии от темно-зеленого (самый низкий) до ярко-красного (самый высокий). Недостающие значения обозначаются серебристым.
4. Клиническая геномика генов ионных каналов
Клиническая геномика объединяет науку о геноме и клинические исследования на людях. Используя полуколичественную ОТ-ПЦР в реальном времени, Borlak и Thum [24] исследовали ремоделирование ионных каналов, вызванное терминальной сердечной недостаточностью у человека. Среди генов, участвующих в фазах 0 и 1 потенциала действия, гены, кодирующие Nav1.5, Cav1.2 и Kv4.3, были обнаружены с пониженной регуляцией, тогда как T-тип Cav3.2 не был затронут. Среди транскриптов, участвующих в реполяризации, Cav1.2 и Kv1.5 были подавлены, тогда как KvLQT1 был активирован, а HERG не изменился. Среди транскриптов, контролирующих потенциал покоя, Kir2.1, Kir3.4 и Kir6.2 были подавлены, тогда как Kir3.1 не изменился. В исследование также была включена группа пациентов с ишемической или дилатационной кардиомиопатией, получающих вспомогательное устройство левого желудочка (LVAD) более 6 месяцев. Эти пациенты показывают более низкие уровни ANF по сравнению с пациентами с терминальной стадией сердечной недостаточности, не оснащенными LVAD. У пациентов с LVAD профиль экспрессии ионных каналов отличался от такового у пациентов, не получавших LVAD.Пациенты с LVAD имели почти нормальную экспрессию Nav1.5, Cav1.2, Kv4.3 и KvLQT1 и в меньшей степени снижали Cav3.2. Сердца с LVAD показали последовательное увеличение экспрессии Kv1.5, Kir3.1 и Kir6.2. Гены, кодирующие кальциевые регуляторные белки, также были заметно затронуты LVAD по сравнению с пациентами, не получавшими вспомогательное устройство. Это исследование демонстрирует, что разгрузка больного сердца благотворно влияет на экспрессию ионных каналов в соответствии с эффектами процедуры на электрофизиологию сердца [25].
Недавно ионное ремоделирование, вызванное хронической фибрилляцией предсердий (ФП), было исследовано у пациентов, перенесших операцию на открытом сердце [26]. Ограничения предыдущих исследований изменений экспрессии ионных каналов у пациентов с ФП включали произвольный выбор субъединиц для исследования и отсутствие адекватного контроля, соответствующего заболеванию. Группу пациентов с хронической ФП и основным пороком клапанов сердца сравнивали с группой пациентов с пороком сердца в синусовом ритме.Двухфакторный иерархический кластерный анализ выявил четкое разделение пациентов с клапанными пороками сердца с синусовым ритмом от пациентов с клапанными пороками сердца в сочетании с ФП. Обе группы пациентов с пороками клапанов сердца при синусовом ритме или ФП показали существенное влияние на экспрессию гена транспорта ионов со значительными изменениями по сравнению с контролем в 24 и 23 генах соответственно. Между ними было значительное совпадение: 66% генов, измененных у пациентов с клапанными пороками сердца в синусовом ритме, были аналогичным образом изменены у пациентов с клапанными пороками сердца с ФП.Специфический молекулярный портрет пациентов с ФП был ограничен кластером из 12 генов ионного транспорта. Был сделан вывод, что на профиль транскрипции генов, участвующих в транспорте ионов, сильно влияет порок сердца. ФП связана с определенным паттерном изменений экспрессии, но в настоящее время неизвестно, вызваны ли они ФП или характерны для пациентов с клапанными пороками сердца с большей вероятностью развития ФП.
Клиническая геномика генов ионных каналов в сердце все еще находится в зачаточном состоянии, о чем свидетельствует очень небольшое количество связанных публикаций.Очевидное ограничение клинической геномики в кардиологии происходит из-за трудностей и этических проблем, связанных с забором биоптатов из пораженного миокарда. Однако одновременное измерение экспрессии 96-192 транскриптов теперь возможно без этапов амплификации в одной эндокардиальной биопсии с использованием недавно разработанных микротехник, таких как микрофлюидные карты Taqman®.
5. Будущие направления
В ближайшие годы геномика, безусловно, продемонстрирует свою силу в исследовании пластичности экспрессии ионных каналов в условиях изменения физиологической или патологической среды.Сердечные каннелопатии — один из таких примеров. Эта группа заболеваний включает различные моногенные нарушения, которые влияют на функцию ионного канала в сердечной мышце и включают (среди прочего) синдром удлиненного интервала QT, синдром Бругада и наследственную болезнь Ленегра [27]. Упрощенный взгляд на сердечные каналопатии состоит в том, что генетический дефект выборочно изменяет функцию ключевого ионного канала, что приводит к аномальному электрогенезу и аритмиям. Однако мы узнали из трансгенеза, что эта точка зрения коротка, потому что сердечные клетки способны адаптироваться к дефициту путем ремоделирования экспрессии других ионных каналов и генов-регуляторов таким образом, что дефицит частично компенсируется [28].Адаптация подразумевает наличие сенсора (например, динамических изменений внутриклеточного кальция) для обнаружения аномалии и петли обратной связи (например, кальций-зависимых факторов транскрипции) для предварительной коррекции дефицита. Гомеостатическая регуляция экспрессии ионных каналов была в центре внимания прекрасного обзора Rosati и McKinnon [29]. Согласно этой парадигме, серьезность фенотипа должна зависеть не только от природы мутировавшего гена, но и от эффективности компенсации, полезной или вредной.Известно, что пенетрантность сердечных каннелопатий низкая, даже если рассматривать популяцию пациентов, несущих одну и ту же генную мутацию [30,31]. То, является ли низкая пенетрантность результатом межиндивидуальных различий в эффективности компенсаторного ремоделирования, должно быть предметом будущих геномных исследований. В этом контексте модель KO мыши может оказаться чрезвычайно полезной. Мы исследовали in vivo фенотип гетерозиготных мышей, дефицитных по Scn5a (кодирующему Nav1.5) [32].Хотя из той же инбредной линии (129 / Sv), мыши Scn5a +/- демонстрируют дефицит проводимости, очень различающийся по степени тяжести (некоторые мыши даже демонстрируют параметры проводимости в нормальном диапазоне), как и пациенты с болезнью Ленегра, гапло-недостаточные для SCN5A. [33]. Это говорит о том, что даже при стабильном генетическом фоне молекулярная программа адаптации может иметь различное влияние на индивидуумов. Легко предположить, что из-за сложности молекулярной программы, которая, вероятно, будет включать в себя многочисленные регулирующие элементы, действующие согласованно, эффективность процесса будет постепенной и, конечно, ускользнет от логики «все или ничего».В зависимости от природы гена, вызывающего гапло-недостаточность, молекулярное ремоделирование может восстановить фенотип, близкий к нормальному, что приведет к незаметным аномалиям, не обнаруживаемым на исходном уровне, и, следовательно, к низкой пенетрантности в популяции носителей гена.
6. Пределы подхода
Наличие транскрипта не обязательно означает присутствие функционального белка. Регуляция функции ионных каналов достигается не только на уровне транскрипции, но также, вероятно, включает ряд критических посттранскрипционных механизмов, таких как процессинг мРНК [34,35], трансляция и посттрансляционные модификации [36], процессинг белков и нацеливание на клеточную мембрану [37] и, в конечном итоге, регулирование посредством фосфорилирования [38] активности канала в комплексе мультибелковых ионных каналов.Тем не менее, регуляция транскрипции оказывается эффективным механизмом для точного и (что наиболее важно) специфического контроля активности канала в долгосрочной перспективе. Кроме того, в настоящее время нет доступных технологий для крупномасштабного исследования экспрессии набора мембранных белков, и это является предметом активных исследований в растущей области протеомики. Хотя мы понимаем, что подход геномики вряд ли отражает всю историю молекулярного ремоделирования, он представляет собой мощное средство для улучшения нашего понимания механизмов, используемых сердечной мышцей для адаптации к различным ограничениям окружающей среды.
В первом абзаце этого обзора утверждается, что теперь выяснен полный репертуар генов ионных каналов. Одним из основных ограничений этого утверждения является то, что ионные каналы состоят не из отдельных белков, а из ансамбля белков, которые образуют комплекс каналов, состоящий не только из α-субъединиц (поры канала) и β-субъединиц (регуляторы), но также дополнительных белков, которые являются ключами для нацеливания и регулирования каналов вторичными посредниками. В настоящее время точное строение комплексов каналов в значительной степени неизвестно.
Благодарности
Мы благодарим Марью Стинман за внимательное чтение рукописи. Эта работа была поддержана грантами от Ouest genopole для платформы функциональной геномики Nantes. SD является получателем должности от CNRS.
Список литературы
[1]Молекулярная генетика и геномика сердечной недостаточности
Nat Rev Genet
2004
11
811
825
[2]Моделирование сердца
Физиология (Bethesda)
2004
19
191
197
[3]и другие.
Динамический веб-доступный ресурс для обработки необработанных данных сканирования микрочипов в консолидированные значения экспрессии генов: важность репликации
Nucleic Acids Res
2004
32
5349
5358
[4]и другие.
Профили экспрессии генов в сердечных клетках человека, подвергнутых гипоксии или экспрессирующих гибридную форму HIF-1 альфа
Physiol Genomics
2002
8
23
32
[5]и другие.
Снижение экспрессии SLIM1 и повышение экспрессии гельсолина в сердечной недостаточности человека, измеренное с помощью массивов олигонуклеотидов высокой плотности
Тираж
2000
102
3046
3052
[6]и другие.
Отпечаток экспрессии гена сердечной недостаточности человека
Proc Natl Acad Sci U S A
2002
99
11387
11392
[7]Отчетливые молекулярные портреты пораженных сердец человека, идентифицированные с помощью специальных микрочипов кДНК
Eur J Heart Fail
2005
7
157
165
[8]и другие.
Зависимая от пола и возраста вариабельность транскриптома человека: последствия для хронической сердечной недостаточности
Proc Natl Acad Sci U S A
2003
100
2754
2759
[9]и другие.
Анализ микрочипов показывает сложное ремоделирование экспрессии сердечных ионных каналов с измененным статусом щитовидной железы: связь с клеточной и интегрированной электрофизиологией
Circ Res
2003
92
234
242
[10]Физиологические и молекулярные основы действия гормонов щитовидной железы
Physiol Ред.
2001
81
1097
1142
[11]Влияние выработки гормона щитовидной железы на токи K + и экспрессию гена канала K + в желудочке крысы
J Physiol
1997
504
271
286
[12]Регулирование белков, циклирующих кальций, гормоном щитовидной железы
Щитовидная железа
2002
12
453
457
[13]Амиодарон и щитовидная железа
Clin Chem
1989
35
1882
1887
[14]Дезетиламиодарон Продление реполяризации сердца зависит от экспрессии генов: новый антиаритмический механизм
J Cardiovasc Pharmacol
1998
32
654
661
[15]и другие.
Длительное введение амиодарона ремоделирует экспрессию транскриптов ионных каналов в сердце мыши
Тираж
2004
110
3028
3035
[16]Влияние трийодтиронина и амиодарона на промотор гена рецептора ЛПНП человека
Biochem Biophys Res Commun
1998
249
517
521
[17]Дезетиламиодарон препятствует связыванию соактиватора GRIP-1 с рецептором бета-1-тироидного гормона
FEBS Lett
2000
481
213
216
[18]и другие.
Неоднородная экспрессия реполяризующих потенциалзависимых токов K + в желудочках взрослых мышей
J Physiol
2004
559
103
120
[19]Электрофизиологические эффекты хронической терапии амиодароном и гипотиреоза, отдельно или в комбинации, на миоциты желудочков морских свинок
J Pharmacol Exp Ther
1999
289
156
165
[20]и другие.
Специфическая картина экспрессии гена ионного канала, связанная с активностью водителя ритма в сердце мыши
J Physiol
2005
562
223
234
[21]и другие.
Первичная структура и функциональная экспрессия субъединицы бета 1 натриевого канала головного мозга крысы
Наука
1992
256
839
842
[22]и другие.
beta 3: дополнительная вспомогательная субъединица чувствительного к напряжению натриевого канала, которая модулирует стробирование канала с четкой кинетикой
Proc Natl Acad Sci U S A
2000
97
2308
2313
[23]Последствия уязвимости желудочковой аритмии во время электрофизиологических исследований на мышах
Physiol Genomics
2003
15
84
91
[24]Признаки экспрессии генов ионных каналов при терминальной стадии сердечной недостаточности
FASEB J
2003
17
1592
1608
[25]Электрофизиологические изменения после механической поддержки кровообращения у пациентов с тяжелой сердечной недостаточностью
Тираж
2001
104
1241
1247
[26]и другие.
Изменения экспрессии ионных каналов предсердий, связанные с пороком клапанов сердца и фибрилляцией предсердий у человека
Тираж
2004
110
Доп. III
129
[27]Сердечные каннелопатии: это в генах
Нат Мед
2004
10
463
464
[28]Генетические манипуляции с функцией сердечного канала K + у мышей: чему мы научились и что нам делать дальше?
Circ Res
2001
89
944
956
[29]Регуляция экспрессии ионных каналов
Circ Res
2004
94
874
883
[30]Низкая пенетрантность при синдроме длинного QT: клиническое влияние
Тираж
1999
99
529
533
[31]и другие.
Значение электрокардиографических параметров и аджмалиновой пробы в диагностике синдрома Бругада, вызванного мутациями SCN5A
Тираж
2004
110
3023
3027
[32]и другие.
Мышиная модель наследственной болезни Ленегра, связанной с SCN5A: возрастное замедление проводимости и фиброз миокарда
Тираж
2005
111
1738
1746
[33]и другие.
Гаплонедостаточность в сочетании со старением вызывает SCN5A-сцепленную наследственную болезнь Ленегре
Джам Колл Кардиол
2003
41
643
652
[34]Понимание посттранскрипционного контроля экспрессии генов в функции клетки
Биологическая ячейка
2003
95
125
127
[35]Связь между процессингом мРНК и транскрипцией: связь работает в обоих направлениях
Exp Cell Res
2004
296
91
97
[36]Мультисайтовая модификация белка и внутримолекулярная передача сигналов
Онкоген
2005
24
1653
1662
[37]Биология сердечных аритмий: трафик белков ионных каналов
Circ Res
2004
94
1418
1428
[38]Молекулярные аспекты адренергической модуляции сердечного L-типа Ca 2+ каналов
Cardiovasc Res
2005
65
28
39
Заметки автора
Авторские права © 2005, Европейское общество кардиологов
Ионных каналов и сердечно-сосудистой системы — Creative Diagnostics
Введение ионных каналов
Когда живые клетки продолжают осуществлять обмен веществ, они должны постоянно обмениваться веществами с окружающей средой, а ионные каналы на клеточной мембране являются важным способом обмена такими веществами.Известно, что большинство веществ, важных для жизни, растворимы в воде, такие как различные ионы, сахара и т. Д., Которые должны попадать в клетки, а водорастворимые отходы, образующиеся в жизнедеятельности, также покидают клетки, они входят и выходят. по каналам. Эти каналы представляют собой ионные каналы на клеточной мембране. Ионные каналы состоят из специальных белков, вырабатываемых клетками. Они собираются и внедряются в клеточную мембрану, образуя гидрофильные поры. Эти поры представляют собой каналы, по которым водорастворимые вещества могут быстро входить и выходить из клеток.Эти каналы являются материальной основой для биоэлектрической транспортной активности клеток, таких как нервы, мышцы и кровеносные сосуды. Ионные каналы являются одними из краеугольных камней для поддержания нормального функционирования живых организмов. Опосредованные биоэлектрические сигналы играют ключевую роль во всех жизненных процессах, таких как сердцебиение, секреция гормонов, передача сигналов, когнитивная память и тому подобное. Мутации в ионных каналах на генетическом уровне могут привести к множеству заболеваний, включая нервную систему, сердечно-сосудистую систему и заболевания эндокринной системы.Регулирование вазоконстрикции и диастолической активности также зависит от открытия и закрытия сосудистых ионных каналов. Кровеносные сосуды обычно делятся на клетки гладких мышц сосудов и клетки эндотелия сосудов. После получения внешних стимулов на гладкую мускулатуру можно вызвать различные прямые и непрямые пути, чтобы стимулировать различные виды проводящих путей. Открывая и закрывая ионные каналы, эндотелиальные клетки способны выделять различные факторы, контролирующие и регулирующие открытие и закрытие ионных каналов на мембране гладкомышечных клеток сосудов.Таким образом, с тех пор, как была предложена концепция ионного канала, исследование сердечного ионного канала стало одной из горячих точек в области сердечных заболеваний.
Взаимосвязь ионных каналов и сердечно-сосудистой системы
Ионные каналы многочисленны и сложны, а каналы Na + , K + и Ca 2+ тесно связаны с сердцем. Многие сердечно-сосудистые заболевания связаны с нарушением функции ионных каналов в какой-то момент или на какой-то стадии их начала; аналогично, многие сердечно-сосудистые препараты эффективны, корректируя аномальную функцию определенных ионных каналов.
Канал для ионов натрия
Канал сердечных ионов натрия состоит из трех субъединиц: α, β1 и β2, и субъединица α является его основной функциональной группой. Ген человека SCN5A кодирует альфа-субъединицу натриевого канала сердца. Альфа-субъединица состоит из четырех гомологичных областей на молекулярном уровне, каждая из которых имеет шесть трансмембранных спиральных сегментов. Активация сердечного натриевого канала приводит к быстрому притоку Na + , деполяризации кардиомиоцитов и образованию фазы 0 потенциала действия.Изменения сердечных натриевых каналов напрямую влияют на самодисциплину, проводимость и продолжительность потенциала действия кардиомиоцитов, что приводит к возникновению аритмий. В клинических исследованиях было обнаружено, что мутации в гене SCN5A вызывают синдром Бругада. Клинические проявления пароксизмальной желудочковой тахикардии или фибрилляции желудочков часто приводят к внезапной смерти во время ночного сна, а на электрокардиограмме выявляются такие симптомы, как блокада правой ножки пучка Гиса.Влияние родственных ингибиторов натриевых каналов на лечение родственных состояний остается неясным.
Кальциевый канал
На клеточной мембране есть три основных кальциевых канала: потенциал-зависимый кальциевый канал (VOC), кальциевый канал, управляемый рецепторами (ROC), и кальциевый канал, управляемый кальцием (SOC). Открытие ионного канала гладкомышечных клеток в трубке может изменить изменение концентрации ионов кальция в сосудистых клетках и регулировать расслабление и сокращение гладких мышц сосудов.Внутриклеточный Ca 2+ в основном поступает из внеклеточного Ca 2+ в клетку через канал ионов кальция или в клетку из эндоплазматического ретикулума. Таким образом, кальциевый канал очень важен для регулирования вазодилатации и сокращения.
ЛОС
На мембране присутствуют шесть типов ЛОС: T, L, N, P, Q и R. Ионы кальция L-типа присутствуют на кровеносных сосудах. Канал, при высоких напряжениях, кальциевый канал L-типа легко активируется.После открытия канала внеклеточный кальций будет течь в большом количестве, вызывая гиперполяризацию, которая заставляет кровеносные сосуды сокращаться, и приток его Ca 2+ длится долгое время. Кальциевые каналы типов N, P, Q и R распределены в нервных клетках.
ROC
Связывая агонист с соответствующим рецептором на мембране, рецептор изменяется и ROC открывается. В отличие от ЛОС, он не изменяется из-за изменения мембранного потенциала, а его открытие связано с образованием фосфоинозитида.
SOC
Это тип канала Ca 2+ , который активируется очищением Ca 2+ в пуле кальция саркоплазматического ретикулума и участвует в различных патологических и физиологических процессах, таких как секреция клеток, активность ферментов, клеточный цикл и апоптоз.
Канал для ионов калия
Существует четыре основных калиевых канала: калиевые каналы, активируемые напряжением (K v ), активируемые кальцием калиевые каналы (K ca ), калиевые каналы, чувствительные к аденозинтрифосфату (K ATP ) и внутренние выпрямляющие калиевые каналы. (K IR ).Канал иона калия регулирует потенциал на мембране гладкомышечных клеток, тем самым влияя на изменение сосудистого тонуса. После открытия канала K + на клеточной мембране гладких мышц сосудов, вызывая большой отток K + и вызывая гиперполяризацию потенциала клеточной мембраны. Увеличение оттока K + вызывает уменьшение притока Ca 2+ , а ЛОС инактивируется и закрывается, тем самым вызывая расширение сосудов.
К ок
Приток Ca 2+ является ответом эндотелиальных клеток на стимуляцию факторов.Ca 2+ активирует калиевые каналы и компенсирует деполяризацию мембранного потенциала при притоке Ca 2+ . Быстрый отток K + , который приводит к гиперполяризации мембран, и Ca 2+ продолжает в значительной степени поступать в клетку. K ca включает активированный кальцием калиевый канал с большой проводимостью (BK ca ), активируемый кальцием калиевый канал (IK ca ) и калиевый канал с низкой проводимостью (SK ca ). ).Исследования показали, что K ca имеет большое физиологическое значение в регуляции эндогенного тонуса резистентных сосудов. Он широко присутствует в гладкомышечных клетках легочной артерии (PASMC). Каналы K ca могут участвовать в регуляции сосудистого тонуса, непосредственно реагируя на изменения внутрицитоплазматического Ca 2+ . Канал BK ca является доминирующим в большинстве артерий, а ингибирование канала BK ca может деполяризовать мембрану и вызвать сокращение.
К ИК
KIR присутствует только в некоторых мозговых кровеносных сосудах малого диаметра, подслизистых артериолах и гладких мышцах коронарных артерий, а K IR 2 является основным подтипом K IR . В состоянии покоя ионы стронция вызывают сокращение этих кровеносных сосудов, а канал K IR 2 имеет высокую чувствительность к сужению сосудов и вазодилататорам, которые, в свою очередь, влияют на мембранный потенциал покоя головного мозга и коронарных артерий.
К ATP
С точки зрения молекулярной структуры канал K ATP представляет собой гетерологичный октамер, образованный внутренним выпрямительным калиевым каналом Kir6x и АТФ с образованием бокс-белка (SUR) в соотношении 1: 1. Субъединица Kir6x является мишенью для АТФ, чтобы ингибировать этот канал, и селективность канала K ATP для K + также определяется ею.
К в
На некоторых гладких мышцах сосудов K v доминирует в определении мембранного потенциала покоя и базальной регуляции.Более того, каналы K v зависят от регуляции индуцированных агонистами протеинкиназ-зависимых сигнальных путей, поэтому в исследованиях было обнаружено, что использование ингибиторов протеинкиназ может напрямую ингибировать каналы K v .
Клиническое значение
В функции сосудов различные ионные каналы и рилизинг-фактор эндотелия сосудов регулируют функцию вазоконстрикции и расслабления кровеносных сосудов, а также изучают взаимосвязь между ионными каналами и эндотелиальным рилизинг-фактором на гладких мышцах сосудов, что полезно для дальнейшего изучения ионного канала. на гладких мышцах сосудов.Исследования заложили прочную основу для того, чтобы ионный канал стал важной мишенью для лекарств, регулирующих вазодилатацию и сокращение. Это будет иметь большое значение для понимания и лечения многих родственных заболеваний, а также для разработки родственных лекарств.
Артикулы:
- Hatta S, и др. . Ионный канал и болезни. Med Electron microsc. 2002, 35 (3) 117-126.
- Riddoch FC, et al. . Высвобождение и секвестрация Ca 2+ с помощью каффбина и рианодин-чувствительного хранилища в субпопуляции клеток неймбластомы человека SH-sY5Y. ЦелI кальций . 2005, 38 (2): 111-120.
- Tan H L, et al. Мутация натриевого канала вызывает изолированное заболевание сердечной проводимости. Природа . 2001, 409: 1043-1047.
- Платошин О, и др. . Неоднородность опосредованного гипоксией снижения IK (V) и увеличения [Ca 2+ ] цитина гладкомышечных клеток легочной артерии. Am J Physiol Lung Cell Mol Physiol . 2007, 293 (2): 402-416.
- Сан П. В., и др. . Физиологическая роль внутренних выпрямительных каналов K + в гладкомышечных клетках сосудов. Архив Пфлюгерса, Европейский журнал физиологии . 2008,547 (1): 137-147.
- Юнь Ф, и др. . Функциональная экспрессия Kir2X в эндотелиальных клетках аорты человека : доминирующая роль Kir2.2. Am J Physiol Cell Physiol . 2005, 289 (6): 11134-1 144.
Твиттер Facebook
.