Рсчс имеет пять уровней: Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)
Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)
Основной целью создания РСЧС являлось объединение усилий федеральных органов исполнительной власти и организаций, органов исполнительной власти субъектов Российской Федерации, органов местного самоуправления и объектов, их сил и средств в области предупреждения и ликвидации чрезвычайных ситуаций природного и техногенного характера, защиты населения и территорий при их возникновении.
В качестве основных задач РСЧС определены:
разработка и реализация правовых и экономических норм, связанных с обеспечением защиты населения и территорий от чрезвычайных ситуаций;
разработка и осуществление целевых и научно-технических программ, направленных на предупреждение чрезвычайных ситуаций и повышение устойчивости функционирования предприятий, учреждений и организаций независимо от их организационно-правовых форм, а также подведомственных им объектов производственного и социального назначения в чрезвычайных ситуациях;
обеспечение готовности к действиям органов управления, сил и средств, предназначенных для предупреждения и ликвидации чрезвычайных ситуаций;
сбор, обработка, обмен и выдача информации в области защиты населения и территорий от чрезвычайных ситуаций;
прогнозирование и оценка социально-экономических последствий чрезвычайных ситуаций;
создание резервов финансовых и материальных ресурсов для предупреждения и ликвидации чрезвычайных ситуаций;
осуществление государственной экспертизы, надзора и контроля в области защиты населения и территорий от чрезвычайных ситуаций;
ликвидация чрезвычайных ситуаций;
осуществление мероприятий по социальной защите населения, пострадавшего от чрезвычайных ситуаций, проведение гуманитарных акций;
реализация прав и обязанностей населения в области защиты от чрезвычайных ситуаций, в том числе лиц, непосредственно участвующих в их ликвидации;
международное сотрудничество в области защиты населения и территорий от чрезвычайных ситуаций.
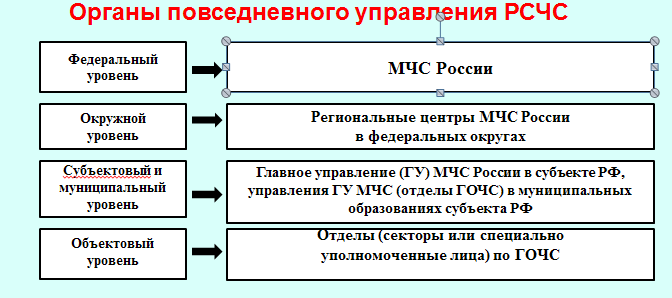
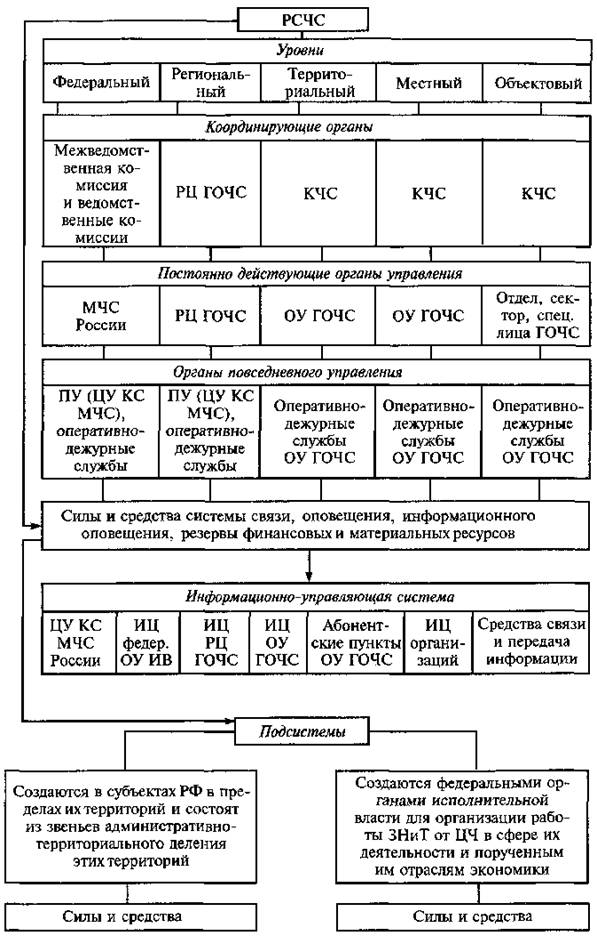
РСЧС включает в себя функциональные и территориальные подсистемы и имеет пять уровней: федеральный, межрегиональный, региональный, муниципальный и объектовый.
Функциональные подсистемы РСЧС создаются федеральными органами исполнительной власти для организации работы в области защиты населения и территорий от чрезвычайных ситуаций в сфере деятельности этих органов.
Территориальные подсистемы единой системы создаются в субъектах Российской Федерации для предупреждения и ликвидации чрезвычайных ситуаций в пределах их территорий и состоят из звеньев, соответствующих административно-территориальному делению этих территорий.
На каждом уровне РСЧС создаются координационные органы, постоянно действующие органы управления, органы повседневного управления, силы и средства, резервы финансовых и материальных ресурсов, системы связи, оповещения и информационного обеспечения.
Постоянно действующими органами управления РСЧС являются:
на федеральном уровне — Министерство Российской Федерации по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий, подразделения федеральных органов исполнительной власти для решения задач в области защиты населения и территорий от чрезвычайных ситуаций и гражданской обороны;
на межрегиональном уровне — территориальные органы МЧС России — региональные центры МЧС России;
на региональном уровне — территориальные органы МЧС России — главные управления МЧС России по субъектам Российской Федерации;
на муниципальном уровне — органы, специально уполномоченные на решение задач в области защиты населения и территорий от чрезвычайных ситуаций и гражданской обороны при органах местного самоуправления;
на объектовом уровне — структурные подразделения объектов, уполномоченные на решение задач в области защиты населения и территорий от чрезвычайных ситуаций и гражданской обороны.
Решения руководителей работ по ликвидации чрезвычайных ситуаций являются обязательными для всех граждан и организаций, находящихся в зоне чрезвычайной ситуации, если иное не предусмотрено законодательством Российской Федерации.
Ответы на Итоговый тест
1. Какой орган проводит работу по упреждающему выявлению и оценке угроз нац. безопасности России?
Г) Совет Безопасности РФ
2. К угрозам международной региональной безопасности общества относятся:
Г) Угроза арабо-израильского конфликта
3. В чем состоят интересы личности согласно концепции национальной безопасности
Интересы личности состоят в реализации конституционных прав и свобод, в обеспечении личной безопасности, в повышении качества и уровня жизни человека гражданина.
4. Почему экономические национальные интересы являются ключевыми?
Они являются ключевыми для обеспечения всех иных интересов, т.
 к. их реализация возможна только на основе устойчивого развития экономики.
к. их реализация возможна только на основе устойчивого развития экономики. 5. В чем заключаются интересы России в военной сфере?
Национальные интересы России в военной сфере заключаются в защите ее независимости, суверенитета, государственной и территориальной целостности, в предотращении военной агрессии против России и ее союзников, в обеспечении условий для мирного, демократического развития государства.
6. Какие существуют угрозы физическому здоровью нации?
Угрозой являются кризис систем здравоохранения и социальной защиты населения, рост потребления алкоголя и наркотических веществ.
7. Может ли школа выполнять задачу защиты конституционного строя?
Школа может сопративляться угрозам физическому здоровью и духовному здоровью нации, через реализацию функций и обучение здоровой, гармонично развитой личности.
1. Назовите систему, созданную в России для предупреждения и ликвидации ЧС
В) Единая государственная система предупреждения и ликвидации ЧС
2.
 РСЧС создана с целью
РСЧС создана с целью Б) объединения усилий органов власти, организаций и предприятий, их сил и средств в области предупреждения и ликвидации ЧС
3. РСЧС состоит из
А) функциональных и территориальных подсистем
4. Какие пять уровней имеет РСЧС
А) федеральный, межрегиональный, региональный, муниципальный, объективный
5. Территориальные подсистемы РСЧС создаются
Б) в субъектах РФ пределах их территорий
6. Какими путями отравляющие вещества проникают в организм человека в результате
А) вдыхания зараженного воздуха, попадания отр. веществ в глаза, на кожу или при употреблении зараженной пищи и воды
7. Бактериологическое оружие — это
А) специальные боеприпасы и боевые приборы, снаряжаемые биологическими средствами, предназначенными для массового поражения силы, сельскохозяйственных животных и посевов с/х культур
8.
 Противогаз служит для защиты органов дыхания, лица и глаз от
Противогаз служит для защиты органов дыхания, лица и глаз от Б) отравляющих, радиоактивных веществ и бактериальных средств.
9. Из предметов бытовой одежды наиболее пригодны для защиты кожи от ХОВ:
А) плащи и накидки из прорезиненной такни или покрытые хлорвиниловой пленкой
10. Для обеззараживания капельной-жидких ОВ и некоторых АХОВ, попавших на тело и одежду человека, на средства индивидуальной защиты и инструмент, нужно использовать:
В) индивидуальные противохимические пакеты
11. В каких случаях нельзя скрывать стоп-кран и останавливать поезд даже в случае крайней необходимости, например при пожаре:
А) на мосту, в тоннели и других местах, где может осложниться эвакуация пожаров
12. В случае поражения электрическим током, если не произошло остановка сердца и дыхания, прежде всего необходимо:
Б) прекратить действие электрического тока на пострадавшего
13.
 Духовное здоровье зависит от:
Духовное здоровье зависит от: В) системы мышления, отношения к окружающему миру
14. Физическое здоровье зависит от:
А) от двигательной активности человека, рационального питания, соблюдения правил личной гигены и безопасного поведения в повседневной жизни, умения отдыхать
15. Одной из составляющих здорового образа жизни является:
Б) оптимальный уровень двигательной активности
16. Какие основные функции выполняет питание в жизни человека:
А) поддерживает биологическую жизнь и обеспечивает постоянный обмен веществ и энергии между организмом человека и окружающей средой
17. Причинами переутомления являются:
Б) неправильная организация труда и чрезмерная учебная нагрузка
18. Для развития выносливости наиболее полезны:
А) ходьба, бег, лыжи, плавание
19. Отрицательное влияние алкоголя на органы человека характеризуются:
А) нарушением защитной функции печени, мозжечка, развитием туберкулеза
20.
 Алкоголизм — это
Алкоголизм — это В) заболевание на почве пьянства, в большинстве случаев с неблагоприятным прогнозом
21. Болезни, возникающие в результате злоупотребления веществами, вызывающими кратковременное чувство благоприятного психического состояние — это
Б) наркомания и токсикомания
22. Три основных признака наркомании и токсикомании — это:
В) психическая и физиологическая зависимость, изменение чувствительности к наркотику
23. Какое из опасных веществ, содержащихся в сигаретах, вызывает привыкание?
А) Никотин
24. Что такое рациональное питание?
Г) Питание с определенным соотношением питательных веществ
25. Назовите питательные вещества, имеющие энергетическую ценность?
В) Белки, жиры и углеводы
26. Что такое личная гигиена?
Б) Совокупность гигенических правил, выполнение которых способствует сохранению и укреплению здоровья
27.
 Что такое закаливание?
Что такое закаливание? А) Повышение устойчивости организма к факторам среды, путем систематического их воздействия на организм
28. Каковы требования к месту сооружения временного жилища:
Б) ровная возвышенная продуваемая площадка, возле — источник воды и достаточно топлива, вблизи поляна для подачи сигналов бедствия
29. Как высушить резиновые сапоги в походе:
А) Вытащить из сапог стельки и потереть внутри досуха тряпкой, поставить сапоги к теплу, но не к открытому огню
30. Ориентирование — это
А) определение своего местонахождения относительно сторон горизонта
31. В солечный полдень тень указывает направление на:
А) север
32. Как легче и точнее измерить пройденное расстояние:
В) парами шагов
33. Что надо сделать, если при движении по азимуту встретилось озеро:
Б) обойти озеро, предварительно наметив ориентир на другой стороне
Кратко ответы: 1-А, 2-Б, 3-А, 4-А, 5-Б, 6-А, 7-А, 8-Б, 9-А, 10-В, 11-А, 12-Б, 13-В, 14-А, 15-Б, 16-А, 17-Б, 18-А, 19-А, 20-В, 21-Б, 22-В, 23-А, 24-Г, 25-В, 26-Б, 27-А, 28-Б, 29-А, 30-А, 31-А, 32-В, 33-Б
1.
 Самый луший способ быть в хорошей форме — каждый день делать зарядку с большой нагрузкой
Самый луший способ быть в хорошей форме — каждый день делать зарядку с большой нагрузкой Нет, зарядку лучше делать с небольшой нагрузкой, но каждый день, большие нагрузки лучше распределить на весь день, чтобы избежать переутомления
2. Чем больше разрабатывать мышцы, тем слабее они становятся.
Нет, чем больше мы занимаемся, тем сильнее становятся наши мышцы
3. Вы не можете переусердствовать в занятиях спортом: чем больше вы занимаетесь, тем лучше
Нет, переусердствовать очень даже можно, тренировок должно быть в меру, и они должны подходить вашей группе здоровья
4. Эффект от спортивных упражнений наступает тогда, когда вы начинаете задыхаться, выполняя их
Нет, наоборот эффект снижается, так как кислород не поступает в кровь в нужном количестве, лучше заниматься по немногу, чтобы не задыхаться
5. Заниматься упражнениями одинаково хорошо и в тепле, и на холоде
Нет, заниматься лучше в прохладном месте, но не в холодном, так как вы вспотеете и можете простудиться из-за переохлаждения.

© ГБПОУ КК ПАТИС
ГБПОУ КК ПАТИС
Государственное бюджетное профессиональное образовательное учреждение Краснодарского края
Приморско-Ахтарский техникум индустрии и сервиса
Адрес: 353860 г. Приморско-Ахтарск, ул. Тамаровского, 85
тел: 8 (861-43) 2-35-94, 8 (861-43) 2-18-98
Адрес сайта: http://патис.рф
Социальные сети: VK и OK
Электронная почта: [email protected]
Режим работы:
ПН — СБ: с 8.00 до 16.00
Выходные дни: ВС
Учредители
Наименование:
Министерство образования, науки и молодежной политики Краснодарского края
Адрес: 350063 г. Краснодар, ул. Рашпилевская, 23
тел: 8 (861) 298-25-73
Адрес сайта: minobr. krasnodar.ru
krasnodar.ru
Электронная почта: [email protected]
Режим работы:
ПН.ВТ.СР.ЧТ. – с 09.00 до 18.00
ПТ. – с 09.00 до 17.00
Перерыв на обед: с 13.00 до 13.50
Выходные дни: СБ.ВС.
Наименование:
Департамент имущественных отношений Краснодарского края
Адрес: 350000 г. Краснодар, ул. Гимназическая, 36
Канцелярия: 8 (861) 268-24-08
Факс: 8 (861) 267-11-75
Специалист по работе с обращениями граждан — консультации, запись на прием — телефон 267-11-78
Телефон горячей линии по вопросам земельных отношений: 8 (861) 992-33-35
Адрес сайта: diok.krasnodar.ru
Электронная почта: [email protected]
Режим работы:
ПН. ВТ.СР.ЧТ. – с 09.00 до 18.00
ВТ.СР.ЧТ. – с 09.00 до 18.00
ПТ. – с 09.00 до 17.00
Перерыв на обед ПН.ВТ.СР.ЧТ.: с 13.00 до 13.50
Перерыв на обед ПТ.: с 13.00 до 13.40
Выходные дни: СБ.ВС.
Тест на тему РСЧС
Тест по предмету
«ОСНОВЫ БЕЗОПАСНОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ»
На тему
ЕДИНАЯ ГОСУДАРСТВЕННАЯ СИСТЕМА
ПРЕДУПРЕЖДЕНИЯ И ЛИКВИДАЦИИ
ЧРЕЗВЫЧАЙНЬЕК СИТУАЦИЙ
1. Что такое чрезвычайная ситуация?
а) синоним экстремальной ситуации;
б) экстремальная ситуация, сложившаяся в результате
снижения уровня производительности труда;
в) обстановка на определённой территории, сложившаяся
г) обстановка на определенной территории, сложившаяся
и результате аварии, опасного природного явления, катастрофы, стихийного или иного бедствия.
2. Как подразделяют чрезвычайные ситуации по характеру
происхождения?
а) природные;
б) техногенные;
в) биолого-социальные и военные;
г) экологические.
3. Что представляют собой природные чрезвычайные ситуации?
а) обстановка на определённой территории, сложившаяся ii результате опасного природного явления или процесса;
б) обстановка на определённой территории, сложившаяся
в результате аварии на промышленном объекте или на транс
порте, пожара или взрыва;
в) обстановка на определённой территории, сложившаяся
в результате отработки новых технологических процессов по
созданию искусственного климата;
г) обстановка на определённой территории, сложившаяся
в результате изучения и создания новых видов оборудования
по изучению природных чрезвычайных ситуаций.
4. Как организационно представлена Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)?
а) состоит из подсистемы — войск гражданской обороны;
б) состоит из территориальных подсистем;
в) состоит из функциональных подсистем;
г) состоит из подсистемы — войск быстрого реагирования.
5. Что представляют собой уровни Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)?
а) национальный;
б) федеральный;
в) региональный, территориальный;
г) местный и объектовый.
6. Где создаются территориальные подсистемы РСЧС?
а) в районах;
б) в республиках;
в) в краях;
г) в областях.
7. Кем создаются функциональные подсистемы РСЧС?
а) федеральными органами представительной власти;
б) федеральными органами исполнительной власти;
в) федеральными войсками Генерального штаба;
г) федеральными службами МВД.
8. На каких объектах экономики создаются подсистемы
Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)?
а) только на государственных объектах экономики;
б) только на акционированных объектах экономики;
в) только на частных объектах экономики;
г) на всех объектах экономики независимо от форм собственности.
9. За что отвечают комиссии РСЧС на объектах экономики?
а) за организацию деятельности по снабжению населения;
б) за организацию деятельности по продовольственному
снабжению населения;
в) за организацию деятельности по защите окружающей
природной среды;
г) за организацию деятельности по вопросам гражданской
обороны и чрезвычайных ситуаций.
10. Кто возглавляет комиссию по чрезвычайным ситуациям в
образовательных учреждениях?
а) работник службы безопасности школы;
б) председатель родительского комитета школы;
в) учитель по предмету «Основы безопасности жизнедеятельности;
г) директор школы.
11. Что представляет собой Гражданская оборона в Российской Федерации?
а) оказание помощи пенсионерам и нетрудоспособному населению;
б) почетная обязанность всех слоев гражданского населения страны;
в) составная часть Единой государственной системы в решении проблем, возникающих при ликвидации последствий чрезвычайных ситуаций мирного и военного времени;
г) защита от всех возможных нападений.
12. Что такое гражданская оборона (ГО)?
а) система добровольных народных дружин;
б) система профилактики различных групп населения;
в) система оборонных, образовательных и профилактических мероприятий, направленных на преодоление экологической безграмотности всеми категориями населения от воспитанников детских садов до образования учащихся и студентов в средней и высшей школе, а также в системе переподготовки работников всех отраслей производства, включая нетрудоспособное население;
г) система оборонных, инженерно-технических и организационных мероприятий, осуществляемых в целях защиты гражданского населения и объектов народного хозяйства от опасностей, возникающих при военных действиях.
Организация
Единой государственной системы предупреждения и ликвидации
чрезвычайных ситуаций (РСЧС)
13. РСЧС создана с целью:
а) прогнозирования ЧС на территории Российской Федерации и организации проведения аварийно-спасательных и других неотложных работ;
б) объединения усилий органов центральной власти, органов исполнительной власти, субъектов Российской Федерации, городов и районов, а также организаций, учреждений и предприятий, их сил и средств в области предупреждения и ликвидации чрезвычайных ситуаций;
в) обеспечения первоочередного жизнеобеспечения населения, пострадавшего в чрезвычайных ситуациях на территории Российской Федерации.
14. РСЧС имеет пять уровней. Назовите их:
а) объектовый;
б) производственный;
в) местный;
г) поселковый;
д) районный;
е) территориальный;
ж) региональный;
з) республиканский;
и) федеральный.
15. Комиссия по чрезвычайным ситуациям органа местного самоуправления является координирующим органом РСЧС на:
а) региональном уровне;
б) федеральном уровне;
в) объектовом уровне;
г) местном уровне;
д) территориальном уровне.
16. В зависимости от обстановки, масштаба прогнозируемой или возникшей чрезвычайной ситуации решением соответствующих органов исполнительной власти субъектов Российской Федерации и органов местного самоуправления в пределах конкретной территории устанавливается один из следующих режимов функционирования РСЧС:
а) повседневной деятельности;
б) прогнозирования обстановки;
в) повышенной готовности;
г) чрезвычайной ситуации;
д) оперативного реагирования.
Из приведенных режимов выберете те, которые не относятся к режимам функционирования РСЧС.
Эталон ответов
1.г;
2.а , б ,в;
3.а;
4.б, в;
5.б, в, г;
6б, в,г;
7.б,
8.г;
9.г;
10.г;
11.в,
12. г.
13.а.
14. а,в,е,ж,и.
15.г.
16. г.
Основные задачи РСЧС
Основные задачи РСЧС.
РСЧС – Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций
(Федеральный закон от 21.12.1994 N 68-ФЗ » О защите населения и территорий от чрезвычайных ситуаций природного и техногенного характера»)
Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций объединяет органы управления, силы и средства федеральных органов исполнительной власти, органов исполнительной власти субъектов Российской Федерации, органов местного самоуправления, организаций, в полномочия которых входит решение вопросов по защите населения и территорий от чрезвычайных ситуаций, в том числе по обеспечению безопасности людей на водных объектах.
Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций функционирует на федеральном, межрегиональном, региональном, муниципальном и объектовом уровнях.
Основными задачами единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций являются:
1. Разработка и реализация правовых и экономических норм по обеспечению защиты населения и территорий от чрезвычайных ситуаций, в том числе по обеспечению безопасности людей на водных объектах.
2. Осуществление целевых и научно-технических программ, направленных на предупреждение чрезвычайных ситуаций и повышение устойчивости функционирования организаций, а также объектов социального назначения в чрезвычайных ситуациях.
3. Обеспечение готовности к действиям органов управления, сил и средств, предназначенных и выделяемых для предупреждения и ликвидации чрезвычайных ситуаций.
4. Сбор, обработка, обмен и выдача информации в области защиты населения и территорий от чрезвычайных ситуаций;
5. Подготовка населения к действиям в чрезвычайных ситуациях, в том числе организация разъяснительной и профилактической работы среди населения в целях предупреждения возникновения чрезвычайных ситуаций на водных объектах.
Подготовка населения к действиям в чрезвычайных ситуациях, в том числе организация разъяснительной и профилактической работы среди населения в целях предупреждения возникновения чрезвычайных ситуаций на водных объектах.
6. Организация оповещения населения о чрезвычайных ситуациях и информирования населения о чрезвычайных ситуациях, в том числе экстренного оповещения населения.
7. Прогнозирование угрозы возникновения чрезвычайных ситуаций, оценка социально-экономических последствий чрезвычайных ситуаций;
8. Создание резервов финансовых и материальных ресурсов для ликвидации чрезвычайных ситуаций;
9. Осуществление государственной экспертизы, государственного надзора в области защиты населения и территорий от чрезвычайных ситуаций.
10. Ликвидация чрезвычайных ситуаций;
11. Осуществление мероприятий по социальной защите населения, пострадавшего от чрезвычайных ситуаций, проведение гуманитарных акций;
12. Реализация прав и обязанностей населения в области защиты от чрезвычайных ситуаций, а также лиц, непосредственно участвующих в их ликвидации;
13. Международное сотрудничество в области защиты населения и территорий от чрезвычайных ситуаций, в том числе обеспечения безопасности людей на водных объектах.
Международное сотрудничество в области защиты населения и территорий от чрезвычайных ситуаций, в том числе обеспечения безопасности людей на водных объектах.
Организация Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций
1. ТЕСТ «Организация Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций (РСЧС)
2. 1. РСЧС создана с целью
а) прогнозирования ЧС на территории РоссийскойФедерации и организации проведения аварийноспасательных и других неотложных работ;
б) объединения усилий органов центральной
власти, органов исполнительной власти субъектов
Российской Федерации, городов и районов, а также
организаций, учреждений и предприятий, их сил и
средств в области предупреждения и ликвидации
чрезвычайных ситуаций;
в) обеспечения первоочередного жизнеобеспечения
населения, пострадавшего в чрезвычайных
ситуациях на территории Российской Федерации.

3. 2. РСЧС состоит из … подсистем :
2. РСЧС состоит из … подсистем :а) территориальных;
б) функциональных;
в) правительственных.
4. 3. Территориальные подсистемы РСЧС создаются:
3. Территориальные подсистемы РСЧСсоздаются:
а) для предупреждения и ликвидации чрезвычайных
ситуаций в городах и районах;
б) для предупреждения и ликвидации чрезвычайных
ситуаций в поселках и населенных пунктах;
в) для предупреждения и ликвидации чрезвычайных
ситуаций на промышленных объектах;
г) для предупреждения и ликвидации чрезвычайных
ситуаций в субъектах Российской Федерации в пределах их
территорий и состоят из звеньев, соответствующих
административно-территориальному делению этих
территорий.
5. 4. РСЧС имеет пять уровней. Назовите их:
4. РСЧС имеет пять уровней.Назовите их:
а) объектовый;
б) производственный;
в) местный;
г) поселковый;
д) районный;
е) территориальный;
ж) региональный;
з) республиканский;
и) федеральный.

6. 5. Каждый уровень РСЧС имеет:
5. Каждый уровень РСЧС имеет:а) координирующие органы;
б) постоянно действующие органы управления,
специально уполномоченные на решение задач в
области защиты населения и территорий от
чрезвычайных ситуаций;
в) органы повседневного управления;
г) силы и средства;
д) силы оперативной готовности;
е) финансовые и материальные резервы;
ж) системы связи, оповещения, информационного
обеспечения.
Найдите лишнее!
7. 6. Координирующим органом РСЧС на территориальном уровне, охватывающим территорию субъекта Российской Федерации, является
комиссия почрезвычайным ситуациям:
а) межведомственная;
б) ведомственная;
в) органа исполнительной власти
субъекта Российской Федерации.
8. 7. Комиссия по чрезвычайным ситуациям органа местного самоуправления является координирующим органом РСЧС на:
7. Комиссия по чрезвычайным ситуацияморгана местного самоуправления
является координирующим органом РСЧС
на:
а) региональном уровне;
б) федеральном уровне;
в) объектовом уровне;
г) местном уровне;
д) территориальном уровне.

9. 8. Рабочими органами комиссий по чрезвычайным ситуациям соответствующих органов государственной власти и местного
самоуправления являются:а) специально создаваемые штабы;
б) органы управления (комитеты, управления,
отделы) по делам ГОЧС;
в) эвакуационные комиссии.
10. 9. В зависимости от обстановки, масштаба прогнозируемой или возникшей чрезвычайной ситуации устанавливается один из следующих
режимов функционирования РСЧС:а) повседневной деятельности:
б) прогнозирования обстановки;
в) повышенной готовности;
г) чрезвычайной ситуации;
д) оперативного реагирования.
11. 10. Назовите закон в России, определяющий правовые и организационные нормы в области защиты от чрезвычайных ситуаций:
10. Назовите закон в России,определяющий правовые и
организационные нормы в области
защиты от чрезвычайных ситуаций:
а) закон Российской Федерации «О безопасности»;
б) Федеральный закон «Об обороне»;
в) Федеральный закон «О защите населения и
территорий от чрезвычайных ситуаций природного и
техногенного характера»;
г) Федеральный закон «О гражданской обороне».

12. 11. Назовите федеральный орган в России, решающий задачи безопасности жизнедеятельности населения:
а) МО;б) МПС;
в) МЧС;
г) Минюст.
Единая Российская государственная система предупреждения и ликвидации чрезвычайных ситуаций
[pic 1]
1 Единая Российская государственная система предупреждения и ликвидации чрезвычайных ситуаций
Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций (РСЧС) – это система, объединяющая органы управления, силы и средства федеральных органов исполнительной власти, органов исполнительной власти субъектов Российской Федерации, органов местного самоуправления и организаций, в полномочия которых входит решение вопросов в области защиты населения и территорий от чрезвычайных ситуаций природного и техногенного характера.
Приставки ФП и (или) ТП к РСЧС расшифровываются как «функциональная подсистема» и «территориальная подсистема» соответственно.
Наиболее ярко выражены две целевые функции РСЧС:
- предупреждение возникновения и снижение размеров ущерба от ЧС;
- ликвидация чрезвычайных ситуаций.

В соответствии с Федеральным законом «О защите населения и территорий от чрезвычайных ситуаций природного и техногенного характера» основными задачами РСЧС являются:
- разработка и реализация правовых и экономических норм по обеспечению защиты населения и территорий от чрезвычайных ситуаций;
- осуществление целевых и научно-технических программ, направленных на предупреждение чрезвычайных ситуаций и повышение устойчивости функционирования организаций, а также объектов социального назначения в чрезвычайных ситуациях;
- обеспечение готовности к действиям органов управления, сил и средств, предназначенных и выделяемых для предупреждения и ликвидации чрезвычайных ситуаций;
- сбор, обработка, обмен и выдача информации в области защиты населения и территорий от чрезвычайных ситуаций;
- подготовка населения к действиям в чрезвычайных ситуациях;
- прогнозирование и оценка социально-экономических последствий чрезвычайных ситуаций;
- создание резервов финансовых и материальных ресурсов для ликвидации чрезвычайных ситуаций; осуществление государственной экспертизы, надзора и контроля в области защиты населения и территорий от чрезвычайных ситуаций; ликвидация чрезвычайных ситуаций;
- осуществление мероприятий по социальной защите населения, пострадавшего от чрезвычайных ситуаций, проведение гуманитарных акций;
- реализация прав и обязанностей населения в области защиты от чрезвычайных ситуаций, а также лиц, непосредственно участвующих в их ликвидации;
- международное сотрудничество в области защиты населения и территорий от чрезвычайных ситуаций.

Организационная структура РСЧС состоит из территориальных и функциональных подсистем и имеет пять уровней:
- федеральный;
- межрегиональный;
- региональный;
- муниципальный;
- объектовый.
На каждом уровне системы создаются координационные органы, постоянно действующие органы управления, органы повседневного управления, силы и средства, резервы финансовых и материальных ресурсов, системы связи, оповещения и информационного обеспечения.
РСЧС состоит из двух подсистем. Территориальные подсистемы РСЧС создаются в субъектах РФ для предупреждения и ликвидации чрезвычайных ситуаций в пределах их территорий и состоят из звеньев, соответствующих административно-территориальному делению этих территорий. Звенья (муниципальный уровень) создаются в муниципальных образованиях (район, населенный пункт) для предупреждения и ликвидации чрезвычайных ситуаций в пределах их территорий.
Задачи, организация, состав сил и средств, порядок функционирования территориальных подсистем и муниципальных звеньев определяются положениями о них, утверждаемыми соответствующими руководителями органов исполнительной власти субъектов РФ и органов местного самоуправления по согласованию с вышестоящими органами управления, специально уполномоченными на решение задач в области защиты населения и территорий от чрезвычайных ситуаций. Функциональные подсистемы РСЧС создаются федеральными органами исполнительной власти в министерствах, федеральных службах, федеральных агентствах и организациях РФ для организации работ по защите населения и территорий от чрезвычайных ситуаций в сфере их деятельности и порученных им отраслях экономики. Задачи, организация, состав сил и средств, порядок деятельности функциональных подсистем РСЧС определяются положениями о них, утверждаемыми руководителями соответствующих федеральных органов исполнительной власти по согласованию с МЧС России.
Функциональные подсистемы РСЧС создаются федеральными органами исполнительной власти в министерствах, федеральных службах, федеральных агентствах и организациях РФ для организации работ по защите населения и территорий от чрезвычайных ситуаций в сфере их деятельности и порученных им отраслях экономики. Задачи, организация, состав сил и средств, порядок деятельности функциональных подсистем РСЧС определяются положениями о них, утверждаемыми руководителями соответствующих федеральных органов исполнительной власти по согласованию с МЧС России.
границ | Фактор транскрипции основной спирали-петли-спирали редьки, RsTT8 действует как положительный регулятор биосинтеза антоцианов
Введение
Редис ( Raphanus sativus L.) принадлежит к семейству Brassicaceae и является экономически важной овощной культурой, выращиваемой для получения масла из семян и проростков, а также съедобных корнеплодов. Кроме того, они являются хорошими модельными культурами для расшифровки механизмов биосинтеза антоцианов, поскольку имеют разнообразный рисунок и интенсивность пигментации в зависимости от накопления антоцианов в листьях, стеблях и корнях. Кроме того, красный редис, содержащий антоцианы, привлек внимание как потенциальный экономический источник натурального пищевого красителя (Jing et al., 2012).
Кроме того, красный редис, содержащий антоцианы, привлек внимание как потенциальный экономический источник натурального пищевого красителя (Jing et al., 2012).
Антоцианы и проантоцианидины (ПА, также называемые конденсированными танинами) являются основными пигментными метаболитами флавоноидных соединений и в изобилии содержатся в кожуре семян, листьях, плодах, цветах и коре многих видов растений (Dixon et al., 2005). Пути биосинтеза антоцианов и флавоноидов были тщательно охарактеризованы, и соответствующие структурные гены, участвующие в этих путях, были изучены на нескольких видах растений, включая Arabidopsis thaliana, Oryza sativa (рис) и Malus domestica (яблоко) (Grotewold, 2006; Лин-Ванг и др., 2010; Лим и Ха, 2013). Структурные гены, кодирующие ферменты пути биосинтеза антоцианов, регулируются факторами транскрипции (TF) и синергически экспрессируются во время накопления антоцианов (Koes et al., 2005; Grotewold, 2006).
Биосинтез антоцианов активируется TF R2R3 MYB, основной спираль-петля-спираль (bHLH) и повторами WD40 (WDR), которые образуют комплекс MBW (Hichri et al. , 2011; Xu et al., 2015). Белки R2R3 MYB в комплексе MBW играют решающую роль в контроле пространственно-временной экспрессии генов биосинтеза антоцианов.Область R3 TF R2R3 MYB взаимодействует с N-концевым доменом bHLH. В то время как R2R3 MYB и bHLH регулируют экспрессию генов биосинтеза антоцианов, WDR формирует стыковочную платформу для bHLH (Hichri et al., 2011).
, 2011; Xu et al., 2015). Белки R2R3 MYB в комплексе MBW играют решающую роль в контроле пространственно-временной экспрессии генов биосинтеза антоцианов.Область R3 TF R2R3 MYB взаимодействует с N-концевым доменом bHLH. В то время как R2R3 MYB и bHLH регулируют экспрессию генов биосинтеза антоцианов, WDR формирует стыковочную платформу для bHLH (Hichri et al., 2011).
В наших предыдущих исследованиях было подтверждено, что RsMYB1 является положительным регулятором транскрипционной активации пути биосинтеза антоцианов у красной редьки ( Raphanus sativus L.) (Lim et al., 2016a). Временная гетерологичная коэкспрессия RsMYB1 и B-Peru [белка bHLH, который, как известно, регулирует биосинтез антоцианов у кукурузы ( Zea mays )] в листьях табака приводила к синергетическому накоплению антоцианов, а эктопическая экспрессия RsMYB1 у арабидопсиса индуцировала более высокий уровень транскриптов эндогенных гены bHLH.Этот результат предполагает, что RsMYB1 контролирует биосинтез антоцианов вместе со своим партнером по связыванию bHLH. Поскольку идентичность этого белка bHLH неизвестна, в этом исследовании мы попытались идентифицировать bHLH, связанный с антоцианами, в редьке.
Поскольку идентичность этого белка bHLH неизвестна, в этом исследовании мы попытались идентифицировать bHLH, связанный с антоцианами, в редьке.
Недавнее исследование показало, что RsMYB1 активирует биосинтез антоцианов в красной редьке ( Raphanus sativus L.), а паттерны транскриптов RsMYB1 совпадают с таковыми у RsTT8 в тканях, накапливающих антоцианы (Lim et al., 2016a).Временная гетерологичная коэкспрессия RsMYB1 и B-Peru [белка bHLH, который, как известно, регулирует биосинтез антоцианов в кукурузе ( Zea mays )] в листьях табака привела к синергетическому накоплению антоцианов. Таким образом, RsMYB1 вместе со своим партнером по связыванию bHLH контролирует биосинтез антоцианов. Поскольку идентичность этого белка bHLH неизвестна, в этом исследовании мы попытались идентифицировать bHLH, связанный с антоцианами, в редьке.
Белки bHLH представляют собой большой класс факторов транскрипции, которые были отнесены к 26 подгруппам (Pires and Dolan, 2009). Связанные с флавоноидами bHLH, которые объединяются в подгруппу IIIf, содержат область взаимодействия с MYB (MIR) на N-конце, за которой следует область взаимодействия WDR через кислотный домен (WD/AD), домен bHLH и С-концевую область. , которые опосредуют образование гомодимеров или гетеродимеров с другими белками bHLH (Heim et al., 2003; Feller et al., 2006). Первые bHLH TF, регулирующие биосинтез антоцианов, были идентифицированы в кукурузе и были обозначены как Red1 и Booster1 (Chandler et al., 1989).Последующая работа выявила ряд дополнительных TF bHLH, которые регулируют биосинтез флавоноидов, включая AN1 и JAF13 у петунии ( Petunia hybrida ) (Quattrocchio et al., 1998; Spelled et al., 2000), TT8 и GLABRA3 (GL3) у Arabidopsis. (Nesi et al., 2000; Feyissa et al., 2009), StbHLh2 и StJAF13 у картофеля ( Solanum tuberosum ) (Payyavula et al., 2013; D’amelia et al., 2014), CmbHLh3 у хризантемы ( Chrysanthemum morifolium ) (Xiang et al., 2015), MdbHLh4 и MdbHLh43 у яблони (Espley et al.
Связанные с флавоноидами bHLH, которые объединяются в подгруппу IIIf, содержат область взаимодействия с MYB (MIR) на N-конце, за которой следует область взаимодействия WDR через кислотный домен (WD/AD), домен bHLH и С-концевую область. , которые опосредуют образование гомодимеров или гетеродимеров с другими белками bHLH (Heim et al., 2003; Feller et al., 2006). Первые bHLH TF, регулирующие биосинтез антоцианов, были идентифицированы в кукурузе и были обозначены как Red1 и Booster1 (Chandler et al., 1989).Последующая работа выявила ряд дополнительных TF bHLH, которые регулируют биосинтез флавоноидов, включая AN1 и JAF13 у петунии ( Petunia hybrida ) (Quattrocchio et al., 1998; Spelled et al., 2000), TT8 и GLABRA3 (GL3) у Arabidopsis. (Nesi et al., 2000; Feyissa et al., 2009), StbHLh2 и StJAF13 у картофеля ( Solanum tuberosum ) (Payyavula et al., 2013; D’amelia et al., 2014), CmbHLh3 у хризантемы ( Chrysanthemum morifolium ) (Xiang et al., 2015), MdbHLh4 и MdbHLh43 у яблони (Espley et al.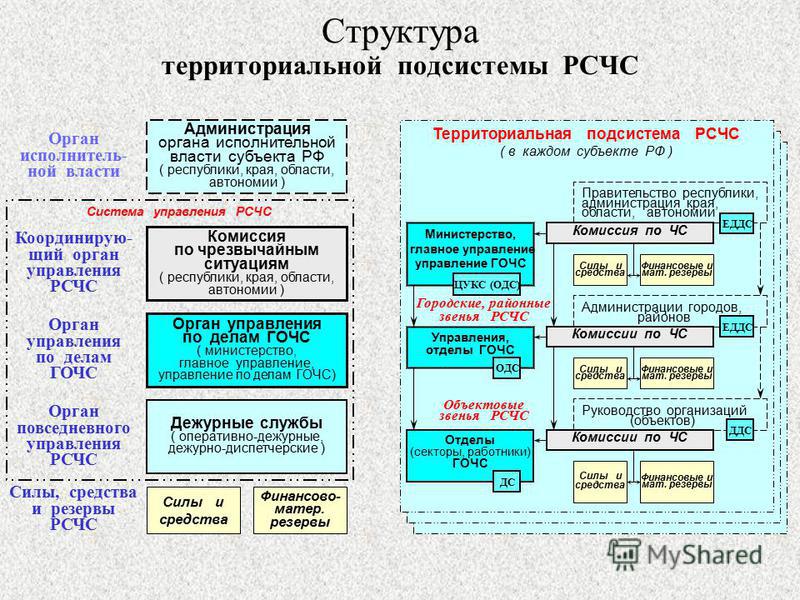 , 2007), а также FhTT8 и FhGL3 у фрезии ( Freesia hybrida ) (Li et al., 2016). Было показано, что многие из этих bHLH TF регулируют физиологические и морфологические процессы, такие как биосинтез флавоноидов и образование корневых волосков и трихом (Grotewold, 2006). Эти комбинированные результаты позволяют предположить, что TF bHLH, действующие вместе с R2R3 MYB, играют решающую роль в биосинтезе антоцианов в растениях.
, 2007), а также FhTT8 и FhGL3 у фрезии ( Freesia hybrida ) (Li et al., 2016). Было показано, что многие из этих bHLH TF регулируют физиологические и морфологические процессы, такие как биосинтез флавоноидов и образование корневых волосков и трихом (Grotewold, 2006). Эти комбинированные результаты позволяют предположить, что TF bHLH, действующие вместе с R2R3 MYB, играют решающую роль в биосинтезе антоцианов в растениях.
Здесь мы выделили транскрипционный фактор bHLH из красной редьки, который мы обозначили как RsTT8, и исследовали его роль в биосинтезе антоцианов.Мы обнаружили, что RsTT8 является положительным регулятором биосинтеза антоцианов. Мы исследовали его эктопическую экспрессию в табаке и арабидопсисе посредством временной и стабильной трансформации соответственно. Хотя гетерологичная экспрессия RsTT8 в листьях табака не приводила к накоплению антоцианов, совместная экспрессия RsTT8 с RsMYB1 приводила к более высоким уровням антоцианов, чем экспрессия только RsMYB1 . Двухгибридный анализ дрожжей (Y2H) подтвердил, что RsTT8 взаимодействует с RsMYB1, который, как известно, играет важную роль в биосинтезе антоцианов в редьке, тем самым подтверждая его роль в биосинтезе антоцианов.Кроме того, временный анализ трансактивации показал, что RsTT8 и RsMYB1 вместе активируют промотор RsCHS и RsDFR . Кроме того, RsTT8 дополнял мутант Arabidopsis tt8-1 , восстанавливая накопление антоцианов в розеточных листьях и накопление PA в семенах. В совокупности эти результаты позволяют предположить, что RsTT8 опосредует биосинтез PA в семенах и взаимодействует с RsMYB1, опосредуя биосинтез антоцианов в листьях.
Двухгибридный анализ дрожжей (Y2H) подтвердил, что RsTT8 взаимодействует с RsMYB1, который, как известно, играет важную роль в биосинтезе антоцианов в редьке, тем самым подтверждая его роль в биосинтезе антоцианов.Кроме того, временный анализ трансактивации показал, что RsTT8 и RsMYB1 вместе активируют промотор RsCHS и RsDFR . Кроме того, RsTT8 дополнял мутант Arabidopsis tt8-1 , восстанавливая накопление антоцианов в розеточных листьях и накопление PA в семенах. В совокупности эти результаты позволяют предположить, что RsTT8 опосредует биосинтез PA в семенах и взаимодействует с RsMYB1, опосредуя биосинтез антоцианов в листьях.
Результаты
Выделение кДНК RsTT8 и филогенетический анализ
Чтобы исследовать механизм, регулирующий биосинтез антоцианов в красной редьке, мы клонировали ген TF bHLH-типа из листьев редьки, клонировали с использованием дегенеративной ПЦР, 5′-RACE и 3′-RACE и обозначили этот ген как RsTT8.RsTT8 имеет ORF 1560 п.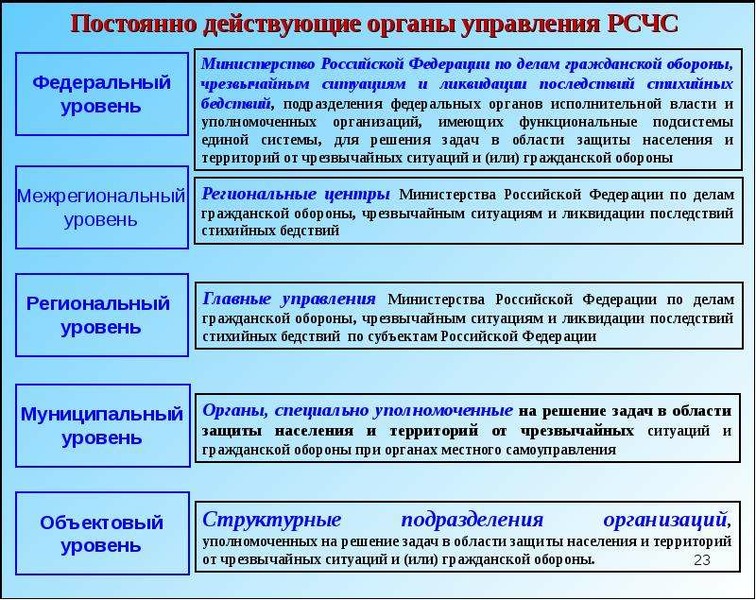 н., кодирующую полипептид из 519 аминокислот (инвентарный номер GenBank KY651179). RsTT8 содержит несколько доменов, которые консервативны в флавоноидных ТФ bHLH-типа, включая N-концевой домен MIR, домен WD/AD, домен основной спираль-петля-спираль (bHLH) и С-концевой аспартокиназу, хоризмат. мутаза, TyrA (ACT)-подобный домен. Домен bHLH содержит около 60 аминокислот, участвующих в связывании ДНК; среди этих остатков 19 аминокислотных остатков консервативны в родственных антоцианинам TF bHLH (дополнительная фигура 2).
н., кодирующую полипептид из 519 аминокислот (инвентарный номер GenBank KY651179). RsTT8 содержит несколько доменов, которые консервативны в флавоноидных ТФ bHLH-типа, включая N-концевой домен MIR, домен WD/AD, домен основной спираль-петля-спираль (bHLH) и С-концевой аспартокиназу, хоризмат. мутаза, TyrA (ACT)-подобный домен. Домен bHLH содержит около 60 аминокислот, участвующих в связывании ДНК; среди этих остатков 19 аминокислотных остатков консервативны в родственных антоцианинам TF bHLH (дополнительная фигура 2).
Затем мы провели филогенетический анализ родственных флавоноидам белков bHLH группы IIIf из различных видов растений (рис. 1) и обнаружили, что эти белки группируются в две клады, клады TT8 и GL3, как описано ранее (Davies et al., 2012). RsTT8 принадлежит к кладе TT8, в которую входят AN1 (петуния), Intensifier (кукуруза) и TT8 (арабидопсис). Клада GL3 содержит JAF13 (петуния), R (кукуруза) и GL3/EGL3 (арабидопсис). Каждая клада ТФ bHLH группы IIIf играет уникальную роль и/или частично дублирующую функцию (Hichri et al. , 2011). Например, AtTT8 и AtGL3 выполняют разные функции в биосинтезе PA и образовании трихом соответственно, но частично дублируют функции в биосинтезе антоцианов.
, 2011). Например, AtTT8 и AtGL3 выполняют разные функции в биосинтезе PA и образовании трихом соответственно, но частично дублируют функции в биосинтезе антоцианов.
Рисунок 1 . Соседнее соединение филогенетического дерева растительных последовательностей bHLH IIIf TF. Цифры рядом с узлами — это значения начальной загрузки из 1000 репликаций. Дерево нарисовано в масштабе, с длинами ветвей в тех же единицах, что и эволюционные расстояния, которые использовались для вывода филогенетического дерева (масштабная линейка, 0.1 аминокислотная замена на сайт). Следующие предполагаемые аминокислотные последовательности были извлечены из баз данных DDBJ/EMBL/GenBank: AmDEL (AAA32663) в Antirrhinum majus ; AtEGL3 (Q9CAD0), AtGL3 (NP_680372), AtMYC1 (Q8W2F1) и AtTT8 (Q9FT81) в Arabidopsis thaliana ; BnTT8 (NP_001302903) в Brassica napus ; BoTT8 (ADP76654) в Brassica oleracea ; FabHLh4 (AFL02463) в Fragaria × ananassa ; FvEGL1 (XP_004308377) в Fragaria vesca ; InDEL (BAE
) и InIVS (BAE) в Ipomoea nil ; LhbHLh2 (BAE20057) и LhbHLh3 (BAE20058) в гибриде Lilium ; LjGL3 (AB4) и LjTT8 (AB4 ) в Lotus japonicus ; MdbHLh4 (ADL36597) и MdbHLh43 (ABB84474) в Malus domestica ; NsAN1 (HQ589210) в Nicotiana sylvestris ; NtAN1a (HQ589208), NtAN1b (HQ589209), NtJAF13a (KF305768) и NtJAF13b (KF298397) в Nicotiana tabacum ; NtoAN1 (HQ589211) в Nicotiana tomentosiformis ; PhAN1 (AAG25928) и PhJAF13 (AAC39455) в Petunia × hybrida ; PfF3G1 (AB103172) и MYC-RP (AB024050) в Perilla frutescens ; RsTT8 (KY651179) в Raphanus sativus ; StAN1 (JX848660) и StJAF13 (NM_001288203) в Solanum tuberosum ; VvMYC1 (ACC68685) и VvMYCA1 (ABM) в Vitis vinifera ; ZmB (CAA40544), ZmIN1 (AAB03841) и ZmLc (P13526) в Zea mays . Чтобы исследовать роль RsTT8 в регуляции транскрипции, мы исследовали субклеточную локализацию RsTT8 в протопластах листьев арабидопсиса. Протопласты котрансформировали конструкциями, содержащими красный флуоресцентный белок (RFP), слитый с сигналом ядерной локализации (NLS) большого Т-антигена SV40 и растворимым GFP (sGFP) или слиянием RsTT8::GFP. Как показано на рисунке 2, флуоресценция GFP наблюдалась в ядрах протопластов, несущих RsTT8::GFP, но по всей цитоплазме тех, которые содержали контроль GFP.Эти результаты указывают на то, что RsTT8 локализован в ядре, что согласуется с его предполагаемой ролью фактора транскрипции. Рисунок 2 . Субклеточная локализация RsTT8 в протопластах листьев арабидопсиса. (A) В этом эксперименте использовали три конструкции: sGFP, растворимый GFP; RsTT8::GFP, RsTT8, объединенный с GFP; и NLS::RFP, сигнал ядерной локализации, слитый с RFP. (B) Нацеливание in vivo на RsTT8 в протопластах арабидопсиса. Для изучения механизмов, контролирующих биосинтез антоцианов, мы проанализировали три сорта редьки, различающиеся по пигментации. Сорт N имеет зеленые листья и белую корневую мякоть и кожицу. Сорт C имеет зеленые листья и красную корневую мякоть с белой корневой кожицей.Сорт D имеет красные листья и белую корневую мякоть с красной кожицей корня (рис. 3А). Содержание антоцианов было количественно определено в листьях, корневой мякоти и кожуре корней этих трех сортов редьки (рис. 3В). Содержание антоцианов в основном соответствовало видимой красной пигментации; Уровни антоцианов были высокими в листьях сорта D, мякоти сорта C и кожуре сорта D. Эти результаты позволяют предположить, что различия в содержании антоцианов в листьях, корневой мякоти и кожуре корней ответственны за различия в фенотипах красной окраски сортов редьки. Рисунок 3 . Фенотипы и содержание антоцианов в трех разных сортах редьки. (A) Листья и корни трех сортов редьки, использованных в этом исследовании. (B) Содержание антоцианов. Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. * и *** обозначают значения, которые достоверно отличаются от сорта N при P < 0,05 и P < 0,001 соответственно по парному t -критерию Стьюдента. Затем мы исследовали уровни транскриптов следующих генов в листьях, корневой мякоти и кожуре корней трех сортов редьки (рис. 4): три регуляторных гена, включая bHLH-тип RsTT8 , R2R3-MYB- введите RsMYB1 и WDR RsTTG1 ; и шесть структурных генов, участвующих в биосинтезе антоцианов, включая восходящий ген RsPAL , ранние гены биосинтеза (EBG) RsCHS, RsCHI и RsF3H , а также поздние гены биосинтеза (LBGs) RsDFR 900 . Рисунок 4 . Экспрессия регуляторных и структурных генов в пути биосинтеза антоцианов у трех разных сортов редьки. Чтобы подтвердить роль RsTT8 и RsMYB1 в биосинтезе антоцианов, мы провели анализ экспрессии путем инфильтрации листьев табака штаммами Agrobacterium, содержащими RsMYB1 и RsTT8 (рис. 5А). Мы обнаружили, что сам по себе RsTT8 не вызывает накопления антоцианов в листьях табака, как и в контрольной группе с имитацией инфильтрации.Напротив, только RsMYB1 и RsMYB1, коэкспрессированный с RsTT8, приводили к красной пигментации инфильтрированных листьев табака. Рисунок 5 . Содержание антоцианов во временно трансформированных листьях табака, инфильтрированных штаммами Agrobacterium, несущими RsMYB1 и RsTT8 . (A) Изображения транзиентно трансформированных листьев табака через 5 дней после агроинфильтрации.Указаны четыре различных анализа: (1) пустой вектор, (2) RsTT8 (bHLH), (3) RsMYB1 (MYB) и (4) RsTT8 и RsMYB1 . Чтобы подтвердить взаимосвязь между уровнями экспрессии генов биосинтеза антоцианов и содержанием антоцианов, мы проанализировали экспрессию десяти структурных генов, участвующих в биосинтезе антоцианов, в инфильтрированных листьях табака с помощью количественной ПЦР. Осмотренные гены включали гены вверх по течению, NTPAL и NTCHS , EBGS NTCHS, NTCHI, NTF3H, NTF3 ‘ H и NTFLS , а также NTDFR, NTANS и NTUFGT (Рисунок 5С). Комплекс MBW регулирует экспрессию генов, участвующих в биосинтезе антоцианов.Чтобы исследовать взаимодействие между RsMYB1 и RsTT8, мы сконструировали четыре вектора-приманки, кодирующие различные области RsTT8 (т. Рисунок 6 . Физическое взаимодействие между RsTT8 и RsMYB1. (A) Схема полноразмерного и частично укороченного RsTT8. (B) Дрожжевой двухгибридный анализ взаимодействий между RsMYB1 и различными укорочениями RsTT8. SD, минимальный средний; AD, только домен активации; BD, только связывающий домен; 3АТ, 3-амино-1,2,4-триазол; L, лейцин; Т, триптофан; Н, гистидин. Биосинтез антоцианов контролируется различными ТФ в пути биосинтеза антоцианов (Hichri et al., 2011; Сюй и др., 2015). Проксимальные промоторные области генов, участвующих в биосинтезе антоцианов, обычно содержат 7-п. соответственно (Zhu et al., 2015). Наши результаты показывают, что RsMYB1 и RsTT8 совместно регулируют биосинтез антоцианов (рис. 4, 5). Таким образом, мы исследовали, могут ли эти TF активировать экспрессию RsCHS и RsDFR , которые демонстрировали более высокие уровни экспрессии в тканях редьки, накапливающих антоцианы, и содержали ряд MRE и BRE в своих промоторах (дополнительная фигура 1), используя переходный система трансактивации. Рисунок 7 . Влияние RsTT8 и RsMYB1 на активность промоторов RsCHS и RsDFR . (A) Эффекторные и репортерные конструкции, используемые в этом анализе активации транскрипции. Затем мы проверили влияние RsTT8 на путь биосинтеза флавоноидов путем экспрессии RsTT8 в мутанте Arabidopsis tt8-1 (SALK_030966), у которого дефицит PA, что приводит к желтым семенам, и не хватает антоцианина на стыке между стеблем и стеблем. розеточные листья (рис. 8А). Семенное потомство T 2 , происходящее от 18 независимых трансформантов T 1 , устойчивых к Basta, давало коричневые семена, сходные с семенами арабидопсиса дикого типа. Рисунок 8 . Фенотипы и содержание антоцианов в трансгенных растениях арабидопсиса T 2 . (A) Фенотипические изменения у tt8-1 мутантов, экспрессирующих RsTT8 . Семена (вверху) и 3-недельные проростки Col-0 дикого типа (слева), мутант tt8-1 (в центре) и потомство T 2 гомозигот tt8-1 , трансформированных с помощью RsTT8 . Биосинтез антоцианов пространственно-временно регулируется ТФ MYB и bHLH у различных растений (Hichri et al., 2011; Xu et al., 2015).Хотя известно, что RsMYB1 является ключевым регулятором биосинтеза антоцианов у редиса, до настоящего времени не сообщалось о TF bHLH у этого вида (Lim et al., 2016a). В этом исследовании мы показали, что RsTT8 является фактором транскрипции bHLH, который вместе с RsMYB1 положительно регулирует биосинтез антоцианов. В частности, мы продемонстрировали, что RsTT8 и RsMYB1 демонстрируют сходные паттерны экспрессии в антоциан-аккумулирующих тканях редьки. Уровни транскриптов генов биосинтеза антоцианов RsCHS и RsDFR были достоверно связаны с уровнями RsTT8 и RsMYB1 в листьях, мякоти корней и кожуре корней, а также с содержанием антоцианов. Комплекс MBW контролирует биосинтез антоцианов, регулируя транскрипцию структурных генов в пути биосинтеза антоцианов. Мы обнаружили, что профили экспрессии RsTT8 и RsMYB1 , а также генов пути биосинтеза антоцианов RsCHS, RsDFR и RsANS положительно связаны с характером накопления антоцианов в листьях и корнях редьки (рис. 4). .В переходном анализе эктопическая экспрессия RsMYB 1 в табаке индуцировала высокую экспрессию гена NtAN1 , которая перекрывала характер экспрессии генов пути биосинтеза антоцианов (рис. Сообщалось об иерархической регуляции между TF bHLH комплекса MBW у некоторых растений, включая арабидопсис, фрезию, петунию и табак (Albert et al., 2014; Montefiori et al., 2015; Xiang et al., 2015; Li et al., 2016; Лю и др., 2016). У арабидопсиса bHLH TF AtTT8 активировался комплексом MBW с самим AtTT8 или с другими факторами bHLH, AtGL3 и AtEGL3. В отличие от арабидопсиса PhAN1 не мог активировать собственную экспрессию, в то время как PhJAF13 активировал его.Анализ активации промотора показал, что NtJAF13 участвует в активации транскрипции в NtAN1, что приводит к регулированию генов биосинтеза антоцианов. Активация экспрессии RsCHS и RsDFR контролировалась RsMYB1 и усиливалась присутствием RsTT8 (рис. 5, 7).В предыдущем исследовании сообщалось, что MYB и bHLH нацелены на цис-элементы в генах путей биосинтеза антоцианов (Zhu et al., 2015). Промотор RsCHS содержит четыре MRE и пять BRE, тогда как промотор RsDFR содержит три из этих элементов. В то время как эти элементы широко распространены в промоторной области RsCHS , они близки к сайту начала трансляции в RsDFR (дополнительная фигура 1). Цис-архитектура определяет активность промотора (Zhu et al., 2015). Коэкспрессия RsTT8 и RsMYB1 в листьях табака увеличивала промоторную активность RsDFR в большей степени, чем активность RsCHS . Предыдущие исследования Zhu et al. (2015), было показано, что BRE и MRE расположены в проксимальных областях, как правило, в пределах 350 п. В нескольких исследованиях сообщалось, что более чем один bHLH TF регулирует биосинтез антоцианов и PA в растениях (например, AtTT8, AtGL3 и AtEGL3 у арабидопсиса (Nesi et al., 2000; Payne et al., 2000; Zhang et al., 2003), FhTT8L и FhGL3L у фрезии (Li et al., 2016), PhAN1 и PhJAF13 у петунии (Quattrocchio et al., 1998; Spelled et al., 2000) и NtAn1 и NtJAF13 у табака (Bai et al. , 2011; Монтефиори и др., 2015). Эти bHLH TF могут иметь перекрывающиеся функции в биосинтезе антоцианов, или они могут взаимодействовать со специфическими MYB TF для выполнения специализированных функций, таких как синтез PA, продукция слизи семенной оболочки и инициация трихом и корневых волосков (Petroni and Tonelli, 2011). В совокупности эти результаты показывают, что одновременная экспрессия bHLH и MYB TF очень важна для накопления антоцианов посредством активации генов пути биосинтеза антоцианов. Дальнейшие исследования иерархической регуляции и механизмов обратной регуляции комплекса MBW дадут представление о пространственно-временной регуляции биосинтеза антоцианов в растениях. Эта работа показывает, что bHLH TF RsTT8 участвует в биосинтезе антоцианов в редьке.RsTT8 принадлежит к кладе TT8 белков bHLH группы IIIf и взаимодействует с доменом MIR RsMYB1 с образованием предполагаемого комплекса MBW. Коэкспрессия RsTT8 и RsMYB1 индуцирует накопление антоцианов и активирует экспрессию генов в пути биосинтеза антоцианов. Тесты на комплементацию показывают, что RsTT8 также участвует в биосинтезе PA в семенах. семян редьки ( Raphanus sativus L.) были получены из Центра сельскохозяйственных генетических ресурсов Национальной академии сельскохозяйственных наук (Чонджу, Корея).В этом исследовании использовались следующие три сорта редьки: Cheongpihongsim (C, IT100676), Daelyughonghwan (D, IT100675) и Namwonammu (N, IT102388). Сорта редьки выращивали в теплицах и фотографировали на стадии зрелости (возраст 6 недель). Количественную полимеразную цепную реакцию (КПЦР) в режиме реального времени и анализ содержания антоцианов проводили с использованием зрелых листьев, кожицы и мякоти зрелых корней. Эксперименты по трансформации проводили с использованием Arabidopsis thaliana экотипа Columbia-0 и мутантной линии прозрачной тесты ( tt ) tt8-1 (SALK_030966), полученной из Центра биологических ресурсов арабидопсиса (ABRC).Все эти растения выращивали на среде Мурасиге и Скуга (МС) или в почве в условиях длинного дня (LD, 16 ч света/8 ч темноты, 100 мкмоль·м –2 с –1 ) при 22 °С. Тотальную РНК экстрагировали из листьев красной редьки [гомозиготное потомство F 3 сорта «Бордо» (Syngenta, Co.)] с использованием реагента TRIzol (Invitrogen, Carlsbad, CA) в соответствии с инструкциями производителя (Lim et al., 2016a). Полноразмерную кДНК гена TT8 редьки получали путем быстрой 5′-амплификации концов кДНК (RACE) и 3′-RACE с использованием набора для амплификации кДНК SMART RACE (Clontech, Madison, WI) с четырьмя генами. специфические праймеры (3’race-TT8-F1, 3’race-TT8-F2, 5’race-TT8-R1 и 5’race-TT8-R2), которые были сконструированы на основе частично секвенированного редьки TT8 ген (инвентарный номерJN625953.1). Был приготовлен дополнительный набор праймеров (RsTT8-F/RsTT8-R) для амплификации гена полноразмерной кДНК. Нуклеотидная последовательность, выведенная аминокислотная последовательность и открытая рамка считывания (ORF) RsTT8 были подвергнуты анализу BLAST на веб-сайте Национального центра биотехнологической информации (NCBI) (http://www.ncbi.nlm.nih.gov). Структурный анализ полученного белка проводили с использованием ExPASy Molecular Biology Server (https://www.expasy.org/tools). Множественное выравнивание последовательностей выполняли с использованием CLUSTAL W (Thompson et al., 1994). Филогенетическое дерево было построено методом объединения соседей (Saitou and Nei, 1987) с использованием программного обеспечения MEGA версии 6 (Kumar et al., 2001). цис- -элементов в промоторах RsCHS и RsDFR анализировали согласно методу Zhu et al. Субклеточную локализацию RsTT8 анализировали в протопластах арабидопсиса, как описано Yoo et al. (2007). Слитые конструкции GFP были созданы в плазмиде p326-sGFP, которая содержит промотор 35S вируса мозаики цветной капусты. Для C-концевого слияния GFP ORF RsTT8 амплифицировали с использованием наборов ген-специфических праймеров (p326-RsTT8-F/R), которые вводили сайт Xba I выше кодона ATG с помощью системы клонирования InFusion (Clontech ).Полученную плазмиду p326-RsTT8-sGFP секвенировали для подтверждения отсутствия ошибок при ПЦР-амплификации. Плазмиды вводили в протопласты арабидопсиса, полученные из тканей листа с помощью трансформации, опосредованной полиэтиленгликолем. Экспрессию слитой конструкции контролировали через 16–20 ч после трансформации, и изображения получали с помощью флуоресцентной конфокальной микроскопии (Leica TCS SP8, Leica Microsystems, Германия). Тотальную РНК из листьев редьки и табака получали с использованием реагента TRIzol (Invitrogen), а кДНК первой цепи получали с использованием набора кДНК EcoDry Kit (Clontech). Общее содержание антоцианов определяли по методу, описанному Shin et al. (2007). Вкратце, порошкообразные образцы тканей инкубировали в 600 мкл буфера для экстракции (метанол, содержащий 1% HCl) в течение 6 ч при 4°C при умеренном встряхивании. Затем добавляли 200 мкл воды и 200 мкл хлороформа с последующим центрифугированием при 14 000 g в течение 5 мин при 4°C для осаждения растительного материала. Для экспериментов с Y2H мы использовали векторы pGADT7 и pGBKT7, содержащие домен активации GAL4 (AD) и ДНК-связывающий домен GAL4 (BD) (Clontech).Полноразмерную кДНК RsMYB1 встраивали в вектор pGADT7, создавая конструкцию AD-RsMYB1. Для создания конструкций связывающего домена (BD) RsTT8 следующие области были амплифицированы с использованием специфических наборов праймеров: полноразмерный RsTT8 (RsTT8L), область, взаимодействующая с MYB (домен MIR), укороченный белок, включающий домен MIR (RsTT8M). ), N-концевая область, укороченный белок, включающий домены MIR и WD/AD (RsTT8N), и С-концевая область, укороченный белок, включающий bHLH и ACT-подобные домены (RsTT8C) (дополнительная таблица 1). Плазмида, используемая для транзиторной трансформации табака и стабильной трансформации арабидопсиса, была сконструирована следующим образом.ORF RsTT8 субклонировали в вектор pENTR/D-TOPO (Invitrogen) и включали в целевой вектор шлюза pB7WG2D (VIB-Гентский университет, Гент, Бельгия) посредством нескольких этапов клонирования шлюза. Полученный вектор поддерживали в штаммах Agrobacterium tumefaciens GV3101 и инфильтрировали в абаксиальные поверхности листьев Nicotiana tabacum . Цвет листьев контролировали через 5 дней после инфильтрации (dpi), как описано Lim et al. Конструкцию pB7WG2D-RsTT8 поддерживали в штамме Agrobacterium GV3101 и трансформировали в мутант Arabidopsis tt8-1 (SALK_030966) с использованием метода погружения цветков.Трансформированные семена арабидопсиса выращивали в почве в условиях 16-часового света/8-часового темноты при 20°C. Трансгенные растения арабидопсиса отбирали путем опрыскивания растений 0,3% раствором Басты. Гомозиготные линии T 2 были отобраны и использованы для дальнейшего анализа. Для выделения промоторов RsCHS (инвентарный номер: LOC108843267) и RsDFR (инвентарный номер: LOC108843267) были разработаны специфические праймеры на основе последовательности всего генома редьки (дополнительная таблица 1).Консервативные цис-элементные мотивы , расположенные в промоторах, проиллюстрированы на (дополнительной фигуре 1). Репортерную гибридную конструкцию получали путем вставки промоторов RsCHS и RsDFR в вектор pTr-GUS на 5′-конце гена GUS (производного от pBI121) после удаления промоторной области CaMV35S. проводили в N. tabacum следующим образом. Агробактерии, содержащие репортерные и эффекторные конструкции, культивировали в среде LB в течение 2 дней при 28°C, осаждали центрифугированием при 6000 об/мин в течение 5 мин при 4°C, ресуспендировали в буфере для инфильтрации (10 мМ MgCl 2 и 100 мкМ ацетосирингона) до ОД 600 из 0.2 (приблизительно 10 мл буфера) и инкубировали при комнатной температуре без встряхивания в течение 2 часов. Перед инфильтрацией листьев табака агробактерии, несущие эффекторную и репортерную конструкции, смешивали в соотношении 3:1 соответственно. S-HL разработал и провел эксперименты и подготовил фигуры. D-HK участвовал в анализе qPCR, анализе Y2H и трансформации Arabidopsis. JK проанализировал антоцианы. J-YL провела транзиентный анализ листьев табака. S-HH разработал исследование и написал рукопись с помощью S-HL. Все авторы прочитали и одобрили окончательный вариант рукописи. Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. Эта работа была поддержана средствами Национального института сельскохозяйственных наук (PJ012458201701) и грантом программы Next-Generation BioGreen 21 (PJ0110
Субклеточная локализация RsTT8
 Данные являются репрезентативными для протопластов, экспрессирующих слитые белки через 16 ч после трансформации. Бар = 10 мкм.
Данные являются репрезентативными для протопластов, экспрессирующих слитые белки через 16 ч после трансформации. Бар = 10 мкм. Анализ экспрессии структурных и регуляторных генов в путях биосинтеза антоцианов различных сортов редьки

 Уровни транскриптов RsTT8 и RsMYB1 были выше в красных листьях (т. е. сорта D), чем в зеленых листьях (сорта C и N). Подобно картине экспрессии RsTT8 и RsMYB1 , уровни транскриптов всех структурных генов были выше у сорта D, чем у сортов C и N (рис. 4А). В частности, более высокие уровни экспрессии RsMYB1 и RsTT8 в красных листьях (разновидность D), чем в зеленых листьях (разновидности C и N), были аналогичны уровням двух LBG.Уровни экспрессии RsTT8 и RsMYB1 были выше в красной корневой мякоти (разновидность C), чем в белой корневой мякоти (разновидности D и N), как и у всех структурных генов (рис. 4B). Интересно, что самые высокие уровни экспрессии RsMYB1 и RsTTG1 были обнаружены в белой корневой мякоти (разновидность D), в то время как уровни транскриптов пяти структурных генов (три EBG и два LBG, за исключением RsPAL ) были ниже у белых. (сорт D), чем в красном (сорт C) корнеплоде.Самые низкие уровни экспрессии RsTT8 и RsMYB1 были обнаружены в кожуре белого корня (разновидность N), и эти уровни были в значительной степени связаны с уровнями RsCHS и двух LBG.
Уровни транскриптов RsTT8 и RsMYB1 были выше в красных листьях (т. е. сорта D), чем в зеленых листьях (сорта C и N). Подобно картине экспрессии RsTT8 и RsMYB1 , уровни транскриптов всех структурных генов были выше у сорта D, чем у сортов C и N (рис. 4А). В частности, более высокие уровни экспрессии RsMYB1 и RsTT8 в красных листьях (разновидность D), чем в зеленых листьях (разновидности C и N), были аналогичны уровням двух LBG.Уровни экспрессии RsTT8 и RsMYB1 были выше в красной корневой мякоти (разновидность C), чем в белой корневой мякоти (разновидности D и N), как и у всех структурных генов (рис. 4B). Интересно, что самые высокие уровни экспрессии RsMYB1 и RsTTG1 были обнаружены в белой корневой мякоти (разновидность D), в то время как уровни транскриптов пяти структурных генов (три EBG и два LBG, за исключением RsPAL ) были ниже у белых. (сорт D), чем в красном (сорт C) корнеплоде.Самые низкие уровни экспрессии RsTT8 и RsMYB1 были обнаружены в кожуре белого корня (разновидность N), и эти уровни были в значительной степени связаны с уровнями RsCHS и двух LBG. В кожуре корня также уровни транскриптов всех шести структурных генов были значительно сопоставимы с уровнями RsTT8 и RsMYB1 в красной кожуре корня (разновидность D) (рис. 4C). Интересно, что уровень транскрипта RsTT8 был низким в кожуре белого корня (разновидность C), тогда как уровень транскрипта RsMYB1 был высоким.Что касается паттерна экспрессии RsTT8 , транскрипты двух EBG ( RsCHS и RsF3H ) и двух LBG были едва обнаружены в белой корневой кожуре (разновидность C). Уровни транскриптов двух LBG были значительно связаны с уровнями RsTT8 и RsMYB1 в кожуре белого корня (разновидность N). Эти объединенные результаты показывают, что высокие уровни экспрессии RsTT8 и RsMYB1 связаны с высокими уровнями транскриптов RsCHS, RsDFR и RsANS и содержанием антоцианов во всех протестированных органах трех сортов редьки (рис. 3, 4). .
В кожуре корня также уровни транскриптов всех шести структурных генов были значительно сопоставимы с уровнями RsTT8 и RsMYB1 в красной кожуре корня (разновидность D) (рис. 4C). Интересно, что уровень транскрипта RsTT8 был низким в кожуре белого корня (разновидность C), тогда как уровень транскрипта RsMYB1 был высоким.Что касается паттерна экспрессии RsTT8 , транскрипты двух EBG ( RsCHS и RsF3H ) и двух LBG были едва обнаружены в белой корневой кожуре (разновидность C). Уровни транскриптов двух LBG были значительно связаны с уровнями RsTT8 и RsMYB1 в кожуре белого корня (разновидность N). Эти объединенные результаты показывают, что высокие уровни экспрессии RsTT8 и RsMYB1 связаны с высокими уровнями транскриптов RsCHS, RsDFR и RsANS и содержанием антоцианов во всех протестированных органах трех сортов редьки (рис. 3, 4). . qPCR-анализ генов биосинтеза антоцианов в листьях (A) , мякоти корня (B) и кожуре корня (C) . Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. *, ** и *** обозначают значения, которые значительно отличаются от сорта N при P < 0,05, P < 0.01 и P < 0,001 соответственно по парному t -критерию Стьюдента.
qPCR-анализ генов биосинтеза антоцианов в листьях (A) , мякоти корня (B) и кожуре корня (C) . Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. *, ** и *** обозначают значения, которые значительно отличаются от сорта N при P < 0,05, P < 0.01 и P < 0,001 соответственно по парному t -критерию Стьюдента. Временная коэкспрессия RsTT8 и RsMYB1 увеличивает накопление антоцианов в листьях табака
 Красная пигментация появилась уже через 2 дня после инфильтрации (dpi) и постепенно накапливалась до 7 dpi. Мы измерили содержание антоцианов в листовых дисках, собранных при 5 dpi. Уровни антоцианов были едва заметны в листьях, инфильтрированных ложным контролем и RsTT8, были выше в листьях, инфильтрированных RsMYB1, и были самыми высокими в листьях, коэкспрессирующих RsTT8 и RsMYB1 (рис. 5B).Эти результаты показывают, что коэкспрессия RsTT8 и RsMYB1 стимулирует накопление антоцианов по сравнению с экспрессией только RsMYB1, и предполагают, что RsTT8 является членом комплекса MBW, который вместе с RsMYB1 регулирует биосинтез антоцианов.
Красная пигментация появилась уже через 2 дня после инфильтрации (dpi) и постепенно накапливалась до 7 dpi. Мы измерили содержание антоцианов в листовых дисках, собранных при 5 dpi. Уровни антоцианов были едва заметны в листьях, инфильтрированных ложным контролем и RsTT8, были выше в листьях, инфильтрированных RsMYB1, и были самыми высокими в листьях, коэкспрессирующих RsTT8 и RsMYB1 (рис. 5B).Эти результаты показывают, что коэкспрессия RsTT8 и RsMYB1 стимулирует накопление антоцианов по сравнению с экспрессией только RsMYB1, и предполагают, что RsTT8 является членом комплекса MBW, который вместе с RsMYB1 регулирует биосинтез антоцианов. (B) Содержание антоцианов. (C) Относительные уровни экспрессии эндогенных структурных и регуляторных генов антоцианов в растениях табака, определенные с помощью анализа количественной ПЦР. Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. *, ** и *** обозначают значения, которые значительно отличаются от контроля при P < 0.05, P < 0,01 и P < 0,001 соответственно по парному t -критерию Стьюдента.
(B) Содержание антоцианов. (C) Относительные уровни экспрессии эндогенных структурных и регуляторных генов антоцианов в растениях табака, определенные с помощью анализа количественной ПЦР. Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. *, ** и *** обозначают значения, которые значительно отличаются от контроля при P < 0.05, P < 0,01 и P < 0,001 соответственно по парному t -критерию Стьюдента. Инфильтрация только RsTT8 не индуцировала экспрессию ни одного из генов биосинтеза антоцианов, как и в контрольной группе. Инфильтрация только RsMYB1 увеличивала уровни экспрессии большинства протестированных генов, за исключением NtPAL, Nt4CL и NtFLS . Повышенные уровни экспрессии наблюдались для четырех исследованных EBG ( NtCHS, NtCHI, NtF3H и NtF3 ‘ H ) и всех трех LBG ( NtDFR, NtANS и NtUFGT ).Коинфильтрация RsTT8 с RsMYB1 существенно увеличивала уровни экспрессии четырех EBG и всех трех LBG. Повышенная экспрессия NtAN2 , bHLH TF, наблюдалась только после коинфильтрации RsTT8 и RsMYB1. Эти паттерны экспрессии генов согласуются с измеренным содержанием антоцианов и красной пигментацией, что указывает на то, что RsTT8 усиливает биосинтез антоцианов.
Инфильтрация только RsTT8 не индуцировала экспрессию ни одного из генов биосинтеза антоцианов, как и в контрольной группе. Инфильтрация только RsMYB1 увеличивала уровни экспрессии большинства протестированных генов, за исключением NtPAL, Nt4CL и NtFLS . Повышенные уровни экспрессии наблюдались для четырех исследованных EBG ( NtCHS, NtCHI, NtF3H и NtF3 ‘ H ) и всех трех LBG ( NtDFR, NtANS и NtUFGT ).Коинфильтрация RsTT8 с RsMYB1 существенно увеличивала уровни экспрессии четырех EBG и всех трех LBG. Повышенная экспрессия NtAN2 , bHLH TF, наблюдалась только после коинфильтрации RsTT8 и RsMYB1. Эти паттерны экспрессии генов согласуются с измеренным содержанием антоцианов и красной пигментацией, что указывает на то, что RsTT8 усиливает биосинтез антоцианов. Белок-белковые взаимодействия между RsMYB1 и RsTT8
 е. полноразмерный RsTT8 и частично укороченные фрагменты RsTT8, обозначенные как RsTT8L, RsTT8M, RsTT8N и RsTT8C), слитые с BD. Эти векторы-приманки котрансформировали в штамм дрожжей Ah209 вместе с вектором-жертвой AD/RsMYB1. Дрожжевые колонии, экспрессирующие RsMYB1 и C-концевые укорочения RsTT8 [RsTT8M (усеченный белок, включающий домен MIR) и RsTT8N (усеченный белок, включающий домены MIR и WD/AD)], росли на селекционной среде (–His–Leu–Trp), содержащей 10 мМ 3AT, что указывает на сильные белок-белковые взаимодействия между RsMYB1 и RsTT8 (рис. 6).Напротив, дрожжевые колонии, экспрессирующие конструкции RsMYB1 и RsTT8, содержащие С-концевую область [RsTT8L (полноразмерный белок) и RsTT8C (усеченный белок, включающий bHLH и ACT-подобные домены)], не росли на селекционной среде (-His-Leu- Trp), содержащий 10 мМ 3AT, что указывает на то, что С-концевая область не важна для белок-белковых взаимодействий между RsMYB1 и RsTT8. Эти результаты подтверждают, что N-концевой домен MIR необходим для белок-белковых взаимодействий между RsTT8 и RsMYB1, и предполагают, что RsTT8 является компонентом комплекса MBW, участвующего в биосинтезе антоцианов.
е. полноразмерный RsTT8 и частично укороченные фрагменты RsTT8, обозначенные как RsTT8L, RsTT8M, RsTT8N и RsTT8C), слитые с BD. Эти векторы-приманки котрансформировали в штамм дрожжей Ah209 вместе с вектором-жертвой AD/RsMYB1. Дрожжевые колонии, экспрессирующие RsMYB1 и C-концевые укорочения RsTT8 [RsTT8M (усеченный белок, включающий домен MIR) и RsTT8N (усеченный белок, включающий домены MIR и WD/AD)], росли на селекционной среде (–His–Leu–Trp), содержащей 10 мМ 3AT, что указывает на сильные белок-белковые взаимодействия между RsMYB1 и RsTT8 (рис. 6).Напротив, дрожжевые колонии, экспрессирующие конструкции RsMYB1 и RsTT8, содержащие С-концевую область [RsTT8L (полноразмерный белок) и RsTT8C (усеченный белок, включающий bHLH и ACT-подобные домены)], не росли на селекционной среде (-His-Leu- Trp), содержащий 10 мМ 3AT, что указывает на то, что С-концевая область не важна для белок-белковых взаимодействий между RsMYB1 и RsTT8. Эти результаты подтверждают, что N-концевой домен MIR необходим для белок-белковых взаимодействий между RsTT8 и RsMYB1, и предполагают, что RsTT8 является компонентом комплекса MBW, участвующего в биосинтезе антоцианов.
RsMYB1 и RsTT8 Coreregulate
RsCHS и RsDFR Promoter Activity RsTT8 и RsMYB1 были независимо инфильтрированы или совместно инфильтрированы в листья табака вместе с модифицированными конструкциями pTr-GUS, содержащими целевые промоторы RsCHS и RsDFR , управляющие экспрессией GUS . Мы обнаружили, что RsTT8 сам по себе не активировал промоторы RsCHS и RsDFR (рис. 7). Один только RsMYB1 не активировал промотор RsCHS , но активировал промотор RsDFR (в 3,5 раза по сравнению с контролем).Коинфильтрация как RsTT8, так и RsMYB1 приводила к приблизительно 2,5-кратному и 18-кратному увеличению активности промоторов RsCHS и RsDFR соответственно. Эти результаты показывают, что опосредованная RsMYB1 активация промотора RsCHS и RsDFR усиливается TF RsTT8 bHLH.
RsTT8 и RsMYB1 были независимо инфильтрированы или совместно инфильтрированы в листья табака вместе с модифицированными конструкциями pTr-GUS, содержащими целевые промоторы RsCHS и RsDFR , управляющие экспрессией GUS . Мы обнаружили, что RsTT8 сам по себе не активировал промоторы RsCHS и RsDFR (рис. 7). Один только RsMYB1 не активировал промотор RsCHS , но активировал промотор RsDFR (в 3,5 раза по сравнению с контролем).Коинфильтрация как RsTT8, так и RsMYB1 приводила к приблизительно 2,5-кратному и 18-кратному увеличению активности промоторов RsCHS и RsDFR соответственно. Эти результаты показывают, что опосредованная RsMYB1 активация промотора RsCHS и RsDFR усиливается TF RsTT8 bHLH. Эффекторная конструкция содержит RsTT8 и RsMYB1 , управляемые промотором CaMV 35S. Репортерная конструкция содержит репортерный ген GUS , управляемый промоторами RsCHS и RsDFR . (B) Анализ активации транскрипции опосредованной RsTT8 и RsMYB1 индукции промоторов RsCHS и RsDFR . Репортерную конструкцию GUS использовали в качестве контроля, а уровни экспрессии GUS устанавливали равными 1. Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов.
Эффекторная конструкция содержит RsTT8 и RsMYB1 , управляемые промотором CaMV 35S. Репортерная конструкция содержит репортерный ген GUS , управляемый промоторами RsCHS и RsDFR . (B) Анализ активации транскрипции опосредованной RsTT8 и RsMYB1 индукции промоторов RsCHS и RsDFR . Репортерную конструкцию GUS использовали в качестве контроля, а уровни экспрессии GUS устанавливали равными 1. Результаты представляют собой средние значения ± стандартное отклонение из трех биологических повторов. Функции RsTT8 в биосинтезе проантоцианидина и антоциана
 На вегетативной стадии трансгенный Arabidopsis T 3 проявлял пурпурный пигмент в месте соединения стебля и розеточных листьев, указывая на то, что мутантный фенотип tt8-1 дополнялся экспрессией RsTT8. Затем мы экстрагировали пигменты из цельных листьев растений дикого типа, tt8-1 и tt8-1 , дополненных RsTT8 (рис. 8B). Содержание антоцианов в растениях tt8-1 составляло 4% от содержания растений дикого типа, тогда как содержание антоцианов в растениях с комплементом tt8-1 было таким же, как и в растениях дикого типа, что согласуется с окраской различных линий. .Эти результаты позволяют предположить, что RsTT8 регулирует биосинтез PA в семенах и биосинтез антоцианов в листьях и стеблях.
На вегетативной стадии трансгенный Arabidopsis T 3 проявлял пурпурный пигмент в месте соединения стебля и розеточных листьев, указывая на то, что мутантный фенотип tt8-1 дополнялся экспрессией RsTT8. Затем мы экстрагировали пигменты из цельных листьев растений дикого типа, tt8-1 и tt8-1 , дополненных RsTT8 (рис. 8B). Содержание антоцианов в растениях tt8-1 составляло 4% от содержания растений дикого типа, тогда как содержание антоцианов в растениях с комплементом tt8-1 было таким же, как и в растениях дикого типа, что согласуется с окраской различных линий. .Эти результаты позволяют предположить, что RsTT8 регулирует биосинтез PA в семенах и биосинтез антоцианов в листьях и стеблях.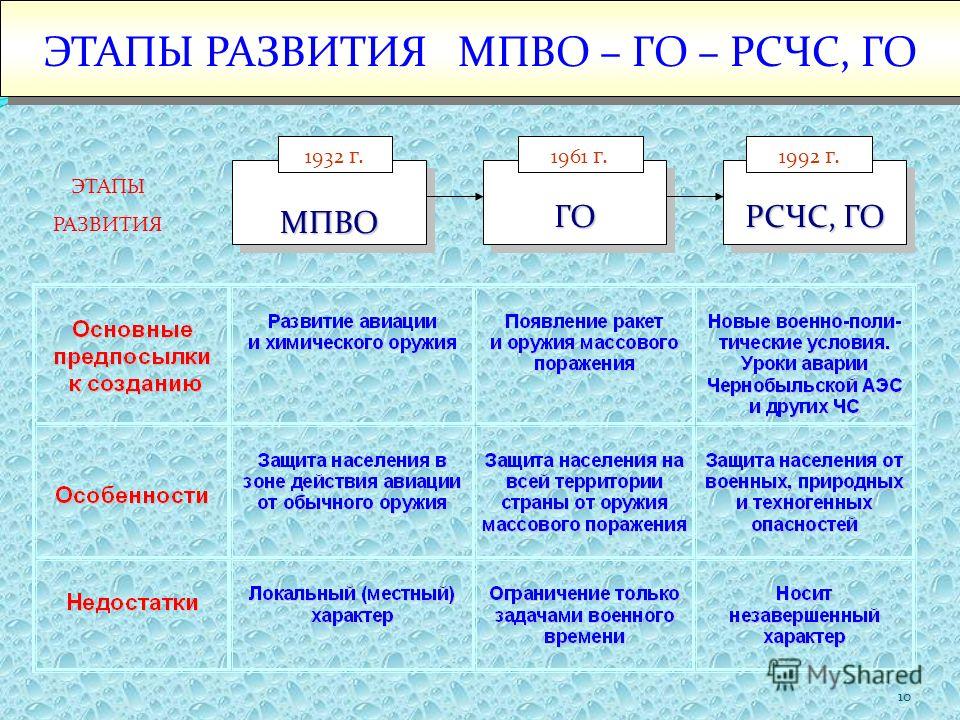 (B) Содержание антоцианов в 3-недельных проростках арабидопсиса. *** Указывает значение, которое значительно отличается от мутанта tt8-1 при P > 0,001 согласно парному тесту Стьюдента t .
(B) Содержание антоцианов в 3-недельных проростках арабидопсиса. *** Указывает значение, которое значительно отличается от мутанта tt8-1 при P > 0,001 согласно парному тесту Стьюдента t . Обсуждение
RsTT8 представляет собой фактор транскрипции bHLH, регулирующий биосинтез антоцианов
 Филогенетический анализ показал, что RsTT8 содержит домены, консервативные в ТФ bHLH. В частности, выведенная аминокислотная последовательность RsTT8 содержит домены MIR, AD/WD, bHLH и ACT (дополнительная фигура 2). Домен bHLH RsTT8 содержит примерно 60 аминокислот высококонсервативного мотива HER (His9, Glu13 и Arg17). Мотив HER был идентифицирован в TF bHLH, которые, как известно, регулируют биосинтез антоцианов у нескольких видов растений, и было показано, что он опосредует связывание с мотивом ДНК E-box (CANNTG) (Hichri et al., 2011; Сюй и др., 2015). Двойной люциферазный анализ показал, что активность промотора IpDFR-B ипомеи пурпурной ( Ipomoea purpurea ) снижалась при мутации мотива E-box (Xu et al., 2015). Филогенетический анализ показал, что RsTT8 принадлежит к кладе TT8 подгруппы bHLH IIIf, сгруппированной с bHLH арабидопсиса, капусты и рапса (т. е. членов семейства Brassicaceae ).
Филогенетический анализ показал, что RsTT8 содержит домены, консервативные в ТФ bHLH. В частности, выведенная аминокислотная последовательность RsTT8 содержит домены MIR, AD/WD, bHLH и ACT (дополнительная фигура 2). Домен bHLH RsTT8 содержит примерно 60 аминокислот высококонсервативного мотива HER (His9, Glu13 и Arg17). Мотив HER был идентифицирован в TF bHLH, которые, как известно, регулируют биосинтез антоцианов у нескольких видов растений, и было показано, что он опосредует связывание с мотивом ДНК E-box (CANNTG) (Hichri et al., 2011; Сюй и др., 2015). Двойной люциферазный анализ показал, что активность промотора IpDFR-B ипомеи пурпурной ( Ipomoea purpurea ) снижалась при мутации мотива E-box (Xu et al., 2015). Филогенетический анализ показал, что RsTT8 принадлежит к кладе TT8 подгруппы bHLH IIIf, сгруппированной с bHLH арабидопсиса, капусты и рапса (т. е. членов семейства Brassicaceae ). Кроме того, MBW контролирует многие другие физиологические процессы, такие как формирование паттерна трихом и образование слизи семян. Ранее анализы Y2H показали, что белки bHLH, такие как AtTT8 и AtEGL, взаимодействуют с антоциан-активирующими MYB, включая AtPAP1, AtPAP2, AtMYB113 и AtMYB114 (Zimmermann et al., 2004). В этом исследовании мы показали, что N-концевая область RsTT8 (т.e., RsTT8C и RsTT8L) ингибировали взаимодействие (фиг. 6). Этот результат предполагает, что домен MIR в N-концевой области RsTT8 необходим для взаимодействия с RsMYB1.
Кроме того, MBW контролирует многие другие физиологические процессы, такие как формирование паттерна трихом и образование слизи семян. Ранее анализы Y2H показали, что белки bHLH, такие как AtTT8 и AtEGL, взаимодействуют с антоциан-активирующими MYB, включая AtPAP1, AtPAP2, AtMYB113 и AtMYB114 (Zimmermann et al., 2004). В этом исследовании мы показали, что N-концевая область RsTT8 (т.e., RsTT8C и RsTT8L) ингибировали взаимодействие (фиг. 6). Этот результат предполагает, что домен MIR в N-концевой области RsTT8 необходим для взаимодействия с RsMYB1. Взаимодействие RsTT8 и RsMYB1 для регуляции биосинтеза антоцианов
 5). Эти результаты согласуются с предыдущей работой о том, что белки bHLH и MYB играют важную роль в биосинтезе антоцианов (Liu et al., 2016; Li et al., 2017). Интересно, что уровень транскриптов RsMYB1 и RsTTG1 был самым высоким, но уровень RsTT8 был ниже в белой корневой мякоти (разновидность D), как и в случае с белой мякотью картофеля (Liu et al., 2016). Этот результат предполагает, что RsTT8 является лимитирующим регулятором биосинтеза антоцианов в мясе.
5). Эти результаты согласуются с предыдущей работой о том, что белки bHLH и MYB играют важную роль в биосинтезе антоцианов (Liu et al., 2016; Li et al., 2017). Интересно, что уровень транскриптов RsMYB1 и RsTTG1 был самым высоким, но уровень RsTT8 был ниже в белой корневой мякоти (разновидность D), как и в случае с белой мякотью картофеля (Liu et al., 2016). Этот результат предполагает, что RsTT8 является лимитирующим регулятором биосинтеза антоцианов в мясе. Подобный иерархический паттерн экспрессии между FhGL3L и FhTT8L также наблюдался у фрезии. По-видимому, это общая регуляторная сеть между bHLH TF комплекса MBW для биосинтеза антоцианов.
Подобный иерархический паттерн экспрессии между FhGL3L и FhTT8L также наблюдался у фрезии. По-видимому, это общая регуляторная сеть между bHLH TF комплекса MBW для биосинтеза антоцианов. н. от места начала трансляции генов пути биосинтеза антоцианов. Путем анализа 159 промоторов 35 видов было обнаружено, что спаривание между BRE и MRE находится в пределах 100 п.н. друг от друга более чем в половине случаев (53%), включая Ginkgo biloba , однодольные и двудольные.Кроме того, искусственное увеличение расстояния между BRE и MRE значительно ослабляло силу активности промотора. В совокупности эти результаты показывают, что расположение цис--элементов более важно, чем количество цис--элементов.
н. от места начала трансляции генов пути биосинтеза антоцианов. Путем анализа 159 промоторов 35 видов было обнаружено, что спаривание между BRE и MRE находится в пределах 100 п.н. друг от друга более чем в половине случаев (53%), включая Ginkgo biloba , однодольные и двудольные.Кроме того, искусственное увеличение расстояния между BRE и MRE значительно ослабляло силу активности промотора. В совокупности эти результаты показывают, что расположение цис--элементов более важно, чем количество цис--элементов. Мы заметили, что RsTT8 играет перекрывающуюся роль в биосинтезе PA в семенах и накоплении антоцианов в листьях и стеблях (рис. 8).Листья трансгенного табака, совместно экспрессирующие RsTT8 и RsMYB1, накапливали значительно более высокие уровни антоцианов, чем листья, экспрессирующие только RsMYB1 или RsTT8 (рис. 5). Кроме того, накопление антоцианов было связано с активацией NtAN1 , эндогенного TF bHLH. В предыдущих исследованиях сообщалось, что экспрессия экзогенного MYB в табаке приводила к повышенному накоплению антоцианов, если усиливалась экспрессия эндогенного NtAN1 (Montefiori et al., 2015; Liu et al., 2016; Chen et al., 2017). Однако трансгенная петуния, содержащая MdMYB10 R6 , имела окрашенный цветок и отсутствие накопления пигмента в вегетативных тканях из-за неспособности образовывать функциональный комплекс MBW для биосинтеза антоцианов (Boase et al., 2015). Фенотипические различия в накоплении пигмента у трансгенных петуний могут быть связаны с различием в доступности и связывающей способности эндогенных bHLH и WDR.
Мы заметили, что RsTT8 играет перекрывающуюся роль в биосинтезе PA в семенах и накоплении антоцианов в листьях и стеблях (рис. 8).Листья трансгенного табака, совместно экспрессирующие RsTT8 и RsMYB1, накапливали значительно более высокие уровни антоцианов, чем листья, экспрессирующие только RsMYB1 или RsTT8 (рис. 5). Кроме того, накопление антоцианов было связано с активацией NtAN1 , эндогенного TF bHLH. В предыдущих исследованиях сообщалось, что экспрессия экзогенного MYB в табаке приводила к повышенному накоплению антоцианов, если усиливалась экспрессия эндогенного NtAN1 (Montefiori et al., 2015; Liu et al., 2016; Chen et al., 2017). Однако трансгенная петуния, содержащая MdMYB10 R6 , имела окрашенный цветок и отсутствие накопления пигмента в вегетативных тканях из-за неспособности образовывать функциональный комплекс MBW для биосинтеза антоцианов (Boase et al., 2015). Фенотипические различия в накоплении пигмента у трансгенных петуний могут быть связаны с различием в доступности и связывающей способности эндогенных bHLH и WDR.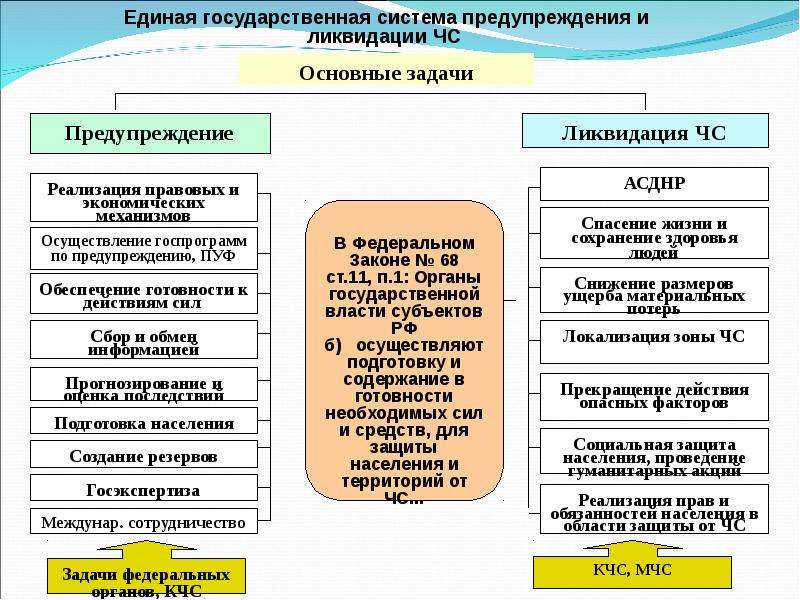 Таким образом, необходимо формирование активного комплекса за счет взаимодействия экзогенных и эндогенных ТФ для манипулирования продукцией ценных вторичных метаболитов в растениях.
Таким образом, необходимо формирование активного комплекса за счет взаимодействия экзогенных и эндогенных ТФ для манипулирования продукцией ценных вторичных метаболитов в растениях. Заключение

Материалы и методы
Растительные материалы
 Эксперименты по транзиторной трансформации проводили с использованием растений табака ( Nicotiana tabacum ), которые выращивали в теплицах при естественном освещении при 28°C.
Эксперименты по транзиторной трансформации проводили с использованием растений табака ( Nicotiana tabacum ), которые выращивали в теплицах при естественном освещении при 28°C. Клонирование
RsTT8 из растений красного редьки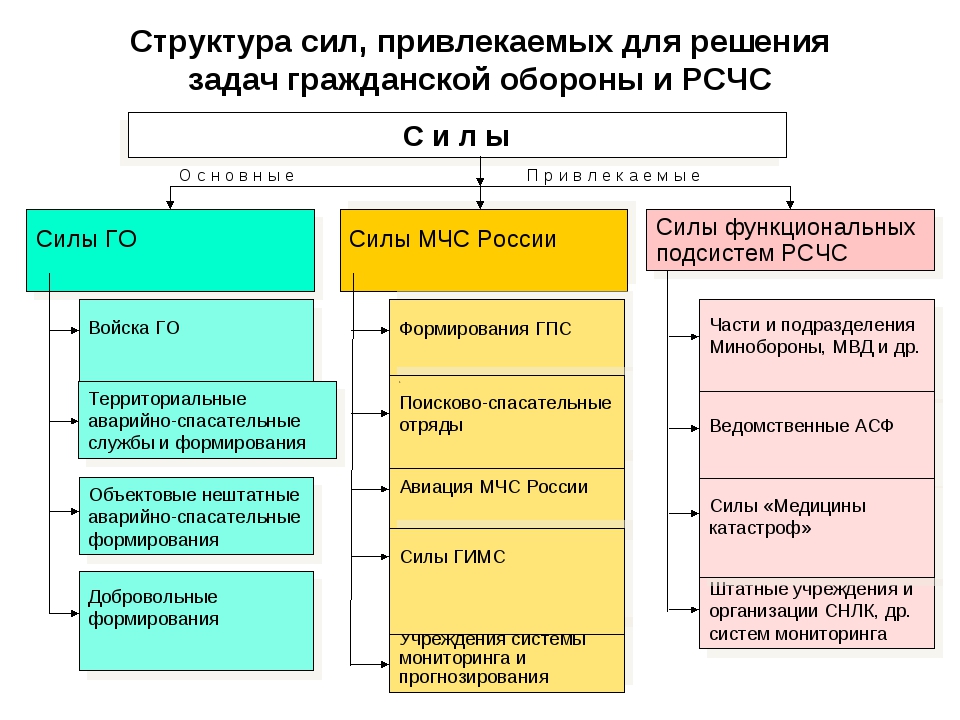 Все ПЦР-фрагменты субклонировали в вектор pGEM-T Easy (Promega, Madison, WI) или в вектор pENTR/D-TOPO (Invitrogen) для проверки последовательностей ДНК. Все последовательности праймеров перечислены в дополнительной таблице 1.
Все ПЦР-фрагменты субклонировали в вектор pGEM-T Easy (Promega, Madison, WI) или в вектор pENTR/D-TOPO (Invitrogen) для проверки последовательностей ДНК. Все последовательности праймеров перечислены в дополнительной таблице 1. Анализ биоинформатики
 (2015).
(2015). Анализ субклеточной локализации RsTT8
Количественный анализ полимеразной цепной реакции в реальном времени (qPCR)
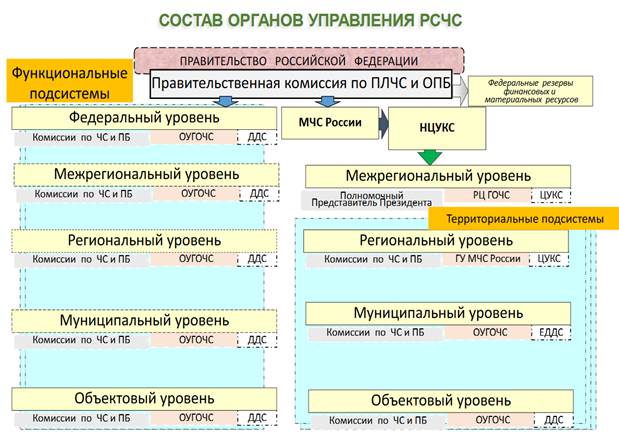 Условия количественной ПЦР и ген-специфические праймеры, за исключением условий для табака NtAN1 и NtAN2 , были такими, как описано ранее (Lim et al., 2016a,b). Праймеры КПЦР для NtAN1 и NtAN2 были следующими: -3′; R, 5′-GGCCGAGGTCCTGAATATGGTGATC-3′). Экспрессию генов нормализовали с использованием генов РНК-полимеразы-II ( RPII ) и глицеральдегид-3-фосфатдегидрогеназы ( GAPDH ) для редьки и табака, соответственно, в качестве внутренних стандартов.Для каждого образца исследовали три биологические повторности.
Условия количественной ПЦР и ген-специфические праймеры, за исключением условий для табака NtAN1 и NtAN2 , были такими, как описано ранее (Lim et al., 2016a,b). Праймеры КПЦР для NtAN1 и NtAN2 были следующими: -3′; R, 5′-GGCCGAGGTCCTGAATATGGTGATC-3′). Экспрессию генов нормализовали с использованием генов РНК-полимеразы-II ( RPII ) и глицеральдегид-3-фосфатдегидрогеназы ( GAPDH ) для редьки и табака, соответственно, в качестве внутренних стандартов.Для каждого образца исследовали три биологические повторности. Измерение общего содержания антоцианов
 Поглощение супернатанта регистрировали при 530 нм (А 530 ) и 657 нм (А 657 ) с использованием устройства для считывания микропланшетов. Содержание антоцианов определяли по следующей формуле: A 530 — 0,33 × A 657 . Содержание антоцианов в каждом образце измеряли в трех независимых экспериментах.
Поглощение супернатанта регистрировали при 530 нм (А 530 ) и 657 нм (А 657 ) с использованием устройства для считывания микропланшетов. Содержание антоцианов определяли по следующей формуле: A 530 — 0,33 × A 657 . Содержание антоцианов в каждом образце измеряли в трех независимых экспериментах. Двухгибридные анализы дрожжей (Y2H)
 Амплифицированные фрагменты лигировали в вектор pBD (Stratagene). Конструкции AD и BD котрансформировали в штамм дрожжей Ah209 в соответствии с инструкциями производителя (Stratagene). Штаммы дрожжей отбирали на среде SD без Leu и Trp и реплицировали на среде SD без Leu, Trp и His и добавляли 10 мМ 3-амино-1,2,4-триазола (3AT), конкурентного ингибитора Продукт гена HIS3 . Рост оценивали через 2 дня при 30°C.
Амплифицированные фрагменты лигировали в вектор pBD (Stratagene). Конструкции AD и BD котрансформировали в штамм дрожжей Ah209 в соответствии с инструкциями производителя (Stratagene). Штаммы дрожжей отбирали на среде SD без Leu и Trp и реплицировали на среде SD без Leu, Trp и His и добавляли 10 мМ 3-амино-1,2,4-триазола (3AT), конкурентного ингибитора Продукт гена HIS3 . Рост оценивали через 2 дня при 30°C. In Planta Assay функции RSTT8
 (2016а).
(2016а). Анализ активации промотора
 Полученные конструкции были перенесены в растительный вектор экспрессии pBAR, который был получен путем расщепления Pst I pB7WG2D.ORF RsTT8 и RsMYB1 были включены в целевой вектор шлюза pB7WG2D посредством нескольких этапов клонирования шлюза. Полученные конструкции pB7WG2D-RsTT8 и pB7WG2D-RsMYB1 использовали в качестве эффекторных конструкций. Все полученные векторы трансформировали в штамм Agrobacterium GV3101.
Полученные конструкции были перенесены в растительный вектор экспрессии pBAR, который был получен путем расщепления Pst I pB7WG2D.ORF RsTT8 и RsMYB1 были включены в целевой вектор шлюза pB7WG2D посредством нескольких этапов клонирования шлюза. Полученные конструкции pB7WG2D-RsTT8 и pB7WG2D-RsMYB1 использовали в качестве эффекторных конструкций. Все полученные векторы трансформировали в штамм Agrobacterium GV3101. Листья табака инфильтрировали агробактериями, содержащими интересующие гены, а затем листья собирали для анализа активности GUS через 3 дня после инфильтрации (dpi), как описано Lim et al. (2013). В качестве контроля использовали агробактерии, несущие только репортерную конструкцию GUS.Для каждого эксперимента использовали не менее трех биологических повторов.
Листья табака инфильтрировали агробактериями, содержащими интересующие гены, а затем листья собирали для анализа активности GUS через 3 дня после инфильтрации (dpi), как описано Lim et al. (2013). В качестве контроля использовали агробактерии, несущие только репортерную конструкцию GUS.Для каждого эксперимента использовали не менее трех биологических повторов. Вклад авторов
Заявление о конфликте интересов
Благодарности

Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fpls.2017.01917/full#supplementary-material
.Дополнительный рисунок 1 .Архитектуры промоторов RsCHS и RsDFR. (A) Схема промоторов RsCHS и RsDFR, показывающая предполагаемые bHLH- и MYB-взаимодействующие цис-элементы, участвующие в биосинтезе антоцианов. Цис-элементы обозначены разными символами. (B) Нуклеотидная последовательность промотора RsCHS. (C) Нуклеотидная последовательность промотора RsDFR. BRE и MRE обозначены красными и зелеными прямоугольниками соответственно, а ожидаемый блок TATA выделен жирным шрифтом.
Дополнительный рисунок 2 .Выравнивание белковых последовательностей RsTT8 и известных bHLH, связанных с антоцианами. MIR (MYB-взаимодействующая область), кислотные WD/AD, bHLH и ACT-подобные домены закрашены разными цветами. 19 консервативных остатков домена bHLH представлены красными прямоугольниками. Стрелки указывают мотив HER в домене bHLH.
19 консервативных остатков домена bHLH представлены красными прямоугольниками. Стрелки указывают мотив HER в домене bHLH.
Сокращения
3АТ, 3-амино-1,2,4-триазол; 4CL, 4-кумарат-КоА-лигаза; AD, домен активации; ANS, антоцианидинсинтаза; BD, связывающий домен; bHLH, базовая спираль-петля-спираль; CHI, халконизомераза; CHS, халконсинтаза; DFR, дигидрофлавонол-4-редуктаза; F3’H, флавоноид-3′-гидроксилаза; F3H, флаванон-3-гидроксилаза; FLS, флавонолсинтаза; GFP, зеленый флуоресцентный белок; MBW, белковый комплекс MYB-bHLH-WDR; PAL, фенилаланинаммиаклиаза; RFP, красный флуоресцентный белок; УФГТ, УДФ-глюкоза: флавоноид-3-О-глюкозилтрансфераза; Y2H, двухгибридный анализ дрожжей.
Ссылки
Альберт, Н.В., Дэвис, К.М., Льюис, Д.Х., Чжан, Х., Монтефиори, М., Брендолиз, К., и соавт. (2014). Законсервированная сеть активаторов и репрессоров транскрипции регулирует пигментацию антоцианов у эвдикотов. Растительная клетка 26, 962–980. doi: 10.1105/tpc. 113.122069
113.122069
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бай, Ю., Паттанаик, С., Патра, Б., Веркман, Дж. Р., Се, С. Х., и Юань, Л. (2011). Связанные с флавоноидами основные регуляторы спираль-петля-спираль, NtAn1a и NtAn1b, табака произошли от двух предков и являются функционально активными. Планта 234, 363–375. doi: 10.1007/s00425-011-1407-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Boase, M.R., Brendolise, C., Wang, L., Ngo, H., Espley, R.V., Hellens, R.P., et al. (2015). Неудачный запуск: саморегулирующийся ген Md-MYB10R6 яблони активен в цветках, но не в листьях петунии. Представитель клеток растений 34, 1817–1823. doi: 10.1007/s00299-015-1827-4
Полнотекстовая перекрестная ссылка | Академия Google
Чендлер, В.Л., Радичелла, Дж. П., Роббинс, Т. П., Чен, Дж., и Теркс, Д. (1989). Два регуляторных гена антоцианинового пути кукурузы гомологичны: выделение B с использованием геномных последовательностей R. Растительная клетка 1, 1175–1183. doi: 10.1105/tpc.1.12.1175
Растительная клетка 1, 1175–1183. doi: 10.1105/tpc.1.12.1175
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен К., Лю Х., Лу К. и Лю Ю. (2017). Эктопическая экспрессия гена транскрипционного фактора R2R3-MYB виноградного гиацинта ( Muscari armeniacum ), MaAN2 , вызывает накопление антоцианов в табаке. Фронт. Растениевод. 8:965. doi: 10.3389/fpls.2017.00965
Полнотекстовая перекрестная ссылка | Академия Google
Д’Амелия, В., Аверсано, Р., Бателли, Г., Карузо, И., Морено, М.С., Кастро-Санс, А.Б., и соавт. (2014). Высокая изменчивость AN1 и взаимодействие с основными кофакторами спираль-петля-спираль, связанными с биосинтезом антоцианов в листьях картофеля. Завод J. 80, 527–540. doi: 10.1111/tpj.12653
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дэвис, К.М., Альберт, Н.В., и Швинн, К.Е. (2012). От посадочных огней до мимикрии: молекулярная регуляция окраски цветов и механизмы формирования пигментации. Функц. Растение Био. 39, 619–638. дои: 10.1071/FP12195
Функц. Растение Био. 39, 619–638. дои: 10.1071/FP12195
Полнотекстовая перекрестная ссылка | Академия Google
Эспли, Р. В., Хелленс, Р. П., Паттерилл, Дж., Стивенсон, Д. Э., Катти-Амма, С., и Аллан, А. С. (2007). Красная окраска плодов яблони связана с активностью фактора транскрипции MYB, MdMYB10. Завод J. 49, 414–427. doi: 10.1111/j.1365-313X.2006.02964.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Феллер А., Эрнандес Дж. М. и Гротевольд Э. (2006). ACT-подобный домен участвует в димеризации нескольких растительных факторов транскрипции «основная спираль-петля-спираль». Дж. Биол. хим. 281, 28964–28974. дои: 10.1074/jbc.M603262200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фейисса, Д., Лёвдал, Т., Олсен, К., Слиместад, Р., и Лилло, К. (2009). Эндогенный ген GL3 , но не EGL3 , необходим для накопления антоцианов, вызванного истощением азота в листьях Arabidopsis на стадии розетки . Планта 230, 747–754. doi: 10.1007/s00425-009-0978-3
Планта 230, 747–754. doi: 10.1007/s00425-009-0978-3
Полнотекстовая перекрестная ссылка | Академия Google
Хейм, М. А., Якоби, М., Вербер, М., Мартин, К., Вейсшаар, Б., и Бейли, П. К. (2003). Семейство основных факторов транскрипции спираль-петля-спираль у растений: полногеномное исследование белковой структуры и функционального разнообразия. мол. биол. Эвол. 20, 735–747. doi: 10.1093/molbev/msg088
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Икри И., Барье Ф., Богс Дж., Каппель К., Делрот С. и Ловержеа В. (2011). Недавние достижения в регуляции транскрипции пути биосинтеза флавоноидов. Дж. Экспл. Бот. 62, 2465–2483. дои: 10.1093/jxb/erq442
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цзин, П., Чжао, С.Дж., Руан, С.Ю., Се, З.Х., Донг, Ю., и Ю, Л. (2012). Наличие антоцианов и глюкозинолатов в корнях китайской красной редьки ( Raphanus sativus L.) и их устойчивость к теплу и рН. Пищевая химия . 133, 1569–1576. doi: 10.1016/j.foodchem.2012.02.051
Пищевая химия . 133, 1569–1576. doi: 10.1016/j.foodchem.2012.02.051
Полнотекстовая перекрестная ссылка | Академия Google
Коес, Р., Вервей, В., и Кватроккио, Ф. (2005). Флавоноиды: красочная модель регуляции и эволюции биохимических путей. Trends Plant Sci. 10, 236–242. doi: 10.1016/j.tplants.2005.03.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кумар С., Тамура К., Якобсен И. Б. и Ней М. (2001). MEGA2: программное обеспечение для анализа молекулярно-эволюционной генетики. Биоинформатика 17, 1244–1245. doi: 10.1093/биоинформатика/17.12.1244
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, Y., Liu, X., Cai, X., Shan, X., Gao, R., Yang, S., et al. (2017). Гены дигидрофлавонол-4-редуктазы Freesia hybrida играют важную и частично перекрывающуюся роль в биосинтезе флавоноидов. Функц. биол. растений 8:428. doi: 10.3389/fpls.2017.00428
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, Y. , Shan, X., Gao, R., Yang, S., Wang, S., Gao, X., et al. (2016). Два IIIf клада-bHLH из Freesia hybrida играют разные роли в биосинтезе флавоноидов и образовании трихом при эктопической экспрессии в Arabidopsis . науч. Респ. 6:30514. дои: 10.1038/srep30514
, Shan, X., Gao, R., Yang, S., Wang, S., Gao, X., et al. (2016). Два IIIf клада-bHLH из Freesia hybrida играют разные роли в биосинтезе флавоноидов и образовании трихом при эктопической экспрессии в Arabidopsis . науч. Респ. 6:30514. дои: 10.1038/srep30514
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лим, С.H., Kim, J.K., Lee, J.Y., Kim, Y.M., Sohn, S.H., Kim, D.H., et al. (2013). Лепестковая активность промотора гена антоцианидинсинтазы табака ( Nicotiana tabacum L.). Тисс растительных клеток. Органный культ. 114, 373–383. doi: 10.1007/s11240-013-0332-0
Полнотекстовая перекрестная ссылка | Академия Google
Лим, С.Х., Сонг, Дж.Х., Ким, Д.Х., Ким, Дж.К., Ли, Дж.Ю., Ким, Ю.М., и др. (2016а). Активация биосинтеза антоцианов экспрессией гена фактора транскрипции R2R3-MYB редьки RsMYB1 . Представитель клеток растений 35, 641–653. doi: 10.1007/s00299-015-1909-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лим, С. Х., Ю, М. К., Ким, Д. Х., Ким, Дж. К., Ли, Дж. Ю., и Ха, С. Х. (2016b). Опосредованное РНК-интерференцией подавление дигидрофлавонол-4-редуктазы в табаке позволяет точно настроить цвет цветков и поток через путь биосинтеза флавоноидов. Физиол растений. Биохим. 109, 482–490. doi: 10.1016/j.plaphy.2016.10.028
Х., Ю, М. К., Ким, Д. Х., Ким, Дж. К., Ли, Дж. Ю., и Ха, С. Х. (2016b). Опосредованное РНК-интерференцией подавление дигидрофлавонол-4-редуктазы в табаке позволяет точно настроить цвет цветков и поток через путь биосинтеза флавоноидов. Физиол растений. Биохим. 109, 482–490. doi: 10.1016/j.plaphy.2016.10.028
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лим, С.Х. и Ха, С.Х. (2013). Разработка маркеров для определения окраски кожуры семян риса. Завод Биотехнолог. 7, 391–398. doi: 10.1007/s11816-013-0276-1
Полнотекстовая перекрестная ссылка | Академия Google
Лин-Ванг, К., Болито, К., Графтон, К., Кортсти, А., Карунайретнам, А., МакГи, Т.К., и соавт. (2010). Фактор транскрипции R2R3 MYB, связанный с регуляцией пути биосинтеза антоцианов у розоцветных. BMC Растение Биол. 10:50. дои: 10.1186/1471-2229-10-50
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лю, Ю. , Lin-Wang, K., Espley, R.V., Wang, L., Yang, H., Yu, B., Dare, A., et al. (2016). Функциональная диверсификация антоциановых активаторов R2R3 MYB картофеля AN1, MYBA1 и MYB113 и их взаимодействие с основными кофакторами спираль-петля-спираль. Дж. Экспл. Бот . 67, 2159–2176. дои: 10.1093/jxb/erw014
, Lin-Wang, K., Espley, R.V., Wang, L., Yang, H., Yu, B., Dare, A., et al. (2016). Функциональная диверсификация антоциановых активаторов R2R3 MYB картофеля AN1, MYBA1 и MYB113 и их взаимодействие с основными кофакторами спираль-петля-спираль. Дж. Экспл. Бот . 67, 2159–2176. дои: 10.1093/jxb/erw014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Montefiori, M., Brendolise, C., Dare, A.P., Lin-Wang, K., Davies, K.M., Hellens, R.P., et al. (2015). У Solanaceae иерархия bHLH придает антоциановому регуляторному комплексу отчетливую целевую специфичность. Дж. Экспл. Бот . 66, 1427–1436. дои: 10.1093/jxb/eru494
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Неси, Н., Дебожон, И., Йонд, К., Пеллетье, Г., Кабош, М., и Лепинец, Л. (2000). Ген TT8 кодирует основной белок домена спираль-петля-спираль, необходимый для экспрессии генов DFR и BAN у стручков арабидопсиса. Растительная клетка 12, 1863–1878 гг. doi: 10.1105/tpc.12.10.1863
doi: 10.1105/tpc.12.10.1863
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пейн, К.Т., Чжан Ф. и Ллойд А.М. (2000). GL3 кодирует белок bHLH, который регулирует развитие трихом арабидопсиса посредством взаимодействия с GL1 и TTG1. Генетика 156, 1349–1362.
Реферат PubMed | Академия Google
Payyavula, R.S., Singh, R.K., and Navarre, D.A. (2013). Факторы транскрипции, сахароза и гены метаболизма сахарозы взаимодействуют, чтобы регулировать метаболизм фенилпропаноидов картофеля. Дж. Экспл. Бот. 64, 5115–5131. doi: 10.1093/jxb/ert303
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Петрони, К.и Тонелли, К. (2011). Последние достижения в регуляции синтеза антоцианов в репродуктивных органах. Растениевод. 181, 219–229. doi: 10.1016/j.plantsci.2011.05.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Quattrocchio, F. , Wing, J.F., Va, K., Mol, J.N., and Koes, R. (1998). Анализ белков доменов bHLH и MYB: видоспецифичные регуляторные различия обусловлены дивергенцией генов-мишеней антоцианов. Завод Дж. 13, 475–488. doi: 10.1046/j.1365-313X.1998.00046.x
, Wing, J.F., Va, K., Mol, J.N., and Koes, R. (1998). Анализ белков доменов bHLH и MYB: видоспецифичные регуляторные различия обусловлены дивергенцией генов-мишеней антоцианов. Завод Дж. 13, 475–488. doi: 10.1046/j.1365-313X.1998.00046.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сайтоу, Н., и Ней, М. (1987). Метод соседнего соединения: новый метод реконструкции филогенетических деревьев. мол. биол. Эвол. 4, 406–425. doi: 10.1093/oxfordjournals.molbev.a040454
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шин, Дж. Э., Парк, Е. Н., и Чой, Г. (2007). PIF3 регулирует биосинтез антоцианов HY5-зависимым образом, при этом оба фактора непосредственно связывают промоторы генов биосинтеза антоцианов у арабидопсиса. Завод J. 49, 981–994. doi: 10.1111/j.1365-313X.2006.03021.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Спелт, К., Кватроккио, Ф. , Мол, Дж. Н., и Коес, Р. (2000). антоцианин1 петунии кодирует основной белок спираль-петля-спираль, который непосредственно активирует транскрипцию структурных генов антоцианов. Растительная клетка 12, 1619–1631. doi: 10.1105/tpc.12.9.1619
, Мол, Дж. Н., и Коес, Р. (2000). антоцианин1 петунии кодирует основной белок спираль-петля-спираль, который непосредственно активирует транскрипцию структурных генов антоцианов. Растительная клетка 12, 1619–1631. doi: 10.1105/tpc.12.9.1619
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Томпсон, Дж.Д., Хиггинс Д.Г. и Гибсон Т.Дж. (1994). CLUSTAL W: повышение чувствительности прогрессивного множественного выравнивания последовательностей за счет взвешивания последовательностей, штрафов за пробелы для конкретных позиций и выбора матрицы весов. Рез. нуклеиновых кислот. 22, 4673–4680. doi: 10.1093/нар/22.22.4673
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xiang, L.L., Liu, X.F., Li, X., Yin, X.R., Grierson, D., Li, F., et al. (2015). Новый транскрипционный фактор bHLH , участвующий в регуляции биосинтеза антоцианов у хризантем ( Chrysanthemum morifolium Ramat.). PLoS ONE 10:e0143892. doi: 10.1371/journal.pone.0143892
doi: 10.1371/journal.pone.0143892
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюй, В., Дубос, К., и Лепинец, Л. (2015). Транскрипционный контроль биосинтеза флавоноидов комплексами MYB-bHLH-WDR. Trends Plant Sci. 20, 176–185. doi: 10.1016/j.tplants.2014.12.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ю, С. Д., Чо, Ю. Х., и Шин, Дж. (2007). Протопласты мезофилла Arabidopsis : универсальная клеточная система для анализа транзиторной экспрессии генов. Нац. протокол 2:1565. doi: 10.1038/nprot.2007.199
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, Ф., Гонсалес, А.М., Пейн, К.Т., и Ллойд, А. (2003). Сеть избыточных белков bHLH функционирует во всех TTG1-зависимых путях Arabidopsis . Разработка 130, 4859–4869. doi: 10.1242/dev.00681
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжу З. , Ван Х., Ван Ю., Гуань С., Wang, F., Tang, J., et al. (2015). Характеристика цис-элементов в проксимальных промоторных областях генов антоцианинового пути выявляет общую регуляторную логику, которая управляет регуляцией пути. Дж. Экспл. Бот . 66, 3775–3789. дои: 10.1093/jxb/erv173
, Ван Х., Ван Ю., Гуань С., Wang, F., Tang, J., et al. (2015). Характеристика цис-элементов в проксимальных промоторных областях генов антоцианинового пути выявляет общую регуляторную логику, которая управляет регуляцией пути. Дж. Экспл. Бот . 66, 3775–3789. дои: 10.1093/jxb/erv173
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Циммерманн, И. М., Хейм, М. А., Вайсшаар, Б., и Уриг, Дж. Ф. (2004). Комплексная идентификация факторов транскрипции Arabidopsis thaliana MYB, взаимодействующих с R/B-подобными белками BHLH. Завод Ж. 40, 22–34. doi: 10.1111/j.1365-313X.2004.02183.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Основной фактор транскрипции спираль-петля-спираль редьки, rstt8 действует как положительный регулятор биосинтеза антоцианов — Университет Кён Хи биосинтез антоцианов
AU — Lim, Sun Hyung
AU — Kim, Da Hye
AU — Kim, Jae K.
AU — Lee, Jong Yeol
AU — Ha, Sun Hwa
N1 — Информация о финансировании: Эта работа была поддержана средствами Национального института сельскохозяйственных наук (PJ012458201701) и грантом программы Next-Generation BioGreen 21 (PJ0110
702) Управления по развитию сельских районов, Республика Корея. Авторское право издателя:
© 2017 Лим, Ким, Ким, Ли и Ха.
Авторское право издателя:
© 2017 Лим, Ким, Ким, Ли и Ха.PY — 8/11/2017
Y1 — 8/11/2017
N2 — Комплекс MYB-bHLH-WDR (MBW) активирует биосинтез антоцианов посредством регуляции транскрипции.RsMYB1 был идентифицирован как ключевой игрок в биосинтезе антоцианов у красной редьки (Raphanus sativus L.), но его партнерский транскрипционный фактор (TF) bHLH еще предстоит определить. В этом исследовании мы выделили ген bHLH TF из красной редьки. Филогенетический анализ показал, что этот ген принадлежит к кладе TT8 подгруппы IIIF ТФ bHLH, поэтому мы обозначили этот ген как RsTT8. Анализ субклеточной локализации показал, что RsTT8-sGFP был локализован в ядрах протопластов Arabidopsis thaliana, несущих конструкцию RsTT8-sGFP.Мы оценили биосинтез антоцианов и уровни экспрессии RsTT8 у трех сортов редьки (N, C и D), которые демонстрируют различные красные фенотипы в листьях, корневой мякоти и кожуре корней. Мякоть корня сорта C, а также листья и кожура сорта D имеют интенсивную красную пигментацию; в этих тканях экспрессия RsTT8 показала полностью положительную связь с экспрессией RsMYB1 TF и пяти из восьми протестированных генов биосинтеза антоцианов (т. е. RsCHS, RsCHI, RsF3H, RsDFR и RsANS).Гетерологическая коэкспрессия как RsTT8, так и RsMYB1 в листьях табака резко увеличивала экспрессию эндогенных генов биосинтеза антоцианов и накопление антоцианов. Кроме того, двухгибридный анализ дрожжей показал, что RsTT8 взаимодействует с RsMYB1 в области взаимодействия с MYB (MIR), а анализ временной трансактивации показал, что RsTT8 активирует промоторы RsCHS и RsDFR при совместной экспрессии с RsMYB1. Комплементация мутанта Arabidopsis tt8-1, у которого отсутствует красная пигментация в листьях и семенах, с помощью RsTT8 восстанавливала красную пигментацию и приводила к высокому содержанию антоцианов и проантоцианидина в листьях и семенах соответственно.Вместе эти результаты показывают, что RsTT8 функционирует как регуляторный партнер с RsMYB1 во время биосинтеза антоцианов.
е. RsCHS, RsCHI, RsF3H, RsDFR и RsANS).Гетерологическая коэкспрессия как RsTT8, так и RsMYB1 в листьях табака резко увеличивала экспрессию эндогенных генов биосинтеза антоцианов и накопление антоцианов. Кроме того, двухгибридный анализ дрожжей показал, что RsTT8 взаимодействует с RsMYB1 в области взаимодействия с MYB (MIR), а анализ временной трансактивации показал, что RsTT8 активирует промоторы RsCHS и RsDFR при совместной экспрессии с RsMYB1. Комплементация мутанта Arabidopsis tt8-1, у которого отсутствует красная пигментация в листьях и семенах, с помощью RsTT8 восстанавливала красную пигментацию и приводила к высокому содержанию антоцианов и проантоцианидина в листьях и семенах соответственно.Вместе эти результаты показывают, что RsTT8 функционирует как регуляторный партнер с RsMYB1 во время биосинтеза антоцианов.
AB — Комплекс MYB-bHLH-WDR (MBW) активирует биосинтез антоцианов посредством регуляции транскрипции. RsMYB1 был идентифицирован как ключевой игрок в биосинтезе антоцианов у красной редьки (Raphanus sativus L. ), но его партнерский транскрипционный фактор (TF) bHLH еще предстоит определить. В этом исследовании мы выделили ген bHLH TF из красной редьки. Филогенетический анализ показал, что этот ген принадлежит к кладе TT8 подгруппы IIIF ТФ bHLH, поэтому мы обозначили этот ген как RsTT8.Анализ субклеточной локализации показал, что RsTT8-sGFP был локализован в ядрах протопластов Arabidopsis thaliana, несущих конструкцию RsTT8-sGFP. Мы оценили биосинтез антоцианов и уровни экспрессии RsTT8 у трех сортов редьки (N, C и D), которые демонстрируют различные красные фенотипы в листьях, корневой мякоти и кожуре корней. Мякоть корня сорта C, а также листья и кожура сорта D имеют интенсивную красную пигментацию; в этих тканях экспрессия RsTT8 показала полностью положительную связь с экспрессией RsMYB1 TF и пяти из восьми протестированных генов биосинтеза антоцианов (т.д., РсЧС, РсЧИ, РсФ3Н, РсДФР и РсАНС). Гетерологическая коэкспрессия как RsTT8, так и RsMYB1 в листьях табака резко увеличивала экспрессию эндогенных генов биосинтеза антоцианов и накопление антоцианов.
), но его партнерский транскрипционный фактор (TF) bHLH еще предстоит определить. В этом исследовании мы выделили ген bHLH TF из красной редьки. Филогенетический анализ показал, что этот ген принадлежит к кладе TT8 подгруппы IIIF ТФ bHLH, поэтому мы обозначили этот ген как RsTT8.Анализ субклеточной локализации показал, что RsTT8-sGFP был локализован в ядрах протопластов Arabidopsis thaliana, несущих конструкцию RsTT8-sGFP. Мы оценили биосинтез антоцианов и уровни экспрессии RsTT8 у трех сортов редьки (N, C и D), которые демонстрируют различные красные фенотипы в листьях, корневой мякоти и кожуре корней. Мякоть корня сорта C, а также листья и кожура сорта D имеют интенсивную красную пигментацию; в этих тканях экспрессия RsTT8 показала полностью положительную связь с экспрессией RsMYB1 TF и пяти из восьми протестированных генов биосинтеза антоцианов (т.д., РсЧС, РсЧИ, РсФ3Н, РсДФР и РсАНС). Гетерологическая коэкспрессия как RsTT8, так и RsMYB1 в листьях табака резко увеличивала экспрессию эндогенных генов биосинтеза антоцианов и накопление антоцианов. Кроме того, двухгибридный анализ дрожжей показал, что RsTT8 взаимодействует с RsMYB1 в области взаимодействия с MYB (MIR), а анализ временной трансактивации показал, что RsTT8 активирует промоторы RsCHS и RsDFR при совместной экспрессии с RsMYB1. Комплементация мутанта Arabidopsis tt8-1, у которого отсутствует красная пигментация в листьях и семенах, с помощью RsTT8 восстанавливала красную пигментацию и приводила к высокому содержанию антоцианов и проантоцианидина в листьях и семенах соответственно.Вместе эти результаты показывают, что RsTT8 функционирует как регуляторный партнер с RsMYB1 во время биосинтеза антоцианов.
Кроме того, двухгибридный анализ дрожжей показал, что RsTT8 взаимодействует с RsMYB1 в области взаимодействия с MYB (MIR), а анализ временной трансактивации показал, что RsTT8 активирует промоторы RsCHS и RsDFR при совместной экспрессии с RsMYB1. Комплементация мутанта Arabidopsis tt8-1, у которого отсутствует красная пигментация в листьях и семенах, с помощью RsTT8 восстанавливала красную пигментацию и приводила к высокому содержанию антоцианов и проантоцианидина в листьях и семенах соответственно.Вместе эти результаты показывают, что RsTT8 функционирует как регуляторный партнер с RsMYB1 во время биосинтеза антоцианов.
KW — Антоцианин
KW — BHLH
KW — MYB
KW — Редька
KW — Транскрипционный фактор 8040OGXK
U2 — 10.3389 / FPLS.2017.01917
DO — 10.3389 / FPLS.2017.01917
м3 — Статья
AN — SCOPUS: 85034086042
VL — 8
Jo — Границы в растениях Наука
JF — Frontiers In Plant Science
SN — 1664-462X
M1 — 1917
ER —
Сравнительный транскриптомный анализ выявил ключевые гены, связанные с пигментацией у редьки (Raphanus sativus L.
 ) кожа и мясо
) кожа и мясоYao, L. H. et al. Флавоноиды в продуктах питания и их польза для здоровья. Растительные продукты Гум. Нутр. 59 , 113–122 (2004).
КАС пабмед Статья ПабМед Центральный Google Scholar
Owens, D. et al. Функциональный анализ предсказанного семейства генов флавонолсинтазы у арабидопсиса. Физиол растений. 147 , 1046–1061 (2008).
КАС пабмед ПабМед Центральный Статья Google Scholar
Mazza, G. Антоцианы во фруктах, овощах и зернах (CRC Press, 2018).
Книга Google Scholar
Гулд, К. С. Швейцарский армейский нож природы: разнообразная защитная роль антоцианов в листьях. Дж. Биомед. Биотехнолог. 2004 , 314–320 (2004).
ПабМед ПабМед Центральный Статья Google Scholar

He, J. & Giusti, M.M. Антоцианы: натуральные красители с полезными для здоровья свойствами. год. Преподобный Food Sci. Технол. 1 , 163–187 (2010).
КАС пабмед Статья Google Scholar
Wang, H. et al. Функциональная характеристика дигидрофлавонол-4-редуктазы в биосинтезе антоцианов пурпурного сладкого картофеля лежит в основе прямых доказательств действия антоцианов против абиотических стрессов. PLoS ONE 8 , e78484 (2013).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar
Lee, S. L. et al. Экстракт листьев пурпурного сладкого картофеля индуцирует апоптоз и снижает экспрессию воспалительных адипокинов в дифференцированных адипоцитах 3T3-L1. Эвид. Дополнение на основе. Альтерн. Мед. 2015 , 1–9 (2015).
Google Scholar

Harborne, JB & Williams, CA. Успехи в исследованиях флавоноидов с 1992 г. Phytochemistry 55 , 481–504 (2000).
КАС пабмед ПабМед Центральный Статья Google Scholar
Танака Ю., Сасаки Н. и Омия А. Биосинтез растительных пигментов: антоцианы, беталаины и каротиноиды. Plant J. 54 , 733–749 (2008).
КАС пабмед Статья ПабМед Центральный Google Scholar
Hichri, I. и др. Недавние достижения в регуляции транскрипции пути биосинтеза флавоноидов. Дж. Экспл. Бот. 62 , 2465–2483 (2011).
КАС пабмед Статья ПабМед Центральный Google Scholar
Allan, A.C., Hellens, R.P. & Laing, W.A. Факторы транскрипции MYB, которые окрашивают наши фрукты. Trends Plant Sci. 13 (3), 99–102 (2008).
КАС пабмед Статья ПабМед Центральный Google Scholar
Koes, R., Verweij, W. & Quattrocchio, F. Флавоноиды: красочная модель регуляции и эволюции биохимических путей. Trends Plant Sci. 10 , 236–242 (2005).
КАС пабмед Статья ПабМед Центральный Google Scholar
Матус Дж.Т., Аква, Ф. и Арсе-Джонсон, П. Анализ подсемейства винограда MYB R2R3 показывает расширенные клады, связанные с качеством вина, и консервативную организацию генной структуры в геномах Vitis и Arabidopsis . BMC Растение Биол. 8 , 83 (2008).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Hichri, I. et al. Основной фактор транскрипции спираль-петля-спираль MYC1 участвует в регуляции пути биосинтеза флавоноидов в виноградной лозе. мол. Растение. 3 , 509–523 (2010).
мол. Растение. 3 , 509–523 (2010).
КАС пабмед Статья ПабМед Центральный Google Scholar
Zheng, T. et al. Регуляция накопления антоцианов посредством репрессии транскрипции, опосредованной MYB75/HAT1/TPL. Генетика PLoS. 15 , e1007993 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar
Цзянь, В. и др. SlMYB75, фактор транскрипции типа MYB, способствует накоплению антоцианов и усиливает выделение летучих ароматов в плодах томатов. Хортик. Рез. 6 , 1–15 (2019).
КАС Статья Google Scholar
Коланеро, С., Тальяни, А., Перата, П. и Гонзали, С. Альтернативный сплайсинг антоцианового гена плода, кодирующего транскрипционный фактор R2R3 MYB, влияет на биосинтез антоцианина в плодах томатов. Завод общ. 1 , 100006 (2020).
Завод общ. 1 , 100006 (2020).
ПабМед Статья ПабМед Центральный Google Scholar
Xu, Z.S., Yang, Q.Q., Feng, K., Yu, X. & Xiong, A.S. DcMYB113, специфичный для корней R2R3-MYB, обуславливает биосинтез и модификацию антоцианов в моркови. Завод Биотехнолог. J. 18 , 1585 (2020).
КАС пабмед ПабМед Центральный Статья Google Scholar
Wang, Q., Wang, Y., Sun, H., Sun, L. & Zhang, L. Метилирование промотора RsMYB1, индуцированное транспозонами, нарушает накопление антоцианов в красной мякоти редьки. Дж. Экспл. Бот. 71 , 2537–2550 (2020).
КАС пабмед ПабМед Центральный Статья Google Scholar
Цзя, Х. и др. Абсцизовая кислота играет важную роль в регуляции созревания плодов земляники. Физиол растений.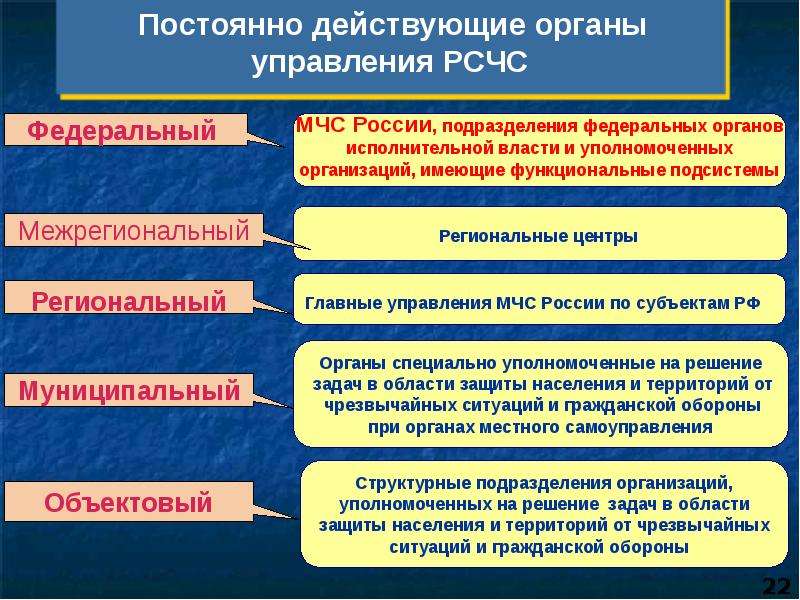 157 , 188–199 (2011).
157 , 188–199 (2011).
КАС пабмед ПабМед Центральный Статья Google Scholar
Jeong, S.W. et al. Подавление этиленом индуцированной сахаром антоциановой пигментации у арабидопсиса. Физиол растений. 154 , 1514–1531 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Дас, П.К. и др. Цитокинины усиливают индуцированный сахаром биосинтез антоцианов у арабидопсиса. мол. Ячейки 34 , 93–101 (2012).
КАС пабмед ПабМед Центральный Статья Google Scholar
Takos, A. M. et al. Вызванная светом экспрессия гена MYB регулирует биосинтез антоцианов в красных яблоках. Физиол растений. 142 , 1216–1232 (2006).
КАС пабмед ПабМед Центральный Статья Google Scholar

Huang, D. et al. Промотор ретротранспозона Ruby1 контролирует накопление антоцианов, вызванное как светом, так и холодом, в красном апельсине. Окружающая среда растительных клеток. 42 , 3092–3104 (2019).
КАС пабмед Статья ПабМед Центральный Google Scholar
An, J. P. и др. Md BBX 22 регулирует индуцированный УФ-В биосинтез антоцианов посредством регуляции функции Md HY 5 и является мишенью Md BT 2 для 26S-опосредованной протеасомной деградации. Завод Биотехнолог. J. 17 , 2231–2233 (2019).
ПабМед ПабМед Центральный Статья Google Scholar
Бай, С. и др. BBX16, белок B-box, положительно регулирует индуцированное светом накопление антоцианов путем активации MYB10 в красной груше. Завод Биотехнолог. J. 17 , 1985–1997 (2019).
КАС пабмед ПабМед Центральный Статья Google Scholar

Lou, Q. et al. Секвенирование транскриптома и анализ метаболитов выявили роль метаболизма дельфинидина в окраске цветков виноградного гиацинта. Дж. Экспл. Бот. 65 , 3157–3164 (2014).
КАС пабмед ПабМед Центральный Статья Google Scholar
Хираи, М. и др. Идентификация факторов транскрипции Arabidopsis Myb, регулирующих биосинтез алифатических глюкозинолатов, на основе омиксов. Проц. Натл. акад. науч. США 104 , 6478–6483 (2007).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar
Hirai, M. et al. Интеграция транскриптомики и метаболомики для понимания глобальных реакций на пищевые стрессы у Arabidopsis thaliana . Проц. Натл. акад. науч. США 101 , 10205–10210 (2004 г.).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar

Альба Р. и др. Анализ транскриптома и отдельных метаболитов выявил несколько точек контроля этилена во время развития плодов томатов. Plant Cell 17 , 2954–2965 (2005).
КАС пабмед ПабМед Центральный Статья Google Scholar
Mounet, F. и др. Анализ регуляторной сети генов и метаболитов в тканях ранних развивающихся плодов выдвигает на первый план новые гены-кандидаты для контроля состава и развития плодов томатов. Физиол растений. 149 , 1505–1528 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Чжу, Г. и др. Перестройка метаболома плодов в селекции томатов. Cell 172 , 249–261 (2018).
КАС пабмед Статья ПабМед Центральный Google Scholar
Stushnoff, C. et al. Профилирование флавоноидов и анализ транскриптома выявили новые корреляции генов и метаболитов в клубнях Solanum tuberosum L.. J. Exp. Бот. 61 , 1225–1238 (2010).
et al. Профилирование флавоноидов и анализ транскриптома выявили новые корреляции генов и метаболитов в клубнях Solanum tuberosum L.. J. Exp. Бот. 61 , 1225–1238 (2010).
КАС пабмед ПабМед Центральный Статья Google Scholar
Чо, К. и др. Сетевой анализ метаболома и транскриптома выявил новую регуляцию пигментации картофеля. Дж. Экспл. Бот. 67 , 1519–1533 (2016).
КАС пабмед ПабМед Центральный Статья Google Scholar
Li, Y. и др. Комбинированный анализ метаболома и транскриптома плода выявил гены-кандидаты, участвующие в биосинтезе флавоноидов у Actinidia arguta . Междунар. Дж. Мол. науч. 19 , 1471 (2018).
Центральный пабмед Статья КАС пабмед Google Scholar

Zhang, J., Qiu, X., Tan, Q., Xiao, Q. & Mei, S. Сравнительное метаболомическое исследование флавоноидов в редьке с разным цветом кожуры и мякоти ( Raphanus sativus L .). Дж. Сельское хозяйство. Пищевая хим. 68 , 14463–14470 (2020).
КАС пабмед Статья ПабМед Центральный Google Scholar
Канехиса, М. и Гото, С. КЭГГ: Киотская энциклопедия генов и геномов. Рез. нуклеиновых кислот. 28 , 27–30 (2000).
КАС пабмед ПабМед Центральный Статья Google Scholar
Wang, Y. et al. Фактор транскрипции R2R3-MYB, подобный MdMYB24, участвует в индуцированном метилжасмонатом биосинтезе антоцианов в яблоке. Физиол растений. Биохим. 139 , 273 (2019).
КАС пабмед Статья ПабМед Центральный Google Scholar

Fei, L. и др. Инверсия rdo5 1, гомолога покоя семян риса4, взаимодействует с bhlh57 и контролирует биосинтез аба и состояние покоя семян у Arabidopsis . Растительная клетка 32 , 1933–1948 (2020).
Артикул КАС Google Scholar
Огава, Т. и др. Участие фактора транскрипции AtbHLh29 в солеустойчивости у Arabidopsis . Физиол клеток растений. 48 , 140–140 (2007).
Google Scholar
Nesi, N. Ген TT8 кодирует основной белок домена спираль-петля-спираль, необходимый для экспрессии генов DFR и BAN в Arabidopsis Siliques. Plant Cell 12 , 1863 (2000).
КАС пабмед ПабМед Центральный Статья Google Scholar
Baudry, A., Caboche, M. & Lepiniec, L. TT8 контролирует собственную экспрессию в регуляции по принципу обратной связи с участием TTG1 и гомологичных факторов MYB и bHLH, обеспечивая сильное и специфичное для клеток накопление флавоноидов в Arabidopsis thaliana . Plant J. 46 , 768–779 (2006).
Plant J. 46 , 768–779 (2006).
КАС пабмед Статья ПабМед Центральный Google Scholar
Padmaja, L.K. и др. Естественные мутации в двух гомеологичных генах TT8 контролируют признак желтой семенной кожуры у аллотетраплоида Brassica juncea (AABB). Теор. заявл. Жене. 127 , 339–347 (2014).
КАС пабмед Статья ПабМед Центральный Google Scholar
Лим, С.-Х. и др. Основной фактор транскрипции спираль-петля-спираль редьки, RsTT8 действует как позитивный регулятор биосинтеза антоцианов. Фронт. Растениевод. https://doi.org/10.3389/fpls.2017.01917 (2017).
Артикул пабмед ПабМед Центральный Google Scholar
Koes, R. E., Spelt, C. E., van den Elzen, P. J. M. & Mol, J. N. M. Клонирование и молекулярная характеристика мультигенного семейства халконсинтазы Petunia hybrida . Ген 81 , 245–257 (1989).
Ген 81 , 245–257 (1989).
КАС пабмед Статья ПабМед Центральный Google Scholar
Clark, S. T. & Verwoerd, W. S. Системный подход к выявлению коррелирующих генов-мишеней для потери цветовой пигментации у растений. БМС Биоинформ. 12 , 343 (2011).
КАС Статья Google Scholar
Холтон Т.А. и Корниш Э.К. Генетика и биохимия биосинтеза антоцианов. Plant Cell 7 , 1071–1083 (1995).
КАС пабмед ПабМед Центральный Статья Google Scholar
Xie, D.Y., Jackson, L.A., Cooper, J.D., Ferreira, D. & Paiva, N.L. Молекулярный и биохимический анализ двух клонов кДНК, кодирующих дигидрофлавонол-4-редуктазу из Medicago runcatula . Физиол растений. 134 , 979–994 (2004).
КАС пабмед ПабМед Центральный Статья Google Scholar

Сингх К., Кумар С., Ядав С. К. и Ахуджа П. С. Характеристика кДНК дигидрофлавонол-4-редуктазы в чае ( Camellia sinensis (L.) О. Кунце). Завод Биотехнолог. Респ. 3 , 95–101 (2009).
Артикул Google Scholar
Hua, C. et al. Молекулярное клонирование и характеристика трех генов, кодирующих дигидрофлавонол-4-редуктазу из Ginkgo biloba в пути биосинтеза антоцианов. PLoS ONE 8 , e72017 (2013).
ОБЪЯВЛЕНИЕ пабмед ПабМед Центральный Статья КАС Google Scholar
Хуанг, Ю. и др. Молекулярное клонирование и характеристика двух генов, кодирующих дигидрофлавонол-4-редуктазу из Populus trichocarpa . PLoS ONE 7 , e30364 (2012 г.).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar

Tian, J. et al. Баланс экспрессии дигидрофлавонол-4-редуктазы и флавонолсинтазы регулирует биосинтез флавоноидов и красную окраску листьев яблони. науч. Респ. 5 , 12228 (2015).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar
Tian, J. et al. Характеристики промоторов гена дигидрофлавонол-4-редуктазы из сортов яблони Malus с различной окраской листьев. Хортик. Рез. 4 , 17070 (2017).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Луо, П. и др. Нарушение равновесия экспрессии флавонолсинтазы и дигидрофлавонол-4-редуктазы тесно связано с образованием цветков белого или красного цвета у растений. Фронт. Растениевод. 6 , 1257 (2015).
ПабМед Статья ПабМед Центральный Google Scholar

Форнале, С. и др. AtMYB7, новый игрок в регулировании УФ-солнцезащитных средств в Arabidopsis thaliana . Физиол клеток растений. 55 , 507–516 (2014).
ПабМед Статья КАС ПабМед Центральный Google Scholar
Wang, Z., Gerstein, M. & Snyder, M. RNA-Seq: революционный инструмент для транскриптомики. Нац. Преподобный Жене. 10 , 57–63 (2009).
КАС пабмед ПабМед Центральный Статья Google Scholar
Пархомчук, Д. и др. Анализ транскриптома путем специфичного секвенирования комплементарной ДНК. Рез. нуклеиновых кислот. 37 , e123 (2009).
ПабМед ПабМед Центральный Статья КАС Google Scholar
Mortazavi, A., Williams, B.A., McCue, K., Schaeffer, L. & Wold, B. Картирование и количественная оценка транскриптомов млекопитающих с помощью RNA-Seq. Нац. Методы 5 , 621–628 (2008).
Нац. Методы 5 , 621–628 (2008).
КАС пабмед Статья ПабМед Центральный Google Scholar
Пертеа, М. и др. Stringtie обеспечивает улучшенную реконструкцию транскриптома из чтений РНК-seq. Нац. Биотехнолог. 33 , 290–295 (2015).
КАС пабмед ПабМед Центральный Статья Google Scholar
Ян Л., Смит Г.К.& Wei, S. FeatureCounts: Эффективная программа общего назначения для присвоения чтений последовательностей геномным признакам. Биоинформатика 30 , 923–930 (2014).
Артикул КАС Google Scholar
Лав, М., Хубер, В. и Андерс, С. Модерированная оценка изменения кратности и дисперсии для данных секвенирования РНК с помощью DESeq2. Геном Биол. 15 , 1–21 (2014).
Артикул КАС Google Scholar

Чжан, Дж. и др. Встречающаяся в природе вариация гена BrMAM-3 связана с накоплением алифатических глюкозинолатов в листьях Brassica rapa . Хортик. Рез. 5 , 1–11 (2018).
ОБЪЯВЛЕНИЕ Статья КАС Google Scholar
Livak, K.J. & Schmittgen, T.D. Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 -ΔΔCT . Methods 25 , 402–408 (2001).
КАС пабмед ПабМед Центральный Статья Google Scholar
Shannon, P. et al. Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Рез. генома. 13 , 2498–2504 (2003).
КАС пабмед ПабМед Центральный Статья Google Scholar
Россия Экстремальные погодные явления — Климатическая оценочная карта
Тенденция роста опасных климатических явлений
Прогноз и мониторинг опасных погодных или климатических явлений в России являются частью государственной системы мониторинга и отчетности. Ежегодно Федеральная служба по гидрометеорологии и мониторингу окружающей среды разрабатывает и выпускает Доклад об особенностях климата на территории Российской Федерации с кратким анализом экстремальных и опасных явлений.
Ежегодно Федеральная служба по гидрометеорологии и мониторингу окружающей среды разрабатывает и выпускает Доклад об особенностях климата на территории Российской Федерации с кратким анализом экстремальных и опасных явлений.
Количество опасных событий (ОС) за последние 9 лет представлено в таблице ниже.
На приведенном ниже рисунке показано количество опасных событий и комплексов событий (в том числе гидрологических и агрометеорологических), причинивших значительный ущерб народному хозяйству и населению.Столбцы, отмеченные красным цветом, показывают количество неожиданных, непрогнозируемых событий. Общая линия тренда значимых опасных событий направлена сильно вверх.
Наиболее частыми опасными явлениями являются ливневые дожди и наводнения, лесные и торфяные пожары, а также сильные ветры, способствующие распространению пожаров. Самые экстремальные погодные явления происходят с мая по август/сентябрь каждого года из-за атмосферных особенностей.
К погодным явлениям, причинившим наибольший ущерб за последние 3 года, относятся: В 2015 г. чрезвычайно сильный ветер в Республике Хакасия (до 31 м/с) в сухой жаркий период года привел к значительным повреждениям сетей, деревьев и некоторое имущество, а также пожары в 1371 частном доме, в которых погибло 23 человека.В 2016 году сильный ливень в Ростове-на-Дону привел к затоплению улиц, размытию дорог и провалам до 5 м2, повреждению 2 мостов. Это нанесло серьезный ущерб электросетям, в результате чего 6 человек получили ранения и 1 человек погиб.
чрезвычайно сильный ветер в Республике Хакасия (до 31 м/с) в сухой жаркий период года привел к значительным повреждениям сетей, деревьев и некоторое имущество, а также пожары в 1371 частном доме, в которых погибло 23 человека.В 2016 году сильный ливень в Ростове-на-Дону привел к затоплению улиц, размытию дорог и провалам до 5 м2, повреждению 2 мостов. Это нанесло серьезный ущерб электросетям, в результате чего 6 человек получили ранения и 1 человек погиб.
В целях обеспечения безопасности населения и территорий от чрезвычайных ситуаций природного и техногенного характера на местном, региональном и республиканском уровнях в 1992 году в России была создана специальная централизованная Единая государственная система предупреждения и ликвидации чрезвычайных ситуаций (РСЧС).Основными задачами системы РСЧС являются прогнозирование чрезвычайных ситуаций; подготовка населения к действиям в чрезвычайных ситуациях; ликвидация чрезвычайных ситуаций и смягчение их социально-экономических последствий; и резервирование финансовых и материальных ресурсов для реагирования на чрезвычайные ситуации.
Метилирование промотора RsMYB1, индуцированное транспозонами, нарушает накопление антоцианов в редьке с красной мякотью | Журнал экспериментальной ботаники
н. в промоторной области RsMYB1 встречался в обе линии.Последующий анализ показал, что мутант с белой плотью был результатом измененного метилирования ДНК в промоторе RsMYB1 . Это наследуемое эпигенетическое изменение было связано с гиперметилированным транспозоном CACTA, который индуцировал распространение метилирования ДНК на промоторную область RsMYB1 . Таким образом, экспрессия RsMYB1 была значительно подавлена, что ингибировало биосинтез антоцианов у мутанта с белой плотью. Изучение каллусов трансгенной редьки и результаты эксперимента по подавлению генов, вызванного вирусом, подтвердили, что RsMYB1 отвечает за накопление антоцианов.Более того, мутантный фенотип частично устранялся обработкой деметилирующим агентом. Это исследование объясняет молекулярный механизм, регулирующий появление белокаменных мутантов красной редьки. ), имеющая зеленую или красную кожицу и красную мякоть, представляет собой уникальный сорт, выращиваемый в Китае, где его потребляют в больших количествах, поскольку он богат антоцианами. Основным антоцианом краснокожей редьки является пеларгонидин с содержанием примерно 4.69 мг г –1 сырой массы (Park et al. , 2011). В дополнение к своей роли растительных пигментов антоцианы хорошо известны своими полезными свойствами для здоровья, такими как антиоксидантная активность, противораковые эффекты и повышение иммунитета (Butelli, 2008; He and Giusti, 2010). Путь биосинтеза антоцианов был изучен у различных видов растений (Shi and Xie, 2014). Транскрипционная регуляция, связанная с биосинтезом антоцианов, также широко изучалась, при этом исследования показали, что факторы транскрипции R2R3-MYB и bHLH играют регулирующую роль как часть комплекса MYB-bHLH-WD40 (Koes et al., 2005; Петрони и Тонелли, 2011). Были проанализированы два гена, Rc (bHLH) и Rd (DFR), влияющие на синтез проантоцианидина в красном и коричневом рисе. В частности, предыдущие исследования показали, что делеция 14 п.н. в гене Rc , которая вводит преждевременный стоп-кодон, изменяет цвет околоплодника с красного на белый (Sweeney, 2006; Furukawa et al. , 2007). Сообщается, что у винограда вставка ретротранспозона в промоторную область VvMYBA1 и две неконсервативные мутации в соседнем гене VvMYBA2 вызывают изменение цвета кожуры с красного на белый (Walker et al., 2007). Вставка 4 п.н. в транскрипт SlMYBATV , который кодирует репрессор R3 MYB, приводит к повышенной экспрессии генов биосинтеза антоцианов у томата (Cao et al. , 2017). В пурпурной цветной капусте наблюдалось накопление антоцианина в ответ на вставку транспозона ДНК-предвестника в вышестоящую регуляторную область гена, кодирующего транскрипционный фактор MYB (Chiu et al. , 2010).
В частности, предыдущие исследования показали, что делеция 14 п.н. в гене Rc , которая вводит преждевременный стоп-кодон, изменяет цвет околоплодника с красного на белый (Sweeney, 2006; Furukawa et al. , 2007). Сообщается, что у винограда вставка ретротранспозона в промоторную область VvMYBA1 и две неконсервативные мутации в соседнем гене VvMYBA2 вызывают изменение цвета кожуры с красного на белый (Walker et al., 2007). Вставка 4 п.н. в транскрипт SlMYBATV , который кодирует репрессор R3 MYB, приводит к повышенной экспрессии генов биосинтеза антоцианов у томата (Cao et al. , 2017). В пурпурной цветной капусте наблюдалось накопление антоцианина в ответ на вставку транспозона ДНК-предвестника в вышестоящую регуляторную область гена, кодирующего транскрипционный фактор MYB (Chiu et al. , 2010).
Эпигенетические модификации генов, кодирующих регуляторы биосинтеза антоцианов, тесно связаны с изменением окраски некоторых сельскохозяйственных культур. Изменение статуса метилирования ДНК этих регуляторных генов влияет на активность пути биосинтеза антоцианов. Метилирование промотора PcMYB10 связано с появлением зеленокожих видов у сорта красной груши (Wang et al. , 2013). Гиперметилирование промотора MdMYB10 приводит к полосатой пигментации плодов яблока Honey Crisp (Telias et al. , 2011). У кукурузы аллель P1-wr гиперметилирован по сравнению с P1-rr , а различные модели накопления пигмента обусловлены эпигенетической регуляцией p1 (Chopra et al., 1998; Сидоренко и др. , 2000). Недавнее исследование показало, что экспрессия p1 может регулироваться статусом метилирования ДНК транспозона CACTA, встроенного в ген Ufo1-1 , что приводит к нестабильному пурпурному фенотипу у кукурузы (Wittmeyer et al. , 2018).
Изменение статуса метилирования ДНК этих регуляторных генов влияет на активность пути биосинтеза антоцианов. Метилирование промотора PcMYB10 связано с появлением зеленокожих видов у сорта красной груши (Wang et al. , 2013). Гиперметилирование промотора MdMYB10 приводит к полосатой пигментации плодов яблока Honey Crisp (Telias et al. , 2011). У кукурузы аллель P1-wr гиперметилирован по сравнению с P1-rr , а различные модели накопления пигмента обусловлены эпигенетической регуляцией p1 (Chopra et al., 1998; Сидоренко и др. , 2000). Недавнее исследование показало, что экспрессия p1 может регулироваться статусом метилирования ДНК транспозона CACTA, встроенного в ген Ufo1-1 , что приводит к нестабильному пурпурному фенотипу у кукурузы (Wittmeyer et al. , 2018).
В редьке были клонированы гены RsMYB1 и RsTT8 , и совместная экспрессия этих двух генов в листьях табака подтвердила, что они способствуют регуляции биосинтеза антоцианов (Lim et al . , 2016, 2017). RsMYB90/RsMYB1 является решающим фактором, определяющим накопление антоцианов в краснокожей редьке (Yi et al. , 2018; Luo et al. , 2020). Другой ген биосинтеза антоцианов, RsF3’H , отвечал за содержание антоцианов на основе цианидина в редьке с пурпурной мякотью (Masukawa et al. , 2018). Кроме того, были идентифицированы гены и микроРНК, связанные с биосинтезом антоцианов, а связанная с ними скоординированная регуляция была выявлена с помощью анализа транскриптома у краснокожей редьки или редьки с красной мякотью (Muleke et al., 2017; Sun и др. ., 2017, 2018; Лю и др. , 2019).
, 2016, 2017). RsMYB90/RsMYB1 является решающим фактором, определяющим накопление антоцианов в краснокожей редьке (Yi et al. , 2018; Luo et al. , 2020). Другой ген биосинтеза антоцианов, RsF3’H , отвечал за содержание антоцианов на основе цианидина в редьке с пурпурной мякотью (Masukawa et al. , 2018). Кроме того, были идентифицированы гены и микроРНК, связанные с биосинтезом антоцианов, а связанная с ними скоординированная регуляция была выявлена с помощью анализа транскриптома у краснокожей редьки или редьки с красной мякотью (Muleke et al., 2017; Sun и др. ., 2017, 2018; Лю и др. , 2019).
‘Xinlimei’ – это особый местный сорт редьки с красной мякотью, выведенный в Пекине, цвет мякоти основного корня которого варьируется (например, светло-зеленый, красный и неравномерно красный) (BVRC и BAAFS, 1977). Систематическая селекция во время селекции привела к созданию коммерческих сортов с красной мякотью, однородной красной мякотью и зеленой кожицей. Однако иногда в ответ на изменение условий культивирования появляются виды с белой или красной кожей.Трехлетний анализ выявил частоту мутаций 0,49–0,57% для MTH01 (краснотелая инбредная линия, которая подвергалась самоскрещиванию в течение более 10 поколений), производя мутанты, включая краснокожих, белокожих и химерных типов. см. дополнительную таблицу S1 по телефону JXB онлайн). Нестабильность цвета мякоти представляет собой серьезную проблему, которую необходимо решить для получения высокочистых гибридов, но механизм ее возникновения неясен.
Однако иногда в ответ на изменение условий культивирования появляются виды с белой или красной кожей.Трехлетний анализ выявил частоту мутаций 0,49–0,57% для MTH01 (краснотелая инбредная линия, которая подвергалась самоскрещиванию в течение более 10 поколений), производя мутанты, включая краснокожих, белокожих и химерных типов. см. дополнительную таблицу S1 по телефону JXB онлайн). Нестабильность цвета мякоти представляет собой серьезную проблему, которую необходимо решить для получения высокочистых гибридов, но механизм ее возникновения неясен.
Цель данного исследования заключалась в выяснении механизмов, лежащих в основе накопления антоцианов в стержневом корне редьки с красной мякотью и образования мутанта с белой мякотью.Мы нанесли на карту ген фактора транскрипции, RsMYB1 , с использованием определения местоположения количественного признака с помощью картирования повторного секвенирования генома (QTL-seq) и анализа транскриптома. Мы проанализировали механизм, опосредующий образование мутантов с белой плотью, и предположили, что индуцированное транспозоном CACTA метилирование промотора RsMYB1 может быть связано с продуцированием мутантов с белой плотью.
» data-legacy-id=»s3″> Растительные материалы
Растительные материалы включали инбредную линию MTH01, происходящую от стародавнего сорта Xinlimei и имеющую красную мякоть и зеленую кожицу, и JC01, мутант с белой мякотью, происходящий от MTH01.Сегрегирующая популяция F 2 была создана путем скрещивания MTH01 и JC01 для картирования генов. В общей сложности 646 F 2 особей были посажены на поле Пекинского центра исследования овощей 7 августа 2015 г.
зеленая или белая мякоть использовалась для анализа гаплотипов (дополнительная таблица S2). Большинство образцов представляли собой местные сорта, полученные из банка генов овощей Пекинского центра исследований овощей.Тотальную ДНК экстрагировали из молодых листьев с помощью модифицированного метода с бромидом цетилтриметиламмония (CTAB) (Murray and Thompson, 1980).
» data-legacy-id=»s5″> Идентификация QTL, относящихся к красной мякоти редьки
Для идентификации генов-кандидатов, связанных с биосинтезом антоцианов, был проведен анализ QTL-seq, как описано Takagi et al. (2013). Вкратце, тотальную ДНК экстрагировали из молодых листьев родителей и каждой особи популяций F 2 с использованием модифицированного метода СТАВ (Murray, Thompson, 1980). Два пула ДНК, основная масса с красной мякотью (тип MTH01) и основная масса с белой мякотью (тип JC01), были созданы путем смешивания равного количества ДНК от 30 особей с красной мякотью или 30 особей с белой мякотью F 2 . Библиотеки секвенирования из MTH01, JC01 и двух групп были проанализированы с помощью платформы HiSeq 2500 (Illumina) (считывания парных концов 100 п.н.) в Annoroad Gene Technology Co., Ltd, Пекин, Китай. Чистые показания для массы с красной мякотью и массы с белой мякотью были сопоставлены с «Aokubi DH» (Mitsui et al., 2015) и «XYB36-2» (Zhang et al. , 2015) референсных геномов с помощью программы BWA (Li and Durbin, 2009). Программа GATK (McKenna, et al. , 2010) использовалась для вызова однонуклеотидных полиморфизмов (SNP) посредством локальной повторной сборки гаплотипов для популяций. Мы рассчитали SNP-индекс для всех вариантов. Анализ скользящего окна был завершен с окном размером 1 Мб с размером шага 10 кб для расчета среднего SNP-индекса.
Два пула ДНК, основная масса с красной мякотью (тип MTH01) и основная масса с белой мякотью (тип JC01), были созданы путем смешивания равного количества ДНК от 30 особей с красной мякотью или 30 особей с белой мякотью F 2 . Библиотеки секвенирования из MTH01, JC01 и двух групп были проанализированы с помощью платформы HiSeq 2500 (Illumina) (считывания парных концов 100 п.н.) в Annoroad Gene Technology Co., Ltd, Пекин, Китай. Чистые показания для массы с красной мякотью и массы с белой мякотью были сопоставлены с «Aokubi DH» (Mitsui et al., 2015) и «XYB36-2» (Zhang et al. , 2015) референсных геномов с помощью программы BWA (Li and Durbin, 2009). Программа GATK (McKenna, et al. , 2010) использовалась для вызова однонуклеотидных полиморфизмов (SNP) посредством локальной повторной сборки гаплотипов для популяций. Мы рассчитали SNP-индекс для всех вариантов. Анализ скользящего окна был завершен с окном размером 1 Мб с размером шага 10 кб для расчета среднего SNP-индекса. Δ(SNP-индекс) рассчитывали путем вычитания SNP-индекса массы с красной мякотью из массы с белой мякотью.Уровень достоверности 0,05 был применен в качестве порога для обнаружения областей-кандидатов QTL.
Δ(SNP-индекс) рассчитывали путем вычитания SNP-индекса массы с красной мякотью из массы с белой мякотью.Уровень достоверности 0,05 был применен в качестве порога для обнаружения областей-кандидатов QTL.
» data-legacy-id=»s7″> Анализ секвенирования РНК
Образцы тканей зрелых стержневых корней MTH01 и JC01 собирали, немедленно замораживали в жидком азоте и хранили при температуре -80 °C. Суммарную РНК экстрагировали с помощью набора MiniBEST Plant RNA Extraction Kit (Takara, Japan).Библиотеки для секвенирования были созданы с помощью набора для подготовки библиотеки NEBNext Ultra RNA Library для Illumina (NEB, США). Коды индексов были добавлены к последовательностям атрибутов каждого образца. Библиотеки секвенировали с помощью платформы HiSeq 4000 (Illumina) (считывания парных концов 150 п.н.) в компании Annoroad Gene Technology Co., Ltd, Пекин, Китай. Чистые чтения были сопоставлены с эталонным геномом Aokubi DH (Mitsui et al. , 2015) с использованием TopHat (Trapnell et al. , 2009) и Bowtie2 (Langmead et al., 2009) программы. Уровни экспрессии генов рассчитывали на основе прочтений на тысячу оснований миллионов картированных прочтений (RPKM) (Wagner et al. , 2012). Программа DEGseq (Wang et al. , 2010) использовалась для идентификации дифференциально экспрессируемых генов (DEG) на основании следующих критериев: отношение |log 2 |≥1 и q<0,05.
Суммарную РНК экстрагировали с помощью набора MiniBEST Plant RNA Extraction Kit (Takara, Japan).Библиотеки для секвенирования были созданы с помощью набора для подготовки библиотеки NEBNext Ultra RNA Library для Illumina (NEB, США). Коды индексов были добавлены к последовательностям атрибутов каждого образца. Библиотеки секвенировали с помощью платформы HiSeq 4000 (Illumina) (считывания парных концов 150 п.н.) в компании Annoroad Gene Technology Co., Ltd, Пекин, Китай. Чистые чтения были сопоставлены с эталонным геномом Aokubi DH (Mitsui et al. , 2015) с использованием TopHat (Trapnell et al. , 2009) и Bowtie2 (Langmead et al., 2009) программы. Уровни экспрессии генов рассчитывали на основе прочтений на тысячу оснований миллионов картированных прочтений (RPKM) (Wagner et al. , 2012). Программа DEGseq (Wang et al. , 2010) использовалась для идентификации дифференциально экспрессируемых генов (DEG) на основании следующих критериев: отношение |log 2 |≥1 и q<0,05. Функциональную аннотацию связанных DEG см. в предыдущем исследовании Mitsui et al. (2015). Последующие РНК-секвенирование и количественная обратная транскрипция (qRT)–ПЦР были завершены с двумя и тремя биологическими повторами соответственно.
Функциональную аннотацию связанных DEG см. в предыдущем исследовании Mitsui et al. (2015). Последующие РНК-секвенирование и количественная обратная транскрипция (qRT)–ПЦР были завершены с двумя и тремя биологическими повторами соответственно.
Для бисульфитного секвенирования (BS-seq) анализа 500 нг геномной ДНК, выделенной из мякоти зрелого стержневого корня редьки, обрабатывали бисульфитом натрия с использованием набора EZ DNA Methylation-Gold (Zymo Research, США). Следующие пять фрагментов выше RsMYB1 были амплифицированы с помощью программы ПЦР в температурном градиенте с ДНК, обработанной бисульфитом, и соответствующими вырожденными праймерами (дополнительная таблица S3): BS1 (от -1842 до -1648 п. н.), BS2 (от -1578 до — 1331 п.н.), BS3 (от -1294 до -1024 п.н.), BS4 (от -581 до -424 п.н.) и BS5 (от -176 до -1 п.н.).Продукты ПЦР очищали и затем клонировали в вектор pMD18-T. Для точной оценки степени метилирования конкретных последовательностей было секвенировано 10 клонов (Сангонг, Шанхай, Китай). Отношение C-метилирования рассчитывали как количество метилированных оснований, деленное на общее количество оснований в каждом цитозиновом сайте.
н.), BS2 (от -1578 до — 1331 п.н.), BS3 (от -1294 до -1024 п.н.), BS4 (от -581 до -424 п.н.) и BS5 (от -176 до -1 п.н.).Продукты ПЦР очищали и затем клонировали в вектор pMD18-T. Для точной оценки степени метилирования конкретных последовательностей было секвенировано 10 клонов (Сангонг, Шанхай, Китай). Отношение C-метилирования рассчитывали как количество метилированных оснований, деленное на общее количество оснований в каждом цитозиновом сайте.
» data-legacy-id=»s15″> Фенотипическая характеристика MTH01 и JC01
Растения редьки дикого типа с красной мякотью и мутантные растения с белой мякотью росли и развивались нормально в нормальных полевых условиях. В МТН01 антоцианы накапливались в мякоти стержневого корня, а также в других тканях, в том числе в части семенной кожуры, кончиках корешков, появляющихся из проросших семян, семядолях и гипокотилях, молодых проростках, корне 3-недельных растений, боковая ветвь цветковых растений и стручков (рис. 1). Цвет кожуры корня постепенно исчезал от стадии расщепления коры к стадии зрелости у MTH01 (рис. 1E, F). В тех же условиях роста накопление антоцианов не наблюдалось ни в мякоти стержневого корня, ни почти во всех проанализированных тканях мутанта JC01 (рис. 1А-В, Е-З). Исключением были гипокотиль на стадии проростка и кожица корня на стадии расщепления коры (рис. 1Г, Д).
1). Цвет кожуры корня постепенно исчезал от стадии расщепления коры к стадии зрелости у MTH01 (рис. 1E, F). В тех же условиях роста накопление антоцианов не наблюдалось ни в мякоти стержневого корня, ни почти во всех проанализированных тканях мутанта JC01 (рис. 1А-В, Е-З). Исключением были гипокотиль на стадии проростка и кожица корня на стадии расщепления коры (рис. 1Г, Д).
Рис. 1.
Сравнение фенотипов MTH01 (слева) и JC01 (справа).(А) Семена. (B) Корешки, возникающие из проросших семян. Стрелка указывает на скопление красного пигмента на кончике корня. (C) Семядоли и гипокотилей. (D) 10-дневные сеянцы. (E) 3-недельные корни. (F) 7-недельные корни. (G) Цветущие ветки. (H) Силикаты. (I) Общие уровни антоцианов в корневой мякоти и кожице гибридных растений MTH01, JC01 и F 1 . Представленные данные представляют собой среднее значение ± стандартное отклонение от трех человек. DW, сухая масса; Ф, плоть; С, кожа. (Эта фигурка доступна в цвете по адресу JXB онлайн. )
)
Рис. 1.
Сравнение фенотипов MTH01 (слева) и JC01 (справа). (А) Семена. (B) Корешки, возникающие из проросших семян. Стрелка указывает на скопление красного пигмента на кончике корня. (C) Семядоли и гипокотилей. (D) 10-дневные сеянцы. (E) 3-недельные корни. (F) 7-недельные корни. (G) Цветущие ветки. (H) Силикаты. (I) Общие уровни антоцианов в корневой мякоти и кожице гибридных растений MTH01, JC01 и F 1 . Представленные данные представляют собой среднее значение ± стандартное отклонение от трех человек.DW, сухая масса; Ф, плоть; С, кожа. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
Содержание антоцианов в мякоти и кожуре стержневого корня MTH01, JC01 и F 1 гибридных (MTH01 × JC01) растений определяли с помощью анализа ВЭЖХ. Высокое содержание антоцианов выявлено в мякоти корня МТН01 (2,71 мг г –1 сухого веса) и в мякоти корня и кожуре гибрида F 1 (3,01 и 2,81 мг г –1 сухого веса соответственно). (Инжир.1И). Напротив, содержание антоцианов в кожуре корней MTH01 было низким (0,2 мг/г –1 сухого веса). Кроме того, антоцианы почти не обнаруживались в корневой мякоти JC01 (0,01 мг/г –1 сухого веса), что указывает на то, что антоцианиновый путь был ингибирован в JC01 при нормальных условиях роста.
(Инжир.1И). Напротив, содержание антоцианов в кожуре корней MTH01 было низким (0,2 мг/г –1 сухого веса). Кроме того, антоцианы почти не обнаруживались в корневой мякоти JC01 (0,01 мг/г –1 сухого веса), что указывает на то, что антоцианиновый путь был ингибирован в JC01 при нормальных условиях роста.
Рис. 2.
Фенотип и характер наследования белокрылого мутанта. (A) Цвет корневой мякоти и кожицы гибридных растений MTH01, JC01 и F 1 и F 2 .(B) Модели наследования мутанта с белой плотью в сегрегирующих популяциях от скрещивания MTH01 × JC01. R/G, красная мякоть и зеленая кожица; R/R, красная мякоть и красная кожица; W/G, белая мякоть и зеленая кожица. (Этот рисунок доступен в цвете по адресу JXB онлайн. )
)
Рис. 2.
Фенотип и характер наследования мутанта с белой плотью. (A) Цвет корневой мякоти и кожицы гибридных растений MTH01, JC01 и F 1 и F 2 . (B) Модели наследования мутанта с белой плотью в сегрегирующих популяциях от скрещивания MTH01 × JC01.R/G, красная мякоть и зеленая кожица; R/R, красная мякоть и красная кожица; W/G, белая мякоть и зеленая кожица. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
Графики, показывающие взаимосвязь между SNP-индексом и положениями хромосом, были построены для красной и белой туш. Также был подготовлен график Δ(SNP-индекс) (построенный в зависимости от положения в геноме) (дополнительные таблицы S5 и S6, дополнительный рисунок S1). Локус red1 был локализован в области размером 2,08 Мб (16,25–18,08 млн пн).интервал 33 млн пн) на хромосоме 7, содержащей 1285 локусов SNP (рис. 3А). Дальнейший анализ сцепления показал, что маркер R7-17024168 был ближайшим SNP к red1 (генетическое расстояние 3,4 сМ) у 646 особей из популяции F 2 (рис. 3B). Дополнительные маркеры, тесно связанные с red1 , не были идентифицированы в пределах интервала привязки. Был проведен анализ QTL-seq на основе другого эталонного генома (Aokubi DH), в результате которого были обнаружены 16 областей-кандидатов, охватывающих 281 186 п.н., с 153 SNP (дополнительная таблица S7).Шесть каркасов из генома Aokubi DH, включая области Rs_scaf158: 166 979–271 436 и Rs_scaf301: 22 876–32 892, были прикреплены к области-кандидату с помощью онлайн-анализа BLAST (рис. 3C).
3C).Рис. 3.
Идентификация RsMYB1 в качестве гена-кандидата, ответственного за накопление антоцианов в редьке с красной мякотью, на основе анализа QTL-seq и RNA-seq. (A) График Δ(SNP-индекс) из анализа QTL-seq. Ось x представляет положения на хромосоме R07, а ось y представляет Δ (SNP-индекс).Кандидатный QTL был идентифицирован на хромосоме R07 (интервал 16,25–18,33 Мб) с Δ(SNP-index) более 0,7 ( P<0,05 ). (B) Генетические расстояния маркеров SNP и гена-кандидата ( red1 ) на хромосоме R07 (интервал 16,25–18,33 Мб) согласно анализу сцепления с участием 646 F 2 особей. (C) Сравнение синтетических областей между хромосомой R07 (интервал 16,25–17,35 Мб) из генома XYB36-2 и шестью каркасами из генома Aokubi DH на основе онлайн-анализа BLAST.(D) Дифференциально экспрессируемые гены (обозначенные вертикальными полосами на панели C) в области-кандидате и их относительные уровни экспрессии на основе данных секвенирования РНК. Тепловая карта была подготовлена с помощью программы MeV4. 9.0: слева — MTH01; правильно, JC01. (Эта цифра доступна в цвете по адресу JXB в Интернете.)
9.0: слева — MTH01; правильно, JC01. (Эта цифра доступна в цвете по адресу JXB в Интернете.)
Рис. 3.
Идентификация RsMYB1 в качестве гена-кандидата, ответственного за накопление антоцианов в красной редьке, на основе анализа QTL-seq и RNA-seq .(A) График Δ(SNP-индекс) из анализа QTL-seq. Ось x представляет положения на хромосоме R07, а ось y представляет Δ (SNP-индекс). Кандидатный QTL был идентифицирован на хромосоме R07 (интервал 16,25–18,33 Мб) с Δ(SNP-index) более 0,7 ( P<0,05 ). (B) Генетические расстояния маркеров SNP и гена-кандидата ( red1 ) на хромосоме R07 (интервал 16,25–18,33 Мб) согласно анализу сцепления с участием 646 F 2 особей. (C) Сравнение синтетических областей между хромосомой R07 (16.интервал 25–17,35 Мб) из генома XYB36-2 и шести каркасов из генома Aokubi DH на основе онлайн-анализа BLAST. (D) Дифференциально экспрессируемые гены (обозначенные вертикальными полосами на панели C) в области-кандидате и их относительные уровни экспрессии на основе данных секвенирования РНК. Тепловая карта была подготовлена с помощью программы MeV4.9.0: слева — MTH01; правильно, JC01. (Эта цифра доступна в цвете по адресу JXB онлайн.)
Тепловая карта была подготовлена с помощью программы MeV4.9.0: слева — MTH01; правильно, JC01. (Эта цифра доступна в цвете по адресу JXB онлайн.)
Чтобы исследовать DEG и антоциановые биосинтетические или регуляторные гены в области-кандидате, мы сравнили транскриптомы MTH01 и JC01.Всего было идентифицировано 796 DEG, в том числе 335 генов с повышенной и 461 отрицательной регуляцией (дополнительная таблица S8). Анализ KEGG был завершен для выявления значительно обогащенных путей, связанных с DEG. Семь обогащенных путей были связаны с биосинтезом вторичных метаболитов, включая биосинтез флавоноидов (map00941) и биосинтез антоцианов (map00942) (дополнительная таблица S9). В области-кандидате 183 гена были аннотированы в шести каркасах генома Aokubi DH, включая девять генов, которые по-разному экспрессировались между MTH01 и JC01 (дополнительная таблица S10, рис.3Д). Среди этих DEG, RSG33469 (гомологичный ген Rsa10033919, расположенный на XYB36-2 хромосоме R07: 16 320 148) и RSG19108 (гомологичный ген Rsa10034073, расположенный на XYB36-2 хромосоме R07: 17 352 870) были аннотированы как ген регулятора синтеза антоцианов . AtMYB90 ( PAP2 ), который кодирует белок семейства факторов транскрипции R2R3-MYB (рис. 3B, D). Таким образом, RSG33469 и RSG19108 были названы RsMYB1 и RsMYB2 соответственно.
AtMYB90 ( PAP2 ), который кодирует белок семейства факторов транскрипции R2R3-MYB (рис. 3B, D). Таким образом, RSG33469 и RSG19108 были названы RsMYB1 и RsMYB2 соответственно.
Кодирующая последовательность RsMYB1 в MTH01 была выделена с помощью ОТ-ПЦР; RsMYB2 не амплифицируется.Анализ выравнивания последовательностей выявил 1–3 SNP между кодирующей последовательностью MTH01 RsMYB1 и последовательностью RsMYB1 в анализируемых эталонных геномах, а также 26 SNP по сравнению с RsMYB2 (дополнительная таблица S11). Это подтвердило, что только RsMYB1 экспрессировались в мякоти стержневого корня MTH01. Хотя данные транскриптома (анализ RPKM), по-видимому, указывают на экспрессию RsMYB2 (рис. 3D), это может быть ложноположительным результатом из-за значительного сходства между RsMYB1 и RsMYB2 .Результаты показали, что RsMYB1 , скорее всего, является геном red1 .
Рис. 4.
Анализ цитозинового метилирования промоторной области RsMYB1 в MTH01 и JC01. (A) Структурное представление и локализация транспозона CACTA, встроенного в локус RsMYB1 . (B, C) McrBC-чувствительный ПЦР-анализ промоторной области RsMYB1-CACTA (от -46 до -303 п. н.) и области транспозона CACTA (от -1009 до -1789 п.н.) в MTH01 и JC01.+ и — указывают, обрабатывалась ли геномная ДНК McrBC перед ПЦР-амплификацией. Отсутствие продукта ПЦР в образцах, обработанных McrBC, указывает на то, что ДНК была метилирована. м, маркер DL2000. (D) Анализ метилирования цитозина промоторной области (BS5; от -176 до -1 п.н. относительно стартового кодона RsMYB1-CACTA , ATG) с помощью бисульфитного секвенирования (информация о местоположении из дополнительной рис. S2A). Процент метилирования каждого цитозина в области указан вертикальными столбиками.
н.) и области транспозона CACTA (от -1009 до -1789 п.н.) в MTH01 и JC01.+ и — указывают, обрабатывалась ли геномная ДНК McrBC перед ПЦР-амплификацией. Отсутствие продукта ПЦР в образцах, обработанных McrBC, указывает на то, что ДНК была метилирована. м, маркер DL2000. (D) Анализ метилирования цитозина промоторной области (BS5; от -176 до -1 п.н. относительно стартового кодона RsMYB1-CACTA , ATG) с помощью бисульфитного секвенирования (информация о местоположении из дополнительной рис. S2A). Процент метилирования каждого цитозина в области указан вертикальными столбиками.
Мобильные элементы широко распространены в геноме и влияют на экспрессию сцепленных генов, в частности, посредством распространения метилирования ДНК (Martin et al. , 2009; Wittmeyer et al. , 2018). Метилирование промотора RsMYB1-CACTA может подавлять экспрессию RsMYB1-CACTA . Мы исследовали степень метилирования ДНК промотора RsMYB1-CACTA (от -303 до -46 п. н.) в MTH01 и JC01 с помощью специфичного для метилирования фермента McrBC и обнаружили, что промотор RsMYB1-CACTA JC01 был сильно метилирован ( Инжир.4Б). Однако высокий уровень метилирования ДНК в области транспозона (от -1789 до -1009 п.н.) выше промотора существенно не отличался между MTH01 и JC01 (рис. 4C).
н.) в MTH01 и JC01 с помощью специфичного для метилирования фермента McrBC и обнаружили, что промотор RsMYB1-CACTA JC01 был сильно метилирован ( Инжир.4Б). Однако высокий уровень метилирования ДНК в области транспозона (от -1789 до -1009 п.н.) выше промотора существенно не отличался между MTH01 и JC01 (рис. 4C).
Мы также сравнили уровень метилирования цитозина в промоторной (BS5) и транспозонной (BS1, BS2, BS3 и BS4) областях генов RsMYB1-CACTA в MTH01 и JC01 на основе количественного анализа BS-seq геномная ДНК, извлеченная из мякоти стержневого корня (дополнительная рис. S2B). Результаты подтвердили гиперметилирование промотора RsMYB1-CACTA у мутанта JC01, в котором 70.56% цитозинов были метилированы. Напротив, только 22,77% цитозинов были метилированы в MTH01 (рис. 4D, дополнительная рис. S2B). Что касается областей транспозонов, BS1 (от -1842 до -1648 п.н.), BS2 (от -1578 до -1331 п.н.), BS3 (от -1294 до -1024 п.н.) и BS4 (от -581 до -424 п. н.) были сильно метилированы в обоих MTH01 и JC01 со степенью метилирования цитозина 62,33–90,7%. Не было никаких существенных различий между MTH01 и JC01 в метилировании BS2, BS3 и BS4, но BS1 был более сильно метилирован в MTH01, чем в JC01 (дополнительная рис.С2Б, С).
н.) были сильно метилированы в обоих MTH01 и JC01 со степенью метилирования цитозина 62,33–90,7%. Не было никаких существенных различий между MTH01 и JC01 в метилировании BS2, BS3 и BS4, но BS1 был более сильно метилирован в MTH01, чем в JC01 (дополнительная рис.С2Б, С).
Гиперметилирование промотора RsMYB1-CACTA также было подтверждено у различных новых химерных мутантов, что усиливает корреляцию между высоким уровнем метилирования ДНК промотора RsMYB1-CACTA и образованием стержневого корня с белой мякотью в MTH01 . У химерных мутантов MTH01 M1, M2 и M3 уровень метилирования промотора RsMYB1-CACTA был значительно выше в белой части стержневого корня, чем в красной части (дополнительная рис.С3). Таким образом, цитозины транспозона CACTA были сильно метилированы, и метилирование ДНК распространилось на промотор RsMYB1 , что привело к ингибированию экспрессии этого гена и образованию стержневого корня с белой мякотью в JC01. Это открытие также объясняет высокую частоту мутантов с белой мякотью у MTH01.
Рис. 5.
Обработка 5-азаЦ обращала мутантный фенотип JC01, вероятно, в результате деметилирования. (A) Фенотипы обработанных 5-азаЦ особей (T1-T8) и необработанных контролей на стадии прорастания. Стрелки указывают на скопление красного пигмента на кончике корня. (B, C) Фенотипы обработанных 5-азаЦ особей на стадиях роста семядолей и молодых проростков. (D) Относительный уровень экспрессии RsMYB1-CACTA в образцах JC01, MTH01 и 5-azaC, на основе анализа qRT-PCR.(E) Общие уровни антоцианов в мякоти корней и кожуре образцов, обработанных JC01, MTH01 и 5-azaC, на основе анализа ВЭЖХ. ДВ, сухая масса. В (D) и (E) представленные данные представляют собой среднее значение ± стандартное отклонение из трех технических повторностей, а разные буквы указывают на значительные различия ( P = 0,05). (Эта цифра доступна в цвете по адресу JXB онлайн.)
ДВ, сухая масса. В (D) и (E) представленные данные представляют собой среднее значение ± стандартное отклонение из трех технических повторностей, а разные буквы указывают на значительные различия ( P = 0,05). (Эта цифра доступна в цвете по адресу JXB онлайн.)
Рис. 5.
Обработка 5-azaC обратила мутантный фенотип JC01, вероятно, в результате деметилирования. (A) Фенотипы обработанных 5-азаЦ особей (T1-T8) и необработанных контролей на стадии прорастания.Стрелки указывают на скопление красного пигмента на кончике корня. (B, C) Фенотипы обработанных 5-азаЦ особей на стадиях роста семядолей и молодых проростков. (D) Относительный уровень экспрессии RsMYB1-CACTA в образцах JC01, MTH01 и 5-azaC, на основе анализа qRT-PCR. (E) Общие уровни антоцианов в мякоти корней и кожуре образцов, обработанных JC01, MTH01 и 5-azaC, на основе анализа ВЭЖХ. ДВ, сухая масса. В (D) и (E) представленные данные представляют собой среднее ± стандартное отклонение из трех технических повторностей, а разные буквы указывают на значительные различия ( P =0. 05). (Этот рисунок доступен в цвете по адресу JXB в Интернете.)
05). (Этот рисунок доступен в цвете по адресу JXB в Интернете.)
VIGS может привести к посттранскрипционному молчанию генов. Рекомбинантную плазмиду pTRV2 -RsMYB1-CACTA использовали для подавления экспрессии RsMYB1-CACTA в редьке Gangshuiluobo, имеющей красную кожицу. Через 2 недели после инфильтрации черешки и кожица корней контрольных сеянцев оставались красными, тогда как у сеянцев, инфильтрированных pTRV2- RsMYB1-CACTA , черешки и кожица корней были белыми или светло-красными (рис.6А). Кроме того, уровень экспрессии RsMYB1-CACTA был ниже в проростках, инфильтрированных pTRV2- RsMYB1-CACTA , чем в контрольных растениях (фиг. 6B). Эти результаты свидетельствуют о том, что RsMYB1-CACTA важен для накопления антоцианов в редьке. Кроме того, сверхэкспрессия RsMYB1-CACTA в мутанте JC01 приводила к образованию красных трансгенных каллусов (рис. 6C, D).
Рис. 6.
Анализ функциональной комплементации RSMYB1-CACTA с помощью VIGS и трансформации Agrobacterium .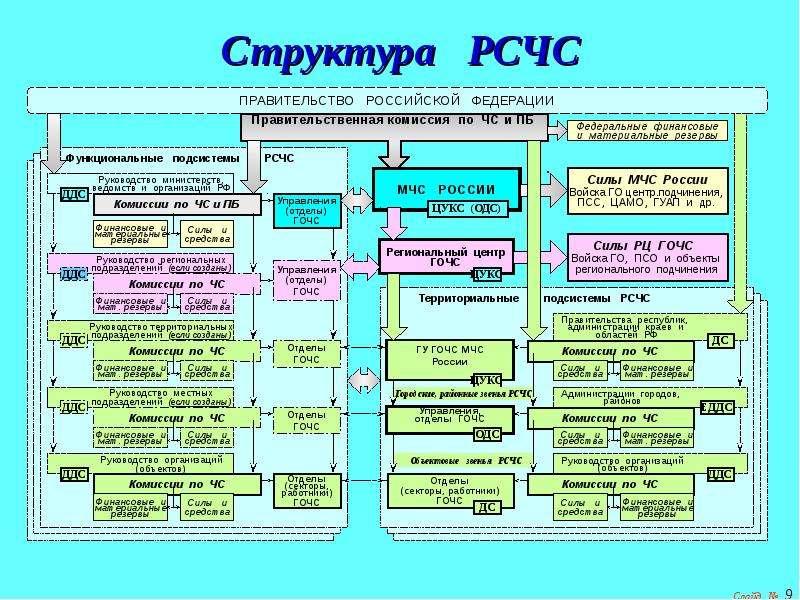 (A) Проростки, инъецированные pTRV2- RsMYB1-CACTA + pTRV1 или pTRV2 + pTRV1. WT, контроль дикого типа. (B) Относительная экспрессия RsMYB1-CACTA в черешках, собранных с проростков, инъецированных pTRV2- RsMYB1-CACTA + pTRV1 (V1, V2 и V3) или pTRV2 + pTRV1 (среднее ± SD, n =3 ). (C) Накопление антоцианов в 35S:GFP и 35S:RsMYB1-CACTA-GFP трансгенных каллусов редьки JC01. (D) Относительная экспрессия RsMYB1-CACTA в трансгенных каллусах (среднее ± SD, n = 3).(Эта цифра доступна в цвете по адресу JXB онлайн.)
(A) Проростки, инъецированные pTRV2- RsMYB1-CACTA + pTRV1 или pTRV2 + pTRV1. WT, контроль дикого типа. (B) Относительная экспрессия RsMYB1-CACTA в черешках, собранных с проростков, инъецированных pTRV2- RsMYB1-CACTA + pTRV1 (V1, V2 и V3) или pTRV2 + pTRV1 (среднее ± SD, n =3 ). (C) Накопление антоцианов в 35S:GFP и 35S:RsMYB1-CACTA-GFP трансгенных каллусов редьки JC01. (D) Относительная экспрессия RsMYB1-CACTA в трансгенных каллусах (среднее ± SD, n = 3).(Эта цифра доступна в цвете по адресу JXB онлайн.)
Рис. 6.
Анализ функциональной комплементации RSMYB1-CACTA с помощью VIGS и трансформации Agrobacterium . (A) Проростки, инъецированные pTRV2- RsMYB1-CACTA + pTRV1 или pTRV2 + pTRV1. WT, контроль дикого типа. (B) Относительная экспрессия RsMYB1-CACTA в черешках, собранных с проростков, инъецированных pTRV2- RsMYB1-CACTA + pTRV1 (V1, V2 и V3) или pTRV2 + pTRV1 (среднее ± SD, n =3 ). (C) Накопление антоцианов в 35S:GFP и 35S:RsMYB1-CACTA-GFP трансгенных каллусов редьки JC01. (D) Относительная экспрессия RsMYB1-CACTA в трансгенных каллусах (среднее ± SD, n = 3). (Этот рисунок доступен в цвете по адресу JXB онлайн.)
(C) Накопление антоцианов в 35S:GFP и 35S:RsMYB1-CACTA-GFP трансгенных каллусов редьки JC01. (D) Относительная экспрессия RsMYB1-CACTA в трансгенных каллусах (среднее ± SD, n = 3). (Этот рисунок доступен в цвете по адресу JXB онлайн.)
Рис. 7.
Фенотип редьки с красной мякотью связан со вставкой транспозона CACTA в промоторную область RsMYB1 . Представлены молекулярные структуры аллелей RsMYB1-CACTA и RsMYB1 с фланкирующими последовательностями. (A) Места вставки перед RsMYB1-CACTA и RsMYB1 указаны для линии с красной мякотью (MTH011) и линии с белой мякотью (Baiyuchun). (B) Изображения 14 сортов редьки, различающихся по цвету мякоти, и результаты электрофореза в агарозном геле для ПЦР-анализа нижних и верхних соединений RsMYB1-CACTA и промоторной области RsMYB1 каждого сорта. Cox1 служил эталонным геном. Фрагменты размером 1000 п.н. и 1800 п.н., соответствующие нисходящему и восходящему соединениям RsMYB1-CACTA , присутствуют в разновидностях с красной мякотью (дорожки 1–6), но не в разновидностях без красной мякоти (дорожки 7–14). . (C) ПЦР-анализ встроенного транспозона CACTA в 111 образцах. Данные, представленные в (B) и (C), представлены в дополнительной таблице S2. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
(B) Изображения 14 сортов редьки, различающихся по цвету мякоти, и результаты электрофореза в агарозном геле для ПЦР-анализа нижних и верхних соединений RsMYB1-CACTA и промоторной области RsMYB1 каждого сорта. Cox1 служил эталонным геном. Фрагменты размером 1000 п.н. и 1800 п.н., соответствующие нисходящему и восходящему соединениям RsMYB1-CACTA , присутствуют в разновидностях с красной мякотью (дорожки 1–6), но не в разновидностях без красной мякоти (дорожки 7–14). . (C) ПЦР-анализ встроенного транспозона CACTA в 111 образцах. Данные, представленные в (B) и (C), представлены в дополнительной таблице S2. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
Рис.7.
Фенотип редиса с красной мякотью связан со вставкой транспозона CACTA в промоторную область RsMYB1 . Представлены молекулярные структуры аллелей RsMYB1-CACTA и RsMYB1 с фланкирующими последовательностями. (A) Места вставки перед RsMYB1-CACTA и RsMYB1 указаны для линии с красной мякотью (MTH011) и линии с белой мякотью (Baiyuchun). (B) Изображения 14 сортов редьки, различающихся по цвету мякоти, и результаты электрофореза в агарозном геле для ПЦР-анализа нижних и верхних соединений RsMYB1-CACTA и промоторной области RsMYB1 каждого сорта. Cox1 служил эталонным геном. Фрагменты размером 1000 п.н. и 1800 п.н., соответствующие нисходящему и восходящему соединениям RsMYB1-CACTA , присутствуют в разновидностях с красной мякотью (дорожки 1–6), но не в разновидностях без красной мякоти (дорожки 7–14). . (C) ПЦР-анализ встроенного транспозона CACTA в 111 образцах. Данные, представленные в (B) и (C), представлены в дополнительной таблице S2. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
(B) Изображения 14 сортов редьки, различающихся по цвету мякоти, и результаты электрофореза в агарозном геле для ПЦР-анализа нижних и верхних соединений RsMYB1-CACTA и промоторной области RsMYB1 каждого сорта. Cox1 служил эталонным геном. Фрагменты размером 1000 п.н. и 1800 п.н., соответствующие нисходящему и восходящему соединениям RsMYB1-CACTA , присутствуют в разновидностях с красной мякотью (дорожки 1–6), но не в разновидностях без красной мякоти (дорожки 7–14). . (C) ПЦР-анализ встроенного транспозона CACTA в 111 образцах. Данные, представленные в (B) и (C), представлены в дополнительной таблице S2. (Этот рисунок доступен в цвете по адресу JXB онлайн.)
 Анализ выравнивания последовательностей выявил 1–3 SNP между кодирующей последовательностью MTH01 RsMYB1 и кодирующей последовательностью RsMYB1 в анализируемых эталонных геномах, а также 26 SNP по сравнению с RsMYB2 (дополнительная таблица S11).Это подтвердило, что только RsMYB1 экспрессировались в мякоти стержневого корня MTH01. Хотя данные транскриптома, по-видимому, указывают на экспрессию RsMYB2 , это могло быть ложноположительным результатом из-за значительного сходства между RsMYB1 и RsMYB2 . Функция RsMYB1-CACTA была дополнительно подтверждена сверхэкспрессией в трансгенной редьке.
Анализ выравнивания последовательностей выявил 1–3 SNP между кодирующей последовательностью MTH01 RsMYB1 и кодирующей последовательностью RsMYB1 в анализируемых эталонных геномах, а также 26 SNP по сравнению с RsMYB2 (дополнительная таблица S11).Это подтвердило, что только RsMYB1 экспрессировались в мякоти стержневого корня MTH01. Хотя данные транскриптома, по-видимому, указывают на экспрессию RsMYB2 , это могло быть ложноположительным результатом из-за значительного сходства между RsMYB1 и RsMYB2 . Функция RsMYB1-CACTA была дополнительно подтверждена сверхэкспрессией в трансгенной редьке. В предыдущих отчетах Yi et al. (2018) и Луо и др. (2020) предположил, что RsMYB2 (Rs388430, «WK10039» R07: 9,36 Мб) является ключевым геном для накопления антоцианов в кожице красной редьки. Однако SNP в кодирующей области RsMYB2 и промоторной области плохо коррелировали с фенотипом красной кожи в естественной популяции, что означает, что существует более одного локуса, контролирующего образование красной кожи (Tatebe, 1938; Harborne and Paxman). , 1964). Более того, у всех растений F 1 в этом исследовании наблюдалась интенсивная красная окраска кожуры и мякоти стержневого корня, хотя оба родителя имели зеленую кожуру корня (рис.2А). Механизм, лежащий в основе накопления антоцианов, может различаться между кожурой корня и мякотью. Кроме того, необходимо выяснить, обладают ли RsMYB1 и RsMYB2 синергетическими эффектами.
, 1964). Более того, у всех растений F 1 в этом исследовании наблюдалась интенсивная красная окраска кожуры и мякоти стержневого корня, хотя оба родителя имели зеленую кожуру корня (рис.2А). Механизм, лежащий в основе накопления антоцианов, может различаться между кожурой корня и мякотью. Кроме того, необходимо выяснить, обладают ли RsMYB1 и RsMYB2 синергетическими эффектами.
 , 2016; Zhang et al. , 2018). Наши анализы McrBC и BS-seq подтвердили, что область транспозона CACTA была гиперметилирована как в MTH01, так и в JC01 (дополнительная рис. S2). Тот факт, что транспозон CACTA был вставлен очень близко к RsMYB1-CACTA (-154 п.н. относительно стартового кодона RsMYB1-CACTA ), вероятно, объясняет повышенное метилирование промоторной области RsMYB1 и связанное с этим подавление экспрессия генов (дополнительная рис.С2). С другой стороны, мы предполагаем, что распространение метилирования от высоко метилированного транспозона в линии MTH01 с красной мякотью может подавляться механизмом, опосредованным ROS1, в соответствии с аналогичным исследованием (Tang et al. , 2016; Zhang и др. , 2018).
, 2016; Zhang et al. , 2018). Наши анализы McrBC и BS-seq подтвердили, что область транспозона CACTA была гиперметилирована как в MTH01, так и в JC01 (дополнительная рис. S2). Тот факт, что транспозон CACTA был вставлен очень близко к RsMYB1-CACTA (-154 п.н. относительно стартового кодона RsMYB1-CACTA ), вероятно, объясняет повышенное метилирование промоторной области RsMYB1 и связанное с этим подавление экспрессия генов (дополнительная рис.С2). С другой стороны, мы предполагаем, что распространение метилирования от высоко метилированного транспозона в линии MTH01 с красной мякотью может подавляться механизмом, опосредованным ROS1, в соответствии с аналогичным исследованием (Tang et al. , 2016; Zhang и др. , 2018). Аналог цитозина 5-азаЦ может сильно деметилировать геном в различных растительных системах, что приводит к задержке роста, порокам развития и реактивации экспрессии молчащих генов (Solís et al., 2015; Тыч и др. , 2017; Чжу и др. , 2018). Мы обнаружили, что деметилирование промотора RsMYB1-CACTA обработкой 5-азаЦ индуцировало накопление антоцианов у белого мутанта JC01. Более того, у химерных мутантов MTH01 M1, M2 и M3 промотор RsMYB1-CACTA был более сильно метилирован в геномной ДНК, выделенной из области стержневого корня с белой мякотью, чем в геномной ДНК из области стержневого корня с красной мякотью (дополнительная рис. .С3). Лежащий в основе этого механизм подобен механизму, регулирующему экспрессию пола у дыни, где переход от мужских цветков к женским у гинециальных линий происходит после вставки транспозонов семейства hAT, что приводит к распространению метилирования ДНК на промотор CmWIP1 (Martin и др. , 2009).
, 2017; Чжу и др. , 2018). Мы обнаружили, что деметилирование промотора RsMYB1-CACTA обработкой 5-азаЦ индуцировало накопление антоцианов у белого мутанта JC01. Более того, у химерных мутантов MTH01 M1, M2 и M3 промотор RsMYB1-CACTA был более сильно метилирован в геномной ДНК, выделенной из области стержневого корня с белой мякотью, чем в геномной ДНК из области стержневого корня с красной мякотью (дополнительная рис. .С3). Лежащий в основе этого механизм подобен механизму, регулирующему экспрессию пола у дыни, где переход от мужских цветков к женским у гинециальных линий происходит после вставки транспозонов семейства hAT, что приводит к распространению метилирования ДНК на промотор CmWIP1 (Martin и др. , 2009).
Сравнение транскриптомов корневой мякоти MTH01 и JC01 показало, что уровни экспрессии 27 из 53 ABG значительно снижены.В частности, уровни экспрессии по крайней мере одной копии ABG ( RSPAL , RSC4CH , RSC4CL , RSCHS , RSCHI , RSF3H , RSDFR , RSANS и RSUF3GT ) и транспортный ген ( RsTT19 ) были существенно снижены у мутанта (дополнительная рис. S5). Пониженная экспрессия этих структурных генов предполагает, что RsMYB1 является ключевым геном в регуляторной сети, контролирующей биосинтез антоцианов. Более раннее исследование на A. thaliana показало, что сверхэкспрессия AtPAP1 , который кодирует транскрипционный фактор R2R3-MYB, повышает экспрессию ряда генов биосинтеза антоцианов и флавонолов (Tohge et al. , 2005). ). Структурные гены пути биосинтеза антоцианов, регулируемые комплексом MYB-bHLH-WD40, являются видо- и тканеспецифичными. Предыдущие исследования показали, что гены позднего пути в A . thaliana (Borevitz et al., 2000; Гонсалес и др. , 2008) и гены раннего и позднего пути у кукурузы (Grotewold et al. , 1994; Falcone Ferreyra et al., 2010) регулируются этим комплексом. В текущем исследовании первым геном пути биосинтеза антоцианов, который демонстрировал резко сниженную экспрессию, был CHS , при этом уровни экспрессии трех копий были снижены на основе данных секвенирования РНК (дополнительная таблица S12, дополнительная рис. S5). Следовательно, RsMYB1 может регулировать экспрессию генов раннего пути биосинтеза антоцианов, начиная с RsCHS .
Более раннее исследование на A. thaliana показало, что сверхэкспрессия AtPAP1 , который кодирует транскрипционный фактор R2R3-MYB, повышает экспрессию ряда генов биосинтеза антоцианов и флавонолов (Tohge et al. , 2005). ). Структурные гены пути биосинтеза антоцианов, регулируемые комплексом MYB-bHLH-WD40, являются видо- и тканеспецифичными. Предыдущие исследования показали, что гены позднего пути в A . thaliana (Borevitz et al., 2000; Гонсалес и др. , 2008) и гены раннего и позднего пути у кукурузы (Grotewold et al. , 1994; Falcone Ferreyra et al., 2010) регулируются этим комплексом. В текущем исследовании первым геном пути биосинтеза антоцианов, который демонстрировал резко сниженную экспрессию, был CHS , при этом уровни экспрессии трех копий были снижены на основе данных секвенирования РНК (дополнительная таблица S12, дополнительная рис. S5). Следовательно, RsMYB1 может регулировать экспрессию генов раннего пути биосинтеза антоцианов, начиная с RsCHS . Однако гены, на которые нацелен комплекс MYB-bHLH-WD40, должны быть подтверждены иммунопреципитацией хроматина.
Однако гены, на которые нацелен комплекс MYB-bHLH-WD40, должны быть подтверждены иммунопреципитацией хроматина.
Редька с красной мякотью является особым сортом в Китае, но его происхождение и эволюция неясны. Транспозоны часто функционировали как модуляторы экспрессии генов во время одомашнивания сельскохозяйственных культур (Oikawa et al. , 2015). Кроме того, сайт-специфические транспозоны также можно использовать для отслеживания генетических взаимоотношений и происхождения (Zhang et al., 2019). В этом исследовании мы определили, что транспозон CACTA, встроенный перед промотором RsMYB1 , связан с окраской всех образцов с красной мякотью и некоторых разновидностей с красной кожей. Исследование наследования цвета кожицы и мякоти стержневого корня редьки, по-видимому, имело отношение к одомашниванию и происхождению редьки с красной мякотью. Он и др. (1997) предположил, что редька с красной кожурой могла произойти в результате скрещивания растений редьки с красной и зеленой кожурой. В этом отчете подтверждается, что популяция F 2 , полученная в результате скрещивания образцов с красной кожурой (с белой мякотью) и с зеленой кожей (с белой мякотью), включала отдельные растения, которые давали стержневой корень с фиолетовым, красным, зеленым или фиолетовым и зеленая кожа. Особь с пурпурной кожей из популяции F 2 была скрещена, в результате чего появилось несколько особей с красной кожей и пурпурной кожей. Самоскрещивание этих особей дало потомство, похожее на редьку с красной мякотью.Таким образом, мы предполагаем, что редька с красной мякотью произошла от редьки с красной кожурой, содержащей транспозон CACTA. Однако необходим тщательный анализ наследственности с участием различных популяций и генотипирование.
В этом отчете подтверждается, что популяция F 2 , полученная в результате скрещивания образцов с красной кожурой (с белой мякотью) и с зеленой кожей (с белой мякотью), включала отдельные растения, которые давали стержневой корень с фиолетовым, красным, зеленым или фиолетовым и зеленая кожа. Особь с пурпурной кожей из популяции F 2 была скрещена, в результате чего появилось несколько особей с красной кожей и пурпурной кожей. Самоскрещивание этих особей дало потомство, похожее на редьку с красной мякотью.Таким образом, мы предполагаем, что редька с красной мякотью произошла от редьки с красной кожурой, содержащей транспозон CACTA. Однако необходим тщательный анализ наследственности с участием различных популяций и генотипирование.
Рис. S3. Уровень метилирования промотора RsMYB1-CACTA (область BS5) в части с белой и красной мякотью химерных мутантов MTH01.
Рис. S4. Филогенетическое древо генов RsMYB1 и RsMYB2 в MTH01 и эталонных геномах.
Рис. S5. Пути биосинтеза антоцианов, а также регуляторные гены и уровни их экспрессии.
Таблица S1. Скорость мутации MTH01.
Таблица S2. Распространение RsMYB1-CACTA среди различных сортов.
Таблица S3. Подробная информация о праймерах, использованных в этом исследовании.
Таблица S4. Данные ресеквенирования генома.
Таблица S5. Подробная информация обо всех SNP, а также SNP-индекс и Δ(SNP-индекс).
Таблица S6. SNP-индекс и Δ(SNP-индекс) для каждого скользящего окна.
Таблица S7. Все 16 областей-кандидатов связаны с цветом мякоти стержневого корня в соответствии с SNP-индексом, основанным на геноме Aokubi DH.
Таблица S8. Гены с дифференциальной экспрессией (MTH01/JC01) и аннотации.
Таблица S9.Значительно обогащены пути KEGG, связанные с DEG.
Таблица S10. Уровни экспрессии DEG в областях-кандидатах и аннотациях.
Таблица S11. Выравнивание последовательностей RsMYB1 и RsMYB2 в MTH01 и эталонном геномах.
Таблица S12. Гены биосинтеза антоцианов, идентифицированные в R. sativus , и уровни их экспрессии в MTH01 и JC01.
8
ABGS
Anthocyanin Биосинтетические гены
9028
QTL
QTL
QTL-SEQ
Количественное чертежное расположение по геному Resequencing
RPKM
RPKM
RPKM
TRV
TRV
VIGS
вирус-индуцированного гена Gene
Эта работа была поддержана грантами Фонда естественных наук Китая (31601753), Национальной ключевой программы исследований и разработок Китая (2017YFD0101806), Программы технологических инноваций Пекинской академии сельскохозяйственных и лесных наук (KJCX20170710) и Пекинского Фонд естественных наук (6164031).Маркировка активации идентифицирует консервативный регулятор MYB биосинтеза фенилпропаноидов
.Растительная клетка
12
,2383
–2394
.Butelli
E
,Titta
L
,Giorgio
M
, и др. .2008
.Обогащение плодов томата полезными для здоровья антоцианами путем экспрессии отдельных факторов транскрипции
.Природные биотехнологии
26
,1301
–1308
.BVRC, BAAFS (Пекинский научно-исследовательский центр овощей, Пекинская академия сельскохозяйственных и лесных наук)
.1977
.Итоги эксперимента по очистке редьки «Синьлимэй»
.Пекин, сельскохозяйственные науки
5
,50
–56
. (на китайском языке)Cao
X
,Qiu
Z
,Wang
X
и др. .2017
.Предполагаемый репрессор R3 MYB является геном-кандидатом, лежащим в основе atroviolacium , локуса антоциановой пигментации плодов томатов
.
Журнал экспериментальной ботаники
68
,5745
–5758
.CHIU
LW
,ZHOU
x
,Burke
S
,WU
,
WU
x
,,
RL
,LI
L
.2010
.Фиолетовая цветная капуста возникает в результате активации фактора транскрипции MYB
.Физиология растений
154
,1470
–1480
.COR
,мА
,мин
,
,
SR
,KO
SM
,LIU
JR
,CHOI
PS
.2008
.Опосредованная Agrobacterium генетическая трансформация редьки ( Raphanus sativus L.)
.Биотехнология растений
25
,205
–208
. .1998
.Гомолог Myb кукурузы кодируется мультикопийным генным комплексом
.Молекулярная и общая генетика
260
,372
–380
.
Espley
RV
,Brendolise
C
,Chagné
D
, и др. .2009
.Множественные повторы промоторного сегмента вызывают ауторегуляцию фактора транскрипции в красных яблоках
.Растительная клетка
21
,168
–183
.Falcone Ferreyra
ML
,RUI
,
,Emiliani
J
,J
,,
,
L
,,
A
,MOROHASHI
K
,Casati
P
,Гротеволд
E
.2010
.Клонирование и характеристика УФ-В-индуцируемой флавонолсинтазы кукурузы
.Журнал завода
62
,77
–91
.Furukawa
T
,T
,M Maekawa
м
,Оки
T
,Suda
II
,IIDA
S
,Shimada
H
,TakaMure
I
,Кадоваки
К
.2007
.
Гены Rc и Rd участвуют в синтезе проантоцианидина в околоплоднике риса
.Журнал завода
49
,91
–102
.Гонсалес
А
,Чжао
М
,Ливитт
ДжМ
,Ллойд
AM
.
2008
.Регуляция пути биосинтеза антоцианов транскрипционным комплексом TTG1/bHLH/Myb в проростках Arabidopsis
.Журнал завода
53
,814
–827
. .1994
.Ген myb -гомологичный P контролирует пигментацию флобафена в цветочных органах кукурузы путем прямой активации подмножества генов биосинтеза флавоноидов
.Сотовый
76
,543
–553
.GUO
N
,CHENG
F
,WU
J
,J
,,
,
,
Zheng
S
,Liang
J
,Wang
x
.2014
.Гены биосинтеза антоцианов в Brassica rapa
.
BMC Genomics
15
,426
.Харборн
JB
,Паксман
GJ
.1964
.Генетика антоцианового продукта в редьке
.Наследственность
19
,505
–506
.He
J
,Джусти
ММ
.2010
.Антоцианы: натуральные красители с полезными для здоровья свойствами
.Ежегодный обзор пищевых наук и технологий
1
,163
–187
.HE
QW
,ZHAO
SY
,SHI
HL
,HL
,,
ZQ
,Lang
FQ
,Wang
SF
.1997
.Предварительное исследование наследования цвета кожуры китайской редьки
.Шаньдунские сельскохозяйственные науки
2
,4
–9
. (на китайском языке)Кобаяши
S
,Гото-Ямамото
N
,Хирочика
H
.
2004
.Вызванные ретротранспозонами мутации цвета кожицы винограда
.Наука
304
,982
.Koes
R
,Verweij
W
,Quattrocchio
F
.2005
.Флавоноиды: красочная модель регуляции и эволюции биохимических путей
.Тенденции в растениеводстве
10
,236
–242
. .2009
.Сверхбыстрое и эффективное с точки зрения памяти сопоставление коротких последовательностей ДНК с геномом человека
.Биология генома
10
,R25
.Ли
Х
,Дурбин
Р
.2009
.Быстрое и точное выравнивание коротких считываний с помощью преобразования Берроуза-Уилера
.Биоинформатика
25
,1754
–1760
.LIM
SH
,KIM
DH
,KIM
JK
,Lee
JY
,HA
SH
.2017
.
Основной фактор транскрипции спираль-петля-спираль редьки, RsTT8 действует как позитивный регулятор биосинтеза антоцианов
.Границы науки о растениях
8
,1917
.LIM
SH
,SH
,,JH
,KIM
DH
,KIM
JK
,Lee
JY
,KIM
YM
,HA
SH
.2016
.Активация биосинтеза антоцианов путем экспрессии гена фактора транскрипции R2R3-MYB редьки RsMYB1
.Отчеты о растительных клетках
35
,641
–653
.Лин
ЛЗ
,Харнли
ДЖМ
.2007
.Метод скрининга для идентификации гликозилированных флавоноидов и других фенольных соединений с использованием стандартного аналитического подхода для всех растительных материалов
.Журнал сельскохозяйственной и пищевой химии
55
,1084
–1096
.
Lister
R
,O’Malley
RC
,TONTI-FILIPIPINI
J
,J
,Gregory
BD
,Berry
CC
,Millar
AH
,Ecker
JR
.2008
.Высокоинтегрированные карты эпигенома с однобазовым разрешением Arabidopsis
.Ячейка
133
,523
–536
.Лю
Y
,Шифф
М
,Динеш-Кумар
SP
.2002
.Индуцированное вирусом замалчивание генов у томатов
.Журнал завода
31
,777
–786
.LIU
TJ
,Чжан
Yj
,Чжан
xh
,Sun
YY
,Wang
HP
,песня
JP
,LI
XX
,2019
.Анализ транскриптома выявил ключевые гены, участвующие в изменении цвета кожуры стержневого корня редьки Xinlimei
.Физиология и биохимия растений
139
,528
–539
.
LUO
XB
,XU
L
, Wangy
,Y
,дон
JH
,CHEN
YL
,Tang
MJ
,вентилятор
LX
,Чжу
ЮЛ
,Лю
ЛВ
.2020
.Генетическая карта сверхвысокой плотности дает представление о синтении генома, рекомбинационном ландшафте и цвете кожуры основного корня редьки ( Raphanus sativus L.)
.Журнал биотехнологии растений
18
,274
–286
.Martin
A
,A
,C
,C
,A
,A
,Rajab
M
,Fernandez
R
,MORIN
H
,Pitrat
M
,Догимонт
С
,Бендахман
А
.2009
.Индуцированное транспозоном эпигенетическое изменение приводит к определению пола у дыни
.Природа
461
,1135
–1138
.
Masukawa
T
, CheonKS
,KS
,MIZUTA
D
,Nakatsuka
A
,Kobayashi
N
.2018
.Вставка ретротранспозона в гомолог флавоноид-3′-гидроксилазы придает редьке характер красного корня ( Raphanus sativus L.вар. longipinnatus L. H. Bailey)
.Садоводческий журнал
87
,89
–96
.McKenna
A
,Hanna
M
,Banks
E
, и др. .2010
.Набор инструментов для анализа генома: платформа MapReduce для анализа данных секвенирования ДНК нового поколения
.Исследование генома
20
,1297
–1303
.Mitsui
Y
,Shimomura
M
,Komatsu
K
, и др. .2015
.Геном редьки и комплексный профиль экспрессии генов образования и развития клубневых корней
.
Научные отчеты
5
,10835
.MULEKE
EM
,вентилятор
L
,Wang
Y
,XU
L
,ZHU
x
,Zhang
W
,CAO
Y
,Каранджа
БК
,Лю
Л
.2017
.Координированная регуляция генов биосинтеза антоцианов обеспечивает разнообразное фенотипическое и пространственно-временное накопление антоцианов у редьки ( Raphanus sativus L.)
.Границы науки о растениях
8
,1243
.Мюррей
MG
,Томпсон
WF
.1980
.Быстрое выделение ДНК растений с высокой молекулярной массой
.Исследование нуклеиновых кислот
8
,4321
–4325
.Oikawa
T
, MaedaH
,H
,,T
,Yamaguchi
T
, TanabeN
,EBANA
K
,YANO
M
,Эбитани
Т
,Изава
Т
.
2015
.Рождение гена черного риса и его локальное распространение путем интрогрессии
.Растительная клетка
27
,2401
–2414
.Park
M
,Lee
JH
,HAN
K,Jang
S
,HAN
J
,LIV
JH
,Jung
JW
,Кан
БК
.2019
.Основной QTL и гены-кандидаты для биосинтеза капсаициноидов в околоплоднике Capsicum chinense , выявленные с помощью QTL-seq и RNA-seq
.Теоретическая и прикладная генетика
132
,515
–529
.Park
NI
,XU
H
,LI
,,
,,
IH
,,
S
,AHN
GH
,LIV
YP
,Ким
SJ
,Парк
SU
.2011
.Накопление антоцианов и экспрессия генов биосинтеза антоцианов в редьке ( Raphanus sativus )
.
Журнал сельскохозяйственной и пищевой химии
59
,6034
–6039
.Петрони
К
,Тонелли
С
.2011
.Последние достижения в регуляции синтеза антоцианов в репродуктивных органах
.Растениеводство
181
,219
–229
.Saxena
RK
,Penmetsa
RV
,Upadhyaya
HD
и др. .2012
.Крупномасштабная разработка экономичных маркеров однонуклеотидного полиморфизма для генетического картирования голубиного гороха и сравнительного картирования бобовых
.Исследование ДНК
19
,449
–461
.Ши
МЗ
,Се
ДИ
.2014
.Биосинтез и метаболическая инженерия антоцианов в Arabidopsis thaliana
.Последние патенты в области биотехнологии
8
,47
–60
.SIDORENKO
LV
,LI
x
,Cocciolone
SM
,,,
Tagliani
L
,Bowen
B
,Daniels
M
,Петерсон
Т
.
2000
.Комплексная структура промотора гена Myb кукурузы : функциональный анализ в трансгенных растениях
.Журнал завода
22
,471
–482
.Solís
MT
,EL-Tantawy
,AA
,AA
,CANO
V
,Risueño
MC
,Testillano
PS
.2015
.5-азацитидин способствует инициации эмбриогенеза микроспор путем снижения глобального метилирования ДНК, но предотвращает последующее развитие эмбрионов у рапса и ячменя
.Границы науки о растениях
6
,472
.Studer
A
,Zhao
Q
,Росс-Ибарра
J
,Doebley
J
.2011
.Идентификация функциональной вставки транспозона в гене одомашнивания кукурузы tb1
.Nature Genetics
43
,1160
–1163
.Sun
Y
,qiu
y
,y
,м
, WangJ
,Zhang
,
,
Wang
H
,песня
J
,Ли
X
.
2017
.Идентификация микроРНК, связанных с биосинтезом антоцианов, в характерной китайской редьке ( Raphanus sativus L.) с помощью высокопроизводительного секвенирования
.Молекулярная генетика и геномика
292
,215
–229
.Sun
Y
,Wang
J
, qiuy
,,,,
T
, J,LI
x
.2018
.Идентификация генов-кандидатов редьки Xinlimei, связанных с биосинтезом антоцианов, на основе анализа транскриптома
.Гена
657
,81
–91
. .2006
.Пойман с поличным: Rc кодирует основной белок спираль-петля-спираль, обуславливающий красный околоплодник риса
.Растительная клетка
18
,283
–294
.Takagi
H
,Abe
A
,Yoshida
K
, и др. .2013
.
QTL-seq: быстрое картирование локусов количественных признаков в рисе путем повторного секвенирования всего генома ДНК из двух объединенных популяций
.Журнал завода
74
,174
–183
.Тан
К
,Лан
Z
,Чжан
H
,Чжу
JK
.2016
.ДНК-деметилаза ROS1 нацелена на области генома с различными модификациями хроматина
.Природные растения
2
,16169
.Татебе
Т
.1938
.О наследовании окраски корней у Raphanus sativus L
.Японский журнал генетики
14
,39
–50
.Telias
A
,Lin-Wang
K
, stevensonde
,Cooney
JM,JM
,,
RP
,ALLAN
AC
,Hoover
EE
,Брейдин
ДМ
.2011
.Паттерн кожуры яблока связан с дифференциальной экспрессией MYB10
.
BMC Биология растений
11
,93
.Тянь
ПФ
.2006
.Progress in plant CACTA elements
.Acta Genetica Sinica
33
,765
–774
.Tohge
T
,Nishiyama
Y
,Hirai
MY
, и др..2005
.Функциональная геномика путем комплексного анализа метаболома и транскриптома растений арабидопсиса со сверхэкспрессией фактора транскрипции MYB
.Журнал завода
42
,218
–235
.Трапнелл
C
,Пачтер
L
,Зальцберг
SL
.2009
.TopHat: обнаружение сплайс-соединений с помощью RNA-Seq
.Биоинформатика
25
,1105
–1111
.Тыч
D
,Ночарова
E
,Сикорова
L
,Фишер
L
.2017
.Опосредованная 5-азацитидином реактивация молчащих трансгенов картофеля ( Solanum tuberosum ) на уровне всего растения
.
Отчеты о растительных клетках
36
,1311
–1322
.Ван Оойен
JW
.2006
.JoinMap® 4, программное обеспечение для расчета карт генетического сцепления в экспериментальных популяциях
.Вагенинген
:Кязьма Б.В.
.Вагнер
ГП
,Кин
К
,Линч
В.Дж.
.2012
.Измерение количества мРНК с использованием данных секвенирования РНК: показатель RPKM несовместим между образцами
.Теория биологических наук
131
,281
–285
.Walker
AR
,Lee
,,
E
,,
,J
,McDavid
DA
,THOMAS
MR
,Robinson
SP
.2007
.Белый виноград возник в результате мутации двух сходных и смежных регуляторных генов
.Журнал завода
49
,772
–785
.
Wang
L
,Feng
Z
,Wang
x
,Wang
x
,Zhang
x
.2010
.DEGseq: R-пакет для идентификации дифференциально экспрессируемых генов из данных RNA-seq
.Биоинформатика
26
,136
–138
.Wang
Z
,MENG
D
,D
,,
A
,LI
T
,Jiang
S
,CON
P
,LI
T
.2013
.Метилирование промотора PcMYB10 связано с зеленокожими видами груши Max Red Bartlett
.Физиология растений
162
,885
–896
.Wittmeyer
K
,Cui
J
,Chatterjee
D
, и др. .2018
.Доминантный и плохо проникающий фенотип кукурузы Нестабильный фактор для апельсина1 вызван изменениями метилирования ДНК в сцепленном транспозоне
.
Растительная клетка
30
,3006
–3023
.Yi
G
,KIM
JS
,Park
,,
JE
,Shin
H
,YU
SH
,Park
S
,HUH
JH
.2018
. Фактор транскрипцииMYB1 является кандидатом, ответственным за красную кожуру корней редиса ( Raphanus sativus L.)
.ПЛОС ОДИН
13
,e0204241
.Zhang
L
,Hu
J
,Han
X
, и др. .2019
.Высококачественная сборка генома яблока выявила связь ретротранспозона и красного цвета плодов
.Nature Communications
10
,1494
.Чжан
Х
,Ланг
Z
,Чжу
ДЖК
.2018
.Динамика и функция метилирования ДНК у растений
.Обзоры природы. Молекулярно-клеточная биология
19
,489
–506
.
Zhang
X
,Yazaki
J
,Sundaresan
A
, и др. .2006
.Полногеномное картирование с высоким разрешением и функциональный анализ метилирования ДНК у Arabidopsis
.Ячейка
126
,1189
–1201
.Zhang
X
,Yue
Z
,Mei
S
, et al. .2015
.A de novo genome of a Chinese radish cultivar
.Horticultural Plant Journal
1
,155
–164
.Zhu
J
,Fang
L
,Yu
J
,Zhao
Y
,Chen
F
,Xia
G
.2018
. Обработка5-азацитидином и сверхэкспрессия TaPBF-D увеличивают накопление глютенина в зерне пшеницы за счет гипометилирования промоторов Glu-1
.Теоретическая и прикладная генетика
131
,735
–746
.
Примечания автора
© Автор(ы), 2020. Опубликовано Oxford University Press от имени Общества экспериментальной биологии.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа цитируется правильно.SEC.gov | Порог частоты запросов превысил
Чтобы обеспечить равный доступ для всех пользователей, SEC оставляет за собой право ограничивать запросы, исходящие от необъявленных автоматических инструментов. Ваш запрос был идентифицирован как часть сети автоматизированных инструментов, выходящих за рамки допустимой политики, и будет управляться до тех пор, пока не будут предприняты действия по объявлению вашего трафика.
Пожалуйста, заявите о своем трафике, обновив свой пользовательский агент, включив в него информацию о компании.
Чтобы ознакомиться с рекомендациями по эффективной загрузке информации с SEC.gov, включая последние документы EDGAR, посетите сайт sec.gov/developer. Вы также можете подписаться на получение по электронной почте обновлений программы открытых данных SEC, включая передовые методы, которые делают загрузку данных более эффективной, и улучшения SEC.gov, которые могут повлиять на процессы загрузки по сценарию. Для получения дополнительной информации обращайтесь по адресу opendata@sec.правительство
Для получения дополнительной информации см. Политику конфиденциальности и безопасности веб-сайта SEC. Благодарим вас за интерес, проявленный к Комиссии по ценным бумагам и биржам США.
Идентификатор ссылки: 0.7ecef50.1643246409.36d77c74
Дополнительная информация
Политика безопасности Интернета
Используя этот сайт, вы соглашаетесь на мониторинг и аудит безопасности. В целях безопасности и для обеспечения того, чтобы общедоступные услуги оставались доступными для пользователей, эта правительственная компьютерная система использует программы для мониторинга сетевого трафика для выявления несанкционированных попыток загрузить или изменить информацию или иным образом нанести ущерб, включая попытки отказать в обслуживании пользователям.
В целях безопасности и для обеспечения того, чтобы общедоступные услуги оставались доступными для пользователей, эта правительственная компьютерная система использует программы для мониторинга сетевого трафика для выявления несанкционированных попыток загрузить или изменить информацию или иным образом нанести ущерб, включая попытки отказать в обслуживании пользователям.
Несанкционированные попытки загрузки информации и/или изменения информации в любой части этого сайта строго запрещены и подлежат судебному преследованию в соответствии с Законом о компьютерном мошенничестве и злоупотреблениях от 1986 г. и Законом о защите национальной информационной инфраструктуры от 1996 г. (см. Раздел 18 USC §§ 1001 и 1030).
Чтобы гарантировать, что наш веб-сайт хорошо работает для всех пользователей, SEC отслеживает частоту запросов на контент SEC.gov, чтобы гарантировать, что автоматический поиск не повлияет на возможность других получить доступ к SEC.содержание правительства. Мы оставляем за собой право блокировать IP-адреса, отправляющие чрезмерные запросы. Текущие правила ограничивают количество пользователей до 10 запросов в секунду, независимо от количества компьютеров, используемых для отправки запросов.
Текущие правила ограничивают количество пользователей до 10 запросов в секунду, независимо от количества компьютеров, используемых для отправки запросов.
Если пользователь или приложение отправляет более 10 запросов в секунду, дальнейшие запросы с IP-адреса (адресов) могут быть ограничены на короткий период. Как только количество запросов упадет ниже порогового значения на 10 минут, пользователь может возобновить доступ к контенту в SEC.правительство Эта практика SEC предназначена для ограничения чрезмерных автоматических поисков на SEC.gov и не предназначена и не ожидается, что она повлияет на отдельных лиц, просматривающих веб-сайт SEC.gov.
Обратите внимание, что эта политика может измениться, поскольку SEC управляет SEC.gov, чтобы обеспечить эффективную работу веб-сайта и его доступность для всех пользователей.
Примечание: Мы не предлагаем техническую поддержку для разработки или отладки процессов загрузки по сценарию.
(45 новых курсов) Menus Свяжитесь с нами Ссылки на нами Ссылки на нами Справка Принципиальное Сообщение Сообщение Миссия Резерфордские школы округа Недавние Новости Общественное оповещение — Без заслуживающей доверия угрозпревью / Показать еще
см. Также : Горячие Курсы 22 Используются Подробнее
Средняя школа Чейза Резерфордтон, Северная Каролина AreaVibes
4 часа назад Средняя школа Чейза — это школа, обслуживающая 6–8 классы, расположенная в округе «Школы округа Резерфорд» в Резерфордтоне, Северная Каролина.В средней школе Чейза в общей сложности 564 ученика и 37 учителей, при соотношении учеников и учителей 16 к 1. Всего нет учеников с бесплатным обедом и нет учеников со льготным обедом.
Студент / Учитель соотношение: 16: 1
Учителя: 37
Студенты: 564
Предварительный просмотр / Показать еще
См. Также : Горячие Курсы 84 Показать детали
Зимние и весенние виды спорта – Спорт – Средняя школа Чейза
828-247-10439 часов назад Средняя школа Чейза находится в Сити, Северная Каролина.840 Chase High Road, Forest City, NC 28043 Тел.: 828-247-1043 Факс: 828-247-0551
Предварительный просмотр / Показать еще
1 См. также 8 Курс 1: Горячий 18 Показать подробности 8 19 Показать детали 8 19Средняя школа Чейза Домашняя страница Facebook
(828) 247-10435 часов назад Средняя школа Чейза существует для того, чтобы подготовить будущих учеников к конкурентоспособности на глобальном уровне. 840 Chase High Rd, Форест Сити, Северная Каролина 28043
5kТелефон: (828) 247-1043 (828) 247-1043
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 45 б / у Подробнее
Чейз Высшая школа
2 часа назад Chase High School расположена в Форест-Сити, Северная Каролина. Офис шерифа округа Резерфорд и система
школы округа Резерфорд были проинформированы о сообщении социальных сетей, распространяемом через TikTok и другие социальные сети, о возможности насилия в школе завтра, 17 декабря.Предварительный просмотр / Показать еще
См. Также : Горячие Курсы 22 Используется Подробнее
Наши школы — Информация о округе — Раттерфордские школы округа
9 часов назад Rutherford County School район расположен в Форест-Сити, Северная Каролина. RS Central High http://rschs.rcsnc.org 641 Hwy. 221 север Rutherfordton , NC 28139
см. Также : Горячие Курсы 89 Использованные Подробнее
Округ Резерфорд
2 часа назад Rutherford County Школа Район расположен в Форест-Сити, Северная Каролина.Сообщество: НЕТ ВЕРОЯТНОЙ УГРОЗЫ Офис шерифа округа Резерфорд и система школы
округа Резерфорд были проинформированы о сообщении в социальных сетях, распространенном через Snapchat, с угрозами учащимся и персоналу школы в школе , описанной как «Центральная средняя школа ».Предварительный просмотр / Подробнее
См. также : Горячие курсы 22 Б/у Показать детали
Средняя школа RS
3 часа назад Средняя школа RS находится по адресу Rutherfordton , Северная Каролина.В соответствии с требованиями законодательства штата и руководства по общественному здравоохранению школы округа Резерфорд предоставили программу дистанционного обучения в течение 2020-2021 школы года.
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 23 Используются Подробнее
Чейз Средняя Школа / Главная страница Государственные школы
6 часов назад Чейз Средняя школа обслуживает студентов в 700 и 8.Он является частью Spokane Public Schools , второго по величине школьного округа в штате Вашингтон.
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 36 Используются Подробнее
RS Средняя Школа Главная Facebook
9 часов назад Средняя школа , Rutherfordton , Северная Каролина . 1707 лайков · 4 разговора об этом. RS Средняя школа — это государственная школа , обслуживающая учащихся 6–8 классов в западных регионах округа Резерфорд в
Предварительный просмотр / Подробнее
Школы в Rutherfordton, NC CHASE MIDDLE SCHOOL
6 часов назад Узнайте больше о CHASE MIDDLE SCHOOL , школе , расположенной по адресу Rutherfordton , NC.Прочитайте school рейтинги и обзоры для CHASE СРЕДНЯЯ ШКОЛА .
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 106 подержанные Посмотреть детали
RS средняя школа
(828) 286-44618 часов назад • погоня за средней школой , Достигнут ожидаемый рост, директор Джейсон Берд • Cliffside Elementary School , Превзошел ожидаемый рост, директор Шэннон Хенсон 545 Charlotte Road, Rutherfordton , NC 28139 Телефон: (828) 286-4461 Факс: (828) 286 …
09 Предварительный просмотр / Показать еще
См. также : Горячие курсы 48 Используется Показать подробности
Средняя школа Chase в Резерфордтоне, Северная Каролина с отзывами YP.com
4 часа назад Найдите 1 объявления, относящиеся к Chase Middle School в Rutherfordton на YP.com. Смотрите отзывы, фотографии, направления, номера телефонов и многое другое для средних школ Чейза мест в Резерфордтон , Северная Каролина.
Предварительный просмотр / Показать больше
см. Также : IT Курсы 64 подержанные Подробнее
RS Средняя школа против Chase Middle School
7 часов назад Средняя школа 50% из всех школ в Северной Каролине по общим результатам тестов (знание математики — нижние 50%, а навыки чтения — лучшие 50%) за 2018-19 школу года.Процент учащихся, достигших уровня знаний по математике, составляет 38% (что ниже, чем в среднем по штату , Северная Каролина, , который составляет 42%) в 2018-19 учебном году школы .
Предварительный просмотр / Подробнее
См. также : Горячие блюда 107 Б/у Показать детали
763 Stacey Rd, Rutherfordton, NC 28139 40 Photos MLS
6 часов назад Chase High School : public : 9-12 6.30: 7: Средняя школа Чейза : общественная : 6-8 6.65: округ Резерфорд Школа округ. Все школы в Резерфордтон , Северная Каролина. Данные предоставлены GreatSchools.org. Рыночная статистика 200 тысяч долларов по прейскуранту в 763 Stacey Rd. 1 год; 5 лет; Цена $/кв. фут; Инвентарь; Дни; 763 Стейси Роуд. $ 199k $ — 28139. $
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 76 Используется Подробнее
RS занимает два, Чейз Splits in Trimatch Sports
Только сейчас Rutherfordton — Борьба отошла на второй план после печали сообщества во вторник вечером, когда RS Central, CHASE и Хендерсонвилл собрались вместе, чтобы почтить память героя сообщества и родителя-борца.Мастер-солдат Джон Хортон был не только преданным общественным слугой и семьянином, но и родителем двух борцов RS Central.
Предварительный просмотр / Показать еще
Смотрите также : IT Courses 130 Подробнее
0 Пруд Просмотр LN LOT 77 & 78, RUTHERFORDTON, NC 28139 MLS
8 часов назад на продажу: 0 Pond View Ln Lot 77 & 78, Rutherfordton , NC 28139 ∙ 45 000 долларов США ∙ MLS# 3817156 ∙ Два участка рядом, готовые к застройке! Очищено, уровень топографии, и далекий вид на горы
превью / Показать еще
Смотреть также : Горячие Курсы 78 Используется Подробнее 9508
4008
4008 SOORS FORD RD, RUTHERFORDTON, NC 28139 MLS 3821050
5 часов назад Продается — 4008 Poors Ford Rd, Rutherfordton , Северная Каролина — 380 000 долларов.Подробная информация, карта и фотографии этого дома для одной семьи с 4 спальнями и 2 ванными комнатами. MLS # 3821050.
превью /
см. Также : Горячие Курсы 85 Используется Подробнее 950 Подробнее
Дома для продажи недалеко от головного преследования Chase Side School City, NC
3 часа назад преследовать Школа Дома на продажу и недвижимость. При посредничестве FOOTHILLS HOMES AND LAND LLC. Продается. 139 000 долларов 5 тысяч долларов. 3 кровати. 2 ванна.1561 кв. фут. Участок 0,65 соток. 123 Walnut ST,
Предварительный просмотр / Показать еще
см. Также : IT Курсы 103 подержанные Подробнее
0 пруд вид LN LOT 77, RUTHERFORDTON, NC 28139 MLS
5 часов назад на продажу : 0 Pond View Ln Lot 77, Rutherfordton , NC 28139 ∙ 22 500 долларов США ∙ MLS# 3817151 ∙ Великолепный участок готов к застройке! Расчищенный, ровный рельеф и далекие виды на горы Хогбак и окрестности NC 28139 12
4 часа назад Chase High School : public : 9-12 7.11: 7: Средняя школа Чейза : общественная : 6-8 7.90: округ Резерфорд Школа округ. Все школы в Резерфордтон , Северная Каролина. Данные предоставлены GreatSchools.org. Рыночная статистика $ 22,5 тыс. Цена по прейскуранту в 0 Pond View Ln # LOT 78. 1 год; 5 лет; Цена $/кв. фут; Инвентарь; Дни; 0 пруд вид ln #lot 78. $ 22k
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 84 Используется Подробнее
Лучшие средние школы в округе Ratherford на севере
9 часов назад Посмотрите лучшие средних школ округа Резерфорд Школы по сравнению с другими школами округа.Узнайте больше здесь.
Предварительный просмотр / Подробнее
См. также : Горячие курсы 99 Б/у Показать детали
Средняя школа RS в Северной Каролине Новости США Образование
6 часов назад Средняя школа RS — это государственная школа , расположенная по адресу Rutherfordton , Северная Каролина, в отдаленном городе. Контингент учащихся средней школы RS составляет 653 человека, а школа обслуживает 6-8 человек.
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 76 Использованные Подробнее 966
763 STACEY RD, RUTHERFORDTON, NC 28139 MLS # 3815992 Zillow
7 часов назад 763 STACEY RD , RUTHERFORDTON , NC 28139-7425 — дом на одну семью, выставленный на продажу по цене 199 900 долларов. Дом площадью 1288 кв. Футов состоит из 3 спален и 2 ванных комнат. Просматривайте дополнительные сведения о недвижимости, историю продаж и данные Zestimate на Zillow. MLS # 3815992
Предварительный просмотр / Показать больше
см. Также : Горячие Курсы 87 Используется Подробнее
Pinnacle Elementary School
7 часов назад Pinnacle Elementary Школа находится в Rutherfordton , Северная Каролина.1-е место: Райан Уилкинс — Чейз Миддл 2-е место: Генри Харпер — Начальная школа Маунт-Вернон-Рут 3-е место: Грейси Коннер — Начальная школа Пиннакл Школа
Предварительный просмотр / Показать еще
См. также:9004 Курсы 47 Используется Показать подробности
Средняя школа Чейза, Форест-Сити, Северная Каролина Рейтинги
2 часа назад Анализ CarolinaSchoolHub.Школа расположена в округе Резерфорд, Северная Каролина. В средней школе Chase обучается около 548 учеников, и она обслуживает 6-8 классы.
Предварительный просмотр / Показать еще
см. Также : IT Курсы 72 Используется Подробнее 950 Подробнее
Chase Cashby RS Central HS, Rutherfordton, NC MaxPreps
Просто проверьте Chase High Школа Спортивная хронология , включая обновления игр во время игры в футбол в RS Central High School с 2018 по 2021 год.RS Central High School Rutherfordton NC. Это я Следуй. 6 футов 0 дюймов, 205 фунтов Старший. Окончил в 2021 году. Играет ( Rutherfordton , Северная Каролина) университетская футбольная команда проиграла домашнюю конференцию в пятницу
Родная страна: Hwy 221, Rutherfordton, 28139-1119, RS Central
4 Местоположение :
HWY 221, Rutherfordton, 28139-1119, RS CentralПол: MEAL
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 80 Используются Подробнее
Rutherfordton Elementary School
(828) 287-37787 часов назад • Средняя школа Чейза , Ожидаемый рост, директор Джейсон Берд • Cliffside Elementary Школа , Превышенный ожидаемый рост, Директор Шеннон Хенсон 201 0 020 Hardin Road, 901, 90 Hardin Road, 901 NC 28139 Телефон: (828) 287-3778 Факс: (828) 286 …
Предварительный просмотр / Показать еще
См. также : Hot Courses 47 Используется Показать детали
432 Gilmer Edwards Rd, Rutherfordton Township, NC, 28139
8 часов назад Rocket Homes › North Carolina › Rutherford County › Rutherfordton Township › 28139 › 432 Gilmer Edwards Rd.Этот дом расположен по адресу: 432 Gilmer Edwards Rd, Rutherfordton , NC, почтовый индекс 28139. Он числится на Rocket Homes с 29 ноября 2021 года и в настоящее время стоит 595 000 долларов. Соседи, живущие рядом с этим домом, имеют средний доход в размере 42 714 долларов.
Расположение: 432 Gilmer Edwards Rd, Rutherfordton Township, 28139, NC
Предварительный просмотр / Показать больше
см. Также : Горячие Курсы 78 Используются Посмотреть детали
Rutherfordton, NC Государственные Школы США .com™
4 часа назад 25 государственных школ были найдены, что может охватывать Резерфордтон , Северная Каролина. . Просмотреть в виде списка Просмотреть карту Продвинутый Государственная школа Ограничение поиска до: —Все типы— Дошкольное (PK или ниже) Elementary Sch. (К-4) Средний Щ. (5-8) Высокий Щ. (9-12) ИЛИ —Все классы— Дошкольный детский сад 1 класс 2 класс 3 класс 4 класс 5 класс 6 класс 7 класс 8 класс 9 класс
Предварительный просмотр / Показать еще
См. также : Hot Courses 54 Б/у Показать детали
108 Thistle Dr, Union Township, NC, 28139 RocketHomes
1 час назад 108 Thistle Dr, Rutherfordton , NC, 28139 в настоящее время не продается.Просмотрите дома для продажи в Rutherfordton , Северная Каролина, и свяжитесь с агентом по недвижимости сегодня, чтобы найти дом своей мечты. Средняя школа Чейза . 840 Chase High Rd • 15,23 миль. Общественный Округа 6-8. Высокий. 4. Центральная средняя школа РС . 641 Hwy 221 North • 6,73 миль. Public Район 9
превью / Показать еще
см. Также : Горячие Курсы 71 подержанные Подробнее
Чейз средней школы, Лесной город, NC Дома для продажи и реальные
5 часов назад Coldwell Banker Realty может помочь вам найти дома в Северной Каролине для продажи, квартиры, квартиры и другую недвижимость рядом со средней школой Chase .
Предварительный просмотр / Показать еще
см. Также : IT Courses 85 подержанных показать подробности
2136 Big Island Rd, Rutherfordton, NC 28139 Homes.com
9 часов назад Этот одноместный резею 2136 Big Island Rd, Rutherfordton, Nc. Это свойство было первоначально построено в 1993 году. 2136 Big Island Rd находится в районе School Rutherford County Schools с близлежащими школами , включая Harris Elementary School , Chase Middle School и Chase High . .
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 89 Используется Посмотреть детали
Rutherford County County Rebiled и публичные записи
(828) 247-10445 часов назад преследовать среднюю школу 840 Chase High Road, rutherford County, Forest City, NC, 28043. Телефон: (828) 247-1044 CLIFFSIDE ELEMENTARY SCHOOL (Направления) PO BOX 338, RUTHERFORD COUNTY, CLIFFSIDE, NC, 28024.
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 175 Подробнее Подробнее
Средние школы в Rutherfordton Township, NC Niche
2 часа назад Explore 2021 Школа Рейтинги и статистика по государственные и частные средние школы в городке Rutherfordton . Найдите лучшие средние школы рядом с вами.
Предварительный просмотр / Показать еще
См. также : Hot Courses 92 Используется Показать детали
2027 Wv Thompson Rd, Rutherfordton, NC 28com
Just Now Оценочная стоимость этого дома в настоящее время оценивается в 202 680, примерно 109,68 долларов за квадратный фут. Это свойство было первоначально построено в 2000 году. 2027 Wv Thompson Rd находится в пределах школы округа Резерфорд школы с соседними школами , включая начальную школу Harris Elementary , среднюю школу Chase и среднюю школу 70071 1 Chase . .
Предварительный просмотр / Показать еще
См. Также : Горячие Курсы 90 Используются Подробнее
176 Bisipop CT, Rutherfordton, NC 28139 Zillow
7 часов назад 176 епископ CT , Rutherfordton, NC 28139-6457 в настоящее время не продается.Дом для одной семьи площадью 2 634 кв. Фута состоит из 4 спален и 4 ванных комнат. Этот дом был построен в 2012 году и в последний раз продавался за. Просмотрите дополнительную информацию о собственности, историю продаж и данные Zestimate о Zillow .
Предварительный просмотр / Показать еще
Смотрите также : Горячие Курсы 87 Используются Подробнее
Rutherfordton, NC MyLife.com
1 час назад Nicholas Chase родился 28.10.1968 и ему 52 года. Николас Чейз в настоящее время живет в Резерфордтон , Северная Каролина; в прошлом Николас также жил в Риме, штат Огайо, в Шелби, штат Северная Каролина, и в Джефферсоне, штат Огайо.Другие имена, которые использует Николас, включают Николас Майкл Чейз , Николас М.М. Чейз и Николас М Чейз .
Предварительный просмотр / Показать еще
См. Также : Life Science Courses 51 Используется Подробнее
Школы в Rutherfordton, NC Отзывы Yellowbook
5 часов назад Школы в Rutherfordton , NC 291 результаты 223072 Детский сад, Кристиан Школа , Средняя школа .Веб-сайт; Быстрая информация. 9. Округ Резерфорд Школы . 1603 Чейз Хай Роуд. Средняя школа Чейза . 840 Чейз High Rd. Forest City, NC …
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 65 Использованные Подробнее
Чейз Высшая школа
7 часов назад • Преследование средней школы , встретили ожидаемый рост , Директор Джейсон Берд • Резерфордтон Начальная школа Школа , Ожидаемый рост, Директор Джо Чейз Средняя школа Бета-клуб.Эмма Алкорн, , Северная Каролина, , государственный секретарь. RS Central High School Beta Club. Clay Burch, 11 класс, математика, 1 место (штат) в средней школе Chase
7 часов назад Резерфордтон , Северная Каролина , США 39 подключений.Присоединяйтесь к Connect Principal — В настоящее время в Chase Middle School в Rutherford County Schools Appalachian State University
Должность: Princpal в Rutherford County …
Местоположение: Rutherfordton, North Carolina, United States 39
Предварительный просмотр / Показать еще
см. Также : Hot Courses 47 подержанные Подробнее
Общественные средние школы в городе Rutherfordton, NC Niche
9 часов назад 2021 Школа рейтинга, тест баллы и статистика для государственных средних школ в Резерфордтон Городок.Сравните государственных средних школ рядом с вами.
Предварительный просмотр / Показать еще
См. Также : Горячие Курсы 99 Подробнее 950 99
Средние школы Yahoo Местный поиск Результаты поиска
(828) 286-39004 часа назад Средние школы недалеко от Форест-Сити, Северная Каролина, 28043. Средняя школа Чейза . Начальная Школа , Средняя школа . 840 Chase High Rd, Forest City, 299 Deter St, Rutherfordton , Северная Каролина · (828) 286-3900.Полк Центральная Школа . Начальная Школа , Средняя школа . 2141 Highway 9 S, Милл Спринг, Северная Каролина · (828) 894-8233.
Предварительный просмотр / Показать еще
см. Также : Горячие Курсы 74 Используется Подробнее
RS Central High School Home Facebook
5 часов назад RS Central High School , Rutherfordton , Rutherfordton , Rutherfordton , Rutherfordton , Rutherfordton , Северная Каролина . 3 574 лайков · 1 об этом говорил · 1 702 были здесь.Центральная средняя школа RS (RSCHS) — это государственная средняя школа , расположенная по адресу Rutherfordton , Северная Каролина. Это
Предварительный просмотр / Показать еще
См. Также : Горячие Курсы 75 Используются Подробнее 950 950 Подробнее
Chase Harris RS Central HS, Rutherfordton, NC MaxPreps
Просто проверить Chase Harris ‘Hare школа спортивная хронология, включая обновления игр во время игры в бейсбол и футбол в RS Central High School с 2016 по 2018 год.RS Central High School Rutherfordton NC. Это я Следуй. 5’10» 200 фунтов Старший. ( Резерфордтон , Северная Каролина) университетская бейсбольная команда проиграла в среду домашнюю игру плей-офф против Ледфорда
Тип фильтра: Все время Последние 24 часа Прошлая неделя Прошлый месяц


