Рн крови: Нарушения кислотного равновесия крови
Нарушения кислотного равновесия крови
Кислотно-щелочное равновесие является важным параметром, который поддерживается в крови человека в определенных пределах. Это необходимо для нормального функционирования различных систем организма, протекания биохимических реакций, оптимального функционирования ферментов.
Кислотами называются вещества, которые могут отдавать ионы водорода, а основаниями (щелочами) вещества, присоединяющие данные ионы. Кислотность и щелочность растворов оценивается по шкале рН от 0 (растворы сильных кислот) до 14 (растворы сильных щелочей). По шкале рН нейтральная кислотность равна 7.
Нормальная кислотность крови составляет 7,35 – 7,45 по шкале рН. Смещение данного показателя ниже 7,35 свидетельствует об ацидозе (смещении кислотно-щелочного баланса крови в сторону увеличения кислотности). При отклонении рН выше 7, 45 возникает алкалоз (избыток веществ со свойствами щелочей в крови).
В процессе обмена веществ в организме в больших количествах образуются продукты, которые способны вызывать изменение данного параметра.
Во время дыхания через легкие осуществляется выделение углекислого газа, который образуется в процессе обмена веществ в организме. Углекислый газ при соединении с водой образует углекислоту, поэтому в случае его избытка в крови развивается ацидоз, а при недостаточной концентрации углекислого газа возникает алкалоз.
Почки выводят с мочой из организма избыток кислот и щелочей. При этом данные органы в определенных пределах могут регулировать количество выделяемых и всасываемых обратно кислот и оснований, за счет чего происходит регуляция уровня рН в крови.
Буферными системами крови называют растворы слабых кислот и щелочей, которые соединяясь с избыточными количествами кислот или оснований (в зависимости от наличия ацидоза или алкалоза) осуществляют их нейтрализацию, чем достигается выравнивание уровня рН.
Причиной ацидоза и алкалоза в большинстве случаев является тяжелое течение основного заболевания, при котором возникающие изменения рН крови превышают возможности механизмов регуляции данного параметра.
Синонимы русские
Нарушения кислотно-щелочного равновесия крови, нарушения кислотно-щелочного гомеостаза.
Синонимы английские
Acid-Base Disorders, Acid–base homeostasis.
Симптомы
Проявления ацидоза и алкалоза часто маскируются проявлениями основного заболевания, которое вызвало изменение кислотно-щелочного баланса крови.
При ацидозе могут быть следующие симптомы:
- тошнота, рвота
- учащение частоты дыхания
- головная боль
- нарушение сознания (вплоть до комы)
- падение артериального давления (при тяжелых формах ацидоза)
- нарушения ритма сердца.
Проявления алкалоза могут включать в себя:
- головные боли
- головокружение
- угнетение сознания (вплоть до комы)
- судороги в различных группах мышц
- нарушения сердечного ритма
Общая информация о заболевании
Кислотно-щелочное равновесие в крови является жизненно важным параметром, нормальные значения которого составляют 7,35 – 7,45 по шкале рН.
Отклонение рН ниже 7,35 свидетельствует об ацидозе. При смещении рН выше 7,45 возникает алкалоз.
Респираторный ацидоз развивается в результате накопления в крови большого количества углекислого газа, который соединяясь с водой, образует углекислоту. Это вызывает повышение кислотности крови. Данное состояние может развиваться при нарушениях дыхания, которые вызывают снижение легочной вентиляции.
Это может быть следствием заболеваний легких (например, при бронхиальной астме), поражений нервной системы (например, при травмах головного мозга), заболеваниях, мышц и нервов, которые приводят к потере способности совершать эффективные дыхательные движения (например, при боковом амиотрофическом склерозе).
Противоположным состоянием является респираторный алкалоз, который возникает при избыточном выведении легкими углекислого газа из организма. В основе механизма развития данного вида алкалоза лежит увеличение ритма и глубины дыхания.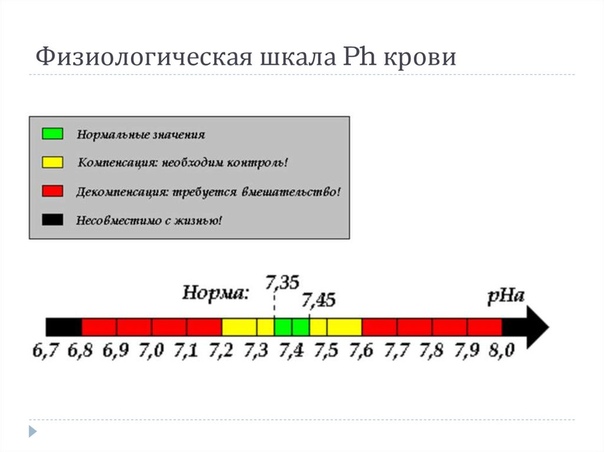
Такое нарушение дыхания может возникать при наличии патологии со стороны различных органов и систем (например, при травмах, опухолях головного мозга, заболеваниях легких, сердечно – сосудистой недостаточности).
Метаболический ацидоз может развиваться по следующим причинам:
- повышение продукции кислот в организме. Повышение продукции кислот в организме может наблюдаться при состояниях, сопровождающихся нарушениями процессов обмена веществ. Например, при сахарном диабете нарушается использование глюкозы клетками по причине недостатка гормона инсулина.
При этом организм начинает вырабатывать энергию не из глюкозы, а из жиров – альтернативный путь получения энергии. Расщепление жиров в печени сопровождается образованием больших количеств кетоновых кислот, что приводит к возникновению ацидоза.
- нарушение функционирования почек. Почки выполняют важную роль в регуляции кислотно-щелочного баланса в крови. При заболеваниях почек, приводящих к нарушению их функций, могут нарушаться процессы выделения кислот и всасывания веществ со щелочной реакцией, что может быть причиной ацидоза.

- потеря больших количеств щелочей с пищеварительными соками. Данное состояние может наблюдаться при выраженной диарее, проведении хирургических вмешательств на кишечнике.
- отравление ядами и токсическими веществами. Процессы расщепления данных веществ в организме могут протекать с образованием большого количества кислот, что может стать причиной ацидоза.
Основными причинами метаболического алкалоза являются следующие:
- потеря больших количеств кислого желудочного содержимого. Может наблюдаться при обильной рвоте, аспирации содержимого желудка с помощью специального зонда.
- применение мочегонных препаратов
- усиленное выведение ионов водорода почками. Такие процессы могут наблюдаться при избытке гормона надпочечников – альдостерона. Альдостерон участвует в регуляции водно-электролитного баланса в организме. Повышение его уровня может быть как при заболеваниях надпочечников, так и при патологии других органов (например, при сердечной недостаточности).

Таким образом, развитие ацидоза или алкалоза часто связано с протеканием патологических процессов, при которых возникающие изменения кислотно-щелочного равновесия превышают компенсационные возможности организма. При этом важную роль в лечении занимает нормализация состояния пациента по основному заболеванию, вызвавшему отклонение рН крови.
Кто в группе риска?
К группе риска развития нарушений кислотно-щелочного баланса крови относятся:
- лица, страдающие заболеваниями легких (например, бронхиальной астмой)
- лица, имеющие заболевания почек с нарушением их функции
- лица, страдающие сахарным диабетом
- лица, имеющие поражения нервной системы (например, травмы головного мозга, инсульты)
- лица, перенесшие большие потери содержимого желудочно – кишечного тракта (например, при обильной рвоте, частом жидком стуле)
- лица, принимающие некоторые препараты (например, мочегонные, аспирин)
- лица, злоупотребляющие алкоголем.

Диагностика
Важную роль в диагностике имеют лабораторные методы исследования, которые позволяют установить уровень рН крови, ее газовый состав, параметры водно-электролитного обмена и другие жизненно важные показатели, мониторинг и коррекция которых необходимы при данных состояниях.
Лабораторные исследования:
- Определение рН крови, газового состава крови. Определение данных параметров может быть проведено с помощью специальных аппаратов – газоанализаторов. Материалом для исследования служит артериальная кровь.
- Общий анализ крови. Данный анализ позволяет оценить основные характеристики состава крови: количество эритроцитов, гемоглобина, лейкоцитов, тромбоцитов. Данное исследование неспецифично для диагностики ацидоза или алкалоза, но является необходимым для выявления причин изменений рН крови.
- Общий анализ мочи с микроскопией. Данный анализ показывает основные физико-химические свойства мочи, уровень ее рН, наличие патологических и физиологических продуктов обмена веществ.

- Глюкоза в плазме крови. Глюкоза является основным источником энергии в организме человека. Повышение уровня глюкозы в крови наблюдается при сахарном диабете. Нарушения обмена веществ, возникающие при этом заболевании, могут приводить развитию ацидоза.
- Калий, натрий, хлор в сыворотке. Калий, натрий, хлор являются основными электролитами в организме человека, которые выполняют множество функций. Среди них участие в транспорте веществ внутрь клетки и выведение из нее продуктов обмена, поддержание водного и кислотно-щелочного баланса в организме.
- Аланинаминотрансфераза (АЛТ). Аланинаминотрансфераза фермент, находящийся во многих клетках организма Большая часть его сосредоточена в печени. При поражении печени уровень данного фермента в крови возрастает. Нарушение функционирования печени может приводить к изменениям кислотно-щелочного баланса в крови.
- Креатинин и мочевина в сыворотке крови. Креатинин и мочевина являются конечными продуктами белкового обмена в организме человека.
 Они выводятся из организма почками. При нарушении функционирования почек может наблюдаться повышение данных показателей. Поражение почек может приводить к изменениям кислотно-щелочного баланса в организме.
Они выводятся из организма почками. При нарушении функционирования почек может наблюдаться повышение данных показателей. Поражение почек может приводить к изменениям кислотно-щелочного баланса в организме.
В зависимости от конкретной клинической ситуации может потребоваться проведение других лабораторных анализов для выявления причин ацидоза или алкалоза (например, определение уровня кетоновых тел в крови и в моче, концентрации лактата в крови и других).
Исследования:
- Рентгенография. С помощью рентгенографии органов грудной клетки можно выявить патологические изменения в легких (например, воспаление легких), вследствие которых возникли изменения ритма и глубины дыхания.
- Ультразвуковое исследование (УЗИ). Метод основан на свойствах ультразвука. С помощью УЗИ можно визуализировать внутренние органы, выявить изменения в их структуре наличие объемных образований (например, кист, опухолей), что может быть необходимо для установления причин нарушений кислотно-щелочного баланса в крови.

- Компьютерная томография (КТ). Метод позволяет получить послойные
высокоинформативные изображения внутренних органов. Это имеет большое значение для выявления заболевания, ставшего причиной возникновения ацидоза или алкалоза (например, нарушение дыхания, возникшие вследствие кровоизлияния в мозг).
Лечение
Лечение расстройств кислотно-щелочного баланса в крови направлено на терапию основного заболевания, которое привело к развитию ацидоза или алкалоза. Для нормализации уровня рН может проводиться внутривенное введение растворов, нейтрализующих кислоты (при ацидозе) или щелочи (при алкалозе).
Лечение респираторного ацидоза направлено на восстановление ритма и глубины дыхания с возможным переводом пациента на искусственную вентиляцию легких (дыхание с помощью специального аппарата в случаях неэффективности деятельности легких).
При респираторном алкалозе может быть использовано вдыхание воздушных смесей, содержащих углекислый газ.
Профилактика
Специфической профилактики изменений кислотно-щелочного баланса в крови не существует. Пациентам, страдающим заболеваниями, которые могут вызывать изменение рН крови (например, сахарным диабетом) следует строго соблюдать рекомендации лечащего врача, регулярно проходить обследования и лечение.
Рекомендуемые анализы
- Определение рН крови
- Определение газового состава крови
- Общий анализ крови
- Общий анализ мочи с микроскопией
- Глюкоза в плазме крови
- Калий, натрий, хлор в сыворотке
- Аланинаминотрансфераза (АЛТ)
- Креатинин в сыворотке
- Мочевина в сыворотке
Анализ крови на уровень pH ᐈ сдать анализ на уровень pH в крови
Описание анализа:
pH крови – показатель, демонстрирующий соотношение кислот (могут отдавать ионы водорода) и щелочей (могут присоединять данные ионы) в крови. Нейтральной кислотности соответствует показатель 7, но в человеческой крови наблюдается небольшое смещение кислотно-щелочного баланса в сторону щелочей – это создает подходящие условия для работы ферментов и биохимических процессов.
Нейтральной кислотности соответствует показатель 7, но в человеческой крови наблюдается небольшое смещение кислотно-щелочного баланса в сторону щелочей – это создает подходящие условия для работы ферментов и биохимических процессов.
Показания к назначению анализа pH крови
На кислотно-щелочной баланс крови может влиять множество заболеваний: эндокринных, неврологических, онкологических, сердечно-сосудистых, нефрологических и других. В разных случаях анализ назначается соответствующим врачом узкой специализации.
В эндокринологии показанием может быть:
- сахарный диабет;
- гиперфункция надпочечников.
В неврологии показанием могут служить:
- повреждения головного мозга;
- боковой амиотрофический склероз.
Онкологом анализ может назначаться, в том случае, если подозреваются опухоли головного мозга.
Кардиологом – при симптомах сердечно-сосудистой недостаточности, нефрологом – при проявлениях почечной недостаточности, гастроэнтерологом – при тошноте, рвоте и диарее. Пульмонологом замер pH крови назначается при бронхиальной астме и заболеваниях легких.
Пульмонологом замер pH крови назначается при бронхиальной астме и заболеваниях легких.
Норма pH крови
Как уже говорилось, кислотно-щелочной баланс человеческой крови незначительно сдвинут в сторону щелочей. Если нейтральным pH является показатель 7, то референтным значением для человеческой крови является 7,35-7,45. Если уровень ниже – развивается ацидоз, выше – алкалоз. Показатели ниже 6,8 и выше 8,0 являются несовместимыми с жизнью.
Повышенный или пониженный pH крови: причины
Как ацидоз, так и алкалоз могут быть двух видов: респираторным и метаболическим.
Респираторный алкалоз возникает, когда легкие выводят из организма слишком много углекислого газа, ацидоз – наоборот, когда большое количество углекислого газа остается в крови.
Метаболический алкалоз возникает вследствие приема мочегонных, гиперфункции надпочечников, а также при рвоте. Метаболический ацидоз вызывает почечная недостаточность, диарея, отравления и усиленное образование кислот в организме (например, при сахарном диабете).
Подготовка к обследованию
Обследование не требует специальной подготовки.
Метод исследования: ион-селективный.
Материал исследования: кровь.
Срок готовности результатов: 1 рабочий день.
pH норма, кислотно-щелочной баланс организма человека
Соотношение кислоты и щелочи в организме называется кислотно-щелочным равновесием (балансом), чтобы измерить это соотношение существует показатель «сила водорода», знакомый всем под названием pH. Измеряется уровень pH с помощью индикаторных полосок или pH метра.
Определение нормального, то есть нейтрального уровня жидкости возможно, если окунуть полоску или электрод pH метра в нее. Важно знать о том, нарушен ли кислотно-щелочной баланс, так как он влияет на состояние организма напрямую. pH норма воды по показателям – 7,0. Если показатель ниже, значит в растворе кислотность повышена¸ если показатель выше – понижена. Для человека очень важно, чтобы соблюдалась ph норма. Для каждой жидкости в организме предусмотрена своя пш норма, в зависимости от среды. pH организма человека зависит от соотношения положительно и отрицательно заряженных ионов.
Для человека очень важно, чтобы соблюдалась ph норма. Для каждой жидкости в организме предусмотрена своя пш норма, в зависимости от среды. pH организма человека зависит от соотношения положительно и отрицательно заряженных ионов.
pH организма человека регулируется таким образом, чтобы усвоение полезных веществ происходило согласно норме, при неправильном кислотно-щелочном балансе минералы и другие питательные вещества могут не усваиваться, это приводит к проблемам со здоровьем, разрушению клеток и, как следствие, болезни или гибели. Следить за уровнем пш важно, измерять можно pH слюны, pH мочи, pH крови.
Предлагаем купить pH метр в Санкт-Петербурге. Оформление заказа — онлайн на сайте или по телефонам в разделе «Контакты». Возможна курьерская доставка до адреса и самовывоз.
pH мочи норма
Уровень пш мочи покажет, насколько организм усваивает минералы, которые регулируют кислотность. Если ее уровень слишком высок, то идет заимствование кальция, натрия, калия и магния из собственных ресурсов – костей и других органов. Так мы самостоятельно восстанавливаем баланс. При нормальном классическом питании pH мочи составляет 6,0. Если в рационе присутствует много мяса, то пш мочи может быть ниже – 5, 0. Если брать общие показатели и разное питание, то у здорового человека пш мочи норма: 4,5-8,0 (максимальное отклонение). Если показатель отличается от нормы, могут возникать серьезные проблемы со здоровьем, при пониженном pH – ацидоз, при завышенном – алкалоз.
Так мы самостоятельно восстанавливаем баланс. При нормальном классическом питании pH мочи составляет 6,0. Если в рационе присутствует много мяса, то пш мочи может быть ниже – 5, 0. Если брать общие показатели и разное питание, то у здорового человека пш мочи норма: 4,5-8,0 (максимальное отклонение). Если показатель отличается от нормы, могут возникать серьезные проблемы со здоровьем, при пониженном pH – ацидоз, при завышенном – алкалоз.
pH слюны норма
pH слюны в норме находится при показателях от 5,6 до 7,9. Также показания могут зависеть от слюноотделения. Рекомендуется измерять pH слюны человека в утреннее время натощак, те соки, которые выделяет организм, в том числе желудок, влияют на болезни полости рта. При низком уровне пш слюны происходит окисление эмали, что приводит к кариесу. Поэтому и рекомендуется полоскание рта с содой, понижающей кислотность. Также рекомендуется полоскать рот щелочной водой, которую можно получить с помощью активаторов воды.
pH крови норма
Анализ pH крови показывает кислотно-щелочное равновесие, которое колеблется с небольшой вариацией. Отклонение от нормальных показателей может привести к серьезным заболеваниям. pH норма крови 7,25 – 7,44. Если pH крови человека сдвигается даже на десятые доли, это может привести к смерти, например при сдвиге на 0,3 человек уже может погибнуть.
Отклонение от нормальных показателей может привести к серьезным заболеваниям. pH норма крови 7,25 – 7,44. Если pH крови человека сдвигается даже на десятые доли, это может привести к смерти, например при сдвиге на 0,3 человек уже может погибнуть.
Наш организм нормализует усваивание кислых и щелочных продуктов, на нейтрализацию кислых продуктов уходит гораздо больше ресурсов. Кровь, имеющая нормальный уровень пш, способна бороться с опухолями, уничтожая пораженные клетки, при нарушении баланса, если низкий ph крови человека, снижается иммунитет, а, следовательно, организм хуже борется с заболеваниями. Чтобы восстановить ph крови, рекомендуется употреблять продукты, повышающие щелочность крови, лимфоциты будут работать в полную силу, уничтожая поврежденные клетки. Низкий ph крови – большая опасность для человека, проверяйте пш крови, чтобы избежать серьезных осложнений.
Нормализовать ph организма человека можно, изготавливая в домашних условиях щелочную и кислотную воду.
pH воды можно определять, пользуясь прибором ph метр, активаторы воды создают щелочную и кислотную воду, такие приборы помогут Вам нормализовать уровень ph в организме, снизить риск различных заболеваний, в том числе и рака. Ph воды норма — это дистиллированная вода с показателем 7,0. Такую воду рекомендуют для питья при нормальном кислотно-щелочном балансе.
Следить за своим здоровьем необходимо, с помощью знаний о пш показателях Вы сможете себя обезопасить и нормализовать кислотно-щелочной баланс самостоятельно.
pH метр крови — AQUA-LAB
Как известно, нейтральная водная среда обладает кислотно-щелочным показателем рН, равном 7. Если этот показатель стремится вверх, то среда характеризуется как излишне щелочная, а вниз – запредельно кислая. Жидкости человеческого организма также не составляют исключение: для функционирования в пределах нормы необходимо, чтобы их кислотно-щелочной баланс оставался неизменным.
Яркий пример жидкой среды в организме – кровь человека, нормальный показатель рН которой должен находиться в весьма тесных границах – 7,35-7,45, а средний рН фактор плазмы артериальной крови, в свою очередь, составляет величину 7,4 рН. Даже малейшие сдвиги в ту или иную сторону могут спровоцировать серьёзные заболевания и патологии и даже привести к летальному исходу. Смещение в сторону повышенной кислотности порождает в организме человека состояние, называемое ацидозом, а в сторону защелачивания – алкалозом.
Даже малейшие сдвиги в ту или иную сторону могут спровоцировать серьёзные заболевания и патологии и даже привести к летальному исходу. Смещение в сторону повышенной кислотности порождает в организме человека состояние, называемое ацидозом, а в сторону защелачивания – алкалозом.
Показатели крови ниже 6,8 или же выше 7,8 рН уже считаются несовместимыми с жизнью. Вот почему все процессы в организме подчинены постоянному решению этой серьёзной задачи – поддерживать водородный показатель крови в норме, путём приведения всех веществ, поступающих в кровь, в строгое соответствие с существующим уровнем рН.
Нормальная кровь не только говорит об общем здоровье человека, но и способна приводить в активное состояние лимфатические клетки организма, которые могут уничтожать злокачественные клетки. В этом и состоит основная функция иммунитета.
Контроль показателей кислотности с помощью рН метра крови
рН метр крови – особый прибор в линейке измерительного оборудования, предназначенного для контроля рН фактора различных сред. Как правило, он относится к портативному типу измерителей, поскольку мониторинг рН может осуществляться не только в специально оборудованных медицинских лабораториях, но и порой в полевых условиях, а на выезде, как известно, именно вес и размеры играют немалую роль в обеспечении оперативности и удобства измерений. Как правило, миниатюрный рН метр для крови имеет наконечник, выступающий в качестве измерительного датчика, поэтому справиться с тестированием достаточно легко.
Как правило, он относится к портативному типу измерителей, поскольку мониторинг рН может осуществляться не только в специально оборудованных медицинских лабораториях, но и порой в полевых условиях, а на выезде, как известно, именно вес и размеры играют немалую роль в обеспечении оперативности и удобства измерений. Как правило, миниатюрный рН метр для крови имеет наконечник, выступающий в качестве измерительного датчика, поэтому справиться с тестированием достаточно легко.
В отличие от лакмусовых бумажек, предназначенных для определения кислотности индикаторным методом, рН метр крови обладает наибольшей точностью, так что, благодаря им значительно упрощается как постановка диагнозов, так и последующее лечение.
Что такое pH. Влияние показателя pH на здоровье человека
Химическая реакция:
рН = 1 / log [H +] = -Iog [H +]
рН 6 в десять раз более кислотный, чем рН 7, рН 5 в сто раз более кислотный, чем рН 7.
Шкала рН колеблется от кислотного рН 0 до щелочного рН 14. Нейтральный показатель рН 7.
Нейтральный показатель рН 7.
При рН 7, показатели воды имеют одинаковую концентрацию ионов Н+ и ОН-.
Растворы с рН менее 7 являются кислыми , потому что они содержат более высокую концентрацию ионов H +.
Вещества с рН выше 7, щелочные поскольку они содержат более высокую концентрацию ОН-, чем Н+.
Шкала рН -логарифмическая шкала, построенная таким образом, что изменение одной единицы рН означает десятикратное изменение концентрации ионов водорода.
Чистая вода без примесей имеет рН около 7; кислые водные растворы имеют pH менее 7 , щелочные- pH более pH7.
Раствор сильной кислоты, такой как соляная имеет рН 0.
Раствор сильной щелочи, такой как гидроксид натрия имеет рН 14.
Таким образом, измерение значений рН измеряется в основном в диапазоне от 0 до 14.
Ацидоз и причины его возникновения.
Наиболее распространенным расстройством кислотно-щелочного баланса является ацидоз, что означает кислотную перегрузку в организме и определяется падением рН ниже 7,35.
Ткани живого организма весьма чувствительны к колебаниям показателя pH — за пределами допустимого диапазона (7,37—7,44), происходит денатурация белков: разрушаются клетки, ферменты теряют способность выполнять свои функции, возможна гибель организма.
Поэтому кислотно-щелочной баланс в организме жёстко регулируется. Существует несколько буферных систем, которые связывают ионы водорода и препятствуют каким-либо изменениям показателя рН. Бикарбонатная буферная система имеет особо важное значение: избыток протонов (H+, ионов водорода) взаимодействует с ионами бикарбоната (HCO3−) с образованием угольной кислоты (h3CO3). В дальнейшем уменьшение количества угольной кислоты происходит в результате ускоренного выделения углекислого газа (CO2) в результате гипервентиляции лёгких (концентрация определяется давлением в альвеолярной газовой смеси)
Уровень pH человеческого организма
Зубной налет может сформировать кислую среду, что может привести к деминерализации и разрушению эмали зубов.
Ферменты и другие белки имеют оптимальные показатели рН и могут стать инактивированными или денатурированными за пределами этого диапазона. Вся внутренняя ткань организма (за исключением ядра клетки) имеет рН около 6,8.
Плазма крови и другие жидкости, которые окружают клетки в организме имеют рН 7,3 до 7,45. РН крови 6,9 и ниже может вызвать очень серьезные последствия для здоровья организма.
Плохое питание, нездоровый образ жизни и стресс ухудшают наше пищеварение, вымывает из костей кальций мешает поджелудочной железе поддерживать нужное количество водного щелочной раствора для балансирования уровня кислоты в организме.
pH норма. pH организма человека
По утверждениям исследователя, биохимика и микробиолога Михаила Николаевича Захваткина, развитие многих болезней в организме зависит от единственной причины. Врачи называют эту причину «Кислота и щелочь», другими словами имеет значение для организма определить кислотность (pH) крови, pH мочи, pH слюны. Конечно, если в организме кислотность высокая, то большинство наиболее важных систем выходит из строя, и уйти от развития болезней становится с каждым днем все более сложнее. Поддерживать pH норму среды в организме не так сложно, как кажется, на первый взгляд. Благодаря балансу pH среды организм способен бороться с заболеваниями, нормальный метаболизм организма сохраняется только при pH норме внутренней среды, способствуя правильному протеканию процессов.
Первым делом, необходимо проверить кислотно-щелочной баланс, чтобы выявить pH слюны или мочи, можно воспользоваться тест-полосками. При желании Вы можете купить тест-полоски pH в нашем интернет-магазине, оставив заявку на сайте.
Очень важно своевременно определить и принять меры по изменению pH организма человека. Человеческий организм старается максимально уравновесить соотношение, уровень pH. Если баланс этого уровня нарушен, то стоит срочно обратиться к врачу для своевременной борьбы с возникающими болезнями.
Поддерживать pH норму среды в организме не так сложно, как кажется, на первый взгляд. Благодаря балансу pH среды организм способен бороться с заболеваниями, нормальный метаболизм организма сохраняется только при pH норме внутренней среды, способствуя правильному протеканию процессов.
Первым делом, необходимо проверить кислотно-щелочной баланс, чтобы выявить pH слюны или мочи, можно воспользоваться тест-полосками. При желании Вы можете купить тест-полоски pH в нашем интернет-магазине, оставив заявку на сайте.
Очень важно своевременно определить и принять меры по изменению pH организма человека. Человеческий организм старается максимально уравновесить соотношение, уровень pH. Если баланс этого уровня нарушен, то стоит срочно обратиться к врачу для своевременной борьбы с возникающими болезнями.
Каким образом происходит определение pH нормы
Вода содержит некоторое количество водород-ионов Н+ и гидроксил-ионов OH-. Кислотность в воде определяет количество ионов водорода, а щелочь определяют гидроксил-ионы. Кислотная особенность жидкости определяется наличием большого количества водород-ионов, а щелочная жидкость с преобладанием гидроксил-ионов. В лабораториях применяют водородный показатель для определения кислотности раствора. Водородный показатель равен отрицательному десятичному логарифму активности водородных ионов, то есть pH. Он определяется значением от 0 до 14 в профессиональных лабораторных условиях. Мы предлагаем вам купить и воспользоваться индикаторными тест-полосками pH для определения кислотности слюны, мочи, жидкости в домашних условиях, со значением от 0 до 12. Имеется специальная шкала сравнения с определением цвета от вишнево-бордовой до темно-синей окраски. Если значение меньше 7, то раствор жидкости кислый, а если больше, то раствор щелочной.
Кислотная особенность жидкости определяется наличием большого количества водород-ионов, а щелочная жидкость с преобладанием гидроксил-ионов. В лабораториях применяют водородный показатель для определения кислотности раствора. Водородный показатель равен отрицательному десятичному логарифму активности водородных ионов, то есть pH. Он определяется значением от 0 до 14 в профессиональных лабораторных условиях. Мы предлагаем вам купить и воспользоваться индикаторными тест-полосками pH для определения кислотности слюны, мочи, жидкости в домашних условиях, со значением от 0 до 12. Имеется специальная шкала сравнения с определением цвета от вишнево-бордовой до темно-синей окраски. Если значение меньше 7, то раствор жидкости кислый, а если больше, то раствор щелочной.
Уровень pH мочи
Показатели ПШ мочи должны быть в пределах от 6,0 до 6,4 в утреннее время, а в вечернее время — от 6,4 до 7,0. Таким образом, если Ваши показатели совпали с нормами pH мочи, это означает, что Ваш организм в норме. pH мочи свидетельствует о том, насколько правильно организм усваивает полезные минералы, такие, как магний, калий, кальций, натрий. При постоянном повышенном уровне кислотности кости становятся ломкими. Чтобы изменить ситуацию, необходимо сбалансировать питание, подобрать индивидуальную диету.
pH мочи свидетельствует о том, насколько правильно организм усваивает полезные минералы, такие, как магний, калий, кальций, натрий. При постоянном повышенном уровне кислотности кости становятся ломкими. Чтобы изменить ситуацию, необходимо сбалансировать питание, подобрать индивидуальную диету.
Уровень pH слюны
Показатели ПШ слюны должны быть в пределах от 6,4 до 6,8 в течение всего дня. Таким образом, если Ваши показатели совпали с нормами pH-слюны, это означает, что Ваш организм здоров. Тест показывает активность ферментов пищеварительного тракта, печени и желудка. При отклонениях от нормы необходимо срочно обратиться к врачу. Самые лучшие показатели pH слюны и мочи должны быть в пределах от 6,4 до 6,5. Необходимо также правильно проводить измерение: за один час до еды или после еды через два часа. Не рекомендуется проверять чаще двух раз в неделю и трех раз в день изменение pH организма человека.
Уровень pH крови
Анализ pH крови крови должен дать значение в пределах от 7,36 до 7,42. Если имеется несоответствие на 0,1, то это может подвергнуть организм серьезной паталогии, а при несоответствии на 0,3 человек погибает. Определить уровень ПШ крови могут только в лабораторных кабинетах.
Для того, чтобы избежать развития и проявления многих болезней необходимо правильно питаться, употреблять «живую» или «мертвую» воду для равновесия баланса pH в организме. В нашем интернет-магазине Вы можете купить активатор воды для обретения здоровья и долгих лет жизни.
Если имеется несоответствие на 0,1, то это может подвергнуть организм серьезной паталогии, а при несоответствии на 0,3 человек погибает. Определить уровень ПШ крови могут только в лабораторных кабинетах.
Для того, чтобы избежать развития и проявления многих болезней необходимо правильно питаться, употреблять «живую» или «мертвую» воду для равновесия баланса pH в организме. В нашем интернет-магазине Вы можете купить активатор воды для обретения здоровья и долгих лет жизни.
Что означает показатель водородный показатель кислотности pН и как выбрать мыло с «правильным» pН
Водородный показатель pH — важная характеристика косметической продукции, в том числе и мыла. Рассказываем, что это за показатель и как он влияет на выбор мыла для различных типов кожи.
Что такое pH
Водородный показатель, pH (на латыни potentia Hydrogenii — сила водорода, или pondus Hydrogenii — вес водорода, произносится «пэ аш») – величина, характеризующая меру активности ионов водорода в растворе, количественно показывающая его кислотность. Это понятие было введено более ста лет назад, в 1908 году, датским химиком С. П. Сёренсеном.
Это понятие было введено более ста лет назад, в 1908 году, датским химиком С. П. Сёренсеном.
Если проще, то рН показывает, насколько кислым или щелочным является раствор вещества. Обычно pH изменяется в интервале от 0 до 14 (хотя при некоторых концентрациях может и выходить за эти пределы). Значение 7 — нейтральная реакция — соответствует чистой дистиллированной воде. Если рН менее 7 — это кислая реакция, если более 7 — то реакция щелочная.
Как измерить pH
Измерить рН можно с помощью индикаторных полосок, которые изменяют свой цвет в зависимости от реакции среды, или с помощью специального прибора — рН-метра (на фото выше).
Для живых организмов этот показатель очень важен, так как многие биохимические процессы могут идти только при определенных значениях рН. Например, в норме рН артериальной крови человека 7,36–7,44 единиц и изменение его даже на несколько десятых говорит о серьезных нарушениях здоровья, требующих медицинского вмешательства. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Какой показатель pH считается нормальным
Показатель рН кожи индивидуален для каждого человека, при этом рН колеблется даже для разных участков тела одного человека. В среднем рН кожи человека составляет 5,5, то есть кожа имеет слабокислую реакцию. Причем надо понимать, что рН кожи человека определяется для тончайшей пленки на верхнем ороговевшем слое эпидермиса, образуемой выделениями потовых и сальных желез кожи. Ее также называют кислотной мантией кожи. Кислую реакцию поверхности кожи формируют в основном органические кислоты — молочная, лимонная, уксусная.
Кожа — это самый большой орган человека, одной из важнейших функций которого является защита организма от неблагоприятных воздействий окружающей среды. Кислотная мантия — это надежный барьер на пути многих микроорганизмов, которые не могут существовать в кислой среде.
Кислотно-щелочной баланс зависит также от типа кожи. Так сухая кожа имеет более кислую реакцию от 3 до 5,2, а жирному типу кожи свойственен pH 5,7-7. У нормального типа кожи рН 5,2-5,7 единиц:
Так сухая кожа имеет более кислую реакцию от 3 до 5,2, а жирному типу кожи свойственен pH 5,7-7. У нормального типа кожи рН 5,2-5,7 единиц:
pH мыла и выбор мыла для разного типа кожи
Кислотность кожи может изменяться под воздействием факторов внешней среды: действие прямого солнечного света, изменение потоотделения, загрязнение, длительное воздействие кислотных или щелочных сред (жесткая вода, моющие средства и др.).
рН обычного твердого мыла от 9 до 11 единиц (слабощелочная реакция), рН жидкого мыла от 6 до 7 единиц (слабокислая реакция, близкая к нейтральной). Любые моющие средства увеличивают рН кожи, т. к. смывают не только загрязнения, но и воздействуют на поверхностный липидно-кислотный слой.
Кроме того, при использовании средств для мытья следует помнить, что, когда на поверхности кожи достаточно много воды (например, во время водной процедуры), органические кислоты, определяющие величину рН кожи, полностью расщепляются и быстро удаляются с ее поверхности. Это сдвигает pH в нейтральную сторону к показателю 7.
Это сдвигает pH в нейтральную сторону к показателю 7.
Даже при умывании только водой, без использования мыла, будет изменяться состояние pH кожи. При первом нанесении воды на одно и то же место рН имеет кислую реакцию, а при втором и третьем, она будет близка к нейтральной.
Восстанавливается рН на поверхности кожи довольно быстро.
Выбирая моющее средство для ухода, необходимо учитывать эти факторы. Поскольку мыло извлекает из поверхностного слоя кожи не только загрязнения, но и жиры, порой чрезмерно ее высушивая, в туалетные мыла добавляют вещества, которые помогают сохранить нормальное содержание жиров и влаги в коже и самое благоприятное для нее значение кислотности.
Людям с сухим типом кожи следует аккуратно пользоваться мылом, и по возможности выбирать мыло с увлажняющими и питательными добавками, например, крем-мыло детское «Мой малыш» или жидкое мыло «Мой малыш».
Для жирного типа кожи можно использовать антибактериальное мыло с маслом чайного дерева «Мой доктор» и «Рецепты чистоты», которое поможет бороться с повышенной активностью микроорганизмов, развивающихся в секрете сальных желез, и предотвратит появление угрей и других кожных высыпаний.
Для людей с чувствительным типом кожи лучше отдать предпочтение мылу с глицерином. Глицерин не только увлажняет и оказывает смягчение, но и защитит от вредных воздействий. В линейке мыла НМЖК это «Глицериновое» мыло с ароматами «Зеленый чай» и «Морской ветер», а также «Глицериновое» мыло в линейке «Рецепты чистоты».
Детерминанты pH крови в норме и при болезни
Crit Care. 2000 г.; 4(1): 6–14.
John A Kellum
1 Медицинский центр Университета Питтсбурга, Питтсбург, Пенсильвания, США.
1 Медицинский центр Университета Питтсбурга, Питтсбург, Пенсильвания, США.
Поступила в редакцию 29 ноября 1999 г .; Принято 30 ноября 1999 г.
Эта статья была процитирована другими статьями в PMC.Abstract
Глубокое понимание кислотно-щелочной физиологии является столь же важным для практики интенсивной терапии, как и понимание физиологии сердца и легких.Реаниматологи тратят большую часть своего времени на решение проблем, связанных с жидкостями, электролитами и рН крови. Недавние успехи в понимании кислотно-щелочной физиологии произошли в результате применения основных физико-химических принципов водных растворов к плазме крови. Этот анализ выявил три независимых переменных, которые регулируют рН в плазме крови. Этими переменными являются диоксид углерода, относительные концентрации электролитов и общие концентрации слабых кислот.Все изменения рН крови в норме и при болезни происходят за счет изменений этих трех переменных. Также обсуждаются клинические последствия этих результатов.
Недавние успехи в понимании кислотно-щелочной физиологии произошли в результате применения основных физико-химических принципов водных растворов к плазме крови. Этот анализ выявил три независимых переменных, которые регулируют рН в плазме крови. Этими переменными являются диоксид углерода, относительные концентрации электролитов и общие концентрации слабых кислот.Все изменения рН крови в норме и при болезни происходят за счет изменений этих трех переменных. Также обсуждаются клинические последствия этих результатов.
Ключевые слова: Кислотно-щелочной баланс, ацидоз, алкалоз, анионный разрыв, газы артериальной крови, разность сильных ионов, сильный ионный разрыв , область тела (например, кардиоторакальная хирургия) или болезненный процесс (например, инфекционное заболевание), практикующие врачи интенсивной терапии чаще озабочены взаимодействием различных органов и патологическими состояниями.Таким образом, наша практика часто определяется определенными синдромами (сепсис, полиорганная недостаточность) и патофизиологическими состояниями (шок), которые не ограничиваются областями одной узкой области.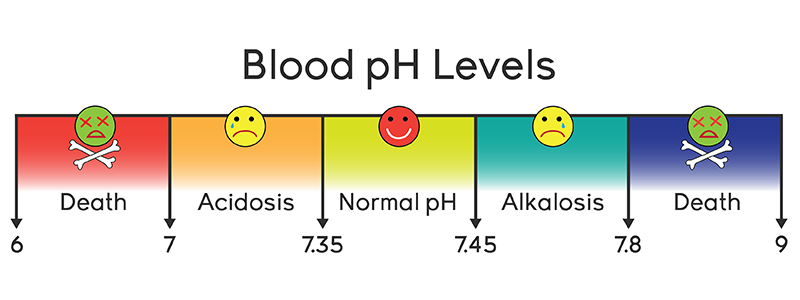 Кислотно-основная регуляция — одна из таких «областей» медицины, которая выходит за рамки специфических для органов, и отделение интенсивной терапии часто является местом, где существуют серьезные нарушения в этой области. По этим причинам ожидается, что реаниматологи и другие лица, призванные ухаживать за тяжелобольными пациентами в отделении интенсивной терапии, операционной или отделении неотложной помощи, будут диагностировать и лечить сложные нарушения кислотно-щелочного баланса.В этом обзоре представлен довольно глубокий анализ химии и физиологии кислотно-щелочного баланса в норме и при патологии.
Кислотно-основная регуляция — одна из таких «областей» медицины, которая выходит за рамки специфических для органов, и отделение интенсивной терапии часто является местом, где существуют серьезные нарушения в этой области. По этим причинам ожидается, что реаниматологи и другие лица, призванные ухаживать за тяжелобольными пациентами в отделении интенсивной терапии, операционной или отделении неотложной помощи, будут диагностировать и лечить сложные нарушения кислотно-щелочного баланса.В этом обзоре представлен довольно глубокий анализ химии и физиологии кислотно-щелочного баланса в норме и при патологии.
Концентрация H + в плазме крови и различных других растворах организма является одной из наиболее жестко регулируемых переменных в физиологии человека. (Большинство принципов, обсуждаемых в этом обзоре, применимы и к физиологии животных. Однако полное обсуждение различий между видами, особенно между водными и наземными видами, выходит за рамки настоящего обзора.) Резкие изменения рН крови вызывают мощные регуляторные эффекты на уровне клетки, органа и организма [1]. Однако механизмы, ответственные за локальный, региональный и системный кислотно-щелочной баланс, изучены не полностью, и в литературе существуют разногласия относительно того, какие методы следует использовать для понимания этих механизмов [2]. Большая часть этих противоречий существует только потому, что строгие правила причинно-следственной связи (в отличие от корреляции) не часто применялись к пониманию кислотно-щелочного баланса, а клинически полезные методы часто использовались для понимания физиологии без надлежащего изучения. научная строгость.Использование различных лабораторных показателей для диагностики кислотно-щелочного расстройства аналогично использованию электрокардиограммы для диагностики инфаркта миокарда. Однако ни изменения в электрокардиограмме, ни нарушения электропроводности, отражаемые этими изменениями, никогда не считались причиной инфаркта миокарда. Напротив, предполагается, что изменения концентрации HCO 3 — (бикарбоната) ответственны за метаболический ацидоз или алкалоз.
Однако механизмы, ответственные за локальный, региональный и системный кислотно-щелочной баланс, изучены не полностью, и в литературе существуют разногласия относительно того, какие методы следует использовать для понимания этих механизмов [2]. Большая часть этих противоречий существует только потому, что строгие правила причинно-следственной связи (в отличие от корреляции) не часто применялись к пониманию кислотно-щелочного баланса, а клинически полезные методы часто использовались для понимания физиологии без надлежащего изучения. научная строгость.Использование различных лабораторных показателей для диагностики кислотно-щелочного расстройства аналогично использованию электрокардиограммы для диагностики инфаркта миокарда. Однако ни изменения в электрокардиограмме, ни нарушения электропроводности, отражаемые этими изменениями, никогда не считались причиной инфаркта миокарда. Напротив, предполагается, что изменения концентрации HCO 3 — (бикарбоната) ответственны за метаболический ацидоз или алкалоз. Неспособность установить причинно-следственную связь привела к многочисленным неверным представлениям о кислотно-щелочной физиологии и вызвала многолетние, часто жаркие споры [2,3,4]. В этом обзоре анализируется то, что известно о причинно-следственных связях между кислотно-щелочными переменными и кислотно-щелочным балансом в норме и при болезни.
Неспособность установить причинно-следственную связь привела к многочисленным неверным представлениям о кислотно-щелочной физиологии и вызвала многолетние, часто жаркие споры [2,3,4]. В этом обзоре анализируется то, что известно о причинно-следственных связях между кислотно-щелочными переменными и кислотно-щелочным балансом в норме и при болезни.
Количественная оценка, классификация и причинно-следственная связь
Чтобы понять кислотно-щелочную физиологию, мы должны сначала договориться о том, как ее описывать и измерять. С тех пор, как Серенсен (1868–1939) впервые ввел обозначение рН, мы использовали шкалу рН для количественной оценки кислотно-щелочного баланса. Шкала рН имеет огромное преимущество, поскольку она подходит для колориметрических и электрометрических методов.Существует также некоторое физиологическое значение логарифмической шкалы pH [5]. Однако pH — запутанная переменная. Это нелинейное преобразование концентрации H + – логарифма ее обратной величины. Строго говоря, pH можно рассматривать только как безразмерное представление концентрации H + , и сам по себе он не является концентрацией. Действительно, рН фактически является логарифмической мерой объема, необходимого для содержания 1 моль/л H + . В плазме крови при рН 7.4 этот объем составляет примерно 25 млн литров [6].
Строго говоря, pH можно рассматривать только как безразмерное представление концентрации H + , и сам по себе он не является концентрацией. Действительно, рН фактически является логарифмической мерой объема, необходимого для содержания 1 моль/л H + . В плазме крови при рН 7.4 этот объем составляет примерно 25 млн литров [6].
Независимо от того, как мы выражаем концентрацию H + , прямо или через pH, общепризнано, что изменения концентрации H + в крови происходят в результате изменения летучих [парциального напряжения углекислого газа (pCO 2 )] и нелетучие кислоты (соляная, серная, молочная и др.). Клинически мы называем изменения в летучих кислотах «дыхательными», а изменения в нелетучих кислотах — «метаболическими».Существует три основных метода количественной оценки (описания) кислотно-щелочных нарушений, каждый из которых отличается только оценкой этого последнего, «метаболического» компонента. Эти три метода количественно определяют метаболический компонент либо с использованием HCO 3 — (в контексте pCO 2 ), стандартного избытка оснований (SBE) или разности сильных ионов (SID). Несмотря на то, что в отношении точности и полезности каждого метода по сравнению с другими ведутся серьезные споры, все три метода дают практически идентичные результаты при использовании для количественной оценки кислотно-щелочного состояния данного образца крови [7,8].Единственные различия между этими тремя подходами носят концептуальный характер (т.е. в том, как они подходят к пониманию механизмов) [9,10,11].
Несмотря на то, что в отношении точности и полезности каждого метода по сравнению с другими ведутся серьезные споры, все три метода дают практически идентичные результаты при использовании для количественной оценки кислотно-щелочного состояния данного образца крови [7,8].Единственные различия между этими тремя подходами носят концептуальный характер (т.е. в том, как они подходят к пониманию механизмов) [9,10,11].
Помимо Хендерсона и Хассельбальха
Поскольку Хассельбальх адаптировал уравнение Хендерсона к обозначениям pH Серенсона, мы использовали следующее уравнение, чтобы понять взаимосвязь между дыхательными и метаболическими кислотно-щелочными переменными:
pH = pK × log [HCO 3 /(0,03 × pCO 2 )] (1)
Это уравнение Хендерсона–Хассельбаха, и важно понять, что оно нам говорит.Увеличение pCO 2 приведет к снижению pH и увеличению концентрации HCO 3 — . Таким образом, у пациента с низким рН крови, состояние, известное как ацидемия, будет иметь либо повышенный рСО 2 , либо рСО 2 , который «не повышен».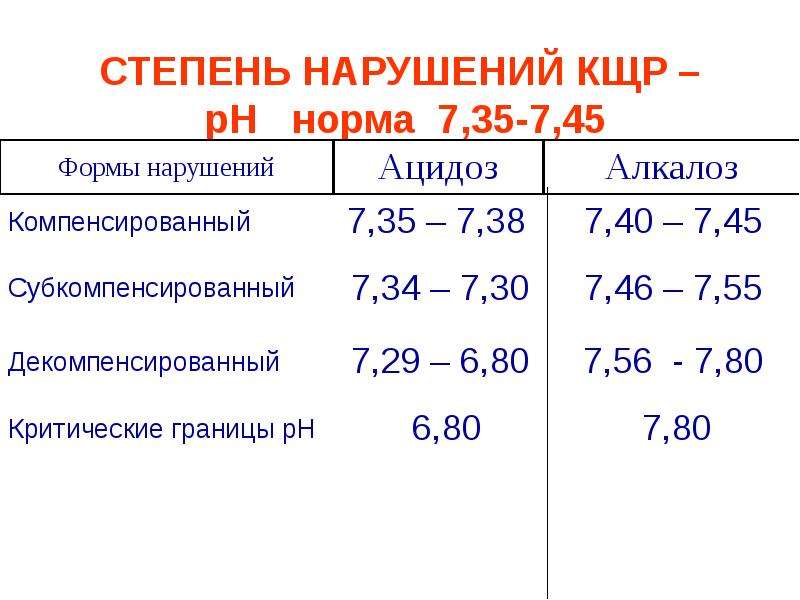 В первом случае мы классифицируем расстройство как «респираторный ацидоз». Мы используем термин «ацидоз» для описания процесса, приводящего к ацидемии, и «респираторный», потому что очевидной причиной является повышенный pCO 2 .Это логично, потому что при добавлении CO 2 в воду (или кровь) образуется угольная кислота, и в результате вполне ожидаемо снижение pH. В последнем случае pCO 2 не повышено, поэтому не может быть респираторного ацидоза. Поэтому мы называем это состояние «метаболическим», поскольку причиной ацидемии должна быть какая-то нелетучая кислота. Мы можем обратить приведенную выше логику вспять и легко классифицировать простые состояния алкалемии как возникающие в результате респираторной или метаболической алкалозы.Таким образом, уравнение 1 позволяет нам классифицировать расстройства в соответствии с первичным типом повышения или понижения кислотности. Со временем физиология накладывает свое влияние на простую химию, и взаимосвязь между pCO 2 и HCO 3 — изменяется, чтобы уменьшить изменения pH.
В первом случае мы классифицируем расстройство как «респираторный ацидоз». Мы используем термин «ацидоз» для описания процесса, приводящего к ацидемии, и «респираторный», потому что очевидной причиной является повышенный pCO 2 .Это логично, потому что при добавлении CO 2 в воду (или кровь) образуется угольная кислота, и в результате вполне ожидаемо снижение pH. В последнем случае pCO 2 не повышено, поэтому не может быть респираторного ацидоза. Поэтому мы называем это состояние «метаболическим», поскольку причиной ацидемии должна быть какая-то нелетучая кислота. Мы можем обратить приведенную выше логику вспять и легко классифицировать простые состояния алкалемии как возникающие в результате респираторной или метаболической алкалозы.Таким образом, уравнение 1 позволяет нам классифицировать расстройства в соответствии с первичным типом повышения или понижения кислотности. Со временем физиология накладывает свое влияние на простую химию, и взаимосвязь между pCO 2 и HCO 3 — изменяется, чтобы уменьшить изменения pH. Однако, внимательно изучив изменения, происходящие в pCO 2 и HCO 3 — по отношению к каждому из них, можно различить высоко консервативные закономерности.Таким образом могут быть установлены правила, позволяющие обнаруживать смешанные расстройства и отделять хронические респираторные расстройства от острых. Например, одним из таких правил является удобная формула для прогнозирования ожидаемого pCO 2 в условиях метаболического ацидоза [12]: (2)
Однако, внимательно изучив изменения, происходящие в pCO 2 и HCO 3 — по отношению к каждому из них, можно различить высоко консервативные закономерности.Таким образом могут быть установлены правила, позволяющие обнаруживать смешанные расстройства и отделять хронические респираторные расстройства от острых. Например, одним из таких правил является удобная формула для прогнозирования ожидаемого pCO 2 в условиях метаболического ацидоза [12]: (2)
Это правило говорит нам, какой pCO 2 должен быть вторичным по отношению к увеличению альвеолярной вентиляции, которое сопровождает метаболический ацидоз.Если pCO 2 изменяется недостаточно или изменяется слишком сильно, мы классифицируем состояние как «смешанное» расстройство с либо респираторным ацидозом, если pCO 2 все еще слишком высокое, либо респираторным алкалозом, если изменение слишком велико. отличный. Это правило вместе с другими (таблица ) недавно было переведено в терминологию SBE [7]: )
 ст.)
ст.) 4 × (PCO 2 — 40)
4 × (PCO 2 — 40)PCO 2 = (40 + SBE) ± 5 (3)
Например, рассмотрим следующий образец газов артериальной крови: pH7.31, pCO 2 31, HCO 3 — 15, SBE-9.5. Уравнение 2 говорит нам, что ожидаемое pCO 2 = (1,5 × 15) + 8 ± 5 = 30,5 ± 5, а в уравнении 3 SBE, добавленное к 40, также дает 30,5.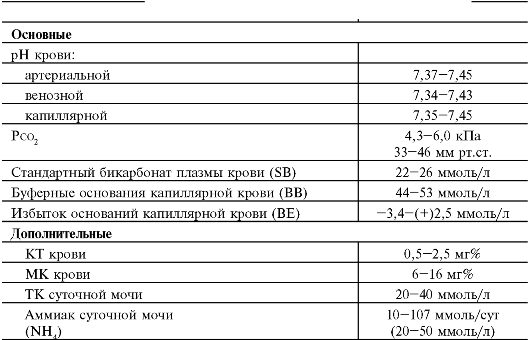 Измеренное значение pCO 2 , равное 31 мм рт. ст., соответствует чистому метаболическому ацидозу (т. е. отсутствие респираторного расстройства).
Измеренное значение pCO 2 , равное 31 мм рт. ст., соответствует чистому метаболическому ацидозу (т. е. отсутствие респираторного расстройства).
Также очень важно понять, чего не говорит нам уравнение Хендерсона-Хассельбаха. Во-первых, он не позволяет выявить тяжесть (количество) метаболического расстройства аналогично дыхательному компоненту.Например, при респираторном ацидозе увеличение pCO 2 количественно определяет расстройство даже при наличии смешанного расстройства. Однако метаболический компонент можно приблизительно оценить только по изменению HCO 3 — . Во-вторых, уравнение 1 не говорит нам ни о каких кислотах, кроме угольной кислоты. Взаимосвязь между CO 2 и HCO 3 — представляет собой полезную клиническую «дорожную карту», которая поможет врачу раскрыть этиологию кислотно-щелочного расстройства, как описано выше.Однако общая концентрация CO 2 и, следовательно, концентрация HCO 3 — определяется pCO 2 , которая, в свою очередь, определяется балансом между альвеолярной вентиляцией и продукцией CO 2 . HCO 3 — не может регулироваться независимо от pCO 2 . Концентрация HCO 3 — в плазме всегда будет увеличиваться по мере увеличения pCO 2 , но это не алкалоз.Чтобы понять, как pH и концентрация HCO 3 — изменяются независимо от pCO 2 , мы должны выйти за рамки Хендерсона и Хассельбаха.
HCO 3 — не может регулироваться независимо от pCO 2 . Концентрация HCO 3 — в плазме всегда будет увеличиваться по мере увеличения pCO 2 , но это не алкалоз.Чтобы понять, как pH и концентрация HCO 3 — изменяются независимо от pCO 2 , мы должны выйти за рамки Хендерсона и Хассельбаха.
Избыток оснований
Для устранения первого «недостатка» уравнения Хендерсона-Хассельбаха – невозможности количественного определения метаболического компонента – было разработано несколько методов. В 1948 г. Сингер и Гастингс предложили термин «буферная основа» для определения суммы HCO 3 — плюс нелетучие слабокислотные буферы (A — ) [13].Изменение буферной базы соответствует изменению метаболического компонента. Методы расчета изменения буферной основы были позже усовершенствованы исследователями [14, 15] и усовершенствованы другими исследователями [16, 17, 18], чтобы получить методологию избытка основания. Избыток оснований — это количество метаболического ацидоза или алкалоза, определяемое как количество кислоты или основания, которое необходимо добавить к образцу цельной крови in vitro , чтобы восстановить pH образца до 7,40 при сохранении pCO 2 держится на уровне 40 мм рт.ст. [15].Хотя этот расчет является достаточно точным in vitro , существует неточность при применении in vivo в том, что избыток основания изменяется с изменением pCO 2 [19,20]. Считается, что этот эффект обусловлен уравновешиванием всего пространства внеклеточной жидкости (цельная кровь + интерстициальная жидкость). Когда уравнение избытка основания модифицируется для учета «среднего» содержания гемоглобина во всем этом пространстве, вместо него используется значение 5 г/дл, и это определяет SBE.Следует отметить, что это значение не отражает истинное содержание гемоглобина, взвешенного в объеме цельной крови вместе с интерстициальной жидкостью, а является скорее эмпирической оценкой, повышающей точность базового избытка.
Избыток оснований — это количество метаболического ацидоза или алкалоза, определяемое как количество кислоты или основания, которое необходимо добавить к образцу цельной крови in vitro , чтобы восстановить pH образца до 7,40 при сохранении pCO 2 держится на уровне 40 мм рт.ст. [15].Хотя этот расчет является достаточно точным in vitro , существует неточность при применении in vivo в том, что избыток основания изменяется с изменением pCO 2 [19,20]. Считается, что этот эффект обусловлен уравновешиванием всего пространства внеклеточной жидкости (цельная кровь + интерстициальная жидкость). Когда уравнение избытка основания модифицируется для учета «среднего» содержания гемоглобина во всем этом пространстве, вместо него используется значение 5 г/дл, и это определяет SBE.Следует отметить, что это значение не отражает истинное содержание гемоглобина, взвешенного в объеме цельной крови вместе с интерстициальной жидкостью, а является скорее эмпирической оценкой, повышающей точность базового избытка. Можно утверждать, что в кислотно-щелочном балансе участвует все внеклеточное жидкостное пространство, так как эта жидкость течет по кровеносным и лимфатическим сосудам, постоянно перемешиваясь [21]. Таким образом, значение SBE заключается в том, что он количественно определяет изменение кислотно-щелочного статуса метаболизма in vivo .Интересно, что избыток оснований является точным in vivo только тогда, когда предполагается постоянная концентрация гемоглобина.
Можно утверждать, что в кислотно-щелочном балансе участвует все внеклеточное жидкостное пространство, так как эта жидкость течет по кровеносным и лимфатическим сосудам, постоянно перемешиваясь [21]. Таким образом, значение SBE заключается в том, что он количественно определяет изменение кислотно-щелочного статуса метаболизма in vivo .Интересно, что избыток оснований является точным in vivo только тогда, когда предполагается постоянная концентрация гемоглобина.
Однако метод избытка оснований не решает второй проблемы, связанной с использованием только уравнения Хендерсона-Хассельбаха (т. е. он по-прежнему не говорит нам о механизмах метаболического кислотно-щелочного баланса). Например, тело не «регулирует» СБЭ. Это вещество не может выводиться с калом или реабсорбироваться из проксимальных канальцев.Точно так же HCO 3 — не является сильной кислотой или основанием, и его добавление или удаление из плазмы не может привести к изменениям SBE. Это не означает, что изменения в SBE и HCO 3 — не коррелируют тесно, потому что они есть. Однако корреляция и причинно-следственная связь — не одно и то же. Различие традиционно приписывают эффекту «буферизации», аргументируя это тем, что сильная кислота (или основание), количественно определяемая SBE, «буферизируется» белками плазмы, гемоглобином и, наконец, HCO 3 — .Результирующие изменения HCO 3 — и pH являются результатом этого буферного процесса. Однако эти буферы на самом деле являются слабыми кислотами, и их добавление к плазме как снижает рН, так и увеличивает чувствительность к pCO 2 (рис. 1). Кроме того, как объяснил Стюарт [6,9], фундаментальные физико-химические свойства биологических растворов во многом определяют так называемую «буферность».
Это не означает, что изменения в SBE и HCO 3 — не коррелируют тесно, потому что они есть. Однако корреляция и причинно-следственная связь — не одно и то же. Различие традиционно приписывают эффекту «буферизации», аргументируя это тем, что сильная кислота (или основание), количественно определяемая SBE, «буферизируется» белками плазмы, гемоглобином и, наконец, HCO 3 — .Результирующие изменения HCO 3 — и pH являются результатом этого буферного процесса. Однако эти буферы на самом деле являются слабыми кислотами, и их добавление к плазме как снижает рН, так и увеличивает чувствительность к pCO 2 (рис. 1). Кроме того, как объяснил Стюарт [6,9], фундаментальные физико-химические свойства биологических растворов во многом определяют так называемую «буферность».
Изменения зависимости между парциальным напряжением диоксида углерода (pCO 2 ) и концентрацией H + в зависимости от изменений «буферной» силы. Отдельные кривые построены для различных концентраций общих нелетучих буферов в ммоль/л. Обратите внимание, что по мере увеличения концентрации «буфера» наклон кривой увеличивается, делая изменения концентрации H + более чувствительными к изменениям концентрации CO 2 .
Отдельные кривые построены для различных концентраций общих нелетучих буферов в ммоль/л. Обратите внимание, что по мере увеличения концентрации «буфера» наклон кривой увеличивается, делая изменения концентрации H + более чувствительными к изменениям концентрации CO 2 .
Физико-химические свойства биологических растворов
Физико-химический анализ кислотно-щелочной физиологии требует применения двух основных принципов. Во-первых, это электронейтральность, согласно которой в водных растворах сумма всех положительно заряженных ионов должна равняться сумме всех отрицательно заряженных ионов.Второй — сохранение массы, что означает, что количество вещества остается постоянным, если оно не добавлено, не образовано, не удалено или не уничтожено. Эти принципы действительно могут показаться очень простыми, но их часто упускают из виду при анализе клинической кислотно-щелочной физиологии, что приводит к неверным выводам. Например, гиперхлоремический метаболический ацидоз может быть вызван только двумя путями. Во-первых, ионы Cl — могут быть добавлены в кровообращение либо через экзогенный источник (например, HCl или физиологический раствор), либо через внутренние сдвиги (например, из эритроцитов).Во-вторых, ионы Cl — могут задерживаться или реабсорбироваться, тогда как вода и другие ионы (т.е. Na + ) выделяются, так что относительная концентрация Cl — увеличивается. Снижение концентрации — HCO 3 или H + не приводит к гиперхлоремии, а скорее гиперхлоремия является причиной ацидоза. Это различие не просто семантика, как и наблюдение Коперника о том, что движется Земля, а не Солнце [11,22].
Во-первых, ионы Cl — могут быть добавлены в кровообращение либо через экзогенный источник (например, HCl или физиологический раствор), либо через внутренние сдвиги (например, из эритроцитов).Во-вторых, ионы Cl — могут задерживаться или реабсорбироваться, тогда как вода и другие ионы (т.е. Na + ) выделяются, так что относительная концентрация Cl — увеличивается. Снижение концентрации — HCO 3 или H + не приводит к гиперхлоремии, а скорее гиперхлоремия является причиной ацидоза. Это различие не просто семантика, как и наблюдение Коперника о том, что движется Земля, а не Солнце [11,22].
В дополнение к этим физико-химическим принципам почти все растворы, представляющие биологический интерес, имеют две важные характеристики. Во-первых, практически все они водные (состоят из воды), а во-вторых, большинство из них щелочные (концентрация OH — > концентрация H + ). Поскольку эти характеристики столь универсальны в физиологии человека, они часто игнорируются в обзорах по физиологии, особенно для клинической медицины, но они чрезвычайно важны. Водные растворы содержат практически неиссякаемый источник H + .Хотя чистая вода лишь незначительно диссоциирует на H + и OH — , электролиты и CO 2 производят мощные электрохимические силы, влияющие на диссоциацию воды. Точно так же водные растворы, которые являются щелочными, ведут себя совершенно по-разному по сравнению с кислыми растворами с точки зрения степени, в которой изменения их состава влияют на изменения pH.
Водные растворы содержат практически неиссякаемый источник H + .Хотя чистая вода лишь незначительно диссоциирует на H + и OH — , электролиты и CO 2 производят мощные электрохимические силы, влияющие на диссоциацию воды. Точно так же водные растворы, которые являются щелочными, ведут себя совершенно по-разному по сравнению с кислыми растворами с точки зрения степени, в которой изменения их состава влияют на изменения pH.
Чтобы проиллюстрировать это, сначала рассмотрим 1 л раствора чистой воды. Чистая вода содержит лишь небольшое количество ионов H + и OH — и молекулярные H 2 O.Чистая вода по определению является нейтральным раствором, поскольку концентрации Н + и ОН — равны. Концентрация этих ионов определяется исключительно степенью диссоциации воды и может быть определена константой K’ w . Диссоциация воды чувствительна к температуре, потому что K’ + и OH — всегда должны быть равными, а H + × OH — = K’ w . Если мы добавим по 10 ммоль/л Na + и Cl — к этому 1 л раствора чистой воды, мы получим водный раствор, содержащий H + , OH — , Na + и Cl ионы — и молекулярная вода. Следует отметить, что раствор не содержит молекул NaOH, HCl или NaCl, поскольку Na + и Cl — являются сильными ионами и поэтому полностью диссоциируют в воде. Раствор, который у нас теперь есть, по определению является нейтральным раствором, и при 25ºC концентрации как H + , так и OH — составляют примерно 100 нмоль/л, или pH 7.0. Если затем добавить 10 ммоль/л HCl, мы получим раствор, содержащий 10 ммоль/л Na + и 20 ммоль/л Cl — . Этот раствор кислый: ОН — =4,4·10 -9 нмоль/л, а Н + = ~ 10 ммоль/л. Обратите внимание, что в этом кислом растворе концентрация Н + увеличилась на количество добавленного Н + (т.е. 10 ммоль/л).
Если мы добавим по 10 ммоль/л Na + и Cl — к этому 1 л раствора чистой воды, мы получим водный раствор, содержащий H + , OH — , Na + и Cl ионы — и молекулярная вода. Следует отметить, что раствор не содержит молекул NaOH, HCl или NaCl, поскольку Na + и Cl — являются сильными ионами и поэтому полностью диссоциируют в воде. Раствор, который у нас теперь есть, по определению является нейтральным раствором, и при 25ºC концентрации как H + , так и OH — составляют примерно 100 нмоль/л, или pH 7.0. Если затем добавить 10 ммоль/л HCl, мы получим раствор, содержащий 10 ммоль/л Na + и 20 ммоль/л Cl — . Этот раствор кислый: ОН — =4,4·10 -9 нмоль/л, а Н + = ~ 10 ммоль/л. Обратите внимание, что в этом кислом растворе концентрация Н + увеличилась на количество добавленного Н + (т.е. 10 ммоль/л). Однако, если бы мы добавили 10 ммоль/л NaOH вместо HCl, раствор вместо этого содержал бы 20 ммоль/л Na + и 10 ммоль/л Cl — и был бы щелочным: H + = 4 .4 × 10 -9 нмоль/л и ОН — = ˜ 10 ммоль/л. Если затем к этому щелочному раствору добавить 5 ммоль/л HCl, результирующая концентрация Na + составит 20 ммоль/л, а Cl — — 15 ммоль/л. Конечная концентрация H + теперь составляет 8,8 × 10 -9 нмоль/л, а OH — составляет приблизительно 5 ммоль/л. Обратите внимание, что в этом последнем примере к раствору было добавлено 5 ммоль/л Н + , однако конечная концентрация свободного Н + изменилась менее чем на миллиардную часть этого количества.Следует также отметить, что раствор, который я описал, не содержит «буферов», и поэтому то, что часто приписывают силе буферных систем, является просто физико-химическим свойством щелочных растворов.
Однако, если бы мы добавили 10 ммоль/л NaOH вместо HCl, раствор вместо этого содержал бы 20 ммоль/л Na + и 10 ммоль/л Cl — и был бы щелочным: H + = 4 .4 × 10 -9 нмоль/л и ОН — = ˜ 10 ммоль/л. Если затем к этому щелочному раствору добавить 5 ммоль/л HCl, результирующая концентрация Na + составит 20 ммоль/л, а Cl — — 15 ммоль/л. Конечная концентрация H + теперь составляет 8,8 × 10 -9 нмоль/л, а OH — составляет приблизительно 5 ммоль/л. Обратите внимание, что в этом последнем примере к раствору было добавлено 5 ммоль/л Н + , однако конечная концентрация свободного Н + изменилась менее чем на миллиардную часть этого количества.Следует также отметить, что раствор, который я описал, не содержит «буферов», и поэтому то, что часто приписывают силе буферных систем, является просто физико-химическим свойством щелочных растворов.
Детерминанты концентрации водорода
Из предыдущего обсуждения видно, что для водных растворов вода является основным источником Н + , а детерминанты концентрации Н + являются детерминантами диссоциации воды. К счастью, даже для такого сложного водного раствора, как плазма крови, существует всего три независимых переменных, определяющих концентрацию H + . Обратите внимание, что я использую термин «определить», а не «описать», потому что, как показал Стюарт [6,9], эти три переменные являются математически независимыми детерминантами концентрации H + . Таким образом, эти переменные причинно связаны с концентрацией H + , а не просто коррелируют.Различие между независимым и зависимым, между причинностью и корреляцией так же важно для кислотно-щелочной физиологии, как и для любой другой области науки. Только путем тщательного анализа причинных переменных можно определить механизмы. Для плазмы крови этими тремя переменными являются pCO 2 , SID и общая концентрация слабых кислот (A TOT ).
К счастью, даже для такого сложного водного раствора, как плазма крови, существует всего три независимых переменных, определяющих концентрацию H + . Обратите внимание, что я использую термин «определить», а не «описать», потому что, как показал Стюарт [6,9], эти три переменные являются математически независимыми детерминантами концентрации H + . Таким образом, эти переменные причинно связаны с концентрацией H + , а не просто коррелируют.Различие между независимым и зависимым, между причинностью и корреляцией так же важно для кислотно-щелочной физиологии, как и для любой другой области науки. Только путем тщательного анализа причинных переменных можно определить механизмы. Для плазмы крови этими тремя переменными являются pCO 2 , SID и общая концентрация слабых кислот (A TOT ).
Углекислый газ
CO 2 является независимым фактором, определяющим рН, и образуется в результате клеточного метаболизма или титрования HCO 3 — метаболическими кислотами. В норме альвеолярная вентиляция регулируется для поддержания артериального pCO 2 на уровне от 35 до 45 мм рт.ст. Когда альвеолярная вентиляция увеличивается или уменьшается непропорционально продукции pCO 2 , возникает кислотно-щелочное расстройство дыхания. Продукция CO 2 организмом (при 220 мл/мин) равна 15000 ммоль/сутки угольной кислоты [23]. Это сопоставимо с менее чем 500 ммоль/день для всех нереспираторных кислот. Дыхательный центр в ответ на сигналы от рСО 2 , рН и парциального напряжения кислорода, а также на некоторые сигналы от физической нагрузки, тревоги, бодрствования и др. управляет альвеолярной вентиляцией.Точное соответствие альвеолярной вентиляции метаболической продукции CO 2 позволяет достичь нормального артериального pCO 2 , равного 40 мм рт.ст. Артериальное рСО 2 регулируется дыхательным центром в ответ на изменение артериального рН, вызванное метаболическим ацидозом или алкалозом, предсказуемым образом.
В норме альвеолярная вентиляция регулируется для поддержания артериального pCO 2 на уровне от 35 до 45 мм рт.ст. Когда альвеолярная вентиляция увеличивается или уменьшается непропорционально продукции pCO 2 , возникает кислотно-щелочное расстройство дыхания. Продукция CO 2 организмом (при 220 мл/мин) равна 15000 ммоль/сутки угольной кислоты [23]. Это сопоставимо с менее чем 500 ммоль/день для всех нереспираторных кислот. Дыхательный центр в ответ на сигналы от рСО 2 , рН и парциального напряжения кислорода, а также на некоторые сигналы от физической нагрузки, тревоги, бодрствования и др. управляет альвеолярной вентиляцией.Точное соответствие альвеолярной вентиляции метаболической продукции CO 2 позволяет достичь нормального артериального pCO 2 , равного 40 мм рт.ст. Артериальное рСО 2 регулируется дыхательным центром в ответ на изменение артериального рН, вызванное метаболическим ацидозом или алкалозом, предсказуемым образом.
Когда элиминация CO 2 недостаточна по сравнению со скоростью образования ткани, pCO 2 будет увеличиваться до нового устойчивого состояния, которое определяется новым соотношением между альвеолярной вентиляцией и производством CO 2 .В частности, это увеличение pCO 2 приведет к увеличению концентраций H + и HCO 3 — в соответствии с уравнением Хендерсона-Хассельбаха (уравнение 1). Таким образом, это изменение концентрации HCO 3 — опосредуется химическим равновесием, а не какой-либо системной адаптацией. Точно так же эта повышенная концентрация HCO 3 — не «буферизирует» концентрацию H + . В СБ никаких изменений нет.Тканевой ацидоз всегда возникает при респираторном ацидозе, потому что СО 2 диффундирует в ткани. Если pCO 2 останется повышенным, организм попытается компенсировать это изменением другой независимой детерминанты pH, а именно SID.
Электролиты (сильные ионы)
Плазма крови содержит многочисленные ионы. Эти ионы можно классифицировать как по заряду, положительным «катионам» и отрицательным «анионам», так и по их склонности к диссоциации в водных растворах.Некоторые ионы полностью диссоциируют в воде, например, Na + , K + , Ca 2+ , Mg 2+ , Cl — . Эти ионы называются «сильными ионами», чтобы отличить их от «слабых ионов» (например, альбумина, фосфата и HCO 3 — ), которые могут существовать как в заряженной (диссоциированной), так и в незаряженной формах. Некоторые ионы, такие как лактат, настолько почти полностью диссоциированы, что в физиологических условиях их можно считать сильными ионами.В нейтральном солевом растворе, содержащем только воду и NaCl, сумма сильных катионов (Na + ) минус сумма сильных анионов (Cl — ) равна нулю (т.е. Na + = Cl — ). Однако в плазме крови сильные катионы (главным образом Na + ) преобладают над сильными анионами (главным образом Cl — ). Разница между суммой всех сильных катионов и всех сильных анионов известна как SID. SID оказывает мощное электрохимическое воздействие на диссоциацию воды и, следовательно, на концентрацию H + .По мере того, как SID становится более положительным, H + , «слабый» катион, уменьшается (и увеличивается pH), чтобы поддерживать электрическую нейтральность (рис. 1).
Разница между суммой всех сильных катионов и всех сильных анионов известна как SID. SID оказывает мощное электрохимическое воздействие на диссоциацию воды и, следовательно, на концентрацию H + .По мере того, как SID становится более положительным, H + , «слабый» катион, уменьшается (и увеличивается pH), чтобы поддерживать электрическую нейтральность (рис. 1).
График зависимости pH от разности сильных ионов (SID). Для этого графика общая концентрация слабой кислоты (A TOT ) и парциальное напряжение двуокиси углерода (pCO 2 ) поддерживались постоянными на уровне 18 ммоль/л и 40 мм рт.ст. соответственно. Предполагается, что константа диссоциации воды для крови составляет 4,4 × 10–14 (моль/л). Обратите внимание, насколько крутой становится кривая pH при SID <20 ммоль/л.Адаптировано из Kellum and Kellum [10].
У здоровых людей SID в плазме составляет от 40 до 42 ммоль/л, хотя у пациентов в критическом состоянии он часто сильно отличается. В соответствии с принципом электронейтральности плазма крови не может быть заряжена, поэтому оставшиеся отрицательные заряды, уравновешивающие СИД, исходят от СО 2 и слабых кислот (А — ) и, в очень небольшой степени, от ОН — . При физиологическом pH вклад OH – настолько мал (диапазон нмоль), что им можно пренебречь.Суммарную концентрацию слабой кислоты (в основном альбумина и фосфата) можно рассматривать вместе и для удобства обозначать сокращенно А ТОТ , где АН + А — = А ТОТ . SID образца крови можно оценить по величине остаточного отрицательного заряда, поскольку SID-(CO 2 +A — )=0. Эта оценка SID была названа «эффективной» SID [24], но на самом деле она ничем не отличается от буферной базы, описанной более полувека назад [13].Таким образом, SID и буферная база являются зеркальным отражением друг друга. Напомним, что SBE по существу является изменением буферной основы in vivo и, следовательно, SBE определяет изменение SID от точки равновесия, где pH=7,4 и pCO 2 = 40 мм рт.
В соответствии с принципом электронейтральности плазма крови не может быть заряжена, поэтому оставшиеся отрицательные заряды, уравновешивающие СИД, исходят от СО 2 и слабых кислот (А — ) и, в очень небольшой степени, от ОН — . При физиологическом pH вклад OH – настолько мал (диапазон нмоль), что им можно пренебречь.Суммарную концентрацию слабой кислоты (в основном альбумина и фосфата) можно рассматривать вместе и для удобства обозначать сокращенно А ТОТ , где АН + А — = А ТОТ . SID образца крови можно оценить по величине остаточного отрицательного заряда, поскольку SID-(CO 2 +A — )=0. Эта оценка SID была названа «эффективной» SID [24], но на самом деле она ничем не отличается от буферной базы, описанной более полувека назад [13].Таким образом, SID и буферная база являются зеркальным отражением друг друга. Напомним, что SBE по существу является изменением буферной основы in vivo и, следовательно, SBE определяет изменение SID от точки равновесия, где pH=7,4 и pCO 2 = 40 мм рт.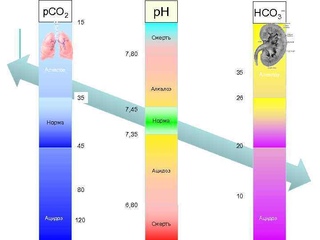 ст. [8].
ст. [8].
Альтернативная оценка SID выглядит следующим образом: (Na + + K + + Ca 2+ + Mg 2+ ) – (Cl – + лактат – ). Это часто называют «кажущимся» SID с пониманием того, что некоторые «неизмеряемые» ионы также могут присутствовать [24].Ни эффективный SID, ни кажущийся SID не являются идеальными оценками истинного SID. Образцы крови пациентов могут содержать неизмеренные сильные ионы (например, сульфаты, кетоны), что делает кажущуюся SID неточной оценкой SID. Точно так же у этих пациентов могут быть аномальные слабые ионы (например, белки), которые сделают эффективный SID неточным. Однако у здоровых людей кажущаяся SID и эффективная SID почти идентичны и, таким образом, являются достоверными оценками SID [24]. Кроме того, когда кажущийся SID и эффективный SID не равны, условие, которое мы назвали сильной ионной щелью (SIG), где кажущийся SID – эффективный SID = SIG, должны присутствовать аномальные сильные и/или слабые ионы [25].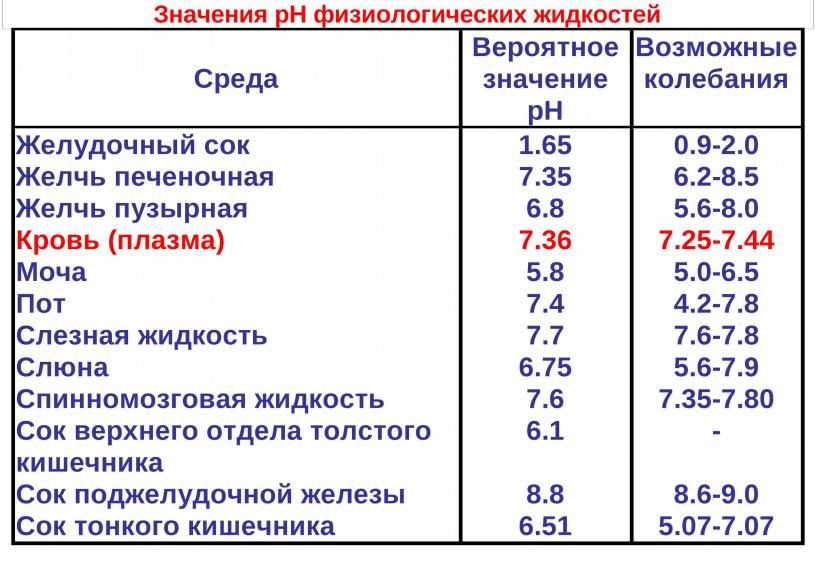 ].SIG является положительным, когда неизмеренные анионы превышают неизмеренные катионы, и отрицательным, когда неизмеренные катионы превышают неизмеренные анионы. Необъяснимые анионы, а в некоторых случаях и катионы были обнаружены в кровотоке больных с различными заболеваниями [25,26,27,28] и у животных в экспериментальных условиях [29].
].SIG является положительным, когда неизмеренные анионы превышают неизмеренные катионы, и отрицательным, когда неизмеренные катионы превышают неизмеренные анионы. Необъяснимые анионы, а в некоторых случаях и катионы были обнаружены в кровотоке больных с различными заболеваниями [25,26,27,28] и у животных в экспериментальных условиях [29].
SIG — это не то же самое, что анионная щель (AG). В норме SIG равен нулю, тогда как AG составляет 8–12 ммоль/л. AG является оценкой суммы SIG + A —.Таким образом, вычитание A — из AG приблизительно соответствует SIG. Удобным и достаточно точным способом оценки A — является использование следующей формулы [30]:
2 (альбумин г/дл) + 0,5 (фосфат мг/дл) (4)
или для международных единиц:
0,2 (альбумин г/л) + 1,5 (фосфат ммоль/л) (5)
Обратите внимание, что «нормальная» АГ для человека с неизмеренными анионами или катионами в плазме равна A — , так что АГ — А — = SIG = 0. Этот метод позволяет «откалибровать» АГ для пациентов с аномальными концентрациями альбумина и/или фосфата.
Этот метод позволяет «откалибровать» АГ для пациентов с аномальными концентрациями альбумина и/или фосфата.
Физиологические механизмы
Чтобы изменить SID, организм должен воздействовать на изменение относительных концентраций сильных катионов и сильных анионов. Почки являются основным органом, который влияет на это изменение. Однако почки могут выделять с мочой лишь очень небольшое количество сильных ионов каждую минуту, и поэтому требуется от нескольких минут до нескольких часов, чтобы существенно повлиять на SID.Обработка сильных ионов почками чрезвычайно важна, потому что каждый ион Cl —, отфильтрованный, но не реабсорбированный, увеличивает SID. Поскольку большая часть человеческого рациона содержит аналогичные соотношения сильных катионов и сильных анионов, обычно имеется достаточное количество Cl —, чтобы это могло быть основным регулирующим механизмом. Это особенно очевидно, если учесть, что на обработку Na + и K + в почках влияют другие приоритеты (например, внутрисосудистый объем и гомеостаз K + в плазме). Соответственно, «переработка кислоты» почками обычно опосредована балансом Cl —. То, как почки справляются с Cl –, безусловно, очень важно. Традиционные подходы к этой проблеме сосредоточены на экскреции H + и подчеркивают важность NH 3 и его дополнительного катиона NH 4 + . H + экскреция сама по себе не имеет значения, однако, поскольку вода представляет собой по существу бесконечный источник свободного H + .Действительно, почка не выделяет H + больше в виде NH 4 +, чем в виде H 2 O. К + . Это достигается введением слабого катиона (NH 4 + ) для выделения с Cl —.
Соответственно, «переработка кислоты» почками обычно опосредована балансом Cl —. То, как почки справляются с Cl –, безусловно, очень важно. Традиционные подходы к этой проблеме сосредоточены на экскреции H + и подчеркивают важность NH 3 и его дополнительного катиона NH 4 + . H + экскреция сама по себе не имеет значения, однако, поскольку вода представляет собой по существу бесконечный источник свободного H + .Действительно, почка не выделяет H + больше в виде NH 4 +, чем в виде H 2 O. К + . Это достигается введением слабого катиона (NH 4 + ) для выделения с Cl —.
Таким образом, NH 4 + важен для системного кислотно-щелочного баланса не из-за переноса H + или из-за его прямого действия в плазме (нормальная концентрация NH 4 + в плазме <0.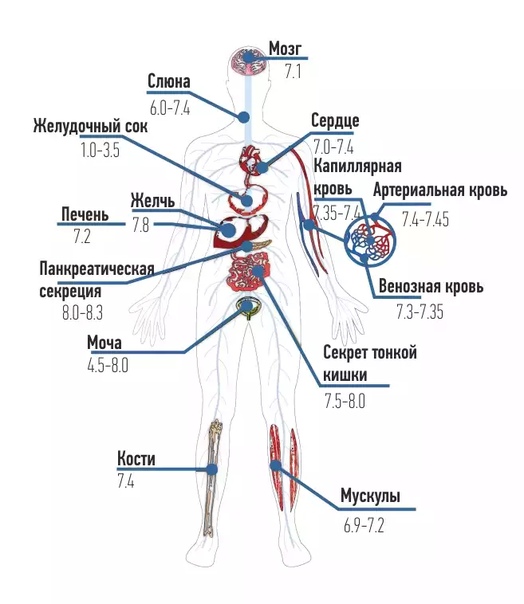 01 ммоль/л), но из-за его «коэкскреции» с Cl –. Конечно, NH 4 + вырабатывается не только в почках. Аммоногенез в печени (а также глутаминогенез) важен для системного кислотно-щелочного баланса и, как и ожидалось, строго контролируется механизмами, чувствительными к рН плазмы [31]. Действительно, эта новая интерпретация роли NH 4 + в кислотно-щелочном балансе подтверждается данными о том, что ацидоз стимулирует печеночный глутаминогенез [32].Метаболизм азота в печени может привести к образованию мочевины, глутамина или NH 4 + . Обычно печень не выделяет больше, чем очень небольшое количество NH 4 + , а скорее включает этот азот либо в мочевину, либо в глютамин. Гепатоциты имеют ферменты, позволяющие им производить любой из этих конечных продуктов, и оба позволяют регулировать NH 4 + в плазме на достаточно низких уровнях. Производство мочевины или глютамина оказывает существенно различное влияние на уровне почек.
01 ммоль/л), но из-за его «коэкскреции» с Cl –. Конечно, NH 4 + вырабатывается не только в почках. Аммоногенез в печени (а также глутаминогенез) важен для системного кислотно-щелочного баланса и, как и ожидалось, строго контролируется механизмами, чувствительными к рН плазмы [31]. Действительно, эта новая интерпретация роли NH 4 + в кислотно-щелочном балансе подтверждается данными о том, что ацидоз стимулирует печеночный глутаминогенез [32].Метаболизм азота в печени может привести к образованию мочевины, глутамина или NH 4 + . Обычно печень не выделяет больше, чем очень небольшое количество NH 4 + , а скорее включает этот азот либо в мочевину, либо в глютамин. Гепатоциты имеют ферменты, позволяющие им производить любой из этих конечных продуктов, и оба позволяют регулировать NH 4 + в плазме на достаточно низких уровнях. Производство мочевины или глютамина оказывает существенно различное влияние на уровне почек. Это связано с тем, что глютамин используется почками для образования NH 4 + и облегчения выделения Cl —. Таким образом, производство глютамина можно рассматривать как оказывающее подщелачивающее действие на рН плазмы из-за того, как он используется почками.
Это связано с тем, что глютамин используется почками для образования NH 4 + и облегчения выделения Cl —. Таким образом, производство глютамина можно рассматривать как оказывающее подщелачивающее действие на рН плазмы из-за того, как он используется почками.
Дальнейшая поддержка этого сценария исходит из недавнего открытия анатомической организации гепатоцитов в соответствии с их ферментативным содержанием [33]. Гепатоциты со склонностью к выработке мочевины расположены ближе к портальной венуле и, таким образом, имеют первые шансы на доставку Nh5 + .Однако ацидоз ингибирует уреагенез, и в этих условиях большее количество NH 4 + доступно нижестоящим гепатоцитам, предрасположенным к выработке глутамина. Таким образом, остаточный NH 4 + «упаковывается» как глютамин для экспорта в почки, где он используется для облегчения экскреции Cl – и, следовательно, увеличивает SID.
Желудочно-кишечный тракт также оказывает важное влияние на СИД. По своей длине желудочно-кишечный тракт совершенно по-разному обрабатывает сильные ионы.В желудке Cl — выкачивается из плазмы в просвет, снижая SID желудочного сока и тем самым снижая pH. Со стороны плазмы SID увеличивается за счет потери Cl –, а pH увеличивается, вызывая так называемый «щелочной прилив», который возникает в начале приема пищи, когда секреция желудочного сока максимальна [34]. В двенадцатиперстной кишке Cl — реабсорбируется и рН плазмы восстанавливается. В норме заметны лишь незначительные изменения pH плазмы, поскольку Cl – возвращается в кровоток почти сразу после его удаления.Однако, если желудочный секрет удаляется у пациента с помощью отсасывающего катетера или с помощью рвоты, Cl — будет постепенно теряться, и SID будет неуклонно увеличиваться. Важно понимать, что именно потеря Cl —, а не H + , является определяющим фактором рН плазмы. Хотя H + «теряется» в виде HCl, он также теряется с каждой молекулой воды, удаляемой из организма.
По своей длине желудочно-кишечный тракт совершенно по-разному обрабатывает сильные ионы.В желудке Cl — выкачивается из плазмы в просвет, снижая SID желудочного сока и тем самым снижая pH. Со стороны плазмы SID увеличивается за счет потери Cl –, а pH увеличивается, вызывая так называемый «щелочной прилив», который возникает в начале приема пищи, когда секреция желудочного сока максимальна [34]. В двенадцатиперстной кишке Cl — реабсорбируется и рН плазмы восстанавливается. В норме заметны лишь незначительные изменения pH плазмы, поскольку Cl – возвращается в кровоток почти сразу после его удаления.Однако, если желудочный секрет удаляется у пациента с помощью отсасывающего катетера или с помощью рвоты, Cl — будет постепенно теряться, и SID будет неуклонно увеличиваться. Важно понимать, что именно потеря Cl —, а не H + , является определяющим фактором рН плазмы. Хотя H + «теряется» в виде HCl, он также теряется с каждой молекулой воды, удаляемой из организма. Когда Cl — (сильный анион) теряется без потери сильного катиона, SID увеличивается и, следовательно, концентрация H + в плазме снижается.Когда H + «теряется» в виде воды (HOH), а не HCl, SID не изменяется и, следовательно, не изменяется концентрация H + в плазме.
Когда Cl — (сильный анион) теряется без потери сильного катиона, SID увеличивается и, следовательно, концентрация H + в плазме снижается.Когда H + «теряется» в виде воды (HOH), а не HCl, SID не изменяется и, следовательно, не изменяется концентрация H + в плазме.
В отличие от желудка, поджелудочная железа выделяет жидкость в тонкую кишку, у которой SID намного выше, чем у плазмы, и очень низкое содержание Cl —. Таким образом, SID плазмы, перфузирующей поджелудочную железу, снижается, явление, которое достигает пика примерно через 1 час после еды и помогает противодействовать щелочному приливу.Если теряется большое количество панкреатической жидкости, например, из-за хирургического дренирования, в результате снижения SID в плазме возникает ацидоз. В толстой кишке жидкость также имеет высокий SID, потому что большая часть Cl — была удалена в тонкой кишке, а оставшиеся электролиты представлены в основном Na + и K + . Организм обычно реабсорбирует большую часть воды и электролитов из этой жидкости, но при тяжелой диарее может теряться большое количество катионов.Если эта потеря будет постоянной, SID в плазме уменьшится, что приведет к ацидозу. Наконец, вопрос о том, способен ли желудочно-кишечный тракт компенсаторно регулировать поглощение сильных ионов, еще недостаточно изучен. Имеются некоторые свидетельства того, что кишечник может модулировать системный ацидоз при экспериментальной эндотоксемии путем удаления анионов из плазмы [35]. Однако полная способность этого органа влиять на кислотно-щелочной баланс неизвестна.
Организм обычно реабсорбирует большую часть воды и электролитов из этой жидкости, но при тяжелой диарее может теряться большое количество катионов.Если эта потеря будет постоянной, SID в плазме уменьшится, что приведет к ацидозу. Наконец, вопрос о том, способен ли желудочно-кишечный тракт компенсаторно регулировать поглощение сильных ионов, еще недостаточно изучен. Имеются некоторые свидетельства того, что кишечник может модулировать системный ацидоз при экспериментальной эндотоксемии путем удаления анионов из плазмы [35]. Однако полная способность этого органа влиять на кислотно-щелочной баланс неизвестна.
Патофизиологические механизмы
Метаболические ацидозы и алкалозы классифицируются в соответствии с ответственными ионами.Таким образом, у нас есть лактоацидоз и хлорид-чувствительный алкалоз и т. д. Важно признать, что метаболический ацидоз вызывается снижением SID, которое создает электрохимическую силу, которая приводит к увеличению концентрации свободного H + . Снижение SID может быть вызвано образованием органических анионов (например, лактата, кетонов), потерей катионов (например, диареей), неправильным обращением с ионами (например, ацидоз почечных канальцев) или добавлением экзогенных анионов (например, ятрогенных ацидоз, отравления).Напротив, метаболические алкалозы возникают в результате неадекватно большого SID, хотя SID не обязательно должен превышать «нормальные» 40–42 ммоль/л. Это может быть вызвано потерей анионов в избытке катионов (например, рвота, диуретики) или, редко, введением сильных катионов в избытке сильных анионов (например, переливанием больших объемов консервированной крови). Таблицы и обеспечивают полезные средства для дифференциации различных причин метаболического ацидоза и алкалоза.
Снижение SID может быть вызвано образованием органических анионов (например, лактата, кетонов), потерей катионов (например, диареей), неправильным обращением с ионами (например, ацидоз почечных канальцев) или добавлением экзогенных анионов (например, ятрогенных ацидоз, отравления).Напротив, метаболические алкалозы возникают в результате неадекватно большого SID, хотя SID не обязательно должен превышать «нормальные» 40–42 ммоль/л. Это может быть вызвано потерей анионов в избытке катионов (например, рвота, диуретики) или, редко, введением сильных катионов в избытке сильных анионов (например, переливанием больших объемов консервированной крови). Таблицы и обеспечивают полезные средства для дифференциации различных причин метаболического ацидоза и алкалоза.
Таблица 2
Таблица 2
Дифференциальный диагноз для метаболического ацидоза (уменьшенный SID)
| почечный трубчатый ацидоз: | : | : |
| моча SID (Na + + k + — Cl)> 0 | мочи SID (Na + + K + Cl — — ) <0 | |
| Дистальная (тип I): рН мочи> 5,5 | желудочно-кишечного тракта: диарея, маленький | |
| дренаж кишечника/поджелудочной железы | ||
| Проксимальный отдел (тип II): моча | ||
pH <5.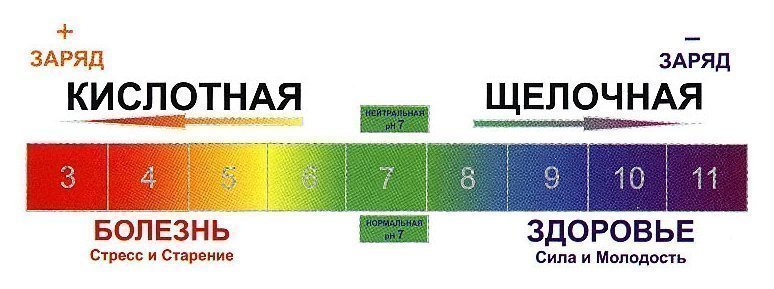 5 / Низкая сыворотка K + 5 / Низкая сыворотка K + | IAtrogenic: парентеральное питание, | |
| 60155 | Saline, анионообменные смолы | |
| дефицит альдостерона (тип IV): | PH моча <5.5 / высокая сыворотка K + |
Таблица 3
Дифференциальный диагноз метаболического алкалоза (Увеличенный SID)
| Степень хлорида <Потеря натрия |
| Хлорид. <10 ммоль / л) |
| Потери желудочно-кишечного тракта: рвота, дренаж желудка, Хлорид |
| Постдиуретическое использование |
| Posthypercapnea |
| Хлорид не отвечает (моча CL — концентрация >20 ммоль/л) |
| Минералокортикоид избыток: первичный гипердостеронизм (Conn |
| синдром |
| синдром, синдром Liddle, синдром Bartter, |
| экзогенные кортикоиды, чрезмерное потребление солодки |
| постоянное мочегонное использование |
| Экзогенная нагрузка на натрий (> Хлорид) |
| Администрирование соли натрия (ацетат, цитрат): массивная кровь |
| переливания, парентеральное питание, расширители объема плазмы, |
| Лактат натрия (раствор Рингера) |
| Другое |
| Тяжелый дефицит внутриклеточных катионов: мг 2+ , K + |
в интенсивной терапии ацидоз ацидоза обычно больше проблемой, чем алкалоз, а у критически больных наиболее частыми источниками метаболического ацидоза являются нарушения гомеостаза хлоридов, лактата и других анионов. Гиперхлоремический метаболический ацидоз возникает либо в результате введения хлоридов, либо вследствие нарушений в обращении с хлоридами, либо в связи с перемещением хлоридов из одного компартмента в другой. Влияние введения хлоридов на развитие метаболического ацидоза известно уже много лет [36,37]. В последнее время этой области уделяется новое внимание в свете лучшего понимания механизмов, ответственных за этот эффект [38,39,40]. В настоящее время на животных моделях сепсиса [38] и у пациентов, перенесших операцию [39,40], показано, что физиологический раствор вызывает метаболический ацидоз не за счет «разбавления» HCO 3 –, а за счет содержания в нем Cl –. .С физико-химической точки зрения это вполне ожидаемо. HCO 3 — является зависимой переменной и не может быть причиной ацидоза. Вместо этого введение Cl — снижает SID (независимая переменная) и приводит к увеличению диссоциации воды и, следовательно, концентрации H + .
Гиперхлоремический метаболический ацидоз возникает либо в результате введения хлоридов, либо вследствие нарушений в обращении с хлоридами, либо в связи с перемещением хлоридов из одного компартмента в другой. Влияние введения хлоридов на развитие метаболического ацидоза известно уже много лет [36,37]. В последнее время этой области уделяется новое внимание в свете лучшего понимания механизмов, ответственных за этот эффект [38,39,40]. В настоящее время на животных моделях сепсиса [38] и у пациентов, перенесших операцию [39,40], показано, что физиологический раствор вызывает метаболический ацидоз не за счет «разбавления» HCO 3 –, а за счет содержания в нем Cl –. .С физико-химической точки зрения это вполне ожидаемо. HCO 3 — является зависимой переменной и не может быть причиной ацидоза. Вместо этого введение Cl — снижает SID (независимая переменная) и приводит к увеличению диссоциации воды и, следовательно, концентрации H + .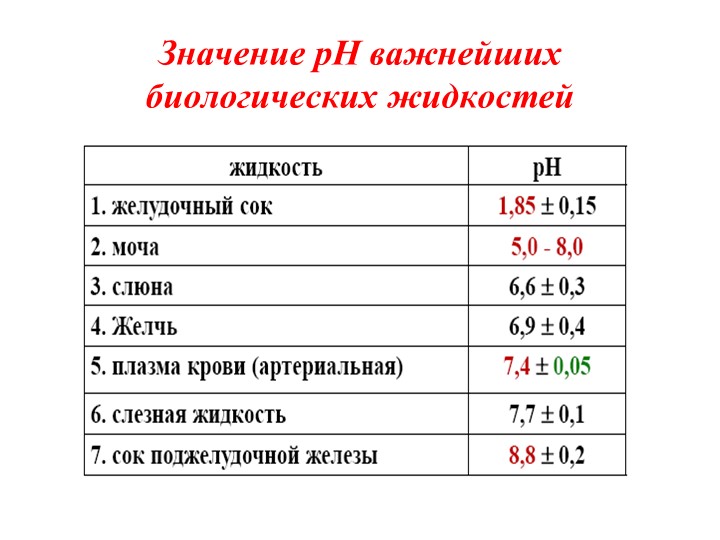 Причина, по которой это происходит при введении физиологического раствора, заключается в том, что, хотя физиологический раствор содержит равные количества как Na + , так и Cl — , плазма их не содержит.При добавлении больших количеств соли концентрация Cl — возрастает значительно больше, чем концентрация натрия. Например, 0,9% («нормальный») физиологический раствор содержит 154 ммоль/л Na + и Cl — . Введение больших объемов этой жидкости будет иметь пропорционально больший эффект на Cl — всего тела, чем на Na + всего тела. Следует отметить, что необходимо учитывать общую концентрацию этих сильных ионов в организме, и, хотя истинный объем распределения Cl — меньше, как у Na + , эффективный объем распределения (после некоторого времени уравновешивания ) равно общему количеству воды в организме [38].
Причина, по которой это происходит при введении физиологического раствора, заключается в том, что, хотя физиологический раствор содержит равные количества как Na + , так и Cl — , плазма их не содержит.При добавлении больших количеств соли концентрация Cl — возрастает значительно больше, чем концентрация натрия. Например, 0,9% («нормальный») физиологический раствор содержит 154 ммоль/л Na + и Cl — . Введение больших объемов этой жидкости будет иметь пропорционально больший эффект на Cl — всего тела, чем на Na + всего тела. Следует отметить, что необходимо учитывать общую концентрацию этих сильных ионов в организме, и, хотя истинный объем распределения Cl — меньше, как у Na + , эффективный объем распределения (после некоторого времени уравновешивания ) равно общему количеству воды в организме [38].
Существуют и другие важные причины гиперхлоремии (таблица), кроме того, эта форма метаболического ацидоза часто встречается при критических состояниях, особенно при сепсисе. Хотя реанимация физиологическим раствором, несомненно, играет определенную роль, существуют необъяснимые источники Cl —, по крайней мере, в животных моделях сепсиса [38]. Мы предположили, что этот Cl — поступает из внутриклеточных и интерстициальных компартментов в результате частичной потери равновесия Доннана из-за выхода альбумина из внутрисосудистого пространства.Однако эта гипотеза еще не проверена.
Хотя реанимация физиологическим раствором, несомненно, играет определенную роль, существуют необъяснимые источники Cl —, по крайней мере, в животных моделях сепсиса [38]. Мы предположили, что этот Cl — поступает из внутриклеточных и интерстициальных компартментов в результате частичной потери равновесия Доннана из-за выхода альбумина из внутрисосудистого пространства.Однако эта гипотеза еще не проверена.
Помимо Cl –, в крови критически больных пациентов могут присутствовать несколько других сильных ионов. Лактат, пожалуй, самый важный из них, но кетоны, сульфаты и некоторые яды (например, метанол, салицилат) важны при соответствующих клинических состояниях. Кроме того, было показано, что необъяснимые анионы присутствуют в крови многих пациентов в критическом состоянии [25,26,27,28].
Слабые кислоты
Третьим и последним определяющим фактором концентрации H + является A TOT .Слабые кислоты представляют собой в основном белки (преимущественно альбумин) и фосфаты, и они вносят оставшиеся заряды, чтобы удовлетворить принципу электронейтральности, так что SID-(CO 2 +A — )=0. Однако A — не является независимой переменной, потому что она изменяется при изменении SID и pCO 2 . Скорее, A TOT (AH + A — ) является независимой переменной, поскольку ее значение не определяется ничем другим. Идентификация A TOT в качестве третьей независимой кислотно-основной переменной привела некоторых авторов к предположению о существовании третьего «вида» кислотно-основного расстройства [41,42].Таким образом, наряду с респираторным и метаболическим ацидозом и алкалозом у нас также будут ацидоз и алкалоз из-за аномалий в A TOT . Однако математическая и, следовательно, химическая независимость не обязательно подразумевает физиологическую независимость. Хотя потеря слабой кислоты (A TOT ) из плазменного пространства представляет собой подщелачивающий процесс, нет никаких доказательств того, что организм регулирует A TOT для поддержания кислотно-щелочного баланса. Кроме того, нет никаких доказательств того, что мы, как клиницисты, должны рассматривать гипоальбуминемию как кислотно-щелочное расстройство.
Однако A — не является независимой переменной, потому что она изменяется при изменении SID и pCO 2 . Скорее, A TOT (AH + A — ) является независимой переменной, поскольку ее значение не определяется ничем другим. Идентификация A TOT в качестве третьей независимой кислотно-основной переменной привела некоторых авторов к предположению о существовании третьего «вида» кислотно-основного расстройства [41,42].Таким образом, наряду с респираторным и метаболическим ацидозом и алкалозом у нас также будут ацидоз и алкалоз из-за аномалий в A TOT . Однако математическая и, следовательно, химическая независимость не обязательно подразумевает физиологическую независимость. Хотя потеря слабой кислоты (A TOT ) из плазменного пространства представляет собой подщелачивающий процесс, нет никаких доказательств того, что организм регулирует A TOT для поддержания кислотно-щелочного баланса. Кроме того, нет никаких доказательств того, что мы, как клиницисты, должны рассматривать гипоальбуминемию как кислотно-щелочное расстройство.
Критически больные пациенты часто имеют гипоальбуминемию, поэтому их A TOT снижен. Однако эти пациенты не часто страдают алкалемией, и их SID также снижен [43]. Когда у этих пациентов нормальный pH и нормальная концентрация SBE и HCO 3 — , представляется наиболее целесообразным рассматривать это как физиологическую компенсацию сниженного A TOT [44], а не классифицировать это состояние как сложное кислотно-щелочное расстройство со смешанным метаболическим ацидозом/гипоальбуминемическим алкалозом.Таким образом, кажется гораздо более вероятным, что это «расстройство» на самом деле является нормальной физиологической реакцией на снижение A TOT . Кроме того, поскольку изменения в A TOT обычно происходят медленно, развитие алкалемии потребует, чтобы почки продолжали выделять Cl —, несмотря на развивающийся алкалоз. Я бы назвал такой сценарий гипохлоремическим метаболическим алкалозом, опосредованным почками, лечение которого будет включать жидкости и/или хлориды, в зависимости от клинических условий. Обозначение Стюартом «нормального» SID, равного примерно 40 ммоль/л, было основано на «нормальном» CO 2 и A TOT [6,9]. «Нормальный» SID для пациента с альбумином 2 г/дл будет намного ниже (например, примерно 32 ммоль/л).
Обозначение Стюартом «нормального» SID, равного примерно 40 ммоль/л, было основано на «нормальном» CO 2 и A TOT [6,9]. «Нормальный» SID для пациента с альбумином 2 г/дл будет намного ниже (например, примерно 32 ммоль/л).
Заключение
В отличие от многих других областей клинической медицины подход к кислотно-щелочной физиологии часто не отличает причину от следствия. Хотя совершенно разумно описывать изменение кислотно-щелочного состояния наблюдаемыми изменениями H + и HCO 3 — , это само по себе не подразумевает причинно-следственную связь.Суть подхода Stewart [6,9] заключается в понимании того, что в определении концентрации H + важны только три переменные: pCO 2 , SID и A TOT . Ни H + , ни HCO 3 — не могут измениться, если не изменится одна или несколько из этих трех переменных. Принцип сохранения массы делает это более важным, чем семантика. Сильные ионы не могут быть созданы или уничтожены для соблюдения электронейтральности, но ионы H + генерируются или поглощаются изменениями в диссоциации воды.Следовательно, чтобы понять, как организм регулирует pH, нам нужно только рассмотреть, как он регулирует эти три независимые переменные. Другие подходы к кислотно-щелочной физиологии игнорируют различие между независимыми и зависимыми переменными, и хотя кислотно-щелочное расстройство можно описать в терминах концентраций H + или HCO 3 — или SBE, неправильно анализировать патологию или планировать лечение на основе изменения этих переменных.
Сильные ионы не могут быть созданы или уничтожены для соблюдения электронейтральности, но ионы H + генерируются или поглощаются изменениями в диссоциации воды.Следовательно, чтобы понять, как организм регулирует pH, нам нужно только рассмотреть, как он регулирует эти три независимые переменные. Другие подходы к кислотно-щелочной физиологии игнорируют различие между независимыми и зависимыми переменными, и хотя кислотно-щелочное расстройство можно описать в терминах концентраций H + или HCO 3 — или SBE, неправильно анализировать патологию или планировать лечение на основе изменения этих переменных.
Ссылки
- Келлум Дж.А. Диагностика и лечение кислотно-щелочных нарушений. Учебник интенсивной терапии. Под редакцией Гренвик А., Шумейкер П.К., Айерс С., Холбрук П.Р. Филадельфия, Пенсильвания: WB Saunders Co, 1999. стр. 839–853.
- Северингхаус JW. Зиггард-Андерсен и «великие трансатлантические кислотно-основные дебаты».
 Scand J Clin Lab Invest. 1993; 53 (доп. 214): 99–104. [PubMed] [Google Scholar]
Scand J Clin Lab Invest. 1993; 53 (доп. 214): 99–104. [PubMed] [Google Scholar] - Siggard-Andersen O, Foch-Andersen N. Избыток основания или буферное основание (сильная разница ионов) как мера недыхательного кислотно-щелочного нарушения.Акта Анаэстиол Сканд. 1995; 39 (дополнение 107): 123–128. [PubMed] [Google Scholar]
- Уортли Л. Сильное отличие ионов: новая парадигма или новая одежда для кислотно-щелочного императора. Критическая помощь Resusc. 1999; 1: 211–214. [PubMed] [Google Scholar]
- Severinghaus JW. Подробнее RipH [письмо]. ДЖАМА. 1992; 267:2035–2036. [PubMed] [Google Scholar]
- Stewart PA. Как понять кислотно-щелочное. Количественный кислотно-щелочной учебник по биологии и медицине. Под редакцией Стюарта П.А., Нью-Йорк: Elsevier, 1981.стр. 1–286.
- Schlichtig R, Grogono AW, Severinghaus JW. Человеческий PaCO 2 и стандартная компенсация избытка оснований для кислотно-щелочного дисбаланса. Крит Уход Мед. 1998; 26:1173–1179.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Schlichtig R, Kellum JA. Избыток основания и сильное различие ионов количественно взаимозаменяемы. Adv Exp Med Biol 2000 (в печати) 2000.
- Stewart PA. Современная количественная кислотно-основная химия. Может J Physiol Pharmacol. 1983; 61: 1444–1461. [PubMed] [Google Scholar]
- Келлум Дж. А., Келлум Дж. А.Метаболический ацидоз у больных в критическом состоянии: уроки физической химии. почки инт. 1998; 53 (прил. 66): 81–86. [PubMed] [Google Scholar]
- Kellum JA. Кислотно-основная физиология в посткоперниковскую эпоху. Curr Opin Crit Care. 1999; 5: 458–463. [Google Scholar]
- Альберт М., Делл Р., Уинтерс Р. Количественное смещение кислотно-щелочного равновесия при метаболическом ацидозе. Энн Интерн Мед. 1967; 66: 312–322. [PubMed] [Google Scholar]
- Singer RB, Hastings AB. Усовершенствованный клинический метод оценки нарушений кислотно-щелочного баланса крови человека.Медицина (Балт) 1948; 27: 223–242. [PubMed] [Google Scholar]
- Astrup P, Jorgensen K, Siggaard-Andersen O, et al.
 Кислотно-щелочной обмен: новый подход. Ланцет. 1960; я: 1035–1039. [PubMed] [Google Scholar]
Кислотно-щелочной обмен: новый подход. Ланцет. 1960; я: 1035–1039. [PubMed] [Google Scholar] - Siggaard-Andersen O. Изменена кислотно-щелочная номограмма pH-log pCO 2 крови. Сканд Джей Лаб Инвест. 1962; 14: 598–604. [PubMed] [Google Scholar]
- Зиггаард-Андерсен О. Кислотно-щелочное состояние крови, 4-е изд. Копенгаген: Мунксгаард, 1974.
- Грогоно А.В., Байлз П.Х., Хоук В. in vivo представление кислотно-щелочного баланса. Ланцет. 1976; я: 499–500. [PubMed] [Google Scholar]
- Severinghaus JW. Номограмма кислотно-щелочного баланса: разрядка Бостон-Копенгаген. Анестезиология. 1976; 45: 539–541. [PubMed] [Google Scholar]
- Brackett NC, Cohen JJ, Schwartz WB. Кривая титрования углекислым газом нормального человека. N Engl J Med. 1965; 272: 6–12. [PubMed] [Google Scholar]
- Prys-Roberts C, Kelman GR, Nunn JF. Детерминанты кривой титрования диоксида углерода in vivo у человека под наркозом.Бр Джей Анест. 1966; 38: 500–509.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Schlichtig R. Кислотно-щелочной баланс (количественный анализ). Учебник интенсивной терапии. Под редакцией Гренвика А., Шумейкера П.К., Айерса С., Холбрука П.Р. Филадельфия, Пенсильвания: WB Saunders Co, 1999. стр. 828–839.
- Магдер С. Патофизиология метаболических кислотно-основных нарушений у больных в критических состояниях. Нефрология интенсивной терапии. Под редакцией Ронко С., Белломо Р. Дордрехта, Нидерланды: Kluwer Academic Publishers, 1997. стр. 279–296.
- Gattinoni L, Lissoni A. Дыхательные кислотно-основные нарушения у пациентов с критическими заболеваниями. Нефрология интенсивной терапии. Под редакцией Ронко С., Белломо Р. Дордрехта, Нидерланды: Kluwer Academic Publishers, 1998. стр. 297–312.
- Figge J, Mydosh T, Fencl V. Белки сыворотки и кислотно-щелочное равновесие: последующее наблюдение. J Lab Clin Med. 1992; 120:713–719. [PubMed] [Google Scholar]
- Kellum JA, Kramer DJ, Pinsky MR. Сильная ионная щель: методология изучения необъяснимых анионов.
 J Крит Уход. 1995; 10:51–55. [PubMed] [Google Scholar]
J Крит Уход. 1995; 10:51–55. [PubMed] [Google Scholar] - Gilfix BM, Bique M, Magder S. Физико-химический подход к анализу кислотно-щелочного баланса в клинических условиях. J Крит Уход. 1993; 8: 187–197. [PubMed] [Google Scholar]
- Mecher C, Rackow EC, Astiz ME, Weil MH. Неучтенный анион при метаболическом ацидозе при тяжелом сепсисе у человека. Крит Уход Мед. 1991; 19: 705–711. [PubMed] [Google Scholar]
- Киршбаум Б. Увеличение анионной щели после трансплантации печени.. Am J Med Sci. 1997; 313:107–110. [PubMed] [Google Scholar]
- Kellum JA, Bellomo R, Kramer DJ, Pinksy MR. Поток анионов в печень при острой эндотоксемии. J Appl Physiol. 1995;78:2212–2217. [PubMed] [Google Scholar]
- Kellum JA, Kramer DJ, Pinsky MR. Закрытие GAP: простой метод повышения точности определения анионного промежутка [аннотация]. Chest. Грудь. 1996; 110 (прил. 4): 18С. [Google Scholar]
- Бурк Э., Хауссингер Д. Гомеостаз рН: концептуальные изменения. Почки сегодня.
 Избранные темы почечной науки. Под редакцией Берлина GM. Внести нефрол. Базель: Каргер, 1992. стр. 58–88.
Избранные темы почечной науки. Под редакцией Берлина GM. Внести нефрол. Базель: Каргер, 1992. стр. 58–88. - Oliver J, Bourke E. Адаптация экскреции мочевины и аммония при метаболическом ацидозе у крыс: новая интерпретация. Clin Sci Med. 1975; 48: 515–520. [PubMed] [Google Scholar]
- Atkinson DE, Bourke E. pH Гомеостаз у наземных позвоночных; ион аммония как источник протонов. Сравнительная и экологическая физиология. Механизмы системной регуляции, кислотно-щелочной регуляции, переноса ионов и метаболизма.Под редакцией Хейслера Н. Спрингера: Берлин, 1995. стр. 1–26.
- Мур РЭБ. Щелочной прилив. Гастроэнтерология. 1967; 52: 1052–1054. [PubMed] [Google Scholar]
- Kellum JA, Bellomo R, Kramer DJ, Pinsky MR. Спланхническая буферизация метаболической кислоты во время ранней эндотоксемии. J Крит Уход. 1997; 12:7–12. [PubMed] [Google Scholar]
- Кушинг Х. О ядовитом действии чистых растворов хлорида натрия на препарат нервных мышц. Am J Physiol. 1902; 6:77 и далее.
 [Google Scholar]
[Google Scholar] - Shires GT, Толмен Дж.Дилюционный ацидоз. Энн Интерн Мед. 1948; 28: 557–559. [PubMed] [Google Scholar]
- Kellum JA, Bellomo R, Kramer DJ, Pinsky MR. Этиология метаболического ацидоза при солевой реанимации при эндотоксемии. . Шок. 1998; 9: 364–468. [PubMed] [Google Scholar]
- Scheingraber S, Rehm M, Sehmisch C, Finsterer U. Быстрая инфузия физиологического раствора вызывает гиперхлоремический ацидоз у пациентов, перенесших гинекологические операции. Анестезиология. 1999;90:1265–1270. [PubMed] [Google Scholar]
- Уотерс Дж. Х., Миллер Л. Р., Клак С., Ким Дж. В.Причина метаболического ацидоза при длительном хирургическом вмешательстве. Крит Уход Мед. 1999;27:2142–2146. [PubMed] [Google Scholar]
- Fencl V, Leith DE. Количественная кислотно-основная химия Стюарта: приложения в биологии и медицине. Респир Физиол. 1993; 91:1–16. [PubMed] [Google Scholar]
- Джабор А., Казда А. Моделирование кислотно-щелочного равновесия. Acta Anaesth Scand.
 1995; 39 (дополнение 107): 119–122. [PubMed] [Google Scholar]
1995; 39 (дополнение 107): 119–122. [PubMed] [Google Scholar] - Kellum JA. Последние достижения в области кислотно-щелочной физиологии применяются в интенсивной терапии.Ежегодник интенсивной терапии и неотложной медицины. Под редакцией Винсента Дж. Л. Гейдельберг: Springer-Verlag, 1998. стр. 579–587.
- Wilkes P. Гипопротеинемия, SID и кислотно-основное состояние у пациентов в критическом состоянии. J Appl Physiol. 1998; 84: 1740–1748. [PubMed] [Google Scholar]
рН крови | Биониндзя
Понимание:
• Хеморецепторы чувствительны к изменениям рН крови
Водный диоксид углерода может соединяться с водой в плазме крови с образованием угольной кислоты (H 2 CO 3 )
- Затем угольная кислота может терять протоны (H + ) с образованием бикарбоната (HCO1 3 – ) или карбонат (CO 3 2– )
- Высвобожденные ионы водорода снижают pH раствора, делая плазму крови менее щелочной
Хеморецепторы чувствительны к изменениям pH крови и могут запускать реакции организма для поддержания баланса
- Легкие могут регулировать количество углекислого газа в кровотоке путем изменения скорости вентиляции
- Почки могут контролировать реабсорбцию ионов бикарбоната из фильтрата и удалять любой избыток в моча
Регуляция рН крови
Применение:
• рН крови регулируется, чтобы оставаться в узком диапазоне 7.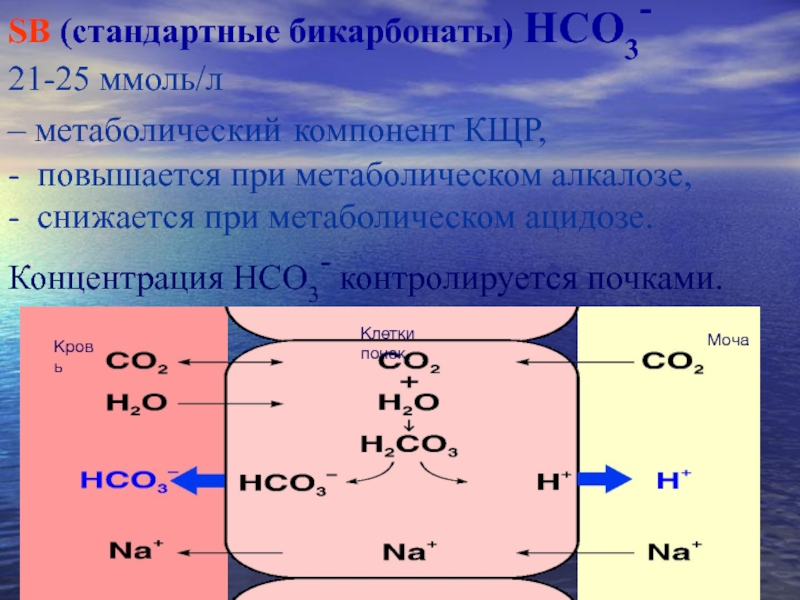 от 35 до 7,45
от 35 до 7,45
Уровень pH крови должен оставаться в пределах очень узкого допустимого диапазона (7,35–7,45), чтобы избежать начала заболевания
- Этот диапазон pH частично поддерживается белками плазмы, которые действуют как буферы
Буферный раствор противостоит изменению pH за счет удаления избытка ионов H + (↑ кислотность) или ионов OH – (↑ щелочность)
- Аминокислоты являются цвиттерионами – они могут иметь как положительный, так и отрицательный заряд
- Аминогруппа может принимать ионы H + , тогда как карбоксильная группа может высвобождать ионы H + (которые образуют воду с ионами OH – )
Плазменные белки в качестве буферов pH
рН в организме человека
рН человеческого тела находится в узком диапазоне между 7.35-7,45, и любые незначительные отклонения от этого диапазона могут иметь серьезные последствия.
Шкала рН Универсальный индикатор рН Цветовая диаграмма диаграмма кислотно-щелочных значений обычных веществ. Изображение предоставлено: Trgrowth / Shutterstock
рН различных жидкостей организма
Хотя рН крови колеблется в пределах 7,35-7,45, рН других жидкостей организма отличается. pH указывает на уровень ионов H+, где низкий pH указывает на слишком много ионов H+, а высокий pH указывает на слишком много ионов OH-.Если уровень pH падает ниже 6,9, это может привести к коме. Однако разные жидкости организма имеют разные значения рН. рН слюны колеблется от 6,5 до 7,5. После проглатывания пища попадает в желудок, где верхний и нижний отделы желудка имеют разные значения рН. Верхняя часть имеет рН 4-6,5, а нижняя часть сильнокислая с рН 1,5-4,0. Затем он попадает в слабощелочной кишечник с рН 7–8,5. Поддержание значений pH в разных регионах имеет решающее значение для их функционирования.
рН желудочно-кишечного тракта. Пищевод, желудок, двенадцатиперстная кишка, тонкая кишка, толстая кишка. Изображение предоставлено: Тимонина / Shutterstock
Изображение предоставлено: Тимонина / Shutterstock
Влияние изменения баланса pH
Различные органы функционируют при оптимальном уровне pH. Например, фермент пепсин требует низкого pH для действия и расщепления пищи, в то время как ферментам в кишечнике для функционирования требуется высокий pH или щелочная среда. Точно так же любое повышение или понижение рН крови может привести к ряду нарушений.
Поддержание pH тела
Уровень pHподдерживается в организме с помощью в основном трех механизмов: буферных систем, контроля дыхания и контроля почек.
Уровень pH рта и тела Play
Буферные системы
Белки входят в состав буферной системы для регулирования уровня pH. Эти белки могут действовать как акцепторы или доноры H+ благодаря наличию основных или кислотных групп. Точно так же фосфатные буферы также помогают снизить уровень pH.Буферы могут помочь в регулировании рН при незначительных физиологических изменениях, например, при задержке дыхания (которая увеличивает содержание СО2 в крови), при физической нагрузке (которая увеличивает содержание молочной кислоты в крови) или при секреции желудочной кислоты.
Респираторный контроль
рН крови в нормальных условиях составляет 7,4. Однако в тканях СО2 диссоциирует на угольную кислоту. Таким образом, присутствие большего количества CO2 делает кровь более кислой. Вот почему, когда мы задерживаем дыхание на длительное время, уровень CO2 в крови повышается, снижая pH, что приводит к обмороку.С другой стороны, при алкалозе или повышенном рН дыхание может стать замедленным, чтобы повысить уровень СО2 и снизить щелочность. Однако низкая частота дыхания также может привести к снижению уровня кислорода, что может быть вредным. Таким образом, дыхание обеспечивает важный контроль для регулирования уровня рН.
Почечный контроль
Почечная система регулирует рН внеклеточной жидкости. Изменения рН, вызванные дыхательной системой, составляют минуты, тогда как изменения, вызванные почечной системой, составляют несколько дней.Если кислотность жидкости высокая, почки выделяют ионы Н+, а при высоком уровне ионов карбоната они удерживают ионы Н+ и секретируют ионы НСО3. Хотя этот процесс медленный, он может оказаться эффективным способом регулирования pH. Одним из ограничений почечной регуляции является то, что рН мочи не может быть ниже 4,4. Так, сильные кислоты могут быть удалены взаимодействием с основными солями фосфорной кислоты или добавлением основания (Nh4) в мочу.
Хотя этот процесс медленный, он может оказаться эффективным способом регулирования pH. Одним из ограничений почечной регуляции является то, что рН мочи не может быть ниже 4,4. Так, сильные кислоты могут быть удалены взаимодействием с основными солями фосфорной кислоты или добавлением основания (Nh4) в мочу.
Нарушения кислотно-щелочного баланса бывают двух типов: ацидоз и алкалоз.При ацидозе pH крови низкий или в крови слишком много кислоты, а при алкалозе pH крови высокий или в крови слишком много щелочи. Ацидоз и алкалоз могут быть вызваны либо дисбалансом кислотно-щелочной секреции почками, либо изменением уровня СО2 в крови из-за нарушений дыхания.
Дополнительное чтение
Анализ газов артериальной крови (ABG)
Обзор испытаний
Анализ газов артериальной крови (ABG) измеряет кислотность (pH) и уровни кислорода и углекислого газа в крови из артерии. Этот тест используется, чтобы выяснить, насколько хорошо ваши легкие способны переносить кислород в кровь и удалять из крови углекислый газ.
Этот тест используется, чтобы выяснить, насколько хорошо ваши легкие способны переносить кислород в кровь и удалять из крови углекислый газ.
Когда кровь проходит через ваши легкие, кислород поступает в кровь, а углекислый газ выходит из крови в легкие. В тесте ABG используется кровь, взятая из артерии, где уровни кислорода и углекислого газа могут быть измерены до того, как они попадут в ткани организма. ABG меры:
- Парциальное давление кислорода (PaO2).
Он измеряет давление кислорода, растворенного в крови, и то, насколько хорошо кислород может перемещаться из воздушного пространства легких в кровь.
- Парциальное давление двуокиси углерода (PaCO2).
Он измеряет давление углекислого газа, растворенного в крови, и то, насколько хорошо углекислый газ может выводиться из организма.
- рН.
pH измеряет ионы водорода (H+) в крови.
 рН крови обычно составляет от 7,35 до 7,45. рН менее 7,0 называется кислотным, а рН более 7.0 называется основным (щелочным). Таким образом, кровь немного проста.
рН крови обычно составляет от 7,35 до 7,45. рН менее 7,0 называется кислотным, а рН более 7.0 называется основным (щелочным). Таким образом, кровь немного проста.- Бикарбонат (HCO3).
Бикарбонат — это химическое вещество (буфер), которое не дает pH крови стать слишком кислой или слишком щелочной.
- Значения содержания кислорода (O2CT) и насыщения кислородом (O2Sat).
Содержание O2 измеряет количество кислорода в крови. Насыщение кислородом измеряет, какая часть гемоглобина в красных кровяных тельцах переносит кислород (O2).
Кровь для анализа ГАК берется из артерии. Большинство других анализов крови делается на образце крови, взятом из вены, после того как кровь уже прошла через ткани организма, где расходуется кислород и образуется углекислый газ.
Почему это делается
Анализ газов артериальной крови (ABG) проводится для:
- Проверьте наличие серьезных проблем с дыханием и заболеваний легких, таких как астма, кистозный фиброз или хроническая обструктивная болезнь легких (ХОБЛ).

- Посмотрите, насколько хорошо работает лечение легочных заболеваний.
- Узнайте, нужен ли вам дополнительный кислород или помощь с дыханием (механическая вентиляция легких).
- Узнайте, получаете ли вы необходимое количество кислорода, когда используете кислород в больнице.
- Измерение кислотно-щелочного уровня в крови у людей с сердечной недостаточностью, почечной недостаточностью, неконтролируемым диабетом, нарушениями сна, тяжелыми инфекциями или с передозировкой лекарств.
Как подготовить
- Если вы принимаете аспирин или какой-либо другой препарат для разжижения крови, спросите своего врача, следует ли вам прекратить его прием перед анализом. Убедитесь, что вы точно понимаете, чего хочет от вас врач. Эти лекарства увеличивают риск кровотечения.
- Сообщите своему врачу ВСЕ лекарства, витамины, добавки и растительные лекарственные средства, которые вы принимаете.
 Некоторые из них могут увеличить риск возникновения проблем во время теста.Ваш врач скажет вам, следует ли вам прекратить прием какого-либо из них перед тестом и как скоро это сделать.
Некоторые из них могут увеличить риск возникновения проблем во время теста.Ваш врач скажет вам, следует ли вам прекратить прием какого-либо из них перед тестом и как скоро это сделать. - Не курите непосредственно перед тестом и не вдыхайте пассивный дым.
Как это делается
Если вы проходите оксигенотерапию, подачу кислорода можно отключить за 20 минут до анализа крови. Это называется тестом «комнатный воздух». Но если вы не можете дышать без кислорода, кислород не отключится.
Образец крови из артерии обычно берут с внутренней стороны запястья (лучевая артерия).Но его также можно взять из артерии в паху (бедренная артерия) или на внутренней стороне руки выше локтевого сгиба (плечевая артерия).
Если кровь берут из запястья, вы будете сидеть с вытянутой рукой, а запястье будет лежать на небольшой подушке. Медицинский работник, берущий кровь, может вращать вашу руку вперед и назад и нащупывать пульс на запястье.
Процедура, называемая тестом Аллена, может быть выполнена, чтобы убедиться, что приток крови к вашей руке нормальный.Тест ABG не будет проводиться на руке, используемой для диализа, или при наличии инфекции или воспаления в области места пункции.
Каково это
Забор крови из артерии более болезненный, чем из вены. Это потому, что артерии глубже и окружены нервами.
- Во время забора крови из артерии вы можете почувствовать головокружение, слабость, головокружение или тошноту.
- Большинство людей испытывают короткую острую боль, когда игла для взятия образца крови входит в артерию.Если вы получаете местную анестезию, вы можете вообще ничего не почувствовать от укола иглой. Или вы можете почувствовать кратковременное покалывание или пощипывание, когда игла проходит через кожу.
- Вы можете чувствовать больше боли, если человек, берущий у вас кровь, с трудом находит вашу артерию, если ваша артерия сужена или если вы очень чувствительны к боли.

Риски
Маловероятно, что у вас возникнут проблемы при взятии образца крови из артерии.
- На этом месте может появиться небольшой синяк.Вы можете снизить вероятность появления синяков, удерживая давление на месте в течение как минимум 10 минут после извлечения иглы (дольше, если у вас проблемы с кровотечением или вы принимаете препараты, разжижающие кровь).
- В редких случаях игла может повредить нерв или артерию. Это может привести к закупорке артерии.
Результаты
Обычный
Каждая лаборатория имеет свой диапазон нормы. В вашем лабораторном отчете должен быть указан диапазон, который ваша лаборатория использует для каждого теста.Нормальный диапазон — это всего лишь ориентир. Ваш врач также рассмотрит ваши результаты в зависимости от вашего возраста, состояния здоровья и других факторов. Значение, которое не находится в нормальном диапазоне, может быть нормальным для вас.
Результаты обычно доступны сразу.
Также обычно указывается концентрация вдыхаемого кислорода, называемая долей вдыхаемого кислорода (FiO2). Это полезно только в том случае, если вы получаете кислородную терапию из баллона или подключены к аппарату искусственной вентиляции легких.
Многие условия могут изменить уровень газов в крови.Ваш врач обсудит с вами любые аномальные результаты, которые могут быть связаны с вашими симптомами и прошлым состоянием здоровья.
Кредиты
Актуально на: 26 октября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E. Gregory Thompson MD – Терапия
Adam Husney MD – Семейная медицина
Elizabeth T.Russo MD — Терапия
Актуально на: 26 октября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E. Грегори Томпсон, доктор медицинских наук, внутренние болезни и Адам Хасни, доктор медицинских наук, семейная медицина, и Элизабет Т. Руссо, доктор медицинских наук, внутренние болезни
Резус-белок предотвращает закисление крови
Семейство факторов группы крови играет роль в контроле pH.
У вас есть полный доступ к этой статье через ваше учреждение.
Белок, относящийся к резус-группе крови, не дает крови становиться слишком кислой. Кредит: Гетти
Белок, аналогичный антигенам резус-фактора, которые используются для определения безопасности переливаний крови, удаляет кислоту из крови и может также играть роль в регулировании pH в других частях тела 1 .
Открытие, сделанное Анной Марией Марини из Свободного университета Брюсселя в Бельгии и ее коллегами, может привести к новым методам лечения одного типа заболевания почек и может даже помочь в борьбе с некоторыми формами мужского бесплодия.
Серная и фосфорная кислоты попадают в кровь, когда клетки расщепляют белки, которые не нужны организму. Кровь обычно слабощелочная (рН 7,4), и даже небольшие изменения ее рН могут быть опасны. Почки обычно удаляют избыток кислоты, выделяя ионы водорода (H + ) и аммиак (NH 3 ) с мочой с образованием аммония (NH 4 + ).
Исследователи знали, что ионы водорода активно выкачиваются из клеток почек, но думали, что растворенный аммиак просто диффундирует через мембрану жировых клеток и попадает в мочу.
Тем не менее, команда Марини показала, что Rhcg, член семейства белков резус-фактора, наиболее известным представителем которого является резус-антиген на красных кровяных тельцах, отвечает за удаление большей части аммиака из клеток почек. Исследователи отключили ген у мышей, чтобы остановить выработку белка Rhcg, и обнаружили, что моча этих животных содержит примерно на одну пятую меньше аммония, чем у обычных мышей.
Исследователи отключили ген у мышей, чтобы остановить выработку белка Rhcg, и обнаружили, что моча этих животных содержит примерно на одну пятую меньше аммония, чем у обычных мышей.
Уровень pH крови мышей, у которых отсутствовал Rhcg, также резко снижался, когда им давали больше кислоты в рационе, и оставался опасно низким — проблема, которая затрагивает людей с формой заболевания почек, известной как ацидоз дистальных почечных канальцев. Марини считает, что ее мыши с нокаутом Rhcg могут быть полезной лабораторной моделью заболевания.
Результат не стал полной неожиданностью для Марини. В 1994 году она и ее коллеги идентифицировали ген белка, транспортирующего аммоний, в клетках дрожжей 2 , и с тех пор другие члены этого семейства белков Mep-Amt были обнаружены у всех беспозвоночных, а также у растений, бактерий и дрожжи.Далее она также показала, что между ними и белками резус-фактора есть сходство, что предполагает их сходную биологическую роль.
Однако, когда другая группа из Франции удалила ген другого белка резус-фактора, Rhbg, который также обнаружен в клетках почек, это не повлияло на способность клеток удалять аммиак из тел мышей 3 . Несмотря на неудачу с идеей Марини, ее группа вывела Rhcg из строя и показала, что он необходим для нормального транспорта аммиака из клеток.
Несмотря на неудачу с идеей Марини, ее группа вывела Rhcg из строя и показала, что он необходим для нормального транспорта аммиака из клеток.
В своей новой работе, которая опубликована в журнале Nature , Марини и ее коллеги также показали, что самцы мышей без Rhcg давали пометы, которые были примерно на 10% меньше, чем у нормальных мышей. Она полагает, что это может быть связано с тем, что белок поглощает ионы аммония в яичках и не дает окружающей среде становиться слишком кислой для правильного созревания сперматозоидов.
«Наши исследования показывают, что Rhcg играет важную роль в кислотно-щелочном балансе в почках и яичках, но нам также необходимо изучить этот белок в других тканях — эта работа — только отправная точка», — добавляет она.
Дэвид Вайнер, профессор медицины медицинского факультета Университета Флориды, является одним из авторов статьи, которая в настоящее время находится в печати, подтверждающей выводы 4 . «Метаболизм аммиака является критически важной характеристикой нормальной функции тканей во всем организме», — говорит он. «Это захватывающие открытия, которые добавляют важную новую информацию к нашему пониманию биологии млекопитающих».
«Это захватывающие открытия, которые добавляют важную новую информацию к нашему пониманию биологии млекопитающих».
Кредит: Гетти
Ссылки
- 1
Бивер, С.и другие. Природа 456, 339–343 (2008).
Артикул Google Scholar
- 2
Марини А. М., Виссерс С., Уррестаразу А. и Андре Б. EMBO J. 13, 3456–3463 (1994).
Артикул Google Scholar
- 3
Chambrey, R. et al. утра. Дж. Физиол. Почечная физиол. 289, F1281–F1290 (2005 г.).
Артикул Google Scholar
- 4
Lee, H. et al. FASEB J. (в печати).
Ссылки для скачивания
Ссылки по теме
Ссылки по теме
Связанные внешние ссылки
Свободный университет Брюсселя
Об этой статье
Процитировать эту статью
Bonner, J.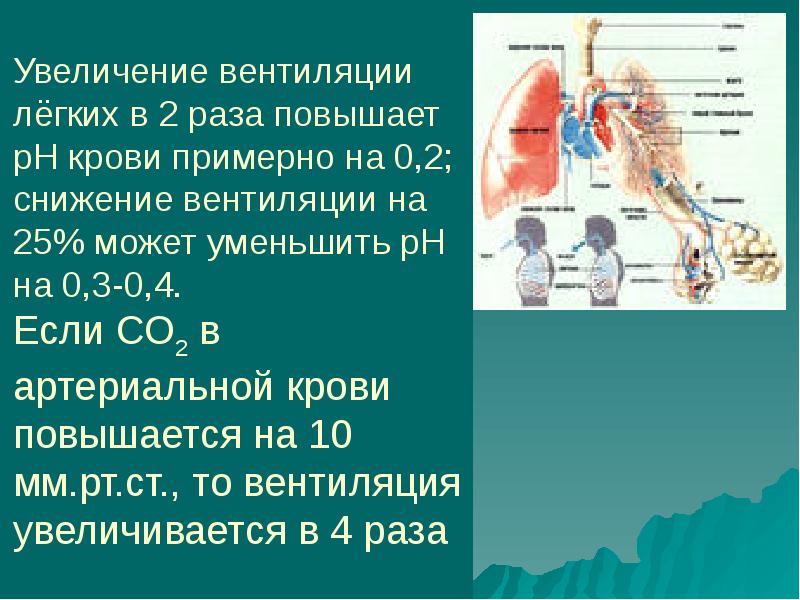 Белок-резус препятствует закислению крови. Природа (2008). https://doi.org/10.1038/news.2008.1241
Белок-резус препятствует закислению крови. Природа (2008). https://doi.org/10.1038/news.2008.1241
Скачать цитату
Поделиться этой статьей
Любой, с кем вы поделитесь следующей ссылкой, сможет прочитать этот контент:
Получить ссылку для общего доступаИзвините, ссылка для общего доступа в настоящее время недоступно для этой статьи.
Предоставлено инициативой Springer Nature SharedIt по обмену контентом.
Кислотно-основные расстройства — Знания @ AMBOSS
Последнее обновление: 12 июля 2021 г.
Резюме
Кислотно-щелочные расстройства представляют собой группу состояний, характеризующихся изменениями концентрации ионов водорода (H + ) или бикарбоната ( HCO 3 — ), которые приводят к изменению рН артериальной крови.Эти состояния можно классифицировать как ацидозы или алкалозы и иметь респираторное или метаболическое происхождение, в зависимости от причины дисбаланса. Диагноз ставится по интерпретации газов артериальной крови (ABG). В условиях метаболического ацидоза расчет анионной щели является важным ресурсом для сужения возможных причин и постановки точного диагноза. Лечение основано на выявлении основной причины.
Диагноз ставится по интерпретации газов артериальной крови (ABG). В условиях метаболического ацидоза расчет анионной щели является важным ресурсом для сужения возможных причин и постановки точного диагноза. Лечение основано на выявлении основной причины.
патофизиология
| Патофизиология кислотно-основных нарушений + [1] | ||||||||
|---|---|---|---|---|---|---|---|---|
| Дыхательный ацидоз | Дыхательный алкалоз | метаболический ацидоз | метаболический алкалоз | |||||
| рН * | ||||||||
| ЦУП 2 | ||||||||
| HCO 3 — | ||||||||
| Механизм |
|
| ||||||
| Общие причины 91 583 |
| |||||||
Диагностика
Обзор
pH и pCO 2 являются наиболее важными лабораторными показателями для оценки кислотно-щелочного состояния любого пациента.
- Шкала pH
- Логарифмическая шкала, выражающая кислотность или щелочность раствора на основе концентрации ионов водорода (pH = -log[H+])
- Нейтральное значение pH равно 7, при этом более низкие значения соответствуют кислым, а более высокие — щелочным.

- Уравнение Хендерсона-Хассельбаха позволяет рассчитать HCO 3 — из pH и pCO 2 : pH = 6.1 + log ([HCO 3 — ] / 0,03 x pCO 2 )
Оценка кислотно-щелочного состояния
[1]Начните с ABG и затем продолжайте 9003 в следующем порядке:
- Оценить pH крови:
- pH (ацидемия): Первичное заболевание – ацидоз.
- pH > 7,45 (алкалемия): первичным заболеванием является алкалоз.
- Оцените pCO 2 (парциальное давление углекислого газа в крови, референсный диапазон: 33–45 мм рт. ст.), чтобы определить, является ли первичное кислотно-щелочное расстройство респираторным или метаболическим:
- рН и рСО 2 изменение в противоположном направлении: нарушение дыхания
- рСО 2 и рН изменяются в одном направлении: нарушение обмена веществ
- Подозревайте смешанное кислотно-щелочное расстройство, если:
- Оценить HCO 3 — (диапазон нормальных значений: 22–28 мэкв/л):
- Оценить pO 2 :
SMORE: изменение pCO 2 в том же направлении, что и pH → Нарушение обмена веществ; изменение рСО 2 в обратном направлении рН → нарушение дыхания
Компенсация (кислотно-щелочная)
[5] [6]- Определение: физиологические изменения, возникающие при нарушениях кислотно-щелочного баланса в попытке поддерживать нормальный рН тела.

- Компенсаторные изменения
- При нарушениях обмена веществ: быстрая компенсация в течение нескольких минут за счет изменения минутной вентиляции
- При респираторных заболеваниях: обычно медленная компенсация в течение от нескольких часов до дней за счет изменения pH мочи
Анионный интервал
Анионный интервал представляет собой разницу между концентрацией неизмеренных анионов и концентрацией неизмеренных катионов.
Расчет
[1]- Анионный интервал = [Неизмеренные анионы] — [Неизмеренные катионы]
- [Неизмеряемые анионы] = [Общие анионы] — [Регулярно измеряемые анионы]
- [Неизмеряемые катионы] = [Общее количество катионов] — [Регулярно измеряемые катионы]
- Поскольку для поддержания электронейтральности требуется, чтобы общая концентрация катионов была приблизительно равна концентрации анионов, формулу анионного зазора можно также выразить следующим образом: анионный зазор = [Обычно измеряемые катионы] — [Обычно измеряемые анионы]
- Если концентрация калия в норме, анионный интервал ≈ [Na + ] — ([Cl — ] + [HCO 3 — ]) (референсный диапазон: 6–12 ммоль/л)
- Если также принимать во внимание уровни калия: анионная щель = ([Na + ] + [K + ]) — ([Cl — ] + [HCO 3 — ]) (ссылка диапазон: 10–16 ммоль/л)
- Увеличение неизмеренных анионов может увеличить анионный интервал (см.
 «Метаболический ацидоз с высоким анионным интервалом» ниже).
«Метаболический ацидоз с высоким анионным интервалом» ниже).
Интерпретация
Причины ацидоза с высоким анионным интервалом (MUDPILES): интоксикация метанолом, уремия, диабетический кетоацидоз, передозировка паральдегида, изониазида или железа, врожденные нарушения обмена веществ, лактоацидоз, интоксикация этиленгликолем, интоксикация салицилатами
3 Casuse
3 нормального анионного разрыва ацидоза (FUSEDCARS): свищ (желчный, поджелудочный), уретерогастральный канал, введение физиологического раствора, эндокринная (болезнь Аддисона, гипер-паратгормон), диарея, ингибитор карбоангидразы, хлорид аммония, почечный канальцевый ацидоз, спиронолактон A ОТРИЦАТЕЛЬНЫЙ анионный разрыв в моче подразумевает потерю бикарбоната через желудочно-кишечный тракт.
Лечение
Лечение нарушений кислотно-щелочного баланса всегда должно устранять основную причину. Некоторые этапы неотложного лечения перечислены ниже. [1]
Каталожные номера
- Каспер Д.
 Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Д.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона .
Макгроу-Хилл Образование
; 2015
Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Д.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона .
Макгроу-Хилл Образование
; 2015 - Tuchscherer J, Rehman H. Метаболический ацидоз при вдыхании толуола. ЦЖЭМ . 2013; 15
(04): стр. 249-252.
дои: 10.2310/8000.2013.130974 . | Открыть в режиме чтения QxMD
- Шпиталь А. Физиологический подход к оценке кислотно-основных нарушений.. N Engl J Med . 2015 г.; 372
(2): стр. 193.
дои: 10.1056/NEJMc1413880 . | Открыть в режиме чтения QxMD
- Meltem AC, Figen C, Nalan MA, et al. Гипокалиемическая мышечная слабость после приема солодки: клинический случай. Журнал дел .2009 г.; 2
(1): стр. 8053.
дои: 10.4076/1757-1626-2-8053. | Открыть в режиме чтения QxMD
- Краут Дж.А., Мадиас Н.Е. Метаболический ацидоз: патофизиология, диагностика и лечение.
 Nature Reviews Нефрология . 2010 г.; 6
(5): стр. 274-285.
doi: 10.1038/nrneph.2010.33. | Открыть в режиме чтения QxMD
Nature Reviews Нефрология . 2010 г.; 6
(5): стр. 274-285.
doi: 10.1038/nrneph.2010.33. | Открыть в режиме чтения QxMD - Джабер С., Паугам С., Футиер Э. и др. Терапия бикарбонатом натрия у пациентов с тяжелой метаболической ацидемией в отделении интенсивной терапии (BICAR-ICU): многоцентровое открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 2018; 392
(10141): стр. 31-40.
doi: 10.1016/s0140-6736(18)31080-8. | Открыть в режиме чтения QxMD
- Костанцо Л.С. Серия обзоров Совета физиологии .
Липпинкотт Уильямс и Уилкинс
; 2014
- Марано М. Оценка ожидаемой вентиляционной реакции на метаболический ацидоз у пациентов с хроническим гемодиализом. Hemodial Int . 2017; 22
(2): стр. 180-183.
дои: 10.1111/хди.12602 . | Открыть в режиме чтения QxMD
- Растегар А. Использование отношения DeltaAG/DeltaHCO3- в диагностике смешанных кислотно-щелочных нарушений. J Am Soc Nephrol . 2007 г.; 18
(9): стр. 2429-31.
doi: 10.1681/ASN.2006121408. | Открыть в режиме чтения QxMD
- Ли С., Кан К.П., Кан С.К. Клиническая польза анионного разрыва в сыворотке. Электролит и кровяное давление: E & BP . 2006 г.; 4
(1): стр. 44-6.
дои: 10.5049/ЕВР.2006.4.1.44. | Открыть в режиме чтения QxMD
- Саджади С.А., Пи А. Гиперфосфатемия, причина метаболического ацидоза с высоким анионным интервалом: отчет о случае и обзор литературы. Американский журнал историй болезни . 2017; 18
: с.463-466.
doi: 10.12659/ajcr.2. | Открыть в режиме чтения QxMD
- Герольд Г. Терапия .
Герольд Г
; 2014
- Кислотная основа онлайн-учебник. http://fitsweb.uchc.edu/student/selectives/TimurGraham/compensatory_responses_respiratory_alkalosis.html .
Обновлено: 21 февраля 2017 г.
Доступ: 21 февраля 2017 г.
- Барретт К.Е., Барман С.М., Бойтано С., Брукс Х.Л. Обзор медицинской физиологии Ганонга (расширенный EB) .
Макгроу Хилл Профессионал
; 2009 г.
Кислотно-основная оценка
Кислотно-основная оценка Нормальные значения
рН = 7.38 — 7.42
[H+] = 40 нМ/л для pH 7,4
PaCO 2 = 40 мм рт.ст.
[HCO 3 ] = 24 мэкв/л
Кислотно-основные определения
Нарушение кислотно-щелочного баланса считается присутствующим, если есть аномалия в
HCO 3 или PaCO 2 или pH.
Ацидоз и алкалоз относятся к расстройствам in vivo, а не к
изменение рН.
Ацидемия (pH < 7,38) и алкалемия (pH > 7,42) относятся к
нарушение рН крови.
Почки и дыхательная система играют ключевую роль в поддержании кислотности
базовый статус.
Первичные нарушения кислотно-основного состояния
Метаболический ацидоз потеря [HCO 3 ] 0r
добавление [H+] Метаболический алкалоз потеря [H+] или добавление
[HCO 3 ]
Респираторный ацидоз увеличение pCO 2 Респираторный алкалоз снижение pCO 2
Необходимые лабораторные значения/информация
- Газы артериальной крови: pH, PaCO 2 , PaO 2 , Sat, CO
- Электролиты: Na, K, Cl, HCO 3
- АМК, глюкоза, креатинин
- FIO2 и история болезни
Анион и катионы
АНИОНЫ
КАТИОНЫ
Хлорид Натрий Бикарбонат (общий CO 2 ) Калий Белки Кальций Органические кислоты Магний Фосфаты Сульфаты
Электрохимический баланс означает, что общее количество анионов такое же, как
Всего катионов.Для практических целей анионный зазор рассчитывается с использованием только натрия,
Хлориды и общий CO 2 .((140-(104+24)) = 12.
Компенсационные меры
Буферизация — происходит немедленно
Дыхательная регуляция pCO 2 есть
средний (12-24 часа)
Происходит почечная регуляция [H] и [HCO 3 ]
медленнее (несколько дней)
Внеклеточный
- почти полностью за счет бикарбоната, концентрация которого самая высокая из
все буфера
- небольшой вклад фосфатов
Внутриклеточный
- Гемоглобин может непосредственно буферировать протоны
- Вход H+ в эритроциты совпадает с выходом Na и K+
- Гемоглобин может непосредственно буферизировать растворенный
- внутриклеточная конверсия
Буферные системы
- Гемоглобин может непосредственно буферировать протоны
- Вход H+ в эритроциты совпадает с выходом Na и K+
- Гемоглобин может непосредственно буферизировать растворенный
- внутриклеточная конверсия
Бикарбонатная буферная система
Рассчитанный бикарбонат:
Всего CO 2 :
измерено по венозной крови
включает бикарбонат и растворенный диоксид углерода
работает немного выше расчетного значения из
номограмма
Первичные изменения в бикарбонатах приводят к метаболической кислоте
базовое расстройство.
Метаболическая компенсация
- Респираторный ацидоз
- Острый: ожидаемое снижение pH = 0,08 x (измеренное PaCO 2 — 40)
- Хроническая: ожидаемое падение pH = 0,03 x (измеренное PaCO 2 — 40)
- Респираторный алкалоз
Компенсация почти завершена
Анионная щель (AG)
- Сумма катионов минус анионы
- (Na+K)-(CL+HCO 3 )
- Использовать измеренный общий CO2 из венозной крови как HCO 3
- анионная щель является артефактом, поскольку некоторые анионы не измеряются
- разрыв в основном из-за неизмеренных белков, фосфатов и сульфатов
- Нормальный анионный интервал составляет 8–12 мэкв/л (зависит от лаборатории)
Бикарбонатный зазор
- полезен для выявления смешанных кислотно-щелочных расстройств
- при одном кислотно-щелочном расстройстве разница между анионной щелью и
изменение общего количества CO 2 должно быть незначительным
- другими словами изменение общего количества CO 2 (нормальное общее
CO 2 — наблюдаемая сумма CO 2 ) должна быть равна анионному интервалу.
- Избыточный бикарбонатный разрыв предполагает метаболический алкалоз
- Уменьшение разрыва свидетельствует о метаболическом ацидозе
Почечная регуляция [H+] и [HCO 3 ]
Две основные функции
- Регенерация отфильтрованного бикарбоната
- Выделение кислоты
- титруемая кислотность
- образование аммония
- свободное выделение H+
Замена бикарбоната для PaCO 2 замены
Гиповентиляция:
- Ожидаемое повышение уровня бикарбоната при хронической задержке CO 2 (Почечная компенсация)
- 0.35 x (текущий PaCO2-нормальный PaCO 2 )
- 0,35 х(60-40)=0,35×20=7 мэкв/л
- Ожидаемое снижение бикарбоната при острой задержке CO 2 (буферизация)
Гипервентиляция:
- Ожидаемое снижение содержания бикарбонатов при резком снижении PaCO 2 (буферизация) составляет 0,2 x (нормальный PaCO2, наблюдаемый PaCO2)
- Ожидаемое снижение содержания биуглеводов при хроническом снижении PaCO2
(Почечная компенсация): 0.5 x (нормальный PaCO2, наблюдаемый PaCO2)
Вентиляция и pCO 2 отношения
- PaCO 2 обратно пропорциональна вентиляции
- Увеличение вентиляции в ответ на снижение pH
- дыхательный центр в мозговом веществе
- реагирует на «промежуточный» pH между значениями CSF и
плазма
- ответ быстрый
- реакция более предсказуема при снижении pH
- при повышении pH вентиляция снижается только при тяжелых
и затяжной
Взаимосвязь между pH и pCO2
рН pCO 2 7.10 79 70 7,20 63 60 7,3 50 50 7,5 32 30
Эту формулу можно использовать, потому что в диапазоне значений pH мы обычно
справляться с этим, существует почти линейная зависимость между pH и pCO2.
Связь между pH и острым CO 2 изменения
Мы можем ожидать почти линейную связь между pH и острым CO 2 изменения
рН ПаСО 2 7,4 40 7,3 50 7.5 30
Респираторная компенсация для основания метаболической кислоты
возмущение
- Метаболический ацидоз
- Снижение PaCO2 в 1,2 раза по сравнению с падением [H+]
- Вы можете использовать следующую сырую формулу 0,1 изменение pH
10 мм замена PaCO 2 .
- Если все остальное в порядке, PaCO 2 должен быть таким же, как
десятичные значения pH i.е. для pH 7,28 уровни CO 2 будет 28 мм рт.
Ацидоз усиливает дыхательную активность, альвеолярную вентиляцию и
избавляется от углекислоты.
Дыхательная система никогда не может полностью компенсировать метаболические
дефект.
Респираторная компенсация пытается поддерживать рН в разумных пределах.
диапазон.
- Метаболический алкалоз
- Только в тяжелых и затяжных случаях
- Необычно видеть удержание CO 2 (не согласен
с книгами и др.)
- Менее предсказуемый
Компенсация никогда не бывает полной.Если pH в норме, вероятно,
наложенное второе кислотно-щелочное нарушение. Оценка ожидаемого PaCO 2 для данного кислого рН также позволяет нам определить,
компенсация соответствующая.
Высокий анионный интервал метаболический
Ацидоз
Обычно от добавления кислоты
- Кетоацидоз
- Лактоацидоз
- Проглатывание
- АСА
- Этиленгликоль
- Метанол
- Почечная недостаточность
- неспособность выделять кислоту
Нормальный анионный разрыв Метаболический ацидоз
Болезнь почек
Проксимальная или дистальная ПТА
Почечная недостаточность (потеря HCO3)
Гипоальдостеронизм / К+сберегающие диуретики
Потеря щелочи
Диарея
Уретеросигмоидостомия
Проглатывание
Ингибиторы карбоангидразы
Метаболический алкалоз
- Рвота/отсасывание желудка
- Контракционный алкалоз
- Постгиеркапнический алкалоз
- Гиперренинизм
- Гипокалиемия
- Цирроз печени с асцитом
- Избыток кортикоидов
- Массивное переливание крови
Респираторный ацидоз
Обструктивная болезнь легких
Угнетение дыхательного центра (лекарственные препараты, анестезия)
Пиквикский синдром/синдром апноэ во сне
Кифосколиоз
Конечная стадия рестриктивной болезни легких1 104 19
Респираторный алкалоз
Беспокойство / Боль
Аспирин Лихорадка
Сепсис Гипоксемия
Беременность Печеночная недостаточность
Вентилятор индуцированное
диффузного интерстициального фиброза
Почечная регуляция [H+] и [HCO 3 ]
- глупая почка обычно лучше умного доктора
- Регенерация фильтрованного бикарбоната
- 4000 мэкв/день у здоровых людей
- наибольшее использование секретируемых кислот
Почечная регуляция [H+] и [HCO 3 ]
Выделение кислоты
- Титруемая кислотность
- в основном с фосфатом
- 10-30 мэкв/день
- Образование аммиака
- H+ соединяется с N3HO из Nh5+, который попадает в ловушку
трубочка
- базовый уровень 30-60 мэкв/день, но может повышаться до 250-400
мэкв/день
Почечная регуляция [H+] и [HCO 3 ]
Выделение свободного [H]
- максимально подкисленная моча — pH = 4.5 — будет учитываться
только 0,04 мэкв +H/L
- Подкисление мочи важно для титрования протонов в
фосфат и аммоний
Почечная регуляция [H+] и [HCO 3 ]
Выделение кислоты, стимулированное
- Ацидемия
- Гиперкапния
- Истощение объема
- Истощение содержания хлоридов
- ? Гипокалиемия
- Альдостерон
Почечная регуляция [H+] и [HCO 3 ]
Выделение кислоты ингибируется
- Алкалиемия
- Надземный [HCO3]
- Гипокапния
- ? Гиперкалиемия
Почечная регуляция [H+] и [HCO 3 ]
Две основные функции
- Регенерация отфильтрованного бикарбоната
- Выделение кислоты
- Титруемая кислотность
- образование аммония
- свободное выделение H+
Подход к интерпретации кислотно-щелочного нарушения
- Является ли пациент ацидным или алкалемическим
- Определите основное кислотно-щелочное расстройство путем оценки HCO 3 и PaCO 2
Что такое [HCO 3 ]
- Повышенный —— Метаболический алкалоз при алкалозе
- Пониженный —- Метаболический ацидоз при ацидозе
Что такое PaCO 2
- Повышенный — Респираторный ацидоз при ацидозе
- Пониженный — Респираторный алкалоз при алкалозе
- Что такое анионная щель (для определения этиологии метаболического ацидоза)
- Что такое бикарбонатный разрыв (для оценки смешанных расстройств)
- Является ли степень компенсации такой, какой вы ожидаете (соответствующей)?
.
 Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Д.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона .
Макгроу-Хилл Образование
; 2015
Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Д.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона .
Макгроу-Хилл Образование
; 2015 Nature Reviews Нефрология . 2010 г.; 6
(5): стр. 274-285.
doi: 10.1038/nrneph.2010.33. | Открыть в режиме чтения QxMD
Nature Reviews Нефрология . 2010 г.; 6
(5): стр. 274-285.
doi: 10.1038/nrneph.2010.33. | Открыть в режиме чтения QxMDпотеря [H+] или добавление [HCO 3 ]
АНИОНЫ
КАТИОНЫ
Буферизация — происходит немедленно
Дыхательная регуляция pCO 2 есть средний (12-24 часа)
Происходит почечная регуляция [H] и [HCO 3 ] медленнее (несколько дней)
- Вход H+ в эритроциты совпадает с выходом Na и K+
- Вход H+ в эритроциты совпадает с выходом Na и K+
измерено по венозной крови
включает бикарбонат и растворенный диоксид углерода
работает немного выше расчетного значения из номограмма
- Острый: ожидаемое снижение pH = 0,08 x (измеренное PaCO 2 — 40)
- Хроническая: ожидаемое падение pH = 0,03 x (измеренное PaCO 2 — 40)
- Сумма катионов минус анионы
- (Na+K)-(CL+HCO 3 )
- Использовать измеренный общий CO2 из венозной крови как HCO 3
- анионная щель является артефактом, поскольку некоторые анионы не измеряются
- разрыв в основном из-за неизмеренных белков, фосфатов и сульфатов
- Нормальный анионный интервал составляет 8–12 мэкв/л (зависит от лаборатории)
- титруемая кислотность
- образование аммония
- свободное выделение H+
- 0.35 x (текущий PaCO2-нормальный PaCO 2 )
- 0,35 х(60-40)=0,35×20=7 мэкв/л
- дыхательный центр в мозговом веществе
- реагирует на «промежуточный» pH между значениями CSF и плазма
- ответ быстрый
- реакция более предсказуема при снижении pH
- при повышении pH вентиляция снижается только при тяжелых и затяжной
- Снижение PaCO2 в 1,2 раза по сравнению с падением [H+]
- Вы можете использовать следующую сырую формулу 0,1 изменение pH 10 мм замена PaCO 2 .
- Если все остальное в порядке, PaCO 2 должен быть таким же, как десятичные значения pH i.е. для pH 7,28 уровни CO 2 будет 28 мм рт.
Ацидоз усиливает дыхательную активность, альвеолярную вентиляцию и избавляется от углекислоты.
Дыхательная система никогда не может полностью компенсировать метаболические дефект.
Респираторная компенсация пытается поддерживать рН в разумных пределах. диапазон.
- Только в тяжелых и затяжных случаях
- Необычно видеть удержание CO 2 (не согласен с книгами и др.)
- Менее предсказуемый
Обычно от добавления кислоты
- АСА
- Этиленгликоль
- Метанол
- неспособность выделять кислоту
Болезнь почек
Проксимальная или дистальная ПТА
Почечная недостаточность (потеря HCO3)
Гипоальдостеронизм / К+сберегающие диуретики
Потеря щелочи
Диарея
Уретеросигмоидостомия
Проглатывание
Ингибиторы карбоангидразы
Обструктивная болезнь легких
Угнетение дыхательного центра (лекарственные препараты, анестезия)
Пиквикский синдром/синдром апноэ во сне
Кифосколиоз
Конечная стадия рестриктивной болезни легких1 104 19
Беспокойство / Боль
Аспирин Лихорадка
Сепсис Гипоксемия
Беременность Печеночная недостаточность
Вентилятор индуцированное
диффузного интерстициального фиброза
- 4000 мэкв/день у здоровых людей
- наибольшее использование секретируемых кислот
- в основном с фосфатом
- 10-30 мэкв/день
- H+ соединяется с N3HO из Nh5+, который попадает в ловушку трубочка
- базовый уровень 30-60 мэкв/день, но может повышаться до 250-400 мэкв/день
- Титруемая кислотность
- образование аммония
- свободное выделение H+
Что такое [HCO 3 ]
- Повышенный —— Метаболический алкалоз при алкалозе
- Пониженный —- Метаболический ацидоз при ацидозе
Что такое PaCO 2
- Повышенный — Респираторный ацидоз при ацидозе
- Пониженный — Респираторный алкалоз при алкалозе





 Они выводятся из организма почками. При нарушении функционирования почек может наблюдаться повышение данных показателей. Поражение почек может приводить к изменениям кислотно-щелочного баланса в организме.
Они выводятся из организма почками. При нарушении функционирования почек может наблюдаться повышение данных показателей. Поражение почек может приводить к изменениям кислотно-щелочного баланса в организме.
 Scand J Clin Lab Invest. 1993; 53 (доп. 214): 99–104. [PubMed] [Google Scholar]
Scand J Clin Lab Invest. 1993; 53 (доп. 214): 99–104. [PubMed] [Google Scholar] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] Кислотно-щелочной обмен: новый подход. Ланцет. 1960; я: 1035–1039. [PubMed] [Google Scholar]
Кислотно-щелочной обмен: новый подход. Ланцет. 1960; я: 1035–1039. [PubMed] [Google Scholar] [PubMed] [Google Scholar]
[PubMed] [Google Scholar] J Крит Уход. 1995; 10:51–55. [PubMed] [Google Scholar]
J Крит Уход. 1995; 10:51–55. [PubMed] [Google Scholar] Избранные темы почечной науки. Под редакцией Берлина GM. Внести нефрол. Базель: Каргер, 1992. стр. 58–88.
Избранные темы почечной науки. Под редакцией Берлина GM. Внести нефрол. Базель: Каргер, 1992. стр. 58–88. [Google Scholar]
[Google Scholar] 1995; 39 (дополнение 107): 119–122. [PubMed] [Google Scholar]
1995; 39 (дополнение 107): 119–122. [PubMed] [Google Scholar] рН крови обычно составляет от 7,35 до 7,45. рН менее 7,0 называется кислотным, а рН более 7.0 называется основным (щелочным). Таким образом, кровь немного проста.
рН крови обычно составляет от 7,35 до 7,45. рН менее 7,0 называется кислотным, а рН более 7.0 называется основным (щелочным). Таким образом, кровь немного проста.
 Некоторые из них могут увеличить риск возникновения проблем во время теста.Ваш врач скажет вам, следует ли вам прекратить прием какого-либо из них перед тестом и как скоро это сделать.
Некоторые из них могут увеличить риск возникновения проблем во время теста.Ваш врач скажет вам, следует ли вам прекратить прием какого-либо из них перед тестом и как скоро это сделать.
 г., на большой высоте)
г., на большой высоте)

 «Метаболический ацидоз с высоким анионным интервалом» ниже).
«Метаболический ацидоз с высоким анионным интервалом» ниже).