Поджелудочная железа человека: Поджелудочная железа и симптомы заболевания
Поджелудочная железа и симптомы заболевания
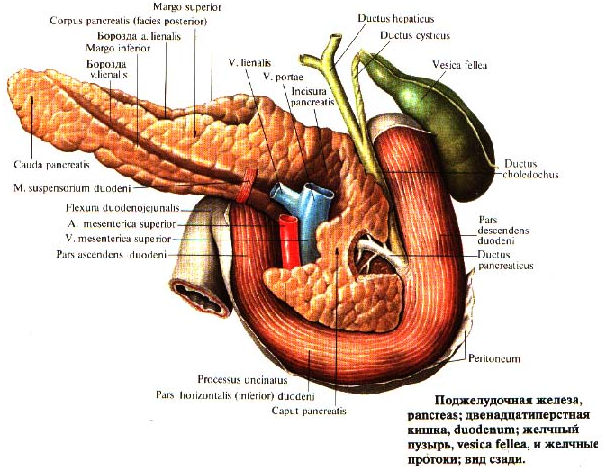
Поджелудочная железа считается ключевым органом эндокринной и пищеварительной систем. Название она получила из-за своего расположения под желудком (в верхней части брюшной полости). Эту железу разделяют на три части. Широкий конец называют головкой, среднюю часть – телом, а узкий конец – хвостом.
Каковы функции поджелудочной железы?
Поджелудочной железой выполняются две важные функции.
- Она вырабатывает энзимы (пищеварительные ферменты) и выделяет их в двенадцатиперстную кишку. Энзимы в пищеварительном тракте разлагают углеводы, белки и жиры. Это так называемая экзокринная функция.
- Еще одна функция — эндокринная, которую выполняют бета-клетки островков Лангерганса, вырабатывая инсулин (гормон), и альфа-клетки, вырабатывая глюкагон. Инсулин контролирует уровень глюкозы (сахара) в крови. Он действует при гипергликемии (высоком содержании сахара в крови), а глюкагон устраняет гипогликемию (недостаток сахара в крови).
 Инсулин способствует также усвоению глюкозы в печени, где та хранится в виде гликогена, а затем и используется при стрессе и физических нагрузках. Когда островки Лангерганса производят мало инсулина, уровень глюкозы поднимается и возникает риск развития сахарного диабета и др.
Инсулин способствует также усвоению глюкозы в печени, где та хранится в виде гликогена, а затем и используется при стрессе и физических нагрузках. Когда островки Лангерганса производят мало инсулина, уровень глюкозы поднимается и возникает риск развития сахарного диабета и др.
Каковы симптомы заболеваний поджелудочной железы?
Проблемы железы проявляются определенными симптомами:
- боль в верхней части живота, в спине
- тошнота
- рвота
- вспучивание живота
- понос
- потеря аппетита
- высыпания (пятна) на коже в области поджелудочной железы и др.
Распространенных заболеваниях поджелудочной железы
Панкреатит
Острый панкреатит – это воспаление поджелудочной железы, возникшее стремительно.
Заболевание возникает, когда выход синтезируемых ею ферментов из железы затруднен и происходит «самопереваривание» органа, вызывающее острую боль.
Наиболее частые причины возникновения острого панкреатита: инфекции, злоупотребление алкоголем и камни в желчном пузыре, попадающие в желчевыводящие пути (поджелудочная железа соединена с желчевыводящими протоками в месте впадения в двенадцатиперстную кишку) и блокирующие выход ферментов. Другие факторы: прием некоторых препаратов, повреждения железы (физические), эпидемический паротит и рак поджелудочной железы.
Другие факторы: прием некоторых препаратов, повреждения железы (физические), эпидемический паротит и рак поджелудочной железы.
Хронический панкреатит – это вялотекущие, периодически повторяющиеся обострения воспаления поджелудочной железы. При обострении появляются симптомы острого панкреатита, а в фазе ремиссии – в основном, пищеварительные расстройства.
При лечении панкреатита следует провести терапию болезней, которые могли стать причиной хронического воспаления. Важно отказаться от употребления алкоголя. Если в желчном пузыре есть камни, наш доктор направит вас на их удаление.
Врач назначает препараты, уменьшающие выделение желудочного сока, а также ферментные средства, не содержащие компоненты желчи. Рекомендуется поголодать первые несколько дней лечения. Разрешено употреблять негазированные щелочные минеральные воды, некрепкий чай.
Доброкачественные новообразования
Кисты располагаются непосредственно в поджелудочной железе или в окружающих тканях.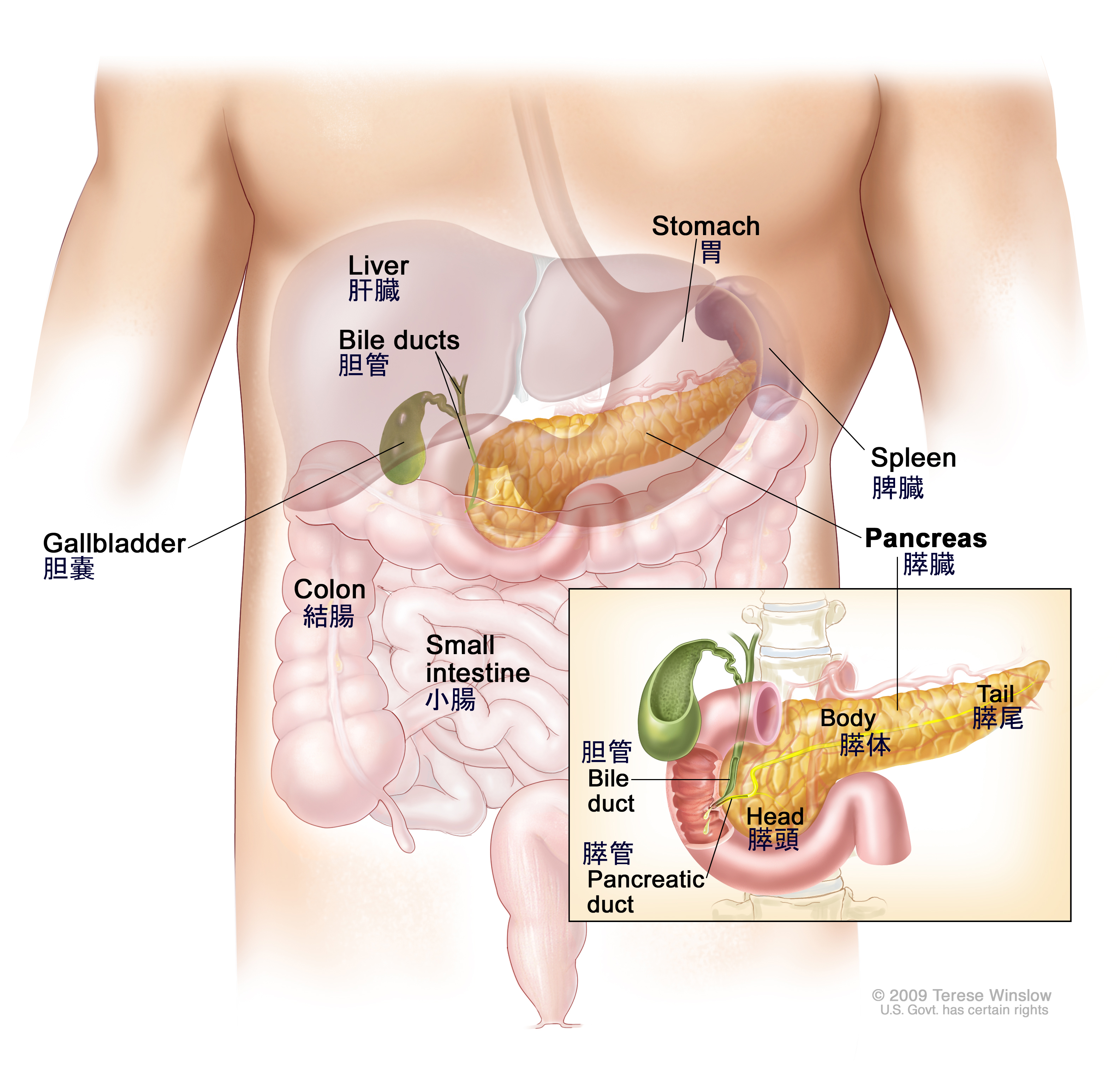 Они часто вызывают боли и сдавливание протоков, поэтому должны быть удалены. В железе появляются и доброкачественные опухоли (фибромы, липомы, аденомы и т.д.), которые тоже удаляют хирургическим путем.
Они часто вызывают боли и сдавливание протоков, поэтому должны быть удалены. В железе появляются и доброкачественные опухоли (фибромы, липомы, аденомы и т.д.), которые тоже удаляют хирургическим путем.
Рак поджелудочной железы
Рак обычно поражает клетки основного протока железы и распространяется на тело органа.
К факторам риска относят курение, хронический панкреатит и возраст старше 65 лет. Запущенный рак поджелудочной железы способен распространиться на органы брюшной полости, привести к летальному исходу.
Для лечения используются хирургические методы, химиотерапия, лучевая терапия и пожизненное введение инсулина и др.
Диагностика
Диагностику заболеваний поджелудочной железы проводят, чтобы выявить особенности патологического процесса. Наши доктора-гастроэнтерологи используют разные методы:
- УЗИ
- 13С-дыхательный тест
- секретин-панкреозиминовый тест
- определение эластазы в кале
- исследование показателей крови и др.

Профилактика заболеваний поджелудочной железы
Следует помнить, что на функционирование железы наиболее негативно влияет алкоголь, курение, нерегулярный прием пищи, жареная, острая и жирная пища. Всего этого следует избегать. Рацион питания должен быть здоровым. Принимать пищу нужно по четыре-пять раз в день, также важна умеренность в еде.
К заболеваниям поджелудочной железы следует серьезно относиться и обязательно всесторонне обследоваться, чтобы получить оптимальное лечение.
Наша клиника предлагает современные способы диагностики с консультацией опытных специалистов для лечения заболеваний поджелудочной железы. Не откладывайте на потом и запишитесь на прием к гастроэнтерологу прямо сейчас.
Заболевание поджелудочной железы
Поджелудочная железа (ПЖ) является секреторным органом, который выделяет панкреатический секрет, содержащий ферменты, в двенадцатиперстную кишку (ДПК)1,2. Данное свойство поджелудочной железы называется экзокринной функцией поджелудочной железы.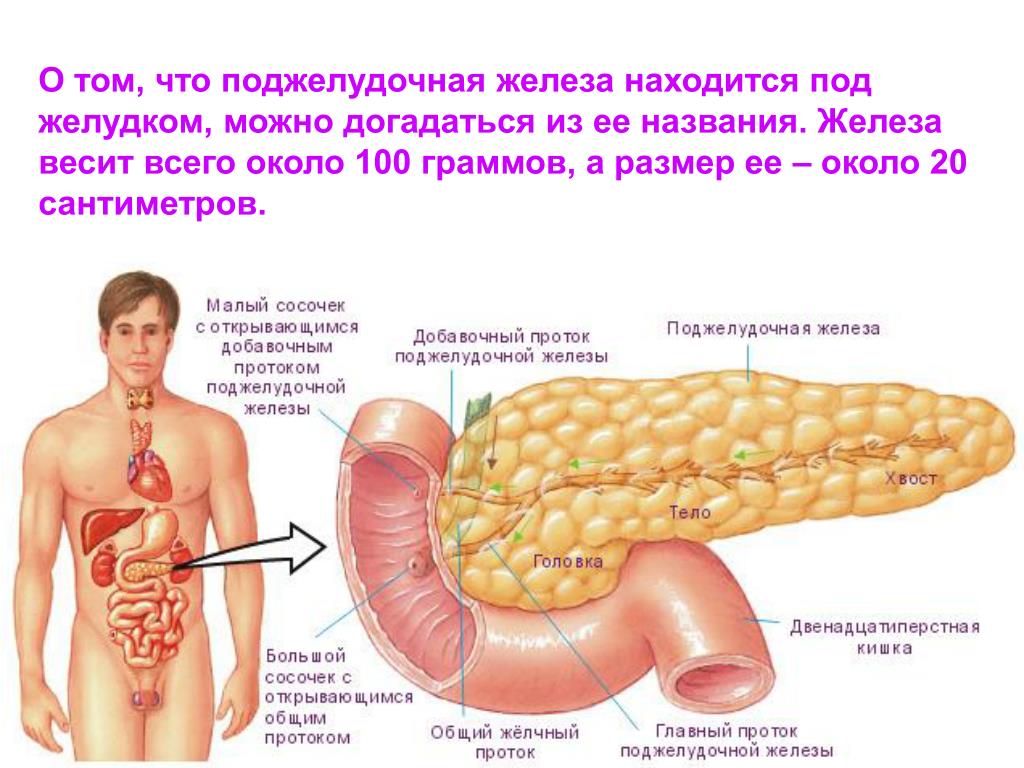 ферменты, содержащиеся в секрете, смешиваясь с пищей, обеспечивают нормальное пищеварение и усвоение всех компонентов пищи – белков, жиров и углеводов1.
ферменты, содержащиеся в секрете, смешиваясь с пищей, обеспечивают нормальное пищеварение и усвоение всех компонентов пищи – белков, жиров и углеводов1.
Экзокринная недостаточность поджелудочной железы (ЭНПЖ) – это состояние, характеризующееся дефицитом экзокринных панкреатических ферментов или отсутствием условий для их работы, что приводит к неправильному перевариванию пищи или нарушению пищеварения1.
Нарушение экзокринной функции поджелудочной железы (или экзокринная недостаточность поджелудочной железы) существенным образом сказывается на процессах пищеварения и, как следствие, на многих функциях организма. Это связано с тем, что панкреатические ферменты играют важную роль в переваривании всех основных компонентов пищи: белков, жиров и углеводов, так необходимых для нормального функционирования организма
Основные клинические признаки ЭНПЖ: вздутие живота (метеоризм), чувство тяжести и несварения в эпигастрии после еды, частый неоформленный стул (диарея), тошнота, рвота, абдоминальная боль, снижение веса, задержка роста у детей, сахарный диабет, остеопороз4.
При этом стеаторея и потеря массы тела являются поздними симптомами заболевания4.
Снижение пищеварительной функции поджелудочной железы (экзокринная недостаточность) может наблюдаться при многих заболеваниях желудочно-кишечного тракта
Достаточно часто может развиваться вторичная недостаточность поджелудочной железы, при которой сама поджелудочная железа не повреждена и она способна производить достаточное количество ферментов, однако, в силу тех или иных причин, ферменты не могут в полной мере оказывать свое действие. Это может наблюдаться при желчекаменной болезни, после холецистэктомии, при холестатических болезнях печени, при гипоацидных состояниях, после резекций желудка. Кроме того, при снижении желудочной кислотности часто возникает избыточный бактериальный рост в 12-перстной и тощей кишке, что изменяет рН в просвете кишки и нарушает процессы всасывания
Если у Вас была диагностирована ЭНПЖ, то Вам следует обсудить с Вашим врачом или диетологом такую диету, чтобы удовлетворялись все потребности в поступлении питательных веществ.
— Заместительная терапия препаратами панкреатических ферментов.
Ваш врач может назначить Вам лечение, которое называется заместительной терапией препаратами панкреатических ферментов или ЗТППФ. ЗТППФ является основным видом лечения ЭНПЖ – она обеспечивает восполнение дефицита пищеварительных ферментов
с пищей, и устранять симптомы ЭНПЖ5.
Гормоны поджелудочной железы
Поджелудочная железа – орган пищеварительной системы. Она выполняет внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) функции. Внешнесекреторная функция поджелудочной железы реализуется выделением панкреатического сока, который содержит ферменты, участвующие в пищеварении.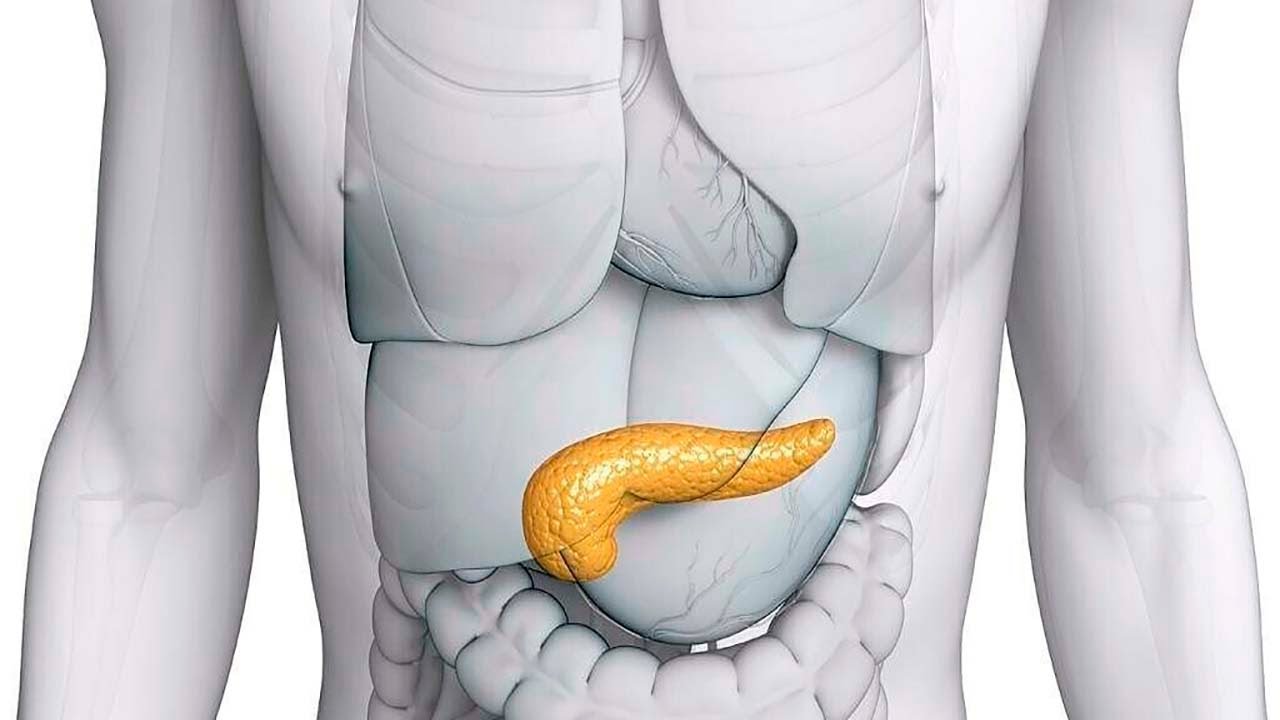
Эндокринная часть поджелудочной железы представлена панкреатическими островками, или островками Лангерганса. Островки состоят из клеток, в которых синтезируются гормоны.
- b-клетки продуцируют инсулин
- a-клетки продуцируют глюкагон
- D-клетки продуцируют соматостатин и гастрин
- РР-клетки продуцируют панкреатический полипептид.
Проинсулин — белок, который синтезируется в b-клетках островков поджелудочной железы. Он практически полностью превращается в инсулин после отщепления от него молекулы С-пептида. Небольшая его доля, которая не превратилась в инсулин, поступает в кровоток в неизмененном виде. Биологическая активность проинсулина гораздо ниже, чем инсулина. Чаще всего определение уровня проинсулина применяется в диагностике инсулино́м.
Инсулин необходим для транспорта глюкозы – основного источника энергии для клеток нашего организма, а также калия и аминокислот внутрь клеток. Сам инсулин проникать в клетки не может, поэтому свою функцию осуществляет посредством взаимодействия с рецепторами на поверхности клеток. Он также стимулирует гликолиз и синтез гликогена в печени и мышцах. Абсолютная недостаточность инсулина вследствие повреждения b-клеток — причина развития сахарного диабета 1 типа. Если нарушение возникает на этапе взаимодействия инсулина с клетками, развивается сахарный диабет 2 типа. При этом инсулина в крови достаточно, синтез его не нарушен, но клетки его «не чувствуют». В обоих случаях в крови повышается уровень глюкозы, так как её «некому» переправить в клетки. Это состояние называется гипергликемией. Бывает и обратная ситуация, когда инсулина в крови слишком много. Это ведет к снижению в крови уровня глюкозы – гипогликемии.
С-пептид образуется из проинсулина. Он является показателем секреции инсулина. Период полувыведения С-пептида из кровотока 30-40 минут, что на порядок дольше, чем у инсулина, а его концентрация примерно в 5 раз больше концентрации инсулина. С-пептид полезно определять у пациентов, которые наблюдаются после удаления поджелудочной железы, для диагностики гипогликемических состояний, при подозрении на инсулино́му. Также С-пептид позволяет оценить уровень эндогенного инсулина, при приеме препаратов инсулина, или при наличии в крови антител к инсулину.
Глюкагон синтезируется a-клетками поджелудочной железы и является антагонистом инсулина. Его повышение служит сигналом для организма о необходимости повысить в крови уровень глюкозы. Это достигается путем распада гликогена до молекул глюкозы, или образование глюкозы альтернативным путём (глюконеогенез).
Действие соматостатина в рамках пищеварительной системы заключается в подавлении секреции гастрина, инсулина, глюкагона, пищеварительных ферментов. Он также подавляет секреторную активность других органов желудочно-кишечного тракта.
Тесты для оценки функции поджелудочной железы:
воспаление поджелудочной железы.: причины, жалобы, диагностика и методы лечения на сайте клиники «Альфа-Центр Здоровья»
Воспаление поджелудочной железы, характеризуется сильной опоясывающей болью, тошнотой, рвотой, которая не приносит облегчения. Возможна механическая желтуха.
Возможна механическая желтуха. Поджелудочная железа имеет два главные функции — эндокринную (в ней, в частности, образуется инсулин) и экзокринную (в ней образуются ряд ферментов, необходимых для пищеварения). Самая частая причина недостаточности экзокринной функции поджелудочной железы у взрослых — алкоголизм, а у детей — муковисцидоз (тяжелое наследственное заболевание, сопровождающееся также тяжелыми легочными инфекциями). Муковисцидоз следует подозревать у всех больных младше 40 лет с необъяснимой недостаточностью экзокринной функции поджелудочной железы.
Жалобы
Хронический панкреатит проявляется постоянной или приступообразной болью в животе, нередко в сочетании с сахарным диабетом (что проявляется повышенным уровнем глюкозы в анализах крови).
При хроническом панкреатите обострения могут сменяться периодами улучшения, либо болезнь сопровождается постоянной болью и нарушениями всасывания пищи из кишечника.
При легком и умеренном повреждении поджелудочной железы поводом для обращения к врачу служит постоянная боль.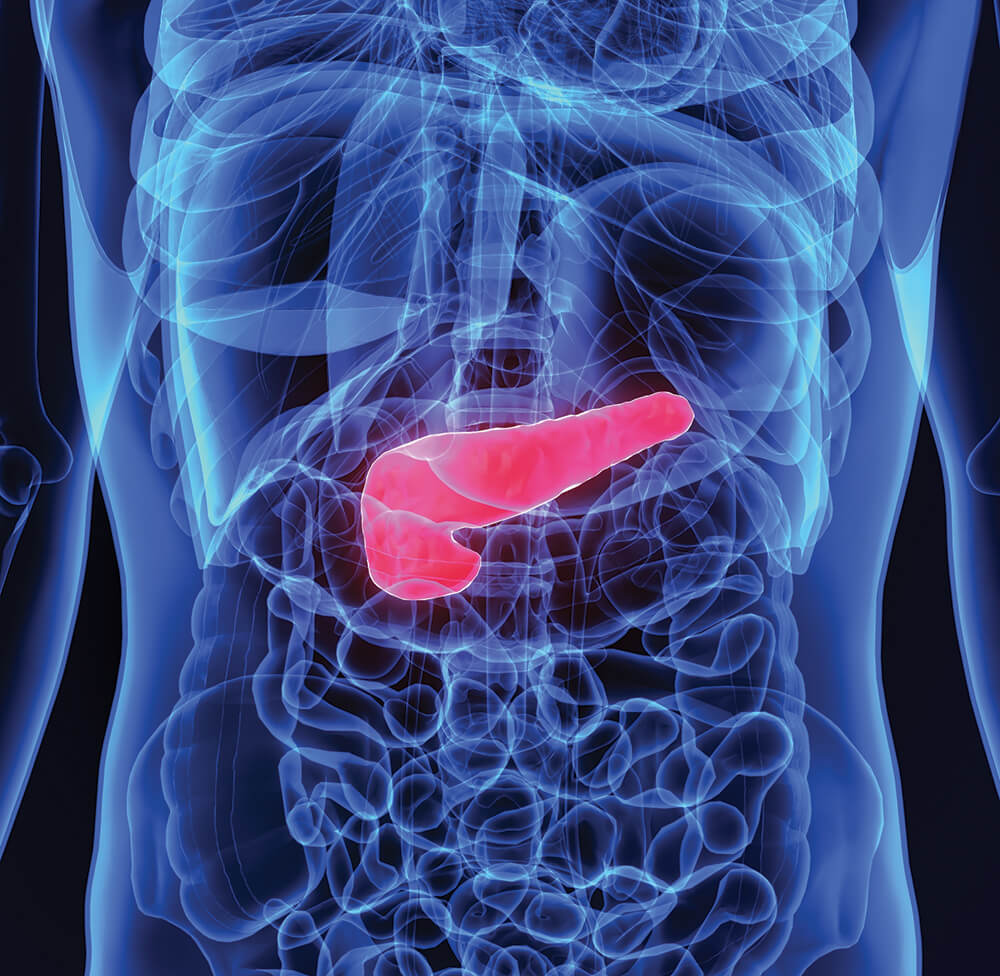
В типичных случаях боль локализуется в середине живота («под ложечкой») и отдает в спину, но может быть более выраженной в правом или левом подреберье, в спине или иметь разлитой характер. Иногда боль локализуется за грудиной или в боку. Обычно она сильная, продолжительная, глубокая и не проходит после еды и приема антацидных средств. Часто она усиливается при употреблении алкоголя или после обильной еды, особенно жирной. Нередко боль настолько сильна, что приходится использовать наркотические анальгетики. Тошнота, рвота и метеоризм (обильное отхождение газов) отмечаются реже; обычно они обусловлены реакцией на боль или применением лекарственных препаратов (особенно наркотических анальгетиков), угнетающих деятельность желудка и кишечника.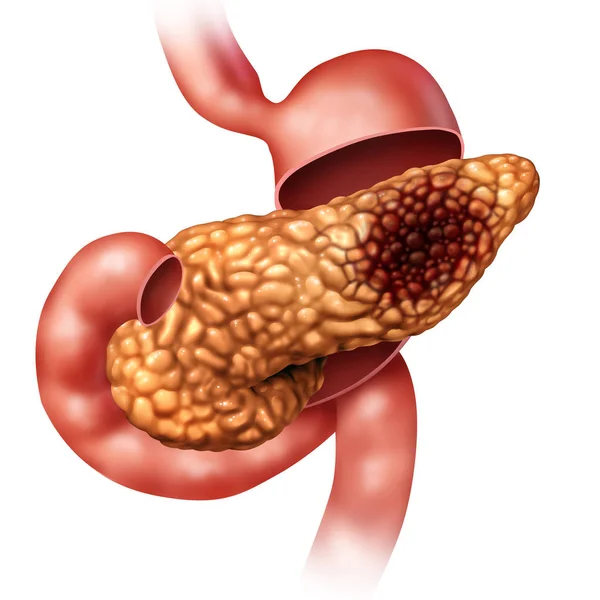
Диагностика
При длительной боли в животе всем больным необходимы ультразвуковое исследование (УЗИ) или компьютерная томография (КТ) для исключения ложной кисты поджелудочной железы. Часто при хроническом панкреатите обнаруживают изменения протоков; взаимосвязи между силой боли и наличием сужений протоков и их расширений не выявлено, однако иногда после установки стента (металлической конструкции, не дающей протоку спадаться) боль уменьшается.
Надежный метод диагностики нарушений пищеварения — определение в кале капель нейтрального жира и кристаллов жирных кислот, а также непереваренных мышечных волокон. Большое число мышечных волокон (более пяти) в мазке кала говорит о нарушении переваривания белков.
При рентгенографии живота можно выявить кальцификаты поджелудочной железы, подтверждающие хронический панкреатит. При УЗИ можно обнаружить кальцификаты (даже те, которые еще не видны на рентгенограммах), увеличение размеров поджелудочной железы и неровность ее контуров. Для диагностики хронического панкреатита используют также КТ живота; при хроническом панкреатите помимо кальцификатов в поджелудочной железе обнаруживают расширение протока поджелудочной железы и желчных протоков, неравномерное увеличение железы, скопление жидкости, изменения в окружающих тканях. Эндоскопическая ретроградная холангиопанкреатография при хроническом панкреатите выявляет расширение протоков, а также участки их стеноза.
Для диагностики хронического панкреатита используют также КТ живота; при хроническом панкреатите помимо кальцификатов в поджелудочной железе обнаруживают расширение протока поджелудочной железы и желчных протоков, неравномерное увеличение железы, скопление жидкости, изменения в окружающих тканях. Эндоскопическая ретроградная холангиопанкреатография при хроническом панкреатите выявляет расширение протоков, а также участки их стеноза.
Лечение
Отказ от алкоголя уменьшает боль примерно у 50% больных. Также применяют ферментные препараты, например панкреатин. Ферментные препараты лучше всего помогают женщинам с неалкогольным хроническим панкреатитом. У мужчин эффективность такого лечения составляет 20—25%, у мужчин, злоупотребляющих алкоголем, — 12—15%, а при тяжелом панкреатите у больных обоего пола — 25%. Во всех случаях при постоянной боли необходимо исключить ложную кисту, поскольку дренирование кисты часто приводит к улучшению. У всех больных хроническим панкреатитом с постоянной болью довольно высок риск наркотической зависимости, поэтому следует применять только ненаркотические анальгетики. Необходимо предостеречь больных, злоупотреблявших алкоголем, от употребления даже малых доз алкоголя на фоне приема парацетамола в дозе 3 г в сутки и более.
Необходимо предостеречь больных, злоупотреблявших алкоголем, от употребления даже малых доз алкоголя на фоне приема парацетамола в дозе 3 г в сутки и более.
где и как болит поджелудочная железа и что при этом делать?
Поджелудочная железа — один из главных внутренних органов человека, но большинство почти ничего не знает о его работе, заболеваниях и даже точном расположении. Однако это полезная информация, необходимая каждому: поджелудочная железа — деликатный орган, и нарушить его работу несложно. Боли в поджелудочной железе — серьезный симптом, который сопутствует многим заболеваниям.
Где находится важный орган пищеварительной системы — поджелудочная железа?
Поджелудочная железа — продолговатый орган, расположенный позади желудка, приблизительно на пять–десять сантиметров выше пупка. Длина поджелудочной железы — 15–22 сантиметра, а вес — всего 50–70 граммов. Орган состоит из трех отделов, которые врачи называют головой, телом и хвостом. Головка прилегает к двенадцатиперстной кишке, тело расположено вплотную к желудку, а хвост находится рядом с селезенкой.
Головка прилегает к двенадцатиперстной кишке, тело расположено вплотную к желудку, а хвост находится рядом с селезенкой.
Хотя поджелудочная железа — орган относительно небольшой, на нем лежит множество разнообразных функций. Поджелудочная выделяет панкреатический сок — «коктейль» из ферментов и солей, необходимых для расщепления различных питательных веществ и их усвоения. Без ферментов мы не смогли бы переваривать пищу. Их в нашем теле вырабатываются десятки видов, не только в поджелудочной, но и в желудке, и в слюнных железах, и в кишечнике.
Интересный факт
За сутки поджелудочная железа может выделять до одного литра панкреатического сока.
Каждый фермент предназначен для расщепления строго определенного типа веществ: одни занимаются белками, другие — соединительными тканями, третьи — углеводами, и так далее. Нехватка даже одного из них может привести к существенным проблемам с пищеварением.
Кроме того, поджелудочная железа вырабатывает гормоны, необходимые для обменных процессов — в частности, инсулин.
Почему болит поджелудочная железа: выясняем причины
Боли в поджелудочной железе никогда не возникают просто так. Они всегда сигнализируют о неполадках, более или менее серьезных.
Боли в поджелудочной железе часто возникают при таких заболеваниях, как панкреатит, вирусные гепатиты, патологии желчевыводящих путей, при которых нарушается отток желчи, диабет, опухоли, аутоиммунные заболевания, глистные инвазии. Сильнее всего боль в поджелудочной железе проявляется при панкреатите.
На заметку
Примерно 90% пациентов с панкреатитом жалуются на сильные боли в поджелудочной железе, и только у 10% заболевание проходит без болевого синдрома.
Болевые ощущения нередко сопровождают прием некоторых лекарственных препаратов, таких как кортикостероиды, гормональные препараты, антибиотики тетрациклинового ряда.
Однако очень часто боль в поджелудочной вызывается не болезнями, а погрешностями в диете. Если мы переедаем или употребляем слишком много алкоголя и тяжелых жирных продуктов, железа работает на пределе возможностей, чтобы помочь организму их усвоить.
Как понять, что болит именно поджелудочная железа? Опознать проблему нетрудно, боль в поджелудочной железе проявляется достаточно специфически. Болевые ощущения локализованы в области вокруг пупка, а при остром панкреатите отдает в спину — этот эффект врачи называют «опоясывающей болью». Боли в поджелудочной усиливаются после обильной или жирной пищи, алкогольных напитков, а также в положении лежа на спине. Эта боль практически не купируется анальгетиками и спазмолитиками, носит постоянный, неприступообразный характер и немного ослабевает, если сесть и наклониться вперед. При панкреатите, помимо боли, наблюдаются тошнота и рвота, слабость, потливость.
Что делать, если болит поджелудочная железа: рекомендации
Боль в поджелудочной часто бывает настолько сильной, что у человека не остается иного выхода, кроме обращения к врачам. И это правильное решение: заподозрив неполадки с поджелудочной, ни в коем случае нельзя заниматься самолечением. Как мы уже говорили выше, эта боль сопровождает множество разных заболеваний, которые требуют различной терапии.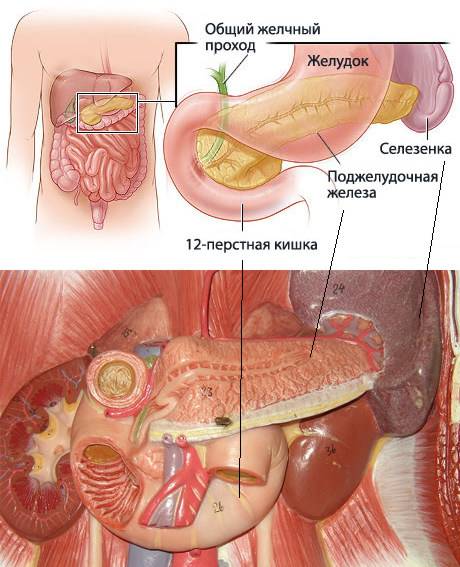 А определить причину можно только после всесторонней диагностики: лабораторных исследований, УЗИ, томографии, рентген-исследования и, в некоторых случаях, диагностической лапароскопии.
А определить причину можно только после всесторонней диагностики: лабораторных исследований, УЗИ, томографии, рентген-исследования и, в некоторых случаях, диагностической лапароскопии.
Терапия основного заболевания всегда включает в себя комплекс мер.
- Диета. Первая задача при лечении поджелудочной железы — максимально разгрузить этот орган, облегчить его работу. Вне зависимости от того, что вызвало боль в поджелудочной, назначается щадящая диета. В первую очередь нужно полностью исключить алкоголь, газированные напитки, кофе и крепкий чай, острую, жирную, жареную пищу, шоколад. Даже у здоровых людей злоупотребление этими продуктами может вызвать неприятные ощущения в области поджелудочной железы. Обычно назначается так называемый стол №5 — меню, основанное на ограничении в жирах и кислых продуктах. Стол №5 — это пища, приготовленная на пару или отварная, пудинги и заливное, нежирное мясо, птица и рыба, продукты, богатые пектинами и клетчаткой: зерновой хлеб, сладкие ягоды, макароны, овощи.
 Питаться нужно часто и понемногу — это позволяет ЖКТ усваивать пищу, не включая «аварийный режим». Желательно есть как минимум пять раз в день, но порции должны быть небольшими. Кстати, такая диета будет полезна не только тем, кто страдает от серьезных заболеваний печени и поджелудочной железы. Она поможет восстановиться после чрезмерного застолья. Даже здоровым людям знакомы такие симптомы, как тяжесть в желудке, тошнота, метеоризм и расстройство желудка — расплата за переедание или непривычную пищу. После праздников с их бесконечными обедами и возлияниями будет полезно временно переключиться на мягкую диету, чтобы вернуть пищеварение в норму. Стол №5 — диета комфортная и не предполагает отказа от широкой группы продуктов.
Питаться нужно часто и понемногу — это позволяет ЖКТ усваивать пищу, не включая «аварийный режим». Желательно есть как минимум пять раз в день, но порции должны быть небольшими. Кстати, такая диета будет полезна не только тем, кто страдает от серьезных заболеваний печени и поджелудочной железы. Она поможет восстановиться после чрезмерного застолья. Даже здоровым людям знакомы такие симптомы, как тяжесть в желудке, тошнота, метеоризм и расстройство желудка — расплата за переедание или непривычную пищу. После праздников с их бесконечными обедами и возлияниями будет полезно временно переключиться на мягкую диету, чтобы вернуть пищеварение в норму. Стол №5 — диета комфортная и не предполагает отказа от широкой группы продуктов. - Медикаментозная терапия. Лечение зависит от основного заболевания, но в любом случае врач назначит препараты, которые помогут снять симптомы и улучшить работу пищеварительного тракта. При боли в поджелудочной железе назначают обезболивающие средства для купирования острых приступов, антациды для восстановления уровня желудочной кислотности и нормализации функции пищеварения, а также ферментные препараты (при хроническом панкреатите вне периода обострений).
 Ферменты, которые содержатся в них, практически не отличаются от наших собственных ферментов и помогают справиться с усвоением пищи, если поджелудочная железа не может вырабатывать достаточное количество панкреатического сока. Кроме того, в некоторых случаях назначают желчегонные средства, антисекреторные вещества (так называемые Н2-блокаторы гистаминовых рецепторов и ингибиторы протонной помпы).
Ферменты, которые содержатся в них, практически не отличаются от наших собственных ферментов и помогают справиться с усвоением пищи, если поджелудочная железа не может вырабатывать достаточное количество панкреатического сока. Кроме того, в некоторых случаях назначают желчегонные средства, антисекреторные вещества (так называемые Н2-блокаторы гистаминовых рецепторов и ингибиторы протонной помпы).
Боль в поджелудочной железе — симптом, который нельзя игнорировать. Однако стоит помнить о том, что пусть и редко, но болезни поджелудочной могут развиваться практически бессимптомно. Поэтому желательно хотя бы раз в пару лет проходить общее обследование у гастроэнтеролога. Это особенно актуально для тех, кто не привык отказывать себе в алкоголе, жирной и жареной пище.
Хирургическое удаление части поджелудочной железы и других тканей в сравнении с другими видами лечения у пациентов с раком поджелудочной железы, который поражает окружающие ткани
Актуальность
Поджелудочная железа — это орган в брюшной полости, который вырабатывает желудочный сок для переваривания пищи.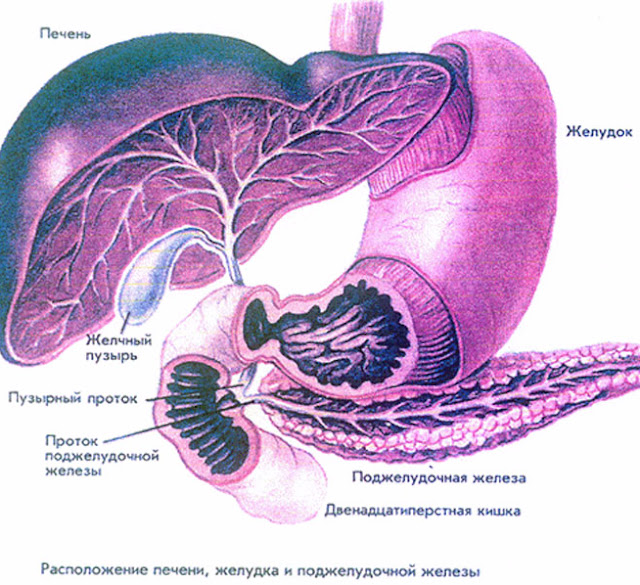 В ней также содержатся клетки, секретирующие инсулин, которые поддерживают уровень сахара в крови. Рак поджелудочной железы это агрессивный вид рака. Хирургические операции по удалению раковой опухоли улучшают выживаемость. Однако, у трети пациентов с раком поджелудочной железы — местно-распространенный вид рака, вовлекающий крупные кровеносные сосуды, которые обычно не удаляют из-за опасений возникновения осложнений после операции. Такие пациенты получают паллиативное лечение. Полагают, что резекция (удаление части органа) поджелудочной железы является альтернативой паллиативному лечению пациентов с местно-распространенным раком поджелудочной железы. Однако, в этой группе пациентов польза и вред от хирургической резекции по сравнению с другими видами лечения не ясны. Мы решили ответить на этот вопрос, выполнив тщательный поиск литературы на предмет исследований, в которых хирургическое удаление сравнивали с паллиативными видами лечения. Мы включили только рандомизированные контролируемые испытания, которые при надлежащем дизайне могут помочь избежать ошибочных выводов.
В ней также содержатся клетки, секретирующие инсулин, которые поддерживают уровень сахара в крови. Рак поджелудочной железы это агрессивный вид рака. Хирургические операции по удалению раковой опухоли улучшают выживаемость. Однако, у трети пациентов с раком поджелудочной железы — местно-распространенный вид рака, вовлекающий крупные кровеносные сосуды, которые обычно не удаляют из-за опасений возникновения осложнений после операции. Такие пациенты получают паллиативное лечение. Полагают, что резекция (удаление части органа) поджелудочной железы является альтернативой паллиативному лечению пациентов с местно-распространенным раком поджелудочной железы. Однако, в этой группе пациентов польза и вред от хирургической резекции по сравнению с другими видами лечения не ясны. Мы решили ответить на этот вопрос, выполнив тщательный поиск литературы на предмет исследований, в которых хирургическое удаление сравнивали с паллиативными видами лечения. Мы включили только рандомизированные контролируемые испытания, которые при надлежащем дизайне могут помочь избежать ошибочных выводов.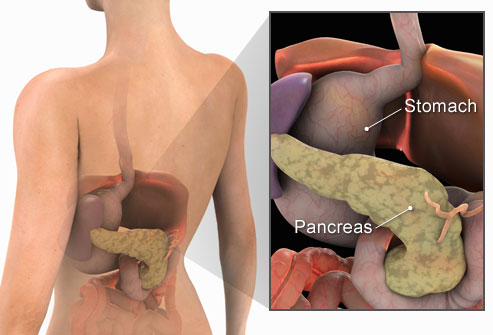 Мы провели поиск литературы, чтобы найти все исследования, опубликованные на декабрь 2013 года. Два автора независимо друг от друга оценивали испытания для включения в обзор и независимо друг от друга извлекали данные из испытаний для минимизации ошибок.
Мы провели поиск литературы, чтобы найти все исследования, опубликованные на декабрь 2013 года. Два автора независимо друг от друга оценивали испытания для включения в обзор и независимо друг от друга извлекали данные из испытаний для минимизации ошибок.
Характеристика исследований
Мы нашли два клинических испытания, в которых сравнивали хирургическое удаление поджелудочной железы с другими видами лечения у пациентов с местно-распространенным раком поджелудочной железы. В этих двух испытаниях приняли участие всего 98 пациентов. 47 пациентов перенесли хирургическое вмешательство, в то время как остальные получали паллиативное лечение. Выбор способа лечения (кому будут проводить хирургическое вмешательство или другие виды лечения) определяли с помощью метода, схожего с подбрасыванием монеты.
Основные результаты
Приблизительно 97% пациентов, перенесших операцию по удалению раковой опухоли, выжили после операции в двух испытаниях. Вероятность выживаемости была в два раза выше у пациентов, перенесших хирургическое вмешательство, по сравнению с пациентами, получавшими другие виды лечения. Выжившие пациенты наблюдались в течение, по меньшей мере, пяти лет. В группе паллиативного лечения через два года выживших не было, в то время как приблизительно 40% пациентов, перенесших хирургическую операцию, были живы через три года после операции. Различия в выживаемости были статистически значимыми. В исследованиях не сообщали об осложнениях, связанных с хирургическим вмешательством, хотя, вероятно, что у значительной части пациентов были осложнения в обеих группах. Ни в одном из испытаний не сообщали о качестве жизни. Также не было доказательств каких-либо различий в продолжительности госпитализации (включая все посещения пациента, связанные с лечением) между двумя группами. Общие затраты на лечение были существенно ниже в группе с хирургическим лечением (около 10000 долларов США), чем в группе с паллиативным лечением в испытании, проведенном в Японии. В другом испытании, проведенном в Греции, не было представлено информации о затратах.
Выжившие пациенты наблюдались в течение, по меньшей мере, пяти лет. В группе паллиативного лечения через два года выживших не было, в то время как приблизительно 40% пациентов, перенесших хирургическую операцию, были живы через три года после операции. Различия в выживаемости были статистически значимыми. В исследованиях не сообщали об осложнениях, связанных с хирургическим вмешательством, хотя, вероятно, что у значительной части пациентов были осложнения в обеих группах. Ни в одном из испытаний не сообщали о качестве жизни. Также не было доказательств каких-либо различий в продолжительности госпитализации (включая все посещения пациента, связанные с лечением) между двумя группами. Общие затраты на лечение были существенно ниже в группе с хирургическим лечением (около 10000 долларов США), чем в группе с паллиативным лечением в испытании, проведенном в Японии. В другом испытании, проведенном в Греции, не было представлено информации о затратах.
Качество доказательств
В целом, в испытаниях был высокий риск смещения (следовательно, есть вероятность ошибочных выводов). Это связано с отсутствием четкой информации, как проводили рандомизацию, а также о том, знали ли люди, оценивающие исходы, к какой группе относятся участники, и все ли участники испытаний были включены в анализ. Общее качество доказательств было очень низким, так как в испытаниях был высокий риск смещения, и было слишком мало испытаний, чтобы оценить, были ли опубликованы исследования только с отрицательными результатами.
Это связано с отсутствием четкой информации, как проводили рандомизацию, а также о том, знали ли люди, оценивающие исходы, к какой группе относятся участники, и все ли участники испытаний были включены в анализ. Общее качество доказательств было очень низким, так как в испытаниях был высокий риск смещения, и было слишком мало испытаний, чтобы оценить, были ли опубликованы исследования только с отрицательными результатами.
Выводы
Существуют доказательства очень низкого качества, что хирургическая резекция повышает уровень выживаемости и снижает затраты на лечение, по сравнению с паллиативными видами лечения у пациентов с местно-распространенным раком поджелудочной железы с вовлечением вен. Для отдельных пациентов с местно-распространенным раком поджелудочной железы, готовых принять потенциально повышенный риск осложнений, связанных с операцией, может быть рассмотрена возможность проведения резекции поджелудочной железы, при наличии достаточного опыта.
Дальнейшие исследования
Необходимы дальнейшие рандомизированные контролируемые испытания для получения более точных результатов, оценки качества жизни пациентов, а также соотношения затрат и эффективности хирургического вмешательства в сравнении с другими видами лечения при местно-распространенном раке поджелудочной железы.
Анатомия и физиология поджелудочной железы – Уралбиовет-консалтинг
Поджелудочная железа (Pancreas) — железа двойной функции: внешнесекреторной и внутрисекреторной. Внешнесекреторная функция заключается в синтезе и выделении в двенадцатиперстную кишку сока, содержащего пищеварительные ферменты и электролиты, внутрисекреторная — в синтезе и выделении в кровь гормонов.Внешнесекреторная часть железы сильно развита и составляет более 95 % ее массы. Она имеет дольчатое строение и состоит из альвеол (ацинусов) и выводных протоков. Основная масса ацинусов (железисто-пузырьковидные концевые отделы) представлена панкреатическими клетками — панкреацитами — секретируемыми клетками.
Внутрисекреторная часть железы представлена островками Лангерганса, которые составляют около 30 % массы железы. Различают несколько видов островков Лангерганса по способности секретировать полипептидные гормоны: Аклетки продуцируют глюкогон, В-клетки — инсулин, D-клетки — самостатин. Основную массу островков Лангерганса (около 60 %) составляют В-клетки.
Поджелудочная железа лежит в брыжейке двенадцатиперстной кишки, на печени, разделяясь на правую, левую и среднюю доли. Проток поджелудочной железы открывается в двенадцатиперстную кишку самостоятельно или вместе с желчным протоком. Иногда встречается добавочный проток, который впадает в двенадцатиперстную кишку самостоятельно. Иннервируется поджелудочная железа симпатическими и парасимпатическими нервами (п. vagus).
У собак железа длинная, узкая, красноватого цвета, образует более объемистую левую ветвь и более длинную правую ветвь, достигающую почек. Поджелудочный проток открывается в двенадцатиперстную кишку вместе с желчным протоком. Иногда встречается добавочный проток. Абсолютная масса железы 13-18 г.
У крупного рогатого скота поджелудочная железа располагается вдоль двенадцатиперстной кишки от 12го грудного до 2-4го поясничного позвонка, под правой ножкой диафрагмы, частично на лабиринте ободочной кишки. Состоит из поперечной и правой продольной ветвей, соединяющихся под углом в правой стороне. Выводной проток открывается обособленно от желчного протока на расстоянии 30-40 см от него (у овец вместе с желчным протоком). Абсолютная масса железы у крупного рогатого скота 350-500 г, у овец 50-70 г.
Выводной проток открывается обособленно от желчного протока на расстоянии 30-40 см от него (у овец вместе с желчным протоком). Абсолютная масса железы у крупного рогатого скота 350-500 г, у овец 50-70 г.
У лошадей на поджелудочной железе различают среднюю часть — тело, прилежащее к воротному изгибу двенадцатиперстной кишки. Левый конец железы, или хвост, длинный и узкий, достигает слева слепого мешка желудка, соединяясь с ним, селезенкой и левой почкой. Правый конец железы, или головка, доходит до правой почки, слепой и ободочной кишки. Поджелудочный проток открывается вместе с печеночным. Иногда встречается дополнительный проток. Цвет железы желтоватый, абсолютная масса до 250-350 г.
У свиней на железе различают среднюю, правую и левую доли. Через среднюю долю проходит воротная вена печени. Железа лежит под двумя последними грудными и двумя первыми поясничными позвонками. Проток один, открывается на 13-20 см дистальнее устья желчного протока. Абсолютная масса железы 150 г.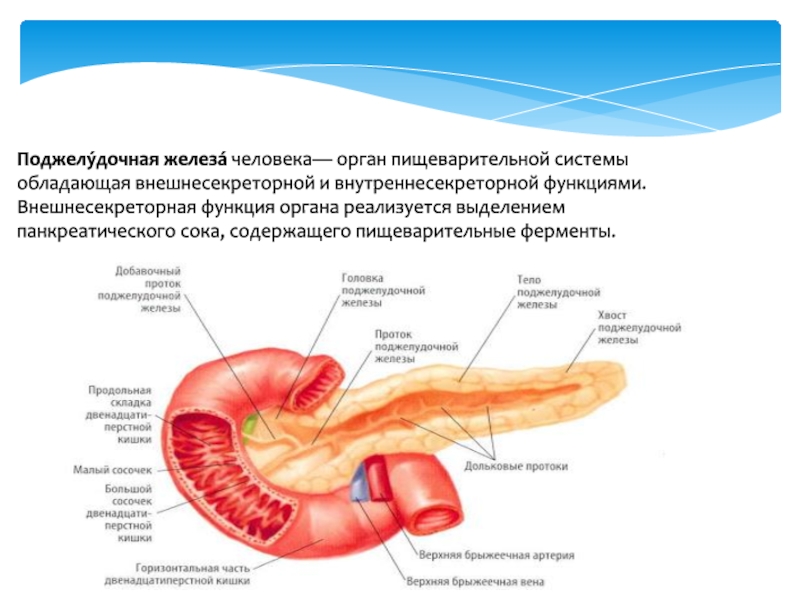
Внешнесекреторная (экзогенная) функция поджелудочной железы. Основной продукт внешнесекреторной функции поджелудочной железы — пищеварительный сок, который содержит 90 % воды и 10% плотного осадка. Плотность сока 1,008-1,010; рН 7,2-8,0 (у лошадей 7,30-7,58; у крупного рогатого скота 8). В состав плотного осадка входят белковые вещества и минеральные соединения: бикарбонат натрия, хлорид натрия, хлорид кальция, фосфорнокислый натрий и др.
Сок поджелудочной железы содержит протеолитические и нуклеолитические ферменты (трипсин, хемотрипсин, карбоксипептидазы, эластазу, нуклеазы, аминопептидазу, коллагеназу, дипептидазу), амилолитические ферменты (аамилазу, мальтазу, лактазу, инвертазу) и липолитические ферменты (липазу, фосфолипазу, холинэстеразу, карбоксиэстеразу, моноглицеридлипазу, щелочную фосфатазу). Трипсин расщепляет белки до аминокислот и выделяется в виде неактивного трипсиногена, который активируется ферментом кишечного сока энтерокиназой. Химотрипсин расщепляет белки и полипептиды до аминокислот и выделяется в форме неактивного химотрипсиногена; активируется трипсином. Карбоксиполипептидазы действуют на полипептиды, отщепляя от них аминокислоты. Дипептидазы расщепляют дипептиды на свободные аминокислоты. Эластаза действует на белки соединительной ткани — эластин, коллаген. Протаминаза расщепляет протамины, нуклеазы — нуклеиновые кислоты на мононуклеотиды и фосфорную кислоту.
Карбоксиполипептидазы действуют на полипептиды, отщепляя от них аминокислоты. Дипептидазы расщепляют дипептиды на свободные аминокислоты. Эластаза действует на белки соединительной ткани — эластин, коллаген. Протаминаза расщепляет протамины, нуклеазы — нуклеиновые кислоты на мононуклеотиды и фосфорную кислоту.
При воспалении поджелудочной железы, аутоиммунных процессах протеолитические ферменты становятся активными уже в самой железе, вызывая ее разрушение. а-Амилаза расщепляет крахмал и гликоген до мальтозы; мальтаза — мальтозу до глюкозы; лактаза расщепляет молочный сахар на глюкозу и галактозу (она имеет существенное значение в пищеварении молодняка), инвертаза — сахарозу на глюкозу и фруктозу; липаза и другие липолитические ферменты расщепляют жиры на глицерин и жирные кислоты. Липолитические ферменты, в частности липаза, секретируются в активном состоянии, но расщепляют только жир, эмульгированный желчными кислотами. Амилазы, также как и липазы, в соке поджелудочной железы находятся в активном состоянии.
Из электролитов в соке поджелудочной железы содержатся натрий, калий, хлор, кальций, магний, цинк, медь и значительное количество бикарбонатов, обеспечивающих нейтрализацию кислого содержимого двенадцатиперстной кишки. Тем самым создается оптимальная среда для активных ферментов.
Доказано, что помимо перечисленного выше действия сок поджелудочной железы обладает свойством регуляции микробной ассоциации в двенадцатиперстной кишке, оказывая определенное бактерицидное действие. Превращение поступления в кишечник панкреатического сока ведет к усиленному бактериальному росту в проксимальном отделе тонкого кишечника у собак.
Эндокринная (гормональная) функция поджелудочной железы. Важнейшими гормонами поджелудочной железы являются инсулин, глюкогон и соматостатин.
Инсулин образуется в Вклетках из предшественника — проинсулина. Синтезируемый проинсулин поступает в аппарат Гольджи, где расщепляется на молекулу Спептида и молекулу инсулина. Из аппарата Гольджи (пластинчатый комплекс) инсулин, Спептид и частично проинсулин поступают в везикулы, где инсулин связывается с цинком и депонируется в таком состоянии.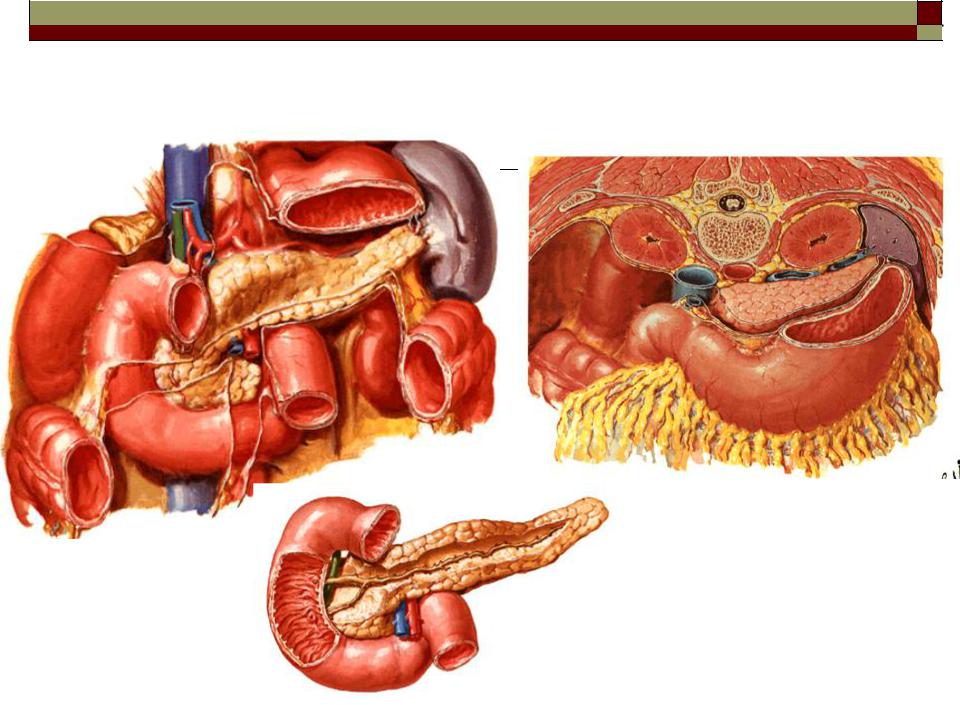 Под влиянием различных стимулов инсулин освобождается от цинка и поступает в прекапиллярное пространство. Основным стимулятором секреции инсулина служит глюкоза: при ее повышении в крови усиливается синтез инсулина. В определенной степени этим свойством обладают аминокислоты аргинин и лейцин, а также глюкогон, глетрин, секретин, глюкокортикоиды, соматостатин, никотиновая кислота. Инсулин в крови находится в свободном и связанном с белками плазмы состоянии. Распад инсулина происходит в печени под влиянием глютатионтрансферазы и глютатионредуктазы, в почках под влиянием инсулиназы, в жировой ткани под влиянием протеолитических ферментов. Проинсулин и Спептид тоже подвергаются дегидратации в печени. Его биологическое действие обусловлено способностью связываться со специфическими рецепторами клеточной цитоплазматической мембраны.
Под влиянием различных стимулов инсулин освобождается от цинка и поступает в прекапиллярное пространство. Основным стимулятором секреции инсулина служит глюкоза: при ее повышении в крови усиливается синтез инсулина. В определенной степени этим свойством обладают аминокислоты аргинин и лейцин, а также глюкогон, глетрин, секретин, глюкокортикоиды, соматостатин, никотиновая кислота. Инсулин в крови находится в свободном и связанном с белками плазмы состоянии. Распад инсулина происходит в печени под влиянием глютатионтрансферазы и глютатионредуктазы, в почках под влиянием инсулиназы, в жировой ткани под влиянием протеолитических ферментов. Проинсулин и Спептид тоже подвергаются дегидратации в печени. Его биологическое действие обусловлено способностью связываться со специфическими рецепторами клеточной цитоплазматической мембраны.
Инсулин усиливает синтез углеводов, белков, нуклеиновых кислот и жира. Он ускоряет транспорт глюкозы в клетки инсулинозависимых тканей (печень, мышцы, жировая ткань), стимулирует синтез гликогена в печени и подавляет глюконеогенез (образование глюкозы из неуглеводных компонентов), гликогенолиз (распад гликогена), что в конечном итоге ведет к снижению уровня сахара в крови. Этот гормон ускоряет транспорт аминокислот через цитоплазматическую мембрану клеток, стимулирует синтез белка. Инсулин участвует в процессе включения жирных кислот в триглицериды жировой ткани, стимулирует синтез липидов и подавляет липолиз (распад жира).
Этот гормон ускоряет транспорт аминокислот через цитоплазматическую мембрану клеток, стимулирует синтез белка. Инсулин участвует в процессе включения жирных кислот в триглицериды жировой ткани, стимулирует синтез липидов и подавляет липолиз (распад жира).
В регуляции синтеза белка и утилизации углеводов вместе с инсулином участвуют кальций и магний. Концентрация инсулина в крови человека 15-20 мкЕД/мл.
Глюкогон — полипептид, секреция которого регулируется глюкозой, аминокислотами, гастроинтестинальными гормонами (панклеозимин) и симпатической нервной системой. Секреция глюкогона усиливается при снижении в крови сахара, СЖК, раздражении симпатической нервной системы, а угнетается при гипергликемии, повышении уровня СЖК, соматостатина. Под влиянием глюкогона стимулируется глюконеогенез, ускоряется распад гликогена, т. е. увеличивается продукция глюкозы. Под действием глюкогона ускоряется синтез активной формы фосфорилазы, участвующей в образовании глюкозы из неуглеводных компонентов (глюконеогенез).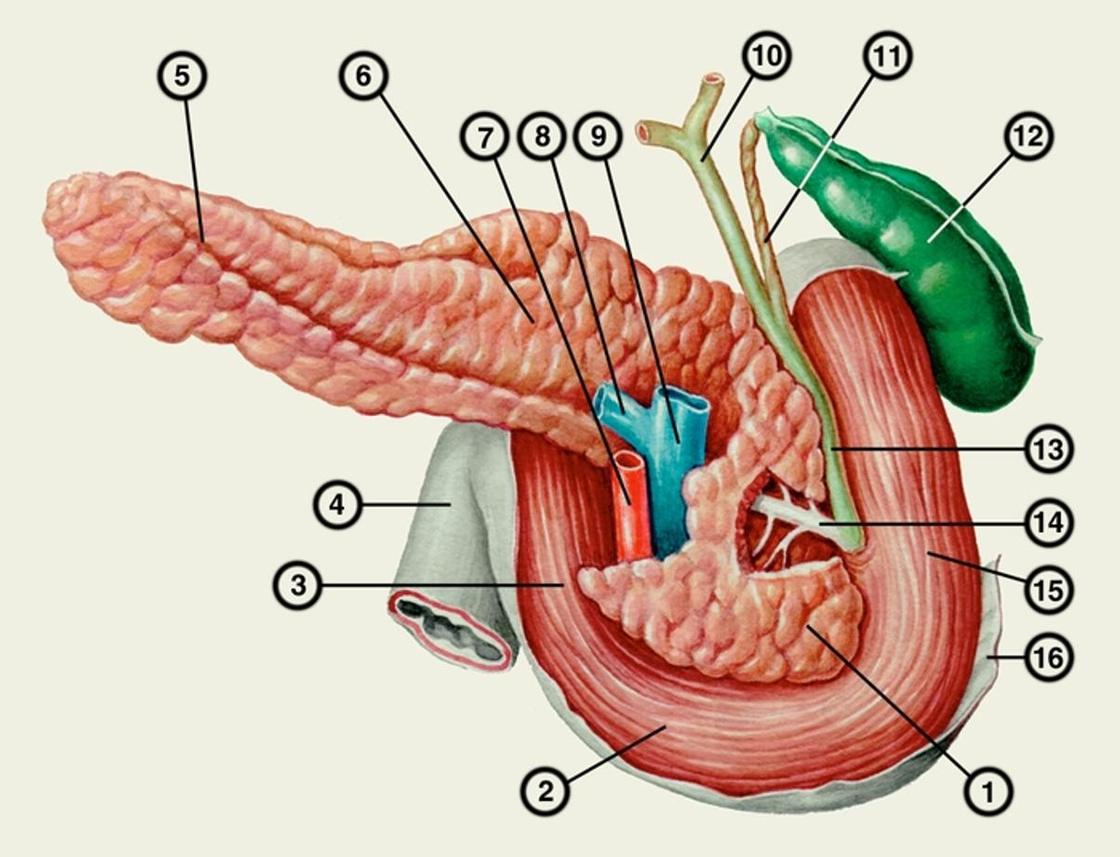 Глюкогон способен связываться с рецепторами адипацитов (клеток жировой ткани), способствуя распаду триглицеридов с образованием глицерина и СЖК. Глюконеогенез сопровождается не только образованием глюкозы, но и промежуточных продуктов обмена веществ — кетоновых тел, развитием кетоацидоза. Содержание в плазме крови глюкогона у человека составляет 50-70пг/мл. Концентрация этого гормона в крови увеличивается при голодании (голодный кетоз у овец), хронических заболеваниях печени.
Глюкогон способен связываться с рецепторами адипацитов (клеток жировой ткани), способствуя распаду триглицеридов с образованием глицерина и СЖК. Глюконеогенез сопровождается не только образованием глюкозы, но и промежуточных продуктов обмена веществ — кетоновых тел, развитием кетоацидоза. Содержание в плазме крови глюкогона у человека составляет 50-70пг/мл. Концентрация этого гормона в крови увеличивается при голодании (голодный кетоз у овец), хронических заболеваниях печени.
Соматостатин — гормон, основной синтез которого осуществляется в гипоталамусе, а также в D-клетках поджелудочной железы. Соматостатин подавляет секрецию СТГ, АКТГ, ТТГ, гастрина, глюкогона, инсулина, ренина, секретина, вазоактивного желудочного пептида, желудочного сока, панкреатических ферментов и электролитов. Содержание соматостатина в крови повышается при сахарном диабете I типа, D-клеточной опухоли поджелудочной железы (соматостатиноме). Говоря о гормонах поджелудочной железы, следует отметить, что энергетический баланс в организме поддерживается сплошными биохимическими процессами, в которых непосредственное участие принимают инсулин, глюкогон и частично соматостатин. Так, во время голодания уровень в крови инсулина снижается, а глюкогона повышается, усиливается глюконеогенез. Благодаря этому поддерживается минимальный уровень глюкозы в крови. Усиление липолиза сопровождается повышением в крови СЖК, которые используются сердечной и другими мышцами, печенью, почками в качестве энергетического материала. В условиях гипогликемии источником энергии становятся и кетокислоты.
Так, во время голодания уровень в крови инсулина снижается, а глюкогона повышается, усиливается глюконеогенез. Благодаря этому поддерживается минимальный уровень глюкозы в крови. Усиление липолиза сопровождается повышением в крови СЖК, которые используются сердечной и другими мышцами, печенью, почками в качестве энергетического материала. В условиях гипогликемии источником энергии становятся и кетокислоты.
Нейроэндокринная регуляция функции поджелудочной железы. Деятельность поджелудочной железы находится под влиянием парасимпатической (n. vagus) и симпатической (чревные нервы) нервной системы, гипоталамогипофизарной системы и других желез внутренней секреции. В частности, блуждающий нерв играет определенную роль в регуляции ферментообразования. Секреторные волокна входят также в состав симпатических нервов, иннервирующих поджелудочную железу. При стимуляции отдельных волокон блуждающего нерва с усилением сокоотделения происходит и его торможение. Основоположником отечественной физиологии И. П. Павловым доказано, что отделение поджелудочного сока начинается при виде корма или раздражении рецепторов полости рта и глотки. Этот феномен необходимо учитывать в случаях назначения голодной диеты при остром панкреатите у собак, кошек и других животных, не допуская их зрительного и обонятельного контакта с кормом.
П. Павловым доказано, что отделение поджелудочного сока начинается при виде корма или раздражении рецепторов полости рта и глотки. Этот феномен необходимо учитывать в случаях назначения голодной диеты при остром панкреатите у собак, кошек и других животных, не допуская их зрительного и обонятельного контакта с кормом.
Наряду с нервной происходит и гуморальная регуляция функции поджелудочной железы. Поступление соляной кислоты в двенадцатиперстную кишку вызывает секрецию поджелудочного сока даже после перерезки блуждающих и чревных (симпатических) нервов и разрушения продолговатого мозга. Это положение лежит в основе назначения медикаментов, снижающих секрецию поджелудочного сока при остром панкреатите. Под влиянием соляной кислоты желудочного сока, поступающего в кишечник, из клеток слизистой оболочки тонкой кишки выделяется просекретин. Соляная кислота активирует просекретин, превращая его в секретин. Всасываясь в кровь, секретин действует на поджелудочную железу, усиливая выделение ею сока: одновременно он тормозит функцию обкладочных желез, чем препятствует чрезмерно интенсивной секреции соляной кислоты железами желудка. Секретин в физиологическом отношении является гормоном. Под влиянием секретина образуется большое количество поджелудочного сока, бедного ферментами и богатого щелочами. Учитывая эту физиологическую особенность, лечение острого панкреатита направлено на снижение секреции соляной кислоты в желудке, подавление активности секретина.
Секретин в физиологическом отношении является гормоном. Под влиянием секретина образуется большое количество поджелудочного сока, бедного ферментами и богатого щелочами. Учитывая эту физиологическую особенность, лечение острого панкреатита направлено на снижение секреции соляной кислоты в желудке, подавление активности секретина.
В слизистой оболочке двенадцатиперстной кишки образуется также гормон панкреозимин, который усиливает образование ферментов в поджелудочном соке. Подобное действие оказывают гастрин (образуется в желудке), инсулин, соли желчных кислот.
Тормозящее влияние на секрецию панкреатического сока оказывают нейропептиды — гастроингибирующий полипептид (ГИП), панкреатический полипептид (ПП), вазоактивный интерстинальный полипептид (ВИП), а также гормон соматостатин.
При лечении плотоядных животных с нарушением внешнесекреторной функции поджелудочной железы необходимо иметь в виду, что на молоко выделяется мало сока, на мясо, черный хлеб — много. При кормлении мясом выделяется много трипсина, при кормлении молоком — много липазы и трипсина.
Источник vetclub.ru
Изображение, функция, условия, тесты, обработка
Источник изображения
© 2014 WebMD, LLC. Все права защищены.
Поджелудочная железа, вид спереди
Поджелудочная железа имеет длину около 6 дюймов и расположена на задней части брюшной полости позади желудка. Головка поджелудочной железы находится на правой стороне живота и соединяется с двенадцатиперстной кишкой (первым отделом тонкой кишки) через небольшую трубку, называемую протоком поджелудочной железы. Узкий конец поджелудочной железы, называемый хвостом, доходит до левой стороны тела.
Заболевания поджелудочной железы
- Диабет, тип 1: иммунная система организма атакует и разрушает клетки поджелудочной железы, вырабатывающие инсулин. Для контроля уровня сахара в крови необходимы пожизненные инъекции инсулина.
- Диабет, тип 2: Организм становится устойчивым к инсулину, вызывая повышение уровня сахара в крови. Со временем поджелудочная железа теряет способность надлежащим образом вырабатывать и высвобождать инсулин, что приводит к потребности в синтетическом инсулине.

- Муковисцидоз: генетическое заболевание, поражающее несколько систем организма, обычно включая легкие и поджелудочную железу.Часто возникают проблемы с пищеварением и диабет.
- Рак поджелудочной железы: В поджелудочной железе много различных типов клеток, каждый из которых может дать начало своему типу опухоли. Наиболее распространенный тип возникает из клеток, выстилающих проток поджелудочной железы. Поскольку ранние симптомы обычно малочисленны или отсутствуют вовсе, рак поджелудочной железы к моменту обнаружения часто прогрессирует.
- Панкреатит: поджелудочная железа воспаляется и повреждается под действием собственных пищеварительных химических веществ. Результатом может стать отек и отмирание ткани поджелудочной железы.Хотя алкоголь или камни в желчном пузыре могут способствовать развитию панкреатита, иногда причину панкреатита так и не находят.
- Псевдокиста поджелудочной железы: после приступа панкреатита может образоваться заполненная жидкостью полость, называемая псевдокистой.
 Псевдокисты могут рассасываться спонтанно, или может потребоваться хирургическое дренирование.
Псевдокисты могут рассасываться спонтанно, или может потребоваться хирургическое дренирование. - Островковая опухоль: клетки поджелудочной железы, вырабатывающие гормоны, аномально размножаются, образуя доброкачественную или раковую опухоль. Эти опухоли вырабатывают избыточное количество гормонов, а затем выделяют их в кровь.Гастриномы, глюкагономы и инсулиномы являются примерами опухолей островковых клеток.
- Увеличенная поджелудочная железа: Увеличенная поджелудочная железа встречается редко. Это может быть безобидная анатомическая аномалия или признак аутоиммунного панкреатита.
поджелудочная железа | анатомия | Британика
поджелудочная железа , сложная железа, которая выделяет пищеварительные ферменты в кишечник и выделяет в кровоток гормоны инсулин и глюкагон, жизненно важные для углеводного (сахарного) обмена.
Анатомия и экзокринные и эндокринные функции
У человека поджелудочная железа весит примерно 80 граммов (около 3 унций) и имеет форму груши.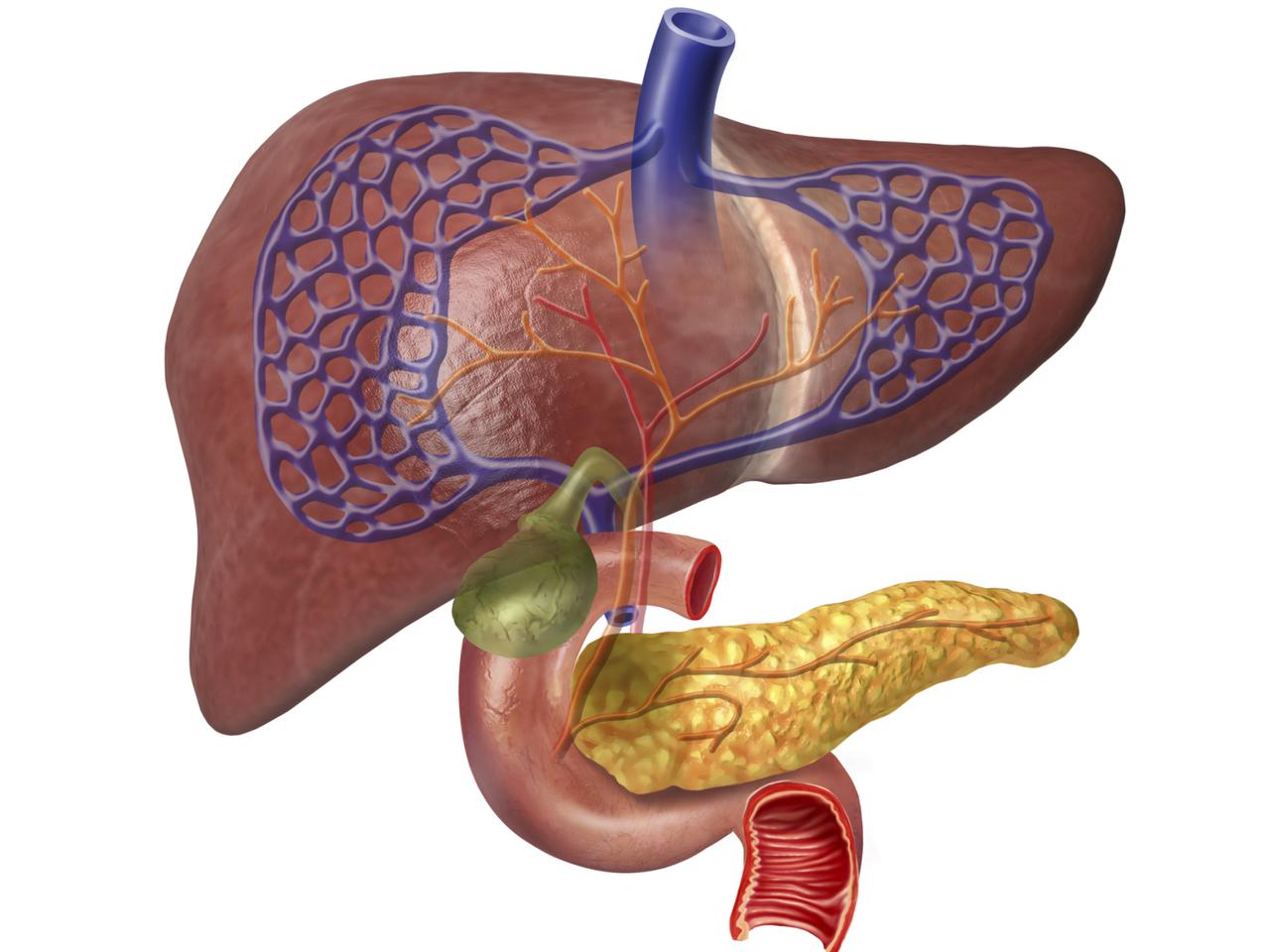 Он расположен в верхней части живота, его головка прилегает непосредственно к двенадцатиперстной кишке (верхняя часть тонкой кишки), а тело и хвост проходят по средней линии почти до селезенки. У взрослых большая часть ткани поджелудочной железы выполняет экзокринную функцию, при которой пищеварительные ферменты секретируются через протоки поджелудочной железы в двенадцатиперстную кишку.Клетки поджелудочной железы, вырабатывающие пищеварительные ферменты, называются ацинарными клетками (от латинского acinus , что означает «виноград»), названными так потому, что клетки объединяются в пучки, напоминающие гроздь винограда. Между скоплениями ацинарных клеток расположены рассеянные участки секреторной ткани другого типа, известные под общим названием островки Лангерганса, названные в честь немецкого патологоанатома XIX века Пауля Лангерганса. Островки выполняют эндокринные функции поджелудочной железы, хотя на их долю приходится лишь 1–2% ткани поджелудочной железы.
Он расположен в верхней части живота, его головка прилегает непосредственно к двенадцатиперстной кишке (верхняя часть тонкой кишки), а тело и хвост проходят по средней линии почти до селезенки. У взрослых большая часть ткани поджелудочной железы выполняет экзокринную функцию, при которой пищеварительные ферменты секретируются через протоки поджелудочной железы в двенадцатиперстную кишку.Клетки поджелудочной железы, вырабатывающие пищеварительные ферменты, называются ацинарными клетками (от латинского acinus , что означает «виноград»), названными так потому, что клетки объединяются в пучки, напоминающие гроздь винограда. Между скоплениями ацинарных клеток расположены рассеянные участки секреторной ткани другого типа, известные под общим названием островки Лангерганса, названные в честь немецкого патологоанатома XIX века Пауля Лангерганса. Островки выполняют эндокринные функции поджелудочной железы, хотя на их долю приходится лишь 1–2% ткани поджелудочной железы.
Британская викторина
Человеческое тело
Возможно, вы знаете, что человеческий мозг состоит из двух половин, но какая часть человеческого тела состоит из крови? Проверьте обе половины своего разума в этой викторине по анатомии человека.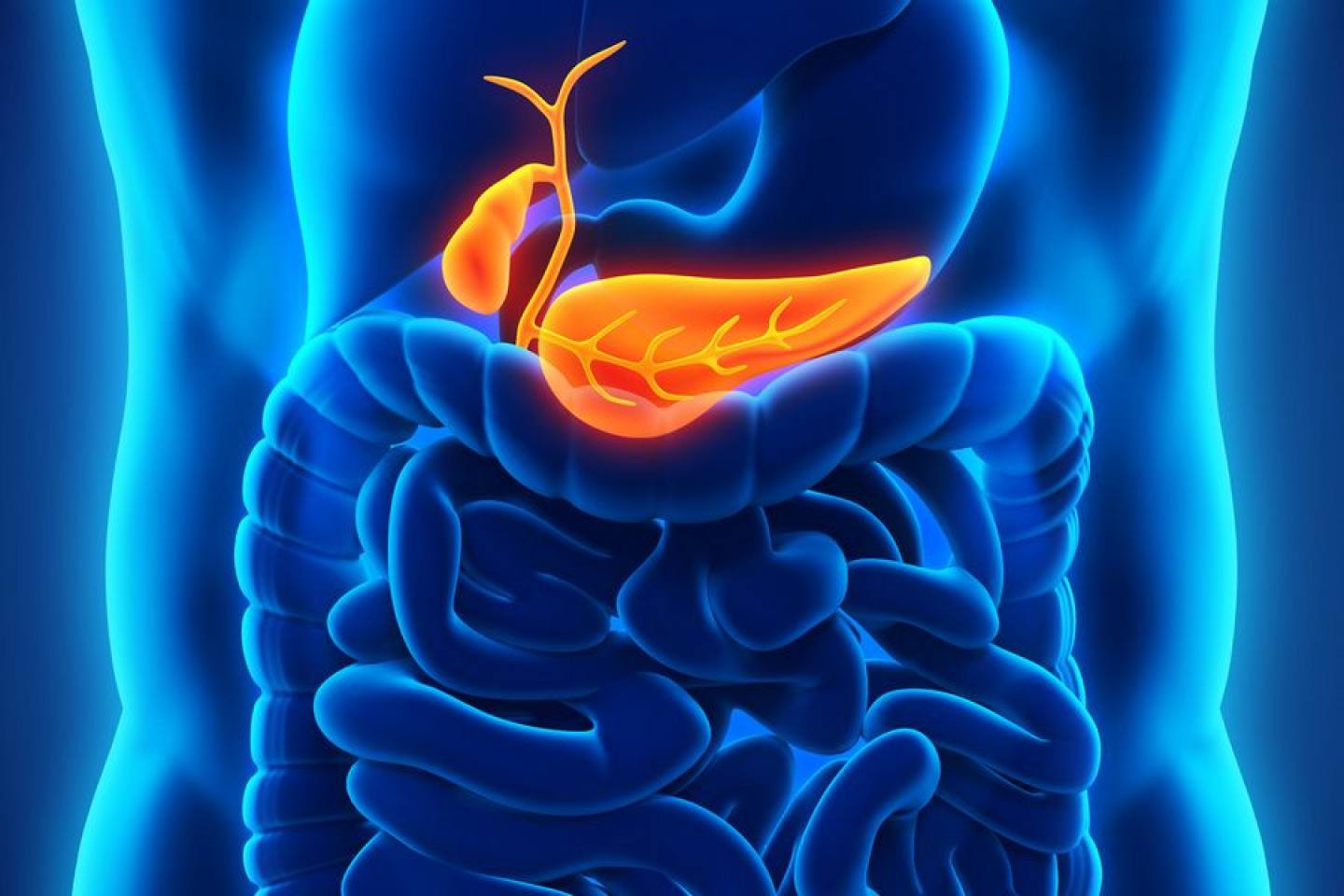
Большой главный проток, Вирсунгов проток, собирает панкреатический сок и впадает в двенадцатиперстную кишку.У многих людей меньший проток (проток Санторини) также впадает в двенадцатиперстную кишку. Ферменты, активные в переваривании углеводов, жиров и белков, непрерывно поступают из поджелудочной железы через эти протоки. Их поток контролируется блуждающим нервом и гормонами секретином и холецистокинином, которые вырабатываются в слизистой оболочке кишечника. Когда пища попадает в двенадцатиперстную кишку, секретин и холецистокинин выделяются в кровоток секреторными клетками двенадцатиперстной кишки. Когда эти гормоны достигают поджелудочной железы, клетки поджелудочной железы стимулируются к выработке и выделению большого количества воды, бикарбоната и пищеварительных ферментов, которые затем поступают в кишечник.
поджелудочная железа Поджелудочная железа человека с поперечным сечением, показывающим проток, впадающий в тонкую кишку.
Эндокринная поджелудочная железа состоит из островков Лангерганса. Существует приблизительно один миллион островков, которые в целом весят около 1 грамма (около 0,04 унции) и разбросаны по всей поджелудочной железе. Клетки, составляющие островки, возникают как из энтодермальных, так и из нейроэктодермальных клеток-предшественников. Приблизительно 75 процентов клеток в каждом островке представляют собой бета-клетки, продуцирующие инсулин, которые сгруппированы в центре островка.Остальная часть каждого островка состоит из альфа-, дельта- и F (или PP) клеток, которые секретируют соответственно глюкагон, соматостатин и панкреатический полипептид и располагаются на периферии островка. Каждый островок кровоснабжается одной или двумя очень маленькими артериями (артериолами), которые разветвляются на многочисленные капилляры. Эти капилляры появляются и сливаются в мелкие вены за пределами островка. Островки также содержат много нервных окончаний (преимущественно непроизвольных, или вегетативных, нервов, которые контролируют и контролируют внутренние органы). Основной функцией эндокринной поджелудочной железы является секреция инсулина и других полипептидных гормонов, необходимых для клеточного хранения или мобилизации глюкозы, аминокислот и триглицеридов. Функция островков может регулироваться сигналами, инициируемыми вегетативными нервами, циркулирующими метаболитами (например, глюкозой, аминокислотами, кетоновыми телами), циркулирующими гормонами или местными (паракринными) гормонами.
Основной функцией эндокринной поджелудочной железы является секреция инсулина и других полипептидных гормонов, необходимых для клеточного хранения или мобилизации глюкозы, аминокислот и триглицеридов. Функция островков может регулироваться сигналами, инициируемыми вегетативными нервами, циркулирующими метаболитами (например, глюкозой, аминокислотами, кетоновыми телами), циркулирующими гормонами или местными (паракринными) гормонами.
Островки Лангерганса содержат альфа-, бета- и дельта-клетки, которые продуцируют соответственно глюкагон, инсулин и соматостатин.Клетки островков четвертого типа, клетки F (или PP), располагаются на периферии островков и секретируют панкреатический полипептид. Эти гормоны регулируют секрецию друг друга посредством паракринных межклеточных взаимодействий.
Британская энциклопедия, Inc. Поджелудочная железа может быть местом острых и хронических инфекций, опухолей и кист. Если его удалить хирургическим путем, жизнь можно поддерживать введением инсулина и сильнодействующих экстрактов поджелудочной железы.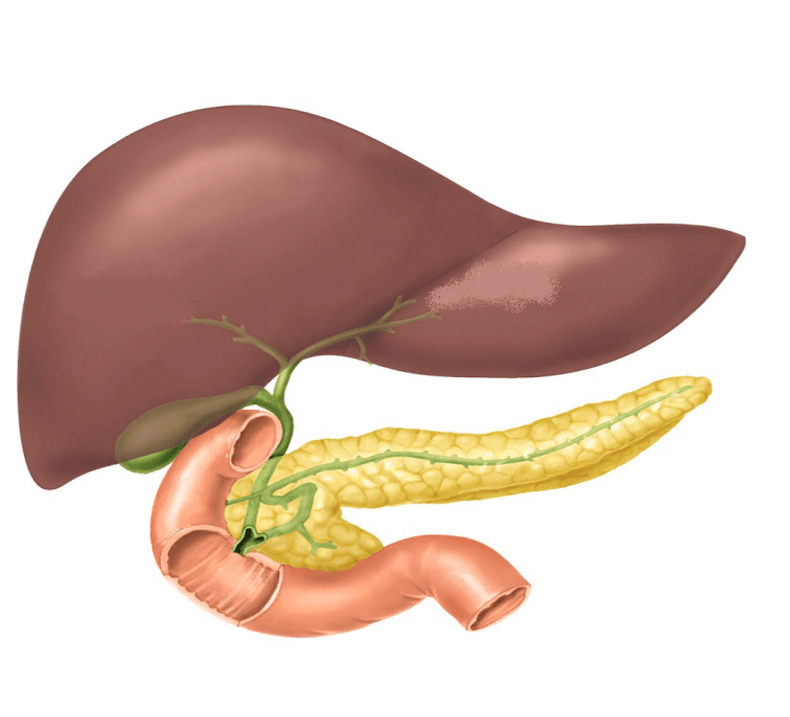 Приблизительно от 80 до 90 процентов поджелудочной железы можно удалить хирургическим путем, не вызывая дефицита эндокринных гормонов (инсулина и глюкагона) или экзокринных веществ (воды, бикарбоната и ферментов).
Приблизительно от 80 до 90 процентов поджелудочной железы можно удалить хирургическим путем, не вызывая дефицита эндокринных гормонов (инсулина и глюкагона) или экзокринных веществ (воды, бикарбоната и ферментов).
Гормональная регуляция энергетического обмена
Открытие инсулина в 1921 году стало одним из важнейших событий в современной медицине. Это спасло жизни бесчисленному количеству пациентов, страдающих сахарным диабетом, нарушением углеводного обмена, характеризующимся неспособностью организма вырабатывать инсулин или реагировать на него. Открытие инсулина также положило начало современному пониманию функции эндокринной поджелудочной железы. Значение эндокринной системы поджелудочной железы заключается в том, что инсулин играет центральную роль в регуляции энергетического обмена.Относительный или абсолютный дефицит инсулина приводит к сахарному диабету, который является основной причиной болезней и смертей во всем мире.
Гормон поджелудочной железы глюкагон в сочетании с инсулином также играет ключевую роль в поддержании гомеостаза глюкозы и в регулировании накопления питательных веществ. Адекватный запас глюкозы необходим для оптимального роста и развития организма, а также для функционирования центральной нервной системы, для которой глюкоза является основным источником энергии. Поэтому были разработаны сложные механизмы, обеспечивающие поддержание концентрации глюкозы в крови в узких пределах как во время еды, так и во время голода.Избыток потребляемых питательных веществ может храниться в организме и становиться доступным позже, например, когда питательных веществ не хватает, как во время голодания, или когда организм использует энергию, как во время физической активности. Жировая ткань является основным местом хранения питательных веществ, почти все в форме жира. В одном грамме жира содержится в два раза больше калорий, чем в одном грамме углеводов или белков. Кроме того, содержание воды в жировой ткани очень низкое (10 процентов). Таким образом, килограмм жировой ткани имеет в 10 раз большую калорийность, чем такой же вес мышечной ткани.
Адекватный запас глюкозы необходим для оптимального роста и развития организма, а также для функционирования центральной нервной системы, для которой глюкоза является основным источником энергии. Поэтому были разработаны сложные механизмы, обеспечивающие поддержание концентрации глюкозы в крови в узких пределах как во время еды, так и во время голода.Избыток потребляемых питательных веществ может храниться в организме и становиться доступным позже, например, когда питательных веществ не хватает, как во время голодания, или когда организм использует энергию, как во время физической активности. Жировая ткань является основным местом хранения питательных веществ, почти все в форме жира. В одном грамме жира содержится в два раза больше калорий, чем в одном грамме углеводов или белков. Кроме того, содержание воды в жировой ткани очень низкое (10 процентов). Таким образом, килограмм жировой ткани имеет в 10 раз большую калорийность, чем такой же вес мышечной ткани.
После приема пищи молекулы углеводов перевариваются и всасываются в виде глюкозы. Возникающее в результате увеличение концентрации глюкозы в крови сопровождается 5-10-кратным увеличением концентрации инсулина в сыворотке, что стимулирует поглощение глюкозы печенью, жировой и мышечной тканями и ингибирует высвобождение глюкозы из ткани печени. Жирные кислоты и аминокислоты, полученные в результате переваривания жира и белка, также поглощаются и накапливаются в печени и периферических тканях, особенно в жировой ткани.Инсулин также ингибирует липолиз (расщепление жира), предотвращая мобилизацию жира. Таким образом, во время «насыщения», или анаболического состояния, проглоченные питательные вещества, которые не используются немедленно, сохраняются, процесс, в значительной степени зависящий от связанного с пищей увеличения секреции инсулина.
Возникающее в результате увеличение концентрации глюкозы в крови сопровождается 5-10-кратным увеличением концентрации инсулина в сыворотке, что стимулирует поглощение глюкозы печенью, жировой и мышечной тканями и ингибирует высвобождение глюкозы из ткани печени. Жирные кислоты и аминокислоты, полученные в результате переваривания жира и белка, также поглощаются и накапливаются в печени и периферических тканях, особенно в жировой ткани.Инсулин также ингибирует липолиз (расщепление жира), предотвращая мобилизацию жира. Таким образом, во время «насыщения», или анаболического состояния, проглоченные питательные вещества, которые не используются немедленно, сохраняются, процесс, в значительной степени зависящий от связанного с пищей увеличения секреции инсулина.
Через несколько часов после еды, когда всасывание питательных веществ в кишечнике завершено, а концентрация глюкозы в крови снизилась до уровня, предшествующего приему пищи, секреция инсулина снижается, а выработка глюкозы печенью возобновляется для поддержания потребностей мозга. Точно так же увеличивается липолиз, обеспечивая жирные кислоты, которые могут использоваться в качестве топлива мышечной тканью, и глицерин, который может быть преобразован в глюкозу в печени. По мере увеличения периода голодания (например, с 12 до 14 часов) концентрация глюкозы в крови и секреция инсулина продолжают снижаться, а секреция глюкагона увеличивается. Увеличение секреции глюкагона и сопутствующее снижение секреции инсулина стимулируют расщепление гликогена с образованием глюкозы (гликогенолиз) и образование глюкозы из аминокислот и глицерина (глюконеогенез) в печени.После истощения запасов гликогена в печени концентрация глюкозы в крови поддерживается за счет глюконеогенеза. Таким образом, голодание, или катаболическое, состояние характеризуется сниженной секрецией инсулина, повышенной секрецией глюкагона и мобилизацией питательных веществ из запасов в печени, мышцах и жировой ткани.
Точно так же увеличивается липолиз, обеспечивая жирные кислоты, которые могут использоваться в качестве топлива мышечной тканью, и глицерин, который может быть преобразован в глюкозу в печени. По мере увеличения периода голодания (например, с 12 до 14 часов) концентрация глюкозы в крови и секреция инсулина продолжают снижаться, а секреция глюкагона увеличивается. Увеличение секреции глюкагона и сопутствующее снижение секреции инсулина стимулируют расщепление гликогена с образованием глюкозы (гликогенолиз) и образование глюкозы из аминокислот и глицерина (глюконеогенез) в печени.После истощения запасов гликогена в печени концентрация глюкозы в крови поддерживается за счет глюконеогенеза. Таким образом, голодание, или катаболическое, состояние характеризуется сниженной секрецией инсулина, повышенной секрецией глюкагона и мобилизацией питательных веществ из запасов в печени, мышцах и жировой ткани.
При дальнейшем голодании скорость липолиза продолжает увеличиваться в течение нескольких дней, а затем стабилизируется. Большая часть жирных кислот, высвобождаемых из жировой ткани, превращается в кетокислоты (бета-гидроксимасляная кислота и ацетоуксусная кислота, также известные как кетоновые тела) в печени, процесс, который стимулируется глюкагоном.Эти кетокислоты представляют собой небольшие молекулы, содержащие два атома углерода. Мозг, который обычно использует глюкозу для получения энергии, начинает использовать кетокислоты в дополнение к глюкозе. В конце концов, более половины ежедневных метаболических потребностей мозга в энергии удовлетворяются за счет кетокислот, что существенно снижает потребность в производстве глюкозы печенью и потребность в глюконеогенезе в целом. Это снижает потребность в аминокислотах, образующихся при распаде мышц, тем самым щадя мышечную ткань. Голодание характеризуется низкими концентрациями инсулина в сыворотке, высокими концентрациями глюкагона в сыворотке и высокими концентрациями свободных жирных кислот и кетокислот в сыворотке.
Большая часть жирных кислот, высвобождаемых из жировой ткани, превращается в кетокислоты (бета-гидроксимасляная кислота и ацетоуксусная кислота, также известные как кетоновые тела) в печени, процесс, который стимулируется глюкагоном.Эти кетокислоты представляют собой небольшие молекулы, содержащие два атома углерода. Мозг, который обычно использует глюкозу для получения энергии, начинает использовать кетокислоты в дополнение к глюкозе. В конце концов, более половины ежедневных метаболических потребностей мозга в энергии удовлетворяются за счет кетокислот, что существенно снижает потребность в производстве глюкозы печенью и потребность в глюконеогенезе в целом. Это снижает потребность в аминокислотах, образующихся при распаде мышц, тем самым щадя мышечную ткань. Голодание характеризуется низкими концентрациями инсулина в сыворотке, высокими концентрациями глюкагона в сыворотке и высокими концентрациями свободных жирных кислот и кетокислот в сыворотке.
Таким образом, в состоянии сытости инсулин стимулирует транспорт глюкозы в ткани (для потребления в качестве топлива или хранения в виде гликогена), транспорт аминокислот в ткани (для создания или замены белка) и транспорт жирных кислот. в ткани (чтобы обеспечить депо жира для будущих энергетических потребностей). В состоянии голодания секреция инсулина снижается, а секреция глюкагона увеличивается. Запасы гликогена в печени, а затем запасы белка и жира мобилизуются для производства глюкозы.В конечном счете, большая часть потребностей в питательных веществах обеспечивается жирными кислотами, мобилизованными из жировых запасов.
в ткани (чтобы обеспечить депо жира для будущих энергетических потребностей). В состоянии голодания секреция инсулина снижается, а секреция глюкагона увеличивается. Запасы гликогена в печени, а затем запасы белка и жира мобилизуются для производства глюкозы.В конечном счете, большая часть потребностей в питательных веществах обеспечивается жирными кислотами, мобилизованными из жировых запасов.
О раке поджелудочной железы | Исследование рака Великобритании
Поджелудочная железа – это железа, вырабатывающая пищеварительные соки и гормоны. Рак поджелудочной железы — это когда аномальные клетки в поджелудочной железе начинают делиться и расти неконтролируемым образом, образуя новообразование (опухоль).
Со временем клетки могут прорастать в окружающие кровеносные сосуды или органы, такие как тонкая кишка (двенадцатиперстная кишка).И раковые клетки могут распространиться на другие участки тела.
Поджелудочная железа
Поджелудочная железа является частью пищеварительной системы.
Поджелудочная железа находится довольно высоко в брюшке. Он лежит поперек вашего тела, где ваши ребра встречаются в нижней части грудины, сразу за животом. Это около 6 дюймов (15 сантиметров) в длину и по форме напоминает лист.
Поджелудочная железа состоит из 3 частей:
- широкий конец называется головкой
- тонкий конец называется хвостом
- часть посередине называется телом
Поджелудочная железа – это большая железа, которая вырабатывает пищеварительные соки и инсулин.Соки стекают по трубке (протоку поджелудочной железы) в двенадцатиперстную кишку. Двенадцатиперстная кишка — это первая часть тонкой кишки, соединенная с желудком.
Другая трубка (проток) впадает в двенадцатиперстную кишку. Желчный проток выходит из желчного пузыря и печени и соединяется с двенадцатиперстной кишкой рядом с протоком поджелудочной железы. Место, где два протока соединяются и встречаются с кишечником, называется фатеровой ампулой.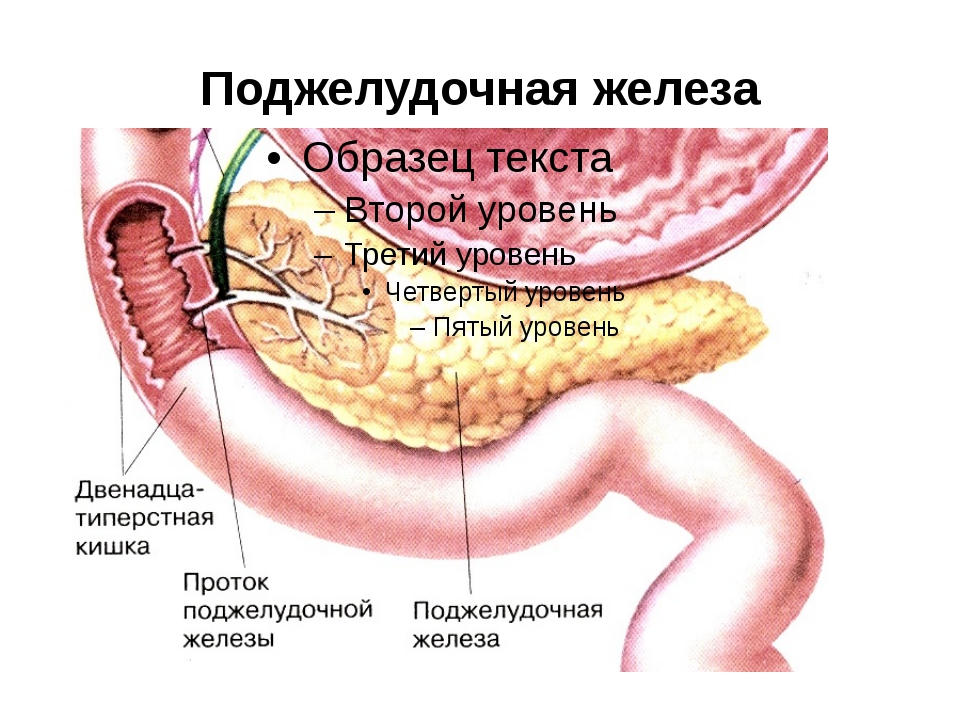
Поджелудочная железа представляет собой листовидный орган, расположенный под печенью, рядом с желчным пузырем, желудком и кишечником.
Является частью как пищеварительной, так и эндокринной систем.
Поджелудочная железа расположена поперек вашего тела сразу за желудком. Его длина составляет около 15 сантиметров.
Поджелудочная железа состоит из трех частей.
Широкий конец называется головкой.
Середина называется телом.
Тонкий конец называется хвостом.
Поджелудочная – большая железа. Он вырабатывает гормоны, которые регулируют уровень сахара в крови. Одним из таких гормонов является инсулин.Это эндокринная функция поджелудочной железы.
Поджелудочная железа также вырабатывает пищеварительные соки
Соки стекают по трубке, называемой протоком поджелудочной железы, в первую часть тонкой кишки.
Желчный проток соединяется с тонкой кишкой рядом с протоком поджелудочной железы.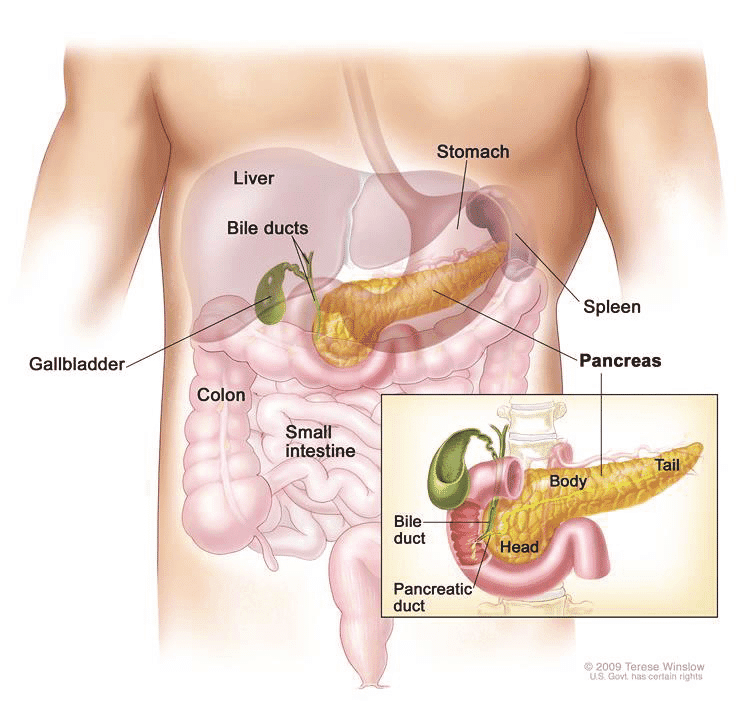
Место, где два протока соединяются и встречаются с кишечником, называется фатеровой ампулой.
Пищеварительные соки содержат ферменты, помогающие расщеплять пищу в кишечнике.
Это называется экзокринной функцией поджелудочной железы.
Рак, который начинается в клетках, вырабатывающих пищеварительные соки, называется экзокринным раком поджелудочной железы. Это самый распространенный тип рака поджелудочной железы.
Рак, который начинается в клетках, вырабатывающих инсулин и другие гормоны, называется эндокринным раком поджелудочной железы или нейроэндокринными опухолями поджелудочной железы.
Рядом с поджелудочной железой находятся лимфатические узлы, которые являются частью нашей иммунной системы и помогают нам бороться с инфекциями.
Лимфатические узлы часто являются первым местом, куда попадают раковые клетки, отделяясь от опухоли.
Для получения информации о раке поджелудочной железы посетите сайт cruk.org/cancer-types
.
Что делает поджелудочная железа?
Поджелудочная железа вырабатывает пищеварительные соки и инсулин, а также другие гормоны, связанные с пищеварением.
Часть, вырабатывающая пищеварительные соки, называется экзокринной поджелудочной железой. Часть, которая вырабатывает гормоны, в том числе инсулин, называется эндокринной поджелудочной железой.
Рак, развивающийся из этих двух частей, может вести себя по-разному и вызывать разные симптомы.
Что делает пищеварительная система?
Пищеварительная система расщепляет и переваривает пищу. Примерно через 2 часа нахождения в желудке частично переваренная пища перемещается в начало двенадцатиперстной кишки.
Когда пища достигает двенадцатиперстной кишки, поджелудочная железа выделяет пищеварительные соки, которые стекают по протоку поджелудочной железы и смешиваются с пищей.
Соки содержат ферменты, которые помогают расщеплять пищу на очень мелкие фрагменты. Эти фрагменты всасываются в организм через тонкую кишку.
Эти фрагменты всасываются в организм через тонкую кишку.
Поджелудочная железа и инсулин
Поджелудочная железа вырабатывает инсулин. Инсулин поддерживает уровень сахара в крови на стабильном уровне. Это означает, что клетки организма получают достаточно пищи, но не слишком много. Поджелудочная железа вырабатывает и выделяет больше инсулина, если уровень сахара в крови высок. Если уровень слишком низкий, он выпускает меньше.
У вас диабет, если вы не вырабатываете достаточно инсулина.
Насколько распространен рак поджелудочной железы?
Ежегодно в Великобритании рак поджелудочной железы диагностируется у 10 500 человек.Это 10-й наиболее распространенный вид рака в Великобритании.
Кто болеет раком поджелудочной железы?
Рак поджелудочной железы чаще встречается у пожилых людей. Более 45 из 100 человек с диагнозом (более 45%) – люди в возрасте 75 лет и старше. Рак поджелудочной железы редко встречается у людей моложе 40 лет.
В Англии рак поджелудочной железы чаще встречается у людей, живущих в более бедных районах. Это чаще встречается у белых и чернокожих, чем у азиатов.
Организация поджелудочной железы человека в норме и при диабете
У нормального здорового взрослого человека поджелудочная железа весит приблизительно 100 г, имеет длину от 14 до 25 см [1], объем приблизительно 72.4 ± 25,8 см 3 [2] и имеет как дольчатую, так и удлиненную форму (рассмотрено ранее [1]). Лежа косо позади задней и верхней брюшной стенки, этот сильно паренхиматозный орган делится на пять анатомических частей: головку, крючковидный отросток (находится в вентральной доле головы), шейку, тело и хвост (рис. 1). Нормальная поджелудочная железа человека растет примерно до 30 лет со значительной вариабельностью массы или объема поджелудочной железы у взрослых [2].
Рис. 1 Основные анатомические особенности поджелудочной железы человека.( a ) Схема поджелудочной железы и окружающих органов. ( b ) Схематическое изображение организации эндокринной и экзокринной поджелудочной железы на клеточном уровне. ( c ) Островок поджелудочной железы человека, показывающий четыре типа эндокринных клеток. Масштабная линейка, 100 мкм. Этот рисунок доступен как часть загружаемого набора слайдов
( b ) Схематическое изображение организации эндокринной и экзокринной поджелудочной железы на клеточном уровне. ( c ) Островок поджелудочной железы человека, показывающий четыре типа эндокринных клеток. Масштабная линейка, 100 мкм. Этот рисунок доступен как часть загружаемого набора слайдов
Расположенный в верхней части живота, с головкой, непосредственно примыкающей к двенадцатиперстной кишке, область тела и хвоста поджелудочной железы простирается по средней линии тела до точки рядом с селезенкой.Точнее, головка лежит непосредственно напротив нисходящей и горизонтальной частей С-образной двенадцатиперстной кишки. Крючковатый отросток выступает вниз от головы и распространяется кзади по направлению к верхней брыжеечной артерии. Часть шейки простирается латерально от головки, где она соединяется с телом поджелудочной железы. Кзади от шеи находятся верхняя брыжеечная артерия и вена, а также место отхождения печеночной воротной вены. Аорта, верхняя брыжеечная артерия, левые почечные сосуды и левая почка расположены кзади от тела поджелудочной железы. Наконец, хвост находится в непосредственной близости от ворот селезенки. Эти анатомические параметры являются ключевыми для функции органа.
Наконец, хвост находится в непосредственной близости от ворот селезенки. Эти анатомические параметры являются ключевыми для функции органа.
Подавляющее большинство тканей поджелудочной железы выполняет свою экзокринную функцию, при которой пищеварительные ферменты вырабатываются и секретируются через сложный проток в двенадцатиперстную кишку. Клетки поджелудочной железы, вырабатывающие эти пищеварительные ферменты, представляют собой ацинарные клетки, происходящие от латинского слова «ацинус», что означает «виноград», поскольку они представляют собой клеточные агрегаты, образующие пучки, похожие на грозди винограда (рис.1) [3]. Ацинарные клетки составляют почти 85% поджелудочной железы, расположены в ацинусах и синтезируют и секретируют ферменты, активные в переваривании белков, жиров и углеводов, включая трипсин, липазу и амилазу [4]. Каждый ацинарный пучок соединяется с системой протоков поджелудочной железы. Центроацинарные клетки представляют собой наиболее периферическую систему протоков и частично покрывают апикальную поверхность ацинарных клеток. Центроацинарные клетки соединяются с вставочными протоками, которые конвергируют и образуют внутридольковые и междольковые протоки, которые, в свою очередь, впадают в главный панкреатический проток.Главный проток, Вирсунгов проток, впадает в двенадцатиперстную кишку. Остаточная часть главного панкреатического протока, расположенная в дорсальной доле, так называемый проток Санторини, впадает в двенадцатиперстную кишку как добавочный панкреатический проток. Главный проток также соединяется с желчным протоком в головке поджелудочной железы, образуя гепатопанкреатический проток (то есть фатерову ампулу). Поток через фатерову ампулу контролируется мышечным сфинктером Одди, открывающимся во время пищеварения и закрывающимся для предотвращения рефлюкса содержимого двенадцатиперстной кишки в дерево протоков поджелудочной железы после приема пищи.
Центроацинарные клетки соединяются с вставочными протоками, которые конвергируют и образуют внутридольковые и междольковые протоки, которые, в свою очередь, впадают в главный панкреатический проток.Главный проток, Вирсунгов проток, впадает в двенадцатиперстную кишку. Остаточная часть главного панкреатического протока, расположенная в дорсальной доле, так называемый проток Санторини, впадает в двенадцатиперстную кишку как добавочный панкреатический проток. Главный проток также соединяется с желчным протоком в головке поджелудочной железы, образуя гепатопанкреатический проток (то есть фатерову ампулу). Поток через фатерову ампулу контролируется мышечным сфинктером Одди, открывающимся во время пищеварения и закрывающимся для предотвращения рефлюкса содержимого двенадцатиперстной кишки в дерево протоков поджелудочной железы после приема пищи.
Ацинарные ферменты секретируются в богатую бикарбонатом жидкость, вырабатываемую эпителием протоков. Секреция поджелудочной железы происходит с низкой скоростью между приемами пищи (0,2–0,3 мл/мин) и заметно увеличивается во время еды (4,0 мл/мин) до общего суточного объема ~2,5 л [5]. Выделение жидкости поджелудочной железы регулируется несколькими гормонами, а также вегетативной нервной системой. Когда пища попадает в двенадцатиперстную кишку, энтероэндокринные клетки, обнаруженные в слизистой оболочке, выделяют гормоны (например, секретин, холецистокинин) в кровоток, которые, в свою очередь, стимулируют поджелудочную железу к выработке и выделению большого количества воды, бикарбонатов и пищеварительных ферментов (например, секретин, холецистокинин).например, амилаза и липаза) и зимогены (например, трипсиноген, химотрипсиноген, проэластаза и прокарбоксипептидаза), которые являются неактивными предшественниками ферментов, которые активируются протеолитическими ферментами после их секреции. Эти ферменты играют решающую роль в переваривании пищи, поступающей в тонкую кишку из желудка.
Выделение жидкости поджелудочной железы регулируется несколькими гормонами, а также вегетативной нервной системой. Когда пища попадает в двенадцатиперстную кишку, энтероэндокринные клетки, обнаруженные в слизистой оболочке, выделяют гормоны (например, секретин, холецистокинин) в кровоток, которые, в свою очередь, стимулируют поджелудочную железу к выработке и выделению большого количества воды, бикарбонатов и пищеварительных ферментов (например, секретин, холецистокинин).например, амилаза и липаза) и зимогены (например, трипсиноген, химотрипсиноген, проэластаза и прокарбоксипептидаза), которые являются неактивными предшественниками ферментов, которые активируются протеолитическими ферментами после их секреции. Эти ферменты играют решающую роль в переваривании пищи, поступающей в тонкую кишку из желудка.
Между скоплениями ацинарных клеток расположены рассеянные участки эндокринной секреторной ткани, известные как островки Лангерганса. Приблизительно один миллион этих микроорганизмов [6] существует в поджелудочной железе, общий вес которых составляет около 1 г и составляет 1–2% от общей массы поджелудочной железы [6]. При развитии поджелудочной железы человека островки возникают из компартмента энтодермальной ткани и наблюдаются в вентральной и дорсальной долях. У человека примерно 40–60% эндокринных клеток представляют собой бета-клетки, продуцирующие инсулин, а остальные представляют собой альфа-, дельта-клетки, панкреатический полипептид (PP; также известный как F) и эпсилон-клетки (рис. 1), которые секретируют глюкагон. соматостатин, панкреатический полипептид и грелин соответственно. Однако пропорция этих различных типов эндокринных клеток внутри островка варьируется в зависимости от размера островка, возраста и расположения в органе (обзор ранее [7, 8]).Меньшие островки состоят в основном из бета-клеток, в то время как более крупные островки могут иметь почти одинаковое количество бета- и альфа-клеток [7, 8]. Островки, происходящие из вентральной доли, содержат области, богатые PP-клетками, с небольшим количеством бета- и альфа-клеток, которые обнаруживаются исключительно в задней головке и крючковидных областях поджелудочной железы [9].
При развитии поджелудочной железы человека островки возникают из компартмента энтодермальной ткани и наблюдаются в вентральной и дорсальной долях. У человека примерно 40–60% эндокринных клеток представляют собой бета-клетки, продуцирующие инсулин, а остальные представляют собой альфа-, дельта-клетки, панкреатический полипептид (PP; также известный как F) и эпсилон-клетки (рис. 1), которые секретируют глюкагон. соматостатин, панкреатический полипептид и грелин соответственно. Однако пропорция этих различных типов эндокринных клеток внутри островка варьируется в зависимости от размера островка, возраста и расположения в органе (обзор ранее [7, 8]).Меньшие островки состоят в основном из бета-клеток, в то время как более крупные островки могут иметь почти одинаковое количество бета- и альфа-клеток [7, 8]. Островки, происходящие из вентральной доли, содержат области, богатые PP-клетками, с небольшим количеством бета- и альфа-клеток, которые обнаруживаются исключительно в задней головке и крючковидных областях поджелудочной железы [9].
Каждый островок кровоснабжается одной или несколькими небольшими артериями (артериолами), которые разветвляются на многочисленные капилляры. Эти капилляры появляются и сливаются в мелкие вены за пределами островка.Что касается иннервации поджелудочной железы, двигательные нервные волокна несут импульсы как к ацинарным клеткам, так и к панкреатическим островкам [10, 11]. Парасимпатические волокна индуцируют секрецию ацинарных клеток, что в конечном итоге приводит к выделению панкреатического сока, а также к стимуляции островков к секреции инсулина, глюкагона и других полипептидных гормонов, необходимых для нормальной регуляции уровня глюкозы в крови. Напротив, симпатические волокна вызывают ингибирование экзокринной и эндокринной секреции (ранее рассмотрено [12]). Таким образом, функции островков регулируются сигналами, инициируемыми вегетативными нервами, циркулирующими метаболитами (напр.г., глюкоза, аминокислоты и кетоновые тела), циркулирующие гормоны и местные (паракринные) гормоны.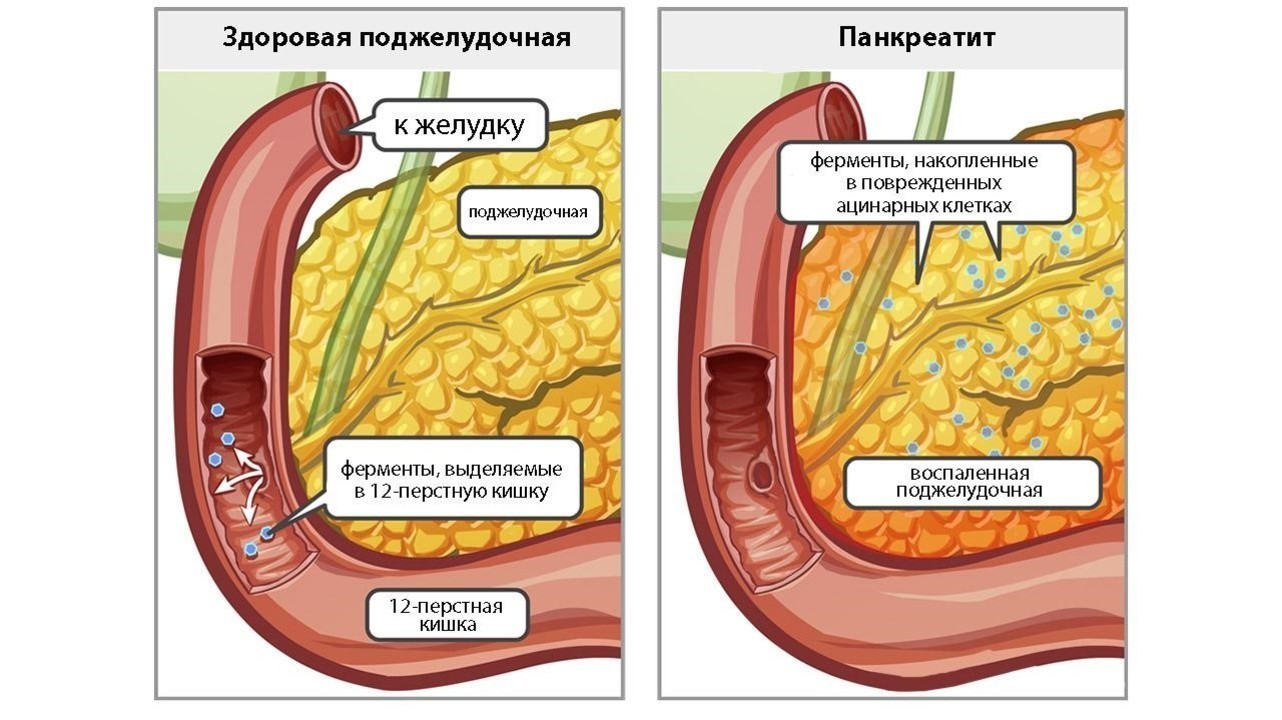
Стереологический анализ всей поджелудочной железы человека
Крупномасштабный захват изображения и компьютерный полуавтоматический анализ среза всей ткани
Использовались доноры с диабетом (nPOD) (№ 6107 Хвост 02, самец 2,2 года, не страдающий диабетом; рис. 1). Во-первых, весь срез ткани захватывается модифицированным методом «захвата изображения виртуального среза» с использованием 10-кратного объектива 23,24 .Изображение одного виртуального среза обычно состоит из нескольких сотен оптических панелей. Каждый виртуальный срез, полученный на нескольких флуоресцентных каналах, объединяется в один композит (рис. 1А). Захват изображения виртуального среза показан на дополнительном рисунке 1Aa.
Рисунок 1: Компьютерный анализ крупномасштабных изображений. ( A ) Виртуальный срез среза поджелудочной железы человека (самка, 2,2 года, не страдающий диабетом; nPOD # 6107 Tail 02), иммуноокрашенный на инсулин (зеленый), глюкагон (красный), соматостатин (белый) и ядра (синие). Серия смежных оптических панелей образца собирается и объединяется в единый монтаж изображения. Композит создается путем слияния четырех перекрывающихся изображений виртуальных срезов. ( B ) Изображения каждого канала, показывающие клеточный состав кластера островков из виртуального среза в ( A ). ( а) Бета-клетки. ( б) Альфа-клетки. ( c) Дельта-клетки. ( г) Ядра. ( e) Состав всех трех эндокринных клеток и ядер. ( f) Общая площадь эндокринных клеток показана как преобразованная 8-битная маска после автоматического порогового значения.( г) Ядра эндокринных клеток. (h) Общая площадь островков, включая неокрашенные фракции, такие как внутриостровковые капилляры. Обратите внимание, что каждому островку, включая небольшие кластеры, присваивается идентификационный номер. Таблица, обобщающая данные, полученные в результате компьютерного крупномасштабного анализа.
Серия смежных оптических панелей образца собирается и объединяется в единый монтаж изображения. Композит создается путем слияния четырех перекрывающихся изображений виртуальных срезов. ( B ) Изображения каждого канала, показывающие клеточный состав кластера островков из виртуального среза в ( A ). ( а) Бета-клетки. ( б) Альфа-клетки. ( c) Дельта-клетки. ( г) Ядра. ( e) Состав всех трех эндокринных клеток и ядер. ( f) Общая площадь эндокринных клеток показана как преобразованная 8-битная маска после автоматического порогового значения.( г) Ядра эндокринных клеток. (h) Общая площадь островков, включая неокрашенные фракции, такие как внутриостровковые капилляры. Обратите внимание, что каждому островку, включая небольшие кластеры, присваивается идентификационный номер. Таблица, обобщающая данные, полученные в результате компьютерного крупномасштабного анализа.
Первым этапом обработки изображения является «вычитание фона с катящимся шаром» для удаления больших пространственных вариаций интенсивности фона, которое применяется ко всем полученным изображениям на 4 каналах в целом (т. е. нет выбора региона). На S.1A.b показано окрашенное DAPI изображение после вычитания фона. Для точного количественного определения массы эндокринных клеток наиболее важным шагом в нашем методе является определение области поджелудочной железы, к которой нормализуется масса эндокринных клеток. Для анализа всего среза ткани важно учитывать структурную изменчивость всей поджелудочной железы. Например, в срезах ткани поджелудочной железы человека большие площади сосудов могут занимать >20% всего среза.Это будет смешивать правильную нормализацию с согласованностью и последующим анализом любых типов сравнений, например, между пострадавшими и контрольными, а также между каждой группой. Здесь мы вручную контурируем «область поджелудочной железы» до нормализованной, исключая области, которые не содержат эндокринных клеток/островков или экзокринных клеток и занимают> 0,05% данного участка (S.1B), такие как крупные кровеносные сосуды и протоки, периферия. накопленная внутрипанкреатическая жировая ткань (которая часто наблюдается у лиц с ожирением и пожилых людей) и пустое пространство между долями экзокринной части поджелудочной железы (которое в некоторых случаях может быть результатом подготовки ткани).
е. нет выбора региона). На S.1A.b показано окрашенное DAPI изображение после вычитания фона. Для точного количественного определения массы эндокринных клеток наиболее важным шагом в нашем методе является определение области поджелудочной железы, к которой нормализуется масса эндокринных клеток. Для анализа всего среза ткани важно учитывать структурную изменчивость всей поджелудочной железы. Например, в срезах ткани поджелудочной железы человека большие площади сосудов могут занимать >20% всего среза.Это будет смешивать правильную нормализацию с согласованностью и последующим анализом любых типов сравнений, например, между пострадавшими и контрольными, а также между каждой группой. Здесь мы вручную контурируем «область поджелудочной железы» до нормализованной, исключая области, которые не содержат эндокринных клеток/островков или экзокринных клеток и занимают> 0,05% данного участка (S.1B), такие как крупные кровеносные сосуды и протоки, периферия. накопленная внутрипанкреатическая жировая ткань (которая часто наблюдается у лиц с ожирением и пожилых людей) и пустое пространство между долями экзокринной части поджелудочной железы (которое в некоторых случаях может быть результатом подготовки ткани). Изображение DAPI используется для рисования контура, как показано в S.1A.c. Комбинация из 4 каналов используется в качестве эталона для определения эндокринных клеток/островков и «области поджелудочной железы». Контур можно нарисовать с помощью компьютерной мыши или графического планшета, что облегчает работу, а также повышает точность. После оконтуривания исключаются области вне контура (S.1A.d). Этот контур затем применяется к другим трем каналам, чтобы убедиться, что анализируется та же область, как показано на S.1A.e–g. Набор из четырех каналов может быть объединен в единое составное изображение RGB с тремя типами эндокринных клеток и ядрами разных цветов для визуальной ясности (S.1А.з). Изображения подготавливаются к анализу с использованием «Макроса обработки изображений» (S.2), а затем «Макрос анализа изображений» (S.3) использует обработанные изображения для количественного анализа. Макрос представляет собой специально написанный сценарий, основанный на функциях Fiji/Imagej и предоставляющий инструкции для количественной оценки интереса в каждом приложении.
Изображение DAPI используется для рисования контура, как показано в S.1A.c. Комбинация из 4 каналов используется в качестве эталона для определения эндокринных клеток/островков и «области поджелудочной железы». Контур можно нарисовать с помощью компьютерной мыши или графического планшета, что облегчает работу, а также повышает точность. После оконтуривания исключаются области вне контура (S.1A.d). Этот контур затем применяется к другим трем каналам, чтобы убедиться, что анализируется та же область, как показано на S.1A.e–g. Набор из четырех каналов может быть объединен в единое составное изображение RGB с тремя типами эндокринных клеток и ядрами разных цветов для визуальной ясности (S.1А.з). Изображения подготавливаются к анализу с использованием «Макроса обработки изображений» (S.2), а затем «Макрос анализа изображений» (S.3) использует обработанные изображения для количественного анализа. Макрос представляет собой специально написанный сценарий, основанный на функциях Fiji/Imagej и предоставляющий инструкции для количественной оценки интереса в каждом приложении. «Макрос обработки изображений» помогает вручную установить пороговые значения для всех четырех каналов, которые будут сохранены в виде текстового файла. Обработанные изображения будут сохранены вместе в одной папке с определенными именами файлов.Затем «Макрос анализа изображений» использует файлы в папке для количественной оценки клеточного состава (т.е. популяций и ядер бета-, альфа- и дельта-клеток; рис. 1Ba-d). Композиция всех трех эндокринных клеток и ядер показана на рис. 1Be. Общая площадь эндокринных клеток измеряется с использованием преобразованных 8-битных изображений (оттенки серого между черным и белым) после автоматического определения порога (рис. 1Bf). Для последующего количественного определения добавляется область ядра каждой эндокринной клетки внутри островков (рис. 1Bg). Общая площадь островков, включающая неокрашенные фракции, такие как внутриостровковые капилляры, измеряется путем автоматического контурирования каждой структуры островков (рис.1Вч). Каждому островку, включая небольшие кластеры, присваивается идентификационный номер, чтобы можно было получить конкретную информацию об отдельных островках, как показано в таблице.
«Макрос обработки изображений» помогает вручную установить пороговые значения для всех четырех каналов, которые будут сохранены в виде текстового файла. Обработанные изображения будут сохранены вместе в одной папке с определенными именами файлов.Затем «Макрос анализа изображений» использует файлы в папке для количественной оценки клеточного состава (т.е. популяций и ядер бета-, альфа- и дельта-клеток; рис. 1Ba-d). Композиция всех трех эндокринных клеток и ядер показана на рис. 1Be. Общая площадь эндокринных клеток измеряется с использованием преобразованных 8-битных изображений (оттенки серого между черным и белым) после автоматического определения порога (рис. 1Bf). Для последующего количественного определения добавляется область ядра каждой эндокринной клетки внутри островков (рис. 1Bg). Общая площадь островков, включающая неокрашенные фракции, такие как внутриостровковые капилляры, измеряется путем автоматического контурирования каждой структуры островков (рис.1Вч). Каждому островку, включая небольшие кластеры, присваивается идентификационный номер, чтобы можно было получить конкретную информацию об отдельных островках, как показано в таблице.
Настройка лабораторного компьютера имеет решающее значение, так как многоканальные изображения большого размера, полученные с помощью микроскопа, требуют высокопроизводительной системы передачи, хранения и поиска. Рекомендуется использовать проводную сеть Ethernet с сервером (серверами) и емкостью хранения более 30 терабайт, поскольку это облегчает передачу, поиск и обработку изображений и данных.Компьютерная система на базе Linux, работающая на сервере, оснащенном многоядерным процессором, 32 ГБ памяти и дополнительным пространством подкачки памяти, оптимальна для запуска «Макроса анализа изображений» на больших файлах изображений. Fuji/ImageJ совместим с Windows и Mac OS X, однако рабочая среда Linux удобна для пакетной обработки, работы в сети, запланированных процедур, массива независимых дисков с программным резервированием (RAID) для резервного копирования и доступа к инструментам командной строки с открытым исходным кодом, полезным для сжатие и преобразование между большими форматами файлов изображений. На практике изображения загружаются на сервер вечером, что позволяет проводить автоматический анализ ночью.
На практике изображения загружаются на сервер вечером, что позволяет проводить автоматический анализ ночью.
Измерения пространственного распределения островков и каждого типа эндокринных клеток в пределах островка
Пространственное распределение островков в срезе ткани можно исследовать путем измерения центроида каждого островка (рис. 2Аа) с использованием «Макроса анализа изображений». Для дальнейшего анализа архитектуры островков измеряются центральные координаты каждого типа эндокринных клеток внутри островков.Реконструированное распределение эндокринных клеток в каждом островке показано на рис. 2Ab (бета-клетки выделены зеленым цветом, альфа-клетки выделены красным цветом и дельта-клетки выделены синим цветом). Координатные данные используются для подсчета количества эндокринных клеток каждого типа в островках и для дальнейшего анализа клеточного состава и географической архитектуры островков (например, для математического моделирования 25,26,27,28,29 ).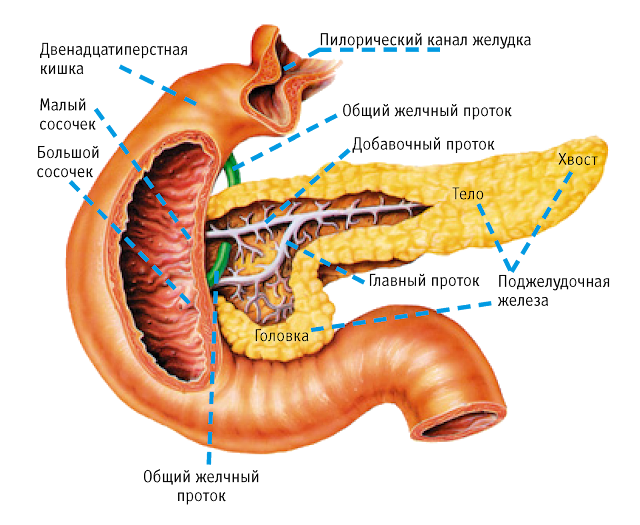 Последовательный анализ с помощью макроса анализа изображений показан на рис. 2B с использованием одного островка в качестве примера. Сначала флуоресцентные сигналы DAPI преобразуются в 8-битные изображения.Затем применяется сегментация водораздела для определения каждой границы ядра (рис. 2Ba). После идентификации каждого ядра каждому из них присваивается определенный идентификационный номер, соответствующий индивидуальным пространственным координатам ядер (рис. 2Бб). Увеличенный вид на рис. 2Bc показывает определенный периметр каждого ядра (желтая линия) с его собственным идентификационным номером. Затем все идентифицированные периметры ядра накладываются на сигналы трех гормонов, чтобы определить, какое ядро относится к какому конкретному типу клеток (рис.2Bd–f, бета-, альфа- и дельта-клетки соответственно). Автоматическая идентификация каждого типа клеток проиллюстрирована на рис. 2C на уровне одной ячейки с использованием бета-клетки в качестве примера. Для каждого идентифицированного ядра (обведенного желтой линией) периметр ядра расширяется на 1 пиксель (~ 1 мкм), чтобы обнаружить цитоплазматическую область, непосредственно окружающую ядро, которая используется для определения соответствующего типа клеток.
Последовательный анализ с помощью макроса анализа изображений показан на рис. 2B с использованием одного островка в качестве примера. Сначала флуоресцентные сигналы DAPI преобразуются в 8-битные изображения.Затем применяется сегментация водораздела для определения каждой границы ядра (рис. 2Ba). После идентификации каждого ядра каждому из них присваивается определенный идентификационный номер, соответствующий индивидуальным пространственным координатам ядер (рис. 2Бб). Увеличенный вид на рис. 2Bc показывает определенный периметр каждого ядра (желтая линия) с его собственным идентификационным номером. Затем все идентифицированные периметры ядра накладываются на сигналы трех гормонов, чтобы определить, какое ядро относится к какому конкретному типу клеток (рис.2Bd–f, бета-, альфа- и дельта-клетки соответственно). Автоматическая идентификация каждого типа клеток проиллюстрирована на рис. 2C на уровне одной ячейки с использованием бета-клетки в качестве примера. Для каждого идентифицированного ядра (обведенного желтой линией) периметр ядра расширяется на 1 пиксель (~ 1 мкм), чтобы обнаружить цитоплазматическую область, непосредственно окружающую ядро, которая используется для определения соответствующего типа клеток. Здесь это автоматическое расширение может ошибочно включать сигналы от других типов клеток из-за непосредственной близости каждого типа эндокринных клеток в пределах данного островка.Таким образом, макрос анализа изображений предназначен для определения наиболее распространенных сигналов, чтобы различать определенный тип клеток (S.3). Видеозапись компьютерного анализа размещена в Интернете (Видео 1). Схематический обзор рабочего процесса показан на рис. 3.
Здесь это автоматическое расширение может ошибочно включать сигналы от других типов клеток из-за непосредственной близости каждого типа эндокринных клеток в пределах данного островка.Таким образом, макрос анализа изображений предназначен для определения наиболее распространенных сигналов, чтобы различать определенный тип клеток (S.3). Видеозапись компьютерного анализа размещена в Интернете (Видео 1). Схематический обзор рабочего процесса показан на рис. 3.
( Aa ) Примеры измеренных центроидов островков и небольших скоплений. ( b) Реконструированное распределение эндокринных клеток в пределах каждого островка (бета-клетки выделены зеленым, альфа-клетки выделены красным и дельта-клетки выделены синим цветом).( B ) Последовательный анализ с помощью макроса анализа изображений. ( a) Сегментация водораздела применяется к 8-битному изображению, преобразованному из флуоресцентных сигналов DAPI. ( b) Ядрам присвоен каждый конкретный идентификационный номер, соответствующий индивидуальным пространственным координатам ядер. ( c) Увеличенный вид, показывающий определенный периметр каждого ядра (желтая линия) с его собственным идентификационным номером. ( г) Бета-клетки. ( e) Альфа-клетки.( f) Дельта-ячейки. ( C ) Автоматическая идентификация каждого типа клеток. В качестве примера показан случай одиночной бета-клетки. Периметр идентифицированного ядра (обведен желтой линией) увеличивается на 1 пиксель (~ 1 мкм), чтобы обнаружить цитоплазматическую область, непосредственно окружающую ядро, которая определит его конкретный тип клетки.
( b) Ядрам присвоен каждый конкретный идентификационный номер, соответствующий индивидуальным пространственным координатам ядер. ( c) Увеличенный вид, показывающий определенный периметр каждого ядра (желтая линия) с его собственным идентификационным номером. ( г) Бета-клетки. ( e) Альфа-клетки.( f) Дельта-ячейки. ( C ) Автоматическая идентификация каждого типа клеток. В качестве примера показан случай одиночной бета-клетки. Периметр идентифицированного ядра (обведен желтой линией) увеличивается на 1 пиксель (~ 1 мкм), чтобы обнаружить цитоплазматическую область, непосредственно окружающую ядро, которая определит его конкретный тип клетки.
Начиная с мультифлуоресцентной иммуногистохимии, 4-канальная визуализация выполняется в режиме виртуальных срезов на микроскопе.Захваченные изображения (каждое по 1–2 ГБ) сначала передаются на Сервер (например, с объемом хранилища 30 ТБ. Обратите внимание, что Сервер служит как для обработки изображений, так и для хранения больших наборов данных). Обработанные изображения загружаются на рабочую станцию для последующего анализа изображения. Наша схема маркировки обработанных изображений показана справа вместе с приблизительным временем обработки на каждом этапе. Во-первых, «Вычитание фона» применяется ко всем изображениям каналов с использованием Fiji/ImageJ. На изображении DAPI «область поджелудочной железы» контурируется вручную и сохраняется как файл «.файл roi. Определенная площадь поджелудочной железы применяется к изображениям, для которых был вычтен фон («BS.**.tif»), и полученные файлы изображений сохраняются как «Cropped.**.tif». Затем, запустив «Макрос обработки изображения», вручную установите порог оптимальной интенсивности в оттенках серого, следуя инструкции, заложенной в макросе. Макрос автоматически создает набор файлов изображений, готовых для количественного определения. Эти файлы в папке «Final» вручную загружаются на сервер для количественного определения различных параметров.
Обратите внимание, что Сервер служит как для обработки изображений, так и для хранения больших наборов данных). Обработанные изображения загружаются на рабочую станцию для последующего анализа изображения. Наша схема маркировки обработанных изображений показана справа вместе с приблизительным временем обработки на каждом этапе. Во-первых, «Вычитание фона» применяется ко всем изображениям каналов с использованием Fiji/ImageJ. На изображении DAPI «область поджелудочной железы» контурируется вручную и сохраняется как файл «.файл roi. Определенная площадь поджелудочной железы применяется к изображениям, для которых был вычтен фон («BS.**.tif»), и полученные файлы изображений сохраняются как «Cropped.**.tif». Затем, запустив «Макрос обработки изображения», вручную установите порог оптимальной интенсивности в оттенках серого, следуя инструкции, заложенной в макросе. Макрос автоматически создает набор файлов изображений, готовых для количественного определения. Эти файлы в папке «Final» вручную загружаются на сервер для количественного определения различных параметров. Запустите «Макрос анализа изображений», и файлы Excel будут автоматически созданы, содержащие результаты с выбранными параметрами. В нижней части перечислены примеры различных анализов со ссылкой на каждый рисунок, показанный в настоящем исследовании.
Запустите «Макрос анализа изображений», и файлы Excel будут автоматически созданы, содержащие результаты с выбранными параметрами. В нижней части перечислены примеры различных анализов со ссылкой на каждый рисунок, показанный в настоящем исследовании.
Моделирование для изучения возможной систематической ошибки выборки, возникающей в результате выбора областей, богатых островками и, кроме того, считается, что среднее значение трех повторов (или более) данного блока ткани представляет общую площадь/массу эндокринных клеток.
Для первого моделирования мы выбрали крайний случай, который содержит как богатые, так и бедные PP-клетками области в области головки поджелудочной железы человека (рис. 4А). Здесь мы стремимся показать, как выбор конкретных областей приводит к неточной количественной оценке. Мы начали с наиболее богатой PP-клетками области (красный прямоугольник на рис. 4Aa) с предположением, что любой исследователь будет искать скопление крупных эндокринных клеток/островков и пытаться захватить как можно больше внутри оптической панели, чтобы получить значимые данные.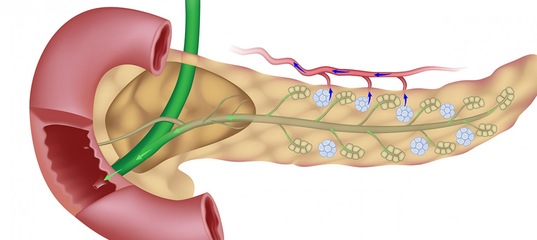 Начиная с области, наиболее богатой РР-клетками, систематически добавлялись другие панели, богатые РР-клетками, в конечном итоге добавляя области, не богатые РР-клетками, количество островков уменьшалось до тех пор, пока все островки не были учтены, в общей сложности до 153 панелей (выбранные оптические панели выделены желтым цветом и пронумерованы последовательно). Каждую панель анализировали на площадь эндокринных клеток и делили на общую площадь поджелудочной железы, чтобы получить процент площади эндокринных клеток. Полоса, отмеченная звездочкой, представляет собой фактическую среднюю площадь эндокринных клеток с использованием нашего метода крупномасштабного количественного определения.Эти результаты предполагают, что выбор областей, богатых островками, может завышать массу эндокринных клеток в 3-10 раз. Это завышение происходит из-за недостаточной нормализации, где «площадь поджелудочной железы» в нашем количественном анализе состояла из 556 оптических панелей, а не из 153, как максимум.
Начиная с области, наиболее богатой РР-клетками, систематически добавлялись другие панели, богатые РР-клетками, в конечном итоге добавляя области, не богатые РР-клетками, количество островков уменьшалось до тех пор, пока все островки не были учтены, в общей сложности до 153 панелей (выбранные оптические панели выделены желтым цветом и пронумерованы последовательно). Каждую панель анализировали на площадь эндокринных клеток и делили на общую площадь поджелудочной железы, чтобы получить процент площади эндокринных клеток. Полоса, отмеченная звездочкой, представляет собой фактическую среднюю площадь эндокринных клеток с использованием нашего метода крупномасштабного количественного определения.Эти результаты предполагают, что выбор областей, богатых островками, может завышать массу эндокринных клеток в 3-10 раз. Это завышение происходит из-за недостаточной нормализации, где «площадь поджелудочной железы» в нашем количественном анализе состояла из 556 оптических панелей, а не из 153, как максимум. ткань, потому что одно и то же смещение выборки будет перенесено на каждый раздел.
ткань, потому что одно и то же смещение выборки будет перенесено на каждый раздел.
( A ) Моделирование 1 с использованием среза ткани поджелудочной железы из области головки, который содержит области, богатые и бедные PP-клетками. ( a) Область поджелудочной железы выделена голубым цветом. Область, богатая РР-клетками, обведена желтым цветом. Врезка: первая область в рамке, снятая с помощью объектива с 10-кратным увеличением, показана красным. Оптические панели были последовательно выбраны, как указано в желтых прямоугольниках. ( b) Выбранные панели систематически добавлялись до 153 панелей.( c ) На график наносится кумулятивное среднее значение каждого количественного определения. Звездочка изображает значение, полученное в результате нашей крупномасштабной количественной оценки. ( B ) Измерение площади эндокринных клеток на каждом 50 -м -м срезе в пределах блока. ( a) Анализ области эндокринных клеток всей поджелудочной железы (т.е. PP, бета- и альфа-клеток) от головки, тела до области хвоста (слева направо). ( b) Блок № 4 был выбран, потому что он показал ту же массу эндокринных клеток, что и блок № 6.Весь блок № 4 был нарезан толщиной 5 мкм, что дало более 300 секций. Общая площадь эндокринных клеток измерялась в каждом 50 срезах с применением нашего крупномасштабного анализа. ( C) Моделирование 2 с использованием образца nPOD, показанного на рис. 1. ( a) Для проверки обычно используемого выбора областей, богатых островками, были последовательно выбраны оптические панели, до 30 панелей, как указано в желтых прямоугольниках. Обратите внимание, что каждая область оптической панели эквивалентна использованию 20-кратного объектива.( b) Диапазон завышения в результате выборки показан по сравнению с крупномасштабным анализом.
( a) Анализ области эндокринных клеток всей поджелудочной железы (т.е. PP, бета- и альфа-клеток) от головки, тела до области хвоста (слева направо). ( b) Блок № 4 был выбран, потому что он показал ту же массу эндокринных клеток, что и блок № 6.Весь блок № 4 был нарезан толщиной 5 мкм, что дало более 300 секций. Общая площадь эндокринных клеток измерялась в каждом 50 срезах с применением нашего крупномасштабного анализа. ( C) Моделирование 2 с использованием образца nPOD, показанного на рис. 1. ( a) Для проверки обычно используемого выбора областей, богатых островками, были последовательно выбраны оптические панели, до 30 панелей, как указано в желтых прямоугольниках. Обратите внимание, что каждая область оптической панели эквивалентна использованию 20-кратного объектива.( b) Диапазон завышения в результате выборки показан по сравнению с крупномасштабным анализом.
Затем мы проверили возможную изменчивость в пределах одного блока ткани (рис. 4В). Мы вырезали целый блок № 4 толщиной 5 мкм, что дало более 300 секций. Мы проверили каждый 50-й -й -й раздел, применяя наш метод. Обоснование выбора блока № 4 заключается в том, что один срез из блока № 4 и блока № 6 дал аналогичные значения массы каждой эндокринной клетки.В нашем препарате эти две секции находились друг от друга на расстоянии ~ 1 см. По сравнению с вариабельностью общей площади эндокринных клеток в пределах всей поджелудочной железы в пределах 0,15–3,0% (рис. 4Ва), различия в массе эндокринных клеток на 6 срезах, исследованных в пределах блока, находились в диапазоне 0,03–0,12% (рис. 4, а). Рис. 4Бб). Таким образом, один раздел на блок обеспечивает репрезентативную количественную оценку, когда измеряется весь раздел.
4В). Мы вырезали целый блок № 4 толщиной 5 мкм, что дало более 300 секций. Мы проверили каждый 50-й -й -й раздел, применяя наш метод. Обоснование выбора блока № 4 заключается в том, что один срез из блока № 4 и блока № 6 дал аналогичные значения массы каждой эндокринной клетки.В нашем препарате эти две секции находились друг от друга на расстоянии ~ 1 см. По сравнению с вариабельностью общей площади эндокринных клеток в пределах всей поджелудочной железы в пределах 0,15–3,0% (рис. 4Ва), различия в массе эндокринных клеток на 6 срезах, исследованных в пределах блока, находились в диапазоне 0,03–0,12% (рис. 4, а). Рис. 4Бб). Таким образом, один раздел на блок обеспечивает репрезентативную количественную оценку, когда измеряется весь раздел.
Использование образца nPOD в области хвоста (т. е. без области, богатой PP-клетками) с окрашиванием тремя основными гормонами (т.е. инсулин, глюкагон и соматостатин), показанные на рис. 1, мы попытались воспроизвести общий метод выбора нескольких областей из одного среза, начав с области, наиболее богатой островками (рис. 4Ca). Согласно большинству применений, описанных в опубликованных статьях, оптические панели последовательно отбирали до 30 панелей, площадь каждой из которых была эквивалентна площади при использовании объектива с 20-кратным увеличением, как указано в желтых прямоугольниках. Средние значения массы эндокринных клеток при выборе от 5 до 30 оптических панелей представлены на рис.4сб. По сравнению с анализом всего среза, который включает 146 оптических панелей, результирующая оценка завышена от 4,5 до 8 раз.
4Ca). Согласно большинству применений, описанных в опубликованных статьях, оптические панели последовательно отбирали до 30 панелей, площадь каждой из которых была эквивалентна площади при использовании объектива с 20-кратным увеличением, как указано в желтых прямоугольниках. Средние значения массы эндокринных клеток при выборе от 5 до 30 оптических панелей представлены на рис.4сб. По сравнению с анализом всего среза, который включает 146 оптических панелей, результирующая оценка завышена от 4,5 до 8 раз.
Сравнение с широко используемой морфометрией с подсчетом точек
Морфометрия с подсчетом точек на сегодняшний день является наиболее широко используемым методом количественного определения массы бета-клеток в поджелудочной железе. На фигуре 5А показан пример сравнения с использованием панели в оттенках серого инсулин-позитивных бета-клеток. Подсчет точек представляет собой регулярную квадратную сетку с интервалом между вершинами ~25 мкм, показанную белыми точками на наложенном изображении. Желтые контуры вокруг бета-клеток показывают степень классифицированной массы бета-клеток. Вершины, зарегистрированные как положительные, выделены зеленым цветом. Общая площадь бета-клеток измеряется как отношение положительных к отрицательным вершинам сетки (всего 945 точек). На этой панели было подсчитано 30 точек, что дало массу бета-клеток 3,18%, тогда как по нашему методу она количественно определяется как 1,54%.
Желтые контуры вокруг бета-клеток показывают степень классифицированной массы бета-клеток. Вершины, зарегистрированные как положительные, выделены зеленым цветом. Общая площадь бета-клеток измеряется как отношение положительных к отрицательным вершинам сетки (всего 945 точек). На этой панели было подсчитано 30 точек, что дало массу бета-клеток 3,18%, тогда как по нашему методу она количественно определяется как 1,54%.
(A ) Пример сравнения с использованием панели инсулин-положительных бета-клеток в градациях серого, наложенной на обычную квадратную сетку с интервалом между вершинами 25 мкм.Степень классифицированной массы бета-клеток обведена желтым цветом. Вершины, зарегистрированные как положительные, выделены зеленым цветом. ( B ) Моделирование с использованием одного и того же среза ткани поджелудочной железы из области головки, которая содержит области, богатые и бедные PP-клетками, показанные на рис.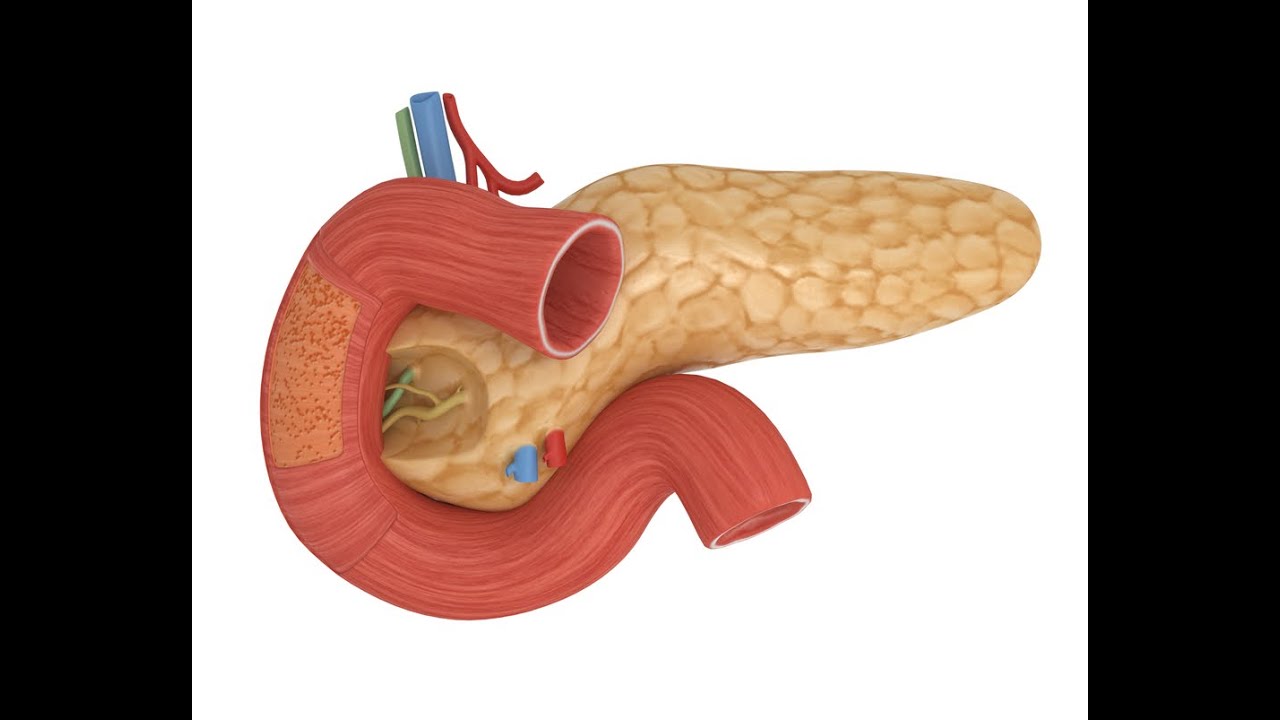 2A. ( C) Сравнение в каждой оптической панели. Различия нормализованы к измерению нашего метода и показаны в виде соотношения. Заниженные значения показаны красными полосами. ( D) Репрезентативный вид панелей, которые привели к недооценке.( E) Пример количественного определения в островках мыши и человека при применении морфометрии с подсчетом точек.
2A. ( C) Сравнение в каждой оптической панели. Различия нормализованы к измерению нашего метода и показаны в виде соотношения. Заниженные значения показаны красными полосами. ( D) Репрезентативный вид панелей, которые привели к недооценке.( E) Пример количественного определения в островках мыши и человека при применении морфометрии с подсчетом точек.
Затем мы провели в основном такое же моделирование, как описано на рис. 4A, B, но с использованием морфометрии с подсчетом точек. В результате диапазон переоценки заметно увеличился аддитивно по сравнению с выбором областей, богатых островками, в диапазоне от 4 до 14 раз (рис. 5B). Сравнение в каждой оптической панели показывает, что это завышение происходит в большинстве из них (рис. 5C).Недооценка на некоторых панелях (красные столбцы на рис. 5С) происходит, когда панель содержит единично разбросанные эндокринные клетки, которые часто попадают между точками (рис. 5D). Общая заметная завышенная оценка может быть также связана с уникальной архитектурой островков человека по сравнению с островками грызунов, которые имеют ядро бета-клеток.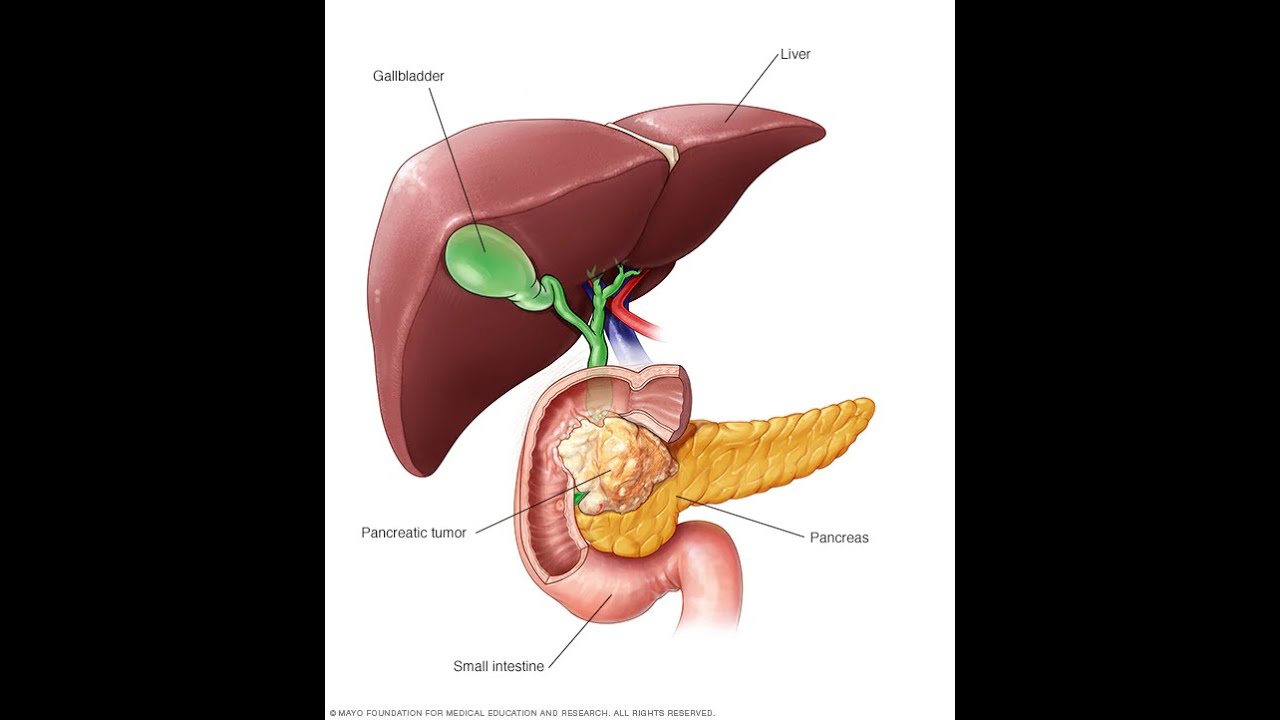 Рисунок 5E иллюстрирует возможную степень переоценки морфометрии подсчета точек между островками мыши и человека (30,4% против 22,3% и 19,3% против 7,4% соответственно).
Рисунок 5E иллюстрирует возможную степень переоценки морфометрии подсчета точек между островками мыши и человека (30,4% против 22,3% и 19,3% против 7,4% соответственно).
Распределение островков по размерам и клеточный состав
Используя вычислительную платформу, такую как MATLAB или Mathematica, можно выполнять различные целевые анализы на основе крупномасштабных наборов данных, полученных с помощью анализа изображений Fiji/Image J, как описано выше.Размеры островков находятся в широком диапазоне от одной эндокринной клетки до большого островка, состоящего из нескольких тысяч клеток. Кроме того, чаще встречаются более мелкие островки (включая одиночные клетки и небольшие скопления). Традиционно такой анализ проводился путем группирования островков по размеру как малых, средних и больших, и результаты суммировались по каждой категории. Наша цель — зафиксировать динамическое изменение клеточного состава по всему широкому распределению размеров островков (рис. 6А). Здесь мы использовали логарифмическую шкалу размера для гистограммы размеров островков, потому что она дает мелкие ячейки для большого количества маленьких островков и большие ячейки для небольшого количества больших островков.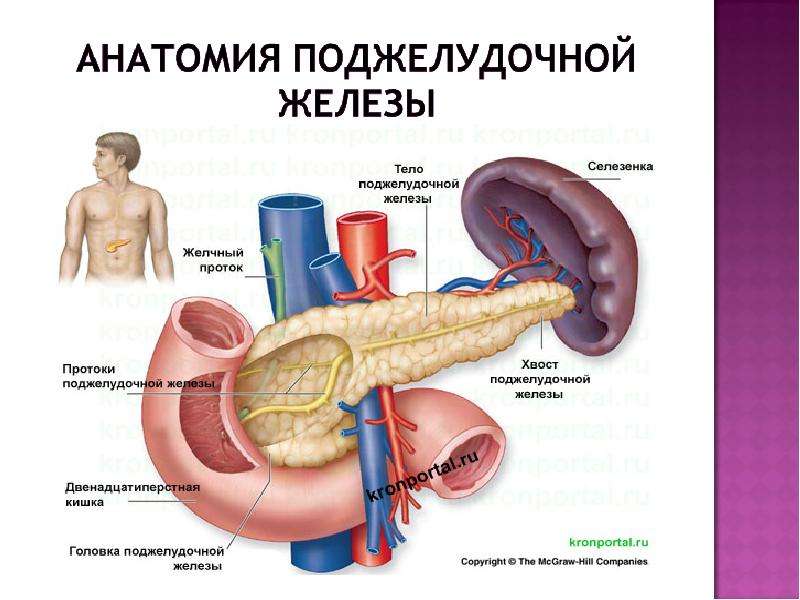 Это обеспечивает не только четкие категории размеров малых островков, но и статистически адекватное количество островков в бинах большого размера. В области головы (nPOD # 6107, возраст 2,2 года) бета-клетки составляют ~ 80% по всему распределению по размерам, тогда как доля альфа-клеток увеличивается в области тела и хвоста.
Это обеспечивает не только четкие категории размеров малых островков, но и статистически адекватное количество островков в бинах большого размера. В области головы (nPOD # 6107, возраст 2,2 года) бета-клетки составляют ~ 80% по всему распределению по размерам, тогда как доля альфа-клеток увеличивается в области тела и хвоста.
Были проанализированы образцы из области головы, тела и хвоста nPOD #6107. ( A) Частота размеров островков (серая полоса) и соотношение бета-клеток (зеленый), альфа-клеток (красный) и дельта-клеток (синий) в островках нанесены на график в зависимости от размера островков; означает ± SEM.Обратите внимание, что размер островков представлен в виде логарифмической шкалы с учетом большого количества маленьких островков и небольшого количества больших островков. Кроме того, площадь островка делится на площадь одной клетки (178 мкм 2 31 ), чтобы сделать их безразмерными значениями, представляющими количество клеток в данной области островка. См. преобразование между логарифмической площадью островка (логарифмическая) и эффективным диаметром (мкм). ( B) Доля распределения размеров островков (серая полоса) и общая площадь островков (красная линия).( C) Трехмерная визуализация распределения островков по размеру и форме. Каждая точка представляет собой отдельный островок/кластер в отношении размера (площади) и формы (округлости и диаметра Ферета). Плотность островков имеет цветовую кодировку от разреженной до плотной. ( D) Трехмерные диаграммы рассеяния, выделяющие островки, содержащие РР.
См. преобразование между логарифмической площадью островка (логарифмическая) и эффективным диаметром (мкм). ( B) Доля распределения размеров островков (серая полоса) и общая площадь островков (красная линия).( C) Трехмерная визуализация распределения островков по размеру и форме. Каждая точка представляет собой отдельный островок/кластер в отношении размера (площади) и формы (округлости и диаметра Ферета). Плотность островков имеет цветовую кодировку от разреженной до плотной. ( D) Трехмерные диаграммы рассеяния, выделяющие островки, содержащие РР.
На рис. 6В показан относительный вклад каждой ячейки малых и больших островков в общую площадь эндокринных клеток. Большее количество эндокринных скоплений и небольших островков (серые столбцы) не имеет заметной доли общей площади (отмечено красной линией), но меньшее количество крупных островков в основном составляет массу островков.
Дополнительными параметрами, которые мы измеряем, являются округлость и диаметр Ферета каждой островковой структуры.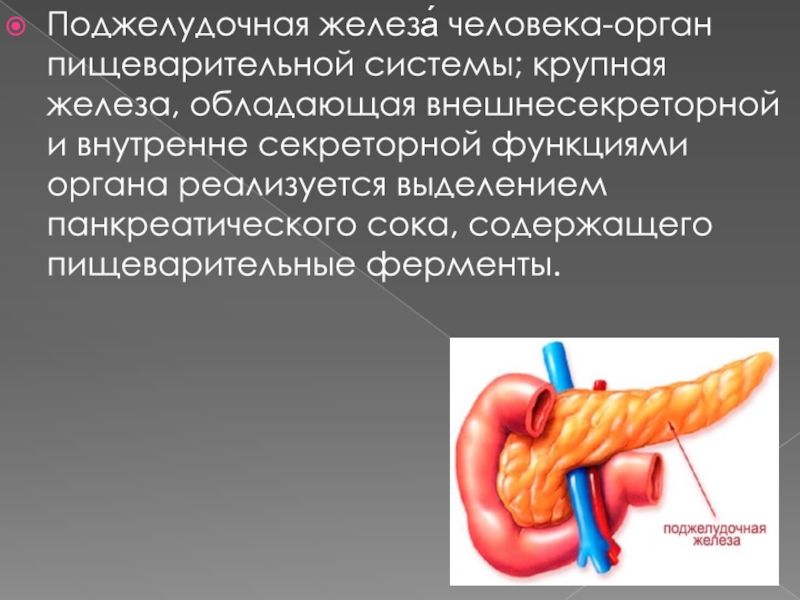 Округлость сообщает о степени округлости конструкции, где 1,0 соответствует идеальному кругу. Диаметр Ферета — это самое длинное расстояние внутри конструкции. Круглость и диаметр Фере тесно связаны между собой и вместе изображают форму данной структуры 21 . При таких параметрах площади, диаметра Ферета и округлости все распределение эндокринных клеток и островков во всем образце можно визуализировать на трехмерной диаграмме рассеяния (рис.6С). Цветовое кодирование сообщает о плотности кластера аналогичного размера и формы. Большое количество синглетов и небольших скоплений эндокринных клеток плотно сгруппированы в нижней части трехмерной диаграммы рассеяния. Небольшое количество крупных островков показано как одиночные рассеянные (т.е. красные точки) с различными размерами и формами от сферической до удлиненной структуры.
Округлость сообщает о степени округлости конструкции, где 1,0 соответствует идеальному кругу. Диаметр Ферета — это самое длинное расстояние внутри конструкции. Круглость и диаметр Фере тесно связаны между собой и вместе изображают форму данной структуры 21 . При таких параметрах площади, диаметра Ферета и округлости все распределение эндокринных клеток и островков во всем образце можно визуализировать на трехмерной диаграмме рассеяния (рис.6С). Цветовое кодирование сообщает о плотности кластера аналогичного размера и формы. Большое количество синглетов и небольших скоплений эндокринных клеток плотно сгруппированы в нижней части трехмерной диаграммы рассеяния. Небольшое количество крупных островков показано как одиночные рассеянные (т.е. красные точки) с различными размерами и формами от сферической до удлиненной структуры.
Трехмерная диаграмма рассеяния, показанная на рис. 6D, предназначена для визуализации регионального распределения определенного типа клеток, в данном случае PP-клеток, содержащих островки, отмеченные красным.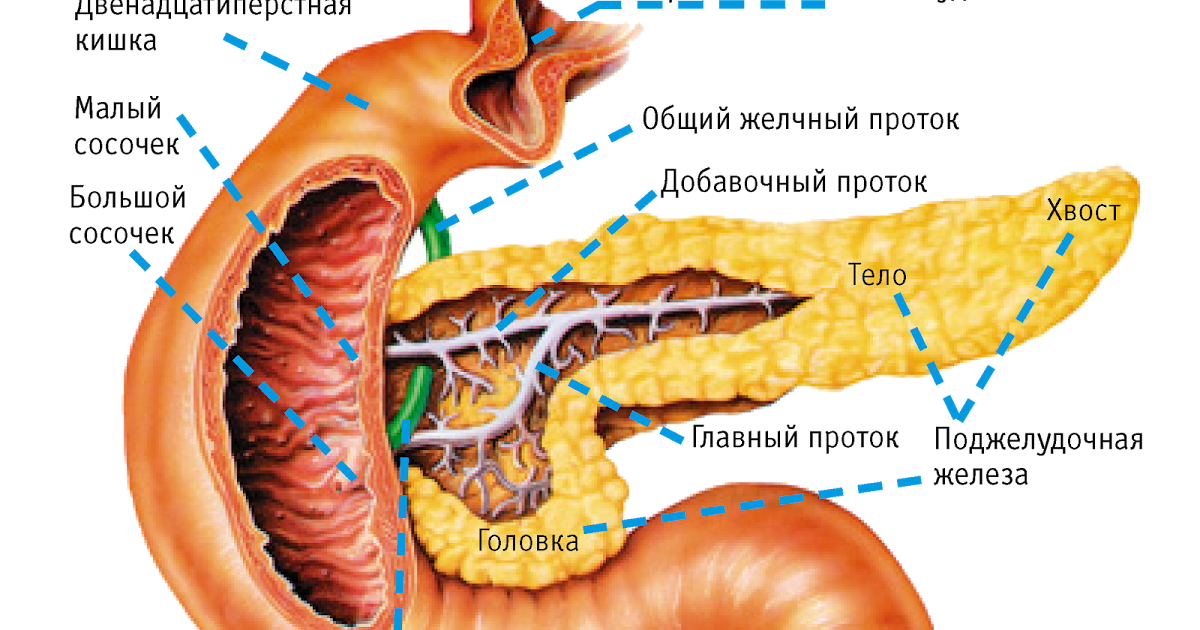 Можно визуально продемонстрировать значительную сегрегацию PP-клеток в области головы в отличие от значительно меньшего количества PP-клеток в области тела и хвоста.
Можно визуально продемонстрировать значительную сегрегацию PP-клеток в области головы в отличие от значительно меньшего количества PP-клеток в области тела и хвоста.
Пользовательские сценарии для этих анализов представлены в S.2–7.
Индивидуальная неоднородность массы бета-клеток/эндокринных клеток
Анализ поджелудочной железы в целом выявил заметную индивидуальную вариабельность (т.е. региональные различия), а также индивидуальную неоднородность массы бета-клеток/островков. На рисунке 7 показаны 10 случаев анализа всей поджелудочной железы от головки, тела до области хвоста.Все графики построены в одном масштабе для лучшего сравнения. В целом региональное распределение массы бета-клеток/островков показывает постепенное увеличение от головы к хвосту, хотя оно заметно колеблется. Прямой корреляции между возрастом и полом не наблюдается. Лица с ожирением, не страдающие диабетом В и большинство больных СД2, кроме I, не отличаются от лиц с нормальным весом. Неоднородность среди пациентов с СД2 и дальнейшее сравнение с недиабетическими субъектами поразительны.
(A–E) лица, не страдающие диабетом. (F–J) пациента с СД2. Ось X: номер блока от головы, тела до области хвоста (слева направо).
Возможная систематическая ошибка при оценке общей массы эндокринных клеток у отдельных лиц путем выбора конкретного блока ткани поджелудочной железы из всей поджелудочной железы человека . Здесь мы рассмотрели, в какие диапазоны «оценочная масса островков» может отклоняться в зависимости от отбора, используя 10 случаев, показанных на рис.8. Граница области головы была анатомически определена на шее, а оставшаяся часть была разделена пополам на области тела и хвоста (например, рис. 8А; случай F). Наша схема моделирования должна была охватывать каждый возможный выбор. Результаты смоделированного анализа каждого отдельного случая приведены в таблице S1. Затем мы объединили все эти результаты из 10 случаев и исследовали диапазон между максимальной и минимальной завышенной оценкой, полученной в результате 5 различных методов отбора, по сравнению с анализом всей поджелудочной железы (точечные диаграммы на рис.
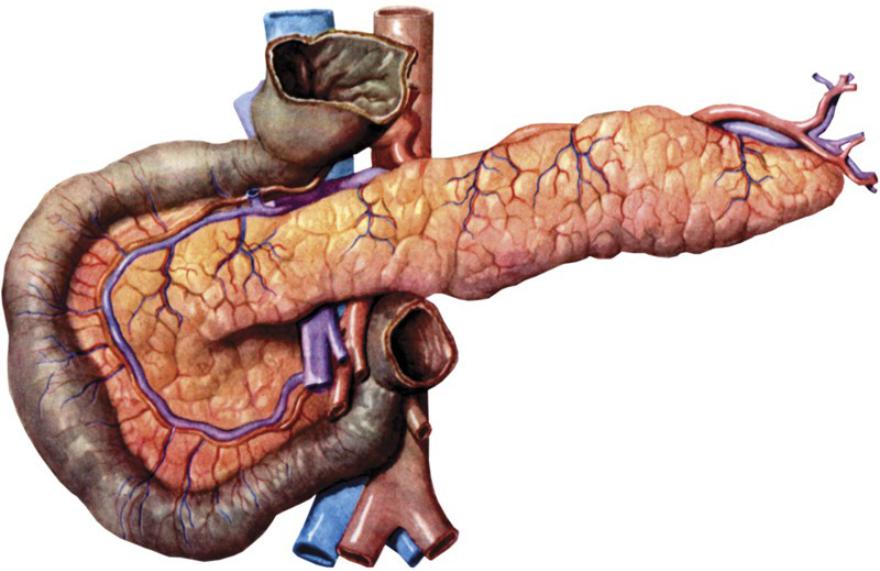 8Б). По сути, любой выбор может привести к занижению или завышению оценки примерно в 2 раза, даже на основе нашего анализа всей ткани поджелудочной железы. Обратите внимание, что при выборе «богатых островками» областей, как мы описали на рис. 3 и 4, завышенная оценка может быть увеличена примерно в 5–10 раз. Рис. 8: Моделирование взятия проб тканей.
8Б). По сути, любой выбор может привести к занижению или завышению оценки примерно в 2 раза, даже на основе нашего анализа всей ткани поджелудочной железы. Обратите внимание, что при выборе «богатых островками» областей, как мы описали на рис. 3 и 4, завышенная оценка может быть увеличена примерно в 5–10 раз. Рис. 8: Моделирование взятия проб тканей. (А) Схема отбора проб. Границу головной области анатомически определяли на шее, а оставшуюся часть делили пополам на туловищную и хвостовую области.( B) Многократные изменения массы островковых клеток при 5 типах моделирования по сравнению с анализом всей поджелудочной железы. ( C) Увеличение соотношения островковых клеток (т.е. бета/альфа, бета-дельта и альфа/дельта клеток) при выборе 100 крупных островков по сравнению с анализом всей поджелудочной железы.
С появлением представления о преобразовании не-бета-клеток в бета-клетки 1,2,3,4,5,6,7,8,9,10 возможны изменения соотношения бета:альфа:дельта-клеток часто измеряется путем выбора определенного количества островков в данном срезе ткани.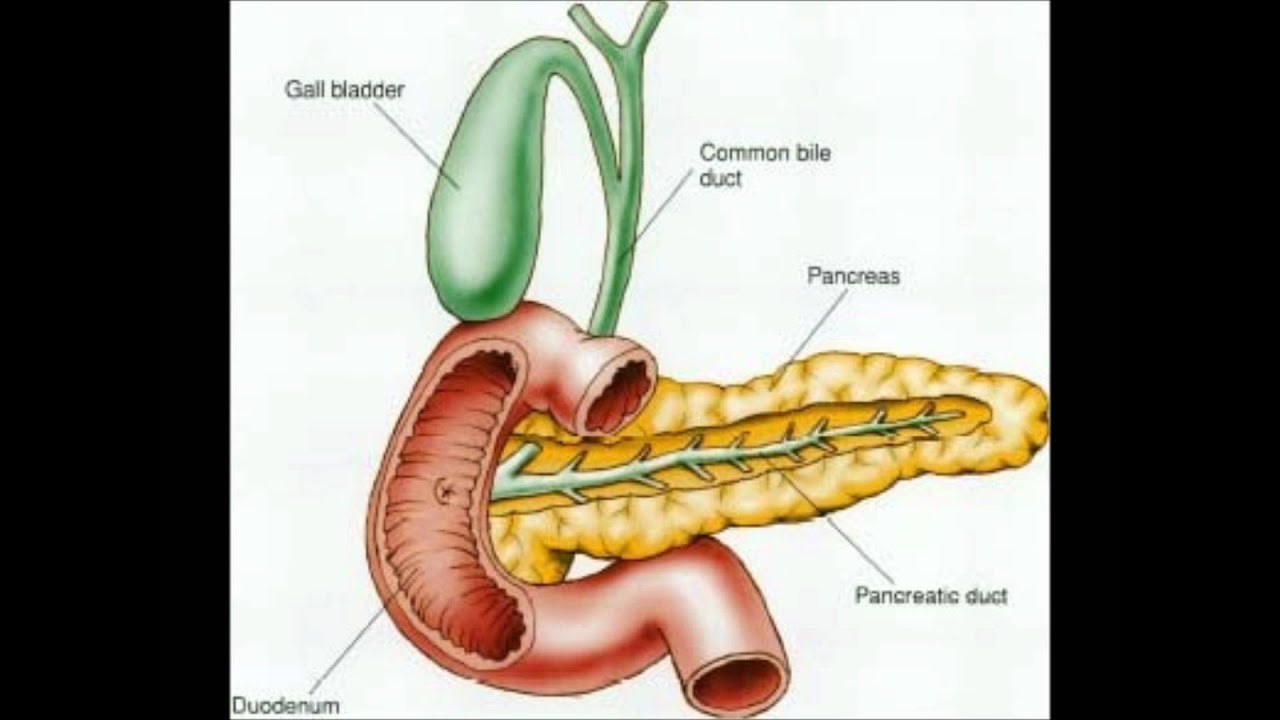 Здесь мы систематически отбирали 100 островков, начиная с самого большого, в каждом срезе/блоке во всех 10 случаях и сравнивали с анализом всей ткани поджелудочной железы (рис. 8С). Среднее общее количество островков на секцию в этом исследовании было > 500, таким образом, самые большие 100 островков составляют примерно 20% от общего числа островков на секцию. Общая тенденция к недооценке соотношения бета/альфа-клеток предполагает переоценку числа альфа-клеток, поскольку соотношение альфа-клеток внутри островка увеличивается с размером островка у человека 21 .Обратите внимание, что эта внутренняя зависящая от размера изменчивость островков человека может способствовать неточному представлению соотношения клеток, даже когда анализируется достаточно большое количество 100 островков. В качестве крайнего сравнения мы также изучили соотношение альфа/дельта клеток. Когда обе популяции значительно меньше, чем у бета-клеток, отбор заметно влияет на точность измерений.
Здесь мы систематически отбирали 100 островков, начиная с самого большого, в каждом срезе/блоке во всех 10 случаях и сравнивали с анализом всей ткани поджелудочной железы (рис. 8С). Среднее общее количество островков на секцию в этом исследовании было > 500, таким образом, самые большие 100 островков составляют примерно 20% от общего числа островков на секцию. Общая тенденция к недооценке соотношения бета/альфа-клеток предполагает переоценку числа альфа-клеток, поскольку соотношение альфа-клеток внутри островка увеличивается с размером островка у человека 21 .Обратите внимание, что эта внутренняя зависящая от размера изменчивость островков человека может способствовать неточному представлению соотношения клеток, даже когда анализируется достаточно большое количество 100 островков. В качестве крайнего сравнения мы также изучили соотношение альфа/дельта клеток. Когда обе популяции значительно меньше, чем у бета-клеток, отбор заметно влияет на точность измерений.
Трехмерная карта маршрутов островков в поджелудочной железе здорового человека
В этом исследовании поджелудочная железа здорового человека от донора использовалась для оценки характеристик островков и их пространственного распределения. Первоначально первые измеряемые параметры состояли из длины ( 25 см ) и объема ( 45 см 3 ). Далее были приняты во внимание четыре области поджелудочной железы, а именно головка (обозначенная как B1), шейка (B2), тело (B3) и хвост (B4). Из каждого среза поджелудочной железы мы использовали один репрезентативный поперечный срез, который был разделен на 16 гистологических слайдов. На каждом предметном стекле проводили полуавтоматические морфометрические измерения с целью выявления особенностей панкреатических островков.Мы проанализировали в общей сложности 5423 островков , принадлежащих к четырем интересующим отделам, а именно головке (910 островков), шейке (813 островков), телу (2057 островков) и хвосту (1643 островков) поджелудочной железы (таблица 1). . В таблице 1 показано количество обнаруженных островков для каждого гистологического предметного стекла (B1[P1–P16]–B4[P1–P16]). Максимальное количество островков, обнаруженных на предметном стекле, было обнаружено в срезе тела поджелудочной железы (233 островка), а именно на предметном стекле B3[P5], тогда как минимальное количество островков было обнаружено в срезе шейки на предметном стекле B2[P4].
Первоначально первые измеряемые параметры состояли из длины ( 25 см ) и объема ( 45 см 3 ). Далее были приняты во внимание четыре области поджелудочной железы, а именно головка (обозначенная как B1), шейка (B2), тело (B3) и хвост (B4). Из каждого среза поджелудочной железы мы использовали один репрезентативный поперечный срез, который был разделен на 16 гистологических слайдов. На каждом предметном стекле проводили полуавтоматические морфометрические измерения с целью выявления особенностей панкреатических островков.Мы проанализировали в общей сложности 5423 островков , принадлежащих к четырем интересующим отделам, а именно головке (910 островков), шейке (813 островков), телу (2057 островков) и хвосту (1643 островков) поджелудочной железы (таблица 1). . В таблице 1 показано количество обнаруженных островков для каждого гистологического предметного стекла (B1[P1–P16]–B4[P1–P16]). Максимальное количество островков, обнаруженных на предметном стекле, было обнаружено в срезе тела поджелудочной железы (233 островка), а именно на предметном стекле B3[P5], тогда как минимальное количество островков было обнаружено в срезе шейки на предметном стекле B2[P4].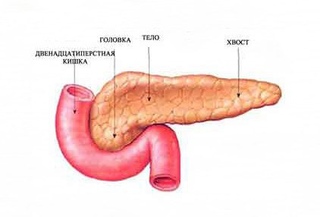 горка.С точки зрения продольной перспективы срезов поджелудочной железы (общее количество островков, обнаруженных во всех срезах на предметных стеклах B1–4[Px]), максимальное количество островков было обнаружено на предметных стеклах B1–4[P15] (473 островка), а минимальное количество островков на предметных стеклах B1–4[P12], всего 156 островков (таблица 1). Анализ морфометрических измерений показал, что общая площадь 2D островков составляет на каждом срезе (таблица 2). Таким образом, 16 гистологических препаратов среза головы (B1) показали общую площадь островков из 9.252 мм мм 2 и средний островной площадью 0,578 мм 2 (± 0,467), в то время как шейный ломтик (B2) показал Total Islet площадь 6,960 мм 2 и средняя площадь островков 0,435 мм 2 (±0,359). Срезы тела и хвоста показывают наибольшее покрытие поверхности (таблица 2). 16 гистологических препаратов среза тела (B3) показали общую площадь островков (и среднюю площадь островков) 14,004 мм 2 (среднее 0.
горка.С точки зрения продольной перспективы срезов поджелудочной железы (общее количество островков, обнаруженных во всех срезах на предметных стеклах B1–4[Px]), максимальное количество островков было обнаружено на предметных стеклах B1–4[P15] (473 островка), а минимальное количество островков на предметных стеклах B1–4[P12], всего 156 островков (таблица 1). Анализ морфометрических измерений показал, что общая площадь 2D островков составляет на каждом срезе (таблица 2). Таким образом, 16 гистологических препаратов среза головы (B1) показали общую площадь островков из 9.252 мм мм 2 и средний островной площадью 0,578 мм 2 (± 0,467), в то время как шейный ломтик (B2) показал Total Islet площадь 6,960 мм 2 и средняя площадь островков 0,435 мм 2 (±0,359). Срезы тела и хвоста показывают наибольшее покрытие поверхности (таблица 2). 16 гистологических препаратов среза тела (B3) показали общую площадь островков (и среднюю площадь островков) 14,004 мм 2 (среднее 0. 875 мм 2 ±0,391), которые были аналогичны общей площади островков, обнаруженной в срезе хвоста (B4), а именно 14,186 мм 2 (в среднем 0,887 мм 2,6330 ±0. Интересно, что хотя два среза (B3 и B4) показывают одинаковые значения общей площади островков, они показывают различное распределение островков на поверхности двух срезов (рис. 1А). С точки зрения 2D общая площадь островков на всех ( 64 предметных стеклах ) гистологических предметных стеклах показывает значение приблизительно 44.4 мм 2 (44 401 127,94 мкм 2 ) со средней площадью 2,775 мм 2 (±0,467) и средней площадью островков на предметном стекле 0,694 мм 2 (таблица ± ). Подробное сравнение площади островка и периметра островка показывает относительные различия в пропорциях между двумя морфометрическими параметрами (дополнительная таблица S1 онлайн). Кроме того, было проведено численное распределение между средней площадью и количеством островков для каждого предметного стекла микроскопа (дополнительная таблица S2 онлайн).
875 мм 2 ±0,391), которые были аналогичны общей площади островков, обнаруженной в срезе хвоста (B4), а именно 14,186 мм 2 (в среднем 0,887 мм 2,6330 ±0. Интересно, что хотя два среза (B3 и B4) показывают одинаковые значения общей площади островков, они показывают различное распределение островков на поверхности двух срезов (рис. 1А). С точки зрения 2D общая площадь островков на всех ( 64 предметных стеклах ) гистологических предметных стеклах показывает значение приблизительно 44.4 мм 2 (44 401 127,94 мкм 2 ) со средней площадью 2,775 мм 2 (±0,467) и средней площадью островков на предметном стекле 0,694 мм 2 (таблица ± ). Подробное сравнение площади островка и периметра островка показывает относительные различия в пропорциях между двумя морфометрическими параметрами (дополнительная таблица S1 онлайн). Кроме того, было проведено численное распределение между средней площадью и количеством островков для каждого предметного стекла микроскопа (дополнительная таблица S2 онлайн). На следующем этапе нас интересовало определение ряда параметров, а именно диаметра островков, среднего объема островков, общего количества островков внутри поджелудочной железы, общего объема, занимаемого островками внутри поджелудочной железы, и общей трехмерной поверхности островков. .
На следующем этапе нас интересовало определение ряда параметров, а именно диаметра островков, среднего объема островков, общего количества островков внутри поджелудочной железы, общего объема, занимаемого островками внутри поджелудочной железы, и общей трехмерной поверхности островков. .
Распределение панкреатических островков.
( A ) двухмерное распределение панкреатических островков на каждом участке (B1–B4) поджелудочной железы. Также представлены поджелудочная железа от донора и схема организации срезов. Дорсальная часть поджелудочной железы представлена слайдами Bx[P1-P4], тогда как вентральная часть поджелудочной железы представлена слайдами Bx[P13–P16].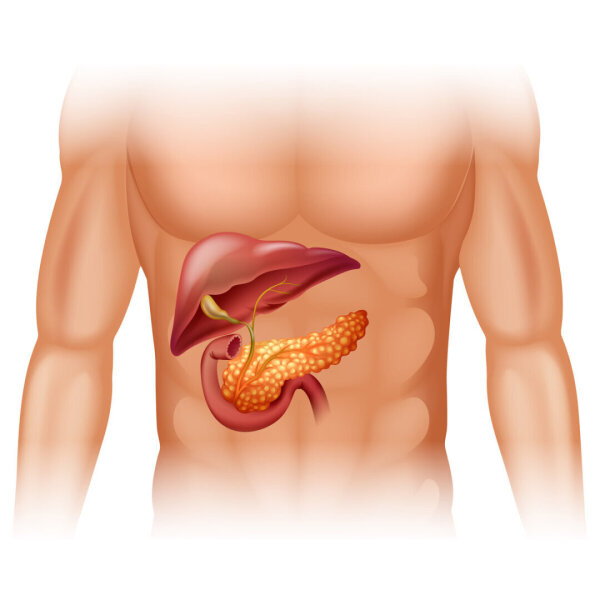 ( B ) доля островков вдоль четырех секций. Распределение островков поджелудочной железы на каждом гистологическом препарате в зависимости от количества островков и их средней площади (мкм 2 ) показано для: ( C ) области головки (B1), ( D ) области перешейка (B2 ), ( E ) область тела (B3), ( F ) область хвоста (B4).Средняя площадь поверхности (мкм 2 ) островков представлена на оси X, тогда как количество островков представлено на оси Y. Количество островков и их средняя площадь на срез (В1–В4) приведены для: ( J ) области головы (B1), ( I ) области перешейка (B2), ( G ) области тела ( B3), ( H ) хвостовая часть (B4). Линии тренда на панелях с C по H используют полином третьего порядка. ( K ) распределение островков, упорядоченное по размеру.Для каждого среза (B1–4) количество островков представлено по оси X, тогда как площадь поверхности (мкм 2 ) островков представлена по оси Y.
( B ) доля островков вдоль четырех секций. Распределение островков поджелудочной железы на каждом гистологическом препарате в зависимости от количества островков и их средней площади (мкм 2 ) показано для: ( C ) области головки (B1), ( D ) области перешейка (B2 ), ( E ) область тела (B3), ( F ) область хвоста (B4).Средняя площадь поверхности (мкм 2 ) островков представлена на оси X, тогда как количество островков представлено на оси Y. Количество островков и их средняя площадь на срез (В1–В4) приведены для: ( J ) области головы (B1), ( I ) области перешейка (B2), ( G ) области тела ( B3), ( H ) хвостовая часть (B4). Линии тренда на панелях с C по H используют полином третьего порядка. ( K ) распределение островков, упорядоченное по размеру.Для каждого среза (B1–4) количество островков представлено по оси X, тогда как площадь поверхности (мкм 2 ) островков представлена по оси Y. Точки в форме ромба представляют собой островки в области головы. Точки квадратной формы представляют собой островки в области шеи, а точки треугольной формы представляют собой островки в области тела. Точки круглой формы представляют собой островки в области хвоста. ( L ) глобальное распределение 5423 островков в зависимости от их периметра и площади.Пунктирная линия тренда панели L использует полиномиальный порядок 4. Прямая пунктирная линия и стрелки в полукруге на панели K и L представляют собой барьер, над которым наблюдались скопления островков.
Точки в форме ромба представляют собой островки в области головы. Точки квадратной формы представляют собой островки в области шеи, а точки треугольной формы представляют собой островки в области тела. Точки круглой формы представляют собой островки в области хвоста. ( L ) глобальное распределение 5423 островков в зависимости от их периметра и площади.Пунктирная линия тренда панели L использует полиномиальный порядок 4. Прямая пунктирная линия и стрелки в полукруге на панели K и L представляют собой барьер, над которым наблюдались скопления островков.
Диаметр островка
Для расчета среднего значения диаметра островка использовались два метода из-за различных форм наблюдаемых островков, которые создают относительную непропорциональность между их площадью и их периметром (т.е.островок в форме звезды будет иметь непропорциональный периметр от площади поверхности, а островок круглой формы будет показывать пропорциональность между периметром и площадью поверхности).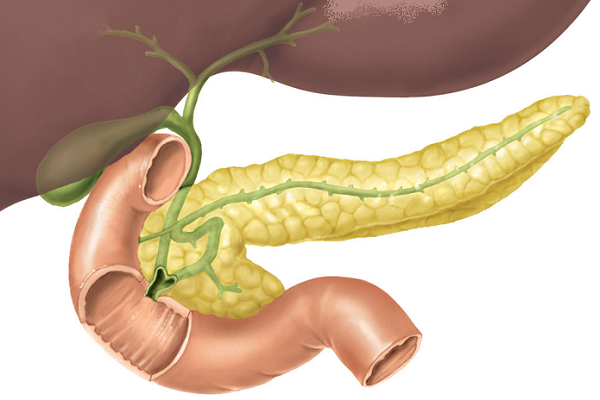 Первый метод учитывал средний периметр ( p м ) островков, измеренный на гистологическом предметном стекле, и рассчитывали средний диаметр островков (1). Таким образом, было обнаружено, что средний диаметр островков (диаметр островков по периметру — d ip ) всей поджелудочной железы имеет значение 113.83 мкм (±7,05). Второй метод, используемый для расчета диаметра панкреатических островков, учитывает их измеренную площадь поверхности ( a м ) по гистологическому предметному стеклу, а средний диаметр островка рассчитывают по формуле (2). Таким образом, с помощью этой второй версии формулы было обнаружено, что средний диаметр островков (диаметр островков с использованием площади — d ia ) всей поджелудочной железы имеет значение 104,02 мкм (± 5,0.67). Путем усреднения двух результатов мы рассчитали средний диаметр (средний диаметр — d м ) между двумя значениями (3), который считается более близким к фактическому среднему значению диаметра островка.
Первый метод учитывал средний периметр ( p м ) островков, измеренный на гистологическом предметном стекле, и рассчитывали средний диаметр островков (1). Таким образом, было обнаружено, что средний диаметр островков (диаметр островков по периметру — d ip ) всей поджелудочной железы имеет значение 113.83 мкм (±7,05). Второй метод, используемый для расчета диаметра панкреатических островков, учитывает их измеренную площадь поверхности ( a м ) по гистологическому предметному стеклу, а средний диаметр островка рассчитывают по формуле (2). Таким образом, с помощью этой второй версии формулы было обнаружено, что средний диаметр островков (диаметр островков с использованием площади — d ia ) всей поджелудочной железы имеет значение 104,02 мкм (± 5,0.67). Путем усреднения двух результатов мы рассчитали средний диаметр (средний диаметр — d м ) между двумя значениями (3), который считается более близким к фактическому среднему значению диаметра островка. Радиус (средний радиус островка — r i ) также был определен (4). Таким образом, средний диаметр островка ( d м ) между двумя методами оценки составил 108,92 мкм (±6.27) с радиусом ( r i ) 54,46 мкм (±3,13).
Радиус (средний радиус островка — r i ) также был определен (4). Таким образом, средний диаметр островка ( d м ) между двумя методами оценки составил 108,92 мкм (±6.27) с радиусом ( r i ) 54,46 мкм (±3,13).
Islet Volume
для полной трехмерной перспективы, MiLE Islet Volume P P ) был рассчитан в соответствии со средним диаметром островков ( D м ) классическая формула объема (5). Таким образом, средний объем островков ( V p ) показал значение 0.00068 мм 3 (686 994,29 ± 107 297,82 мкм 3 ) или 0,00069 мкл (±0,00011). Средняя трехмерная площадь поверхности островков ( A im ) показала значение 0,037 мм 2 (37 464,69 ± 4 109,69 мкм 2 ) и была рассчитана по формуле (6).
Общее количество островков и их объем внутри поджелудочной железы
Аппроксимация общего количества островков и объема, который они занимают, была сделана посредством виртуализации.Рассматривалась виртуальная модель, в которой поджелудочная железа была разделена на срезы толщиной, равной среднему региональному диаметру островка ( d i ). Далее мы считали, что каждый виртуальный срез включает в себя количество островков соответствующего региона. Таким образом, количество островков из каждого виртуального среза суммировали, чтобы выяснить общее количество островков в поджелудочной железе (7). Следовательно, количество островков в поджелудочной железе приблизилось к 3 204 588 островкам ( ~ 3.2 миллиона островков ). Выведенный по тому же правилу, что и выше, общий объем островков (8) показал значение 2 см 3 , среднее между четырьмя секциями (B1–4) при 0,5 ±0,1 см 3 ( Таблица 3). Общая площадь поверхности Islet 3D оценивалась на 1132 см 2 (или 0,1 м 2 ), усреднение между четырьмя разделами при 283 ± 93 см 2 (Таблица 3). Наконец, наша оценка процента островков от общего объема поджелудочной железы (45 см 3 ) показала приблизительное значение 4 .487% . Средний процент островков между секциями (B1–B4) составил 1,12 ± 0,3% (см. Таблицу 3).
Общая площадь поверхности Islet 3D оценивалась на 1132 см 2 (или 0,1 м 2 ), усреднение между четырьмя разделами при 283 ± 93 см 2 (Таблица 3). Наконец, наша оценка процента островков от общего объема поджелудочной железы (45 см 3 ) показала приблизительное значение 4 .487% . Средний процент островков между секциями (B1–B4) составил 1,12 ± 0,3% (см. Таблицу 3).
Распределение островков
Распределение островков внутри поджелудочной железы было одной из основных целей данного исследования. Используя тепловые карты для обзора структуры ткани поджелудочной железы, нам удалось проследить более плотные или менее плотные участки срезов (рис. 1А и рис.2Д). Мы также использовали тепловые карты для определения площади поверхности, занятой островками на каждом предметном стекле (рис. 2C). При сравнении двухмерных распределений четырех срезов первое важное наблюдение заключалось в том, что островки сгруппированы в головке поджелудочной железы. Эти группы островков постепенно распространяются по всей поджелудочной железе вплоть до области хвоста (рис. 1А и 2С, D). Обратите внимание, что начиная с головки и до хвоста поджелудочной железы темно-синяя область (низкая плотность) уменьшается в пользу светло-голубой области (более высокой плотности — рис.2С,Г). Доля островков вдоль поджелудочной железы также представляет интерес (рис. 1В). Особое наблюдение в этом случае указывает на то, что среднее количество островков на B1–4[P12] было очень небольшим по сравнению со средним количеством островков на других предметных стеклах B1–4[Px]. Не менее интересно, что среднее количество островков, присутствующих на предметных стеклах B1–4[P4] и B1–4[P15], показало самые большие значения. Кроме того, для каждого среза было выполнено как распределение числа островков и средней площади островков/препарата, так и распределение площади и периметра отдельных островков (рис.
2C). При сравнении двухмерных распределений четырех срезов первое важное наблюдение заключалось в том, что островки сгруппированы в головке поджелудочной железы. Эти группы островков постепенно распространяются по всей поджелудочной железе вплоть до области хвоста (рис. 1А и 2С, D). Обратите внимание, что начиная с головки и до хвоста поджелудочной железы темно-синяя область (низкая плотность) уменьшается в пользу светло-голубой области (более высокой плотности — рис.2С,Г). Доля островков вдоль поджелудочной железы также представляет интерес (рис. 1В). Особое наблюдение в этом случае указывает на то, что среднее количество островков на B1–4[P12] было очень небольшим по сравнению со средним количеством островков на других предметных стеклах B1–4[Px]. Не менее интересно, что среднее количество островков, присутствующих на предметных стеклах B1–4[P4] и B1–4[P15], показало самые большие значения. Кроме того, для каждого среза было выполнено как распределение числа островков и средней площади островков/препарата, так и распределение площади и периметра отдельных островков (рис.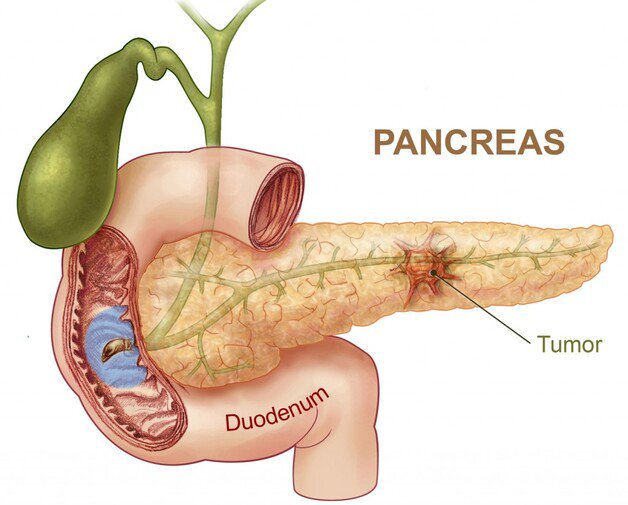 1С–Г). Таким образом, кластеризация распределения, наблюдаемая на рис. 1Е, указывает на почти равномерное рассеяние островков в теле поджелудочной железы. Глобальная тепловая карта, представляющая перекрывающиеся распределения четырех срезов, также показывает общее количество островков (рис. 2F) и сумму всех площадей островков (рис. 2А) на B1–4 [Px]. Оба распределения, рассматриваемые с боковой стороны, показывают схожую картину. Однако, если смотреть сверху, оба распределения показывают разные модели. Если боковой рисунок показывает линейную зависимость между общим количеством островков и суммой всех площадей островков, вид сверху показывает большую площадь островков на левой стороне срезов и большее количество островков на правой стороне срезов. (Инжир.2А,Е).
1С–Г). Таким образом, кластеризация распределения, наблюдаемая на рис. 1Е, указывает на почти равномерное рассеяние островков в теле поджелудочной железы. Глобальная тепловая карта, представляющая перекрывающиеся распределения четырех срезов, также показывает общее количество островков (рис. 2F) и сумму всех площадей островков (рис. 2А) на B1–4 [Px]. Оба распределения, рассматриваемые с боковой стороны, показывают схожую картину. Однако, если смотреть сверху, оба распределения показывают разные модели. Если боковой рисунок показывает линейную зависимость между общим количеством островков и суммой всех площадей островков, вид сверху показывает большую площадь островков на левой стороне срезов и большее количество островков на правой стороне срезов. (Инжир.2А,Е).
Тепловая карта распределения панкреатических островков по их количеству и площади поверхности.
( A ) Глобальная тепловая карта, представляющая перекрывающиеся распределения панели C (сумма всех плотностей от B1 до B4). Желтые области представляют более высокую плотность островков, а красный цвет представляет области с более низкой плотностью, ( B ) общая площадь островков по срезам (B1–4), ( C ) тепловая карта, которая указывает площадь поверхности, занятую островками. , ( D ) тепловая карта, представляющая плотность островков в секциях B1–B4.Желтые области представляют более высокую плотность островков, а синий цвет представляет области с более низкой плотностью, ( E ) общее количество островков в каждой секции, а именно B1–B4, ( F ) глобальная тепловая карта, представляющая перекрывающиеся распределения из панели D (сумма всех площадей поверхностей B1–4). Желтые области представляют более высокую занятость поверхности островками, а красный цвет указывает на более низкую занятость поверхности.
Желтые области представляют более высокую плотность островков, а красный цвет представляет области с более низкой плотностью, ( B ) общая площадь островков по срезам (B1–4), ( C ) тепловая карта, которая указывает площадь поверхности, занятую островками. , ( D ) тепловая карта, представляющая плотность островков в секциях B1–B4.Желтые области представляют более высокую плотность островков, а синий цвет представляет области с более низкой плотностью, ( E ) общее количество островков в каждой секции, а именно B1–B4, ( F ) глобальная тепловая карта, представляющая перекрывающиеся распределения из панели D (сумма всех площадей поверхностей B1–4). Желтые области представляют более высокую занятость поверхности островками, а красный цвет указывает на более низкую занятость поверхности.
Предпочтения по размеру островков
В соответствии с эволюционными параметрами каждого вида структура поджелудочной железы указывает на оптимальный размер ее внутренних компонентов, эндокринных или экзокринных.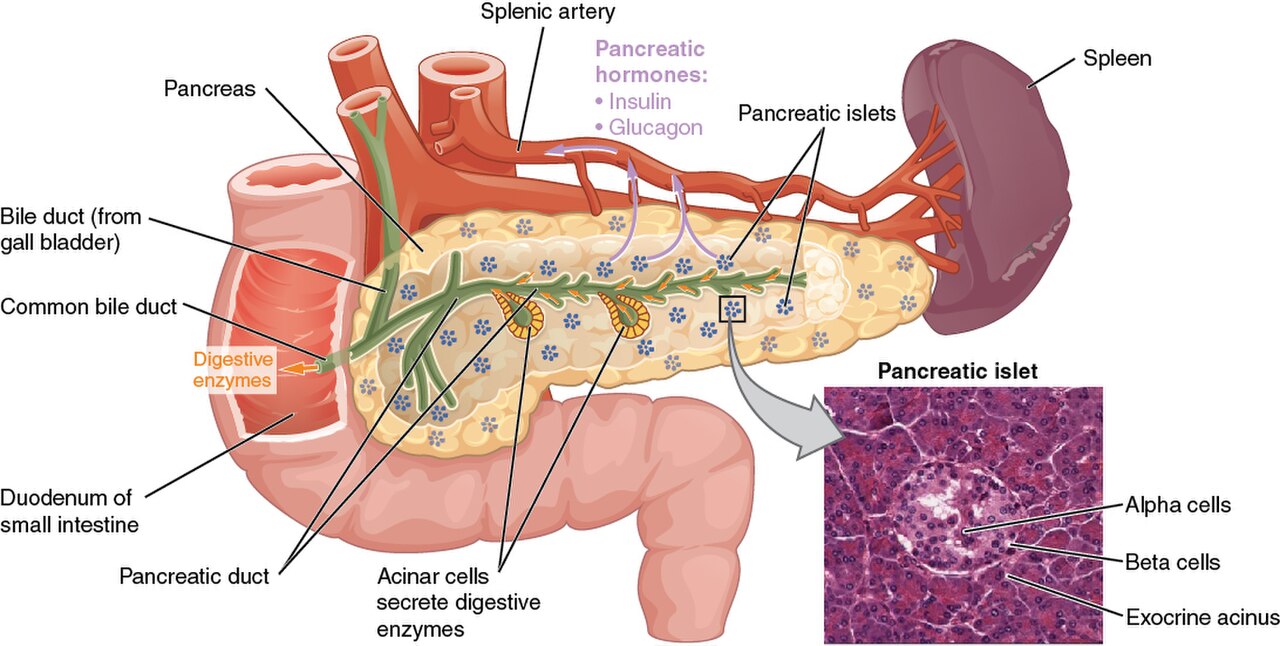 Наши данные свидетельствуют о том, что поджелудочная железа человека, по-видимому, «предпочитает» определенные размеры, когда речь идет об островках (таблица 4). С представленностью 67% (3614 островков) являются островки с площадью поверхности от 1000 до 10000 мкм 2 (рис. 3A, C, E, G, I и таблица 4). За этим большинством с долей 24% (1305 островков) следуют островки площадью от 10 000 до 100 000 мкм 2 (рис. 3A, B, D, F-I). Интересно, но не удивительно, что только 9% (493 островка) островков имеют площадь до 1000 мкм 2 (рис.3С). Наконец, менее 1% представлено отдельными скоплениями островков (рис. 3I).
Наши данные свидетельствуют о том, что поджелудочная железа человека, по-видимому, «предпочитает» определенные размеры, когда речь идет об островках (таблица 4). С представленностью 67% (3614 островков) являются островки с площадью поверхности от 1000 до 10000 мкм 2 (рис. 3A, C, E, G, I и таблица 4). За этим большинством с долей 24% (1305 островков) следуют островки площадью от 10 000 до 100 000 мкм 2 (рис. 3A, B, D, F-I). Интересно, но не удивительно, что только 9% (493 островка) островков имеют площадь до 1000 мкм 2 (рис.3С). Наконец, менее 1% представлено отдельными скоплениями островков (рис. 3I).
Пропорции островков поджелудочной железы человека.
(
( A ) Группа островков (верхняя вершина -6356 мкм 2 , нижний Islet-54,291 мкм 2 , левый остров -6700 мкм 2 ) Включен в категорию 1000-10 000 мкм 2 и 10 000-100 000 мкм 2 (поле зрения 20x), ( B ) Islet Пример ( B ) Islet (41,708 мкМ 2 ) Входит в категорию 10 000 мкМ 2 -100 000 мкм 2 (поле View 20x) , ( C ) выборка островков (верхний островок −386 мкм 2 , нижний островок −8814 мкм 2 ), входящих в категорию <1000 мкм 2 и 1000–10000 7мкм (поле 20 10 000 9019 мкм) 40X), ( D ) островок (20,368 мкм 2 ) относящийся к категории 10,000–100,000 мкм 2 (поле зрения 20X), ( E ) 1 0m 902 включен пример островка (6282 в категории 1000–10 000 мкм 2 (поле зрения 40X), ( F ) островковый образец (8805 мкм 2 ) включен в категорию 10 000–100 ,000 мкм 2 (поле зрения 40X), ( G ) группа островков (верхний левый островок −14,930 мкм 2 , нижний островок −136 мкм 2 , нижний правый островок −140902 2 ) в диапазоне от 1000 до 10 000 мкм 2 до 10 000-100 000 мкм 2 (поле зрения 20x), ( H ) Пример острова (29 975 мкм 2 ) Включен в категорию 10 000-100 000 мкм.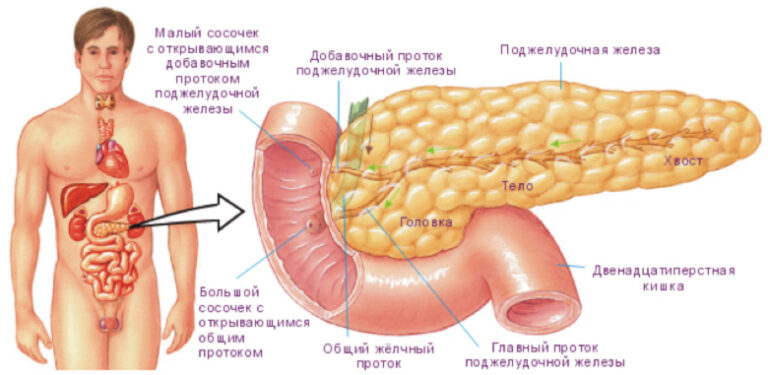 2 (поле зрения 20X), ( I ) процент островков по размеру, ( K ) средняя площадь островков (темно-серый на правой оси) и средний периметр островков (светло-серый на левой оси) по срезам (В1–4).
2 (поле зрения 20X), ( I ) процент островков по размеру, ( K ) средняя площадь островков (темно-серый на правой оси) и средний периметр островков (светло-серый на левой оси) по срезам (В1–4).
Формы островков
Форма островков обеспечивает уникальное расположение клеток 9 . Недавние данные свидетельствуют о том, что многие изменения в структуре и функции островков, связанные с диабетом, связаны только с гипергликемией и исчезают при нормализации уровня глюкозы в крови 26 . Таким образом, уникальность этой гетерогенной конформации имеет глубокое функциональное значение. Островки поджелудочной железы имеют различную форму и обычно трудно поддаются определению в этом отношении. В нашем случае рассматривались два основных вопроса: 1) насколько островки Лангерганса близки к идеальной сферической структуре в различных областях поджелудочной железы человека? 2) если панкреатические островки слишком далеки от идеальной сферической структуры, то насколько они неправильны по форме? Что касается первого вопроса, мы разработали индекс сферичности ( I s ) с учетом двух параметров островков (9). Абсолютное значение периметра островка ( P м ), измеренное на двумерных гистологических предметных стеклах, и относительный параметр, а именно средний диаметр островка ( d м ). Однако в качестве первой точки отсчета мы использовали отношение между периметром окружности ( Cp ) и диаметром ( Cd ), а именно π (7). Затем те же шаги были применены для отношения ( I π ) между средним периметром островка и средним диаметром островка (8).Расстояние от идеальных пропорций было количественно определено через показатель сферичности ( I s ), в данном случае как отношение между π и I π (9). Таким образом, мы грубо измерили, насколько форма островка отличается от идеальной формы круга (и, следовательно, от идеальной сферы). Учитывали средний периметр и диаметр островка для каждого среза (B1–4) поджелудочной железы и оценивали расстояния от идеальных пропорций круга (π) (табл.
Абсолютное значение периметра островка ( P м ), измеренное на двумерных гистологических предметных стеклах, и относительный параметр, а именно средний диаметр островка ( d м ). Однако в качестве первой точки отсчета мы использовали отношение между периметром окружности ( Cp ) и диаметром ( Cd ), а именно π (7). Затем те же шаги были применены для отношения ( I π ) между средним периметром островка и средним диаметром островка (8).Расстояние от идеальных пропорций было количественно определено через показатель сферичности ( I s ), в данном случае как отношение между π и I π (9). Таким образом, мы грубо измерили, насколько форма островка отличается от идеальной формы круга (и, следовательно, от идеальной сферы). Учитывали средний периметр и диаметр островка для каждого среза (B1–4) поджелудочной железы и оценивали расстояния от идеальных пропорций круга (π) (табл. 5).Так, островки неправильной формы показали диспропорцию между периметром и диаметром ( I s имеет тенденцию к удалению от 1 к более высоким положительным значениям), а островки круглой формы приблизились к пропорциям периметра и диаметра окружности ( I s больше склоняется к 1). Островки из хвоста поджелудочной железы показывают отношение ( I π = 3,2526) ближе к π, что позволяет предположить, что в среднем островки из хвоста поджелудочной железы ближе к идеальной сферической структуре по сравнению с другими участками ( I с = 1.0353). Этот метод также предполагает, что островки, расположенные в шейке поджелудочной железы, имеют пропорции ( I π = 3,3268), которые наиболее далеки от идеальных (π) и демонстрируют различные неправильные формы островков ( I s = 1,0589).
5).Так, островки неправильной формы показали диспропорцию между периметром и диаметром ( I s имеет тенденцию к удалению от 1 к более высоким положительным значениям), а островки круглой формы приблизились к пропорциям периметра и диаметра окружности ( I s больше склоняется к 1). Островки из хвоста поджелудочной железы показывают отношение ( I π = 3,2526) ближе к π, что позволяет предположить, что в среднем островки из хвоста поджелудочной железы ближе к идеальной сферической структуре по сравнению с другими участками ( I с = 1.0353). Этот метод также предполагает, что островки, расположенные в шейке поджелудочной железы, имеют пропорции ( I π = 3,3268), которые наиболее далеки от идеальных (π) и демонстрируют различные неправильные формы островков ( I s = 1,0589).

Скопления островков
Что касается нашего исследования, возможно, одним из самых интересных наблюдений было обнаружение скоплений островков.Распределение островков по площади поверхности, по-видимому, указывает на «пороговый» размер выше 100 000 мкм 2 (рис. 1K, L). Похоже, что более крупные островки, площадь которых превышает 100 000 мкм 2 , обычно представляют собой скопления островков (рис. 4A–D). По нашим наблюдениям, структуры, находящиеся выше этих размеров, представляют собой скопления островков. Двойные слепые морфометрические измерения выявили в общей сложности 11 скоплений островков на всех четырех срезах (рис. 1K, L). Шесть кластеров были обнаружены в срезе головки (B1) поджелудочной железы, три в срезе шеи (B2) и два в срезе хвоста (B3).В срезе тела (Б4) поджелудочной железы отсутствовали кластероподобные островковые структуры (рис. 1Л, М). Более того, эти скопления островков, по-видимому, располагаются на периферии поджелудочной железы. Соответствующий пример кластера островков находится в шейке поджелудочной железы и представлен слайдом B2[P14], где ацинарная ткань и кровеносные сосуды интеркалированы среди групп островков (рис. 4B, D). При ближайшем рассмотрении можно наблюдать границы инкапсуляции между островками, расположенными в кластере (рис. 4Г). Учитывая известную неоднородность этого органа, мы задались вопросом, являются ли эти скопления обычно частью поджелудочной железы здорового человека (у лиц без семейной предрасположенности к СД1 или СД2) или они являются просто особенностью, характерной только для этого конкретного поджелудочная железа.В будущем мы намерены изучить этот орган у других доноров-людей, чтобы увидеть, регулярно ли эти структуры обнаруживаются в поджелудочной железе здорового человека. Кроме того, кластеры островков могут иметь решающее значение для процедур трансплантации островков. Наши данные показывают, что скопления островков состоят из небольших островков, которые плотно собираются вдоль более крупных кровеносных сосудов (рис.
Соответствующий пример кластера островков находится в шейке поджелудочной железы и представлен слайдом B2[P14], где ацинарная ткань и кровеносные сосуды интеркалированы среди групп островков (рис. 4B, D). При ближайшем рассмотрении можно наблюдать границы инкапсуляции между островками, расположенными в кластере (рис. 4Г). Учитывая известную неоднородность этого органа, мы задались вопросом, являются ли эти скопления обычно частью поджелудочной железы здорового человека (у лиц без семейной предрасположенности к СД1 или СД2) или они являются просто особенностью, характерной только для этого конкретного поджелудочная железа.В будущем мы намерены изучить этот орган у других доноров-людей, чтобы увидеть, регулярно ли эти структуры обнаруживаются в поджелудочной железе здорового человека. Кроме того, кластеры островков могут иметь решающее значение для процедур трансплантации островков. Наши данные показывают, что скопления островков состоят из небольших островков, которые плотно собираются вдоль более крупных кровеносных сосудов (рис.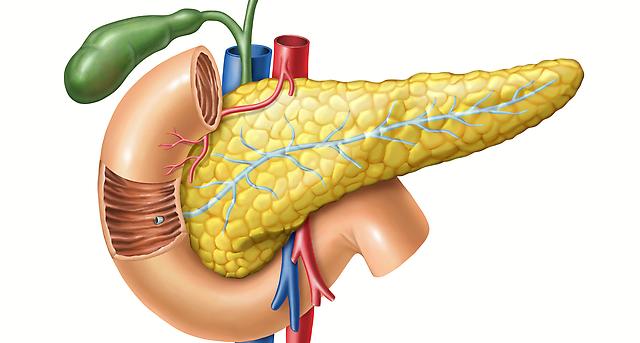 4B, D). Маленькие островки человека менее уязвимы к гипоксии и состоят из большего количества β-клеток с более высоким содержанием инсулина, чем большие островки 27,28 . Хотя тело и хвост поджелудочной железы содержат множество мелких одиночных островков, которые можно легко выделить, при пересадке в воротную вену печени они лишены интимных связей с магистральным кровотоком.С другой стороны, наши данные показывают, что скопления островков чаще появляются в головке и шейке поджелудочной железы (рис. 1K). Таким образом, кластеры островков содержат более крупные кровеносные сосуды, которые могут быть непосредственно связаны микрохирургическими методами с кровотоком пациента (рис. 4B, D). Возможно, их микрохирургическая изоляция также будет проблематичной, учитывая, что эти анатомические структуры могут быть особенно редкими и трудно найти in vivo . Тем не менее, гетерогенность поджелудочной железы, возможно, превосходит только перипанкреатическая жировая ткань, где в этом случае были сделаны другие наблюдения.
4B, D). Маленькие островки человека менее уязвимы к гипоксии и состоят из большего количества β-клеток с более высоким содержанием инсулина, чем большие островки 27,28 . Хотя тело и хвост поджелудочной железы содержат множество мелких одиночных островков, которые можно легко выделить, при пересадке в воротную вену печени они лишены интимных связей с магистральным кровотоком.С другой стороны, наши данные показывают, что скопления островков чаще появляются в головке и шейке поджелудочной железы (рис. 1K). Таким образом, кластеры островков содержат более крупные кровеносные сосуды, которые могут быть непосредственно связаны микрохирургическими методами с кровотоком пациента (рис. 4B, D). Возможно, их микрохирургическая изоляция также будет проблематичной, учитывая, что эти анатомические структуры могут быть особенно редкими и трудно найти in vivo . Тем не менее, гетерогенность поджелудочной железы, возможно, превосходит только перипанкреатическая жировая ткань, где в этом случае были сделаны другие наблюдения.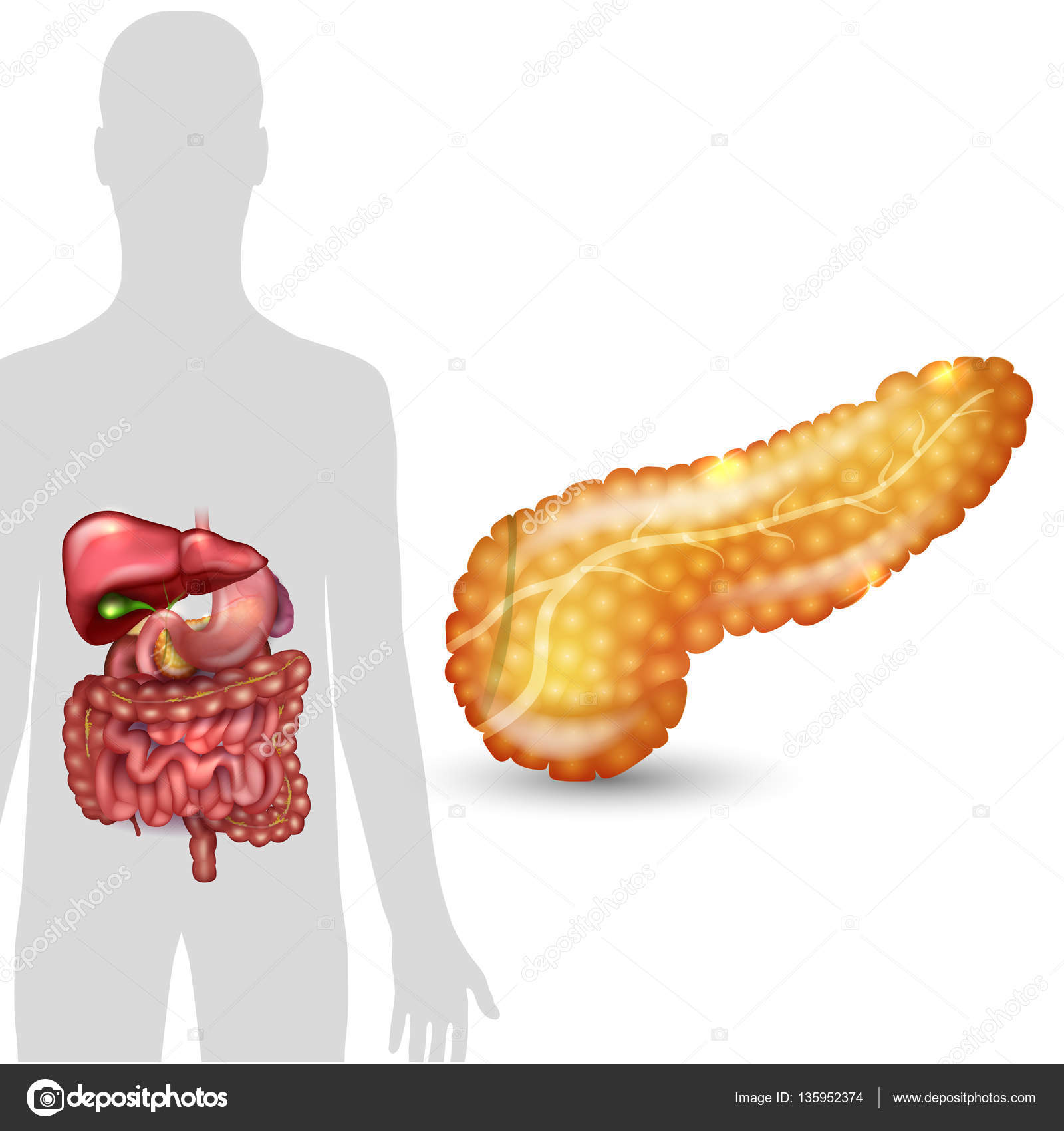 Внутри поджелудочной железы иммунные реакции отсутствовали. В перипанкреатической жировой ткани эти иммунные ответы были захвачены кровеносными сосудами (рис. 4F). Кроме того, в перипанкреатической жировой ткани наблюдалось множество различных лимфоидных структур (рис. 4Е). Таким образом, представляется, что воспалительный процесс в перипанкреатической ткани может быть постоянным, динамичным и общим процессом, окружающим поджелудочную железу здорового человека. Эти два наблюдения заставляют нас полагать, что перипанкреатическая жировая ткань активно участвует в механизмах инициации как СД1, так и СД2 (в отношении генетической предрасположенности к тому или иному фенотипу).Эти наблюдения заставляют нас задаться вопросом, возможно ли, что иммунный ответ на бета-клетки на самом деле инициируется посредством индукции из перипанкреатической ткани.
Внутри поджелудочной железы иммунные реакции отсутствовали. В перипанкреатической жировой ткани эти иммунные ответы были захвачены кровеносными сосудами (рис. 4F). Кроме того, в перипанкреатической жировой ткани наблюдалось множество различных лимфоидных структур (рис. 4Е). Таким образом, представляется, что воспалительный процесс в перипанкреатической ткани может быть постоянным, динамичным и общим процессом, окружающим поджелудочную железу здорового человека. Эти два наблюдения заставляют нас полагать, что перипанкреатическая жировая ткань активно участвует в механизмах инициации как СД1, так и СД2 (в отношении генетической предрасположенности к тому или иному фенотипу).Эти наблюдения заставляют нас задаться вопросом, возможно ли, что иммунный ответ на бета-клетки на самом деле инициируется посредством индукции из перипанкреатической ткани.
Скопления островков и существующий воспалительный процесс в перипанкреатической жировой ткани.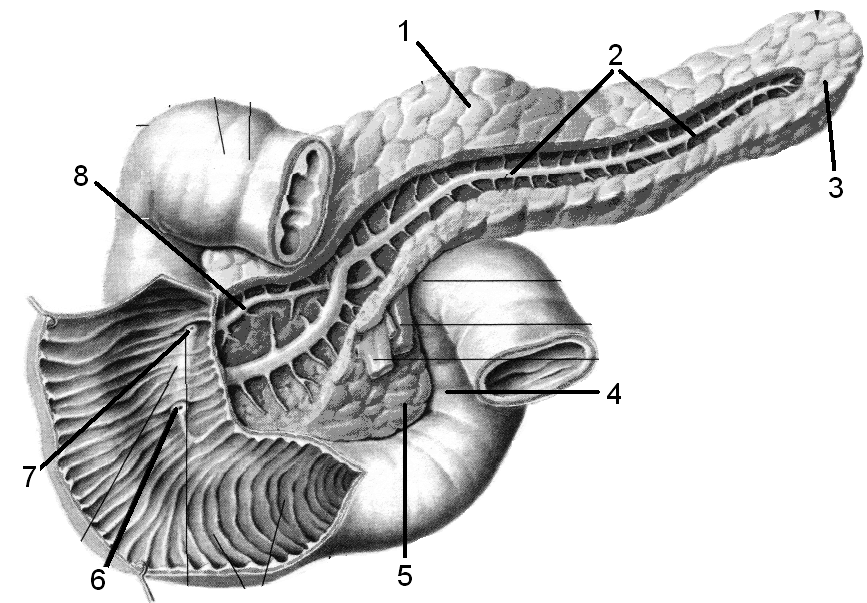
( A ) относительное расположение скопления островков на предметном стекле B2 (P14) (шейка поджелудочной железы). На панели также показано относительное расположение шейки поджелудочной железы и полученная на ее основе тепловая карта, которая дополнительно указывает площадь поверхности, занятую островками.( B ) границы скопления островков (черная пунктирная линия) на предметном стекле B2 (P14) (поле зрения 4x), ( C ) окно в нижней части скопления островков (красная пунктирная линия), ( D ) крупный вид островков внутри скопления (поле зрения 20x), ( E ) лимфоидно организованная ткань внутри перипанкреатической жировой ткани, взятая из головного среза поджелудочной железы (поле зрения 10x). Красноватое пятно слева представляет собой ошибку обработки. ( F ) Воспалительный процесс, захваченный на кровеносном сосуде, взятом из перипанкреатической жировой ткани хвостового среза поджелудочной железы (поле зрения 20х).Кровеносный сосуд заполнен эритроцитами и воспалительными клетками (нейтрофилами, лимфоцитами, эозинофилами).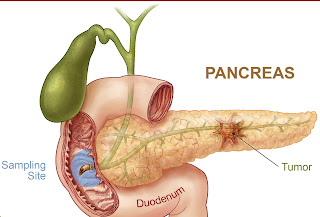
Органоиды поджелудочной железы человека: на шаг ближе к пониманию биологии и лечению заболеваний
Авторы этой недавней статьи, опубликованной в BMC Developmental Biology, представляют новый способ изучения того, что происходит внутри поджелудочной железы, путем создания «органоидов поджелудочной железы человека». Используя клетки, взятые из поджелудочной железы человека, авторы создают самособирающиеся тканеподобные структуры, которые имитируют человеческую поджелудочную железу на гораздо более простом уровне, помогая нам понять развитие, форму и функцию органа.В этом исследовании они не только способны генерировать эти «мини» органоиды поджелудочной железы, но и идут дальше, способствуя их размножению в течение длительных периодов времени с устойчивой генетической стабильностью. Они надеются, что эта клеточная технология поможет разрушить процессы на клеточном и тканевом уровне, которые происходят с течением времени, чтобы углубить наше понимание в отношении более эффективных терапевтических вмешательств, решения проблем на начальном этапе заболеваний, вызванных поджелудочной железой, таких как диабет, рак поджелудочной железы и многое другое. Эти и подобные клеточные технологии приведут нас к более глубокому пониманию и более эффективному лечению болезней.
Эти и подобные клеточные технологии приведут нас к более глубокому пониманию и более эффективному лечению болезней.
Николь Прайор, Никитас Георгакопулос и Мериткселл Хуч
Органоиды представляют собой новую технологию органоспецифической тканевой культуры клеток в трехмерном внеклеточном матриксе (ECM). Это приводит к образованию трехмерных клеточных кластеров, которые воспроизводят многие характеристики органов происхождения.Текущие усилия по разработке моделей человеческих органоидов помогут нам лучше понять, как формируются и функционируют наши органы, и как помочь в случаях возникновения заболеваний.
В нашем исследовании, опубликованном в журнале BMC Developmental Biology, мы описываем получение органоидов поджелудочной железы человека (hPO) и показываем, как их можно использовать в будущих исследованиях. Поджелудочная железа расположена рядом с желудком и играет важную роль в нашей пищеварительной системе. В поджелудочной железе обнаружены три основных типа клеток; 1) эндокринные клетки , которые находятся в островках Лангерганса и вырабатывают гормоны, включая инсулин, которые контролируют метаболизм сахара в нашем организме, 2) ацинарные клетки , которые производят пищеварительные ферменты, и 3) клетки протоков поджелудочной железы , которые образуют протоки (выделены на рис. 1) для сбора пищеварительных ферментов и транспортировки их в тонкую кишку, чтобы способствовать расщеплению пищи.
В поджелудочной железе обнаружены три основных типа клеток; 1) эндокринные клетки , которые находятся в островках Лангерганса и вырабатывают гормоны, включая инсулин, которые контролируют метаболизм сахара в нашем организме, 2) ацинарные клетки , которые производят пищеварительные ферменты, и 3) клетки протоков поджелудочной железы , которые образуют протоки (выделены на рис. 1) для сбора пищеварительных ферментов и транспортировки их в тонкую кишку, чтобы способствовать расщеплению пищи.
Рисунок 1: Поджелудочная железа является частью пищеварительной системы, обратите внимание на связь поджелудочной железы с кишечником через проток поджелудочной железы. Изображение адаптировано из материалов Blausen.com (2014 г.).
Сотрудники Blausen.com (2014 г.). «Медицинская галерея Blausen Medical 2014». ВикиЖурнал медицины 1 (2). DOI: 10.15347/wjm/2014.010. ISSN 2002-4436.
Нарушение работы этих клеток связано с рядом заболеваний поджелудочной железы.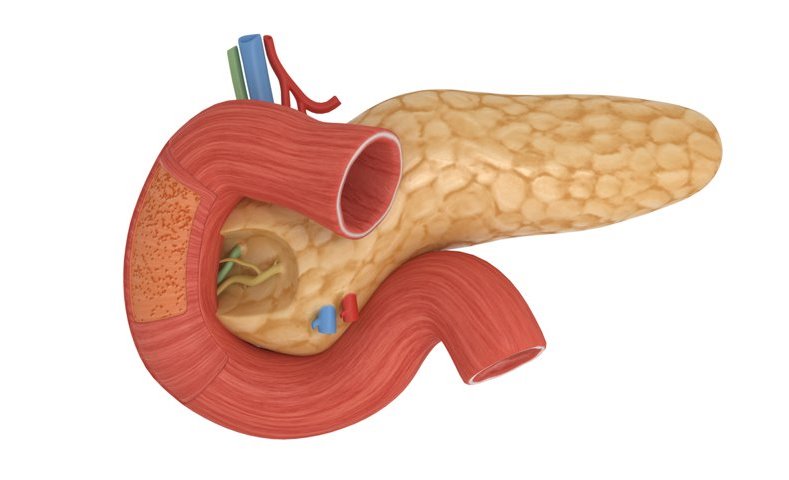 Рак поджелудочной железы может поражать любой из этих типов клеток и имеет самый низкий показатель выживаемости в Великобритании среди всех видов рака.Диабет является наиболее распространенным заболеванием эндокринной системы и поражает более 4 миллионов человек в Великобритании. Другие серьезные заболевания, хотя, возможно, менее известные, включают панкреатит (воспаление поджелудочной железы), муковисцидоз (поражающий клетки протоков) и недостаточность поджелудочной железы (снижение функции ацинарных клеток). Тяжелые случаи заболевания поджелудочной железы часто оставляют пациентов с необходимостью пересадки поджелудочной железы или островковых клеток, полученных от умерших доноров органов. Однако самые большие препятствия для трансплантации поджелудочной железы включают ограниченное количество доноров органов и необходимость пожизненной иммуносупрессии.
Рак поджелудочной железы может поражать любой из этих типов клеток и имеет самый низкий показатель выживаемости в Великобритании среди всех видов рака.Диабет является наиболее распространенным заболеванием эндокринной системы и поражает более 4 миллионов человек в Великобритании. Другие серьезные заболевания, хотя, возможно, менее известные, включают панкреатит (воспаление поджелудочной железы), муковисцидоз (поражающий клетки протоков) и недостаточность поджелудочной железы (снижение функции ацинарных клеток). Тяжелые случаи заболевания поджелудочной железы часто оставляют пациентов с необходимостью пересадки поджелудочной железы или островковых клеток, полученных от умерших доноров органов. Однако самые большие препятствия для трансплантации поджелудочной железы включают ограниченное количество доноров органов и необходимость пожизненной иммуносупрессии.
Мы стремились создать систему 3D-культивирования для долгосрочного размножения hPO, которая послужит основой для изучения клеток протоков поджелудочной железы, заболеваний поджелудочной железы и разработки клеточной терапии диабета. При разработке модели hPO мы знали, что для применения клеточной терапии в клинике она должна соответствовать определенным критериям, включающим размножение клеток химически определенным способом, совместимым с Надлежащими производственными процессами (GMP), с убедительными доказательствами того, что клетки не представляют риск образования опухоли.
При разработке модели hPO мы знали, что для применения клеточной терапии в клинике она должна соответствовать определенным критериям, включающим размножение клеток химически определенным способом, совместимым с Надлежащими производственными процессами (GMP), с убедительными доказательствами того, что клетки не представляют риск образования опухоли.
Чтобы создать hPO, мы выделили фрагменты протоков из небольших образцов ткани поджелудочной железы человека и поместили их в ECM, чтобы он действовал как 3D-каркас. Чтобы это было успешным, мы должны были разработать культуральную среду, которая включала бы все сигналы и факторы роста, необходимые для поддержки перехода протоков поджелудочной железы в расширяемые органоиды поджелудочной железы (рис. 2). Благодаря серии оптимизаций и итераций, в которых мы тестировали активаторы и ингибиторы ключевых сигнальных путей клеток, мы получили культуральную среду с определенным химическим составом, которая поддерживает долгосрочное культивирование клеток поджелудочной железы. Кроме того, мы разработали протокол для замораживания ткани поджелудочной железы и извлечения из нее здоровых долговременно расширяющихся органоидов. Это дает нам возможность хранить ткани, делиться образцами и получать органоиды позднее.
Кроме того, мы разработали протокол для замораживания ткани поджелудочной железы и извлечения из нее здоровых долговременно расширяющихся органоидов. Это дает нам возможность хранить ткани, делиться образцами и получать органоиды позднее.
Рис. 2. Протоки поджелудочной железы человека можно культивировать in vitro и размножать в виде органоидов поджелудочной железы.
Важно отметить, что генетический анализ показал, что даже после долговременной экспансии hPOs не обнаруживали больших генетических аномалий. Это очень важно, так как накопление генетических дефектов во время культивирования может изменить поведение клеток и повлиять на результаты.Мы также обнаружили, что при трансплантации этих клеток в поджелудочную железу мышей клетки hPO не образуют опухолей, что свидетельствует об их генетической безопасности как in vitro, так и in vivo.
Наконец, мы стремились разработать химически определенный ECM, в котором можно культивировать hPO, поскольку обычно используемые ECM (Matrigel и BME 2-RGF) имеют животное происхождение и не подходят для клеточной терапии. В сотрудничестве с Cellendes, компанией, специализирующейся на гидрогелевых технологиях, мы впервые смогли продемонстрировать образование и распространение hPO в гидрогеле с полностью определенным химическим составом.
В сотрудничестве с Cellendes, компанией, специализирующейся на гидрогелевых технологиях, мы впервые смогли продемонстрировать образование и распространение hPO в гидрогеле с полностью определенным химическим составом.
Наша демонстрация долговременной экспансии органоидов поджелудочной железы человека в определенных химических условиях делает эту систему интересной для многих областей исследований (рис. 3). Эта система может быть использована в качестве модели биологии здоровой протоковой поджелудочной железы и разработки моделей заболеваний протокового компартмента, таких как кистозный фиброз. Органоиды также могут быть получены из болезненных состояний и уже использовались для моделирования различных типов рака поджелудочной железы (PDAC и IPMN).
Рисунок 3: Органоиды поджелудочной железы человека потенциально могут быть использованы во многих областях исследований, таких как исследования здоровых тканей, пораженных тканей и регенеративная медицина.
Важно отметить, что наш протокол не основан на изменении генома или идентичности клеток для достижения долгосрочной экспансии.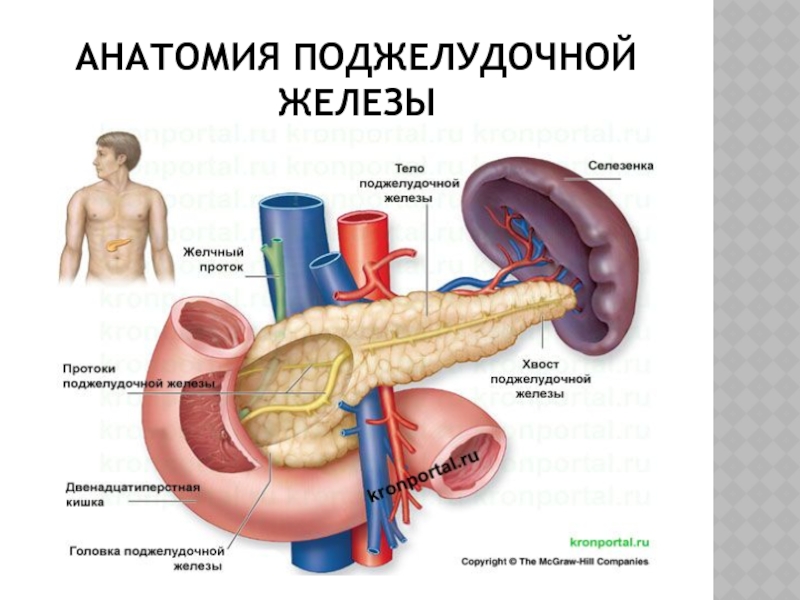 Это, в сочетании с отсутствием образования опухоли при трансплантации мышам, делает hPO безопасным подходом для потенциальной клеточной терапии. Клеточная терапия дает надежду пациентам, у которых нет доступных вариантов лечения. Они обеспечивают возможность лечения заболевания путем извлечения клеток у пациента или других доноров, изменения их в лаборатории для создания рабочих клеток и трансплантации их пациенту.Теоретически это будет лечить болезнь, устраняя необходимость в иммуносупрессии, поскольку клетки будут либо собственными, либо очень близкими к пациенту.
Это, в сочетании с отсутствием образования опухоли при трансплантации мышам, делает hPO безопасным подходом для потенциальной клеточной терапии. Клеточная терапия дает надежду пациентам, у которых нет доступных вариантов лечения. Они обеспечивают возможность лечения заболевания путем извлечения клеток у пациента или других доноров, изменения их в лаборатории для создания рабочих клеток и трансплантации их пациенту.Теоретически это будет лечить болезнь, устраняя необходимость в иммуносупрессии, поскольку клетки будут либо собственными, либо очень близкими к пациенту.
Адаптация системы культивирования для клеток человека финансировалась в рамках программы ЕС (LSFM4LIFE), целью которой является изучение потенциала hPO в качестве клинической клеточной терапии. Могут ли hPO быть источником для трансплантации клеточной терапии при диабете, еще предстоит выяснить.
.

 Инсулин способствует также усвоению глюкозы в печени, где та хранится в виде гликогена, а затем и используется при стрессе и физических нагрузках. Когда островки Лангерганса производят мало инсулина, уровень глюкозы поднимается и возникает риск развития сахарного диабета и др.
Инсулин способствует также усвоению глюкозы в печени, где та хранится в виде гликогена, а затем и используется при стрессе и физических нагрузках. Когда островки Лангерганса производят мало инсулина, уровень глюкозы поднимается и возникает риск развития сахарного диабета и др.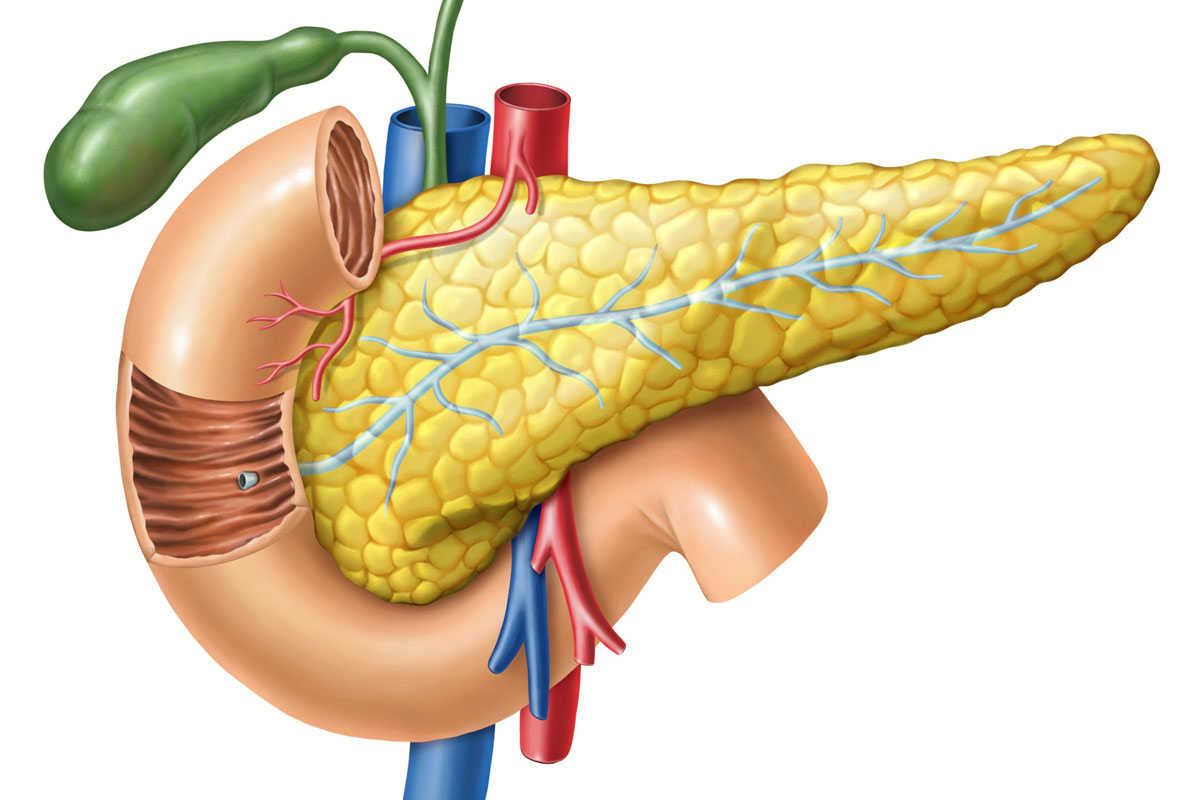
 Питаться нужно часто и понемногу — это позволяет ЖКТ усваивать пищу, не включая «аварийный режим». Желательно есть как минимум пять раз в день, но порции должны быть небольшими. Кстати, такая диета будет полезна не только тем, кто страдает от серьезных заболеваний печени и поджелудочной железы. Она поможет восстановиться после чрезмерного застолья. Даже здоровым людям знакомы такие симптомы, как тяжесть в желудке, тошнота, метеоризм и расстройство желудка — расплата за переедание или непривычную пищу. После праздников с их бесконечными обедами и возлияниями будет полезно временно переключиться на мягкую диету, чтобы вернуть пищеварение в норму. Стол №5 — диета комфортная и не предполагает отказа от широкой группы продуктов.
Питаться нужно часто и понемногу — это позволяет ЖКТ усваивать пищу, не включая «аварийный режим». Желательно есть как минимум пять раз в день, но порции должны быть небольшими. Кстати, такая диета будет полезна не только тем, кто страдает от серьезных заболеваний печени и поджелудочной железы. Она поможет восстановиться после чрезмерного застолья. Даже здоровым людям знакомы такие симптомы, как тяжесть в желудке, тошнота, метеоризм и расстройство желудка — расплата за переедание или непривычную пищу. После праздников с их бесконечными обедами и возлияниями будет полезно временно переключиться на мягкую диету, чтобы вернуть пищеварение в норму. Стол №5 — диета комфортная и не предполагает отказа от широкой группы продуктов.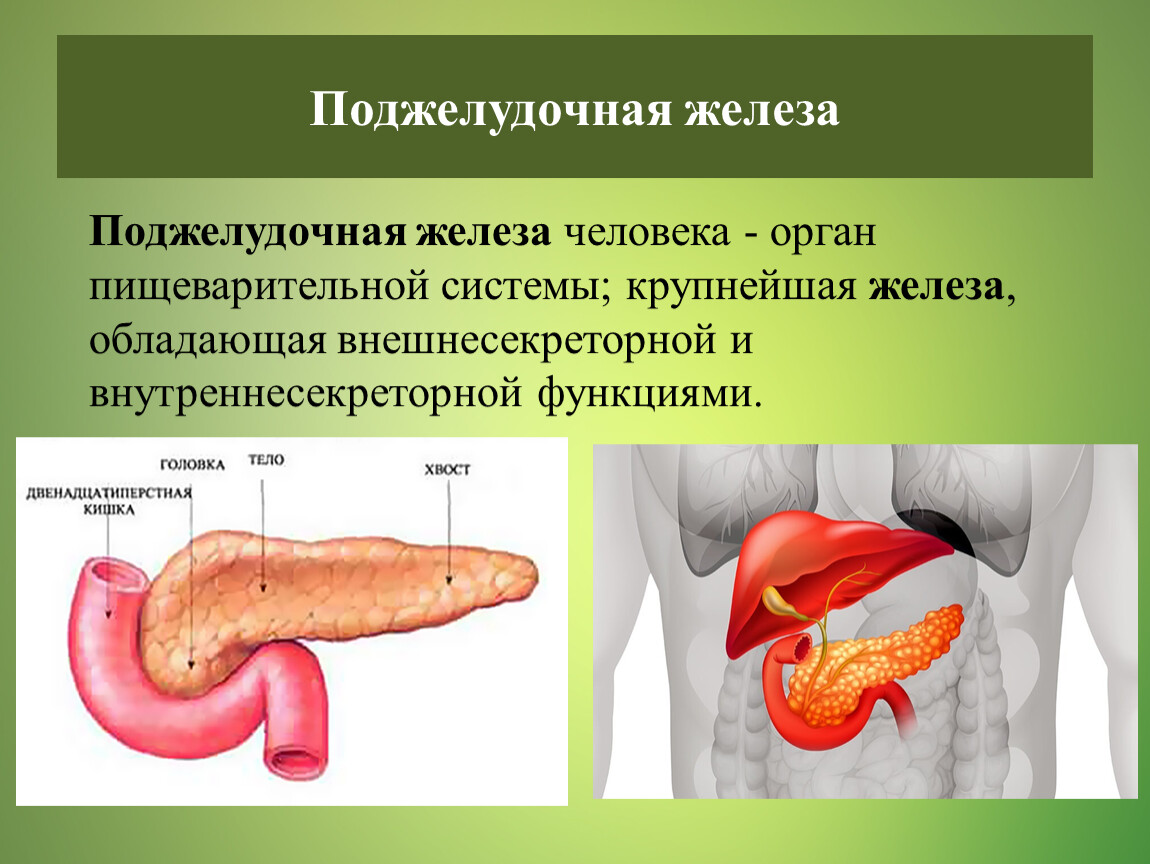 Ферменты, которые содержатся в них, практически не отличаются от наших собственных ферментов и помогают справиться с усвоением пищи, если поджелудочная железа не может вырабатывать достаточное количество панкреатического сока. Кроме того, в некоторых случаях назначают желчегонные средства, антисекреторные вещества (так называемые Н2-блокаторы гистаминовых рецепторов и ингибиторы протонной помпы).
Ферменты, которые содержатся в них, практически не отличаются от наших собственных ферментов и помогают справиться с усвоением пищи, если поджелудочная железа не может вырабатывать достаточное количество панкреатического сока. Кроме того, в некоторых случаях назначают желчегонные средства, антисекреторные вещества (так называемые Н2-блокаторы гистаминовых рецепторов и ингибиторы протонной помпы). Псевдокисты могут рассасываться спонтанно, или может потребоваться хирургическое дренирование.
Псевдокисты могут рассасываться спонтанно, или может потребоваться хирургическое дренирование.