Наиболее важной функцией лимфатической системы является: Сборник идеальных эссе по обществознанию
Лимфатическая система — Docsity
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ГАПОУ «Республиканский базовый медицинский колледж имени Э.Р. Раднаева» РЕФЕРАТ на тему: Лимфатическая система Работу выполнили: студенты 112 гр. Малханов Т. Нимбуева Н. Преподаватель: Хабалтуева М.А. Улан-Удэ 2019 С О Д Е Р Ж А Н И Е Стр ВВЕДЕНИЕ……………………………………………………………….….3 1.1. Анатомия лимфатической системы…………………………..5 1.1.1. Грудной проток…………………………………………5 1.1.2. Лимфатические сосуды и узлы отдельных областей тела…………………………………………..6 1.2. Физиология лимфатической системы ………………………16 1.2.1. Функции лимфатической системы…………………..16 1.2.2. Состав и свойства лимфы…………………………….17 1.2.3. Процесс образования лимфы ………………………..18 1.2.4. Механизмы передвижения лимфы…………………..21 ЗАКЛЮЧЕНИЕ…………………………………………………………….22 БИБЛИОГРАФИЯ…………………………………………………………23 2 1.1. Анатомия лимфатической системы 1.1.1. Грудной проток Грудной проток (ductus thoracicus) — непарный лимфатический проток длиной 30-45 см, с неодинаковым просветом (имеются расширения в начальном и конечном его отделах). Формируется в брюшной полости, в забрюшинной клетчатке, на уровне XII грудного — II поясничного позвонков из слияния правого и левого поясничных стволов, которые образуются из соединения выносящих лимфатических сосудов, соответственно правых и левых пояс- ничных лимфатических узлов. Они в свою очередь принимают лимфу от подвздошных лимфатических узлов, собирающих лимфу от нижних конечностей и брюшной стенки, а также от внутренних подчревных и крестцовых лимфатических узлов, несущих лимфу от органов малого таза. Примерно в трети случаев в начальную часть грудного протока впадают 1-3 кишечных ствола (trunci intestinales), выносящих лимфу от брыжеечных лимфатических узлов. В грудной проток впадают выносящие лимфатические сосуды редко встречающихся предпозвоночных, межреберных, а также висцеральных (предаортальных) лимфатических узлов грудной полости. В большинстве случаев в своем начале проток имеет расширение — цистерну грудного протока (cisterna chyli) веретенообразной формы, располагающуюся на передней поверхности тел позвонков начиная от II поясничного до XI грудного.
Формируется в брюшной полости, в забрюшинной клетчатке, на уровне XII грудного — II поясничного позвонков из слияния правого и левого поясничных стволов, которые образуются из соединения выносящих лимфатических сосудов, соответственно правых и левых пояс- ничных лимфатических узлов. Они в свою очередь принимают лимфу от подвздошных лимфатических узлов, собирающих лимфу от нижних конечностей и брюшной стенки, а также от внутренних подчревных и крестцовых лимфатических узлов, несущих лимфу от органов малого таза. Примерно в трети случаев в начальную часть грудного протока впадают 1-3 кишечных ствола (trunci intestinales), выносящих лимфу от брыжеечных лимфатических узлов. В грудной проток впадают выносящие лимфатические сосуды редко встречающихся предпозвоночных, межреберных, а также висцеральных (предаортальных) лимфатических узлов грудной полости. В большинстве случаев в своем начале проток имеет расширение — цистерну грудного протока (cisterna chyli) веретенообразной формы, располагающуюся на передней поверхности тел позвонков начиная от II поясничного до XI грудного. В грудном протоке выделяют брюшную (pars abdominalis), грудную (pars thoracica) и шейную (pars cervicalis) части. В грудной проток впадает (в его грудную или, чаще, шейную части) крупный левый бронхосредостенный ствол (truncus bronchomediastinalis) от органов левой половины грудной клетки (левого легкого, левой половины сердца, пищевода, трахеи) и от щитовидной железы. У места впадения в венозный угол грудной проток принимает левый подключичный ствол (truncus subclavius sinister) — от левой верхней конечности и левый яремный ствол 5 (truncus jugularis sinister) — от левой половины головы и шеи. На протяжении грудного протока имеется 7 — 9 клапанов, препятствующих обратному току лимфы. Стенка грудного протока состоит из трех нечетко разграниченных оболочек: внутренней, средней и наружной. Внутренняя оболочка выстлана эндотелием, средняя состоит из слоев циркулярно и продольно лежащих гладкомышечных клеток, пронизанных коллагеновыми и эластическими волокнами, наружная (наиболее толстая) включает слой соединительной ткани и продольно расположенные пучки гладкомышечных клеток.
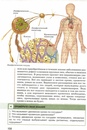
В грудном протоке выделяют брюшную (pars abdominalis), грудную (pars thoracica) и шейную (pars cervicalis) части. В грудной проток впадает (в его грудную или, чаще, шейную части) крупный левый бронхосредостенный ствол (truncus bronchomediastinalis) от органов левой половины грудной клетки (левого легкого, левой половины сердца, пищевода, трахеи) и от щитовидной железы. У места впадения в венозный угол грудной проток принимает левый подключичный ствол (truncus subclavius sinister) — от левой верхней конечности и левый яремный ствол 5 (truncus jugularis sinister) — от левой половины головы и шеи. На протяжении грудного протока имеется 7 — 9 клапанов, препятствующих обратному току лимфы. Стенка грудного протока состоит из трех нечетко разграниченных оболочек: внутренней, средней и наружной. Внутренняя оболочка выстлана эндотелием, средняя состоит из слоев циркулярно и продольно лежащих гладкомышечных клеток, пронизанных коллагеновыми и эластическими волокнами, наружная (наиболее толстая) включает слой соединительной ткани и продольно расположенные пучки гладкомышечных клеток. Грудной проток собирает лимфу от нижних конечностей, стенок и органов таза и брюшной полости, левой половины грудной полости. От правой верхней конечности, правой половины головы и шеи, органов правой половины грудной полости лимфа оттекает в правый лимфатический проток (ductus lymphaticus dexter), короткий сосуд длиной 10-12 мм и диаметром до 2 мм. Он располагается в правой надключичной ямке и впадает в правый венозный угол — место слияния правых внутренней яремной и подключичных вен или в их конечные отделы. Правый лимфатический проток в области устья имеет клапаны. Лимфатические стволы, образующие правый лимфатический проток, могут соединяться между собой до образования протока или могут открываться самостоятельно в правый венозный угол, а также в конечные отделы правой внутренней яремной или правой подключичной вены. 1.1.2. Лимфатические сосуды и узлы отдельных областей тела Нижняя конечность. Регионарными для нижней конечности являются подколенные (nodi ymphatici poplitei) и паховые (nodi lymphatici nguinales) лимфатические узлы, которые делятся на поверхностные и глубокие.
Грудной проток собирает лимфу от нижних конечностей, стенок и органов таза и брюшной полости, левой половины грудной полости. От правой верхней конечности, правой половины головы и шеи, органов правой половины грудной полости лимфа оттекает в правый лимфатический проток (ductus lymphaticus dexter), короткий сосуд длиной 10-12 мм и диаметром до 2 мм. Он располагается в правой надключичной ямке и впадает в правый венозный угол — место слияния правых внутренней яремной и подключичных вен или в их конечные отделы. Правый лимфатический проток в области устья имеет клапаны. Лимфатические стволы, образующие правый лимфатический проток, могут соединяться между собой до образования протока или могут открываться самостоятельно в правый венозный угол, а также в конечные отделы правой внутренней яремной или правой подключичной вены. 1.1.2. Лимфатические сосуды и узлы отдельных областей тела Нижняя конечность. Регионарными для нижней конечности являются подколенные (nodi ymphatici poplitei) и паховые (nodi lymphatici nguinales) лимфатические узлы, которые делятся на поверхностные и глубокие. Лимфатические сосуды нижней конечности также делятся на поверхностные, собирающие лимфу от кожи и подкожной клетчатки, и глубокие, отводящие лимфу от глубоких тканей: фасций, сухожилий, мышц, связок, суставов и 6 костей. Поверхностные лимфатические сосуды (vasa lymphatica superficialia) делятся на медиальную и заднелатеральную группы. Сосуды медиальной группы берут начало в коже I, И, III пальцев, собирают лимфу от тыльной поверхности медиальной части стопы, медиальной и заднемедиальной поверхностей голени, всего бедра и впадают в поверхностные паховые лимфатические узлы (nodi lymphatici inguinales superficiales), которые в количестве 12-16 залегают под кожей в верхней трети бедра, ниже паховой связки. В эти же узлы оттекает лимфа от передней брюшной стенки (ниже пупка), ягодичной области, наружных половых органов, промежности и части органов малого таза(Лысов П. К., Сапин М. Р.,2009). Лимфатические сосуды латеральной группы формируются в области IV и V пальцев, латеральной части тыльной поверхности стопы и латеральной поверхности голени, поднимаются вверх и несколько ниже коленного сустава присоединяются к сосудам медиальной группы.
Лимфатические сосуды нижней конечности также делятся на поверхностные, собирающие лимфу от кожи и подкожной клетчатки, и глубокие, отводящие лимфу от глубоких тканей: фасций, сухожилий, мышц, связок, суставов и 6 костей. Поверхностные лимфатические сосуды (vasa lymphatica superficialia) делятся на медиальную и заднелатеральную группы. Сосуды медиальной группы берут начало в коже I, И, III пальцев, собирают лимфу от тыльной поверхности медиальной части стопы, медиальной и заднемедиальной поверхностей голени, всего бедра и впадают в поверхностные паховые лимфатические узлы (nodi lymphatici inguinales superficiales), которые в количестве 12-16 залегают под кожей в верхней трети бедра, ниже паховой связки. В эти же узлы оттекает лимфа от передней брюшной стенки (ниже пупка), ягодичной области, наружных половых органов, промежности и части органов малого таза(Лысов П. К., Сапин М. Р.,2009). Лимфатические сосуды латеральной группы формируются в области IV и V пальцев, латеральной части тыльной поверхности стопы и латеральной поверхности голени, поднимаются вверх и несколько ниже коленного сустава присоединяются к сосудам медиальной группы. Задняя группа лимфатических сосудов начинается в коже подошвенной поверхности латерального края и пятки стопы, а затем достигают подколенной ямки, где впадают в 1-3 подко- ленных лимфатических узла (nodi lymphatici poplitei). Выносящие сосуды этих узлов несут лимфу в 2-7 глубоких паховых узла (nodi lymphatici inguinales profundi). Выносящие лимфатические сосуды паховых лимфатических узлов через сосудистую лакуну направляются в полость таза к наружным подвздошным лимфатическим узлам. Глубокие лимфатические сосуды (vasalymphatica profunda) нижней конечности образуются из лимфатических капилляров мышц, суставов, синовиальных сумок и влагалищ, надкостниц, костей и костного мозга, нервов стопы, голени и коленного сустава, поднимаются вверх, сопровождая крупные артерии и вены голени, и впадают в подколенные лимфатические узлы. Выносящие лимфатические сосуды подколенных узлов проникают через приводящий канал на бедро, где соединяются с глубокими лимфатическими сосудами бедра, при этом в верхней трети бедра одна часть этих лимфатичес- 7 полой вене — разделяются на левые поясничные (nodi lymphatici lumbales sinistri): латеральные, аортальные, предаортальные, позадиаортальные, промежуточные поясничные (nodi lymphatici lumbales intermedii): между аортой и нижней полой веной и правые поясничные (nodi lymphatici lumbales dextri): латеральные кавальные, предкавальные, позадикавальные.
Задняя группа лимфатических сосудов начинается в коже подошвенной поверхности латерального края и пятки стопы, а затем достигают подколенной ямки, где впадают в 1-3 подко- ленных лимфатических узла (nodi lymphatici poplitei). Выносящие сосуды этих узлов несут лимфу в 2-7 глубоких паховых узла (nodi lymphatici inguinales profundi). Выносящие лимфатические сосуды паховых лимфатических узлов через сосудистую лакуну направляются в полость таза к наружным подвздошным лимфатическим узлам. Глубокие лимфатические сосуды (vasalymphatica profunda) нижней конечности образуются из лимфатических капилляров мышц, суставов, синовиальных сумок и влагалищ, надкостниц, костей и костного мозга, нервов стопы, голени и коленного сустава, поднимаются вверх, сопровождая крупные артерии и вены голени, и впадают в подколенные лимфатические узлы. Выносящие лимфатические сосуды подколенных узлов проникают через приводящий канал на бедро, где соединяются с глубокими лимфатическими сосудами бедра, при этом в верхней трети бедра одна часть этих лимфатичес- 7 полой вене — разделяются на левые поясничные (nodi lymphatici lumbales sinistri): латеральные, аортальные, предаортальные, позадиаортальные, промежуточные поясничные (nodi lymphatici lumbales intermedii): между аортой и нижней полой веной и правые поясничные (nodi lymphatici lumbales dextri): латеральные кавальные, предкавальные, позадикавальные. Все перечисленные поясничные лимфатические узлы вместе с соединяющими их лимфатическими сосудами образуют возле брюшной части аорты и нижней полой вены густое лимфатическое сплетение. Через поясничные лимфатические узлы протекает лимфа от нижних конечностей, стенок и органов таза. В эти же узлы впадают выносящие лимфатические сосуды висцеральных лимфатических узлов, собирающих лимфу от внутренних органов брюшной полости (желудочные, брыжеечные, ободочные и др.). К париетальным лимфатическим узлам относятся также непостоянные нижние диафрагмальные лимфатические узлы (nodi lymphatici phrenici inferiores), располагающиеся на задней брюшной стенке возле нижней диафрагмальной артерии. Они собирают лимфу от диафрагмы, задней части правой и левой долей печени. От нижних диафрагмальных лимфатических узлов лимфа оттекает к чревным, позадикавальным и промежуточным поясничным лимфатическим узлам. Висцеральные лимфатические узлы брюшной полости располагаются на пути движения лимфы от органов, как правило, в несколько рядов.
Все перечисленные поясничные лимфатические узлы вместе с соединяющими их лимфатическими сосудами образуют возле брюшной части аорты и нижней полой вены густое лимфатическое сплетение. Через поясничные лимфатические узлы протекает лимфа от нижних конечностей, стенок и органов таза. В эти же узлы впадают выносящие лимфатические сосуды висцеральных лимфатических узлов, собирающих лимфу от внутренних органов брюшной полости (желудочные, брыжеечные, ободочные и др.). К париетальным лимфатическим узлам относятся также непостоянные нижние диафрагмальные лимфатические узлы (nodi lymphatici phrenici inferiores), располагающиеся на задней брюшной стенке возле нижней диафрагмальной артерии. Они собирают лимфу от диафрагмы, задней части правой и левой долей печени. От нижних диафрагмальных лимфатических узлов лимфа оттекает к чревным, позадикавальным и промежуточным поясничным лимфатическим узлам. Висцеральные лимфатические узлы брюшной полости располагаются на пути движения лимфы от органов, как правило, в несколько рядов. Поэтому часть из них находится в области ворот паренхиматозных органов или рядом с полыми органами, а другие локализуются по ходу крупных непарных висце-ральных сосудов или их ветвей. От желудка лимфа оттекает в правые и левые желудочные узлы (nodi lymphatici gastrici) у малой кривизны желудка, кардиальные (лимфатическое кольцо кардии — annulus lymphaticus cardiae), правые и левые желудочно- сальниковые (nodi lymphatici gastroomentalis dextri et sinistri у большой кривизны желудка), панкреатические (nodi lymphatici pancreatici) и селезеночные — (nodi lymphatici lienalis) в воротах селезенки, пилорические 10 (nodi lymphatici pylorici) по ходу желудочно-двенадцатиперстно-кишечной артерии, печеночные (nodi lymphatici hepatici) вдоль печеночных сосудов. От печени лимфа оттекает преимущественно в печеночные (в толще печёночно-двенадцатиперстной связки), желчепузырные, пилорические, правые желудочные, чревные и поясничные лимфатические узлы и через нижние и верхние диафрагмальные — в узлы средостения.
Поэтому часть из них находится в области ворот паренхиматозных органов или рядом с полыми органами, а другие локализуются по ходу крупных непарных висце-ральных сосудов или их ветвей. От желудка лимфа оттекает в правые и левые желудочные узлы (nodi lymphatici gastrici) у малой кривизны желудка, кардиальные (лимфатическое кольцо кардии — annulus lymphaticus cardiae), правые и левые желудочно- сальниковые (nodi lymphatici gastroomentalis dextri et sinistri у большой кривизны желудка), панкреатические (nodi lymphatici pancreatici) и селезеночные — (nodi lymphatici lienalis) в воротах селезенки, пилорические 10 (nodi lymphatici pylorici) по ходу желудочно-двенадцатиперстно-кишечной артерии, печеночные (nodi lymphatici hepatici) вдоль печеночных сосудов. От печени лимфа оттекает преимущественно в печеночные (в толще печёночно-двенадцатиперстной связки), желчепузырные, пилорические, правые желудочные, чревные и поясничные лимфатические узлы и через нижние и верхние диафрагмальные — в узлы средостения. От почек лимфу собирают почечные узлы (nodi lymphatici renales), связанные выносящими сосудами с поясничными узлами. От двенадцатиперстной кишки и прилежащей к ней головки поджелудочной железы основной лимфоотток идет в панкреатодуоденальные узлы (nodi lymphatici pancreatoduodenales), лежащие у места ветвления поджелудочно-двенадцатиперстных артерий. Лимфатические сосуды от тощей и подвздошной кишок впадают в верхние брыжеечные узлы (nodi lymphatici mesenterici superiores), которых насчитывается 60-180. Брыжеечные лимфатические узлы расположены в брыжейке тонкой кишки тремя группами: около брыжеечного края кишки, около ствола и ветвей верхней брыжеечной артерии и возле начального ее отдела. Выносящие сосуды верхних брыжеечных лимфатических узлов следуют к поясничным лимфатическим узлам, а в ряде случаев (до 25%) впадают непосредственно в грудной проток, образуя кишечные стволы (trunci intestinales). Oт конечного отдела подвздошной кишки лимфа направляется в подвздошно-ободочные лимфатические узлы (nodi lymphatici ileocolici).
От почек лимфу собирают почечные узлы (nodi lymphatici renales), связанные выносящими сосудами с поясничными узлами. От двенадцатиперстной кишки и прилежащей к ней головки поджелудочной железы основной лимфоотток идет в панкреатодуоденальные узлы (nodi lymphatici pancreatoduodenales), лежащие у места ветвления поджелудочно-двенадцатиперстных артерий. Лимфатические сосуды от тощей и подвздошной кишок впадают в верхние брыжеечные узлы (nodi lymphatici mesenterici superiores), которых насчитывается 60-180. Брыжеечные лимфатические узлы расположены в брыжейке тонкой кишки тремя группами: около брыжеечного края кишки, около ствола и ветвей верхней брыжеечной артерии и возле начального ее отдела. Выносящие сосуды верхних брыжеечных лимфатических узлов следуют к поясничным лимфатическим узлам, а в ряде случаев (до 25%) впадают непосредственно в грудной проток, образуя кишечные стволы (trunci intestinales). Oт конечного отдела подвздошной кишки лимфа направляется в подвздошно-ободочные лимфатические узлы (nodi lymphatici ileocolici). От толстой кишки (до нисходящей ободочной) лимфа отводится к подвздошно-ободочно-кишечным, правым, средним и левым ободочно- кишечным, к правым и левым желудочно-сальниковым узлам, а от них — к верхним брыжеечным и поясничным узлам. От нисходящей ободочной и сигмовидной кишки лимфу собирают левые ободочно-кишечные (nodi lymphatici colici sinistri) и сигмовидные лимфатические узлы (nodi lymphatici sigmoidei), а далее нижние брыжеечные (nodi lymphatici mesenterici inferiores) и затем поясничные лимфатические узлы. Следует отметить, что на пути 11 лимфатических сосудов ободочной кишки к ее регионарным лимфатическим узлам располагаются непосредственно возле медиальной стенки кишки (нижней — для поперечной ободочной) небольшие околоободочные узлы nodi lymphatici paracolici). Выносящие лимфатические сосуды подвздошно-ободочных, брыжеечно- ободочных, правых и левых ободочных лимфатических узлов направляются к париетальным поясничным лимфатическим узлам, а также к центральной подгруппе верхних брыжеечных лимфатических узлов, находящихся у начала верхней брыжеечной артерии.
От толстой кишки (до нисходящей ободочной) лимфа отводится к подвздошно-ободочно-кишечным, правым, средним и левым ободочно- кишечным, к правым и левым желудочно-сальниковым узлам, а от них — к верхним брыжеечным и поясничным узлам. От нисходящей ободочной и сигмовидной кишки лимфу собирают левые ободочно-кишечные (nodi lymphatici colici sinistri) и сигмовидные лимфатические узлы (nodi lymphatici sigmoidei), а далее нижние брыжеечные (nodi lymphatici mesenterici inferiores) и затем поясничные лимфатические узлы. Следует отметить, что на пути 11 лимфатических сосудов ободочной кишки к ее регионарным лимфатическим узлам располагаются непосредственно возле медиальной стенки кишки (нижней — для поперечной ободочной) небольшие околоободочные узлы nodi lymphatici paracolici). Выносящие лимфатические сосуды подвздошно-ободочных, брыжеечно- ободочных, правых и левых ободочных лимфатических узлов направляются к париетальным поясничным лимфатическим узлам, а также к центральной подгруппе верхних брыжеечных лимфатических узлов, находящихся у начала верхней брыжеечной артерии. Грудная полость. В грудной полости выделяют париетальные (пристеночные) лимфатические узлы, расположенные на стенках (передние, нижние, задние) и висцеральные (внутренностные), находящиеся в грудной полости на пути лимфы от ее внутренних органов. К париетальным узлам грудной полости относятся окологрудные (парамаммарные). окологрудинные (парастернальные), межреберные, предпозвоночные, верхние диафрагмальные; к висцеральным — передние и задние средостенные, легочные, пищеводные, бронхолегочные, верхние и нижние трахеобронхиальные, околотрахеальные, предперикардиальные и латеральные перикардиальные узлы(Самусев Р. П., Липченко В. Я.,2008). От стенок грудной полости, париетальной плевры, перикарда, части печени и молочной железы лимфа поступает в основном в межреберные (nodi lymphatici intercostales), окологрудинные (nodi lymphatici parasternales) и верхние (nodi lymphatici phrenici superiores) диафрагмальные узлы. Среди последних выделяют латеральные перикардиальные, предперикардиальные и позадиперикардиальные лимфатические узлы.
Грудная полость. В грудной полости выделяют париетальные (пристеночные) лимфатические узлы, расположенные на стенках (передние, нижние, задние) и висцеральные (внутренностные), находящиеся в грудной полости на пути лимфы от ее внутренних органов. К париетальным узлам грудной полости относятся окологрудные (парамаммарные). окологрудинные (парастернальные), межреберные, предпозвоночные, верхние диафрагмальные; к висцеральным — передние и задние средостенные, легочные, пищеводные, бронхолегочные, верхние и нижние трахеобронхиальные, околотрахеальные, предперикардиальные и латеральные перикардиальные узлы(Самусев Р. П., Липченко В. Я.,2008). От стенок грудной полости, париетальной плевры, перикарда, части печени и молочной железы лимфа поступает в основном в межреберные (nodi lymphatici intercostales), окологрудинные (nodi lymphatici parasternales) и верхние (nodi lymphatici phrenici superiores) диафрагмальные узлы. Среди последних выделяют латеральные перикардиальные, предперикардиальные и позадиперикардиальные лимфатические узлы. К диафрагмальным узлам направляются лимфатические сосуды от диафрагмы, перикарда, плевры и диафрагмальной части печени, а от них — в окологрудинные, задние средостениые, нижние трахеобронхиальные и бронхолегочные лимфатические узлы. Лимфоотток от молочной железы идет в нескольких направлениях: от 12 лимфатические узлы. Локтевые расположены в области одноименного сустава, подмышечные — в подмышечной полости и делятся на поверхностные и глубокие. К узлам подходят поверхностные и глубокие лимфатические сосуды, собирающие лимфу от образований верхней конечности. Поверхностные лимфатические сосуды располагаются рядом с подкожными венами верхней конечности и образуют три группы: медиальную, среднюю и латеральную (Лысов П. К., Сапин М. Р.,2009). Медиальная группа поверхностных лимфатических сосудов верхней конечности локализуется в коже и подкожной основе IV-V пальцев и, частично, III пальца и собирает лимфу от медиальной части кисти, предплечья и плеча. Часть этих сосудов впадает в поверхностные подмышечные узлы (nodi lymphatici axillares superficiales), часть — в поверхностные локтевые (nodi lymphatici cubitales superficiales), выносящие сосуды которых достигают центральных подмышечных лимфатических узлов.
К диафрагмальным узлам направляются лимфатические сосуды от диафрагмы, перикарда, плевры и диафрагмальной части печени, а от них — в окологрудинные, задние средостениые, нижние трахеобронхиальные и бронхолегочные лимфатические узлы. Лимфоотток от молочной железы идет в нескольких направлениях: от 12 лимфатические узлы. Локтевые расположены в области одноименного сустава, подмышечные — в подмышечной полости и делятся на поверхностные и глубокие. К узлам подходят поверхностные и глубокие лимфатические сосуды, собирающие лимфу от образований верхней конечности. Поверхностные лимфатические сосуды располагаются рядом с подкожными венами верхней конечности и образуют три группы: медиальную, среднюю и латеральную (Лысов П. К., Сапин М. Р.,2009). Медиальная группа поверхностных лимфатических сосудов верхней конечности локализуется в коже и подкожной основе IV-V пальцев и, частично, III пальца и собирает лимфу от медиальной части кисти, предплечья и плеча. Часть этих сосудов впадает в поверхностные подмышечные узлы (nodi lymphatici axillares superficiales), часть — в поверхностные локтевые (nodi lymphatici cubitales superficiales), выносящие сосуды которых достигают центральных подмышечных лимфатических узлов. Лимфатические сосуды латеральной группы формируются в коже и подкожной основе I—III пальцев, а также латерального края кисти. Они собирают лимфу от кисти, предплечья и плеча, следуя вдоль латеральной подкожной вены, и впадают в глубокие подмышечные лимфатические узлы (nodi lymphatici axillaris profundi). Лимфатические сосуды средней группы следуют от передней (ладонной) поверхности запястья и предплечья, направляясь в сторону локтя, где часть из них присоединяется к медиальной, а часть — к латеральной группе лимфатических сосудов. Глубокие лимфатические сосуды верхней конечности от мышц, сухожилий, фасций, суставов и связок, надкостницы, нервов идут по ходу глубоких артерий и вен к локтевым узлам и далее к глубоким подмышечным. Глубокие подмышечные лимфатические узлы располагаются в жировой клетчатке подмышечной полости в виде 6 групп: латеральные лимфатические узлы; медиальные, или грудные; подлопаточные, или задние; нижние; центральные, лежащие между подмышечной веной и медиальной стенкой полости; верхушечные, которые располагаются под ключицей.
Лимфатические сосуды латеральной группы формируются в коже и подкожной основе I—III пальцев, а также латерального края кисти. Они собирают лимфу от кисти, предплечья и плеча, следуя вдоль латеральной подкожной вены, и впадают в глубокие подмышечные лимфатические узлы (nodi lymphatici axillaris profundi). Лимфатические сосуды средней группы следуют от передней (ладонной) поверхности запястья и предплечья, направляясь в сторону локтя, где часть из них присоединяется к медиальной, а часть — к латеральной группе лимфатических сосудов. Глубокие лимфатические сосуды верхней конечности от мышц, сухожилий, фасций, суставов и связок, надкостницы, нервов идут по ходу глубоких артерий и вен к локтевым узлам и далее к глубоким подмышечным. Глубокие подмышечные лимфатические узлы располагаются в жировой клетчатке подмышечной полости в виде 6 групп: латеральные лимфатические узлы; медиальные, или грудные; подлопаточные, или задние; нижние; центральные, лежащие между подмышечной веной и медиальной стенкой полости; верхушечные, которые располагаются под ключицей. Подмышечные 15 узлы принимают лимфу от верхней конечности, верхних отделов передней брюшной стенки, стенок грудной полости и латеральных частей молочной железы. Из выносящих сосудов подмышечных узлов формируется подключичный ствол (truncus subclavius) или 2-3 крупных сосуда, сопровождающих подключичную вену и впадающих слева — в грудной проток, а справа — в правый лимфатический проток или правую подключичную вену. 1.2. Физиология лимфатической системы 1.2.1. Функции лимфатической системы Наиболее важной функцией лимфатической системы является возврат белков, электролитов и воды из интерстициального пространства в кровь. (Покровский В. М., Коротько Г. Ф .,1997). За сутки в составе лимфы в кровоток возвращается более 100 г белка, профильтровавшегося из кровеносных капилляров в интерстициальное пространство. Нормальная лимфоциркуляция необходима для формирования максимально концентрированной мочи в почке. Через лимфатическую систему переносятся многие продукты, всасывающиеся в желудочно-кишечном тракте, и прежде всего жиры.
Подмышечные 15 узлы принимают лимфу от верхней конечности, верхних отделов передней брюшной стенки, стенок грудной полости и латеральных частей молочной железы. Из выносящих сосудов подмышечных узлов формируется подключичный ствол (truncus subclavius) или 2-3 крупных сосуда, сопровождающих подключичную вену и впадающих слева — в грудной проток, а справа — в правый лимфатический проток или правую подключичную вену. 1.2. Физиология лимфатической системы 1.2.1. Функции лимфатической системы Наиболее важной функцией лимфатической системы является возврат белков, электролитов и воды из интерстициального пространства в кровь. (Покровский В. М., Коротько Г. Ф .,1997). За сутки в составе лимфы в кровоток возвращается более 100 г белка, профильтровавшегося из кровеносных капилляров в интерстициальное пространство. Нормальная лимфоциркуляция необходима для формирования максимально концентрированной мочи в почке. Через лимфатическую систему переносятся многие продукты, всасывающиеся в желудочно-кишечном тракте, и прежде всего жиры. Некоторые крупномолекулярные ферменты, такие как гистаминаза и липаза, поступают в кровь исключительно по системе лимфатических сосудов. Лимфатическая система действует как транспортная система по удалению эритроцитов, оставшихся в ткани после кровотечения, а также по удалению и обезвреживанию бактерий, попавших в ткани. Лимфатическая система продуцирует и осуществляет перенос лимфоцитов и других важнейших факторов иммунитета. При возникновении инфекции в каких-либо частях тела региональные лимфатические узлы воспаляются в результате задержки в них бактерий или токсинов. В синусах лимфатических узлов, расположенных в корковом и мозговом слоях, содержится эффективная фильтрационная система, которая позволяет практически стерилизовать поступающую в лимфатические узлы инфицированную лимфу. 16 1.2.2. Состав и свойства лимфы Лимфа (Iympha — чистая вода, влага) представляет собой прозрачную жидкость, в которой содержатся белые форменные элементы крови — лимфоциты, а также небольшое количество эозинофилов и моноцитов.
Некоторые крупномолекулярные ферменты, такие как гистаминаза и липаза, поступают в кровь исключительно по системе лимфатических сосудов. Лимфатическая система действует как транспортная система по удалению эритроцитов, оставшихся в ткани после кровотечения, а также по удалению и обезвреживанию бактерий, попавших в ткани. Лимфатическая система продуцирует и осуществляет перенос лимфоцитов и других важнейших факторов иммунитета. При возникновении инфекции в каких-либо частях тела региональные лимфатические узлы воспаляются в результате задержки в них бактерий или токсинов. В синусах лимфатических узлов, расположенных в корковом и мозговом слоях, содержится эффективная фильтрационная система, которая позволяет практически стерилизовать поступающую в лимфатические узлы инфицированную лимфу. 16 1.2.2. Состав и свойства лимфы Лимфа (Iympha — чистая вода, влага) представляет собой прозрачную жидкость, в которой содержатся белые форменные элементы крови — лимфоциты, а также небольшое количество эозинофилов и моноцитов. Количество лимфоцитов колеблется от 2000 до 10 000 в 1 мм3. По своему составу плазма лимфы напоминает плазму крови, однако содержание белка в ней меньше, чем в плазме крови, и она имеет более низкое коллоидно-осмо- тическое давление, более высокую электропроводность. Емкость лимфатического русла очень изменчива. (Д.А. Жданов, В.В. Куприянов,1952). Если по какой-то причине нарушается отток венозной крови, лимфообразование резко увеличивается, меняется состав лимфы. В таких случаях лимфатические капилляры вместе с лимфатическими сосудами играют важную роль в предупреждении отеков. Объем лимфы в организме человека составляет 1-2 л. Образующаяся лимфа постоянно опекает в венозное русло. За сутки через грудной лимфатический проток в кровь поступает 1200-1500 мл лимфы, в которой содержится примерно 35,5 х 109 лимфоцитов (Козлов В. И, Кривский И. П.,2005). Лимфа, собираемая из лимфатических протоков во время голодания или после приема нежирной пищи, представляет собой бесцветную, почти прозрачную жидкость, отличающуюся от плазмы крови в 3—4 раза меньшим содержанием белков.
Количество лимфоцитов колеблется от 2000 до 10 000 в 1 мм3. По своему составу плазма лимфы напоминает плазму крови, однако содержание белка в ней меньше, чем в плазме крови, и она имеет более низкое коллоидно-осмо- тическое давление, более высокую электропроводность. Емкость лимфатического русла очень изменчива. (Д.А. Жданов, В.В. Куприянов,1952). Если по какой-то причине нарушается отток венозной крови, лимфообразование резко увеличивается, меняется состав лимфы. В таких случаях лимфатические капилляры вместе с лимфатическими сосудами играют важную роль в предупреждении отеков. Объем лимфы в организме человека составляет 1-2 л. Образующаяся лимфа постоянно опекает в венозное русло. За сутки через грудной лимфатический проток в кровь поступает 1200-1500 мл лимфы, в которой содержится примерно 35,5 х 109 лимфоцитов (Козлов В. И, Кривский И. П.,2005). Лимфа, собираемая из лимфатических протоков во время голодания или после приема нежирной пищи, представляет собой бесцветную, почти прозрачную жидкость, отличающуюся от плазмы крови в 3—4 раза меньшим содержанием белков. Лимфа грудного протока, а также лимфатических сосудов кишечника через 6—8 ч после приема жирной пищи непрозрачна, молочно- белого цвета, так как в ней содержатся эмульгированные жиры, всосавшиеся в кишечнике. Вследствие малого содержания белков вязкость лимфы меньше, а относительная плотность ниже, чем плазмы крови. Реакция лимфы щелочная. В лимфе содержится фибриноген, поэтому она способна свертываться, образуя рыхлый, слегка желтоватый сгусток. 17 веществ) из кровяного русла в тканевую жидкость, должно быть равным разности между указанными двумя давлениями, т. е. примерно 6—10 мм рт. ст. Присасывающая сила отрицательного давления в тканях действует независимо от изменения гидростатического давления в капиллярах, т. е. от уровня системного артериального давления, что увеличивает надежность процесса перехода воды из кровяного русла в ткани и образование лимфы. Фактором, содействующим лимфообразованию, может быть повышение осмотического давления тканевой жидкости и самой лимфы. Этот фактор приобретает большое значение, если в тканевую жидкость и лимфу переходит значительное количество продуктов диссимиляций.
Лимфа грудного протока, а также лимфатических сосудов кишечника через 6—8 ч после приема жирной пищи непрозрачна, молочно- белого цвета, так как в ней содержатся эмульгированные жиры, всосавшиеся в кишечнике. Вследствие малого содержания белков вязкость лимфы меньше, а относительная плотность ниже, чем плазмы крови. Реакция лимфы щелочная. В лимфе содержится фибриноген, поэтому она способна свертываться, образуя рыхлый, слегка желтоватый сгусток. 17 веществ) из кровяного русла в тканевую жидкость, должно быть равным разности между указанными двумя давлениями, т. е. примерно 6—10 мм рт. ст. Присасывающая сила отрицательного давления в тканях действует независимо от изменения гидростатического давления в капиллярах, т. е. от уровня системного артериального давления, что увеличивает надежность процесса перехода воды из кровяного русла в ткани и образование лимфы. Фактором, содействующим лимфообразованию, может быть повышение осмотического давления тканевой жидкости и самой лимфы. Этот фактор приобретает большое значение, если в тканевую жидкость и лимфу переходит значительное количество продуктов диссимиляций.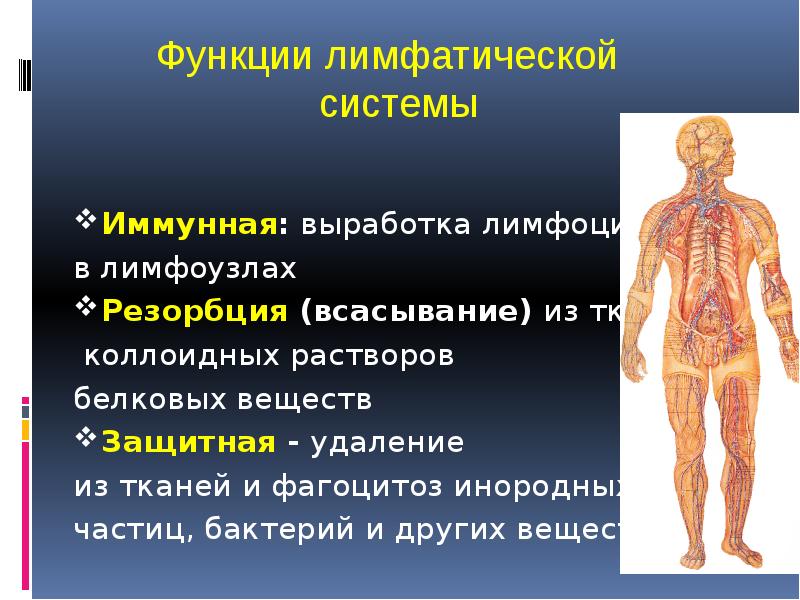 Большинство продуктов обмена имеет относительно низкую молекулярную массу и потому повышает осмотическое давление тканевой жидкости, что в свою очередь обусловливает поступление в ткани воды из крови и усиливает лимфообразование (Куприянов, В. В., Бородин Ю. И., Караганов Я. Л., Выренков Ю. Е.,1983). Усиление лимфообразования происходит при введении в кровь некоторых так называемых лимфогонных веществ. Лимфогонным свойством обладают вещества, извлеченные из земляники, пептоны, гистамин и др. Механизм усиленного лимфообразования и лимфообращения при действии лимфогонных веществ состоит в том, что они увеличивают проницаемость стенки капилляров. Действие лимфогонных веществ аналогично действию факторов, вызывающих воспалительные реакции (бактерийные токсины, ожог и т. п.). Последние также увеличивают проницаемость капилляров, что ведет к образованию воспалительного экссудата. Стенка капилляров обладает избирательной проницаемостью. Особенно отчетливо эта избирательность проявляется в капиллярах мозга, которые не пропускают из крови ряд веществ, свободно проходящих через капиллярную стенку других органов.
Большинство продуктов обмена имеет относительно низкую молекулярную массу и потому повышает осмотическое давление тканевой жидкости, что в свою очередь обусловливает поступление в ткани воды из крови и усиливает лимфообразование (Куприянов, В. В., Бородин Ю. И., Караганов Я. Л., Выренков Ю. Е.,1983). Усиление лимфообразования происходит при введении в кровь некоторых так называемых лимфогонных веществ. Лимфогонным свойством обладают вещества, извлеченные из земляники, пептоны, гистамин и др. Механизм усиленного лимфообразования и лимфообращения при действии лимфогонных веществ состоит в том, что они увеличивают проницаемость стенки капилляров. Действие лимфогонных веществ аналогично действию факторов, вызывающих воспалительные реакции (бактерийные токсины, ожог и т. п.). Последние также увеличивают проницаемость капилляров, что ведет к образованию воспалительного экссудата. Стенка капилляров обладает избирательной проницаемостью. Особенно отчетливо эта избирательность проявляется в капиллярах мозга, которые не пропускают из крови ряд веществ, свободно проходящих через капиллярную стенку других органов. 20 1.2.4. Механизмы передвижения лимфы В нормальных условиях в организме существует равновесие между скоростью лимфообразования и скоростью оттока лимфы от тканей. Отток лимфы из лимфатических капилляров совершается по лимфатическим сосудам, которые, сливаясь, образуют два крупных лимфатических протока, впадающих в вены. Таким образом, жидкость, вышедшая из крови в капиллярах, снова возвращается в кровяное русло, принося ряд, продуктов клеточного обмена. В перемещении лимфы определенную роль играют ритмические сокращения стенок некоторых лимфатических сосудов. В минуту происходит 8—10, а по данным отдельных исследователей, 22 сокращения. Перемещение лимфы при сокращении сосудистой стенки в связи с существованием клапанов в лимфатических сосудах происходит только в одном направлении. Морфологически обнаружены нервные волокна, подходящие к крупным лимфатическим сосудам а физиологическими экспериментами показано влияние симпатических нервов на лимфоток. При раздражении симпатического пограничного ствола наблюдали настолько сильное сокращение и спазм лимфатических сосудов, что движение лимфы в них прекращалось.
20 1.2.4. Механизмы передвижения лимфы В нормальных условиях в организме существует равновесие между скоростью лимфообразования и скоростью оттока лимфы от тканей. Отток лимфы из лимфатических капилляров совершается по лимфатическим сосудам, которые, сливаясь, образуют два крупных лимфатических протока, впадающих в вены. Таким образом, жидкость, вышедшая из крови в капиллярах, снова возвращается в кровяное русло, принося ряд, продуктов клеточного обмена. В перемещении лимфы определенную роль играют ритмические сокращения стенок некоторых лимфатических сосудов. В минуту происходит 8—10, а по данным отдельных исследователей, 22 сокращения. Перемещение лимфы при сокращении сосудистой стенки в связи с существованием клапанов в лимфатических сосудах происходит только в одном направлении. Морфологически обнаружены нервные волокна, подходящие к крупным лимфатическим сосудам а физиологическими экспериментами показано влияние симпатических нервов на лимфоток. При раздражении симпатического пограничного ствола наблюдали настолько сильное сокращение и спазм лимфатических сосудов, что движение лимфы в них прекращалось.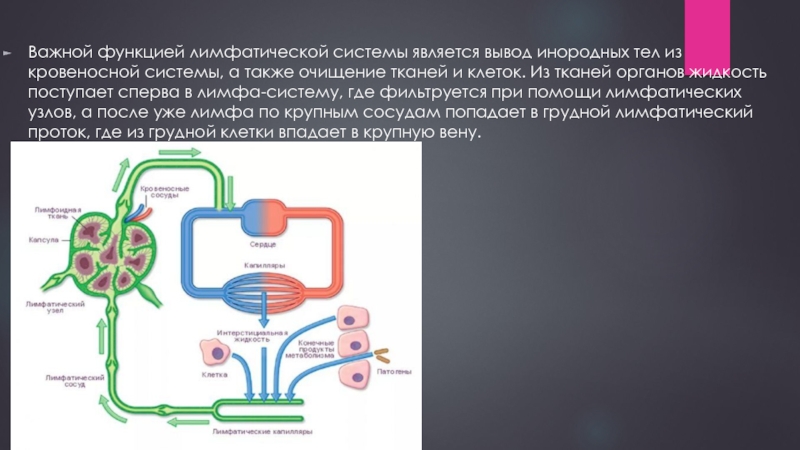 Установлено также, что лимфоток изменяется рефлекторно при болевых раздражениях, повышении давления в каротидном синусе и при раздражении рецепторов кровеносных сосудов многих внутренних органов. В передвижении лимфы большое значение имеют отрицательное давление в грудной полости и увеличение объема грудной клетки при вдохе. Последнее вызывает расширение грудного лимфатического протока, что облегчает движение лимфы по лимфатическим сосудам. Движению лимфы, способствуют сгибания и разгибания ног во время работы и ходьбы. При мышечных сокращениях лимфатические сосуды сдавливаются, что вызывает перемещение лимфы только в одном направлении. Количество лимфы, возвращающейся в течение суток через грудной проток в кровь, составляет у человека около 1000—3000 мл. 21 ЗАКЛЮЧЕНИЕ 1. Лимфатическая система является важной составляющей постоянства внутренней среды организма человека. В организме наряду с системой кровеносных сосудов имеется система лимфатических сосудов. Она начинается с разветвленной сети замкнутых капилляров, стенки которых обладают высокой проницаемостью и способностью всасывать коллоидные растворы и взвеси.
Установлено также, что лимфоток изменяется рефлекторно при болевых раздражениях, повышении давления в каротидном синусе и при раздражении рецепторов кровеносных сосудов многих внутренних органов. В передвижении лимфы большое значение имеют отрицательное давление в грудной полости и увеличение объема грудной клетки при вдохе. Последнее вызывает расширение грудного лимфатического протока, что облегчает движение лимфы по лимфатическим сосудам. Движению лимфы, способствуют сгибания и разгибания ног во время работы и ходьбы. При мышечных сокращениях лимфатические сосуды сдавливаются, что вызывает перемещение лимфы только в одном направлении. Количество лимфы, возвращающейся в течение суток через грудной проток в кровь, составляет у человека около 1000—3000 мл. 21 ЗАКЛЮЧЕНИЕ 1. Лимфатическая система является важной составляющей постоянства внутренней среды организма человека. В организме наряду с системой кровеносных сосудов имеется система лимфатических сосудов. Она начинается с разветвленной сети замкнутых капилляров, стенки которых обладают высокой проницаемостью и способностью всасывать коллоидные растворы и взвеси. Лимфатические капилляры впадают в лимфатические сосуды, по которым находящаяся в них жидкость — лимфа — притекает к двум крупным лимфатическим протокам — шейному и грудному, впадающим в подключичные вены. 2. В отличие от кровеносных сосудов по которым происходит как приток крови к тканям тела, так и ее отток от них, лимфатические сосуды служат лишь для оттока лимфы, т. е. возвращают в кровь поступившую в ткани жидкость. Лимфатические сосуды являются как бы дренажной системой, удаляющей избыток находящейся в органах тканевой, или интерстициальной, жидкости. Важно, что оттекающая от тканей лимфа по пути к венам проходит через биологические фильтры — лимфатические узлы. В них задерживаются и не попадают в кровоток некоторые чужеродные частицы, например бактерии и т. п. Они поступают из тканей в лимфатические, а не в кровеносные капилляры вследствие более высокой проницаемости стенок первых по сравнению со вторыми. 22
Лимфатические капилляры впадают в лимфатические сосуды, по которым находящаяся в них жидкость — лимфа — притекает к двум крупным лимфатическим протокам — шейному и грудному, впадающим в подключичные вены. 2. В отличие от кровеносных сосудов по которым происходит как приток крови к тканям тела, так и ее отток от них, лимфатические сосуды служат лишь для оттока лимфы, т. е. возвращают в кровь поступившую в ткани жидкость. Лимфатические сосуды являются как бы дренажной системой, удаляющей избыток находящейся в органах тканевой, или интерстициальной, жидкости. Важно, что оттекающая от тканей лимфа по пути к венам проходит через биологические фильтры — лимфатические узлы. В них задерживаются и не попадают в кровоток некоторые чужеродные частицы, например бактерии и т. п. Они поступают из тканей в лимфатические, а не в кровеносные капилляры вследствие более высокой проницаемости стенок первых по сравнению со вторыми. 22
Строение кожи
сточник: Справочник дерматовенеролога, ЛА «Научная книга»
Кожа (лат. cutis) — сложный орган, являющийся наружным покровом тела человека, выполняющий защитные и физиологические функции.
cutis) — сложный орган, являющийся наружным покровом тела человека, выполняющий защитные и физиологические функции.
Кожа покрывает все тело человека, а ее площадь равна 1,5…2 м2в зависимости от возраста, роста и пола. Вес ее без гиподермы равен 4…6 % от общего веса человека, с гиподермой — 16…18 %; в зависимости от толщины подкожной жировой клетчатки (на ягодицах и животе) этот слой может составлять более 10 см. Толщина дермы разная — от 0,5 до 5 мм и зависит от места расположения. На спине, плечах и разгибательной поверхности бедер дерма наиболее толстая, на ладонях и ступнях — от 30 мкм до 1,5 мм. В области рта, носа, заднего прохода, мочеиспускательного канала и влагалища кожа переходит непосредственно в слизистые оболочки. Цвет кожи зависит от характера расположения поверхностных сосудов и наличия пигмента меланина.
 Эти поля особенно хорошо видны на тыльной поверхности кистей.
Эти поля особенно хорошо видны на тыльной поверхности кистей.На ладонной и подошвенной поверхности пальцев бороздки расположены параллельно. Расположение бороздок (sulci cutis) и гребешков (cristae cutis) на подушечках пальцев рук человека строго индивидуально.
В коже различают три отдела:
1) эпидермис (надкожица) — epidermis;
2) дерма (собственно кожа) — cutis propria, corium;
3) гиподерма (подкожная жировая клетчатка) — subcutis.
Кожа состоит из слоев различного эмбрионального происхождения. Эпидерма происходит из наружного зародышевого листа — эктодермы, дерма и гиподерма — из среднего зародышевого листка — мезодермы. Эпидермис является эпителиальной тканью, дерма и гиподерма в основном представляют собой соединительную ткань.
Эпидермис — наружный слой кожи, состоящий из кератиноцитов, или эпидермальных клеток. Под эпидермисом располагается дерма, в состав которой входят коллаген и придатки кожи (волосяные фолликулы, сальные железы, апокринные и эккринные железы).
Клетки в эпидермисе. Кроме кератиноцитов, в эпидермисе встречаются три вида других клеток. Наиболее распространенная клетка — меланоцит (дендрическая клетка, располагающаяся в базальном слое). На один меланоцит приходится приблизительно 36 кератиноцитов. Функция меланоцита — синтез и секреция меланинсодержащих органелл (меланосом). Меланоциты передают меланосомы кератиноцитам. Следующая по частоте клетка — клетка Лангерганса, которая имеет костномозговое происхождение, обладает антигенпрезентирующей функцией и осуществляет иммунный надзор. Эти дендрические клетки располагаются преимущественно в шиповатом слое. Они впервые были описаны студентом-медиком Паулем Лангергансом в 1868 г. В небольшом количестве в эпидермисе встречаются клетки Меркеля.
Строение зоны базальной мембраны (ЗБМ). Зона базальной мембраны при световой микроскопии и окраске гематоксилин-эозином в норме не видна; при окраске по Шиффу она выявляется в виде гомогенной ленты толщиной 0,5…1,0 мкм. Ультраструктурные и иммунологические исследования позволили установить, что ЗБМ представляет собой сложную структуру, предназначенную для соединения базального слоя с дермой. Верхняя часть ЗБМ состоит из цитоплазматических тонофиламентов базальных клеток, которые соединяются с полудесмосомами. Полудесмосомы связаны с lamina lucida и lamina densa якорными филаментами. Нижняя часть ЗБМ соединена с дермой якорными филаментами, проходящими через ее коллагеновые волокна. Значение этих структур в поддержании целостности кожи продемонстрировано при буллезном эпидермолизе — наследственном заболевании, при котором они не образуются или исчезают.
Структура эпидермиса и его функции. Наиболее важные функции эпидермиса — защита от факторов окружающей среды (барьерная функция), предупреждение обезвоживания и иммунный надзор. Роговой слой играет наиболее важную роль в защите от токсинов и обезвоживания. Многие токсины представляют собой неполярные соединения, которые способны относительно легко проходить через богатые липидами межклеточные пространства рогового слоя, однако извитые границы между клетками в роговом и нижерасположенных слоях являются надежным барьером от них. Ультрафиолетовое излучение (другой фактор окружающей среды, повреждающий живые клетки) эффективно отражается роговым слоем и поглощается меланосомами. Меланосомы концентрируются над ядрами кератиноцитов в виде зонтика, защищая как ядерную ДНК, так и дерму. В нормальном эпидермисе содержание воды уменьшается: от 70…75 % в глубоких слоях до 10…15 % в основании рогового слоя. Предупреждение обезвоживания — исключительно важная функция эпидермиса, поскольку его значительное повреждение (например, при токсическом эпидермальном некролизе) приводит к гибели организма.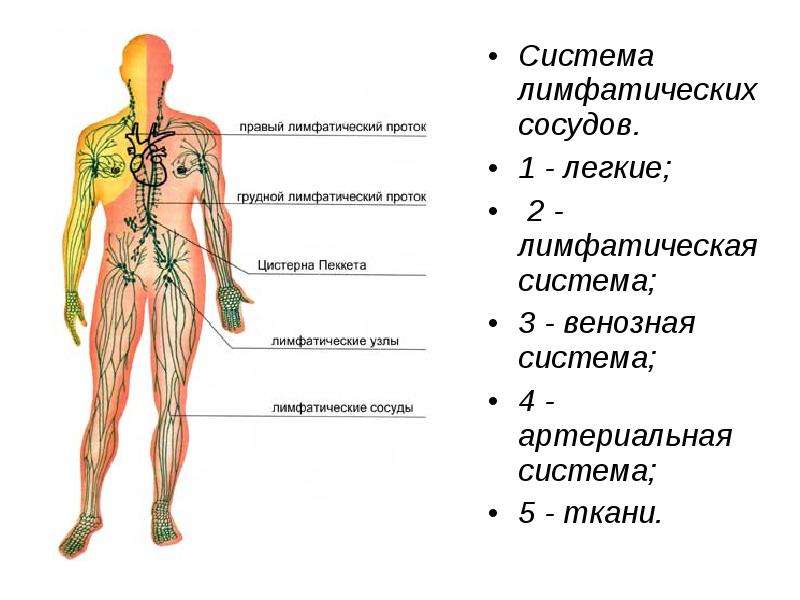
Иммунный надзор против чужеродных антигенов связан с функцией клеток Лангерганса, расположенных между кератиноцитами. Клетки Лангерганса поглощают внешний антиген и готовят его для представления Т-лимфоцитам в лимфатических узлах. Воспалительные клетки (нейтрофилы, эозинофилы, лимфоциты) также способны взаимодействовать и разрушать микроорганизмы в эпидермисе.
В эпидермисе кератиноциты связаны друг с другом десмосомальным комплексом, включающим в себя десмосомы и цитоплазматические тонофиламенты, состоящие из цитокератинов. В зернистом слое тонофиламенты образованы в основном кератинами 1 и 10. Врожденные дефекты этих кератинов вызывают ослабление связей между кератиноцитами, что приводит к врожденной буллезной ихтиозиформной эритродермии (эпидермолитический гиперкератоз). Дефекты кератинов типа 5 и 14 в базальном слое являются причиной развития простого врожденного эпидермолиза. При пузырчатке аутоантитела, образующиеся против десмосомальных белков, повреждают десмосомы.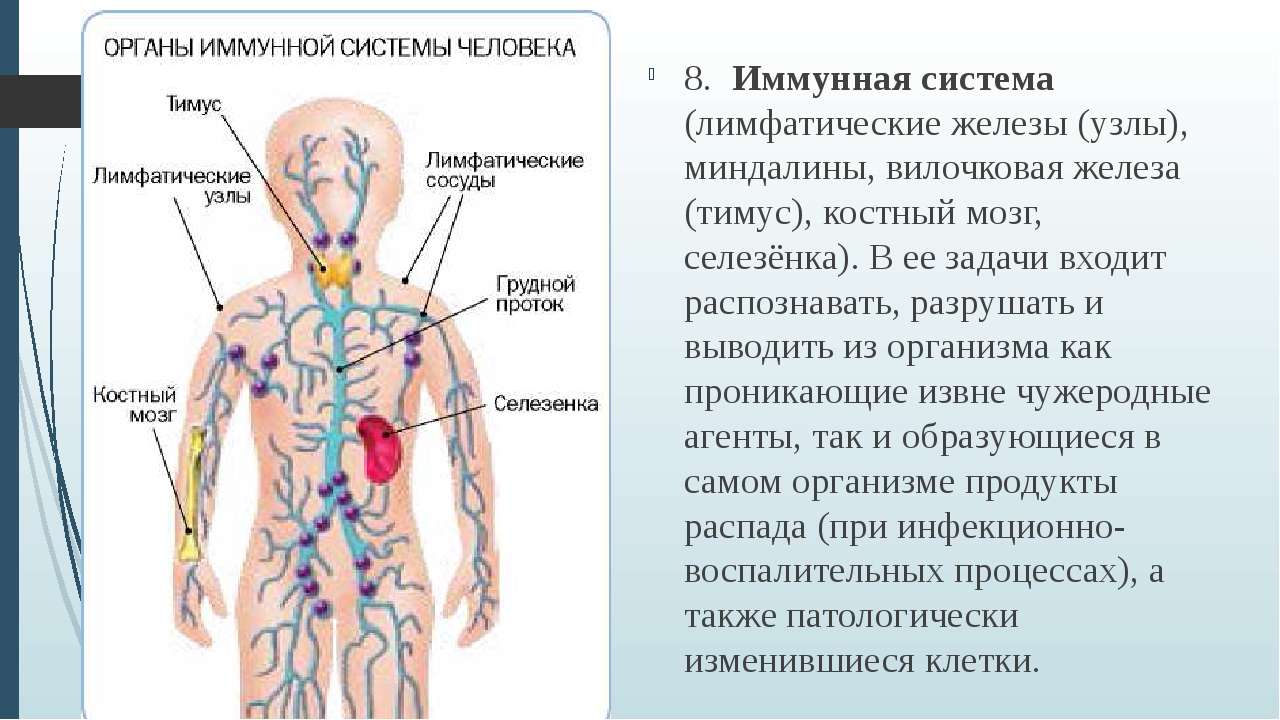
Структурные компоненты базальной мембраны могут отсутствовать или уменьшаться в количестве при врожденных заболеваниях. В верхней части зоны базальной мембраны, в lamina lucida, полудесмосомы связывают базальные кератиноциты и базальную мембрану. При буллезном пемфигоиде (приобретенном буллезном дерматозе) образуются антитела против полудесмосом, что приводит к повреждению последних и образованию полости между клетками и базальной мембраной. При линеарном IgA-буллезном дерматозе антитела против якорных филаментов в lamina lucida ослабляют эти структуры и вызывают появление пузырей.
Эпидермис — наиболее биологически активный из всех слоев, так как состоит из разных клеток с различными функциями. Эпидермис образует весь внешний покров кожи человека и защищает организм от вредных воздействий окружающей среды; именно здесь образуются новые клетки.
Эпидермис состоит из пяти слоев:
1) самый глубокий — зародышевый, базальный, или ростковый, слой — stratum basale, stratum germinativum;
2) шиповидный слой — stratum spijsum;
3) зернистый, или кератогиалиновый, слой — stratum granuljsum;
4) элеидиновый, или блестящий, слой — stratum lucidum;
5) поверхностный, или роговой, слой — stratum corneum.
Базальный, или зародышевый, слой снизу граничит с дермой и состоит из одного ряда палисадообразно расположенных на базальной мембране цилиндрических клеток, имеющих овальные крупные ядра.
Протоплазма клеток содержит сульфгидрильные группы и рибонуклеиновую кислоту (РНК). Это слой клеток называется основным, или ростковым, так как именно в нем происходит постоянный рост всех лежащих выше слоев эпидермиса.
Клетки базального слоя постоянно делятся, в результате чего на поверхности кожи происходит постоянное обновление ороговевающих и отмирающих клеток новыми молодыми клетками. Молодые клетки отодвигают к поверхности кожи старые клетки. В старых клетках происходят биохимические изменения, приводящие к их ороговению. Меняется их форма, они становятся ромбовидными, кубическими, плоскими. Ороговевшие, безъядерные пластины постепенно отслаиваются с поверхности кожи — физиологическое шелушение. Оно происходит у человека на протяжении всей жизни.
В эпидерме нет кровеносных сосудов. Питание клеток осуществляется за счет циркулирующей между неплотно прилегающими друг к другу клетками лимфы. От нижнего полюса клеток базального слоя отходят протоплазматические отростки, соединяющие эпидермис с сосочковым слоем собственно кожи.
Кроме того, что базальный слой отвечает за рождение новых клеток, он еще содержит меланоциты (melanocytus), способные вырабатывать пигмент меланин — вещество темно-коричневого цвета. Меланин не содержит железа. Зерна меланина расположены над верхним полюсом ядра и по его бокам. Количество зерен меланина разное у людей разных рас и у одного человека на различных участках кожи. Степень накопления меланина находится в прямой зависимости от степени пигментированности кожи. У блондинов количество пигмента незначительно, и он откладывается только в клетках базального слоя; у брюнетов содержание пигмента больше. У жителей тропических стран пигмент имеется не только в базальном, но и в шиповидном слое. Единственные люди на земле, не имеющие меланоцитов вообще, — альбиносы.
Единственные люди на земле, не имеющие меланоцитов вообще, — альбиносы.
Пигмент меланин защищает организм от вредного воздействия лучистой энергии. Меланоциты начинают действовать, когда кожа открыта попаданию прямых солнечных лучей, вырабатывая все больше и больше меланина и пытаясь таким образом защитить кожу. Именно меланин придает коже загорелый вид после пребывания на солнце. Он поглощает ультрафиолетовые лучи солнца, но не полностью, поэтому солнце хотя и в меньшей мере, но вредит клеткам кожи, что приводит к преждевременному старению и даже раку.
Шиповидный слой — это средний и самый толстый клеточный слой эпидермиса, который располагается над базальным слоем и состоит обычно из 3…6 (на отдельных участках — до 15) рядов клеток кубической формы, приобретающих в верхних рядах ромбовидную форму.
Эти клетки соединены отходящими от них протоплазматическими мостиками, состоящими из нитей фибрина.
Между клетками имеются межклеточные канальца, наполненные лимфой.
В этом слое обычно не наблюдается деления клеток, и отсутствуют зерна пигмента.
Зернистый, или кератогиалиновый, слой состоит из 1…3, а на ладонях и подошвах из 5…7 рядов уплощенных клеток, имеющих форму ромба, вытянутых параллельно поверхности кожи, с овальными ядрами. В протоплазме клеток много зерен особого белкового вещества — кератогиалина, который содержит мукополисахариды, РНК, ДНК (дезоксирибонуклеиновая кислота) и представляет собой первую стадию начинающегося здесь процесса ороговения клеток. В связи с этим кожа имеет телесный цвет и матовый оттенок. В слизистых оболочках этот слой, как и роговой, отсутствует, сосуды здесь располагаются более поверхностно, а слизистая оболочка имеет бледно-красный цвет. Три последующих слоя эпидермиса — базальный, шиповидный и зернистый — объединяют под названием мальпигиева слоя.
Элеидиновый (блестящий, прозрачный) слой расположен над зернистым, отделяя его от рогового слоя. Находится не на всех участках кожного покрова, а только там, где толщина эпидермиса значительна (ладони и подошвы), и полностью отсутствует на лице. Состоит из 1…3 рядов плоских клеток, большая часть которых не содержит ядер. В протоплазме клеток находятся элеидин (сильно преломляющее свет вещество, относящееся к альбуминам), гликоген и капли жира.
Находится не на всех участках кожного покрова, а только там, где толщина эпидермиса значительна (ладони и подошвы), и полностью отсутствует на лице. Состоит из 1…3 рядов плоских клеток, большая часть которых не содержит ядер. В протоплазме клеток находятся элеидин (сильно преломляющее свет вещество, относящееся к альбуминам), гликоген и капли жира.
Элеидин представляет собой дальнейшую стадию ороговения клеток эпидермиса.
Поверхностный, или роговой, слой состоит из 5…6 рядов сплющенных, совершенно утративших свою форму клеток. На ладонях и подошвах этих рядов бывает до 10…15. Этот слой наиболее развит там, где кожа подвергается значительному механическому воздействию. Клетки рогового слоя лишены ядер и состоят из кератина.
Между стенками клеток имеется большое количество других веществ — жиров, жирных кислот, холестерина, оставшихся от живых клеток, а также аминокислот, сахаров и других водорастворимых веществ, оставшихся после кератинизации, ороговения.
С поверхности рогового слоя клетки удаляются путем шелушения, таким образом, постоянно поддерживается приблизительно одинаковая толщина слоя. По мере того как новые клетки движутся к этому слою, с поверхности удаляется соответствующее количество клеток.
Примерный химический состав рогового и блестящего слоев:
1) роговое вещество — 50…70 %;
2) водорастворимые вещества (липиды) — 2…20 %;
3) вода — 15 %.
Содержание различных компонентов меняется следующим образом: чем глубже расположен слой, тем больше в нем воды и водорастворимых веществ; чем выше расположен слой, тем больше в нем содержится рогового вещества.
Быстрота полного обновления эпидермиса различна на разных участках тела: на локте на это затрачивается 10 дней, на подошве — 1 месяц.
Плотная часть рогового слоя вместе с блестящим слоем образует мощное препятствие для прохождения через кожу жидкостей и растворенных в ней веществ. Этого барьера нет только в тонкой коже вокруг глаз.
Этого барьера нет только в тонкой коже вокруг глаз.
В эпидермисе находится большое количество нервных окончаний. Граница между эпидермисом и дермой — это неровная волнистая линия, так как эпидерма внедряется в дерму в виде закругленных на конце тяжей, между которыми находятся выпячивания соединительнотканного слоя кожи — дермы, называемые сосочками.
Дерма — соединительнотканный отдел кожи. Состоит из коллагеновых, эластических и аргирофильных волокон, кровеносных и лимфатических сосудов, мышц, нервов и клеточных элементов. В дерме находятся два не очень четко разграниченных слоя:
1) cосочковый — pars papillaris;
2) cетчатый — pars reticularis.
Этот слой выполняет поддерживающую функцию и придает коже эластичность, форму и упругость.
Сосочковый слой состоит из конусообразных выступов — сосочков, размеры которых на различных участках кожи разные.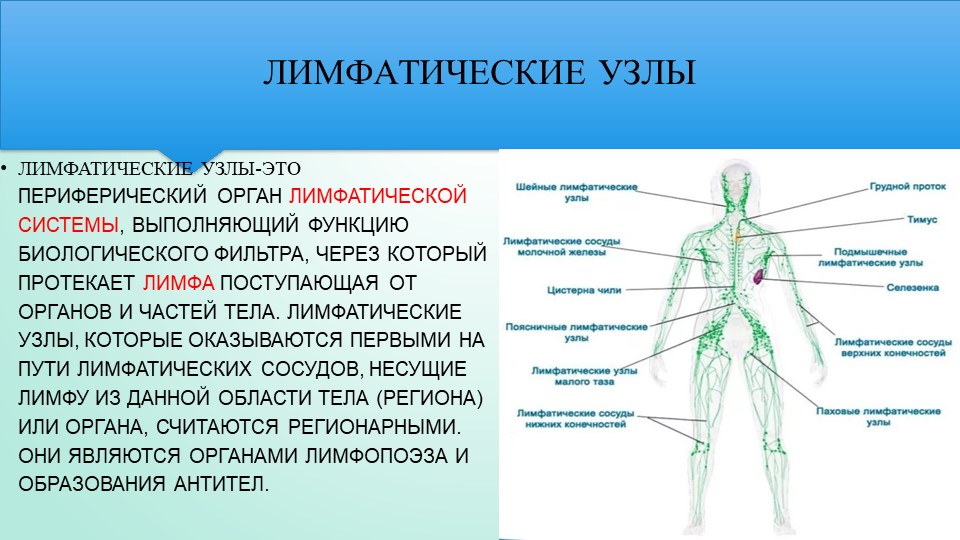 В области грудных сосков и на пальцах они бывают высотой 200 мкм, на лице — 30 мкм, на волосистой части головы — совсем маленькие. На 1 мм2 находится от 200 до 400 сосочков, расположенных рядами, со строго индивидуальным рисунком (используется в судебной практике при дактилоскопии).
В области грудных сосков и на пальцах они бывают высотой 200 мкм, на лице — 30 мкм, на волосистой части головы — совсем маленькие. На 1 мм2 находится от 200 до 400 сосочков, расположенных рядами, со строго индивидуальным рисунком (используется в судебной практике при дактилоскопии).
Коллагеновые волокна дермы расположены в виде переплетающихся между собой пучков, расположенных параллельно поверхности кожи. В сосочковом слое коллагеновые волокна проходят вертикально, проникают в сосочки и окружают волосяные фолликулы.
В сетчатом слое коллагеновые волокна расположены параллельно, переплетаются между собой и образуют характерный и своеобразный сетчатый рисунок, в петлях которого располагаются сосуды, нервы и железы.
По мере приближения к сосочковому слою волокна становятся все более тонкими.
Эластичные волокна переплетаются так же, как и коллагеновые, образуют сеть, имея с ними одинаковое направление. В сетчатом слое они более толстые, чем в сосочковом, дают ответвления к сосочкам и окружают сосуды.
В сетчатом слое они более толстые, чем в сосочковом, дают ответвления к сосочкам и окружают сосуды.
Строение дермы. Дерма делится на две значительно различающиеся части — сосочковую и ретикулярную. Поверхностная сосочковая дерма представляет собой относительно тонкую зону, располагающуюся под эпидермисом. При световой микроскопии видно, что она состоит из нежных волокон и большого количества сосудов. Волосяные фолликулы окружены перифолликулярной дермой, соприкасающейся с сосочковой дермой, сходной с ней морфологически. Сосочковую и перифолликулярную дерму называют адвентиционной дермой, однако последний термин употребляется редко. Основную массу дермы составляет ретикулярная часть. В ней меньше сосудов, чем в сосочковой дерме, но много толстых, четко очерченных коллагеновых волокон.
Компоненты дермы. Дерма состоит из коллагена (70…80 %), эластина (1…3 %) и протеогликанов. Коллаген придает дерме упругость, эластин — эластичность, протеогликаны удерживают воду. В основном в дерме имеются коллагены I и III типов, образующие коллагеновые пучки, которые располагаются преимущественно горизонтально. Эластические волокна вкраплены между коллагеновыми.
В основном в дерме имеются коллагены I и III типов, образующие коллагеновые пучки, которые располагаются преимущественно горизонтально. Эластические волокна вкраплены между коллагеновыми.
Окситалановые волокна (мелкие эластические волокна) обнаруживаются в сосочковой дерме и ориентированы перпендикулярно поверхности кожи.
Протеогликаны (преимущественно гиалуроновая кислота) формируют основное аморфное вещество вокруг эластических и коллагеновых волокон.
Самая «главная» клетка дермы — фибробласт, в котором и происходит синтез коллагена, эластина и протеогликанов.
Функции дермы:
1) терморегуляция посредством изменения величины кровотока в сосудах дермы и потоотделения эккринными потовыми железами;
2) механическая защита подлежащих структур, обусловленная наличием коллагена и гиалуроновой кислоты;
3) обеспечение кожной чувствительности, так как иннервация кожи в основном локализована в дерме.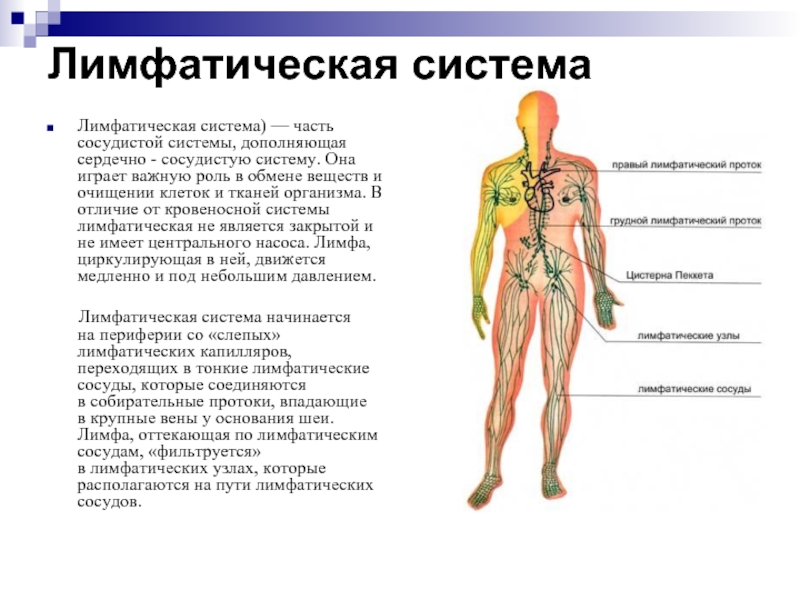
Структурный компонент дермы, поражаемый при врожденных и аутоиммунных дерматозах, — это коллаген. При буллезной системной красной волчанке и приобретенном буллезном эпидермолизе выявляются антитела против VII типа коллагена, входящего в состав якорных филаментов дермы, которые прикрепляют к ней базальную мембрану. Повреждение данного типа коллагена приводит к образованию пузыря под базальной мембраной; на месте пузыря формируется рубец. Если же полости располагаются над базальной мембраной, рубцов не остается.
При врожденном буллезном эпидермолизе выявляется отсутствие VII типа коллагена и якорных филаментов (или уменьшение их количества), что приводит к формированию выраженных рубцов. Наиболее тяжелая форма этого дерматоза — рецессивный дистрофический буллезный эпидермолиз, который характеризуется деформацией кистей и стоп, появлением грубых рубцов в верхних дыхательных путях и желудочно-кишечном тракте и ранней смертью.
При синдроме Элерса…Данлоса отмечаются патологические изменения I и III типов коллагена. Кожные проявления синдрома включают гиперрастяжимость кожи, легкость образования пузырей, слабую тенденцию к заживлению, что сопровождается образованием обширных рубцов.
Кожные проявления синдрома включают гиперрастяжимость кожи, легкость образования пузырей, слабую тенденцию к заживлению, что сопровождается образованием обширных рубцов.
Иннервация кожи. Кожа очень богата различными воспринимающими нервными окончаниями. Чувствительные нервные волокна, идущие от кожных рецепторов, входят в состав черепных и спинномозговых нервов. Крупные нервные стволы, поступающие в дерму из подкожной клетчатки, образуют сплетения: глубокое — на границе с подкожной клетчаткой и поверхностное — у основания сосочков. Расположение нервов кожи повторяет сосудистую сеть: крупные миелинизированные кожные ветви мышечно-кожных нервов подкожной клетчатки образуют глубокое нервное сплетение ретикулярной дермы, из которого нервные волокна, поднимаясь вверх, формируют поверхностное подсосочковое сплетение. Нервы этих сплетений иннервируют кожу, а свободные нервные окончания являются чувствительными рецепторами.
Они располагаются в сосочковой дерме в виде отдельных волокон, окруженных шванновскими клетками, и передают ощущения прикосновения, боли, температуры, зуда, механического воздействия. Кроме того, в коже присутствуют два типа механорецепторов — тельца Мейсснера и тельца Паччини, реагирующие на давление и вибрацию.
Кроме того, в коже присутствуют два типа механорецепторов — тельца Мейсснера и тельца Паччини, реагирующие на давление и вибрацию.
Количество данных рецепторов увеличено по сравнению с другими участками тела в области сосков, губ, головки полового члена, кончиков пальцев.
Потеря кожной чувствительности. Важность кожной иннервации наилучшим образом иллюстрируют заболевания, при которых разрушаются кожные нервы. Самое типичное заболевание — болезнь Гансена (лепра), при которой поражение и разрушение нервов приводит к обезображивающим деформациям конечностей, поскольку больные в течение многих лет получают «незамеченные» травмы.
Роль сосудов дермы в регуляции температуры тела. Температура тела частично определяется величиной кожного кровотока. Понижение температуры связано с увеличением кровотока в сосудистой сети верхней части сосочковой дермы, что приводит к выделению тепла. Сосудистая сеть дермы состоит из поверхностного и глубокого сплетения артериол и венул, связанных коммуникативными сосудами. Кровоток в поверхностной сети регулируется тонусом гладких мышц восходящих артериол. Он может быть уменьшен при повышении их тонуса и путем шунтирования из артериол в венозные каналы глубокой сети через гломусные тельца (артериолы, окруженные несколькими слоями мышечных клеток). При понижении температуры уменьшается кровоток в сосочковой дерме, кровь шунтируется от поверхностных сплетений и, соответственно, уменьшается теплоотдача. Дерма имеет две горизонтально расположенные сети кровеносных сосудов — поверхностную и глубокую, расположенную на границе дермы с гиподермой.
Кровоток в поверхностной сети регулируется тонусом гладких мышц восходящих артериол. Он может быть уменьшен при повышении их тонуса и путем шунтирования из артериол в венозные каналы глубокой сети через гломусные тельца (артериолы, окруженные несколькими слоями мышечных клеток). При понижении температуры уменьшается кровоток в сосочковой дерме, кровь шунтируется от поверхностных сплетений и, соответственно, уменьшается теплоотдача. Дерма имеет две горизонтально расположенные сети кровеносных сосудов — поверхностную и глубокую, расположенную на границе дермы с гиподермой.
Артерии входят в дерму из подкожной клетчатки перпендикулярно ее поверхности, разветвляются на более мелкие сосуды и образуют глубокую сосудистую сеть, снабжающую кровью волосяные мешочки и потовые железы. От глубокой сосудистой сети кровеносные сосуды идут перпендикулярно вверх в сосочковый слой дермы, где они вновь разветвляются на более мелкие сосуды, идущие параллельно поверхности кожи и образующие поверхностную сосудистую сеть. В каждом сосочке есть капилляр в виде шпилькообразной петли, поднимающейся к вершине сосочка.
В каждом сосочке есть капилляр в виде шпилькообразной петли, поднимающейся к вершине сосочка.
Поверхностная сосудистая сеть снабжает кровью сальные железы, выводные протоки потовых желез, верхнюю часть волосяных фолликулов.
Венозная сосудистая сеть состоит из четырех сплетений, идущих параллельно артериальной сети.
В дерме имеются две горизонтально расположенные сети лимфатических сосудов — поверхностная и глубокая. От поверхностной сети отходят в сосочки дермы слепые выросты (синусы).
От глубокой сети берут начало лимфатические сосуды, образующие, постепенно укрупняясь и переплетаясь друг с другом, сплетения на границе с подкожной клетчаткой. Кровеносная система кожи очень хорошо развита и может вмещать до 1/6 общего количества крови. Кровеносные сосуды кожи обладают способностью расширяться и суживаться рефлекторно под влиянием раздражения нервных окончаний или в результате психических реакций — радости, страха, гнева и т. д.
д.
Как уже отмечалось, дерма отвечает за эластичность, прочность и податливость кожи при растяжении. Эластин дает коже способность легко и быстро возвращаться к прежней форме, поэтому она не обвисает после растяжения. Коллаген отвечает за силу и упругость и вместе с эластином удерживает кожу от чрезмерного растяжения и обвисания. У новорожденных и детей в волокнистой соединительной ткани в аморфном веществе содержится много воды, связанной гликозаминогликанами, поэтому коллагеновые волокна способны набухать и накапливать влагу. С возрастом и под воздействием вредного влияния окружающей среды они становятся все более хрупкими. Содержание гликозаминогликанов в аморфном веществе уменьшается, а также уменьшается содержание воды. Коллагеновые волокна разрабатываются и образуют толстые грубые пучки. Эластиновые волокна тоже в значительной степени разрушаются, из-за чего кожа теряет упругость, становится неэластичной и дряблой. Взаимосвязь дермы и эпидермиса становится все более и более слабой, что в конечном итоге приводит к недостаточному поступлению в верхнюю кожу кислорода и питательных веществ. В пожилом возрасте эластичные волокна перерождаются, что приводит к дряблости и морщинистости кожи.
В пожилом возрасте эластичные волокна перерождаются, что приводит к дряблости и морщинистости кожи.
В коже имеется мышечная ткань. Она представлена поперечнополосатыми мышцами в коже лица, обусловливающими мимику, гладкими мышцами, располагающимися слоями в грудном соске, анальном сфинктере, в крайней плоти и пучками в мышцах, поднимающих волос. Мышцы, поднимающие волос, одним своим концом прикреплены к волосяному фолликулу под углом в 45°, а другим — к сосочковому слою. Эти мышцы могут рефлекторно сокращаться, например, под воздействием холода (волос выпрямляется и появляется шероховатая, так называемая гусиная кожа). Частое сокращение и нормальный тонус мышц в значительной мере способствуют опорожнению сальных желез. Если кожа вялая, то такое опорожнение затруднено, что, в свою очередь, ведет к скоплению отделяемого в устьях сальных желез.
Клеточные элементы дермы состоят из клеток соединительной ткани. К ним относятся фибробласты и тучные клетки Эрлиха неправильной формы с отростками и базофильной зернистостью протоплазмы, которые располагаются в небольшом количестве около кровеносных сосудов.
В собственно коже имеются и пигментные клетки, и лимфоциты.
Толщина дермы составляет от 0,5 до 4 мм.
Величина рН кожи колеблется в диапазоне от 5 до 6. Поверхность кожи имеет слабо кислотный характер. рН рогового слоя определяется действием находящихся в этой области водорастворимых веществ: аминокислот, карбамида, молочной кислоты, углеводородов и полипептидов. Каждое из этих веществ в отдельности и вместе с другими образует сильную буферную систему.
Тонкая пленка, покрывающая поверхность кожи, называется гидролипидной мантией, или кислотной мантией кожи. Она состоит из жира сальных желез, пота и составных частей вязких субстанций, которые связывают слущенные клетки. Она слегка кисловата по сравнению со щелочной средой, поэтому и называется кислотной. Ее физиологическая функция до конца не изучена. Одни исследователи выражают мнение, что она представляет собой лишь тонкий слой скопившихся на коже остаточных веществ, не выполняющий никакой физиологической функции, а являющийся лишь хорошей средой для развития бактерий и кожных грибков, но есть и другое мнение, что именно в этой среде и погибают и грибы, и бактерии.
Межклеточное вещество (матрикс) составляет основную часть дермы. Оно некристаллическое (аморфное). Важными компонентами матрикса являются различные мукополисахариды и мукопротеины в виде коллоидных растворов. Важнейшим мукополисахаридом кожи является гиалуроновая кислота. Она связывает воду и образует гель. Другая функция геля — защитная, предохраняющая организм от распространения в нем болезнетворных бактерий, проникающих через эпидермис.
Вода составляет около 70…80 % от общей массы кожи. Она довольно равномерно распространяется по клеткам и межклеточному веществу. Важную роль в регулировании осмотического давления в тканях играют электролиты Na+ и К+. В коже содержатся различные электролиты, важнейшими ионами которых являются ионы натрия, калия и хлора. Клетки принимают в себя калий, в то время как натрий скапливается в межклеточной жидкости. С помощью точного и устойчивого количества электролитов сохраняется равномерное осмотическое давление между клеткой и окружающей ее жидкостью и, таким образом, одинаковое количество воды в тканях. Это жидкостное напряжение (тургор) обеспечивает коже вместе с волокнами соединительной ткани упругость и эластичность.
Это жидкостное напряжение (тургор) обеспечивает коже вместе с волокнами соединительной ткани упругость и эластичность.
Гиподерма, или подкожная жировая клетчатка. Дерма переходит в подкожную жировую клетчатку, при этом четкой границы перехода нет. Подкожная жировая клетчатка развита неодинаково на различных участках тела. Наиболее развита гиподерма в области живота и ягодиц, особенно у женщин. Подкожно-жировая клетчатка состоит из пучков соединительной ткани, переплетающихся и образующих крупнопетлистую сеть. В ячейках сети находится жировая ткань в виде жировых долек, состоящих из скопления крупных жировых клеток. В центре клетки находится жир, окруженный протоплазмой в виде узкого ободка по краю клетки. В расширенной части ободка протоплазмы лежит овальное сплющенное ядро.
В гиподерме находятся кровеносные и лимфатические сосуды, нервные стволы и специфические нервные аппараты, потовые железы и корни волос.
Подкожно-жировой слой, являясь плохим проводником тепла, предохраняет кожу от охлаждения, кроме того, он придает телу округлые формы. Толщина его зависит от возраста, пола, питания и образа жизни. Он обладает не только теплоизоляционными свойствами, но и обеспечивает организм энергией.
Толщина его зависит от возраста, пола, питания и образа жизни. Он обладает не только теплоизоляционными свойствами, но и обеспечивает организм энергией.
Строение подкожной клетчатки. Подкожная клетчатка состоит из жировых долек, разделенных фиброзными перегородками. В состав последних входят коллаген, кровеносные и лимфатические сосуды, нервы. Подкожная клетчатка сохраняет тепло, поглощает энергию механических воздействий (удары), а также является энергетическим резервом организма.
Потовые железы (glandulae sudoriferae) — это простые трубчатые железы. Различают эккринные и апокринные железы, состоящие из тела и выводного протока. Тело потовой железы заложено в подкожной клетчатке и имеет вид клубочка, от которого отходит выводной проток, пронизывающий толщу кожи и открывающийся на ее поверхности. Потовые железы располагаются по всей поверхности кожи, за исключением красной каймы губ, головки полового члена, внутреннего листка крайней плоти, внутренней поверхности больших и малых половых губ и клитора. Много потовых желез на ладонях и подошвах. Общее количество потовых желез — от 2 до 5 млн.
Много потовых желез на ладонях и подошвах. Общее количество потовых желез — от 2 до 5 млн.
Эккринные потовые железы выделяют пот, не изменяя при этом своей структуры. Апокринные железы при выделении пота теряют часть протоплазмы железистой клетки. Эти железы в 2…3 раза больше эккринных, а их выводные протоки открываются в устья волосяных фолликулов. Они располагаются в подмышечных впадинах, в области половых органов, заднего прохода, промежности, вокруг сосков и в наружном слуховом проходе. Функционировать начинают в период полового созревания и тесно связаны с функцией половых желез. Апокринные железы выделяют пот со своеобразным запахом, свойственным каждому человеку.
Сальные железы (glandulae sebaceae) — альвеолярные железы. Они расположены в дерме по всему кожному покрову, особенно много их на лице, волосистой части головы, в межлопаточной области и грудине. Железы отсутствуют на ладонях и подошвах. Большая часть выводных протоков сальных желез открывается в волосяной фолликул, а выводные протоки желез, находящихся на внутреннем листке крайней плоти, малых половых губ, клиторе, крыльях носа, на границе крайней каймы губ, открываются непосредственно на поверхности кожи.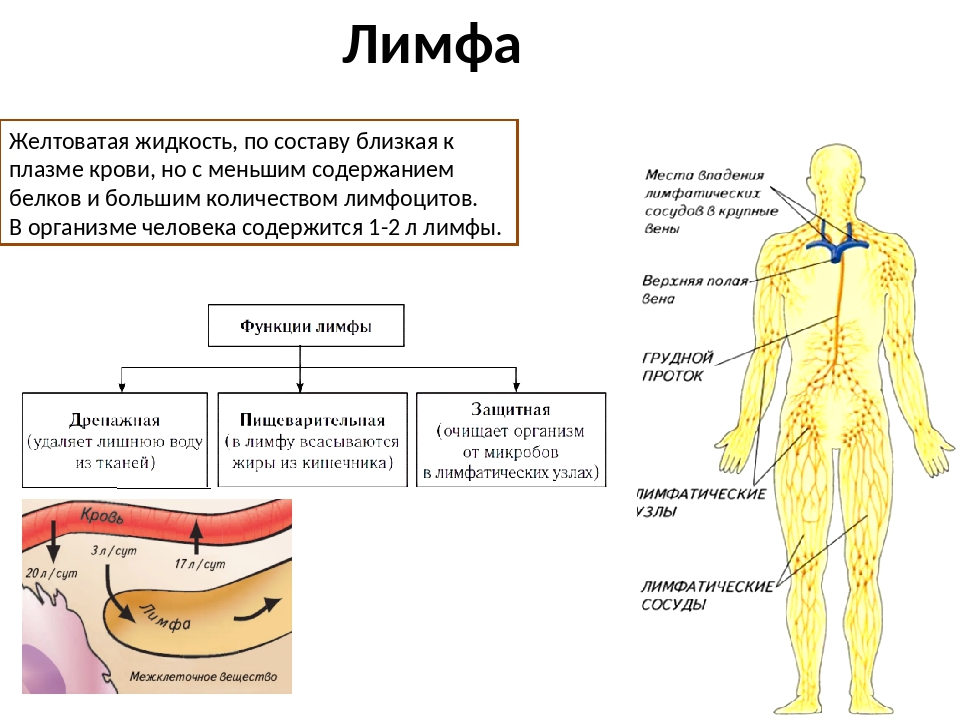 Каждый волос окружен 6…8 сальными железами. Сальные железы происходят из эктодермального зародышевого листка. Основной слой сальных желез состоит из клеток, схожих с базальными клетками эпидермиса. Они постоянно размножаются, поэтому состав клеток регулярно обновляется. В результате жирового перерождения самих клеток образуется секрет сальных желез, выделяющийся через выводной проток в воронку фолликула. Основная функция кожного сала — это смазка поверхности кожи и волос, оно придает им мягкость и предохраняет волосы от ломкости, а кожу от сухости.
Каждый волос окружен 6…8 сальными железами. Сальные железы происходят из эктодермального зародышевого листка. Основной слой сальных желез состоит из клеток, схожих с базальными клетками эпидермиса. Они постоянно размножаются, поэтому состав клеток регулярно обновляется. В результате жирового перерождения самих клеток образуется секрет сальных желез, выделяющийся через выводной проток в воронку фолликула. Основная функция кожного сала — это смазка поверхности кожи и волос, оно придает им мягкость и предохраняет волосы от ломкости, а кожу от сухости.
Функция сальных желез. Сальные железы, являясь частью пилосебационного комплекса, относятся к голокриновым железам. Они производят кожное сало, в состав которого входят эфиры воска и холестерина, сквален и триглицериды. Сало выделяется через выводной проток в волосяной фолликул и далее покрывает кожу, выполняя, по-видимому, защитную функцию. Кроме того, оно обладает антигрибковыми свойствами. Сальные железы имеются на всей поверхности тела, за исключением ладоней и подошв.
Эккринные железы развиваются из эпидермиса и не являются частью пилосебационного комплекса. Функция эккринных потовых желез — терморегуляция за счет выделения пота, в состав которого входят в основном вода и электролиты (испарение сопровождается охлаждением организма). Выводные протоки желез проходят через дерму, эпидермис и открываются непосредственно на поверхности кожи. Эккринные железы располагаются по всему кожному покрову, за исключением губ, ногтевого ложа и головки полового члена. Эккринные потовые железы встречаются только у приматов и лошадей. Апокринные железы развиваются из того же зачатка, что и волосяные фолликулы и сальные железы. Выводной проток открывается в волосяной фолликул над сальной железой. Их функция связана с выделением запаха. Железы локализуются в основном в подмышечных областях и промежности. Установлено, что их активность зависит от половых гормонов. Кстати, молочные железы и железы, продуцирующие ушную серу, — это модифицированные потовые железы. Многослойный плоский эпителий имеет разную толщину на разных участках кожи (0,1…0,2 мм). На ладонях и подошвах он значительно толще, чем на лице.
Многослойный плоский эпителий имеет разную толщину на разных участках кожи (0,1…0,2 мм). На ладонях и подошвах он значительно толще, чем на лице.
Волосы бывают длинные, щетинистые и пушковые. Длинные волосы растут на голове, лице (борода и усы), в подмышечных впадинах и на половых органах. Щетинистые волосы — это волосы, растущие на слизистой оболочке носа и в наружном слуховом проходе, волосы бровей и ресниц. Пушковые волосы растут почти по всей поверхности тела. Волос состоит из стержня и корня.
Стержень — это свободная часть волоса, выступающая над поверхностью кожи, корень — часть, погруженная в кожу. Нижняя часть корня расщепляется, образуя утолщение — луковицу. Она подковообразно обхватывает сосочек волоса, представляющий собой соединительнотканный выступ, напоминающий сосочек кожи. Здесь находятся кровеносные сосуды, обеспечивающие питание волос.
Корневая часть расположена в волосяном мешочке, который открывается на поверхности кожи углублением — воронкой. Стержень волоса состоит из кутикулы (оболочки), коркового вещества, содержащего пигмент, и мозгового вещества.
Стержень волоса состоит из кутикулы (оболочки), коркового вещества, содержащего пигмент, и мозгового вещества.
Волосяной фолликул состоит из эпителиальной и соединительнотканной частей. В седых волосах отсутствует пигмент, а в корковом веществе образуются пузырьки воздуха. Волосы отсутствуют на ладонях, подошвах, ногтевых фалангах пальцев рук и ног, красной кайме губ, сосках, головке полового члена, внутреннем листке крайней плоти, малых половых губах и внутренней поверхности больших половых губ. Продолжительность жизни волос составляет от 50 дней и нескольких месяцев до 2…3 лет. На месте выпавших волос появляются новые в результате размножения клеток фолликула.
На волосистой части головы имеется от 90 тыс. до 700 тыс. волос.
Ногти — это плотные роговые четырехугольные пластинки, задняя и боковые поверхности которых погружены в складки кожи. В ногтевой пластинке различают:
1) тело ногтя;
2) передний свободный край;
3) задний скрытый край;
4) два боковых края.
Ногтевая пластинка расположена на ногтевом ложе. Белое полулуние из-за зернистого слоя эпидермиса на проксимальном конце называется луночкой ногтя. Задняя часть пластинки — это корень ногтя, который является его растущей частью. Ноготь на руках растет со скоростью 1 мм в неделю, а на ногах — 0,25 мм. Если ноготь удалить полностью, то в течение 3-4 месяцев он отрастет полностью. Потовые и сальные железы, волосы и ногти называют придатками кожи.
Рекомендации врачей — Инфекционная больница Павловского
Пятница, 23 Январь 2015
ОРВИ: профилактика и лечение (рефлексотерапия)
Серьезный ущерб здоровью населения и экономике приносят острые респираторные вирусные инфекции (ОРВИ). Группу этих инфекций составляют разнородные по этиологии вирусные болезни, возбудителями которых являются вирусы гриппа, парамикровирусы, коронавирусы, риновирусы, аденовирусы, реовирусы и другие. Наиболее коварные и токсичные из них – вирусы гриппа.
Наиболее коварные и токсичные из них – вирусы гриппа.
По своему взаимодействию с организмом в зависимости от продолжительности пребывания вируса в организме различают две формы инфекции: острая инаппаратная и персистентная (латентная, хроническая, медленная). Они тесно связаны между собой, часто одна форма переходит в другую под влиянием тех или иных внешних и внутренних факторов.
Чаще всего в ответ на внедрение вируса в клетке они теряют способность своевременно и в достаточном количестве вырабатывать интерферон, создаются условия формирования дефектных интерферирующих вирусных частиц, играющих важную роль в механизме поддержания латентной гриппозной инфекции, интеграции генома вируса с геномом клетки, появления температурочувствительных мутантов и др. Вот почему вирусы так изменчивы, и весьма трудно найти надежные средства защиты от них.
Последние 10-15 лет характеризуются интенсивным развитием иммунологии инфекционных заболеваний. Установлено, что образование иммунных комплексов при взаимодействии вирусов с антителами является важнейшим механизмом, обеспечивающим выздоровление и формирование специфической невосприимчивости при реинфекции.
Еще в 1979 году нами была обоснована возможность диагностики, профилактики и лечения респираторной вирусной инфекции и последствий ее длительного пребывания в организме различными методами рефлексотерапии (иглоукалывание, электропунктура, точечный массаж и др.). Респираторные инфекции являются одним из неблагоприятных «факторов риска» для организма на любой стадии его развития, создавая условия для развития вегето-сосудистых нарушений, приобретенных иммунодефицитных состояний и др.
Это объясняется тем, что при персистенции вируса постоянно происходит биосинтез вирусных белков, который приводит к изменению мембранного потенциала эпителиальных клеток слизистых оболочек дыхательных путей и ЛОР-органов, являющихся элементом центральной эмбриогенетически зависимой составной подсистемы организма. В эту подсистему наряду с эпителием входят важнейшие регуляторы жизнедеятельности организма (головной мозг, тимус, верхний шейный симпатический ганглий, щитовидная железа, синокаротидные гломусы, костный мозг и др. ). Изменение мембранного потенциала одной или множества эпителиальных клеток в свою очередь ведет к асимметрии клеточного и суммарного электрогенеза, автоволновых процессов в связанных с ними эмбриогенетически элементах, то есть создаются условия для появления так называемого генератора патологического усиленного возбуждения.
). Изменение мембранного потенциала одной или множества эпителиальных клеток в свою очередь ведет к асимметрии клеточного и суммарного электрогенеза, автоволновых процессов в связанных с ними эмбриогенетически элементах, то есть создаются условия для появления так называемого генератора патологического усиленного возбуждения.
Возникшие биофизические, биохимические и структурные изменения в слизистых оболочках по соединительнотканным, нервным, сосудистым путям транслируются в кожные структуры, приводя к изменению их электрической и магнитной проницаемости, нарушению проводимости элементов нервной системы, ускоряя процессы изнашивания не только ее, но и такой важной биологически активной системы автоматического регулирования (БАСАР), морфологическим субстратом которой является соединительная ткань. Именно она осуществляет сбор, обработку первичной информации с помощью своих элементов (эпидермис. тучные клетки, растворимые белки, коллаген и др.) и преобразование ее в сигналы, воспринимаемые нервной, эндокринной иммунной и другими системами.
Существуют различные методы восстановления нарушенного равновесия: лекарственные и нелекарственные, гомеопатические, физиотерапевтические и другие. Г.Н.Крыжановский считает, что в ряде случаев акупунктурные точки тоже представляют собой афферентные поля с входом в детерминальные структуры патологических систем. Многовековые наблюдения позволили установить наиболее вероятную локализацию этих полей, однако далеко не всегда вероятная и истинная локализация афферентных полей совпадают, поэтому результаты лечения различных заболеваний, проведенного по традиционной методике, иногда не столь эффективны.
Таким образом, совместно с нервной, кровеносной и лимфатической системами образуется особая структура наружного покрова в зависимости от вида живого организма и условий окружающей среды. Группы клеток, объединенные одной функцией того или иного органа, имеют свое представительство на кожном покрове в виде своего рода контрольных пунктов – точек акупунктуры (ТА).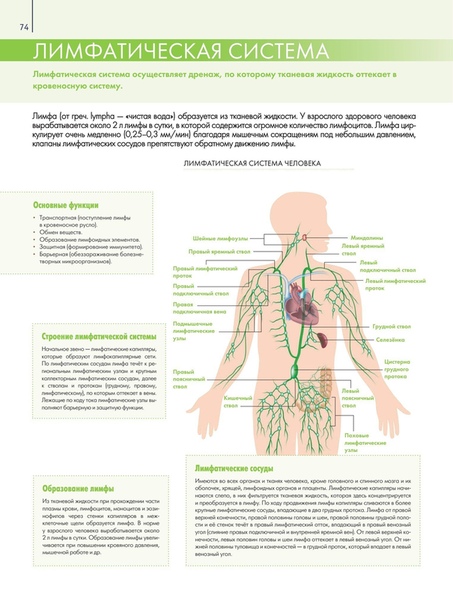
Если учесть связи каждой клетки базального слоя с поверхностными клетками рогового слоя и дермой, то таких точек имеется бесчисленное множество, и через каждую из них можно получить информацию о работе и состоянии своей группы на клеточном и субклеточном уровнях. Объединяясь, точки формируют на коже участки, которые условно можно назвать зонами акупунктуры (ЗА), отражающими состояние более крупных функциональных единиц или даже всего органа и связанных с ним систем.
Некоторые области организма являются наиболее уязвимыми в связи с тем, что постоянно подвергаются воздействию неблагоприятных факторов внешней среды. К таким областям относится лицо, шея, руки, слизистые оболочки верхних дыхательных путей.
При определении зон акупунктуры, необходимых для достижения лечебного эффекта, исходили из патогенеза гриппа и других ОРЗ, наличия рефлекторных связей слизистых оболочек того или иного пораженного отдела дыхательных путей с зонами кожи и нейроэндокринными образованиями. При воздействии на выявленные зоны с измененными параметрами тем или иным способом рефлекторно происходит нормализация кровообращения в слизистых оболочках дыхательных путей и сопряженных с ними образований, с повышением сопротивляемости за счет выделения биологически активных веществ – факторов неспецифической защиты (интерферон, иммуноглобулины, комплемент и др.).
При воздействии на выявленные зоны с измененными параметрами тем или иным способом рефлекторно происходит нормализация кровообращения в слизистых оболочках дыхательных путей и сопряженных с ними образований, с повышением сопротивляемости за счет выделения биологически активных веществ – факторов неспецифической защиты (интерферон, иммуноглобулины, комплемент и др.).
Были выделены зоны акупунктуры (1-9) для профилактического и лечебного воздействия у больных гриппом и другими ОРЗ и при их осложнениях.
— Зоны первой области – грудины – связаны с костным мозгом грудины, то есть с кроветворением. При воздействии на кожные покровы грудины происходят нормализация кровообращения и иннервация костного мозга, а также улучшение кровообращения пищевода, трахее, бронхов, легких и других органов.
Необходимо помнить, что при раздражении кожных зон происходит нормализация кровообращения и трофики нервных образований, расположенных в этой зоне, а затем рефлекторное улучшение кровообращения и иннервации связанных с ними органов и систем.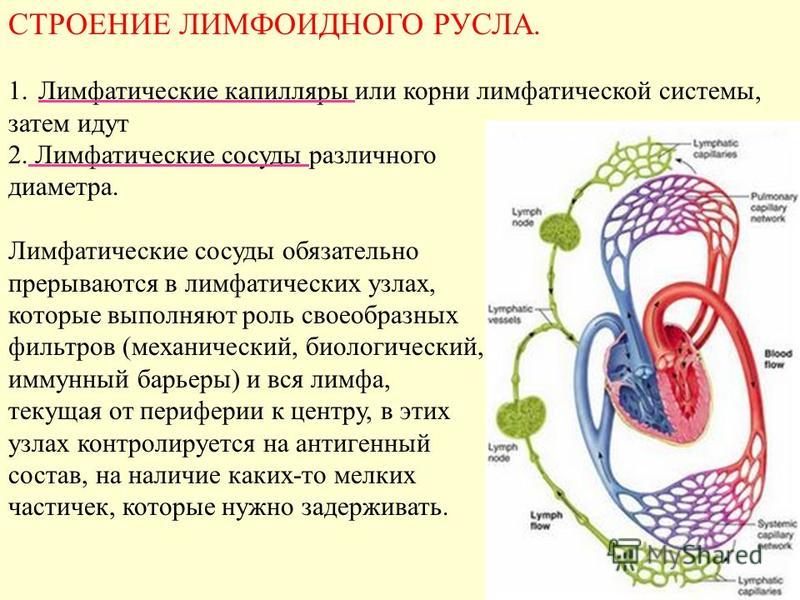
— Зоны второй области связаны с вилочковой железой, которая играет значительную роль в формировании иммунного ответа, участвует в регуляции роста и общего развития организма.
— Зоны третьей области связаны с синокаротидными гломусами, щитовидной и околощитовидными железами, которые контролируют химический состав крови и участвуют в эндокринной регуляции оргаенизации.
— Зоны четвертой и пятой области связаны с шейными вегетативными ганглиями, регулирующими все сосудистые реакции организма (головы, эндокринных желез, сердца, легких, желудка, кишечника и других органов).
— Зоны шестой, седьмой и восьмой области через систему смешанных черепно-мозговых нервов, и в первую очередь тройничного, связаны с гипофизом, гипоталамусом, структурами головного мозга, зрительным, обонятельным, слуховым и вестибулярным его аппаратами.
— Зоны девятой области имеют особую функциональную значимость, так как территория корковой иннервации кисти в коре головного мозга занимает значительную площадь.
Для уточнения зоны воздействия производят пальпацию, то есть механическое раздражение зон кожи путем надавливания на них пальцем или твердым телом, напоминающим форму пальца, до появления слегка болезненного ощущения. Надавливание на кожу надо производить всегда с одной и той же силой. В области 2 и 3 необходима особая осторожность, так как в зоне 3 располагаются сонные артерии и при резком надавливании может появиться головокружение, а при грубых манипуляциях в области зоны 2 – тахикардия.
Во время пальпации определяют зоны кожи с повышенной и пониженной болевой чувствительностью, то есть места с нарушением порога болевой чувствительности. Как правило, в этих же местах обнаруживаются участки, имеющие уплотнения или довольно значительные разрыхления подкожной клетчатки. Рецепт зон составляется ежедневно с учетом клинических проявлений болезни и выявленных в момент обследования зон акупунктуры. Воздействие на выявленные зоны производят последовательно в соответствии с порядком перечисления областей 1-9.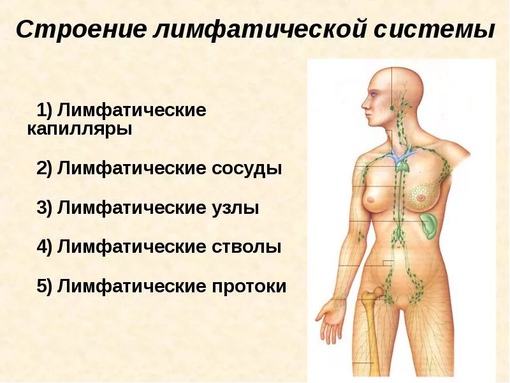 При пневмонии дополнительно осматривают зоны туловища, стоп.
При пневмонии дополнительно осматривают зоны туловища, стоп.
Воздействие оказывают кончиком указательного или среднего пальца или двумя-тремя пальцами сразу. Силу воздействия на зону регулируют болезненными ощущениями пациента. Надавливают до появления болезненности, а затем проводят вращательные движения по часовой стрелке и против нее с последующим продвижением к соседней зоне (3-5 секунд на каждую зону, не более).
В задних отделах шеи движение пальцев идет только сверху вниз, в симметричных зонах можно воздействовать одновременно двумя руками.
Утром и в другое время суток для быстрой активации организма более сильное давление сочетают с быстрыми интенсивными движениями в зоне акупунктуры. Перед сном воздействие надо осуществлять легкими, спокойными, неинтенсивными движениями, желательно в сочетании с дыхательной гимнастикой.
При отсутствии каких-либо клинических проявлений (если при обследовании не выявлено ни одной зоны с повышенной болевой чувствительностью) производят интенсивное воздействие (кроме областей 2 и 3) в течение 3-5 секунд на каждую зону не менее трех раз в день (не реже чем через 5-6 часов).
При выявлении зон с повышенной болевой чувствительностью или измененными тактильными свойствами воздействуют на болевые центры этих зон по 10-15 секунд каждые 30-40 минут в течение дня ежесуточно до полного восстановления болевой (или тактильной) чувствительности. После этого переходят на обычный профилактический режим.
В осеннее-зимне-весенние периоды, когда опасность заражения особенно велика, точечный массаж в области зон необходимо сочетать с другими профилактическими мерами: применять оксолиновую мазь, ремантадин, интерферон, витамины и др. Воздействие следует также осуществлять после каждого контакта с больным ОРЗ (после поездки в городском транспорте, на работе, пребывания в общественных местах) не реже чем через 2-3 часа.
Допускается втирание в наиболее болезненные зоны мазей успокаивающего или раздражающего действия, наклеивание кружков перцового пластыря, горчичников, йодные аппликации.
Сеансы рефлексотерапии или других видов терапии целесообразно сочетать с акупрессурой по изложенной методике для пролонгирования проведенной процедуры (иглотерапия, электропунктуры, лазеропунктуры и т. д. вне кабинета рефлексотерапии – в домашних или стационарных условиях). Это значительно сокращает сроки лечения.
д. вне кабинета рефлексотерапии – в домашних или стационарных условиях). Это значительно сокращает сроки лечения.
При строгом соблюдении правил воздействия метод не имеет возрастных ограничений и с целью повышения сопротивляемости организма может применяться в комплексе с другими мероприятиями больным с различными хроническими заболеваниями легких и сердца, ревматоидными артритами, хроническими неспецифическими полиартритами и др.
Противопоказан точечный массаж при гнойничковых заболеваниях кожи в области зон акупунктуры, а также наличие наличии здесь родинок, бородавок и новообразований.
В заключение надо сказать о том, что методические рекомендации «Профилактика и лечение острых вирусных респираторных заболеваний и их осложнений методами рефлексотерапии» утверждены и рекомендованы к внедрению. Обучение этому методу и использование его в детских дошкольных учреждениях, школах, а также взрослыми позволяет (применяя его как своего рода ежедневную гимнастику наряду с другими санитарно-гигиеническими и оздоровительными мероприятиями) предупредить развитие ранних форм сердечно-сосудистых, психосоматических и других заболеваний, являющихся следствием острых респираторных вирусных инфекций.
Эффективность метода в полной мере проявляется при его регулярном и систематическом использовании в течение всей жизни.
ПРОВЕРОЧНАЯ РАБОТА ПО БИОЛОГИИ НА ТЕМУ «КРОВООБРАЩЕНИЕ» (8 класс)
ПРОВЕРОЧНАЯ РАБОТА ПО ТЕМЕ «КРОВООБРАЩЕНИЕ»
1 ВАРИАНТ
1. Скорость кровотока максимальна:
а) в нижней полой вене
б) в аорте
в) в легочной артерии
г) в легочной вене
2. У людей, попавших в аварию, или пострадавших в результате травм, пульс прощупывают в области шеи. В каком кровеносном сосуде обнаруживается этот пульс?
а) в сонной артерии
б) в легочной артерии
в) в аорте
3. Гормоны каких желез внутренней секреции влияют на работу сердца при резких физических нагрузках или эмоциональном возбуждении?
а) поджелудочной
б) надпочечников
в) надпочечников и гипофиза
4. Сердце человека состоит из:
а) трех камер и расположено в грудной полости
б) четырех камер и расположено вне грудной полости
в) четырех камер и расположено в грудной полости
5. Малый круг кровообращения заканчивается:
Малый круг кровообращения заканчивается:
а) в левом предсердии
б) в левом желудочке
в) в правом желудочке
6. Наиболее важной функцией лимфатической системы является:
а) возвращение питательных веществ в кровь, иммунная защита организма
б) транспорт кислорода и углекислого газа
в) синтез органических соединений
7. Полые вены впадают:
а) в левое предсердие
б) в правое предсердие
в) в левый желудочек
г) в правый желудочек
8. Минимальным суммарным просветом обладают:
а) полые вены
б) аорта
в) капилляры
г) легочные артерии
9. Одним из признаков артериального кровотечения является:
а) непрерывность струи крови
б) алый цвет крови
в) темный цвет крови
10. С помощью какого специального прибора измеряют кровяное давление?
11. Какие клапаны регулируют продвижение крови из предсердий в желудочки?
12. Как называют самопроизвольные сокращения сердца?
Как называют самопроизвольные сокращения сердца?
ПРОВЕРОЧНАЯ РАБОТА ПО ТЕМЕ «КРОВООБРАЩЕНИЕ»
2 ВАРИАНТ
1. Скорость движения крови:
а) в аорте меньше, чем в капиллярах
б) в венах больше, чем в капиллярах
в) в капиллярах больше, чем в артериях
2. Пульс – это:
а) скорость течения крови
б) колебания стенок сосудов
в) величина давления крови на стенки сосудов
3. Какая частота сердечных сокращений в 1 минуту характерна для новорожденного ребенка?
а) 60-80
б) 40-50
в) 130-140
4. Расслабление сердца длится:
а) половину времени от всего цикла
б) меньше половины этого времени
в) больше половины
5. Какие сосуды впадают в правое предсердие?
а) легочные вены
б) верхняя и нижняя полая вены
в) венечные (коронарные) сосуды
г) легочные артерии
6. Кровь в аорту поступает:
а) из правого желудочка сердца
б) из левого предсердия
в) из левого желудочка сердца
г) из правого предсердия
7. Непрерывность тока крови создается:
Непрерывность тока крови создается:
а) эластичностью сосудов
б) сердечным ритмом
в) минимальным трением крови о стенки сосудов
8. Такое заболевание, как варикозное расширение вен ног наиболее характерно для:
а) людей, стоящих у станка
б) пловцов
в) бегунов
9. В каком месте измеряют кровяное давление тонометром?
а) в бедренной артерии
б) в сонной артерии
в) в плечевой артерии?
10. Как называется самая крупная артерия?
11. Какие клапаны препятствуют возврату крови из артерий в желудочки?
12. Как называется разница между максимальным и минимальным давлениями?
ОТВЕТЫ К ПРОВЕРОЧНОЙ РАБОТЕ ПО ТЕМЕ «КРОВООБРАЩЕНИЕ»
ба
б
в
а
а
б
б
б
тонометра
створчатые
автоматией сердца
б
б
в
а
б
в
а
а
в
аорта
полулунные
пульсовым давлением
Лимфатическая система: части и общие проблемы
Обзор
Лимфатическая система — это сеть тканей, сосудов и органов, которые работают вместе, чтобы переместить лимфу обратно в ваш кровоток. Лимфатическая система — это часть вашей иммунной системы.
Лимфатическая система — это часть вашей иммунной системы.Что такое лимфатическая система?
Лимфатическая система — это сеть тканей, сосудов и органов, которые работают вместе, чтобы переместить бесцветную водянистую жидкость, называемую лимфой, обратно в вашу систему кровообращения (ваш кровоток).
Ежедневно через артерии и более мелкие артериолы кровеносных сосудов и капилляров проходит около 20 литров плазмы.После доставки питательных веществ к клеткам и тканям организма и получения продуктов их жизнедеятельности около 17 литров возвращаются в кровоток по венам. Оставшиеся три литра просачиваются через капилляры в ткани вашего тела. Лимфатическая система собирает эту лишнюю жидкость, теперь называемую лимфой, из тканей вашего тела и перемещает ее, пока она в конечном итоге не вернется в кровоток.
Ваша лимфатическая система выполняет множество функций. Его основные функции:
- Поддерживает уровень жидкости в вашем теле: Как только что описано, лимфатическая система собирает лишнюю жидкость, которая вытекает из клеток и тканей по всему телу, и возвращает ее в кровоток, который затем рециркулирует по вашему телу.

- Поглощает жиры из пищеварительного тракта: Лимфа включает жидкости из кишечника, содержащие жиры и белки, и транспортирует их обратно в кровоток.
- Защищает ваше тело от инородных захватчиков: Лимфатическая система является частью иммунной системы. Он производит и высвобождает лимфоциты (лейкоциты) и другие иммунные клетки, которые контролируют, а затем уничтожают чужеродных захватчиков, таких как бактерии, вирусы, паразиты и грибки, которые могут проникнуть в ваш организм.
- Транспортирует и удаляет продукты жизнедеятельности и аномальные клетки из лимфы.
###
Анатомия
Какие части лимфатической системы?
Лимфатическая система состоит из многих частей. К ним относятся:
- Лимфа: Лимфа, также называемая лимфатической жидкостью, представляет собой скопление лишней жидкости, которая вытекает из клеток и тканей (которая не реабсорбируется в капилляры), а также других веществ.
 К другим веществам относятся белки, минералы, жиры, питательные вещества, поврежденные клетки, раковые клетки и чужеродные захватчики (бактерии, вирусы и т. Д.). Лимфа также переносит белые кровяные тельца (лимфоциты), борющиеся с инфекциями.
К другим веществам относятся белки, минералы, жиры, питательные вещества, поврежденные клетки, раковые клетки и чужеродные захватчики (бактерии, вирусы и т. Д.). Лимфа также переносит белые кровяные тельца (лимфоциты), борющиеся с инфекциями. - Лимфатические узлы: Лимфатические узлы — это железы в форме бобов, которые контролируют и очищают лимфу, когда она фильтруется через них. Узлы отфильтровывают поврежденные клетки и раковые клетки. Эти лимфатические узлы также производят и хранят лимфоциты и другие клетки иммунной системы, которые атакуют и уничтожают бактерии и другие вредные вещества в жидкости.По всему телу разбросано около 600 лимфатических узлов. Некоторые существуют как единый узел; другие — тесно связанные группы, называемые цепями. Некоторые из наиболее известных лимфатических узлов находятся в подмышечной впадине, паху и шее. Лимфатические узлы связаны с другими лимфатическими сосудами. ·
- Лимфатические сосуды: Лимфатические сосуды — это сеть капилляров (микрососудов) и большая сеть трубок, расположенных по всему телу, которые транспортируют лимфу от тканей.
 Лимфатические сосуды собирают и фильтруют лимфу (в узлах) по мере того, как она продолжает двигаться к более крупным сосудам, называемым собирающими протоками. Эти сосуды работают так же, как и ваши вены: они работают при очень низком давлении, в них есть ряд клапанов, чтобы жидкость двигалась в одном направлении.
Лимфатические сосуды собирают и фильтруют лимфу (в узлах) по мере того, как она продолжает двигаться к более крупным сосудам, называемым собирающими протоками. Эти сосуды работают так же, как и ваши вены: они работают при очень низком давлении, в них есть ряд клапанов, чтобы жидкость двигалась в одном направлении. - Собирающие протоки: Лимфатические сосуды опорожняют лимфу в правый лимфатический проток и левый лимфатический проток (также называемый грудным протоком). Эти протоки соединяются с подключичной веной, которая возвращает лимфу в кровоток.Подключичная вена проходит под ключицей. Возвращение лимфы в кровоток помогает поддерживать нормальный объем крови и давление. Это также предотвращает чрезмерное скопление жидкости вокруг тканей (так называемый отек).
Лимфатическая система собирает лишнюю жидкость, которая вытекает из клеток и тканей по всему телу, и возвращает ее в кровоток, который затем рециркулирует по всему телу.
- Селезенка: Этот самый большой лимфатический орган расположен слева под ребрами и над животом.
 Селезенка фильтрует и накапливает кровь и производит лейкоциты, которые борются с инфекцией или болезнью.
Селезенка фильтрует и накапливает кровь и производит лейкоциты, которые борются с инфекцией или болезнью. - Тимус: Этот орган расположен в верхней части грудной клетки под грудиной. Созревает определенный тип белых кровяных телец, которые борются с чужеродными организмами.
- Миндалины и аденоид: Эти лимфоидные органы задерживают патогены из пищи, которую вы едите, и воздуха, которым вы дышите. Они — первая линия защиты вашего тела от иностранных захватчиков.
- Костный мозг: Это мягкая губчатая ткань в центре некоторых костей, например, бедра и грудины.Лейкоциты, эритроциты и тромбоциты производятся в костном мозге.
- Пятна Пейера: Это небольшие образования лимфатической ткани в слизистой оболочке, выстилающей тонкую кишку. Эти лимфоидные клетки контролируют и уничтожают бактерии в кишечнике.
- Приложение: Ваш аппендикс содержит лимфоидную ткань, которая может уничтожить бактерии, прежде чем они пробьют стенку кишечника во время всасывания.
 Ученые также полагают, что аппендикс играет роль в размещении «хороших бактерий» и повторном заселении кишечника полезными бактериями после того, как инфекция исчезла.
Ученые также полагают, что аппендикс играет роль в размещении «хороших бактерий» и повторном заселении кишечника полезными бактериями после того, как инфекция исчезла.
Состояния и расстройства
Какие условия влияют на лимфатическую систему?
Многие состояния могут поражать сосуды, железы и органы, составляющие лимфатическую систему. Некоторые случаются во время развития до рождения или в детстве. Другие развиваются в результате болезни или травмы. Некоторые общие и менее распространенные заболевания и нарушения лимфатической системы включают:
- Увеличенные (опухшие) лимфатические узлы ( лимфаденопатия ): Увеличение лимфатических узлов вызвано инфекцией, воспалением или раком.Общие инфекции, которые могут вызвать увеличение лимфатических узлов, включают стрептококковое горло, мононуклеоз, ВИЧ-инфекцию и инфицированные кожные раны. Лимфаденит относится к лимфаденопатии, вызванной инфекцией или воспалительным заболеванием.

- Набухание или скопление жидкости ( лимфедема ): Лимфедема может быть результатом закупорки лимфатической системы, вызванной рубцовой тканью от поврежденных лимфатических сосудов или узлов. Лимфедема также часто наблюдается при удалении лимфатических узлов у тех, кто перенес операцию или лучевую терапию для удаления рака.Накопление лимфатической жидкости чаще всего наблюдается в руках и ногах. Лимфедема может быть очень легкой или довольно болезненной, обезображивая и выводя из строя. Люди с лимфедемой подвержены риску серьезных и потенциально опасных для жизни инфекций глубоких кожных покровов.
- Рак лимфатической системы: Лимфома — это рак лимфатических узлов, возникающий при неконтролируемом росте и размножении лимфоцитов. Существует несколько различных типов лимфомы, включая лимфому Ходжкина и неходжкинскую лимфому.Раковые опухоли также могут блокировать лимфатические протоки или находиться рядом с лимфатическими узлами и мешать току лимфы через узел.

Другие расстройства включают:
- Лимфангит: это воспаление лимфатических сосудов.
- Лимфангиома: это заболевание, с которым вы родились. Это порок лимфатической системы. Лимфангиоматоз — это наличие множественных или широко распространенных пороков развития лимфатических сосудов.
- Кишечная лимфангиэктазия: это состояние, при котором потеря лимфатической ткани в тонком кишечнике приводит к потере белка, гаммаглобулинов, альбумина и лимфоцитов.
- Лимфоцитоз: это состояние, при котором количество лимфоцитов в организме превышает норму.
- Лимфатический филяриатоз: это инфекция, вызванная паразитом, из-за которого лимфатическая система не функционирует должным образом.
- Болезнь Кастлемана. Болезнь Кастлемана связана с чрезмерным разрастанием клеток лимфатической системы организма.
- Лимфангиолейомиоматоз: это редкое заболевание легких, при котором аномальные мышечные клетки начинают бесконтрольно расти в легких, лимфатических узлах и почках.

- Аутоиммунный лимфопролиферативный синдром: это редкое генетическое заболевание, при котором имеется большое количество лимфоцитов в лимфатических узлах, печени и селезенке.
- Брыжеечный лимфаденит: это воспаление лимфатических узлов в брюшной полости.
- Тонзиллит: воспаление и инфекция миндалин.
уход
Как сохранить здоровье лимфатической системы?
Чтобы ваша лимфатическая система оставалась сильной и здоровой, вам необходимо:
- Избегайте воздействия токсичных химикатов, таких как пестициды или чистящие средства.Эти химические вещества могут накапливаться в вашем организме, и организму становится труднее фильтровать отходы.
- Пейте много воды, чтобы избежать обезвоживания, чтобы лимфа могла легко перемещаться по телу.
- Поддерживайте здоровый образ жизни, включающий регулярные упражнения и здоровое питание.
Часто задаваемые вопросы
Когда мне следует позвонить своему врачу по поводу проблемы с моей лимфатической системой?
Позвоните своему врачу, если вы чувствуете усталость (сильную усталость) или у вас необъяснимый отек, который длится более нескольких недель или мешает вашей повседневной деятельности.
Как мой врач проверит мою лимфатическую систему?
Чтобы убедиться, что ваша лимфатическая система работает должным образом, ваш врач может использовать визуализационные тесты, такие как компьютерная томография или МРТ. Эти тесты позволяют вашему врачу увидеть блокировки в вашей лимфатической системе.
Селезенка и лимфатическая система (для подростков)
Что такое селезенка и лимфатическая система?
Селезенка расположена в верхней левой части живота под грудной клеткой. Он помогает защитить организм, удаляя изношенные эритроциты и другие инородные тела (например, микробы) из кровотока.
Селезенка является частью лимфатической системы , которая представляет собой обширную дренажную сеть. Лимфатическая (lim-FAT-ik) система работает, чтобы поддерживать баланс жидкости в организме и защищать организм от инфекций. Он состоит из сети лимфатических сосудов, по которым проходит
Лимфа — прозрачная водянистая жидкость, которая содержит белки, соли и другие вещества, распространяющиеся по всему телу.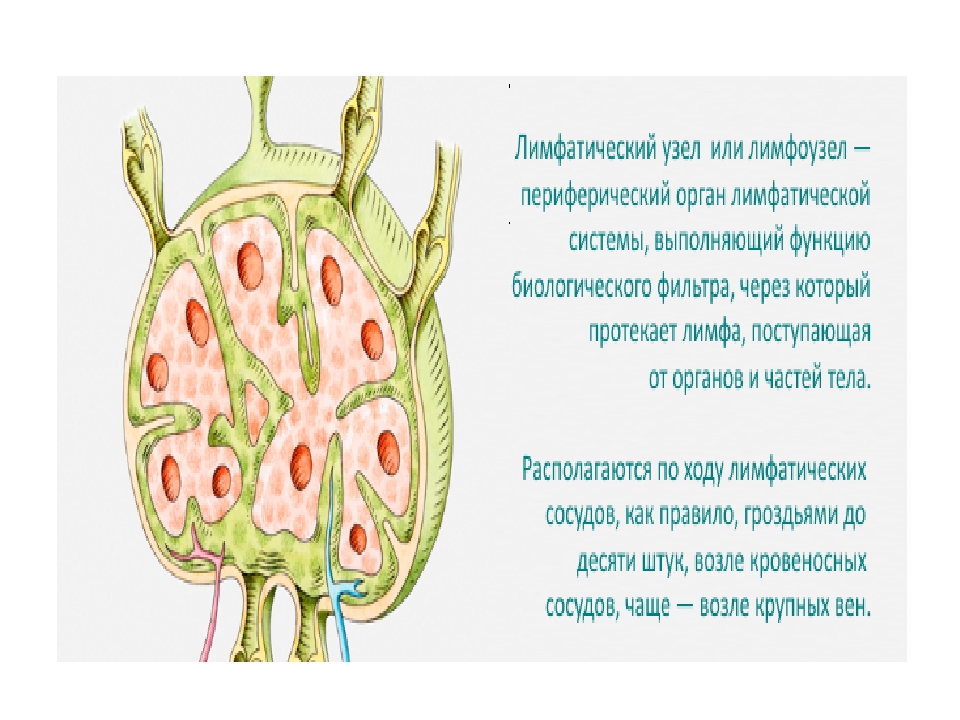
Что делает селезенка?
Селезенка действует как фильтр. Он отсеивает старые и поврежденные клетки и помогает контролировать количество крови и кровяных телец, циркулирующих в организме.
Селезенка также помогает избавиться от микробов. Он содержит лейкоциты под названием
. лимфоциты и макрофаги. Эти клетки работают, чтобы атаковать и уничтожить микробы, а также удалить их из крови, которая проходит через селезенку.Организм также использует селезенку как место для хранения крови и железа для будущего использования.
Что делает лимфатическая система?
Одна из основных задач лимфатической системы — собирать лишнюю лимфатическую жидкость из тканей тела и возвращать ее в кровь.Это важно, потому что вода, белки и другие вещества всегда просачиваются из крошечных кровеносных капилляров в окружающие ткани тела. Если лимфатическая система не отводит лишнюю жидкость, лимфатическая жидкость накапливается в тканях тела, заставляя их набухать.
Лимфатическая система представляет собой сеть очень маленьких трубок (или сосудов), по которым отводится лимфатическая жидкость со всего тела. Основные части лимфатической ткани расположены в:
- костный мозг
- селезенка
- вилочковая железа
- лимфатические узлы
- миндалины
Сердце, легкие, кишечник, печень и кожа также содержат лимфатическую ткань.
Основные лимфатические сосуды:
- грудной проток: Он начинается около нижней части позвоночника и собирает лимфу из таза, живота и нижней части грудной клетки. Грудной проток проходит через грудную клетку и впадает в кровь через большую вену около левой стороны шеи.
- правый лимфатический проток: Он собирает лимфу с правой стороны шеи, груди и руки и впадает в большую вену около правой стороны шеи.
Лимфатическая система также помогает защитить организм от микробов (вирусов, бактерий и грибков), которые могут вызывать болезни. Эти микробы отфильтровываются в лимфатических узлах, небольших скоплениях ткани вдоль сети лимфатических сосудов. Внутри лимфатических узлов лимфоциты, называемые Т-клетками и В-клетками, помогают организму бороться с инфекцией. В-клетки вырабатывают антител — специальные белки, которые останавливают распространение инфекций, задерживая болезнетворные микробы и уничтожая их.
Эти микробы отфильтровываются в лимфатических узлах, небольших скоплениях ткани вдоль сети лимфатических сосудов. Внутри лимфатических узлов лимфоциты, называемые Т-клетками и В-клетками, помогают организму бороться с инфекцией. В-клетки вырабатывают антител — специальные белки, которые останавливают распространение инфекций, задерживая болезнетворные микробы и уничтожая их.
Большинство наших лимфатических узлов сосредоточены в области шеи, подмышек и паха.Они также обнаруживаются вдоль лимфатических путей в груди, брюшной полости и тазу, где они фильтруют кровь.
При инфекции в лимфатических узлах накапливаются микробы. Например, если горло инфицировано, лимфатические узлы на шее могут опухать. Вот почему врачи проверяют увеличение лимфатических узлов (иногда называемых опухшими «железами») на шее, когда у кого-то болит горло. Это называется лимфаденопатией.
Лимфатическая система (для родителей)
Что такое лимфатическая система?
Лимфатическая система является частью иммунной системы. Он поддерживает баланс жидкости в организме и защищает организм от инфекций. Лимфатические (lim-FAT-ik) сосуды, ткани, органы и железы работают вместе, отводя водянистую жидкость, называемую лимфой , по всему телу.
Он поддерживает баланс жидкости в организме и защищает организм от инфекций. Лимфатические (lim-FAT-ik) сосуды, ткани, органы и железы работают вместе, отводя водянистую жидкость, называемую лимфой , по всему телу.
Что делает лимфатическая система?
Одна из основных задач лимфатической системы — дренировать лишние
лимфатическая (LIMF) жидкость из тканей тела и возврат ее в кровь. Лимфа содержит лейкоциты, называемые лимфоцитами, (LIM-fuh-сайты) и хилом, (KYE-ul), которые состоят из жиров и белков кишечника.Это важно, потому что вода, белки и другие вещества всегда просачиваются из крошечных кровеносных капилляров в окружающие их ткани. Если лимфатическая система не дренирует его, эта лишняя жидкость накапливается в тканях и заставляет их набухать.
Что находится в лимфатической системе?
К органам и тканям, входящим в лимфатическую систему, относятся:
- Костный мозг, густое губчатое желе внутри костей, которое образует многие виды клеток крови, в том числе клетки иммунной системы
- Вилочковая железа, вырабатывающая клетки иммунной системы, называемые Т-лимфоцитами, особенно до и во время полового созревания
- миндалины
- приложение
- лимфатические узлы
Лимфатические узлы представляют собой небольшие скопления ткани вдоль сети
лимфатические сосуды, которые очищают лимфу при движении через них. Они отфильтровывают вирусы, бактерии и грибки, вызывающие болезни.
Они отфильтровывают вирусы, бактерии и грибки, вызывающие болезни.Большинство лимфатических узлов сосредоточены в области шеи, подмышек и паха. Они также обнаруживаются вдоль лимфатических путей в груди, брюшной полости и тазу, где они фильтруют кровь. Внутри лимфатических узлов Т-клетки и другой тип лимфоцитов, В-клетки, помогают организму бороться с инфекцией. В-клетки вырабатывают антитела — особые белки, которые останавливают распространение инфекций, задерживая болезнетворные микробы и уничтожая их.
При заражении в лимфатических узлах накапливаются микробы.Если, например, их горло инфицировано, лимфатические узлы на шее могут опухать. Вот почему врачи проверяют увеличение лимфатических узлов (иногда называемых опухшими «железами») на шее, когда у кого-то болит горло. Когда лимфатические узлы набухают, это называется лимфаденопатией (lim-fad-n-OP-uh-thee).
Лимфатические сосуды или трубки — это пути, по которым проходит лимфа. Основные лимфатические сосуды:
- Грудной проток: Он начинается около нижней части позвоночника и собирает лимфу из таза, живота и нижней части грудной клетки.
 Грудной проток (thuh-RA-sik) проходит через грудную клетку и впадает в кровь через большую вену около левой стороны шеи.
Грудной проток (thuh-RA-sik) проходит через грудную клетку и впадает в кровь через большую вену около левой стороны шеи. - Правый лимфатический проток: Он собирает лимфу с правой стороны шеи, груди и руки и впадает в большую вену около правой стороны шеи.
| Вопрос | Ответ | |||
|---|---|---|---|---|
| Наиболее важными функциями лимфатической системы являются: | баланс жидкости внутренней среды и иммунитет. | |||
| Лимфатические капилляры, которые действуют в ворсинах тонкой кишки, называются: | млечные сосуды | |||
| Лимфа из всего тела оттекает в грудной проток, кроме лимфы из: | правый верхний квадрант | |||
| Лимфатические сосуды выдерживают большее давление | ||||
| Если лимфатический возврат заблокирован, что из следующего не произойдет? | Уровень СО2 в крови повысится | |||
| Лимфатическая циркуляция поддерживается за счет всего следующего, за исключением: | сердца | |||
| Лимфатическая циркуляция начинается с лимфатической: | капилляров | |||
лимфатической системы как специализированный компонент кровеносной системы.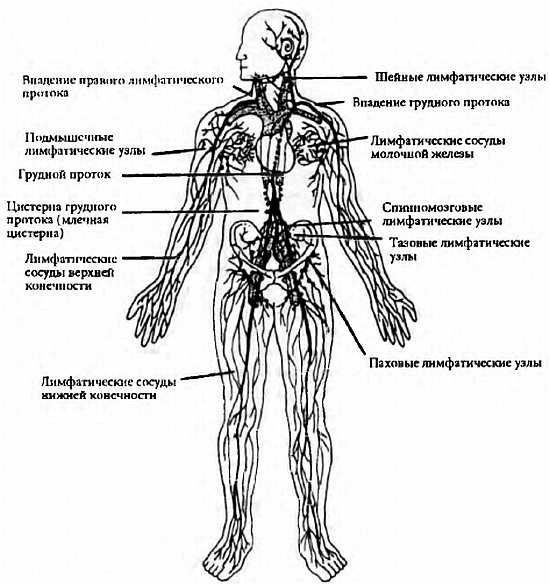 Т или Ж? Т или Ж? | True | |||
| Лимфатические сосуды, как и сосуды в кровеносной системе, образуют замкнутый контур кровообращения. Т или Ж? | Ложь. | |||
| Лимфа и интерстициальная жидкость очень похожи по составу на плазму крови. Т или Ж? | True | |||
| Лимфатические сосуды имеют односторонние клапаны, очень похожие на вены. Т или Ж? | True | |||
| Молочная лимфа, обнаруженная в млечных сосудах после пищеварения, называется хилусом.Т или Ж? | True | |||
| Хиловая цистерна представляет собой расширенную структуру грудного протока, которая служит местом хранения лимфы, движущейся к точке входа в венозную систему. Т или Ж? | Истинно | |||
| Действия, которые приводят к центральному движению или оттоку лимфы, называются лимфокинетическими действиями. Т или Ж? | True | |||
| Небольшое углубление лимфатического узла, из которого выходит эфферентный лимфатический сосуд, называется: | hilum | |||
| Лимфатические узлы, расположенные перед ухом, называются: | ничего из вышеперечисленного | |||
| Инфекция лимфатического узла называется: | аденит | |||
| Лимфатическая ткань лимфатических узлов служит местом окончательного созревания: | моноцитов и лимфоцитов | даже | Ложь. За исключением сравнительно небольшого числа отдельных узлов, большинство лимфатических узлов располагаются группами или кластерами в определенных областях. | |
| Кортикальные узелки состоят из упакованных лимфоцитов, которые окружают область, называемую зародышевым центром. Т или Ж? | True | |||
| Более 85% лимфы из груди попадает в лимфатические узлы: | подмышечной области. | |||
| Грудь — молочная железа и окружающие ткани — дренируются посредством: | a.Лимфатические сосуды, которые берут начало в коже груди и дренируют ее, за исключением ареолы и соска. б. Лимфатические сосуды, которые берут начало в самой груди, включая кожу ареолы и соска, и дренируют ее. | |||
| Аденоиды опухшие: | глоточные миндалины | |||
| секреты вилочковой железы: | тимозин | |||
| вилочковая железа расположена: | в средостении | в средостении | As | возрастает в средостении размер; этот процесс называется инволюцией.Ложь. С возрастом вилочковая железа уменьшается в размерах. Такой процесс сжатия органа называется инволюцией. |
| Селезенка функционирует исключительно для защиты от чужеродных микроорганизмов. Т или Ж? | Ложь. | |||
| Селезенка удаляет несовершенные тромбоциты из крови. Т или Ж? | True | |||
| ____________ — это термин, который относится к опухоли из клеток лимфоидной ткани. | Лимфома | |||
| Инфекция среднего уха известна как _________ __________ __________ | острый средний отит | |||
| Септицемия также известна как _________ _________ | заражение крови | |||
| ____________, поражающие лимфатические узлы. | филяриальный | |||
| Двумя основными категориями лимфом являются _____________ и _______________ лимфома. | Ходжкинские и неходжкинские | |||
| ______ небный, глоточный, трубный и язычный — примеры | миндалин | |||
| ______ гематопоэз | селезенка | кроветворение | красных кровяных телец | 9027 |
| ______ находится в средостении | вилочковая железа | |||
| _____ служит резервуаром для крови | селезенка | |||
| ______ Т-лимфоциты | тимус | ______ | ____ половая зрелостьполовая клетка | Хиловая цистерна — это расширенная структура грудного протока, которая служит местом хранения лимфы, попадающей в венозную систему.True |
| Здоровые капилляры «пропускают» белки. Т или Ж? | True | |||
| Лимфа грудного протока «закачивается» в венозную систему во время вдоха. Т или Ж? | True | |||
| Лимфатические узлы имеют несколько афферентных и эфферентных сосудов. Т или Ж? | Ложь. | |||
| Лимфедема набухает из-за скопления лимфы. Т или Ж? | True | |||
| Анастомоз — это удаление части.Т или Ж? | Ложь. Хирургическая процедура, соединяющая две структуры тела | |||
| Селезенка расположена под диафрагмой, над правой почкой и нисходящей ободочной кишкой. Т или Ж? | Ложь. Селезенка находится чуть выше большей части левой почки и нисходящей ободочной кишки и позади дна желудка | |||
| Спленомегалия — это удаление селезенки. Т или Ж? | Ложь. Аномальное увеличение селезенки | |||
| Лимфатическая система является компонентом ______ системы | кровеносной | |||
| Миндалины, тимус, селезенка и костный мозг — все структуры ______ системы | Лимфатическая | |||
| лимфатическая | правый квадрант впадает в правый _____ _____, а затем в правый _____ _____ | лимфатический проток / подключичная вена | ||
| Лимфа из остальной части тела впадает в _____ _____ | грудной проток | |||
| cisterna chyli | ||||
| Лимфатические сосуды имеют более тонкие стенки и больше клапанов, и содержат _____ _____ | лимфатических узлов | |||
| По мере увеличения диаметра лимфатических сосудов стенки становятся толще на ____ 284 | Переплетение _____ _____ находятся в оболочке медиа а Наружная оболочка стенок крупных лимфатических сосудов | эластичных волокон | ||
| _______ клапаны придают лимфатическим сосудам варикозный вид с бусинами | Односторонний | |||
Большинство лимфатических сосудов обладают способностью к восстановлению или регенерации при повреждении. Т или Ж? Т или Ж? | True | |||
| _____ абсорбируют жиры и другие питательные вещества из тонкой кишки | Lacteals | |||
| какой процент белков просачивается и возвращается через лимфатические сосуды? | 50% | |||
| Сокращения скелетных мышц (увеличение / уменьшение) кровоток | увеличение | |||
| Общий объем лимфы зависит от глубины ______ | вдоха | |||
| _____ миндалины расположены с каждой стороны горла | Небный | |||
| _____ находится в левом подреберье брюшно-тазовой полости, непосредственно под диафрагмой | селезенка | |||
| _____ находится чуть выше большей части левой почки и нисходящей ободочной кишки, а также позади дна желудка. | селезенка | |||
| _____ ____ состоит из плотных масс развивающихся лимфоцитов. | Белая пульпа | |||
____ ____ состоит из сети тонких ретикулярных волокон, погруженных в кровь, исходящую из близлежащих артериол. | Красная пульпа | |||
| Сеть ____ ____ поддерживает тяжи белых кровяных телец (WBC) и родственных клеток, окруженных синусоидами, наполненными кровью. | красная пульпа |
Лимфатическая система и иммунная система
Медицинская терминология рака
© Авторские права 1996-2013
9: Лимфатическая и иммунная системы
Содержание
Функции лимфатической системыКомпоненты лимфатической системы
Циркуляция тканевых жидкостей
Иммунная система
Фокус на рак
Корни, суффиксы и префиксы
Связанные аббревиатуры и акронимы
Дополнительные ресурсы
Функции лимфатической системы
функции лимфатической системы:- Отводит лишнюю жидкость и белки из тканей по всему телу и возвращает их обратно в кровоток.
- Удаляет продукты жизнедеятельности, производимые клетками.
- Борется с инфекциями.
- Поглощает жиры и жирорастворимые витамины из пищеварительной системы и переносит их в кровоток.

Компоненты лимфатической системы
| Источник изображения: Викимедиа Лицензия: CC-BY-3.0 |
|
Основными (инкапсулированными) лимфатическими органами являются лимфатические узлы, тимус и селезенка. Кроме того, лимфоидные ткани включают:
- Лимфоидная ткань, связанная со слизистой оболочкой (MALT)
- Это пучки лимфатических клеток, называемые лимфатическими узлами , расположенные внутри слизистых оболочек, выстилающих желудочно-кишечный тракт, дыхательные пути, репродуктивные и мочевыводящие пути.
 Эти узелки содержат лимфоциты и макрофаги, которые защищают от вторжения бактерий и других патогенов, попадающих в эти проходы вместе с пищей, воздухом или мочой. Эти узелки могут быть одиночными или сгруппированными в кластеры.
Эти узелки содержат лимфоциты и макрофаги, которые защищают от вторжения бактерий и других патогенов, попадающих в эти проходы вместе с пищей, воздухом или мочой. Эти узелки могут быть одиночными или сгруппированными в кластеры.Основные группы лимфатических узлов включают:
- Миндалины : это скопления лимфатической ткани под слизистой оболочкой носа, рта и горла. Лимфоциты и макрофаги в миндалинах обеспечивают защиту от посторонних веществ и патогенов, попадающих в организм через нос или рот.
- Аденоиды : скопление лимфатической ткани, которое свисает с верхней части задней части полости носа. Аденоиды становятся больше после рождения, но обычно перестают расти к 7 годам. Как и миндалины, их можно удалить без значительного увеличения риска инфекций.
- Пейеровы бляшки : это скопления лимфатических узелков в слизистой оболочке, выстилающей подвздошную кишку тонкой кишки. Они играют важную роль в защите от большого количества патогенов, попадающих в желудочно-кишечный тракт.

Циркуляция тканевых жидкостей
Жидкость в промежутках между тканями называется интерстициальной жидкостью или «тканевой жидкостью». Это обеспечивает клетки организма питательными веществами (через кровоснабжение) и средствами удаления отходов. Лимфа образуется, когда интерстициальная жидкость собирается через крошечные лимфатические капилляры (см. Диаграмму), которые расположены по всему телу. Затем он транспортируется по лимфатическим сосудам к лимфатическим узлам, которые очищают и фильтруют его.Затем лимфа течет в лимфатические протоки , а затем попадает в правую или левую подключичную вену , где снова смешивается с кровью.
Кровь обогащена кислородом (дыхательной системой) и питательными веществами (пищеварительной системой), которые циркулируют по всему телу (сердечно-сосудистая система). Некоторая жидкость (плазма крови) просачивается в ткани через крошечные капилляры, пополняя интерстициальную жидкость, которая в конечном итоге стекает обратно в лимфатическую систему.
Иммунная система
Иммунная система включает в себя ряд средств защиты от вирусов, бактерий, грибковых инфекций и паразитов (таких как нитчатые черви). Лимфатическая система является частью более широкой иммунной системы.
- Врожденная иммунная система
- Это неспецифические, неизменные линии защиты, которые включают:
- Физические и химические барьеры для патогенов.
- Производство цитокинов, и других химических факторов для привлечения иммунных клеток к участкам инфекции.
- Активирует каскад комплемента для идентификации бактерий, активации клеток и содействия удалению мертвых клеток или комплексов антител.
- Обнаруживает и удаляет инородные вещества, присутствующие в органах, тканях, крови и лимфе, с помощью специализированных лейкоцитов.
- Активация адаптивной иммунной системы посредством процесса, известного как презентация антигена .
- Адаптивная иммунная система
- Адаптивный (или приобретенный) иммунитет — это когда иммунологическая память создается после первоначального ответа на новый патоген, что приводит к усиленному ответу на будущее воздействие того же патогена.
 Этот процесс приобретенного иммунитета лежит в основе вакцинации. Это важно, потому что бактерии и вирусы постоянно адаптируются и развиваются в «гонке вооружений» с нашей иммунной системой. К особенностям адаптивной иммунной системы относятся:
Этот процесс приобретенного иммунитета лежит в основе вакцинации. Это важно, потому что бактерии и вирусы постоянно адаптируются и развиваются в «гонке вооружений» с нашей иммунной системой. К особенностям адаптивной иммунной системы относятся:- Распознавание специфических «чужих» антигенов в процессе презентации антигена .
- Генерация ответов, предназначенных для уничтожения конкретных патогенов или инфицированных патогенами клеток.
- Развитие иммунологической памяти, в которой каждый патоген «запоминается» сигнатурными антителами или рецепторами Т-клеток.Эти клетки памяти можно использовать для быстрого устранения патогена в случае последующего заражения.
- Клетки иммунной системы
В иммунную систему вовлечено множество различных типов и подтипов клеток. Некоторые из основных типов включают:
- Лимфоциты : белые клетки, которые циркулируют между кровью и лимфой. Они играют важную роль в борьбе с инфекцией.
 Есть много видов лимфоцитов; основными типами являются Т-клетки , В-клетки и естественные клетки-киллеры.Лимфоциты первоначально развиваются в костном мозге . Некоторые мигрируют в тимус, где созревают в Т-клетки; другие созревают в костном мозге как В-клетки.
Есть много видов лимфоцитов; основными типами являются Т-клетки , В-клетки и естественные клетки-киллеры.Лимфоциты первоначально развиваются в костном мозге . Некоторые мигрируют в тимус, где созревают в Т-клетки; другие созревают в костном мозге как В-клетки. - Нейтрофилы : являются наиболее распространенным типом лейкоцитов и являются важной частью врожденной иммунной системы. Нейтрофилы представляют собой тип фагоцитов (клетки, которые поглощают, а затем переваривают клеточный мусор и патогены). Обычно они обнаруживаются в кровотоке, но быстро попадают в место повреждения или инфекции после химических сигналов, таких как интерлейкин-8.
- Макрофаги : представляют собой другой тип фагоцитов и играют роль как в врожденной, так и в адаптивной иммунной системе. Они атакуют инородные вещества, инфекционные микробы и раковые клетки. Макрофаги также стимулируют лимфоциты и другие иммунные клетки реагировать на патогены.

- Дендритные клетки : антигенпрезентирующие клетки , которые действуют как посредники между врожденной и адаптивной иммунными системами. Обычно они располагаются в тканях, контактирующих с внешней средой, таких как кожа, слизистая оболочка носа, легкие, желудок и кишечник.В ответ на патогены они мигрируют в лимфатические узлы, где взаимодействуют с Т-клетками и В-клетками, чтобы инициировать адаптивный иммунный ответ.
- Лимфоциты : белые клетки, которые циркулируют между кровью и лимфой. Они играют важную роль в борьбе с инфекцией.
- Антигены и антитела
- Антитела (также известные как иммуноглобулины ) представляют собой Y-образные белки, продуцируемые В-клетками, которые связываются со специфическими антигенами на поверхности чужеродных объектов, таких как бактерии и вирусы. Это идентифицирует и «маркирует» чужеродный объект как «чужой», давая сигнал другим иммунным клеткам атаковать их.
- Гормоны и иммунная система
- Иммунная система вырабатывает несколько гормонов. Эти гормоны обычно известны как лимфокинов .
 Стероиды и кортикостероиды (компоненты адреналина) подавляют иммунную систему.
Стероиды и кортикостероиды (компоненты адреналина) подавляют иммунную систему.
Cancer Focus
- Метастатическое распространение рака через лимфатические узлы
- Лимфатические узлы, расположенные рядом с первичной опухолью, часто являются первым местом метастазирования (распространения рака).Метастазы в лимфатические узлы редко опасны для жизни, но их обнаружение является прогностическим фактором для многих типов рака, поскольку показывает, что опухоль развила способность распространяться. Опухолевые клетки могут путешествовать по лимфатической системе и распространяться в лимфатические узлы и отдаленные органы.
- Биопсия сторожевого лимфатического узла
- Рядом с первичной опухолью вводят краситель, чтобы определить положение сигнального лимфатического узла (первого лимфатического узла, к которому раковые клетки с наибольшей вероятностью распространятся, поскольку лимфатическая система отводит жидкость от опухоли).
 Сторожевой узел удаляется хирургическим путем, и патолог проверяет наличие раковых клеток. БСЛУ чаще всего используется для диагностики рака груди и меланомы. Это менее обширная операция по сравнению со стандартной операцией на лимфатических узлах.
Сторожевой узел удаляется хирургическим путем, и патолог проверяет наличие раковых клеток. БСЛУ чаще всего используется для диагностики рака груди и меланомы. Это менее обширная операция по сравнению со стандартной операцией на лимфатических узлах. - Иммуносупрессия
- Это снижение активности или эффективности иммунной системы и ее способности бороться с инфекциями и другими заболеваниями. Некоторые заболевания, такие как СПИД или лимфома, могут вызывать иммуносупрессию. Это также частый побочный эффект противоопухолевой химиотерапии, приводящий к повышенному риску инфицирования больных раком во время лечения.
- Лимфома
- Общий термин, обозначающий злокачественное заболевание лимфатической ткани, характеризующееся аномальным неконтролируемым ростом клеток. Существует несколько типов лимфомы, включая лимфому Ходжкина, при этом большинство других типов классифицируются как неходжкинские лимфомы.
- Лимфома Ходжкина
- Злокачественное новообразование лимфатической ткани, которое чаще всего встречается у мужчин, пик заболеваемости приходится на возраст от 15 до 35 лет.
 Оно характеризуется прогрессирующим безболезненным увеличением лимфатических узлов, селезенки и лимфатической ткани в целом.При лимфоме Ходжкина клетки Рида-Штернберга (особый тип лимфоцитов) становятся аномальными и неконтролируемым образом растут.
Оно характеризуется прогрессирующим безболезненным увеличением лимфатических узлов, селезенки и лимфатической ткани в целом.При лимфоме Ходжкина клетки Рида-Штернберга (особый тип лимфоцитов) становятся аномальными и неконтролируемым образом растут.
Интернет-ресурсов по лимфоме Ходжкина - Неходжкинская лимфома (НХЛ)
- НХЛ — это рак лимфатической ткани, который не включает аномальные клетки Рида-Штернберга (особый тип лимфоцитов). Есть много разных типов НХЛ. Некоторые растут очень медленно, другие быстро растут и нуждаются в агрессивном лечении.
Интернет-ресурсов для НХЛ - Лимфома, связанная со СПИДом
- Заболеваемость неходжкинской лимфомой росла параллельно с эпидемией СПИДа.Лимфомы, поражающие ВИЧ-инфицированных людей, в основном относятся к агрессивным типам B-клеток (диффузные крупноклеточные, B-иммунобластные или мелкие нерасщепленные лимфомы Беркитта / Беркитта), которые реже встречаются у пациентов с лимфомами, не инфицированными ВИЧ.
 Считается, что вирус ВИЧ не является прямой причиной лимфомы, скорее он ослабляет защитные силы организма и может повысить восприимчивость к другим инфекциям, таким как вирусы Эпштейна-Барра и HHV-8, которые связаны с этими типами лимфом.
Считается, что вирус ВИЧ не является прямой причиной лимфомы, скорее он ослабляет защитные силы организма и может повысить восприимчивость к другим инфекциям, таким как вирусы Эпштейна-Барра и HHV-8, которые связаны с этими типами лимфом.
Интернет-ресурсы по лимфоме, связанной со СПИДом - Макроглобулинемия Вальденстрема
- Это редкое злокачественное заболевание, связанное с избытком бета-лимфоцитов (тип клеток в иммунной системе), которые секретируют иммуноглобулины (тип антител).WM обычно встречается у людей старше шестидесяти, но был обнаружен у более молодых людей.
Интернет-ресурсов по макроглобулинемии Вальденстрема - Иммунотерапия рака
- Это лечение, стимулирующее иммунную систему пациента к атаке раковых клеток. Различные подходы включают: 1) вакцинацию против рака для обучения иммунной системе распознавать раковые клетки как мишени для уничтожения, 2) введение терапевтических антител для набора клеток иммунной системы для уничтожения опухолевых клеток и 3) иммунотерапию на основе клеток , который либо переливает иммунные клетки (такие как естественные клетки-киллеры), либо вводит цитокины (такие как интерлейкины), которые активируют иммунные клетки.

- Вакцинация против ВПЧ и рак шейки матки
- Вирус папилломы человека (ВПЧ) — частая причина инфекции. Существует более 100 различных подтипов ВПЧ. ВПЧ типов 16 и 18 вызывают 70% случаев рака шейки матки, а также связаны с раком заднего прохода, вульвы, влагалища, полового члена, а также рта и горла. Со временем они могут вызвать изменение клеток шейки матки, что приведет к предраковым состояниям — цервикальной интраэпителиальной неоплазии (CIN) с более высоким риском развития рака.Вакцинация против ВПЧ 16, 18 и других типов ВПЧ «высокого риска» снижает риск развития рака шейки матки и других видов рака, связанных с ВПЧ.
Интернет-ресурсы по вакцинации против ВПЧ и рака шейки матки - Лимфедема
- Лимфедма — это аномальное скопление межклеточной жидкости из-за проблем с лимфатической системой. Причин может быть много. В контексте рака это часто является результатом обструкции опухолью или увеличенными лимфатическими узлами. Это также может быть побочным эффектом лучевой терапии или хирургического вмешательства, в результате которого были повреждены лимфатические сосуды.

Корни, суффиксы и префиксы
Большинство медицинских терминов состоит из корневого слова плюс суффикс (окончание слова) и / или префикс (начало слова). Вот несколько примеров, связанных с лимфатической и иммунной системами. Для получения дополнительной информации см. Глава 4: Понимание компонентов медицинской терминологии
.| компонент | означает | пример | ||||||
| aden (o) — | железа | Лимфаденопатия — заболевание | лимфатических узлов | о) — | Иммунитет | Иммуносупрессия = снижение активации или эффективности иммунной системы | ||
| лимфа (о) — | Лимфа | Лимфома = опухоль лимфоидных клеток | лимфоидные клетки | лимфоидные клетки | лимфоидные клетки | — | лимфатический узел | Лимфаденэктомия = хирургическое удаление лимфатического узла (ов) |
| лимфанги (о) — | лимфатические сосуды | Лимфангит = воспаление | ||||||
| селезенка | Спленомегалия = увеличение селезенки | |||||||
| 90 737 тимус (о) — | тимус | Тимэктомия = хирургическое удаление тимуса | ||||||
| токс (о) — | яд | Иммунотоксичность = неблагоприятное воздействие на функцию иммунной системы в результате воздействия химических веществ. |
Связанные аббревиатуры и акронимы
| AIDS | Синдром приобретенного иммунодефицита | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EBV | вирус Эпштейна-Барра | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВИЧ | Вирус иммунодефицита человека | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВПЧ | Хумапилломавирус | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ВПГ | Вирус простого герпесаИммуноглобулин D | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IgE | Иммуноглобулин E | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IgG | Иммуноглобулин G | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| M 86 Лимфоидная ткань, связанная со слизистой оболочкой | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NHL | Неходжкинская лимфома | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NKT | Т-клетка-естественный киллер | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 SLN | Ресурсы (9 ссылок)
| Гены | Функция | Модели | Фенотип | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Prox1 Lympatre | ||||||||||
| VEGF-C 16 | Фактор роста | KO | Отсутствие лимфатической сосудистой сети (- / -) лимфатическая развитие сосудов, лимфатическая гипоплазия и лимфедема (+/-) | |||||||
| VEGFR-3 19 | Рецептор фактора роста | KO | Сердечно-сосудистая недостаточность, дефектное ремоделирование | сосудов 9137FEG 92 | Фактор роста рецептор | Chy мышей (инактивация m утонения) | Лимфедема, хилезный асцит, гипопластический кожные лимфатические сосуды | |||
| LYVE-1 22,23 | Гиалуронановый рецептор | КО | только лимфатические дефекты, лимфатические дефекты | только межкостные лимфоузлы форма просвета сосуда | ||||||
| Syk / SLP-76 24,25 | Тирозинкиназа / адаптерный белок | KO | Аномальные кровяно-лимфатические связи, хилезный асцит, дефект гематопоэтического9 | Spred-1 / Spred-2 26 | Отрицательные регуляторы активации ERK | Double KO | Лимфедема, расширенная и заполненная кровью лимфатические сосуды | |||
| KO | Постнатальное лимфо-венозное разделение дефект в тонкий кишечник | |||||||||
| Подопланин 37 | Мембрана гликопротеин | KO | Лимфедема, дилатация и неправильная структура лимфатических сосудов, снижение лимфатического транспорта 4 | 8 Транскрипция Лимфатическая гиперплазия, ретроградная лимфа кровоток (+/-), аномальное формирование паттерна и перициты вложение лимфатических сосудов, отсутствие клапанов, лимфатическая дисфункция (- / -) | ||||||
| Foxc1 / Foxc2 7 140 90 Transcription факторов | Соединение , мутант (Foxc1 +/-; Foxc2 — / -) | Дефектный лимфатический отросток из вен во время развития (сниженная экспрессия VEGF-C ) | ||||||||
| Эфрин B2 32 | Лиганд EphB рецепторов | Дефектное ремоделирование лимфатических сосудов сеть, гиперплазия, отсутствие клапанов, хилоторакс | ||||||||
| Нейропилин-2 31 | Фактор роста рецептор | уменьшение лимфатических сосудов | Транзитное уменьшение лимфатических сосудов | капилляры во время развития | ||||||
| Ангиопоэтин-2 29,30 | Фактор роста | KO | Хилезный асцит и подкожный отек, аномальный паттерн лимфатических сосудов, аномальный лимфатический покров, лимфатических сосудов Aspp1 141 | 913 64 p53-связывающий белок KO | Подкожный отек, дезорганизованная и нефункциональная лимфатическая сосудистая сеть у эмбриона, собирающие лимфатические сосуды с неправильным паттерном у взрослых | |||||
| Андреномедуллин | 8 9137 KO-активный Интерстициальная лимфедема (КО), аномальные яремные||||||||||
| Эмилин-1 142 | Белок ЕСМ | КО | Гиперпластическое сокращение, увеличенные лимфатические сосуды с неровным узором сосудов с неровной структурой , лимфедема | |||||||
| Интегрин α 9 52 | Рецептор адгезии | KO | Хилоторакс, лимфедема | |||||||
VEGF-C | Гиперпластический фактор лимфатические сосуды | | |||||||||
| VEGF-D 6 4 | Фактор роста | TG (K14) | Гиперпластические лимфатические сосуды | |||||||
| VEGF-A 72 | Фактор роста | TG (K14) | 80129 | H1364 | лимфатические сосуды 9279 927 927 927 927 927 927 927 9279 | Фактор роста | TG | Увеличение числа и увеличение лимфатических сосудов | ||
| Ангиопоэтин-1 79 | Фактор роста | TG (K14)4 | Увеличение лимфатических сосудов | 9134 Elk3) 143 Фактор транскрипции | KO | Хилоторакс, расширенные лимфатические сосуды | ||||
| SOX18 (рваный) 95 | Транскрипция мутации spontsema misc , сердечно-сосудистые и дефекты волосяных фолликулов | |||||||||
| Pi3kca 144 | Фосфоинозитид 3-киназа | Мутант, неспособный взаимодействовать с Ras | Хилезный асцит, восстановление лимфатических капилляров | 4 | ||||||
| трис-хромосом 145 | 0 Трис | 0 Трис 16 | Аномальный размер и структура яремных лимфатических мешочков, отек шеи |
Исследования моделей с нокаутом мышей выявили ряд генов, участвующих в эмбриональном развитии лимфатической системы, в дополнение к Prox1 ().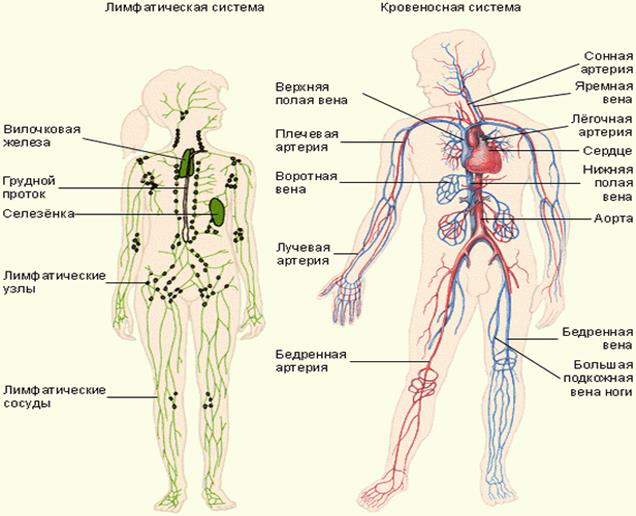 Среди них фактор роста эндотелия сосудов (VEGF) -C и, что наиболее вероятно, его рецептор VEGFR-3 незаменимы для раннего лимфатического развития, что было выявлено делецией VEGF-C у мышей, что приводит к полному отсутствию лимфатической сосудистой сети и внутриутробной смерти. из-за скопления жидкости в тканях. 16 Сигнал VEGF-C во время эмбрионального развития необходим для прорастания Prox1-позитивных лимфатически коммитированных эндотелиальных клеток из вен с образованием начальных лимфатических мешков ().Однако отсутствие VEGF-D — единственного другого известного лиганда VEGFR-3 — не влияет на развитие лимфатической системы. 16,17 Экзогенный, но не эндогенный, VEGF-D может восстанавливать фенотип мышей с дефицитом VEGF-C, предполагая, что VEGF-D не экспрессируется в критических участках образования лимфатических мешков у эмбриона. 16,18 Делеция VEGFR-3 вызывает гибель эмбриона из-за сердечно-сосудистой недостаточности на E 9.5, до начала лимфатического развития, 19 , что демонстрирует его необходимость для развития кровеносных сосудов, но не позволяет оценить его роль в лимфатическом развитии.
Среди них фактор роста эндотелия сосудов (VEGF) -C и, что наиболее вероятно, его рецептор VEGFR-3 незаменимы для раннего лимфатического развития, что было выявлено делецией VEGF-C у мышей, что приводит к полному отсутствию лимфатической сосудистой сети и внутриутробной смерти. из-за скопления жидкости в тканях. 16 Сигнал VEGF-C во время эмбрионального развития необходим для прорастания Prox1-позитивных лимфатически коммитированных эндотелиальных клеток из вен с образованием начальных лимфатических мешков ().Однако отсутствие VEGF-D — единственного другого известного лиганда VEGFR-3 — не влияет на развитие лимфатической системы. 16,17 Экзогенный, но не эндогенный, VEGF-D может восстанавливать фенотип мышей с дефицитом VEGF-C, предполагая, что VEGF-D не экспрессируется в критических участках образования лимфатических мешков у эмбриона. 16,18 Делеция VEGFR-3 вызывает гибель эмбриона из-за сердечно-сосудистой недостаточности на E 9.5, до начала лимфатического развития, 19 , что демонстрирует его необходимость для развития кровеносных сосудов, но не позволяет оценить его роль в лимфатическом развитии. В то время как в нормальных тканях взрослого человека экспрессия VEGFR-3 в значительной степени ограничена лимфатическим эндотелием, в этот момент времени на раннем эмбриональном развитии VEGFR-3 присутствует как в венозном, так и в предположительно лимфатическом эндотелии 20 (). Фактически, самым ранним маркером лимфатической компетенции является рецептор-1 гиалуроновой кислоты эндотелия лимфатических сосудов (LYVE-1), гомолог рецептора гиалуроновой кислоты CD44, специфичного для эндотелия кровеносных сосудов. 21 Он экспрессируется на эндотелиальных клетках передней кардинальной вены уже на E 9.0–9,5 () и является одним из наиболее широко используемых маркеров лимфатического эндотелия. Тем не менее, мыши с нокаутом LYVE-1 не имеют или имеют только незначительные лимфатические дефекты, 22,23 , и биологическая функция этого белка пока неизвестна.
В то время как в нормальных тканях взрослого человека экспрессия VEGFR-3 в значительной степени ограничена лимфатическим эндотелием, в этот момент времени на раннем эмбриональном развитии VEGFR-3 присутствует как в венозном, так и в предположительно лимфатическом эндотелии 20 (). Фактически, самым ранним маркером лимфатической компетенции является рецептор-1 гиалуроновой кислоты эндотелия лимфатических сосудов (LYVE-1), гомолог рецептора гиалуроновой кислоты CD44, специфичного для эндотелия кровеносных сосудов. 21 Он экспрессируется на эндотелиальных клетках передней кардинальной вены уже на E 9.0–9,5 () и является одним из наиболее широко используемых маркеров лимфатического эндотелия. Тем не менее, мыши с нокаутом LYVE-1 не имеют или имеют только незначительные лимфатические дефекты, 22,23 , и биологическая функция этого белка пока неизвестна.
После формирования лимфатических мешков кровь и лимфатическая сосудистая система продолжают развиваться отдельно. Поддерживается лишь несколько соединений, чтобы лимфа могла вернуться в кровообращение. Было обнаружено, что несколько молекул участвуют в контроле разделения двух типов сосудистой сети (), включая тирозинкиназу Syk и адаптерный белок SLP-76.Инактивация любого из этих генов у мышей приводит к аномальным кровно-лимфатическим связям во время эмбриогенеза 24 (). Поскольку экспрессия Syk и SLP-76 ограничена в основном гемопоэтическими клетками и не обнаруживается в эндотелиальных клетках, интактная передача сигналов Syk и SLP-76 в гемопоэтических клетках, которые могут быть потенциальным источником эндотелиальных предшественников во время развития, по-видимому, необходима для предотвратить смешение кровяно-лимфатических сосудов. 24, 25 Сходный фенотип с заполненными кровью лимфатическими сосудами эмбриона был зарегистрирован для мышей с двойным нокаутом Spred-1 / Spred-2.Спреды подавляют передачу сигналов VEGF-C, ингибируя опосредованную VEGFR-3 активацию ERK, 26 , что предполагает роль передачи сигналов VEGFR-3 в разделении сосудов.
Поддерживается лишь несколько соединений, чтобы лимфа могла вернуться в кровообращение. Было обнаружено, что несколько молекул участвуют в контроле разделения двух типов сосудистой сети (), включая тирозинкиназу Syk и адаптерный белок SLP-76.Инактивация любого из этих генов у мышей приводит к аномальным кровно-лимфатическим связям во время эмбриогенеза 24 (). Поскольку экспрессия Syk и SLP-76 ограничена в основном гемопоэтическими клетками и не обнаруживается в эндотелиальных клетках, интактная передача сигналов Syk и SLP-76 в гемопоэтических клетках, которые могут быть потенциальным источником эндотелиальных предшественников во время развития, по-видимому, необходима для предотвратить смешение кровяно-лимфатических сосудов. 24, 25 Сходный фенотип с заполненными кровью лимфатическими сосудами эмбриона был зарегистрирован для мышей с двойным нокаутом Spred-1 / Spred-2.Спреды подавляют передачу сигналов VEGF-C, ингибируя опосредованную VEGFR-3 активацию ERK, 26 , что предполагает роль передачи сигналов VEGFR-3 в разделении сосудов. Недавнее исследование ангиопоэтин-подобного белка 4 (Angptl4, также известного как жировой фактор, индуцированного голоданием, Fiaf), кроме того, показывает, что для устойчивого разделения кровеносных и лимфатических сосудов постнатально необходимы активные механизмы. 27 В течение нескольких дней после рождения у этих животных развиваются летальные дефекты разделения лимфатических и кровеносных сосудов в кишечнике, связанные со снижением экспрессии Prox1 в LEC тонкой кишки.
Недавнее исследование ангиопоэтин-подобного белка 4 (Angptl4, также известного как жировой фактор, индуцированного голоданием, Fiaf), кроме того, показывает, что для устойчивого разделения кровеносных и лимфатических сосудов постнатально необходимы активные механизмы. 27 В течение нескольких дней после рождения у этих животных развиваются летальные дефекты разделения лимфатических и кровеносных сосудов в кишечнике, связанные со снижением экспрессии Prox1 в LEC тонкой кишки.
Заключительные этапы лимфатического развития — ремоделирование и созревание начальной сети лимфатических сосудов в лимфатические капилляры и сбор лимфатических сосудов — требуют прорастания новых лимфатических капилляров из ранее существовавших, а также получения покрытия стеночными клетками вокруг и формирование клапанов в собирающих лимфатических сосудах (). Фактор транскрипции Foxc2, 28 фактор роста ангиопоэтин-2, 29, 30 некиназный рецептор нейропилин-2, 31 и лиганд рецептора Eph ephrinB2 32 были идентифицированы как молекулярные медиаторы этих процессов. основан на нокаутных мышах, проявляющих соответствующие лимфатические фенотипы на поздних стадиях эмбрионального развития ().Также для правильного образования необходим трансмембранный гликопротеин подопланин, который экспрессируется на LEC, но не на эндотелиальных клетках кровеносных сосудов (BEC) in vivo и in vitro и является установленным маркером лимфатического эндотелия, 33–37 и функция зрелой лимфатической сосудистой сети. Мыши с нокаутом по подпланину умирают при рождении из-за дыхательной недостаточности и, кроме того, обнаруживают различные лимфатические дефекты 37,38 (). Подопланин способен к агрегации тромбоцитов посредством взаимодействия с C-typelectin-like рецептором 2 (CLEC-2) на тромбоцитах, 39,40 и участвует в цитоскелетной организации эндотелиальных и других клеток. 37,41,42 Однако его точная молекулярная функция до сих пор остается неизвестной. Учитывая фенотип мышей с нокаутом Syk / SLP-76 24 вместе с тем фактом, что CLEC-2 передает сигналы через Syk и SLP-76 на агрегирование тромбоцитов, 43 можно предположить потенциальную функцию подопланина в предотвращении анастомозов между лимфатические и кровеносные сосуды путем тромбообразования.
основан на нокаутных мышах, проявляющих соответствующие лимфатические фенотипы на поздних стадиях эмбрионального развития ().Также для правильного образования необходим трансмембранный гликопротеин подопланин, который экспрессируется на LEC, но не на эндотелиальных клетках кровеносных сосудов (BEC) in vivo и in vitro и является установленным маркером лимфатического эндотелия, 33–37 и функция зрелой лимфатической сосудистой сети. Мыши с нокаутом по подпланину умирают при рождении из-за дыхательной недостаточности и, кроме того, обнаруживают различные лимфатические дефекты 37,38 (). Подопланин способен к агрегации тромбоцитов посредством взаимодействия с C-typelectin-like рецептором 2 (CLEC-2) на тромбоцитах, 39,40 и участвует в цитоскелетной организации эндотелиальных и других клеток. 37,41,42 Однако его точная молекулярная функция до сих пор остается неизвестной. Учитывая фенотип мышей с нокаутом Syk / SLP-76 24 вместе с тем фактом, что CLEC-2 передает сигналы через Syk и SLP-76 на агрегирование тромбоцитов, 43 можно предположить потенциальную функцию подопланина в предотвращении анастомозов между лимфатические и кровеносные сосуды путем тромбообразования.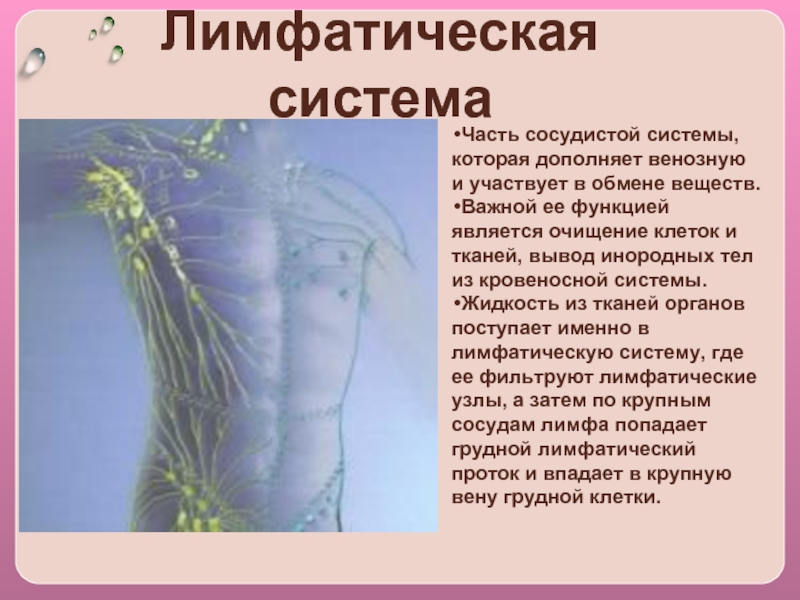
Хотя эндотелиальные клетки, выстилающие лимфатические сосуды, происходят из эндотелиальных клеток кровеносных сосудов и, следовательно, эти два типа клеток генетически тесно связаны, в процессе развития LEC все больше приобретают специфическую экспрессию различных генов, что отличает их от BEC и отражает различные функции две сосудистые системы.В дополнение к вышеупомянутым маркерам Prox1, VEGFR-3, LYVE-1 и подопланину, эти гены включают, например, лимфатический хемокин CCL21 44 и нейропилин-2, 31 корецептор для нескольких факторов роста, включая VEGF-C 45 и фактор роста гепатоцитов (HGF). 46 Благодаря возможности выделения LEC и BEC из кожи человека и размножения их в культуре на несколько пассажей без потери их дифференцировки, специфичной для клонов, 34–36,47 можно было изучить молекулярные различия между двумя типами клеток очень подробно о транскиптоме 34,36 , а также на уровне протеома. 48 Кроме того, недавние исследования, сравнивающие свежевыделенные и культивируемые LEC, подчеркнули значительное влияние тканевого микроокружения in vivo на транскрипционные профили эндотелиальных клеток. 49,50
49,50
Решающая роль в спецификации происхождения LEC по сравнению с BEC должна быть отведена Prox1. Его эктопическая экспрессия в BECs индуцирует экспрессию генов лимфатических маркеров в этих клетках, 36,51 , тогда как приобретение экспрессии лимфатических маркеров зачатыми эндотелиальными клетками во время эмбрионального развития отменяется у мышей, нулевых по Prox1. 5 Недавно интегрин α 9 — который, как было показано, участвует в развитии лимфатической системы 52 () и является рецептором для VEGF-C и -D 53 — и VEGFR- 3 были идентифицированы как гены-мишени Prox1, 54 , способствующие миграции LEC в направлении сигналов VEGF-C. Подтверждая эту потенциальную новую роль Prox1 в миграции клеток, мы недавно обнаружили, что он способствует инвазивности капозиформной гемангиоэндотелиомы. 55
Лимфангиогенез у взрослых
У взрослых организмов лимфангиогенез происходит только при определенных патологических состояниях, таких как восстановление тканей, воспаление и рост опухоли. В настоящее время неясно, происходит ли рост лимфатических сосудов в этих условиях исключительно за счет пролиферации местных эндотелиальных клеток и прорастания ранее существовавших сосудов, или же он включает также включение циркулирующих эндотелиальных клеток-предшественников в участки активного лимфангиогенеза.
В настоящее время неясно, происходит ли рост лимфатических сосудов в этих условиях исключительно за счет пролиферации местных эндотелиальных клеток и прорастания ранее существовавших сосудов, или же он включает также включение циркулирующих эндотелиальных клеток-предшественников в участки активного лимфангиогенеза.
Предполагаемые лимфатические эндотелиальные клетки-предшественники, коэкспрессирующие маркеры лимфатического эндотелия и стволовых клеток, были идентифицированы в печени и пуповинной крови плода человека. 56 Тем не менее, эксперименты с использованием сублетально облученных мышей с трансплантированным GFP-экспрессирующим костным мозгом показали, что полученные из костного мозга эндотелиальные клетки-предшественники не вносят вклад в индуцированный опухолью или VEGF-C лимфангиогенез, поскольку GFP-положительные донорские клетки не наблюдались в новообразованные лимфатические сосуды, когда рост лимфатической сосудистой сети был вызван применением VEGF-C или опухолевыми имплантатами у этих мышей. 57 В отличие от этого клетки костного мозга были включены в растущие лимфатические сосуды в воспаленных или обработанных фактором роста фибробластов (FGF) -2 роговицах химерных мышей GFP, 58,59 , а также во время связанных с воспалением лимфангиогенез в трансплантатах почек человека. 60 Предполагается, что эти клетки являются макрофагами, которые трансдифференцируются в LEC, 59,60 , и их относительный вклад в новые сосуды оказывается незначительным.Однако макрофаги и другие воспалительные клетки могут, кроме того, играть косвенную роль в неоваскуляризации через секрецию лимфангиогенных факторов, таких как VEGF-C или VEGF-D. 61,62
57 В отличие от этого клетки костного мозга были включены в растущие лимфатические сосуды в воспаленных или обработанных фактором роста фибробластов (FGF) -2 роговицах химерных мышей GFP, 58,59 , а также во время связанных с воспалением лимфангиогенез в трансплантатах почек человека. 60 Предполагается, что эти клетки являются макрофагами, которые трансдифференцируются в LEC, 59,60 , и их относительный вклад в новые сосуды оказывается незначительным.Однако макрофаги и другие воспалительные клетки могут, кроме того, играть косвенную роль в неоваскуляризации через секрецию лимфангиогенных факторов, таких как VEGF-C или VEGF-D. 61,62
VEGF-C и структурно близкородственный VEGF-D на сегодняшний день являются наиболее важными и лучше всего охарактеризованными лимфангиогенными факторами роста. При сверхэкспрессии в коже мышей они вызывают гиперплазию кожных лимфатических сосудов 63,64 () — в отличие от VEGF-C, VEGF-D делает это в основном постнатально, а не в эмбрионе. 65 VEGF-C, кроме того, способствует росту, миграции и выживанию культивируемых LEC человека. 47 Основным рецептором VEGF-C и -D является VEGFR-3; Однако после протеолитического расщепления эти факторы роста также могут связывать VEGFR-2. 66–69 Хотя было показано, что исключительной активации передачи сигналов VEGFR-3 достаточно, чтобы способствовать лимфангиогенезу, 64 вклад сигналов VEGFR-2 в лимфангиогенез менее очевиден. В этом контексте несколько исследований продемонстрировали лимфангиогенный потенциал VEGF-A, который является лигандом VEGFR-2, но не VEGFR-3 — in vitro 34 и in vivo . 70–73 Хотя VEGF-A может действовать косвенно, привлекая VEGF-C и -D-продуцирующие воспалительные клетки, 61,62,74 , по крайней мере, часть его эффектов на лимфатические сосуды можно отнести к VEGFR-2, поскольку они могут быть отменены антителами, специфически блокирующими этот рецептор. 71,72 Недавнее исследование, анализирующее независимые от VEGFR-3 механизмы лимфангиогенеза, предполагает, что сигналы VEGFR-2 в лимфатических сосудах способствуют их увеличению, но не образованию новых сосудистых отростков.
65 VEGF-C, кроме того, способствует росту, миграции и выживанию культивируемых LEC человека. 47 Основным рецептором VEGF-C и -D является VEGFR-3; Однако после протеолитического расщепления эти факторы роста также могут связывать VEGFR-2. 66–69 Хотя было показано, что исключительной активации передачи сигналов VEGFR-3 достаточно, чтобы способствовать лимфангиогенезу, 64 вклад сигналов VEGFR-2 в лимфангиогенез менее очевиден. В этом контексте несколько исследований продемонстрировали лимфангиогенный потенциал VEGF-A, который является лигандом VEGFR-2, но не VEGFR-3 — in vitro 34 и in vivo . 70–73 Хотя VEGF-A может действовать косвенно, привлекая VEGF-C и -D-продуцирующие воспалительные клетки, 61,62,74 , по крайней мере, часть его эффектов на лимфатические сосуды можно отнести к VEGFR-2, поскольку они могут быть отменены антителами, специфически блокирующими этот рецептор. 71,72 Недавнее исследование, анализирующее независимые от VEGFR-3 механизмы лимфангиогенеза, предполагает, что сигналы VEGFR-2 в лимфатических сосудах способствуют их увеличению, но не образованию новых сосудистых отростков.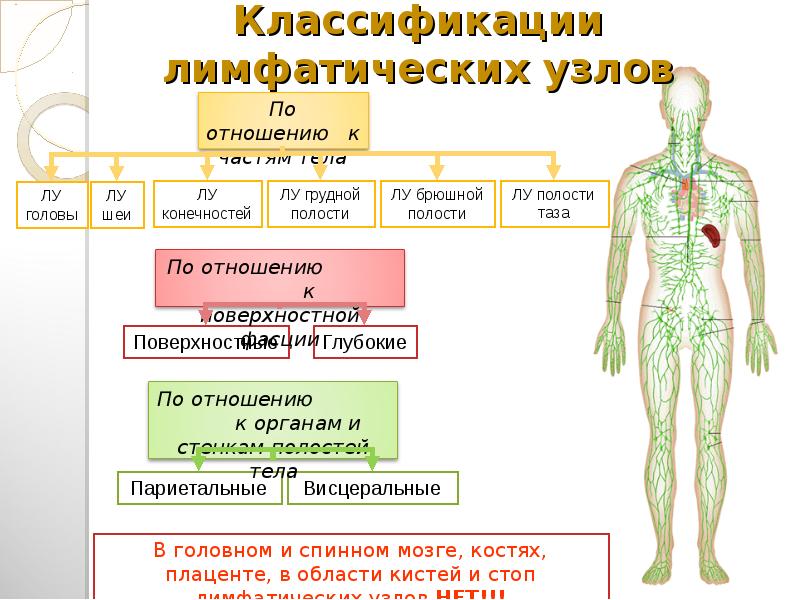 75 На взрослой модели лимфангиогенеза в регенерирующей коже как VEGFR-2, так и VEGFR-3 были необходимы для миграции и пролиферации LEC, в то время как передача сигналов через любой из них по отдельности оказалась достаточной для последующей организации LEC в функциональные капилляры. 76 Вопрос о возможном временном компоненте VEGFR-3-зависимого по сравнению с независимым лимфангиогенезом недавно был решен путем применения растворимого слитого белка VEGFR-3-Ig у постнатальных и взрослых мышей для блокирования передачи сигналов через VEGFR-3.Это исследование предполагает, что постнатально сигналы VEGF-C / D через VEGFR-3 необходимы только для поддержания малых лимфатических сосудов в течение первых нескольких недель жизни. После этого лимфатические сосуды регенерируют, несмотря на постоянное ингибирование VEGFR-3. 65 В соответствии с этими выводами, блокада VEGFR-3 у взрослых мышей с помощью нейтрализующих антител специфически подавляет рост новых лимфатических сосудов, не затрагивая выживание и функцию ранее существовавших сосудов.
75 На взрослой модели лимфангиогенеза в регенерирующей коже как VEGFR-2, так и VEGFR-3 были необходимы для миграции и пролиферации LEC, в то время как передача сигналов через любой из них по отдельности оказалась достаточной для последующей организации LEC в функциональные капилляры. 76 Вопрос о возможном временном компоненте VEGFR-3-зависимого по сравнению с независимым лимфангиогенезом недавно был решен путем применения растворимого слитого белка VEGFR-3-Ig у постнатальных и взрослых мышей для блокирования передачи сигналов через VEGFR-3.Это исследование предполагает, что постнатально сигналы VEGF-C / D через VEGFR-3 необходимы только для поддержания малых лимфатических сосудов в течение первых нескольких недель жизни. После этого лимфатические сосуды регенерируют, несмотря на постоянное ингибирование VEGFR-3. 65 В соответствии с этими выводами, блокада VEGFR-3 у взрослых мышей с помощью нейтрализующих антител специфически подавляет рост новых лимфатических сосудов, не затрагивая выживание и функцию ранее существовавших сосудов. 77 В целом это указывает на то, что другие факторы могут стать важными для роста и поддержания лимфатических сосудов во взрослой жизни.Действительно, к настоящему времени идентифицировано множество факторов роста, способных стимулировать лимфангиогенез, включая ангиопоэтин (Ang) -1, 78,79 фактор роста гепатоцитов (HGF), 80, 81 фактор роста фибробластов (FGF) — 2, 82–84 инсулиноподобный фактор роста (IGF) 1 и 2, 85 и факторы роста тромбоцитов (PDGF). 86 Некоторые из них могут действовать на лимфатические сосуды опосредованно через сигнальный путь VEGF-C / VEGFR-3 или только в определенных патологических ситуациях (рассмотрено в 87 ).
77 В целом это указывает на то, что другие факторы могут стать важными для роста и поддержания лимфатических сосудов во взрослой жизни.Действительно, к настоящему времени идентифицировано множество факторов роста, способных стимулировать лимфангиогенез, включая ангиопоэтин (Ang) -1, 78,79 фактор роста гепатоцитов (HGF), 80, 81 фактор роста фибробластов (FGF) — 2, 82–84 инсулиноподобный фактор роста (IGF) 1 и 2, 85 и факторы роста тромбоцитов (PDGF). 86 Некоторые из них могут действовать на лимфатические сосуды опосредованно через сигнальный путь VEGF-C / VEGFR-3 или только в определенных патологических ситуациях (рассмотрено в 87 ).
Недавно идентифицированные лимфангиогенные факторы включают гормон роста (GH), 88 и многофункциональный пептид адреномедуллин (AM), который передает сигналы через рецептор, подобный рецептору кальцитонина (calcrl), связанный с белком, модифицирующим активность рецептора (RAMP) 2.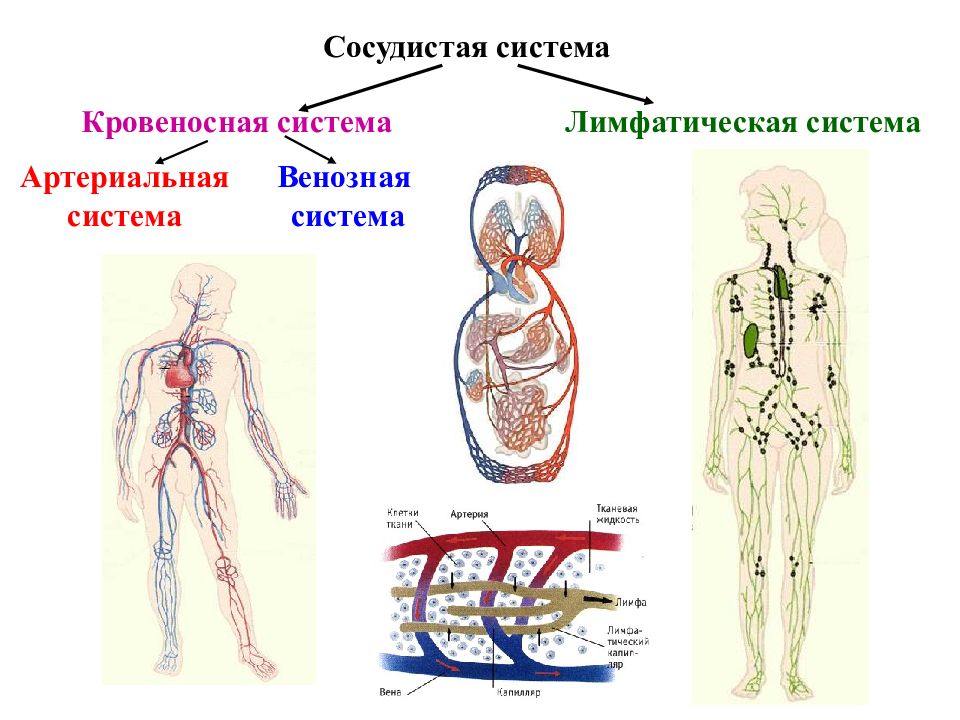 В дополнение к передаче сигналов AM, играющей роль в лимфатическом развитии, что было выявлено мышами с нокаутом либо для самого AM, либо для calcrl или RAMP2 (), лечение адреномедуллином способствует пролиферации культивируемых LEC человека. 89
В дополнение к передаче сигналов AM, играющей роль в лимфатическом развитии, что было выявлено мышами с нокаутом либо для самого AM, либо для calcrl или RAMP2 (), лечение адреномедуллином способствует пролиферации культивируемых LEC человека. 89
Лимфатическая система при заболевании
Лимфедема
Основная физиологическая функция лимфатической сосудистой сети — принимать жидкость, вытекающую из капилляров крови в интерстициальные пространства в ткани, и возвращать ее в кровообращение. Любая неспособность сделать это приводит к лимфедеме, хроническому, инвалидизирующему и обезображивающему состоянию. Накопление богатой белком жидкости в тканях вызывает отек конечностей и у большинства пациентов также связано с воспалительными реакциями, фиброзом, разрастанием жировой и соединительной ткани в пораженных областях и другими симптомами.
В зависимости от причины лимфедема подразделяется на первичную (наследственную) и вторичную (приобретенную) формы. Первичная лимфедема встречается редко и обычно характеризуется гипер- или гипоплазией лимфатических сосудов и / или недостаточной функцией лимфатических клапанов. Было описано множество различных синдромов, для некоторых из которых можно идентифицировать лежащие в основе генетические дефекты. Болезнь Милроя, форма врожденной лимфедемы с аутосомно-доминантным наследованием, может быть приписана инактивирующим киназу мутациям в гене VEGFR-3 , обнаруженных в нескольких затронутых семьях, 90,91 , а также у мышей Chy , которые имеют гипоплазированные кожные лимфатические сосуды, связанные с лимфедемой 92 ().Другой наследственной формой лимфедемы, которая проявляется позже в период полового созревания, является синдром лимфедема-дистихиаза, называемый так потому, что, помимо отека, у пациентов часто появляются двойные ряды ресниц (дистихиаз). Это нарушение вызвано доминантными инактивирующими мутациями в гене FOXC2 , 93 , который кодирует связанный с вилкой фактор транскрипции, необходимый для правильного формирования лимфатических клапанов и регуляции соответствующего рекрутирования перицитов в лимфатические сосуды 28 () .
Первичная лимфедема встречается редко и обычно характеризуется гипер- или гипоплазией лимфатических сосудов и / или недостаточной функцией лимфатических клапанов. Было описано множество различных синдромов, для некоторых из которых можно идентифицировать лежащие в основе генетические дефекты. Болезнь Милроя, форма врожденной лимфедемы с аутосомно-доминантным наследованием, может быть приписана инактивирующим киназу мутациям в гене VEGFR-3 , обнаруженных в нескольких затронутых семьях, 90,91 , а также у мышей Chy , которые имеют гипоплазированные кожные лимфатические сосуды, связанные с лимфедемой 92 ().Другой наследственной формой лимфедемы, которая проявляется позже в период полового созревания, является синдром лимфедема-дистихиаза, называемый так потому, что, помимо отека, у пациентов часто появляются двойные ряды ресниц (дистихиаз). Это нарушение вызвано доминантными инактивирующими мутациями в гене FOXC2 , 93 , который кодирует связанный с вилкой фактор транскрипции, необходимый для правильного формирования лимфатических клапанов и регуляции соответствующего рекрутирования перицитов в лимфатические сосуды 28 () . Наконец, мутации в гене, кодирующем SOX18, связанный с SRY фактор транскрипции, были описаны как вызывающие рецессивные и доминантные формы синдрома гипотрихоза-лимфедемы-телеангиэктазии. 94 SOX18, как известно, важен для развития кровеносных сосудов, а фенотип рваных мышей, которые имеют спонтанную миссенс-мутацию в гене Sox18 , указывает на то, что SOX18 также участвует в лимфатическом развитии 95 (). Однако в большинстве семей с лимфедемой не происходит ни одной из вышеупомянутых мутаций, поэтому еще несколько генов, связанных с лимфедемой, все еще ждут своего открытия.
Наконец, мутации в гене, кодирующем SOX18, связанный с SRY фактор транскрипции, были описаны как вызывающие рецессивные и доминантные формы синдрома гипотрихоза-лимфедемы-телеангиэктазии. 94 SOX18, как известно, важен для развития кровеносных сосудов, а фенотип рваных мышей, которые имеют спонтанную миссенс-мутацию в гене Sox18 , указывает на то, что SOX18 также участвует в лимфатическом развитии 95 (). Однако в большинстве семей с лимфедемой не происходит ни одной из вышеупомянутых мутаций, поэтому еще несколько генов, связанных с лимфедемой, все еще ждут своего открытия.
Вторичная лимфедема развивается при закупорке лимфатических сосудов, что в промышленно развитых странах в основном является результатом хирургического вмешательства или лучевой терапии рака груди, тогда как в тропических странах лимфатический филяриатоз, паразитарная инфекция, переносимая комарами, является наиболее частой причиной лимфедемы. (рассмотрено в 96 ).
На сегодняшний день лечебного лечения лимфедемы не существует, а терапевтические меры ограничиваются ручным лимфодренажем и давящей повязкой.Основываясь на его мощном лимфангиогенном эффекте, VEGF-C был протестирован на его способность улучшать лимфатическую функцию на животных моделях лимфедемы. У мышей Chy вирус-опосредованная генная терапия VEGF-C стимулировала рост функциональных кожных лимфатических сосудов, 92 и хирургически индуцированную лимфедему на модели уха кролика можно было успешно лечить путем инъекции рекомбинантного белка VEGF-C. 97 Нежелательный рост и негерметичность кровеносных сосудов, возникающие в результате активации VEGFR-2 с помощью VEGF-C, можно было избежать с помощью мутантной формы VEGF-C, специфичной для VEGFR-3. 98 Хотя эти исследования продемонстрировали восстановление только лимфатических капилляров, недавно было показано, что аденовирусной доставкой VEGF-C или -D также можно регенерировать функциональные и зрелые собирающие лимфатические сосуды и соединить их с трансплантатами лимфатических узлов в течение шести месяцев. после хирургического удаления подмышечных лимфатических узлов и всех связанных собирающих лимфатических сосудов у взрослых мышей. 99
после хирургического удаления подмышечных лимфатических узлов и всех связанных собирающих лимфатических сосудов у взрослых мышей. 99
Лимфатическая сосудистая сеть в гомеостазе липидов
Учитывая роль лимфатических сосудов в опосредовании поглощения липидов из кишечника, накопление жира в отечных тканях пациентов с лимфедемой, тесная анатомическая ассоциация лимфатических узлов с жировой ткани и способности лимфы способствовать дифференцировке преадипоцитов в зрелые адипоциты in vitro , 100,101 можно было бы заподозрить связь между лимфатической функцией и гомеостазом липидов.Недавнее исследование на взрослых мышах Prox1 +/-, которые выживают исключительно на фоне NMRI и страдают ожирением по сравнению с их однопометниками дикого типа, действительно предполагает связь между лимфатической дисфункцией и ожирением у взрослых. У этих мышей аномальная утечка лимфы в основном из лимфатических сосудов брыжейки, по-видимому, способствует накоплению липидов в адипоцитах, а также адипогенной дифференцировке. 101
101
Роль лимфатических сосудов в воспалении
Воспаление возникает как реакция на повреждение ткани или инфекцию, в контексте аутоиммунных заболеваний и во время роста опухоли.Биологическая роль лимфатических сосудов в патогенезе воспаления до сих пор полностью не выяснена. С одной стороны, они могут истощать отек, связанный с воспалением, и участвовать в удалении иммунных клеток и воспалительных цитокинов из очага инфекции — с другой стороны, они имеют решающее значение для установления иммунных ответов, выступая в качестве путей выхода для активированных антигенпрезентирующие клетки от очага инфекции до регионарных лимфатических узлов. Все больше данных свидетельствует о том, что лимфатические сосуды могут активно участвовать в воспалительном процессе.
Лимфатическая гиперплазия и / или усиленный лимфангиогенез наблюдались при псориатических поражениях кожи человека, 72 в слизистой оболочке кишечника пациентов с язвенным колитом, 102 в суставах мышей с воспалительным артритом, 103 , а также при трансплантации почки отторжение 104 и хроническое воспаление дыхательных путей у мышей. 74
74
VEGF-A, по-видимому, играет решающую роль в лимфангиогенезе, связанном с воспалением. Его экспрессия повышена в псориатической коже человека, 105 , и мыши, сверхэкспрессирующие VEGF-A в эпидермисе, демонстрируют длительную воспалительную реакцию после индукции кожных реакций гиперчувствительности замедленного типа (DTH), которые связаны с пролиферацией LEC и лимфатической гиперплазией и могут ингибируется блокадой VEGFR-1 и -2. 72 Фактически, недавно было обнаружено, что лимфангиогенез, связанный с хроническими реакциями DTH у мышей, сильно зависит от VEGF-A, поскольку его можно предотвратить с помощью нейтрализующего антитела VEGF-A. 106 Интересно, что в этом исследовании VEGF-A не только индуцировал лимфангиогенез в месте воспаления, где он был произведен, но и в дренирующих лимфатических узлах. Повышенный лимфангиогенез лимфатических узлов также наблюдался после иммунизации; в этом случае, однако, это, по-видимому, опосредовано В-клетками, продуцирующими лимфангиогенные факторы в самом лимфатическом узле.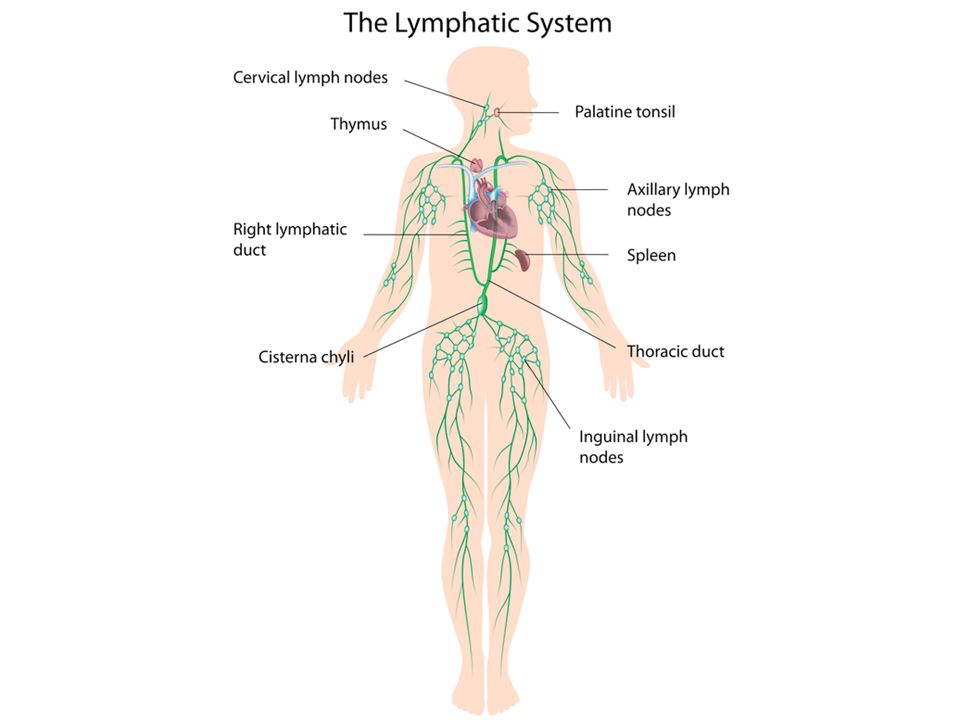 107
107
VEGF-A-опосредованный воспалительный лимфангиогенез может, по крайней мере, частично быть результатом рекрутирования макрофагов, поставляющих VEGF-C и –D. 61,62 Кроме того, сообщалось, что макрофаги физически участвуют в лимфангиогенезе за счет включения во вновь формирующиеся лимфатические сосуды в воспаленной роговице мыши. 59
Наши недавние исследования лимфангиогенеза в коже мышей, облученной УФ-В, предполагают, что VEGF-A преимущественно индуцирует протекающие нефункциональные лимфатические сосуды.Под воздействием УФ-В-ИК-излучения увеличение экспрессии VEGF-A сопровождается развитием гиперпроницаемых, функционально нарушенных лимфатических сосудов в коже, и эти аномалии сосудов можно предотвратить путем введения нейтрализующего антитела к VEGF-A. 108 В целом, лимфангиогенез, связанный с воспалением, индуцированный VEGF-A, по-видимому, оказывает довольно усугубляющее действие на воспалительный процесс.
VEGF-C-опосредованный лимфангиогенез, однако, может играть более благоприятную роль в воспалении. В воспаленных тканях VEGF-C секретируется преимущественно иммунными клетками, такими как дендритные клетки, макрофаги и нейтрофилы, и его экспрессия повышается в ответ на провоспалительные цитокины. 74,109 Высокие уровни VEGF-C были обнаружены в синовиальной оболочке суставов при артрите пациентов с ревматоидным артритом. 110 В суставах мышей с воспалительным артритом VEGF-C, секретируемый TNF α , стимулировал CD11b-положительные клетки, индуцировал лимфангиогенез, 103 и усиленный лимфодренаж оказывал положительное влияние на разрешение воспаления в этих суставах. мышей. 111,112 В соответствии с этими открытиями, ингибирование передачи сигналов VEGFR-3 растворимым VEGFR-3-Ig предотвращало лимфангиогенез на мышиной модели хронического воспаления дыхательных путей, что, в свою очередь, усугубляло отек бронхов. 74 Блокада VEGFR-3 также приводила к длительному воспалению и отеку в ответ на облучение UVB. 113 Таким образом, в отличие от VEGF-A, VEGF-C, по-видимому, способствует лимфатическому кровотоку и способствует разрешению воспаления, что позволяет предположить, что стимуляция лимфангиогенеза с помощью VEGF-C может быть полезной для лечения определенных воспалительных состояний.
В воспаленных тканях VEGF-C секретируется преимущественно иммунными клетками, такими как дендритные клетки, макрофаги и нейтрофилы, и его экспрессия повышается в ответ на провоспалительные цитокины. 74,109 Высокие уровни VEGF-C были обнаружены в синовиальной оболочке суставов при артрите пациентов с ревматоидным артритом. 110 В суставах мышей с воспалительным артритом VEGF-C, секретируемый TNF α , стимулировал CD11b-положительные клетки, индуцировал лимфангиогенез, 103 и усиленный лимфодренаж оказывал положительное влияние на разрешение воспаления в этих суставах. мышей. 111,112 В соответствии с этими открытиями, ингибирование передачи сигналов VEGFR-3 растворимым VEGFR-3-Ig предотвращало лимфангиогенез на мышиной модели хронического воспаления дыхательных путей, что, в свою очередь, усугубляло отек бронхов. 74 Блокада VEGFR-3 также приводила к длительному воспалению и отеку в ответ на облучение UVB. 113 Таким образом, в отличие от VEGF-A, VEGF-C, по-видимому, способствует лимфатическому кровотоку и способствует разрешению воспаления, что позволяет предположить, что стимуляция лимфангиогенеза с помощью VEGF-C может быть полезной для лечения определенных воспалительных состояний.
Тем не менее, в этом отношении следует учитывать некоторые важные аспекты. В модели воспаления роговицы у мышей локальная блокада передачи сигналов VEGFR-3 значительно подавляла перенос дендритных клеток, экспрессирующих VEGFR-3, от роговицы к дренирующим лимфатическим узлам, что предотвращало индукцию гиперчувствительности замедленного типа (ГЗТ) и отторжение. трансплантатов роговицы. Этот эффект зависел от переноса дендритных клеток per se , а не от снижения функции лимфатических сосудов, поскольку он наступал раньше, чем потенциальное ингибирование лимфангиогенеза, которое можно было бы ожидать от лечения анти-VEGFR-3. 114
Однако в контексте отторжения трансплантата почки лимфатический эндотелий действительно, по-видимому, активно способствует воспалительному процессу — за счет секреции хемокина CCL21, который привлекает CCR7-положительные иммунные клетки, тем самым облегчая их транспортировку к лимфатическим узлам и лимфатическим узлам. формирование адаптивного иммунитета. 104
104
Помимо хорошо охарактеризованного пути CCL21 / CCR7 и рецептора маннозы, о котором несколько лет назад сообщалось, что он важен для адгезии лимфоцитов к лимфатическому эндотелию, 115 существуют новые механизмы входа иммунных клеток в афферентные лимфатические сосуды. в настоящее время разгадывается.Подобно эндотелию кровеносных сосудов, LEC могут активироваться воспалительными цитокинами, чтобы обнажить ключевые рецепторы адгезии лейкоцитов, такие как молекула межклеточной адгезии-1 (ICAM-1), молекула адгезии сосудистых клеток-1 (VCAM-1) и E-селектин, содействие трансмиграции лейкоцитов через лимфатический эндотелий. 116 Напротив, LYVE-1, который, как предполагалось, играет роль в опосредованной гиалуронаном адгезии лейкоцитов к лимфатическому эндотелию, интернализуется и разрушается при стимуляции LEC провоспалительными цитокинами. 117 Наконец, недавно было высказано предположение, что сфингозин-1-фосфат (S1P), присутствующий в воспаленных периферических тканях, ингибирует проникновение Т-клеток в афферентные лимфатические сосуды через рецептор 1 S1P, экспрессируемый на Т-лимфоцитах. 118
Роль лимфатических сосудов в развитии рака
Лимфатические сосуды как пути перемещения по телу используются не только иммунными, но и раковыми клетками. Метастазы в регионарные лимфатические узлы представляют собой первый этап распространения опухоли при многих формах рака и являются важным прогностическим индикатором прогрессирования заболевания.Ряд исследований на моделях опухолей на животных установил концепцию, что опухоли — а не просто случайное вторжение в уже существующие лимфатические сосуды поблизости — могут активно индуцировать ассоциированный с опухолью лимфангиогенез, секретируя соответствующие факторы роста, такие как VEGF-C, 119– 121 VEGF-D, 122 или VEGF-A, 70 , который способствует их распространению в дренирующие (сторожевые) лимфатические узлы и за их пределы. Факторы, происходящие из опухоли, которые частично также могут быть связаны с инфильтрирующими опухоль макрофагами, 61 , кроме того, было обнаружено, что они вызывают расширение лимфатической сети в сторожевых лимфатических узлах даже до прибытия метастатических раковых клеток, как если бы создать благоприятную среду для будущих метастазов 70,119,123 ().Оказавшись там, метастатические опухолевые клетки продолжают индуцировать рост лимфатических сосудов в сторожевых лимфатических узлах, что приводит к усиленному дренажу факторов роста и увеличению лимфатических сосудов в удаленных лимфатических узлах (2). VEGF-C-индуцированный лимфангиогенез в лимфатических узлах способствовал метастазированию плоскоклеточной карциномы в отдаленные лимфатические узлы и легкие, 119 , что указывает на то, что лимфангиогенез в лимфатических узлах способствует метастазированию опухоли за пределы сторожевого узла. Важно отметить, что хотя корреляция между экспрессией VEGF-C или -D и метастазированием опухоли неоднократно подтверждалась также при раковых заболеваниях человека (обзор 124 ), степень лимфангиогенеза, связанного с опухолью, была установлена как мощный предиктор метастазирования лимфатических узлов в меланоме человека. , 125,126 значимая корреляция между лимфангиогенезом в сторожевых лимфатических узлах и метастазами в отдаленные лимфатические узлы была недавно обнаружена у пациентов с раком груди у человека. 127 Взятые вместе, эти результаты показывают, что лимфангиогенез в месте первичной опухоли, а также в дренирующем лимфатическом узле активно способствует метастатическому распространению рака, и его ингибирование может представлять интерес для предотвращения метастазирования опухоли.
Лимфангиогенез опухоли и лимфатических узлов способствует метастазированию рака. Происходящие из опухоли VEGF-A и / или VEGF-C / -D индуцируют лимфангиогенез в месте первичной опухоли и внутри сигнальных LN, даже до метастазирования, возможно, подготавливая LN для прибытия метастатических опухолевых клеток.Попадая в дозорный LN, эти клетки сохраняют свою лимфангиогенную активность, вероятно, способствуя дальнейшему распространению рака на отдаленные лимфатические узлы и органы. Хемокин CCL21, происходящий из лимфатического эндотелия, привлекает экспрессирующие CCR7 раковые клетки к лимфатическим сосудам, облегчая их проникновение в лимфатическую систему. CCR7 , CC-хемокиновый рецептор 7; LN , лимфатический узел; VEGF , фактор роста эндотелия сосудов.
Для этой цели подавление эффектов VEGF-C и -D путем блокирования передачи сигналов VEGFR-3 представляется наиболее перспективным, учитывая их решающее значение для роста лимфатических сосудов.Действительно, уменьшение лимфангиогенеза опухоли и метастазирования в лимфатические узлы было достигнуто посредством нейтрализации антител против VEGFR-3 или его лигандов, 122,128 растворимого слитого белка VEGFR-3-Ig, 129,130 или опосредованной малой интерферирующей РНК (siRNA). Молчание гена VEGF-C. 131 Уверенность в том, что ингибирование пути VEGF-C / -D / VEGFR-3 может быть безопасной антилимфангиогенной стратегией, была обеспечена недавним открытием, что оно не влияет на нормальные лимфатические сосуды у взрослых мышей. 65 Между тем, все больше данных указывает на роль VEGFR-3 также в ангиогенезе опухолей. В то время как в нормальных тканях взрослого человека экспрессия VEGFR-3 ограничена в основном лимфатическим эндотелием, он снова экспрессируется в кровеносных сосудах ангиогенной опухоли. 132–134 Более того, недавно было показано, что вмешательство в функцию VEGFR-3 посредством блокирующего антитела ингибирует ангиогенез опухоли и, таким образом, рост опухолевых ксенотрансплантатов у мышей, 135 , что может представлять собой дополнительный положительный эффект анти- VEGFR-3 терапия против рака.
Поскольку VEGF-C и -D могут активировать VEGFR-2, а VEGF-A способствует лимфангиогенезу и метастазированию опухоли, блокада VEGFR-2 также приводит к умеренному подавлению лимфангиогенеза и лимфатических метастазов — в дополнение к ингибированию ангиогенеза и роста опухоли — и антитела против VEGFR-2 и против VEGFR-3 в комбинации более эффективно снижают метастазы в лимфатических узлах и легких, чем любое антитело по отдельности. 128
Другой потенциальной мишенью для ингибирования метастазирования рака через лимфатические сосуды может быть не киназный рецептор нейропилин-2.Недавно сообщалось, что он экспрессируется на активированных опухолью, но не в покоящихся лимфатических сосудах взрослых. Антитело, блокирующее его взаимодействие с VEGF-C, подавляло лимфангиогенез опухоли и уменьшало функциональные лимфатические сосуды, связанные с опухолью, и лимфатические метастазы, оставляя нормальные, сформировавшиеся лимфатические узлы у взрослых мышей без изменений. 136
Помимо факторов, секретирующих опухолевые клетки, которые способствуют росту лимфатических сосудов, LEC могут секретировать факторы, которые притягивают опухолевые клетки к лимфатическим сосудам, и, следовательно, может стоить целенаправленного воздействия.Поскольку его рецептор CCR7 экспрессируется некоторыми линиями раковых клеток, одним из таких кандидатов может быть лимфатический хемокин CCL21, который, как известно, играет решающую роль в миграции активированных дендритных клеток через лимфатические сосуды к региональным лимфатическим узлам. Действительно, было показано, что CCL21 индуцирует хемотаксис экспрессирующих CCR7 метастатических клеток меланомы человека in vitro, и in vivo, , 137 , а сверхэкспрессия CCR7 способствовала метастазированию меланомы мыши B16 в дренирующие лимфатические узлы. 138
Благодарности
Исследования лаборатории авторов поддерживаются грантом Национального института здравоохранения CA69184, грантом Швейцарского национального фонда 3100A0-108207, грантом Австрийского научного фонда S9408-B11, Цюрихской лигой рака, Oncosuisse и Европейской комиссией. Сообщества гранта LSHC-CT-2005-518178 (MD).
Сноски
Раскрытие информации Г-жа Куени и доктор Детмар не имеют конфликтов интересов или финансовых связей, о которых следует раскрывать.
Список литературы
1. Asellius G. De lactibus sive lacteis venis. Медиолани; Милан: 1627. [Google Scholar] 2. Baluk P, Fuxe J, Hashizume H, Romano T, Lashnits E, Butz S, Vestweber D, Corada M, Molendini C, Dejana E, Mc-Donald DM. Функционально специализированные соединения между эндотелиальными клетками лимфатических сосудов. J Exp Med. 2007. 204: 2349–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Сабин Фр. О происхождении лимфатической системы из вен и развитии лимфатических сосудов и грудного протока у свиней.Am J Anat. 1902; 1: 367–389. [Google Scholar] 4. Хантингтон GS, McClure CFW. Анатомия и развитие яремных лимфатических мешков домашней кошки ( Felis domestica ) Anat Rec. 1908; 2: 1–18. [Google Scholar] 5. Wigle JT, Harvey N, Detmar M, Lagutina I, Grosveld G, Gunn MD, Jackson DG, Oliver G. Существенная роль Prox1 в индукции фенотипа лимфатических эндотелиальных клеток. Эмбо Дж. 2002; 21: 1505–1513. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Wigle JT, Oliver G. Функция Prox1 необходима для развития лимфатической системы мышей.Клетка. 1999; 98: 769–778. [PubMed] [Google Scholar] 7. Оливер Г., Соса-Пинеда Б., Гейзендорф С., Спана Е.П., Doe CQ, Грусс П. Prox1, ген гомеобокса, родственный prospero , экспрессируемый во время развития мыши. Mech Dev. 1993; 44: 3–16. [PubMed] [Google Scholar] 8. Сринивасан Р.С., Диллард М.Э., Лагутин О.В., Лин Ф.Дж., Цай С., Цай М.Дж., Самохвалов И.М., Оливер Г. Трассировка линий демонстрирует венозное происхождение лимфатической сосудистой сети млекопитающих. Genes Dev. 2007; 21: 2422–2432. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9.Янив К., Исогай С., Кастранова Д., Краситель Л., Хитоми Дж., Вайнштейн Б.М. Живая визуализация лимфатического развития у рыбок данио. Nat Med. 2006; 12: 711–716. [PubMed] [Google Scholar] 10. Ny A, Koch M, Schneider M, Neven E, Tong RT, Maity S, Fischer C, Plaisance S, Lambrechts D, Heligon C, Terclavers S, Ciesiolka M, Kalin R, Man WY, Senn I, Wyns S, Lupu F , Brandli A, Vleminckx K, Collen D, Dewerchin M, Conway EM, Moons L, Jain RK, Carmeliet P. Генетическая модель головастика Xenopus laevis для изучения лимфангиогенеза.Nat Med. 2005; 11: 998–1004. [PubMed] [Google Scholar] 11. Schneider M, Othman-Hassan K, Christ B, Wilting J. Лимфангиобласты в зачатке крыла птиц. Dev Dyn. 1999; 216: 311–319. [PubMed] [Google Scholar] 12. Wilting J, Aref Y, Huang R, Tomarev SI, Schweigerer L, Christ B, Valasek P, Papoutsi M. Двойное происхождение птичьих лимфатических сосудов. Dev Biol. 2006. 292: 165–173. [PubMed] [Google Scholar] 13. Kreuger J, Nilsson I., Kerjaschki D, Petrova T, Alitalo K, Claesson-Welsh L. Раннее развитие лимфатических сосудов из эмбриональных стволовых клеток.Артериосклер Thromb Vasc Biol. 2006; 26: 1073–1078. [PubMed] [Google Scholar] 14. Liersch R, Nay F, Lu L, Detmar M. Индукция дифференцировки лимфатических эндотелиальных клеток в эмбриоидных телах. Кровь. 2006; 107: 1214–1216. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Buttler K, Kreysing A, von Kaisenberg CS, Schweigerer L, Gale N, Papoutsi M, Wilting J. Мезенхимальные клетки с лейкоцитарными и лимфэндотелиальными характеристиками в мышиных эмбрионах. Dev Dyn. 2006; 235: 1554–1562. [PubMed] [Google Scholar] 16. Karkkainen MJ, Haiko P, Sainio K, Partanen J, Taipale J, Petrova TV, Jeltsch M, Jackson DG, Talikka M, Rauvala H, Betsholtz C, Alitalo K.Фактор роста эндотелия сосудов С необходим для прорастания первых лимфатических сосудов из вен эмбриона. Nat Immunol. 2004; 5: 74–80. [PubMed] [Google Scholar] 17. Болдуин М.Э., Халфорд М.М., Руфейл С., Уильямс Р.А., Хиббс М.Л., Грааль Д., Кубо Х., Стакер С.А., Ахен М.Г. Фактор роста эндотелия сосудов D необходим для развития лимфатической системы. Mol Cell Biol. 2005; 25: 2441–2449. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Авантаджиато В., Орландини М., Акампора Д., Оливьеро С., Симеоне А.Эмбриональный паттерн экспрессии мышиного гена figf , фактора роста, принадлежащего к семейству факторов роста тромбоцитов / факторов роста эндотелия сосудов. Mech Dev. 1998. 73: 221–224. [PubMed] [Google Scholar] 19. Dumont DJ, Jussila L, Taipale J, Lymboussaki A, Mustonen T, Pajusola K, Breitman M, Alitalo K. Сердечно-сосудистая недостаточность у эмбрионов мышей с дефицитом рецептора VEGF-3. Наука. 1998. 282: 946–949. [PubMed] [Google Scholar] 20. Kaipainen A, Korhonen J, Mustonen T, van Hinsbergh VW, Fang GH, Dumont D, Breitman M, Alitalo K.Экспрессия гена fms-подобной тирозинкиназы 4 ограничивается лимфатическим эндотелием во время развития. Proc Natl Acad Sci USA. 1995. 92: 3566–3570. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Banerji S, Ni J, Wang SX, Clasper S, Su J, Tammi R, Jones M, Jackson DG. LYVE-1, новый гомолог гликопротеина CD44, является лимфатическим рецептором гиалуронана. J Cell Biol. 1999; 144: 789–801. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Гейл Н. В., Прево Р., Эспиноза Дж., Фергюсон Д. Дж., Домингес М. Г., Янкопулос Г. Д., Терстон Дж., Джексон Д. Г..Нормальное лимфатическое развитие и функция у мышей с дефицитом лимфатического рецептора гиалуронана LYVE-1. Mol Cell Biol. 2007; 27: 595–604. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Хуанг С.С., Лю И.Х., Смит Т., М.Р. Шах, Ф. Джонсон, Хуанг Дж. С.. У мышей CRSBP-1 / LYVE-l-null обнаруживаются идентифицируемые морфологические и функциональные изменения лимфатических капиллярных сосудов. FEBS Lett. 2006; 580: 6259–6268. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Abtahian F, Guerriero A, Sebzda E, Lu MM, Zhou R, Mocsai A, Myers EE, Huang B, Jackson DG, Ferrari VA, Tybulewicz V, Lowell CA, Lepore JJ, Koretzky GA, Kahn ML.Регулирование разделения кровеносных и лимфатических сосудов с помощью сигнальных белков SLP-76 и Syk. Наука. 2003. 299: 247–251. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Себзда Э., Хиббард С., Суини С., Абтахиан Ф., Безман Н., Клеменс Дж., Мальцман Дж. С., Ченг Л., Лю Ф., Тернер М., Тибулевич В., Корецки Г. А., Кан М. Л.. Мутантные мыши Syk и Slp-76 обнаруживают клеточно-автономный вклад гемопоэтических клеток в развитие сосудов. Dev Cell. 2006; 11: 349–361. [PubMed] [Google Scholar] 26. Танигучи К., Коно Р., Аяда Т., Като Р., Ичияма К., Морисада Т., Оике Ю., Йонемицу Ю., Маэхара Ю., Ёсимура А.Спреды необходимы для эмбрионального лимфангиогенеза, регулируя передачу сигналов рецептора 3 фактора роста эндотелия сосудов. Mol Cell Biol. 2007. 27: 4541–4550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Бэкхед Ф., Кроуфорд П.А., О’Доннелл Д., Гордон Д.И. Постнатальный лимфатический отдел от сосудистой сети в тонком кишечнике требует наличия жирового фактора натощак. Proc Natl Acad Sci USA. 2007. 104: 606–611. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Петрова Т.В., Карпанен Т., Норрмен С., Меллор Р., Тамакоши Т., Файнголд Д., Феррелл Р., Керьяшки Д., Мортимер П., Ила-Херттуала С., Миура Н., Алитало К.Дефектные клапаны и аномальное рекрутирование муральных клеток лежат в основе лимфатической сосудистой недостаточности при дистихиазе лимфедемы. Nat Med. 2004; 10: 974–981. [PubMed] [Google Scholar] 29. Гейл Н.В., Терстон Дж., Хакетт С.Ф., Ренард Р., Ван К., Мак-Клейн Дж., Мартин К., Витте С., Витте М. Х., Джексон Д., Сури С., Кампочьяро, Пенсильвания, Виганд С. Дж., Янкопулос, Г. Д.. Ангиопоэтин-2 необходим для постнатального ангиогенеза и формирования лимфатического паттерна, и ангиопоэтин-1 выполняет только последнюю роль. Dev Cell. 2002; 3: 411–423. [PubMed] [Google Scholar] 30.Шимода Х., Бернас М.Дж., Витте М.Х., Гейл Н.В., Янкопулос Г.Д., Като С. Аномальное привлечение периэндотелиальных клеток в лимфатические капилляры в пищеварительных органах мышей с дефицитом ангиопоэтина-2. Cell Tissue Res. 2007. 328: 329–337. [PubMed] [Google Scholar] 31. Юань Л., Мойон Д., Пардано Л., Бреант С., Карккайнен М. Дж., Алитало К., Эйхманн А. Аномальное развитие лимфатических сосудов у мутантных мышей по нейропилину 2. Разработка. 2002; 129: 4797–4806. [PubMed] [Google Scholar] 32. Макинен Т., Адамс Р., Бейли Дж, Лу К., Зиемецки А., Алитало К., Кляйн Р., Уилкинсон Г.А.Сайт взаимодействия PDZ в ephrinB2 необходим для ремоделирования лимфатической сосудистой сети. Genes Dev. 2005; 19: 397–410. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Breiteneder-Geleff S, Soleiman A, Kowalski H, Horvat R, Amann G, Kriehuber E, Diem K, Weninger W, Tschachler E, Alitalo K, Kerjaschki D. Ангиосаркомы выражают смешанные эндотелиальные фенотипы кровеносных и лимфатических капилляров: подопланин как специфический маркер лимфатического эндотелия. Am J Pathol. 1999; 154: 385–394. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34.Хиракава С., Хонг Ю.К., Харви Н., Шахт В., Мацуда К., Либерманн Т., Детмар М. Идентификация генов, специфичных для сосудистого происхождения, путем транскрипционного профилирования изолированных кровеносных сосудов и лимфатических эндотелиальных клеток. Am J Pathol. 2003. 162: 575–586. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Kriehuber E, Breiteneder-Geleff S, Groeger M, Soleiman A, Schoppmann SF, Stingl G, Kerjaschki D, Maurer D. Изоляция и характеристика дермальных лимфатических и эндотелиальных клеток крови выявляют стабильные и функционально специализированные клеточные клоны.J Exp Med. 2001; 194: 797–808. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Петрова Т.В., Макинен Т., Макела Т.П., Саарела Дж., Виртанен I, Феррелл Р.Э., Finegold DN, Керьяшки Д., Ила-Хертуала С., Алитало К. Лимфатическое эндотелиальное репрограммирование эндотелиальных клеток сосудов с помощью фактора транскрипции гомеобокса Prox-1. Эмбо Дж. 2002; 21: 4593–4599. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Шахт V, Рамирес М.И., Хонг Ю.К., Хиракава С., Фенг Д., Харви Н., Уильямс М., Дворжак А.М., Дворжак Х.Ф., Оливер Дж., Детмар М.Дефицит Т1альфа / подопланина нарушает нормальное формирование лимфатической сосудистой сети и вызывает лимфедему. Эмбо Дж. 2003; 22: 3546–3556. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Рамирес М.И., Миллиен Дж., Хайндс А., Цао И., Селдин, округ Колумбия, Уильямс М.С. T1alpha, ген дифференцировки клеток легкого типа I, необходим для нормальной пролиферации клеток легких и образования альвеол при рождении. Dev Biol. 2003. 256: 61–72. [PubMed] [Google Scholar] 39. Като Ю., Фудзита Н., Кунита А., Сато С., Канеко М., Осава М., Цуруо Т. Молекулярная идентификация Aggrus / T1alpha как фактора, вызывающего агрегацию тромбоцитов, экспрессируемого в колоректальных опухолях.J Biol Chem. 2003; 278: 51599–51605. [PubMed] [Google Scholar] 40. Судзуки-Иноуэ К., Като И., Иноуэ О., Канеко М.К., Мишима К., Ятоми Ю., Ямадзаки Ю., Наримацу Х., Одзаки Ю. Вовлечение рецептора змеиного токсина CLEC-2 в опосредованную подопланином активацию тромбоцитов раковыми клетками. J Biol Chem. 2007; 282: 25993–26001. [PubMed] [Google Scholar] 41. Martin-Villar E, Megias D, Castel S, Yurrita MM, Vilaro S, Quintanilla M. Подопланин связывает белки ERM, чтобы активировать RhoA и способствовать эпителиально-мезенхимальному переходу.J Cell Sci. 2006; 119: 4541–4553. [PubMed] [Google Scholar] 42. Викки А., Лехембр Ф., Вик Н., Хантуш Б., Керьяшки Д., Кристофори Г. Инвазия опухоли при отсутствии эпителиально-мезенхимального перехода: опосредованное подпланином ремоделирование актинового цитоскелета. Раковая клетка. 2006; 9: 261–272. [PubMed] [Google Scholar] 43. Suzuki-Inoue K, Fuller GL, Garcia A, Eble JA, Pohlmann S, Inoue O, Gartner TK, Hughan SC, Pearce AC, Laing GD, Theakston RD, Schweighoffer E, Zitzmann N, Morita T, Tybulewicz VL, Ozaki Y, Watson SP.Новый Syk-зависимый механизм активации тромбоцитов лектиновым рецептором C-типа CLEC-2. Кровь. 2006; 107: 542–549. [PubMed] [Google Scholar] 44. Ганн, доктор медицины, Тангеманн К., Там С., Цистер Дж. Г., Розен С.Д., Уильямс Л.Т. Хемокин, экспрессируемый в лимфоидных венулах высокого эндотелия, способствует адгезии и хемотаксису наивных Т-лимфоцитов. Proc Natl Acad Sci USA. 1998. 95: 258–263. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Карпанен Т., Хекман К.А., Кескитало С., Елч М., Оллила Х, Нойфельд Г., Таманьоне Л., Алитало К.Функциональное взаимодействие VEGF-C и VEGF-D с рецепторами нейропилина. Фасеб Дж. 2006; 20: 1462–1472. [PubMed] [Google Scholar] 46. Sulpice E, Plouet J, Berge M, Allanic D, Tobelem G, Merkulova-Rainon T. Нейропилин-1 и нейропилин-2 действуют как корецепторы, усиливая проангиогенную активность. Кровь. 2008; 111: 2036–2045. [PubMed] [Google Scholar] 47. Макинен Т., Вейккола Т., Мустйоки С., Карпанен Т., Катимел Б., Ницца ЕС, Вайз Л., Мерсер А., Ковальски Х., Керьяшки Д., Стакер С.А., Ахен М.Г., Алитало К. Изолированные лимфатические эндотелиальные клетки передают сигналы роста, выживания и миграции через рецептор VEGF-C / D VEGFR-3.Эмбо Дж. 2001; 20: 4762–4773. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Roesli C, Mumprecht V, Neri D, Detmar M. Идентификация поверхностно-доступного, клон-специфичного сосудистого протеома с помощью двумерного пептидного картирования. Фасеб Дж. 2008 [PubMed] [Google Scholar] 49. Amatschek S, Kriehuber E, Bauer W, Reininger B, Meraner P, Wolpl A, Schweifer N, Haslinger C, Stingl G, Maurer D. Программы дифференцировки, специфичных для кровеносных и лимфатических эндотелиальных клеток, строго контролируются тканевой средой.Кровь. 2007; 109: 4777–4785. [PubMed] [Google Scholar] 50. Wick N, Saharinen P, Saharinen J, Gurnhofer E, Steiner CW, Raab I, Stokic D, Giovanoli P, Buchsbaum S, Burchard A, Thurner S, Alitalo K, Kerjaschki D. Транскриптомное сравнение лимфатических эндотелиальных клеток кожи человека ex vivo и in vitro. Physiol Genomics. 2007. 28: 179–192. [PubMed] [Google Scholar] 51. Hong YK, Harvey N, Noh YH, Schacht V, Hirakawa S, Detmar M, Oliver G. Prox1 — это главный контрольный ген в программе, определяющей судьбу лимфатических эндотелиальных клеток.Dev Dyn. 2002; 225: 351–357. [PubMed] [Google Scholar] 52. Хуанг XZ, Ву Дж. Ф., Феррандо Р., Ли Дж. Х., Ван Ю. Л., Фарез Р. В., младший, Шеппард Д. Смертельный двусторонний хилоторакс у мышей, лишенных интегрина alpha9beta1. Mol Cell Biol. 2000; 20: 5208–5215. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Vlahakis NE, Young BA, Atakilit A, Sheppard D. Лимфангиогенные факторы роста эндотелия сосудов VEGF-C и -D являются лигандами для интегрина alpha9beta1. J Biol Chem. 2005; 280: 4544–4552. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54.Mishima K, Watabe T, Saito A, Yoshimatsu Y, Imaizumi N, Masui S, Hirashima M, Morisada T, Oike Y, Araie M, Niwa H, Kubo H, Suda T, Miyazono K. Прокс1 индуцирует дифференцировку лимфатического эндотелия через интегрин альфа9 и другие сигнальные каскады. Mol Biol Cell. 2007. 18: 1421–1429. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Dadras SS, Skrzypek A, Nguyen L, Shin J, Schulz MMP, Arbiser J, Mihm MC, Detmar M. Прокс-1 способствует инвазии капозиформных гемангиоэндотелиом. J Invest Dermatol. 26 июня 2008 г .; [Epub перед печатью] [PubMed] [Google Scholar] 56.Salven P, Mustjoki S, Alitalo R, Alitalo K, Rafii S. VEGFR-3 и CD133 идентифицируют популяцию CD34 + лимфатических / сосудистых эндотелиальных клеток-предшественников. Кровь. 2003. 101: 168–172. [PubMed] [Google Scholar] 57. He Y, Rajantie I, Ilmonen M, Makinen T, Karkkainen MJ, Haiko P, Salven P, Alitalo K. Предшествующий лимфатический эндотелий, но не эндотелиальные клетки-предшественники, важны для лимфангиогенеза опухоли и лимфатических метастазов. Cancer Res. 2004. 64: 3737–3740. [PubMed] [Google Scholar] 58. Релига П., Цао Р., Бьорндал М., Чжоу З., Чжу З., Цао Ю.Наличие циркулирующих эндотелиальных клеток-предшественников костного мозга во вновь образованных лимфатических сосудах. Кровь. 2005; 106: 4184–4190. [PubMed] [Google Scholar] 59. Маруяма К., И. М., Курсифен К., Джексон Д. Г., Кейно Х., Томита М., Ван Ройен Н., Такенака Х., Д’Амор П. А., Стейн-Стрейлин Дж., Лозордо Д. В., Стрейлин Д. В.. Вызванный воспалением лимфангиогенез в роговице возникает из-за CD11b-положительных макрофагов. J Clin Invest. 2005; 115: 2363–2372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Kerjaschki D, Huttary N, Raab I, Regele H, Bojarski-Nagy K, Bartel G, Krober SM, Greinix H, Rosenmaier A, Karlhofer F, Wick N, Mazal PR.Лимфатические эндотелиальные клетки-предшественники участвуют в лимфангиогенезе de novo в трансплантатах почек человека. Nat Med. 2006; 12: 230–234. [PubMed] [Google Scholar] 61. Schoppmann SF, Birner P, Stockl J, Kalt R, Ullrich R, Caucig C, Kriehuber E, Nagy K, Alitalo K, Kerjaschki D. Связанные с опухолью макрофаги экспрессируют лимфатические эндотелиальные факторы роста и связаны с перитуморальным лимфангиогенезом. Am J Pathol. 2002; 161: 947–956. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Cursiefen C, Chen L, Borges LP, Jackson D, Cao J, Radziejewski C, D’Amore PA, Dana MR, Wiegand SJ, Streilein JW.VEGF-A стимулирует лимфангиогенез и гемангиогенез при воспалительной неоваскуляризации посредством рекрутирования макрофагов. J Clin Invest. 2004. 113: 1040–1050. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Jeltsch M, Kaipainen A, Joukov V, Meng X, Lakso M, Rauvala H, Swartz M, Fukumura D, Jain RK, Alitalo K. Гиперплазия лимфатических сосудов у трансгенных мышей VEGF-C. Наука. 1997; 276: 1423–1425. [PubMed] [Google Scholar] 64. Вейккола Т., Юссила Л., Макинен Т., Карпанен Т., Йельч М., Петрова Т.В., Кубо Х., Терстон Дж., Макдональд Д.М., Ахен М.Г., Укладчик С.А., Алитало К.Передачи сигналов через рецептор-3 фактора роста эндотелия сосудов достаточно для лимфангиогенеза у трансгенных мышей. Эмбо Дж. 2001; 20: 1223–1231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Karpanen T, Wirzenius M, Makinen T., Veikkola T, Haisma HJ, Achen MG, Stacker SA, Pytowski B, Yla-Herttuala S, Alitalo K. Чувствительность лимфангиогенного фактора роста модулируется постнатальным созреванием лимфатических сосудов. Am J Pathol. 2006; 169: 708–718. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Achen MG, Jeltsch M, Kukk E, Makinen T., Vitali A, Wilks AF, Alitalo K, Stacker SA.Фактор роста эндотелия сосудов D (VEGF-D) является лигандом тирозинкиназ рецептора 2 VEGF (Flk1) и рецептора 3 VEGF (Flt4) Proc Natl Acad Sci USA. 1998. 95: 548–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Joukov V, Pajusola K, Kaipainen A, Chilov D, Lahtinen I, Kukk E, Saksela O, Kalkkinen N, Alitalo K. Новый фактор роста эндотелия сосудов, VEGF-C, является лигандом для Flt4 (VEGFR-3) и KDR (VEGFR-2) рецепторные тирозинкиназы. Эмбо Дж. 1996; 15: 1751. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68.Жуков В., Сорса Т., Кумар В., Йелч М., Клаэссон-Уэлш Л., Сао Й, Саксела О., Калккинен Н., Алитало К. Протеолитический процессинг регулирует рецепторную специфичность и активность VEGF-C. Эмбо Дж. 1997; 16: 3898–3911. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Ямада Ю., Незу Дж., Шимане М., Хирата Ю. Молекулярное клонирование нового фактора роста эндотелия сосудов, VEGF-D. Геномика. 1997. 42: 483–488. [PubMed] [Google Scholar] 70. Hirakawa S, Kodama S, Kunstfeld R, Kajiya K, Brown LF, Detmar M. VEGF-A индуцирует опухоль и лимфангиогенез сторожевых лимфатических узлов и способствует лимфатическим метастазам.J Exp Med. 2005; 201: 1089–1099. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Hong YK, Lange-Asschenfeldt B, Velasco P, Hirakawa S, Kunstfeld R, Brown LF, Bohlen P, Senger DR, Detmar M. VEGF-A способствует образованию лимфатических сосудов, связанных с репарацией тканей, через VEGFR-2 и интегрины alpha1beta1 и alpha2beta1 . Фасеб Дж. 2004; 18: 1111–1113. [PubMed] [Google Scholar] 72. Kunstfeld R, Hirakawa S, Hong YK, Schacht V, Lange-Asschenfeldt B, Velasco P, Lin C, Fiebiger E, Wei X, Wu Y, Hicklin D, Bohlen P, Detmar M.Индукция кожных реакций гиперчувствительности замедленного типа у трансгенных мышей VEGF-A приводит к хроническому воспалению кожи, связанному со стойкой лимфатической гиперплазией. Кровь. 2004. 104: 1048–1057. [PubMed] [Google Scholar] 73. Надь Дж. А., Василе Э., Фенг Д., Сундберг К., Браун Л. Ф., Детмар М. Дж., Лавитц Дж. А., Бенджамин Л., Тан X, Мансо Э. Дж., Дворжак А. М., Дворжак Х. Ф. Фактор сосудистой проницаемости / фактор роста эндотелия сосудов индуцирует лимфангиогенез, а также ангиогенез. J Exp Med. 2002; 196: 1497–14506.[Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Балук П., Таммела Т., Атор Э, Любинска Н., Ахен М.Г., Хиклин Д.Д., Елч М., Петрова Т.В., Питовски Б., Стакер С.А., Ила-Херттуала С., Джексон Д.Г., Алитало К., Макдональд Д.М. Патогенез стойкой гиперплазии лимфатических сосудов при хроническом воспалении дыхательных путей. J Clin Invest. 2005; 115: 247–257. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Wirzenius M, Tammela T, Uutela M, He Y, Odorisio T, Zambruno G, Nagy JA, Dvorak HF, Yla-Herttuala S, Shibuya M, Alitalo K.Отчетливые сигналы фактора роста эндотелия сосудов для увеличения и прорастания лимфатических сосудов. J Exp Med. 2007; 204: 1431–1440. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Голдман Дж., Рутковски Дж. М., Шилдс Дж. Д., Паскье М. С., Куй Й, Шмокель Г. Г., Уилли С., Хиклин Д. Д., Питовски Б., Шварц М. А.. Кооперативная и дублирующая роль передачи сигналов VEGFR-2 и VEGFR-3 в лимфангиогенезе взрослых. Фасеб Дж. 2007; 21: 1003–1012. [PubMed] [Google Scholar] 77. Питовски Б., Гольдман Дж., Персо К., Ву И., Витте Л., Хиклин Д. Д., Скобе М., Бордман К. С., Шварц М. А..Полное и специфическое ингибирование регенерации лимфатических сосудов у взрослых с помощью нового нейтрализующего антитела VEGFR-3. J Natl Cancer Inst. 2005; 97: 14–21. [PubMed] [Google Scholar] 78. Morisada T, Oike Y, Yamada Y, Urano T, Akao M, Kubota Y, Maekawa H, Kimura Y, Ohmura M, Miyamoto T., Nozawa S, Koh GY, Alitalo K, Suda T. Ангиопоэтин-1 продвигает LYVE-1- положительное образование лимфатических сосудов. Кровь. 2005; 105: 4649–4656. [PubMed] [Google Scholar] 79. Таммела Т., Сааристо А., Лохела М., Морисада Т., Торнберг Дж., Норрмен К., Оике Ю., Паюсола К., Терстон Г., Суда Т., Ила-Хертуала С., Алитало К.Ангиопоэтин-1 способствует лимфатическому разрастанию и гиперплазии. Кровь. 2005; 105: 4642–4648. [PubMed] [Google Scholar] 80. Кадзия К., Хиракава С., Ма Б., Дринненберг И., Детмар М. Фактор роста гепатоцитов способствует формированию и функционированию лимфатических сосудов. Эмбо Дж. 2005; 24: 2885–2895. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Cao R, Bjorndahl MA, Gallego MI, Chen S, Religa P, Hansen AJ, Cao Y. Фактор роста гепатоцитов — это лимфангиогенный фактор с косвенным механизмом действия. Кровь. 2006; 107: 3531–3536.[PubMed] [Google Scholar] 82. Чанг Л.К., Гарсия-Кардена Г., Фарнебо Ф., Фаннон М., Чен Э.Дж., Баттерфилд С., Мозес М.А., Маллиган Р.К., Фолкман Дж., Кайпайнен А. Дозозависимый ответ FGF-2 на лимфангиогенез. Proc Natl Acad Sci USA. 2004; 101: 11658–116563. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Кубо H, Cao R, Brakenhielm E, Makinen T, Cao Y, Alitalo K. Блокада передачи сигналов рецептора-3 фактора роста эндотелия сосудов ингибирует лимфангиогенез, индуцированный фактором роста 2 фибробластов в роговице мыши.Proc Natl Acad Sci USA. 2002; 99: 8868–8873. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Шин Дж. У., Мин М., Ларье-Лахарг Ф., Канрон Х, Кунстфельд Р., Нгуен Л., Хендерсон Дж. Э., Бикфалви А., Детмар М., Хонг Ю. К.. Prox1 способствует клоноспецифической экспрессии рецептора-3 FGF в лимфатическом эндотелии: роль передачи сигналов FGF в лимфангиогенезе. Mol Biol Cell. 2006; 17: 576–584. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Бьорндал М., Цао Р., Ниссен Л.Дж., Класпер С., Джонсон Л.А., Сюэ И., Чжоу З., Джексон Д., Хансен А.Дж., Цао Ю.Инсулиноподобные факторы роста 1 и 2 индуцируют лимфангиогенез in vivo . Proc Natl Acad Sci USA. 2005; 102: 15593–15598. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Cao R, Bjorndahl MA, Religa P, Clasper S, Garvin S, Galter D, Meister B, Ikomi F, Tritsaris K, Dissing S, Ohhashi T, Jackson DG, Cao Y. PDGF-BB индуцирует внутриопухолевый лимфангиогенез и способствует лимфатическим метастазам. Раковая клетка. 2004. 6: 333–345. [PubMed] [Google Scholar] 87. Куени Л.Н., Детмар М. Новое понимание молекулярного контроля лимфатической сосудистой системы и его роли в развитии заболеваний.J Invest Dermatol. 2006; 126: 2167–2177. [PubMed] [Google Scholar] 89. Фриц-Сикс К.Л., Данворт В.П., Ли М., Кэрон К.М. Передача сигналов адреномедуллина необходима для развития лимфатических сосудов мышей. J Clin Invest. 2008; 118: 40–50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Irrthum A, Karkkainen MJ, Devriendt K, Alitalo K, Vikkula M. Врожденная наследственная лимфедема, вызванная мутацией, которая инактивирует тирозинкиназу VEGFR3. Am J Hum Genet. 2000; 67: 295–301. [Бесплатная статья PMC] [PubMed] [Google Scholar] 91.Карккайнен М.Дж., Феррелл Р.Э., Лоуренс Е.К., Кимак М.А., Левинсон К.Л., Мактигу М.А., Алитало К., Finegold DN. Миссенс-мутации мешают передаче сигналов VEGFR-3 при первичном лимфатическом отеке. Нат Жене. 2000. 25: 153–159. [PubMed] [Google Scholar] 92. Karkkainen MJ, Saaristo A, Jussila L, Karila KA, Lawrence EC, Pajusola K, Bueler H, Eichmann A, Kauppinen R, Kettunen MI, Yla-Herttuala S, Finegold DN, Ferrell RE, Alitalo K. Модель генной терапии наследственная лимфедема человека. Proc Natl Acad Sci USA. 2001; 98: 12677–12682.[Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Фанг Дж., Дагенаис С.Л., Эриксон Р.П., Арльт М.Ф., Глинн М.В., Горски Д.Л., Сивер Л.Х., Гловер Т.В. Мутации в FOXC2 (MFH-1) , транскрипционном факторе семейства вилкоголовых, ответственны за наследственный синдром лимфедема-дистихиаза. Am J Hum Genet. 2000. 67: 1382–1388. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Irrthum A, Devriendt K, Chitayat D, Matthijs G, Glade C, Steijlen PM, Fryns JP, Van Steensel MA, Vikkula M. Мутации в гене фактора транскрипции SOX18 лежат в основе рецессивных и доминантных форм гипотрихоза-лимфедема-телеангиэктазии.Am J Hum Genet. 2003. 72: 1470–1478. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Pennisi D, Gardner J, Chambers D, Hosking B, Peters J, Muscat G, Abbott C, Koopman P. Мутации в Sox18 лежат в основе сердечно-сосудистых заболеваний и дефектов волосяных фолликулов у ободранных мышей. Нат Жене. 2000. 24: 434–437. [PubMed] [Google Scholar] 96. Мелроуз В.Д. Лимфатический филяриатоз: новый взгляд на старую болезнь. Int J Parasitol. 2002; 32: 947–960. [PubMed] [Google Scholar] 97. Szuba A, Skobe M, Karkkainen MJ, Shin WS, Beynet DP, Rockson NB, Dakhil N, Spilman S, Goris ML, Strauss HW, Quertermous T, Alitalo K, Rockson SG.Лечебный лимфангиогенез с человеческим рекомбинантным VEGF-C. Фасеб Дж. 2002; 16: 1985–1987. [PubMed] [Google Scholar] 98. Сааристо А., Вейккола Т., Таммела Т., Энхольм Б., Карккайнен М.Дж., Паюсола К., Бюлер Х., Ила-Херттуала С., Алитало К. Лимфангиогенная генная терапия с минимальными побочными эффектами на кровеносные сосуды. J Exp Med. 2002; 196: 719–730. [Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Таммела Т., Сааристо А., Холопайнен Т., Лытикка Дж., Котронен А., Питконен М., Або-Рамадан У., Ила-Херттуала С., Петрова Т.В., Алитало К.Терапевтическая дифференциация и созревание лимфатических сосудов после лимфодиссекции и трансплантации. Nat Med. 2007; 13: 1458–1466. [PubMed] [Google Scholar] 100. Nougues J, Reyne Y, Dulor JP. Дифференциация предшественников адипоцитов кролика в первичной культуре. Int J Obes. 1988; 12: 321–333. [PubMed] [Google Scholar] 101. Harvey NL, Srinivasan RS, Dillard ME, Johnson NC, Witte MH, Boyd K, Sleeman M, Oliver G. Лимфатические сосудистые дефекты, вызванные гаплонедостаточностью Prox1, вызывают ожирение у взрослых.Нат Жене. 2005; 37: 1072–1081. [PubMed] [Google Scholar] 102. Кайзерлинг Э., Кробер С., Гелефф С. Лимфатические сосуды слизистой оболочки толстой кишки при язвенном колите. Лимфология. 2003. 36: 52–61. [PubMed] [Google Scholar] 103. Чжан К., Лу И, Пруль С.Т., Го Р., Яо З., Шварц Э.М., Бойс Б.Ф., Син Л. Повышенный лимфангиогенез в суставах мышей с воспалительным артритом. Arthritis Res Ther. 2007; 9: R118. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Kerjaschki D, Regele HM, Moosberger I, Nagy-Bojarski K, Watschinger B, Soleiman A, Birner P, Krieger S, Hovorka A, Silberhumer G, Laakkonen P, Petrova T, Langer B, Raab I.Лимфатический неоангиогенез при трансплантации почек человека связан с иммунологически активными лимфоцитарными инфильтратами. J Am Soc Nephrol. 2004. 15: 603–612. [PubMed] [Google Scholar] 105. Детмар М., Браун Л.Ф., Клаффи К.П., Йео К.Т., Кочер О., Джекман Р.В., Берс Б., Дворжак Х.Ф. Сверхэкспрессия фактора проницаемости сосудов / фактора роста эндотелия сосудов и его рецепторов при псориазе. J Exp Med. 1994; 180: 1141–1146. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Халин С., Тоблер Н.Е., Вигл Б., Браун Л.Ф., Детмар М.VEGF-A, продуцируемый хронически воспаленной тканью, вызывает лимфангиогенез в дренирующих лимфатических узлах. Кровь. 2007. 110: 3158–3167. [Бесплатная статья PMC] [PubMed] [Google Scholar] 107. Анджели В., Джинхо Ф., Ллодра Дж., Quemeneur Л., Френетт П.С., Скобе М., Джессбергер Р., Мерад М., Рэндольф Дж. Дж. Лимфангиогенез, управляемый В-клетками, в воспаленных лимфатических узлах усиливает мобилизацию дендритных клеток. Иммунитет. 2006; 24: 203–215. [PubMed] [Google Scholar] 108. Kajiya K, Hirakawa S, Detmar M. Фактор роста эндотелия сосудов-A опосредует индуцированное ультрафиолетом B нарушение функции лимфатических сосудов.Am J Pathol. 2006; 169: 1496–1503. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Ristimaki A, Narko K, Enholm B, Joukov V, Alitalo K. Провоспалительные цитокины регулируют экспрессию лимфатического эндотелиального митогена, фактора роста эндотелия сосудов-C. J Biol Chem. 1998. 273: 8413–8418. [PubMed] [Google Scholar] 110. Паавонен К., Манделин Дж., Партанен Т., Юссила Л., Ли Т.Ф., Ристимаки А., Алитало К., Континен Ю.Т. Факторы роста эндотелия сосудов C и D и их рецепторы VEGFR-2 и 3 в кровеносных и лимфатических сосудах здоровой и артритной синовиальной оболочки.J Rheumatol. 2002; 29: 39–45. [PubMed] [Google Scholar] 111. Proulx ST, Kwok E, You Z, Beck CA, Shealy DJ, Ritchlin CT, Boyce BF, Xing L, Schwarz EM. МРТ и количественная оценка функции дренирующих лимфатических узлов при воспалительном артрите. Ann N Y Acad Sci. 2007; 1117: 106–123. [PubMed] [Google Scholar] 112. Polzer K, Baeten D, Soleiman A, Distler J, Gerlag DM, Tak PP, Schett G, Zwerina J. Блокада TNF увеличивает лимфангиогенез в артритных суставах мыши и человека. Ann Rheum Dis. 2008 [PubMed] [Google Scholar] 113.Каджиа К., Детмар М. Важная роль лимфатических сосудов в контроле образования отека и воспаления, вызванного УФ-В. J Invest Dermatol. 2006; 126: 919–921. [PubMed] [Google Scholar] 114. Чен Л., Хамра П., Курсифен С., Чжан К., Питовски Б., Стрейлин Дж. В., Дана М.Р. Рецептор-3 фактора роста эндотелия сосудов опосредует индукцию аллоиммунитета роговицы. Nat Med. 2004; 10: 813–815. [PubMed] [Google Scholar] 115. Irjala H, Johansson EL, Grenman R, Alanen K, Salmi M, Jalkanen S. Рецептор маннозы является новым лигандом для L-селектина и опосредует связывание лимфоцитов с лимфатическим эндотелием.J Exp Med. 2001; 194: 1033–1042. [Бесплатная статья PMC] [PubMed] [Google Scholar] 116. Джонсон Л.А., Класпер С., Холт А.П., Лалор П.Ф., Бабан Д., Джексон Д.Г. Вызванный воспалением механизм трансмиграции лейкоцитов через эндотелий лимфатических сосудов. J Exp Med. 2006; 203: 2763–2777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 117. Джонсон Л.А., Прево Р., Класпер С., Джексон Д.Г. Вызванное воспалением поглощение и деградация лимфатического эндотелиального рецептора гиалуронана LYVE-1. J Biol Chem. 2007; 282: 33671–33680.[PubMed] [Google Scholar] 118. Ledgerwood LG, Lal G, Zhang N, Garin A, Esses SJ, Ginhoux F, Merad M, Peche H, Lira SA, Ding Y, Yang Y, He X, Schuchman EH, Allende ML, Ochando JC, Bromberg JS. Сфингозин-1-фосфатный рецептор 1 вызывает задержку в ткани, ингибируя проникновение Т-лимфоцитов периферической ткани в афферентные лимфатические сосуды. Nat Immunol. 2008; 9: 42–53. [PubMed] [Google Scholar] 119. Хиракава С., Браун Л.Ф., Кодама С., Паавонен К., Алитало К., Детмар М. VEGF-C-индуцированный лимфангиогенез в сторожевых лимфатических узлах способствует метастазированию опухоли в отдаленные участки.Кровь. 2007; 109: 1010–1017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 120. Mandriota SJ, Jussila L, Jeltsch M, Compagni A, Baetens D, Prevo R, Banerji S, Huarte J, Montesano R, Jackson DG, Orci L, Alitalo K, Christofori G, Pepper MS. Лимфангиогенез, опосредованный фактором роста эндотелия сосудов С, способствует метастазированию опухоли. Эмбо Дж. 2001; 20: 672–682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Скобе М., Хавигорст Т., Джексон Д.Г., Прево Р., Джейнс Л., Веласко П., Риккарди Л., Алитало К., Клаффи К., Детмар М.Индукция лимфангиогенеза опухоли с помощью VEGF-C способствует метастазированию рака груди. Nat Med. 2001; 7: 192–198. [PubMed] [Google Scholar] 122. Stacker SA, Caesar C, Baldwin ME, Thornton GE, Williams RA, Prevo R, Jackson DG, Nishikawa S, Kubo H, Achen MG. VEGF-D способствует метастатическому распространению опухолевых клеток через лимфатические сосуды. Nat Med. 2001; 7: 186–191. [PubMed] [Google Scholar] 123. Harrell MI, Iritani BM, Ruddell A. Опухоль-индуцированный лимфангиогенез сторожевых лимфатических узлов и усиление лимфотока предшествуют метастазам меланомы.Am J Pathol. 2007. 170: 774–786. [Бесплатная статья PMC] [PubMed] [Google Scholar] 124. Риндеркнехт М., Детмар М. Лимфангиогенез опухоли и метастазирование меланомы. J. Cell Physiol. 2008. 216: 347–354. [PubMed] [Google Scholar] 125. Дадрас С.С., Ланге-Ассшенфельдт Б., Веласко П., Нгуен Л., Вора А., Музикански А., Янке К., Хаушильд А., Хиракава С., Михм М.С., Детмар М. Лимфангиогенез опухоли предсказывает метастазирование меланомы в сторожевые лимфатические узлы. Мод Pathol. 2005; 18: 1232–1242. [PubMed] [Google Scholar] 126. Dadras SS, Paul T, Bertoncini J, Brown LF, Muzikansky A, Jackson DG, Ellwanger U, Garbe C, Mihm MC, Detmar M.Опухолевый лимфангиогенез: новый прогностический индикатор метастазирования кожной меланомы и выживаемости. Am J Pathol. 2003; 162: 1951–1960. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Van den Eynden GG, Vandenberghe MK, van Dam PJ, Colpaert CG, van Dam P, Dirix LY, Vermeulen PB, Van Marck EA. Увеличение лимфангиогенеза сторожевых лимфатических узлов связано с поражением подмышечных лимфатических узлов, не являющихся сигнальными, у пациентов с раком молочной железы с положительным сигнальным узлом. Clin Cancer Res. 2007; 13: 5391–5397. [PubMed] [Google Scholar] 128.Робертс Н., Клоос Б., Касселла М., Подграбинска С., Персод К., Ву Ю., Питовски Б., Скобе М. Ингибирование активации VEGFR-3 антагонистическим антителом более эффективно подавляет лимфатические узлы и отдаленные метастазы, чем инактивация VEGFR-2. Cancer Res. 2006; 66: 2650–2657. [PubMed] [Google Scholar] 129. Karpanen T, Egeblad M, Karkkainen MJ, Kubo H, Yla-Herttuala S, Jaattela M, Alitalo K. Фактор роста эндотелия сосудов C способствует лимфангиогенезу опухоли и росту опухоли внутри лимфатической системы. Cancer Res.2001; 61: 1786–1790. [PubMed] [Google Scholar] 130. He Y, Kozaki K, Karpanen T., Koshikawa K, Yla-Herttuala S, Takahashi T, Alitalo K. Подавление лимфангиогенеза опухоли и метастазирования в лимфатические узлы путем блокирования передачи сигналов рецептора 3 фактора роста эндотелия сосудов. J Natl Cancer Inst. 2002; 94: 819–825. [PubMed] [Google Scholar] 131. Чен З., Варни М.Л., Бакора М.В., Коуэн К., Сольхейм Дж.С., Талмадж Дж. Э., Сингх Р.К. Подавление экспрессии фактора роста эндотелиальных клеток-C с использованием малых векторов интерферирующей РНК в опухолях молочной железы подавляет лимфангиогенез опухоли и спонтанные метастазы и увеличивает выживаемость.Cancer Res. 2005; 65: 9004–9011. [PubMed] [Google Scholar] 132. Кубо Х., Фудзивара Т., Джусила Л., Хаши Х, Огава М., Симидзу К., Аване М., Сакаи Й., Такабаяси А., Алитало К., Ямаока Ю., Нисикава С. И.. Участие рецептора фактора роста эндотелия сосудов-3 в поддержании целостности выстилки эндотелиальных клеток во время ангиогенеза опухоли. Кровь. 2000; 96: 546–553. [PubMed] [Google Scholar] 133. Партанен Т.А., Алитало К., Миеттинен М. Отсутствие специфичности лимфатических сосудов рецептора 3 фактора роста эндотелия сосудов в 185 сосудистых опухолях.Рак. 1999; 86: 2406–2412. [PubMed] [Google Scholar] 134. Valtola R, Salven P, Heikkila P, Taipale J, Joensuu H, Rehn M, Pihlajaniemi T, Weich H, deWaal R, Alitalo K. VEGFR-3 и его лиганд VEGF-C связаны с ангиогенезом при раке молочной железы. Am J Pathol. 1999; 154: 1381–1390. [Бесплатная статья PMC] [PubMed] [Google Scholar] 135. Лаакконен П., Вальтари М., Холопайнен Т., Такахаши Т., Питовски Б., Штайнер П., Хиклин Д., Персо К., Тонра Дж. Р., Витте Л., Алитало К. Рецептор 3 фактора роста эндотелия сосудов участвует в ангиогенезе и росте опухоли.Cancer Res. 2007. 67: 593–599. [PubMed] [Google Scholar] 136. Caunt M, Mak J, Liang WC, Stawicki S, Pan Q, Tong RK, Kowalski J, Ho C, Reslan HB, Ross J, Berry L, Kasman I, Zlot C, Cheng Z, Le Couter J, Filvaroff EH, Ploughman G, Peale F, French D, Carano R, Koch AW, Wu Y, Watts RJ, Tessier-Lavigne M, Bagri A. Блокирование функции нейропилина-2 подавляет метастазирование опухолевых клеток. Раковая клетка. 2008. 13: 331–342. [PubMed] [Google Scholar] 137. Шилдс Дж. Д., Эммет М. С., Данн Д. Б., Джори К. Д., Сейдж Л. М., Ригби Г., Мортимер П. С., Орландо А., Левик Дж. Р., Бейтс Д. О..Опосредованная хемокинами миграция клеток меланомы в лимфатические сосуды — механизм, способствующий метастазированию. Онкоген. 2007; 26: 2997–3005. [PubMed] [Google Scholar] 138. Wiley HE, Gonzalez EB, Maki W, Wu MT, Hwang ST. Экспрессия CC-хемокинового рецептора-7 и метастазирование в регионарные лимфатические узлы меланомы мышей B16. J Natl Cancer Inst. 2001; 93: 1638–1643. [PubMed] [Google Scholar] 139. Кридерман Б.М., Майлойд Т.Л., Витте М.Х., Дагене С.Л., Витте К.Л., Реннельс М., Бернас М.Дж., Линч М.Т., Эриксон Р.П., Колдер М.С., Миура Н., Джексон Д., Брукс Б.П., Гловер Т.В.Мыши с гаплонедостаточностью FOXC2 являются моделью аутосомно-доминантного синдрома лимфедема-дистихиаза у человека. Hum Mol Genet. 2003; 12: 1179–1185. [PubMed] [Google Scholar] 140. Seo S, Fujita H, Nakano A, Kang M, Duarte A, Kume T. Факторы транскрипции вилки, Foxc1 и Foxc2, необходимы для спецификации артерий и лимфатического разрастания во время развития сосудов. Dev Biol. 2006; 294: 458–470. [PubMed] [Google Scholar] 141. Хирасима М., Сано К., Морисада Т., Мураками К., Россант Дж., Суда Т. Сборка лимфатических сосудов нарушена у эмбрионов мышей с дефицитом Aspp1.Dev Biol. 2008 [PubMed] [Google Scholar] 142. Danussi C, Spessotto P, Petrucco A, Wassermann B, Sabatelli P, Montesi M, Doliana R, Bressan GM, Colombatti A. Дефицит Эмилина1 вызывает структурные и функциональные дефекты лимфатической сосудистой сети. Mol Cell Biol. 2008 [Бесплатная статья PMC] [PubMed] [Google Scholar] 143. Ayadi A, Zheng H, Sobieszczuk P, Buchwalter G, Moerman P, Alitalo K, Wasylyk B. Мутантные мыши, нацеленные на сеть, развивают сосудистый фенотип и активируют egr-1. Эмбо Дж. 2001; 20: 5139–5152. [Бесплатная статья PMC] [PubMed] [Google Scholar] 144.Gupta S, Ramjaun AR, Haiko P, Wang Y, Warne PH, Nicke B, Nye E, Stamp G, Alitalo K, Downward J. Связывание ras с фосфоинозитид-3-киназой p110alpha необходимо для управляемого ras туморогенеза у мышей. Клетка. 2007. 129: 957–968. [PubMed] [Google Scholar] 145. Гиттенбергер-Де Гроот А.С., Ван ден Аккер Н.М., Бартелингс М.М., Уэбб С., Ван Вугт Дж.М., Хаак М.С. Аномальное лимфатическое развитие у эмбрионов мышей с трисомией 16 предшествует отеку затылочной кости. Dev Dyn. 2004. 230: 378–384. [PubMed] [Google Scholar]Лимфатический сосуд — обзор
1 Структура и функция лимфатической сосудистой сети
Лимфатические сосуды находятся во всех тканях, за исключением костного мозга и центральной нервной системы (Tammela & Alitalo, 2010) .Лимфатическая система устроена так, что всасывающие начальные лимфатические капилляры со слепыми концами расположены в большинстве органов (Schmid-Schonbein, 1990). Лимфатические капилляры состоят из одного слоя лимфатических эндотелиальных клеток (ЛЭК). Они не одинаковы по размеру, а имеют широкую ширину от 10 до 80 мкм в диаметре (Fischer et al., 1996; Spiegel et al., 1992). LEC капилляров экспрессируют высокие уровни мембранного гликопротеина лимфатического сосуда, эндотелиального рецептора гиалуронана-1 (LYVE-1).LYVE-1 незаменим для нормального лимфатического развития и мобилизации DC в LN (Gale et al., 2007), но как рецептор гиалуронана он, вероятно, играет важную роль в регуляции иммунитета и воспаления (Jackson, 2009).
Эндотелиальные клетки лимфатических капилляров имеют форму листа дуба с перекрывающимися створками на границе, что объясняет их абсорбционную природу (Рис. 2.1; Baluk et al., 2007). Эти «пуговичные» соединения между эндотелиальными клетками обладают теми же соединительными белками, что и соединения между эндотелиальными клетками крови, поэтому их отличает не их молекулярный состав, а скорее их организация (Baluk et al., 2007). В следующем тексте мы обсудим критическую организацию этих соединений в продвижении DC входа в лимфатические сосуды.
Рисунок 2.1. Изображение пути DC от интерстиция ткани к дренирующему LN через лимфатическую сеть. После навигации через внеклеточный матрикс, DCs д. Проходить через базальную лимфатическую мембрану, которая содержит «заранее сформированные порталы» (белые; ~ 1-2 мкм в диаметре), обычно связанные с точкой CCL21 (красным). Затем DC должны протиснуться через щели в «пуговичных» соединениях (отмечены красным) между лимфатическими эндотелиальными клетками (LEC) в форме дубовых листьев, прежде чем попасть в просвет сосуда.Зазоры между этими переходами составляют 2–3 мкм. Оказавшись внутри, DCs продолжают взаимодействовать с просветной стороной LEC в процессе, называемом «внутрилимфатическим» ползанием, вероятно, благодаря плоскому поперечному сечению этих сосудов (диаметр 10–80 мкм). Когда DC достигают коллекторных сосудов, увеличенный диаметр (100–220 мкм) и скорость потока способствуют тому, что поток через эту область в 200 раз быстрее, чем в начальных капиллярах.
По мере того, как лимфатические сосуды расширяются к LN, начальные лимфатические капилляры сходятся в более крупные собирающие лимфатические сосуды (Schmid-Schonbein, 1990).У мышей эти сосуды мало экспрессируют LYVE-1 (Makinen et al., 2005), а LEC собирательных сосудов имеют веретенообразную форму. Их отличительные особенности включают просветные клапаны, которые обеспечивают однонаправленный поток, и организованную настенную стенку, состоящую из специализированных мышечных клеток (Muthuchamy & Zawieja, 2008). Коллекторные сосуды состоят из луковичных сегментов, называемых лимфангионами, которые под действием мышечных клеток сокращаются скоординированно, так что лимфа, проталкиваемая через один лимфангион, проталкивается в следующий, когда клапан закрывается, чтобы предотвратить обратный ток жидкости.Коллекторные сосуды обладают внутренней проницаемостью (Scallan & Huxley, 2010), что означает, что часть содержимого лимфы теряется при транспортировке. В отличие от лимфатических капилляров, межклеточные соединения между LECs собирающих сосудов имеют вид «застежки-молнии», более напоминающий таковые между эндотелиальными клетками, выстилающими кровеносные сосуды, и поэтому не считаются абсорбирующими (Baluk et al., 2007). Глубокие собирающие лимфатические сосуды внедряются в перинодальную жировую ткань, контактируют с субкапсулярным синусом ЛУ и переходят в более мелкие терминальные лимфатические капилляры, которые заканчиваются в капсуле ЛУ (Randolph, Angeli, & Swartz, 2005).Лимфа и клетки внутри нее затем проходят через капсулу и вокруг нее, при этом разные типы клеток находят разные позиции для входа в паренхиму LN — Т-клетки входят в паренхиму после прохождения по синусу к мозговому веществу, но DC продвигаются к мозговому веществу вблизи участки вдоль синуса, где они входят в LN (Braun et al., 2011). Лимфа выходит из ЛУ через эфферентный лимфатический сосуд с очевидными свойствами, аналогичными афферентному собирающему сосуду, и может проходить через несколько ЛУ, прежде чем вернуться в кровообращение через грудной проток.
Когда лимфатическая система повреждена, в периферических тканях происходит накопление богатой белком интерстициальной жидкости, которая вызывает хроническое воспаление. Считается, что это, в свою очередь, связано с фиброзом и нарушением иммунных ответов (Lister, Black, Calonje, & Burnand, 1997; Mallon, Powell, Mortimer, & Ryan, 1997; Rockson, 2001), но мало что известно об этом последовательность событий или причин неблагоприятных изменений. Хотя первичная или врожденная лимфедема встречается относительно редко, это состояние серьезно подрывает здоровье.Кроме того, вторичная или приобретенная лимфедема гораздо более распространена и особенно часто встречается при филяриатозе и после хирургического вмешательства при раке груди в промышленно развитых странах (Harwood & Mortimer, 1995).

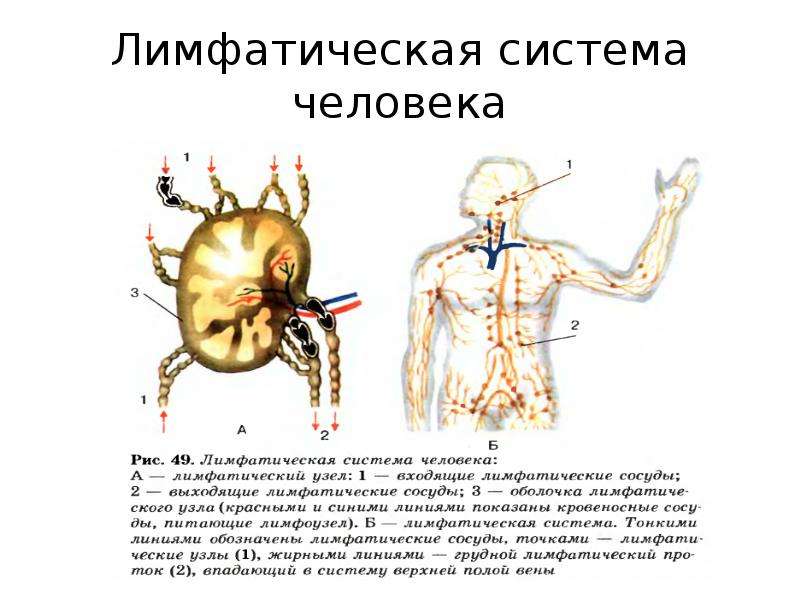
 К другим веществам относятся белки, минералы, жиры, питательные вещества, поврежденные клетки, раковые клетки и чужеродные захватчики (бактерии, вирусы и т. Д.). Лимфа также переносит белые кровяные тельца (лимфоциты), борющиеся с инфекциями.
К другим веществам относятся белки, минералы, жиры, питательные вещества, поврежденные клетки, раковые клетки и чужеродные захватчики (бактерии, вирусы и т. Д.). Лимфа также переносит белые кровяные тельца (лимфоциты), борющиеся с инфекциями.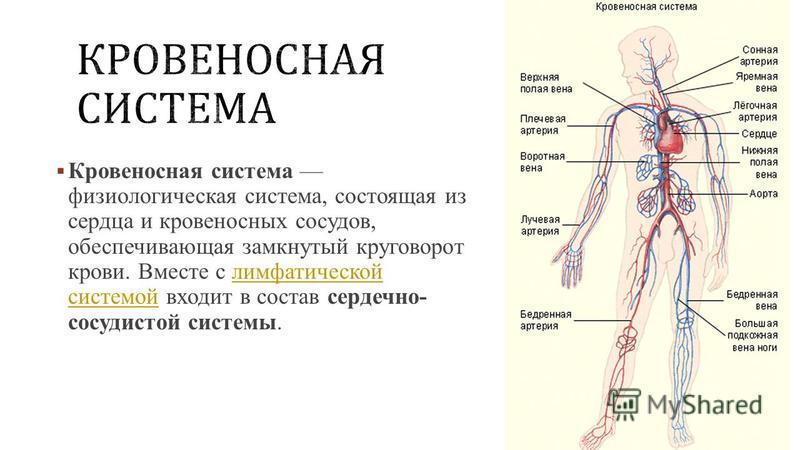 Лимфатические сосуды собирают и фильтруют лимфу (в узлах) по мере того, как она продолжает двигаться к более крупным сосудам, называемым собирающими протоками. Эти сосуды работают так же, как и ваши вены: они работают при очень низком давлении, в них есть ряд клапанов, чтобы жидкость двигалась в одном направлении.
Лимфатические сосуды собирают и фильтруют лимфу (в узлах) по мере того, как она продолжает двигаться к более крупным сосудам, называемым собирающими протоками. Эти сосуды работают так же, как и ваши вены: они работают при очень низком давлении, в них есть ряд клапанов, чтобы жидкость двигалась в одном направлении. Селезенка фильтрует и накапливает кровь и производит лейкоциты, которые борются с инфекцией или болезнью.
Селезенка фильтрует и накапливает кровь и производит лейкоциты, которые борются с инфекцией или болезнью.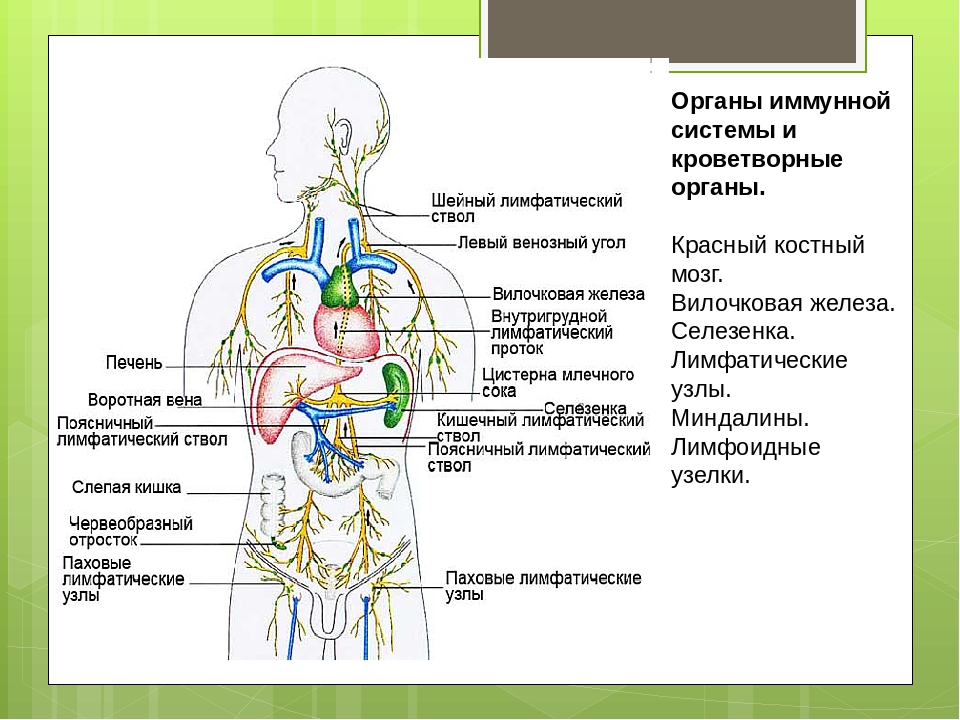 Ученые также полагают, что аппендикс играет роль в размещении «хороших бактерий» и повторном заселении кишечника полезными бактериями после того, как инфекция исчезла.
Ученые также полагают, что аппендикс играет роль в размещении «хороших бактерий» и повторном заселении кишечника полезными бактериями после того, как инфекция исчезла.


 Грудной проток (thuh-RA-sik) проходит через грудную клетку и впадает в кровь через большую вену около левой стороны шеи.
Грудной проток (thuh-RA-sik) проходит через грудную клетку и впадает в кровь через большую вену около левой стороны шеи. Т или Ж?
Т или Ж? Т или Ж?
Т или Ж?
 Основные группы лимфатических узлов расположены в миндалинах, аденоидах, подмышечных впадинах, шее, паху и средостении.
Основные группы лимфатических узлов расположены в миндалинах, аденоидах, подмышечных впадинах, шее, паху и средостении.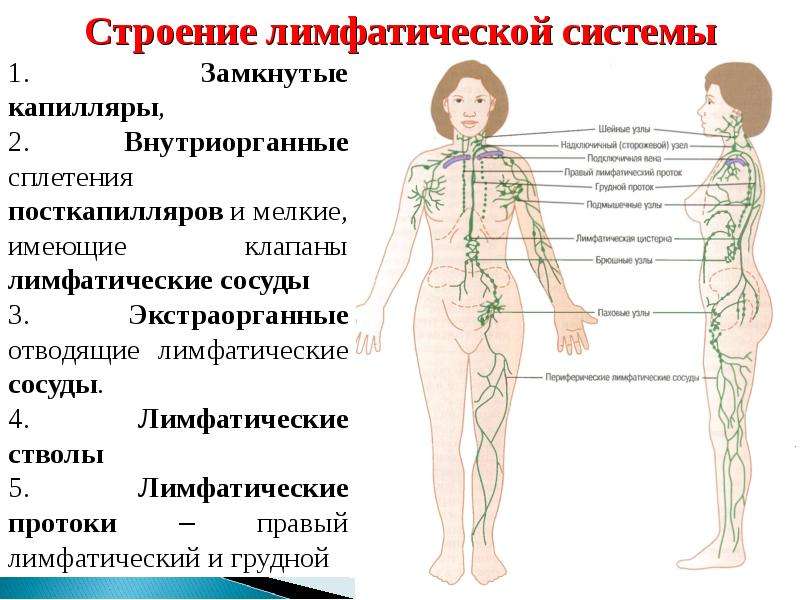 Эти узелки содержат лимфоциты и макрофаги, которые защищают от вторжения бактерий и других патогенов, попадающих в эти проходы вместе с пищей, воздухом или мочой. Эти узелки могут быть одиночными или сгруппированными в кластеры.
Эти узелки содержат лимфоциты и макрофаги, которые защищают от вторжения бактерий и других патогенов, попадающих в эти проходы вместе с пищей, воздухом или мочой. Эти узелки могут быть одиночными или сгруппированными в кластеры.
 Этот процесс приобретенного иммунитета лежит в основе вакцинации. Это важно, потому что бактерии и вирусы постоянно адаптируются и развиваются в «гонке вооружений» с нашей иммунной системой. К особенностям адаптивной иммунной системы относятся:
Этот процесс приобретенного иммунитета лежит в основе вакцинации. Это важно, потому что бактерии и вирусы постоянно адаптируются и развиваются в «гонке вооружений» с нашей иммунной системой. К особенностям адаптивной иммунной системы относятся: Есть много видов лимфоцитов; основными типами являются Т-клетки , В-клетки и естественные клетки-киллеры.Лимфоциты первоначально развиваются в костном мозге . Некоторые мигрируют в тимус, где созревают в Т-клетки; другие созревают в костном мозге как В-клетки.
Есть много видов лимфоцитов; основными типами являются Т-клетки , В-клетки и естественные клетки-киллеры.Лимфоциты первоначально развиваются в костном мозге . Некоторые мигрируют в тимус, где созревают в Т-клетки; другие созревают в костном мозге как В-клетки.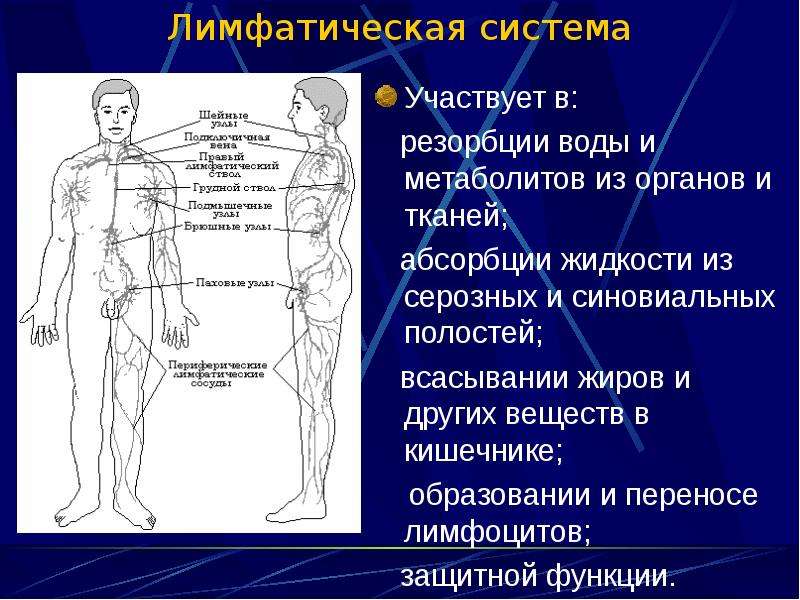
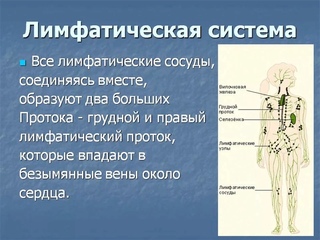 Стероиды и кортикостероиды (компоненты адреналина) подавляют иммунную систему.
Стероиды и кортикостероиды (компоненты адреналина) подавляют иммунную систему. Сторожевой узел удаляется хирургическим путем, и патолог проверяет наличие раковых клеток. БСЛУ чаще всего используется для диагностики рака груди и меланомы. Это менее обширная операция по сравнению со стандартной операцией на лимфатических узлах.
Сторожевой узел удаляется хирургическим путем, и патолог проверяет наличие раковых клеток. БСЛУ чаще всего используется для диагностики рака груди и меланомы. Это менее обширная операция по сравнению со стандартной операцией на лимфатических узлах. Оно характеризуется прогрессирующим безболезненным увеличением лимфатических узлов, селезенки и лимфатической ткани в целом.При лимфоме Ходжкина клетки Рида-Штернберга (особый тип лимфоцитов) становятся аномальными и неконтролируемым образом растут.
Оно характеризуется прогрессирующим безболезненным увеличением лимфатических узлов, селезенки и лимфатической ткани в целом.При лимфоме Ходжкина клетки Рида-Штернберга (особый тип лимфоцитов) становятся аномальными и неконтролируемым образом растут.  Считается, что вирус ВИЧ не является прямой причиной лимфомы, скорее он ослабляет защитные силы организма и может повысить восприимчивость к другим инфекциям, таким как вирусы Эпштейна-Барра и HHV-8, которые связаны с этими типами лимфом.
Считается, что вирус ВИЧ не является прямой причиной лимфомы, скорее он ослабляет защитные силы организма и может повысить восприимчивость к другим инфекциям, таким как вирусы Эпштейна-Барра и HHV-8, которые связаны с этими типами лимфом. 

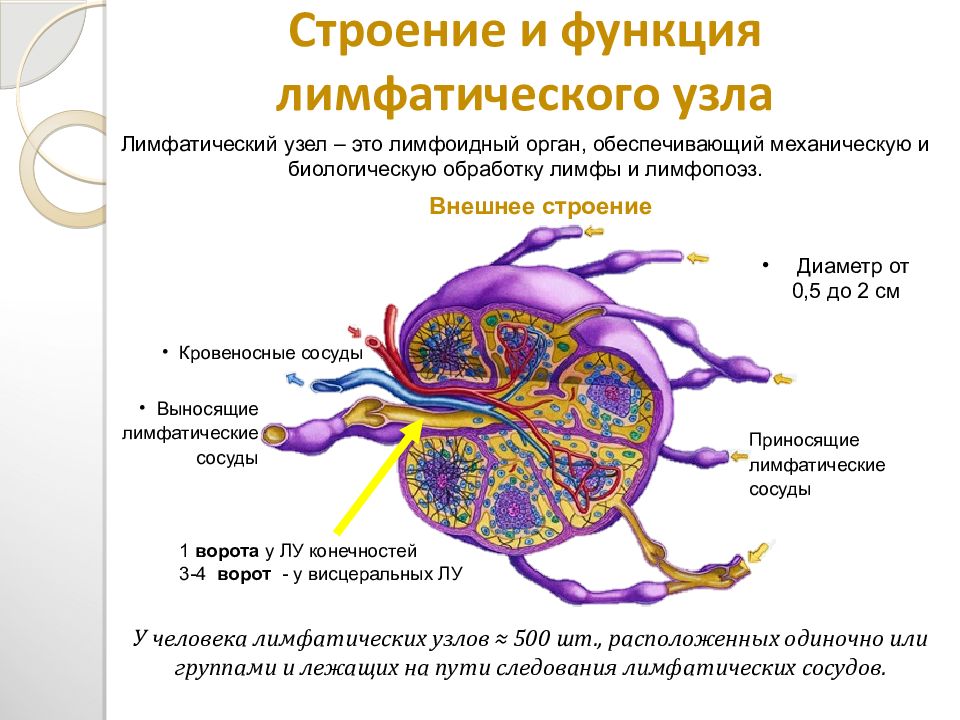
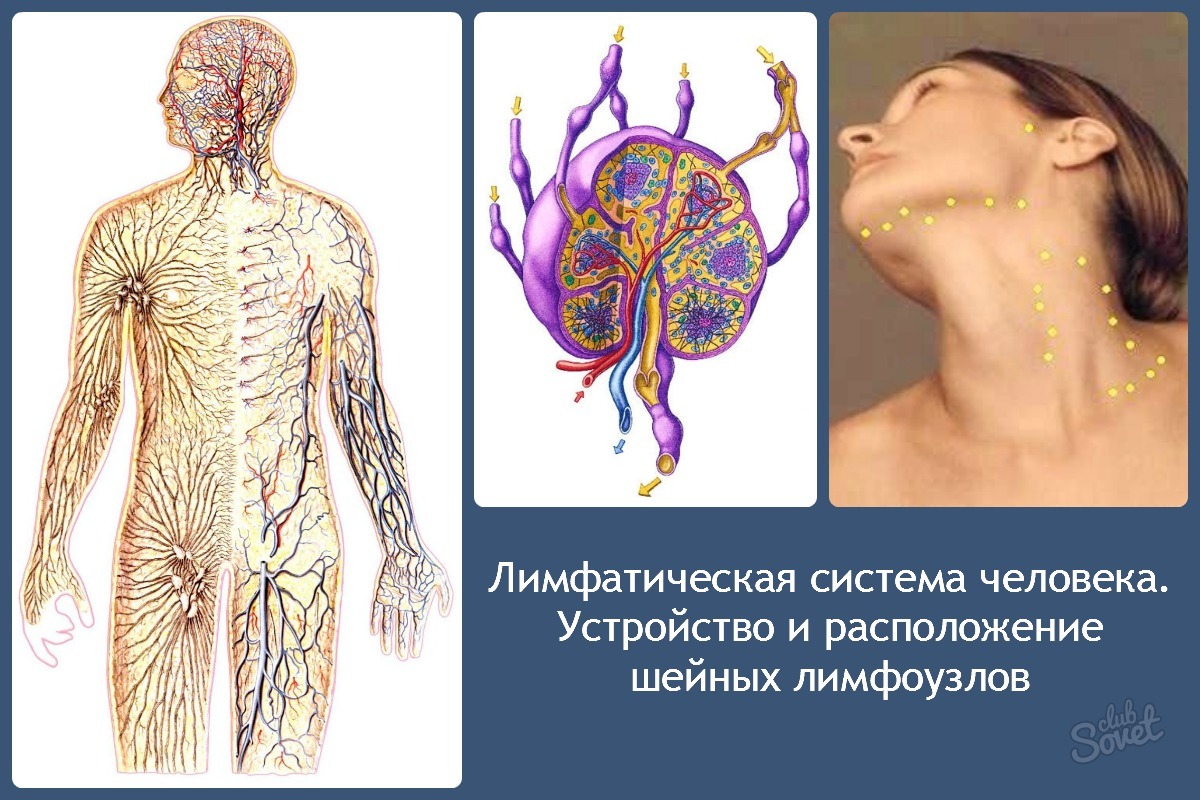 Иммунобиология: иммунная система в здоровье и болезнях.5-е издание. Нью-Йорк: наука о гирляндах; 2001.
Иммунобиология: иммунная система в здоровье и болезнях.5-е издание. Нью-Йорк: наука о гирляндах; 2001.
 Появляется все больше свидетельств того, что лимфатическая система также способствует развитию ряда заболеваний, таких как лимфедема, метастазирование рака и различные воспалительные заболевания.Открытие различных молекулярных маркеров, позволяющих различать кровеносные и лимфатические сосуды, вместе с доступностью все большего числа моделей in vitro, и in vivo, для изучения различных аспектов биологии лимфатической системы, позволило добиться огромного прогресса в исследованиях в области биологии лимфатических сосудов. развитие и функция лимфатической системы. В этом обзоре обсуждаются недавние достижения в нашем понимании эмбрионального развития лимфатической сосудистой сети, молекулярных механизмов, опосредующих лимфангиогенез у взрослых, роли лимфангиогенеза в хроническом воспалении и метастазировании рака лимфатической системы, а также растущей важности лимфатической сосудистой сети как терапевтической мишени. .
Появляется все больше свидетельств того, что лимфатическая система также способствует развитию ряда заболеваний, таких как лимфедема, метастазирование рака и различные воспалительные заболевания.Открытие различных молекулярных маркеров, позволяющих различать кровеносные и лимфатические сосуды, вместе с доступностью все большего числа моделей in vitro, и in vivo, для изучения различных аспектов биологии лимфатической системы, позволило добиться огромного прогресса в исследованиях в области биологии лимфатических сосудов. развитие и функция лимфатической системы. В этом обзоре обсуждаются недавние достижения в нашем понимании эмбрионального развития лимфатической сосудистой сети, молекулярных механизмов, опосредующих лимфангиогенез у взрослых, роли лимфангиогенеза в хроническом воспалении и метастазировании рака лимфатической системы, а также растущей важности лимфатической сосудистой сети как терапевтической мишени. . Будучи второй сосудистой системой, обнаруженной у высших позвоночных, помимо сосудистой сети, она выполняет несколько жизненно важных функций, включая регулирование тканевого давления, иммунный надзор и абсорбцию пищевых жиров в кишечнике. Интерес к фундаментальным исследованиям лимфатической системы был усилен растущими доказательствами того, что лимфатическая система также способствует развитию ряда заболеваний, таких как лимфедема, метастазирование рака и различные воспалительные заболевания.Открытие различных молекулярных маркеров, позволяющих различать кровеносные и лимфатические сосуды, вместе с доступностью все большего числа моделей in vitro, и in vivo, для изучения различных аспектов биологии лимфатической системы, позволило нам добиться огромного прогресса в нашем понимании развитие и функции лимфатической системы.
Будучи второй сосудистой системой, обнаруженной у высших позвоночных, помимо сосудистой сети, она выполняет несколько жизненно важных функций, включая регулирование тканевого давления, иммунный надзор и абсорбцию пищевых жиров в кишечнике. Интерес к фундаментальным исследованиям лимфатической системы был усилен растущими доказательствами того, что лимфатическая система также способствует развитию ряда заболеваний, таких как лимфедема, метастазирование рака и различные воспалительные заболевания.Открытие различных молекулярных маркеров, позволяющих различать кровеносные и лимфатические сосуды, вместе с доступностью все большего числа моделей in vitro, и in vivo, для изучения различных аспектов биологии лимфатической системы, позволило нам добиться огромного прогресса в нашем понимании развитие и функции лимфатической системы. Тканевая жидкость, вероятно, входит в эти начальные лимфатические сосуды между прерывистыми соединениями клеток, напоминающими пуговицу. 2 Через более крупные собирающие лимфатические сосуды и, в конечном итоге, через грудной проток, он возвращается в кровеносную систему через лимфатические и венозные связи на стыке яремной и подключичной вен. В кишечнике специализированные лимфатические сосуды, так называемые млечные сосуды, поглощают пищевые жиры и жирорастворимые витамины, чтобы транспортировать их в венозную систему кровообращения.В отличие от кровеносной системы, лимфатическая система не имеет центрального насоса, вместо этого лимфа перемещается вперед за счет действия скелетных мышц, дыхательного движения и сокращения гладких мышц в стенках собирающих лимфатических сосудов.
Тканевая жидкость, вероятно, входит в эти начальные лимфатические сосуды между прерывистыми соединениями клеток, напоминающими пуговицу. 2 Через более крупные собирающие лимфатические сосуды и, в конечном итоге, через грудной проток, он возвращается в кровеносную систему через лимфатические и венозные связи на стыке яремной и подключичной вен. В кишечнике специализированные лимфатические сосуды, так называемые млечные сосуды, поглощают пищевые жиры и жирорастворимые витамины, чтобы транспортировать их в венозную систему кровообращения.В отличие от кровеносной системы, лимфатическая система не имеет центрального насоса, вместо этого лимфа перемещается вперед за счет действия скелетных мышц, дыхательного движения и сокращения гладких мышц в стенках собирающих лимфатических сосудов. К ним относятся лимфатические узлы, тимус, миндалины, селезенка и пятна Пейера, и они имеют решающее значение для иммунной функции лимфатической системы. Иммунные клетки, такие как лимфоциты и антигенпрезентирующие дендритные клетки, транспортируются по лимфатическим сосудам от кожи и других органов к региональным лимфатическим узлам, где инициируются специфические иммунные ответы.
К ним относятся лимфатические узлы, тимус, миндалины, селезенка и пятна Пейера, и они имеют решающее значение для иммунной функции лимфатической системы. Иммунные клетки, такие как лимфоциты и антигенпрезентирующие дендритные клетки, транспортируются по лимфатическим сосудам от кожи и других органов к региональным лимфатическим узлам, где инициируются специфические иммунные ответы. 4
4  9 У птиц и лягушек Xenopus, однако, части лимфатической системы происходят из соседних вен, в то время как другие, вероятно, происходят из местных лимфангиобластов, что обеспечивает поддержку центростремительной модели лимфатического развития. 10–12 Могут ли и как лимфангиобласты также вносить вклад в эмбриональный лимфангиогенез у млекопитающих, остается неизвестным. Доказательства существования лимфангиобластов также у млекопитающих получены на эмбриоидных телах мышей. В этих трехмерных структурах, происходящих из эмбриональных стволовых клеток, LECs, кажется, не только отпочковываются от ранее существовавших структур, подобных кровеносным сосудам, но также были обнаружены вдали от сосудистых областей, куда они могли либо мигрировать, либо развиться локально из лимфатических сосудов. прародители. 13,14 Кроме того, рассеянные мезенхимальные клетки, экспрессирующие лейкоцитарный маркер CD45, панэндотелиальный маркер CD31 и лимфатические эндотелиальные маркеры Prox1 и LYVE-1, недавно наблюдались у эмбрионов мышей и предположительно являются предшественниками лимфэндотелия, способными интегрироваться в растущие лимфатические сосуды.
9 У птиц и лягушек Xenopus, однако, части лимфатической системы происходят из соседних вен, в то время как другие, вероятно, происходят из местных лимфангиобластов, что обеспечивает поддержку центростремительной модели лимфатического развития. 10–12 Могут ли и как лимфангиобласты также вносить вклад в эмбриональный лимфангиогенез у млекопитающих, остается неизвестным. Доказательства существования лимфангиобластов также у млекопитающих получены на эмбриоидных телах мышей. В этих трехмерных структурах, происходящих из эмбриональных стволовых клеток, LECs, кажется, не только отпочковываются от ранее существовавших структур, подобных кровеносным сосудам, но также были обнаружены вдали от сосудистых областей, куда они могли либо мигрировать, либо развиться локально из лимфатических сосудов. прародители. 13,14 Кроме того, рассеянные мезенхимальные клетки, экспрессирующие лейкоцитарный маркер CD45, панэндотелиальный маркер CD31 и лимфатические эндотелиальные маркеры Prox1 и LYVE-1, недавно наблюдались у эмбрионов мышей и предположительно являются предшественниками лимфэндотелия, способными интегрироваться в растущие лимфатические сосуды. . 15
. 15  AM , адреномедуллин; Ang , ангиопоэтин; Angptl , ангиопоэтин-подобный белок; E , эмбриональный день мыши; FGF , фактор роста фибробластов; GH , гормон роста; HGF , фактор роста гепатоцитов; IGF , инсулиноподобный фактор роста; Nrp2 , нейропилин-2; PDGF , фактор роста тромбоцитов; VEGF , фактор роста эндотелия сосудов.
AM , адреномедуллин; Ang , ангиопоэтин; Angptl , ангиопоэтин-подобный белок; E , эмбриональный день мыши; FGF , фактор роста фибробластов; GH , гормон роста; HGF , фактор роста гепатоцитов; IGF , инсулиноподобный фактор роста; Nrp2 , нейропилин-2; PDGF , фактор роста тромбоцитов; VEGF , фактор роста эндотелия сосудов.