Массовая доля какого элемента в белках наибольшая: подскажите ответы на тест по химии по теме белки 2 вариант
подскажите ответы на тест по химии по теме белки 2 вариант
подскажите ответы на тест по химии по теме белки 2 вариант — Умные вопросы Массовая доля какого элемента в белках наибольшая?А) Углерода В) Кислорода
Б) Водорода Г) Азота
А2. Укажите, к какой группе веществ относится гемоглобин:
А) Аминокислоты В) Моносахариды
Б) Белки Г) Полисахариды
А3. Свертывание спирали в клубок-«глобулу» характеризует:
А) Первичную структуру белка В) Третичную структуру белка
Б) Вторичную структуру белка Г) Четвертичную структуру белка
А4. При горении белков ощущается запах:
А) Тухлых яиц В) Аммиака
Б) Жженого пера (рога) Г) Горелой резины
А5. Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих:
А) Группу -SH В) Бензольное кольцо
Б) Гидроксильную группу Г) Альдегидную группу
 Белки, защищающие от проникающих в клетку бактерий:
Белки, защищающие от проникающих в клетку бактерий: А) Гемоглобин В) Ферменты
Б) Антитела Г) Антитоксины
Часть Б
Б1. Белки можно обнаружить:
А) Ксантопротеиновой реакцией Г) С помощью перманганата калия
Б) Действием индикатора Д) С помощью биуретовой реакции
В) По появлению запаха при сжигании Е) С помощью реакции «серебряного зеркала»
Б2. Какие утверждения о белках верны?
А) Белки гидролизуются до аминов
Б) В макромолекуле белка присутствуют пептидные связи
В) При гидролизе белков образуются аминокислоты
Г) В макромолекуле белков присутствуют водородные связи
Е) Основная функция белков в организме — энергетическая 9 годов назад от Аня Мажарова
https://www.lintastour.ru как выбрать детский летний лагерь.
1 ответ
Массовая доля какого элемента в белках наибольшая?А) Углерода
А2.
 Укажите, к какой группе веществ относится гемоглобин:
Укажите, к какой группе веществ относится гемоглобин: Б) Белки
А3. Свертывание спирали в клубок-«глобулу» характеризует:
В) Третичную структуру белка
А4. При горении белков ощущается запах:
Б) Жженого пера (рога)
А5. Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих:
В) Бензольное кольцо
А6. Белки, защищающие от проникающих в клетку бактерий:
Б) Антитела
Часть Б
Б1. Белки можно обнаружить:
А) Ксантопротеиновой реакцией
Д) С помощью биуретовой реакции
В) По появлению запаха при сжигании
Б2. Какие утверждения о белках верны?
Б) В макромолекуле белка присутствуют пептидные связи
В) При гидролизе белков образуются аминокислоты
Г) В макромолекуле белков присутствуют водородные связи 9 годов назад от екатерина елифанкина
Связанные вопросы
1 ответ
6 годов назад от Корлик Малкин2 ответов
9 годов назад от Николаев Александр2 ответов
4 годов назад от Сергей Пантелеев| 1. В молекуле белка содержится один атом серы и массовая доля серы в белке 0,32%. Вычислите значение молярной массы (г/моль) белка: | |
| 2. Качественной реакцией на белки является взаимодействие с: | |
| 3. Денатурация белков происходит под действием: | |
| б) хлорида натрия | |
| в) хлорида ртути | г) карбоната кальция |
| 4. Качественной реакцией на белки является взаимодействие с: | |
5.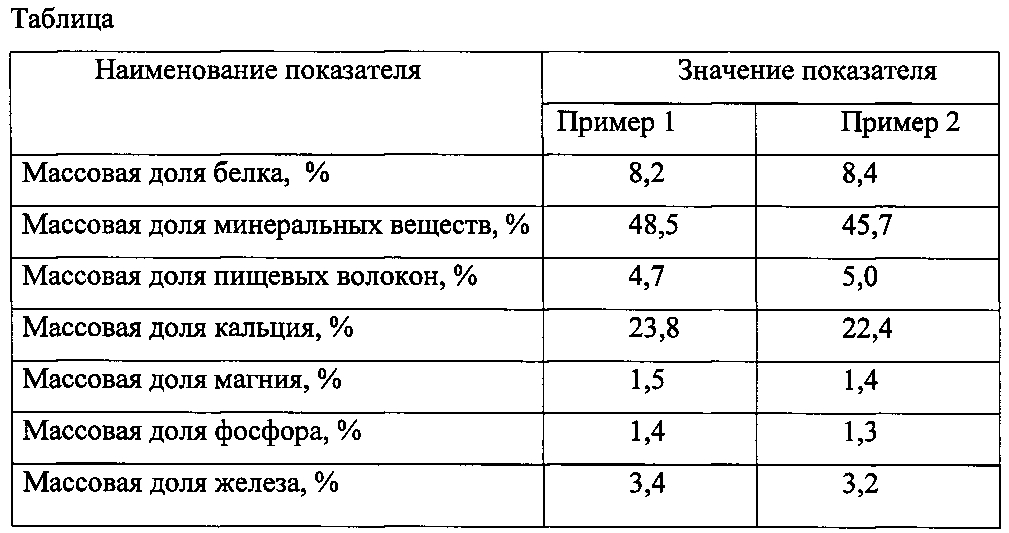 Массовая доля какого элемента в
белках наибольшая: Массовая доля какого элемента в
белках наибольшая: | |
| 6. Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих: | |
| а) бензольное кольцо | б) гидроксильную группу |
| в) альдегидную группу | г) аминогруппу |
| 7. Белки можно обнаружить: | |
| а) ксантопротеиновой реакцией | б) действием индикатора |
| в) с помощью перманганата калия | г) действием щелочи |
8. Какие утверждения о
белках верны? Какие утверждения о
белках верны? | |
| а) в макромолекуле белка присутствуют пептидные связи | б) при гидролизе белков образуются аминокислоты |
| в) в макромолекуле белков присутствуют водородные связи | г) все ответы верны |
| 9. При горении белков ощущается запах: | |
| в) жженого пера | г) горелой резины |
| 10. Укажите, к какой группе веществ относится гемоглобин: | |
| а) аминокислоты | б) моносахариды |
| г) полисахариды | |
Тест » Білки» – «На Урок»
Запитання 1
Структурным звеном белков являются:
Аминокислоты
Запитання 2
Образование спирали характеризует:
варіанти відповідей
Первичную структуру белка
Вторичную структуру белка
Третичную структуру белка
Четвертичную структуру белка
Запитання 3
Действие каких факторов вызывает необратимую денатурацию белка?
варіанти відповідей
Взаимодействие с растворами солей свинца, железа, ртути
Воздействие на белок концентрированным раствором азотной кислоты
Сильное нагревание
Все перечисленные факторы верны
Запитання 4
Белки, выполняющие каталитическую функцию, называются:
варіанти відповідей
Запитання 5
В полимерной цепи белков соседние остатки
аминокислот связаны друг с другом … связью.
варіанти відповідей
сложноэфирной
Запитання 6
варіанти відповідей
Построены из остатков аминокислот
Содержат в своем составе только Карбон, Гидроген и Оксиген
Гидролизуются в кислотной и щелочной среде
Способны к денатурации
Являются полисахаридами
Являются природными полимерами
Запитання 7
Иногда белок может утратить свою структурную организацию. Это называется денатурацией белка. Каковы некоторые причины денатурации?
варіанти відповідей
повышение температуры
воздействие света
действие кислот и щелочей
Запитання 8
Какие из перечисленных веществ являются белками?
варіанти відповідей
Запитання 9
Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих:
варіанти відповідей
Гидроксильную группу
Бензольное кольцо
Альдегидную группу
Запитання 10
Какие утверждения о белках верны?
варіанти відповідей
Белки гидролизуются до аминов
В макромолекуле белка присутствуют пептидные связи
При гидролизе белков образуются аминокислоты
В макромолекуле белков присутствуют водородные связи
С азотной кислотой белки дают черное окрашивание
Основная функция белков в организме — энергетическая
Запитання 11
Для проведения ксантопротеиновой реакции потребуется реагент:
варіанти відповідей
Запитання 12
Схема строения какой молекулы изображена на рисунке?
варіанти відповідей
вторичная структура белка
вторичная структура ДНК
третичная структура белка
четвертичная структура ДНК
Запитання 13
Массовая доля какого элемента в молекуле белка наибольшая?
варіанти відповідей
Запитання 14
Сколько из известных аминокислот участвуют в синтезе белка:
варіанти відповідей
Запитання 15
При нагревании белков в растворах кислот и щелочей происходит:
варіанти відповідей
Образование четвертичной структуры
Цветная реакция на белки
Образование пептидных связей
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
| 1. |
Химические элементы клетки
Сложность: лёгкое |
2 |
| 2. |
Гидрофильные и гидрофобные вещества
Сложность: лёгкое |
2 |
3.
|
Структура молекулы белка
Сложность: лёгкое |
2 |
| 4. |
Ускорители процессов в клетке
Сложность: среднее |
3 |
5.
|
Углеводы и липиды
Сложность: среднее |
3 |
| 6. |
Роль воды в клетке
Сложность: среднее |
3 |
7.
|
Нуклеиновые кислоты
Сложность: лёгкое |
1 |
| 8. |
Нуклеотиды
Сложность: среднее |
3 |
9.
|
Роль минеральных веществ в клетке
Сложность: среднее |
3 |
| 10. |
Мономеры органических веществ
Сложность: сложное |
3 |
Азот — обзор | ScienceDirect Topics
Реактивный кислород и азот
Макрофаги, нейтрофилы и другие фагоциты генерируют токсичные интермедиаты активного кислорода (ROI) и интермедиаты реактивного азота (RNI), которые непосредственно убивают патогены. ROI и RNI также служат молекулами передачи сигнала, которые регулируют экспрессию воспалительных генов.
ROI и RNI также служат молекулами передачи сигнала, которые регулируют экспрессию воспалительных генов.
Эти молекулы также могут оказывать вредное воздействие на нормальные ткани, повреждая ДНК, окисляя липиды мембран и нитрозилируя белки.Высвобождение реактивных промежуточных соединений может быть инициировано микробными продуктами, воспалительными цитокинами и взаимодействием рецепторов Fc с помощью IgG. Эти события вызывают транслокацию нескольких цитозольных белков, в том числе Rac2 и гуанозинтрифосфатазы Rho-семейства (GTPase), в мембраносвязанный комплекс, несущий цитохром c, , с последующей активацией восстановленной никотинамидадениндинуклеотидфосфатной (NADPH) оксидазы. Реакция, катализируемая НАДФН-оксидазой, приводит к образованию супероксида, который, в свою очередь, увеличивает содержание пероксида водорода, гидроксильных радикалов и анионов, хлорноватистой кислоты и хлораминов.
ROI могут непосредственно способствовать инициированию хронического заболевания. При окислении липидов образуются альдегиды, которые замещают остатки лизина в аполипопротеине В-100. Этот измененный фрагмент либо связывается с TLR2, чтобы вызвать продукцию цитокинов, либо интернализуется макрофагами, что приводит к образованию пенистых клеток и жировых полос, первичных поражений атеросклероза. Впоследствии измененные эпитопы в поврежденных белках хозяина могут быть представлены Т-клеткам для инициации адаптивного иммунного ответа, который усиливает воспалительное поражение сосудов.
При окислении липидов образуются альдегиды, которые замещают остатки лизина в аполипопротеине В-100. Этот измененный фрагмент либо связывается с TLR2, чтобы вызвать продукцию цитокинов, либо интернализуется макрофагами, что приводит к образованию пенистых клеток и жировых полос, первичных поражений атеросклероза. Впоследствии измененные эпитопы в поврежденных белках хозяина могут быть представлены Т-клеткам для инициации адаптивного иммунного ответа, который усиливает воспалительное поражение сосудов.
Синтазы оксида азота (NOS) превращают аргинин и молекулярный кислород в цитруллин и оксид азота (NO). Существует три изоформы NOS: NOS нейронов (ncNOS или NOS1) и NOS эндотелиальных клеток (ecNOS или NOS3) экспрессируются конститутивно, тогда как NOS макрофагов (macNOS, iNOS или NOS2) индуцируется провоспалительными цитокинами, вирусными продуктами, микробами, низкое напряжение кислорода и низкий рН окружающей среды.
Глобальная масса и средний показатель rubisco
Значение
Rubisco часто называют самым распространенным белком на Земле, однако количественные данные, подтверждающие оценку его глобальной массы, недостаточны. Здесь мы приводим надежную и подробную оценку глобальной массы Rubisco, которая на порядок больше, чем предыдущие оценки. Мы используем эту оценку для получения средней по времени скорости наземного и морского Rubisco и показываем, что они, соответственно, в 100 и 7 раз ниже, чем измеренные in vitro k cat Rubisco при 25 °C.
Здесь мы приводим надежную и подробную оценку глобальной массы Rubisco, которая на порядок больше, чем предыдущие оценки. Мы используем эту оценку для получения средней по времени скорости наземного и морского Rubisco и показываем, что они, соответственно, в 100 и 7 раз ниже, чем измеренные in vitro k cat Rubisco при 25 °C.
Abstract
Фотосинтетическая ассимиляция углерода обеспечивает накопление энергии в живом мире и производит большую часть биомассы в биосфере.Rubisco (d-рибулозо-1,5-бисфосфаткарбоксилаза/оксигеназа) отвечает за подавляющее большинство глобальной фиксации углерода и считается самым распространенным белком на Земле. Здесь мы приводим обновленную и точную оценку общей массы Рубиско на Земле, заключая, что она составляет ≈0,7 Гт, что более чем на порядок выше, чем считалось ранее. Мы обнаружили, что >90% ферментов Rubisco находятся в ≈2 × 10 14 m 2 листьев наземных растений, и что Rubisco составляет ≈3% от общей массы листьев, которую мы оцениваем в ≈ 30 Гт сухой массы. Мы используем нашу оценку общей массы Рубиско, чтобы получить эффективную усредненную по времени каталитическую скорость Рубиско, равную ≈0,03 с –1 на суше и ≈0,6 с –1 в океане. По сравнению с максимальной каталитической скоростью, наблюдаемой in vitro при 25 °C, эффективная скорость в дикой природе примерно в 100 раз медленнее на суше и в семь раз медленнее в океане. Более низкая температура окружающей среды и отсутствие работы Rubisco в ночное время могут объяснить большую часть отличий от лабораторных условий в океане, но не на суше, где требуется количественная оценка многих других факторов в глобальном масштабе.Наш анализ помогает заострить резкое различие между лабораторной и дикой средой, а также между наземной и морской средой.
Мы используем нашу оценку общей массы Рубиско, чтобы получить эффективную усредненную по времени каталитическую скорость Рубиско, равную ≈0,03 с –1 на суше и ≈0,6 с –1 в океане. По сравнению с максимальной каталитической скоростью, наблюдаемой in vitro при 25 °C, эффективная скорость в дикой природе примерно в 100 раз медленнее на суше и в семь раз медленнее в океане. Более низкая температура окружающей среды и отсутствие работы Rubisco в ночное время могут объяснить большую часть отличий от лабораторных условий в океане, но не на суше, где требуется количественная оценка многих других факторов в глобальном масштабе.Наш анализ помогает заострить резкое различие между лабораторной и дикой средой, а также между наземной и морской средой.
Совместное действие фотосинтетического механизма и цикла фиксации углерода Кальвина-Бенсона контролирует глобальный углеродный цикл и производит подавляющее большинство органического углерода, присутствующего в биосфере (1). Фиксация атмосферного CO 2 в цикле Кальвина-Бенсона обеспечивается активностью фермента Рубиско, который как таковой играет ключевую роль в глобальном углеродном цикле.Почти 40 лет назад, вскоре после открытия Rubisco, Эллис назвал его самым распространенным белком на Земле (2). Это утверждение было получено всего в одном абзаце гораздо более длинной статьи, подробно описывающей роль Rubisco в первичной продуктивности, основанной на фиксации углерода в земной среде и числе оборотов фермента Rubisco, измеренном в лаборатории.
Фиксация атмосферного CO 2 в цикле Кальвина-Бенсона обеспечивается активностью фермента Рубиско, который как таковой играет ключевую роль в глобальном углеродном цикле.Почти 40 лет назад, вскоре после открытия Rubisco, Эллис назвал его самым распространенным белком на Земле (2). Это утверждение было получено всего в одном абзаце гораздо более длинной статьи, подробно описывающей роль Rubisco в первичной продуктивности, основанной на фиксации углерода в земной среде и числе оборотов фермента Rubisco, измеренном в лаборатории.
Краткий анализ, проведенный Эллисом, помог подчеркнуть важную роль Rubisco в окружающей среде, а также возможности использования расчетов на обратной стороне конверта в качестве инструмента для оценки изобилия белков в биосфере.Однако фактическая надежность этой оценки неясна. Чтобы продемонстрировать неопределенность, связанную с оценкой общей массы Рубиско, отметим, что Эллис получил примерно 0,04 гигатонны (Gt = 10 15 г) белка. Это можно сравнить с коллагеном, наиболее распространенным белком в организме человека, на долю которого приходится ≈30% от ≈10 кг общей белковой массы взрослого человека (3, 4). Коллаген содержится не только в организме человека, но и в домашнем скоте. Учитывая коллаген, присутствующий в домашнем скоте, мы приходим к общей массе коллагена ≈0.05 Гт, что превышает общую массу, указанную для Rubisco. Кроме того, мы отмечаем, что первоначальная оценка Эллиса не учитывала фиксацию углерода в морской среде, что подтверждает поток, аналогичный наземной фиксации углерода (5).
Это можно сравнить с коллагеном, наиболее распространенным белком в организме человека, на долю которого приходится ≈30% от ≈10 кг общей белковой массы взрослого человека (3, 4). Коллаген содержится не только в организме человека, но и в домашнем скоте. Учитывая коллаген, присутствующий в домашнем скоте, мы приходим к общей массе коллагена ≈0.05 Гт, что превышает общую массу, указанную для Rubisco. Кроме того, мы отмечаем, что первоначальная оценка Эллиса не учитывала фиксацию углерода в морской среде, что подтверждает поток, аналогичный наземной фиксации углерода (5).
Цель настоящей работы состояла в том, чтобы использовать независимую методологию для построения точной оценки общей массы Рубиско во всем мире. Мы обнаружили, что глобальная масса Rubisco составляет ≈0,7 Гт, что более чем на порядок превышает предыдущую оценку, сообщенную Эллисом.Мы используем эту независимую оценку, чтобы исследовать среднюю глобальную скорость Rubisco и обнаружили, что в земной среде это соответствует ≈1% его характеристики k cat .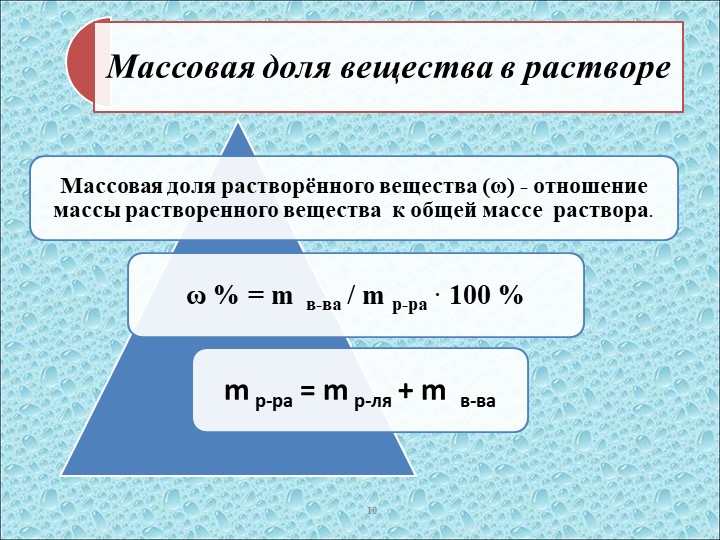
Результаты
Для оценки общей массы белков Rubisco мы оценили общую массу наземных и морских белков Rubisco отдельно (рис. 1). Для наземного Rubisco мы используем двухэтапный подход. Сначала мы оцениваем глобальную сухую массу листьев. Затем мы оцениваем характеристическую массовую долю Рубиско в этой сухой массе.Перемножая эти два компонента, мы получаем оценку общей массы Рубиско, как показано на Рис. 1.
Рис. 1.Схематическое изображение нашей методики оценки массы Рубиско. Наша методология оценки массы наземного RuBisco состоит из двух частей: оценка общей массы листьев и оценка средней массовой доли RuBisco из массы сухих листьев. Наша методика оценки массы морского RuBisco основана на оценке общей биомассы морских автотрофов, а также на отчетах о доле RuBisco в сухом весе автотрофов.
Оценка общей массы листьев в глобальном масштабе.
Чтобы оценить глобальную массу листьев, мы полагаемся на два независимых метода. Первый метод возникает из оценки общей биомассы наземных растений (6). Эта оценка ≈450 Гт углерода соответствует ≈900 Гт сухого веса при условии содержания углерода ≈40–50% в сухом весе (7). Чтобы преобразовать этот общий сухой вес растений в общую массу листьев, мы используем метаанализ массовой доли различных растительных компартментов в разных биомах (8, 9).Мы используем среднюю долю массы листьев по биомам, взвешенную по доле биомассы растений в каждом биоме (10) (шаг 1 на рис. 1). В целом, этот подход дает оценку ≈50 Гт сухой массы листьев, что составляет ≈6% от общей массы растений (полный расчет на https://bit.ly/2RYH74k).
Эта оценка ≈450 Гт углерода соответствует ≈900 Гт сухого веса при условии содержания углерода ≈40–50% в сухом весе (7). Чтобы преобразовать этот общий сухой вес растений в общую массу листьев, мы используем метаанализ массовой доли различных растительных компартментов в разных биомах (8, 9).Мы используем среднюю долю массы листьев по биомам, взвешенную по доле биомассы растений в каждом биоме (10) (шаг 1 на рис. 1). В целом, этот подход дает оценку ≈50 Гт сухой массы листьев, что составляет ≈6% от общей массы растений (полный расчет на https://bit.ly/2RYH74k).
Наш второй подход к оценке глобальной массы листьев основан на первой оценке общей площади листьев на суше, а затем преобразовании ее в массу с использованием оценки массы листьев на единицу площади листа (этап 4 на рис.1). Чтобы оценить общую площадь листьев, мы полагаемся как на полевые измерения (11), так и на данные дистанционного зондирования (12) индекса площади листьев (LAI = общая площадь листьев на единицу площади суши) по всему земному шару. (Подробности о построении карт LAI приведены в Methods .) Таким образом, мы создаем две карты площади листьев, одну на основе полевых измерений LAI, а другую на основе дистанционного зондирования LAI. Мы суммируем площади листьев по всей земной поверхности Земли и получаем две независимые оценки глобальной площади листьев.В качестве наилучшей оценки мы используем среднее геометрическое двух оценок (шаг 2 на рис. 1), которое составляет ≈2 × 10 14 м 2 (https://bit.ly/2GtzbkN). Это эквивалентно 200 × 10 6 км 2 , или примерно в два раза превышает глобальную свободную ото льда площадь суши. Мы используем две наши независимые оценки общей площади листьев (одна основана на дистанционном зондировании, а другая на основе наземных измерений) для оценки неопределенности, связанной с нашей оценкой общей массы листьев (https://bit.ly/2WnDxzr). Мы прогнозируем неопределенность (близкую к 95% мультипликативному доверительному интервалу) приблизительно в два раза ( Методы ).
(Подробности о построении карт LAI приведены в Methods .) Таким образом, мы создаем две карты площади листьев, одну на основе полевых измерений LAI, а другую на основе дистанционного зондирования LAI. Мы суммируем площади листьев по всей земной поверхности Земли и получаем две независимые оценки глобальной площади листьев.В качестве наилучшей оценки мы используем среднее геометрическое двух оценок (шаг 2 на рис. 1), которое составляет ≈2 × 10 14 м 2 (https://bit.ly/2GtzbkN). Это эквивалентно 200 × 10 6 км 2 , или примерно в два раза превышает глобальную свободную ото льда площадь суши. Мы используем две наши независимые оценки общей площади листьев (одна основана на дистанционном зондировании, а другая на основе наземных измерений) для оценки неопределенности, связанной с нашей оценкой общей массы листьев (https://bit.ly/2WnDxzr). Мы прогнозируем неопределенность (близкую к 95% мультипликативному доверительному интервалу) приблизительно в два раза ( Методы ).
Чтобы преобразовать общую площадь листьев в общую массу листьев, мы умножаем нашу оценку глобальной площади листьев на оценку массы листьев на единицу площади. Мы полагаемся на две отдельные процедуры для расчета массы листьев на единицу площади. Первая процедура опирается на глобальную базу данных признаков растений (13), а вторая опирается на недавно созданную карту распределения признаков растений (14).Объединение этих двух источников данных (этап 3 на рис. 1; подробно в Methods ) дает оценку ≈100 г сухого веса на квадратный метр площади листа (https://bit.ly/2Tjx8Dq). Умножая среднюю массу листьев на площадь листьев на общую площадь листьев (этап 4 на рис. 1), мы получаем оценку ≈20 Гт для глобальной массы листьев (https://bit.ly/2Tjx8Dq). . Это значение также включает сельскохозяйственные культуры, которые составляют относительно небольшую долю (≈2%) биомассы растений из-за их высокой скорости оборота по сравнению с деревьями (6).
Наши два метода оценки массы листьев основаны на независимых наборах данных, каждый со своими предположениями и оговорками. Таким образом, относительно небольшая разница между методом массовой доли листа (50 Гт) и методом площади листа (20 Гт) для оценки глобальной массы листьев предполагает относительную надежность нашей оценки. В качестве наилучшей оценки общей массы листьев мы используем среднее геометрическое оценок обоих подходов (шаг 5 на рис. 1), соответствующее ≈30 Гт.Мы используем две наши независимые оценки для оценки неопределенности, связанной с нашей оценкой общей массы листа. Мы прогнозируем, что неопределенность (близкая к 95% мультипликативному доверительному интервалу) будет примерно двукратной (https://bit.ly/2RpopxC).
Таким образом, относительно небольшая разница между методом массовой доли листа (50 Гт) и методом площади листа (20 Гт) для оценки глобальной массы листьев предполагает относительную надежность нашей оценки. В качестве наилучшей оценки общей массы листьев мы используем среднее геометрическое оценок обоих подходов (шаг 5 на рис. 1), соответствующее ≈30 Гт.Мы используем две наши независимые оценки для оценки неопределенности, связанной с нашей оценкой общей массы листа. Мы прогнозируем, что неопределенность (близкая к 95% мультипликативному доверительному интервалу) будет примерно двукратной (https://bit.ly/2RpopxC).
Оценка массовой доли белков РБФК/О в сухой массе листа.
Далее мы оцениваем среднюю долю РБФК/О в общей массе листа (выделено красным на рис. 1). Мы полагаемся на недавний метаанализ, который охарактеризовал несколько физиологических параметров самых разных видов растений (15).Мы дополняем этот набор данных данными о видах растений С4 (13, 16⇓⇓–19). Первым параметром, который мы используем для нашего анализа, является количество азота в Рубиско на единицу азота листа. Мы конвертируем количество азота в Рубиско на единицу азота листа в общую массу Рубиско на единицу листового азота, используя тот факт, что, как и в других белках, азот составляет ≈15% от общей массы Рубиско (20). Второй параметр, который мы используем, это концентрация азота в листьях. Перемножая эти два числа, получаем оценку массы Рубиско на единицу массы сухого листа (шаг 6 на рис.1). Наш набор данных содержит измерения для древесных растений, а также травянистых растений C3 и C4. Для каждого из них мы рассчитываем среднее геометрическое массовой доли RuBisco в сухой массе листьев. По нашим оценкам, на Rubisco приходится ≈2% массы сухих листьев у древесных растений, ≈5% массы сухих листьев у травянистых растений С3 и ≈1% массы сухих листьев у травянистых растений С4. По нашим оценкам, листья древесных растений составляют ≈70%, листья травянистых растений С3 составляют ≈20%, а листья травянистых растений С4 составляют ≈10% от общей массы листьев ( Методы ).Наносим характеристическую долю каждой формы роста на ее долю от общей массы листа.
Мы конвертируем количество азота в Рубиско на единицу азота листа в общую массу Рубиско на единицу листового азота, используя тот факт, что, как и в других белках, азот составляет ≈15% от общей массы Рубиско (20). Второй параметр, который мы используем, это концентрация азота в листьях. Перемножая эти два числа, получаем оценку массы Рубиско на единицу массы сухого листа (шаг 6 на рис.1). Наш набор данных содержит измерения для древесных растений, а также травянистых растений C3 и C4. Для каждого из них мы рассчитываем среднее геометрическое массовой доли RuBisco в сухой массе листьев. По нашим оценкам, на Rubisco приходится ≈2% массы сухих листьев у древесных растений, ≈5% массы сухих листьев у травянистых растений С3 и ≈1% массы сухих листьев у травянистых растений С4. По нашим оценкам, листья древесных растений составляют ≈70%, листья травянистых растений С3 составляют ≈20%, а листья травянистых растений С4 составляют ≈10% от общей массы листьев ( Методы ).Наносим характеристическую долю каждой формы роста на ее долю от общей массы листа. В целом, по нашим оценкам, на Rubisco приходится ≈2,5% общей массы листьев (рис. 2) (что на основе растворимого белка соответствует нескольким десяткам процентов, измеренным в литературе). Объединив наши оценки глобальной массы листа и массовой доли RuBisco в листьях (шаг 7 на рис. 1), мы оцениваем, что общая масса земного RuBisco составляет ≈0,7 Гт (https://bit.ly/2UssG5A).Мы распространяем наши неопределенности для каждого параметра, используемого для оценки общей массы Рубиско, чтобы оценить неопределенность, связанную с нашей наилучшей оценкой массы земного Рубиско. Мы прогнозируем примерно трехкратную неопределенность, связанную с нашей оценкой глобальной массы Rubisco (https://bit.ly/2Ust9ES).
В целом, по нашим оценкам, на Rubisco приходится ≈2,5% общей массы листьев (рис. 2) (что на основе растворимого белка соответствует нескольким десяткам процентов, измеренным в литературе). Объединив наши оценки глобальной массы листа и массовой доли RuBisco в листьях (шаг 7 на рис. 1), мы оцениваем, что общая масса земного RuBisco составляет ≈0,7 Гт (https://bit.ly/2UssG5A).Мы распространяем наши неопределенности для каждого параметра, используемого для оценки общей массы Рубиско, чтобы оценить неопределенность, связанную с нашей наилучшей оценкой массы земного Рубиско. Мы прогнозируем примерно трехкратную неопределенность, связанную с нашей оценкой глобальной массы Rubisco (https://bit.ly/2Ust9ES).
Распределение фракции Рубиско из сухой массы листьев. Каждый цвет обозначает отдельную категорию формы роста растений: темно-зеленые значения представляют древесные растения, а светло-зеленые значения представляют травянистые растения C3.Вертикальная линия указывает среднюю фракцию для каждой формы роста, используемой для анализа.
Одно потенциальное предостережение в нашем анализе заключается в том, что измерения массы листа могут также включать ткани листа, которые не являются фотосинтезирующими, такие как черешок и средняя жилка. На эти ткани приходится ≈20% общего азота листьев (21), а это означает, что даже если включение этих тканей вызывает завышенную оценку массы Рубиско, это мало по сравнению с неопределенностью, которую мы прогнозируем для нашей оценки.
Оценка массы морских белков Rubisco.
Приблизительно половина глобальной чистой первичной продуктивности приходится на океаны (5), поэтому можно ожидать, что глобальная масса белков Rubisco в морской среде будет значительной. Мы оцениваем общую массу белков Rubisco в морской среде, комбинируя оценку общей биомассы морских автотрофов с оценками содержания Rubisco в морских автотрофах (выделены синим цветом на рис. 1). Недавно мы оценили общую морскую автотрофную биомассу в ≈1 Гт С (6).Предполагая, что углерод составляет ≈50% сухой биомассы, мы оцениваем общую биомассу морских автотрофов как ≈2 Гт. Мы сосредоточимся на микроводорослях, которые, вероятно, преобладают над макроводорослями и морскими водорослями как океанские автотрофы (6). Микроводоросли обычно имеют содержание белка ≈50% от сухой массы (22). Поэтому мы оцениваем ≈1 Гт белков у морских автотрофов. Далее мы оцениваем массовую долю белков Rubisco в белковой массе морских автотрофов. Мы полагаемся на предыдущие отчеты (23⇓⇓⇓⇓⇓⇓⇓⇓⇓–33) о значениях 0.1–20% для разных видов микроводорослей и цианобактерий. Мы используем среднее геометрическое измеренной доли протеома Rubisco для каждой группы фитопланктона. Мы используем данные об относительной биомассе каждой таксономической группы (6) для расчета взвешенной глобальной средней доли протеома Rubisco. По нашим оценкам, в морском фитопланктоне Rubisco составляет ≈3% от общей массы белка. Умножив нашу оценку ≈1 Гт белков у морских автотрофов на нашу оценку, согласно которой Rubisco составляет ≈3% общего клеточного белка (шаг 8 на рис.1), мы оцениваем общую массу морских белков Rubisco в ≈0,03 Гт, что составляет <10% от общей массы Rubisco (https://bit.
Мы сосредоточимся на микроводорослях, которые, вероятно, преобладают над макроводорослями и морскими водорослями как океанские автотрофы (6). Микроводоросли обычно имеют содержание белка ≈50% от сухой массы (22). Поэтому мы оцениваем ≈1 Гт белков у морских автотрофов. Далее мы оцениваем массовую долю белков Rubisco в белковой массе морских автотрофов. Мы полагаемся на предыдущие отчеты (23⇓⇓⇓⇓⇓⇓⇓⇓⇓–33) о значениях 0.1–20% для разных видов микроводорослей и цианобактерий. Мы используем среднее геометрическое измеренной доли протеома Rubisco для каждой группы фитопланктона. Мы используем данные об относительной биомассе каждой таксономической группы (6) для расчета взвешенной глобальной средней доли протеома Rubisco. По нашим оценкам, в морском фитопланктоне Rubisco составляет ≈3% от общей массы белка. Умножив нашу оценку ≈1 Гт белков у морских автотрофов на нашу оценку, согласно которой Rubisco составляет ≈3% общего клеточного белка (шаг 8 на рис.1), мы оцениваем общую массу морских белков Rubisco в ≈0,03 Гт, что составляет <10% от общей массы Rubisco (https://bit. ly/2RWZkiV). Мы используем различные оценки биомассы морских автотрофов, а также вариабельность измерений доли протеома Rubisco у морских автотрофов, чтобы оценить неопределенность, связанную с нашей оценкой общей массы морских Rubisco. Мы прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой (https://bit.ly/2G8ni3t).
ly/2RWZkiV). Мы используем различные оценки биомассы морских автотрофов, а также вариабельность измерений доли протеома Rubisco у морских автотрофов, чтобы оценить неопределенность, связанную с нашей оценкой общей массы морских Rubisco. Мы прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой (https://bit.ly/2G8ni3t).
Оценка эффективной ставки наземного и морского Rubisco.
В отличие от метода, использованного Эллисом, наш подход к оценке общей массы RuBisco не основан на количестве RuBisco. Следовательно, мы можем использовать нашу оценку общей массы Рубиско, чтобы оценить его среднюю эффективную скорость фиксации углерода. В этом разделе мы рассчитываем эффективную ставку как наземного, так и морского Rubisco. Наша методология аналогична недавним попыткам количественно оценить скорость ферментов in vivo (34).А именно, мы оцениваем общий поток (реакции в единицу времени), поддерживаемый совместным действием всех белков Rubisco в данной среде (наземной или морской). Затем мы делим общий поток на оценку общего количества активных сайтов Rubisco, которую мы получаем из наших оценок общей массы Rubisco. Разделив общий поток на количество активных центров белка, поддерживающих этот поток, мы получим оценку средней каталитической скорости одного фермента Rubisco (рис.3 А ).
Затем мы делим общий поток на оценку общего количества активных сайтов Rubisco, которую мы получаем из наших оценок общей массы Rubisco. Разделив общий поток на количество активных центров белка, поддерживающих этот поток, мы получим оценку средней каталитической скорости одного фермента Rubisco (рис.3 А ).
Оценка эффективной ставки среднего рубиско. ( A ) Мы используем оценки общей годовой скорости фиксации углерода — валовой первичной продуктивности — в наземной и морской средах в сочетании с нашими оценками общей массы Rubisco в этих средах. Переведем единицы общей скорости фиксации углерода в реакции в секунду, используя тот факт, что каждая реакция Рубиско фиксирует один атом углерода, имеющий массу 12 Да.Мы также конвертируем наши оценки общей массы Rubisco в количество активных центров путем деления общей массы на молекулярную массу активного сайта. Разделив общее количество реакций, которые все активные центры выполняют каждую секунду, на общее количество активных центров, мы получаем оценку средней скорости одного активного центра. B и C показывают расчеты для наземного и морского Rubisco соответственно.
B и C показывают расчеты для наземного и морского Rubisco соответственно.
Для наземной среды валовая первичная продуктивность (GPP), которая включает всю фиксацию углерода, включая количество, выдыхаемое организмом, оценивается в ≈120 Гт C y −1 (35).Это значение представляет собой общий поток углерода, фиксируемый на суше каждый год, и, хотя точное значение остается предметом споров, оно оценивается как более чем двукратное (36), что достаточно для целей нашего анализа. Мы используем наземный GPP как меру общего потока, поддерживаемого совместным действием всех наземных белков Rubisco. Чтобы вычислить среднюю эффективную скорость Rubisco, которая измеряется в реакциях в секунду, мы переведем оценку земного GPP в единицы молекул CO 2 фиксированных в секунду.Поскольку каждая молекула CO 2 содержит один атом углерода с молекулярной массой 12 Да, мы можем выразить глобальный поток GPP в фиксированных единицах атомов углерода в секунду. Поскольку каждый год имеет ≈3 × 10 7 с, общий поток земной фиксации углерода составляет ≈2 × 10 32 атомов углерода (и, следовательно, молекул CO 2 ) в секунду, как показано на рис. 3 B. .
Поскольку каждый год имеет ≈3 × 10 7 с, общий поток земной фиксации углерода составляет ≈2 × 10 32 атомов углерода (и, следовательно, молекул CO 2 ) в секунду, как показано на рис. 3 B. .
Мы преобразуем нашу оценку общей массы наземных белков Rubisco в оценку общего количества активных центров Rubisco, используя молекулярную массу активного сайта Rubisco, которая составляет ≈70 кДа [одна большая и одна малая субъединица в типе I Рубиско (37)].Мы подсчитали, что общее количество активных центров Rubisco составляет ≈6 × 10 33 (или ≈10 33 октамеров Rubisco L8S8). Разделив общую скорость всех ферментов Rubisco на общее количество ферментов Rubisco, мы рассчитали, что средняя каталитическая скорость одного фермента Rubisco составляет ≈0,03 с -1 , как показано на рис. 3 C (https:// бит.лы/2DG4GpY). Мы распространяем наши прогнозы для оценки общей массы Rubisco, а также неопределенности, связанной с оценкой земного GPP, для оценки неопределенности, связанной с оценкой средней во времени скорости земного Rubisco. В целом, мы прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой средней по времени скорости земного Rubisco (https://bit.ly/2MJauly).
В целом, мы прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой средней по времени скорости земного Rubisco (https://bit.ly/2MJauly).
Для морской среды две независимые линии данных свидетельствуют о том, что GPP примерно в два раза превышает чистую первичную продуктивность. Во-первых, измерения автотрофного дыхания, фотодыхания и секреции растворенного органического углерода показывают, что примерно 50% углерода, фиксируемого фотосинтезом, теряется в этих процессах (38, 39).Во-вторых, измерения валовой продукции кислорода (общая масса кислорода, произведенного в результате фотосинтеза) примерно в 2,7 раза выше, чем измеренная чистая первичная продуктивность (38). Не весь кислород, образующийся в результате фотосинтеза, связан с фиксацией углерода; некоторые процессы, такие как реакция Мелера и дополнительные терминальные оксидазы (40), используют электроны, образующиеся при расщеплении воды, для других целей. На эти процессы обычно приходится 20–25% общего производства кислорода (41). Это означает, что оставшиеся 75–80% связаны с производством углерода, что диктует, что валовое производство углерода (GPP) примерно в два раза выше, чем чистая первичная продуктивность.Глобальная чистая первичная продуктивность морской среды оценивается в ≈50 Гт С·год 90 027–1 (5), и, таким образом, глобальная валовая первичная продуктивность моря составляет ≈100 Гт С·год –1 . Как и в случае с земной средой, мы конвертируем GPP в единицы реакции в секунду и получаем оценку ≈1,5 × 10 32 атомов углерода (и, следовательно, CO 2 молекул), зафиксированных в секунду. Наша оценка общей массы морского Rubisco составляет ≈0,03 Гт, что соответствует ≈3 × 10 32 морских активных участков Rubisco.Разделив общую скорость всех морских ферментов Rubisco на общее количество активных центров Rubisco, мы подсчитали, что средняя каталитическая скорость одного Rubisco в морской среде составляет ≈0,6 с -1 , что примерно на порядок выше, чем у Rubisco.
Это означает, что оставшиеся 75–80% связаны с производством углерода, что диктует, что валовое производство углерода (GPP) примерно в два раза выше, чем чистая первичная продуктивность.Глобальная чистая первичная продуктивность морской среды оценивается в ≈50 Гт С·год 90 027–1 (5), и, таким образом, глобальная валовая первичная продуктивность моря составляет ≈100 Гт С·год –1 . Как и в случае с земной средой, мы конвертируем GPP в единицы реакции в секунду и получаем оценку ≈1,5 × 10 32 атомов углерода (и, следовательно, CO 2 молекул), зафиксированных в секунду. Наша оценка общей массы морского Rubisco составляет ≈0,03 Гт, что соответствует ≈3 × 10 32 морских активных участков Rubisco.Разделив общую скорость всех морских ферментов Rubisco на общее количество активных центров Rubisco, мы подсчитали, что средняя каталитическая скорость одного Rubisco в морской среде составляет ≈0,6 с -1 , что примерно на порядок выше, чем у Rubisco. в наземной среде (https://bit.ly/2DG4GpY). Мы следуем той же процедуре распространения ошибки, что и для наземного Rubisco, и прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой усредненной по времени скорости морского Rubisco (https://bit.ly/2RSVyXA).
в наземной среде (https://bit.ly/2DG4GpY). Мы следуем той же процедуре распространения ошибки, что и для наземного Rubisco, и прогнозируем примерно четырехкратную неопределенность, связанную с нашей оценкой усредненной по времени скорости морского Rubisco (https://bit.ly/2RSVyXA).
Чтобы подтвердить наши результаты, мы сравнили наши глобальные оценки уровня Rubisco с измерениями продуктивности и биомассы производителей в нескольких разных местах на суше и в океане. Расчет уровня Rubisco в 20 местах дает числа, находящиеся в пределах неопределенности, которую мы сообщаем для нашей глобальной оценки, что повышает нашу уверенность в достоверности подхода ( Приложение SI ).
Обсуждение
Наша работа предлагает методологию оценки общей глобальной массы Rubisco.В то время как Эллис использовал каталитическую скорость Rubisco in vitro для оценки общего количества Rubisco, мы полагаемся на массовые доли общей автотрофной биомассы. По нашим оценкам, общая масса ферментов Rubisco составляет ≈0,7 Гт в наземной среде и ≈0,03 Гт в морской среде. Наша оценка более чем на порядок выше давней оценки ≈0,04 Гт (2). Использование измеренных массовых долей позволяет гораздо лучше ограничить параметры, используемые для оценки общей массы Rubisco, что приводит к большому отличию от предыдущих значений.Большая разница между нашей оценкой и оценкой Эллиса показывает, что его первоначальное заявление о том, что Rubisco является самым распространенным белком на Земле, не было подтверждено. Даже с нашей гораздо более высокой оценкой неясно, действительно ли Rubisco является самым распространенным белком в биосфере. Для обоснования этого утверждения требуется всестороннее сравнение массы Rubisco с массой других вездесущих белков. Это направление исследований выходит за рамки данной статьи, но в настоящее время мы изучаем его.
Наша оценка более чем на порядок выше давней оценки ≈0,04 Гт (2). Использование измеренных массовых долей позволяет гораздо лучше ограничить параметры, используемые для оценки общей массы Rubisco, что приводит к большому отличию от предыдущих значений.Большая разница между нашей оценкой и оценкой Эллиса показывает, что его первоначальное заявление о том, что Rubisco является самым распространенным белком на Земле, не было подтверждено. Даже с нашей гораздо более высокой оценкой неясно, действительно ли Rubisco является самым распространенным белком в биосфере. Для обоснования этого утверждения требуется всестороннее сравнение массы Rubisco с массой других вездесущих белков. Это направление исследований выходит за рамки данной статьи, но в настоящее время мы изучаем его.
Еще одно преимущество нашей методологии заключается в том, что, поскольку она не основана на каталитической скорости Rubisco, мы можем использовать нашу оценку для вывода эффективной усредненной по времени скорости Rubisco. Мы находим, что эффективные скорости наземного и морского Rubisco составляют ≈0,03 с -1 и ≈0,6 с -1 соответственно. Как эта скорость соотносится с максимальной каталитической скоростью Рубиско в растениях? Используя набор кинетических параметров Рубискоса (42), мы оцениваем характеристику k cat наземных растений, которая составляет ≈3 с −1 при 25 °C (https://bit.ly/2CNq6j2). Таким образом, эффективная каталитическая скорость Rubisco в дикой наземной среде составляет ≈1% от его максимальной скорости. Характеристика k cat морских автотрофов существенно не отличается от характеристики наземных растений, хотя у цианобактерий Rubisco обычно быстрее (42), и мы оцениваем ее в ≈4 с −1 (https:/ /bit.ly/2CNq6j2). Таким образом, эффективная каталитическая скорость Rubisco в морской среде составляет ≈15% от его максимальной скорости при 25 ° C.
Мы находим, что эффективные скорости наземного и морского Rubisco составляют ≈0,03 с -1 и ≈0,6 с -1 соответственно. Как эта скорость соотносится с максимальной каталитической скоростью Рубиско в растениях? Используя набор кинетических параметров Рубискоса (42), мы оцениваем характеристику k cat наземных растений, которая составляет ≈3 с −1 при 25 °C (https://bit.ly/2CNq6j2). Таким образом, эффективная каталитическая скорость Rubisco в дикой наземной среде составляет ≈1% от его максимальной скорости. Характеристика k cat морских автотрофов существенно не отличается от характеристики наземных растений, хотя у цианобактерий Rubisco обычно быстрее (42), и мы оцениваем ее в ≈4 с −1 (https:/ /bit.ly/2CNq6j2). Таким образом, эффективная каталитическая скорость Rubisco в морской среде составляет ≈15% от его максимальной скорости при 25 ° C.
Есть два тривиальных фактора, которые помогают частично объяснить разницу между нашими оценками и измеренными in vitro значениями k cat . Первый фактор заключается в том, что поток солнечной энергии, приводящий в действие фиксацию углерода, ограничен дневным временем, поэтому мы ожидаем, что наша среднегодовая скорость будет в два раза ниже, чем скорость фиксации в дневное время (или, точнее, в ≈1,9 раза для морской атмосферы). окружающая среда из-за продуктивности в основном летом в высоких широтах с длинным световым днем; https://bit.ly/2CSY5qB). Второй фактор – это температура, при которой происходит фиксация углерода. Обычно максимальная скорость Rubisco измеряется in vitro при 25 °C, но скорость фиксации зависит от температуры, при которой работает фермент, поэтому, если в природе Rubisco работает при более низких температурах, можно ожидать, что его максимальная скорость будет быть ниже измеренной in vitro скорости ≈3-4 с -1 . Мы используем глобальные карты средних температур и первичной продуктивности для оценки средних температур, при которых происходит фиксация углерода на суше и в океане.По нашим оценкам, Rubisco работает в среднем при ≈24 °C на суше и при ≈10 °C в океане (https://bit.
Первый фактор заключается в том, что поток солнечной энергии, приводящий в действие фиксацию углерода, ограничен дневным временем, поэтому мы ожидаем, что наша среднегодовая скорость будет в два раза ниже, чем скорость фиксации в дневное время (или, точнее, в ≈1,9 раза для морской атмосферы). окружающая среда из-за продуктивности в основном летом в высоких широтах с длинным световым днем; https://bit.ly/2CSY5qB). Второй фактор – это температура, при которой происходит фиксация углерода. Обычно максимальная скорость Rubisco измеряется in vitro при 25 °C, но скорость фиксации зависит от температуры, при которой работает фермент, поэтому, если в природе Rubisco работает при более низких температурах, можно ожидать, что его максимальная скорость будет быть ниже измеренной in vitro скорости ≈3-4 с -1 . Мы используем глобальные карты средних температур и первичной продуктивности для оценки средних температур, при которых происходит фиксация углерода на суше и в океане.По нашим оценкам, Rubisco работает в среднем при ≈24 °C на суше и при ≈10 °C в океане (https://bit. ly/2HG9AXV). Используя данные по температурной зависимости Rubisco k cat (32), мы оцениваем максимальную скорость Rubisco ≈3 с −1 на суше и ≈1 с −1 в океане при средних температурах окружающей среды. . Для морской среды эти два фактора объясняют большую часть разницы между усредненной по времени скоростью Rubisco и максимальной скоростью, измеренной in vitro, подразумевая, что Rubisco работает вблизи своего k cat в фитопланктоне (32).Однако на суше, даже с учетом этих факторов, Rubisco все еще более чем на порядок ниже своего k cat .
ly/2HG9AXV). Используя данные по температурной зависимости Rubisco k cat (32), мы оцениваем максимальную скорость Rubisco ≈3 с −1 на суше и ≈1 с −1 в океане при средних температурах окружающей среды. . Для морской среды эти два фактора объясняют большую часть разницы между усредненной по времени скоростью Rubisco и максимальной скоростью, измеренной in vitro, подразумевая, что Rubisco работает вблизи своего k cat в фитопланктоне (32).Однако на суше, даже с учетом этих факторов, Rubisco все еще более чем на порядок ниже своего k cat .
Многие факторы могут объяснить более низкую эффективную каталитическую скорость Rubisco. Скорость Rubisco может быть ограничена абиотическими факторами, такими как наличие солнечной радиации (например, когда листья затенены в пологе), концентрация CO 2 , воздействию которой подвергаются ферменты Rubisco, водоснабжение, снабжение питательными веществами, температура, и другие. Это также может быть вызвано физиологическими процессами, такими как фотодыхание, регенерация RuBP, состояние активации RuBisco и другие. Это лишь неполный список факторов, которые в будущем следует количественно изучить и сравнить между наземной и морской средой.
Это также может быть вызвано физиологическими процессами, такими как фотодыхание, регенерация RuBP, состояние активации RuBisco и другие. Это лишь неполный список факторов, которые в будущем следует количественно изучить и сравнить между наземной и морской средой.
Другой способ сформулировать вопрос о неэффективности состоит в том, чтобы рассмотреть, почему мы видим, что большое количество ферментов Rubisco работает с субмаксимальной скоростью, в отличие от меньшего количества ферментов Rubisco, работающих быстрее.У этой загадки есть несколько возможных объяснений, на которых мы кратко остановимся. Один из аргументов предполагает, что избыток Rubisco позволяет растениям быстрее реагировать на изменяющиеся условия окружающей среды, такие как изменения условий освещения (например, солнечные блики). Это похоже на предполагаемый избыточный пул рибосом у бактерий с ограниченным содержанием углерода (43). Другая возможная гипотеза состоит в том, что Рубиско играет роль в хранении азота в тканях растений. С точки зрения стехиометрии элементов, растения имеют обильные запасы углерода из атмосферы, но ограничены запасами других важных элементов, таких как азот и фосфор.Белки имеют элементарную стехиометрию, подходящую для хранения азота, когда углерод в изобилии, без потребности в фосфоре, который потребовался бы для хранения в нуклеиновых кислотах. Таким образом, растения могут использовать белок в качестве резервуара азота, и Rubisco, содержащийся в растениях, может выполнять эту роль.
С точки зрения стехиометрии элементов, растения имеют обильные запасы углерода из атмосферы, но ограничены запасами других важных элементов, таких как азот и фосфор.Белки имеют элементарную стехиометрию, подходящую для хранения азота, когда углерод в изобилии, без потребности в фосфоре, который потребовался бы для хранения в нуклеиновых кислотах. Таким образом, растения могут использовать белок в качестве резервуара азота, и Rubisco, содержащийся в растениях, может выполнять эту роль.
Наш анализ эффективной скорости ферментов Rubisco в наземной и морской средах показывает сильную разницу между двумя средами: морские ферменты Rubisco работают на порядок выше, чем на суше.Почему морские ферменты Rubisco работают намного быстрее в океане? Частичным объяснением этой разницы является недостаточное насыщение CO 2 на суше. Большинство фотосинтезирующих организмов в морской среде — цианобактерии и эукариотический фитопланктон — снабжены механизмами концентрации углерода, которые увеличивают локальную концентрацию CO 2 в окрестностях Рубиско, помогая снизить перенасыщение CO 2 и связанные с ним ограничения ( 44). Мы считаем, что представленные здесь результаты побуждают к специальному анализу с использованием подробных измерений для тщательного анализа факторов, определяющих общую количественную разницу между морской и наземной средой.
Мы считаем, что представленные здесь результаты побуждают к специальному анализу с использованием подробных измерений для тщательного анализа факторов, определяющих общую количественную разницу между морской и наземной средой.
В целом, наш анализ проливает свет на распространение Rubisco в природной среде и обеспечивает дидактическую основу для оценки влияния различных признаков растений на распространенность Rubisco. Мы используем предполагаемую общую массу Rubisco, чтобы показать, что в среднем Rubisco работает намного ниже своей максимальной скорости. Дальнейшие исследования покажут относительную важность факторов, которые способствуют ограничению уровня Rubisco, и изучат, в какой степени Rubisco может играть дополнительную роль помимо своей каталитической функции.
Методы
Полное описание нашего анализа, включая источники данных и код, используемый для получения наших результатов, можно найти на https://github.com/milo-lab/rubisco_mass/.
Расчет общей площади листьев.

Для оценки общей площади листьев построим две карты распределения площади листьев по земному шару. Первая карта — это карта продукта GLASS LAI (12), которая основана на дистанционном зондировании. Поскольку количество листьев меняется в течение года из-за лиственных растений, мы используем месячные составные карты и вычисляем среднегодовое значение общей площади листьев.Мы решили использовать составную карту с общей площадью листьев, наиболее близкой к среднегодовой.
Поскольку дистанционное зондирование LAI может стать насыщенным при высоких значениях LAI (45), мы используем наземные значения LAI в различных биомах в качестве независимого источника (11). Средние значения LAI, измеренные на земле, для каждого биома представляют собой площадь листвы на поверхность земли с растительностью, но во многих биомах (например, в пустынях) большая часть поверхности земли не покрыта растительностью. Мы используем результаты недавнего исследования, в ходе которого была составлена глобальная карта растительного покрова (46). Для каждого местоположения мы умножаем долю земли, покрытой растительностью (либо деревьями, либо короткой растительностью), на средний LAI, измеренный в конкретном биоме, в котором находится местоположение (шаг 9 на рис. 1). Наземные измерения LAI, вероятно, завышают среднегодовые значения LAI в лиственных биомах, поскольку значения LAI, равные 0, обычно не сообщаются. Комбинируя оценки на основе дистанционного зондирования, которые, вероятно, занижают фактическую площадь листьев, а также наземные измерения, которые, вероятно, завышают оценки, мы делаем нашу оценку общей площади листьев более надежной.
Для каждого местоположения мы умножаем долю земли, покрытой растительностью (либо деревьями, либо короткой растительностью), на средний LAI, измеренный в конкретном биоме, в котором находится местоположение (шаг 9 на рис. 1). Наземные измерения LAI, вероятно, завышают среднегодовые значения LAI в лиственных биомах, поскольку значения LAI, равные 0, обычно не сообщаются. Комбинируя оценки на основе дистанционного зондирования, которые, вероятно, занижают фактическую площадь листьев, а также наземные измерения, которые, вероятно, завышают оценки, мы делаем нашу оценку общей площади листьев более надежной.
Оценка массы листа на единицу площади листа.
Для оценки характеристической массы листьев на единицу площади мы опираемся на две методики. Наша первая методология основана на глобальной базе данных признаков растений. Эта база данных включает измерения сухой массы листа на единицу площади листа для ≈2000 видов растений (13). Мы рассчитали среднее геометрическое массы листа на единицу площади листа для всех видов и получили оценку ≈100 г м -2 .
Наша вторая методология опирается на недавно созданную карту распределения признаков растений (14).На этой карте указана масса листьев на единицу площади листа в каждом месте. Мы вычисляем среднее значение всех пикселей на этой карте, взвешенное по площади листьев в каждом пикселе. При оценке общей площади листьев мы создаем две карты площади листьев, одну на основе дистанционного зондирования, а другую на основе полевых измерений. В результате получаются две оценки средней массы листьев на единицу площади листьев, одна из которых взвешена по карте площади листьев на основе дистанционного зондирования, а другая взвешена по карте площади листьев, измеренной в полевых условиях.Мы используем среднее геометрическое этих двух оценок, которое составляет ≈100 г м -2 , в качестве нашей наилучшей оценки массы листьев на единицу площади листа на основе карты признаков, представленной Батлером и др. (14).
В качестве наилучшей оценки характеристической массы листа на единицу площади листа мы используем среднее геометрическое оценки, основанной на базе данных видов, и оценки, основанной на картах признаков растений (шаг 3 на рис. 1). Наша наилучшая оценка массы листьев на единицу площади листа составляет ≈100 г м -2 .
1). Наша наилучшая оценка массы листьев на единицу площади листа составляет ≈100 г м -2 .
Оценка доли общей площади листьев древесных и травянистых растений.
Наш анализ дал оценку общей массы листьев. Поскольку разные типы растений, такие как древесные растения и травянистые растения С3 и С4, содержат разные характерные количества Rubisco на сухой вес листа, нам необходимо оценить долю каждого типа растений в общей массе листьев. Чтобы получить нашу оценку, мы делаем два шага: ( i ) оцениваем долю общей массы листьев древесных растений и ( ii ) делим массу листьев травянистых между растениями С3 и С4.
Для оценки доли общей массы листьев у древесных растений мы используем те же две методики, что и для оценки общей массы листьев: одна основана на доле массы листьев от массы растения, а другая основана на площади листьев. В каждом методе мы делим оценку массы листьев на древесные или травянистые листья в зависимости от биома, в котором находится лист. Мы определяем листья как принадлежащие травянистым растениям, если они расположены на пастбищах пахотных земель, а остальные биомы считаем принадлежащими древесным растениям.Каждая методология дает расчетные доли общей массы листьев древесных и травянистых растений. Мы используем среднее геометрическое двух оценок в качестве наилучшей оценки доли общей массы листьев у древесных и травянистых растений: 70% и 30% соответственно (https://bit.ly/2HQJ7qX).
Мы определяем листья как принадлежащие травянистым растениям, если они расположены на пастбищах пахотных земель, а остальные биомы считаем принадлежащими древесным растениям.Каждая методология дает расчетные доли общей массы листьев древесных и травянистых растений. Мы используем среднее геометрическое двух оценок в качестве наилучшей оценки доли общей массы листьев у древесных и травянистых растений: 70% и 30% соответственно (https://bit.ly/2HQJ7qX).
Далее мы оцениваем долю массы листьев травянистых растений С3 и С4. Чтобы получить нашу оценку, мы отдельно оцениваем долю массы листьев у растений С4 на пахотных землях и в несельскохозяйственных травянистых биомах.Что касается пахотных земель, мы полагаемся на карты распределения культур повсеместно распространенных культур С4 (сахарный тростник, кукуруза и сорго) из опубликованных источников (47). Мы объединяем карты распределения для всех этих культур и создаем карту доли земли, содержащей культуры C4. Затем мы накладываем эту карту на наши карты, оценивающие глобальное распределение массы листьев, и интегрируем по всему растению, чтобы оценить общую массу листьев у культур C4. Для несельскохозяйственных травянистых растений мы полагаемся на карту глобального распространения растений С4 (48).Эта карта дает количественную оценку доли земли, на которой преобладают растения C4. Мы исключили растения С4 на пахотных землях из этой карты, потому что мы рассчитали их массу отдельно в предыдущем разделе. Мы накладываем карту естественного распределения растений C4 на наши карты, оценивающие глобальное распределение листьев, и интегрируем по всей планете, чтобы оценить общую массу листьев у естественных травянистых растений C4. Карта глобального распространения растений С4 показывает, что растения С4 также доминируют в таких биомах, как саванна и кустарники, которые содержат древесные растения.Это потому, что травы C4 можно найти в подлеске этих биомов.
Для несельскохозяйственных травянистых растений мы полагаемся на карту глобального распространения растений С4 (48).Эта карта дает количественную оценку доли земли, на которой преобладают растения C4. Мы исключили растения С4 на пахотных землях из этой карты, потому что мы рассчитали их массу отдельно в предыдущем разделе. Мы накладываем карту естественного распределения растений C4 на наши карты, оценивающие глобальное распределение листьев, и интегрируем по всей планете, чтобы оценить общую массу листьев у естественных травянистых растений C4. Карта глобального распространения растений С4 показывает, что растения С4 также доминируют в таких биомах, как саванна и кустарники, которые содержат древесные растения.Это потому, что травы C4 можно найти в подлеске этих биомов.
Поскольку неясно, какая часть массы листьев в этих биомах приходится на травянистые, мы получаем две оценки, основанные на распределении естественных растений С4, одна из которых включает только луга, а другая включает также саванны и кустарники. В каждом случае оценивали общую массу листьев несельскохозяйственных растений С4. Мы используем среднее геометрическое двух оценок в качестве наилучшей оценки массы листьев природных растений С4.Мы суммируем наши оценки общей массы листьев культур С4 и несельскохозяйственных растений С4, чтобы оценить общую массу листьев растений С4. Мы делим общую массу листьев растений C4 на нашу наилучшую оценку общей массы листьев, основанную на оценках площади листьев, чтобы получить оценку доли общей массы листьев, приходящейся на растения C4. В целом, по нашим оценкам, ≈10% общей массы листьев приходится на растения C4, что оставляет ≈20% общей массы листьев у травянистых растений C3 (https://bit.ly/2FWZgsL).
В каждом случае оценивали общую массу листьев несельскохозяйственных растений С4. Мы используем среднее геометрическое двух оценок в качестве наилучшей оценки массы листьев природных растений С4.Мы суммируем наши оценки общей массы листьев культур С4 и несельскохозяйственных растений С4, чтобы оценить общую массу листьев растений С4. Мы делим общую массу листьев растений C4 на нашу наилучшую оценку общей массы листьев, основанную на оценках площади листьев, чтобы получить оценку доли общей массы листьев, приходящейся на растения C4. В целом, по нашим оценкам, ≈10% общей массы листьев приходится на растения C4, что оставляет ≈20% общей массы листьев у травянистых растений C3 (https://bit.ly/2FWZgsL).
Анализ неопределенности.
Наряду с описанием процедур, ведущих к оценке параметров, используемых для получения глобальной массы и скорости RuBisco, мы количественно изучаем основные источники неопределенности, связанные с каждым параметром, и рассчитываем диапазон неопределенности для каждого из них. Мы следуем той же методологии, описанной Bar-On et al. (6). Мы предпочитаем сообщать о неопределенностях как представляющих, насколько это возможно, учитывая множество ограничений, то, что эквивалентно 95% доверительному интервалу для оценки среднего значения.Неопределенности, указанные в нашем анализе, являются мультипликативными (кратное изменение среднего значения), а не аддитивными (± изменение оценки). Мы решили использовать мультипликативную неопределенность, потому что она более устойчива к возможным выбросам в исходных данных и потому что это естественный способ сообщить о неопределенности, связанной со средним геометрическим значением выборки. Чтобы оценить общую массу наземного и морского Rubisco, мы сначала оцениваем несколько величин, таких как общая масса листьев и содержание Rubisco в массе листьев (рис.1). Каждая из этих величин рассчитывается как среднее геометрическое нескольких источников данных или оценок независимых методов. Мы полагаемся на разницу между независимыми методами оценки одной и той же величины или на изменчивость данных, на которых основывается наша оценка, как на источник для оценки неопределенности, связанной с нашей оценкой.
Мы следуем той же методологии, описанной Bar-On et al. (6). Мы предпочитаем сообщать о неопределенностях как представляющих, насколько это возможно, учитывая множество ограничений, то, что эквивалентно 95% доверительному интервалу для оценки среднего значения.Неопределенности, указанные в нашем анализе, являются мультипликативными (кратное изменение среднего значения), а не аддитивными (± изменение оценки). Мы решили использовать мультипликативную неопределенность, потому что она более устойчива к возможным выбросам в исходных данных и потому что это естественный способ сообщить о неопределенности, связанной со средним геометрическим значением выборки. Чтобы оценить общую массу наземного и морского Rubisco, мы сначала оцениваем несколько величин, таких как общая масса листьев и содержание Rubisco в массе листьев (рис.1). Каждая из этих величин рассчитывается как среднее геометрическое нескольких источников данных или оценок независимых методов. Мы полагаемся на разницу между независимыми методами оценки одной и той же величины или на изменчивость данных, на которых основывается наша оценка, как на источник для оценки неопределенности, связанной с нашей оценкой. Затем мы распространяем неопределенность в каждой величине на нашу окончательную оценку общей массы наземных и морских Rubisco и их средних во времени скоростей.
Затем мы распространяем неопределенность в каждой величине на нашу окончательную оценку общей массы наземных и морских Rubisco и их средних во времени скоростей.
Мы рассчитываем неопределенность каждой величины относительно среднего геометрического данных, использованных для ее оценки (источники данных или оценки, основанные на независимых методах), путем логарифмирования значений, сообщаемых либо в рамках исследований, либо из разных исследований. Логарифмирование перемещает значения в логарифмическое пространство, где вычисляется SE (путем деления SD на квадратный корень из числа значений). Затем мы умножаем SE на коэффициент 1,96, что дает доверительный интервал 95%, если преобразованные данные нормально распределены.Наконец, мы возводим результат в степень, чтобы получить мультипликативный коэффициент в линейном пространстве, который представляет доверительный интервал (подобный 95% доверительному интервалу, если данные распределены логарифмически нормально). Когда данных достаточно, неопределенность вокруг среднего геометрического будет низкой (поскольку мы основываем нашу неопределенность SE в логарифмическом пространстве). Тем не менее, этот тип неопределенности не учитывает возможность того, что распределение значений в выборочных данных не точно отражает природную среду.Чтобы учесть это в нашем прогнозе неопределенности, мы генерируем дополнительную мультипликативную неопределенность, основанную на SD, а не на SE в логарифмическом пространстве. Мы рассматриваем мультипликативную неопределенность на основе SE как недооценку фактической неопределенности, а мультипликативную неопределенность на основе SD как завышенную оценку фактической неопределенности (поскольку она не включает уменьшение неопределенности из-за усреднения). В качестве меры неопределенности мы используем среднее геометрическое мультипликативной неопределенности на основе SE и мультипликативной неопределенности на основе SD.Хотя это не стандартная статистическая процедура, мы считаем ее разумным компромиссом для получения надежной оценки неопределенности.
Тем не менее, этот тип неопределенности не учитывает возможность того, что распределение значений в выборочных данных не точно отражает природную среду.Чтобы учесть это в нашем прогнозе неопределенности, мы генерируем дополнительную мультипликативную неопределенность, основанную на SD, а не на SE в логарифмическом пространстве. Мы рассматриваем мультипликативную неопределенность на основе SE как недооценку фактической неопределенности, а мультипликативную неопределенность на основе SD как завышенную оценку фактической неопределенности (поскольку она не включает уменьшение неопределенности из-за усреднения). В качестве меры неопределенности мы используем среднее геометрическое мультипликативной неопределенности на основе SE и мультипликативной неопределенности на основе SD.Хотя это не стандартная статистическая процедура, мы считаем ее разумным компромиссом для получения надежной оценки неопределенности.
Благодарности
Мы благодарим Rui Alvez, Peter Crockford, Niv De Malach, Avi Flamholz, Dina Hochhauser, Rob Phillips, John Raven, Mark Stitt и Xinguang Zhu и двух анонимных рецензентов за полезные отзывы об этой рукописи. Это исследование было поддержано Европейским исследовательским советом (проект NOVCARBFIX 646827), Израильским научным фондом (грант 740/16), Канадским центром исследований альтернативной энергетики Бека, Дана и Йосси Холландер, Фондом семьи Ульманн, Благотворительным фондом Хелмсли. , Благотворительный фонд Ларсона, Благотворительный фонд семьи Вольфсон, Чарльз Ротшильд и Сельмо Нуссенбаум.Р.М. является профессиональным председателем Чарльза и Луизы Гартнер. YMB-O — стипендиат Азриэли.
Это исследование было поддержано Европейским исследовательским советом (проект NOVCARBFIX 646827), Израильским научным фондом (грант 740/16), Канадским центром исследований альтернативной энергетики Бека, Дана и Йосси Холландер, Фондом семьи Ульманн, Благотворительным фондом Хелмсли. , Благотворительный фонд Ларсона, Благотворительный фонд семьи Вольфсон, Чарльз Ротшильд и Сельмо Нуссенбаум.Р.М. является профессиональным председателем Чарльза и Луизы Гартнер. YMB-O — стипендиат Азриэли.
- Copyright © 2019 Автор(ы). Опубликовано ПНАС.
Углеводы, белки и жиры. Нарушения питания
Белки состоят из единиц, называемых аминокислотами, связанных друг с другом в сложные образования. Поскольку белки представляют собой сложные молекулы, организму требуется больше времени для их расщепления. В результате они являются гораздо более медленным и продолжительным источником энергии, чем углеводы.
Есть 20 аминокислот. Тело синтезирует некоторые из них из внутренних компонентов, но не может синтезировать 9 аминокислот, называемых незаменимыми аминокислотами. Их необходимо употреблять в пищу. Всем необходимы 8 из этих аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Младенцам также нужен 9-й, гистидин.
Их необходимо употреблять в пищу. Всем необходимы 8 из этих аминокислот: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Младенцам также нужен 9-й, гистидин.
Процент белка, который организм может использовать для синтеза незаменимых аминокислот, варьируется от белка к белку.Организм может использовать 100% белка яйца и высокий процент белка молока и мяса. Организм может использовать чуть меньше половины белка, содержащегося в большинстве овощей и злаков.
Организму необходим белок для поддержания и замены тканей, а также для функционирования и роста. Белок обычно не используется для получения энергии. Однако, если организм не получает достаточно калорий из других питательных веществ или из жира, хранящегося в организме, белок расщепляется на кетоновые тела, которые используются для получения энергии. Если потребляется больше белка, чем необходимо, организм расщепляет белок и откладывает его компоненты в виде жира.
В организме содержится большое количество белка. Белок, основной строительный материал в организме, является основным компонентом большинства клеток. Например, мышцы, соединительные ткани и кожа состоят из белка.
Белок, основной строительный материал в организме, является основным компонентом большинства клеток. Например, мышцы, соединительные ткани и кожа состоят из белка.
Взрослым необходимо съедать около 60 граммов белка в день (0,8 грамма на килограмм веса или 10–15% от общего количества калорий). Взрослым, которые пытаются нарастить мышечную массу, нужно немного больше. Детям также нужно больше, потому что они растут. Людям, которые ограничивают калории, чтобы похудеть, обычно требуется большее количество белка, чтобы предотвратить потерю мышечной массы во время похудения.Пожилым людям может потребоваться более высокий уровень белка до 1,2 г/кг массы тела. Однако это количество является чрезмерным и потенциально вредным при определенных состояниях, таких как почечная недостаточность и почечная недостаточность. Исследования также показывают, что белок более насыщает (помогает людям чувствовать себя сытыми дольше), чем углеводы и жиры.
Белки: строительные блоки организма
За исключением воды и жира, человеческий организм почти полностью состоит из белка. Белок является основным компонентом мышц, костей, органов, кожи и ногтей.За исключением воды, мышцы примерно на 80% состоят из белка, что делает это питательное вещество особенно важным для спортсменов.
Белок является основным компонентом мышц, костей, органов, кожи и ногтей.За исключением воды, мышцы примерно на 80% состоят из белка, что делает это питательное вещество особенно важным для спортсменов.
Как используется белок?
Организм расщепляет потребляемый белок на аминокислоты и усваивает их. Он используется для построения мышц и органов, для выработки гормонов и антител, для хранения в виде жира и для сжигания в качестве энергии.
Типы белковых добавок
Существует множество различных видов белковых добавок. Сывороточный протеин богат BCAA * , что делает его легко усваиваемым и высокоэффективным.
- BCAA (аминокислоты с разветвленной цепью) — это общее название незаменимых аминокислот валина, лейцина и изолейцина. BCAA — это незаменимые аминокислоты, которые преобразуются в энергию в мышцах.
Белок является важной частью состава тела.
Сколько белка нужно организму?
Ежедневное максимальное количество белка, которое организм может использовать для синтеза белка, составляет около 2 граммов на 1 килограмм массы тела. Потребление большего количества белка не увеличит синтез, но увеличит количество потребляемой энергии и приведет к увеличению жировых отложений.Слишком много белка может также обременять печень и почки.
Потребление большего количества белка не увеличит синтез, но увеличит количество потребляемой энергии и приведет к увеличению жировых отложений.Слишком много белка может также обременять печень и почки.
Максимальное ежедневное количество, используемое для синтеза белка, составляет около 2 г на 1 кг массы тела
Поэтому важно регулировать количество потребляемого белка.Если вы едите три хорошо сбалансированных приема пищи в день, вы легко сможете получить необходимое вашему организму количество белка. Важно не только то, сколько вы едите, но и когда вы едите.
Употребляйте вместе белки и углеводы
Когда белок потребляется вместе с углеводами (сахар или глюкоза), уровень сахара в крови повышается и вырабатывается инсулин, стимулирующий синтез аминокислот.
Углеводы также используются в качестве первого источника энергии, предотвращая использование аминокислот. После тренировки рекомендуется выпить что-нибудь вроде киселя, который позволит вам потреблять одновременно и углеводы, и белки.
Когда употреблять белок
Важно употреблять белок в нужное время. Идеальное время для употребления – сразу после тренировки.
Организм быстрее расщепляет белок сразу после тренировки, а также активнее синтезирует его, в результате чего больше аминокислот усваивается мышцами.
Белок, потребляемый сразу после тренировки, синтезируется лучше, чем белок, потребляемый через 2 часа после тренировки.
Другие направления деятельности
Точно измеренное время жизни белка в мозге мышей выявило различия между тканями и субклеточными фракциями .Взрослых (старше 3,5 месяцев) самцов мышей дикого типа (C57BL/6JRj) приобретали в Janvier Labs (Германия). Репортерную линию мышей R26R LacZ
44 скрещивали с индуцируемой тамоксифеном драйверной линией CaMKCreERT2, экспрессирующей слитый белок CreER T2 под контролем регуляторных элементов гена CaMKIIα 17 . Экспрессию вызывали внутрибрюшинной инъекцией тамоксифена в дозе 2 мг, растворенной в кукурузном масле (Sigma), два раза в день перед забором мозга и обработкой ткани. В обогащенной среде (EE) мышей помещали в большие пластиковые клетки группами по 5–8 особей и снабжали игрушками. Последняя состояла из ходовых колес, труб, предмета корпуса, а также множества предметов разного размера и фактуры. Чтобы обеспечить новизну, по крайней мере два предмета, за исключением предмета корпуса и ходовых колес, менялись на два новых предмета через день. Остальные игрушки были переставлены в клетке для обеспечения пространственной новизны. Мышей обогащали за 6 недель до начала мечения SILAC и во время мечения SILAC.Ранее мы показали, что этот протокол обогащения приводит к расширению функции памяти 45 .
В обогащенной среде (EE) мышей помещали в большие пластиковые клетки группами по 5–8 особей и снабжали игрушками. Последняя состояла из ходовых колес, труб, предмета корпуса, а также множества предметов разного размера и фактуры. Чтобы обеспечить новизну, по крайней мере два предмета, за исключением предмета корпуса и ходовых колес, менялись на два новых предмета через день. Остальные игрушки были переставлены в клетке для обеспечения пространственной новизны. Мышей обогащали за 6 недель до начала мечения SILAC и во время мечения SILAC.Ранее мы показали, что этот протокол обогащения приводит к расширению функции памяти 45 .Silac Mouse Marking
L-
12 C 6 -LYSINE, L- 13 C 6 -LYSINE и L- 13 C 6 — 15 N 4 -аргининовые корма SILAC 14 были приобретены у Silantes, Martinsried, Германия. Для экспериментов с импульсами мышей сначала приучали к немеченому L- 12 C 6 -лизиновой диете, прежде чем начинать кормить L- 13 C 6 -лизиновой диетой. Мы сделали это, чтобы избежать нежелательных эффектов, таких как потеря веса, которая может произойти из-за смены диеты. В этой работе использовалось несколько различных импульсов маркировки. Для общего определения времени жизни белка мы полагались на короткие импульсы (0, 5, 14 и 21 день), которые мы оценили после предварительного исследования как наилучшее время импульсов для изображения большей части протеома (который имеет медианное значение). срок службы 8,12 дня и в среднем 10,7 дня). Для долгоживущих белков мы добавили два дополнительных более длинных импульса (30 и 60 дней), чтобы лучше представить изменение наиболее стабильной фракции протеома.Мы также включили подход пульса и погони, когда мы пульсировали в течение 14 дней, и мы преследовали свет L- 12 C 6 -лизиновая диета в течение 7 дней (используется для оценки пула лизина на дополнительном рисунке 3 и для определения более или менее стабильных белков на дополнительном рисунке 10). Наконец, мы включили подход с импульсом и погоней, при котором погоня происходила одновременно со вторым импульсом, для подтверждения правильности нашей модели (как подробно показано на дополнительном рис.
Мы сделали это, чтобы избежать нежелательных эффектов, таких как потеря веса, которая может произойти из-за смены диеты. В этой работе использовалось несколько различных импульсов маркировки. Для общего определения времени жизни белка мы полагались на короткие импульсы (0, 5, 14 и 21 день), которые мы оценили после предварительного исследования как наилучшее время импульсов для изображения большей части протеома (который имеет медианное значение). срок службы 8,12 дня и в среднем 10,7 дня). Для долгоживущих белков мы добавили два дополнительных более длинных импульса (30 и 60 дней), чтобы лучше представить изменение наиболее стабильной фракции протеома.Мы также включили подход пульса и погони, когда мы пульсировали в течение 14 дней, и мы преследовали свет L- 12 C 6 -лизиновая диета в течение 7 дней (используется для оценки пула лизина на дополнительном рисунке 3 и для определения более или менее стабильных белков на дополнительном рисунке 10). Наконец, мы включили подход с импульсом и погоней, при котором погоня происходила одновременно со вторым импульсом, для подтверждения правильности нашей модели (как подробно показано на дополнительном рис. 9). Все животные получали корм вволю и имели неограниченный доступ к воде. Потребление пищи контролировали ежедневно, чтобы исключить из исследования мышей, которые не ели регулярно. Мозг мыши «полного SILAC», использованной на дополнительном рисунке 3 (> 2 поколения на диете L- 13 C 6 -лизин SILAC), также был приобретен у Silantes.
9). Все животные получали корм вволю и имели неограниченный доступ к воде. Потребление пищи контролировали ежедневно, чтобы исключить из исследования мышей, которые не ели регулярно. Мозг мыши «полного SILAC», использованной на дополнительном рисунке 3 (> 2 поколения на диете L- 13 C 6 -лизин SILAC), также был приобретен у Silantes.
Определение свободного
13 C 6 лизина в плазме крови Сыворотку крови экстрагировали двумя объемами экстракционного буфера (метанол/хлороформ/вода 32.25:12,5:6,25 [об/об/об]). Смесь встряхивали и центрифугировали в течение 5 минут при 2000× g при 4 °C. Объем 20 мкл верхней полярной фазы сушили в токе азота, переводили в летучее состояние с помощью метоксиимино (MEOX)- и триметилсилильных (TMS) производных и анализировали с помощью ГХ-МС, как недавно описано 46 . Для количественного определения лизина анализировали 4 производных ТМС. Отношение 12 C 6 к 13 C 6 лизина определяли путем количественного определения отношения массы к заряду 317 Da/e и 322 Da/e. Всего в этот эксперимент было включено 33 независимых экспериментальных измерения, каждое из которых соответствовало одному животному. Вариация зависит от пищевого поведения каждого животного. Это не проблема в определениях МС, где каждый биологический образец соответствовал пулу из четырех животных (что было необходимо для получения достаточного количества материала для внутриклеточного обогащения синаптических фракций).
Всего в этот эксперимент было включено 33 независимых экспериментальных измерения, каждое из которых соответствовало одному животному. Вариация зависит от пищевого поведения каждого животного. Это не проблема в определениях МС, где каждый биологический образец соответствовал пулу из четырех животных (что было необходимо для получения достаточного количества материала для внутриклеточного обогащения синаптических фракций).
Иммунообогащение β-галактозидазы
Бета-галактозидазу обогащали путем иммунопреципитации анти-β-галактозидазой (Promega, Mannheim, Germany; mAb Z3781) и вытягивания с помощью Dynabeads Protein A (ThermoFisher Scientific, Германия).Вкратце, кору головного мозга мыши рассекали, гомогенизировали, обрабатывали ультразвуком и обрабатывали бензоназой-нуклеазой (Sigma) для удаления нуклеиновых кислот. Для 20 мг образца гомогената 300 мкл Dynabeads Protein A загружали 70 мкг антитела против β-галактозидазы в соответствии с протоколом производителя.
Приготовление и характеристика фракций головного мозга
Чтобы получить достаточное количество материала для фракционирования, ткани (кора или мозжечок) от 4 мышей были объединены для каждой биологической повторности. После извлечения мозга фракции мозга очищали от коры и мозжечка мыши, как описано 22,47 . Вкратце, после вскрытия ткани гомогенизировали в ледяном сахарозном буфере (320 мМ сахарозы, 5 мМ HEPES, pH 7,4) с помощью гомогенизатора из стеклотефлона при 900 об/мин. После сбора образца гомогената для дальнейшего анализа образцы подвергали центрифугированию в течение 2 мин при 1000 × г (для удаления крупного клеточного дебриса, P1) и центрифугированию в течение 12 мин при 15000 × г для осаждения P2. дробь (дополнительный рис.21а). Для получения фракций аксонов проводили дополнительную стадию фракционирования, применяя ступенчато-градиентное центрифугирование (6, 9 и 13% фиколла в сахарозе). Две фракции на двух границах раздела среды с 9% фиколла объединяли (что называется P2’), промывали сахарозным буфером и дополнительно обрабатывали для гипоосмотического лизиса. После лизиса синаптосомальные мембраны осаждали в течение 15 мин при 17000× г , а супернатант центрифугировали в течение 2 ч при 300000× г , чтобы получить аксональный (пресинаптический) осадок (называемый LS2).
После извлечения мозга фракции мозга очищали от коры и мозжечка мыши, как описано 22,47 . Вкратце, после вскрытия ткани гомогенизировали в ледяном сахарозном буфере (320 мМ сахарозы, 5 мМ HEPES, pH 7,4) с помощью гомогенизатора из стеклотефлона при 900 об/мин. После сбора образца гомогената для дальнейшего анализа образцы подвергали центрифугированию в течение 2 мин при 1000 × г (для удаления крупного клеточного дебриса, P1) и центрифугированию в течение 12 мин при 15000 × г для осаждения P2. дробь (дополнительный рис.21а). Для получения фракций аксонов проводили дополнительную стадию фракционирования, применяя ступенчато-градиентное центрифугирование (6, 9 и 13% фиколла в сахарозе). Две фракции на двух границах раздела среды с 9% фиколла объединяли (что называется P2’), промывали сахарозным буфером и дополнительно обрабатывали для гипоосмотического лизиса. После лизиса синаптосомальные мембраны осаждали в течение 15 мин при 17000× г , а супернатант центрифугировали в течение 2 ч при 300000× г , чтобы получить аксональный (пресинаптический) осадок (называемый LS2). Сразу после очистки каждую фракцию быстро замораживали в жидком азоте и хранили при температуре -80 °С до использования в дальнейших экспериментах. Качество фракций головного мозга было подтверждено иммуноблоттингом (дополнительная рис. 21b) с использованием антител, перечисленных в дополнительной таблице 4.
Сразу после очистки каждую фракцию быстро замораживали в жидком азоте и хранили при температуре -80 °С до использования в дальнейших экспериментах. Качество фракций головного мозга было подтверждено иммуноблоттингом (дополнительная рис. 21b) с использованием антител, перечисленных в дополнительной таблице 4.
Масс-спектрометрия
Концентрацию белка в отдельных образцах определяли с помощью набора BCA (ThermoFisher Scientific). Для каждого образца 100 мкг общего белка наносили на предварительно отлитые гели NuPAGE (4–15%, ThermoFisher Scientific).Гели запускали при постоянном напряжении, окрашивали в течение ночи кумасси синим и обесцвечивали водой. После обесцвечивания каждую дорожку разрезали на 23 кусочка геля с помощью гель-резака собственного производства и обрабатывали для расщепления в геле с использованием трипсина 48 (Serva). Элюированные пептиды сушили и ресуспендировали в 5% ацетонитриле и 0,1% растворе муравьиной кислоты, а затем обрабатывали для ЖХ-МС в онлайн-системе ВЭЖХ UltiMate 3000 RSLCnano (ThermoFisher Scientific), соединенной онлайн с Q-Exactive-HF. Пептиды обессоливали на обращенно-фазовой предварительной колонке С18 (длина 3 см, внутренний диаметр 100 мкм, внешний диаметр 360 мкм) в течение 3 мин. Через 3 минуты предварительная колонка была подключена к аналитической колонке (длина 30 см, внутренний диаметр 75 мкм), изготовленной на месте с использованием обращенно-фазовой смолы ReproSil-Pur C18 AQ 1,9 мкм. Пептиды разделяли линейным градиентом 5–50% буфера В (80% ацетонитрила и 0,1% муравьиной кислоты) при скорости потока 10 нл/мин в течение 88 мин и 58 мин градиента. Температуру предколонки и самой колонки во время хроматографии устанавливали на уровне 50 °C.Данные МС были получены путем сканирования прекурсоров в диапазоне масс от 350 до 1600 Да с разрешением 60 000 при м / z 200. 30 лучших ионов-предшественников были выбраны для MS2 с использованием сбора данных, зависящего от данных (DDA). режиме при разрешении 15000 на м / z 200 с максимальным IT 50 мс. Для MS2 фрагментацию HCD выполняли с целевым значением заполнения AGC, равным 1e5 ионам.
Пептиды обессоливали на обращенно-фазовой предварительной колонке С18 (длина 3 см, внутренний диаметр 100 мкм, внешний диаметр 360 мкм) в течение 3 мин. Через 3 минуты предварительная колонка была подключена к аналитической колонке (длина 30 см, внутренний диаметр 75 мкм), изготовленной на месте с использованием обращенно-фазовой смолы ReproSil-Pur C18 AQ 1,9 мкм. Пептиды разделяли линейным градиентом 5–50% буфера В (80% ацетонитрила и 0,1% муравьиной кислоты) при скорости потока 10 нл/мин в течение 88 мин и 58 мин градиента. Температуру предколонки и самой колонки во время хроматографии устанавливали на уровне 50 °C.Данные МС были получены путем сканирования прекурсоров в диапазоне масс от 350 до 1600 Да с разрешением 60 000 при м / z 200. 30 лучших ионов-предшественников были выбраны для MS2 с использованием сбора данных, зависящего от данных (DDA). режиме при разрешении 15000 на м / z 200 с максимальным IT 50 мс. Для MS2 фрагментацию HCD выполняли с целевым значением заполнения AGC, равным 1e5 ионам. Прекурсоры были выделены с окном 1,4 Да. Вариант блокировки массы ( м / z 445.1200) использовался для внутренней повторной калибровки. Для эксперимента на дополнительном рисунке 2 гомогенат мозга мыши «полный SILAC» смешивали с гомогенатом нормального мозга, расщепляли в растворе и обрабатывали для MS.
Прекурсоры были выделены с окном 1,4 Да. Вариант блокировки массы ( м / z 445.1200) использовался для внутренней повторной калибровки. Для эксперимента на дополнительном рисунке 2 гомогенат мозга мыши «полный SILAC» смешивали с гомогенатом нормального мозга, расщепляли в растворе и обрабатывали для MS.
Для целенаправленного обнаружения β-галактозидазы обогащенный белок подвергали расщеплению «на гранулах» с использованием трипсина (Promega). Вкратце, гранулы ресуспендировали в 30 мкл 1% RapiGest (Waters) и нагревали до 95°С в течение 5 мин. Затем добавляли 20 мкл 55 мМ дитиотретола и инкубировали в течение 1 ч при 750 об/мин при комнатной температуре с последующим добавлением 20 мкл 100 мМ йодацетамида в течение 20 мин, 750 об/мин при комнатной температуре в темноте.После разбавления концентрации детергента до 0,1% добавляли 10 мкл 0,1 мкг/мкл трипсина (Promega) и инкубировали в течение ночи при 750 об/мин, 37°С. Трипсин гасили добавлением 20 мкл 10% муравьиной кислоты. Непереваренные пептиды осаждали, а надосадочную жидкость обессоливали и сушили. Пептиды ресуспендировали в 40 мкл 5% ацетонитрила, содержащего 0,1% муравьиной кислоты. Объем 5 мкл ресуспендированных пептидов вводили в преколонку C18 с обращенной фазой (длина 3 см, внутренний диаметр 100 мкм, внешний диаметр 360 мкм), а затем в аналитическую колонку (длина 30 см, внутренний диаметр 75 мкм), приготовленную на месте. с использованием ReproSil-Pur C18 AQ 1.Смола с обращенной фазой 9 мкм. Пептиды разделяли линейным градиентом 5–50% буфера B (80% ацетонитрила и 0,1% муравьиной кислоты) при скорости потока 10 нл/мин в течение 58 мин градиента на масс-спектрометре TSQ Vantage Triple Quadrupole для целевой МС.
Непереваренные пептиды осаждали, а надосадочную жидкость обессоливали и сушили. Пептиды ресуспендировали в 40 мкл 5% ацетонитрила, содержащего 0,1% муравьиной кислоты. Объем 5 мкл ресуспендированных пептидов вводили в преколонку C18 с обращенной фазой (длина 3 см, внутренний диаметр 100 мкм, внешний диаметр 360 мкм), а затем в аналитическую колонку (длина 30 см, внутренний диаметр 75 мкм), приготовленную на месте. с использованием ReproSil-Pur C18 AQ 1.Смола с обращенной фазой 9 мкм. Пептиды разделяли линейным градиентом 5–50% буфера B (80% ацетонитрила и 0,1% муравьиной кислоты) при скорости потока 10 нл/мин в течение 58 мин градиента на масс-спектрометре TSQ Vantage Triple Quadrupole для целевой МС.
Анализ данных масс-спектрометрии
Полученные данные RAW были проанализированы с использованием программного обеспечения MaxQuant 49 версии 1.5.2.8 на базе поисковой системы Andromeda 50 . База данных мыши UniProt (скачана в 2015.11; содержащий 16 727 рассмотренных записей) использовался для идентификации белков. Для определения метки на пептидах множественность была выбрана равной «2», а метка 13 C 6 -лизин отмечена как тяжелая. Количественная оценка белка была основана на «уникальных и бритвенных пептидах» для данного белка. Для каждого белка в каждый из трех моментов времени (5, 14 и 21 день) было измерено три биологических повтора и три технических повтора (всего 27 измерений для каждого типа образца, хотя не все белки всегда были обнаружены в все дроби, см. дополнительные рис.6–7 для подробного описания оценки погрешности при расчете времени жизни). Медианы отношения H/L (тяжелые к легким) среди обнаруженных пептидов (>3) определяли для каждого белка. Соотношения использовали для определения времени жизни белка после моделирования пула аминокислот, как описано ниже. Для анализа долгоживущих белков (дополнительная таблица 1 и рис. 15–16) мы определили специальную базу данных белков с более длительным временем жизни в наших результатах, но мы также включили ранее описанные долгоживущие белки 2,3.
Для определения метки на пептидах множественность была выбрана равной «2», а метка 13 C 6 -лизин отмечена как тяжелая. Количественная оценка белка была основана на «уникальных и бритвенных пептидах» для данного белка. Для каждого белка в каждый из трех моментов времени (5, 14 и 21 день) было измерено три биологических повтора и три технических повтора (всего 27 измерений для каждого типа образца, хотя не все белки всегда были обнаружены в все дроби, см. дополнительные рис.6–7 для подробного описания оценки погрешности при расчете времени жизни). Медианы отношения H/L (тяжелые к легким) среди обнаруженных пептидов (>3) определяли для каждого белка. Соотношения использовали для определения времени жизни белка после моделирования пула аминокислот, как описано ниже. Для анализа долгоживущих белков (дополнительная таблица 1 и рис. 15–16) мы определили специальную базу данных белков с более длительным временем жизни в наших результатах, но мы также включили ранее описанные долгоживущие белки 2,3. и белки, идентифицированные только в безмеченой фракции во всех измеренных пробах.Для более подходящего определения времени жизни этих LLP мы также использовали более длинные импульсы (30 и 60 дней) и сообщали о положении каждого конкретного белка по отношению ко всему протеому как «немеченый процентильный ранг», который положительно коррелирует с их стабильность. Для анализа пептидов, содержащих два лизина (анализ неправильного расщепления; дополнительная рис. 8), мы разработали набор конкретных экспериментов, поскольку мы идентифицировали очень мало пептидов, содержащих два лизина, в нашем исходном наборе данных (~ 15), что указывает на то, что наш 16-часовой протокол пищеварения особенно эффективен.Само по себе это можно рассматривать как положительный аспект в измерениях МС, но это бесполезно для такого рода анализа. Для этого, во-первых, мы оптимизировали протокол, который позволил бы нам обнаруживать пептиды с двумя лизинами в разных формах маркировки. Мы переваривали в растворе гомогенат мозга наших 21-дневных импульсных мышей с использованием трех разных протеаз, то есть химотрипсина, GluC, ArgC, трипсина (ProMega) в течение коротких периодов времени.
и белки, идентифицированные только в безмеченой фракции во всех измеренных пробах.Для более подходящего определения времени жизни этих LLP мы также использовали более длинные импульсы (30 и 60 дней) и сообщали о положении каждого конкретного белка по отношению ко всему протеому как «немеченый процентильный ранг», который положительно коррелирует с их стабильность. Для анализа пептидов, содержащих два лизина (анализ неправильного расщепления; дополнительная рис. 8), мы разработали набор конкретных экспериментов, поскольку мы идентифицировали очень мало пептидов, содержащих два лизина, в нашем исходном наборе данных (~ 15), что указывает на то, что наш 16-часовой протокол пищеварения особенно эффективен.Само по себе это можно рассматривать как положительный аспект в измерениях МС, но это бесполезно для такого рода анализа. Для этого, во-первых, мы оптимизировали протокол, который позволил бы нам обнаруживать пептиды с двумя лизинами в разных формах маркировки. Мы переваривали в растворе гомогенат мозга наших 21-дневных импульсных мышей с использованием трех разных протеаз, то есть химотрипсина, GluC, ArgC, трипсина (ProMega) в течение коротких периодов времени. Вкратце, 20 мкг гомогената денатурировали с использованием 10 мкл 1% RapiGest (Waters) при 95 °C в течение 5 минут.Дисульфидные связи восстанавливали с использованием 10 мМ ДТТ с последующим алкилированием с использованием 55 мМ иодацетамида в течение 30 мин при 37°С, 750 об/мин. Белки расщепляли при соотношении фермента к белку 1:100 с использованием 4 протеиназ по отдельности в течение 2 и 4 часов. Реакцию переваривания гасили подкислением с использованием 20 мкл 10% ТФУ. Непереваренные белки осаждали центрифугированием на максимальной скорости (10 000 об/мин) в течение 15–20 мин в настольной центрифуге. Супернатант обессоливали с помощью StageTips. Среди протестированных условий мы получили наилучшие результаты при 2-часовой инкубации с трипсином.В этом случае мы наблюдали наибольшее количество пептидов, содержащих два лизина (~170 пептидов). Среди них 34 были надежно измерены в трех разных биологических повторностях в форме с нулевым, одним и двумя 13C-лизинами, и они представлены на дополнительном рисунке 8.
Вкратце, 20 мкг гомогената денатурировали с использованием 10 мкл 1% RapiGest (Waters) при 95 °C в течение 5 минут.Дисульфидные связи восстанавливали с использованием 10 мМ ДТТ с последующим алкилированием с использованием 55 мМ иодацетамида в течение 30 мин при 37°С, 750 об/мин. Белки расщепляли при соотношении фермента к белку 1:100 с использованием 4 протеиназ по отдельности в течение 2 и 4 часов. Реакцию переваривания гасили подкислением с использованием 20 мкл 10% ТФУ. Непереваренные белки осаждали центрифугированием на максимальной скорости (10 000 об/мин) в течение 15–20 мин в настольной центрифуге. Супернатант обессоливали с помощью StageTips. Среди протестированных условий мы получили наилучшие результаты при 2-часовой инкубации с трипсином.В этом случае мы наблюдали наибольшее количество пептидов, содержащих два лизина (~170 пептидов). Среди них 34 были надежно измерены в трех разных биологических повторностях в форме с нулевым, одним и двумя 13C-лизинами, и они представлены на дополнительном рисунке 8. Для анализа данных двойного импульса in vivo (дополнительный рисунок 9 ) мы использовали только уникальные пептиды, которые были надежно обнаружены во всех четырех формах (легкий, Lys6, Arg10 и Lys6-Arg10) с помощью этой схемы пульсации (дополнительная рис. 9a).Проценты, указанные на дополнительных рисунках 9c-h, относятся к общему количеству, полученному из суммы всех интенсивностей (свет, Lys6, Arg10 и Lys6-Arg10). Поскольку мы не измеряли пул аргинина, мы оценили эффективность лизина, оптимизировав только связанный с ним параметр b (1/тау sol ) для модели с аргинином, в то время как все остальные параметры были ограничены параметрами, обнаруженными в модели только с лизином. Из-за метаболизма аргинина в пролин мы анализировали только пептиды, содержащие один лизин, один аргинин и не содержащие пролин.Если для одного белка было обнаружено более одного уникального пептида, значения усреднялись для одного и того же белка.
Для анализа данных двойного импульса in vivo (дополнительный рисунок 9 ) мы использовали только уникальные пептиды, которые были надежно обнаружены во всех четырех формах (легкий, Lys6, Arg10 и Lys6-Arg10) с помощью этой схемы пульсации (дополнительная рис. 9a).Проценты, указанные на дополнительных рисунках 9c-h, относятся к общему количеству, полученному из суммы всех интенсивностей (свет, Lys6, Arg10 и Lys6-Arg10). Поскольку мы не измеряли пул аргинина, мы оценили эффективность лизина, оптимизировав только связанный с ним параметр b (1/тау sol ) для модели с аргинином, в то время как все остальные параметры были ограничены параметрами, обнаруженными в модели только с лизином. Из-за метаболизма аргинина в пролин мы анализировали только пептиды, содержащие один лизин, один аргинин и не содержащие пролин.Если для одного белка было обнаружено более одного уникального пептида, значения усреднялись для одного и того же белка.
Целевые эксперименты по МС для обнаружения β-галактозидазы были проанализированы с помощью Skyline (версия 3. 1).
1).
Количественное определение белков
Для получения значений белков iBAQ 10 мкг гомогената коры головного мозга и 10 мкг UPS2 (смесь Universal Protein Dynamic Range Standard, содержащая очищенные 48 белков человека; Sigma) подвергали расщеплению в растворе с использованием трипсина. и анализировали методом ЖХ-МС/МС на масс-спектрометре Orbitrap Fusion Tribrid.Образец гомогената коры головного мозга и UPS2 измеряли семь раз, при этом общее количество белка на колонке составляло 1 мкг. Файлы RAW были проанализированы с использованием программного обеспечения MaxQuant 49 версии 1.5.2.8 на основе поисковой системы Andromeda 50 . База данных UniProt для мышей (загружена 11 ноября 2015 г.; содержит 16 727 проверенных записей) и база данных UPS2 (загружена с веб-сайта Sigma) использовались для идентификации и количественного определения белков. Опция MaxQuant iBAQ была отмечена для анализа.Кроме того, полученные значения iBAQ 16 были нанесены на график относительно известных количеств белков в стандарте UPS2. Калибровочные наклоны были рассчитаны, как описано 23 , взяв средние значения технических повторов. Абсолютное количество белков, присутствующих во фракциях головного мозга, рассчитывали методом линейной регрессии. Все загрязняющие вещества были удалены из списка белков, а содержание белка было усреднено по семи повторностям после нормализации медианы и выражено как log 10 + 10 нормализованных интенсивностей, как это часто делается с этой типологией данных.Количественную оценку содержания белка в культуре клеток проводили с помощью LFQ, как описано 51 .
Калибровочные наклоны были рассчитаны, как описано 23 , взяв средние значения технических повторов. Абсолютное количество белков, присутствующих во фракциях головного мозга, рассчитывали методом линейной регрессии. Все загрязняющие вещества были удалены из списка белков, а содержание белка было усреднено по семи повторностям после нормализации медианы и выражено как log 10 + 10 нормализованных интенсивностей, как это часто делается с этой типологией данных.Количественную оценку содержания белка в культуре клеток проводили с помощью LFQ, как описано 51 .
Моделирование пула аминокислот и определение продолжительности жизни
Лизин у животных присутствует по крайней мере в двух пулах: пуле растворимого (свободного) лизина и пуле, иммобилизованном в белки 52 . При кормлении рационом SILAC 13 C 6 -лизины (тяжелые лизины, H sol ) включаются в пул свободного лизина (дополнительная рис. 3с), смешивая с немечеными лизинами (легкие лизины, L золь ). Поскольку пул растворимого лизина используется для синтеза белка, тяжелые лизины из этого пула входят в пул, иммобилизованный в белках ( H prot ). В то же время деградация белка мобилизует лизины из ранее существовавших белков ( L prot , а позже также H prot ) в пул растворимого лизина. В конце концов, лизины удаляются с экскрецией.Во время кормления с 13 C 6 -Lysines, эти четыре населения Lysines ( л Соль , H SOL
3с), смешивая с немечеными лизинами (легкие лизины, L золь ). Поскольку пул растворимого лизина используется для синтеза белка, тяжелые лизины из этого пула входят в пул, иммобилизованный в белках ( H prot ). В то же время деградация белка мобилизует лизины из ранее существовавших белков ( L prot , а позже также H prot ) в пул растворимого лизина. В конце концов, лизины удаляются с экскрецией.Во время кормления с 13 C 6 -Lysines, эти четыре населения Lysines ( л Соль , H SOL
(1)
$$\frac{{{\mathrm d}H _{\mathrm {prot}}}}{{{\mathrm d}t}} = — a \times H_{\mathrm {prot}} + a \times H _ {\ mathrm {соль}} $ $
(2)
$$\frac{{{\mathrm d}L _{\mathrm {sol}}}}{{{\mathrm d}t}} = — r \times a \times L _{\mathrm {sol}} + r \times a \times L_{\mathrm {prot}} — b \times L_{\mathrm {sol}}$$
(3)
$$\frac{{{\mathrm {d}}H_{{\mathrm {sol}}}}}{{{\mathrm {d}}t}} = — r \times a \times H_{{ \mathrm {sol}}} + r \times a \times H_{{\mathrm {prot}}} — b \times H_{{\mathrm {sol}}} + c$$
(4)
, где \(a = 1/\tau _{{\mathrm {degr}}}\), \(b = 1/\tau _{{\mathrm {sol}}}\) и c соответствующие скорости деградации белка, экскреции лизина и кормления тяжелым лизином. Учитывая, что общее количество растворимых лизинов сохраняется, лизины, которые всасываются, также должны выводиться из организма. Таким образом, четвертое уравнение можно еще больше упростить, используя:
(5)
Учитывая, что общее количество растворимых лизинов сохраняется, лизины, которые всасываются, также должны выводиться из организма. Таким образом, четвертое уравнение можно еще больше упростить, используя:
(5)
Параметр r учитывает размеры двух пулов, а именно:
$$r = \frac{{N \times S_{{\mathrm {prot}}}}}{{S_{{\mathrm {соль}}}}}$$
(6)
S prot указывает общее количество белков, S sol общее количество свободно доступных лизинов, а N среднее количество лизинов, включенных в один белок.Таким образом, на представляет собой отношение количества лизинов, включенных в белки, к количеству свободно доступных лизинов.
a , b и r являются единственными независимыми параметрами уравнения. Решение связанной системы дифференциальных уравнений с использованием начальных условий \(H_{{\mathrm {sol}}}\left( 0 \right) = 0\), \(H_{{\mathrm {prot}}}\left( 0 \right) = 0\), \(L_{{\mathrm {sol}}}\left( 0 \right) = 1\) и \(L_{{\mathrm {prot}}}\left( 0 \right) = 1\), находим аналитическое выражение для \(H_{{\mathrm {sol}}}\left( t \right)\), \(H_{{\mathrm {prot}}}\left ( t \right)\), \(L_{{\mathrm {sol}}}\left( t \right)\) и \(L_{{\mathrm {prot}}}\left( t \right) \). 2}}$$
2}}$$
(11)
Обратите внимание, что ранее наблюдалась двойная экспоненциальная «двухфазная» динамика пула 5 , однако без формальной математической обработки.
После моделирования пула растворимых лизинов мы приняли во внимание отдельные интересующие белки (POI). В дальнейшем мы снова предполагаем, что общее количество POI сохраняется с течением времени. Для простоты мы не учитывали незначительный вклад лизинов, высвобождаемых из одного POI, в растворимый пул. Затем динамика отдельного POI описывается следующим дифференциальным уравнением: }t}} = — \frac{1}{{\tau _{\mathrm{poi}}}} \times H_{{\mathrm {poi}}} + \frac{1}{{\tau _{{ \mathrm {poi}}}}} \times H_{{\mathrm {sol}}}$$
(12)
где \(1{\mathrm{/}}\tau _{{\mathrm {poi}}}\) – скорость, с которой портится POI.{t/\tau _{{\mathrm {poi}}} — t/\tau _2}} \right)}}{{\tau _2 — \tau _{{\mathrm {poi}}}}}} \ справа)}$$
(13)
Этот результат согласуется с работой Гуана и его сотрудников 13 . {t/\tau _{{\mathrm {poi}}} — t/\tau _2}} \right)} }{{\tau _2 — \tau _{{\mathrm {poi}}}}}} \right)}$$
{t/\tau _{{\mathrm {poi}}} — t/\tau _2}} \right)} }{{\tau _2 — \tau _{{\mathrm {poi}}}}}} \right)}$$
(20)
Чтобы определить времена жизни ( t 1/2 ) всех белков, можно подобрать экспериментальные данные для каждого отдельного POI с помощью функции для \(H_{{\mathrm {poi}}}\left( t \right)\) как указано выше.Однако, поскольку все белки построены из одного и того же пула аминокислот, мы рассматриваем параметры уравнения a , b и r как глобальные, т. е. общие для всех белков, и извлекаем из них только периоды полураспада белков. человек подходит, тем самым получая гораздо более надежные результаты соответствия. Мы провели оптимизацию параметров уравнения, чтобы получить значения { a , b , r } растворимого пула \(H_{{\mathrm {sol}}}\left( t \right) \), что лучше всего описывает наши экспериментальные данные.Поэтому мы сопоставили динамику маркировки всех POI, которые были надежно обнаружены в любое время в гомогенате коры головного мозга (2409), с различными комбинациями параметров глобального уравнения. Чтобы учесть возможные эффекты, связанные с деградацией всего протеома, мы включили в эту настройку также данные, полученные в ходе экспериментов с отслеживанием импульсов, схематически представленных на дополнительных рисунках 3e – f. Мы сравнили сумму квадратов отклонений измеренных точек данных от подобранных кривых для полного набора данных.Минимум этого значения, указывающий на лучшую комбинацию параметров уравнения, использовался для подбора экспериментальных данных всех POI с использованием функции \(H_{{\mathrm {poi}}}\left(t\right)\) (дополнительный рис. . 3 и см. Дополнительный рис. 5 для некоторых подходящих примеров). Кроме того, мы также проверили, что растворимый пул \(H_{{\mathrm {sol}}}\left( t \right)\), полученный в результате оптимизации параметров уравнения, хорошо согласуется со всеми другими экспериментальными показателями, которые мы наблюдаем из других пять совершенно разных наборов экспериментов (измерения плазмы ГХ-МС на дополнительном рис.4b, трансгенный подход на дополнительном рисунке 4f, анализ неправильного расщепления на дополнительном рисунке 8, подход с двойным импульсом in vivo на дополнительном рисунке 9 и подход импульса и погони на дополнительном рисунке 3i).
Чтобы учесть возможные эффекты, связанные с деградацией всего протеома, мы включили в эту настройку также данные, полученные в ходе экспериментов с отслеживанием импульсов, схематически представленных на дополнительных рисунках 3e – f. Мы сравнили сумму квадратов отклонений измеренных точек данных от подобранных кривых для полного набора данных.Минимум этого значения, указывающий на лучшую комбинацию параметров уравнения, использовался для подбора экспериментальных данных всех POI с использованием функции \(H_{{\mathrm {poi}}}\left(t\right)\) (дополнительный рис. . 3 и см. Дополнительный рис. 5 для некоторых подходящих примеров). Кроме того, мы также проверили, что растворимый пул \(H_{{\mathrm {sol}}}\left( t \right)\), полученный в результате оптимизации параметров уравнения, хорошо согласуется со всеми другими экспериментальными показателями, которые мы наблюдаем из других пять совершенно разных наборов экспериментов (измерения плазмы ГХ-МС на дополнительном рис.4b, трансгенный подход на дополнительном рисунке 4f, анализ неправильного расщепления на дополнительном рисунке 8, подход с двойным импульсом in vivo на дополнительном рисунке 9 и подход импульса и погони на дополнительном рисунке 3i).
Секвенирование и количественный анализ экстракции РНК
Тотальную РНК экстрагировали из гомогената мгновенно замороженной ткани с использованием реагента QIAzol Lysis (Qiagen GmbH), обработанного спин-колонками RNeasy и ДНКазой для очистки РНК и удаления остаточной загрязняющей геномной ДНК.Подготовку библиотеки для секвенирования мРНК проводили в соответствии со стандартными протоколами Illumina с использованием набора TruSeq RNA Sample Prep Kit v2. Библиотеки проверяли на качество и количественно определяли с использованием NanoDrop 2000 (ThermoFisher Scientific), биоанализатора Agilent 2100 (Agilent Technologies) и Qubit (ThermoFisher Scientific). Данные одностороннего секвенирования 50 bp были получены на Illumina HiSeq2000™ с использованием наборов Illumina TrueSeq SBS. Данные, представленные на рис. 1b, выражены в виде log 10 количества мРНК, выраженного в виде фрагментов на миллион килобаз.
Сортировка ядер по типам клеток
Сортировку ядер нейронов и глии проводили, как описано 53 с небольшими изменениями. Вкратце, кору головного мозга быстрозамороженных мышей гомогенизировали, сшивали (1% формальдегид) и гасили (0,125 М глицина) при комнатной температуре в течение 5 мин. Неочищенные осадки ядер дополнительно очищали в градиенте сахарозы, окрашивали конъюгированным анти-NeuN-Alexa488 (MAB377X, 1:1000) в течение 20 минут и повторно суспендировали в буфере для суспензии ядер (0.2% твин-20, 1% БСА, 1x полный коктейль ингибиторов протеаз Roche без ЭДТА в 1x PBS). В качестве отрицательного контроля использовали антимышиный Alexa488 (A-11029, 1:2000). Сортировка проводилась с помощью BD FACSARIA III с соплом 85 мкм. Гейтинг был выполнен на основе размера ядер, исключения агрегатов и флуоресценции Alexa488. Ядра сортировали в пробирки Falcon, покрытые БСА, центрифугировали, мгновенно замораживали и хранили при -80 °C до дальнейшей обработки. Эффективность сортировки была подтверждена установкой небольшой фракции отсортированных ядер и визуализацией в перевернутом эпифлуоресцентном микроскопе Nikon Ti (Nikon Corporation, Тиёда, Токио, Япония), оснащенном воздушным объективом ×20.
Вкратце, кору головного мозга быстрозамороженных мышей гомогенизировали, сшивали (1% формальдегид) и гасили (0,125 М глицина) при комнатной температуре в течение 5 мин. Неочищенные осадки ядер дополнительно очищали в градиенте сахарозы, окрашивали конъюгированным анти-NeuN-Alexa488 (MAB377X, 1:1000) в течение 20 минут и повторно суспендировали в буфере для суспензии ядер (0.2% твин-20, 1% БСА, 1x полный коктейль ингибиторов протеаз Roche без ЭДТА в 1x PBS). В качестве отрицательного контроля использовали антимышиный Alexa488 (A-11029, 1:2000). Сортировка проводилась с помощью BD FACSARIA III с соплом 85 мкм. Гейтинг был выполнен на основе размера ядер, исключения агрегатов и флуоресценции Alexa488. Ядра сортировали в пробирки Falcon, покрытые БСА, центрифугировали, мгновенно замораживали и хранили при -80 °C до дальнейшей обработки. Эффективность сортировки была подтверждена установкой небольшой фракции отсортированных ядер и визуализацией в перевернутом эпифлуоресцентном микроскопе Nikon Ti (Nikon Corporation, Тиёда, Токио, Япония), оснащенном воздушным объективом ×20. После сортировки ядра расщепляли в геле и обрабатывали для MS, как описано в разделе «Методы».
После сортировки ядра расщепляли в геле и обрабатывали для MS, как описано в разделе «Методы».
Культуры гиппокампа и фармакологическая обработка
Первые покровные стекла были приготовлены путем их очистки азотной кислотой в течение ночи. После кислотной обработки покровные стекла тщательно промывали бидистиллированной водой, стерилизовали и на ночь покрывали 1 мг/мл PLL. После покрытия покровные стекла тщательно промывали стерильной водой и инкубировали с посевной средой (MEM с добавлением 10% лошадиной сыворотки, 3.3 мМ глюкозы и 2 мМ глутамина). Культуры нейронов гиппокампа получали из диссоциированного гиппокампа мышей E18 54 . Короче говоря, мозг был извлечен из черепов мышей E18, а гиппокампы были выделены под микроскопом для вскрытия. После трех промывок HBSS (Invitrogen, Waltham, MA, USA) для удаления остатков тканей гиппокампы инкубировали в течение 15 минут в растворе фермента, как описано 54 . После рассечения нейроны высевали при концентрации ~30 000/см 2 и оставляли для прикрепления на 1–4 ч при 37°C в клеточном инкубаторе с 5% CO 2 .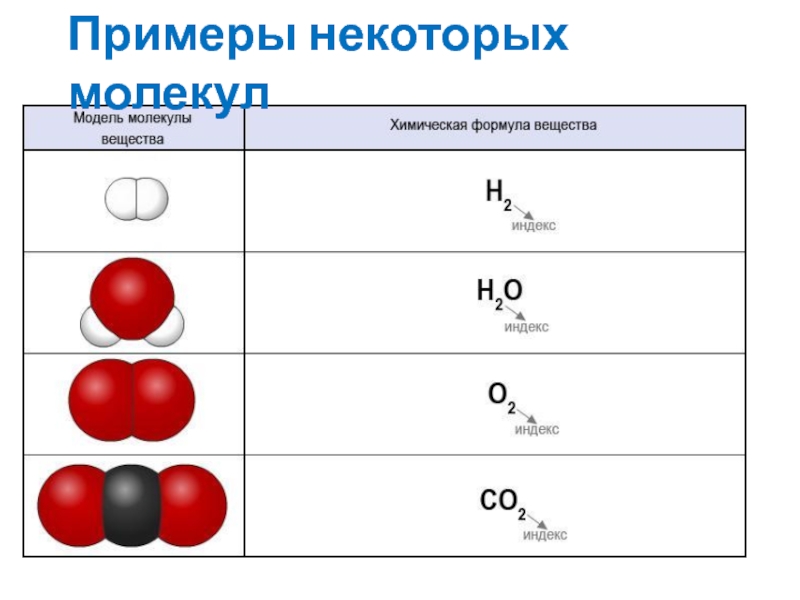 После адгезии среду заменили на среду Neurobasal-A (Gibco, Life Technologies, Карлсбад, Калифорния, США), содержащую 1:50 добавку B27 (Gibco) и 1:100 GlutaMAX (Gibco). Нейроны хранили в культуре при 37 °C и 5% CO 2 в течение 15 дней перед фармакологической обработкой. Культуры обрабатывали в течение 24 часов либо лактацистином (Santa Cruz; CAS 133343-34-7) в конечной концентрации 10 мкМ 42 , либо циклогексимидом (SIGMA; C4859) в конечной концентрации 75 мкМ. Никаких явных признаков клеточного стресса после лечения не наблюдалось.Образцы экстрагировали 8 М мочевиной и осаждали 4 объемами ацетона. Ресуспендированный лизат после оценки содержания белка трипсинизировали в растворе в течение ночи и загружали в масс-спектрометр Q-Exactive Hybrid Quadrupole Orbitrap. Содержание белка определяли с помощью LFQ, как описано 51 , и относительную разницу в содержании белка определяли относительно необработанного контроля. Для этих экспериментов использовали три биологических повтора, соответствующие трем независимым культурам нейронов.
После адгезии среду заменили на среду Neurobasal-A (Gibco, Life Technologies, Карлсбад, Калифорния, США), содержащую 1:50 добавку B27 (Gibco) и 1:100 GlutaMAX (Gibco). Нейроны хранили в культуре при 37 °C и 5% CO 2 в течение 15 дней перед фармакологической обработкой. Культуры обрабатывали в течение 24 часов либо лактацистином (Santa Cruz; CAS 133343-34-7) в конечной концентрации 10 мкМ 42 , либо циклогексимидом (SIGMA; C4859) в конечной концентрации 75 мкМ. Никаких явных признаков клеточного стресса после лечения не наблюдалось.Образцы экстрагировали 8 М мочевиной и осаждали 4 объемами ацетона. Ресуспендированный лизат после оценки содержания белка трипсинизировали в растворе в течение ночи и загружали в масс-спектрометр Q-Exactive Hybrid Quadrupole Orbitrap. Содержание белка определяли с помощью LFQ, как описано 51 , и относительную разницу в содержании белка определяли относительно необработанного контроля. Для этих экспериментов использовали три биологических повтора, соответствующие трем независимым культурам нейронов. Изменение содержания белка после лечения по сравнению с контролем показано на дополнительном рисунке 23 в зависимости от времени жизни белка, которое было измерено in vivo в образце гомогената мозга.
Изменение содержания белка после лечения по сравнению с контролем показано на дополнительном рисунке 23 в зависимости от времени жизни белка, которое было измерено in vivo в образце гомогената мозга.
Определение поверхностей белков
Оценки поверхности белков (дополнительный рисунок 23e) были получены на основе информации о структурах белков, полученной из базы данных белков (PDB). Были проанализированы следующие белки: актин, AMPAR, амфифизин, AP1 бета, AP1 mu, AP180, фагот, киназа CAMKII, цитратаконитаза, цитратсинтаза, тяжелая цепь клатрина, легкая цепь клатрина, ClC3, комплекс 1, комплекс 2 и комплекс 3. митохондриальной дыхательной цепи, креатинкиназа типа U, CSP, динамин, эндофилин, эпсин1, фАТФаза альфа, бета, дельта, эпсилон и гамма, GABABR1, гефирин, гексокиназа, гомер, интерсектин1, l1cam, mGluR1, mGluR5, моноаминоксидаза а, munc18, нейрексин, нейролигин, NFL, NMDAR, nrcam, пикколо, PIPKIgamma, psd95, rab3a, rab3b, rab3c, RIM1, SCAMP1, shank2, SNAP25, SNAP29, SV2a, SV2b, SV2c, синапсин1, синапсин2, синапсин3, синаптобрефизин2, синаптотагмин1, синдапин, синтаксин1а, тубулин, VAMP4, vGlut1, vGlut2, vti1b, субъединицы вАТФазы а, с и d и растворимый комплекс вАТФазы (субъединицы АН). Большинство структур ранее были описаны в наших публикациях 22,23 . Для белков, которых не было в наших предыдущих публикациях, были созданы полные структуры путем объединения структурных данных из банка данных белков (www.rcsb.org) с дополнительной информацией, основанной на аналогичных белках. В деталях использовались следующие идентификаторы PDB: AMPAR, 3KG2; нейролигин 3BIX и 3BIW; нейрексин 3BIW и 2H0B; l1cam, 1CFB; тубулин, 1JFF. Доступная для растворителя поверхность на основе треугольной сетки (SAS) была рассчитана путем вычитания сеток, которые были экранированы другими белками или липидными мембранами, что привело к наилучшему приближению поверхности полигона для открытой поверхности.
Большинство структур ранее были описаны в наших публикациях 22,23 . Для белков, которых не было в наших предыдущих публикациях, были созданы полные структуры путем объединения структурных данных из банка данных белков (www.rcsb.org) с дополнительной информацией, основанной на аналогичных белках. В деталях использовались следующие идентификаторы PDB: AMPAR, 3KG2; нейролигин 3BIX и 3BIW; нейрексин 3BIW и 2H0B; l1cam, 1CFB; тубулин, 1JFF. Доступная для растворителя поверхность на основе треугольной сетки (SAS) была рассчитана путем вычитания сеток, которые были экранированы другими белками или липидными мембранами, что привело к наилучшему приближению поверхности полигона для открытой поверхности.
Биоинформатика, представление дат, анализ данных и статистика
Информация о белках, такая как длина белка, была получена из The Universal Protein Resource (UniProt Consortium 55 ). Изоэлектрическую точку рассчитывали с помощью ExPASy (https://web.expasy. org/compute_pi/), а общее среднее гидропатии (GRAVY) рассчитывали с помощью онлайн-инструмента для обработки последовательностей (http://www.bioinformatics.org/sms2). /protein_gravy.html). Для прогнозирования беспорядка использовался IUPred 56 с отсечкой 0.5 для определения нарушения в режиме «короткий или длинный» с каноническими последовательностями белков, полученными от Uniprot. Для каждого белка сообщается процент последовательности, превышающей этот порог. Из-за несоответствия информации о классификации белков и локализации белков головного мозга, для классификации белков мы полагались на базу данных, созданную путем ручной интеграции трех других баз данных (Synprot 19 , SynaptomeDB 20 и G2C:Genes to Cognition 21). ), наряду с предыдущими публикациями 22,23 , получив надежную локализацию/принадлежность ~ 1200 белков, как подробно описано в дополнительных данных 1.Мы использовали эту категоризацию для классификации, представленной на рис.
org/compute_pi/), а общее среднее гидропатии (GRAVY) рассчитывали с помощью онлайн-инструмента для обработки последовательностей (http://www.bioinformatics.org/sms2). /protein_gravy.html). Для прогнозирования беспорядка использовался IUPred 56 с отсечкой 0.5 для определения нарушения в режиме «короткий или длинный» с каноническими последовательностями белков, полученными от Uniprot. Для каждого белка сообщается процент последовательности, превышающей этот порог. Из-за несоответствия информации о классификации белков и локализации белков головного мозга, для классификации белков мы полагались на базу данных, созданную путем ручной интеграции трех других баз данных (Synprot 19 , SynaptomeDB 20 и G2C:Genes to Cognition 21). ), наряду с предыдущими публикациями 22,23 , получив надежную локализацию/принадлежность ~ 1200 белков, как подробно описано в дополнительных данных 1.Мы использовали эту категоризацию для классификации, представленной на рис. 2, 3 и дополнительный рисунок 20. Для семейства белков и принадлежности к молекулярному комплексу мы полагались на ранее опубликованные данные 55 . Все анализы проводились с помощью программ Matlab (The Mathworks Inc., Natick, MA, USA), GraphPad Prism (GraphPad Software) или SigmaPlot (Systat Software) с использованием самописных программ. Для нечеткой кластеризации c-средних мы использовали соответствующую функцию Fuzzy Logic Toolbox.Время жизни определяли, как описано выше в разделе «Моделирование пула аминокислот и математическое определение времени жизни». Функциональный анализ обогащения был выполнен с помощью набора инструментов GEne SeT AnaLysis Toolkit 57 на основе WEB или с помощью STRING 36 , функционального инструмента ассоциации белков для анализа и визуализации белковых сетей. Для функционального анализа обогащения мы полагались на анализ обогащения сверхпредставления (ORA) и на неизбыточные модули онтологии генов, чтобы избежать терминов-синонимов.
2, 3 и дополнительный рисунок 20. Для семейства белков и принадлежности к молекулярному комплексу мы полагались на ранее опубликованные данные 55 . Все анализы проводились с помощью программ Matlab (The Mathworks Inc., Natick, MA, USA), GraphPad Prism (GraphPad Software) или SigmaPlot (Systat Software) с использованием самописных программ. Для нечеткой кластеризации c-средних мы использовали соответствующую функцию Fuzzy Logic Toolbox.Время жизни определяли, как описано выше в разделе «Моделирование пула аминокислот и математическое определение времени жизни». Функциональный анализ обогащения был выполнен с помощью набора инструментов GEne SeT AnaLysis Toolkit 57 на основе WEB или с помощью STRING 36 , функционального инструмента ассоциации белков для анализа и визуализации белковых сетей. Для функционального анализа обогащения мы полагались на анализ обогащения сверхпредставления (ORA) и на неизбыточные модули онтологии генов, чтобы избежать терминов-синонимов. Значения P для этого анализа были скорректированы с помощью метода Холма-Бонферрони, а о частоте ложных открытий сообщалось как –log 10 (где более высокие значения указывают на более важную значимость). Трехмерное представление синапса и синаптического пузырька с соответствующим количеством молекул было адаптировано из нашей предыдущей работы 23 . Для отсортированных ядер, чтобы избежать какой-либо возможной систематической ошибки при обнаружении, время жизни белка рассчитывали только для белков, которые были обнаружены как в нейронах, так и в глиальных клетках, где разница в интенсивности между двумя типами клеток составляла ≤500%.Специфичность клеточной экспрессии для микроглии, нейронов, астроцитов и олигодендроцитов была определена на основе данных, опубликованных Шармой и соавторами, поскольку они были более чем в 10 раз более распространены в одном типе клеток по сравнению со всеми другими типами клеток 37 (в соответствии с предложенным принципом).
Значения P для этого анализа были скорректированы с помощью метода Холма-Бонферрони, а о частоте ложных открытий сообщалось как –log 10 (где более высокие значения указывают на более важную значимость). Трехмерное представление синапса и синаптического пузырька с соответствующим количеством молекул было адаптировано из нашей предыдущей работы 23 . Для отсортированных ядер, чтобы избежать какой-либо возможной систематической ошибки при обнаружении, время жизни белка рассчитывали только для белков, которые были обнаружены как в нейронах, так и в глиальных клетках, где разница в интенсивности между двумя типами клеток составляла ≤500%.Специфичность клеточной экспрессии для микроглии, нейронов, астроцитов и олигодендроцитов была определена на основе данных, опубликованных Шармой и соавторами, поскольку они были более чем в 10 раз более распространены в одном типе клеток по сравнению со всеми другими типами клеток 37 (в соответствии с предложенным принципом). авторами). Данные для ГАМКергических и глутаматергических нейронов были получены из предыдущей работы 38 . Результаты по уменьшению деградации белка были получены из работы Хакима и сотрудников 42 и выражены, как и в исходной работе, как log 2 H/M.Диаграммы Венна первоначально были построены с помощью Венни (http://bioinfogp.cnb.csic.es/tools/venny/). Расчет ошибки в определении продолжительности жизни резюмируется для наборов данных о мозге на дополнительных рисунках 6–7. Среднее значение r 2 фитингов и средний 95% доверительный интервал на дополнительном рисунке 6b, c указаны для всех наборов данных, и они в значительной степени перекрываются. Поверхности белков определяли, как указано в предыдущем разделе.Экспонированные поверхности для растворимых белков считались равными их фактическим поверхностям. Для трансмембранных или прикрепленных к мембране белков мы считали обращенные к мембране стороны неэкспонированными и соответственно уменьшали открытые поверхности.
авторами). Данные для ГАМКергических и глутаматергических нейронов были получены из предыдущей работы 38 . Результаты по уменьшению деградации белка были получены из работы Хакима и сотрудников 42 и выражены, как и в исходной работе, как log 2 H/M.Диаграммы Венна первоначально были построены с помощью Венни (http://bioinfogp.cnb.csic.es/tools/venny/). Расчет ошибки в определении продолжительности жизни резюмируется для наборов данных о мозге на дополнительных рисунках 6–7. Среднее значение r 2 фитингов и средний 95% доверительный интервал на дополнительном рисунке 6b, c указаны для всех наборов данных, и они в значительной степени перекрываются. Поверхности белков определяли, как указано в предыдущем разделе.Экспонированные поверхности для растворимых белков считались равными их фактическим поверхностям. Для трансмембранных или прикрепленных к мембране белков мы считали обращенные к мембране стороны неэкспонированными и соответственно уменьшали открытые поверхности. То же самое было сделано для белков, входящих в белковые комплексы, поскольку поверхности, покрытые белками-партнерами, не считались экспонированными. Дальнейшее восстановление было проведено для белков, которые находятся в полимерах комплексов, таких как тубулин.Для времени жизни белка мы полагались на 95% доверительный интервал, так как это наиболее подходящая мера ошибки для типологии данных, которые мы сообщаем 58 . Все значения P для множественных сравнений были скорректированы с поправкой Бонферрони, и они были рассчитаны из доверительных интервалов, как сообщалось в другом месте 59 .
То же самое было сделано для белков, входящих в белковые комплексы, поскольку поверхности, покрытые белками-партнерами, не считались экспонированными. Дальнейшее восстановление было проведено для белков, которые находятся в полимерах комплексов, таких как тубулин.Для времени жизни белка мы полагались на 95% доверительный интервал, так как это наиболее подходящая мера ошибки для типологии данных, которые мы сообщаем 58 . Все значения P для множественных сравнений были скорректированы с поправкой Бонферрони, и они были рассчитаны из доверительных интервалов, как сообщалось в другом месте 59 .
Проценты указаны в процентах по массе указанных элементов. Индекс | Таблицы Справочник по данным 10.9: Процентный состав — Химия LibreTexts
Информация о питании обычно представлена на этикетке. Процентный составХимикам часто необходимо знать, какие элементы присутствуют в соединении и в каком процентном соотношении. Состав процентов представляет собой массовые проценты каждого элемента в соединении. Он рассчитывается аналогично тому, что было указано для арахисового масла. \[\% \: \text{по массе} = \frac{\text{масса элемента}}{\text{масса соединения}} \times 100\%\] Состав в процентах от массовых данных Пример задачи ниже показывает расчет процентного состава соединения на основе данных о массе. Пример \(\PageIndex{1}\) Известно, что одно недавно синтезированное соединение содержит элементы цинк и кислород. При разложении \(20,00 \: \text{г}\) образца соединения остается \(16,07 \: \text{г}\) цинка. Определить процентный состав соединения. Раствор Шаг 1: Перечислите известные количества и спланируйте проблему. Известный
Неизвестно
Вычтите, чтобы найти массу кислорода в соединении. Разделите массу каждого элемента на массу соединения, чтобы найти процент по массе. Шаг 2: Рассчитать . \[\text{Масса кислорода} = 20,00 \: \text{g} — 16,07 \: \text{g} = 3,93 \: \text{g} \: \ce{O}\] \[\% \: \ce{Zn} = \frac{16. \[\% \: \ce{O} = \frac{3,93 \: \text{g} \: \ce{O}}{20,00 \: \text{g}} \times 100\% = 19,65\ % \: \ce{O}\] Шаг 3: Подумайте о своем результате. Расчеты имеют смысл, поскольку сумма двух процентов составляет \(100\%\). По массе это соединение в основном состоит из цинка. Процентный состав химической формулыПроцентный состав соединения также можно определить по формуле соединения.Нижние индексы в формуле сначала используются для расчета массы каждого элемента в одном моле соединения. Это делится на молярную массу соединения и умножается на \(100\%\). \[\% \: \text{по массе} = \frac{\text{масса элемента в} \: 1 \: \text{моль}}{\text{молярная масса соединения}} \times 100\ %\] Процентный состав данного соединения всегда одинаков, если соединение чистое. Пример \(\PageIndex{2}\) Гептоксид дихлора \(\left( \ce{Cl_2O_7} \right)\) представляет собой высокореакционное соединение, используемое в некоторых реакциях органического синтеза. Раствор Шаг 1: Перечислите известные количества и спланируйте проблему. Известный
Неизвестно
Рассчитайте массовые проценты каждого элемента путем деления массы этого элемента в 1 моле соединения на молярную массу соединения и умножения на \(100\%\). Шаг 2: Расчет. \[\% \ce{Cl} = \frac{70,90 \: \text{g} \: \ce{Cl}}{182,90 \: \text{g}} \times 100\% = 38,76\% \ : \ce{Cl}\] \[\% \: \ce{O} = \frac{112,00 \: \text{g} \: \ce{O}}{182,90 \: \text{g}} \times 100\% = 61,24\ % \: \ce{O}\] Шаг 3: Подумайте о своем результате. Сумма процентов составляет \(100\%\). Процентный состав также может быть использован для определения массы определенного элемента, содержащегося в любой массе соединения.В предыдущем примере задачи было обнаружено, что процентный состав семиокиси дихлора равен \(38,76\% \: \ce{Cl}\) и \(61,24\% \: \ce{O}\). Предположим, вам нужно знать массу хлора и кислорода, присутствующих в образце \(12,50 \: \text{g}\) семиокиси дихлора. Вы можете установить коэффициент пересчета на основе процента по массе каждого элемента: \[12.50 \: \text{g} \: \ce{Cl_2O_7} \times \frac{38.76 \: \text{g} \: \ce{Cl}}{100 \: \text{g} \: \ce{Cl_2O_7}} = 4,845 \: \text{g} \: \ce{Cl}\] \[12.50 \: \text{g} \: \ce{Cl_2O_7} \times \frac{61,24 \: \text{g} \: \ce{O}}{100 \: \text{g} \: \ce{ Cl_2O_7}} = 7,655 \: \text{g} \: \ce{O}\] Сумма двух масс равна \(12,50 \: \text{g}\), масса размера выборки. Резюме
|

 2 Белки
2 Белки Биология, Общие биологические закономерности (9–11 класс): уроки, тесты, задания.
Биология, Общие биологические закономерности (9–11 класс): уроки, тесты, задания. 6
6 Значения Солнечной системы взяты из Арнетта, см. Ниже.Видно, что состав человеческого тела резко отличается от содержания элементов в земной коре. Элементы, на которых основана жизнь, часто обобщаются комбинацией CHONPS, углерода, водорода, кислорода, азота, фосфора и серы. Обратите внимание, что азот редко встречается на Земле, но является основным компонентом белков, рабочих молекул жизни.
Значения Солнечной системы взяты из Арнетта, см. Ниже.Видно, что состав человеческого тела резко отличается от содержания элементов в земной коре. Элементы, на которых основана жизнь, часто обобщаются комбинацией CHONPS, углерода, водорода, кислорода, азота, фосфора и серы. Обратите внимание, что азот редко встречается на Земле, но является основным компонентом белков, рабочих молекул жизни. На этикетке банки с арахисовым маслом указано, что одна порция считается размером \(32 \: \text{g}\). На этикетке также указаны массы различных типов соединений, которые присутствуют в каждой порции. Одна порция содержит \(7 \: \text{г}\) белка, \(15 \: \text{г}\) жира и \(3 \: \text{г}\) сахара. Рассчитав долю белка, жира или сахара в одной порции арахисового масла и переведя значения в проценты, мы можем определить состав арахисового масла в процентах по массе.
На этикетке банки с арахисовым маслом указано, что одна порция считается размером \(32 \: \text{g}\). На этикетке также указаны массы различных типов соединений, которые присутствуют в каждой порции. Одна порция содержит \(7 \: \text{г}\) белка, \(15 \: \text{г}\) жира и \(3 \: \text{г}\) сахара. Рассчитав долю белка, жира или сахара в одной порции арахисового масла и переведя значения в проценты, мы можем определить состав арахисового масла в процентах по массе.
 07 \: \text{g} \: \ce{Zn}}{20.00 \: \text{g}} \times 100\% = 80.35\% \: \ce{Zn}\]
07 \: \text{g} \: \ce{Zn}}{20.00 \: \text{g}} \times 100\% = 80.35\% \: \ce{Zn}\] Рассчитайте процентный состав семиокиси дихлора.
Рассчитайте процентный состав семиокиси дихлора.
