Липиды в плазматической мембране выполняют функцию: Липиды плазматической мембраны — Справочник химика 21
Липиды плазматической мембраны — Справочник химика 21
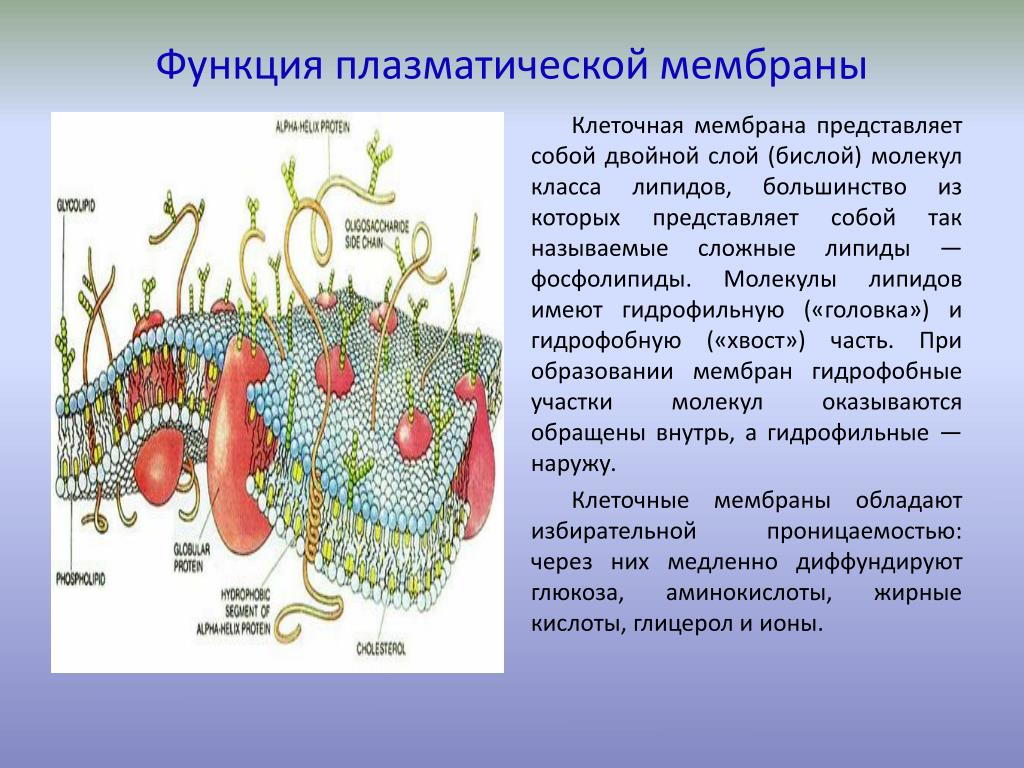
Клетка состоит из протоплазмы, в которой находится ядро, и плазматической мембраны. Непременным условием нормальной работы клетки является проницаемость стенки клетки (которая образована плазматической мембраной) для химических соединений, участвующих в биосинтезе. Материалом плазматической мембраны служат липиды и белки. О белках мы еще будем говорить в гл. 27. Что касается липидов, то отметим прежде всего разнообразие классов соединений, которые относят к этой группе природных веществ жиры, масла, стероиды, терпены. Общим для них являются гидрофобность и растворимость в неполярных растворителях. Поэтому через мембрану клетки легко проникают органические соединения, преимущественно имеющие гидрофобный характер. Сложнее обстоит дело с неорганическими катионами. [c.114]Плазматическая мембрана состоит из двойного липидного слоя.
Содержание запасных жиров определяется составом питательной среды (высоким отношением /N), и эти жиры могут быть выделены непосредственно из клеток. Количество других липидных соединений от состава среды почти не зависит. Эти липиды освобождаются лишь после гидролиза белков и полисахаридов и представляют собой компоненты липопротеинов, входящих в состав плазматической мембраны и внутренних мембран, и липополисахаридов.
На рис. I показан вид плазматической мембраны эритроцита сбоку. Эта фотография, на которой видны две темные линии ( железнодорожные пути ) получена после фиксации клеток четырех-окисью осмия. Линии соответствуют наружному и внутреннему полярным слоям, состоящим из полярных голов мембранных липидов. Светлая зона между линиями соответствует гидрофобной части липидного бислоя, в которой находятся неполярные углеводород-
Плазматическая мембрана состоит из двойного липидного слоя. Гидрофобные концы молекул фосфолипидов и триглицеридов направлены внутрь, а гидрофильные головки -наружу. Благодаря гидрофобным взаимодействиям между остатками жирных кислот, входящих в состав липидов, и электростатическому взаимодействию между гидрофильны- [c.44]
Клетка окружена клеточной или плазматической мембраной, которая отделяет содержимое клетки от межклеточной среды и выполняет важную роль в метаболизме.

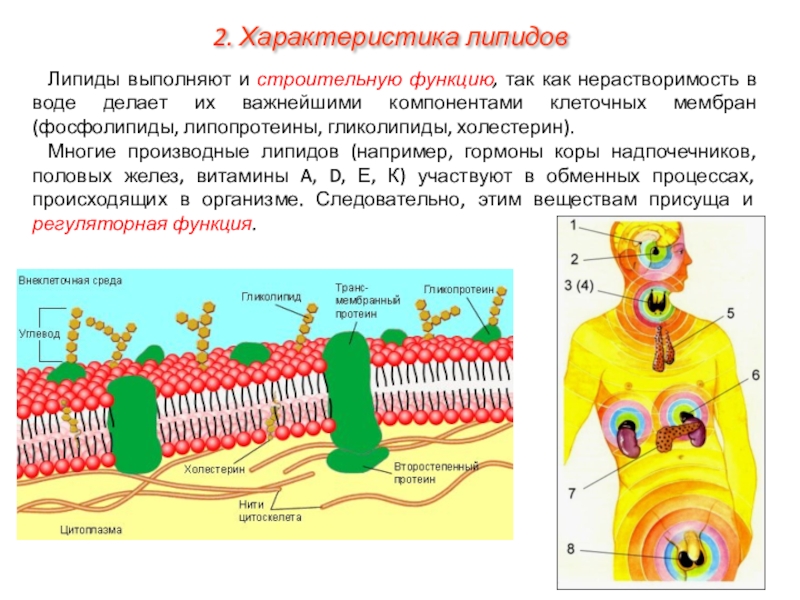
На наружной поверхности плазматической мембраны всех ядерных клеток имеются углеводы, связанные с белками (гликопротеиды) или липидами (липопротеиды). Полагают, что углеводы участвуют в процессах межклеточного узнавания. [c.33]
Несмотря на то что каждому типу мембран присущи определенные липидные и белковые компоненты, основные структурные и функциональные особенности, обсуждаемые в этой главе, характерны как для внутриклеточных, так и для плазматических мембран. Прежде всего нам хотелось бы рассмотреть структуру и организацию главных компонентов всех биологических мембран — липидов, белков и углеводов. Затем мы обсудим механизмы, используемые клетками для транспорта малых молекул через плазматическую мембрану, а также способы поглощения и выделения клетками макромолекул и крупных частиц. В последующих главах будут проанализированы некоторые дополнительные функции плазматической мембраны роль в клеточной адгезии (гл. 14) и в сигнальных функциях (гл. 12).
Прежде всего нам хотелось бы рассмотреть структуру и организацию главных компонентов всех биологических мембран — липидов, белков и углеводов. Затем мы обсудим механизмы, используемые клетками для транспорта малых молекул через плазматическую мембрану, а также способы поглощения и выделения клетками макромолекул и крупных частиц. В последующих главах будут проанализированы некоторые дополнительные функции плазматической мембраны роль в клеточной адгезии (гл. 14) и в сигнальных функциях (гл. 12).
Липиды нерастворимы в воде, но хорошо растворяются в органических растворителях. В большинстве животных клеток они составляют около 50% массы плазматической мембраны животных, а почти все остальное приходится на белки. На 1 мкм липидного бислоя расположено пример-
Окаймленные ямки распределены на поверхности клеток более или менее случайным образом, так что поглощение плазматической мембраны (липиды вместе со специфическими белками-рецепторами) имеет место по всей клеточной поверхности. В неполяризованных клетках поглощенные участки мембраны возвращаются также случайным образом на поверхность клетки. Однако в поляризованных клетках, напри- [c.419]
В неполяризованных клетках поглощенные участки мембраны возвращаются также случайным образом на поверхность клетки. Однако в поляризованных клетках, напри- [c.419]
Миелиновая ткань имеет консистенцию жира и для невооруженного глаза белую окраску (как в белом веществе головного мозга). Б световом микроскопе такие волокна при обработке их обычными липидными красителями имеют вид черных структур. С миелином, извлеченным различными приемами фракционирования клетки (рис. 4.6), проведены биохимические исследования. Они показали, что миелин состоит приблизительно на 80% из липидов и на 20% из белка один из основных липидов —холестерол, а такие вещества, как цереброзиды и фосфолипиды, содержатся также в разных тканях и у разных видов животных в разных количествах. Рентгеноструктурный анализ показывает, что миелин состоит из единиц, повторяющихся с периодом около 18 нм. В электронном микроскопе его легко узнать по чередованию светлых и темных слоев с периодом около 18 нм, который, если сделать поправку на сморщивание ткани при обработке, соответствует двойной толщине сжатой плазматической мембраны.
Теперь мы отдаем себе отчет в том, что эти первые описания, хотя и верные в общем виде, давали упрощенное представление о чрезвычайно разнообразных жизненных циклах вирусов. Во-первых, белковая оболочка (или кансид) почти у всех вирусов состоит из полипептидных цепей более чем одного типа, причем эти цепи нередко сгруппированы в несколько слоев. Во-вторых, у многих вирусов их белковый капсид окружен еще и мембраной, в которую помимо белка входят и липиды. У многих из этих вирусов сборка наружной оболочки происходит в плазматической мембране клетки-хозяина, и дочерние вирусные частицы выходят наружу, отпочковываясь от этой плазматической мембраны (рис. 5-70). Отпочковывание позволяет потомству вируса покидать клетку, не нарушая ее плазматической мембраны, т. е. не убивая клетку. Липидные компоненты мембраны вируса идентичны липидам плазматической мембраны клетки-хозяина, тогда как белки, присутствующие в липидном бислое, вирусоспецифичны Сборку вирусной мембраны в плазматической мембране клетки-хозяина мы обсудим в гл.
В организме большая часть липидов представлена ацилглицеролами в виде триацилглицеролов они являются главными липидами жировых отложений и пищи. Кроме того, ацилглицеролы, в первую очередь фосфолипиды, являются основными компонентами плазматических и других мембран. Фосфолипиды участвуют в метаболизме многих липидов. Гликофосфолипиды, построенные из сфингозина, остатков сахаров и жирных кислот, составляют 5— 10% вс липидов плазматической мембраны. [c.247]
Значительная часть наш их знаний о мембранах сложилась благодаря интенсивным многолетним исследованиям, проведенным на мембранах определенных типов. К их числу относятся следующие 1. Мие-линовая оболочка, состоящая из плазматических мембран, образуемых шванновскими клетками, которые прилежат ко многим нейронам. Шванновские клетки как бы наматываются на аксоны нейронов, причем цитоплазма из них выдавливается и образуются тонкие, но плотно упакованные мембранные слои, окружающие аксоны и служащие для них прекрасным изолятором .
Изучение фотографических изображений клетки, полученных прн помощи микроскопа в разные моменты времени, позволили увидеть, что плазматическая мембрана, так же как и митохондрии и другие органеллы, постоянно находится в движении. Митохондрии скручиваются и поворачиваются, а поверхность мембраны постоянно совершает волнообразные движения. Пузырьки освобождают свое содержимое в окружающую среду, выводя его из клеток, а перенос веществ внутрь клетки осуществляется за счет процесса эндоцитоза (гл.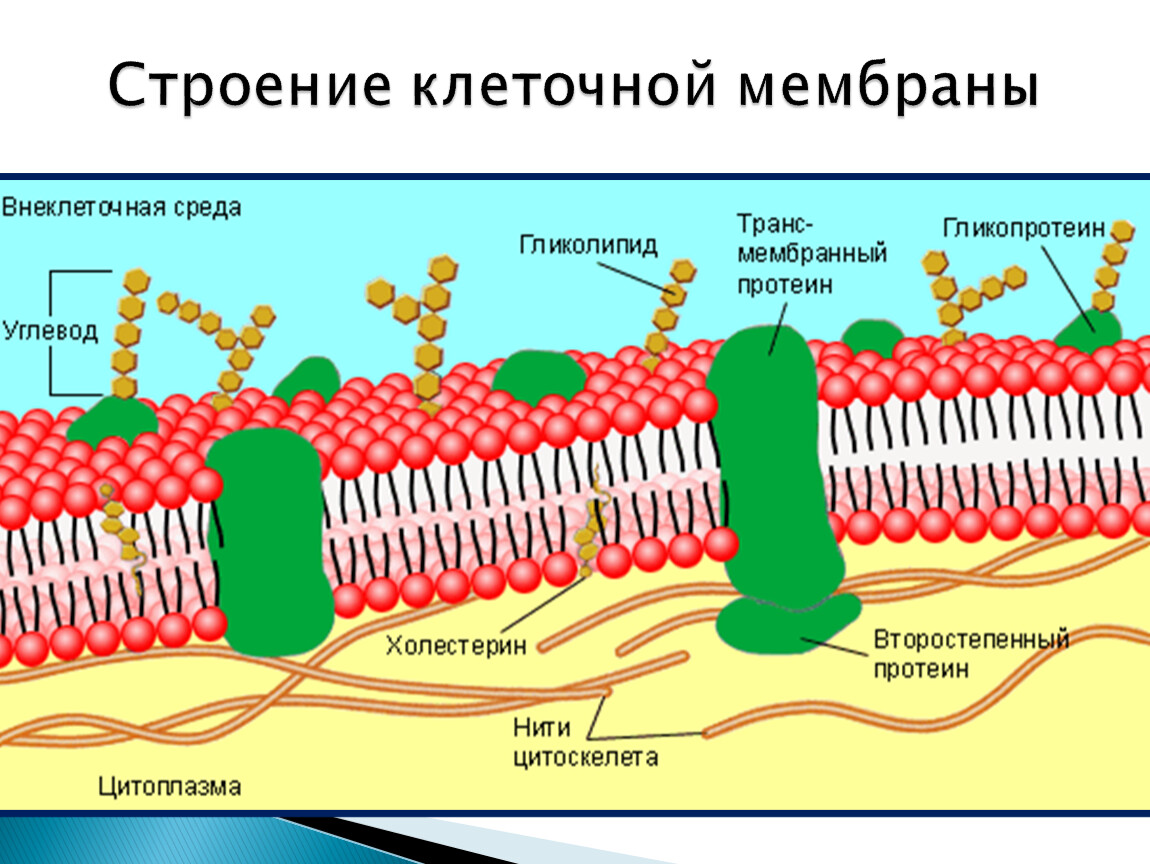 1, разд. Б.4). При помощи химических методов было показано также, что составляющие мембраны вещества транспортируются из эндоплаз1матического ретикулума в пузырьки аппарата Гольджи, в экскреторные гранулы и в плазматическую мембрану. Важным этапом биосинтетических процессов, протекающих в клетке, является присоединение углеводных (гликозильных) остатков к молекулам белка с образованием гликопротеидов и гликолипидов. Ферменты, катализирующие эти реакции, — гликозилтрансферазы (гл. 12)-—обнаружены в эндоплазматическом ретикулуме и в пузырьках а1ппарата Гольджи. Эти ферменты катализируют присоединение углеводных единиц (по одной в каждом акте реакции) к определенным местам молекул белков, липидов и других соединений, экскретируемых из клеток. Другие ферменты катализируют присоединение сульфатных и ацетильных групп к углеводным фрагментам молекул глико Протеидов. [c.356]
1, разд. Б.4). При помощи химических методов было показано также, что составляющие мембраны вещества транспортируются из эндоплаз1матического ретикулума в пузырьки аппарата Гольджи, в экскреторные гранулы и в плазматическую мембрану. Важным этапом биосинтетических процессов, протекающих в клетке, является присоединение углеводных (гликозильных) остатков к молекулам белка с образованием гликопротеидов и гликолипидов. Ферменты, катализирующие эти реакции, — гликозилтрансферазы (гл. 12)-—обнаружены в эндоплазматическом ретикулуме и в пузырьках а1ппарата Гольджи. Эти ферменты катализируют присоединение углеводных единиц (по одной в каждом акте реакции) к определенным местам молекул белков, липидов и других соединений, экскретируемых из клеток. Другие ферменты катализируют присоединение сульфатных и ацетильных групп к углеводным фрагментам молекул глико Протеидов. [c.356]
Несмотря на большое число исследований, чисто химический аспект действия инсулина остается неясным — .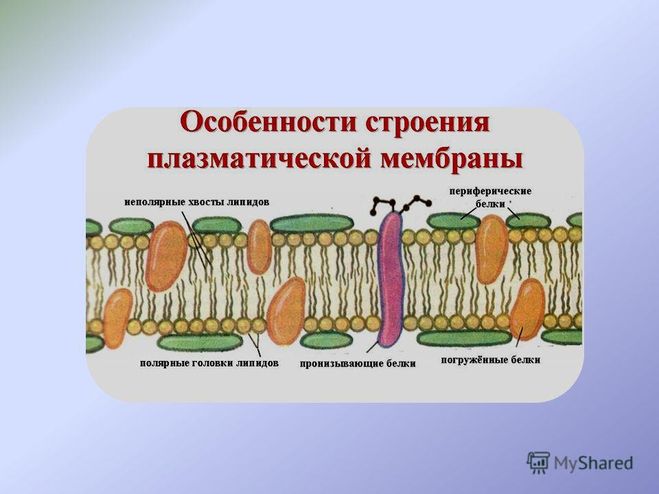 Обычно считается, что гормон действует на плазматические мембраны всех тканей, вызывая заметные изменения проницаемости, что поиводит к возрастанию поглощения глюкозы, различных ионов и других веществ. Такого рода изменения проницаемости могут обусловить сильное влияние инсулина на важнейшие процессы биосинтеза имеет место, в частности, повышение синтеза гликогена, липидов и белков. В то же время процессы катаболизма подавляются и активность катаболических ферментов, например глюкозо-6-фосфатазы, снижается. Ключом к пониманию действия инсулина может явиться выяснение вопроса о природе его вторичного посредника , аналогичного по своему действию сАМР. Высказывались предположения, что вторичным посредником для инсулина является сАМР, однако более вероятно, что эту роль выполняет какой-то ион, возможно К+ . [c.505]
Обычно считается, что гормон действует на плазматические мембраны всех тканей, вызывая заметные изменения проницаемости, что поиводит к возрастанию поглощения глюкозы, различных ионов и других веществ. Такого рода изменения проницаемости могут обусловить сильное влияние инсулина на важнейшие процессы биосинтеза имеет место, в частности, повышение синтеза гликогена, липидов и белков. В то же время процессы катаболизма подавляются и активность катаболических ферментов, например глюкозо-6-фосфатазы, снижается. Ключом к пониманию действия инсулина может явиться выяснение вопроса о природе его вторичного посредника , аналогичного по своему действию сАМР. Высказывались предположения, что вторичным посредником для инсулина является сАМР, однако более вероятно, что эту роль выполняет какой-то ион, возможно К+ . [c.505]
Полимиксины обладают ярковыраженным бактерицидным действием против большинства грамотрицательных актерий, превосходя в этом отношении многие другие антибиотики. Мишеиью действия полимиксинов является плазматическая мембрана бактерий. Показано, что полимиксины связываются с фосфатными группами кардиолипина, фосфатидилэтаноламина или других кислых липидов, нарушая барьерные функции мембраны. [c.288]
Мишеиью действия полимиксинов является плазматическая мембрана бактерий. Показано, что полимиксины связываются с фосфатными группами кардиолипина, фосфатидилэтаноламина или других кислых липидов, нарушая барьерные функции мембраны. [c.288]
Термин мембранао используется вот уже более 100 лет для обозначения клеточной границы, служащей, с одной стороны, барьером между содержимым клеткн н внешней средой, а с другой — полупроницаемой перегородкой, через которую могут проходить вода и некоторые из растворенных в ней веществ. В 1851 г. немецким физиолог X. фон Моль описал плазмолиз клеток растений, предположив, что клеточные стенки функционируют как мембраны. В 1855 г. ботаник К. фон Негели наблюдал различия в проникновении пигментов в поврежденные н неповрежденные растительные клетки и исследовал клеточную границу, которой он дал название плазматическая мембрана. Он предположил, что клеточная граница ответственна за осмотические свойства клеток. В 1877 г. немецкий ботаник В. Пфеффер опубликовал свой труд Исследование осмоса , где постулировал существование клеточных мембран, основываясь на сходстве между клетками и осмометрами, имевэщими искусственные полупроницаемые мембраны. В 80-х годах прошлого столетия датский ботаник X. де Фриз продолжил осмометрические исследования растительных клеток, предположив, что неповрежденный слой протоплазмы между плазмалеммой и тонопластом функционирует как мембрана. Его исследования послужили фундаментом при создании физико-химических теорий осмотического давления и электролитической диссоциации голландцем Я. Вант-Гоффом и шведским ученым С. Аррениусом. В 1890 г. немецкий физикохимик и философ В. Оствальд обратил внимание на возможную роль мембран в биоэлектрических процессах. Между 1895 и 1902 годами Э. Овертон измерил проницаемость клеточной мембраны для большого числа соединений и наглядно показал зависимость между растворимостью этих соединений в липидах и способностью их проникать через мембраны. Он предположил, что мембрана имеет липидную природу и содержит холестерин и другие липиды.
Пфеффер опубликовал свой труд Исследование осмоса , где постулировал существование клеточных мембран, основываясь на сходстве между клетками и осмометрами, имевэщими искусственные полупроницаемые мембраны. В 80-х годах прошлого столетия датский ботаник X. де Фриз продолжил осмометрические исследования растительных клеток, предположив, что неповрежденный слой протоплазмы между плазмалеммой и тонопластом функционирует как мембрана. Его исследования послужили фундаментом при создании физико-химических теорий осмотического давления и электролитической диссоциации голландцем Я. Вант-Гоффом и шведским ученым С. Аррениусом. В 1890 г. немецкий физикохимик и философ В. Оствальд обратил внимание на возможную роль мембран в биоэлектрических процессах. Между 1895 и 1902 годами Э. Овертон измерил проницаемость клеточной мембраны для большого числа соединений и наглядно показал зависимость между растворимостью этих соединений в липидах и способностью их проникать через мембраны. Он предположил, что мембрана имеет липидную природу и содержит холестерин и другие липиды. Современные представления о строении мембран как подвижных липопротеиновых ансамблей были сформулированы в начале 70-х годов нашего столетня. [c.549]
Современные представления о строении мембран как подвижных липопротеиновых ансамблей были сформулированы в начале 70-х годов нашего столетня. [c.549]
Плазматическая мембрана. На электронных микрофотографиях ультратонких срезов бактерий, фиксированных четырехокисью осмия, плазматическая мембрана представляется многослойной. Она состоит из двух осмофильных и потому темных слоев толщиной 2-3 нм каждый и промежуточного более светлого слоя толщиной 4-5 нм. По своему строению мембраны бактериальных, животных и растите.пьных клеток очень сходны. Это дает основание говорить об универсальной элементарной мембране . Мембраны можно выделить, подвергнув осмотическому шоку протопласты, полученные с помощью лизоцима. Мембрана богата липвдами, в особенности фосфолипидами. Составляя всего 8-15 % сухого вещества клетки, мембраны содержат 70-90 % всех ее липидов. [c.23]
Внешние, или плазматические, мембраны многих клеток, а также мембраны ряда внутриклеточньк органелл, например митохондрий и хлоропластов, удалось вьщелить в свободном виде и изучить их молекулярный состав. Во всех мембранах имеются полярные липиды в количестве, составляющем в зависимости от типа мембраны от 20 до 80% ее массы, остальное приходится главным образом на долю белков. Так, в плазматических мембранах животньк клеток количество белков и липидов, как правило, примерно одинаково во внутренней митохондриальной мембране содержится около 80% белков и только 20% липидов, а в миелиновьк мембранах мозга, наоборот, около 80% липидов и только 20% белков. Липидная часть мембран представляет собой смесь [c.342]
Во всех мембранах имеются полярные липиды в количестве, составляющем в зависимости от типа мембраны от 20 до 80% ее массы, остальное приходится главным образом на долю белков. Так, в плазматических мембранах животньк клеток количество белков и липидов, как правило, примерно одинаково во внутренней митохондриальной мембране содержится около 80% белков и только 20% липидов, а в миелиновьк мембранах мозга, наоборот, около 80% липидов и только 20% белков. Липидная часть мембран представляет собой смесь [c.342]
Плазматическая мембрана вместо глицериновых эфиров жирных кислот содержит глицериновые эфиры с jo (фитанил)- и С оСбифи-танил)-изопреноидными алкилами. В качестве нейтральных липидов встречаются также свободные С и- и Сз(,-изопреноидные углеводороды [c.108]
Повреждение поверхностных структур или слоев клетки. Этанол в достаточно высокой концентрации (70%) вызывает коагуляцию белков и оказывает бактерицидное действие. Фенолы, крезолы, нейтральные мыла и поверхностно-активные вещества (детергенты) действуют на наружные слои клеток и нарушают избирательную проницаемость плазматической мембраны. Клеточные мембраны состоят главным образом из липидов и белков. Детергенты имеют поляркую структуру, причем их молекулы содержат как липофильные группы (длинные углеводородные цепи или ароматические кольца), так и гидрофильные ионизированные группы. Накапливаясь в липопротеиновых мембранах (тоже имеющих полярную структуру), детергенты нарушают их функции. Поскольку эти вещества обладают широким спектром антимикробного действия, их обычно применяют для дезинфекции различных поверхностей и одежды. С детергентами сходны по своему действию некоторые полипептидные антибиотики (полимиксин, колистин, бацитрацин, субти-лин) и антимикробные вещества растительного происхождения. [c.204]
Клеточные мембраны состоят главным образом из липидов и белков. Детергенты имеют поляркую структуру, причем их молекулы содержат как липофильные группы (длинные углеводородные цепи или ароматические кольца), так и гидрофильные ионизированные группы. Накапливаясь в липопротеиновых мембранах (тоже имеющих полярную структуру), детергенты нарушают их функции. Поскольку эти вещества обладают широким спектром антимикробного действия, их обычно применяют для дезинфекции различных поверхностей и одежды. С детергентами сходны по своему действию некоторые полипептидные антибиотики (полимиксин, колистин, бацитрацин, субти-лин) и антимикробные вещества растительного происхождения. [c.204]
Внешняя граница клетки образована клеточной (или плазматической) мембраной (или оболочкой). Типичная двох1ная мембрана (называемая элементарной мембраной) толщиной около 80 А, очевидно, представляет собой относительно жесткую и упорядоченную структуру, состоящую И.З бимолекулярного слоя полярных липидов, покрытого с обеих сторон белковыми пленками.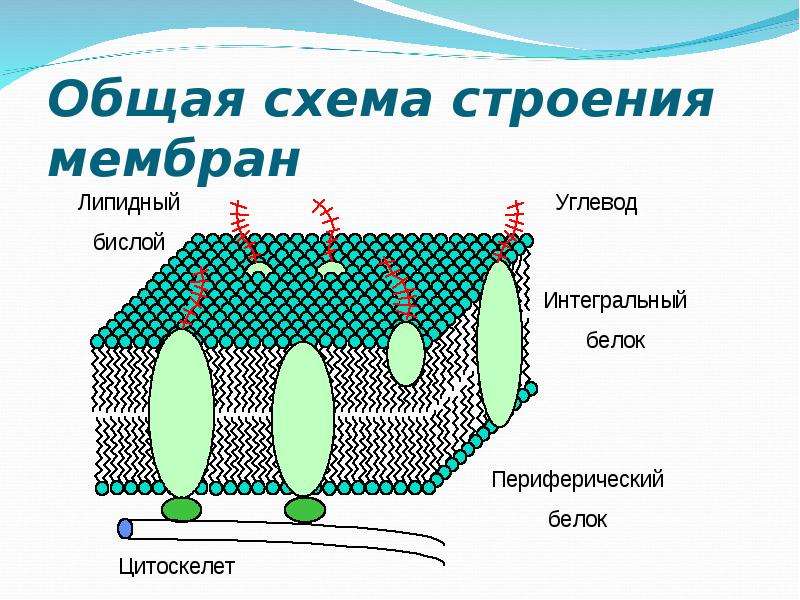 Эту мембрану ни в коем случае нельзя считать гомогенной на всем ее протяжении. Наоборот, она представляет собой мозаику из различных функциональных единиц, слегка различающихся по своей структуре, высокоизбирательных и специализированных в клетках разных типов. Мембрана определяет такие весьма разнообразные и вместе с тем чрезвычайно ванлные характеристики клетки, как избирательная проницаемость, активный перенос питательных веществ и ионов (т. е. их поступление в клетку), контрактильные свойства, способность клеток вступать в ассоциацию друг с другом и распознавать друг друга (например, при формировании органов). Плазматические мембраны могут слунгить также местом протекания некоторых сложных ферментативных процессов, таких, как гликолиз или даже синтез белка (у микроорганизмов). [c.248]
Эту мембрану ни в коем случае нельзя считать гомогенной на всем ее протяжении. Наоборот, она представляет собой мозаику из различных функциональных единиц, слегка различающихся по своей структуре, высокоизбирательных и специализированных в клетках разных типов. Мембрана определяет такие весьма разнообразные и вместе с тем чрезвычайно ванлные характеристики клетки, как избирательная проницаемость, активный перенос питательных веществ и ионов (т. е. их поступление в клетку), контрактильные свойства, способность клеток вступать в ассоциацию друг с другом и распознавать друг друга (например, при формировании органов). Плазматические мембраны могут слунгить также местом протекания некоторых сложных ферментативных процессов, таких, как гликолиз или даже синтез белка (у микроорганизмов). [c.248]
Однотипные мембраны из различных клеток подобны по составу липидов. В мембранах клеток животных содержится 15—25% фосфолипидов, несущих большой отрицательный заряд (фосфатидилсерины, фосфатидилинозитиды). Плазматические мембраны клеток животных богаты холестерином и гликолипидами, митохондриальные — кардиолипином, который в норме не встречается в других типах мембран. [c.236]
Плазматические мембраны клеток животных богаты холестерином и гликолипидами, митохондриальные — кардиолипином, который в норме не встречается в других типах мембран. [c.236]
Первые сведения о том, что молекулы липидов в биологической мембране образуют бислой, были получены в ходе простых, но элегантных экспериментов, выполненных в 1925 год) Было показано, что липиды из мембран эритроцитов, экстрагированные ацетоном, всплывают на поверхность воды, образуя пленку. Площадь пленки уменьшали с помощью подвижного барьера до тех пор, пока не формировался сплошной мономолекулярный слой. При этом оказалось, что площадь мопослоя примерно в два раза больше первоначальной площади поверхности клеток. Поскольку единственной мембраной эритроцитов является плазматическая мембрана, экспериментаторы заключили, что молекулы липидов в ней должны быть организованы в виде непрерывного бислоя. Это заключение имело глубокое влияние на всю клеточную биологию. В настоящее время наличие липидного бислоя в клеточных мембранах доказано и более тонкими методами. Например, с помощью рентгеноструктурного анализа было продемонстрировано существование липидных бислоев в высокоорганизованных складках клеточных мембран, которые формируют изолирующую миелиповую оболочку, окружающую нервные клетки (см. разд. 19.2.4). О том, что все биологические мембраны содержат липидные бислой- убедительно свидетельствуют и данные электронно-микроскопических исследований при изучении образцов, приготовленных методом замораживания скалывания, оказалось, что все клеточные мембраны могут быть механически расщеплены как раз между двумя липидными монослоями (см. разд. 6.2.6). Самопроизвольное формирование бислоя является особым свойством молекул липидов, которое реализуется даже вне клетки. [c.350]
Например, с помощью рентгеноструктурного анализа было продемонстрировано существование липидных бислоев в высокоорганизованных складках клеточных мембран, которые формируют изолирующую миелиповую оболочку, окружающую нервные клетки (см. разд. 19.2.4). О том, что все биологические мембраны содержат липидные бислой- убедительно свидетельствуют и данные электронно-микроскопических исследований при изучении образцов, приготовленных методом замораживания скалывания, оказалось, что все клеточные мембраны могут быть механически расщеплены как раз между двумя липидными монослоями (см. разд. 6.2.6). Самопроизвольное формирование бислоя является особым свойством молекул липидов, которое реализуется даже вне клетки. [c.350]
Значительным щагом вперед в понимании структуры и функции мембран следует считать осознание того, что биологические мембраны -это двумерные жидкости. Однако ясно, что представление о мембране как о липидном море, в котором свободно плавают белки, оказалось сильно упрощенным. Многие клетки обладают способностью удерживать мембранные белки в специфических доменах в непрерывном липидном бислое. Например, в эпителиальных клетках, выстилающих кишечник или почечные канальцы, некоторые ферменты плазматической мембраны и транспортные белки располагаются только на апикальной поверхности клеток, тогда как другие — только на базальной и латеральной (рис. 6-36). Такое асимметричное распределение мембранных белков существенно для функционирования эпителия (мы обсудим )то позже, см. разд. 6.4.11). Липидный состав этих двух мембранных доменов также различен, что указывает на то, что эпителиальные клетки могут ограничивать диффузию между доменами как молекул белка, так и молекул липидов (хотя эксперименты с мечеными молекулами липидов наводят на мысль, что это справедливо лишь для липидных молекул внешнего монослоя мембраны). Такое пространственное разделение белков и липидов, по-видимому, поддерживается (по крайней мере частично) благо- [c.375]
Многие клетки обладают способностью удерживать мембранные белки в специфических доменах в непрерывном липидном бислое. Например, в эпителиальных клетках, выстилающих кишечник или почечные канальцы, некоторые ферменты плазматической мембраны и транспортные белки располагаются только на апикальной поверхности клеток, тогда как другие — только на базальной и латеральной (рис. 6-36). Такое асимметричное распределение мембранных белков существенно для функционирования эпителия (мы обсудим )то позже, см. разд. 6.4.11). Липидный состав этих двух мембранных доменов также различен, что указывает на то, что эпителиальные клетки могут ограничивать диффузию между доменами как молекул белка, так и молекул липидов (хотя эксперименты с мечеными молекулами липидов наводят на мысль, что это справедливо лишь для липидных молекул внешнего монослоя мембраны). Такое пространственное разделение белков и липидов, по-видимому, поддерживается (по крайней мере частично) благо- [c.375]
 У клеток есть и более сильные способы иммобилизации определенных мембранных белков. Это хорошо видно на примере пурпурных мембран Haloba terium. В данном случае молекулы бактериородоисина собраны в большие двумерные кристаллы, в которых отдельные белковые молекулы фиксированы по отпошепию друг к другу. Крупные агрегаты такого типа диффундируют очень медленно. В более общем случае ограничение латеральной подвижности специфических мембранных белков связано с их взаимодействием с макромолекулярными образованиями, находящимися снаружи или внутри клеток Мы уже говорили о том, что некоторые мембранные белки эритроцитов тесно связаны с внутренним цитоскелетом В клетках других типов белки плазматической мембраны могут быть также связаны с цитоскелетом или внеклеточным матриксом, либо и с тем и с другим. Четыре известных способа иммобилизации специфических мембранных белков показаны на рис. 6-38. [c.376]
У клеток есть и более сильные способы иммобилизации определенных мембранных белков. Это хорошо видно на примере пурпурных мембран Haloba terium. В данном случае молекулы бактериородоисина собраны в большие двумерные кристаллы, в которых отдельные белковые молекулы фиксированы по отпошепию друг к другу. Крупные агрегаты такого типа диффундируют очень медленно. В более общем случае ограничение латеральной подвижности специфических мембранных белков связано с их взаимодействием с макромолекулярными образованиями, находящимися снаружи или внутри клеток Мы уже говорили о том, что некоторые мембранные белки эритроцитов тесно связаны с внутренним цитоскелетом В клетках других типов белки плазматической мембраны могут быть также связаны с цитоскелетом или внеклеточным матриксом, либо и с тем и с другим. Четыре известных способа иммобилизации специфических мембранных белков показаны на рис. 6-38. [c.376] В плазматических мембранах всех эукариотических клеток большинство белков, расположенных на поверхности клетки, а также некоторые липидные молекулы наружного липидного монослоя ковалентно связаны с олигосахаридными цепями. Некоторые плазматические мембраны содержат молекулы интегральных нротеогликанов, в которых несколько полисахаридных цепей ковалентно сшиты с трансмембранным белком или связанным с липидами коровым белком. Хотя функция углеводов клеточной поверхности пока непонятна, представляется вероятным, что по крайней мере некоторые из них принимают участие в процессах межклеточного узнавания и узнавания между клеткой и матриксом. [c.379]
Некоторые плазматические мембраны содержат молекулы интегральных нротеогликанов, в которых несколько полисахаридных цепей ковалентно сшиты с трансмембранным белком или связанным с липидами коровым белком. Хотя функция углеводов клеточной поверхности пока непонятна, представляется вероятным, что по крайней мере некоторые из них принимают участие в процессах межклеточного узнавания и узнавания между клеткой и матриксом. [c.379]
Чтобы понять взаимоотношения между клеточными комиартментами. полезно представить себе, как они могли возникнуть в процессе эволюции. Считается, что предшественниками эукариотических клеток были организмы, напоминающие бактерии. У бактерий, как правило, нет внутренних мембран соответствующие функции у них выполняет плазматическая мембрана. К таким функциям относится, например, транспорт ионов, синтез АТР и синтез липидов. Однако размеры современных эукариотических клеток превышают размер типичной бактериальной клетки (такой, как Е.соИ) в 10-30 раз.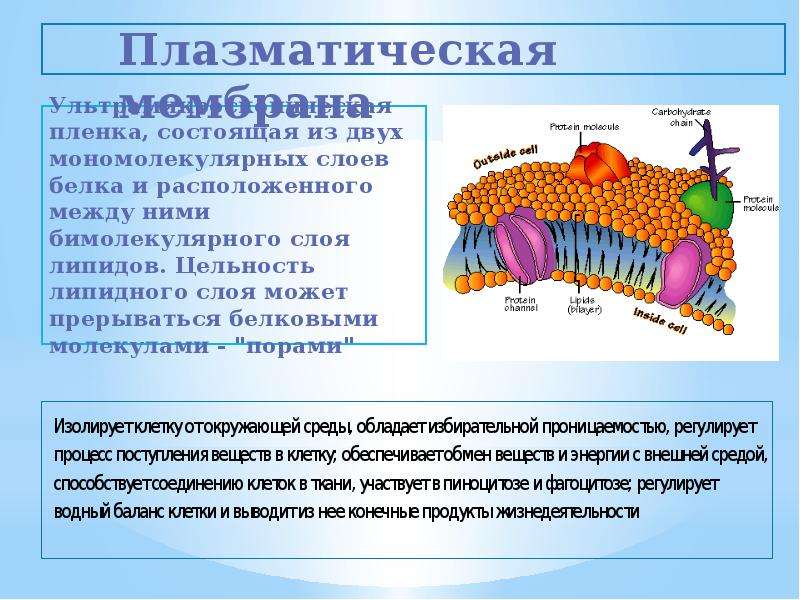 Изобилие внутренних мембран в клетках эукариот можно рассматривать как адаптацию к этом) [c.8]
Изобилие внутренних мембран в клетках эукариот можно рассматривать как адаптацию к этом) [c.8]
Все эукариотические клетки имеют Эндоплазматический ретикулум (ЭР). Его чрезвычайно извилистая мембрана обычно составляет более половины общего количества клеточных мембран (см. габл. 8-2). Полагают, что хотя мембрана ЭР имеет многочисленные складки и изгибы, пронизывающие всю цитоплазму, она образует непрерывную поверхность, ограничивающую единое внутреннее пространство. Это внутреннее пространство, называемое полостью ЭР, часто занимает более 10% общего объема клетки (см. табл. 8-1). Полость ЭР отделяется от цитозоля одиночной мембраной (мембраной ЭР), служащей связующим звеном между этими двумя комиартментами. Наоборот полости ЭР и каждой цистерны аппарата Г ольджи отделены друг от друга двумя мембранами и цитозолем, поэтому транспорт макромолекул между этими органеллами осуществляется при помощи транспортных пузырьков (рис. 8-36), ЭР играет важнейшую роль в клеточных биосинтезах. На мембранах ЭР начинается синтез трансмембранных белков и липидов ЭР, аппарата Гольджи, лизосом и плазматической мембраны. Здесь же производится большинство липидов для мембран митохондрий и пероксисом (см. разд. 8.6.14). Кроме того, все вновь синтезированные белки, независимо от их места назначения (полость ЭР, аппарат Гольджи, лизосомы или внеклеточное пространство), сначала поступают в полость ЭР. Так как ЭР служит отправной точкой для синтеза всех секретируемых белков, он также является местом, где начинается формирование внеклеточного матрикса. [c.38]
На мембранах ЭР начинается синтез трансмембранных белков и липидов ЭР, аппарата Гольджи, лизосом и плазматической мембраны. Здесь же производится большинство липидов для мембран митохондрий и пероксисом (см. разд. 8.6.14). Кроме того, все вновь синтезированные белки, независимо от их места назначения (полость ЭР, аппарат Гольджи, лизосомы или внеклеточное пространство), сначала поступают в полость ЭР. Так как ЭР служит отправной точкой для синтеза всех секретируемых белков, он также является местом, где начинается формирование внеклеточного матрикса. [c.38]
Плазматическая мембрана, мембраны аппарата Гольджи и лизосом — это части мембранной системы, связанной с ЭР с помощью трапспортпых пузырьков, поставляющих в нее и белки, и липиды. Митохондрии и пероксисомы пе принадлежат к этой системе и нуждаются в других механизмах для импорта белков и липгшов мембран. Мы уже убедились в том, что большинство белков этих органелл доставляется из цитозоля посттрапеляциоппо. Хотя некоторые липиды модифицируются в митохондриях, сами митохондрии все равно должны получить их либо прямо из ЭР, где опи синтезируются, либо через другие клеточные мембраны. [c.57]
Хотя некоторые липиды модифицируются в митохондриях, сами митохондрии все равно должны получить их либо прямо из ЭР, где опи синтезируются, либо через другие клеточные мембраны. [c.57]
Большинство клеток в тканях поляризованы, а их плазматическая мембрана состоит из двух (а иногда и большего числа) различных доменов или частей. Например, типичная эпителиальная клетка имеет две физически непрерывных, но различных по составу части клеточной мембраны (см. рис. 6-36) апикальная часть обращена в полость органа и часто несет специальные приспособления, такие, как реснички или щеточная каемка микроворсинок базолатеральная часть покрывает всю остальную клетку. Эти две части соединены по границе кольцом плотных контактов (см. разд. 14.1.1). которые не позволяют белкам (и липидам внешней половины липидного бислоя) диффундировать из одной части мембраны в другую. Вот почему, хотя обе части мембраны и видны в электронный микроскоп как единое целое, они надежно изолированы друг от друга плотными контактами и содержат разные наборы белков. Липидный состав двух бислоев тоже различен, в частности, глико липиды встречаются только в апикальной части мембраны. Существуют убедительные данные, показывающие, что и набор белков, секретируемых с апикальной и базолатеральной поверхности эпителиальной клетки, тоже различен. Следовательно, в поляризованных клетках должны существовать механизмы, специфически направляющие как мембранные, так и секретируемые белки к определенному домен плазматической мембраны. В опытах по культивированию поляризованных клеток удалось установить, что белки, предназначенные для разных доменов, вместе проходят путь от ЭР до транс-сеть Гольджи, где они сортируются и направляются в составе секреторных или трапспортпых пузырьков к соответствующим участкам клеточной [c.78]
Липидный состав двух бислоев тоже различен, в частности, глико липиды встречаются только в апикальной части мембраны. Существуют убедительные данные, показывающие, что и набор белков, секретируемых с апикальной и базолатеральной поверхности эпителиальной клетки, тоже различен. Следовательно, в поляризованных клетках должны существовать механизмы, специфически направляющие как мембранные, так и секретируемые белки к определенному домен плазматической мембраны. В опытах по культивированию поляризованных клеток удалось установить, что белки, предназначенные для разных доменов, вместе проходят путь от ЭР до транс-сеть Гольджи, где они сортируются и направляются в составе секреторных или трапспортпых пузырьков к соответствующим участкам клеточной [c.78]
Все известные нейромедиаторы, а также большинство гормонов и локальных химических медиаторов водорастворимы. Есть, однако, исключения, и они образуют отдельный класс сигнальных молекул. Важными примерами служат сравнительно плохо растворимые в воде стероидные и гиреоидные гормоны, которые переносятся кровью в виде растворимых комплексов со специфическими белками-переносчиками. С таким различием в растворимости связаны фундаментальные различия в механизмах действия этих двух классов молекул на клетки-мишени. Водорастворимые молекулы слишком гидрофильны, чтобы прямо приходить через липидный бислой плазматической мембраны поэтому они связываются со специфическими белковыми рецепторами на клеточной поверхности. Напротив, стероидные и тиреоидные гормоны растворимы в липидах и, отделившись от белка-носителя, могут легко проникать через плазматическую мембрану клетки-мишени. Эти гормоны связываются с белковыми рецепторами внутри клетки (рис. 12-7). [c.346]
С таким различием в растворимости связаны фундаментальные различия в механизмах действия этих двух классов молекул на клетки-мишени. Водорастворимые молекулы слишком гидрофильны, чтобы прямо приходить через липидный бислой плазматической мембраны поэтому они связываются со специфическими белковыми рецепторами на клеточной поверхности. Напротив, стероидные и тиреоидные гормоны растворимы в липидах и, отделившись от белка-носителя, могут легко проникать через плазматическую мембрану клетки-мишени. Эти гормоны связываются с белковыми рецепторами внутри клетки (рис. 12-7). [c.346]
Текучесть бислоев зависит от ненасыщенности гидрофобных цепей и от присутствия в мембране дополнительных веществ. В частности, холестерин — один из основных компонентов плазматической мембраны всех эукариотических клеток — существенно влияет на текучесть бислоя (Dei-num et al., 1988). В составе мембран эритроцитов присутствует до 30 % холестерина, так как он легко взаимодействует с фосфолипидами, образуя комплексы 1 1. Его плоское стероидное ядро легко проникает в структуру мембраны и увеличивает ориентацию углеводородных цепей в жидкокристаллической фазе ядра стероидов перекрывают 9—12 углеродных звеньев в липиде. Наибольщее сродство к холестерину проявляют сфингомиелины. Однако селективность межмолекулярных взаимодействий фосфолипидов друг с другом — отдельная проблема клинической биохимии и в данном разделе мы ее рассматривать не будем (Никифорова, 1981). [c.113]
Его плоское стероидное ядро легко проникает в структуру мембраны и увеличивает ориентацию углеводородных цепей в жидкокристаллической фазе ядра стероидов перекрывают 9—12 углеродных звеньев в липиде. Наибольщее сродство к холестерину проявляют сфингомиелины. Однако селективность межмолекулярных взаимодействий фосфолипидов друг с другом — отдельная проблема клинической биохимии и в данном разделе мы ее рассматривать не будем (Никифорова, 1981). [c.113]
Плазматическая мембрана Строение мембраны 2 слоя липидов
Плазматическая мембрана
Строение мембраны 2 слоя липидов Погруженные белки Пронизывающие белки Периферические белки
Строение мембраны n Двойной слой фосфолипидов Липиды имеют полярные головки, содержащие остатки фосфорной кислоты, и неполярные хвосты – остатки жирных кислот. С полярными головками (благодаря электростатическим взаимодействиям) соединяются периферические белки.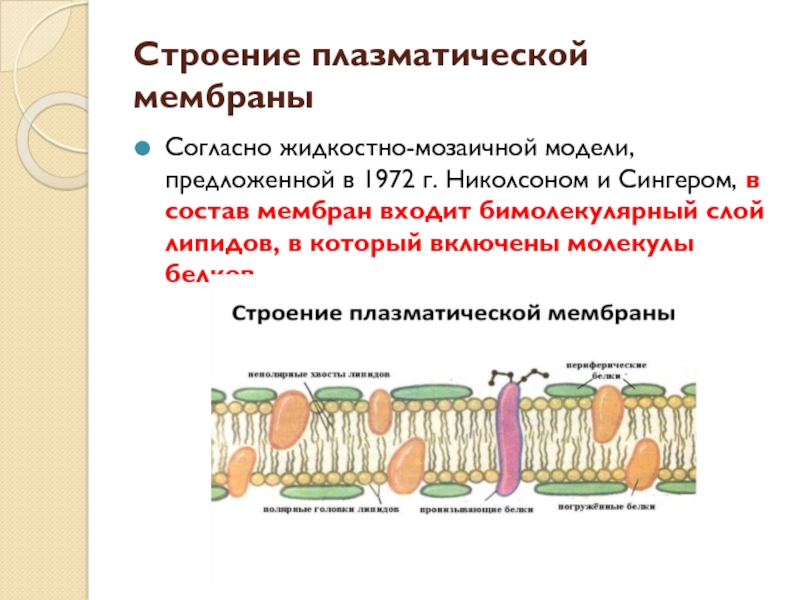
Строение мембраны n n Двойной слой фосфолипидов Погруженные белки Многие погруженные белки – ферменты, они располагаются в определенном порядке, образуя «конвейер» .
Строение мембраны n n n Двойной слой фосфолипидов Погруженные белки Периферические белки не позволяют ферментам (погруженным белкам) изменить порядок их расположения в мембране и разорвать «конвейер» .
Строение мембраны n n Двойной слой фосфолипидов Периферические белки Погруженные белки Пронизывающие белки образуют поры.
Гликокаликс Полисахариды Фосфолипиды Периферические белки Пронизывающие Погруженные белки
Вид мембраны сверху Полисахариды Фосфолипиды Пронизывающие белки Периферические белки Погруженные белки
Функции мембраны
1. Мембранный транспорт
Мембранный транспорт – продвижение веществ через мембрану. Мембранный транспорт играет важную роль в поддержании гомеостаза клетки.
Мембранный транспорт играет важную роль в поддержании гомеостаза клетки.
Гомеостаз (от греч. “homoios” – подобный и “stasis” – состояние) – постоянство состава.
Пассивный транспорт веществ
Диффузия транспорт веществ по градиенту концентрации (т. е. от большей концентрации к меньшей). Пример: прохождение через поры веществ, растворимых в воде или жирах.
Облегченный транспорт n Перенос – транспорт веществ с помощью «переносчиков» . Примеры: FСпециальные вещества-переносчики соединяются с транспортируемыми веществами и протаскивают их через мембрану, а затем возвращаются. FРоль переносчиков могут играть белки мембраны – пермеазы.
Активный транспорт веществ
Натрий-калиевый насос Из клетки выходят ионы натрия, в клетку заходят ионы калия (на каждые три иона натрия, выходящих из клетки, в клетку заходят два иона калия). Создается разность электрических потенциалов, при этом расщепляется АТФ и выделяется энергия. Натриевый и калиевый каналы образованы белкомферментом, расщепляющим молекулы АТФ (натрий-калийзависимой АТФ-азой). Этот фермент находится в мембране и активизируется ионами натрия и калия.
Создается разность электрических потенциалов, при этом расщепляется АТФ и выделяется энергия. Натриевый и калиевый каналы образованы белкомферментом, расщепляющим молекулы АТФ (натрий-калийзависимой АТФ-азой). Этот фермент находится в мембране и активизируется ионами натрия и калия.
Натрий-калиевый насос Насос действует по принципу открывающихся и закрывающихся каналов. Натриевые и калиевые насосы находятся рядом. Под действием ионов натрия в белке натриевого канала разрушаются водородные связи, канал раскрывается, ионы натрия выходят из клетки. Затем натриевый канал закрывается, открывается калиевый канал, ионы калия заходят в клетку.
Эндоцитоз
Эндоцитоз проникновение в клетку крупных молекул биополимеров. ü ü Фагоцитоз. Пиноцитоз.
Фагоцитоз (от греч. «phagos» – пожирать и «kytos» – клетка) – поглощение клеткой твердых частиц пищи.
Пиноцитоз (от греч. «pino» – пью и «kytos» – клетка) – поглощение клеткой жидких веществ в виде капель.
«pino» – пью и «kytos» – клетка) – поглощение клеткой жидких веществ в виде капель.
Экзоцитоз
Экзоцитоз выведение веществ из клетки; процесс, обратный эндоцитозу.
Задания: 1. Фагоцитоз представляет собой: 1) активный транспорт в клетку жидкости с растворенными в ней веществами; 2) захват плазматической мембраной твердых частиц и втягивание их в клетку; 3) избирательный транспорт в клетку растворимых органических веществ; 4) пассивное поступление в клетку воды и некоторых ионов.
Задания: 2. Клеточная стенка имеется у клеток: 1) только животных; 2) только растений; 3) растений и грибов; 4) всех живых организмов.
Задания: 3. К какой группе органических соединений относится целлюлоза? 1) полисахарид; 2) дисахарид; 3) белок; 4) липид.
Задания: 4. Липиды в клеточной мембране расположены послойно. Сколько таких слоев содержится в мембране? 1) 1; 2) 2; 3) 3; 4) 4.
Задания: 5. Один из участков наружной плазматической мембраны содержит разветвленные полисахариды. Назовите этот участок мембраны: 1) пространство между липидными слоями мембраны; 2) наружная поверхность; 3) внутренняя поверхность; 4) пространство между белковым и липидным слоем.
Задания: 6. Какой структурный компонент клетки имеют и прокариоты, и эукариоты? 1) ядро; 2) митохондрии; 3) аппарат Гольджи; 4) плазматическую мембрану.
Задания: 7. Плазматическая мембрана НЕ выполняет функции: 1) транспорта веществ; 2) защиты клетки; 3) взаимодействия с другими клетками; 4) синтеза белка.
Задания: 8. Углеводные остатки, входящие в структуру клеточной мембраны, выполняют функцию: 1) транспортную; n 2) сигнальную; n 3) пиноцитоза; n 4) фагоцитоза. n
Задания: 9. Белки, входящие в структуру клеточной мембраны, выполняют функцию: 1) строительную; 2) защитную; 3) ферментативную; 4) все указанные функции.
Задания: 10. Вода проникает через мембрану путем: 1) диффузии; 2) калий-натриевого насоса; 3) активного переноса; 4) облегченного транспорта.
Задания: 11. Клетки каких организмов не могут поглощать твердые частицы? 1) грибов; 2) цветковых растений; 3) амеб; 4) бактерий; 5) лейкоцитов человека; 6) инфузорий.
Урок биологии в 10-м классе «Строение и функции органоидов клетки. Плазматическая мембрана»
Статья является конспектом урока-изучения и первичного закрепления новых знаний (курс “Общая биология”, 10 класс, по программе В.Б. Захарова).
Задачи:
- формирование знаний о строении, свойствах и функциях внутреннего слоя клеточной оболочки – плазматической мембраны (а на ее примере и других мембран клетки), с использованием мыльного пузыря в качестве модели.
- развитие понятия о соответствии строения
выполняемым функциям.

- первичное закрепление полученных знаний с помощью заданий в формате ЕГЭ.
Оборудование:
- таблица “Строение растительной и животной клеток по данным светового и электронного микроскопов”.
- раствор моющего средства (для получения мыльных пузырей), пластмассовая трубочка, тонкая швейная игла.
- рисунок на доске: модели молекул <Рисунок 1>.
- дидактические материалы с заданиями в формате ЕГЭ.
Ход урока
Учитель: На прошлом уроке мы провели лабораторную работу “Плазмолиз и деплазмолиз в клетках кожицы лука”, при проведении которой познакомились с интересными явлениями. В чем их суть?
Ученики: При помещении растительной
ткани (эпидермис чешуйки лука) в гипертонический
раствор поваренной соли (NaCl) не происходило
диффузии этого раствора в клетки, а наблюдался
выход воды из вакуолей клеток в сторону
гипертонического раствора NaCl, чтобы
уравновесить концентрации ионов по обе стороны
клеточной оболочки. При этом объем вакуолей и
всей цитоплазмы в целом уменьшался, что вело к
отхождению цитоплазмы от клеточной стенки –
плазмолизу. При возвращении исследуемой ткани в
чистую воду мы также не наблюдали выхода
растворенных веществ из вакуолей, а только
поступление воды из окружающего пространства
внутрь клетки, в вакуоли с клеточным соком, что
вело к восстановлению объема клетки до прежних
границ – деплазмолизу.
При этом объем вакуолей и
всей цитоплазмы в целом уменьшался, что вело к
отхождению цитоплазмы от клеточной стенки –
плазмолизу. При возвращении исследуемой ткани в
чистую воду мы также не наблюдали выхода
растворенных веществ из вакуолей, а только
поступление воды из окружающего пространства
внутрь клетки, в вакуоли с клеточным соком, что
вело к восстановлению объема клетки до прежних
границ – деплазмолизу.
Учитель: Какой вывод можно сделать из проведенного опыта?
Ученики: Вероятно, поверхность клетки свободно пропускает воду в обоих направлениях, но задерживает ионы Na+ и Cl—, входящие в состав поваренной соли.
Учитель: Свойство, которое мы обнаружили, называется избирательной проницаемостью или полупроницаемостью плазматической мембраны.
Что такое плазматическая мембрана (или
плазмалемма), каково ее строение, свойства и
функции мы и должны разобраться на сегодняшнем
уроке. Как мы и договорились, вести урок будут
ваши товарищи, которые подготовили лекцию о
клеточных мембранах. Ваша задача – в процессе
прослушивания записать основные сведения о
клеточных мембранах. Полученные знания вы должны
будете применить, отвечая на вопроса теста в
конце урока.
Как мы и договорились, вести урок будут
ваши товарищи, которые подготовили лекцию о
клеточных мембранах. Ваша задача – в процессе
прослушивания записать основные сведения о
клеточных мембранах. Полученные знания вы должны
будете применить, отвечая на вопроса теста в
конце урока.
Лектор 1. Строение мембран.
Плазматическая мембрана есть во всех клетках (под гликокаликсом – у животных и под клеточной стенкой у других организмов), она обеспечивает взаимодействие клетки с окружающей ее средой. Плазмалемма образует подвижную поверхность клетки, которая может иметь выросты и впячивания, совершает волнообразные колебательные движения, в ней постоянно перемещаются макромолекулы.
Несмотря на эти непрерывные изменения, клетка
всегда остается охваченной плотно прилегающей
мембраной. Плазматическая мембрана представляет
собой тонкую пленку толщиной менее 10 нм. Даже при
увеличении ее толщины в 1 млн. раз мы получим
величину всего около 1 см, при этом, если всю
клетку увеличить в 1 млн. раз, ее размер будет
сравним с достаточно большой аудиторией.
Даже при
увеличении ее толщины в 1 млн. раз мы получим
величину всего около 1 см, при этом, если всю
клетку увеличить в 1 млн. раз, ее размер будет
сравним с достаточно большой аудиторией.
Мембрана включает два основных типа молекул: фосфолипиды, образующие бислой в толще мембраны, и белки на ее поверхностях. Эти молекулы удерживаются вместе с помощью нековалентных взаимодействий. Такая модель мембраны, похожая на сэндвич, была предложена американскими учеными Даниели и Давсоном в 1935 году. С появлением электронного микроскопа она была подтверждена и несколько видоизменена. В настоящее время принята жидкостно-мозаичная модель мембраны, согласно которой белковые молекулы, плавающие в жидком липидном бислое, образуют в нем своеобразную мозаику. Схема этой современной модели, предложенной в 1972 году Сингером и Николсоном, дана в учебнике.
К некоторым белкам на наружной поверхности
ковалентно прикреплены углеводы, образуя гликопротеины
– своеобразные молекулярные антенны, являющиеся
рецепторами. Гликопротеины участвуют в
распознавании внешних сигналов, поступающих из
окружающей среды или из других частей самого
организма, и в реакции клеток на их воздействие.
Такое взаимное узнавание – необходимый этап,
предшествующий оплодотворению, а также
сцеплению клеток в процессе дифференцирования
тканей. С распознаванием связана и регуляция
транспорта молекул и ионов через мембрану, а
также иммунный ответ, в котором гликопротеины
играют роль антигенов.
Гликопротеины участвуют в
распознавании внешних сигналов, поступающих из
окружающей среды или из других частей самого
организма, и в реакции клеток на их воздействие.
Такое взаимное узнавание – необходимый этап,
предшествующий оплодотворению, а также
сцеплению клеток в процессе дифференцирования
тканей. С распознаванием связана и регуляция
транспорта молекул и ионов через мембрану, а
также иммунный ответ, в котором гликопротеины
играют роль антигенов.
Лектор 2. Свойства мембран.
Чтобы понять, какими свойствами обладают эти
микроскопические структуры, возьмем в качестве
модели мыльный пузырь. Дело в том, что молекулы
мыла и фосфолипидов, входящих в состав мембран,
имеют аналогичное строение <Рисунок 1>.
Мыла (соли жирных кислот) в своем строении имеют гидрофильную
головку (из заряженной карбоксильной группы) и
длинный гидрофобный хвост. У фосфолипидов,
входящих в состав мембран, тоже имеется
гидрофобная хвостовая часть (из двух цепей
жирных кислот) и большая гидрофильная головка,
содержащая отрицательно заряженную группу
фосфорной кислоты.
У фосфолипидов,
входящих в состав мембран, тоже имеется
гидрофобная хвостовая часть (из двух цепей
жирных кислот) и большая гидрофильная головка,
содержащая отрицательно заряженную группу
фосфорной кислоты.
Рис. 1. Модели молекул.
Когда вещества подобного строения смешиваются с водой, их молекулы самопроизвольно принимают такую конфигурацию: гидрофильные головки погружаются в воду, а гидрофобные хвосты в контакт с водой не вступают, контактируя только между собой и с другими гидрофобными веществами, которые могут быть вокруг, например, с воздухом. Оказываясь на границе между двумя средами аналогичной природы, и молекулы мыла, и молекулы фосфолипидов способны к образованию бислоя. Некоторые важные свойства биологических мембран (как и мыльных пузырей), перечисленные далее, объясняются структурой липидного бислоя.
а) Подвижность.
Липидный бислой по существу – жидкое образование, в пределах плоскости которого молекулы могут свободно передвигаться – “течь” без потери контактов в силу взаимного притяжения (“лектор” демонстрирует перетекание жидкости в стенке мыльного пузыря, висящего на пластмассовой трубочке). Гидрофобные хвосты могут свободно скользить друг относительно друга.
б) Способность самозамыкаться.
“Лектор” демонстрирует, как при протыкании
мыльного пузыря и последующего извлечения иглы
целостность его стенки сразу же
восстанавливается. Благодаря этой способности
клетки могут сливаться путем слияния их
плазматических мембран (например, при развитии
мышечной ткани). Этот же эффект наблюдается при
разрезании клетки на две части микроножом, после
чего каждая часть оказывается окруженной
замкнутой плазматической мембраной.
в) Избирательная проницаемость.
То есть, непроницаемость для молекул, растворимых в воде, из-за маслянистой пленки, образованной гидрофобными хвостами фосфолипидных молекул. Чтобы физически проникнуть сквозь такую пленку, вещество само должно быть гидрофобным, или оно может протиснуться через случайные щели, образовавшиеся в результате молекулярных перемещений (мелкие молекулы, например, молекулы воды).
Белки, пронизывающие всю толщу мембраны, или располагающиеся на внешней и внутренней ее поверхностях, помогают клетке обмениваться веществами с окружающей средой. Белковые молекулы обеспечивают избирательный транспорт веществ через мембрану, являясь ферментами, кроме того, внутри белковых молекул или между соседними молекулами образуются поры, через которые в клетки пассивно поступают вода и некоторые ионы.
Лектор 3. Функции плазматической
мембраны.
Функции плазматической
мембраны.
Для чего же служит клетке структура с таким строением и свойствами? Оказывается, что она:
- Придает клетке форму и защищает от физических и химических повреждений.
- Благодаря подвижности, способности образовывать выросты и выпячивания, осуществляет контакт и взаимодействие клеток в тканях и органах.
- Отделяет клеточную среду от внешней среды и поддерживает их различия.
- Является своеобразным указателем типа клеток в силу того, что белки и углеводы на поверхности мембран и различных клеток неодинаковы.
- Регулирует обмен между клеткой и средой, избирательно обеспечивая транспорт в клетку питательных веществ и выведение наружу конечных продуктов обмена.
Лектор 4. Я хочу рассказать, как происходит транспорт
через плазматическую мембрану, а аналогично и
через другие мембраны клетки. Транспорт бывает
пассивный, не требующий затрат энергии, и
активный, энергозависимый, в процессе которого
расходуется энергия, получаемая вследствие
гидролиза молекул АТФ.
Транспорт бывает
пассивный, не требующий затрат энергии, и
активный, энергозависимый, в процессе которого
расходуется энергия, получаемая вследствие
гидролиза молекул АТФ.
1. Диффузия.
Это пассивный процесс; перемещение веществ осуществляется из области с высокой концентрацией в область с низкой концентрацией. Газы и липофильные (жирорастворимые) молекулы диффундируют быстро, ионы и малые полярные молекулы (глюкоза, аминокислоты, жирные кислоты) – медленно. Диффузию ускоряют поры в белковых молекулах.
Разновидностью диффузии является осмос – перемещение воды через мембрану.
2. Эндоцитоз.
Это активный транспорт веществ через мембрану
в клетку (экзоцитоз – из клетки). В зависимости от
характера переносимого через мембрану вещества
различают два типа этих процессов: если
переносится плотное вещество – фагоцитоз (от
греч. “фагос” – пожирать и “цитос” – клетка),
если же капли жидкости, содержащие разнообразные
вещества в растворенном или взвешенном
состоянии, то – пиноцитоз (от греч. “пино” –
пить и “цитос” – клетка).
“фагос” – пожирать и “цитос” – клетка),
если же капли жидкости, содержащие разнообразные
вещества в растворенном или взвешенном
состоянии, то – пиноцитоз (от греч. “пино” –
пить и “цитос” – клетка).
Принцип переноса в обоих случаях идентичен: в том месте, где поверхность клетки соприкасается с частицей или каплей вещества, мембрана прогибается, образует углубление и окружает частицу или каплю жидкости, которая в “мембранной упаковке” погружается внутрь клетки. Здесь образуется пищеварительная вакуоль, и в ней перевариваются поступившие в клетку органические вещества. Фагоцитоз широко распространен у животных, а пиноцитоз осуществляется клетками животных, растений, грибов, бактерий и сине-зеленых водорослей.
3. Активный транспорт при использовании ферментов, встроенных в мембрану.
Перенос идет против градиента концентрации с
затратами энергии, например, в клетку поступают
(“накачиваются”) ионы калия, а из клетки
выводятся (“выкачиваются”) ионы натрия. Эта
работа сопровождается накоплением на мембране
разности электрических потенциалов. Такие
клеточные транспортные системы принято называть
“насосами”. Аналогично осуществляется
транспорт аминокислот и сахаров.
Эта
работа сопровождается накоплением на мембране
разности электрических потенциалов. Такие
клеточные транспортные системы принято называть
“насосами”. Аналогично осуществляется
транспорт аминокислот и сахаров.
Далее “лекторы” помогают слушателям сформулировать выводы по теме урока.
Выводы:
- Плазмалемма – тонкая, около 10 нм толщиной, пленка на поверхности клетки. Она включает липопротеиновые структуры (липиды и белки).
- К некоторым поверхностным молекулам белков присоединены углеводные молекулы (они связаны с механизмом распознавания).
- Липиды мембраны самопроизвольно образуют бислой. Этим обусловливается избирательная проницаемость мембраны.
- Мембранные белки выполняют разнообразные функции, существенно облегчают транспорт через мембрану.
- Мембранные липиды и белки способны
перемещаться в плоскости мембраны, благодаря
чему поверхность клетки не бывает идеально
гладкой.

Для закрепления информации, полученной на уроке, ученикам предлагаются задания в формате ЕГЭ.
Часть “А”
Выберите один правильный ответ.
А1. Строение и функции плазматической мембраны обусловлены входящими в ее состав молекулами:
1) гликогена и крахмала
2) ДНК и АТФ
3) белков и липидов
4) клетчатки и глюкозы
А2. Плазматическая мембрана не выполняет функцию:
1) транспорта веществ
2) защиты клетки
3) взаимодействие с другими клетками
4) синтеза белка
А3. Углеводы, входящие в структуру клеточной мембраны, выполняют функцию:
1) транспорта веществ
2) рецепторную
3) образования двойного слоя мембраны
4) фотосинтеза
А4. Белки, входящие в структуру клеточной мембраны выполняют функцию:
1) строительную
2) защитную
3) транспортную
4) все указанные функции
А5. Фагоцитоз – это:
Фагоцитоз – это:
1) поглощение клеткой жидкости
2) захват твердых частиц
3) транспорт веществ через мембрану
4) ускорение биохимических реакций
А6. Гидрофильные поверхности мембран образованы:
1) неполярными хвостами липидов
2) полярными головками липидов
3) белками
4) углеводами
А7. Прохождение через мембрану ионов Na+ и K+ происходит путем:
1) диффузии
2) осмоса
3) активного переноса
4) не осуществляется
А8. Через липидный слой мембраны свободно проходит:
Часть “В”1) вода
2) эфир
3) глюкоза
4) крахмал
Альтернативный тест (оцените каждое утверждение, “да” или “нет”):
1) при активном транспорте затрачивается энергия
2) фагоцитоз – это вид эндоцитоза
3) диффузия – это вид активного транспорта
4) клеточная стенка растений состоит из целлюлозы
5) осмос – это диффузия воды
6) пиноцитоз – это вид фагоцитоза
7) плазмалемма состоит из трех слоев липидов
8) у животной клетки нет клеточной стенки
9) плазмалемма обеспечивает связь клетки со средой обитания
Часть “С”
Задания со свободным развернутым ответом
С1.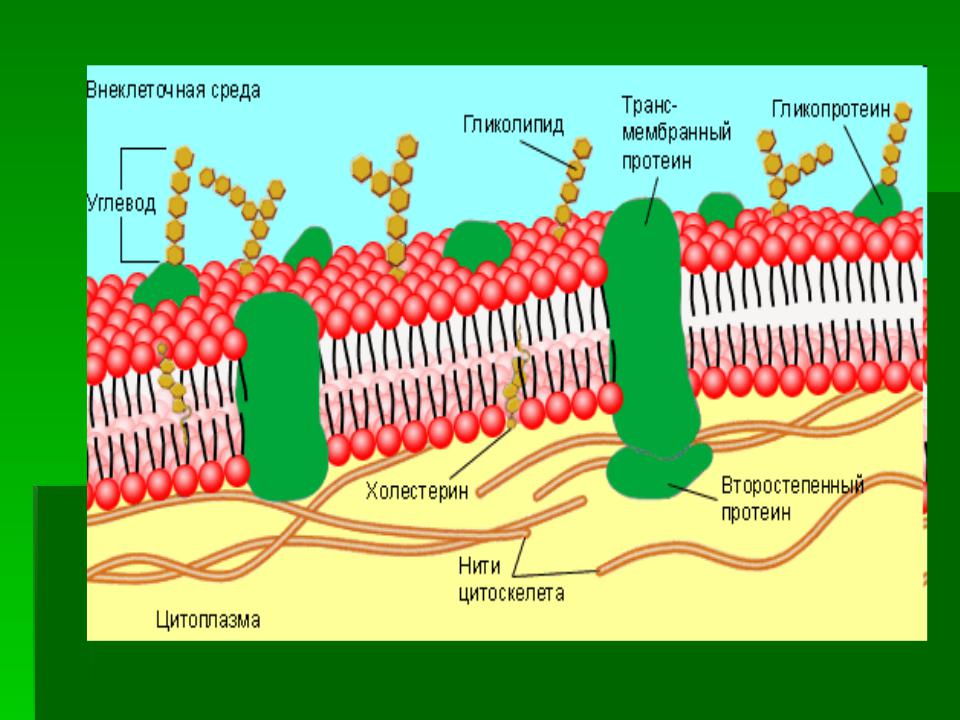 Каково значение эндоцитоза:
Каково значение эндоцитоза:
а) для простейших и низших беспозвоночных?
б) для высокоорганизованных животных и человека?
С2. Что является физической основой вакуолярного транспорта в клетке?
С3. Каково биологическое значение неровностей поверхности плазмалеммы некоторых клеток (микроворсинки, реснички и т.п.)?
С4. Электрический скат и электрический угорь оглушают свою жертву разрядами в несколько сотен вольт. Какие свойства плазмалемм клеток поддерживают возможность создания таких разрядов?
С5. Как работает функция плазмалеммы по снабжению клетки “удостоверением личности”?
Ответы к заданиям.
Часть “А”.
1–3, 2–4, 3–2, 4–4, 5–2, 6–2, 7–3, 8–2.
Часть “В”.
1, 2, 4, 5, 8, 9 – “да”; 3, 6, 7 – “нет”
Часть “С”.
1а. Возможность поступления пищи в клетки и
дальнейшее переваривание в лизосомах.
1б. Фагоцитарная деятельность лейкоцитов имеет огромное значение в защите организма от болезнетворных бактерий и других нежелательных частиц. Пиноцитоз в клетках почечных канальцев приводит к всасыванию белков из первичной мочи.
2. Основные свойства липидных бислоев – способность мембран замыкаться.
3. Увеличение площади поверхности клетки для обмена между клеткой и окружающей ее средой.
4. Наличие ферментных систем, осуществляющих активный транспорт (“насосов”), приводит к перераспределению зарядов на плазмалемме и созданию мембранной разности потенциалов.
5. Для этого есть ряд специфических химических групп на поверхности мембраны – “антенны”, являющиеся, чаще всего, гликопротеинами.
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
- Главная
-
Университет
- Об университете
- Структура
- Нормативные документы и процедуры
- Лечебная деятельность
- Международное сотрудничество
-
Пресс-центр
- Новости
- Анонсы
- События
- Объявления и поздравления
- Конференции
-
Фотоальбом
- Предварительное распределение-2022
- Отчетное заседание рабочей группы по координации деятельности Центров мониторинга профессиональных рисков и психологической поддержки медицинских работников
- Студенты ГрГМУ помогают практическому здравоохранению в борьбе с коронавирусом
- В ГрГМУ прошла расширенная итоговая коллегия главного управления здравоохранения Гродненского облисполкома
- Расширенное заседание совета университета
- Студенты ГрГМУ помогают практическому здравоохранению
- Рабочий визит в Грузию в рамках учебной аккредитации вузов-партнеров
- Новогодний бал во Дворце Независимости
- Новогодний бал для талантливой молодежи Гродненщины
- Финал V Турнира трех вузов по ScienceQuiz
- Встреча представителей учреждений здравоохранения со студентами-выпускниками вуза
- Визит профессора Джаниты Абейвикремы Лиянаге, Чрезвычайного и Полномочного Посла Демократической Социалистической Республики Шри-Ланки
- Областной этап конкурса «Студент года-2021″
- Республиканская онлайн-конференция, посвященная 60-летию кафедры акушерства и гинекологии
- Alma Mater-2021 (ПФ, МДФ)
- В ГрГМУ вручили сертификаты слушателям школы резерва кадров
- Оториноларингологические чтения
- Alma Mater-2021 (ЛФ, МПФ)
- Диалоговая площадка с депутатом Палаты представителей Олегом Сергеевичем Гайдукевичем
- Визит экспертной группы бизнес-премии «Лидер года»
- Заместитель премьер-министра Республики Беларусь Игорь Викторович Петришенко встретился со студентами ГрГМУ
- Делегация Багдадского университета с визитом в ГрГМУ
- Студенческий фестиваль национальных культур-2021
- Студент года-2021
- Занятия в симуляционном центре ГрГМУ, имитирующем «красную зону»
- Торжественная церемония вручения дипломов о переподготовке
- Праздничный концерт, посвященный Дню Матери
- Церемония подписания договора о сотрудничестве вуза и Гродненской православной епархии
- Диалоговая площадка с председателем Гродненского облисполкома Владимиром Степановичем Караником
- Выставка-презентация учреждений высшего образования «Образование будущего»
- Товарищеский турнир по мини-футболу
- Конференция «Современные проблемы радиационной и экологической медицины, лучевой диагностики и терапии»
- Посвящение в первокурсники-2021
-
Встреча заместителя министра здравоохранения Д.
 В. Чередниченко со студентами
В. Чередниченко со студентами
- Открытый диалог, приуроченный к 19-летию БРСМ
- Группа переподготовки по специальности «Организация здравоохранения»
- Собрания факультетов для первокурсников-2021
- День знаний — 2021
- Совет университета
- Студенты военной кафедры ГрГМУ приняли присягу
- День освобождения Гродно-2021
- Ремонтные и отделочные работы
- Итоговая практика по военной подготовке
- День Независимости-2021
- Студенты военной кафедры ГрГМУ: итоговая практика-2021
- Выпускной лечебного факультета-2021
- Выпускной медико-психологического и медико-диагностического факультетов-2021
- Выпускной педиатрического факультета-2021
- Выпускной факультета иностранных учащихся-2021
- Вручение дипломов выпускникам-2021
- Митинг-реквием, посвященный 80-й годовщине начала Великой Отечественной войны
- Акция «Память», приуроченная к 80-летию начала Великой Отечественной войны
- Республиканский легкоатлетический студенческий забег «На старт, молодежь!»
- Актуальные вопросы гигиены питания
- Торжественное мероприятие к Дню медицинских работников-2021
- Совет университета
- Выездное заседание Республиканского совета ректоров
- Церемония вручения медалей и аттестатов особого образца выпускникам 2021 года
- Предупреждение деструктивных проявлений в студенческой среде и влияния агрессивного информационного контента сети интернет
- Онлайн-выставка «Помнить, чтобы не повторить»
- Областная межвузовская конференция «Подвиг народа бессмертен»
- Финал первого Республиканского интеллектуального турнира ScienceQuiz
- Конференция «Актуальные вопросы коморбидности заболеваний в амбулаторной практике: от профилактики до лечения»
- День семьи-2021
- Диалоговая площадка с председателем Гродненского областного Совета депутатов
- Праздничные городские мероприятия к Дню Победы
- Областной этап конкурса «Королева студенчества-2021″
- Праздничный концерт к 9 мая 2021
- IV Республиканский гражданско-патриотический марафон «Вместе – за сильную и процветающую Беларусь!»
- Университетский кубок КВН-2021
- Музыкальная планета студенчества (завершение Дней ФИУ-2021)
- Молодёжный круглый стол «Мы разные, но мы вместе»
-
Дни ФИУ-2021.
 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
- Неделя донорства в ГрГМУ
- Творческая гостиная. Дни ФИУ-2021
- Открытие XVIII студенческого фестиваля национальных культур
- Передвижная мультимедийная выставка «Партизаны Беларуси»
- Республиканский субботник-2021
- Семинар «Человек внутри себя»
- Международный конкурс «Здоровый образ жизни глазами разных поколений»
- Вручение нагрудного знака «Жена пограничника»
- Встреча с представителями медуниверситета г. Люблина
- Королева Студенчества ГрГМУ — 2021
- День открытых дверей-2021
- Управление личными финансами (встреча с представителями «БПС-Сбербанк»)
- Весенний «Мелотрек»
- Праздничный концерт к 8 Марта
- Диалоговая площадка с председателем Гродненского облисполкома
- Расширенное заседание совета университета
- Гродно — Молодежная столица Республики Беларусь-2021
- Торжественное собрание, приуроченное к Дню защитника Отечества
- Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты
- Новогодний ScienceQuiz
- Финал IV Турнира трех вузов ScienseQuiz
- Областной этап конкурса «Студент года-2020″
- Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения»
- Студент года — 2020
- День Знаний — 2020
- Церемония награждения лауреатов Премии Правительства в области качества
- Военная присяга
- Выпускной лечебного факультета-2020
- Выпускной медико-психологического факультета-2020
- Выпускной педиатрического факультета-2020
- Выпускной факультета иностранных учащихся-2020
- Распределение — 2020
- Стоп коронавирус!
- Навстречу весне — 2020
- Профориентация — 18-я Международная специализированная выставка «Образование и карьера»
- Спартакиада среди сотрудников «Здоровье-2020″
- Конференция «Актуальные проблемы медицины»
- Открытие общежития №4
- Встреча Президента Беларуси со студентами и преподавателями медвузов
- Новогодний утренник в ГрГМУ
-
XIX Республиканская студенческая конференция «Язык.
 Общество. Медицина»
Общество. Медицина»
- Alma mater – любовь с первого курса
- Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике
- Областной этап «Студент года-2019″
- Финал Science Qiuz
- Конференция «Актуальные проблемы психологии личности и социального взаимодействия»
- Посвящение в студенты ФИУ
- День Матери
- День открытых дверей — 2019
- Визит в Азербайджанский медицинский университет
- Семинар-тренинг с международным участием «Современные аспекты сестринского образования»
- Осенний легкоатлетический кросс — 2019
- 40 лет педиатрическому факультету
- День Знаний — 2019
- Посвящение в первокурсники
- Акция к Всемирному дню предотвращения суицида
- Турслет-2019
- Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы
- День Независимости
- Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии»
- Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019
- Выпускной медико-психологического факультета — 2019
- Выпускной лечебного факультета — 2019
- В добрый путь, выпускники!
- Распределение по профилям субординатуры
- Государственные экзамены
- Интеллектуальная игра «Что? Где? Когда?»
- Мистер и Мисс факультета иностранных учащихся-2019
- День Победы
- IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава»
- Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!»
- Литературно-художественный марафон «На хвалях спадчыны маёй»
- День открытых дверей-2019
- Их имена останутся в наших сердцах
- Областной этап конкурса «Королева Весна — 2019″
- Королева Весна ГрГМУ — 2019
-
Профориентация «Абитуриент – 2019» (г.
 Барановичи)
Барановичи)
- Мероприятие «Карьера начинается с образования!» (г. Лида)
- Итоговое распределение выпускников — 2019
- «Навстречу весне — 2019″
- Торжественная церемония, посвященная Дню защитника Отечества
- Торжественное собрание к Дню защитника Отечества — 2019
- Мистер ГрГМУ — 2019
- Предварительное распределение выпускников 2019 года
- Митинг-реквием у памятника воинам-интернационалистам
- Профориентация «Образование и карьера» (г.Минск)
- Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета
- Спартакиада «Здоровье — 2019»
-
Итоговая научно-практическая конференция «Актуальные проблемы медицины».

- Расширенное заседание Совета университета.
- Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы»
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- XVI съезд хирургов Республики Беларусь
- Итоговая практика
- Конкурс «Студент года-2018»
- Совет университета
- 1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.)
- 1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.)
- День знаний
- День независимости Республики Беларусь
- Церемония награждения победителей конкурса на соискание Премии СНГ
- День герба и флага Республики Беларусь
- «Стань донором – подари возможность жить»
- VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед»
- Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018»
- Окончательное распределение выпускников 2018 года
- Митинг-реквием, приуроченный к 75-летию хатынской трагедии
- Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год»
- Конкурсное шоу-представление «Мистер ГрГМУ-2018»
- Предварительное распределение выпускников 2018 года
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- II Съезд учёных Республики Беларусь
- Круглый стол факультета иностранных учащихся
- «Молодежь мира: самобытность, солидарность, сотрудничество»
- Заседание выездной сессии Гродненского областного Совета депутатов
- Областной этап республиканского конкурса «Студент года-2017»
- Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым
-
Конференция «Актуальные вопросы инфекционной патологии», 27.
 10.2017
10.2017
- XIX Всемирный фестиваль студентов и молодежи
- Республиканская научно-практическая конференция «II Гродненские аритмологические чтения»
- Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения»
- Праздник, посвящённый 889-летию города Гродно
- Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017)
- ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве
- 1 сентября — День знаний
- Итоговая практика на кафедре военной и экстремальной медицины
- Квалификационный экзамен у врачей-интернов
- Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь
- Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем»
- День государственного флага и герба
- 9 мая
- Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ»
- «Стань донором – подари возможность жить»
- «Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию
- Весенний кубок КВН «Юмор–это наука»
- Мисс ГрГМУ-2017
- Распределение 2017 года
- Общегородской профориентационный день для учащихся гимназий, лицеев и школ
- Праздничный концерт, посвященный Дню 8 марта
- Конкурсное шоу-представление «Мистер ГрГМУ–2017»
- «Масленица-2017»
- Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества
-
Лекция профессора, д.
 м.н. О.О. Руммо
м.н. О.О. Руммо
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань
- Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ
- «Студент года-2016»
- Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- День матери в ГрГМУ
- Итоговая практика-2016
- День знаний
- Визит китайской делегации в ГрГМУ
- Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша)
- Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника
- Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию
- Республиканская университетская суббота-2016
- Республиканская акция «Беларусь против табака»
- Встреча с поэтессой Яниной Бокий
- 9 мая — День Победы
- Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь
- Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память»
- «Цветы Великой Победы»
- Концерт народного ансамбля польской песни и танца «Хабры»
- Суботнiк ў Мураванцы
- «Мисс ГрГМУ-2016»
- Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ»
- Визит иностранной делегации из Медицинского совета Мальдивской Республики
- «Кубок ректора Гродненского государственного медицинского университета по дзюдо»
- «Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь
- Распределение выпускников 2016 года
- Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ
- Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан
- Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ
- Состоялось открытие фотовыставки «По следам Библии»
- «Кубок декана» медико-диагностического факультета по скалолазанию
- Мистер ГрГМУ-2016
- Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ
- Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года
- Визит Посла Республики Индия в УО «ГрГМУ»
- Торжественное собрание и концерт, посвященный Дню защитника Отечества
- Митинг-реквием, посвященный Дню памяти воинов-интернационалистов
- Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома
- Итоговая научно-практическая конференция Гродненского государственного медицинского университета
- Новогодний концерт
- Открытие профессорского консультативного центра
- Концерт-акция «Молодёжь против СПИДа»
- «Студент года-2015»
- Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича
- «Аlma mater – любовь с первого курса»
- Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб
- «Открытый Кубок по велоориентированию РЦФВиС»
-
Совместное заседание Советов университетов г.
 Гродно
Гродно
- Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко
- День города
- Дебаты «Врач — выбор жизни»
- День города
- Праздничный концерт «Для вас, первокурсники!»
- Акция «Наш год – наш выбор»
- День знаний
- Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет»
- Принятие военной присяги студентами ГрГМУ
- День Независимости Республики Беларусь
- Вручение дипломов выпускникам 2015 года
- Республиканская олимпиада студентов по педиатрии
- Открытие памятного знака в честь погибших защитников
- 9 мая
- «Вторая белорусско-польская дерматологическая конференция: дерматология без границ»
- Мистер университет
- Мисс универитет
- КВН
- Гродненский государственный медицинский университет
- Чествование наших ветеранов
- 1 Мая
- Cовместный субботник
- Наши издания
- Медицинский календарь
- Университет в СМИ
- Видео-презентации
- Общественные объединения
- Комиссия по противодействию коррупции
- Образовательная деятельность
- Абитуриентам
- Студентам
- Выпускникам
- Слайдер
- Последние обновления
- Баннеры
- Иностранному гражданину
- Научная деятельность
- Поиск
Плазматическая мембрана.
 Клеточная стенка
Клеточная стенкаСт. 69
Рассмотрите первый форзац учебник. Из каких частей состоят растительная и животные клетки? В чем их сходство и отличие?
Как растительная, так и животная клетка состоят из оболочки, ядра, цитоплазмы и находящихся в ней органоидов. Отличаются же животная и растительная клетки именно этими органоидами: в растительной клетке есть пластиды, есть большая центральная вакуоль, есть клеточная стенка. В животной вышеперечисленных органоидов нет, зато вакуоли делятся по функциям – пищеварительные (лизосомы), сократительные, митохондрии и т.п.
Ст. 76
1. Объясните, как образуется липидный бислой.
Наружная клеточная мембрана состоит из липидного бислоя, заключённого между двумя слоями белков. Известно, что молекулы фосфолипида обладают
гидрофильно — гидрофобными свойствами. При попадании в воду они располагаются так, что их гидрофобные части вступают в тесный контакт друг с другом, а гидрофильные части – с водой. Такие молекулы способны
Такие молекулы способны
спонтанно образовывать двухслойные структуры в виде маленьких замкнутых пузырьков.
2. Как располагаются белки в плазматической мембране? Какими участками гидрофильными или гидрофобными, они погружены внутрь плазматической мембраны? Какую функцию выполняют мембранные белки?
Белки не образуют сплошного слоя, а встречаются на отдельных участках в виде вкраплений, погружённых в липидный бислой. Они погружены гидрофобными участками внутрь плазматической мембраны. С наружной стороны с белками и липидами соединены углеводы. Они образуют гликолипидные и гликопротеидные комплексы.
3. Какие структуры плазматической мембраны обеспечивают: а) избирательную проницаемость; б) распознавание соседних клеток; в) взаимное сцепление клеток друг «с другом в одной ткани?»
Избирательную проницательность обеспечивают белки — переносчики. Для каждого вещества существует свой специфический белок — переносчик (или канал),
Распознавание соседних клеток обеспечивают белки — рецепторы, которые могут распознавать не только соседние клетки, но и разные вещества (например – гормоны).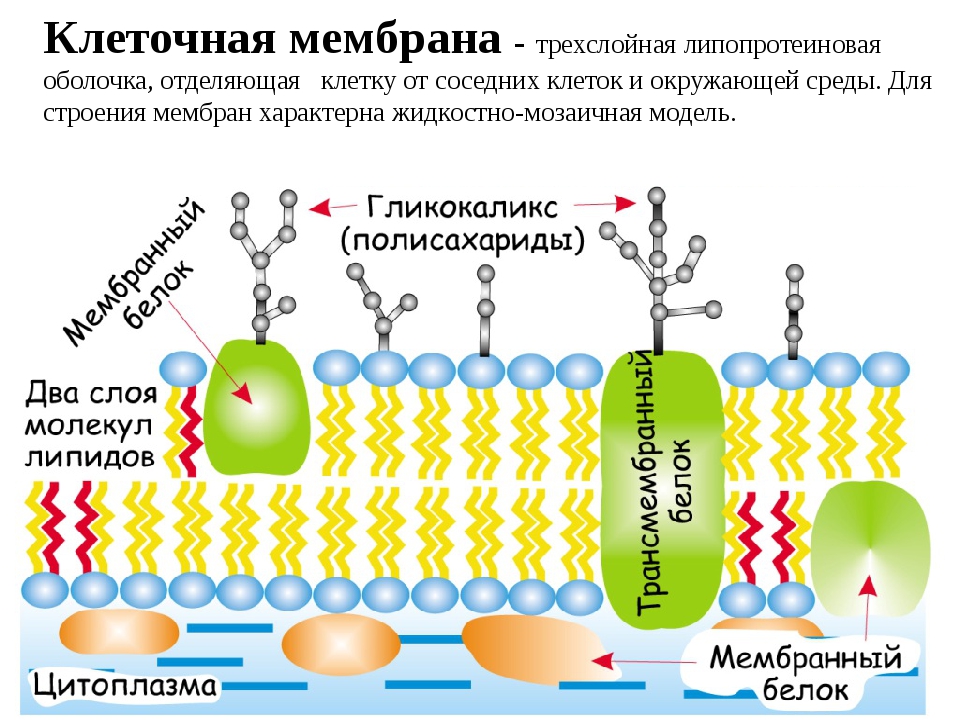 Взаимное сцепление клеток обеспечивают межклеточные соединения, которые, в зависимости от органа или в зависимости от того, кому они принадлежат (растения, животные или люди) имеют разное строение и название. Для растений характерны десмосомы и плазмодесмы, а для людей, например, вставочные диски миокарда. Также клетки соединяются между собой при помощи микротрубочек и микрофиламентов.
Взаимное сцепление клеток обеспечивают межклеточные соединения, которые, в зависимости от органа или в зависимости от того, кому они принадлежат (растения, животные или люди) имеют разное строение и название. Для растений характерны десмосомы и плазмодесмы, а для людей, например, вставочные диски миокарда. Также клетки соединяются между собой при помощи микротрубочек и микрофиламентов.
4. Из каких органических веществ построена оболочка клетки? Для каких организмов характерна эта клеточная структура? Чем оболочка клетки отличается от плазматической мембраны?
Основу клеточной оболочки составляет плазматическая мембрана (наружная клеточная мембрана, плазмолемма) – биологическая мембрана, ограничивающая внутренние содержимое клетки от внешней среды.
Все биологические мембраны представляют собой двойной слой липидов, гидрофобные концы которых обращены внутрь, а гидрофильные головки – наружу. Кроме липидов в состав мембраны входят белки. Это клеточная структура характерна для животных и человека. У растений мембраны клеток покрыты клеточной стенкой из целлюлозы.
Это клеточная структура характерна для животных и человека. У растений мембраны клеток покрыты клеточной стенкой из целлюлозы.
5. Какие способы поступления веществ через плазматическую мембрану вам известны? Приведите примеры веществ, поступающих в клетку тем или иным способом.
Существует несколько механизмов транспорта веществ через плазматическую мембрану: диффузия, осмос, активный транспорт, эндоцитоз и экзоцитозю.
Малые незаряженные молекулы и жирорастворимые вещества поступают в клетку диффузно. Так, молекулы кислорода (02), углекислого газа (С02), этилового спирта (С2НбОН) легко диффундируют через липидный бислой.
Осмос: Например, если поместить клетку в гипертонический раствор с более высокой концентрацией солей, то вода из клетки станет поступать в межклеточное пространство.
6. Какие два вида эндоцитоза вам известны? Назовите известные вам специализированные клетки и одноклеточные организмы, способные к эндоцитозу.
— Фагоцитоз
— Пиноцитоз
Амеба, инфузория туфелька
7. В извитых канальцах почки при образовании вторичной мочи происходит обратное всасывание глюкозы и ионов натрия в кровь. Какой вид транспорта веществ имеет место в этом процессе? Ответ поясните.
Это активный транспорт, так как он идёт против градиента концентрации соответствующих веществ (оттуда, где меньше туда, где больше). Для этого требуется тратить энергию.
8. Цианистый водород и угарный газ – яды, легко проникающие через плазматическую мембрану. Почему ни одна из клеток не выработала приспособлений, препятствующих поступлению этих веществ внутрь клетки?
И тот и другой газы вещества низкомолекулярные, причём оба – слабополярные (практически неполярные). Поэтому они легко растворяются в фосфолипидном бислое мембраны и свободно диффундируют по градиенту концентрации внутрь клетки. Чтобы создать препятствия их проникновению, пришлось бы принципиально менять структуру мембраны
Чтобы создать препятствия их проникновению, пришлось бы принципиально менять структуру мембраны
9. Перечертите в тетрадь и заполните таблицу.
Транспорт веществ через плазматическую мембрану
Межклеточные контакты
Межклеточные контакты — соединения между клетками, образованные при помощи белков. Межклеточные контакты обеспечивают непосредственную связь между клетками. Кроме того, клетки взаимодействуют друг с другом на расстоянии с помощью сигналов (главным образом — сигнальных веществ), передаваемых через межклеточное вещество.
Строение межклеточных соединений
В тех тканях, в которых клетки или их отростки плотно прилегают друг к другу (эпителий, мышечная ткань и пр.) между мембранами контактирующих клеток формируются связи – межклеточные контакты. Каждый тип межклеточных контактов формируется за счет специфических белков, подавляющее большинство которых — трансмембранные белки. Специальные адапторные белки могут соединять белки межклеточных контактов с цитоскелетом, а специальные «скелетные» белки — соединять отдельные молекулы этих белков в сложную надмолекулярную структуру. Во многих случаях межклеточные соединения разрушаются при удалении из среды ионов Ca2+.
Специальные адапторные белки могут соединять белки межклеточных контактов с цитоскелетом, а специальные «скелетные» белки — соединять отдельные молекулы этих белков в сложную надмолекулярную структуру. Во многих случаях межклеточные соединения разрушаются при удалении из среды ионов Ca2+.
Функции межклеточных соединений
Межклеточные соединения возникают в местах соприкосновения клеток в тканях и служат для межклеточного транспорта веществ и передачи сигналов (межклеточное взаимодействие), а также для механического скрепления клеток друг с другом.
Через щелевые контакты могут передаваться электрические сигналы. Клетки органов и тканей вырабатывают ряд химических веществ, действующих на другие клетки (в том числе через межклеточные контакты) и вызывающих изменения в работе цитоскелета, в интенсивности обмена веществ и процессе синтеза клеткой белков.
Типы межклеточных соединений
Простое межклеточное соединение
При простом межклеточном соединении оболочки клеток сближены на расстояние 15 – 20 нм. Это соединение занимает наиболее обширные участки соприкасающихся клеток. Посредством простых соединений осуществляется слабая механическая связь, не препятствующая транспорту веществ в межклеточных пространствах. Разновидностью простого соединения является контакт типа «замок», когда билипидные мембраны соседних клеток вместе с участком цитоплазмы вдавливаются друг в друга, чем достигается большая поверхность соприкосновения и более прочная механическая связь.
Это соединение занимает наиболее обширные участки соприкасающихся клеток. Посредством простых соединений осуществляется слабая механическая связь, не препятствующая транспорту веществ в межклеточных пространствах. Разновидностью простого соединения является контакт типа «замок», когда билипидные мембраны соседних клеток вместе с участком цитоплазмы вдавливаются друг в друга, чем достигается большая поверхность соприкосновения и более прочная механическая связь.
Плотное соединение (запирающая зона)
В плотном соединении клеточные мембраны максимально сближены, здесь фактически происходит их слияние. Роль плотного соединения заключается в механическом сцеплении клеток и препятствии транспорту веществ по межклеточным пространствам. Эта область непроницаема для макромолекул и ионов, она ограждает межклеточные щели от внешней среды. Плотные соединения обычно образуются между эпителиальными клетками в тех органах (желудке, кишечнике и пр.), где эпителий ограничивает содержимое этих органов (желудочный сок, кишечный сок). В этих участках плотные контакты охватывают по периметру каждую клетку, межмембранные пространства отсутствуют, а соседние клеточные оболочки слиты в одну. Если же плотное сцепление происходит на ограниченном участке, то образуется пятно слипания (десмосома).Частными случаями плотного соединения являются зоны замыкания и слипания.
В этих участках плотные контакты охватывают по периметру каждую клетку, межмембранные пространства отсутствуют, а соседние клеточные оболочки слиты в одну. Если же плотное сцепление происходит на ограниченном участке, то образуется пятно слипания (десмосома).Частными случаями плотного соединения являются зоны замыкания и слипания.
Плотные контакты (англ. tight junctions) — запирающие межклеточные контакты, присущие клеткам позвоночных животных, в составе которых мембраны соседних клеток максимально сближены и «сшиты» специализированными белками клаудинами и окклюдинами (англ.). Распространены в эпителиальных тканях, где составляют наиболее апикальную часть (лат. zonula occludens) комплекса контактов между клетками, в который входят адгезионные контакты и десмосомы. Плотные контакты построены из нескольких лент, опоясывающих клетку, которые, пересекаясь между собой, образуют сетевидную связь. С цитоплазматической стороны ассоциированы с актиновыми филаментами.
Эпителиальные ткани выполняют барьерную и транспортную функции, для этого они должны быть способны пропускать одни вещества и задерживать другие.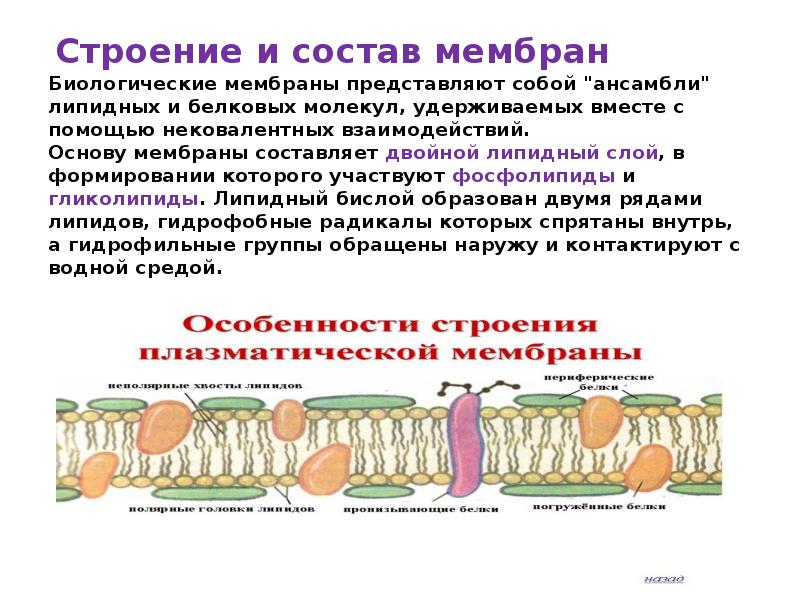 Такую выборочную проницаемость успешно обеспечивают клеточные мембраны, однако между клетками остаются промежутки, через которые может проходить так называемый парацеллюлярный (параклеточный) транспорт (англ. Paracellular transport). Роль плотных контактов заключается в том, чтобы ограничивать и регулировать параклеточную диффузию: они предотвращают протекание тканевой жидкости через эпителий, но при необходимости могут быть проницаемыми для ионов, небольших гидрофильных молекул и даже макромолекул. Также плотные контакты выполняют так называемую функцию «ограждения», они предотвращают диффузию компонентов мембраны в её внешнем слое, благодаря чему поддерживается разница в составе апикальной и базолатеральной мембран. Плотные контакты задействованы в сигнальных путях, регулирующих пролиферацию, поляризацию и дифференциацию эпителиальных клеток.
Такую выборочную проницаемость успешно обеспечивают клеточные мембраны, однако между клетками остаются промежутки, через которые может проходить так называемый парацеллюлярный (параклеточный) транспорт (англ. Paracellular transport). Роль плотных контактов заключается в том, чтобы ограничивать и регулировать параклеточную диффузию: они предотвращают протекание тканевой жидкости через эпителий, но при необходимости могут быть проницаемыми для ионов, небольших гидрофильных молекул и даже макромолекул. Также плотные контакты выполняют так называемую функцию «ограждения», они предотвращают диффузию компонентов мембраны в её внешнем слое, благодаря чему поддерживается разница в составе апикальной и базолатеральной мембран. Плотные контакты задействованы в сигнальных путях, регулирующих пролиферацию, поляризацию и дифференциацию эпителиальных клеток.
Плотные контакты состоят из тонких лент, пересекающихся между собой, которые полностью опоясывают клетку и контактируют с аналогичными лентами на соседних клетках. На электронных микрофотографиях заметно, что в участках плотных контактов мембраны соприкасаются одна с другой или даже сливаются. Комбинация метода замораживания-скалывания с электронной микроскопией с высоким разрешением позволила установить, что плёнки плотных контактов построены из белковых частиц диаметром 3-4 нм, которые выступают с обеих поверхностей мембраны. Также в пользу того, что в образовании плотных контактов ключевую роль играют белки, свидетельствует деление клеток под действием протеолитического фермента трипсина.
На электронных микрофотографиях заметно, что в участках плотных контактов мембраны соприкасаются одна с другой или даже сливаются. Комбинация метода замораживания-скалывания с электронной микроскопией с высоким разрешением позволила установить, что плёнки плотных контактов построены из белковых частиц диаметром 3-4 нм, которые выступают с обеих поверхностей мембраны. Также в пользу того, что в образовании плотных контактов ключевую роль играют белки, свидетельствует деление клеток под действием протеолитического фермента трипсина.
Всего в состав тесных контактов входит около 40 различных белков, как мембранных, так и цитоплазматических. Последние необходимы для прикрепления актиновых филаментов, регуляции и сигнализирования.
Мембранные белки
Мембранные белки плотных контактов можно разделить на две группы: те, которые пересекают мембрану 4 раза, и те, которые пересекают её только раз. Первая группа значительно распространена, в неё входят белки клаудины, окклюдины и трицеллюлин. Они имеют общие черты строения, в частности в них имеются четыре α-спиральных трасмембранных домена, N- и С-концы обращены к цитозолю, а домены, выступающие в межклеточное пространство, участвуют в гомо- или гетерофильных взаимодействиях с подобными белками на соседней клетке.
Они имеют общие черты строения, в частности в них имеются четыре α-спиральных трасмембранных домена, N- и С-концы обращены к цитозолю, а домены, выступающие в межклеточное пространство, участвуют в гомо- или гетерофильных взаимодействиях с подобными белками на соседней клетке.
Основными белками плотных контактов являются клаудины (лат. claudo). Их роль была продемонстрирована на примере мышей с отсутствующим геном клаудин-1, — в эпидермисе таких животных не формируются плотные контакты и они погибают в течение дня после рождения из-за обезвоживания вследствие интенсивного испарения[1]. Клаудины также участвуют в формировании селективных каналов для транспорта ионов. В геноме человека есть гены по крайней мере 24 различных клаудинов, экспрессия которых происходит тканеспецифически.
Второе место по распространенности в плотных контактах занимают белки окклюдины (от лат. occludo — закрывать), они регулируют транспорт маленьких гидрофильных молекул и прохождение нейтрофилов через эпителий. Наибольшие концентрации третьего белка — трицеллюлина, наблюдаются в местах контакта трех клеток.
Наибольшие концентрации третьего белка — трицеллюлина, наблюдаются в местах контакта трех клеток.
К белкам плотных контактов, пересекающим мембрану один раз, относятся JAM-A,-B,-C и-D (англ. junctional adhesion molecules) и родственные им CAR (англ. coxsackievirus and adenovirus receptor), CLMP (англ. CAR-like membrane protein) и ESAM (англ. endothelial-cell selective adhesion molecule), имеющие по два иммуноглобулинных домена, а также белки CRB3 (англ. Crumbs homologue 3) и Bves
Цитоплазматические белки
Цитоплазматическая пластинка плотных контактов необходима для их присоединения к актиновым филаментам, регуляции сцепления клеток и параклеточного транспорта, а также для передачи сигналов от поверхности внутрь клетки. В её состав входят адаптерные, каркасные и цитоскелетные белки, а также элементы сигнальных путей (киназы, фосфатазы). Наиболее изучен белок цитоплазматической пластинки — ZO-1, он имеет несколько доменов белок-белкового взаимодействия, каждый из которых обеспечивает контакт с другими компонентами, в том числе три PDZ-домена (англ. PSD95–DlgA–ZO-1) — с клаудинами и другими адаптерными белками — ZO-2 и ZO-3, GUK-домен (англ. guanylate kinase homology) — с окклюдинами, а Sh4-домен — с сигнальными белками.
PSD95–DlgA–ZO-1) — с клаудинами и другими адаптерными белками — ZO-2 и ZO-3, GUK-домен (англ. guanylate kinase homology) — с окклюдинами, а Sh4-домен — с сигнальными белками.
С цитоплазматической стороной плотных контактов также ассоциированы комплексы белков PAR3/PAR6 и Pals1/PATJ, необходимые для установления полярности клеток и эпителиального морфогенеза.
Функции
Первые исследования функций плотных контактов привели к представлению, что это статические непроницаемые структуры, необходимые для того, чтобы ограничить диффузию веществ между клетками. Впоследствии было выяснено, что они избирательно проницаемы, к тому же их пропускная способность отличается в различных тканях и может регулироваться. Также установлена ещё одна функция плотных контактов: роль в поддержании полярности клеток путем ограничения диффузии липидов и белков во внешнем слое плазматической мембраны. В первом десятилетии 21 века также накоплены данные, свидетельствующие об участии этих структур в сигнальных путях, в частности, регулирующих пролиферацию и полярность.
Регулирование парацеллюлярного транспорта
Непроницаемость плотных контактов в большинстве водорастворимых соединений может быть продемонстрирована в опыте по введению гидроксида лантана (электронно плотный коллоидный раствор) в кровеносные сосуды поджелудочной железы. Через несколько минут после инъекции ацинарные клетки фиксируются, и из них готовятся препараты для микроскопии. В таком случае можно наблюдать, что гидроксид лантана диффундирует из крови в пространство между латеральными поверхностями клеток, но не может проникнуть через плотные контакты в их верхней части. Другие опыты показали, что плотные контакты также непроницаемы для солей. Например при выращивании почек собаки MDCK (англ. Madin-Darby canine kidney) в среде с очень низкой концентрацией кальция, они формируют монослой, однако не сочетаются между собой плотными контактами. Через такой монослой могут свободно двигаться соли и жидкости. Если культуре добавить кальция, то за час формируются плотные контакты, и слой становится непроницаемым для жидкостей.
Однако не во всех тканях плотные контакты полностью непроницаемы, существуют так называемые неплотные эпителии (англ. leaky epithelia). Например, эпителий тонкого кишечника пропускает в 1000 раз больше ионов Na +, чем эпителий канальцев почек. Ионы проникают через параклеточные поры диаметром 4 Å, селективные по заряду и размеру частиц, которые формируются белками клаудинами. Поскольку эпителии различных органов эксрессируют различные наборы клаудинов, то отличается и их проницаемость для ионов. Например, специфический клаудин, присутствуюий только в почках, позволяет проходить ионам магния в процессе реабсорбции.
Межклеточное пространство эпителия может быть проницаемым и для больших частиц, например, при повторении упомянутого опыта с гидроксидом лантана на ткани эпителия тонкого кишечника кролика можно наблюдать прохождение коллоидных частиц между клетками. Крупные молекулы транспортируются через специальные пути утечки (англ. leak pathway) диаметром более 60 Å. Это важно, например, для процессов всасывания аминокислот и моносахаридов, концентрация которых в тонком кишечнике возрастает после еды достаточно для их пассивного транспорта.
Поддержание различия между апикальной и базолатеральной мембранами
Если в среду, контактирующую с апикальной частью монослоя MDCK-клеток, добавить липосомы, содержащие флуоресцентно меченые гликопротеины, некоторые из них спонтанно сливаются с клеточными мембранами. После этого флуоресценцию можно обнаружить в апикальной, но не в базолатеральной части клеток при условии целостности плотных контактов. Если же их разрушить, удалив из среды кальций, флуоресцентные белки диффундируют и равномерно распределяются по всей поверхности клетки.
Цитозольный слой мембраны имеет одинаковый липидный состав, как в апикальном, так и в базолатеральном участках, эти липиды могут свободно диффундировать. С другой стороны, липиды внеклеточного слоя двух частей клетки существенно различаются, и обмену между ними препятствуют плотные контакты. Например, все гликолипиды, как и белки заякоренные гликозилфосфатидилинозитолом, в мембранах MDCK клеток расположены исключительно в внеклеточном слое апикальной части, а фосфатидилхолин — почти исключительно в базолатеральной части.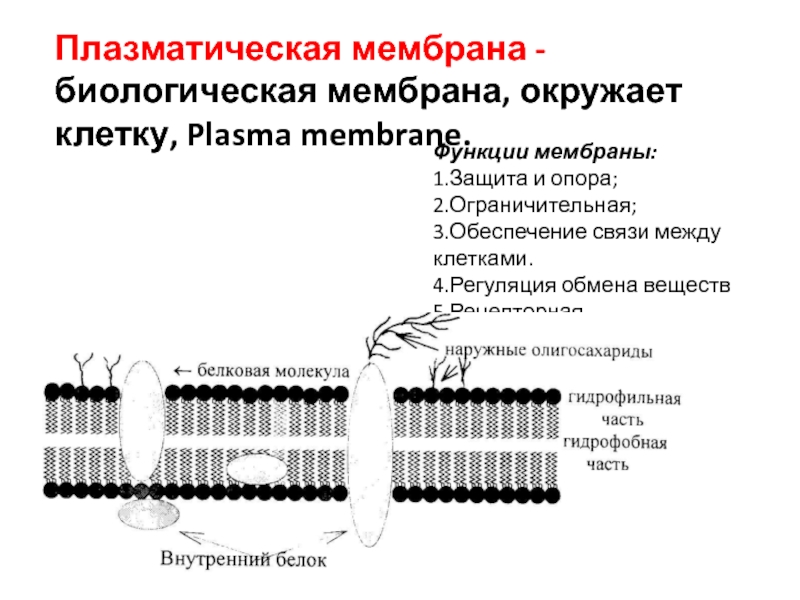
Болезни, связанные с плотными контактами
С нарушением формирования тесных контактов связаны некоторые наследственные расстройства человека, например мутации в генах клаудина-16 и клаудина-19, которые приводят к гипомагниемии, вследствие чрезмерной потери магния с мочой. Мутации в гене клаудина-13 и трицеллюлина вызывают наследственную глухоту. Дисрегуляция некоторых белков плотных контактов связана с онкологическими заболеваниями, например экспрессия ZO-1 и ZO-2 снижается во многих типах рака. Компоненты тесных контактов также могут быть мишенями для онкогенных вирусов.
Некоторые вирусы используют мембранные белки плотных контактов для проникновения в клетку, в частности клаудин-1 является корецептором для вируса гепатита C. Другие вирусы присоединяются к белкам плотных контактов, чтобы разрушить барьер, отделяющий их от настоящих рецепторов на базолатеральной слое эпителиальных клеток, или неэпителиальных клетках.
Плотные контакты могут быть мишенью и для бактериальных патогенов, например Clostridium perfringens — возбудитель газовой гангрены, выделяет энтеротоксин (англ. ), действующий на внеклеточные домены мембранных клаудинов и окклюдинов, и вызывает протечки эпителия. Helicobacter pylori — возбудитель гастрита — вводит в клетки белок CagA, взаимодействующий с комплексом ZO-1-JAM-A, считается, что это помогает бактерии преодолеть защитный барьер желудочного эпителия.
), действующий на внеклеточные домены мембранных клаудинов и окклюдинов, и вызывает протечки эпителия. Helicobacter pylori — возбудитель гастрита — вводит в клетки белок CagA, взаимодействующий с комплексом ZO-1-JAM-A, считается, что это помогает бактерии преодолеть защитный барьер желудочного эпителия.
Адгезионные контакты
Адгезионные контакты (англ. adherens junctions, AJ) — якорные межклеточные контакты, ассоциированные с микрофиламентами, обеспечивающие целостность и механическую прочность ткани, в частности противостояние растяжению, придающие клеткам возможность координированно использовать актиновый цитоскелет. Адгезионные контакты относятся к гомофильным, то есть соединяют клетки одинакового типа. В их формировании принимают участие белки кадгерины и катенины.
Морфологически адгезионные контакты являются относительно простыми, в отличие от десмосом, плотных и щелевых контактов, они не имеют высокоспециализированных ультраструктур, кроме скопления актиновых филаментов.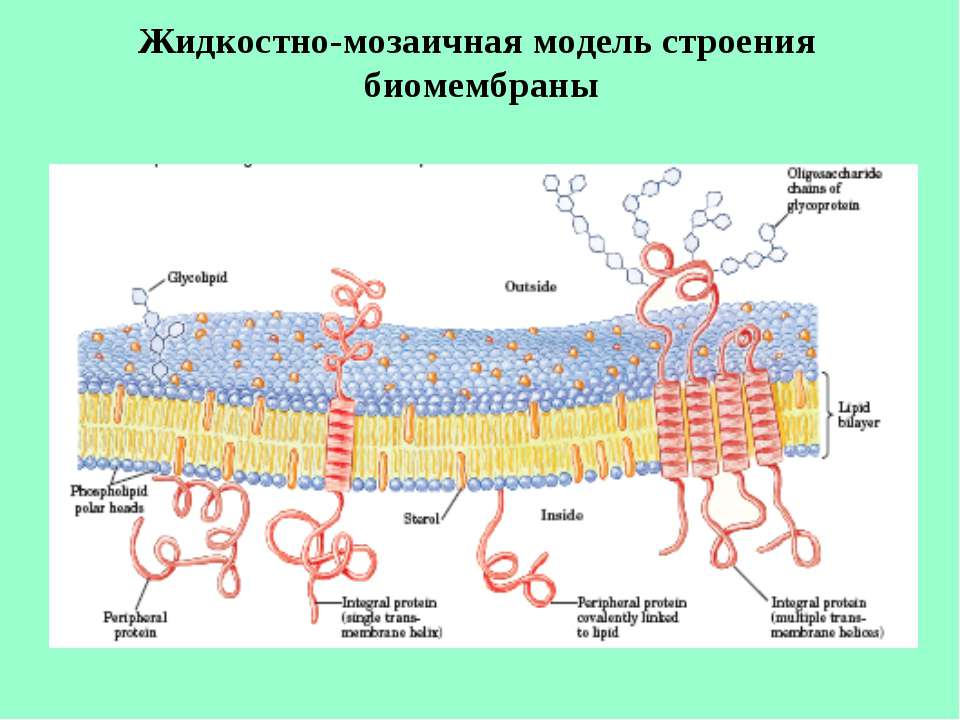 От других типов соединений клеток они отличаются относительной гибкостью и изменчивостью.
От других типов соединений клеток они отличаются относительной гибкостью и изменчивостью.
Чаще всего адгезионные контакты встречаются в эпителиальных тканях, здесь они образуют вокруг каждой клетки поясок, который называют зоной прилипания (англ. zonula adherens). Такие зоны в эпителии позвоночных животных преимущественно размещаются базальнее участка плотных контактов (англ. zonula occludens) и апикальнее десмосом (англ. macula adherens).
Однако распространение адгезионных контактов в организме не ограничено только эпителием, во многих неэпителиальных тканях, например в нервной и соединительной, они присутствуют в форме точечных или полосковидных сообщений клеток. Также они хорошо выражены в сердечной мышце, где обеспечивают косвенное сообщение сократительного аппарата кардиомиоцитов. Вместе с десмосомами адгезивные контакты образуют так называемые вставные диски между клетками миокарда.
В зоне адгезионных контактов мембраны соседних клеток удалены друг от друга на расстояние 10-20 нм.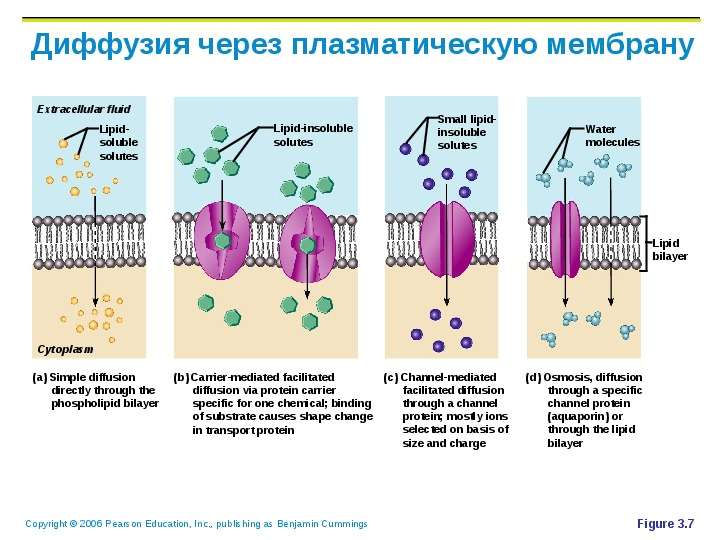 В состав адгезионных контактов входят три основных элемента:
В состав адгезионных контактов входят три основных элемента:
Собственно сообщение клеток происходит благодаря трансмембранным молекулам клеточной адгезии (англ. cell adhesion molecules, CAM), из которых самыми распространенными в адгезионных контактах являются классические кадгерины. Их N-конечная (N-terminus) внеклеточная часть в присутствии ионов кальция взаимодействует с подобной молекулой на соседней клетке, обеспечивая слипание клеток, а внутриклеточный C-конечный (C-terminus) домен связывается с якорными белками. Также в адгезионных контактах были обнаружены другие трансмембранные белки: нектины и везатины.
Адаптером между CAM и элементами цитоскелета выступают внутриклеточные якорные белки, большинство из них крепят цитоплазматическую сторону кадгеринов к актиновым филаментам. Кадгерины непосредственно взаимодействуют с β-катенином и плакоглобинами (γ-катенинами), которые в свою очередь присоединяются к молекулам α-катенина, а те — к винкулину, α-актинину или ZO-1 (англ. ), которые уже связываются с актином. В комплексе якорных белков с кадгеринами присутствует также белок p120-катенин, который, вероятно, участвует в регулировании силы адгезионных контактов между клетками. Нектины крепятся к актиновым филаментам через белок афадин.
Третьим компонентом являются пучки актиновых филаментов в соседних клетках, что косвенно соединены между собой. Также была продемонстрирована связь адгезионных контактов с микротрубочками, хотя значительного их скопления в этих участках и не наблюдается. Микротрубочки могут присоединяться к адгезионным контактам как плюс-, так и минус-концами, вместе с моторными белками они, вероятно, участвуют в транспортировке белков, необходимых для формирования контактов, в частности кадгеринов.
), которые уже связываются с актином. В комплексе якорных белков с кадгеринами присутствует также белок p120-катенин, который, вероятно, участвует в регулировании силы адгезионных контактов между клетками. Нектины крепятся к актиновым филаментам через белок афадин.
Третьим компонентом являются пучки актиновых филаментов в соседних клетках, что косвенно соединены между собой. Также была продемонстрирована связь адгезионных контактов с микротрубочками, хотя значительного их скопления в этих участках и не наблюдается. Микротрубочки могут присоединяться к адгезионным контактам как плюс-, так и минус-концами, вместе с моторными белками они, вероятно, участвуют в транспортировке белков, необходимых для формирования контактов, в частности кадгеринов.
Функции
Схематическое изображение процесса формирования трубки из слоя эпителиальных клеток
Одной из основных функций адгезионных контактов является физическое соединение клеток в единую ткань, их ослабление часто приводит к диссоциации клеток. Такого эффекта можно достичь, обработав ткань или монослойную культуру хелатирующим агентами, такими как ЭДТА, связывающими ионы кальция, вследствие чего взаимодействие между кадгеринами нарушается. Однако, хелатирующих агентов обычно недостаточно для полного разделения клеток, поскольку между ними существуют другие — кальций независимые — контакты.
Такого эффекта можно достичь, обработав ткань или монослойную культуру хелатирующим агентами, такими как ЭДТА, связывающими ионы кальция, вследствие чего взаимодействие между кадгеринами нарушается. Однако, хелатирующих агентов обычно недостаточно для полного разделения клеток, поскольку между ними существуют другие — кальций независимые — контакты.
Адгезионные контакты обеспечивают образование широкой межклеточной сети из пучков сократительных актиновых филаментов, расположенных параллельно мембранам клеток и соединенных между собой с помощью белков катенинов и кадгеринов. Такая организация позволяет не только противостоять механическому напряжению, но и согласовывать поведение клеток во время процессов морфогенеза. Например, координированное сокращение колец актиновых филаментов соседних клеток является необходимым для формирования трубок из слоя эпителия, в частности во время закладки нервной трубки. Одним из примеров является Shroom3-зависимое сокращение зоны прилипания, при этом актин-связывающий белок Shroom3 привлекает к участку адгезионные контакты Rho-киназы и активирует миозин-II, в результате чего и происходит сокращение.
Адгезионные контакты также задействованы в межклеточной передаче сигналов, об этом свидетельствует локализация в зрелых контактах рецепторной тирозинфосфатазы μ и белка RACK1, который взаимодействует с ней. При снижении экспрессии α-катенина наблюдается значительное увеличение темпов пролиферации эпителиальных клеток, было показано, что за этот эффект отвечает сигнальный путь инсулин / MAPK.
Десмосома (пятно сцепления, липкое соединение)
Десмосома — один из типов межклеточных контактов, обеспечивающих прочное соединение клеток (как правило, эпителиальной или мышечной ткани) у животных. Функция десмосом заключается главным образом в обеспечении механической связи между клетками.
Существуют 3 типа десмосом — точечные (лат. macula adherens), опоясывающие (лат. zonula adherens) и гемидесмосомы. Точечная десмосома представляет собой небольшую площадку (диаметром до 0,5 мкм), соединяющую мембраны двух соседних клеток. Количество точечных десмосом на одной клетке может достигать 2000.
Десмосомы образуются между клетками тех тканей, которые могут подвергаться трению, растяжению и другим механическим воздействиям (эпителиальные клетки, клетки сердечной мышцы). Со стороны цитоплазмы к десмосомам прикрепляются промежуточные филаменты, которые формируют в цитоплазме сеть, обладающую большой прочностью на разрыв. Через десмосомы промежуточные филаменты соседних клеток объединяются в непрерывную сеть, охватывающую всю ткань.
Десмосома состоит из белков клеточной адгезии из семейства кадгеринов и соединительных (адапторных) белков, которые соединяют их с промежуточными филаментами. Белки клеточной адгезии, формирующие десмосомы — десмоглеин и десмоколлин. Как и другие кадгерины, эти трансмембранные белки имеют по пять внеклеточных доменов и являются кальцийсвязывающими. Они обеспечивают гомофильное соединение клеток — между собой соединяются две одинаковые по строению молекулы белка. Внутриклеточный белок десмоплакин (при участии еще двух белков, плакофиллина и плакоглобина) соединяет внутриклеточные домены десмоглеина с промежуточными филаментами. Тип промежуточных филаментов зависит от типа клеток: в большинстве эпителиальных клеток они кератиновые, а в клетках сердечной мышцы — десминовые, и т. п.
Тип промежуточных филаментов зависит от типа клеток: в большинстве эпителиальных клеток они кератиновые, а в клетках сердечной мышцы — десминовые, и т. п.
Если контакты похожего строения образуются между клетками и внеклеточным матриксом, то они называются гемидесмосомами, или полудесмосомами.
Медицинское значение
С нарушением функции десмосом связаны кожные болезни, которые объединены под названием пузырные дерматозы. Две наиболее распространённые формы — pemphigus vulgaris (обыкновенная пузырчатка) и pemphigus foliaceus (пластинчатая пузырчатка). Обычно они имеют аутоиммунную природу, хотя сходные патологии могут быть и наследственными. При вульгарной пузырчатке антитела атакуют белок десмоглеин-3, который присутствует во всех слоях эпителия. При пластинчатой пузырчатке образуются аутоантитела против белка десмоглеин-1, который экспрессируется только в верхних слоях эпидермиса кожи. У больных образуются пузыри, так как слои эпидермиса разрываются, часть его клеток гибнет, а в образующиеся полости поступает межклеточная жидкость.
При вульгарной пузырчатке пузыри образуются не только на коже, но на других слизистых (в основном во рту). Эта болезнь протекает более тяжело и может закончиться смертью. Развивается она обычно в возрасте 40-60 лет. При пластинчатой пузырчатке поражения захватывают только кожу, которая отслаивается в виде пластинок.
Нексус (щелевой контакт)
Щелевое соединение, щелевой контакт (англ. gap junction) — тип соединения клеток в организме с помощью белковых каналов (коннексонов). Через щелевые контакты могут непосредственно передаваться от клетки к клетке электрические сигналы (потенциалы действия), а также малые молекулы (с молекулярной массой примерно до 1.000 Д). Этим щелевые контакты отличаются от плазмодесм, через которые могут транспортироваться макромолекулы и даже органоиды.
Структурную основу щелевого соединения составляют коннексоны — каналы, образуемые шестью белками-коннексинами. В нервной системе щелевое соединение между нейронами встречается в так называемых электрических синапсах. Отдельные коннексоны обычно сосредоточены на ограниченных по площади участках мембран — нексусах, или бляшках (англ. plaque) диаметром 0,5-1 мкм. В области нексуса мембраны соседних клеток сближены, расстояние между ними составляет 2-4 нм.
Отдельные коннексоны обычно сосредоточены на ограниченных по площади участках мембран — нексусах, или бляшках (англ. plaque) диаметром 0,5-1 мкм. В области нексуса мембраны соседних клеток сближены, расстояние между ними составляет 2-4 нм.
Белки щелевых контактов
У позвоночных основу щелевых контактов составляют коннексины — первое из описанных семейств белков щелевых контактов. В геноме человека идентифицирован 21 ген щелевых контактов, в геноме мыши — 20 генов.
У беспозвоночных имеется другое семейство белков щелевых контактов, сходных с коннексинами по структуре и функциям, но негомологичных им (имеющих несходную первичную структуру) — иннексины. В геноме Caenorhabditis elegans найдено 25 генов иннексинов, в геноме Drosophila melanogaster — 8.
Позднее выяснилось, что у позвоночных, кроме коннексинов, имеются также белки, гомологичные иннексинам. Эти белки, открытые группой российских ученых, получили название паннексины. В геноме человека и мыши к настоящему времени идентифицированы 3 гена паннексинов.
У иглокожих и некоторых других групп животных есть щелевые контакты, но нет генов ни одного из вышеназванных семейств. Это означает, что существуют ещё не открытые семейства белков щелевых контактов.
Местонахождения в организме и функции щелевых контактов
Основная функция щелевых контактов — электрическое соединение двух клеток, а также перенос небольших молекул между ними. В различных тканях оно существует с разными задачами. В нервной системе щелевые контакты — один из способов передачи возбуждения между нейронами, электрический синапс. В сердце щелевые контакты соединяют кардиомиоциты для обеспечения синхронности сокращения всех клеток одного отдела. Щелевые контакты встречаются практически во всех тканях. Одним из исключений является поперечно-полосатая мускулатура, где клеткам не требуется электрическая связь, поскольку они там слиты в симпласт (однако щелевые контакты встречаются в сосудах, питающих мышцы). Также щелевые контакты не обнаруживаются у эритроцитов и зрелых сперматозоидов. Щелевые контакты даже соединяют клетки фолликула с ооцитом (формально, клетки разных организмов), а разрушение этой связи является одним из сигналов для ооцита при овуляции. Очень значительную роль в функционировании организма играют так называемые полуканалы — «половинки» щелевых контактов, открытые в межклеточное пространство. Например, они участвуют в создании кальциевой волны в эндотелии, выпуская АТФ наружу из клетки, что способствует поддержанию кровяного давления в сосуде.
Изменения щелевых контактов — одна из причин эффекта «свидетеля» при облучении.
Щелевые контакты даже соединяют клетки фолликула с ооцитом (формально, клетки разных организмов), а разрушение этой связи является одним из сигналов для ооцита при овуляции. Очень значительную роль в функционировании организма играют так называемые полуканалы — «половинки» щелевых контактов, открытые в межклеточное пространство. Например, они участвуют в создании кальциевой волны в эндотелии, выпуская АТФ наружу из клетки, что способствует поддержанию кровяного давления в сосуде.
Изменения щелевых контактов — одна из причин эффекта «свидетеля» при облучении.
Синапс (синаптическое соединение)
Синапсы являются особыми формами межклеточных соединений. Они характерны для нервной ткани и встречаются между нейронами (межнейронные синапсы) или между нейроном и клеткой-мишенью (нервно-мышечные синапсы и пр.). Синапсы – участки контакта двух клеток, специализированных для односторонней передачи возбуждения или торможения от одной клетки к другой. Их функция – именно передача нервного импульса с нейрона на другую нервную клетку или клетку-мишень.
Основные элементы химического синапса: синаптическая щель, везикулы (синаптические пузырьки), нейромедиаторы, рецепторы.
Передача импульсов осуществляется химическим путём с помощью медиаторов или электрическим путём посредством прохождения ионов из одной клетки в другую.
границ | От редакции: Влияние мембранных липидов на функцию белка
Эукариоты разделены на связанные с мембраной органеллы, которые разделены цитозолем, однако связь между органеллами необходима для клеточного гомеостаза и для ответа на внешние сигналы. Передача информации между органеллами происходит посредством множества механизмов. Например, связывание лигандов с их рецепторами передает сигналы через бислой мембраны, чтобы активировать пути передачи сигнала.Передача информации также происходит посредством везикулярного транспорта и перемещения грузов между органеллами; секреция растворимых факторов во внеклеточное пространство; и поглощение материала извне клетки для деградации посредством эндолизосомного пути.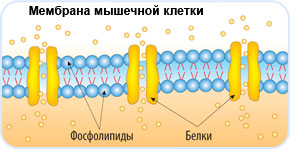 В то время как белки управляют этими путями, состав мембраны может оказывать сильное влияние на регулирование их эффективности. Нарушение регуляции механики, влияющей на состав мембраны, может привести к множеству заболеваний (напр.g., рак), которые проявляются дефектной функцией белка. Таким образом, важно понять, как липиды принципиально влияют на такие пути.
В то время как белки управляют этими путями, состав мембраны может оказывать сильное влияние на регулирование их эффективности. Нарушение регуляции механики, влияющей на состав мембраны, может привести к множеству заболеваний (напр.g., рак), которые проявляются дефектной функцией белка. Таким образом, важно понять, как липиды принципиально влияют на такие пути.
По большей части органелларные мембраны состоят из амфипатических липидов, которые собираются в бислои с полярными головными группами, обращенными к цитозолю или внеклеточной среде, в то время как гидрофобные группы обращены друг к другу, чтобы исключить попадание воды. Липидные компоненты мембран делятся на три основные группы: глицерофосфолипиды (ГФЛ), сфинголипиды (СЛ) и стеролы.GPL содержат глицериновую основу с жирными кислотами, присоединенными в виде сложных эфиров к двум атомам углерода, в то время как третий гидроксил не модифицирован или связан с головной группой через связь сложного эфира фосфорной кислоты. GPL включают основные липиды фосфатидилхолин (PC), фосфатидилэтаноламин (PE) и фосфатидилсерин (PS), а также липиды в низких концентрациях, такие как фосфатидная кислота (PA), диацилглицерин (DAG) и фосфоинозитиды (PI). SL содержат сфингоидную основу, которая включает аминоспирт сфингозин.Этот сфингозиновый остов может быть связан с жирной кислотой посредством амидной связи. SL включают церамид (Cer), сфингомиелин (SM) и гликозилированные сфинголипиды. Липидный состав органелл широко различается, чтобы дать каждому компартменту характерный профиль, влияющий на функцию ассоциированных с мембраной белков.
SL содержат сфингоидную основу, которая включает аминоспирт сфингозин.Этот сфингозиновый остов может быть связан с жирной кислотой посредством амидной связи. SL включают церамид (Cer), сфингомиелин (SM) и гликозилированные сфинголипиды. Липидный состав органелл широко различается, чтобы дать каждому компартменту характерный профиль, влияющий на функцию ассоциированных с мембраной белков.
Липидный бислой оказывает два основных влияния на мембранные белки. Эти эффекты можно разделить на специфические белок-липидные взаимодействия и неспецифические взаимодействия, на которые влияют физические свойства мембран.Липиды могут рекрутировать растворимые белки, которые содержат домены связывания липидов, которые распознают определенные виды липидов. Такие домены представляют собой консервативные модульные белковые складки, включая PH (гомология плекстрина) (Harlan et al., 1994), PX (гомология phox) (Xu et al., 2001) и FYVE (Fab1p, YOTB, Vac1p и EEA1) (Gillooly et al., 2000) домены, которые распознают специфические фосфорилированные формы PI, например, фосфатидилинозитол-3-фосфат (PI3P). Липиды также могут быть связаны белковыми областями, в которых отсутствует консервативная белковая складка, включая многоосновные области, которые связывают анионные липиды, такие как эффекторный домен MARCKS (MED), который предпочтительно связывает PI(4,5)P 2 (Denisov et al., 1998). Здесь Уэда и соавт. показывают, что гипервариабельная область малых GTPases Rab4 и Rab5 способствует внутренней способности этих Rab к связыванию, когда присутствуют PS, PI и холестерин.
Липиды также могут быть связаны белковыми областями, в которых отсутствует консервативная белковая складка, включая многоосновные области, которые связывают анионные липиды, такие как эффекторный домен MARCKS (MED), который предпочтительно связывает PI(4,5)P 2 (Denisov et al., 1998). Здесь Уэда и соавт. показывают, что гипервариабельная область малых GTPases Rab4 и Rab5 способствует внутренней способности этих Rab к связыванию, когда присутствуют PS, PI и холестерин.
Хотя органеллы имеют различные наборы липидов, их соотношение не является постоянным. Вместо этого локальный состав мембран постоянно ремоделируется как часть регуляции клеточных функций. Например, фосфоинозитиды могут по-разному фосфорилироваться и дефосфорилироваться специфическими киназами и фосфатазами.Такие изменения не только влияют на рекрутирование белков со специфическими доменами, связывающими липиды, но и изменяют локальный поверхностный заряд мембраны. Липиды также могут быть модифицированы под действием фосфолипазы C (PLC) и PLD для удаления головных групп липидов с образованием DAG и PA, которые изменяют связывание с белками и их функцию, о чем свидетельствует активация протеинкиназы C с помощью DAG (Kong et al. , 1991). ) или ингибирование активации SNARE посредством связывания Sec18 с помощью PA (Starr et al., 2019). Липиды также можно модифицировать путем удаления ацильной цепи с помощью PLA1, PLA2 и PLB с образованием лизолипидов, которые взаимодействуют со специфическими рецепторами (Moolenaar, 2000) и влияют на кривизну мембраны (Kooijman et al., 2003). Удаление ацильных замен также может быть сопряжено с их обменом под действием ацилтрансфераз (Sanford, Frosolono, 1983).
, 1991). ) или ингибирование активации SNARE посредством связывания Sec18 с помощью PA (Starr et al., 2019). Липиды также можно модифицировать путем удаления ацильной цепи с помощью PLA1, PLA2 и PLB с образованием лизолипидов, которые взаимодействуют со специфическими рецепторами (Moolenaar, 2000) и влияют на кривизну мембраны (Kooijman et al., 2003). Удаление ацильных замен также может быть сопряжено с их обменом под действием ацилтрансфераз (Sanford, Frosolono, 1983).
Не только общий состав липидов мембраны влияет на функцию белка, но и распределение липидов в двойном слое усложняет взаимодействие между белками и мембранами. Изменение характеристик створки может происходить за счет перемещения специфических липидов через бислой посредством функции флиппаз (Backer and Dawidowicz, 1987) (Fazeli et al.) и floppases (Dekkers et al., 1998) для установления липидной асимметрии между листочками. Напротив, липидная асимметрия может быть гомогенизирована за счет неразборчивой транслокации липидов скрамблазами (Daleke, 2003). Другие модификации происходят посредством невезикулярного переноса липидов между мембранами (Bankaitis et al., 1990). Наконец, физические характеристики мембраны могут изменяться за счет образования мембранных микродоменов, богатых стеролом и сфинголипидами, которые одновременно утолщают и делают мембрану более жесткой, влияя на функцию белка (Edidin, 2003; Wang and Silvius, 2003).Эти модификации вместе с интердигитацией липидов, гидрофобным несоответствием и компрессией мембран могут точно регулировать функцию белков и их пути (Andersen and Koeppe, 2007). Наконец, различные физические свойства мембран могут быть изменены небольшими молекулами, в том числе теми, которые влияют на электрический потенциал мембран (Ефимова и др.) или усилением нарушения липидов для усиления действия противогрибковых препаратов (Захарова и др.).
Другие модификации происходят посредством невезикулярного переноса липидов между мембранами (Bankaitis et al., 1990). Наконец, физические характеристики мембраны могут изменяться за счет образования мембранных микродоменов, богатых стеролом и сфинголипидами, которые одновременно утолщают и делают мембрану более жесткой, влияя на функцию белка (Edidin, 2003; Wang and Silvius, 2003).Эти модификации вместе с интердигитацией липидов, гидрофобным несоответствием и компрессией мембран могут точно регулировать функцию белков и их пути (Andersen and Koeppe, 2007). Наконец, различные физические свойства мембран могут быть изменены небольшими молекулами, в том числе теми, которые влияют на электрический потенциал мембран (Ефимова и др.) или усилением нарушения липидов для усиления действия противогрибковых препаратов (Захарова и др.).
В этом сборнике статей мы видим образец того, как мембрана может влиять на функцию белка.Начиная с фосфоинозитидов, во включенных статьях показано, как эти липиды влияют на подкисление органелл (Банерджи и Кейн), транспортировку белков в реснички (Нечипуренко), рекрутирование эффекторов RUFY в эндосомы (Чар и Пьер) и установление участков контакта с мембраной (Заман и др. ). .). Как упоминалось выше, ИП могут быть модифицированы фосфолипазами с образованием ПА и ДАГ. Здесь Мун и Джун показывают, как слияние митохондрий регулируется PA. В другой статье показано, что преобразование PA в lysoPA посредством активности PLA контролирует рост нейритов (Maemoto et al.). Наконец, показано, что богатые DAG структуры влияют на потребление капель липидов тубулярным эндоплазматическим ретикулумом (Ganesan et al.).
). .). Как упоминалось выше, ИП могут быть модифицированы фосфолипазами с образованием ПА и ДАГ. Здесь Мун и Джун показывают, как слияние митохондрий регулируется PA. В другой статье показано, что преобразование PA в lysoPA посредством активности PLA контролирует рост нейритов (Maemoto et al.). Наконец, показано, что богатые DAG структуры влияют на потребление капель липидов тубулярным эндоплазматическим ретикулумом (Ganesan et al.).
Другие классы липидов, представленные в этой коллекции, включают холестерин, гликолипиды и сфинголипиды. Показано, что у дрожжей эргостерол влияет на ГТФазу Sey1/атластин во время слияния микросом эндоплазматического ретикулума (Moon и Jun). Гликолипиды включают GPL и SL, в которых головная группа модифицирована углеводами. Здесь Hanafusa et al. показывают, как два гликолипида лактозилцерамид и фосфатидилглюкозид по-разному регулируют отдельные классы липидных рафтов на плазматической мембране.Наконец, Hurst и Fratti обсуждают, как эргостерол и сфинголипиды влияют на слияние вакуолей.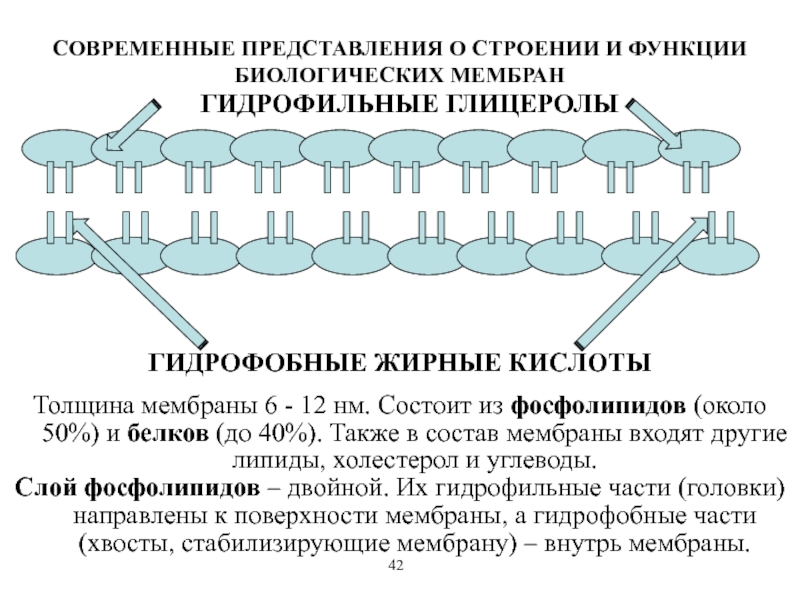
Открытые вопросы и вызовы
Регуляция белков мембранными липидами является быстро расширяющейся и интересной областью исследований. Несмотря на то, что в последние годы были достигнуты большие успехи, остается много вопросов, которые остаются неуловимыми и сложными для решения. Нерешенные вопросы включают:
• Как различные липиды действуют согласованно, чтобы влиять на специфические белок-липидные взаимодействия? Мембранные белки окружены коктейлем из липидов, которые меняются в пространстве и времени.Другими словами, стехиометрия липидов, окружающих определенный белок или набор белков (например, SNARE), будет меняться в зависимости от продолжительности пути. Липиды, такие как фосфоинозитиды и их метаболиты, быстро модифицируются под действием специфических киназ, фосфатаз и липаз. Таким образом, нарушение регуляции времени и порядка модификации липидов может оказывать сильное влияние на функцию белка и блокировать прогрессирование пути.
• Как можно отслеживать динамику липидов с помощью флуоресцентной микроскопии, не изменяя указанную динамику или присущие им физические свойства? Липиды обычно отслеживаются с помощью флуоресцентных зондов, которые распознают определенные группы липидов. Несмотря на информативность, использование громоздких зондов может блокировать взаимодействие липидов и изменять их латеральную диффузию. Эти зонды также могут иметь нецелевое связывание и искажать показания. Альтернативно, ацильная цепь заменена флуорофором. Поскольку физические свойства ацильных цепей частично или полностью определяют биохимическое поведение липида, замена одного из них флуорофором по существу создает новый липид, свойства которого не имеют значения и могут вызывать нежелательные физические эффекты в интересующей системе.
Несмотря на информативность, использование громоздких зондов может блокировать взаимодействие липидов и изменять их латеральную диффузию. Эти зонды также могут иметь нецелевое связывание и искажать показания. Альтернативно, ацильная цепь заменена флуорофором. Поскольку физические свойства ацильных цепей частично или полностью определяют биохимическое поведение липида, замена одного из них флуорофором по существу создает новый липид, свойства которого не имеют значения и могут вызывать нежелательные физические эффекты в интересующей системе.
• Как рафтоподобные липидные микродомены и асимметрия мембран влияют на функцию белков на эндомембранах? Большая часть работы над мембранными микродоменами и асимметрией была проделана на плазматической мембране, поэтому их важность внутри клетки менее понятна.
• Как нам лучше всего определить истинный результат изменения модификации липидов? Изучение модификации липидов на функции белка обычно проверяется путем ингибирования модифицирующего фермента. Полученный фенотип представляет собой смесь блокирования продукции нового липида с накоплением предшественника.Хотя это можно частично решить с помощью определенных восстановленных систем, мы должны учитывать, что отсутствующий липид должен быть заменен другим другим липидом, что еще больше изменит стехиометрию липидов и введет новую переменную.
Полученный фенотип представляет собой смесь блокирования продукции нового липида с накоплением предшественника.Хотя это можно частично решить с помощью определенных восстановленных систем, мы должны учитывать, что отсутствующий липид должен быть заменен другим другим липидом, что еще больше изменит стехиометрию липидов и введет новую переменную.
• Как вы измеряете в реальном времени влияние динамических изменений гидрофобного несоответствия и переплетения на функцию белка? Изменения толщины мембран с помощью таких механизмов могут оказывать сильное влияние на организацию и функцию белков. Тем не менее, быстрое латеральное ремоделирование липидов и временные изменения толщины бислоя трудно отследить.
Вклад авторов
РФ написала редакция.
Финансирование
Работа выполнена при поддержке Национального научного фонда РФ под номером MCB-1818310.
Конфликт интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Андерсен О.С. и Кёппе Р.Э. 2-й (2007). Толщина бислоя и функция мембранного белка: энергетическая перспектива. год. Преподобный Биофиз. биомол. Структура 36, 107–130. doi: 10.1146/annurev.biophys.36.040306.132643
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bankaitis, V.A., Aitken, J.R., Cleves, A.E., и Dowhan, W. (1990). Существенная роль белка-переносчика фосфолипидов в функции Гольджи дрожжей. Природа 347, 561–562. дои: 10.1038/347561a0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Деккерс, Д.В., Комфуриус П., Шройт А.Дж., Беверс Э.М. и Цваал Р.Ф. (1998). Трансбислойное перемещение фосфолипидов, меченных NBD, в мембранах эритроцитов: направленный наружу транспорт с помощью белка 1 множественной лекарственной устойчивости (MRP1). Биохимия 37, 14833–14837. дои: 10.1021/bi981011w
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Денисов Г.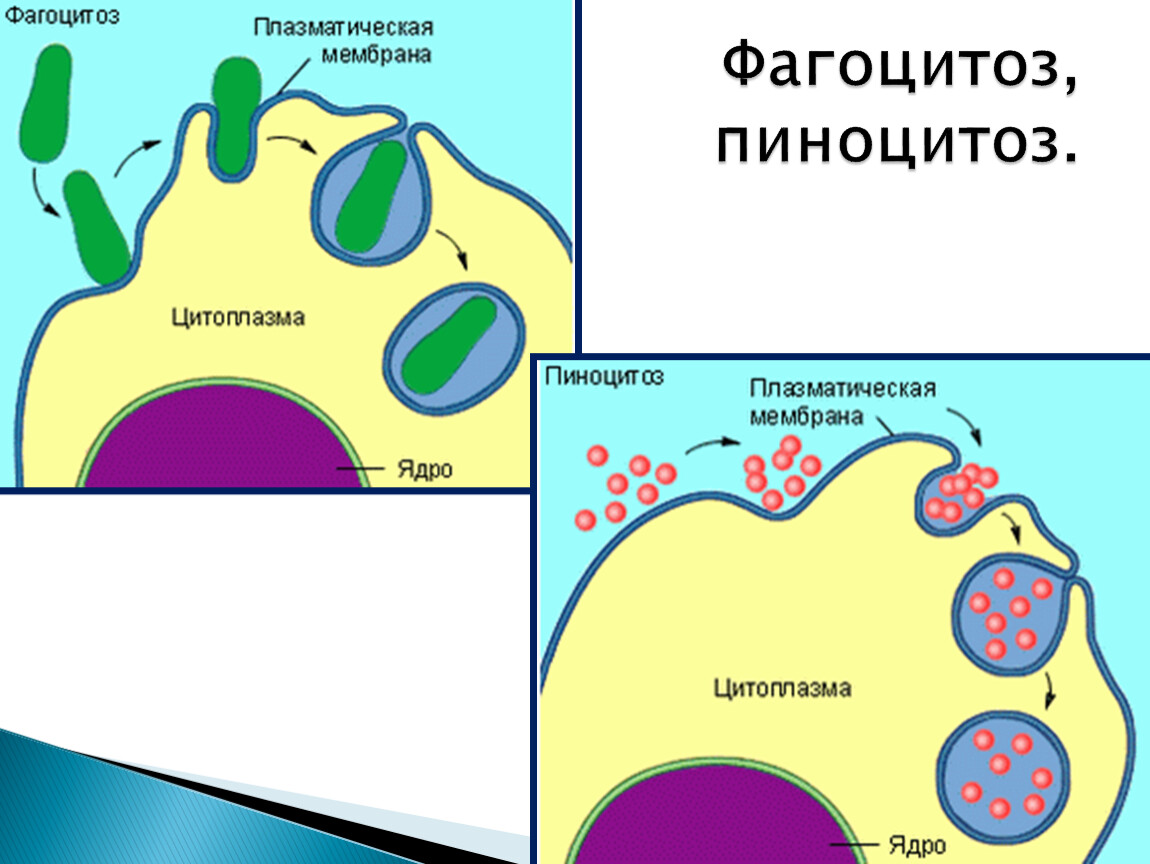 , Ванаски С., Луан П., Глейзер М. и Маклафлин С. (1998). Связывание основных пептидов с мембранами приводит к образованию боковых доменов, обогащенных кислыми липидами фосфатидилсерином и фосфатидилинозитол-4,5-бисфосфатом: электростатическая модель и экспериментальные результаты. Биофиз. J. 74, 731–744. дои: 10.1016/S0006-3495(98)73998-0
, Ванаски С., Луан П., Глейзер М. и Маклафлин С. (1998). Связывание основных пептидов с мембранами приводит к образованию боковых доменов, обогащенных кислыми липидами фосфатидилсерином и фосфатидилинозитол-4,5-бисфосфатом: электростатическая модель и экспериментальные результаты. Биофиз. J. 74, 731–744. дои: 10.1016/S0006-3495(98)73998-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Gillooly, D.J., Morrow, I.C., Lindsay, M., Gould, R., Bryant, N.J., Gaullier, J.M., et al. (2000). Локализация фосфатидилинозитол-3-фосфата в клетках дрожжей и млекопитающих. Эмбо Дж. 19, 4577–4588. doi: 10.1093/emboj/19.17.4577
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харлан, Дж.Э., Хайдук П.Дж., Юн Х.С. и Фесик С.В. (1994). Домены гомологии плекстрина связываются с фосфатидилинозитол-4,5-бисфосфатом. Природа 371, 168–170. дои: 10.1038/371168a0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kong, F. H., Kishi, Y., Perez-Sala, D., and Rando, R.R. (1991). Фармакофор дебромоаплизиатоксина, ответственный за активацию протеинкиназы С. Проц. Натл. акад. науч. США . 88, 1973–1976. doi: 10.1073/pnas.88.5.1973
H., Kishi, Y., Perez-Sala, D., and Rando, R.R. (1991). Фармакофор дебромоаплизиатоксина, ответственный за активацию протеинкиназы С. Проц. Натл. акад. науч. США . 88, 1973–1976. doi: 10.1073/pnas.88.5.1973
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kooijman, E.E., Chupin, V., de Kruijff, B., и Burger, K.N. (2003). Модуляция кривизны мембран фосфатидной кислотой и лизофосфатидной кислотой. Трафик 4, 162–174. doi: 10.1034/j.1600-0854.2003.00086.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сэнфорд, Г.Л., и Фросолоно, М.Ф. (1983). Роль ацилтрансферазы в биосинтезе легочного микросомального фосфатидилглицерина. Биохим. Биофиз. Рез. коммун. 116, 23–29. doi: 10.1016/0006-291X(83)-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Старр М.Л., Спаркс Р.П., Аранго А.С., Херст Л.Р., Чжао З., Лихан М. и др. (2019). Фосфатидная кислота индуцирует конформационные изменения протомеров Sec18, которые предотвращают праймирование SNARE. Дж. Биол. хим. 294, 3100–3116. doi: 10.1074/jbc.RA118.006552
Дж. Биол. хим. 294, 3100–3116. doi: 10.1074/jbc.RA118.006552
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Т.Ю. и Сильвиус Дж. Р. (2003). Разделение сфинголипидов на упорядоченные домены в липидных бислоях без холестерина и с холестерином. Биофиз. Дж. 84, 367–378. doi: 10.1016/S0006-3495(03)74857-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюй Ю., Хортсман Х., Сит Л., Вонг С. Х. и Хонг В. (2001). SNX3 регулирует эндосомальную функцию посредством своего PX-домена-опосредованного взаимодействия с PtdIns(3)P. Нац. Клеточная биол. 3, 658–666.дои: 10.1038/35083051
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
То Биологический проект > Клетка Биология > Клетка Мембраны > Обзор Клеточные мембраны: Основные понятия Графика жидкостной мозаичной модели клеточной мембраны
проблема 1 То Биологический проект > Клетка Биология > Клетка Мембраны > Обзор http://www.biology.arizona.edu |
5.1: Компоненты и структура — Biology LibreTexts
Навыки для развития
- Понимание жидкостно-мозаичной модели клеточных мембран
- Опишите функции фосфолипидов, белков и углеводов в мембранах
- Обсудить текучесть мембран
Плазматическая мембрана клетки определяет клетку, очерчивает ее границы и определяет характер ее взаимодействия с окружающей средой (см. сводку в таблице \(\PageIndex{1}\)).Клетки исключают одни вещества, поглощают другие и выделяют третьи, и все это в контролируемых количествах. Плазматическая мембрана должна быть очень гибкой, чтобы определенные клетки, такие как эритроциты и лейкоциты, могли изменять форму при прохождении через узкие капилляры. Это наиболее очевидные функции плазматической мембраны. Кроме того, поверхность плазматической мембраны несет маркеры, которые позволяют клеткам распознавать друг друга, что жизненно важно для формирования тканей и органов на раннем этапе развития, а позже играет роль в различении «своих» и «чужих» клеток. иммунный ответ.
сводку в таблице \(\PageIndex{1}\)).Клетки исключают одни вещества, поглощают другие и выделяют третьи, и все это в контролируемых количествах. Плазматическая мембрана должна быть очень гибкой, чтобы определенные клетки, такие как эритроциты и лейкоциты, могли изменять форму при прохождении через узкие капилляры. Это наиболее очевидные функции плазматической мембраны. Кроме того, поверхность плазматической мембраны несет маркеры, которые позволяют клеткам распознавать друг друга, что жизненно важно для формирования тканей и органов на раннем этапе развития, а позже играет роль в различении «своих» и «чужих» клеток. иммунный ответ.
Одной из самых сложных функций плазматической мембраны является способность передавать сигналы с помощью сложных интегральных белков, известных как рецепторы. Эти белки действуют как приемники внеклеточных входов и как активаторы внутриклеточных процессов. Эти мембранные рецепторы обеспечивают внеклеточные места прикрепления эффекторов, таких как гормоны и факторы роста, и они активируют каскады внутриклеточных ответов, когда их эффекторы связаны. Иногда рецепторы захватываются вирусами (одним из примеров является ВИЧ, вирус иммунодефицита человека), которые используют их для проникновения в клетки, а иногда гены, кодирующие рецепторы, мутируют, вызывая нарушение процесса передачи сигнала с катастрофическими последствиями.
Иногда рецепторы захватываются вирусами (одним из примеров является ВИЧ, вирус иммунодефицита человека), которые используют их для проникновения в клетки, а иногда гены, кодирующие рецепторы, мутируют, вызывая нарушение процесса передачи сигнала с катастрофическими последствиями.
Жидкая мозаика Модель
Существование плазматической мембраны было установлено в 1890-х годах, а ее химические компоненты были идентифицированы в 1915 году. Основными компонентами, идентифицированными в то время, были липиды и белки. Первая общепринятая модель строения плазматической мембраны была предложена в 1935 г. Хью Дэвсоном и Джеймсом Даниэлли; он был основан на внешнем виде плазматической мембраны в виде «железнодорожного пути» на ранних электронных микрофотографиях. Они предположили, что структура плазматической мембраны напоминает бутерброд, где белок аналогичен хлебу, а липиды аналогичны начинке.В 1950-х годах достижения в микроскопии, особенно в просвечивающей электронной микроскопии (ПЭМ), позволили исследователям увидеть, что ядро плазматической мембраны состоит из двойного, а не одного слоя.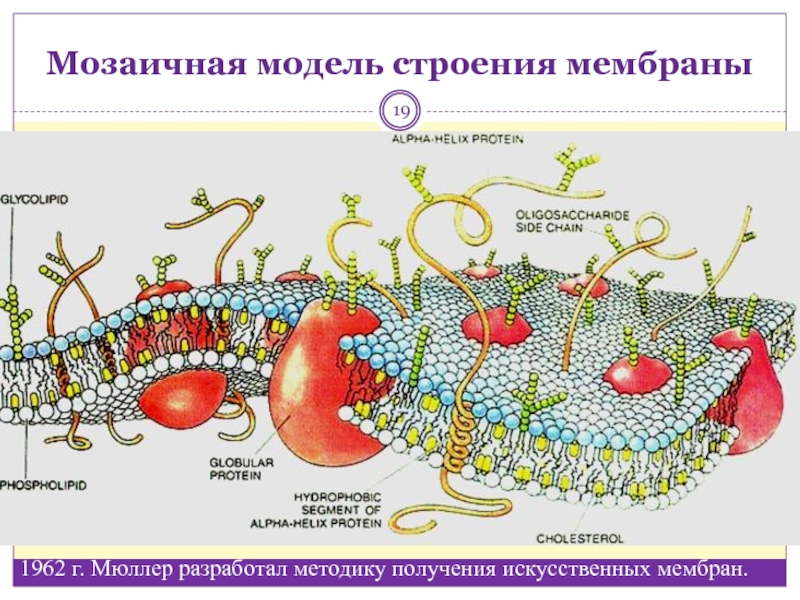 Новая модель, которая лучше объясняет как микроскопические наблюдения, так и функцию этой плазматической мембраны, была предложена С.Дж. Певица и Гарт Л. Николсон в 1972 году.
Новая модель, которая лучше объясняет как микроскопические наблюдения, так и функцию этой плазматической мембраны, была предложена С.Дж. Певица и Гарт Л. Николсон в 1972 году.
Объяснение, предложенное Сингером и Николсоном, называется жидкостно-мозаичной моделью. Модель несколько эволюционировала с течением времени, но она по-прежнему лучше всего описывает структуру и функции плазматической мембраны в том виде, в каком мы их сейчас понимаем.Модель жидкостной мозаики описывает структуру плазматической мембраны как мозаику компонентов, включая фосфолипиды, холестерин, белки и углеводы, что придает мембране жидкий характер. Плазматические мембраны имеют толщину от 5 до 10 нм. Для сравнения, эритроциты человека, видимые с помощью световой микроскопии, имеют ширину примерно 8 мкм, или примерно в 1000 раз шире плазматической мембраны. Мембрана немного похожа на бутерброд (рис. \(\PageIndex{1}\)).
Рисунок \(\PageIndex{1}\): жидкостно-мозаичная модель плазматической мембраны описывает плазматическую мембрану как жидкую комбинацию фосфолипидов, холестерина и белков. Углеводы, присоединенные к липидам (гликолипидам) и белкам (гликопротеины), отходят от обращенной наружу поверхности мембраны.
Углеводы, присоединенные к липидам (гликолипидам) и белкам (гликопротеины), отходят от обращенной наружу поверхности мембраны. Основными компонентами плазматической мембраны являются липиды (фосфолипиды и холестерин), белки и углеводы, присоединенные к некоторым липидам и некоторым белкам. Фосфолипид представляет собой молекулу, состоящую из глицерина, двух жирных кислот и головной группы, связанной с фосфатом. Холестерин, еще один липид, состоящий из четырех слитых углеродных колец, обнаружен наряду с фосфолипидами в ядре мембраны.Соотношение белков, липидов и углеводов в плазматической мембране зависит от типа клеток, но для типичной клетки человека белок составляет около 50 процентов состава по массе, липиды (всех типов) составляют около 40 процентов состава. композиции по массе, причем остальные 10 процентов композиции по массе составляют углеводы. Однако концентрация белков и липидов различна для разных клеточных мембран. Например, миелин — отросток мембраны специализированных клеток, изолирующих аксоны периферических нервов, — содержит только 18 % белка и 76 % липидов. Внутренняя мембрана митохондрий содержит 76 процентов белка и только 24 процента липидов. Плазматическая мембрана эритроцитов человека на 30 процентов состоит из липидов. Углеводы присутствуют только на внешней поверхности плазматической мембраны и присоединяются к белкам, образуя гликопротеины, или присоединяются к липидам, образуя гликолипиды.
Внутренняя мембрана митохондрий содержит 76 процентов белка и только 24 процента липидов. Плазматическая мембрана эритроцитов человека на 30 процентов состоит из липидов. Углеводы присутствуют только на внешней поверхности плазматической мембраны и присоединяются к белкам, образуя гликопротеины, или присоединяются к липидам, образуя гликолипиды.
Фосфолипиды
Основная ткань мембраны состоит из амфифильных молекул фосфолипидов. Гидрофильные или «водолюбивые» участки этих молекул (выглядящие как набор шариков в художественном исполнении модели) (рис. \(\PageIndex{1}\)) контактируют с водной жидкостью как внутри, так и внутри. вне клетки.Гидрофобные или ненавидящие воду молекулы, как правило, неполярны. Они взаимодействуют с другими неполярными молекулами в химических реакциях, но обычно не взаимодействуют с полярными молекулами. Помещенные в воду, гидрофобные молекулы имеют тенденцию образовывать шар или кластер. Гидрофильные области фосфолипидов склонны образовывать водородные связи с водой и другими полярными молекулами как снаружи, так и внутри клетки. Таким образом, поверхности мембраны, обращенные внутрь и наружу клетки, гидрофильны.Напротив, внутренняя часть клеточной мембраны гидрофобна и не взаимодействует с водой. Следовательно, фосфолипиды образуют превосходную двухслойную клеточную мембрану, которая отделяет жидкость внутри клетки от жидкости вне клетки.
Таким образом, поверхности мембраны, обращенные внутрь и наружу клетки, гидрофильны.Напротив, внутренняя часть клеточной мембраны гидрофобна и не взаимодействует с водой. Следовательно, фосфолипиды образуют превосходную двухслойную клеточную мембрану, которая отделяет жидкость внутри клетки от жидкости вне клетки.
Молекула фосфолипида (рис. \(\PageIndex{2}\)) состоит из трехуглеродного глицеринового остова с двумя молекулами жирных кислот, присоединенными к атомам углерода 1 и 2, и фосфатсодержащей группой, присоединенной к третьему атому углерода. Такое расположение дает молекуле в целом область, называемую головкой (фосфатсодержащая группа), которая имеет полярный характер или отрицательный заряд, и область, называемую хвостом (жирные кислоты), которая не имеет заряда.Голова может образовывать водородные связи, а хвост нет. Молекула с таким расположением положительно или отрицательно заряженной области и незаряженной или неполярной области называется амфифильной или «двойной любовью».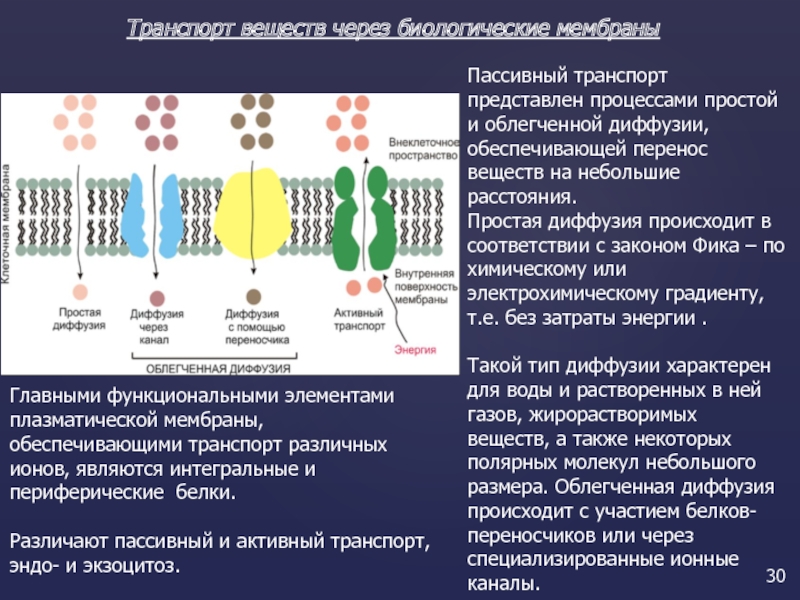
Эта характеристика жизненно важна для структуры плазматической мембраны, поскольку в воде фосфолипиды имеют тенденцию располагаться так, что их гидрофобные хвосты обращены друг к другу, а гидрофильные головки обращены наружу. Таким образом, они образуют липидный бислой — барьер, состоящий из двойного слоя фосфолипидов, который отделяет воду и другие материалы на одной стороне барьера от воды и других материалов на другой стороне. Фактически, фосфолипиды, нагреваемые в водном растворе, имеют тенденцию спонтанно образовывать маленькие сферы или капли (называемые мицеллами или липосомами), при этом их гидрофильные головки образуют внешнюю часть, а гидрофобные хвосты — внутри (рис. \(\PageIndex{3}\)) .
\(\PageIndex{3}\)) .
Белки
Белки составляют второй основной компонент плазматических мембран. Интегральные белки (некоторые специализированные типы называются интегринами), как следует из их названия, полностью интегрированы в структуру мембраны, а их гидрофобные трансмембранные области взаимодействуют с гидрофобной областью фосфолипидного бислоя (рис. \(\PageIndex{1} \)).Однопроходные интегральные мембранные белки обычно имеют гидрофобный трансмембранный сегмент, состоящий из 20–25 аминокислот. Некоторые охватывают только часть мембраны, объединяясь с одним слоем, в то время как другие простираются от одной стороны мембраны к другой и обнажаются с обеих сторон. Некоторые сложные белки состоят из до 12 сегментов одного белка, которые сильно свернуты и встроены в мембрану (рис. \(\PageIndex{4}\)). Этот тип белка имеет гидрофильный участок или участки и один или несколько умеренно гидрофобных участков.Такое расположение областей белка имеет тенденцию ориентировать белок рядом с фосфолипидами, при этом гидрофобная область белка примыкает к хвостам фосфолипидов, а гидрофильная область или области белка выступают из мембраны и контактируют с цитозолем или внеклеточной жидкости.
\(\PageIndex{4}\)). Этот тип белка имеет гидрофильный участок или участки и один или несколько умеренно гидрофобных участков.Такое расположение областей белка имеет тенденцию ориентировать белок рядом с фосфолипидами, при этом гидрофобная область белка примыкает к хвостам фосфолипидов, а гидрофильная область или области белка выступают из мембраны и контактируют с цитозолем или внеклеточной жидкости.
Периферийные белки находятся на внешней и внутренней поверхностях мембран, прикрепленные либо к интегральным белкам, либо к фосфолипидам. Периферические белки, наряду с интегральными белками, могут служить ферментами, структурными прикреплениями волокон цитоскелета или частью клеточных сайтов узнавания. Их иногда называют «клеточно-специфическими» белками. Организм распознает собственные белки и атакует чужеродные белки, связанные с инвазивными патогенами.
Организм распознает собственные белки и атакует чужеродные белки, связанные с инвазивными патогенами.
Углеводы
Углеводы являются третьим основным компонентом плазматических мембран. Они всегда находятся на внешней поверхности клеток и связаны либо с белками (образуя гликопротеины), либо с липидами (образуя гликолипиды) (рис. \(\PageIndex{1}\)). Эти углеводные цепи могут состоять из 2–60 моносахаридных звеньев и могут быть как прямыми, так и разветвленными. Наряду с периферическими белками углеводы образуют на клеточной поверхности специализированные участки, позволяющие клеткам узнавать друг друга.Эти участки имеют уникальные паттерны, которые позволяют распознать клетку, подобно тому, как черты лица, уникальные для каждого человека, позволяют распознать его или ее. Эта функция распознавания очень важна для клеток, поскольку она позволяет иммунной системе различать клетки тела (называемые «своими») и чужеродные клетки или ткани (называемые «чужими»). Подобные типы гликопротеинов и гликолипидов обнаруживаются на поверхности вирусов и могут часто меняться, не позволяя иммунным клеткам распознавать их и атаковать их.
Эти углеводы на внешней поверхности клетки — углеводные компоненты как гликопротеинов, так и гликолипидов — в совокупности называются гликокаликсом (что означает «сахарное покрытие»). Гликокаликс обладает высокой гидрофильностью и притягивает большое количество воды к поверхности клетки. Это способствует взаимодействию клетки с водной средой и способности клетки получать вещества, растворенные в воде. Как обсуждалось выше, гликокаликс также важен для идентификации клеток, само-/не-самоопределения и эмбрионального развития, и используется в межклеточных прикреплениях для формирования тканей.
Evolution Connection: как вирусы заражают определенные органы
Образцы гликопротеинов и гликолипидов на поверхности клеток дают многим вирусам возможность для заражения. Вирусы ВИЧ и гепатита заражают только определенные органы или клетки в организме человека. ВИЧ способен проникать через плазматические мембраны подтипа лимфоцитов, называемых Т-хелперными клетками, а также через некоторые моноциты и клетки центральной нервной системы. Вирус гепатита атакует клетки печени.
Вирус гепатита атакует клетки печени.
Эти вирусы способны внедряться в эти клетки, потому что клетки имеют сайты связывания на своей поверхности, специфичные для определенных вирусов и совместимые с ними (Рисунок \(\PageIndex{5}\)).Другие участки распознавания на поверхности вируса взаимодействуют с иммунной системой человека, побуждая организм вырабатывать антитела. Антитела вырабатываются в ответ на антигены или белки, связанные с инвазивными патогенами, или в ответ на чужеродные клетки, например, при трансплантации органов. Эти же участки служат местами для прикрепления антител и либо уничтожения, либо ингибирования активности вируса. К сожалению, эти сайты распознавания ВИЧ меняются с большой скоростью из-за мутаций, что очень затрудняет производство эффективной вакцины против вируса, поскольку вирус развивается и адаптируется.У человека, инфицированного ВИЧ, быстро разовьются разные популяции или варианты вируса, отличающиеся различиями в этих сайтах распознавания. Такое быстрое изменение поверхностных маркеров снижает эффективность иммунной системы человека в борьбе с вирусом, поскольку антитела не распознают новые вариации поверхностных паттернов. В случае с ВИЧ проблема усугубляется тем фактом, что вирус специфически заражает и разрушает клетки, участвующие в иммунном ответе, еще больше выводя хозяина из строя.
В случае с ВИЧ проблема усугубляется тем фактом, что вирус специфически заражает и разрушает клетки, участвующие в иммунном ответе, еще больше выводя хозяина из строя.
Текучесть мембран
Мозаичная характеристика мембраны, описанная в жидкостно-мозаичной модели, помогает проиллюстрировать ее природу. Интегральные белки и липиды существуют в мембране в виде отдельных, но слабо связанных молекул. Они напоминают отдельные разноцветные плитки мозаичной картины и плавают, несколько двигаясь друг относительно друга.Однако мембрана не похожа на воздушный шар, который может расширяться и сжиматься; скорее, он довольно жесткий и может лопнуть при проникновении внутрь или при попадании в клетку слишком большого количества воды. Однако из-за своей мозаичной природы очень тонкая игла может легко проникнуть в плазматическую мембрану, не вызывая ее разрыва, и мембрана будет течь и самоуплотняться при извлечении иглы.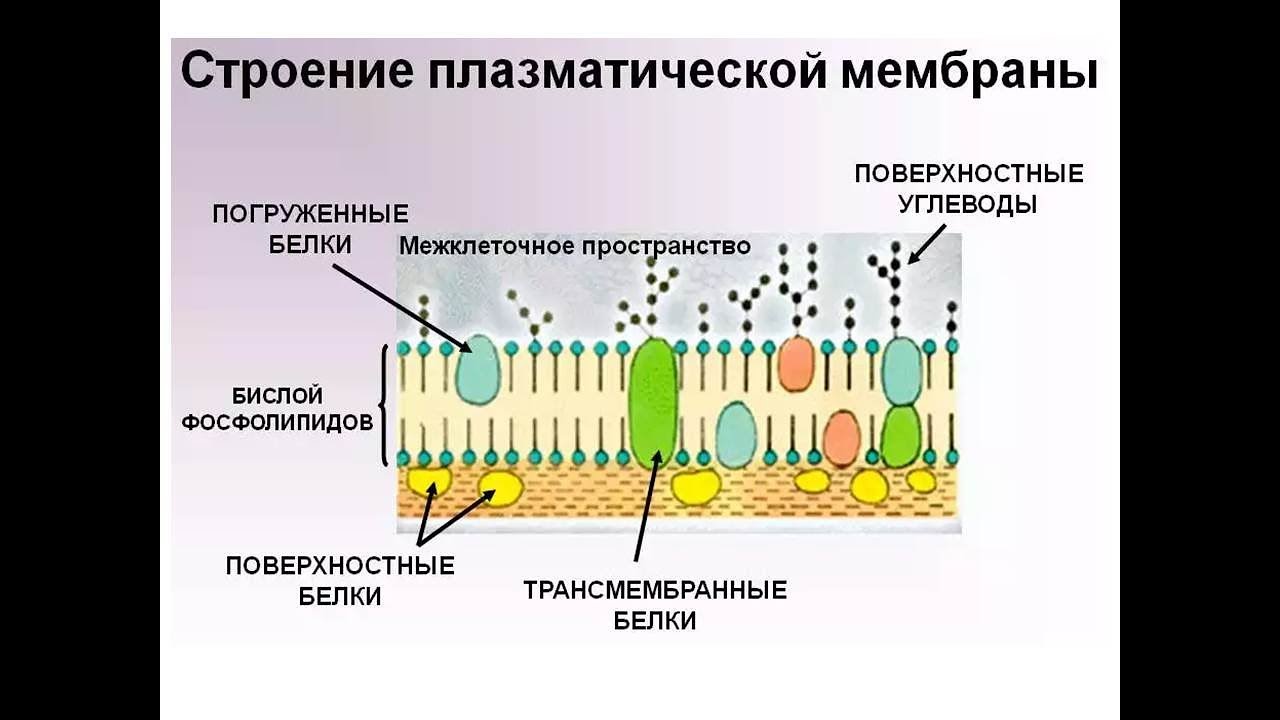
Мозаичные характеристики мембраны частично, но не полностью объясняют ее текучесть. Есть два других фактора, которые помогают поддерживать эту характеристику жидкости.Одним из факторов является природа самих фосфолипидов. В насыщенной форме жирные кислоты в хвостах фосфолипидов насыщены связанными атомами водорода. Между соседними атомами углерода нет двойных связей. Это приводит к относительно прямым хвостам. Напротив, ненасыщенные жирные кислоты не содержат максимального числа атомов водорода, но содержат некоторые двойные связи между соседними атомами углерода; двойная связь приводит к изгибу цепочки атомов углерода примерно на 30 градусов (рис. \(\PageIndex{2}\)).
Таким образом, если насыщенные жирные кислоты с их прямыми хвостами сжимаются при понижении температуры, они давят друг на друга, образуя плотную и довольно жесткую мембрану. Если ненасыщенные жирные кислоты сжимаются, «перегибы» в их хвостах отталкивают соседние молекулы фосфолипидов, сохраняя некоторое пространство между молекулами фосфолипидов. Эта «локтевая комната» помогает поддерживать текучесть мембраны при температурах, при которых мембраны с хвостами насыщенных жирных кислот в их фосфолипидах «замерзают» или затвердевают.Относительная текучесть мембраны особенно важна в холодных условиях. Холодная среда имеет тенденцию сжимать мембраны, состоящие в основном из насыщенных жирных кислот, делая их менее текучими и более восприимчивыми к разрыву. Многие организмы (одним из примеров являются рыбы) способны адаптироваться к холодным условиям, изменяя долю ненасыщенных жирных кислот в своих мембранах в ответ на понижение температуры.
Эта «локтевая комната» помогает поддерживать текучесть мембраны при температурах, при которых мембраны с хвостами насыщенных жирных кислот в их фосфолипидах «замерзают» или затвердевают.Относительная текучесть мембраны особенно важна в холодных условиях. Холодная среда имеет тенденцию сжимать мембраны, состоящие в основном из насыщенных жирных кислот, делая их менее текучими и более восприимчивыми к разрыву. Многие организмы (одним из примеров являются рыбы) способны адаптироваться к холодным условиям, изменяя долю ненасыщенных жирных кислот в своих мембранах в ответ на понижение температуры.
Ссылка на обучение
Посетите этот сайт, чтобы увидеть анимацию текучести и мозаичности мембран.
Животные имеют дополнительный мембранный компонент, который способствует поддержанию текучести. Холестерин, который находится рядом с фосфолипидами в мембране, имеет тенденцию ослаблять воздействие температуры на мембрану. Таким образом, этот липид действует как буфер, предотвращая снижение текучести при более низких температурах и слишком сильное увеличение текучести при повышенных температурах. Таким образом, холестерин расширяет в обоих направлениях диапазон температур, при которых мембрана является достаточно текучей и, следовательно, функциональной.Холестерин также выполняет другие функции, такие как организация кластеров трансмембранных белков в липидные рафты.
Таким образом, холестерин расширяет в обоих направлениях диапазон температур, при которых мембрана является достаточно текучей и, следовательно, функциональной.Холестерин также выполняет другие функции, такие как организация кластеров трансмембранных белков в липидные рафты.
| Компонент | Местоположение |
|---|---|
| Фосфолипиды | Основная ткань мембраны |
| Холестерин | Прикрепляется между фосфолипидами и между двумя слоями фосфолипидов |
| Интегральные белки (например, интегрины) | Встроен в слой(и) фосфолипидов. Может проникать или не проникать через оба слоя Может проникать или не проникать через оба слоя |
| Периферические белки | На внутренней или внешней поверхности двойного слоя фосфолипидов; не встроены в фосфолипиды |
| Углеводы (компоненты гликопротеинов и гликолипидов) | Обычно прикрепляются к белкам на внешнем слое мембраны |
Карьера: Иммунолог
Изменения в периферических белках и углеводах, влияющие на сайты узнавания клетки, представляют главный интерес для иммунологии.Эти изменения учитываются при разработке вакцин. Многие инфекционные заболевания, такие как оспа, полиомиелит, дифтерия и столбняк, были побеждены с помощью вакцин.
Иммунологи — это врачи и ученые, которые исследуют и разрабатывают вакцины, а также лечат и изучают аллергии или другие иммунные проблемы. Некоторые иммунологи изучают и лечат аутоиммунные проблемы (заболевания, при которых иммунная система человека атакует его или ее собственные клетки или ткани, такие как волчанка) и иммунодефициты, как приобретенные (например, синдром приобретенного иммунодефицита или СПИД), так и наследственные (например, тяжелые комбинированные заболевания). иммунодефицит или SCID).Иммунологов вызывают для помощи в лечении пациентов с трансплантацией органов, иммунная система которых должна быть подавлена, чтобы их тела не отторгали пересаженный орган. Некоторые иммунологи работают над тем, чтобы понять естественный иммунитет и влияние на него окружающей среды человека. Другие работают над вопросами о том, как иммунная система влияет на такие заболевания, как рак. В прошлом важность наличия здоровой иммунной системы для предотвращения рака вообще не понималась.
иммунодефицит или SCID).Иммунологов вызывают для помощи в лечении пациентов с трансплантацией органов, иммунная система которых должна быть подавлена, чтобы их тела не отторгали пересаженный орган. Некоторые иммунологи работают над тем, чтобы понять естественный иммунитет и влияние на него окружающей среды человека. Другие работают над вопросами о том, как иммунная система влияет на такие заболевания, как рак. В прошлом важность наличия здоровой иммунной системы для предотвращения рака вообще не понималась.
Для работы иммунологом требуется степень кандидата или доктора медицинских наук.Кроме того, иммунологи проходят не менее 2–3 лет обучения по аккредитованной программе и должны сдать экзамен Американского совета по аллергии и иммунологии. Иммунологи должны обладать знаниями о функциях человеческого тела, поскольку они касаются вопросов, выходящих за рамки иммунизации, а также знаниями в области фармакологии и медицинских технологий, таких как лекарства, методы лечения, тестовые материалы и хирургические процедуры.
Резюме
Современное понимание плазматической мембраны называется жидкостно-мозаичной моделью.Плазматическая мембрана состоит из двойного слоя фосфолипидов, гидрофобные жирнокислотные хвосты которых контактируют друг с другом. Ландшафт мембраны усеян белками, некоторые из которых пересекают мембрану. Некоторые из этих белков служат для транспортировки материалов в клетку или из нее. Углеводы присоединяются к некоторым белкам и липидам на обращенной наружу поверхности мембраны, образуя комплексы, которые служат для идентификации клетки с другими клетками. Жидкая природа мембраны обусловлена температурой, конфигурацией хвостов жирных кислот (некоторые из которых перекручены двойными связями), наличием встроенного в мембрану холестерина и мозаичным характером белков и комбинаций белков и углеводов, которые не прочно фиксируется на месте.Плазматические мембраны охватывают и определяют границы клеток, но они не являются статичным мешком, они динамичны и постоянно находятся в движении.
Глоссарий
- амфифильный
- молекула, имеющая полярный или заряженный участок и неполярный или незаряженный участок, способная взаимодействовать как с гидрофильным, так и с гидрофобным окружением
- модель жидкой мозаики
- описывает структуру плазматической мембраны как мозаику компонентов, включая фосфолипиды, холестерин, белки, гликопротеины и гликолипиды (цепочки сахаров, присоединенные к белкам или липидам, соответственно), что приводит к жидкому характеру (текучести)
- гликолипид
- комбинация углеводов и липидов
- гликопротеин
- комбинация углеводов и белков
- гидрофильный молекула
- , способная связываться с водой; «водолюбивый»
- гидрофобный молекула
- , не имеющая способности связываться с водой; «ненавидящий воду»
- интегральный белок белок
- , интегрированный в структуру мембраны, интенсивно взаимодействующий с углеводородными цепями мембранных липидов и часто пронизывающий мембрану; эти белки могут быть удалены только путем разрушения мембран детергентами
- периферический белок белок
- , обнаруженный на поверхности плазматической мембраны либо на ее внешней, либо на внутренней стороне; эти белки можно удалить (смыть с мембраны) промывкой с высоким содержанием соли
Авторы и атрибуты
Конни Рай (Общественный колледж Восточного Миссисипи), Роберт Уайз (Университет Висконсина, Ошкош), Владимир Юруковский (Общественный колледж округа Саффолк), Жан ДеСэ (Университет Северной Каролины в Чапел-Хилл), Юнг Чой (Технологический институт Джорджии) ), Яэль Ависсар (Колледж Род-Айленда) среди других авторов.Оригинальный контент от OpenStax (CC BY 4.0; бесплатно скачать по адресу http://cnx.org/contents/185cbf87-c72…[email protected]).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Эффективная замена фосфолипидов и сфинголипидов наружных листков плазматической мембраны в клетках экзогенными липидами
Значимость
Применение метил-α-циклодекстрина для полной замены эндогенных сфинголипидов и фосфолипидов наружных листков плазматической мембраны живых клеток млекопитающих экзогенными природными и неприродными липиды представлены в этой статье.Оценивали виды липидов наружного листка, при этом липиды, заменяемые вне наружного листка плазматической мембраны, соответствовали ожидаемой липидной асимметрии. Метод сделает возможным ряд исследований мембранной структуры/функции.
Abstract
Наше понимание мембран и функции мембранных липидов значительно отстает от понимания нуклеиновых кислот и белков, в основном потому, что сложно управлять липидным составом клеточных мембран. Чтобы помочь решить эту проблему, мы показываем, что липидный обмен, катализируемый метил-α-циклодекстрином (MαCD), можно использовать для максимальной замены сфинголипидов и фосфолипидов во внешнем листке плазматической мембраны живых клеток млекопитающих экзогенными липидами, включая неестественные липиды. .Кроме того, эксперименты по обмену липидов показали, что 70–80% клеточного сфингомиелина находится во внешнем листке плазматической мембраны; асимметрия метаболически активных клеток была аналогична ранее определенной для эритроцитов, судя по липидному составу наружного листка; и фосфатидилхолин наружного листка плазматической мембраны имел значительно более низкий уровень ненасыщенности, чем фосфатидилхолин в остальной части клетки. Данные также предоставили приблизительную оценку общего количества клеточных липидов, находящихся в плазматической мембране (около половины).В дополнение к таким применениям липидомики метод обмена должен иметь широкий потенциал для исследования функции липидов и модификации клеточного поведения путем модификации липидов.
За последние полвека наше понимание клеток и биологических процессов на клеточном уровне претерпело революцию, основанную на достижениях в нашей способности контролировать структуру и состав клеточных нуклеиновых кислот и белков. Напротив, наше понимание функции липидов в мембранах, окружающих клетки, и их внутренних компартментов развивалось гораздо медленнее.Основная проблема заключается в невозможности манипулировать липидным составом мембран так же легко, как другими клеточными молекулами. Это сложная проблема, осложненная тем фактом, что эукариотические плазматические мембраны проявляют асимметрию (т. е. различие в липидном составе листков внутренней и наружной мембран) по отношению к их распределению липидов в липидном бислое. В целом листок наружной мембраны клеток млекопитающих состоит в основном из сфингомиелина (СМ) и фосфатидилхолина (ФХ).Напротив, внутренний или цитоплазматический листок состоит в основном из аминофосфолипидов [например, фосфатидилэтаноламина (ФЭ) и фосфатидилсерина (ФС)] (1, 2). Асимметричное расположение липидов в клеточной мембране влияет на различные биологические свойства, такие как проницаемость мембраны, мембранный потенциал, поверхностный заряд, механическая стабильность мембран и форма мембран (3⇓–5). Следовательно, возможность манипулировать липидным составом живой клеточной мембраны могла бы стать полезным инструментом для использования в исследованиях и разработках патологических заболеваний, опосредованных клеточными мембранами.В настоящее время существует ограниченное количество подходов к изучению функции липидов путем изменения липидного состава с использованием ингибиторов синтеза и метаболической инженерии (6⇓–8). Однако молекулы-ингибиторы действуют медленно, ограничены определенными классами липидов и не всегда достаточно специфичны. Метаболическая инженерия — мощный, но трудоемкий метод, который до сих пор эффективно применялся только к бактериям. Такие способы не позволяют эффективно вводить широкий спектр экзогенных липидов со специфическими головными группами и композициями ацильных цепей или вводить неприродные липиды.В этом отношении привлекательной альтернативой является изменение липидного состава путем обмена липидов с использованием циклодекстринов (ЦД). ЦД, циклические олигомеры глюкозы с гидрофобной полостью, давно используются для переноса и модификации клеточных стеролов (9), но их использование для обмена сфинголипидов и фосфолипидов в клетках мало изучено. Предыдущие исследования показали, что фосфолипиды могут быть доставлены в клетки с помощью метил-β-циклодекстрина (MβCD) и что доставленные липиды не быстро превращаются (10, 11).Однако объем обмена был низким, за исключением липидов с короткими ацильными цепями. Кроме того, чтобы преодолеть эффекты экстракции холестерина с помощью MβCD, холестерин должен был быть добавлен обратно в клетки.
Ранее мы разработали использование CD для осуществления эффективного обмена липидов наружного листка в модельных мембранных везикулах, определяя условия, при которых весь внешний липидный монослой (листок) липидного бислоя мембраны может быть заменен экзогенными липидами in situ с использованием MβCD или гидроксипропил(HP)αCD без нарушения липидного состава внутреннего листка (12⇓⇓⇓⇓⇓–18).Это позволило получить искусственные везикулы, которые имитируют естественные мембраны, имея как естественный липидный состав, так и асимметрию. Этот подход начинает находить применение в других лабораториях (19⇓⇓–22).
В этом исследовании мы устанавливаем процедуру эффективного обмена клеточных фосфолипидов и сфинголипидов из внешнего листка клеточной плазматической мембраны живых клеток млекопитающих экзогенными липидами с использованием MαCD, нагруженного липидами. Преимущество альфа-CD состоит в том, что полость слишком мала для взаимодействия со стеролами (15).ТСХ и масс-спектрометрию липидов проводили для оценки эффективности обмена и асимметрии клеточных липидов. Были определены условия, обеспечивающие эффективный обмен, и была выявлена важная основная липидомная информация, касающаяся состава липидов наружного листка плазматической мембраны. Этот метод должен обеспечить ряд исследований структуры и функций мембран в будущем.
Результаты
MαCD связывает различные фосфолипиды и сфинголипиды и может осуществлять эффективный обмен липидов в модельных мембранах.
Предыдущие исследования показали, что MβCD сильно взаимодействует с фосфолипидами и холестерином, тогда как HPαCD специфически взаимодействует с фосфолипидами, но слабо (15, 23). Мы пришли к выводу, что MαCD, который, как и HPαCD, имеет слишком маленькую полость для связывания холестерина, должен, подобно MβCD, сильно взаимодействовать с фосфолипидами. Для подтверждения этого MαCD титровали в липидные везикулы. Солюбилизация везикул, наблюдаемая, когда CD эффективно связывает липиды, индуцировалась MαCD в концентрациях, несколько более низких, чем необходимо для MβCD ( SI Приложение , рис.С1). Зависимость солюбилизации от структуры фосфолипидов была умеренной и сходной для MαCD и MβCD. Чтобы подтвердить отсутствие специфичности фосфолипидов во время обмена, был разработан протокол обмена липидов в модельных мембранных везикулах, аналогичный разработанному ранее для MβCD (12). Эффективный обмен наблюдали с использованием яичной СМ (eSM) для передачи липидов, заменяемых во внешний листок акцепторных везикул, состоящих из 1:1:1 (моль:моль) 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоэтаноламина (1:1:1 (моль:моль)). POPE)/1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо-L-серин (POPS)/1-пальмитоил-2-олеоил-sn-глицерин-3-фосфохолин (POPC) с 40 мол.% холестерина ( Приложение SI , рис.С2). POPC, POPE и POPS были заменены eSM в аналогичной степени, с, возможно, немного меньшим обменом POPS. Поскольку циклодекстрины катализируют обмен липидов во внешнем листке мембран, после обмена везикулы должны иметь асимметричное распределение липидов. Маркировка POPE мембранонепроницаемым зондом, меченным тринитробензолсульфонатом, подтвердила ожидаемую липидную асимметрию ( SI, Приложение , рис. S2C).
Процедура MαCD-опосредованного обмена для клеток млекопитающих.
Затем был разработан протокол экспериментов по обмену липидов с использованием клеток карциномы легкого A549, выращенных на чашках для культивирования клеток (рис. 1). Клетки были чувствительны к обработке только MαCD, округляясь в течение 15 минут ( SI, Приложение , Таблица S1). Во избежание этого MαCD перед добавлением к клеткам предварительно инкубировали с липидными везикулами. После инкубации клеток со смесью липид-MαCD раствор, содержащий MαCD и обменные клеточные липиды, удаляли. Инкубация клеток с MαCD, предварительно смешанным со сфинголипидом или фосфолипидом, поддерживала нормальную морфологию клеток в течение 6 часов и более ( SI, Приложение , Таблица S1).После обмена в оптимальных условиях выживало <1% клеток, окрашенных трипановым синим в цитоплазме (т.е. >99% клеток). Обратите внимание, что поддержание нормальной морфологии очень чувствительно к концентрациям как липидов, так и MαCD. Поддержание нормального поведения клеток после инкубации со смесями липидов и MαCD также наблюдалось путем измерения клатрин-опосредованного эндоцитоза трансферрина. Нормальные уровни эндоцитоза наблюдались после инкубации клеток с SM головного мозга (bSM)/POPC, нагруженным MαCD ( Приложение SI , рис.С3). Напротив, эндоцитоз сильно ингибировался после частичной экстракции клеточного холестерина с помощью MβCD.
Рис. 1.Схематическое изображение обмена липидов в клетках. MαCD обозначен закрытым шестиугольником. Экзогенные липиды, введенные в клетки, показаны красным цветом. Эндогенные липиды показаны синим цветом.
Кинетика MαCD-опосредованного обмена липидов наружных листков плазматической мембраны с экзогенными липидами.
Уровни обмена с использованием bSM в качестве донора анализировали в условиях, исключающих изменения морфологии клеток.Для этого эндогенные липиды клеток метаболически метили ацетатом 3 H, а затем количественно определяли клеточные липиды до и после замены путем экстракции с последующей ТСХ и измерением радиоактивности в каждой полосе липидов. SI Приложение , рис. S4 A показывает, что преобладающими клеточными фосфолипидами были PC, SM, PS+фосфатидилинозитол (PI) и PE с небольшими количествами фосфатидилглицерина (PG) и кардиолипина (CL). Их относительный уровень мечения радиоактивным изотопом (таблица 1) примерно соответствовал их объемной концентрации в клетках, что определялось обугливанием пластин HP-TLC ( SI Приложение , рис.S4 B ) и МС (табл. 1).
Таблица 1.Влияние липидного обмена на содержание фосфолипидов и сфингомиелина в клетке -2-1,3-бензоксадиазол-4-ил) (NBD-DPPE) в клетки и от степени катализируемого MαCD удаления эндогенного липида. Уровни липидов после обмена затем сравнивали с уровнями до обмена. Доставка NBD-DPPE и удаление эндогенного SM, липида, преимущественно расположенного во внешних листках плазматической мембраны (PM) (2), следовали сходной кинетике с периодом полувыведения порядка 15–20 минут при 37 ° C (рис. .2 А ). Обмен при 15 °C через 1 ч был примерно вдвое меньше, возможно, из-за более медленного обмена ( SI Приложение , рис. S5 A и B ). Ассоциация экзогенного NBD-DPPE с клетками в отсутствие MαCD была незначительной, что свидетельствует о том, что MαCD необходим для обмена липидов. Эксперименты также показали очень мало или отсутствие доставки экзогенного bSM в отсутствие MαCD (см. ниже).
Рис. 2.Эффективность и кинетика липидного обмена между клетками MαCD, нагруженными липидами, и клетками A549 при 37 °C.( A ) Кинетика липидного обмена с использованием 1,5 мМ bSM (или 1:9 моль:моль NBD-DPPE/bSM) и 40 мМ MαCD. Удаление эндогенных SM измеряли по 3 H SM, оставшимся в 3 H меченых клетках A549 после замены липидов; Было проанализировано 10% проб. Доставку меченого NBD флуоресцентного липида оценивали по уровню связанной с клетками флуоресценции NBD. Единицы флуоресценции произвольны. ( B ) Влияние концентрации MαCD на остаточный процент 3 H SM = [(cpm SM после замены)/(cpm SM до замены)] × 100%, оставшиеся в клетках A549 после замены липидов.Процент обменного эндогенного SM = 100% − остаточный процент 3 H SM. Экзогенный липид представлял собой 1,5 мМ bSM. ( C ) Влияние концентрации липида, смешанного с MαCD, на остаточный процент 3 H SM, остающийся в клетках A549 после замены липидов. Концентрация MαCD составляла 40 мМ. Некоторые клетки округлялись, когда концентрация экзогенного bSM составляла 0,2 мМ или меньше. ( D ) Различные комбинации липидов приводили к одинаковым уровням процентного обмена 3 H SM.Липиды состояли из 1,5 мМ bSM, 3 мМ POPC, 3 мМ 1:1 (моль:моль) bSM/POPC или bSM/1,2-диолеоил-sn-глицеро-3-фосфохолина. Концентрация MαCD составляла 40 мМ. Для B–D данные были нормированы на уровень радиоактивного ФС+ФИ в той же пробе с использованием соотношения процентного соотношения 3 H SM = (имп/мин СМ после замены/имп/мин СМ до замены) × (имп/мин ФС+ФИ до замены/имп/мин PS+PI после замены) × 100%. PS и PI, которые совместно мигрируют на ТСХ, представляют собой липиды внутренних листков, недоступные для обмена (что подтверждается на рис.3 А ). Для AD показаны средние значения и SD из трех экспериментов. cpm, отсчетов в минуту.
MαCD-опосредованная замена липидов наружных листков плазматической мембраны экзогенными липидами эффективна.
Максимальная степень обмена радиоактивно меченого СМ из клеток составляла около 70–75% (рис. 2 A–D ). На это максимальное значение не влияли изменения концентрации MαCD или экзогенных липидов (фиг. 2 B и C ).Несколько более высокий уровень удаления эндогенного СМ путем обмена (∼80%) был измерен с использованием МС (таблица 1). Уровни эндогенного обмена SM были одинаковыми для разных типов клеток ( SI, Приложение , рис. S6), и когда в качестве экзогенного липида использовали bSM, POPC, bSM/POPC или eSM/1,2-диолеоил-sn-глицерин. -3-фосфохолиновая смесь (рис. 2 D ). Трипсинизация клеток перед обменом не увеличивала уровень обмена, что указывает на то, что обмен не ограничивался контактами клеточной пластинки. После 30-минутного обмена с bSM и MαCD добавление свежей смеси bSM и MαCD заменяло лишь небольшое дополнительное количество эндогенного SM, а общий обмен был не более чем за один часовой цикл обмена ( SI Приложение , рис.S5 С ). Точно так же измерение количества экстрагированной радиоактивности, перенесенной из клеток в супернатант при обмене, показало, что подавляющее большинство обмениваемых эндогенных SM (85%) и PC (80%) удалялось после 30-минутного цикла обмена. Небольшая доля СМ (15% от общего количества, извлеченного после двух циклов обмена) и ФХ (20% от общего количества, извлеченного после двух циклов обмена), появляющаяся в супернатанте после второго раунда обмена, может в основном представлять собой фон, возникающий в результате отслоение клеток или клеточный дебрис.
Наиболее вероятным объяснением всех этих результатов является то, что 70–80% замены СМ представляет собой полную замену СМ наружного листка ПМ, при этом необменимый пул СМ недоступен для обмена из-за расположения в цитозольном листке ПМ или внутренних мембранах , что согласуется с предыдущими исследованиями (24).
Обмен липидов, отличных от SM, согласуется с тем, что обмен ограничивается липидами во внешнем листке PM.
Как показано на рис. 3 A , в условиях максимального (∼75%) обмена СМ процент обмена ФХ и ФЭ был очень низким (10–15%), а обмена ФС+ФИ практически не было .(МС показывает, что PS и PI присутствуют в соотношении, близком к 1:1; таблица 1.) Все эти липиды либо находятся в больших количествах во внутренних мембранах, либо расположены в цитозольных листках, недоступных для MαCD. На эти выводы не повлияло то, как были нормализованы значения радиоактивности (рис. 3 A по сравнению с SI Приложение , рис. S7). Обмен практически не влиял на уровень холестерина или триглицеридов, если вообще влиял ( SI Приложение , рис. S8).
Рис. 3.Липидный состав и локализация клеточных и экзогенных липидов после обмена при 37 °С.( A ) Процент остаточных эндогенных липидов, меченных 3 H, в клетках A549 после 1-часового обмена с 1,5 мМ bSM и 40 мМ MαCD. (Радиоактивность после замены/радиоактивность до замены) × 100% рассчитывали для каждого липида, как показано, со значениями до замены, нормализованными к 100% для каждого липида. Показаны средние значения трех экспериментов и SD. ( B ) ТСХ липидов A549 после 1-часового обмена. Экзогенные липиды наносили на 40 мМ MαCD. (Дорожка 1) Контрольные образцы без MαCD или экзогенных липидов.(Дорожка 2) Обработка 1,5 мМ экзогенного bSM, но без MαCD. (Дорожка 3) Обмен с 1,5 мМ экзогенного bSM и MαCD. (Дорожка 4) Обмен с 3 мМ экзогенными POPC и MαCD. Показан низкоподвижный участок пластины для ТСХ, на котором хроматографирована 1/10 часть всего образца. Обратите внимание, что SM работает как несколько диапазонов.
Аналогичные эксперименты с немеченым bSM, в которых уровни липидов оценивались путем обугливания липидных полос на ТСХ, дали результаты, аналогичные результатам, полученным с радиоактивно мечеными липидами. В соответствии с измерениями радиоактивности большая часть эндогенного СМ удалялась при замене на экзогенный ПОФХ (рис.3 B , дорожка 4), тогда как на уровни PS+PI обмен не влиял (фиг. 3 B , дорожки 3 и 4). В отсутствие MαCD доставка липидов была очень незначительной или отсутствовала (фиг. 3 B , дорожка 2).
Поскольку эндогенный СМ составляет примерно 40% общего липида наружного листка (см. ниже), полный обмен 1:1 липида наружного листка с экзогенным СМ должен увеличить концентрацию СМ в наружном листке плазматической мембраны примерно в 2,5 раза (если СМ наружного листка является 80% от общего SM, общее SM должно увеличиться на 2.в 2 раза). Это примерно то, что наблюдали, судя по интенсивности окрашивания, при использовании обугливания (фиг. 3 B , дорожки 2 и 3). Эксперименты с МС с использованием обмена неестественного липида N -гепадеканоил-d-эритро-сфингозилфосфорилхолина (C 17:0 SM) в клетках дали аналогичные результаты. Количество экзогенных СМ С 17:0 в клетках после обмена было в 2,1 раза выше, чем общее количество эндогенных клеточных СМ до обмена (табл. 1), что свидетельствует о полной замене фосфолипидов и сфинголипидов наружного листка ПМ в примерно Процесс обмена 1:1.В общем, мы проверяли степень обмена не только по радиоактивному мечению, но и по обугливанию липидов на ТСХ и/или МС. Везде, где можно было сравнить методы, они давали одинаковые ответы.
Наконец, количество липида ганглиозида GM1 наружного листка РМ, выводимого из клеток, также соответствовало эффективному обмену липидов наружного листка РМ. Согласно анализу связывания субъединицы холерного токсина B, меченного флуоресцентной меткой, около 90% связывания холерного токсина B было устранено ( SI Приложение , рис.S9), хотя это может не соответствовать точно 90% удалению GM1 (25).
Интересно, что объединение наблюдения о том, что SM включает 40% липидов наружного листка, с наблюдением, что 9–14% всех липидов клеток приходится на SM наружного листка (таблица 1), указывает на то, что в этих клетках внешний листок содержит ~25–35 % от общего количества фосфолипидов и сфинголипидов (при условии, что гликосфинголипиды являются второстепенными компонентами липидов). Таким образом, можно оценить, что плазматическая мембрана содержит примерно ≥50% общего количества фосфолипидов и сфинголипидов.
Асимметрия липидов наружного листка и особый состав ацильных цепей.
Состав клеточного липида, экстрагированного с помощью MαCD, соответствовал ожидаемому для его происхождения из наружного листка плазматической мембраны. Он содержал высокий уровень ФХ и СМ, гораздо меньшее количество ФЭ и небольшое количество ФС+ПИ или их отсутствие (рис. 4 —). В целом СМ составлял ~40% экстрагированных липидов. Подобный общий состав липидов наружного листка был ранее обнаружен для плазматической мембраны эритроцитов (2).Эксперименты с МС с использованием экзогенного обмена С 17:0 СМ в клетки предоставили дополнительную информацию о молекулярном составе видов липидов, обмениваемых из клеток; в частности, с точки зрения состава ацильной цепи ( SI Приложение , таблицы S2 и S3). В случае ПК остаточные частицы в клетках после обмена показали, что отношение сильно ненасыщенных частиц (с тремя и более двойными связями) к относительно менее ненасыщенным частицам (с одной или двумя двойными связями) увеличивается на [0.99/0,74 — 1] × 100% = 34% ( Приложение SI , таблица S2). Это говорит о том, что внешний листок ТЧ был обогащен видами, которые не являются сильно ненасыщенными, поскольку они предпочтительно удалялись при обмене. Это согласуется и расширяет предыдущее исследование MS, в котором сравнивалась ненасыщенность цельных PM и целых клеток и было обнаружено обогащение менее ненасыщенными видами цельных PM (26).
Рис. 4.Эндогенные липиды, экстрагированные из клеток, и локализация экзогенных липидов. ( A ) Эндогенные липиды, экстрагированные из клеток A549 при обмене с 1.5 мМ BSM и 40 мМ MαCD. Радиоактивность эндогенных липидов, экстрагированных из клеток A549 при обработке 1,5 мМ bSM, но без MαCD, использовали в качестве фона и вычитали. Показаны средние значения пяти экспериментов и SD. Все данные образца были рассчитаны на основе данных хроматографии либо 10%, либо 30% образца в соответствующем масштабе. ( B ) Локализация экзогенных липидов после замены. На микрофотографиях отдельных конфокальных срезов показаны репрезентативные клетки после 1-часового обмена с 1.5 мМ 1:9 (моль:моль) NBD-DPPE/bSM, загруженные на 40 мМ MαCD ( слева , без обработки), или после замены и 5-минутной инкубации с дитионитом ( справа , обработано дитионитом).
В случае эндогенных СМ, хотя все виды показали высокий уровень обмена ( SI Приложение , Таблица S3, Правый ), мы нашли коэффициент обмена для длинноцепочечных СМ (с не менее чем 36 атомами углерода ) по сравнению с короткоцепочечным СМ (с менее чем 36 атомами углерода) увеличивается. Соотношение СМ с длинной и короткой ацильной цепью увеличивается в четыре раза.Эти результаты показывают, что виды SM с более короткой ацильной цепью были заменены в гораздо большей степени, чем виды с более длинной ацильной цепью, так что остаточный эндогенный SM в клетках после обмена был обогащен длинноцепочечными соединениями ( SI Приложение , Таблица S3, ). Слева ). Это убедительно свидетельствует о том, что большая доля длинноцепочечных видов SM, чем короткоцепочечных видов, расположена в другом месте, кроме внешнего листка PM. Альтернативная возможность, селективная экстракция SM с более короткой цепью с помощью MαCD, менее вероятна, поскольку обмен липидов наружных листков, по-видимому, почти завершен.Что касается других видов фосфолипидов, то лишь небольшая их часть находится во внешнем листке ПМ (рис. 3 –), поэтому неудивительно, что нет очевидного влияния обмена на состав ацильных цепей остаточных липидов по сравнению с теми, которые присутствовали до этого. был отмечен обмен ( Приложение SI , таблица S2).
Обмененный NBD-липид в основном находится в плазматической мембране.
Флуоресцентные микрофотографии показали локализацию NBD-липидов в плазматической мембране в клетках (рис.4 B , Слева ). Показано расположение наружной створки от доступности группы НБД до разрушения относительно непроницаемым для мембран восстановителем дитионитом натрия (рис. 4 В , Справа ). Большая часть флуоресценции быстро терялась при обработке дитионитом со слабой остаточной флуоресценцией, связанной с внутренней частью клетки. Эта интерпретация была подтверждена спектроскопическими измерениями снижения флуоресценции NBD при обработке дитионитом, которые показали, что 70-80% NBD-липидов, обменявшихся в клетках, были доступны для дитионита ( SI Приложение , рис.С10). Доступность дитионита не сильно зависела от температуры.
Кроме того, был проведен эксперимент, в котором оценивали распределение экзогенных радиоактивно меченых СМ, введенных в клетки после обмена. Как и в случае с эндогенным SM, 80% экзогенного 14 C-SM, доставленного в клетки, можно было удалить путем повторного обмена, показывая, что его распределение было сходно с распределением эндогенного липида ( SI Приложение , рис. С11). Это также указывает на то, что асимметрия СМ оставалась стабильной по крайней мере через 1 ч после первоначального обмена.Был проведен еще один эксперимент по измерению содержания СМ в клетках после замены липидов наружного листка экзогенными СМ. Повышенные уровни SM сохранялись в течение многих часов ( SI, Приложение , рис. S12).
Обсуждение
Это исследование показывает, что в живых клетках может быть достигнута простая и эффективная замена липидов наружных листков ТЧ экзогенными липидами. Этот процесс дает важную информацию о доле различных видов липидов во внешнем листке ТЧ. Состав головной группы липидов для культивируемых клеток был очень похож на ранее установленный с использованием эритроцитов (2).Это интересно, потому что, несмотря на то, что эритроциты относительно просты для изучения, поскольку у них в значительной степени отсутствуют внутренние мембраны, они не содержат и не выполняют такие же сложные метаболические функции, как большинство других клеток, и это могло изменить состав наружных листков. Кроме того, состав листков эритроцитов в значительной степени решался с помощью фосфолипаз (2), которые могли нарушить структуру мембраны, особенно если гидролиз липидов изменяет переключение липидов между внутренним и внешним листками. Наш метод обмена должен вызывать гораздо меньше возмущений, поэтому он должен быть широко применим к анализу асимметрии, в котором с 1970-х годов не наблюдалось большого прогресса (2).
Мы также проверили степень обмена липидов не только с помощью радиоактивной метки, но также и по общему уровню липидов, определяемому по обугливанию липидов на ТСХ, которая отражает общее содержание липидов, и с помощью МС. Каждый метод потенциально может дать несколько разные ответы. На радиоактивное мечение можно было бы повлиять, если бы радиоактивность распределялась по-разному в разных липидах. Обугливание в некоторой степени зависит от липидной ацильной цепи и структуры головной группы (хотя мы в основном использовали ее для оценки изменений уровня одного типа головной группы).MS предполагает, что на чувствительность не влияет то, имеют ли стандарты структуры ацильных цепей, отличные от природных видов. Наблюдение, что при сравнении этих различных методов они давали очень похожие ответы, указывает на то, что все они давали надежные результаты, несмотря на эти проблемы.
Исследования по обмену также показывают, что SM является преимущественно липидом внешнего листка РМ в культивируемых клетках. Если метаболические процессы, такие как поперечная диффузия, не являются необычно активными, содержание SM в наружных листках PM должно значительно превышать содержание SM во внутренних мембранах плюс листках цитозольной мембраны, чтобы обеспечить высокий уровень обмена SM, наблюдаемый в наших экспериментах.
Проблема, которую нельзя игнорировать, заключается в том, увеличивается ли переворот липидов (поперечная диффузия между листочками) во время или после обмена липидов. Если бы триггер увеличился, а распределение липидов стало бы случайным во время обмена, структура экстрагированных липидов сильно отличалась бы от того, что мы наблюдали. Мы заметили, что экстрагированные липиды (PC и SM, мало PE, без PS+PI) соответствуют тому, что известно для наружного листка из исследований асимметрии эритроцитов. Кроме того, было показано, что распределение экзогенных меченных радиоактивным изотопом СМ, введенных в клетки обменным путем, сходно с распределением эндогенных СМ (~80% СМ находится во внешнем листке плазматической мембраны).Этого бы не наблюдалось, если бы SM распределялся поровну между внутренним и внешним листком (т. е. обмен 50% или меньше). Однако можно предположить, что с некоторыми экзогенными липидами, не протестированными в этом отчете (например, PE), может быть усиленный триггер.
Наблюдение, что условия, которые сохраняют нормальную морфологию клеток, были разными для яичной, мозговой и молочной СМ ( SI, Приложение , Таблица S1), показывает, что условия обмена чувствительны к структуре ацильной цепи. Мы еще не понимаем происхождение этого эффекта, но он показывает, что для будущих применений оптимальные условия обмена должны быть определены экспериментально и не обязательно будут идентичны тем, что описаны в этом отчете.
Метод обмена должен иметь важные биологические применения помимо описанных здесь, связанных с липидомным анализом. Сюда входят исследования того, как изменение состава липидов влияет на биологические функции. В связи с этим обмен должен значительно расширить возможности, которые могут быть достигнуты путем модификации липидов ингибиторами или разработки модифицированных путей синтеза липидов (6, 7). Обмен может быть полезен для введения очень широкого спектра липидов, липидов с определенной головной группой и составом одной ацильной цепи, а также, как показано здесь, неприродных липидов.Введение аналогов негидролизуемых липидов позволит изучить функции фосфолипаз. Также возможно нацелить липидный обмен на удаление определенных видов липидов. Для этого липиды наружных листков сначала должны быть выделены из PM. После выделения различных видов липидов, например, с помощью ТСХ или ВЭЖХ, смесь липидов РМ может быть восстановлена с удалением одного конкретного вида липидов. Обмен с использованием этой восстановленной смеси приведет к селективному удалению целевого липида, отсутствующего в восстановленной смеси, из клеток.
Следует также отметить, что обмен также может позволить изучать влияние липидов на белки ТЧ гораздо менее тревожным образом, чем когда белки должны быть сначала выделены, а затем восстановлены в искусственных мембранах с другими липидами. Наконец, благоприятное изменение свойств клеток путем изменения липидов может иметь практическое применение в биотехнологии.
Материалы и методы
Материалы.
Линия клеток рака молочной железы MDA-MB-231, клетки почки COS 7, карцинома легкого A549 и клетки поджелудочной железы BxPC-3 получены из ATCC.bSM, eSM, молочный сфингомиелин, C 17:0 SM, POPC, 1,2-диолеоил-sn-глицеро-3-фосфохолин и NBD-DPPE, POPE, POPS и холестерин были получены от Avanti Polar Lipids. 3 H ацетат был получен от PerkinElmer, Inc. MαCD был приобретен у AraChem. MαCD, растворенный в дистиллированной воде, был слегка мутным. Мутность удаляли фильтрованием через фильтр 0,2 мкм или центрифугированием. Для расчета концентрации показатель преломления растворов МАЦД в воде измеряли на рефрактометре Бауша и Ломба.Значения показателя преломления сравнивали со стандартной кривой, построенной с использованием серии растворов осветленного МАЦД, концентрация которого измерялась по сухой массе. 14 C-SM был произведен компанией American Radiolabeled Chemicals (Сент-Луис). Перед использованием он был повторно очищен с помощью ТСХ. MβCD, конъюгированный с FITC холерный токсин B и порошок параформальдегида были приобретены у Sigma Aldrich. Среда RPMI 1640, DMEM, FBS, HBSS, PBS Дульбекко, 200 мг/л KCl, 200 мг/л KH 2 PO 4 , 8 г/л NaCl и 2.16 г/л Na 2 HPO 4 (DPBS) были торговой маркой Gibco и приобретены у Life Technologies. Трансферрин, конъюгированный с Alexa Fluor 488 (TF-AF488) и CellMask Deep Red (раствор для окрашивания плазматических мембран), был торговой маркой Molecular Probes и получен от Life Technologies. Среду для заливки VECTASHIELD приобретали у Vector Laboratories, Inc. BSA получали от Millipore. 10-кратный PBS с рН 7,8 ± 0,2 при разбавлении до 1-кратного разбавления был приобретен у Bio-Rad Laboratories Inc. Лимонная кислота и хлорид натрия были приобретены у Fisher Scientific.Использовали дистиллированную и деионизированную воду. Другие химикаты были химически чистыми.
Культура клеток.
Клетки A549 и BxPC-3 культивировали в среде RPMI 1640. Для культивирования клеток MDA-MB-231 и COS 7 использовали DMEM. Все среды были дополнены 10% FBS. Все клетки культивировали в инкубаторе при 37 °C с 5% CO 2.
Высокопроизводительная ТСХ.
Образцы и стандарты чистых липидов растворяли в 1:1 (об.:об.) хлороформ/метанол. В некоторых случаях липиды из образцов асимметричных везикул сначала экстрагировали смесью 2:2:1 (об:об) хлороформ/метанол/вода и сушили в токе азота, но это не влияло на результаты.Затем растворенные липиды наносили на пластины HP-TLC (силикагель 60) (Merck) или пластины Uniplate Silica Gel G (Analtech, Inc.) и хроматографировали в смеси 65:25:5 (об.:об.) хлороформ/метанол/28,0– 30,0% (об./об.) гидроксида аммония. После хроматографии пластины для ТСХ сушили на воздухе и насыщали смесью 3% (масса/объем) ацетата меди и 8% (объем) фосфорной кислоты путем распыления, а затем снова сушили на воздухе. Затем планшеты обжигали при 180°C для образования липидных полос. Интенсивность липидных полос измеряли с использованием программного обеспечения ImageJ (Национальные институты здравоохранения).Липиды в образцах определяли количественно путем сравнения интенсивности полосы за вычетом фона с кривой, состоящей из различных стандартных количеств каждого липида, хроматографированных на одной и той же пластине для ТСХ. Интенсивность стандартных полос соответствовала линейной кривой зависимости интенсивности от количества липидов.
Получение загруженного липидами MαCD для экспериментов по обмену липидов в клетках.
Желаемое количество липидов, растворенных в органическом растворителе, помещали в стеклянные пробирки и сушили азотом, а затем высоким вакуумом в течение 1 часа.Многослойные везикулы готовили из высушенных липидов при 70 °C путем добавления предварительно нагретой среды RPMI 1640. К многослойным везикулам добавляли желаемое количество MαCD (из 400-мМ исходного раствора MαCD, растворенного в DPBS). Концентрация липидов и MαCD зависела от экспериментальных требований, но наиболее обычными условиями было то, что после смешивания липидов и MαCD концентрация липидов составляла 1,5 мМ, а концентрация MαCD составляла 40 мМ. Затем смесь MαCD и липида инкубировали при 37°C в течение 30 мин.Затем насыщенную липидами смесь MαCD использовали для обмена липидов в клетках.
Обмен липидов между клетками и нагруженный липидами MαCD.
Если не указано иное, клетки культивировали в 10-сантиметровых чашках с 10 мл среды. После удаления питательной среды и трехкратной промывки 10 мл DPBS аликвоту 1500 мкл насыщенного липидами MαCD с 1,5 мМ липида и 40 мМ MαCD добавляли к клеткам млекопитающих с конфлюэнтностью ~90%, культивируемым в 100-мм чашках (Corning Incorporated ). Клетки инкубировали с MαCD, нагруженным липидами, в течение 1 ч при 37 °C, если не указано иное.После удаления MαCD, нагруженного липидами, и трехкратного промывания 10 мл DPBS клетки удаляли с планшета путем выскабливания в 5 мл DPBS. Клетки осаждали в стеклянную пробирку путем 3-минутного центрифугирования при 300 × g в скоростном вакуумном концентраторе (Savant). Для экспериментов, в которых было два раунда обмена, после удаления супернатанта из первого раунда обмена в клетку добавляли свежую смесь липидов и MαCD и проводили второй раунд обмена липидов.
3 H Мечение клеток, обмен липидов и экстракция липидов.Если не указано иное, 11 мкл 1,8 М ацетата натрия и 10 мкКи 3 H ацетата добавляли в 10-сантиметровые чашки с 70% конфлюэнтными клетками A549 в 10 мл среды RPMI 1640 с добавлением 10% FBS. Клетки инкубировали в течение 24 ч при 37°С. Затем среду удаляли и клетки трижды промывали 10 мл DPBS с добавлением 2 мМ ацетата натрия. (pH немного увеличился с 7,4 до 7,5 после добавления ацетата натрия).5 мМ bSM) добавляли в один планшет, а в качестве контроля в другой планшет добавляли 1,5 мл 1,5 мМ мультиламеллярных везикул bSM. Планшеты инкубировали при 37 °C в течение 1 ч в инкубаторе с 5% CO 2 . После инкубации супернатант удаляли для анализа 3 H-меченых липидов, выделенных из клеток (описано здесь). Для анализа остаточных радиоактивно меченых липидов в клетках после замены планшеты трижды промывали 10 мл DPBS с добавлением 2 мМ ацетата натрия.Клетки соскабливали в 5 мл DPBS с добавлением 2 мМ ацетата натрия и осаждали в стеклянные пробирки путем центрифугирования в течение 3 мин при 300 × г . После удаления супернатанта липиды экстрагировали из клеток 3 мл 3:2 (об:об) гексана/изопропанола, инкубировали при комнатной температуре в течение 30 мин, встряхивая каждые 5 мин, растворитель удаляли в новую стеклянную пробирку и затем высушивают газообразным азотом при осторожном нагревании.
Выделение и анализ
3 Н-меченых липидов из клеток.Липиды, экстрагированные, как описано ранее, растворяли в 100 мкл 1:1 (об.:об.) хлороформ/метанол и аликвоту 10 мкл наносили на планшеты HP-TLC Silica gel 60 (Merck). Липиды разделяли в смеси 65:25:5 (об:об) хлороформ/метанол/концентрированный гидроксид аммония. После сушки планшета на воздухе липиды окрашивали в емкости с йодом. Полосы липидов отмечали карандашом, и планшет помещали в вытяжной шкаф до исчезновения окрашивания йодом. Силикагель, соответствующий определенным липидным полосам, идентифицированным по их положению относительно липидных стандартов, соскребали с пластин.В качестве контроля также подсчитывали силикагель между полосами, чтобы подтвердить отсутствие липидов между полосами, окрашенными йодом. После добавления 2,5 мл смеси ScintiVerse BD (Fisher Scientific) радиоактивность подсчитывали с помощью сцинтилляционного счетчика Beckman LS6500 (Beckman Coulter, Inc.).
Разделение и анализ
3 H меченых липидов, выделенных из клеток.Супернатант смеси липидов и MαCD после липидного обмена собирали и центрифугировали при 72 000 об/мин (Beckman Coulter TLA 100.3) в течение 30 мин в ультрацентрифуге Optima TL (Beckman Coulter) для удаления клеток/клеточного детрита. К супернатанту после ультрацентрифугирования добавляли равный объем смеси 3:2 (об:об) гексан/изопропанол для экстракции липидов. Ту же самую процедуру повторяли для второго цикла экстракции из водной фазы первых экстракций. Экстрагированные липиды объединяли, сушили азотом, а затем растворяли в 90 мкл 1:1 (об:об) метанола/хлороформа вместе с 1 мкг/мкл каждого нерадиоактивного ФС, СМ, ФХ и ФЭ (добавление немеченых липидов позволяет визуализировать положение липидов при окрашивании йодом пластины для ТСХ).Затем аликвоты по 9 или 30 мкл наносили на пластину с силикагелем HP-TLC. Разделение и анализ липидов, меченных 3 Н, проводили, как описано ранее.
Экстракция липидов и анализ немеченых клеток A549.
Липиды экстрагировали и разделяли по той же процедуре, что и клетки с радиоактивной меткой. После хроматографии пластины для ТСХ сушили на воздухе и насыщали смесью 3% (масса/объем) ацетата меди и 8% (объем) фосфорной кислоты путем распыления, а затем снова сушили на воздухе.Планшеты обугливали при 180°С для образования липидных полос.
Мониторинг кинетики обмена с флуоресценцией и радиоактивностью.
Смесь 40 мМ MαCD с 1,5 мМ 1:9 (моль:моль) NBD-DPPE/bSM готовили, как описано ранее. Затем 500 мкл нагруженного липидами MαCD добавляли к 90% конфлюэнтным клеткам A549, культивируемым в 6-луночных планшетах (Corning Inc.). Клетки инкубировали в течение разного времени при 37 °C, а затем удаляли MαCD, нагруженный липидами. После трех промывок 2 мл DPBS клетки удаляли с планшета путем соскоба в 1 мл DPBS и помещали в 1.Пластиковые центрифужные пробирки объемом 5 мл. Клетки осаждали 3-минутным центрифугированием при 300 × g и ресуспендировали в 100 мкл DPBS. Затем добавляли 900 мкл этанола. Интенсивность флуоресценции NBD измеряли в флуоресцентных кюветах с использованием Fluorolog 3 (Jobin Yvon Horiba). Флуоресценцию измеряли при длине волны возбуждения 465 нм и длине волны испускания 534 нм. Контроль неспецифического прилипания липидов к клеткам готовили аналогичным образом, но без MαCD, и использовали в качестве нулевой точки времени.В аналогичном эксперименте клетки A549 метили 3 H и подвергали липидному обмену с использованием смеси 1,5 мМ bSM и 40 мМ MαCD, как описано ранее. Клетки собирали после разного времени инкубации, а липиды экстрагировали и разделяли на планшете HP-TLC, как описано ранее. Затем радиоактивность в диапазонах PS+PI и SM измеряли сцинтилляционным счетом, как описано ранее. Контроль неспецифического прилипания липидов к клеткам готовили аналогичным образом, но без MαCD, и использовали в качестве нулевой точки времени.
Влияние концентрации MαCD на эффективность обмена SM.
После мечения 3 H клетки A549 обрабатывали нагруженным липидами MαCD с 1,5 мМ bSM в сочетании с концентрациями MαCD 0, 2, 10, 40 или 80 мМ при 37 °C в течение 1 ч в CO 2 инкубатор . Клетки собирали и анализировали радиоактивность в полосах PS+PI и SM, как и ранее.
Влияние концентрации СМ на эффективность обмена СМ.
После мечения 3 H клетки A549 обрабатывали 40 мМ MαCD, загруженным 0, 0.1, 0,2, 0,5, 1, 1,5, 2 или 3 мМ БСМ при 37 °С в течение 1 ч в инкубаторе СО 2 . Клетки собирали и анализировали радиоактивность в полосах PS+PI и SM, как и ранее.
Дитионит для гашения флуоресценции NBD-DPPE.
NBD-DPPE заменяли в клетках A549, как описано ранее [за исключением стадии липидного обмена при 15 °C, комнатной температуре (23 °C) или 37 °C]. Клетки суспендировали в 1 мл DPBS и измеряли флуоресценцию до и (в зависимости от времени) после добавления аликвоты 50 мкл свежеприготовленного 1 М дитионита, приготовленного в 1 М трис-буфере (рН 10), для получения конечного результата. концентрация дитионита 50 мМ.Для микроскопических экспериментов обмен проводили, как и ранее, в течение 1 ч при 37 °С: аликвоту 7 мкл клеток, суспендированных в 1 мл DPBS, до или через 5 мин после обработки дитионитом наносили на предметные стекла микроскопа и накрывали покровным стеклом. Затем флуоресценцию NBD визуализировали с помощью конфокальной лазерной сканирующей микроскопии с использованием системы конфокального лазерного сканирующего микроскопа Zeiss LSM 5 Pascal (Carl Zeiss AG) для визуализации местоположения флуоресценции в клетке.
Содержание фосфолипидов по данным ЖХ/МС/МС.
Фосфолипиды экстрагировали из предоставленных образцов с использованием метода Блая и Дайера.Экстракты разбавляли внутренними стандартами (Avanti Polar Lipids) в соответствии со структурой классов фосфолипидов. Образцы готовили в силанизированных вкладышах для инъекций объемом 500 мкл и флаконах для анализа ЖХ/МС/МС. Экстракт каждого образца анализировали на сверхэффективном жидкостном хроматографе Waters Acquity (Waters Corporation)/системе AB Sciex 5500 MS. Экстракты классовых фосфолипидов для каждого образца вводили на колонку с обращенной фазой Agilent Eclipse XDB-C8 (4,6 × 50 мм, размер частиц 1,8 мкм) для разделения молекулярных частиц в каждом классе с помощью градиентной элюции и обнаруживали с помощью МС с использованием запланированного мониторинг множественных реакций.Таким образом, был измерен пик с уникальным временем элюирования колонки и профилем массы к фрагменту. Пики видов фосфолипидов интегрировали и нормализовали к соединениям внутреннего стандарта в соответствующих классах. Это обеспечило количественную оценку с использованием соотношения площади соединения/внутреннего стандарта, умноженного на концентрацию или концентрации внутреннего стандарта, первоначально добавленные к экстракции образца.
Благодарности
Мы благодарим Avanti Polar Lipids, Inc. и Джеффа Д.Мура за проведение исследований РС, о которых сообщалось здесь. Эта работа была поддержана грантом Национального научного фонда DMR 1404985 и грантом NIH GM 112638. проектное исследование; Г.Л., Дж.К., З.Х. и Дж.Р.С.К. проведенное исследование; Г.Л., Дж.К., З.Х., Дж.Р.С.К. и Э.Л. проанализированные данные; и Г.Л. и Э.Л. написал бумагу.
Заявление о конфликте интересов: На используемую технологию подана предварительная заявка на патент.
Эта статья является прямой отправкой PNAS. W.D. является приглашенным редактором, приглашенным редакционной коллегией.
Эта статья содержит вспомогательную информацию в Интернете по адресу www.pnas.org/lookup/suppl/doi:10.1073/pnas.1610705113/-/DCSupplemental.
3.1 Клеточная мембрана – анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Опишите молекулярные компоненты, из которых состоит клеточная мембрана
- Связь структуры клеточной мембраны с ее функциями
- Описать, как молекулы пересекают клеточную мембрану, исходя из их свойств и градиентов концентрации
- Сравните и сопоставьте различные типы пассивного транспорта с активным транспортом, предоставив примеры каждого
Несмотря на различия в структуре и функциях, все живые клетки многоклеточных организмов имеют окружающую клеточную мембрану.Так же, как внешний слой вашей кожи отделяет ваше тело от окружающей среды, клеточная мембрана (также известная как плазматическая мембрана) отделяет внутреннее содержимое клетки от внешней среды. Эта клеточная мембрана обеспечивает защитный барьер вокруг клетки и регулирует, какие материалы могут проходить внутрь или наружу.
Структура и состав клеточной мембраны
Клеточная мембрана представляет собой чрезвычайно гибкую структуру, состоящую в основном из двух слоев фосфолипидов («бислой»).Холестерин и различные белки также встроены в мембрану, придавая мембране множество функций, описанных ниже.
Одна молекула фосфолипида имеет фосфатную группу на одном конце, называемую «головой», и две расположенные рядом цепи жирных кислот, образующие липидные «хвосты» (рис. 3.1.1). Липидные хвосты одного слоя обращены к липидным хвостам другого слоя, встречаясь на границе двух слоев. Головки фосфолипидов обращены наружу, один слой обращен внутрь клетки, а другой — наружу (рис. 3.1.1).
Рисунок 3.1.1 – Структура фосфолипидов и бислой: Молекула фосфолипидов состоит из полярной фосфатной «головы», которая является гидрофильной, и неполярного липидного «хвоста», который является гидрофобным. Ненасыщенные жирные кислоты вызывают изгибы гидрофобных хвостов. Фосфолипидный бислой состоит из двух соседних листов фосфолипидов, расположенных хвост к хвосту. Гидрофобные хвосты связываются друг с другом, образуя внутреннюю часть мембраны. Полярные головки контактируют с жидкостью внутри и снаружи клетки.Фосфатная группа отрицательно заряжена, что делает головку полярной и гидрофильной — или «водолюбивой». Гидрофильная молекула (или участок молекулы) притягивается к воде. Таким образом, фосфатные головки притягиваются к молекулам воды как внеклеточной, так и внутриклеточной среды. Липидные хвосты, с другой стороны, не заряжены, или неполярны, и гидрофобны, или «боятся воды». Гидрофобная молекула (или участок молекулы) отталкивается и отталкивается водой.Таким образом, фосфолипиды представляют собой амфипатические молекулы. Амфипатическая молекула содержит как гидрофильную, так и гидрофобную области. На самом деле, мыло работает для удаления масляных и жирных пятен, потому что оно обладает амфипатическими свойствами. Гидрофильная часть может растворяться в воде для стирки, в то время как гидрофобная часть может задерживать жир в пятнах, которые затем можно смыть. Аналогичный процесс происходит в вашей пищеварительной системе, когда соли желчных кислот (образованные из холестерина, фосфолипидов и соли) помогают расщеплять поглощенные липиды.
Поскольку фосфатные группы полярны и гидрофильны, они притягиваются к воде во внутриклеточной жидкости. Внутриклеточная жидкость (ICF) — это жидкость внутри клетки. Фосфатные группы также притягиваются к внеклеточной жидкости. Внеклеточная жидкость (ECF) представляет собой жидкую среду вне оболочки клеточной мембраны (см. рисунок выше). Поскольку липидные хвосты гидрофобны, они встречаются во внутренней области мембраны, исключая из этого пространства водянистую внутриклеточную и внеклеточную жидкость.В дополнение к фосфолипидам и холестерину клеточная мембрана содержит множество белков, подробно описанных в следующем разделе.
Мембранные белки
Липидный бислой образует основу клеточной мембраны, но он приправлен различными белками. Два различных типа белков, которые обычно связаны с клеточной мембраной, — это интегральный белок и периферический белок (рис. 3.1.2). Как следует из названия, интегральный белок представляет собой белок, встроенный в мембрану.Существует множество различных типов интегральных белков, каждый из которых выполняет различные функции. Например, интегральный белок, который расширяет отверстие через мембрану для проникновения ионов в клетку или выхода из нее, известен как канальный белок. Периферийные белки обычно находятся на внутренней или внешней поверхности липидного двойного слоя, но также могут быть присоединены к внутренней или внешней поверхности интегрального белка.
Рисунок 3.1.2- Клеточная мембрана: Клеточная мембрана клетки представляет собой двойной слой фосфолипидов, содержащий множество различных молекулярных компонентов, включая белки и холестерин, некоторые из которых имеют присоединенные углеводные группы.Некоторые интегральные белки служат распознаванием клеток или белками поверхностной идентичности, которые маркируют клеточную идентичность, чтобы ее могли распознавать другие клетки. Некоторые интегральные белки действуют как ферменты или участвуют в клеточной адгезии между соседними клетками. Рецептор представляет собой тип распознающего белка, который может избирательно связывать конкретную молекулу вне клетки, и это связывание вызывает химическую реакцию внутри клетки. Некоторые интегральные белки выполняют двойную роль как рецептора, так и ионного канала.Одним из примеров взаимодействия рецептор-канал являются рецепторы на нервных клетках, которые связывают нейротрансмиттеры, такие как дофамин. Когда молекула дофамина связывается с белком-рецептором дофамина, канал внутри трансмембранного белка открывается, позволяя определенным ионам поступать в клетку. Периферические белки часто связаны с интегральными белками внутренней клеточной мембраны, где они играют роль в клеточной передаче сигналов или прикреплении к внутренним клеточным компонентам (т.е. цитоскелету, обсуждаемому позже).
Некоторые интегральные мембранные белки являются гликопротеинами.Гликопротеин представляет собой белок, к которому присоединены молекулы углеводов, которые распространяются во внеклеточную среду. Прикрепленные углеводные метки к гликопротеинам помогают распознавать клетки. Углеводы, происходящие из мембранных белков и даже из некоторых мембранных липидов, вместе образуют гликокаликс. Гликокаликс представляет собой нечеткое покрытие вокруг клетки, образованное из гликопротеинов и других углеводов, прикрепленных к клеточной мембране. Гликокаликс может играть различные роли.Например, у него могут быть молекулы, которые позволяют клетке связываться с другой клеткой, он может содержать рецепторы для гормонов или ферменты для расщепления питательных веществ. Гликокалицы, обнаруженные в организме человека, являются продуктом генетической структуры этого человека. Они придают каждой из триллионов клеток человека «идентичность» принадлежности к телу человека. Эта идентичность является основным способом, которым клетки иммунной защиты человека «знают» не атаковать собственные клетки тела человека, но это также причина, по которой органы, пожертвованные другим человеком, могут быть отвергнуты.
Транспорт через клеточную мембрану
Одним из величайших чудес клеточной мембраны является ее способность регулировать концентрацию веществ внутри клетки. Эти вещества включают ионы, такие как Ca ++ , Na + , K + и Cl – , питательные вещества, включая сахара, жирные кислоты и аминокислоты, а также продукты жизнедеятельности, особенно двуокись углерода (CO 2). ), который должен покинуть ячейку.
Липидная двухслойная структура мембраны обеспечивает первый уровень контроля.Фосфолипиды плотно упакованы, а внутренняя часть мембраны гидрофобна. Эта структура делает мембрану избирательно проницаемой. Мембрана с избирательной проницаемостью позволяет проходить через нее без посторонней помощи только веществам, отвечающим определенным критериям. В случае клеточной мембраны через липидный бислой могут перемещаться только относительно небольшие неполярные материалы (помните, липидные хвосты мембраны неполярны). Некоторыми примерами из них являются другие липиды, кислород и углекислый газ, а также спирт.Однако водорастворимые материалы, такие как глюкоза, аминокислоты и электролиты, нуждаются в некоторой помощи, чтобы пересечь мембрану, потому что они отталкиваются гидрофобными хвостами фосфолипидного двойного слоя. Все вещества, которые проходят через мембрану, делают это одним из двух основных способов, которые классифицируются в зависимости от того, требуется ли энергия. Пассивный транспорт – это перемещение веществ через мембрану без затрат клеточной энергии. Напротив, активный транспорт — это перемещение веществ через мембрану с использованием энергии аденозинтрифосфата (АТФ).
Пассивный транспорт
Чтобы понять , как вещества пассивно перемещаются через клеточную мембрану, необходимо понять градиенты концентрации и диффузию. Градиент концентрации — это разница концентрации вещества в пространстве. Молекулы (или ионы) будут распространяться/диффундировать из того места, где они более сконцентрированы, туда, где они менее сконцентрированы, пока они не будут равномерно распределены в этом пространстве. (Когда молекулы движутся таким образом, говорят, что они перемещаются 90 428 вниз по градиенту своей концентрации, 90 429, от высокой концентрации к низкой концентрации.) Диффузия — это перемещение частиц из области с более высокой концентрацией в область с более низкой концентрацией. Несколько общих примеров помогут проиллюстрировать эту концепцию. Представьте, что вы находитесь в закрытой комнате. Если распылить флакон с духами, молекулы аромата естественным образом диффундируют из того места, где они оставили флакон, во все углы комнаты, и это распространение будет продолжаться до тех пор, пока молекулы не будут равномерно распределены в комнате. Другой пример — ложка сахара, помещенная в чашку чая.В конце концов сахар будет диффундировать по чаю до тех пор, пока не останется градиента концентрации. В обоих случаях, если в комнате теплее или чай горячее, диффузия происходит еще быстрее, поскольку молекулы сталкиваются друг с другом и распространяются быстрее, чем при более низких температурах.
Внешний веб-сайт
Посетите эту ссылку, чтобы увидеть диффузию и то, как она приводится в движение кинетической энергией молекул в растворе. Как температура влияет на скорость диффузии и почему?
Всякий раз, когда вещество находится в большей концентрации на одной стороне полупроницаемой мембраны, такой как клеточные мембраны, любое вещество, которое может перемещаться по градиенту своей концентрации через мембрану, будет делать это.Если вещества могут перемещаться через клеточную мембрану без затрат энергии клеткой, то движение молекул называется пассивным транспортом. Рассмотрим вещества, которые могут легко диффундировать через липидный бислой клеточной мембраны, такие как газы кислород (O 2 ) и углекислый газ (CO 2 ). Эти небольшие жирорастворимые газы и другие небольшие жирорастворимые молекулы могут растворяться в мембране и входить или выходить из клетки в соответствии с градиентом их концентрации. Этот механизм перемещения молекул через клеточную мембрану со стороны, где они более сконцентрированы, в сторону, где они менее сконцентрированы, представляет собой форму пассивного транспорта, называемого простой диффузией. O 2 обычно диффундирует в клетки, потому что он более сконцентрирован вне их, а CO 2 обычно диффундирует из клеток, потому что он более сконцентрирован внутри них.
Прежде чем двигаться дальше, важно понять, что градиенты концентрации кислорода и углекислого газа всегда будут существовать в живой клетке и никогда не достигнут одинакового распределения. Это связано с тем, что клетки быстро расходуют кислород во время метаболизма, поэтому обычно внутри клетки концентрация O 2 ниже, чем снаружи.В результате кислород будет диффундировать извне клетки непосредственно через липидный бислой мембраны в цитоплазму внутри клетки. С другой стороны, поскольку клетки производят CO 2 как побочный продукт метаболизма, концентрации CO 2 повышаются в цитоплазме; следовательно, CO 2 будет перемещаться из клетки через липидный бислой во внеклеточную жидкость, где его концентрация ниже. (Рисунок 3.1.3).
Рисунок 3.1.3 – Простая диффузия через клеточную (плазменную) мембрану: Структура липидного двойного слоя позволяет небольшим незаряженным веществам, таким как кислород и углекислый газ, и гидрофобным молекулам, таким как липиды, проходить через клеточную мембрану вниз градиент их концентрации путем простой диффузии.Большие полярные или ионные молекулы, которые являются гидрофильными, не могут легко пересекать бислой фосфолипидов. Заряженные атомы или молекулы любого размера не могут пересечь клеточную мембрану посредством простой диффузии, поскольку заряды отталкиваются гидрофобными хвостами внутри двойного слоя фосфолипидов. Растворенные вещества, растворенные в воде по обе стороны от клеточной мембраны, имеют тенденцию диффундировать вниз по градиенту их концентрации, но поскольку большинство веществ не могут свободно проходить через липидный бислой клеточной мембраны, их движение ограничено белковыми каналами и специализированными транспортными механизмами в мембране. . Облегченная диффузия — это процесс диффузии, используемый для тех веществ, которые не могут пересечь липидный бислой из-за своего размера, заряда и/или полярности, но делают это по градиенту концентрации (рис. 3.1.4). Например, хотя ионы натрия (Na + ) высококонцентрированы вне клеток, эти электролиты заряжены и не могут пройти через неполярный липидный бислой мембраны. Их диффузии способствуют мембранные белки, которые образуют натриевые каналы (или «поры»), так что ионы Na+ могут перемещаться по градиенту концентрации извне клеток внутрь клеток.Типичным примером облегченной диффузии с использованием белка-носителя является перемещение глюкозы в клетку, где она используется для производства АТФ. Хотя глюкоза может быть более концентрированной вне клетки, она не может пересечь липидный бислой путем простой диффузии, потому что она большая и полярная и, следовательно, отталкивается фосфолипидной мембраной. Чтобы решить эту проблему, специальный белок-носитель, называемый переносчиком глюкозы, будет переносить молекулы глюкозы в клетку, чтобы облегчить ее внутреннюю диффузию.Отличие канала от носителя состоит в том, что носитель обычно меняет форму в процессе диффузии, а канал — нет. Есть много других растворенных веществ, которые должны подвергаться облегченной диффузии, чтобы попасть в клетку, например, аминокислоты, или выйти из клетки, например, отходы.
Рисунок 3.1.4 – Облегченная диффузия: (a) Облегченная диффузия веществ через клеточную (плазматическую) мембрану происходит с помощью таких белков, как канальные белки и белки-переносчики.Канальные белки менее избирательны, чем белки-переносчики, и обычно слабо различают свой груз в зависимости от размера и заряда. (b) Белки-носители более избирательны, часто позволяя пересекаться только одному определенному типу молекул.Осмос
Специальным примером облегченного транспорта является перемещение воды через клеточную мембрану всех клеток через белковые каналы, известные как аквапорины. Осмос — это диффузия воды через полупроницаемую мембрану из места, где относительное количество воды больше, туда, где относительное количество воды меньше (по градиенту концентрации воды) (рис. 3.1.5).
Рисунок 3.1.5 – Осмос: Осмос – это диффузия воды через полупроницаемую мембрану по градиенту ее концентрации. Если мембрана проницаема для воды, но не для растворенного вещества, вода уравняет свою концентрацию, диффундируя в сторону с более низкой концентрацией воды (и, следовательно, в сторону с более высокой концентрацией растворенного вещества). В стакане слева раствор справа от мембраны гипертоничен.Сами по себе клетки не могут регулировать движение молекул воды через свою мембрану, поэтому важно, чтобы клетки находились в среде, в которой концентрация растворенных веществ вне клеток (во внеклеточной жидкости) равна концентрации растворенные вещества внутри клеток (в цитоплазме).Два раствора с одинаковой концентрацией растворенных веществ называются изотоническими (равное напряжение). Когда клетки и их внеклеточная среда изотоничны, концентрация молекул воды одинакова снаружи и внутри клеток, и клетки сохраняют свою нормальную форму (и функцию).
Осмос возникает, когда существует дисбаланс растворенных веществ вне клетки по сравнению с внутри клетки. Раствор, который имеет более высокую концентрацию растворенных веществ, чем другой раствор, называется гипертоническим , и молекулы воды имеют тенденцию диффундировать в гипертонический раствор (рис. 3.1.6). Клетки в гипертоническом растворе сморщиваются, когда вода выходит из клетки посредством осмоса. Напротив, раствор, который имеет более низкую концентрацию растворенных веществ, чем другой раствор, называется гипотоническим , и молекулы воды имеют тенденцию диффундировать из гипотонического раствора. Клетки в гипотоническом растворе будут поглощать слишком много воды и набухать, рискуя в конечном итоге лопнуть. Важнейшим аспектом гомеостаза живых существ является создание внутренней среды, в которой все клетки тела находятся в изотоническом растворе.Различные системы органов, особенно почки, работают для поддержания этого гомеостаза.
Рисунок 3.1.6 – Концентрация раствора: В гипертоническом растворе концентрация растворенного вещества выше, чем в другом растворе. Изотонический раствор имеет концентрацию растворенного вещества, равную концентрации другого раствора. Гипотонический раствор имеет более низкую концентрацию растворенного вещества, чем другой раствор.Активный транспорт
При всех описанных выше способах транспортировки клетка не расходует энергию.Мембранные белки, которые помогают в пассивном транспорте веществ, делают это без использования АТФ. При первично-активном транспорте АТФ необходима для перемещения вещества через мембрану с помощью мембранного белка и против градиента его концентрации.
Один из наиболее распространенных видов активного транспорта включает белки, которые служат насосами. Слово «насос», вероятно, вызывает в воображении мысли об использовании энергии для накачивания шины велосипеда или баскетбольного мяча. Точно так же энергия АТФ требуется этим мембранным белкам для переноса веществ — молекул или ионов — через мембрану против градиента их концентрации (из области с низкой концентрацией в область с высокой концентрацией).
Натрий-калиевый насос , который также называется Na + /K + АТФаза, транспортирует натрий из клетки, одновременно перемещая калий в клетку. Насос Na + /K + является важным ионным насосом, присутствующим в мембранах всех клеток. Активность этих насосов в нервных клетках настолько велика, что на нее приходится большая часть их использования АТФ.
Рисунок 3.1.7 Натрий-калиевый насос обнаружен во многих клеточных (плазматических) мембранах.Приводимый в действие АТФ, насос перемещает ионы натрия и калия в противоположных направлениях, каждый против своего градиента концентрации. За один цикл насоса три иона натрия вытесняются из клетки, а два иона калия импортируются в клетку.Активные транспортные насосы могут также работать вместе с другими активными или пассивными транспортными системами для перемещения веществ через мембрану. Например, натрий-калиевый насос поддерживает высокую концентрацию ионов натрия вне клетки. Следовательно, если клетке нужны ионы натрия, все, что ей нужно сделать, это открыть пассивный натриевый канал, поскольку градиент концентрации ионов натрия заставит их диффундировать в клетку.Таким образом, действие активного транспортного насоса (натрий-калиевого насоса) обеспечивает пассивный транспорт ионов натрия за счет создания градиента концентрации. Когда активный транспорт обеспечивает транспорт другого вещества таким образом, это называется вторичным активным транспортом.
Симпортеры — это вторичные активные переносчики, которые перемещают два вещества в одном направлении. Например, симпортер натрий-глюкоза использует ионы натрия для «втягивания» молекул глюкозы в клетку. Поскольку клетки хранят глюкозу для получения энергии, глюкоза обычно находится в более высокой концентрации внутри клетки, чем снаружи; однако из-за действия натрий-калиевого насоса ионы натрия легко диффундируют в клетку, когда симпортер открыт.Поток ионов натрия через симпортер обеспечивает энергию, которая позволяет глюкозе двигаться через симпортер в клетку против градиента ее концентрации.
И наоборот, антипортеры представляют собой вторичные активные транспортные системы, которые транспортируют вещества в противоположных направлениях. Например, антипортер ионов натрия и водорода использует энергию поступающего внутрь потока ионов натрия для перемещения ионов водорода (H + ) из клетки. Натрий-водородный антипортер используется для поддержания pH внутри клетки.
Прочие виды мембранного транспорта
Другие формы активного транспорта не включают мембранных носителей. Эндоцитоз (введение «в клетку») представляет собой процесс поглощения клетками материала путем его обволакивания частью своей клеточной мембраны и последующего отщипывания этой части мембраны (рис. 3.1.8). После отщипывания часть мембраны и ее содержимое становится самостоятельным внутриклеточным пузырьком. Везикула представляет собой мембранозный мешок — сферическую полую органеллу, ограниченную двухслойной липидной мембраной.Эндоцитоз часто приносит в клетку материалы, которые необходимо расщепить или переварить. Фагоцитоз («поедание клеток») — эндоцитоз крупных частиц. Многие иммунные клетки участвуют в фагоцитозе вторгшихся патогенов. Как и маленькие пакмены, их работа состоит в том, чтобы патрулировать ткани тела на наличие нежелательных веществ, таких как вторжение бактериальных клеток, их фагоцитирование и переваривание. В отличие от фагоцитоза, пиноцитоз («питье клетки») через мембранные везикулы доставляет в клетку жидкость, содержащую растворенные вещества.
Рисунок 3.1.8 – Три формы эндоцитоза: Эндоцитоз – это форма активного транспорта, при которой клетка окутывает внеклеточные материалы с помощью своей клеточной мембраны. (а) При фагоцитозе, который является относительно неселективным, клетка захватывает крупные частицы в более крупные везикулы, известные как вакуоли. (б) При пиноцитозе клетка поглощает мелкие частицы жидкости. (c) Напротив, эндоцитоз, опосредованный рецепторами, является довольно избирательным. Когда внешние рецепторы связывают специфический лиганд, клетка отвечает эндоцитозом лиганда.Фагоцитоз и пиноцитоз захватывают большие порции внеклеточного материала, и они, как правило, не обладают высокой избирательностью в отношении вводимых веществ. Клетки регулируют эндоцитоз определенных веществ посредством эндоцитоза, опосредованного рецепторами. Рецептор-опосредованный эндоцитоз — это эндоцитоз участка клеточной мембраны, который содержит множество рецепторов, специфичных для определенного вещества. Как только поверхностные рецепторы связывают достаточное количество специфического вещества (лиганда рецептора), клетка эндоцитирует часть клеточной мембраны, содержащую комплексы рецептор-лиганд.Железо, необходимый компонент гемоглобина, таким образом эндоцитируется красными кровяными тельцами. Железо связано с белком, называемым трансферрином в крови. Специфические рецепторы трансферрина на поверхности эритроцитов связывают молекулы железо-трансферрин, и клетка эндоцитирует комплексы рецептор-лиганд.
В отличие от эндоцитоза, экзоцитоз («извлечение из клетки») представляет собой процесс клеточного экспорта материала с помощью везикулярного транспорта (рис. 3.1.9). Многие клетки производят вещества, которые должны выделяться, как фабрика, производящая продукт на экспорт.Эти вещества обычно упакованы в мембраносвязанные везикулы внутри клетки. Когда мембрана везикул сливается с клеточной мембраной, везикула высвобождает свое содержимое в интерстициальную жидкость. Затем мембрана везикул становится частью клеточной мембраны.
Конкретные примеры экзоцитоза включают клетки желудка и поджелудочной железы, продуцирующие и секретирующие пищеварительные ферменты посредством экзоцитоза (рис. 3.1.10), и эндокринные клетки, продуцирующие и секретирующие гормоны, которые разносятся по всему телу.
Добавление новой мембраны к плазматической мембране обычно сопровождается эндоцитозом, так что клетка не увеличивается постоянно. Благодаря этим процессам клеточная мембрана постоянно обновляется и изменяется по мере необходимости.
Рисунок 3.1.9 – Экзоцитоз: Экзоцитоз очень похож на эндоцитоз наоборот. Материал, предназначенный для экспорта, упаковывается в везикулу внутри клетки. Мембрана везикулы срастается с клеточной мембраной, и содержимое выходит во внеклеточное пространство. Рисунок 3.1.10 – Ферментные продукты клеток поджелудочной железы: Ацинарные клетки поджелудочной железы производят и секретируют множество ферментов, которые переваривают пищу. Крошечные черные гранулы на этой электронной микрофотографии представляют собой секреторные пузырьки, заполненные ферментами, которые будут экспортироваться из клеток посредством экзоцитоза. LM × 2900. (Микрофотография предоставлена Регентами Медицинской школы Мичиганского университета © 2012)Болезни клеток: кистозный фиброз
Кистозный фиброз (МВ) поражает приблизительно 30 000 человек в Соединенных Штатах, и ежегодно регистрируется около 1 000 новых случаев.Это генетическое заболевание наиболее известно своим поражением легких, вызывающим затрудненное дыхание и хронические легочные инфекции, но оно также поражает печень, поджелудочную железу и кишечник. Всего около 50 лет назад прогноз для детей, рожденных с муковисцидозом, был очень мрачным — ожидаемая продолжительность жизни редко превышала 10 лет. Сегодня, благодаря достижениям в лечении, многие пациенты с муковисцидозом доживают до 30 лет.
Симптомы муковисцидоза возникают из-за неисправности мембранного ионного канала, называемого регулятором трансмембранной проводимости при муковисцидозе, или CFTR.У здоровых людей белок CFTR является интегральным мембранным белком, который транспортирует ионы Cl– из клетки. У человека с муковисцидозом мутирует ген CFTR, поэтому клетка вырабатывает дефектный канальный белок, который обычно не встраивается в мембрану, а вместо этого разрушается клеткой.
Для функционирования CFTR требуется АТФ, что делает его транспорт Cl– формой активного транспорта. Это долгое время озадачивало исследователей, потому что ионы Cl– на самом деле текут вниз по градиенту их концентрации при транспортировке из клеток.Активный транспорт обычно перекачивает ионы против градиента их концентрации , но CFTR представляет собой исключение из этого правила.
В нормальной легочной ткани перемещение Cl– из клетки поддерживает богатую Cl– отрицательно заряженную среду непосредственно вне клетки. Это особенно важно для эпителиальной выстилки дыхательной системы. Клетки респираторного эпителия выделяют слизь, которая служит для улавливания пыли, бактерий и другого мусора. Ресничка (множественное число = реснички) — это один из волосовидных придатков, обнаруженных на некоторых клетках.Реснички на эпителиальных клетках перемещают слизь и ее захваченные частицы вверх по дыхательным путям от легких и наружу. Чтобы эффективно продвигаться вверх, слизь не может быть слишком вязкой, скорее, она должна иметь жидкую, водянистую консистенцию. Транспорт Cl– и поддержание электроотрицательной среды за пределами клетки притягивает положительные ионы, такие как Na+, во внеклеточное пространство. Накопление ионов Cl– и Na+ во внеклеточном пространстве создает богатую растворенными веществами слизь с низкой концентрацией молекул воды.В результате посредством осмоса вода из клеток и внеклеточного матрикса переходит в слизь, «разжижая» ее. В нормальной дыхательной системе именно так слизь остается достаточно разбавленной, чтобы ее можно было вывести из дыхательной системы.
Если канал CFTR отсутствует, ионы Cl– не транспортируются из клетки в достаточном количестве, что не позволяет им притягивать положительные ионы. Отсутствие ионов в секретируемой слизи приводит к отсутствию нормального градиента концентрации воды.Таким образом, нет осмотического давления, втягивающего воду в слизь. Образующаяся слизь густая и липкая, и мерцательный эпителий не может эффективно удалить ее из дыхательной системы. Проходы в легких блокируются слизью вместе с мусором, который она несет. Бактериальные инфекции возникают легче, потому что бактериальные клетки не эффективно удаляются из легких.
Обзор главыКлеточная мембрана обеспечивает барьер вокруг клетки, отделяя ее внутренние компоненты от внеклеточной среды.Он состоит из двойного фосфолипидного слоя с гидрофобными внутренними липидными «хвостами» и гидрофильными внешними фосфатными «головками». Различные мембранные белки разбросаны по всему бислою, как встроенные в него, так и прикрепленные к нему периферически. Клеточная мембрана избирательно проницаема, что позволяет лишь ограниченному количеству материалов диффундировать через липидный бислой. Все материалы, которые пересекают мембрану, делают это с помощью пассивных (не требующих энергии) или активных (требующих энергии) транспортных процессов.Во время пассивного транспорта вещества перемещаются путем простой диффузии или облегченной диффузии через мембрану по градиенту их концентрации. Вода проходит через мембрану в процессе диффузии, называемом осмосом. Во время активного транспорта расходуется энергия, чтобы способствовать движению вещества через мембрану в направлении против градиента их концентрации. Активный транспорт может осуществляться с помощью белковых насосов или с помощью везикул.
Вопросы по интерактивной ссылкеПосетите эту ссылку, чтобы увидеть диффузию и то, как она приводится в движение кинетической энергией молекул в растворе.Как температура влияет на скорость диффузии и почему?
Более высокие температуры ускоряют диффузию, потому что молекулы имеют большую кинетическую энергию при более высоких температурах.
Контрольные вопросы
Вопросы критического мышления
Какие материалы могут легко диффундировать через липидный бислой и почему?
Только материалы, которые являются относительно небольшими и неполярными, могут легко диффундировать через липидный бислой.Крупные частицы не могут поместиться между отдельными фосфолипидами, которые упакованы вместе, а полярные молекулы отталкиваются гидрофобными/неполярными липидами, которые выстилают внутреннюю часть бислоя.
Почему рецептор-опосредованный эндоцитоз считается более избирательным, чем фагоцитоз или пиноцитоз?
Рецептор-опосредованный эндоцитоз является более избирательным, поскольку вещества, которые вводятся в клетку, представляют собой специфические лиганды, которые могут связываться с эндоцитозируемыми рецепторами.Фагоцитоз или пиноцитоз, с другой стороны, не имеют такой специфичности рецептор-лиганд и вносят любые материалы, которые оказываются близко к мембране, когда она покрыта оболочкой.
Что общего между осмосом, диффузией, фильтрацией и перемещением ионов от одинакового заряда? Чем они отличаются?
Эти четыре явления схожи в том смысле, что они описывают движение веществ по определенному типу градиента. Осмос и диффузия связаны с перемещением воды и других веществ по градиенту их концентрации соответственно.Фильтрация описывает движение частиц по градиенту давления, а движение ионов от одинакового заряда описывает их движение по градиенту электрического поля.
Регулируют ли транспортеры ABC организацию плазматической мембраны? | Cellular & Molecular Biology Letters
Коулман Дж.А., Квази Ф., Молдей Р.С. Р4-АТФазы млекопитающих и транспортеры ABC и их роль в транспорте фосфолипидов. Липиды Biochim BiophActa Mol Cell Biol. 1831; 2013: 555–74.
Google Scholar
Роби Р.В., Плучино К.М., Холл М.Д., Фойо А.Т., Бейтс С.Е., Готтесман М.М.Пересматривая роль транспортеров ABC при раке с множественной лекарственной устойчивостью. Нат Рев Рак. 2018;18:452–64.
КАС пабмед ПабМед Центральный Google Scholar
Певица С.Дж., Николсон Г.Л. Жидкостно-мозаичная модель строения клеточных мембран. Наука. 1972;175(80):720–31.
КАС пабмед Google Scholar
Danielli JF, Davson H. Вклад в теорию проницаемости тонких пленок.J Cell Comp Physiol. 1935; 5: 495–508.
КАС Google Scholar
Фрай Л.Д., Эдидин М. Быстрое смешение антигенов клеточной поверхности после образования гетерокарионов мыши-человека. Дж. Клеточные науки. 1970;7.
Николсон Г.Л. Трансмембранный контроль рецепторов на нормальных и опухолевых клетках. I. Цитоплазматическое влияние на компоненты клеточной поверхности. ВВА. 1976; 457: 57–108.
КАС пабмед Google Scholar
Николсон Г.Л.Жидкостно-мозаичная модель мембранной структуры: все еще актуальна для понимания структуры, функции и динамики биологических мембран спустя более 40 лет. Биохим Биофиз Акта Биомембр. 1838; 2014: 1451–66.
Google Scholar
Саймонс К., Ван Меер Г. Сортировка липидов в эпителиальных клетках. Биохимия. 1988; 27: 6197–202.
КАС пабмед Google Scholar
Иконен Э., Саймонс К.Сортировка белков и липидов от транс-сети Гольджи к плазматической мембране в поляризованных клетках. Semin Cell Dev Biol. 1998; 9: 503–9.
КАС пабмед Google Scholar
Хьорт Ипсен Дж., Карлстрём Г., Муртисен О.Г., Веннерстрём Х., Цукерманн М.Ю. Фазовые равновесия в системе фосфатидилхолин-холестерин. ВВА. 1987; 905: 162–72.
Google Scholar
Саймонс К., Ваз ВЛК.Модельные системы, липидные рафты и клеточные мембраны. Annu Rev Biophys Biomol Struct. 2004; 33: 269–95.
КАС пабмед Google Scholar
Lin WC, Blanchette CD, Ratto TV, Longo ML. Асимметрия липидов в липидных бислоях, поддерживаемых DLPC/DSPC: комбинированное исследование с помощью АСМ и флуоресцентной микроскопии. Биофиз Дж. 2006; 90: 228–37.
КАС пабмед Google Scholar
Марш Д.Холестерин-индуцированные домены жидкой мембраны: сборник тройных фазовых диаграмм липид-плот. Биохим Биофиз Акта Биомембр. 1788; 2009: 2114–23.
Google Scholar
Браун Д.А., Роуз Дж.К. Сортировка GPI-заякоренных белков в мембранные субдомены, обогащенные гликолипидами, во время транспорта к апикальной клеточной поверхности. Клетка. 1992; 68: 533–44.
КАС пабмед Google Scholar
Браун Д.А., Лондон Э.Функции липидных рафтов в биологических мембранах. Annu Rev Cell Dev Biol. 1998; 14:111–36.
КАС пабмед Google Scholar
Лингвуд Д., Саймонс К. Липидные рафты как мембраноорганизующий принцип. Наука. 2010;327(80):46–50.
КАС пабмед Google Scholar
Макинтош Т.Дж., Видал А., Саймон С.А. Сортировка липидов и трансмембранных пептидов между растворимыми в детергентах бислоями и рафтами, устойчивыми к детергентам.Биофиз Дж. 2003; 85: 1656–66.
КАС пабмед ПабМед Центральный Google Scholar
Сево С., Эдди Р.Дж., Максфилд Ф.Р., Пьерини Л.М. Зависимая от цитоскелета сегрегация мембранных доменов во время поляризации нейтрофилов. Мол Биол Селл. 2001; 12:3550–62.
КАС пабмед ПабМед Центральный Google Scholar
фон Халлер П.Д., Донохью С., Гудлетт Д.Р., Эберсолд Р., Уоттс Д.Д.Масс-спектрометрическая характеристика белков, выделенных из мембранных доменов, устойчивых к детергентам Т-клеток Jurkat. Протеомика. 2001; 1:1010–21.
Google Scholar
Ланглет С., Бернард А.М., Древот П., Х. Х. Мембранные рафты и передача сигналов многоцепочечными иммунными рецепторами распознавания. Курр Опин Иммунол. 2000;12:250–5.
КАС пабмед Google Scholar
Древот П., Ланглет С., Го XJ, Бернард А.М., Колар О., Шовен Д.П. и др.Механизм инициации сигнала TCR предварительно собран и активирован в подмножестве мембранных рафтов. EMBO J. 2002; 21: 1899–908.
КАС пабмед ПабМед Центральный Google Scholar
Harder T, Engelhardt KR. Мембранные домены в лимфоцитах — от липидных рафтов до белковых каркасов. Движение. 2004; 5: 265–75.
КАС пабмед Google Scholar
Куби Р., Матас Л.А., Поу М., Агилера Х., Гил К.Дифференциальная чувствительность к детергентам актинового цитоскелета от нервных окончаний. Биохим Биофиз Акта Биомембр. 1828; 2013: 2385–93.
Google Scholar
Молнар Э., Свами М., Хольцер М., Бек-Гарсия К., Ворч Р., Тиле С. и др. Холестерин и сфингомиелин управляют лиганд-независимым формированием нанокластеров Т-клеточного антигенного рецептора. Дж. Биол. Хим. 2012; 287:42664–74.
ПабМед ПабМед Центральный Google Scholar
Джейнс П.В., Лей С.К., Маги А.И.Агрегация липидных рафтов сопровождает передачу сигналов через Т-клеточный антигенный рецептор. Джей Селл Биол. 1999; 147:447–61.
КАС пабмед ПабМед Центральный Google Scholar
Zhang W, Trible RP, Samelson LE. Пальмитоилирование LAT: его важная роль в нацеливании на мембранные микродомены и фосфорилировании тирозина во время активации Т-клеток. Иммунитет. 1998; 9: 239–46.
КАС пабмед Google Scholar
Джейнс П.В., Лей С.К., Маги А.И., Кабуридис П.С.Роль липидных рафтов в передаче сигналов Т-клеточного антигенного рецептора (TCR). Семин Иммунол. 2000;12:23–34.
КАС пабмед Google Scholar
Gaus K, Chklovskaia E, Fazekas De St. Groth B, Jessup W, Harder T. Конденсация плазматической мембраны в месте активации Т-лимфоцитов. Джей Селл Биол. 2005; 171:121–31.
КАС пабмед ПабМед Центральный Google Scholar
Зех Т., Эйсинг К.С., Гаус К., Де Вет Б., Шевченко А., Саймонс К. и др.Накопление плотных липидов в доменах плазматической мембраны Т-клеток, участвующих в передаче сигналов TCR. EMBO J. 2009; 28: 466–76.
КАС пабмед ПабМед Центральный Google Scholar
Кабуридис П.С., Янзен Дж., Маги А.Л., Лей С.К. Истощение холестерина разрушает липидные рафты и модулирует активность множественных сигнальных путей в Т-лимфоцитах. Евр Дж Иммунол. 2000;30:954–63.
КАС пабмед Google Scholar
Гнядецки Р.Истощение мембранного холестерина вызывает лиганд-независимую активацию Fas и апоптоз. Biochem Biophys Res Commun. 2004; 320:165–9.
КАС пабмед Google Scholar
Зидовецки Р., Левитан И. Использование циклодекстринов для управления содержанием холестерина в плазматической мембране: доказательства, заблуждения и стратегии контроля. Биохим Биофиз Акта Биомембр. 1768; 2007: 1311–24.
Google Scholar
Кусуми А., Шираи Ю.М., Кояма-Хонда И., Судзуки К.Н., Фудзивара Т.К.Иерархическая организация плазматической мембраны: исследования с помощью отслеживания одиночных молекул в сравнении с корреляционной спектроскопией флуоресценции. ФЭБС лат. 2010; 584:1814–23.
КАС пабмед Google Scholar
Yechiel E, Edidin M. Микрометрические домены в плазматических мембранах фибробластов. Джей Селл Биол. 1987; 105: 755–60.
КАС пабмед Google Scholar
Ваврезиник Л., Риньо Х., Марге Д., Ленн П.Ф.Законы диффузии корреляционной спектроскопии флуоресценции для исследования субмикронной клеточной мембранной организации. Биофиз Дж. 2005; 89: 4029–42.
КАС пабмед ПабМед Центральный Google Scholar
Lenne PF, Wawrezinieck L, Conchonaud F, Wurtz O, Boned A, Guo XJ, et al. Динамическое молекулярное удержание в плазматической мембране микродоменами и сеткой цитоскелета. EMBO J. 2006; 25:3245–56.
КАС пабмед ПабМед Центральный Google Scholar
Х-Т, Марге Д.Обнаружение нанодоменов в живой клеточной мембране с помощью флуоресцентной корреляционной спектроскопии. Annu Rev Phys Chem. 2011;62:417–36.
КАС пабмед Google Scholar
Mailfert S, Hamon Y, Bertaux N, He HT, Marguet D. Руководство пользователя по характеристике субдоменов плазматической мембраны в живых клетках с помощью корреляционной спектроскопии флуоресценции с изменением пятна. Методы клеточной биологии. 2017; 139:1–22.
КАС пабмед Google Scholar
Петрашек З., Швилле П.Точное измерение коэффициентов диффузии с помощью сканирующей флуоресцентной корреляционной спектроскопии. Биофиз Дж. 2008; 94: 1437–48.
ПабМед Google Scholar
Эггелинг С., Рингеманн С., Медда Р., Шварцманн Г., Сандхофф К., Полякова С. и др. Прямое наблюдение за наномасштабной динамикой мембранных липидов в живой клетке. Природа. 2009; 457:1159–62.
КАС пабмед Google Scholar
Рупрехт В., Визер С., Марге Д., Шютц Г.Дж.Корреляционная спектроскопия флуоресценции с точечной вариацией позволяет проводить хроноскопию времени удержания в мембранах со сверхвысоким разрешением. Биофиз Дж. 2011; 100: 2839–45.
КАС пабмед ПабМед Центральный Google Scholar
Блуин С.М., Хамон Ю., Гоннорд П., Буларан С., Каган Дж., Виарис де Лесеньо С. и др. Зависимое от гликозилирования разделение IFN-γR в липидных и актиновых нанодоменах имеет решающее значение для активации JAK. Клетка. 2016; 166: 920–34.
КАС пабмед Google Scholar
Сако Ю., Кусуми А. Компартментальная структура плазматической мембраны для движений рецепторов, выявленная анализом движения на нанометровом уровне. Джей Селл Биол. 1994; 125:1251–64.
КАС пабмед Google Scholar
Fujiwara T, Ritchie K, Murakoshi H, Jacobson K, Kusumi A. Фосфолипиды подвергаются хмелевой диффузии в компартментализованной клеточной мембране.Джей Селл Биол. 2002; 157:1071–81.
КАС пабмед ПабМед Центральный Google Scholar
Субчински В.К., Кусуми А. Динамика молекул-плотов в клетке и искусственных мембранах: подходы с использованием спиновой маркировки импульсным ЭПР и оптической микроскопии одиночных молекул. Биохим Биофиз Акта. 1610; 2003: 231–43.
Google Scholar
Уиллиг К.И., Риццоли С.О., Вестфаль В., Ян Р., Хелл С.В.STED-микроскопия показывает, что синаптотагмин остается сгруппированным после экзоцитоза синаптических пузырьков. Природа. 2006; 440:935–9.
КАС пабмед Google Scholar
Шарма П., Варма Р., Сарасий Р.С., Ира Г.К., Кришнамурти Г. и др. Наноразмерная организация множественных GPI-заякоренных белков в мембранах живых клеток. Клетка. 2004; 116: 577–89.
КАС пабмед Google Scholar
Госвами Д., Гоуришанкар К., Билграми С., Гош С., Рагхупати Р., Чадда Р. и др.Нанокластеры GPI-заякоренных белков формируются в результате активности кортикального актина. Клетка. 2008; 135:1085–97.
КАС пабмед Google Scholar
Lasserre R, Guo XJ, Conchonaud F, Hamon Y, Hawchar O, Bernard AM, et al. Нанодомены Raft способствуют рекрутированию и активации плазматической мембраны Akt/PKB. Nat Chem Biol. 2008; 4: 538–47.
КАС пабмед Google Scholar
Севчик Э., Брамешубер М., Фёльзер М., Вегубер Дж., Хонигманн А., Шютц Г.Й.GPI-заякоренные белки не располагаются в упорядоченных доменах плазматической мембраны живых клеток. Нац коммун. 2015;6.
Hilgemann DW, Feng S, Nasuhoglu C. Сложная и интригующая жизнь PIP2 с ионными каналами и переносчиками. наук СТКЭ. 2001; 2001.
Шуаки-Бенмансур Н., Румински К., Сартр А.М., Фелипот М.С., Саллес А., Бергот Э. и др. Фосфоинозитиды регулируют динамику и активацию мембран комплекса TCR/CD3. Научный представитель 2018;8.
Андерсон Р.Г.В., Джейкобсон К.Клеточная биология: роль липидных оболочек в нацеливании белков на кавеолы, плоты и другие домены липидов. Наука. 2002; 296 (80): 1821–185.
КАС пабмед Google Scholar
Xu C, Gagnon E, Call ME, Schnell JR, Schwieters CD, Carman CV и др. Регуляция активации Т-клеточного рецептора за счет динамического мембранного связывания цитоплазматического мотива на основе тирозина CD3ε. Клетка. 2008; 135: 702–13.
КАС пабмед ПабМед Центральный Google Scholar
Ганьон Э., Шуберт Д.А., Гордо С., Чу Х.Х., Вухерпфенниг К.В.Локальные изменения липидного окружения микрокластеров TCR регулируют связывание мембран цитоплазматическим доменом CD3ε. J Эксперт Мед. 2012;209:2423–39.
КАС пабмед ПабМед Центральный Google Scholar
Нойманн Дж., Роуз-Сперлинг Д., Хельмих Ю.А. Разнообразные отношения между транспортерами ABC и липидами: обзор. Биохим Биофиз Акта Биомембр. 1859; 2017: 605–18.
Google Scholar
Zarubica A, Plazzo AP, Stöckl M, Trombik T, Hamon Y, Müller P, et al.Функциональные последствия влияния ABCA1 на липидное микроокружение плазматической мембраны: биофизическое исследование. FASEB J. 2009; 23:1775–85.
КАС пабмед Google Scholar
Джин Х., Свиридов Д., Лю Ю., Вайсман Б., Аддади Л., Ремалей А.Т. и др. ABCA1 (ATP-связывающий кассетный переносчик A1) опосредует ApoA-I (аполипопротеин a-I) и миметический пептид ApoA-I, мобилизацию микродоменов внеклеточного холестерина, депонированных макрофагами.Артериосклеры Тромб Васк Биол. 2016; 36: 2283–91.
КАС пабмед ПабМед Центральный Google Scholar
Родригес-лима Ф., Фенсом А.С., Джозефс М., Эванс Дж., Вельдман Дж., Катан М. Стеролзависимая трансактивация промотора ABC1 с помощью LXR/RXR. Дж. Биол. Хим. 2000;44.
Лоун Р.М., Уэйд Д.П., Гарвин М.Р., Ван Х., Шварц К., Портер Дж.Г. и др. Продукт гена болезни Танжера ABC1 контролирует путь удаления липидов, опосредованный клеточным аполипопротеином.Джей Клин Инвест. 1999; 104: R25–31.
КАС пабмед ПабМед Центральный Google Scholar
Singaraja RR, Brunham LR, Visscher H, Kastelein JJP, Hayden MR. Отток и атеросклероз: клиническое и биохимическое влияние изменений в гене ABCA1. Артериосклеры Тромб Васк Биол. 2003; 23:1322–32.
КАС пабмед Google Scholar
Иатан И., Альрасади К., Руэль И., Алваили К., Дженест Дж.Влияние мутаций ABCA1 на риск инфаркта миокарда. Curr Atheroscler Rep. 2008; 10:413–26.
КАС пабмед Google Scholar
Ведхачалам С., Дуонг П.Т., Никель М., Нгуен Д., Дханасекаран П., Сайто Х. и др. Механизм АТФ-связывающего кассетного транспортера A1, опосредованного оттоком клеточных липидов к аполипопротеину а-I и образованием частиц липопротеинов высокой плотности. Дж. Биол. Хим. 2007; 282:25123–30.
КАС пабмед Google Scholar
Сорси-Томас М.Г., Оуэн Дж.С., Фулп Б., Бхат С., Чжу Х., Паркс Дж.С. и др.Зарождающиеся липопротеины высокой плотности, образованные ABCA1, напоминают липидные рафты и структурно организованы тремя мономерами апоА-I. J липидный рез. 2012; 53:1890–909.
КАС пабмед ПабМед Центральный Google Scholar
Хрони А., Лю Т., Фитцджеральд М.Л., Фримен М.В., Заннис В.И. Свойства поперечного связывания и оттока липидов мутантов ApoA-I предполагают прямую связь между спиралями ApoA-I и ABCA1. Биохимия. 2004;43:2126–39.
КАС пабмед Google Scholar
Ван Н., Сильвер Д.Л., Костет П., Высокий А.Р. Специфическое связывание ApoA-I, усиление оттока холестерина и изменение морфологии плазматической мембраны в клетках, экспрессирующих ABC1. Дж. Биол. Хим. 2000; 275:33053–8.
КАС пабмед Google Scholar
Филлипс МЦ. Является ли ABCA1 белком, переносящим липиды? J липидный рез. 2018;59:749–63.
КАС пабмед ПабМед Центральный Google Scholar
Tarr PT, Tarling EJ, Bojanic DD, Edwards PA, Baldán Á.Возникающие новые парадигмы для транспортеров ABCG. Биохим Биофиз Акта 2009;1791:584–593.
Стурек Дж. М., Касл Дж. Д., Трейс А. П., Пейдж Л. С., Касл А. М., Эванс-Молина С. и др. Внутриклеточная роль ABCG1-опосредованного транспорта холестерина в регулируемом секреторном пути β-клеток поджелудочной железы мышей. Джей Клин Инвест. 2010;120:2575–89.
КАС пабмед ПабМед Центральный Google Scholar
Neufeld EB, O’Brien K, Walts AD, Stonik JA, Malide D, Combs CA, et al.Транспортер ABCG1 человека мобилизует плазматическую мембрану и поздний эндосомальный несфингомиелин-ассоциированный холестерин для оттока и этерификации. Биология (Базель). 2014;3:866–91.
КАС Google Scholar
Воан А.М., Орам Дж.Ф. ABCG1 перераспределяет клеточный холестерин в домены, удаляемые липопротеинами высокой плотности, но не липид-истощенными аполипопротеинами. Дж. Биол. Хим. 2005; 280:30150–7.
КАС пабмед Google Scholar
Пандзич Э., Гелиссен И.С., Ван Р., Бартер П.Дж., Свиридов Д., Гаус К. и др.Кассетный переносчик связывания АТФ, ABCG1, локализуется в кортикальных актиновых филаментах. Научный представитель 2017;7.
Kaminski WE, Orsó E, Diederich W, Klucken J, Drobnik W, Schmitz G. Идентификация нового переносчика кассеты, связывающего АТФ, чувствительного к стеролам человека (ABCA7). Biochem Biophys Res Commun. 2000; 273: 532–8.
КАС пабмед Google Scholar
Ван Н., Лан Д., Гербод-Джаннон М., Линсел-Нитшке П., Йеле А.В., Чен В. и др.АТФ-связывающий кассетный переносчик A7 (ABCA7) связывает аполипопротеин α-I и опосредует отток клеточных фосфолипидов, но не холестерина. Дж. Биол. Хим. 2003; 278:42906–12.
КАС пабмед Google Scholar
Хаяси М., Абэ-Дохмаэ С., Оказаки М., Уэда К., Йокояма С. Гетерогенность липопротеинов высокой плотности, генерируемых ABCA1 и ABCA7. J липидный рез. 2005; 46:1703–11.
КАС пабмед Google Scholar
Linsel-Nitschke P, Jehle AW, Shan J, Cao G, Bacic D, Lan D, et al.Возможная роль ABCA7 в оттоке клеточных липидов к апоА-I. J липидный рез. 2005; 46:86–92.
КАС пабмед Google Scholar
Ивамото Н., Абэ-Дохмаэ С., Сато Р., Йокояма С. Экспрессия ABCA7 регулируется клеточным холестерином через путь SREBP2 и связана с фагоцитозом. J липидный рез. 2006; 47: 1915–27.
КАС пабмед Google Scholar
Meurs I, Calpe-Berdiel L, Habets KLL, Zhao Y, Korporaal SJA, Mommaas AM, et al.Влияние делеции макрофага ABCA7 на липидный обмен и развитие атеросклероза в присутствии и в отсутствие ABCA1. ПЛОС Один. 2012;7:e30984.
КАС пабмед ПабМед Центральный Google Scholar
Репа Дж.Дж., Берге К.Е., Помайзл С., Ричардсон Дж.А., Хоббс Х., Мангельсдорф Д.Дж. Регуляция АТФ-связывающих кассетных транспортеров стерола ABCG5 и ABCG8 Х-рецепторами печени α и β. Дж. Биол. Хим. 2002; 277:18793–800.
КАС пабмед Google Scholar
Берге К.Е., Тиан Х., Граф Г.А., Ю.Л., Гришин Н.В., Шульц Дж. и др. Накопление пищевого холестерина при ситостеролемии, вызванное мутациями в соседних транспортерах ABC. Наука. 2000; 290(80):1771–5.
КАС пабмед Google Scholar
Воан А.М., Орам Дж.Ф. ABCA1 и ABCG1 или ABCG4 действуют последовательно, удаляя клеточный холестерин и генерируя ЛПВП, богатые холестерином.J липидный рез. 2006; 47: 2433–43.
КАС пабмед Google Scholar
Додацки А., Вортман М., Саубамеа Б., Шассеньо С., Николич С., Принц Н. и др. Экспрессия и функция Abcg4 в гематоэнцефалическом барьере мыши: роль в ограничении проникновения в головной мозг пептида амилоида-β. Научный представитель 2017;7.
Сано О., Ито С., Като Р., Симидзу Ю., Кобаяши А., Кимура Ю. и др. ABCA1, ABCG1 и ABCG4 распределяются по отдельным мембранным мезодоменам и нарушают устойчивые к детергентам домены на плазматической мембране.ПЛОС Один. 2014;9:e109886.
ПабМед ПабМед Центральный Google Scholar
Quazi F, Molday RS. Дифференциальные фосфолипидные субстраты и направленный транспорт с помощью АТФ-связывающих кассетных белков ABCA1, ABCA7 и ABCA4 и болезнетворных мутантов. Дж. Биол. Хим. 2013; 288:34414–26.
КАС пабмед ПабМед Центральный Google Scholar
Шамбенуа О., Хамон Ю., Марге Д., Риньо Х., Россенеу М., Чимини Г.Для специфического закрепления аполипопротеина A-I на клеточной поверхности требуется функциональный транспортер ABCA1. Дж. Биол. Хим. 2001; 276:9955–60.
КАС пабмед Google Scholar
Хамон Ю., Броккардо С., Шамбенуа О., Лучани М.Ф., Тоти Ф., Часлин С. и др. ABC1 способствует поглощению апоптотических клеток и трансбислойному перераспределению фосфатидилсерина. Nat Cell Biol. 2000; 2: 399–406.
КАС пабмед Google Scholar
Цянь Х., Чжао С., Цао П., Лэй Дж., Ян Н., Гун С.Структура экспортера липидов человека ABCA1. Клетка. 2017;169(7):1228-39.e10. https://doi.org/10.1016/j.cell.2017.05.020. Epub 2017 8 июня.
Ву А., Грела Э., Войтович К., Филипчак Н., Хамон Ю., Лучовски Р. и др. Транспортер ABCA1 снижает цитотоксичность амфотерицина В в клетках млекопитающих. Cell Mol Life Sci. 2019: 1–16.
Hirayama H, Kimura Y, Kioka N, Matsuo M, Ueda K. АТФазная активность человеческого ABCG1 стимулируется холестерином и сфингомиелином. J липидный рез.2013; 54: 496–502.
КАС пабмед ПабМед Центральный Google Scholar
Кобаяши А., Такандзава Ю., Хирата Т., Симидзу Ю., Мисаса К., Киока Н. и др. Эффлюкс сфингомиелина, холестерина и фосфатидилхолина посредством ABCG1. J липидный рез. 2006; 47: 1791–802.
КАС пабмед Google Scholar
Сано О., Кобаяши А., Нагао К., Кумагаи К., Киока Н., Ханада К. и др.Сфингомиелин-зависимость оттока холестерина, опосредованная ABCG1. J липидный рез. 2007; 48: 2377–84.
КАС пабмед Google Scholar
Kim WS, Hsiao JHT, Bhatia S, Glaros EN, Don AS, Tsuruoka S, et al. ABCA8 стимулирует продукцию сфингомиелина в олигодендроцитах. Биохим Дж. 2013;452:401–10.
КАС пабмед Google Scholar
Oude Elferink RPJ, Paulusma CC.Функция и патофизиологическое значение ABCB4 (P-гликопротеин MDR3). Pflugers Arch Eur J Physiol. 2007; 453: 601–10.
КАС Google Scholar
Сакаи Х., Танака Ю., Танака М., Бан Н., Ямада К., Мацумура Ю. и др. Дефицит ABCA2 приводит к аномальному метаболизму сфинголипидов в мозге мышей. Дж. Биол. Хим. 2007; 282:19692–9.
КАС пабмед Google Scholar
Мак Дж.Т., Таунсенд Д.М., Белянски В., Тью К.Д.Транспортер ABCA2: внутриклеточная роль в транспортировке и метаболизме холестерина, полученного из ЛПНП, и соединений, связанных со стеролами. Curr Drug Metab. 2007; 8: 47–57.
КАС пабмед ПабМед Центральный Google Scholar
Zhou C-J, Zhao L-X, Inagaki N, Guan J-L, Nakajo S, Hirabayashi T, et al. АТФ-связывающий кассетный переносчик ABC2/ABCA2 в головном мозге крысы: новый ассоциированный с лизосомами мембранный белок млекопитающих и специфический маркер для олигодендроцитов, но не для миелиновых оболочек.Дж. Нейроски. 2001; 21: 849–57.
КАС пабмед ПабМед Центральный Google Scholar
Davis W Jr. АТФ-связывающий кассетный транспортер-2 (ABCA2) регулирует гомеостаз холестерина и метаболизм рецепторов липопротеинов низкой плотности в клетках нейробластомы N2a. Биохим Биофиз Акта. 1811; 2011: 1152–64.
Google Scholar
Порно MI, Slotte JP. Обратимые эффекты деградации сфингомиелина на распределение и метаболизм холестерина в фибробластах и трансформированных клетках нейробластомы.Биохим Дж. 1990; 271:121–6.
КАС пабмед ПабМед Центральный Google Scholar
Барцокис Г. Возрастное разрушение миелина: модель развития снижения когнитивных функций и болезни Альцгеймера. Нейробиол Старение. 2004; 25: 5–18, ответ автора 49–62.
КАС пабмед Google Scholar
Масе С., Кузен Э., Рикард С., Женен Э., Спанакис Э., Лафарг-Субигу С. и др.ABCA2 является сильным генетическим фактором риска ранней болезни Альцгеймера. Нейробиол Дис. 2005; 18:119–25.
ПабМед Google Scholar
Воллмер М.А., Капаки Э., Херсбергер М., Мантвайлер Дж., Бруннер Ф., Цолаки М. и др. Этническая генетическая ассоциация ABCA2 со спорадической болезнью Альцгеймера. Am J Med Genet Part B Neuropsychiatr Genet. 2006; 141Б: 534–6.
КАС Google Scholar
Ямано Г., Фунахаши Х., Каванами О., Чжао Л-Х, Бан Н., Учида Ю. и др.ABCA3 представляет собой белок мембраны ламеллярного тела в клетках альвеолярного типа II легких человека 1 . ФЭБС лат. 2001; 508: 221–5.
КАС пабмед Google Scholar
Бан Н., Мацумура Ю., Сакаи Х., Такандзава Ю., Сасаки М., Араи Х. и др. ABCA3 как переносчик липидов в биогенезе легочного сурфактанта. Дж. Биол. Хим. 2007; 282:9628–34.
КАС пабмед Google Scholar
Чеонг Н., Чжан Х., Мадеш М., Чжао М., Ю К., Додиа С. и др.ABCA3 имеет решающее значение для биогенеза пластинчатых тел in vivo. Дж. Биол. Хим. 2007; 282:23811–7.
КАС пабмед Google Scholar
Мацумура Ю., Сакаи Х., Сасаки М., Бан Н., Инагаки Н. Опосредованное ABCA3 поглощение холин-фосфолипидов во внутриклеточные везикулы в клетках A549. ФЭБС лат. 2007; 581:3139–44.
КАС пабмед Google Scholar
Шуленин С., Ноги Л.М., Аннило Т., Верт С.Е., Уитсетт Дж.А., Дин М. Мутации гена ABCA3 у новорожденных с летальным дефицитом сурфактанта. N Engl J Med. 2004; 350:1296–303.
КАС пабмед Google Scholar
Kawaguchi K, Morita M. Подсемейство D транспортеров ABC: отчетливые различия в поведении между ABCD1-3 и ABCD4 в субклеточной локализации, функции и заболеваниях человека. Биомед Рез Инт. 2016;2016.
Mosser J, Douar AM, Sarde CO, Kioschis P, Feil R, Moser H, et al.Предполагаемый Х-сцепленный ген адренолейкодистрофии имеет неожиданную гомологию с транспортерами ABC. Природа. 1993; 361: 726–30.
КАС пабмед Google Scholar
Van Roermund CWT, Visser WF, Ijlst L, Van Cruchten A, Boek M, Kulik W, et al. Человеческий пероксисомальный полутранспортер ABC ALDP функционирует как гомодимер и принимает сложные эфиры ацил-КоА. FASEB J. 2008; 22:4201–8.
ПабМед Google Scholar
Тромпьер Д., Савари С.Х-сцепленная адренолейкодистрофия. Морган и Клейпул; 2013.
Genin EC, Geillon F, Gondcaille C, Athias A, Gambert P, Trompier D, et al. Субстратная специфичность перекрывается и взаимодействует между белком адренолейкодистрофии (ALDP/ABCD1) и белком, связанным с адренолейкодистрофией (ALDRP/ABCD2). Дж. Биол. Хим. 2011; 286:8075–84.
КАС пабмед ПабМед Центральный Google Scholar
Van Roermund CWT, Visser WF, Ijlst L, Waterham HR, Wanders RJA.Дифференциальная субстратная специфичность человеческих ABCD1 и ABCD2 при β-окислении пероксисомальных жирных кислот. Биохим Биофиз Акта 2011; 1811:148–152.
Ferdinandusse S, Jimenez-Sanchez G, Koster J, Denis S, Van Roermund CW, Silva-Zolezzi I, et al. Новый дефект биосинтеза желчных кислот из-за дефицита пероксисомального ABCD3. Хум Мол Жене. 2015;24:361–70.
КАС пабмед Google Scholar
Wanders RJA, Waterham HR.Новый взгляд на биохимию пероксисом млекопитающих. Анну Рев Биохим. 2006; 75: 295–332.
КАС пабмед Google Scholar
Саргсян Ю., Томс С. Поддержание здорового контакта: как пероксисомы взаимодействуют с другими клеточными органеллами. Тренды Мол Мед. 2019.
Trompier D, Vejux A, Zarrouk A, Gondcaille C, Geillon F, Nury T, et al. Пероксисомы головного мозга. Биохимия. 2014;98:102–10.
КАС пабмед Google Scholar
Кассманн СМ.Миелиновые пероксисомы — необходимые органеллы для поддержания белого вещества в нервной системе. Биохимия. 2014; 98:111–8.
КАС пабмед Google Scholar
Wanders RJA, Опрос-BT. Роль пероксисом в метаболизме липидов человека и ее значение для неврологического развития. Нейроски Летт. 2017; 637:11–7.
КАС пабмед Google Scholar
Лодхи И.Ю., Семенкович В.Ф.Пероксисомы: связующее звено для метаболизма липидов и клеточной передачи сигналов. Клеточный метаб. 2014;19:380–92.
КАС пабмед ПабМед Центральный Google Scholar
Димас П., Монтани Л., Перейра Дж. А., Морено Д., Трецмюллер М., Гербер Дж. и др. Миелинизация и ремиелинизация ЦНС зависят от синтеза жирных кислот олигодендроцитами. Элиф. 2019;8.
Цудзи С., Судзуки М., Арига Т., Секин М., Курияма М., Миятаке Т. Аномалия длинноцепочечных жирных кислот в сфингомиелине мембраны эритроцитов у пациентов с адренолейкодистрофией.Дж. Нейрохим. 1981; 36: 1046–9.
КАС пабмед Google Scholar
Танака К., Шимада М., Наруто Т., Ямамото Х., Саеки Ю., Сай Х. и др. Жирные кислоты с очень длинной цепью в сфингомиелине мембраны эритроцитов: обнаружение гемизигот и гетерозигот ALD. Неврология. 1986; 36: 791–5.
КАС пабмед Google Scholar
Абэ Ю., Хоншо М., Наканиси Х., Тагучи Р., Фудзики Ю.Полиненасыщенные жирные кислоты с очень длинной цепью накапливаются в фосфатидилхолине фибробластов у пациентов с синдромом Зеллвегера и дефицитом ацил-КоА-оксидазы1. Биохим Биофиз Акта 2014; 1841: 610–619.
Браун Ф.Р., Чен В.В., Киршнер Д.А., Фрайер К.Л., Пауэрс Дж.М., Мозер А.Б. и др. Миелиновая мембрана белого вещества головного мозга при адренолейкодистрофии — биохимические свойства. Дж. Нейрохим. 1983; 41: 341–8.
КАС пабмед Google Scholar
Игараси М., Шаумбург Х.Х., Пауэрс Дж., Кисимото Ю., Койлодный Э., Судзуки К.Аномалии жирных кислот при адренолейкодистрофии. Дж. Нейрохим. 1976; 26: 851–60.
КАС пабмед Google Scholar
Уилсон Р., Сарджент Дж. Р. Липидный и жирнокислотный состав ткани головного мозга больных адренолейкодистрофией. Дж. Нейрохим. 1993; 61: 290–7.
КАС пабмед Google Scholar
Huffnagel IC, van de Beek MC, Showers AL, Orsini JJ, Klouwer FCC, Dijkstra IME и др.Сравнение С26:0-карнитина и С26:0-лизофосфатидилхолина как диагностических маркеров в сухих пятнах крови у новорожденных и больных адренолейкодистрофией. Мол Жене Метаб. 2017; 122:209–15.
КАС пабмед Google Scholar
Herzog K, Pras-Raves ML, Ferdinandusse S, Vervaart MAT, Luyf ACM, van Kampen AHC, et al. Функциональная характеристика нарушений пероксисомального β-окисления в фибробластах с помощью липидомики. J Наследовать Metab Dis.2018;41:479–87.
КАС пабмед Google Scholar
Хама К., Фудзивара Ю., Морита М., Ямазаки Ф., Накашима Ю., Такей С. и др. Профилирование и визуализация фосфолипидов в мозге мышей с дефицитом Abcd1. Липиды. 2018;53:85–102.
КАС пабмед Google Scholar
Чжан Ф., Камп Ф., Гамильтон Дж.А. Диссоциация жирных кислот с длинной и очень длинной цепью из двойных слоев фосфолипидов.Биохимия. 1996; 35:16055–60.
КАС пабмед Google Scholar
Хо Дж.К., Мозер Х., Кисимото Ю., Гамильтон Дж.А. Взаимодействие жирных кислот с очень длинной цепью с модельными мембранами и сывороточным альбумином: последствия для патогенеза адренолейкодистрофии. Джей Клин Инвест. 1995; 96: 1455–63.
КАС пабмед ПабМед Центральный Google Scholar
Алонсо А., Гони FM.Физические свойства церамидов в мембранах. Анну Рев Биофиз. 2018; 47: 633–54.
КАС пабмед Google Scholar
Гонсалес-Рамирес Э.Дж., Гоньи Ф.М., Алонсо А. Смешивание цереброзидов головного мозга с церамидами, холестерином и фосфолипидами головного мозга. Научный представитель 2019;9.
Weinhofer I, Forss-Petter S, Kunze M, Žigman M, Berger J. Мыши с адренолейкодистрофией, сцепленной с Х-хромосомой, демонстрируют нарушения метаболизма холестерина.ФЭБС лат. 2005; 579: 5512–6.
КАС пабмед Google Scholar
Chu BB, Liao YC, Qi W, Xie C, Du X, Wang J и др. Транспорт холестерина через мембранные контакты лизосома-пероксисома. Клетка. 2015; 161: 291–306.
КАС пабмед Google Scholar
Raas Q, Gondcaille C, Hamon Y, Leoni V, Caccia C, Ménétrier F, et al. CRISPR/Cas9-опосредованный нокаут генов Abcd1 и Abcd2 в клетках BV-2: новые модели микроглии для Х-сцепленной адренолейкодистрофии.Biochim Biophys Acta 2019; 1864: 704–714.
Xiao J, Luo J, Hu A, Xiao T, Li M, Kong Z и др. Транспорт холестерина через контакты мембраны пероксисомы-ER связан PI (4,5) P2 и расширенными синаптотагминами. Наука Китая Life Sci. 2019;62:1117–35.
КАС пабмед Google Scholar
Yang H. Расширенные синаптотагмины, контакт пероксисомы с эндоплазматическим ретикулумом и транспорт холестерина. Наука Китая Life Sci.2019;62:1266–9.
ПабМед Google Scholar
Оуэн Д.М., Гаус К., Маги А.И., Себекауэр М. Динамическая организация плазматической мембраны лимфоцитов: уроки передовых методов визуализации. Иммунология. 2010; 131:1–8.
КАС пабмед ПабМед Центральный Google Scholar
Guia S, Jaeger BN, Piatek S, Mailfert S, Trombik T, Fenis A, et al. Ограничение активирующих рецепторов на плазматической мембране контролирует толерантность естественных клеток-киллеров.Sci Signal 2011; 4: ra21–ra21.
He HT, Lellouch A, Marguet D. Липидные плоты и инициация передачи сигналов Т-клеточного рецептора. Семин Иммунол. 2005; 17:23–33.
КАС пабмед Google Scholar
Армстронг А.Дж., Гебре А.К., Паркс Дж.С., Хедрик К.С. АТФ-связывающий кассетный переносчик G1 негативно регулирует пролиферацию тимоцитов и периферических лимфоцитов. Дж Иммунол. 2010; 184:173–83.
КАС пабмед Google Scholar
Bensinger SJ, Bradley MN, Joseph SB, Zelcer N, Janssen EM, Hausner MA, et al.Передача сигналов LXR связывает метаболизм стеролов с пролиферацией при приобретенном иммунном ответе. Клетка. 2008; 134:97–111.
КАС пабмед ПабМед Центральный Google Scholar
Гуссенс П., Родригес-Вита Дж., Эцеродт А., Массе М., Растуан О., Гуиран В. и др. Мембранный отток холестерина стимулирует связанное с опухолью перепрограммирование макрофагов и прогрессирование опухоли. Клеточный метаб. 2019;29:1376–89 д4.
КАС пабмед Google Scholar
Westerterp M, Gourion-Arsiquaud S, Murphy AJ, Shih A, Cremers S, Levine RL, et al.Регуляция мобилизации гемопоэтических стволовых клеток и клеток-предшественников путями оттока холестерина. Клеточная стволовая клетка. 2012;11:195–206.
КАС пабмед ПабМед Центральный Google Scholar
Саг Д., Вингендер Г., Новыхед Х., Ву Р., Гебре А.К., Паркс Дж.С. и др. АТФ-связывающий кассетный переносчик G1 внутренне регулирует развитие инвариантных NKT-клеток. Дж Иммунол. 2012; 189:5129–38.
КАС пабмед ПабМед Центральный Google Scholar
Pradel LC, Mitchell AJ, Zarubica A, Dufort L, Chasson L, Naquet P, et al.АТФ-связывающий кассетный транспортер маркирует тканевые макрофаги и модулирует запускаемые цитокинами программы поляризации. Евр Дж Иммунол. 2009; 39: 2270–80.
КАС пабмед Google Scholar
Cheng HY, Gaddis DE, Wu R, McSkimming C, Haynes LD, Taylor AM, et al. Потеря ABCG1 влияет на дифференцировку регуляторных Т-клеток и атеросклероз. Джей Клин Инвест. 2016; 126:3236–46.
ПабМед ПабМед Центральный Google Scholar
Вестертерп М., Готье Э.Л., Ганда А., Молуски М.М., Ван В., Фотакис П. и др.Накопление холестерина в дендритных клетках связывает инфламмасому с приобретенным иммунитетом. Клеточный метаб. 2017;25:1294–304 e6.
КАС пабмед ПабМед Центральный Google Scholar
Nowyhed HN, Chandra S, Kiosses W, Marcovecchio P, Andary F, Zhao M, et al. Транспортер кассеты связывания АТФ ABCA7 регулирует развитие и функцию NKT-клеток, контролируя экспрессию CD1d и содержание липидного рафта. Научный доклад 2017; 7: 40273.
КАС пабмед ПабМед Центральный Google Scholar
Heng TSP, Painter MW, Elpek K, Lukacs-Kornek V, Mauermann N, Turley SJ, et al.Иммунологический геномный проект: сети экспрессии генов в иммунных клетках. Нат Иммунол. 2008; 9: 1091–4.
КАС пабмед Google Scholar
Liu S-L, Sheng R, O’Connor MJ, Cui Y, Yoon Y, Kurilova S, et al. Одновременная количественная оценка in situ двух пулов клеточных липидов с использованием ортогональных флуоресцентных датчиков. Angew Chemie Int Ed. 2014;53:14387–91.
КАС Google Scholar
Лю С.Л., Шэн Р., Юнг Дж.Х., Ван Л., Стек Э., О’Коннор М.Дж. и др.Ортогональные датчики липидов выявляют трансбислойную асимметрию холестерина плазматической мембраны. Nat Chem Biol. 2017;13:268–74.
КАС пабмед Google Scholar
Кампен КР. Мембранные белки: ключевые игроки раковой клетки. J Membr Biol. 2011; 242:69–74.
КАС пабмед Google Scholar
Hofmann UB, Westphal JR, van Muijen GNP, Ruiter DJ. Матриксные металлопротеиназы при меланоме человека.Джей Инвест Дерматол. 2000; 115: 337–44.
КАС пабмед Google Scholar
Ирвин М.Э., Мюллер К.Л., Бохин Н., Ге Ю., Бернер Д.Л. Локализация EGFR в липидном рафте изменяет реакцию раковых клеток на ингибитор тирозинкиназы EGFR гефитиниб. J Cell Physiol. 2011; 226:2316–28.
КАС пабмед ПабМед Центральный Google Scholar
Zhang Z, Wang L, Du J, Li Y, Yang H, Li C и др.Локализация липидного рафта рецептора эпидермального фактора роста изменяет экспрессию матриксной металлопротеиназы-1 в клетках SiHa посредством сигнального пути MAPK/ERK. Онкол Летт. 2016;12:4991–8.
КАС пабмед ПабМед Центральный Google Scholar
Норамбуэна А., Шварц М.А. Влияние интегрин-опосредованной клеточной адгезии на компоненты липидного слоя плазматической мембраны и передачу сигналов. Мол Биол Селл. 2011;22:3456.
КАС пабмед ПабМед Центральный Google Scholar
Рагху Х., Содадасу П.К., Малла Р.Р., Гонди К.С., Эстес Н., Рао Дж.С.Локализация uPAR и MMP-9 в липидных рафтах имеет решающее значение для миграции, инвазии и ангиогенеза в клетках рака молочной железы человека. БМК Рак. 2010;10:647.
КАС пабмед ПабМед Центральный Google Scholar
Tosi MR, Tugnoli V. Эфиры холестерина при злокачественных новообразованиях. Клин Чим Акта. 2005; 359: 27–45.
КАС пабмед Google Scholar
Чен Т., Го Дж., Ян М., Чжу С., Цао С.Экзосомы, содержащие хемокины, высвобождаются из опухолевых клеток, подвергшихся тепловому стрессу, через липидный рафт-зависимый путь и действуют как эффективная противоопухолевая вакцина.




 В. Чередниченко со студентами
В. Чередниченко со студентами
 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
 Общество. Медицина»
Общество. Медицина»
 Барановичи)
Барановичи)

 10.2017
10.2017
 м.н. О.О. Руммо
м.н. О.О. Руммо
 Гродно
Гродно
 и клеточные отсеки.
и клеточные отсеки. Холестерин является липидным компонентом
клеточных мембран, регулирующий текучесть мембран и входящий в состав
мембранные сигнальные системы. Липиды мембран создают гидрофобные
барьер между водными компартментами клетки. Основная структура
Липидная часть мембраны представляет собой липидный бислой с гидрофобными
ядра, состоящие преимущественно из цепочек жирных кислот, и гидрофильные поверхности.
Холестерин является липидным компонентом
клеточных мембран, регулирующий текучесть мембран и входящий в состав
мембранные сигнальные системы. Липиды мембран создают гидрофобные
барьер между водными компартментами клетки. Основная структура
Липидная часть мембраны представляет собой липидный бислой с гидрофобными
ядра, состоящие преимущественно из цепочек жирных кислот, и гидрофильные поверхности.