Кардиомиоциты типичные и атипичные: В чем отличие типичных кардиомиоцитов от атипичных?
Блокаторы β-адренергических рецепторов — Антиаритмические препараты II класса — Справочник лекарств
Антиаритмические препараты – это обширная и разнородная группа лекарственных средств, которые устраняют нарушения сердечного ритма и используются при аритмиях.
Важной особенностью антиаритмических препаратов является высокая направленность их действия – они влияют конкретно на проводящую систему сердца.
Сердце состоит из двух типов клеток – кардиомиоцитов: типичных и атипичных (нетипичных).
Типичные кардиомиоциты по структуре и функциям представляют собой обычные мышечные клетки, которые способны сокращаться, обеспечивая тем самым насосную функцию сердца и движение крови по сосудам. Сокращается сердце под действием биоэлектрических импульсов.
Атипичные же кардиомиоциты по структуре и функциям больше напоминают нервные клетки, способные воспроизводить и передавать электрические импульсы. Атипичные кардиомиоциты составляют проводящую систему сердца, обеспечивающую равномерную проводимость импульса по всему сердцу, а также способность автономно воспроизводить и поддерживать этот импульс при необходимости.
Биоэлектрический импульс генерируется и проводится по сердцу благодаря токам ионов натрия, калия и кальция, а также работе β-адренорецепторов.
Проводящая система пронизывает все сердце и состоит из таких основных частей: синусового (синусно-предсердного) узла, предсердно-желудочкового узла, межузловых проводящих пучков, пучка Гиса и волокон Пуркинье.
Каждый участок проводящей системы отвечает за последовательное сокращение определенных отделов сердца – предсердий, межжелудочковой перегородки и желудочков. Нарушение проведения возбуждения на любом из участков проводящей системы сердца приводит к развитию аритмий.
Клинические особенности и тактика лечения аритмий в наибольшей степени зависит от участка проводящей системы, где происходит регулярное нарушение проведения биоэлектрического импульса.
В зависимости от механизма действия, а также особенностей влияния на определенные нарушения ритма, все антиаритмические препараты делят на 4 основных класса: блокаторы натриевых каналов (I класс), блокаторы β-адренорецепторов (II класс), блокаторы калиевых каналов (III класс), блокаторы кальциевых каналов (IV класс).
Рассмотрим подробно антиаритмические препараты II класса – блокаторы β-адренорецепторов (β-адреноблокаторы).
Показания к применению
Антиаритмические препараты II класса в равной степени показаны при желудочковых аритмиях и наджелудочковых аритмиях – нарушениях сердечного ритма на уровне желудочков и предсердий соответственно.
Применяются антиаритмические препараты II класса также при артериальной гипертензии (гипертонической болезни), ишемической болезни сердца (стенокардии).
Фармакологическое действие
Антиаритмические препараты II класса оказывают противоаритмическое действие за счет блокады β-адренорецепторов проводящей системы сердца.
Дополнительно все антиаритмические препараты II класса понижают артериальное давление (антигипертензивное действие) и уменьшают потребность сердца в кислороде при стенокардии (антиангинальное действие).
Классификация антиаритмических препаратов II класса
Антиаритмические препараты II класса в зависимости от особенностей действия классифицируют на:
- неселективные (неизбирательные) β-адреноблокаторы: пропранолол, соталол;
- кардиоселективные (избирательно влияют на сердце) β-адреноблокаторы: атенолол, метопролол, бисопролол, бетаксолол, эсмолол, небиволол;
- гибридные (сочетанные) α, β-адреноблокаторы: карведилол.

Соталол объединяет в себе свойства антиаритмических препаратов II и III класса, сочетая свойства β-адреноблокатора и блокатора калиевых каналов.
Основы лечения антиаритмическими препаратами II класса
Учитывая определенные особенности и сложности в подборе индивидуальной дозы и конкретного препарата, а также широкий спектр побочных эффектов и особенностей взаимодействия с другими лекарствами, любые антиаритмические препараты назначает только опытный врач-кардиолог.
Антиаритмические препараты II класса используют длительно, чаще всего – пожизненно.
Отмена, коррекция дозы или замена антиаритмического препарата II класса должна проводиться только врачом и под контролем врача, поскольку существует риск развития серьезных нарушений сердечного ритма.
Особенности лечения антиаритмическими препаратами II класса
Неселективные β-адреноблокаторы (пропранолол) блокируют не только первый тип β-адренорецепторов в сердце, но и второй тип β-адренорецепторов в бронхах, вызывая их спазм. Поэтому неселективные β-адреноблокаторы противопоказаны пациентам с сопутствующими заболеваниями дыхательной системы – бронхиальной астмой, хронической обструктивной болезнью легких, хроническим бронхитом.
Поэтому неселективные β-адреноблокаторы противопоказаны пациентам с сопутствующими заболеваниями дыхательной системы – бронхиальной астмой, хронической обструктивной болезнью легких, хроническим бронхитом.
Учитывая сопутствующие антигипертензивный и антиангинальный эффекты, антиаритмические препараты II класса обычно используют у пациентов с аритмией на фоне гипертонической болезни или ишемической болезни сердца (стенокардии).
Инфаркт миокарда
Инфа́ркт миока́рда — одна из клинических форм ишемической болезни сердца, протекающая с развитием ишемического некроза участка миокарда, обусловленного абсолютной или относительной недостаточностью его кровоснабжения.
1 декабря 2012 года Американская коллегия кардиологии и Американская ассоциация сердца опубликовали самые современные клинические рекомендации по ведению инфаркта миокарда со стойкими подъёмами сегмента ST на ЭКГ и его ранних осложнений[1]. Чуть раньше в октябре 2012 года свои рекомендации по данной форме заболевания обновило Европейское общество кардиологии[2].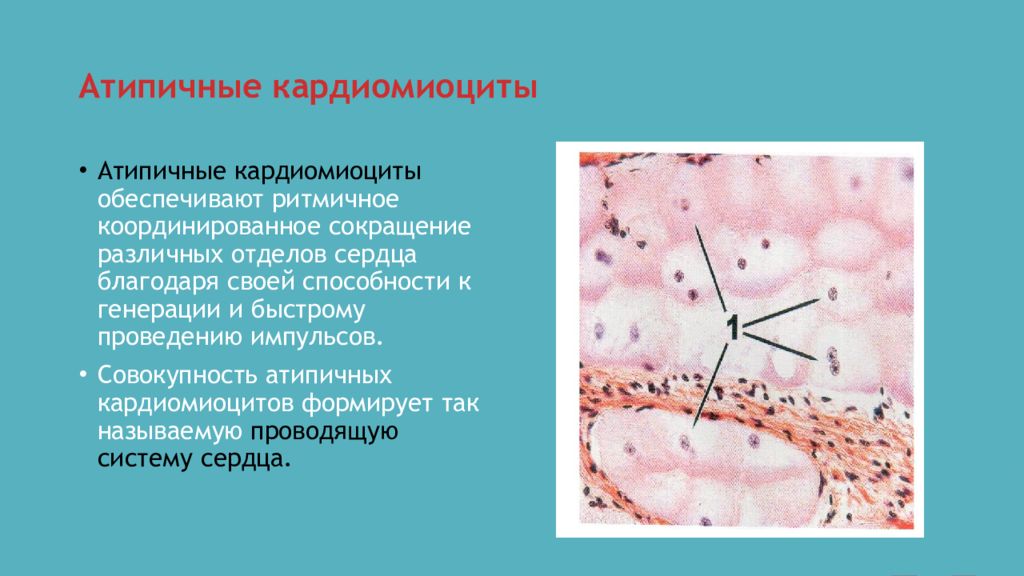
Классификация
По стадиям развития:
- Острейший период (до 2 часов от начала ИМ)
- Острый период (до 10 дней от начала ИМ)
- Подострый период (с 10 дня до 4-8 недель)
- Период рубцевания (с 4-8 нед до 6 месяцев)
По анатомии поражения:
- Трансмуральный
- Интрамуральный
- Субэндокардиальный
- Субэпикардиальный
По объёму поражения:
- Крупноочаговый (трансмуральный), Q-инфаркт
- Мелкоочаговый, не Q-инфаркт
- Локализация очага некроза.
- Инфаркт миокарда левого желудочка (передний, боковой, нижний, задний).
- Изолированный инфаркт миокарда верхушки сердца.
- Инфаркт миокарда межжелудочковой перегородки (септальный).
- Инфаркт миокарда правого желудочка.

- Сочетанные локализации: задне-нижний, передне-боковой и др.
По течению:
- Моноциклическое
- Затяжное
- Рецидивирующий ИМ (в 1у коронарную артерию подсыпает, новый очаг некроза от 72 часов до 8 дней)
- Повторный ИМ (в др. кор. арт., новый очаг некроза через 28 дней от предыдущего ИМ)
Клиническая классификация, подготовленная объединённой рабочей группой Европейского общества кардиологов, Американского кардиологического колледжа, Американской ассоциации сердца и Всемирной кардиологической федерации (2007)[5]:
- Спонтанный ИМ (тип 1), связанный с ишемией вследствие первичного коронарного события, такого как эрозия бляшки и/или разрушение, растрескивание или расслоение.
- Вторичный ИМ (тип 2), связанный с ишемией, вызванной увеличением недостатка кислорода или его поступления, например, при коронарном спазме, коронарной эмболии, анемии, аритмии, гипер- или гипотензии.
- Внезапная коронарная смерть (тип 3), включая остановку сердца, часто с симптомами предполагаемой ишемии миокарда с ожидаемой новой элевацией ST и новой блокадой левой ножки пучка Гиса, выявлением свежего тромба коронарной артерии при ангиографии и/или аутопсии, наступившей смертью до получения образцов крови или перед повышением концентрации маркеров.

- ЧКВ-ассоциированный ИМ (тип 4а).
- ИМ, связанный с тромбозом стента (тип 4б), который подтверждён ангиографией или аутопсией.
- АКШ-ассоциированный ИМ (тип 5).
Нужно иметь в виду, что иногда у пациентов может возникать несколько типов ИМ одновременно или последовательно. Следует учесть, что термин «инфаркт миокарда» не входит в понятие «некроз кардиомиоцитов» вследствие проведения АКШ (отверстие в желудочке, манипуляции с сердцем) и влияния следующих факторов: почечной и сердечной недостаточности, кардиостимуляции, электрофизиологической абляции, сепсиса, миокардита, действия кардиотропных ядов, инфильтративных заболеваний.
Этиология
Инфаркт миокарда развивается в результате обтурации просвета сосуда кровоснабжающего миокард (коронарная артерия). Причинами могут стать (по частоте встречаемости):
- Атеросклероз коронарных артерий (тромбоз, обтурация бляшкой) 93-98 %
- Хирургическая обтурация (перевязка артерии или диссекция при ангиопластике)
- Эмболизация коронарной артерии (тромбоз при коагулопатии, жировая эмболия т.
 д.)
д.) - Спазм коронарных артерий
Отдельно выделяют инфаркт при пороках сердца (аномальное отхождение коронарных артерий от аорты).
Факторы риска
Основная статья: Факторы риска ишемической болезни сердцаОсновная статья: Сердечно-сосудистый риск
- Табакокурение и пассивное курение[6]
- Артериальная гипертензия
- Ревмокардит
- Перенесённые стафилококковые и стрептококковые инфекции
- Повышенная концентрация холестерина ЛПНП («плохого» холестерина) в крови
- Низкая концентрация холестерина ЛПВП («хорошего» холестерина) в крови
- Высокий уровень триглицеридов в крови
- Низкий уровень физической активности
- Возраст
- Загрязнение атмосферы[7]
- Пол (Мужчины чаще страдают от инфаркта миокарда, чем женщины)
- Ожирение[8]
- Алкоголизм
- Сахарный диабет
- Инфаркт миокарда в прошлом и манифестация любых других проявлений атеросклероза
Патогенез
Различают стадии:
- Ишемии
- Повреждения (некробиоза)
- Некроза
- Рубцевания
Ишемия может являться предшественником инфаркта и длиться довольно долго. В основе процесса — нарушение гемодинамики миокарда. Обычно клинически значимым считается сужение просвета артерии сердца до такой степени, когда ограничение кровоснабжения миокарда не может быть больше компенсировано. Чаще всего это происходит при сужении артерии на 70% площади её сечения. При исчерпывании компенсаторных механизмов говорят о повреждении, тогда страдают метаболизм и функция миокарда. Изменения могут носить обратимый характер (ишемия). Стадия повреждения длится от 4 до 7 часов. Некроз характеризуется необратимостью повреждения. Через 1-2 недели после инфаркта некротический участок начинает замещаться рубцовой тканью. Окончательное формирование рубца происходит через 1-2 месяца.
В основе процесса — нарушение гемодинамики миокарда. Обычно клинически значимым считается сужение просвета артерии сердца до такой степени, когда ограничение кровоснабжения миокарда не может быть больше компенсировано. Чаще всего это происходит при сужении артерии на 70% площади её сечения. При исчерпывании компенсаторных механизмов говорят о повреждении, тогда страдают метаболизм и функция миокарда. Изменения могут носить обратимый характер (ишемия). Стадия повреждения длится от 4 до 7 часов. Некроз характеризуется необратимостью повреждения. Через 1-2 недели после инфаркта некротический участок начинает замещаться рубцовой тканью. Окончательное формирование рубца происходит через 1-2 месяца.
Клиническая картина
Основной клинический признак — интенсивная боль за грудиной (ангинозная боль). Однако болевые ощущения могут носить вариабельный характер. Пациент может жаловаться на чувство дискомфорта в груди, боли в животе, горле, руке, лопатке[9]. Нередко заболевание имеет безболевой характер, что характерно для больных сахарным диабетом.
Болевой синдром сохраняется более 15 минут (могут длиться 1 час) и купируется через несколько часов, либо после применения наркотических анальгетиков, нитраты неэффективны. Бывает профузный (липкий) пот [неизвестный термин].
В 20-40 % случаев при крупноочаговых поражениях развиваются признаки сердечной недостаточности. Пациенты отмечают одышку, непродуктивный кашель.
Нередко встречаются аритмии. Как правило это различные формы экстрасистолий или фибрилляция предсердий. Нередко единственным симптомом инфаркта миокарда является внезапная остановка сердца.
Предрасполагающим фактором является физическая нагрузка, психоэмоциональное напряжение, состояние утомления, гипертонический криз.
Атипичные формы инфаркта миокарда
В некоторых случаях симптомы инфаркта миокарда могут носить атипичный характер. Такая клиническая картина затрудняет диагностику инфаркта миокарда. Различают следующие атипичные формы инфаркта миокарда:
- Абдоминальная форма — симптомы инфаркта представлены болями в верхней части живота, икотой, вздутием живота, тошнотой, рвотой.
 В данном случае симптомы инфаркта могут напоминать симптомы острого панкреатита.
В данном случае симптомы инфаркта могут напоминать симптомы острого панкреатита. - Астматическая форма — симптомы инфаркта представлены нарастающей одышкой. Симптомы инфаркта напоминают симптомы приступа бронхиальной астмы.
- Безболевая ишемия миокарда наблюдается редко. Возможна слабость. Такое развитие инфаркта наиболее характерно для больных сахарным диабетом, у которых нарушение чувствительности является одним из проявлений болезни (диабета).
- Церебральная форма — симптомы инфаркта представлены головокружениями, нарушениями сознания, неврологическими симптомами; нарушение понимания, происходящего вокруг.
- Коллаптоидная форма — начинается с развития коллапса; в клинике доминируют резкая внезапная артериальная гипотензия, головокружение, появление холодного пота, потемнение в глазах. Расценивается как проявление кардиогенного шока.
- Аритмическая форма — начинается с пароксизма нарушения ритма сердца;
- Периферическая — отличается локализацией боли не в загрудинной или прекардиальной области, а в области горла, в левой руке, конце левого мизинца, в шейно-грудном отделе позвоночника, нижней челюсти.

- Отёчная — у больного появляются одышка, слабость, сравнительно быстро отеки и даже асцит, увеличивается печень — т. е. развивается острая правожелудочковая недостаточность.
- Комбинированная — сочетает различные проявления нескольких атипичных форм.
Диагностика
Болевые зоны при инфаркте миокарда: тёмно-красный = типичная область, светло-красный = другие возможные области.
Вид со спины.
- Ранняя:
- Электрокардиография
- Эхокардиография
- Анализ крови на кардиотропные белки (MB-КФК, АсАТ, ЛДГ1, тропонин[10])
- Отсроченная:
- Коронарография
- Сцинтиграфия миокарда (в настоящее время применяется редко)
Описания ЭКГ при инфаркте миокарда
Стадия развивающегося инфаркта миокарда (0-6 часов)
Стадия развивающегося инфаркта миокарда
- Куполообразный сегмент ST выше изолинии
- Сегмент ST сливается с зубцом T
- Зубец R высокий
- Зубец Q невысокий
Острая стадия инфаркта миокарда (6-7 суток)
Острая стадия инфаркта миокарда
- Отрицательный зубец T
- Уменьшение амплитуды зубца R
- Углубление зубца Q
Заживающий инфаркт миокарда (7-28 суток)
Заживающий инфаркт миокарда
- Отрицательный зубец T
- Сегмент ST приближается к изолинии
Заживший инфаркт миокарда (на 29 сутки — до нескольких лет)
Заживший инфаркт миокарда
- Стойкий зубец Q
- Сниженная амплитуда зубца R
- Положительный зубец T
- Комплекс ST на изолинии[11]
Осложнения
Ранние:
Поздние:
Лечение
Первая помощь
- При подозрении на инфаркт миокарда больного сначала усаживают и успокаивают.
 Рекомендуется положение сидя, желательно на кресле со спинкой, или полулёжа с согнутыми коленями. Тугую мешающую одежду расстёгивают, ослабляют галстук[15].
Рекомендуется положение сидя, желательно на кресле со спинкой, или полулёжа с согнутыми коленями. Тугую мешающую одежду расстёгивают, ослабляют галстук[15]. - Если больному выписано лекарство от боли в груди, такое как нитроглицерин, и это лекарство под рукой, то больному дают это лекарство[16].
- Если в течение 3 минут после сидения в покое или после принятия нитроглицерина боль не проходит, без промедления вызывают карету скорой помощи. Оказывающим первую помощь нельзя поддаваться на уговоры больного о том, что всё сейчас пройдёт[16]. Если скорая помощь не сможет прибыть быстро, пациента везут в больницу на попутной машине. При этом в машине желательно находиться двум здоровым людям, чтобы один вёл машину, а другой следил за состоянием больного[17].
- Если под рукой оказался аспирин, и у больного нет на аспирин известной ему аллергии, то ему дают разжевать 300 мг аспирина. Если больной постоянно принимает аспирин, принятую этим днём дозу дополняют до 300 мг.
 Важно разжевать таблетки, иначе аспирин не подействует достаточно быстро[15][17].
Важно разжевать таблетки, иначе аспирин не подействует достаточно быстро[15][17]. - В случае остановки сердца (потеря сознания, отсутствующее или агональное дыхание) немедленно начинают сердечно-лёгочную реанимацию. Её применение многократно увеличивает шансы больного на выживание. Ещё больше увеличивает выживаемость применение портативных дефибрилляторов: будучи в общественном месте (кафе, аэропорт, и т. д.), оказывающим первую помощь необходимо осведомиться у персонала о наличии у них или поблизости дефибриллятора. Определение отсутствия пульса больше не является необходимым условием для начала реанимации, достаточно потери сознания и отсутствия ритмичного дыхания[18].
Врачебная помощь
Лечение на ранних этапах при возможности сводится к устранению боли, восстановлению коронарного кровотока (тромболитическая терапия, ангиопластика коронарных артерий, АКШ). При выраженной сердечной недостаточности в условиях клиники возможна постановка внутриаортальной баллонной контрпульсации.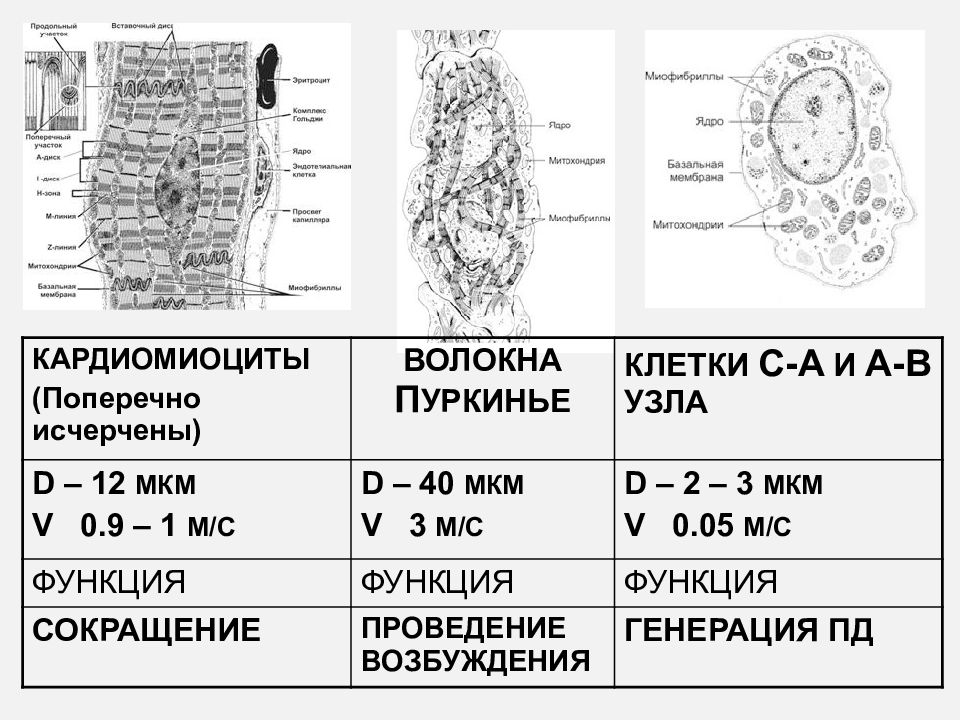
Устранение боли, одышки и тревоги[править | править вики-текст]
Если боль сохраняется на момент приезда бригады скорой медицинской помощи, врач применяет морфин. Предварительно 10 мг морфина гидрохлорида разводят в 10 мл 0,9 % раствора хлорида натрия или дистиллированной воды. Первую дозу 2-5 мг (то есть 2-5 мл раствора) вводят внутривенно струйно. Затем дополнительно вводят 2-5 мг каждые 5-15 минут до устранения боли или возникновения побочных эффектов.
Введение морфина при инфаркте миокарда без подъёма сегмента ST увеличивает риск смерти[19].
Также с обезболивающей целью возможно применение нейролептанальгезии — сочетание наркотического анальгетика фентанила (0,05-0,1 мг) и нейролептика дроперидола (2,5-10 мг в зависимости от уровня артериального давления). При необходимости нейролептанальгезию повторяют в более низкой дозе.
При наличии у больного артериальной гипоксемии (насыщение артериальной крови кислородом < 90 %), одышки или других признаков сердечной недостаточности дают увлажнённый кислород (через маску или носовой катетер) со скоростью 2-5 л/мин.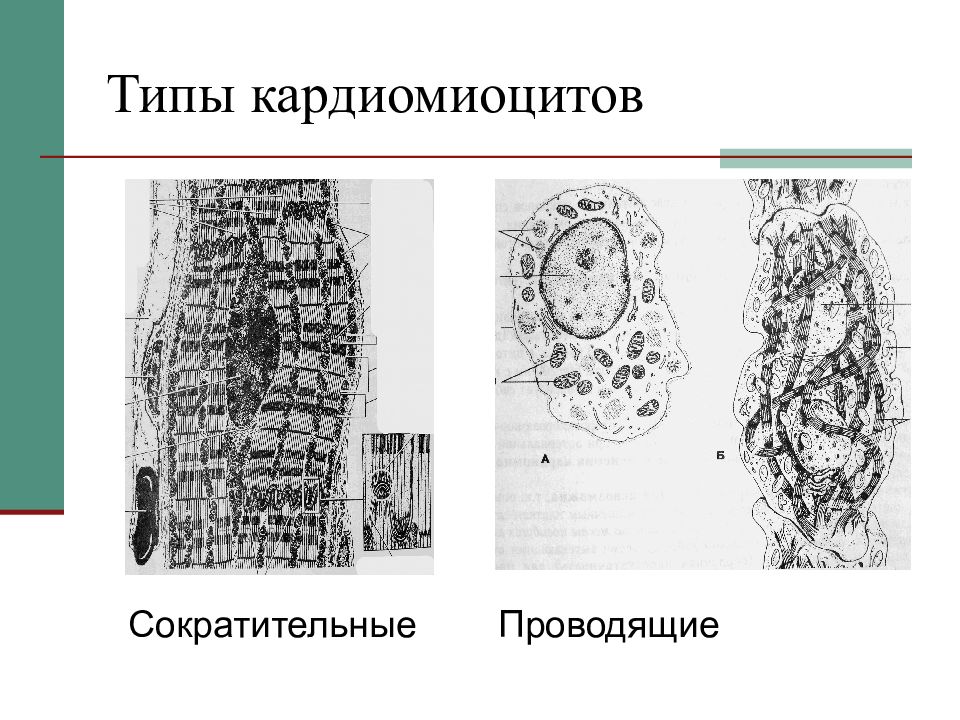 Артериальную гипоксемию по возможности определяют с помощью пульсоксиметрии.
Артериальную гипоксемию по возможности определяют с помощью пульсоксиметрии.
Несмотря на это, систематические обзоры 2009 и 2010 годов показали, что применение кислорода при инфаркте миокарда увеличивает риск смерти и зону некроза, поэтому на данный момент не рекомендуют использовать кислородотерапию рутинно[20][21].
Больному с выраженным возбуждением, тревогой, страхом (которые не исчезают после введения наркотического анальгетика) можно назначить транквилизатор (например, диазепам внутривенно 2,5-10 мг). Также важно успокоить пациента и его близких.
Антитромбоцитарная терапия
Всем людям с признаками острого коронарного синдрома (инфаркта миокарда или первичной нестабильной стенокардией), не принимающим данное лекарство и без противопоказаний к нему, следует принять ацетилсалициловую кислоту, предварительно разжевав, в первой нагрузочной дозе 162–325 мг[1][3][22][23] (или 150–300 мг согласно европейским рекомендациям[2][4]).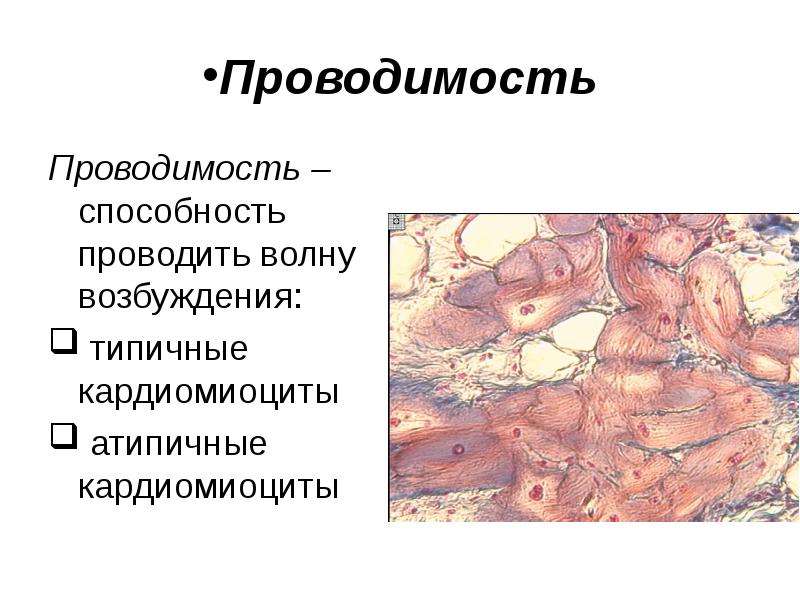 Для этих целей не подходит кишечно-растворимая форма, так как начало её действия медленное. При выраженной тошноте, рвоте, сопутствующих заболеваниях желудка возможно внутривенное введение ацетилсалициловой кислоты в дозе 250–500 мг. Далее ацетилсалициловая кислота показана таким больным пожизненно в дозе 75–162 мг/сут[24]. При наличии противопоказаний к ацетилсалициловой кислоте применяют клопидогрел в нагрузочной первой дозе 300 мг и в последующем 75 мг/сут[25][26]. Комбинация клопидогрела с аспирином эффективнее, чем монотерапия аспирином при инфаркте миокарда без подъёма сегмента ST (без статистически значимого влияние на смертность) и экономически оправдана, когда для здравоохранения приемлемы затраты порядка 6078 фунтов стерлингов за каждый дополнительный год полноценной жизни (quality-adjusted life year (QALY))[27]. Рутинное добавление клопидогреля к аспирину при консервативном лечении острого коронарного синдрома без подъёма сегмента ST, а также установке металлического стента без нанесения цитостатика и стента покрытого цитостатиком было рекомендовано Американской коллегией кардиологов в 2007 году[22].
Для этих целей не подходит кишечно-растворимая форма, так как начало её действия медленное. При выраженной тошноте, рвоте, сопутствующих заболеваниях желудка возможно внутривенное введение ацетилсалициловой кислоты в дозе 250–500 мг. Далее ацетилсалициловая кислота показана таким больным пожизненно в дозе 75–162 мг/сут[24]. При наличии противопоказаний к ацетилсалициловой кислоте применяют клопидогрел в нагрузочной первой дозе 300 мг и в последующем 75 мг/сут[25][26]. Комбинация клопидогрела с аспирином эффективнее, чем монотерапия аспирином при инфаркте миокарда без подъёма сегмента ST (без статистически значимого влияние на смертность) и экономически оправдана, когда для здравоохранения приемлемы затраты порядка 6078 фунтов стерлингов за каждый дополнительный год полноценной жизни (quality-adjusted life year (QALY))[27]. Рутинное добавление клопидогреля к аспирину при консервативном лечении острого коронарного синдрома без подъёма сегмента ST, а также установке металлического стента без нанесения цитостатика и стента покрытого цитостатиком было рекомендовано Американской коллегией кардиологов в 2007 году[22].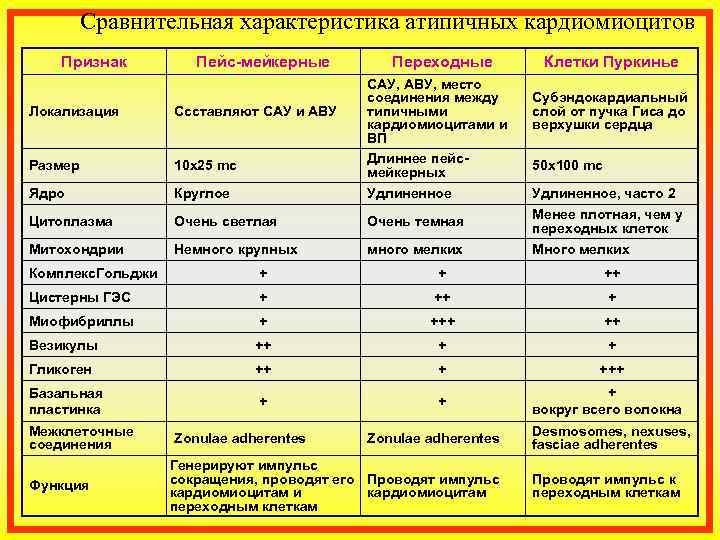 В 2011 году эти рекомендации были немного скорректированы — в частности как аналог клопидогреля (75 мг/сутки) при установке стентов был рекомендован прасугрель по 10 мг в сутки[3].
В 2011 году эти рекомендации были немного скорректированы — в частности как аналог клопидогреля (75 мг/сутки) при установке стентов был рекомендован прасугрель по 10 мг в сутки[3].
Антикоагулянты
Применяют нефракционированный гепарин в течение 48 ч. В начале вводят внутривенно струйно 60 МЕ/кг (но не более 4000 МЕ), затем постоянно внутривенно с начальной скоростью 13 МЕ/кг/ч (но не более 100 МЕ/ч) Дальнейшую дозу подбирают, ориентируясь на АЧТВ, который должен в 1,5-2 раза быть больше нормы и контролироваться через 3, 6, 12, 24 ч.
Также возможно применение низкомолекулярного гепарина (эноксапарина), который вводят под кожу живота в дозе 1 мг/кг 2 раза в сутки до 5-7 дней. За 15 мин до первой п/к инъекции необходимо внутривенно струйно ввести 30 мг данного препарата. Доза первых 2 п/к инъекций — не более 100 мг. Преимущества низкомолекулярного гепарина перед нефракционированным: простота введения и нет необходимости в постоянном контроле свёртывания крови.
Иногда применяют фондапаринукс в дозе 2,5 мг под кожу живота 1 раз в сутки. Данный препарат наиболее удобен в применении и в отличие от гепарина вызывает тромбоцитопению в более редких случаях.
Тромболитическая терапия
Тромболитическая терапия показана при инфаркте миокарда с подъёмом сегмента ST на ЭКГ. Эффективность её убедительно доказана, позволяет восстановить коронарный кровоток, ограничить размер инфаркта и снизить смертность. Тромболизис проводят как можно раньше и в пределах 12 ч от начала заболевания. Для этого применяют стрептокиназу в дозе 1,5 млн МЕ внутривенно на 100 мл 0,9 % раствора хлорида натрия в течение 30-60 мин. Также используют альтеплазу на 100—200 мл изотонического раствора по схеме: 15 мг внутривенно струйно, затем 0,75 мг/кг в течение 30 мин (но не более 50 мг) и далее 0,5 мг/кг в течение 60 мин (но не более 35 мг). Альтеплаза имеет преимущества перед стрептокиназой в виде более эффективного восстановления коронарного кровотока за счёт тропности к фибрину тромба, а также отсутствии антигенности.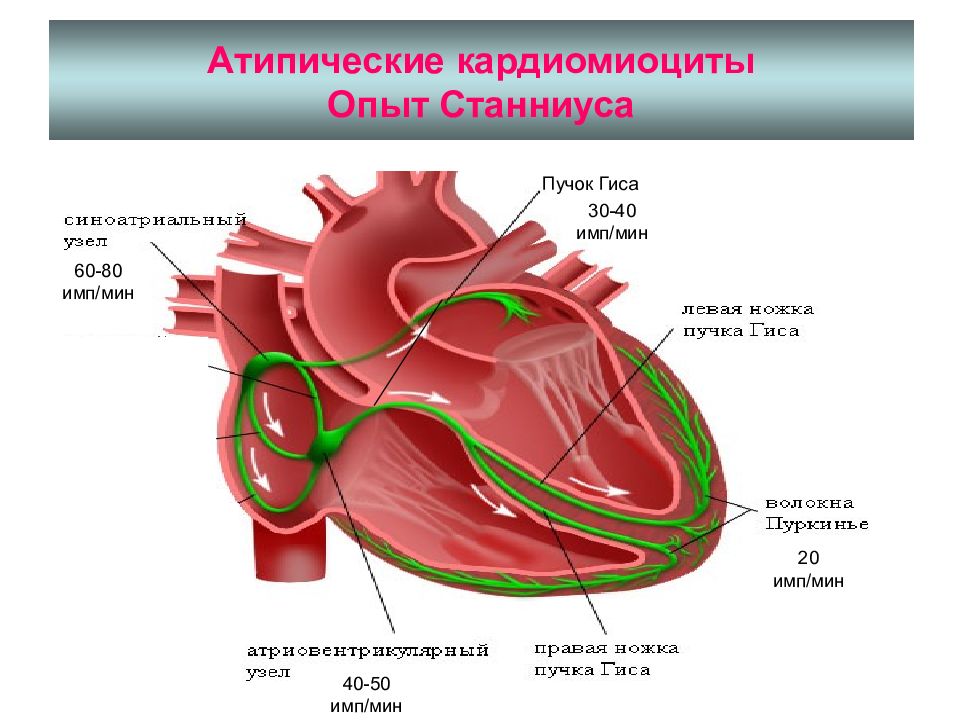
Бета-адреноблокаторы
При отсутствии противопоказаний применяют метопролол, пропранолол или атенолол. Однако эффективность внутривенного применения бета-адреноблокаторов на ранних этапах не доказана и повышает риск развития кардиогенного шока. Хотя по некоторым данным лечение пациента с сердечным приступом во время перевозки в больницу с помощью метопролола, может значительно уменьшить повреждения сердца при инфаркте миокарда [28]
Лечение инфаркта миокарда стволовыми клетками и экзосомами
В настоящее время терапия инфаркта миокарда стволовыми клетками активно исследуется в экспериментах на животных; клинических испытаний на людях, доказывающих эффективность данной методики, не проводилось. Несмотря на то, что в опытах на животных стволовые клетки оказывают положительный эффект, вопрос лечения ими исследован явно недостаточно для перехода к экспериментам на людях.
В эксперименте на крысах было показано, что мобилизация стволовых клеток под действием колониестимулирующих факторов (англ. Colony-stimulating factor) ускоряет процессы репарации миокарда после инфаркта, при этом рубца почти не остаётся[29].
Colony-stimulating factor) ускоряет процессы репарации миокарда после инфаркта, при этом рубца почти не остаётся[29].
В систематическом обзоре, опубликованном специалистами Cochrane Collaboration в 2012 году, сообщается, что терапия стволовыми клетками может существенно улучшить прогноз при остром инфаркте миокарда[30].
В экспериментах на животных даже однократное введение экзосом мезенхимальных стволовых клеток уменьшает размер инфаркта и улучшает состояние подопытных. Очевидно, экзосомы восполняют дефицит ферментов, важных для снабжения клетки энергией, а значит, и для скорейшей реабилитации сердечной мышцы [31][32].
Психические изменения и психозы
При инфаркте миокарда возможны психические изменения невротического и неврозоподобного характера. В основе этих изменений лежит реакция личности на тяжёлое, опасное для жизни заболевание. Помимо особенностей личности, психическое состояние больного ИМ определяется также соматогенными и внешними (средовыми) факторами (психологическое влияние медицинского персонала, родственников, других больных и т.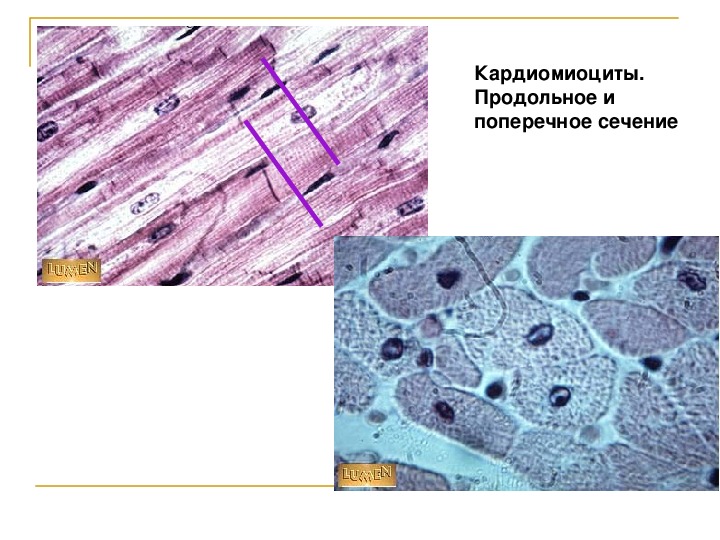 д.).
д.).
Следует различать адекватные (нормальные) и патологические (невротические) реакции. Реакция на болезнь квалифицируется как адекватная, если: а) поведение больного, его переживания и представления о болезни соответствуют полученной от врача информации о тяжести ИМ и его возможных последствиях; б) больной соблюдает режим, следует предписаниям врача и в) больной в состоянии контролировать свои эмоции.
Среди патологических реакций более чем в 40% случаев наблюдается кардиофобическая реакция, при которой больные испытывают страх перед повторным ИМ и перед внезапной смертью от сердечного приступа. Такие больные чрезмерно осторожны, особенно при попытках расширения режима физической активности. Усиление страха сопровождается дрожью в теле, слабостью, потливостью, сердцебиением, чувством нехватки воздуха.
Также одной из патологических реакций при ИМ возможна депрессивная (тревожно-депрессивная) реакция. Отмечается угнетённое настроение. Больные не верят в возможность благоприятного течения заболевания, испытывают внутреннюю напряжённость, предчувствие надвигающейся беды, опасения за исход заболевания, тревогу за благополучие семьи. Характерны нарушения сна, двигательное беспокойство, потливость, учащённое сердцебиение.
Характерны нарушения сна, двигательное беспокойство, потливость, учащённое сердцебиение.
Заметно реже, в основном у пожилых, наблюдается ипохондрическая (депрессивно-ипохондрическая) реакция. При ней отмечаются постоянная и явная переоценка тяжести своего состояния, несоответствие обилия жалоб объективным соматическим изменениям, чрезмерная фиксация внимания на состоянии своего здоровья.
Чревата осложнениями анозогнозическая реакция, при которой отмечается отрицание болезни с игнорированием врачебных рекомендаций и грубыми нарушениями режима.
В отдельных случаях наблюдается истерическая реакция. Для поведения больного характерны эгоцентризм, демонстративность, стремление привлечь к себе внимание окружающих, вызвать сочувствие, эмоциональная лабильность.
Отмеченные выше психические изменения наблюдаются на фоне психической астении: общей слабости, быстрой утомляемости при незначительном физическом или умственном напряжении, ранимости, повышенной возбудимости, нарушениях сна, вегетососудистой неустойчивости.
Психическая астения выражена в большей степени при длительном пребывании на постельном режиме и у больных пожилого возраста.
Если не проводить специальных мероприятий, изменения психики усугубляются, становятся стойкими и в дальнейшем могут значительно препятствовать реабилитации вплоть до инвалидизации по психическому состоянию.
Одно из наиболее грозных осложнений острого периода болезни — психозы, которые наблюдаются примерно в 6—7% случаев. Грубые нарушения поведения, резкие вегетативные сдвиги сопровождаются значительным ухудшением соматического состояния, при психозах чаще наступает летальный исход. В подавляющем большинстве случаев психозы развиваются на 1-й неделе заболевания. Длительность их обычно не превышает 2—5 дней.
Главными причинами психозов при ИМ являются интоксикации продуктами распада из некротического очага в миокарде, ухудшение церебральной гемодинамики и гипоксемия, вызванные нарушением сердечной деятельности. Не случайно психозы наблюдаются чаще всего у больных с обширными поражениями миокарда и острой недостаточностью кровообращения (кардиогенный шок, отёк лёгких).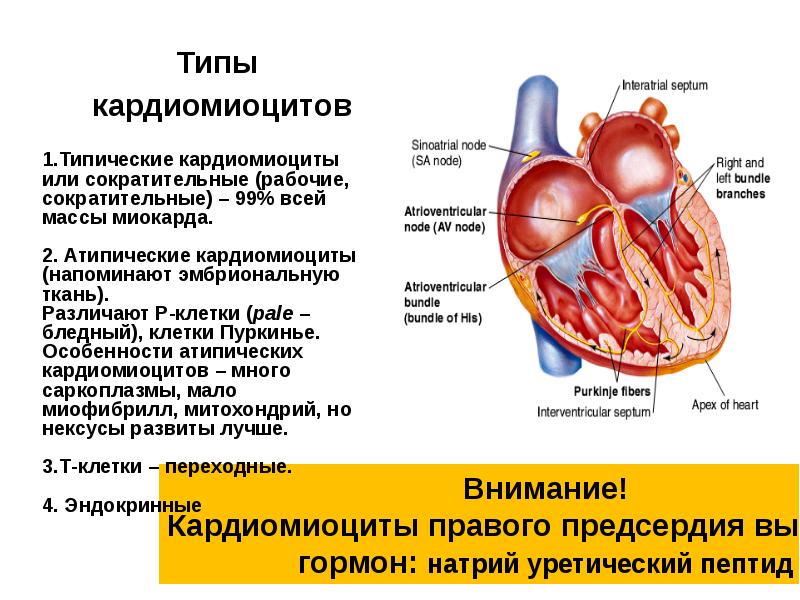
К возникновению психоза при ИМ предрасполагают поражения головного мозга различной природы (последствия черепно-мозговых травм, хронический алкоголизм, церебральный атеросклероз, гипертоническая болезнь и др.) и пожилой возраст.
Чаще всего психоз возникает в вечерние и ночные часы. Как правило, он протекает в форме делирия. Нарушается сознание с потерей ориентировки в окружающей обстановке и во времени, возникают иллюзии и галлюцинации (чаще зрительные), больной испытывает тревогу и страх, нарастает двигательное беспокойство, приводя к двигательному возбуждению (беспрестанные попытки встать с кровати, выбежать в коридор, вылезти в окно и т. д.). Нередко делирию предшествует состояние эйфории — повышенного настроения с отрицанием болезни и грубой переоценкой своих сил и возможностей.
У больных старческого возраста иногда наблюдаются так называемые просоночные состояния: больной, пробуждаясь ночью, встаёт, несмотря на строгий постельный режим, и начинает бродить по больничному коридору, не осознавая, что он серьёзно болен и находится в больнице.
Профилактика
- Антитромботическая терапия аспирином и/или клопидогрелом снижает риск рецидива инфаркта миокарда. Применение клопидогрела и аспирина снижает риск сердчечно-сосудистых событий, но в то же время повышает риск развития кровотечений[33].
- Бета-блокаторы могут применяться для профилактики инфаркта миокарда у людей, перенёсших инфаркт миокарда в прошлом[34]. Из всех бета-блокаторов бисопролол, метопролола сукцинат и карведилол улучшают прогноз у людей со сниженной фракцией выброса левого желудочка ниже 40 %[35]. Бета-блокаторы после перенесённого инфаркта миокарда снижают смертность и заболеваемость.
- Терапия статинами после инфаркта миокарда снижает смертность[36][37].
- Применение полиненасыщенных длинноцепочечных омега-3 жирных кислот (докозагексаеновой и эйкозапентаеновой) в больших дозах также улучшает прогноз после перенесённого инфаркта миокарда[38][39][40].

- Применение нефракционированного гепарина внутривенно или низкомолекулярного гепарина подкожно у лиц с первичной нестабильной стенокардией снижает риск инфаркта миокарда[41].
- Ингибиторы АПФ также применяют для профилактики инфаркта миокарда у людей со сниженной фракцией выброса левого желудочка ниже 40 %[42].
Прогноз
Прогноз заболевания условно неблагоприятный, после возникновения инфаркта в миокарде развиваются необратимые ишемические изменения, что может привести к осложнениям различной степени тяжести.
Материал из Википедии — свободной энциклопедии
Дела сердечные — Ingredients: — LiveJournal
Как известно, сердце — это мышечный орган, который приводит в движение кровь, благодаря своим ритмическим сокращениям. Мышечная ткань сердца представлена особыми клетками — кардиомицитами. В ходе гистогенеза возникает 3 вида кардиомиоцитов:
- рабочие, или типичные, или же сократительные, кардиомиоциты,
- атипичные кардиомиоциты (сюда входят пейсмекерные, проводящие и переходные кардиомиоциты), а также
- секреторные кардиомиоциты.

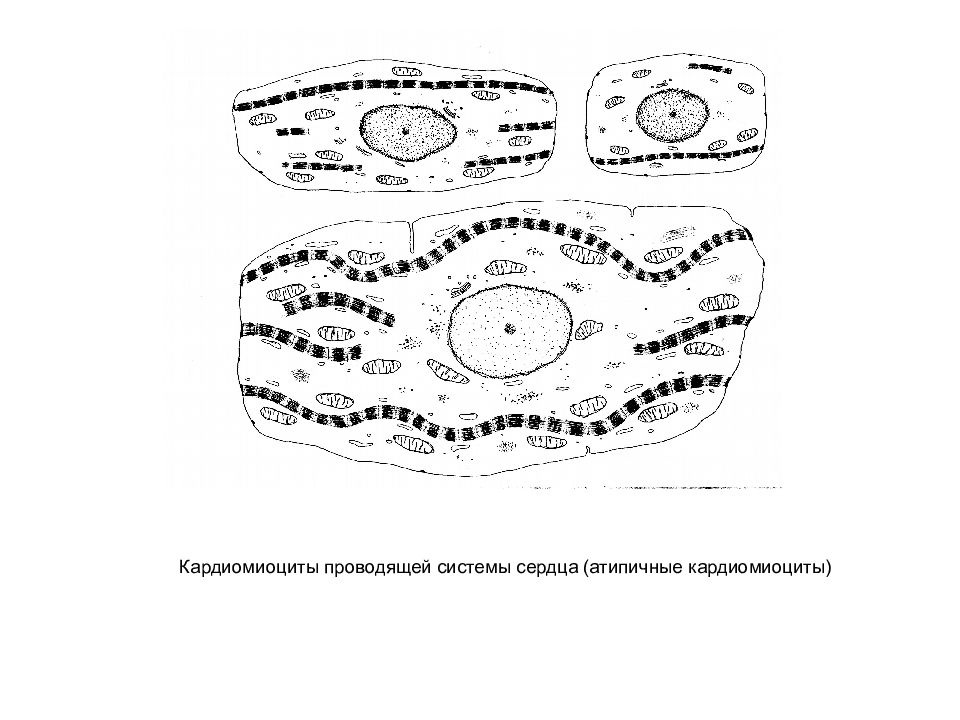
Синусные (пейсмекерные) кардиомиоциты способны автоматически в определенном ритме сменять состояние сокращения на состояние расслабления (в этих клетках меньше КУД — критический уровень деполяризации). Они воспринимают управляющие сигналы от нервных волокон, в ответ на что изменяют ритм сократительной деятельности. Синусные (пейсмекерные) кардиомиоциты передают управляющие сигналы переходным кардиомиоцитам, а последние — проводящим. Проводящие кардиомиоциты образуют цепочки клеток, соединенных своими концами. Первая клетка в цепочке воспринимает управляющие сигналы от синусных кардиомиоцитов и передает их далее — другим проводящим кардиомиоцитам. Клетки, замыкающие цепочку, передают сигнал через переходные кардиомиоциты рабочим.
Секреторные кардиомиоциты располагаются в основном в правом предсердии и ушках и выполняют особую функцию.
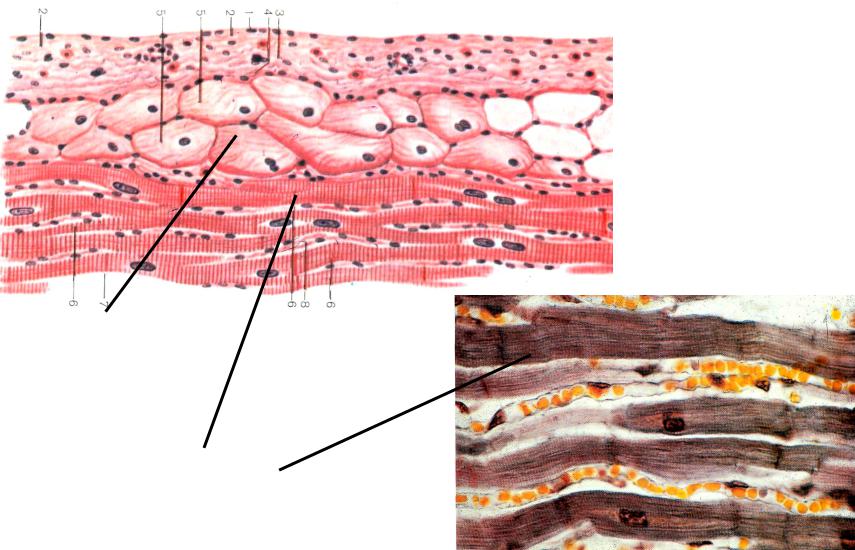 Они вырабатывают гормон — натрийуретический фактор (ПНФ). При растяжении предсердий секрет поступает в кровь и воздействует на собирательные трубочки почки, клетки клубочковой зоны коры надпочечников, участвующие в регуляции объема внеклеточной жидкости и уровня артериального давления. ПНФ вызывает стимуляцию диуреза и натриуреза (в почках), расширение сосудов, угнетение секреции альдостерона и кортизола (в надпочечниках), снижение артериального давление. В частности, по этой причине при сердечной недостаточности наблюдаются отёки. Мой домашний рецепт: если вы не можете ни вздохнуть, ни повернуться от боли в груди, пульс бьёт в ушах, а морда похожа на утро в китайской деревне, то скорее погрызите сахар кусками. Это поможет справиться с острой сердечной недостаточностью, компенсировав дефицит глюкозы, вызванный всплеском адреналина. Потом, конечно, у вас может случиться приступ панкреохолецистита, но им уже можно заняться на досуге. Главное, вы будете живы. По моему скромному мнению, именно эта история приключилась с красноярским следователем.
Они вырабатывают гормон — натрийуретический фактор (ПНФ). При растяжении предсердий секрет поступает в кровь и воздействует на собирательные трубочки почки, клетки клубочковой зоны коры надпочечников, участвующие в регуляции объема внеклеточной жидкости и уровня артериального давления. ПНФ вызывает стимуляцию диуреза и натриуреза (в почках), расширение сосудов, угнетение секреции альдостерона и кортизола (в надпочечниках), снижение артериального давление. В частности, по этой причине при сердечной недостаточности наблюдаются отёки. Мой домашний рецепт: если вы не можете ни вздохнуть, ни повернуться от боли в груди, пульс бьёт в ушах, а морда похожа на утро в китайской деревне, то скорее погрызите сахар кусками. Это поможет справиться с острой сердечной недостаточностью, компенсировав дефицит глюкозы, вызванный всплеском адреналина. Потом, конечно, у вас может случиться приступ панкреохолецистита, но им уже можно заняться на досуге. Главное, вы будете живы. По моему скромному мнению, именно эта история приключилась с красноярским следователем.
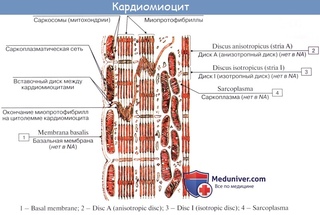
Сократительные кардиомиоциты имеют удлиненную (100—150 мкм) форму, близкую к цилиндрической. Их концы соединяются друг с другом, так что цепочки клеток составляют так называемые функциональные волокна (толщиной до 20 мкм). В области контактов клеток образуются так называемые вставочные диски. Кардиомиоциты могут ветвиться и образуют трехмерную сеть. Их поверхности покрыты базальной мембраной, в которую снаружи вплетаются ретикулярные и коллагеновые волокна. Ядро кардиомиоцита (иногда их два у человека, а у зверей вроде мыши или крысы вообще нормально по 4, 8 и даже 16 и 32) овальное и лежит в центральной части клетки. У полюсов ядра сосредоточены немногочисленные органеллы общего значения. Миофибриллы слабо обособлены друг от друга, могут расщепляться. Их строение аналогично строению миофибрилл миосимпласта скелетного мышечного волокна. От поверхности плазмолеммы в глубь кардиомиоцита направлены Т-трубочки, находящиеся на уровне Z-линии. Их мембраны сближены, контактируют с мембранами гладкой эндоплазматической (т. е. саркоплазматической) сети. Петли последней вытянуты вдоль поверхности миофибрилл и имеют латеральные утолщения (L-системы), формирующие вместе с Т-трубочками триады или диады (назначение этой системы — депо Ca2+, необходимого для сокращения). В цитоплазме имеются включения гликогена и липидов(источники энергии), особенно много включений миоглобина (обеспечивает кардиомиоциты кислородом при сдавливании сосудов во время мышечной работы). Механизм сокращения кардиомиоцитов такой же, как у миосимпласта.
е. саркоплазматической) сети. Петли последней вытянуты вдоль поверхности миофибрилл и имеют латеральные утолщения (L-системы), формирующие вместе с Т-трубочками триады или диады (назначение этой системы — депо Ca2+, необходимого для сокращения). В цитоплазме имеются включения гликогена и липидов(источники энергии), особенно много включений миоглобина (обеспечивает кардиомиоциты кислородом при сдавливании сосудов во время мышечной работы). Механизм сокращения кардиомиоцитов такой же, как у миосимпласта.
Кардиомиоциты соединяются друг с другом своими торцевыми концами. Здесь образуются так называемые вставочные диски: эти участки выглядят как тонкие пластинки при увеличении светового микроскопа. Фактически же концы кардиомиоцитов имеют неровную поверхность, поэтому выступы одной клетки входят во впадины другой. Поперечные участки выступов соседних клеток соединены друг с другом интердигитациями и десмосомами. К каждой десмосоме со стороны цитоплазмы подходит миофибрилла, закрепляющаяся концом в десмоплакиновом комплексе. Таким образом, при сокращении тяга одного кардиомиоцита передается другому. Боковые поверхности выступов кардиомиоцитов объединяются нексусами (или щелевыми соединениями). Это создает между ними метаболические связи и обеспечивает синхронность сокращений.
Таким образом, при сокращении тяга одного кардиомиоцита передается другому. Боковые поверхности выступов кардиомиоцитов объединяются нексусами (или щелевыми соединениями). Это создает между ними метаболические связи и обеспечивает синхронность сокращений.
Возможности регенерации сердечной мышечной ткани. При длительной усиленной работе (например, в условиях постоянно повышенного артериального давления крови) происходит рабочая гипертрофия кардиомиоцитов. Кардиомиоциты относятся к детерминированным клеткам, не способным к делению. У них отсутствует клеточный центр, редуцирована гранулярная эндоплазматическая сеть, вообще хорошо развиты только митохондрии, обеспечивающие энергией работу по мышечному сокращению, поэтому погибающие кардиомиоциты (в частности, при инфаркте миокарда) не восстанавливаются, а замещаются элементами соединительной ткани.
Однако накопилось уже порядочное количество данных о том, что кардиомиоциты таки обновляются в течение жизни.
Olaf Bergmann с группой товарищей опубликовали в Science в 2009-м статью об исследовании пролиферативной активности кардиомиоцитов людей с помощью измерения уровня C14, который встраивается в ДНК активно делящихся клеток и обладает периодом полураспада 5370 лет (т.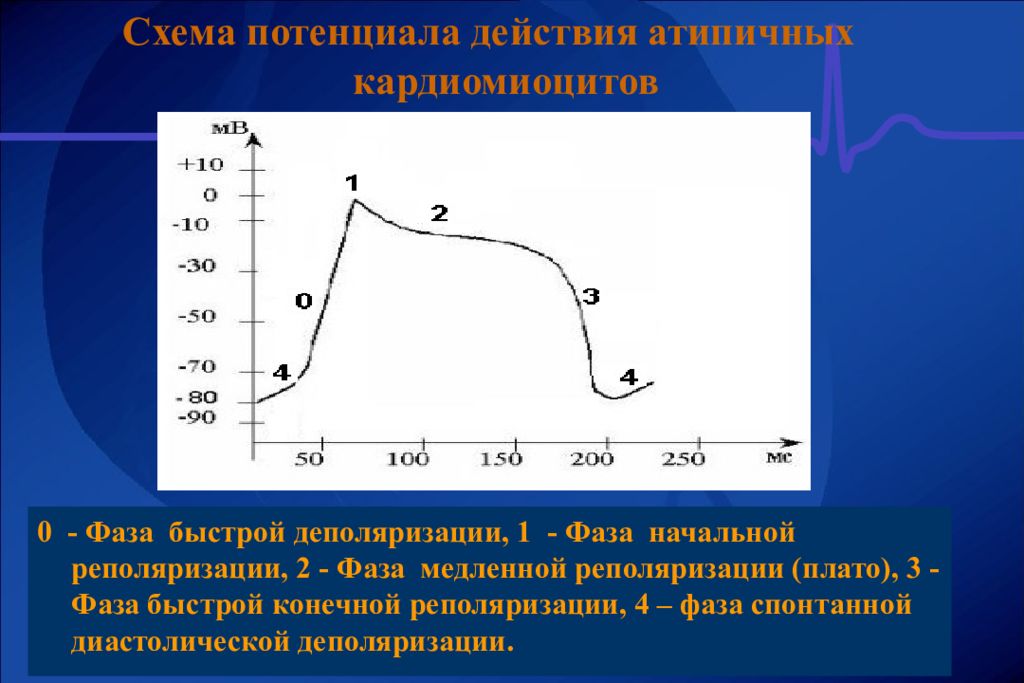 е. содержание С14 в ДНК клетки соответствует содержанию С14 в атмосфере во время образования этой самой клетки). Холодная война с её испытаниями ядерного оружия принесла полезный инструмент для детекции даты рождения клетки.
е. содержание С14 в ДНК клетки соответствует содержанию С14 в атмосфере во время образования этой самой клетки). Холодная война с её испытаниями ядерного оружия принесла полезный инструмент для детекции даты рождения клетки.
С помощью этого инструмента и математической модели удалось оценить, что в возрасте 25 лет у человека делятся около 1% кардиомиоцитов в год, а к 75 годам их доля снижается до 0,45%.
Источником новых кардиомиоцитов могут быть клетки-предшественники из костного мозга, мигрирующие в миокард. Более того, уже применяют трансплантацию стволовых клеток костного мозга в миокард (к примеру, Donndorf. J Thorac Cardiovasc Surg 2011;142:911-920). Эмбриональные стволовые клетки также могут дифференцироваться в кардиомиоциты. Но и это ещё не всё. Оказалось, что далеко ходить не надо и в самом сердце есть стволовые клетки, которые дают начало различным видам кардиомиоцитов.
Dr. Piero Anversa уже 25 лет копается в сердце в поисках стволовых клеток и обновления кардиомиоцитов. И да, оказывается, что пролиферирующих кардиомиоцитов крайне мало, но они есть и конфокальная микроскопия позволяет их пересчитать. У пациентов после инфаркта миокарда поличество пролиферирующих кардиомиоцитов увеличивается в десятки раз (и составляет 0,08%, ага). Таким образом, изучение механизмов, запускающих обновление кардиомиоцитов приведёт к совершенно новому подходу в восстановительной терапии после инфарктов и при сердечной недостаточности.
И да, оказывается, что пролиферирующих кардиомиоцитов крайне мало, но они есть и конфокальная микроскопия позволяет их пересчитать. У пациентов после инфаркта миокарда поличество пролиферирующих кардиомиоцитов увеличивается в десятки раз (и составляет 0,08%, ага). Таким образом, изучение механизмов, запускающих обновление кардиомиоцитов приведёт к совершенно новому подходу в восстановительной терапии после инфарктов и при сердечной недостаточности.
Ki-67 (маркер активной фазы клеточного цикла) в ядре кадриомиоцита крысы.
вестибулярный аппарат — Docsity
РЕФЕРАТ На тему :Проводящая система сердца, ведущие узлы, законы движения,регуляция кровообращения Составила: Толстенко М группа 241 Сердце — мышечный орган, состоящий из четырех камер: правого предсердия, собирающего венозную кровь из организма; правого желудочка, нагнетающего венозную кровь в малый круг кровообращения — в легкие, где и происходит газообмен с атмосферным воздухом; левого предсердия, собирающего обогащенную кислородом кровь из легочных вен; левого желудочка, обеспечивающего продвижение крови ко всем органам организма. Кардиомиоциты Стенки предсердий и желудочков состоят из поперечно-полосатой мышечной ткани, представленной кардиомиоцитами и имеющей ряд отличий от ткани скелетных мышц. Кардиомиоциты составляют около 25% от общего числа клеток сердца и около 70% массы миокарда. В составе стенок сердца имеются фибробласты, гладкомышечные клетки сосудов, эндотелиальные и нервные клетки. В мембране кардиомиоцитов содержатся белки, выполняющие транспортные, ферментативные и рецепторные функции. Среди последних — рецепторы гормонов, катехоламинов и других сигнальных молекул. Кардиомиоциты имеют одно или несколько ядер, множество рибосом и аппарат Гольджи. Они способны синтезировать сократительные и белковые молекулы. В этих клетках синтезируются некоторые белки, специфические для определенных стадий клеточного цикла. Однако кардиомиоциты рано теряют способность делиться и их созревание, равно как и приспособление к возрастающим нагрузкам, сопровождается увеличением массы клеток и их размеров. Причины потери клетками способности делиться остаются неясными.
Кардиомиоциты Стенки предсердий и желудочков состоят из поперечно-полосатой мышечной ткани, представленной кардиомиоцитами и имеющей ряд отличий от ткани скелетных мышц. Кардиомиоциты составляют около 25% от общего числа клеток сердца и около 70% массы миокарда. В составе стенок сердца имеются фибробласты, гладкомышечные клетки сосудов, эндотелиальные и нервные клетки. В мембране кардиомиоцитов содержатся белки, выполняющие транспортные, ферментативные и рецепторные функции. Среди последних — рецепторы гормонов, катехоламинов и других сигнальных молекул. Кардиомиоциты имеют одно или несколько ядер, множество рибосом и аппарат Гольджи. Они способны синтезировать сократительные и белковые молекулы. В этих клетках синтезируются некоторые белки, специфические для определенных стадий клеточного цикла. Однако кардиомиоциты рано теряют способность делиться и их созревание, равно как и приспособление к возрастающим нагрузкам, сопровождается увеличением массы клеток и их размеров. Причины потери клетками способности делиться остаются неясными.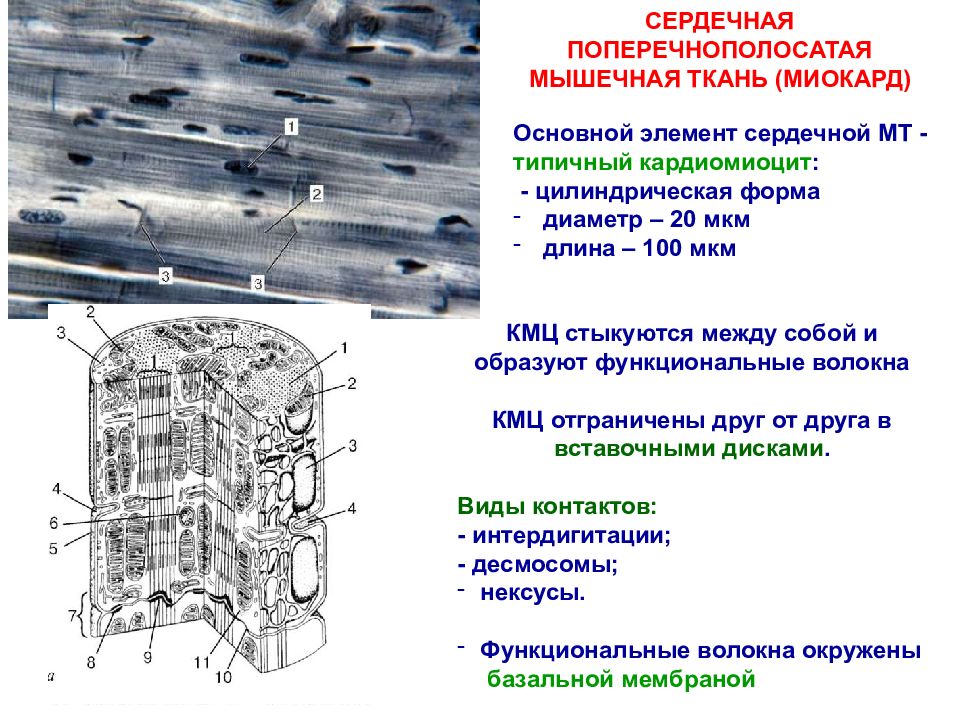 Кардиомиоциты отличаются по своему строению, свойствам и функциям. Различают типичные, или сократительные, кардиомиоциты и атипичные, формирующие в сердце проводящую систему. Типичные кардиомиоциты — сократительные клетки, образующие предсердия и желудочки. Атипичные кардиомиоциты — клетки проводящей системы сердца, обеспечивающие возникновение возбуждения в сердце и проведение его от места возникновения к сократительным элементам предсердий и желудочков. Абсолютное большинство кардиомиоцитов (волокон) сердечной мышцы принадлежит к рабочему миокарду, который обеспечивает сокращения сердца. Сокращение миокарда называют систолой, расслабление — диастолой. Имеются также атипичные кардиомиоциты и волокна сердца, функцией которых является генерация возбуждения и проведение его к сократительному миокарду предсердий и желудочков. Эти клетки и волокна формируют проводящую систему сердца. Атриовентрикулярный узел Этот элемент проводящей системы расположен в углу между основанием правого предсердия и межпредсердной перегородкой.
Кардиомиоциты отличаются по своему строению, свойствам и функциям. Различают типичные, или сократительные, кардиомиоциты и атипичные, формирующие в сердце проводящую систему. Типичные кардиомиоциты — сократительные клетки, образующие предсердия и желудочки. Атипичные кардиомиоциты — клетки проводящей системы сердца, обеспечивающие возникновение возбуждения в сердце и проведение его от места возникновения к сократительным элементам предсердий и желудочков. Абсолютное большинство кардиомиоцитов (волокон) сердечной мышцы принадлежит к рабочему миокарду, который обеспечивает сокращения сердца. Сокращение миокарда называют систолой, расслабление — диастолой. Имеются также атипичные кардиомиоциты и волокна сердца, функцией которых является генерация возбуждения и проведение его к сократительному миокарду предсердий и желудочков. Эти клетки и волокна формируют проводящую систему сердца. Атриовентрикулярный узел Этот элемент проводящей системы расположен в углу между основанием правого предсердия и межпредсердной перегородкой.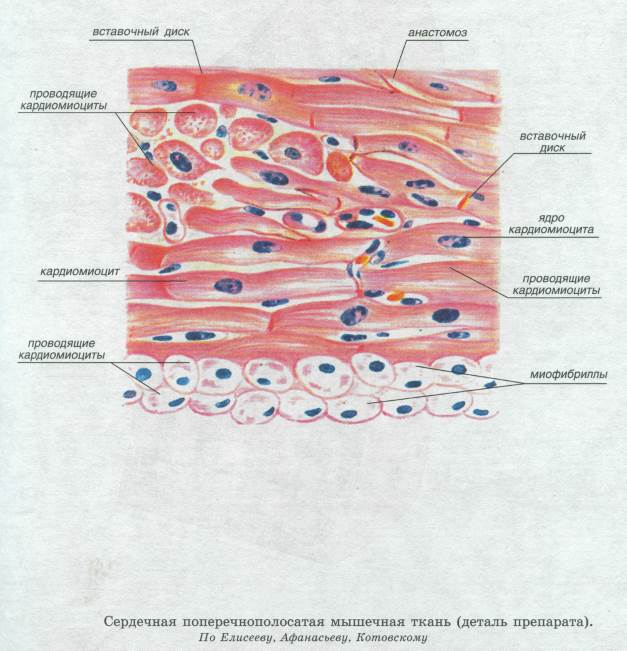 Его размеры — 5х3 мм. Узел задерживает часть импульсов от водителя ритма и передаёт их на желудочки с частотой 40-60 в минуту. Пучок Гиса Это проводящий путь сердца, который обеспечивает связь между миокардом предсердий и желудочков. В межжелудочковой перегородке происходит его разветвление на две ножки, каждая из которых идёт к своему желудочку. Длина общего ствола составляет от 8 до 18 мм. Он проводит импульсы с частотой 20-40 в минуту. Волокна Пуркинье Это концевая часть проводящей системы. Волокна отходят от ножек пучка Гиса и обеспечивают передачу импульсов на все участки миокарда желудочков. Частота передачи — не более 20 в минуту. Внутриклеточные механизмы реализуются за счет свойств миокардиальных волокон и проявляются даже на изолированном и денервированном сердце. Один из этих механизмов отражен в законе Франка — Старлинга, который называют также законом гетерометрической саморегуляции или законом сердца. Закон Франка — Старлинга утверждает, что при увеличении растяжения миокарда во время диастолы увеличивается сила его сокращения в систолу.
Его размеры — 5х3 мм. Узел задерживает часть импульсов от водителя ритма и передаёт их на желудочки с частотой 40-60 в минуту. Пучок Гиса Это проводящий путь сердца, который обеспечивает связь между миокардом предсердий и желудочков. В межжелудочковой перегородке происходит его разветвление на две ножки, каждая из которых идёт к своему желудочку. Длина общего ствола составляет от 8 до 18 мм. Он проводит импульсы с частотой 20-40 в минуту. Волокна Пуркинье Это концевая часть проводящей системы. Волокна отходят от ножек пучка Гиса и обеспечивают передачу импульсов на все участки миокарда желудочков. Частота передачи — не более 20 в минуту. Внутриклеточные механизмы реализуются за счет свойств миокардиальных волокон и проявляются даже на изолированном и денервированном сердце. Один из этих механизмов отражен в законе Франка — Старлинга, который называют также законом гетерометрической саморегуляции или законом сердца. Закон Франка — Старлинга утверждает, что при увеличении растяжения миокарда во время диастолы увеличивается сила его сокращения в систолу.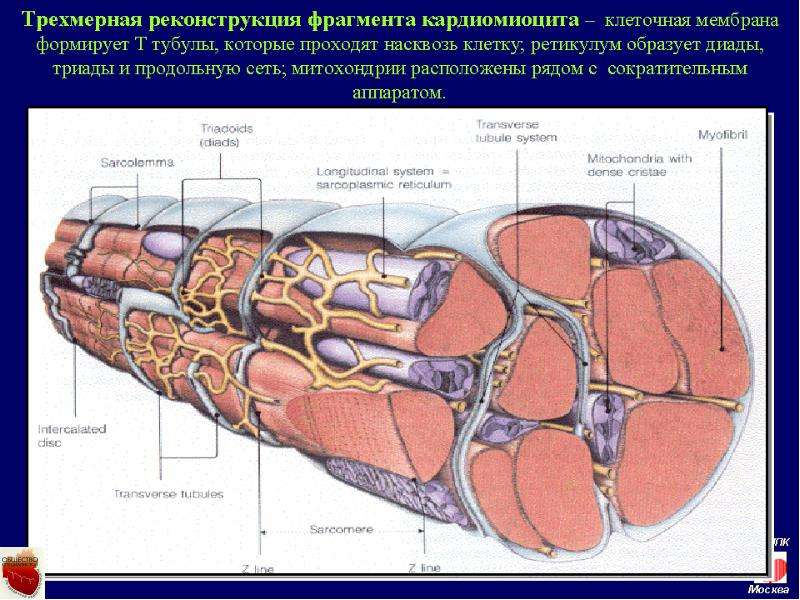 Такая закономерность выявляется при растяжении волокон миокарда не более чем на 45% от их исходной длины. Дальнейшее растяжение миокардиальных волокон приводит к снижению эффективности сокращения. Сильное растяжение создает опасность развития тяжелой патологии сердца. В естественных условиях степень растяжения желудочков зависит от величины конечно-диастолического объема, определяемого наполнением желудочков кровью, поступающей во время диастолы из вен, величиной конечно- систолического объема, силой сокращения предсердий. Чем больше венозный возврат крови к сердцу и величина конечно-диастолического объема желудочков, тем больше сила их сокращения. Увеличение притока крови к желудочкам называют нагрузкой объемом или преднагрузкой. Прирост сократительной активности сердца и возрастание объема сердечного выброса при увеличении преднагрузки не требуют большого увеличения энергетических затрат. Одна из закономерностей саморегуляции сердца была открыта Анрепом (феномен Анрепа). Она выражается в том, что при увеличении сопротивления выбросу крови из желудочков сила их сокращения возрастает.
Такая закономерность выявляется при растяжении волокон миокарда не более чем на 45% от их исходной длины. Дальнейшее растяжение миокардиальных волокон приводит к снижению эффективности сокращения. Сильное растяжение создает опасность развития тяжелой патологии сердца. В естественных условиях степень растяжения желудочков зависит от величины конечно-диастолического объема, определяемого наполнением желудочков кровью, поступающей во время диастолы из вен, величиной конечно- систолического объема, силой сокращения предсердий. Чем больше венозный возврат крови к сердцу и величина конечно-диастолического объема желудочков, тем больше сила их сокращения. Увеличение притока крови к желудочкам называют нагрузкой объемом или преднагрузкой. Прирост сократительной активности сердца и возрастание объема сердечного выброса при увеличении преднагрузки не требуют большого увеличения энергетических затрат. Одна из закономерностей саморегуляции сердца была открыта Анрепом (феномен Анрепа). Она выражается в том, что при увеличении сопротивления выбросу крови из желудочков сила их сокращения возрастает. Такое увеличение сопротивления изгнанию крови получило название нагрузки давлением или постнагрузки. Оно возрастает при повышении артериального давления крови. В этих условиях резко возрастает работа и энергетические потребности желудочков. Увеличение сопротивления изгнанию крови левым желудочком может развиться также при стенозе аортального клапана и сужении аорты. Еще одна закономерность саморегуляции сердца отражена в феномене Боудича, называемом также феноменом лестницы или законом гомеометрической саморегуляции. Лестница Боудича (ритмоионотропная зависимость 1878 г.) — постепенное увеличение силы сердечных сокращений до максимальной амплитуды, наблюдаемое при последовательном нанесении на него раздражителей постоянной силы. Закон гомеометрической саморегуляции (феномен Боудича) проявляется в том, что при увеличении частоты сердечных сокращений сила сокращений возрастает. Одним из механизмов усиления сокращения миокарда является увеличение содержания ионов Са2+ в саркоплазме миокардиальных волокон.
Такое увеличение сопротивления изгнанию крови получило название нагрузки давлением или постнагрузки. Оно возрастает при повышении артериального давления крови. В этих условиях резко возрастает работа и энергетические потребности желудочков. Увеличение сопротивления изгнанию крови левым желудочком может развиться также при стенозе аортального клапана и сужении аорты. Еще одна закономерность саморегуляции сердца отражена в феномене Боудича, называемом также феноменом лестницы или законом гомеометрической саморегуляции. Лестница Боудича (ритмоионотропная зависимость 1878 г.) — постепенное увеличение силы сердечных сокращений до максимальной амплитуды, наблюдаемое при последовательном нанесении на него раздражителей постоянной силы. Закон гомеометрической саморегуляции (феномен Боудича) проявляется в том, что при увеличении частоты сердечных сокращений сила сокращений возрастает. Одним из механизмов усиления сокращения миокарда является увеличение содержания ионов Са2+ в саркоплазме миокардиальных волокон.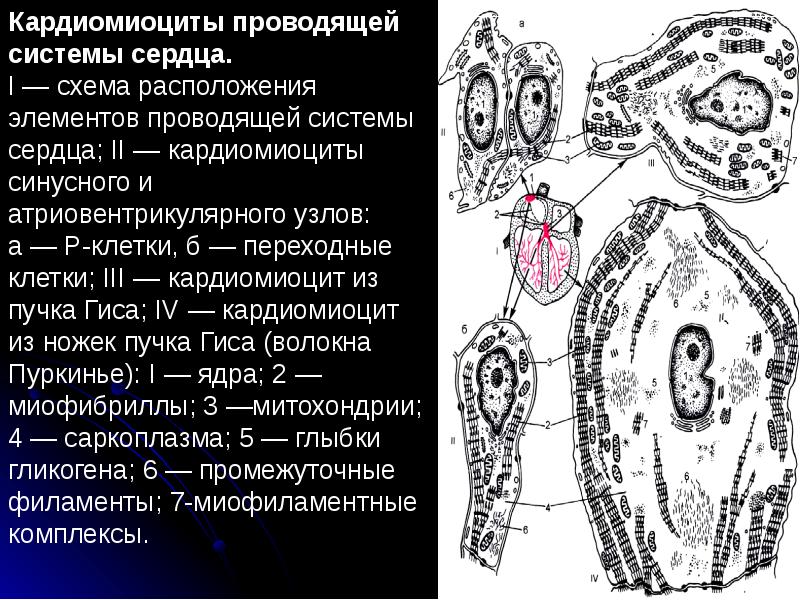 При частых возбуждениях ионы Са2+ не успевают удаляться из саркоплазмы, что создает условия для более интенсивного взаимодействия между актиновыми и миозиновыми нитями. Феномен Боудича был выявлен на изолированном сердце. В естественных условиях проявление гомеометрической саморегуляции можно наблюдать при резком повышении тонуса симпатической нервной системы и увеличении в крови уровня адреналина. В клинических условиях некоторые проявления этого феномена можно наблюдать у больных при тахикардии, когда частота сокращений сердца быстро возрастает. Регуляция кровообращения Иннервация сердца и сосудов Деятельность сердца регулируется двумя парами нервов: блуждающими и симпатическими (рис. 32). Блуждающие нервы берут начало в продолговатом мозге, а симпатические нервы отходят от шейного симпатического узла. Блуждающие нервы тормозят сердечную деятельность. Если начать раздражать блуждающий нерв электрическим током, то происходит замедление и даже остановка сердечных сокращений (рис. 33). После прекращения раздражения блуждающего нерва работа сердца восстанавливается.
При частых возбуждениях ионы Са2+ не успевают удаляться из саркоплазмы, что создает условия для более интенсивного взаимодействия между актиновыми и миозиновыми нитями. Феномен Боудича был выявлен на изолированном сердце. В естественных условиях проявление гомеометрической саморегуляции можно наблюдать при резком повышении тонуса симпатической нервной системы и увеличении в крови уровня адреналина. В клинических условиях некоторые проявления этого феномена можно наблюдать у больных при тахикардии, когда частота сокращений сердца быстро возрастает. Регуляция кровообращения Иннервация сердца и сосудов Деятельность сердца регулируется двумя парами нервов: блуждающими и симпатическими (рис. 32). Блуждающие нервы берут начало в продолговатом мозге, а симпатические нервы отходят от шейного симпатического узла. Блуждающие нервы тормозят сердечную деятельность. Если начать раздражать блуждающий нерв электрическим током, то происходит замедление и даже остановка сердечных сокращений (рис. 33). После прекращения раздражения блуждающего нерва работа сердца восстанавливается. Под влиянием импульсов, поступающих к сердцу по симпатическим нервам, учащается ритм сердечной деятельности и усиливается каждое сердечное сокращение (рис. 34). При этом возрастает систолический, или ударный, объем крови. Если собака находится в спокойном состоянии, ее сердце сокращается от 50 до 90 раз в 1 мин. Если перерезать все нервные волокна, направляющиеся к сердцу, сердце сокращается теперь 120- 140 раз в 1 мин. Если перерезать только блуждающие нервы сердца, ритм сердца возрастет до 200-250 ударов в 1 мин. Это связано с влиянием сохранившихся симпатических нервов. Сердце человека и многих животных находится под постоянным сдерживающим влиянием блуждающих нервов. Блуждающий и симпатический нервы сердца обычно действуют согласованно: если повышается возбудимость центра блуждающего нерва, то соответственно понижается возбудимость центра симпатического нерва. Во время сна, в состоянии физического покоя организма сердце замедляет свой ритм за счет усиления влияния блуждающего нерва и некоторого снижения: влияния симпатического нерва.
Под влиянием импульсов, поступающих к сердцу по симпатическим нервам, учащается ритм сердечной деятельности и усиливается каждое сердечное сокращение (рис. 34). При этом возрастает систолический, или ударный, объем крови. Если собака находится в спокойном состоянии, ее сердце сокращается от 50 до 90 раз в 1 мин. Если перерезать все нервные волокна, направляющиеся к сердцу, сердце сокращается теперь 120- 140 раз в 1 мин. Если перерезать только блуждающие нервы сердца, ритм сердца возрастет до 200-250 ударов в 1 мин. Это связано с влиянием сохранившихся симпатических нервов. Сердце человека и многих животных находится под постоянным сдерживающим влиянием блуждающих нервов. Блуждающий и симпатический нервы сердца обычно действуют согласованно: если повышается возбудимость центра блуждающего нерва, то соответственно понижается возбудимость центра симпатического нерва. Во время сна, в состоянии физического покоя организма сердце замедляет свой ритм за счет усиления влияния блуждающего нерва и некоторого снижения: влияния симпатического нерва. Во время физической работы ритм сердца учащается. При этом происходит усиление влияния симпатического нерва и снижение влияния блуждающего нерва на сердце. Таким путем обеспечивается экономный режим работы сердечной мышцы.
Во время физической работы ритм сердца учащается. При этом происходит усиление влияния симпатического нерва и снижение влияния блуждающего нерва на сердце. Таким путем обеспечивается экономный режим работы сердечной мышцы.
ЛЕКЦИЯ 27 из 39 ЭЛЕКТРИЧЕСКАЯ И СОКРАТИТЕЛЬНАЯ ФУНКЦИИ
ЛЕКЦИЯ 27 (из 39) ЭЛЕКТРИЧЕСКАЯ И СОКРАТИТЕЛЬНАЯ ФУНКЦИИ СЕРДЦА А. Т. Марьянович, проф.
ПРЕДЫДУЩАЯ ЛЕКЦИЯ ГЕМОСТАЗ
КАРДИОПОМПА ДЛЯ ЗАКРЫТОГО МАССАЖА ПРИСОСКА ПОДНЯТИЕ ПЕРЕДНЕЙ ГРУДНОЙ СТЕНКИ РАСШИРЕНИЕ ГРУДНОЙ ПОЛОСТИ
ДЕФИБРИЛЛЯЦИ
ПЛАН ЛЕКЦИИ 1. РОЛЬ СЕРДЦА В КРОВООБРАЩЕНИИ 2. ПРОИЗВОДИТЕЛЬНОСТЬ СЕРДЦА 3. ПРОВОДЯЩАЯ СИСТЕМА И РАБОЧИЙ МИОКАРД 4. СЕРДЕЧНЫЙ ЦИКЛ 5. ЭКГ
II ПРОИЗВОДИТЕЛЬНОСТЬ СЕРДЦА
СО (УО) ОБЪЕМ КРОВИ, ВЫБРАСЫВАЕМЫЙ ЖЕЛУДОЧКОМ ЗА ОДНО СОКРАЩЕНИЕ
ЧСС 60 -80 БРАДИ НОРМА ТАХИ
УО МОК ЧСС PO 2 VO 2 ГД МОД ЧД
70 уд/мин 5 л/мин 70 мл PO 2 VO 2 ЧД МОД ГД
СОПЖ = СОЛЖ ОБЪЕМНАЯ СКОРОСТЬ ПОСТОЯННА ПО ВСЕЙ ПРОТЯЖЕННОСТИ СОСУДИСТОГО РУСЛА
СУБМАКСИМАЛЬНАЯ 110 мл Х 180 уд/мин ≈ 20 л/мин
МАКСИМАЛЬНАЯ 30 л/мин
КОНЕЧНО-ДИАСТОЛИЧЕСКИЙ ОБЪЕМ — КДО КОЛИЧЕСТВО КРОВИ, НАКАПЛИВАЮЩЕЕСЯ В ЖЕЛУДОЧКЕ (и П, и Л) В КОНЦЕ ДИАСТОЛЫ ПЕРЕД СИСТОЛОЙ ≈ 140 мл
КОНЕЧНОСИСТОЛИЧЕСКИЙ ОБЪЕМ КОЛИЧЕСТВО КРОВИ, ОСТАЮЩЕЕСЯ В ЖЕЛУДОЧКЕ ПОСЛЕ СИСТОЛЫ КСО = КДО – СО 140 – 70 мл ≈ 70
III ПРОВОДЯЩАЯ СИСТЕМА И РАБОЧИЙ МИОКАРД
ДЛЯ ЭФФЕКТИВНОЙ НАСОСНОЙ ДЕЯТЕЛЬНОСТИ НУЖНА СИНХРОННАЯ РАБОТА МЫШЕЧНЫХ ВОЛОКОН МИОКАРДА
ДВА СИНЦИТИЯ ТИПИЧНЫЕ КАРДИОМИОЦИТЫ АТИПИЧНЫЕ КАРДИОМИОЦИТЫ
ТИПИЧНЫЕ клетки рабочего миокарда, сократительные 99% МАССЫ МИОКАРДА МНОГО МИОФИБРИЛЛ, МИТОХОНДРИЙ, РАЗВИТ СПР ОБЕСПЕЧИВАЮТ СОКРАЩЕНИЕ
ТИПИЧНЫЕ КАРДИОМИОЦИТЫ
АТИПИЧНЫЕ клетки проводящей системы, пейсмекерные СЛАБО РАЗВИТ СОКРАТИТЕЛЬНЫЙ АППАРАТ ОБЛАДАЮТ АВТОМАТИЕЙ
СИНОАТРИАЛЬНЫЙ УЗЕЛ
IV СВОЙСТВА МИОКАРДА
СВОЙСТВА МИОКАРДА АВТОМАТИЯ ВОЗБУДИМОСТЬ ПРОВОДИМОСТЬ СОКРАТИМОСТЬ
АВТОМАТИЯ СПОСОБНОСТЬ АТИПИЧНЫХ КАРДИОМИОЦИТОВ К САМОВОЗБУЖДЕНИЮ СПОНТАННОЙ ГЕНЕРАЦИИ ПД В ОТСУТСТВИЕ ВНЕШНИХ РАЗДРАЖИТЕЛЕЙ
САМОЗАРОЖДЕНИЕ ВОЗБУЖДЕНИЯ ЧАСТЬ Na-КАНАЛОВ ОТКРЫТА и в ПОКОЕ НЕМНОГО Na+ ВХОДИТ в КАРДИОМИОЦИТ ПОТЕНЦИАЛ ПОКОЯ МЕДЛЕННО СНИЖАЕТСЯ АКТИВИРУЮТСЯ Na/Ca-КАНАЛЫ ГЕНЕРАЦИЯ ИМПУЛЬСА
БЫСТРАЯ ДЕПОЛЯРИЗАЦИЯ РЕПОЛЯРИЗАЦИЯ K Na Na Ca МЕДЛЕННАЯ (СПОНТАННАЯ) ДИАСТОЛИЧЕСКАЯ ДЕПОЛЯРИЗАЦИЯ
НАЧАЛЬНАЯ БЫСТРАЯ РЕПОЛЯРИЗАЦ ИЯ Cl МЕДЛЕННАЯ РЕПОЛЯРИЗАЦИЯ (ПЛАТО) Ca Na БЫСТРАЯ ДЕПОЛЯРИЗ АЦИЯ КОНЕЧНАЯ БЫСТРАЯ РЕПОЛЯРИЗАЦИЯ K ТИПИЧНЫЙ ПОКОЙ
ГРАДИЕНТ АВТОМАТИИ (ГАСКЕЛА) – НЕОДИНАКОВАЯ СПОСОБНОСТЬ К АВТОМАТИИ РАЗЛИЧНЫХ ОТДЕЛОВ ПРОВОДЯЩЕЙ СИСТЕМЫ
ВОДИТЕЛИ РИТМА pacemakers I ПОРЯДКА – СА-УЗЕЛ 60 -90 II ПОРЯДКА – АВ-УЗЕЛ 40 -50 ПУЧОК ГИСА 30 -40 ВОЛОКНА ПУРКИНЬЕ 20
ПД ОТДЕЛОВ ПРОВОДЯЩЕЙ СИСТЕМЫ
ОПЫТ СТАННИУСА
ВОЗБУДИМОСТЬ СПОСОБНОСТЬ ОТВЕЧАТЬ НА ДЕЙСТВИЕ РАЗДРАЖИТЕЛЕЙ ГЕНЕРАЦИЕЙ ПД ТИПИЧНЫЕ и АТИПИЧНЫЕ КАРДИОМИОЦИТЫ
ОТНОСИТЕЛЬНАЯ ЭКЗАЛЬТАЦИЯ АБСОЛЮТНАЯ РЕФРАКТЕРНОСТЬ
В РЕЗУЛЬТАТЕ ТИПИЧНЫЕ КАРДИОМИОЦИТЫ НЕ СПОСОБНЫ К ТЕТАНУСУ ОТ ЧЕГО ЭТО ЗАЩИЩАЕТ СЕРДЦЕ?
ГДЕ ЗДЕСЬ СЕРДЦЕ, А ГДЕ СКЕЛЕТНАЯ МЫШЦА?
ЭКСТРАСИ СТОЛА и КОМПЕН САТОРНАЯ ПАУЗА
ПРОВОДИМОСТЬ ТИПИЧНЫЕ КАРДИОМИОЦИТЫ – ФУНКЦИОНАЛЬНЫЙ СИНЦИТИЙ – КЛЕТКИРАБОТАЮТ КАК ЕДИНОЕ ЦЕЛОЕ АТИПИЧНЫЕ КАРДИОМИОЦИТЫ –
СКОРОСТЬ ПРОВЕДЕНИЯ м/с 0.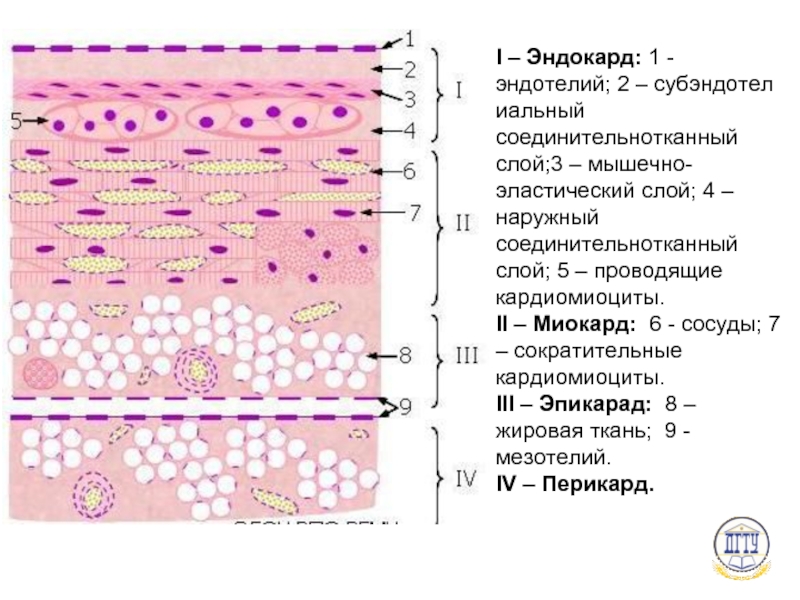 4 АВЗАДЕРЖК А 4. 0
4 АВЗАДЕРЖК А 4. 0
АВ-ЗАДЕРЖКА В АВ-УЗЛЕ МЕНЬШЕ ЩЕЛЕВЫХ КОНТАКТОВ ЗАДЕРКА НА 0, 09 с ПУЧОК ПРОВОДИТ В ОДНУ СТОРОНУ
НЕКСУСЫ – КОНТАКТЫ С НИЗКИМ ЭЛЕКТРИЧЕСКИМ СОПРОТИВЛЕНИЕМ
СОКРАТИМОСТЬ
СОКРАТИМОСТЬ МИОКАРДА ЗАКОН «ВСЕ ИЛИ НИЧЕГО» ЗАКОН СЕРДЦА (ФРАНКАСТАРЛИНГА) ДЛИТЕЛЬНОСТЬ СОКРАЩЕНИЯ ~ ДЛИТЕЛЬНОСТИ ПД (мс): П ~ 100, Ж ~ 300 -400 НЕ СПОСОБНА К ТЕТАНУСУ НУЖЕН ВНЕКЛЕТОЧНЫЙ Ca 2+
«ВСЕ ИЛИ НИЧЕГО» УВЕЛИЧЕНИЕ СИЛЫ РАЗДРАЖЕНИЯ ВЫШЕ ПОРОГОВОЙ НЕ ВЕДЕТ К УВЕЛИЧЕНИЮ СИЛЫ СОКРАЩЕНИЯ
СИЛА СОКРАЩЕНИЯ СИЛА РАЗДРАЖЕНИЯ
ЗАКОН СЕРДЦА, или ФРАНКА–СТАРЛИНГА СИЛА СОКРАЩЕНИЯ МИОКАРДА ~ СТЕПЕНИ ЕГО КРОВЕНАПОЛНЕНИЯ В ДИАСТОЛУ ЧЕМ БОЛЬШЕ РАСТЯЖЕНИЕ МИОКАРДА В ДИАСТОЛУ, ТЕМ СИЛЬНЕЕ ЕГО СОКРАЩЕНИЕ В СИСТОЛУ ЭТО – ГЕТЕРОМЕТРИЧЕСКАЯ САМОРЕГУЛЯЦИЯ
РАСТЯЖИМОСТЬ И ЭЛАСТИЧНОСТЬ СМЯГЧАЮТ ГИДРАВЛИЧЕСКИЙ УДАР ЭЛАСТИЧЕСКИЕ СИЛЫ, ВОЗНИКАЮЩИЕ ПРИ РАСТЯЖЕНИИ СТЕНОК (В ДИАСТОЛУ), УВЕЛИЧИВАЮТ СИЛУ СОКРАЩЕНИЙ В НАЧАЛЕ СИСТОЛЫ, И СПОСОБСТВУЮТ РАССЛАБЛЕНИЮ ПО ЕЕ ОКОНЧАНИИ
ЭНЕРГЕТИЧЕСКОЕ ОБЕСПЕЧЕНИЕ МИОКАРДА ГЛАВНЫЙ ИСТОЧНИК АЭРОБНОЕ ОКИСЛЕНИЕ (ЗАВИСИТ от O 2) НОСИТЕЛИ (%): СВОБ.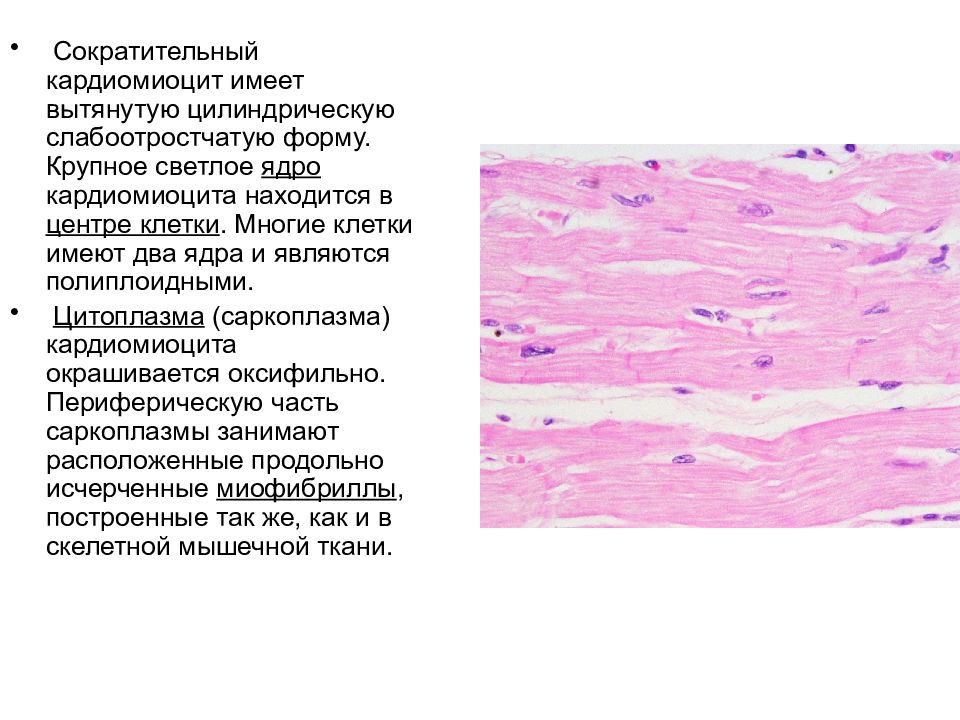 ЖК и МОЛОЧНАЯ К-ТА – 60 ГЛЮКОЗА – 30 ПВК и КЕТОНОВЫЕ ТЕЛА – 10
ЖК и МОЛОЧНАЯ К-ТА – 60 ГЛЮКОЗА – 30 ПВК и КЕТОНОВЫЕ ТЕЛА – 10
ПЕРЕРЫВ 5 МИН
СЕРДЕЧНЫЙ ЦИКЛ При ЧСС = 75 уд/мин ЦИКЛ = 0. 8 с
ЦИКЛ ЖЕЛУДОЧКОВ ЦИКЛ 0. 80 S 0. 33 D 0. 47
ЦИКЛ S ПЕРИОД НАПРЯЖЕНИЯ D ПЕРИОД ИЗГНАНИЯ
ЦИКЛ S ПЕРИОД НАПРЯЖЕНИЯ D ПЕРИОД ИЗГНАНИЯ ФАЗА АСИНХРОННОГО СОКРАЩЕНИЯ ФАЗА БЫСТРОГО ИЗГНАНИЯ ФАЗА ИЗОМЕТРИЧЕСКОГО СОКРАЩЕНИЯ ФАЗА МЕДЛЕННОГО ИЗГНАНИЯ
ЦИКЛ S ПЕРИОД НАПРЯЖЕНИЯ D ПЕРИОД ИЗГНАНИЯ ФАЗА АСИНХРОННОГО СОКРАЩЕНИЯ ФАЗА БЫСТРОГО ИЗГНАНИЯ ФАЗА ИЗОМЕТРИЧЕСКОГО СОКРАЩЕНИЯ ФАЗА МЕДЛЕННОГО ИЗГНАНИЯ
ЦИКЛ D S Прото D ПЕРИОД ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ ПЕРИОД НАПОЛНЕНИЯ Пре s
ЦИКЛ D S Прото D ПЕРИОД ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ ПЕРИОД НАПОЛНЕНИЯ ФАЗА БЫСТРОГО НАПОЛНЕНИЯ ФАЗА МЕДЛЕННОГО НАПОЛНЕНИЯ Пре s
1. НАПРЯЖЕНИЯ 2. 3. 4. 5. 6. асинхронного сокращения изоволюмического сокращения ИЗГНАНИЯ быстрого медленного ПРОДОДИАСТОЛИЧЕСКИЙ ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ НАПОЛНЕНИЯ быстрого медленного ПРЕСИСТОЛИЧЕСКИЙ
НАПРЯЖЕНИЯ 2. 3. 4. 5. 6. асинхронного сокращения изоволюмического сокращения ИЗГНАНИЯ быстрого медленного ПРОДОДИАСТОЛИЧЕСКИЙ ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ НАПОЛНЕНИЯ быстрого медленного ПРЕСИСТОЛИЧЕСКИЙ
ЦИКЛ ЛЕВОГО ЖЕЛУДОЧКА
ЦИКЛ D S Прото D ПЕРИОД ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ ПЕРИОД НАПОЛНЕНИЯ ФАЗА БЫСТРОГО НАПОЛНЕНИЯ ФАЗА МЕДЛЕННОГО НАПОЛНЕНИЯ Пре s
ПРЕСИСТОЛА ЖЕЛУДОЧКОВ, или СИСТОЛА ПРЕДСЕРДИЙ АВ ОТКРЫТЫ ПЛ ЗАКРЫТЫ ДАВЛЕНИЕ в ЕДИНОЙ ПОЛОСТИ ~ 0→ 5 -8 мм рт. ст. ДОПОЛНИТЕЛЬН О в ЖЕЛУДОЧКИ ПОСТУПАЕТ
ПРЕСИСТОЛИЧЕСКИЙ ПЕРИОД
СИСТОЛА ЖЕЛУДОЧКОВ
ПЕРИОД НАПРЯЖЕНИЯ: ФАЗА АСИНХРОННОГ О СОКРАЩЕНИЯ
ПЕРИОД НАПРЯЖЕНИЯ: ФАЗА ИЗОВОЛЮМИЧЕСКОГО СОКРАЩЕНИЯ ПЛ закрыты В начале фазы АВ закрываются → начало I тона Р↑ до 80 мм рт. ст.
ПЕРИОД НАПРЯЖЕНИ асинхронного сокращения изоволюмического сокращения
ПЕРИОД ИЗГНАНИЯ АВ закрыты ПЛ открыты ФАЗА БЫСТРОГО Р ↑ ЛЖ до 120 ПЖ до 30 ФАЗА МЕДЛЕННОГО P↓ до 80
ПЕРИОД ИЗГНАНИЯ быстрого медленного
ДИАСТОЛА ЖЕЛУДОЧКО В
ПРОТОДИАСТОЛИЧЕСКИЙ ПЕРИОД PЖ
ПРОТОДИАСТОЛИЧЕСКИЙ ПЕРИОД
ПЕРИОД ИЗОВОЛЮМИЧЕСКОГО РАССЛАБЛЕНИЯ ВСЕ КЛАПАНЫ ЗАКРЫТЫ В КОНЦЕ РЖ
ПЕРИОД ИЗОВОЛЮМИЧЕСКОГ О РАССЛАБЛЕНИЯ
ПЕРИОД НАПОЛНЕНИЯ АВ-клапаны – ОТКРЫТЫ ПЛ-клапаны – ЗАКРЫТЫ БЫСТРОЕ НАПОЛНЕНИЕ → III ТОН
ПЕРИОД НАПОЛНЕНИЯ быстрого медленного
ПРЕСИСТОЛИЧЕСКИЙ ПЕРИОД СИСТОЛА ПРЕДСЕРДИЙ → IV ТОН
ПРЕСИСТОЛИЧЕСКИ Й ПЕРИОД
ДИАСТОЛА НЕОБХОДИМА ДЛЯ обеспечения исходной поляризации кардиомиоцитов (работа Na/K-насоса) удаления Са 2+ из саркоплазмы ресинтеза гликогена и АТФ наполнения сердца кровью
V ЭКГ
ВИДЫ КАРДОГРАФИИ ЭКГ ВЕКТОРКАРДИОГРАФИЯ БАЛЛИСТОКАРДИОГРАФИЯ ЭХОКАРДИОГРАФИЯ (УЗИ) ФОНОКАРДИОГРАФИЯ (ФКГ) РЕНТГЕНОКИМОГРАФИЯ МЕХАНОКАРДИОГРАФИЯ ПОЛИКАРДИОГРАФИЯ
1856 – Rudolf v. Kölliker (Швейцария) и Heinrich Müller (Германия): работа сердца сопровождается электрическими явлениями 1872 – Alexander Muirhead (UK), приложив электрод к запястью пациента, заметил колебания электрического потенциала 1878 – Sir John Burdon-Sanderson (UK) капиллярным электрометром зарегистрировал ЭКГ лягушки 1887 – Augustus Waller (UK) с помощью капиллярного электрометра и фотопластинки – ЭКГ человека 1903 – Willem Einthoven (Нидерланды) ЭКГ на основе струнного гальванометра; отведения I — III
Kölliker (Швейцария) и Heinrich Müller (Германия): работа сердца сопровождается электрическими явлениями 1872 – Alexander Muirhead (UK), приложив электрод к запястью пациента, заметил колебания электрического потенциала 1878 – Sir John Burdon-Sanderson (UK) капиллярным электрометром зарегистрировал ЭКГ лягушки 1887 – Augustus Waller (UK) с помощью капиллярного электрометра и фотопластинки – ЭКГ человека 1903 – Willem Einthoven (Нидерланды) ЭКГ на основе струнного гальванометра; отведения I — III
1856 Albert v. Kölliker Швейцария и Heinrich Müller Германия: работа сердца сопровождаетс я электрическим и явлениями
1878 Sir John Burdon. Sanderson (UK) капиллярным электрометром зарегистрирова л ЭКГ лягушки
1924 1903 ЭКГ на основе струнного гальванометра отведения I — III Willem Einthoven The Netherlands 1860– 1927
ВЕКТОРНАЯ ТЕОРИЯ ЭКГ 1. ВОЛНА ВОЗБУЖДЕНИЯ (ДЕПОЛЯРИЗАЦИИ) РАСПРОСТРАНЯЕТСЯ ПО СЕРДЦУ 2. ЭТУ ВОЛНУ МОЖНО ПРЕДСТАВИТЬ В ВИДЕ СЕРИИ ОТДЕЛЬНЫХ ЭЛЕКТРИЧЕСКИХ ДИПОЛЕЙ 3. РЕЗУЛЬТИРУЮЩИЙ ДИПОЛЬ – СУММА ВСЕХ ДИПОЛЕЙ – ОРИЕНТИРОВАН ВДОЛЬ ОСНОВНОГО НАПРАВЛЕНИЯ ДВИЖЕНИЯ ВОЛНЫ В ДАННЫЙ МОМЕНТ
ЭТУ ВОЛНУ МОЖНО ПРЕДСТАВИТЬ В ВИДЕ СЕРИИ ОТДЕЛЬНЫХ ЭЛЕКТРИЧЕСКИХ ДИПОЛЕЙ 3. РЕЗУЛЬТИРУЮЩИЙ ДИПОЛЬ – СУММА ВСЕХ ДИПОЛЕЙ – ОРИЕНТИРОВАН ВДОЛЬ ОСНОВНОГО НАПРАВЛЕНИЯ ДВИЖЕНИЯ ВОЛНЫ В ДАННЫЙ МОМЕНТ
ЭЛ. ТОКИ В ГРУДНОЙ КЛЕТКЕ ВОЗБУЖДЕНИЕ (–) РАСПРОСТРАНЯЕТСЯ по ПЕРЕГОРОДКЕ СТЕНКИ ЖЕЛУДОЧКОВ ЕЩЕ в ПОКОЕ (+) ТОК ИДЕТ от ОСНОВАНИЯ (–) к ВЕРХУШКЕ (+)
ЭЛЕКТРОД БЛИЖЕ к ОСНОВАНИЮ – ПОКАЖЕТ ( ), БЛИЖЕ к ВЕРХУШКЕ (+)
СТАНДАРТНЫЕ ОТВЕДЕНИЯ по Эйнтховену Биполярные
УСИЛЕННЫЕ ОТВЕДЕНИЯ ОТ КОНЕЧНОСТЕЙ по Гольдбергеру УНИПОЛЯРНЫЕ
ГРУДНЫЕ ОТВЕДЕНИЯ по Вильсону УНИПОЛЯРНЫЕ
ЭЛЕКТРИЧЕСКАЯ ОСЬ СЕРДЦА ОРИЕНТАЦИЯ СЕРДЕЧНОГО ДИПОЛЯ ВО ВРЕМЯ ФАЗЫ НАИБОЛЕЕ ИНТЕНСИВНОЙ ДЕПОЛЯРИЗАЦИИ ЖЕЛУДОЧКОВ (КОГДА R ДОСТИГАЕТ МАКСИМУМА) ВЕКТОР МЕЖДУ ТОЧКАМИ СЕРДЦА, ОБЛАДАЮЩИМИ НАИБОЛЬШЕЙ РАЗНОСТЬЮ ПОТЕНЦИАЛОВ
ЭЛЕКТРО КАРДИО СТИМУЛЯТО
ИНТРА КОРПОРАЛЬНЫЕ –ЭЛЕКТРОД в ПП или в ПЖ –ДВА ЭЛЕКТРОДА: в ПРЕДСЕРДИИ и ЖЕЛУДОЧКЕ –ЧАСТОТНАЯ АДАПТАЦИЯ –ТЕЛЕМЕТРИЯ и “АНТИ-ТАХИ”
LECTIO FINITA EST
СЛЕДУЮЩАЯ ЛЕКЦИЯ РЕГУЛЯЦИЯ РАБОТЫ СЕРДЦА
– HPO 42 –
Мышечная ткань — это.
 .. Что такое Мышечная ткань?
.. Что такое Мышечная ткань?Мы́шечными тка́нями (лат. textus muscularis) называют ткани, различные по строению и происхождению, но сходные по способности к выраженным сокращениям. Состоят из вытянутых клеток, которые принимают раздражение от нервной системы и отвечают на него сокращением. Они обеспечивают перемещения в пространстве организма в целом, его движение органов внутри организма (сердце, язык, кишечник и др.) и состоят из мышечных волокон. Свойством изменения формы обладают клетки многих тканей, но в мышечных тканях эта способность становится главной функцией.
Основные морфологические признаки элементов мышечных тканей: удлиненная форма, наличие продольно расположенных миофибрилл и миофиламентов — специальных органелл, обеспечивающих сократимость, расположение митохондрий рядом с сократительными элементами, наличие включений гликогена, липидов и миоглобина.
Специальные сократительные органеллы — миофиламенты или миофибриллы обеспечивают сокращение, которое возникает при взаимодействии в них двух основных фибриллярных белков — актина и миозина — при обязательном участии ионов кальция. Митохондрии обеспечивают эти процессы энергией.Запас источников энергии образуют гликоген и липиды. Миоглобин — белок, обеспечивающий связывание кислорода и создание его запаса на момент сокращения мышцы, когда сдавливаются кровеносные сосуды (поступление кислорода при этом резко падает).
Митохондрии обеспечивают эти процессы энергией.Запас источников энергии образуют гликоген и липиды. Миоглобин — белок, обеспечивающий связывание кислорода и создание его запаса на момент сокращения мышцы, когда сдавливаются кровеносные сосуды (поступление кислорода при этом резко падает).
Свойства мышечной ткани
- Возбудимость
- Проводимость
- Сократимость
- Лабильность
Виды мышечной ткани
Гладкая мышечная ткань
Состоит из одноядерных клеток — миоцитов веретеновидной формы длиной 20—500 мкм. Их цитоплазма в световом микроскопе выглядит однородно, без поперечной исчерченности. Эта мышечная ткань обладает особыми свойствами: она медленно сокращается и расслабляется, обладает автоматией, является непроизвольной (то есть ее деятельность не управляется по воле человека). Входит в состав стенок внутренних органов: кровеносных и лимфатических сосудов, мочевыводящих путей, пищеварительного тракта (сокращение стенок желудка и кишечника).
Поперечно-полосатая скелетная мышечная ткань
Состоит из миоцитов, имеющих большую длину (до нескольких сантиметров) и диаметр 50—100 мкм; эти клетки многоядерные, содержат до 100 и более ядер; в световом микроскопе цитоплазма выглядит как чередование тёмных и светлых полосок. Свойствами этой мышечной ткани является высокая скорость сокращения, расслабления и произвольность (то есть её деятельность управляется по воле человека). Эта мышечная ткань входит в состав скелетных мышц, а также стенки глотки, верхней части пищевода, ею образован язык, глазодвигательные мышцы. Волокна длиной от 10 до 12 см.
Поперечно-полосатая сердечная мышечная ткань
Состоит из 1 или 2-х ядерных кардиомиоцитов, имеющих поперечную исчерченность цитоплазмы(по периферии цитолеммы). Кардиомиоциты разветвлены и образуют между собой соединения — вставочные диски, в которых объединяется их цитоплазма.Существует также другой межклеточный контакт- аностамозы(впячивание цитолеммы одной клетки в цитолемму другой) Этот вид мышечной ткани образует миокард сердца. Развивается из миоэпикардальной пластинки (висцерального листка спланхнотома шеи зародыша) Особым свойством этой ткани является автоматия — способность ритмично сокращаться и расслабляться под действием возбуждения, возникающего в самих клетках(типичные кардиомиоциты). Эта ткань является непроизвольной(атипичные кардиомиоциты). Существует 3-й вид кардиомиоцитов- секреторные кардиомиоциты (в них нет фибрилл) Они синтезируют гормон тропонин, понижающий АД и расширяющий стенки кровеносных сосудов.
Развивается из миоэпикардальной пластинки (висцерального листка спланхнотома шеи зародыша) Особым свойством этой ткани является автоматия — способность ритмично сокращаться и расслабляться под действием возбуждения, возникающего в самих клетках(типичные кардиомиоциты). Эта ткань является непроизвольной(атипичные кардиомиоциты). Существует 3-й вид кардиомиоцитов- секреторные кардиомиоциты (в них нет фибрилл) Они синтезируют гормон тропонин, понижающий АД и расширяющий стенки кровеносных сосудов.
Функции мышечной ткани
Двигательная. Защитная. Теплообменная. Так же можно выделить еще одну функцию — мимическую (социальную). Мышцы лица, управляя мимикой, передают информацию окружающим.
Примечания
Кардиомиоциты (клетки сердечной мышцы) — структура, функции и гистология
Структура, функция и гистология
Определение: что такое кардиомиоциты?
Кардиомиоциты, также известные как миокардиоциты, представляют собой клетки, составляющие сердечную мышцу / сердечную мышцу.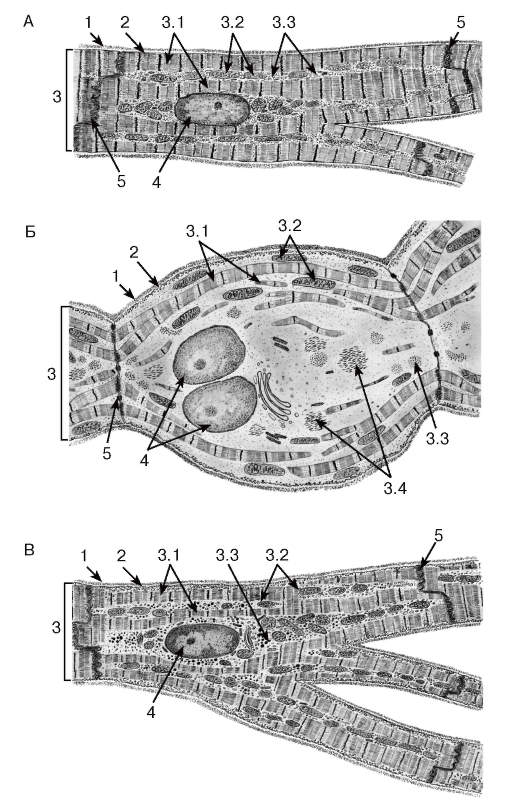
Как главный тип клеток сердца, сердечные клетки в первую очередь участвуют в сократительной функции сердца, что позволяет перекачивать кровь по всему телу. У людей, а также у многих других животных кардиомиоциты являются первыми клетками, которые окончательно дифференцируются, что делает сердце одним из первых органов, формирующихся у развивающегося плода.
Было показано, что в эмбрионе мыши, например, клетки-предшественники сердечных мышц начинают развиваться примерно через 6 дней после оплодотворения. Хотя кардиомиоциты содержат многие органеллы, обнаруженные в клетках других животных, они также содержат другие (например, миофибриллы), которые позволяют им эффективно выполнять свою функцию.
Некоторые из основных характеристик включают:
- Удлиненные цилиндрические клетки и поперечнополосатые
- Большинство кардиомиоцитов имеют одно ядро
- Имеют сократительные белки
- Кардиомиоциты прикреплены друг к другу через вставные диски
Ультраструктура кардиомиоцитов
Хотя кардиомиоциты являются мышечными клетками, они во многих отношениях отличаются от других мышечных клеток. В отличие от других мышечных клеток в организме, кардиомиоциты обладают высокой устойчивостью к утомлению и поэтому всегда сокращаются и расслабляются, чтобы обеспечить надлежащее кровообращение по всему телу.
В отличие от других мышечных клеток в организме, кардиомиоциты обладают высокой устойчивостью к утомлению и поэтому всегда сокращаются и расслабляются, чтобы обеспечить надлежащее кровообращение по всему телу.
Это стало возможным благодаря структурным компонентам ячейки, которая состоит из:
Мембрана подвала
Базальная мембрана миоцитов — это граница, которая отделяет внутриклеточную часть клетки от внеклеточной среды. Он состоит из гликопротеинов, ламинина и фибронектина, коллагена типа IV, а также протеогликанов, которые обеспечивают его общую ширину около 50 нм.
Таким образом, мембрана состоит из двух основных слоев, которые включают lamina densa и lamina lucida. Предоставляя интерфейс для непрерывности с внеклеточной средой, базальная мембрана помогает улавливать такие ионы, как кальций, а также действует как барьер, через который происходит обмен различных макромолекул.
Сарколемма
Сарколемма — это особая структура, которая также служит внешней оболочкой клетки. Сарколемма состоит из коллагена, гликокаликса (который сокращает базальную мембрану) и плазмалеммы.
Сарколемма состоит из коллагена, гликокаликса (который сокращает базальную мембрану) и плазмалеммы.
Поскольку сарколемма состоит из липидного бислоя, она также контролирует тип молекул, проникающих в клетку. Например, из-за гидрофобного ядра липидного бислоя сарколемма непроницаема для некоторых молекул.
Сарколемма также является частью вставочных дисков, а также поперечной трубчатой системы сердечной мышцы. Он служит механической связью между сердечными клетками (кардиомиоцитами) через специализированные вставочные диски.
Кроме того, он способствует взаимодействию возбуждения и сокращения через поперечные канальцы (инвагинации сарколеммы в цитоплазму сердечных клеток). Поперечные канальцы (Т-канальцы) также организуют клетки сердечной мышцы в пары, создавая поперечно-полосатые мышечные тяжи.
Десмосомы
Щелевые соединения, которые являются частью сарколеммы, представляют собой каналы между соседними волокнами сердечной мышцы.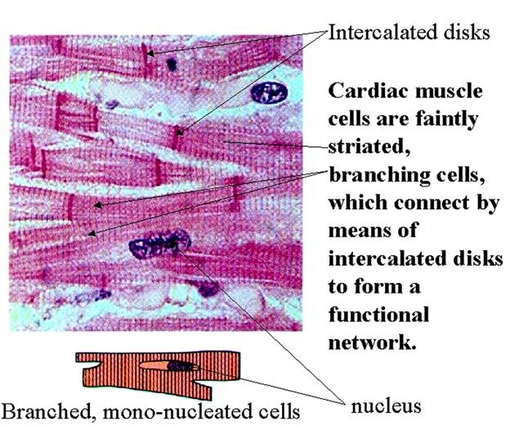 Эти структуры позволяют деполяризующему току проходить через клетки сердечной мышцы от одной к другой и, таким образом, способствуют сокращению и расслаблению клеток.
Эти структуры позволяют деполяризующему току проходить через клетки сердечной мышцы от одной к другой и, таким образом, способствуют сокращению и расслаблению клеток.
В отличие от щелевых соединений, десмосомы, также являющиеся частью сарколеммы, служат для скрепления концов волокон сердечной мышцы вместе. Это предотвращает растяжение клеток сердечных мышц во время сокращения. Десмосомы способны выдерживать механическое напряжение, которое позволяет им удерживать клетки вместе.
* Было показано, что десмосомы способны противостоять механическим воздействиям из-за того, что они обладают повышенной адгезией. Таким образом, десмосомы устойчивы к хелатирующим агентам.
* Наличие липидного бислоя в сарколемме позволяет ему действовать как барьер для диффузии.
* Мембранные белки сарколеммы действуют как насосы, рецепторы и каналы, регулирующие движение ионов. Итак, сарколемма активно участвует в сократительном процессе клетки.
* Ряд рецепторов также обнаружен на мембране кардиомиоцитов. К ним относятся α, мускариновая и эндотелиновая рецепторные системы.
Саркомеры (сократительные белки и белки цитокелета)
По сути, саркомеры — это функциональные единицы, выстилающие миофибриллы.
Саркомеры делятся на два важных компонента, которые включают:
· Сократительные белки — (действующие и миозин), участвующие в сокращении миофиламентов.
· Белки цитоскелета — Белки, которые помогают поддерживать форму клетки, стабилизируют белки саркомера и поддерживают механическую целостность, а также сопротивление.
Миофиламент
Миофиламенты — это сократительные белки, которые состоят из миозина (толстые волокна диаметром около 15 нм) и белков актина (тонкие волокна диаметром около 7 нм).
В клетке миозин составляет важную группу моторных белков, которые вызывают сокращение мышц.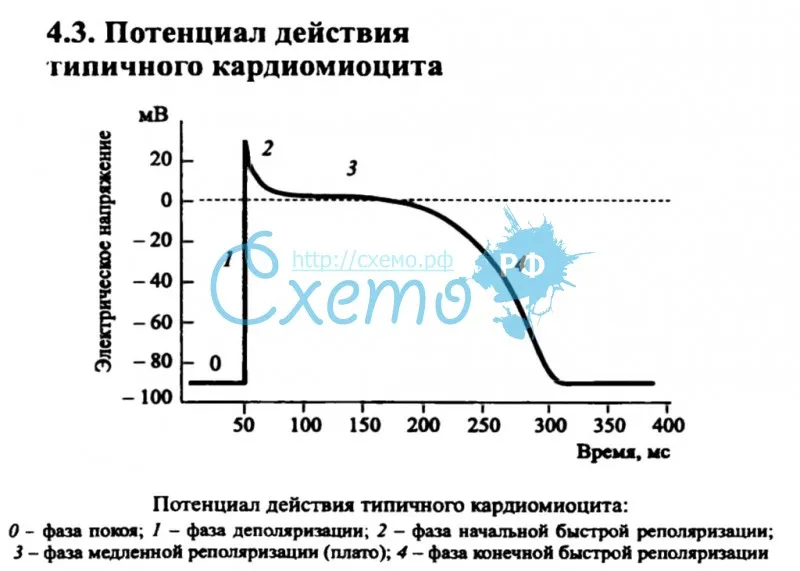 В кардиомиоцитах миозин II отвечает за сокращение мышц, что позволяет крови циркулировать по телу.
В кардиомиоцитах миозин II отвечает за сокращение мышц, что позволяет крови циркулировать по телу.
Этот тип миозина состоит из двух тяжелых (с моторными головками) и легких цепей.Благодаря энергии, полученной от АТФ, именно головная часть миозина связывается с актином, что приводит к сокращению мышц.
Актин, с другой стороны, состоит из отдельных единиц актина, известных как глобулярный актин (G-актин). Нить также связана с регуляторными белками, включая тропонин-Т, тропонин-С, тропонин-I и тропомиозин.
В то время как тропонин находится в бороздках между актиновыми филаментами, тропомиозин покрывает участки, на которых актин связывается с миозином. Их соответствующие действия, следовательно, контролируют связывание миозина с актином и, следовательно, сокращение и расслабление сердечных мышц.
Как и другие клетки организма, кардиомиоциты плотно упакованы различными типами органелл, которые поддерживают жизнь клетки и вносят свой вклад в ее функцию.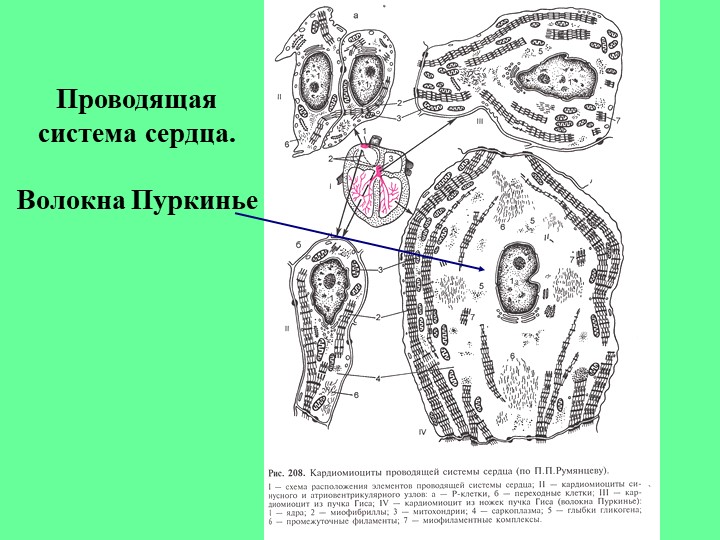
Однако, в отличие от других клеток, кардиомиоциты содержат большое количество митохондрий (занимают около 40 процентов клетки), которые поддерживают высокий уровень АТФ, необходимый клеткам.
Как упоминалось ранее, сердечные мышцы постоянно сокращаются и расслабляются, поскольку кровь циркулирует по телу. Это требует большого количества энергии, поскольку эти мышцы не отдыхают, как в случае с другими типами мышц.
Значит, здесь большое количество митохондрий гарантирует, что клетки получают достаточно энергии, необходимой для поддержания сердечного сокращения.
Некоторые из других важных органелл, обнаруженных в кардиомиоцитах, включают:
См. Дополнительную информацию об органеллах здесь.
Функция кардиомиоцитов (механизм)
Кардиомиоциты проходят цикл сокращения-расслабления, который позволяет сердечным мышцам перекачивать кровь по всему телу.Это достигается за счет процесса, известного как соединение возбуждения и сокращения, который преобразует потенциал действия (электрический стимул) в сокращение мышц.
Механизм сжатия
Во время потенциала действия деполяризация мембраны приводит к притоку ионов кальция в клетку. Поскольку кальций связывается с рецепторами внутри клетки, это приводит к высвобождению еще большего количества кальция в клетку (через кальциевые каналы в Т-канальцах). В свою очередь, это приводит к укорачиванию актин-миозиновых фибрилл в клетке и, как следствие, к общему сокращению клетки.
Этот процесс можно представить в виде следующих шагов:
· Потенциал действия индуцируется клетками кардиостимулятора (в синоатриальном и атриовентрикулярном узлах) и сначала передается кардиомиоцитам через щелевые соединения ( интеркалированные диски)
· Кальциевые каналы в Т-канальцах активируются потенциалом действия, когда он проходит между саркомерами миофибриллы, высвобождая ионы кальция в клетку
· В цитоплазме кардиомиоцитов, Кальций связывается с сердечным тропонином-C, который, в свою очередь, перемещает тропониновый комплекс из места связывания актина.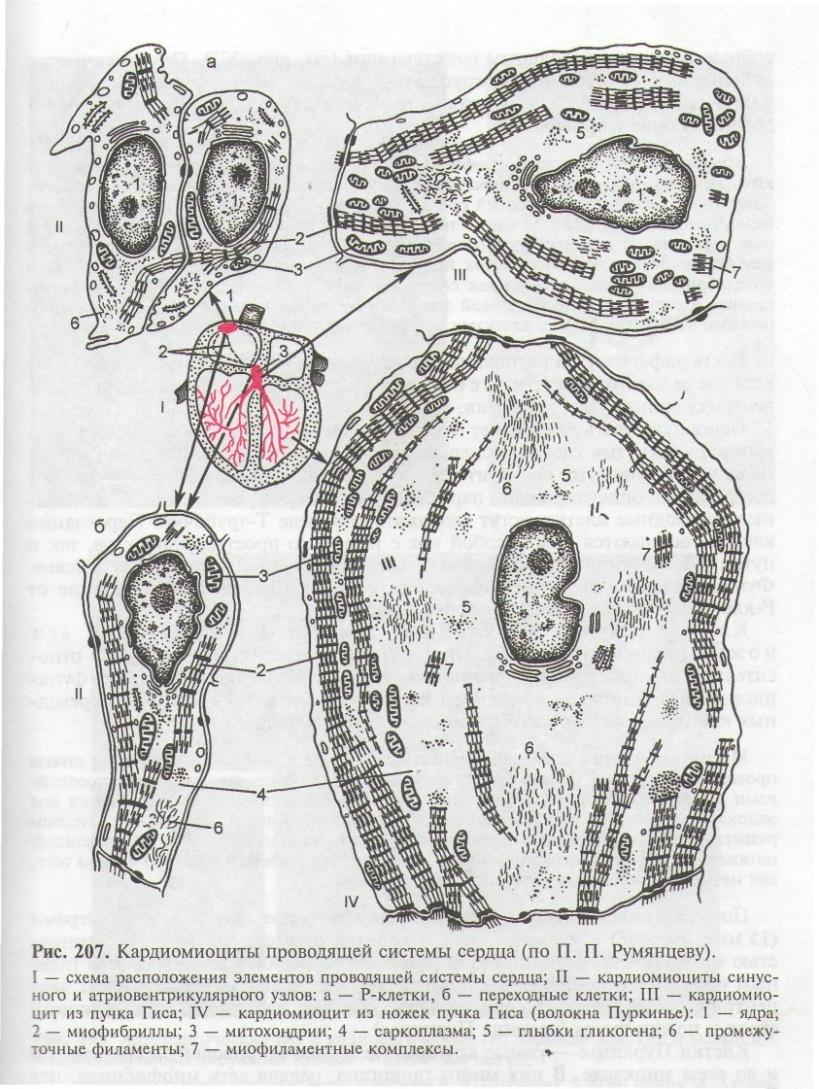 В результате актин может свободно связывать миозин, инициируя сокращение
В результате актин может свободно связывать миозин, инициируя сокращение
· Поскольку миозин связывается с молекулой ATO, нити актина притягиваются к центральной части саркомера, что вызывает сокращение мышцы
· In в фазе реполяризации кальций удаляется из цитоплазмы клетки (из цитозоля в саркоплазматический ретикулум или внеклеточную жидкость). Это позволяет комплексу тропонина вернуться в исходное положение, что, в свою очередь, завершает сокращение
Обновление кардиомиоцитов
Хотя считалось, что регенерация клеток сердечной мышцы отсутствует, исследования показали, что эти клетки обновляются со значительно низкой скоростью на протяжении всей жизни человека.Например, для более молодых людей, около 25 лет, годовой оборот кардиомиоцитов составляет около 1 процента. Однако для пожилых людей (75 лет и старше) этот показатель снижается примерно до 0,45 процента.
В течение жизни человека обновляется менее 50 процентов этих клеток, что показывает, что по сравнению со многими другими клетками кардиомиоциты имеют очень долгую продолжительность жизни.
* В случае травм или инфаркта миокарда моноциты привлекаются для удаления поврежденных / некротических кардиомиоцитов.Предполагается, что фагоцитоз этих клеток является одной из предпосылок восстановления сердца.
Регенерация кардиомиоцитов
В отличие от некоторых животных, таких как данио, поврежденные сердечные мышцы человека не регенерируют в достаточной степени, чтобы сердце могло исцелить себя. По этой причине у большинства людей, которые получают различные травмы сердца, а также сердечные приступы (которые влияют на кардиомиоциты), в результате развивается сердечная недостаточность, которая может привести к смерти.
Эта способность, согласно исследованиям, теряется примерно через неделю жизни, что означает, что у человека невозможно регенерация сердца. Из-за неспособности сердечной мышцы к регенерации имплантация механических желудочковых устройств и трансплантация сердца были по большей части единственным решением.
Хотя сердечные клетки неспособны к регенерации (достаточно быстро, чтобы восстановить повреждения / повреждения), исследования показали, что клетки-предшественники у взрослых способны производить новые клетки.Эти клетки, известные как сердечные стволовые клетки, находятся в сердце, и усилия были направлены на их изоляцию.
В настоящее время предложен ряд методов регенерации кардиомиоцитов.
Сюда входят:
Имплантация кардиомиоцитов, полученных из ИПСК
Используя технологию индуцированных плюрипотентных стволовых клеток (ИПСК), исследователи смогли добиться функции кардиомиоцитов, что устраняет необходимость использования человеческих эмбрионов для этой цели.Трансплантация кардиомиоцитов, полученных с помощью этого метода (ИПСК), в поврежденное сердце оказалась успешной, позволяя сердечным мышцам нормально функционировать.
Прямое перепрограммирование фибробластов
Сердечные фибробласты составляют около 50 процентов от общего числа сердечных клеток.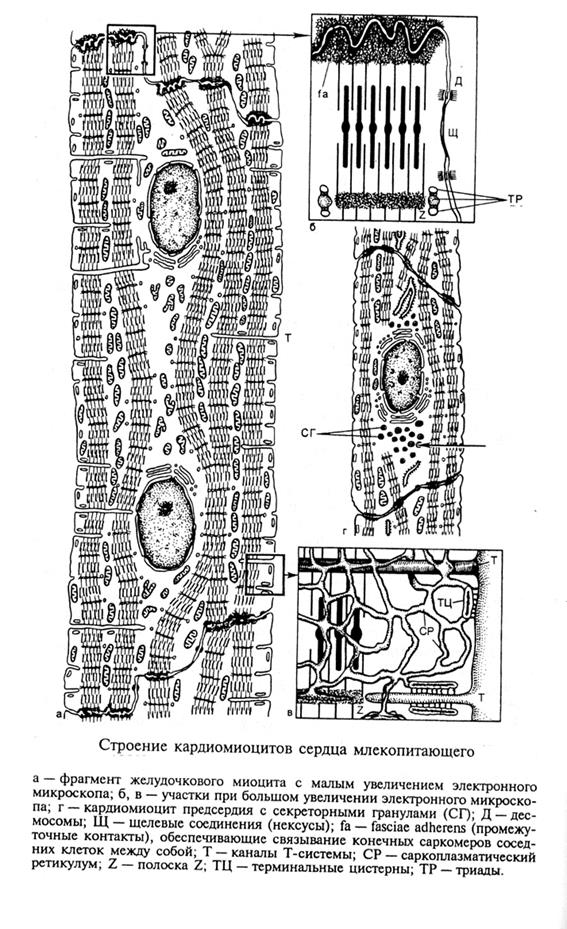 Из-за их способности очень хорошо выживать и соединяться с другими соседними клетками, фибробласты оказались особенно идеальными для прямого репрограммирования с целью преобразования их в клетки, напоминающие кардиомиоциты.
Из-за их способности очень хорошо выживать и соединяться с другими соседними клетками, фибробласты оказались особенно идеальными для прямого репрограммирования с целью преобразования их в клетки, напоминающие кардиомиоциты.
За последнее десятилетие был успешно проведен ряд исследований по перепрограммированию фибробластов в кардиомиоцитоподобные клетки. Например, в исследовании, проведенном в 2012 году Олсоном и его коллегами, перепрограммирование оказалось успешным: клетки не только показали улучшенные характеристики, но и показали снижение образования рубцов после инфаркта миокарда.
Использование путей, которые способствуют делению сердечных клеток — Согласно недавним исследованиям, использование определенных путей (например,г. в передаче сигналов Hippo-YAP), которые способствуют делению, также могут способствовать регенерации.
Микроскопия (гистология)
Чтобы наблюдать кардиомиоциты под микроскопом, необходимо зафиксировать и прикрепить клетки под микроскопом. После того, как клетки зафиксированы и проницаемы на предметном стекле, они готовы к окрашиванию и просмотру.
После того, как клетки зафиксированы и проницаемы на предметном стекле, они готовы к окрашиванию и просмотру.
Требования
- Образец кардиомиоцитов (получен от такого животного, как грызуны)
- Параформальдегид
- Забуференный фосфатом физиологический раствор (pH 7.4)
- Тканевый клей
- 0,1 М бикарбонат натрия (pH 8,0)
- Nutator
- Центрифуга (контролируемая температура)
- Покровное стекло (с камерами)
- Предметное стекло микроскопа
- Питательная среда (на 5% состоит из плода крупного рогатого скота сыворотка, 47,5% MEM, 10 мМ пировиноградная кислота, раствор Тирода, 6,1 мМ глюкоза и 4,0 мМ HEPES)
- Блокирующий раствор, состоящий из 0,01% BSA в PBS
Stains
- MitoTracker Deep Red 633
- Alexa Fluor 568 фаллоидин
- SYTO 11 Зеленая флуоресцентная нуклеиновая кислота
- Альбумин бычьей сыворотки
Подготовка образца
· Взвешивание клеток в среде при 5% углекислого газа 30 градусов Цельсия
· Пометьте образец MitoTracker Deep Red 633 и инкубируйте e около 30 минут в инкубаторе с CO2 — Этот шаг направлен на окрашивание митохондрий
· Промыть образец с помощью PBS два раза в темноте — Этого можно достичь, накрыв алюминиевой фольгой пробирку с образцом
· Используя низкую перегрузочную силу при температуре около 30 градусов Цельсия, осаждают изолированные клетки на минуту, затем суспендируют клетки в 4-процентном параформальдегиде в PBS до (при 30 градусах Цельсия) fix
· Снова осаждайте клетки в течение примерно минуты при низкой силе перегрузки и ресуспендируйте клетки в PBS
· Нанесите кардиомиоциты на покровное стекло с камерой с помощью тканевого клея и Cell-Tak Cell
· Дайте камере постоять около 2 часов при комнатной температуре — камеру нельзя трогать
· Вымойте клетки с помощью PBS — на стекле. SS поверхность
SS поверхность
· Использование 0.1 процент Triton X-100 в PBS, проницаемость клеток при комнатной температуре в течение примерно 3 минут
· Промыть клетки с помощью PBS два раза в течение примерно 2 минут
· Обработайте клетки блокирующим раствором в течение примерно 30 минут. минут при комнатной температуре
· Пометьте клетки в течение 30 минут в темноте при комнатной температуре, используя:
- Alexa Fluor 568 фаллоидин — для окрашивания актина
- SYTO 11 Зеленая флуоресцентная нуклеиновая кислота — для окрашивания ядра
· Промыть клетки с помощью PBS три раза (три минуты для каждой промывки)
· Поддержание клеток в PBS, содержащем антибиотики
· Просмотрите слайд под микроскопом (под иммерсионным объективом 60X)
Наблюдение
При просмотре под микроскопом митохондрии приобретают синий цвет; актин станет красным, а ядро приобретет зеленый цвет, как окраска зеленой флуоресцентной нуклеиновой кислоты.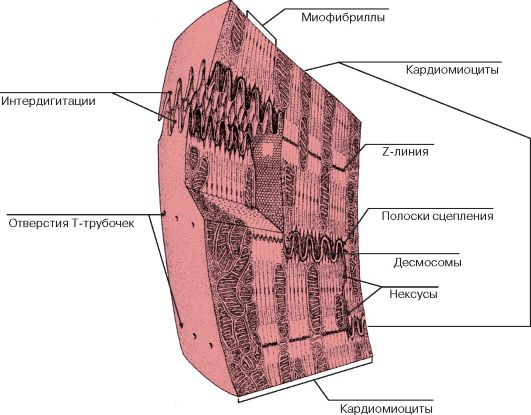
Вернуться на главную страницу Cell Biology
Вернуться от изучения кардиомиоцитов на главную страницу MicroscopeMaster
Ссылки
К. Эллисон Уокер и Фрэнсис Г. Спинале. (1999). Структура и функция сердечного миоцита: обзор фундаментальных концепций. Обзор фундаментальной науки.
Джереми Пиннелл, Саймон Тернер и Саймон Хауэлл. (2007). Физиология сердечной мышцы. Непрерывное образование в области анестезии, интенсивной терапии и боли, том 7, выпуск 3, июнь 2007 г., страницы 85–88.
Ширли Ден и Эдвард Бенджамин Торп. (2018). Миелоидный рецептор CD36 необходим для раннего фагоцитоза инфаркта миокарда и индукции Nr4a1-зависимых механизмов восстановления сердца.
Вальдшнеп Э.А., Маткович С.Ю. (2005). Структура, функции кардиомиоцитов и связанные с ними патологии ..
Юэцю Чен, Цзыин Ян, Чжэнь-Ао Чжао и Женя Шэнь. (2017). Прямое перепрограммирование фибробластов в кардиомиоциты.Chen et al. Исследование стволовых клеток и терапия.
Исследование стволовых клеток и терапия.
Ссылки
https://www.bcm.edu/news/heart/promote-adult-heart-tissue-regeneration
Физиологическая сократимость кардиомиоцитов в стенке непорочной вены мыши и крысы
Все процедуры на животных были одобрены Комитетом по уходу и использованию животных в учреждении и проводились в соответствии с Руководящими принципами ухода и использования животных , утвержденными Советом Американского физиологического общества.
Окрашивание тканей трансгенных мышей X-gal.
Протокол перфузии in situ использовался, как описано ранее (17). Двух-трехмесячных трансгенных мышей cTnT-lacZ (36) гепаринизировали в течение 30 минут и анестезировали внутрибрюшинной инъекцией пентобарбитала (100 мг / кг). После открытия полости грудной клетки левый желудочек канюлировали для перфузии системы кровообращения фильтрованным раствором Кребса-Хенселейта (118 мМ NaCl, 25 мМ NaHCO 3 , 4. 7 мМ KCl, 12 мМ KH 2 PO 4 , 2,25 мМ MgSO 4 , 2,25 мМ CaCl 2, 0,32 мМ EGTA, 15 мМ d-глюкозы и 2 мМ пирувата натрия, насыщенный кислородом 5% CO 2 -95% O 2 при 37 ° C, pH 7,4) с использованием перистальтического насоса (Bio-Rad, Hercules, CA) при скорости потока 4 мл / мин. Кровь вылилась из разрезов в легком. За префиксом перфузии следили с использованием фильтрованного 3,7% формальдегида в PBS до затвердевания висцеральных тканей. Раствор Кребса-Хенселейта ненадолго перфузировали для удаления излишка фиксатора перед перфузией раствором субстрата X-gal [0.1% 5-бром-4-хлориндолилгалактопиранозида, 5 мМ ферроцианида калия и 0,02% IGEPAL (Sigma-Aldrich, Сент-Луис, Миссури), 0,01% дезоксихолата натрия в PBS] при 37 ° C. За развитием окраски наблюдали и, при необходимости, позволяли развиваться дальше, отсекая блок ткани сердце / легкое-аорта / непарная вена и инкубируя при осторожном перемешивании в растворе субстрата X-gal при 37 ° C.
7 мМ KCl, 12 мМ KH 2 PO 4 , 2,25 мМ MgSO 4 , 2,25 мМ CaCl 2, 0,32 мМ EGTA, 15 мМ d-глюкозы и 2 мМ пирувата натрия, насыщенный кислородом 5% CO 2 -95% O 2 при 37 ° C, pH 7,4) с использованием перистальтического насоса (Bio-Rad, Hercules, CA) при скорости потока 4 мл / мин. Кровь вылилась из разрезов в легком. За префиксом перфузии следили с использованием фильтрованного 3,7% формальдегида в PBS до затвердевания висцеральных тканей. Раствор Кребса-Хенселейта ненадолго перфузировали для удаления излишка фиксатора перед перфузией раствором субстрата X-gal [0.1% 5-бром-4-хлориндолилгалактопиранозида, 5 мМ ферроцианида калия и 0,02% IGEPAL (Sigma-Aldrich, Сент-Луис, Миссури), 0,01% дезоксихолата натрия в PBS] при 37 ° C. За развитием окраски наблюдали и, при необходимости, позволяли развиваться дальше, отсекая блок ткани сердце / легкое-аорта / непарная вена и инкубируя при осторожном перемешивании в растворе субстрата X-gal при 37 ° C.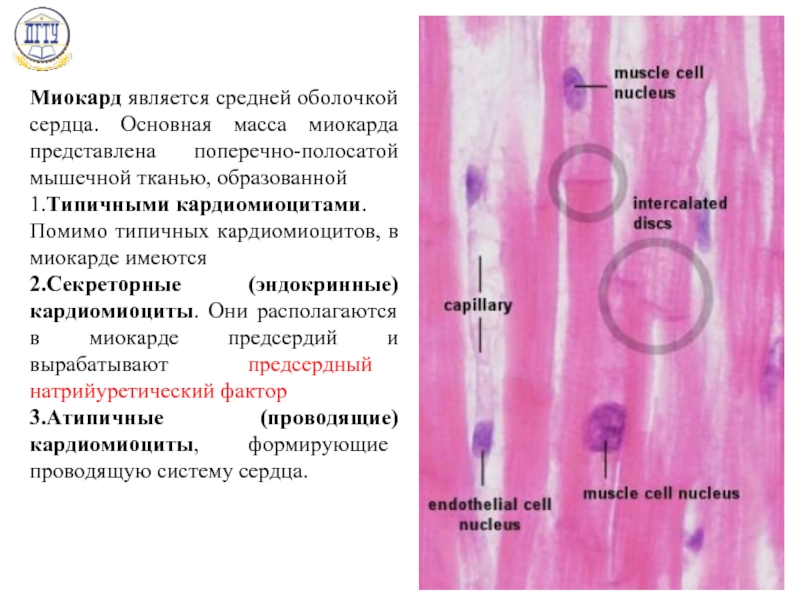 После трех полосканий по 5 минут в PBS при комнатной температуре тканевый блок постфиксировали в 3,7% формальдегиде при 4 ° C в течение ночи.Образцы всей ткани были визуализированы под микроскопом для препарирования и сфотографированы.
После трех полосканий по 5 минут в PBS при комнатной температуре тканевый блок постфиксировали в 3,7% формальдегиде при 4 ° C в течение ночи.Образцы всей ткани были визуализированы под микроскопом для препарирования и сфотографированы.
Окрашивание гематоксилином и эозином.
Системную перфузионную фиксацию in situ взрослых мышей дикого типа проводили в течение 1 ч, как описано выше. Блок ткани, содержащий аорту и непостоянную вену, вырезали и дополнительно фиксировали в 3,7% формальдегиде в течение ночи для лучшего сохранения венозной структуры. После обезвоживания в 30% сахарозе в течение 48 часов тканевый блок помещали в оптимальную температуру охлаждения (О.C.T.) и быстро замораживали в жидком азоте для криосекции. Поперечные срезы толщиной 10 мкм вырезали с помощью криостата Leica CM 1950. Срезы окрашивали гематоксилином и эозином (8), исследовали с помощью микроскопа Zeiss Axiovert 100 и фотографировали.
SDS-PAGE и вестерн-блоттинг.
Неполные ткани вены и сердца взрослых мышей собирали сразу после смерти и обрабатывали для SDS-PAGE или замораживали при -80 ° C до использования. С помощью высокоскоростного механического гомогенизатора ткани быстро гомогенизировали в буфере для образцов Laemmli SDS-PAGE, содержащем 2% SDS для предотвращения эндогенного ферментативного расщепления белков, нагревали при 80 ° C в течение 5 минут и осветляли центрифугированием в микроцентрифуга на максимальной скорости 5 мин.Белковые экстракты разделяли на 14% геле Лэммли с соотношением акриламид: бисакриламид 180: 1. Образцы предсердий и желудочков загружали из расчета 40 мкг ткани на дорожку. Каждое 1-миллиметровое кольцо сосуда растворяли в 25 мкл буфера для образца SDS-геля и загружали из расчета 3 мкл на дорожку. Гели окрашивали кумасси бриллиантовым синим R250 для выявления полос белка. Двойные гели подвергали блоттингу на нитроцеллюлозных мембранах с помощью устройства для полусухого переноса (Bio-Rad).
С помощью высокоскоростного механического гомогенизатора ткани быстро гомогенизировали в буфере для образцов Laemmli SDS-PAGE, содержащем 2% SDS для предотвращения эндогенного ферментативного расщепления белков, нагревали при 80 ° C в течение 5 минут и осветляли центрифугированием в микроцентрифуга на максимальной скорости 5 мин.Белковые экстракты разделяли на 14% геле Лэммли с соотношением акриламид: бисакриламид 180: 1. Образцы предсердий и желудочков загружали из расчета 40 мкг ткани на дорожку. Каждое 1-миллиметровое кольцо сосуда растворяли в 25 мкл буфера для образца SDS-геля и загружали из расчета 3 мкл на дорожку. Гели окрашивали кумасси бриллиантовым синим R250 для выявления полос белка. Двойные гели подвергали блоттингу на нитроцеллюлозных мембранах с помощью устройства для полусухого переноса (Bio-Rad).
После блокирования в TBS, содержащем 1% BSA, мембраны инкубировали с моноклональными антителами (mAb) CGβ6 против гладкомышечного α-тропомиозина (от Dr.Джим Лин, Университет Айовы; 1: 2,000 разведение), CG1 против β-тропомиозина гладких мышц (от доктора Джима Лина; разведение 1: 4000), CT3 против сердечного TnT (разведение 1: 4000) и TnI-1 против сердечного TnI (разведение 1: 1000). ) при 4 ° C в течение ночи (13, 20). После промывок высокой жесткости в TBS, содержащем 0,5% тритона X-100 и 0,05% SDS, мембраны инкубировали со вторым антителом против мышиного IgG, конъюгированным с щелочной фосфатазой (Santa Cruz Biotechnology, Санта-Крус, Калифорния), при комнатной температуре в течение 1 часа. , снова промыли и проявили в растворе субстрата 5-бром-4-хлор-3-индолилфосфат / нитросиний тетразолий для визуализации белковых полос, распознаваемых mAb.
) при 4 ° C в течение ночи (13, 20). После промывок высокой жесткости в TBS, содержащем 0,5% тритона X-100 и 0,05% SDS, мембраны инкубировали со вторым антителом против мышиного IgG, конъюгированным с щелочной фосфатазой (Santa Cruz Biotechnology, Санта-Крус, Калифорния), при комнатной температуре в течение 1 часа. , снова промыли и проявили в растворе субстрата 5-бром-4-хлор-3-индолилфосфат / нитросиний тетразолий для визуализации белковых полос, распознаваемых mAb.
Окрашивание фосфопротеином.
Для исследования фосфорилирования белков гели SDS-PAGE окрашивали с использованием реагентов Pro-Q Diamond (Invitrogen) в соответствии с инструкциями производителя. Маркеры фосфопротеинов (PeppermintStick; Invitrogen) использовали в качестве контроля. Визуализацию флуоресценции выполняли с использованием сканера Typhoon 9210 (GE Healthcare) с возбуждением на длине волны 532 нм и записью излучения на длине волны 580 нм для обнаружения и количественного определения полос фосфопротеинов.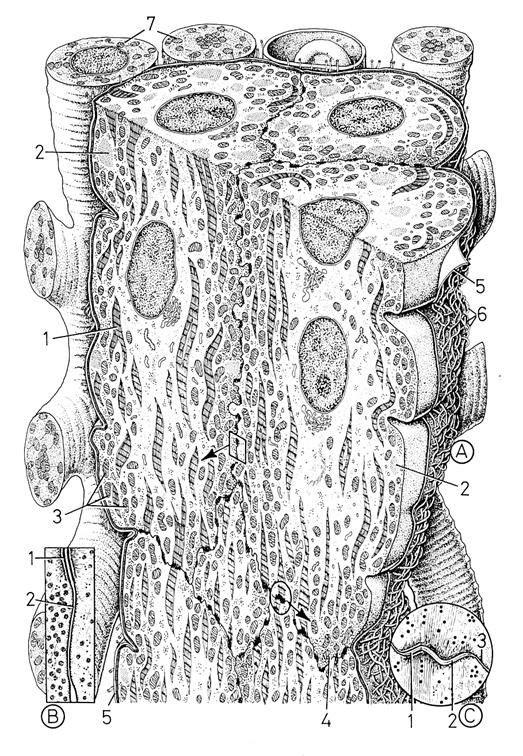
In vivo обработка изопротеренолом была проведена у взрослых мышей для максимального увеличения катализируемого протеинкиназой А (PKA) фосфорилирования белков сердечных миофиламентов (37).Применяли внутрибрюшинную инъекцию изопротеренола (0,2 мг / кг), когда животные находились под легкой анестезией с использованием изофлурана, а частоту сердечных сокращений контролировали с помощью поверхностной ЭКГ. Как только увеличение частоты сердечных сокращений достигло плато, мышь была умерщвлена, и сердце и грудные вены были немедленно изолированы и быстро обработаны в образцы SDS-PAGE, как указано выше, чтобы минимизировать эффект эндогенных фосфатаз.
Препарат ткани для измерения сократимости. В исследовании использовали
мышей C57BL / 6 и крыс Sprague-Dawley.Через 30 минут после внутрибрюшинной инъекции 100 единиц (мыши) или 300 единиц (крысы) гепарина животное анестезировали внутрибрюшинной инъекцией пентобарбитала натрия (100 мг / кг массы тела). Сердце и непарную вену были быстро изолированы и помещены в буфер Кребса-Хенселейта, непрерывно насыщенный 95% O 2 -5% CO 2 при комнатной температуре.
Полоски предсердных мышц мышей получали путем зажима верхней части и связывания нижней части левого предсердия с помощью 6–0 швов для закрепления на стальных тросах, подключенных к устройству измерения силы.
Переднюю сосочковую мышцу левого желудочка мыши получали путем рассечения вместе с сухожилием на одном конце и небольшой части ткани стенки желудочка на другом конце (28). Концы сухожилия и стенки желудочка были связаны швами 6–0 для закрепления на стальных тросах, соединенных с устройством для измерения силы.
Неполная вена была обрезана для удаления соединительных тканей и разрезана на кольца диаметром 1 мм для крепления к прибору для измерения силы с помощью крючков из стальной проволоки.Особое внимание было уделено тому, чтобы избежать растяжения или повреждения тканей. Кольца из проксимальной и дистальной частей непарной вены 4-недельной крысы использовали для сравнения гладкомышечных и кардиоподобных паттернов сократимости. Кольца из проксимальной части непарной вены мыши использовали для измерения сократимости по сравнению с полосами предсердий и сосочковыми мышцами желудочков мыши.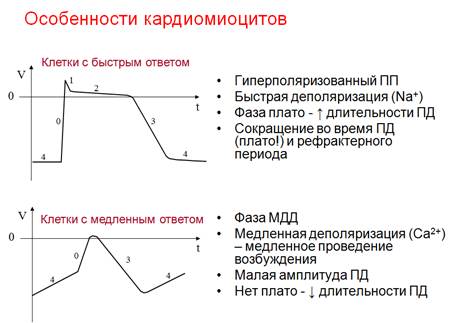 Трехнедельные мыши были выбраны для сравнения паттерна сократимости в отношении преимущества более эффективного переливания по сравнению с более толстыми взрослыми тканями.Ранее мы показали, что экспрессия белков сердечной мышцы в венозных кардиомиоцитах синхронизирована с экспрессией в мышцах предсердий и желудочков во время развития (17), оправдывая использование тканей молодых мышей того же возраста для сравнения сократимости. Тем не менее, взрослых мышей использовали в исследованиях лечения изопротеренолом ex vivo с учетом созревания β-адренергических сигналов в процессе развития.
Трехнедельные мыши были выбраны для сравнения паттерна сократимости в отношении преимущества более эффективного переливания по сравнению с более толстыми взрослыми тканями.Ранее мы показали, что экспрессия белков сердечной мышцы в венозных кардиомиоцитах синхронизирована с экспрессией в мышцах предсердий и желудочков во время развития (17), оправдывая использование тканей молодых мышей того же возраста для сравнения сократимости. Тем не менее, взрослых мышей использовали в исследованиях лечения изопротеренолом ex vivo с учетом созревания β-адренергических сигналов в процессе развития.
Выборочные измерения сокращений сердечной мышцы и гладких мышц.
Кольцо непорочной вены крысы помещали в термостатируемую камеру с непрерывной перфузией насыщенного кислородом буфера Кребса-Хенселейта со скоростью 3 мл / мин. Тканям давали возможность уравновеситься в течение 20 минут с помощью электрических импульсных стимуляций с частотой 0,1 Гц. Анализы проводили при 27 ° C. Изометрическую сократительную силу измеряли с помощью датчика силы Aurora Scientific, модель 403A и записывали с помощью программного обеспечения Chart 5 (Aurora Scientific).
Кольца из проксимальной и дистальной частей непарнокопытной вены крысы электрически стимулировали на 0.1 Гц в физиологическом растворе Кребса для индукции сокращений сердечной мышцы. Затем буфер заменяли на модифицированный буфер Кребса, содержащий 90 мМ KCl (24, 29) в течение 2 минут, чтобы вызвать сокращение гладких мышц, в то время как кардиомиоциты были парализованы, несмотря на продолжающуюся электрическую стимуляцию с частотой 0,1 Гц. Затем перфузию возвращали в нормальный буфер Кребса и регистрировали восстановление электрически стимулированного сокращения сердечной мышцы.
Сравнение сократительной способности препаратов непарной вены и сердечной мышцы.
Сравнение сократительной способности непорочного кольца, предсердной полоски и сосочковой мышцы проводили при 27 ° C и стимуляции 0,1 Гц. Полоса левого предсердия и сосочковая мышца были установлены вертикально, а неполноправное кольцо — горизонтально в трех различных ваннах для органов с непрерывной перфузией насыщенного кислородом буфера Кребса. Изометрическую сократительную силу измеряли с использованием датчиков силы Aurora Scientific Model 403A для непрямого кольца и модели 300B для предсердной полоски и сосочковой мышцы, работающих с использованием программного обеспечения Chart 5 или ASI 600A, соответственно (Aurora Scientific).Стимулирующее напряжение устанавливали равным двойному пороговому напряжению для каждой тестируемой ткани.
Изометрическую сократительную силу измеряли с использованием датчиков силы Aurora Scientific Model 403A для непрямого кольца и модели 300B для предсердной полоски и сосочковой мышцы, работающих с использованием программного обеспечения Chart 5 или ASI 600A, соответственно (Aurora Scientific).Стимулирующее напряжение устанавливали равным двойному пороговому напряжению для каждой тестируемой ткани.
Установленные мышечные ткани были отрегулированы до оптимальной длины после 20-минутного уравновешивания при электрической стимуляции 0,1 Гц. Затем мышцы подвергали стимуляции с частотой 1 Гц и тестировали на влияние 3, 10 и 50 нМ изопротеренола на развитие изометрической силы и сократительной скорости. Испытания изопротеренола проводили при 32 ° C в тусклом свете. Каждый анализ был завершен за 1 час, чтобы убедиться в жизнеспособности ткани.
Анализ данных.
Денситометрический анализ SDS-PAGE геля, геля, окрашенного Pro-Q, и изображений вестерн-блоттинга, сканированных с разрешением 600 точек / дюйм, выполняли с использованием программного обеспечения National Institutes of Health Image версии 1.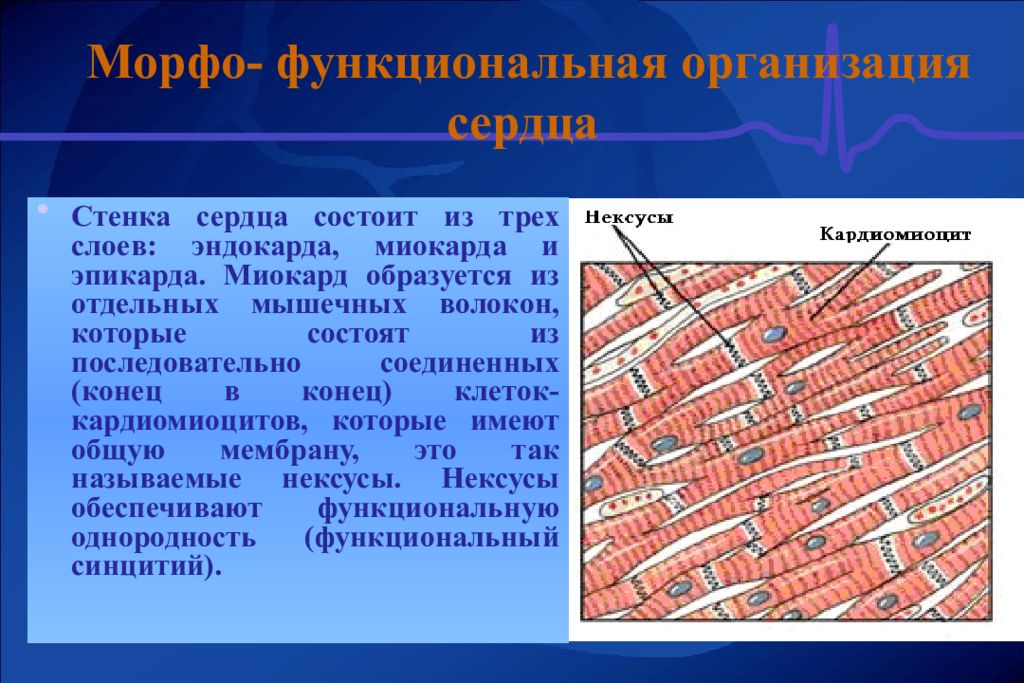 61. Количественные данные были задокументированы как средние значения ± стандартная ошибка среднего. Статистическая значимость разницы между средними значениями анализировалась с использованием парного теста Стьюдента t или двустороннего дисперсионного анализа.
61. Количественные данные были задокументированы как средние значения ± стандартная ошибка среднего. Статистическая значимость разницы между средними значениями анализировалась с использованием парного теста Стьюдента t или двустороннего дисперсионного анализа.
19.2 Сердечная мышца и электрическая активность — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Описать строение сердечной мышцы
- Определите и опишите компоненты проводящей системы, которая распределяет электрические импульсы через сердце
- Сравнить влияние движения ионов на мембранный потенциал проводящих и сократительных клеток сердца
- Связать характеристики электрокардиограммы с событиями сердечного цикла
- Определить блоки, которые могут прервать сердечный цикл
Напомним, что сердечная мышца имеет несколько общих характеристик как со скелетной, так и со скелетной мышцей, но она обладает некоторыми собственными уникальными свойствами.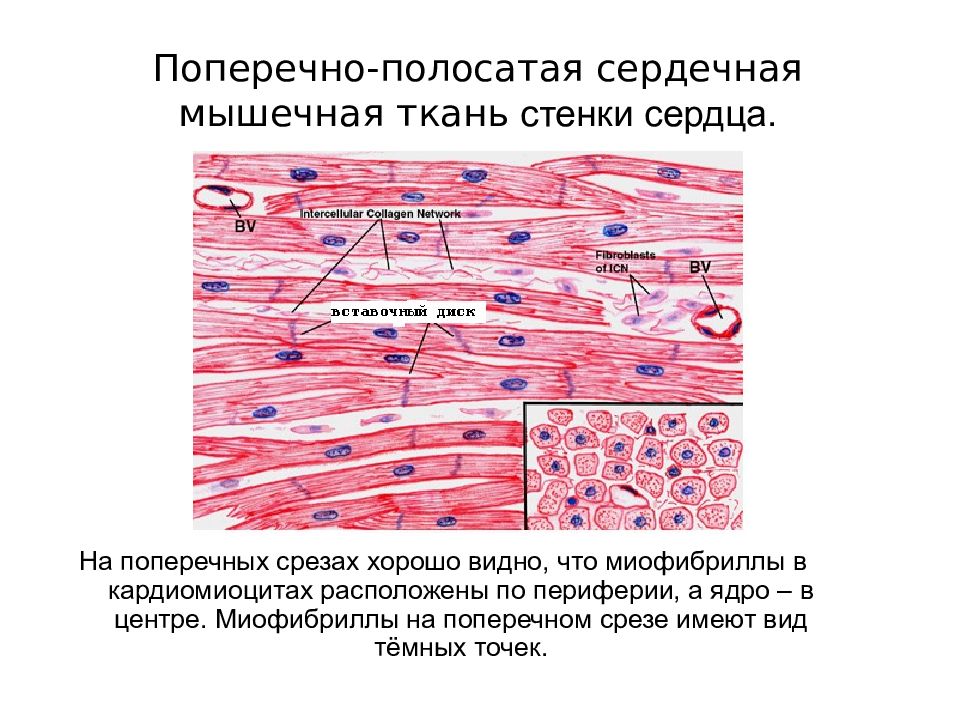 Сокращения сердца (сердцебиение) контролируются специализированными клетками сердечной мышцы, называемыми кардиостимуляторами, которые непосредственно контролируют частоту сердечных сокращений. Это свойство известно как авторитмичность . На это не подействуют ни гладкие, ни скелетные мышцы. Хотя сердечную мышцу невозможно контролировать сознательно, клетки водителя ритма реагируют на сигналы вегетативной нервной системы (ВНС), ускоряя или замедляя частоту сердечных сокращений. Клетки водителя ритма также могут реагировать на различные гормоны, которые модулируют частоту сердечных сокращений, чтобы контролировать кровяное давление.
Сокращения сердца (сердцебиение) контролируются специализированными клетками сердечной мышцы, называемыми кардиостимуляторами, которые непосредственно контролируют частоту сердечных сокращений. Это свойство известно как авторитмичность . На это не подействуют ни гладкие, ни скелетные мышцы. Хотя сердечную мышцу невозможно контролировать сознательно, клетки водителя ритма реагируют на сигналы вегетативной нервной системы (ВНС), ускоряя или замедляя частоту сердечных сокращений. Клетки водителя ритма также могут реагировать на различные гормоны, которые модулируют частоту сердечных сокращений, чтобы контролировать кровяное давление.
Существует два основных типа клеток сердечной мышцы: сократительные клетки миокарда и проводящие клетки миокарда. сократительных клеток миокарда составляют основную часть (99 процентов) клеток в предсердиях и желудочках. Сократительные клетки проводят импульсы и отвечают за сокращения, которые перекачивают кровь по телу. миокардиальных проводящих клеток (1 процент клеток) являются ауторитмическими клетками и образуют проводящую систему сердца. За исключением клеток Пуркинье, они, как правило, намного меньше сократительных клеток и имеют мало миофибрилл или нитей, необходимых для сокращения.Их функция во многом схожа с нейронами, хотя они являются специализированными мышечными клетками. Проводящие клетки миокарда инициируют и распространяют потенциал действия (электрический импульс), который проходит через сердечную мышцу и запускает сокращения, толкающие кровь.
миокардиальных проводящих клеток (1 процент клеток) являются ауторитмическими клетками и образуют проводящую систему сердца. За исключением клеток Пуркинье, они, как правило, намного меньше сократительных клеток и имеют мало миофибрилл или нитей, необходимых для сокращения.Их функция во многом схожа с нейронами, хотя они являются специализированными мышечными клетками. Проводящие клетки миокарда инициируют и распространяют потенциал действия (электрический импульс), который проходит через сердечную мышцу и запускает сокращения, толкающие кровь.
По сравнению с гигантскими цилиндрами скелетных мышц, клетки сердечной мышцы или кардиомиоциты значительно короче и имеют гораздо меньший диаметр. Сердечная мышца также демонстрирует полосы, чередующийся узор из темных полос А и светлых полос I, приписываемых точному расположению миофиламентов и фибрилл, которые организованы в саркомеры по длине клетки (Рисунок 19.2.1 a ). Эти сократительные элементы практически идентичны скелетным мышцам. Т (поперечные) канальцы проникают от поверхностной плазматической мембраны, сарколеммы, внутрь клетки, позволяя электрическому импульсу достигать внутренней части. Т-канальцы находятся только на Z-дисках, тогда как в скелетных мышцах они находятся на стыке полос A и I. Следовательно, в сердечной мышце вдвое меньше Т-канальцев, чем в скелетных мышцах. Кроме того, саркоплазматический ретикулум хранит мало ионов кальция, поэтому большая часть ионов кальция должна поступать извне клеток.Результат — более медленное начало сокращения. Митохондрии в изобилии, они дают энергию для сердечных сокращений. Обычно кардиомиоциты имеют одно центральное ядро, но в некоторых клетках могут быть обнаружены два или более ядра.
Т (поперечные) канальцы проникают от поверхностной плазматической мембраны, сарколеммы, внутрь клетки, позволяя электрическому импульсу достигать внутренней части. Т-канальцы находятся только на Z-дисках, тогда как в скелетных мышцах они находятся на стыке полос A и I. Следовательно, в сердечной мышце вдвое меньше Т-канальцев, чем в скелетных мышцах. Кроме того, саркоплазматический ретикулум хранит мало ионов кальция, поэтому большая часть ионов кальция должна поступать извне клеток.Результат — более медленное начало сокращения. Митохондрии в изобилии, они дают энергию для сердечных сокращений. Обычно кардиомиоциты имеют одно центральное ядро, но в некоторых клетках могут быть обнаружены два или более ядра.
Клетки сердечной мышцы разветвляются свободно. Соединение между двумя соседними клетками отмечено критической структурой, называемой вставным диском , которая помогает поддерживать синхронизированное сокращение мышцы (рис. 19.2.1 b ). Сарколеммы из соседних клеток соединяются между собой интеркалированными дисками.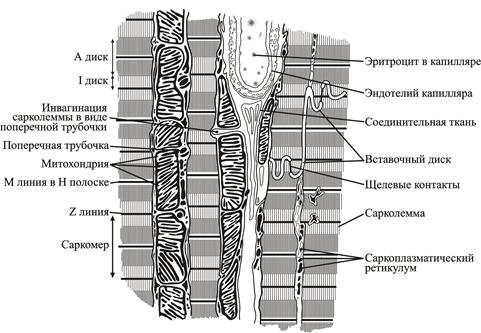 Они состоят из десмосом, специализированных связывающих протеогликанов, плотных контактов и большого количества щелевых контактов, которые позволяют ионам проходить между клетками и помогают синхронизировать сокращение (рис. 19.2.1 c ). Межклеточная соединительная ткань также помогает связывать клетки вместе. Важность прочного связывания этих клеток вместе обусловлена силами сокращения.
Они состоят из десмосом, специализированных связывающих протеогликанов, плотных контактов и большого количества щелевых контактов, которые позволяют ионам проходить между клетками и помогают синхронизировать сокращение (рис. 19.2.1 c ). Межклеточная соединительная ткань также помогает связывать клетки вместе. Важность прочного связывания этих клеток вместе обусловлена силами сокращения.
Ежедневное подключение — ремонт и замена
Поврежденные клетки сердечной мышцы обладают крайне ограниченными способностями к самовосстановлению или замене мертвых клеток посредством митоза. Недавние данные свидетельствуют о том, что по крайней мере некоторые стволовые клетки остаются в сердце, которые продолжают делиться и, по крайней мере, потенциально заменяют эти мертвые клетки.Однако вновь образованные или восстановленные клетки редко бывают такими же функциональными, как исходные клетки, и сердечная функция снижается. В случае сердечного приступа или инфаркта миокарда мертвые клетки часто заменяются участками рубцовой ткани. Вскрытие, проведенное на людях, которым была проведена трансплантация сердца, показывает некоторую пролиферацию исходных клеток. Если исследователи смогут разблокировать механизм, который генерирует новые клетки и полностью восстанавливает митотические возможности сердечной мышцы, прогноз для выживших после сердечного приступа значительно улучшится.На сегодняшний день клетки миокарда, продуцируемые внутри пациента ( in situ, ) сердечными стволовыми клетками, кажутся нефункциональными, хотя клетки, выращенные в чашках Петри ( in vitro, ), действительно побеждают.
Недавние данные свидетельствуют о том, что по крайней мере некоторые стволовые клетки остаются в сердце, которые продолжают делиться и, по крайней мере, потенциально заменяют эти мертвые клетки.Однако вновь образованные или восстановленные клетки редко бывают такими же функциональными, как исходные клетки, и сердечная функция снижается. В случае сердечного приступа или инфаркта миокарда мертвые клетки часто заменяются участками рубцовой ткани. Вскрытие, проведенное на людях, которым была проведена трансплантация сердца, показывает некоторую пролиферацию исходных клеток. Если исследователи смогут разблокировать механизм, который генерирует новые клетки и полностью восстанавливает митотические возможности сердечной мышцы, прогноз для выживших после сердечного приступа значительно улучшится.На сегодняшний день клетки миокарда, продуцируемые внутри пациента ( in situ, ) сердечными стволовыми клетками, кажутся нефункциональными, хотя клетки, выращенные в чашках Петри ( in vitro, ), действительно побеждают. Возможно, скоро эта загадка будет раскрыта, и новые достижения в лечении станут обычным делом.
Возможно, скоро эта загадка будет раскрыта, и новые достижения в лечении станут обычным делом.
Волна сокращения, которая позволяет сердцу работать как единое целое, называемая функциональным синцитием, начинается с клеток кардиостимулятора. Эта группа клеток самовозбуждаема и способна деполяризоваться до пороговых и запускать потенциалы действия самостоятельно, что называется ауторитмичностью; они делают это через определенные интервалы, которые определяют частоту сердечных сокращений.Поскольку они связаны щелевыми контактами с окружающими мышечными волокнами, специализированными волокнами проводящей системы сердца, клетки водителя ритма могут передавать деполяризацию другим волокнам сердечной мышцы таким образом, чтобы сердце сокращалось скоординированным образом.
Если эмбриональные клетки сердца разделить в чашку Петри и сохранить в живых, каждая из них будет способна генерировать свой собственный электрический импульс с последующим сокращением. Когда две независимо бьющиеся клетки эмбриональной сердечной мышцы помещаются вместе, клетка с более высокой собственной частотой задает темп, и импульс распространяется от более быстрой клетки к более медленной, вызывая сокращение. Чем больше ячеек соединяется вместе, тем скорость передачи берет на себя самая быстрая ячейка. Полностью развитое сердце взрослого человека сохраняет способность генерировать собственный электрический импульс, инициируемый самыми быстрыми клетками, как часть системы сердечной проводимости. Компоненты проводящей системы сердца включают синоатриальный узел, атриовентрикулярный узел, предсердно-желудочковый пучок, ветви предсердно-желудочкового пучка и клетки Пуркинье (рис. 19.2.2).
Чем больше ячеек соединяется вместе, тем скорость передачи берет на себя самая быстрая ячейка. Полностью развитое сердце взрослого человека сохраняет способность генерировать собственный электрический импульс, инициируемый самыми быстрыми клетками, как часть системы сердечной проводимости. Компоненты проводящей системы сердца включают синоатриальный узел, атриовентрикулярный узел, предсердно-желудочковый пучок, ветви предсердно-желудочкового пучка и клетки Пуркинье (рис. 19.2.2).
Sinoatrial (SA) Узел
Нормальный сердечный ритм устанавливается синоатриальным узлом (SA) , специализированным скоплением проводящих миокард клеток, расположенных в верхней и задней стенках правого предсердия в непосредственной близости от устья верхней полой вены. Узел SA имеет самую высокую скорость деполяризации и известен как кардиостимулятор сердца. Он запускает синусовый ритм , или нормальный электрический паттерн, за которым следует сокращение сердца.
Узел SA имеет самую высокую скорость деполяризации и известен как кардиостимулятор сердца. Он запускает синусовый ритм , или нормальный электрический паттерн, за которым следует сокращение сердца.
Этот импульс распространяется от своего инициирования в узле SA через предсердия по специализированным межузловым путям к сократительным клеткам миокарда предсердий и атриовентрикулярному узлу. Межузловые пути состоят из трех полос (передняя, средняя и задняя), которые ведут непосредственно от узла SA к следующему узлу проводящей системы, атриовентрикулярному узлу (см.рисунок 19.2.2). Импульс проходит между этими двумя узлами примерно за 50 мс (миллисекунд). Относительная важность этого пути обсуждалась, поскольку импульс достигнет атриовентрикулярного узла, просто следуя клеточному пути через сократительные клетки миокарда в предсердиях. Кроме того, существует специальный путь, называемый связкой Бахмана или межпредсердной полосой , который проводит импульс непосредственно из правого предсердия в левое предсердие.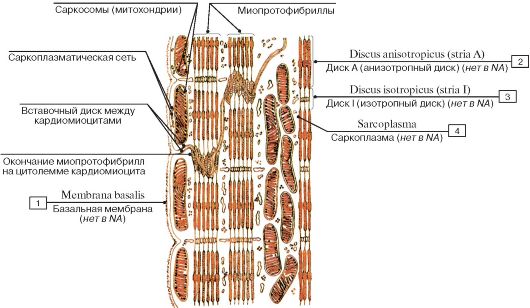 Независимо от пути, когда импульс достигает атриовентрикулярной перегородки, соединительная ткань сердечного скелета препятствует распространению импульса в клетки миокарда желудочков, за исключением атриовентрикулярного узла. На рисунке 19.2.3 показано инициирование импульса в узле SA, который затем распространяет импульс по предсердиям к атриовентрикулярному узлу.
Независимо от пути, когда импульс достигает атриовентрикулярной перегородки, соединительная ткань сердечного скелета препятствует распространению импульса в клетки миокарда желудочков, за исключением атриовентрикулярного узла. На рисунке 19.2.3 показано инициирование импульса в узле SA, который затем распространяет импульс по предсердиям к атриовентрикулярному узлу.
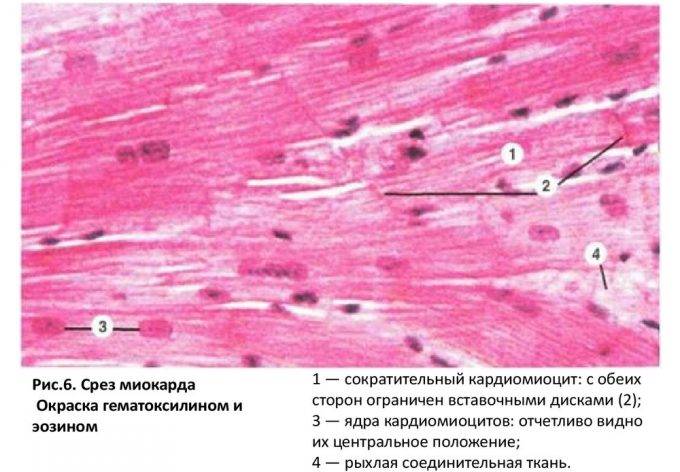 (6) Начинается сокращение желудочков.
(6) Начинается сокращение желудочков.Электрическое событие, волна деполяризации, запускает мышечное сокращение. Волна деполяризации начинается в правом предсердии, и импульс распространяется через верхние части обоих предсердий, а затем вниз через сократительные клетки. Затем сократительные клетки начинают сокращаться от верхних к нижним частям предсердий, эффективно перекачивая кровь в желудочки.
Атриовентрикулярный (АВ) узел
Атриовентрикулярный (АВ) узел — это второе скопление специализированных проводящих клеток миокарда, расположенное в нижней части правого предсердия внутри предсердно-желудочковой перегородки.Каркас сердца предотвращает распространение импульса непосредственно на желудочки, не проходя через АВ-узел. Существует критическая пауза перед тем, как АВ-узел деполяризуется и передает импульс атриовентрикулярному пучку (см. Рис. 19.2.3, шаг 3). Эта задержка передачи частично объясняется малым диаметром ячеек узла, которые замедляют импульс.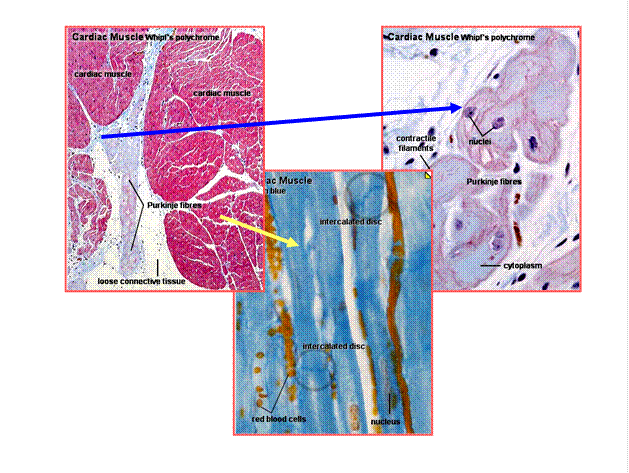 Кроме того, проводимость между узловыми клетками менее эффективна, чем между проводящими клетками. Эти факторы означают, что импульс проходит через узел примерно за 100 мс.Эта пауза имеет решающее значение для работы сердца, поскольку позволяет кардиомиоцитам предсердий завершить свое сокращение, которое перекачивает кровь в желудочки до того, как импульс будет передан клеткам самого желудочка. При экстремальной стимуляции узлом SA, узел AV может передавать импульсы с максимальной скоростью 220 в минуту. Это устанавливает типичную максимальную частоту сердечных сокращений у здорового молодого человека. Поврежденные сердца или сердца, стимулированные лекарствами, могут сокращаться с большей скоростью, но с такой скоростью сердце больше не может эффективно перекачивать кровь.
Кроме того, проводимость между узловыми клетками менее эффективна, чем между проводящими клетками. Эти факторы означают, что импульс проходит через узел примерно за 100 мс.Эта пауза имеет решающее значение для работы сердца, поскольку позволяет кардиомиоцитам предсердий завершить свое сокращение, которое перекачивает кровь в желудочки до того, как импульс будет передан клеткам самого желудочка. При экстремальной стимуляции узлом SA, узел AV может передавать импульсы с максимальной скоростью 220 в минуту. Это устанавливает типичную максимальную частоту сердечных сокращений у здорового молодого человека. Поврежденные сердца или сердца, стимулированные лекарствами, могут сокращаться с большей скоростью, но с такой скоростью сердце больше не может эффективно перекачивать кровь.
Атриовентрикулярный пучок (его пучок), пучковые ветви и волокна Пуркинье
Возникающий из атриовентрикулярного узла атриовентрикулярный пучок , или пучок His , проходит через межжелудочковую перегородку, прежде чем разделиться на две ветвей предсердно-желудочкового пучка , обычно называемые левой и правой ветвями пучка.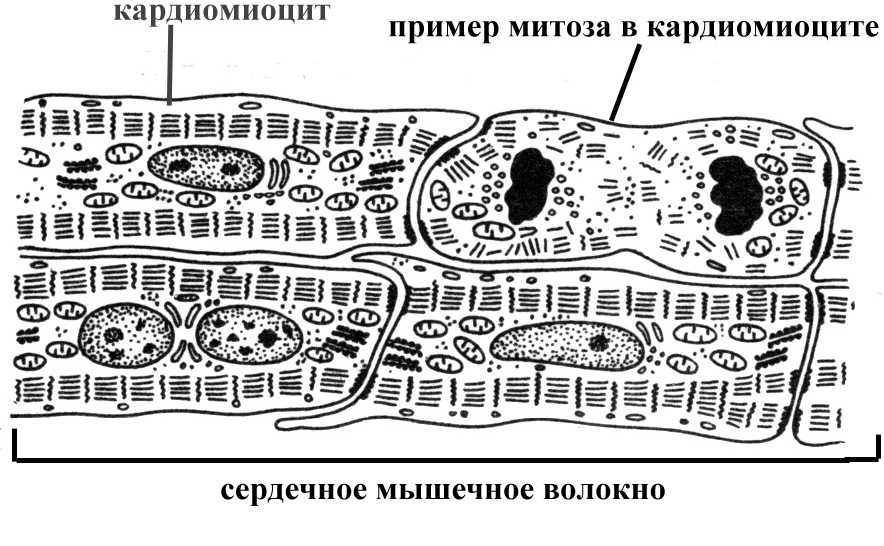 Левая ножка пучка Гиса имеет два пучка. Левая ножка пучка Гиса снабжает левый желудочек, а правая ножка пучка Гиса — правый желудочек.Поскольку левый желудочек намного больше правого, левая ножка пучка Гиса также значительно больше правой. Части правой ножки пучка Гиса находятся в модераторной полосе и снабжают правые сосочковые мышцы. Из-за этой связи каждая сосочковая мышца получает импульс примерно в одно и то же время, поэтому они начинают сокращаться одновременно, как раз перед оставшимися сократительными клетками миокарда желудочков. Считается, что это способствует развитию напряжения на сухожильных хордах до сокращения правого желудочка.Слева нет соответствующей группы модераторов. Обе ветви пучка опускаются вниз и достигают вершины сердца, где соединяются с волокнами Пуркинье (см. Рис. 19.2.3, шаг 4). Этот проход занимает примерно 25 мс.
Левая ножка пучка Гиса имеет два пучка. Левая ножка пучка Гиса снабжает левый желудочек, а правая ножка пучка Гиса — правый желудочек.Поскольку левый желудочек намного больше правого, левая ножка пучка Гиса также значительно больше правой. Части правой ножки пучка Гиса находятся в модераторной полосе и снабжают правые сосочковые мышцы. Из-за этой связи каждая сосочковая мышца получает импульс примерно в одно и то же время, поэтому они начинают сокращаться одновременно, как раз перед оставшимися сократительными клетками миокарда желудочков. Считается, что это способствует развитию напряжения на сухожильных хордах до сокращения правого желудочка.Слева нет соответствующей группы модераторов. Обе ветви пучка опускаются вниз и достигают вершины сердца, где соединяются с волокнами Пуркинье (см. Рис. 19.2.3, шаг 4). Этот проход занимает примерно 25 мс.
Волокна Пуркинье — это дополнительные проводящие миокардиальные волокна, которые передают импульс сократительным клеткам миокарда в желудочках.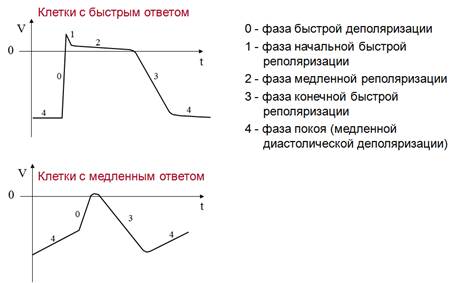 Они проходят через миокард от верхушки сердца к атриовентрикулярной перегородке и основанию сердца.Волокна Пуркинье обладают высокой скоростью проводимости, и электрический импульс достигает всех мышечных клеток желудочка примерно за 75 мс (см. Рис. 19.2.3, шаг 5). Поскольку электрический стимул начинается на верхушке, сокращение также начинается на верхушке и распространяется вверх, к основанию сердца, подобно сдавливанию тюбика зубной пасты снизу. Это позволяет перекачивать кровь из желудочков в аорту и легочный ствол. Общее время, прошедшее от инициирования импульса в узле SA до деполяризации желудочков, составляет примерно 225 мс.
Они проходят через миокард от верхушки сердца к атриовентрикулярной перегородке и основанию сердца.Волокна Пуркинье обладают высокой скоростью проводимости, и электрический импульс достигает всех мышечных клеток желудочка примерно за 75 мс (см. Рис. 19.2.3, шаг 5). Поскольку электрический стимул начинается на верхушке, сокращение также начинается на верхушке и распространяется вверх, к основанию сердца, подобно сдавливанию тюбика зубной пасты снизу. Это позволяет перекачивать кровь из желудочков в аорту и легочный ствол. Общее время, прошедшее от инициирования импульса в узле SA до деполяризации желудочков, составляет примерно 225 мс.
Сердечные проводящие клетки
Потенциалы действия значительно различаются между сердечными проводящими клетками и сердечными сократительными клетками. В то время как Na + и K + играют существенные роли, Ca 2+ также имеет решающее значение для обоих типов клеток. В отличие от скелетных мышц и нейронов, проводящие клетки сердца не обладают стабильным потенциалом покоя.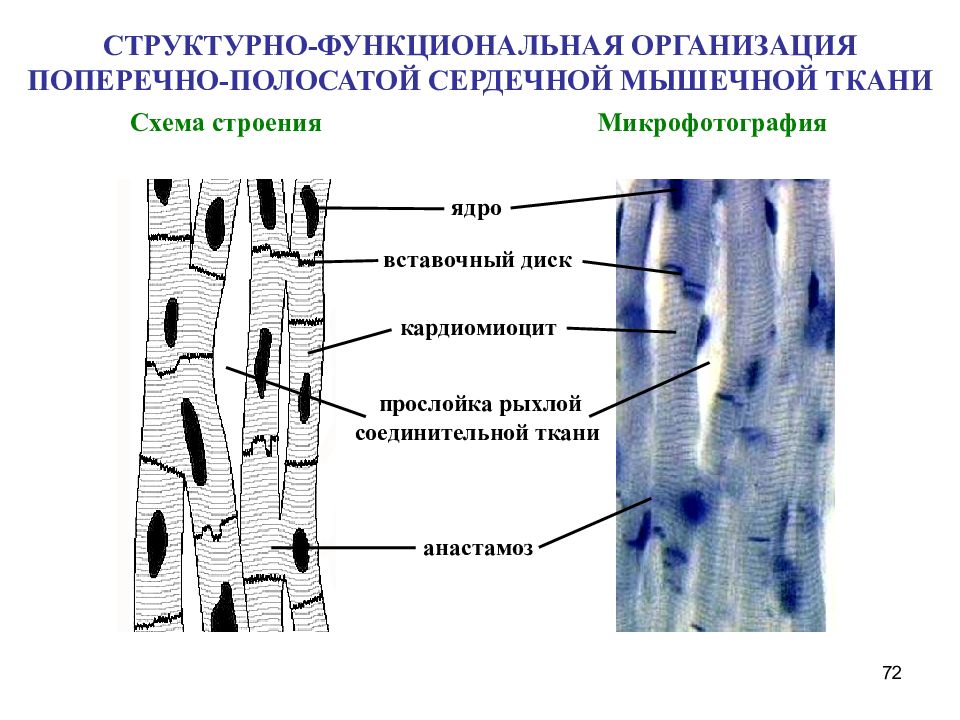 Проводящие клетки содержат ряд каналов для ионов натрия, которые обеспечивают нормальный и медленный приток ионов натрия, что вызывает медленное повышение мембранного потенциала от начального значения -60 мВ до примерно -40 мВ.Результирующее движение ионов натрия создает спонтанную деполяризацию (или предпотенциальную деполяризацию ) и доводит клетку до порогового значения. В этот момент открываются каналы для ионов кальция, управляемые напряжением, и Ca 2+ входит в клетку, формируя фазу нарастания потенциала действия и далее деполяризуя его с более высокой скоростью, пока он не достигнет значения приблизительно +5 мВ. В этот момент каналы ионов кальция закрываются, а управляемые по напряжению каналы K + открываются, обеспечивая выход K + , что приводит к реполяризации.Когда мембранный потенциал достигает примерно -60 мВ, каналы K + закрываются, а управляемые по напряжению медленные каналы Na + открываются, и фаза препотенциала начинается снова.
Проводящие клетки содержат ряд каналов для ионов натрия, которые обеспечивают нормальный и медленный приток ионов натрия, что вызывает медленное повышение мембранного потенциала от начального значения -60 мВ до примерно -40 мВ.Результирующее движение ионов натрия создает спонтанную деполяризацию (или предпотенциальную деполяризацию ) и доводит клетку до порогового значения. В этот момент открываются каналы для ионов кальция, управляемые напряжением, и Ca 2+ входит в клетку, формируя фазу нарастания потенциала действия и далее деполяризуя его с более высокой скоростью, пока он не достигнет значения приблизительно +5 мВ. В этот момент каналы ионов кальция закрываются, а управляемые по напряжению каналы K + открываются, обеспечивая выход K + , что приводит к реполяризации.Когда мембранный потенциал достигает примерно -60 мВ, каналы K + закрываются, а управляемые по напряжению медленные каналы Na + открываются, и фаза препотенциала начинается снова.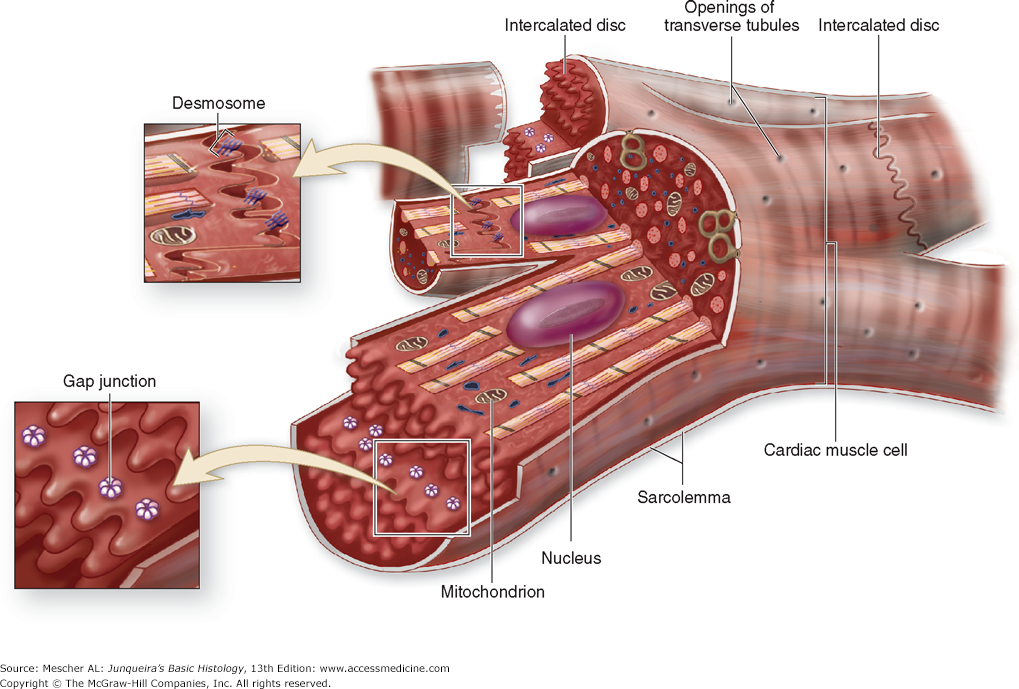 Этот феномен объясняет свойства ауторитмичности сердечной мышцы (рис. 19.2.4).
Этот феномен объясняет свойства ауторитмичности сердечной мышцы (рис. 19.2.4).
Сердечные сократительные клетки
Существует совершенно другая электрическая картина, затрагивающая сократительные клетки. В этом случае происходит быстрая деполяризация, за которой следует фаза плато, а затем реполяризация. Это явление объясняет длительные рефрактерные периоды, необходимые клеткам сердечной мышцы для эффективного перекачивания крови, прежде чем они смогут выстрелить во второй раз. Эти сердечные миоциты обычно не инициируют свой собственный электрический потенциал, хотя они способны на это, а скорее ждут импульса, который до них дойдет.
Сократительные клетки демонстрируют гораздо более стабильную фазу покоя, чем проводящие клетки, при примерно -80 мВ для клеток в предсердиях и -90 мВ для клеток в желудочках. Поскольку ячейки повторно соединены щелевыми контактами, потенциал действия распространяется от ячейки к ячейке за счет потока ионов через щелевые контакты. При стимулировании положительным зарядом, проходящим от соседних клеток, управляемые по напряжению быстрые каналы Na + быстро открываются, запуская механизм деполяризации с положительной обратной связью.Этот быстрый приток положительно заряженных ионов повышает мембранный потенциал примерно до +30 мВ, после чего натриевые каналы закрываются. Период быстрой деполяризации обычно длится 3-5 мс. За деполяризацией следует фаза плато, в которой мембранный потенциал снижается относительно медленно. Это в значительной степени связано с открытием медленных каналов Ca 2+ , что позволяет Ca 2+ войти в ячейку, в то время как несколько каналов K + открыты, что позволяет K + выйти из ячейки. Относительно длинная фаза плато длится примерно 175 мс. Когда мембранный потенциал достигает примерно нуля, каналы Ca 2+ закрываются, а каналы K + открываются, позволяя K + выйти из клетки. Реполяризация длится примерно 75 мс. В этот момент мембранный потенциал падает, пока снова не достигнет уровня покоя, и цикл повторяется. Все событие длится от 250 до 300 мс (рисунок 19.2.5).
Относительно длинная фаза плато длится примерно 175 мс. Когда мембранный потенциал достигает примерно нуля, каналы Ca 2+ закрываются, а каналы K + открываются, позволяя K + выйти из клетки. Реполяризация длится примерно 75 мс. В этот момент мембранный потенциал падает, пока снова не достигнет уровня покоя, и цикл повторяется. Все событие длится от 250 до 300 мс (рисунок 19.2.5).
Клетки сердечной мышцы претерпевают сокращения по типу подергивания с длительными рефрактерными периодами, за которыми следуют короткие периоды расслабления.Расслабление необходимо, чтобы сердце могло наполняться кровью для следующего цикла. Абсолютный рефрактерный период для сердечной сократительной мышцы длится примерно 200 мс, а относительный рефрактерный период длится примерно 50 мс, всего 250 мс. Рефрактерный период очень длительный, чтобы предотвратить возможность тетании, состояния, при котором мышца остается непроизвольно сокращенной. В области сердца тетания несовместима с жизнью, поскольку она мешает сердцу перекачивать кровь.
Рисунок 19.2.5 — Потенциал действия в сердечных сократительных клетках: (a) Обратите внимание на длительную фазу плато из-за притока ионов кальция. Увеличенный рефрактерный период позволяет клетке полностью сжаться до того, как может произойти другое электрическое событие. (b) Потенциал действия сердечной мышцы сравнивается с потенциалом действия скелетных мышц.Ионы кальция
Ионы кальция играют две важнейшие роли в физиологии сердечной мышцы. Их приток через медленные кальциевые каналы составляет длительную фазу плато и период абсолютной рефрактерности, которые позволяют сердечной мышце функционировать должным образом.Ионы кальция также объединяются с регуляторным белком тропонином в комплексе тропонин-тропомиозин; этот комплекс устраняет ингибирование, которое не позволяет головкам молекул миозина образовывать поперечные мостики с активными центрами на актине, которые обеспечивают силовой ход сокращения. Примерно 20 процентов кальция, необходимого для сокращения, доставляется за счет притока Ca 2+ во время фазы плато. Оставшийся для сокращения Ca 2+ высвобождается из хранилища в саркоплазматическом ретикулуме.
Сравнительные показатели проводимости системы обжига
Паттерн предпотенциальной или спонтанной деполяризации, за которой следует только что описанная быстрая деполяризация и реполяризация, наблюдается в узле SA и некоторых других проводящих клетках сердца. Поскольку узел SA является кардиостимулятором, он достигает порога быстрее, чем любой другой компонент проводящей системы. Это инициирует распространение импульсов на другие проводящие клетки. Узел SA без нервного или эндокринного контроля инициирует сердечный импульс примерно 80–100 раз в минуту.Хотя каждый компонент проводящей системы способен генерировать свой собственный импульс, скорость постепенно замедляется по мере продвижения от узла SA к волокнам Пуркинье. Без узла SA, узел AV генерировал бы частоту сердечных сокращений 40-60 ударов в минуту. Если атриовентрикулярный узел был заблокирован, атриовентрикулярный пучок запускался бы со скоростью примерно 30-40 импульсов в минуту. Пучковые ветви будут иметь внутреннюю частоту 20–30 импульсов в минуту, а волокна Пуркинье будут срабатывать со скоростью 15–20 импульсов в минуту.В то время как несколько исключительно тренированных спортсменов-аэробистов демонстрируют частоту пульса в состоянии покоя в диапазоне 30–40 ударов в минуту (самый низкий зарегистрированный показатель составляет 28 ударов в минуту для велосипедиста Мигеля Индурайна), для большинства людей частота пульса ниже 50 ударов в минуту. указывает на состояние, называемое брадикардией. В зависимости от конкретного человека, когда показатели упадут намного ниже этого уровня, сердце не сможет поддерживать адекватный кровоток к жизненно важным тканям, что поначалу приведет к снижению функциональной потери систем, потере сознания и, в конечном итоге, к смерти.
Путем аккуратного размещения поверхностных электродов на теле можно записать сложный, составной электрический сигнал сердца. Это отслеживание электрического сигнала — это электрокардиограмма (ЭКГ) , также обычно сокращенно ЭКГ (K, прибывающая кардиология, от немецкого термина кардиология). Тщательный анализ ЭКГ показывает подробную картину нормальной и аномальной функции сердца и является незаменимым инструментом клинической диагностики. Стандартный электрокардиограф (прибор, который генерирует ЭКГ) использует 3, 5 или 12 отведений.Чем больше отведений использует электрокардиограф, тем больше информации дает ЭКГ. Термин «вывод» может использоваться для обозначения кабеля от электрода к электрическому записывающему устройству, но обычно он описывает разность напряжений между двумя электродами (биполярные отведения). Электрокардиограф с 12 отведениями использует 10 электродов, размещенных в стандартных местах на коже пациента (рис. 19.2.6), грудные электроды однополярные, а отведения от придатков — биполярные. В амбулаторных электрокардиографах непрерывного действия пациент носит небольшое портативное устройство с батарейным питанием, известное как монитор Холтера, или просто холтеровское устройство, которое непрерывно контролирует электрическую активность сердца, обычно в течение 24 часов в течение обычного распорядка дня пациента.
Рисунок 19.2.6 — Стандартное размещение отведений ЭКГ: При ЭКГ с 12 отведениями шесть электродов размещаются на груди, а четыре электрода — на конечностях.Нормальная запись ЭКГ представлена на рисунке 19.2.7. Каждый компонент, сегмент и интервал помечены и соответствуют важным электрическим событиям, демонстрируя взаимосвязь между этими событиями и сокращениями в сердце.
На ЭКГ есть пять основных компонентов (точек): зубец P, комплекс QRS и зубец T.Небольшой зубец P представляет деполяризацию предсердий. Предсердия начинают сокращаться примерно через 25 мс после начала зубца P. Большой комплекс QRS представляет собой деполяризацию желудочков, которая требует гораздо более сильного электрического сигнала из-за большего размера желудочковой сердечной мышцы. Желудочки начинают сокращаться, когда QRS достигает пика зубца R. Наконец, зубец T представляет реполяризацию желудочков.Реполяризация предсердий происходит во время комплекса QRS, который маскирует его на ЭКГ.
Основные сегменты и интервалы записи ЭКГ показаны на рисунке 19.2.7. Сегменты определяются как области между двумя волнами. Интервалы включают один сегмент плюс одну или несколько волн. Например, сегмент PR начинается в конце зубца P и заканчивается в начале комплекса QRS. Интервал PR начинается в начале зубца P и заканчивается началом комплекса QRS.Интервал PR более важен с клинической точки зрения, поскольку он измеряет продолжительность от начала деполяризации предсердий (зубца P) до инициации комплекса QRS. Так как зубец Q может быть трудно увидеть на некоторых графиках, измерения часто расширяют до R, который лучше виден. Если будет задержка прохождения импульса от узла SA к узлу AV, это будет видно в интервале PR. На рисунке 19.2.8 события сердечных сокращений соотносятся с соответствующими сегментами и интервалами ЭКГ.
Внешний веб-сайт
Посетите этот сайт для более подробного анализа ЭКГ.
Рисунок 19.2.7 — Электрокардиограмма: Нормальная кривая показывает зубец P, комплекс QRS и зубец T. Также указаны интервалы PR, QT, QRS и ST, а также сегменты P-R и S-T. Рисунок 19.2.8 — Трассировка ЭКГ, связанная с системой проведения: На этой диаграмме коррелирует запись ЭКГ с электрическими и механическими событиями сердечного сокращения.Каждый сегмент ЭКГ соответствует одному событию сердечного цикла.Ежедневное подключение —
Отклонения ЭКГИногда область сердца, отличная от узла SA, инициирует импульс, за которым следует преждевременное сокращение. Такая область, которая на самом деле может быть компонентом проводящей системы или некоторых других сократительных клеток, известна как эктопический очаг или эктопический кардиостимулятор. Эктопический очаг может быть вызван локальной ишемией; воздействие определенных лекарств, включая кофеин, дигиталис или ацетилхолин; повышенная стимуляция как симпатических, так и парасимпатических отделов вегетативной нервной системы; или ряд заболеваний или патологических состояний.Случайные явления, как правило, преходящи и не опасны для жизни, но если состояние становится хроническим, это может привести либо к аритмии, отклонению от нормального характера проведения и сокращения импульсов, либо к фибрилляции, нескоординированному сердцебиению.
Хотя интерпретация ЭКГ возможна и чрезвычайно важна после некоторой тренировки, полное понимание сложностей и тонкостей обычно требует нескольких лет опыта. В целом, размер электрических колебаний, продолжительность событий и подробный векторный анализ обеспечивают наиболее полную картину сердечной функции.Например, усиленный зубец P может указывать на увеличение предсердий, увеличенный зубец Q может указывать на ИМ, а увеличенный подавленный или инвертированный зубец Q часто указывает на увеличенные желудочки. Зубцы T часто кажутся более плоскими, когда в миокард доставляется недостаточное количество кислорода. Повышение сегмента ST выше исходного уровня часто наблюдается у пациентов с острым ИМ и может казаться пониженным ниже исходного уровня при гипоксии.
Каким бы полезным ни был анализ этих электрических записей, существуют ограничения.Например, не все области, страдающие инфарктом миокарда, могут быть видны на ЭКГ. Кроме того, он не покажет эффективность накачки, что требует дальнейшего тестирования, такого как ультразвуковой тест, называемый эхокардиограммой или визуализацией ядерной медицины. Также возможна электрическая активность без пульса, которая будет отображаться на записи ЭКГ, хотя соответствующее перекачивающее действие отсутствует. Общие отклонения, которые могут быть обнаружены с помощью ЭКГ, показаны на рисунке 19.2.9.
Рисунок 19.2.9 — Общие отклонения ЭКГ: (a) При блокаде второй степени или частичной блокаде половина зубцов P не сопровождается комплексом QRS и зубцами T, в то время как за другой половиной следуют. (b) При фибрилляции предсердий электрическая картина аномальна перед комплексом QRS, и частота между комплексами QRS увеличилась. (c) При желудочковой тахикардии форма комплекса QRS ненормальна. (d) При фибрилляции желудочков нормальная электрическая активность отсутствует. (e) При блокаде третьей степени нет корреляции между предсердной активностью (зубец P) и желудочковой активностью (комплекс QRS).Внешний веб-сайт
Посетите этот сайт, чтобы получить более полную библиотеку аномальных ЭКГ.
Ежедневное подключение — внешние автоматические дефибрилляторы
В случае серьезного нарушения электрической активности сердца может произойти прекращение электрической активности или фибрилляция. При фибрилляции сердце бьется диким, неконтролируемым образом, что не позволяет ему эффективно качать кровь. Фибрилляция предсердий (см. Рисунок 19.2.9 b ) является серьезным заболеванием, но пока желудочки продолжают перекачивать кровь, жизнь пациента не может быть в непосредственной опасности. Фибрилляция желудочков (см. Рис. 19.2.9 d ) — это неотложная медицинская помощь, которая требует жизнеобеспечения, поскольку желудочки не перекачивают кровь эффективно. В условиях больницы его часто называют «синим кодом». Если не лечить всего несколько минут, фибрилляция желудочков может привести к смерти мозга. Наиболее распространенным методом лечения является дефибрилляция, при которой используются специальные электроды для приложения заряда к сердцу от внешнего источника электричества в попытке установить нормальный синусовый ритм (рис. 19.2.10). Дефибриллятор эффективно останавливает сердце, чтобы узел SA мог запустить цикл нормальной проводимости. Из-за их эффективности в восстановлении нормального синусового ритма внешние автоматические дефибрилляторы (EAD) размещаются в местах, часто посещаемых большим количеством людей, таких как школы, рестораны и аэропорты. Эти устройства содержат простые и прямые устные инструкции, которым может следовать немедицинский персонал в попытке спасти жизнь.
Рисунок 19.2.10 — Дефибрилляторы: (a) Немедицинский персонал может использовать внешний автоматический дефибриллятор для восстановления нормального синусового ритма у человека с фибрилляцией.(b) Лопатки дефибриллятора чаще используются в больницах. (кредит b: «widerider107» /flickr.com)Аномальные сердечные ритмы, слишком быстрые (тахикардия), слишком медленные (брадикардия), слишком ранние (эктопические) или нерегулярные, известны как аритмий и диагностируются с помощью ЭКГ. Блок сердца относится к прерыванию нормального проводящего пути. Их номенклатура очень проста. Узловые блоки SA возникают внутри узла SA. Блоки АВ-узла возникают внутри АВ-узла.Инфрагисианские блоки включают пучок Гиса. Блокада пучковой ветви возникает в пределах левой или правой ветвей предсердно-желудочкового пучка. Гемиблоки являются частичными и возникают в пределах одного или нескольких пучков ветви предсердно-желудочкового пучка. Клинически наиболее распространенными типами являются атриовентрикулярная узловая и инфрагистиальная блокада.
AV-блоков часто описывают поэтапно. Блок первой степени или частичный блок указывает на задержку проводимости между узлами SA и AV. Это можно распознать на ЭКГ как аномально длинный интервал PR.Блок второй степени или неполный блок возникает, когда одни импульсы от узла SA достигают узла AV и продолжаются, а другие — нет. В этом случае на ЭКГ выявляются некоторые зубцы P, за которыми не следует комплекс QRS, в то время как другие кажутся нормальными. При третьей степени или полной блокаде нет корреляции между предсердной активностью (зубец P) и желудочковой активностью (комплекс QRS). Даже в случае полной СА-блокады АВ-узел возьмет на себя роль водителя ритма и продолжит инициировать сокращения со скоростью 40–60 сокращений в минуту, что достаточно для поддержания сознания.Блокады второй и третьей степени демонстрируются на ЭКГ, представленной на рисунке 19.2.9.
Если SA-узел не функционирует, сердце поддерживает узловой ритм , который берет начало в АВ-узле. Если это становится хроническим, кардиолог может имплантировать искусственный кардиостимулятор , который подает электрические импульсы в сердечную мышцу, чтобы гарантировать, что сердце продолжает сокращаться и эффективно перекачивать кровь, чтобы ускорить частоту сердечных сокращений и восстановить полный синусовый ритм. кардиологи программируют искусственные кардиостимуляторы, которые могут обеспечивать временную стимуляцию по запросу или на постоянной основе.Некоторые устройства также содержат встроенные дефибрилляторы.
Обычно метаболизм сердечной мышцы полностью аэробный. Кислород из легких доставляется к сердцу и любому другому органу, присоединяясь к молекулам гемоглобина внутри эритроцитов. Клетки сердца также хранят значительное количество кислорода в миоглобине. Обычно эти два механизма, циркулирующий кислород и кислород, связанный с миоглобином, могут поставлять достаточно кислорода сердцу даже во время максимальной производительности.
Жирные кислоты и глюкоза из кровотока расщепляются в митохондриях с высвобождением энергии в форме АТФ.И капли жирных кислот, и гликоген хранятся в саркоплазме и обеспечивают дополнительный запас питательных веществ. (Дополнительные сведения о метаболизме см. В дополнительных материалах.)
Обзор главы
Сердце регулируется как нервными, так и эндокринными органами, но оно способно инициировать свой собственный потенциал действия с последующим сокращением мышц. Проводящие клетки в сердце определяют частоту сердечных сокращений и передают ее через миокард. Сократительные клетки сокращаются и продвигают кровь.Нормальным путем передачи проводящих клеток является синоатриальный (SA) узел, межузловые пути, атриовентрикулярный (AV) узел, атриовентрикулярный (AV) пучок His, ветви пучка и волокна Пуркинье. Потенциал действия для проводящих клеток состоит из предпотенциальной фазы с медленным притоком Na + , за которым следует быстрый приток Ca 2+ и отток K + . Сократительные клетки обладают потенциалом действия с расширенной фазой плато, что приводит к расширенному рефрактерному периоду, что позволяет сердцу полностью сокращаться для эффективного перекачивания крови.Узнаваемые точки на ЭКГ включают зубец P, который соответствует деполяризации предсердий, комплекс QRS, который соответствует деполяризации желудочков, и зубец T, который соответствует реполяризации желудочков.
Обзорные вопросы
Вопросы о критическом мышлении
1. Почему фаза плато так важна для функции сердечной мышцы?
2. Как задержка импульса в атриовентрикулярном узле влияет на сердечную функцию?
3.Как щелевые соединения и вставочные диски способствуют сокращению сердца?
4. Почему клетки сердечной мышцы демонстрируют авторитмичность?
Глоссарий
- искусственный кардиостимулятор
- Медицинское устройство, которое передает электрические сигналы сердцу, чтобы оно сокращалось и перекачало кровь к телу
- атриовентрикулярный пучок
- (также пучок His) группа специализированных проводящих клеток миокарда, передающих импульс от АВ-узла через межжелудочковую перегородку; образуют левую и правую ветви предсердно-желудочкового пучка
- ветви предсердно-желудочкового пучка
- (также, левая или правая ветви пучка Гиса) специализированные проводящие клетки миокарда, которые возникают в результате разветвления предсердно-желудочкового пучка и проходят через межжелудочковую перегородку; ведут к волокнам Пуркинье, а также к правой сосочковой мышце через модераторную ленту
- атриовентрикулярный (АВ) узел
- скопление миокардиальных клеток, расположенных в нижней части правого предсердия внутри предсердно-желудочковой перегородки; получает импульс от узла SA, приостанавливает его, а затем передает его в специализированные проводящие клетки в межжелудочковой перегородке
- ауторитмичность
- Способность сердечной мышцы инициировать собственный электрический импульс, который запускает механическое сокращение, которое перекачивает кровь с фиксированной скоростью без нервного или эндокринного контроля
- Связка Бахмана
- (также межпредсердная полоса) группа специализированных проводящих клеток, которые передают импульс непосредственно от узла SA в правом предсердии в левое предсердие
- пучок Его
- (также атриовентрикулярный пучок) группа специализированных миокардиальных проводящих клеток, которые передают импульс от АВ-узла через межжелудочковую перегородку; образуют левую и правую ветви предсердно-желудочкового пучка
- электрокардиограмма (ЭКГ)
- поверхностная запись электрической активности сердца, которая может использоваться для диагностики нерегулярной функции сердца; также сокращенно EKG
- блокада сердца
- нарушение нормального проводящего пути
- межпредсердный диапазон
- (также пучок Бахмана) группа специализированных проводящих клеток, которые передают импульс непосредственно от узла SA в правом предсердии в левое предсердие
- вставной диск
- физическое соединение между соседними клетками сердечной мышцы; состоящий из десмосом, специализированных связывающих протеогликанов и щелевых контактов, которые обеспечивают прохождение ионов между двумя клетками
- межузловые пути
- специализированных проводящих клеток в предсердиях, которые передают импульс от узла SA через клетки миокарда предсердия и к узлу AV
- клетки миокарда, проводящие
- специализированных клеток, которые передают электрические импульсы по сердцу и запускают сокращение сократительных клеток миокарда
- сократительные клетки миокарда
- Основная масса клеток сердечной мышцы в предсердиях и желудочках, которые проводят импульсы и сокращаются для продвижения крови
- Зубец P
- Компонент электрокардиограммы, представляющий деполяризацию предсердий
- кардиостимулятор
- кластер специализированных клеток миокарда, известный как узел SA, который инициирует синусовый ритм
- Предпотенциальная деполяризация
- (также, спонтанная деполяризация) механизм, который отвечает за аоритмические свойства сердечной мышцы; мембранный потенциал увеличивается, поскольку ионы натрия диффундируют через всегда открытые каналы для ионов натрия и вызывают повышение электрического потенциала
- Волокна Пуркинье
- специализированных проводящих волокон миокарда, которые отходят от ветвей пучка Гиса и передают импульс сокращающим волокнам миокарда желудочков
- Комплекс QRS
- Компонент электрокардиограммы, который представляет деполяризацию желудочков и включает в качестве компонента реполяризацию предсердий
- синоатриальный (SA) узел
- , известный как кардиостимулятор, специализированное скопление проводящих миокард клеток, расположенное в верхней части правого предсердия, которое имеет самую высокую собственную скорость деполяризации, которая затем распространяется по всему сердцу
- ритм синусовый
- нормальная сократительная способность сердца
- спонтанная деполяризация
- (также, предпотенциальная деполяризация) механизм, который отвечает за аоритмические свойства сердечной мышцы; мембранный потенциал увеличивается, поскольку ионы натрия диффундируют через всегда открытые каналы для ионов натрия и вызывают повышение электрического потенциала
- Зубец Т
- Компонент электрокардиограммы, представляющий реполяризацию желудочков
Решения
Ответы на вопросы о критическом мышлении
- Он предотвращает преждевременное распространение дополнительных импульсов по сердцу, тем самым давая мышце достаточно времени для сокращения и эффективного перекачивания крови.
- Он обеспечивает достаточное время для сокращения предсердной мышцы и перекачки крови в желудочки до того, как импульс будет передан в нижние камеры.
- Щелевые соединения внутри вставочных дисков позволяют импульсам распространяться от одной клетки сердечной мышцы к другой, позволяя ионам натрия, калия и кальция перемещаться между соседними клетками, распространяя потенциал действия и обеспечивая скоординированные сокращения.
- Без истинного потенциала покоя происходит медленный приток ионов натрия через медленные каналы, который создает препотенциал, который постепенно достигает порогового значения.
Передача сигналов ретиноевой кислоты непосредственно активируется в кардиомиоцитах и защищает сердца мыши от апоптоза после инфаркта миокарда
Рецензент № 1 (Доказательства, воспроизводимость и ясность (обязательно)):
Сводка
Рукопись, озаглавленная «Прямая активация передачи сигналов RA в кардиомиоцитах защищает сердца от апоптоза после инфаркта миокарда у мышей», написанная Да Силва и соавторами, описывает новый механизм, с помощью которого ретиноевая кислота (RA), небольшая молекула, которая, как известно, важна для развития сердца и функция, проявляет свою роль через прямое воздействие на кардиомиоциты.Была разработана новая индуцибельная модель мыши RARE-Cre-ERT2, в которой RA может быть удален в определенные периоды развития и во многих тканях. После проверки того, что новая линия имитирует эндогенную передачу сигналов RA путем скрещивания RARE-Cre-ERT2 с линиями R26L и mTmG, результаты показывают, что кардиомиоциты эмбрионов E11-E18 и взрослых мышей, подвергшихся инфаркту миокарда (MI), проявляют активность RA. Изящные эксперименты были проведены на эмбрионах беременных самок, которым вводили РА. Дополнительные данные, полученные от мышей, подвергшихся инфаркту миокарда, подтверждают усиление передачи сигналов RA в различных клетках, включая кардиомиоциты.У мышей с 50% снижением уровня ALDh2A инфаркты увеличиваются, а также увеличивается фиброз и апоптоз. Механически секвенирование РНК из изолированных кардиомиоцитов, обработанных RA, позволяет идентифицировать Tgm2 и Ace1 как гены, чувствительные к RA в кардиомиоцитах.
Основные комментарии
Настоящее исследование важно, потому что оно ставит под сомнение существующую догму о косвенной роли RA в сердце, согласно которой сердечные фибробласты являются основными типами клеток, реагирующих на RA, которая действует аутокринным образом.Разработанная новая линия RA-репортеров позволяет с высокой чувствительностью отслеживать клоны клеток, чувствительных к RA. В целом, это хорошо спланированное исследование раскрывает важную новую информацию о защитном сигнальном механизме RA в сердце, полученную в результате впечатляющего количества исследований in vivo. В то время как передача сигналов RA четко задокументирована в кардиомиоцитах во время определенных окон развития сердца, некоторые проблемы возникают в отношении сердца взрослых. В частности, следует лучше задокументировать вклад кардиомиоцитов, обеспечивающих защитный ответ после ИМ, с учетом относительно небольшой фракции, реагирующей на RA.Дополнительные опасения вызывают модель MI и использование мышей для надлежащего контроля. Ниже перечислены основные проблемы, требующие решения.
Мы были рады прочитать общую очень положительную оценку рецензента 1, который нашел наше исследование «важным», «хорошо спланированным» и содержащим «впечатляющий объем работы in vivo».
1. Одна проблема связана с утверждением, что передача сигналов RA в кардиомиоцитах и особенно во взрослых кардиомиоцитах не зависит от эпикарда и возникает из местного источника RA, основанного на GFP-положительных клетках, расположенных вдали от эпикарда.Относительно небольшая популяция кардиомиоцитов отвечает на передачу сигналов RA и выявляется благодаря чувствительности созданной новой линии RARE-Cre-ERT2. Вопрос в том, каков вклад популяции кардиомиоцитов в кардиопротекторный эффект РА после ИМ? Чтобы решить эту проблему, чувствительность к передаче сигналов RA следует сравнивать с мышами со специфической для кардиомиоцитов или эндотелиальной экспрессией репортеров RA. Какова степень инфаркта миокарда и ремоделирования сердца в этих двух линиях? Есть ли защита в обеих линиях?
Мы благодарим рецензента 1 за эти комментарии.Белок ALDh2A2 активируется в различных типах клеток в поврежденных и пограничных зонах (это исследование), а также в эпикарде (Kikuchi et al., 2011). Мы не можем формально исключить, что индуцированная инфарктом миокарда экспрессия эпикардиального- Aldh2a2 способствует ответу GFP, но, учитывая близость клеток GFP к клеткам ALDh2A2 + в зонах повреждения / границы, вероятно, что первичным ответом является местный. Что касается количества кардиомиоцитов, отвечающих на RA после инфаркта, мы хотели бы указать, что активация GFP в нашем трансгенном штамме требует определенного уровня передачи сигналов RA, и возможно, что большее количество кардиомиоцитов реагирует на RA, чем может быть обнаружено с помощью наш репортер напрягает.Это было добавлено к обсуждению нашей исправленной рукописи в строках 434–438.
Мы также согласны с тем, что несколько типов клеток отвечают на передачу сигналов RA (например, клетки PECAM1 + , клетки αSMA + , клетки TropT + , см. Рисунок 4E). Расшифровка точного вклада каждого типа клеток в фенотип, наблюдаемый с повсеместным ALDh2A, потребует удаления всех трех генов рецепторов ретиноевой кислоты ( Rar a / b / g ) специфическим для клеточного типа образом. Создание этих штаммов заняло бы больше года, и мы считаем, что это выходит за рамки данной статьи.
Прочитав комментарии этого рецензента, мы понимаем, что название или наша статья могли вводить в заблуждение, поскольку мы официально не доказали, что передача сигналов RA в кардиомиоцитах отвечает за лучшее восстановление после перевязки LAD. Поэтому мы изменили название на: «Передача сигналов ретиноевой кислоты непосредственно активируется в кардиомиоцитах и защищает сердца мышей от апоптоза после инфаркта миокарда».
2. Секвенирование РНК проводили из кардиомиоцитов, выделенных из эмбриональных сердец, обработанных RA, для идентификации генов, чувствительных к RA.В чем причина того, что после ИМ не выполняли РНК-секвенирование в кардиомиоцитах взрослых, выделенных из сердец мышей RARECreERT2? Как минимум, количественная ПЦР должна быть проведена, чтобы оценить, активируются ли также 2 идентифицированных гена (Tgm2 и Ace1) в сердцах взрослых мышей RARECreERT2 после ИМ.
Выделить чистые популяции кардиомиоцитов из сердец взрослых сложно, и обычно образуются небольшие количества жизнеспособных клеток, которые часто загрязнены сердечными фибробластами. Таким образом, идентификация специфической для кардиомиоцитов реакции на передачу сигналов RA у взрослых является труднодостижимой.Таким образом, мы обратились к сердцу E18.5, для которого существуют хорошие процедуры выделения кардиомиоцитов.
Что касается второго пункта, мы теперь добавили данные qPCR, показывающие, что как Tgm2 , так и Ace1 активируются в инфаркте RARE-Cre-ER T2 сердец по сравнению с фиктивным контролем (Рисунок 6 — приложение к рисунку 2C) .
3. В легендах об окрашивании всей массы X-gal или GFP отсутствует информация о количестве использованных эмбрионов. Пожалуйста, укажите количество эмбрионов, использованных на всех соответствующих рисунках, для подтверждения научной строгости.
Мы благодарим рецензента 1 за указание на это. Число эмбрионов, проанализированных на предмет окрашивания целиком, теперь добавлено к подписям к рисункам.
Белок4. Иммунофлуоресценция с отрицательным контролем с антителом к ALDh2A2 должна быть предоставлена для демонстрации специфичности сигнала.
ALDh2A2 не обнаруживается в неповрежденном сердце; и мы добавили вставку из фиктивного сердца RARE-Cre-ER T2 , окрашенного ALDh2A2 (рис. 4B), которое не имеет конкретной маркировки.Чтобы дополнительно подтвердить специфичность антитела ALDh2A2, мы выполнили эмбриональные делеции Aldh2a1 / a2 / a3 путем инъекции тамоксифена на E13.5 и анализа на E18.5. Делеция ферментов Aldh2a и во время позднего сердечного развития приводит к резкому снижению иммунореактивности ALDh2A2 в сердце при анализе с помощью IF. Анализ уровней мРНК Aldh2a2 методом кПЦР подтверждает эффективность нокдауна (> 90%) с использованием этой стратегии. Эти данные добавлены на Рисунок 5 — дополнение к рисунку 1A-C.
5. На рис. 4 показана передача сигналов RA в сердцах взрослых RARECreERT2 после имитации или инфаркта миокарда. Контрольные сердечки CreERT2 после имитации или ИМ должны отображаться параллельно. Кроме того, какие контрольные мыши были использованы на рисунке 5?
Aldh2a1 f / f ; a2 f / f ; a3 f / f (мыши с тройным флоксированием, без трансгена Cre) использовались в качестве контроля, и эта информация теперь добавлена на рис. текст (строки 286-287). Предыдущее исследование показало, что активация линии CAGGCreER (JAX No.004682) (та же линия, использованная здесь) инъекцией тамоксифена в течение 10 дней с последующим инфарктом миокарда, не приводило к временным побочным эффектам, как было выявлено эхокардиографическим анализом (Konstandin et al., 2013) (см. Строки 284-286). Следовательно, мы считаем, что нет необходимости в проведении операций по ИМ на контрольной группе CAGGCreER , поскольку эти эксперименты уже проводились.
6. Интересно, что 5 доз тамоксифена снижают ALDh2A2 только на 50%. Пожалуйста, дайте объяснение.
Эффективность Cre-опосредованной делеции сильно зависит от структуры хроматина, и известно, что гены с молчанием труднее вырезать (Long and Rossi, 2009).Мы выполнили инъекции тамоксифена за неделю до инфаркта миокарда, момент времени, когда белок ALDh2A2 не обнаруживается (см. Рис. 4B и Zhou et al., 2011; Kikuchi et al., 2011), и поэтому Aldh2a2 , вероятно, заглушен эпигенетически. Неполное иссечение в сердце взрослого человека также можно увидеть на геномном уровне, который показывает только 60% рекомбинированного аллеля (Рисунок 5 — рисунок в приложении 1D). Мы также хотели бы обратить внимание рецензента на наш ответ на комментарий 4, где мы демонстрируем гораздо более высокое снижение (> 90%) уровней мРНК Aldh2a2 после индуцированной тамоксифеном делеции CAGGCreER на поздних этапах сердечного развития, когда Aldh2a2 активно выражается.
7. Поперечные срезы контрольных сердец и сердец RAK ko после инфаркта миокарда атипичны, поскольку они не показывают ожидаемой потери миокардиальной ткани, особенно после 6 дней инфаркта миокарда, как показано на рисунке 4B. Продольные сечения или поперечные сечения на разных уровнях должны быть показаны для документирования степени MI на Рисунке 5.
Анализ потери ткани миокарда после инфаркта миокарда на поперечных срезах является стандартным методом, реализованным в многочисленных публикациях (например,г. Gao et al., 2019). В нашем исследовании мы проанализировали 6 поперечных срезов на мышь, с шагом 40 мкм. Таким образом, была проанализирована значительная и очень репрезентативная часть зоны инфаркта у оперированных мышей. Относительно того, почему ожидаемая потеря ткани меньше, чем ожидалось рецензентом 1, неясно, но это может быть связано с хирургическими процедурами. Мы хотели бы отметить, что все операции были выполнены одним и тем же исследователем в одинаковых условиях как для контрольных мышей, так и для мышей RAKO .Таким образом, мы уверены, что наблюдаемое увеличение размера инфаркта связано с потерей передачи сигналов RA, а не с экспериментальными вариациями.
Анализ областей инфаркта на продольных срезах невозможно в собранных сердцах, так как мы удалили верхушки для экстракции РНК.
8. Поскольку получить воспроизводимые инфаркты после операции по ИМ сложно, количество мышей следует увеличить как минимум до 10 в каждой группе.
Мы увеличили количество анализируемых мышей до 10 на группу в нашей исправленной версии рукописи, как это было предложено рецензентом 1.
9. Идентичны ли показатели выживаемости контрольных мышей и мышей RAK после ИМ? При такой разнице в фиброзе можно было ожидать, что у контрольных мышей продолжительность жизни больше, чем у RAK ko после инфаркта миокарда.
На рис. 5 — дополнение к рисунку 2D мы теперь документируем выживаемость RAKO через 6 дней после инфаркта миокарда. Как предсказал автор обзора 1, мышей RAKO демонстрируют повышенную раннюю гибель по сравнению с контролем (4 из 14 мышей RAKO умерли до 6 дней, в то время как у контрольных мышей ранняя смерть не задокументирована).
10. Каков эффект BMS493 у мышей, имитирующих фиктивную операцию или мышей, прооперированных после инфаркта миокарда? Инактивация передачи сигналов RA с помощью BMS493 должна уменьшать размер инфаркта у мышей RAK ko после ИМ.
Наши данные предполагают, что передача сигналов RA имеет защитный эффект после инфаркта миокарда, и лечение BMS493 не «спасет» увеличенный инфаркт у мышей RAKO. Кроме того, BMS493 имеет относительно короткий период полураспада, и мышам необходимо вводить инъекции несколько раз в день, чтобы эффективно блокировать передачу сигналов RA.
Незначительные баллы
1. Строка 92: добавить ссылку 22 из Guleria 2011.
Это было исправлено.
2. Пожалуйста, проверьте орфографию на предмет опечаток.
Это было выполнено.
Рецензент №1 (значение (обязательно)):
Технически это исследование имеет большое значение, поскольку была разработана новая линия мышей, позволяющая отслеживать клоны RA в определенные периоды развития и во многих тканях.Концептуальная новизна заключается в открытии того, что популяция кардиомиоцитов реагирует на передачу сигналов RA на поздних стадиях эмбрионального развития, а также в поврежденном сердце взрослого человека. Как специалист по механизмам сердечной недостаточности, я считаю, что текущее исследование потенциально очень важно для сердечной области.
Нам было приятно узнать, что рецензент 1 считает наше исследование «технически значимым» и «потенциально очень значимым для сердечной области».
Рефери дают перекрестные комментарии
Я полностью согласен с комментариями рецензента 2 относительно проблем с экспериментами MI и отсутствием количественного анализа с использованием иммунофлуоресценции для оценки передачи сигналов RA в целом.Я также согласен с вопросами, поднятыми Reviewer 3.
Рецензент № 2 (Доказательства, воспроизводимость и ясность (обязательно)):
Новая клеточная линия была разработана для мониторинга передачи сигналов ретиноевой кислоты (RA), которая используется во многих клеточных линиях. Активация передачи сигналов ретиноевой кислоты изучалась во время эмбриогенеза и после перенесенного инфаркта миокарда. Показано, что передача сигналов RA активируется в основном в фибробластах после инфаркта миокарда, и показано, что подавление RA приводит к предположительно более крупным инфарктам с большим рубцом.Показаны классические ответы на выбор нижестоящих эффекторов RA. Исследования хорошо написаны. Технические проблемы включают отсутствие оценки зоны риска в исследованиях инфаркта, что делает утверждение о том, что размер инфаркта увеличивается, необоснованным. Клеточные исследования выполняются с экзогенным RA, которые показывают, что происходит активация программ генов RA.
Этот рецензент прав в том, что наше исследование не включало анализ оценки риска. Однако мы не согласны с его / ее мнением о том, что наше утверждение об увеличении размера инфаркта у животных с мутантами Aldh2a необоснованно.Действительно, наши измерения, выполненные на срезах, показывают статистически значимое увеличение размера инфаркта у животных, у которых было удалено Aldh2a1 / 2/3 .
Рецензент № 2 (значение (обязательно)):
Хотя указано во введении; явное преимущество новой клеточной линии должно быть лучше задокументировано как в прямых сравнительных исследованиях, так и в улучшенном обсуждении. Индикатор выглядит как все или ничего; степень активации передачи сигналов RA, количество RA, необходимое для превращения клетки в «положительную», и долговечность ответа остаются неясными.Все данные во время эмбриогенеза представляют собой качественные флуоресцентные исследования, что является относительным ограничением.
Мы хотели бы поблагодарить рецензента 2 за эти полезные комментарии. К сожалению, количественную оценку количества atRA, необходимого для активации передачи сигналов RA in vivo, трудно выполнить . В качестве решения мы решили эти проблемы, используя первичные кардиомиоциты, выделенные из RARECreER T2 ; mTmG E18,5 сердца. Вкратце, обрабатывая клетки 10 нМ atRA и затем выполняя визуализацию живых клеток, мы могли обнаружить первые клетки GFP + через 28 часов лечения RA, и что уровни клеток GFP + достигли пика примерно через 48 часов.Затем мы обрабатывали клетки различными дозами atRA (т.е. 0,1 нМ-1000 нМ) в течение 48 часов (продолжительность лечения основывалась на эксперименте с динамикой времени) и подсчитывали количество клеток GFP + . Кардиомиоциты ответили на передачу сигналов RA в зависимости от дозы (рис. 2I). Более того, как показано на рис. 2 — рисунок в приложении 1D, мы смогли обнаружить клетки GFP + с концентрациями RA всего лишь 0,1–1 нМ, что является физиологически значимым. Эти количественные данные предоставляют ценную информацию о дозах РА, необходимых для «превращения» кардиомиоцитов в «положительные».
Мы не уверены, что правильно поняли вопрос о «долговечности» ответа. Cre индуцированная рекомбинация трансгена mTmG с использованием линии RARE-CreER T 2 приводит к постоянной активации GFP.
Следует обсудить возможное возникновение активации селективных рецепторов с помощью RA, клеточная линия явно выявляет только RARb. Также следует обсудить нерецепторные взаимодействия РА.
Линия RARECreER T2 использует элемент ответа на ретиноевую кислоту (RARE) из гена Rarb , точного прямого целевого гена передачи сигналов RA, который является наиболее часто используемой стратегией для создания репортерных линий мыши RA (Rossant et al. al., 1991; Dolle et al., 2010; Bilbija et al., 2012). Однако мы понимаем, что активация Rarb RARE может не отражать передачу сигналов RA в ее полном объеме и не учитывает нерецепторные взаимодействия, как правильно указал рецензент 2. Это ограничение нашей линии, которая имеет теперь адресуется в строках 384–387 обсуждения.
Рефери дают перекрестные комментарии
Согласен с комментариями рецензентов 1 и 3; особенно главный комментарий 1 Рецензента 1.
Рецензент № 3 (Доказательства, воспроизводимость и ясность (обязательно)):
Резюме:
В статье тестируется новая индуцируемая репортерная линия трансгенной ретиноевой кислоты мышей, которая позволяет проводить эксперименты по отслеживанию клонов для клеток, в которых присутствует ретиноевая кислота. Это используется, чтобы показать, что ретиноевая кислота непосредственно действует на кардиомиоциты в середине и конце беременности, а также, что интересно, возникает после инфаркта миокарда у взрослых. Был использован соответствующий набор контролей, и впечатляет сильное ингибирование репортера при применении обратного агониста RAR BMS493.В целом исследования логичны и обеспечивают прямую проверку хорошо сформулированных идей.
Мы были счастливы прочитать общую положительную оценку рецензента 3, который нашел наше исследование логичным и обеспечило прямую проверку хорошо сформулированных идей.
Основные комментарии:
1. Транскрипты Aldh2a1 и Aldh2a3 увеличиваются при инфаркте. Каково их распределение белка по сравнению с Aldh2a2? Это особенно важно, потому что исследования по удалению ферментов приводят только к 50% снижению белка ALDh2A2 (рис. 5C), но почти на 70% снижению уровней мРНК Aldh2a1 и Aldh2a2.Кроме того, количественное определение изменения экспрессии белка по интенсивности флуоресценции будет очень неточным. Если это лучший подход, необходимо предпринять некоторые попытки продемонстрировать, как это соотносится с реальными уровнями.
Мы согласны с тем, что измерение уровней белка ALDh2A2 с помощью IF не очень надежно, и мы удалили рисунок 5C из статьи.
Ранее мы протестировали несколько коммерческих антител к ALDh2A1 и ALDh2A3, но нашли их неудовлетворительными. Мы протестировали новые антитела, но не наблюдали иммунореактивности ALDh2A1 или ALDh2A3 в сердце после инфаркта миокарда.Следовательно, из-за технических трудностей мы не смогли предоставить данные о распределении белков ALDh2A1 и ALDh2A3 в сердце после инфаркта миокарда.
2. Было высказано предположение, что регуляция Tgm2 с помощью RA напрямую зависит от его действия в течение 9 часов, однако, учитывая, что измеримая регуляция транскрипта может происходить через 2-3 часа, этот аргумент не является убедительным.
Это отличный момент, поднятый рецензентом 3. Действительно, утверждение о том, что активация Tgm2 с помощью RA может быть прямой, на основе данных лечения 9 часов RA, может быть усилено.Чтобы дополнительно проверить, являются ли Tgm2 и Ace1 прямыми или непрямыми мишенями для RA, мы провели эксперименты, в которых лечение RA было сокращено до 3 часов и в которых ингибитор синтеза белка циклогексимид был добавлен в среду для дальнейшего ограничения непрямой активации . Tgm2 и Ace1. Как показано на фиг. 6 в дополнении к фигуре 2D, никакой модуляции экспрессии Tgm2 или Ace1 не наблюдается после 3-часовой обработки RA, как с циклогексимидом, так и без него. Экспрессия Rarb все еще активируется только после 3-часовой обработки RA. В целом эти данные предполагают, что Tgm2 и Ace1 являются косвенными целями RA. Эти новые данные адресованы в строках 352-359 раздела результатов и в строках 447-448 обсуждения.
Незначительные комментарии:
1. В строке 36 описано, что окисление ретинальдегида до ретиноевой кислоты считается этапом, ограничивающим скорость. Какая ссылка для этого? Раньше считалось окислением ретинола до e.г. Вольф Г. Регуляция образования ретиноевой кислоты. Nutr Rev.1996; 54: 182-4.
Мы согласны с рецензентом 3 в том, что это спорное утверждение, и мы удалили его из рукописи.
2. Что может объяснить различия с репортером ретиноевой кислоты мыши Rossant в зачатках конечностей, т.е. Rossant показывает низкий / отсутствующий репортер в конечностях на E8.5?
Линия RARE-LacZ , использованная Россантом и др. 1991 документирует острую активацию активности RA и не маркирует постоянно клетки.Линия RARECreER T2 , связанная с репортерами Rosa26 LacZ или mTmG , постоянно метит RA-чувствительные клетки и, таким образом, подходит для анализа клеточных клонов. Поэтому мы полагаем, что мечение конечностей нашей линией RARECreER T2 является результатом активации RA в предшественниках конечностей на ранней стадии (например, E6.5 или E7.5), которые с помощью E8.5 мигрировали в зачатки конечностей и, благодаря постоянной природе активации репортера, продолжают экспрессировать β-gal / GFP.Для проверки этой гипотезы потребуются конкретные эксперименты, выходящие за рамки данной статьи.
3. В строке 414-415 обсуждение внезапно переходит к обсуждению пути RAS без какого-либо объяснения этого.
Мы согласны с тем, что переход был очень резким, и благодарим рецензента 3 за указание на это. Это было исправлено.
Рецензент № 3 (значение (обязательно)):
Природа и значение:
Результаты тестирования новой индуцибельной линии репортеров трансгенной ретиноевой кислоты у мышей, ценной для будущих исследований развития передачи сигналов ретиноевой кислоты.Исследование также предоставляет дополнительные доказательства роли ретиноевой кислоты в восстановлении сердца после инфаркта миокарда.
Работа — важный шаг вперед по сравнению с нынешними знаниями
Аудитория: Биологи развития и кардиофизиологи
Мой опыт: передача сигналов ретиноевой кислоты
Рефери дают перекрестные комментарии
Согласен со всеми комментариями
Артикул:
Konstandin, M.H., Toko, H., Gastelum, G.M., Quijada, P., Де Ла Торре, А., Кинтана, М., Коллинз, Б., Дин, С., Авитабиле, Д., Фёлькерс, М., и др. (2013). Фибронектин необходим для репаративного ответа сердечных клеток-предшественников после инфаркта миокарда. Circ. Res. 113, 115–125.
Кикучи К., Холдуэй Дж. Э., Майор Р. Дж., Блюм Н., Дан Р. Д., Бегеманн Г. и Посс К. (2011). Производство ретиноевой кислоты эндокардом и эпикардием является ответной реакцией на травму, необходимой для регенерации сердца у рыбок данио. Dev. Cell 20, 397–404.
Гао, Ф., Катаока, М., Лю, Н., Лян, Т., Хуанг, З.П., Гу, Ф., Дин, Дж., Лю, Дж., Чжан, Ф., Ма, К., Ван, Ю. , Zhang, M., Hu, X., Kyselovic, J., Hu, X., Pu, W.T., Wang, J., Chen, J. и Wang D. (2019). Терапевтическая роль miR-19a / 19b в регенерации сердца и защите от инфаркта миокарда. Nature Communications 10, 1802 г.
Лонг, М.А., Росси, Ф.М.В. (2009). Молчание ингибирует Cre-опосредованную рекомбинацию репортеров Z / AP и Z / EG во взрослых клетках. PLoS One 4 (5), e5435.
Чжоу, Б., Honor, L.B., He, H., Qing, M., Oh, J.H., Баттерфилд, C., Lin, R.Z., Melero-Martin, J.M., Dolmatova, E., Duffy, H.S., et al. (2011). Эпикард взрослой мыши модулирует повреждение миокарда, секретируя паракринные факторы. J. Clin. Вкладывать деньги. 121, 1894–1904.
https://doi.org/10.7554/eLife.68280.sa2Атипичные боли в груди: ранние признаки сердечного приступа
Боли в груди… Они сложные.
Многие из нас испытали этот момент: боль или дискомфортное напряжение в груди после подъема тяжестей или неустойчивый пульс и затрудненное дыхание во время панической атаки.Может, мы просто чувствуем себя не в своей тарелке — что-то не так. Такие моменты могут заставить нас задуматься, есть ли у нас сердечный приступ или эти симптомы нормальны.
В то время как многие люди, испытывающие сердечную боль в груди, обычно испытывают ишемическую боль в груди или стенокардию, есть ряд людей, которые испытывают атипичные симптомы, которые могут вызывать беспокойство и тревогу.
«Удивительно высокий процент болей в груди сердечного происхождения, которые не проявляются как острые, похожие на нож колющие боли, но они, безусловно, привлекают наше внимание», — сказал Джоэл Купер, доктор медицины, врач семейной медицины в Banner Urgent Care. .«Но боли в груди всегда привлекают внимание пациентов, у которых они есть, и, безусловно, привлекают внимание врачей и других медицинских специалистов, оценивающих их».
В чем разница между атипичной и типичной болью в груди?
«Атипичная боль в груди — это любая боль в груди, не отвечающая критериям общепринятого или очевидного диагноза», — сказал д-р Купер. «Это необычная диагностическая категория, на самом деле не очень точная или полезная».
Типичная боль в груди — это боль в груди, ожидаемая при определенном диагнозе, например, сокрушительная боль в груди за грудиной, которую врачи ожидают увидеть при сердечном приступе.
«Более полезный способ подумать об этом: опасна ли боль в груди для пациента? Это повод для беспокойства? Можно ли установить его причину с помощью дальнейших тестов или диагностических исследований? Что можно сделать, чтобы помочь пациенту? » — сказал доктор Купер.
Каковы атипичные симптомы?
Типичные симптомы сердечного приступа включают боль или давление в груди, учащенное сердцебиение, холодный пот и одышку. У других — чаще всего у женщин, пожилых людей и диабетиков — симптомы могут быть более незаметными или вообще не затрагивать грудную клетку.
«Вместо сокрушительных болей в груди за грудиной или ощущения« слона, сидящего на моей груди », которое наблюдается у мужчин, женщины могут проявлять себя иначе», — сказал доктор Купер.
Атипичные симптомы сердечного приступа могут включать усталость, одышку, дискомфорт в горле, челюсти, шее, руках, спине и животе — ощущение, которое описывается почти как растяжение мышц или боль. Проблема также может проявляться в виде несварения желудка или изжоги и даже может имитировать другие желудочно-кишечные проблемы.
Каковы причины атипичных болей в груди?
Распространенные причины атипичной боли в груди включают заболевания желудочно-кишечного тракта, дыхательных путей и опорно-двигательного аппарата.Также нередки случаи, когда люди с тревогой или паническими атаками думают, что у них сердечный приступ.
«Заболевания сердца, аорты, легких, пищевода, желудка, внутренних органов брюшной полости и опорно-двигательного аппарата могут вызывать дискомфорт и боль в груди», — сказал доктор Купер. «Одной из наиболее распространенных скелетно-мышечных причин атипичной боли в груди, которую мы наблюдаем у взрослых, является костохондрит».
Костохондрит — это воспаление хряща, соединяющего ребра с грудиной. Это вызывает болезненность или болезненность и может усиливаться при глубоком вдохе или кашле.
Тем не менее, даже если есть менее серьезная причина атипичных болей в груди, в целом боль в груди имеет большое значение в медицине — то, что вы никогда не должны отмахиваться или относиться легкомысленно. Почему? Когда дело доходит до сердечного приступа, время — ткань.
«Чем больше времени требуется на диагностику и лечение острого коронарного синдрома или сердечного приступа, тем более стойкий ущерб нанесен сердцу и тем меньше вероятность того, что у пациента будет благоприятный исход или даже выживет», — сказал д-р Купер. «Даже если вы были в отделении неотложной помощи 10 раз до этого с подозрением на сердечный приступ и ничего не обнаружили, кроме тревоги, это сердечный приступ, пока не будет доказано обратное.”
Когда вам следует обращаться за медицинской помощью?
Если вы старше, если у вас в прошлом был сердечный приступ, семейный анамнез сердечных заболеваний и если боль в груди сопровождается другими тревожными симптомами, такими как одышка и головокружение, позвоните в службу 911 или обратитесь к немедленно. Если вы молоды и здоровы и не страдаете сердечными заболеваниями, вам также следует проконсультироваться с лечащим врачом.
«Итог: если вы думаете, что у вас сердечный приступ, вполне возможно, что это так», — д-р.- предупредил Купер. «Поскольку сердечный приступ может быть смертельным, вы не должны бросать кости на этом. Если окажется, что ваши боли в груди вызваны чем-то менее серьезным — отлично! Вы будете уверены, что у вас не сердечный приступ. Но, по крайней мере, вы предприняли соответствующие шаги, чтобы выяснить это ».
Статьи по теме:
Присоединиться к разговору
Скелетные мышцы взрослых мышей содержат клетки, которые могут дифференцироваться в кардиомиоциты in vitro
Цитирование: Виницкий С.О., Гопал Т.В., Хассанзаде С., Такахаши Х., Грайдер Д., Рогавски М.А. и др.(2005) Скелетные мышцы взрослых мышей содержат клетки, которые могут дифференцироваться в биомиоциты in vitro. ПЛоС Биол 3 (4): e87. https://doi.org/10.1371/journal.pbio.0030087
Академический редактор: Кеннет Р. Чиен, Калифорнийский университет в Сан-Диего, Соединенные Штаты Америки
Поступила: 23 декабря 2004 г .; Одобрена: 6 января 2005 г .; Опубликован: 15 марта 2005 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями декларации Creative Commons Public Domain, которая предусматривает, что после размещения в общественном достоянии эта работа может свободно воспроизводиться, распространяться, передаваться, модифицированы, созданы на основе или иным образом использованы кем-либо в любых законных целях.
Конкурирующие интересы: Заявка на патент США под названием «Стволовые клетки, которые трансформируются в биологические кардиомиоциты» (PTC # 33860) была подана правительством США, а SOW, TVG, SH и NDE указаны в качестве соавторов.
Сокращения: AP, потенциал действия; CPS, сердечные предшественники от Spoc; Cre, Cre-рекомбиназа; DAPI, 4 ‘, 6-диамидино-2-фенилиндол; EGF, фактор роста эпидермиса; ЭМ, электронная микроскопия; FGF, фактор роста фибробластов; GFP, зеленый флуоресцентный белок; HSC, кроветворные стволовые клетки; Иллинойс, интерлейкин; MI, инфаркт миокарда; RLCP, регулирующая легкая цепь фосфорилированного сердечного миозина; Spoc, предшественник кардиомиоцитов на основе скелета; SVF, клетки сосудистой фракции стромы
Введение
Сложность восстановления сердечной функции после смерти кардиомиоцитов, например, при сердечном приступе, контрастирует с повреждением скелетных мышц, при котором количество миоцитов может увеличиваться за счет привлечения новых миоцитов из местного ствола -клеточный пул, называемый сателлитными ячейками.В настоящее время трансплантация сердца с внутренними ограничениями снабжения, иммуносупрессией и отторжением органов остается единственным долгосрочным методом лечения необратимой сердечной недостаточности. Инъекция фетальных или эмбриональных стволовых клеток в инфаркт сердца имеет определенные перспективы [1,2,3], но осложняется возможностью иммунологического отторжения, а также политическими и этическими соображениями. Пластичность клеток, наблюдаемая после трансплантации in vivo различных клеточных линий [4,5,6,7] или после трансформации in vitro 5-азацитидином [8], подтолкнула к изучению клеточной терапии.Исследователи идентифицировали эндогенную пролиферацию кардиомиоцитов [9] и экспериментировали со скелетными миобластами, а также со взрослыми стволовыми клетками, выделенными из крови или сердца, чтобы попытаться восстановить сердечные повреждения [9,10,11,12,13,14,15].
Анализ исследований трансплантации стволовых клеток in vivo усложнился отчасти из-за растущего понимания процесса слияния донорских стволовых клеток и зрелых клеток реципиента in vivo [16,17,18]. Недавние исследования показали, что небольшая популяция клеток в мышином жире прогрессирует до побивания клеток in vitro [19].Три независимые группы имеют изолированные стволовые клетки сердца, которые демонстрируют способность дифференцироваться в кардиомиоциты in vivo [14,15,20]. Все три типа клеток интенсивно пассируются, после чего два из них могут дифференцироваться in vitro.
При оценке множества первичных культур клеток различных линий мы заметили неприлипающие клетки, изолированные из скелетных мышц взрослых мышей, которые становятся бьющимися плавающими клетками. Мы назвали их клетками Spoc (скелетные предшественники кардиомиоцитов) за их способность генерировать биение кардиомиоцитов in vitro.Эти клетки, легко получаемые из скелетных мышц, открывают новые возможности для кардиологических исследований и терапевтических вмешательств. При системном введении мышам с острым инфарктом они мигрируют в область сердечного инфаркта и дифференцируются в сердечные миоциты.
Результаты / Обсуждение
Характеристика клеток Spoc
При первоначальном выделении клетки Spoc представляют собой CD34 — и CD45 — (данные не показаны). Диссоциация 10 г мышц ноги дает примерно 2 × 10 6 клеток Spoc.Клетки C-kit + , содержащие менее 1% клеток Spoc, присутствуют после выделения, но могут быть удалены аффинной очисткой без каких-либо изменений в последующих результатах (данные не показаны). Электронная микроскопия (ЭМ) показывает, что в день выделения клетки Spoc имеют диаметр 4-8 мкм, часто меньше, чем эритроцит, и демонстрируют обильные везикулы, указывающие на активный транспорт. Присутствует много ламеллиподий и филоподий, что частично может объяснить типичное скопление клеток в виде липучки, которое затрудняет химическое и физическое диспергирование (рис. 1).Фенотип CD34 — / CD45 — / c-kit — отличает клетки Spoc от других неприлипающих клеток, ранее описанных как происходящие из скелетных мышц [5]. Клетки Spoc отличаются от сателлитных клеток по следующим критериям: (1) клетки Spoc не экспрессируют Pax-7 [21] или поверхностный маркер c-met [22]; (2) примерно одинаковое количество клеток Spoc выделяется как от молодых (менее 4 недель), так и от старых (от 12 до 16 недель) мышей, в то время как сателлитные клетки трудно изолировать от нормальных мышц мышей после В возрасте 8 недель без первой индукции мышечной травмы [21]; (3) при изоляции клетки Spoc остаются круглыми плавающими клетками диаметром приблизительно 4 мкм, тогда как изолированные сателлитные клетки вскоре становятся прикрепленными; (4) Spoc-клетки — это CD34 – и Myf-5 –, исключая их из класса покоящихся сателлитных клеток [23]; и (5) три суперрегуляторных гена скелетных мышц myf5, myoD, и миогенин , как известно, когда-то присутствуют в сателлитных клетках [22], но в клетках Spoc все три маркера остаются отрицательными с первого дня. изоляции на протяжении длительного культивирования (данные не показаны).Таким образом, клетки Spoc не являются ни сателлитными, ни дифференцированными клетками скелетных мышц.
Рис. 1. ЭМ клеток Spoc в день 0
Электронная микрофотография свежевыделенной клетки Spoc (A) показывает ее небольшой размер по сравнению с типичным двояковогнутым профилем эритроцита над ней (стрелка). (B) показана типичная клетка Spoc с большим количеством везикулярных структур, ламеллиподий и филоподий. (C) показывает три клетки Spoc, настолько плотно сгруппированные, что их границы трудно различить.Это типичное скопление затрудняет анализ клеточной сортировки по флуоресценции (FACS).
https://doi.org/10.1371/journal.pbio.0030087.g001
В течение первых 7 дней в среде, содержащей эпидермальный фактор роста (EGF) и фактор роста фибробластов (FGF), клетки Spoc проходят несколько раундов деления, начиная с выражать GATA-4 (в основном кардиоспецифический фактор транскрипции) и превращаются в кластеры плавающих круглых сердечных предшественников из клеток Spoc (CPS) с увеличенным диаметром 10–14 мкм.Образец Окрашивание GATA-4 в этих клетках необычно тем, что оно преимущественно цитоплазматическое, что отличается от ожидаемого ядерного окрашивания фактора транскрипции. Хорошо известно, что многие факторы транскрипции, хотя и встречаются редко, имеют цитоплазматическую фазу. GATA-4 был описан аналогичным образом, и в этом случае было показано, что он перемещается в ядро после добавления бета-адренергического препарата изопротеренола [24,25]. По этим причинам изопротеренол добавляли к культуре клеток CPS на 1 ч, после чего Окрашивание GATA-4 наблюдалось в ядрах многих клеток (рис. 2).Эти клетки продолжают экспрессировать другие кардиоспецифические маркеры, включая сердечный тропонин-T, Nkx-2.5, MLC-2v и сердечный кальциевый канал L-типа, обнаруживаемый либо с помощью иммуноокрашивания, либо с помощью ПЦР в реальном времени (рис. 3A-3G; данные ПЦР в реальном времени не показаны). Хотя Nkx-2.5 может присутствовать в гладких мышцах сосудов, ни альфа-, ни бета-миозин не присутствует в гладких мышцах. Активные кардиомиоциты, полученные из клеток Spoc, экспрессируют как альфа-, так и бета-миозин на 28 день, как показано окрашиванием поликлональными антителами против альфа- и бета-миозина (Рисунок S1).На более поздних стадиях коннексин 43 экспрессируется в кластерах клеток (Figure 3H-3I). Еще до того, как они срослись, некоторые изолированные клетки начинают биться (Видео S1).
Рисунок 2. Сублокализация GATA-4 в клетках Spoc
(А) GATA-4 обнаруживается в цитоплазме клеток Spoc 10-го дня (цитоспин).
(B) Изображение Номарского (A), на котором показаны синие ядра, окрашенные DAPI.
(C) Объединить изображение, показывающее ядра и Окрашивание ГАТА-4.
(D) Когда клетки Spoc инкубируют с 20 мкМ изопротеренола в течение 1 ч, Наблюдается ядерное окрашивание GATA-4.
(E) Изображение Номарского (D).
(F) Слияние (D) и (E), показывающее сублокализацию GATA-4 для ядер. Более слабый Сигнал GATA-4 присутствует в цитоплазме.
https://doi.org/10.1371/journal.pbio.0030087.g002
Рис. 3. Положительное окрашивание клеток CPS на кардиоспецифические белки
(A) GATA-4 в клетках CPS 7 дней.
(B) Окрашивание ядер с помощью DAPI.
(C) Наложение (A) и (B).
(D) Nkx-2.5 обнаружен в ядрах круглых бьющихся клеток на 21 день (зеленый).
(E) Некардиальные клетки (красные стрелки) не показывают ядерного окрашивания на Nkx-2.5.
(F) Наложение (D) и (E).
(G) Биение клеток через 28 дней культивирования дает положительное окрашивание для сердечного канала Са ++ L-типа.
(H) Коннексин 43 (зеленый) в кластере одноядерных бьющихся клеток на 21 день в культуре.
(I) Световая микрофотография Номарского (дифференциальный интерференционный контраст) кластера клеток на (H).
https://doi.org/10.1371/journal.pbio.0030087.g003
Sca-1 Разделение клеток Spoc
Дальнейшее фракционирование клеток Spoc путем сортировки по маркеру Sca-1 (антиген клеточной поверхности, обнаруженный на гемопоэтических стволовых клетках мыши [HSCs]) показывает, что бьющиеся клетки развиваются из пула Sca-1 —, который включает 20 % –40% от общего количества изолированных клеток. Это контрастирует с недавними исследованиями, в которых изолированная популяция Sca-1 + из сердца, направленная к сердцу после сосудистой инъекции, показала признаки сердечной дифференцировки [14,26].Когда полученная из скелетных мышц фракция Sca-1 + клеток Spoc высевается в наших условиях (см. «Материалы и методы») отдельно от фракции Sca-1 —, первые клетки быстро прикрепляются к пластине и с за исключением нескольких предположительно контаминирующих клеток Sca-1 –, которые не развиваются в бьющиеся клетки. После удаления популяции Sca-1 + оставшаяся популяция Sca-1 — подвергается дополнительным делениям перед началом дифференциации.Иногда небольшая круглая бьющаяся клетка без организованного саркомера видна через 3 дня, но примерно 80% от общей популяции клеток дифференцируются в бьющиеся клетки после 7-10-дневного периода пролиферации. Эти CPS-клетки, полученные из Sca-1 — , остаются в этом незрелом состоянии, то есть круглые, слабо прикрепленные и спонтанно бьющиеся, в течение более 2 месяцев культивирования. Когда популяция клеток CPS, помеченная зеленым флуоресцентным белком (GFP) Sca-1 —, переносится на немаркированный адгезивный монослой очищенных клеток Sca-1 + , флуоресцентные клетки Sca-1 — прикрепляются к монослой в течение 24 часов, растягиваются и созревают в бьющиеся клетки.Поскольку вытянутые клетки GFP + развивают саркомерную структуру, сигнал GFP уменьшается. Этот феномен, который, возможно, происходит из-за подавления GFP, управляемого промотором бета-актина, или из-за исключения белка GFP из развивающейся саркоплазмы, может поставить под угрозу обнаружение меченных GFP донорских клеток в модели инфаркта мыши.
Клетки Spoc не происходят из костного мозга или жировой ткани
КлеткиSpoc, по-видимому, не являются клетками костного мозга, секвестрированными в скелетных мышцах, и, поскольку они относятся к c-kit —, они отличаются от клеток костного мозга c-kit + и клеток побочной популяции, которые использовались напрямую. или косвенно в экспериментах по восстановлению инфаркта сердца [11,13].Когда приблизительно 50 мг цельного костного мозга или диссоциированного всего сердца совместно культивируют в отделенных проницаемой мембраной отделениях в соотношении 1: 1 с клетками Spoc, только клетки Spoc развиваются в бьющиеся кардиомиоциты. Таким образом, костный мозг и сердце не содержат популяции клеток, которые можно выделить таким образом и фенотипически сходны с клетками Spoc.
Мы также провели эксперименты, чтобы определить, похожи ли Spoc клетки на клетки сосудистой фракции стромы адипоцитов (SVF), которые были получены из смеси паховых и внутрилопаточных жировых подушечек мышей [19].Клетки Spoc культивировали параллельно с SVF в нашей среде, содержащей EGF / FGF, а также в методике с добавлением бета-меркаптоэтанола, эритропоэтина, интерлейкина (IL) -3, IL-6 и фактора стволовых клеток, как указано в [[ 19], за исключением того, что клетки пахового и внутрилопаточного происхождения держали отдельно друг от друга. В дополненной культуре метокульта клетки Spoc превратились в клетки CPS, которые впоследствии слились в большие (до 1 мм в длину) бьющиеся миоциты, как описано ранее [19]. Нам не удалось получить клетки CPS или какие-либо биологические клетки из SVF, полученных только из пахового жира.Результат, аналогичный культивированию клеток Spoc, наблюдался с SVF, полученным внутри лопаточного канала, культивировавшимся в дополненной методике, но только в культурах, которые имели микроскопическое загрязнение волокнами скелетных мышц. Ни SVF из паховой области, ни из внутрилопаточных жировых подушечек не давали никаких бьющихся клеток при культивировании в стандартных условиях для клеток EGF / FGF Spoc. Planat-Benard et al. [19] сообщают об эффективности преобразования в кардиомиоциты 0,02–0,07%, тогда как 1–10% от общего количества клеток Spoc становятся бьющимися кардиомиоцитами.Когда чистые клетки Sca-1 — Spoc высеваются, после фазы пролиферации примерно 80% клеток бьют CPS-клетки.
В отличие от случая с HSC, колониеобразующие единицы не образуются, когда клетки Spoc культивируются в метилцеллюлозе в присутствии эритропоэтина, IL-3, IL-6 и фактора стволовых клеток (данные не показаны). Чтобы оценить способность клеток Spoc восстанавливать костный мозг, были выполнены стандартные и конкурентные трансплантации костного мозга с клетками Spoc.У четырех мышей 3 × 10 6 клеток костного мозга и 3 × 10 4 GFP + / Sca-1 — клеток Spoc вводили каждой из смертельно облученных мышей. Все четыре мыши выжили; однако в периферической крови или костном мозге наблюдалась только редкая клетка, происходящая от донора GFP + (данные не показаны). Костный мозг шести смертельно облученных мышей, которым инъецировали 1,5 × 10 5 клеток Sca-1 — Spoc или 2 × 10 5 клеток Spoc, нефракционированных для Sca-1, не удалось спасти, и все шесть мышей погибли. в течение 2 нед.Таким образом, поскольку для восстановления костного мозга требуется только один HSC, в 2 × 10 5 Spoc клетках не содержится HSC.
Передача ЭМ клеток CPS по мере их продвижения к бьющимся клеткам
На рис. 4 показано развитие клеток CPS после репликации. Через три дня после повторного посева плавающих клеток (см. Материалы и методы), когда увеличивающееся количество клеток CPS показывает ритмическое биение, EM показывает круглые клетки с большими центральными ядрами, окруженными обильными митохондриями и толстыми миозиновыми нитями (рис. 4A и 4D).Когда клетки прикрепляются к пластине для культуры ткани, центральное ядро удлиняется, и становятся видны электронно-плотные структуры (рис. 4B; стрелка на рис. 4E), при этом миозиновые нити расходятся наружу (вставка / вставка, рис. 4B). К 2 неделям электронно-плотные тела начали выравниваться с нитями, курсирующими между ними (рис. 4C). Эти структуры почти идентичны тем, которые наблюдаются в развивающихся кардиомиоцитах, происходящих из эмбриоидных тел [27]. К 8 неделям культивирования электронно-плотные структуры в ЭМ бьющихся клеток развиваются и становятся Z-линиями организованных саркомеров (рис. 4G).Бьющиеся клетки также имеют одно или два больших ядра, расположенных в центре, окруженных митохондриями, что отличает их от мышечных трубок скелета, которые имеют множество мелких субсарколеммальных ядер.
Рис. 4. Трансмиссионные ЭМ показывают пострепликационную прогрессию клеток CPS
(A) Круглые, 3-й день клетки содержат неупорядоченные миозиновые нити. Некоторые из этих ячеек бьются, все еще плавая (см. Видео S1), и обычно имеют точки доступа, как показано на рисунке 6A.
(B) Верхний прямоугольник — это увеличенное изображение нижней панели, показывающее миозиновые нити характеристики 1.Длина 6 мкм, расходится наружу от плотного тела.
(C) Клетка на 14-й день с единственным центральным ядром показывает растяжение плотных тел в организующий саркомер.
(D) Круглые клетки на 3-й день, содержащие обильные митохондрии (вставка).
(E) Удлиненная клетка на 7-й день, содержащая плотное тело (наконечник стрелки).
(F) Безъядерная клетка на 14-й день, та же клетка, что и в (C).
(G) К 56-му дню присутствует четко выраженный саркомер с узнаваемыми полосами A и I, а также линиями M и Z.
(H) Саркомер кардиомиоцита плода показан для сравнения.
https://doi.org/10.1371/journal.pbio.0030087.g004
Переходные процессы кальция и потенциал сердечной деятельности в клетках CPS
По мере того, как клетки CPS прогрессируют до спонтанного биения кардиомиоцитов in vitro, частота биений колеблется от 1 до 8 Гц. Клетки продолжают биться даже после культивирования в течение 3 мес. Несмотря на отсутствие биений на начальном этапе, некоторые кластеры клеток, прикрепленных к внеклеточному матриксу, демонстрируют переходные процессы кальция, обнаруженные флуо-4 (концентрация 4 мкМ), визуализированные с помощью конфокальной микроскопии (видео S2).Это говорит о том, что возбуждающая часть «возбуждение-сокращение» развивается до того, как сократительный аппарат клетки станет достаточно зрелым, чтобы преодолеть минимальное сопротивление, обеспечиваемое внеклеточным матриксом. Круглые пульсирующие клетки, показанные на видео S1, переходят в эллиптические пульсирующие клетки, показанные на видео S3, а затем в более зрелые кардиомиоциты, показанные на видео S4. Эти последние клетки также отображают переходные процессы кальция, обнаруженные с помощью флуо-3 (концентрация 4 мкМ), как показано на видео S5 и на рисунке 5.К 14 дню после повторного высева 10% клеток в сливной чашке спонтанно взбиваются. Переходные процессы кальция указывают на существование потенциалов действия (AP), которые были охарактеризованы путем записи участков отдельных клеток в культуре (рис. 6). Различные сердечные AP наблюдаются в бьющихся и не бьющихся клетках (рис. 6A и 6B), которые оба показывают мембранный потенциал покоя приблизительно -60 мВ с сильным выбросом 50–90 мВ. Форма и продолжительность APs соответствуют описанию APs кардиомиоцитов взрослых мышей, у которых отсутствует фаза плато, наблюдаемая в кардиомиоцитах других видов [28].
Рис. 5. Измерение переходной частоты кальция
Графическое представление переходного процесса кальция в бьющихся кардиомиоцитах, полученных из CPS-клеток (A). Интенсивность флуоресценции пропорциональна количеству кальция, связывающегося с красителем флуо-3 при высвобождении кальция из саркоплазматического ретикулума. Показаны пиковая интенсивность (B) и базовая линия (C).
https://doi.org/10.1371/journal.pbio.0030087.g005
Рис. 6. Записи напряжения всей клетки от кардиомиоцитов, полученных из клеток Spoc
(A) Спонтанное срабатывание ПД в не бьющейся, каплевидной клетке.
(B) Типичный AP из записи в (A) в увеличенной шкале времени; Порог AP составляет –60 мВ.
(C) Возгорание потенциала действия в другой ячейке блокируется при перфузии ванны с 0,5 мМ хлоридом кадмия (горизонтальная полоса).
(D) Демонстрируется ускорение активации AP при перфузии 25 нМ изопротеренола (горизонтальная полоса), что указывает на присутствие адренергических рецепторов на этих клетках.
(E) AP скелетных миотрубок, если они присутствуют, отличаются тем, что на их частоту не влияет Cd ++ .
(F) Изопротеренол также не влияет на частоту АД скелетных мышц.
https://doi.org/10.1371/journal.pbio.0030087.g006
Биение кардиомиоцитов, полученных из клеток Spoc, отличается от спорадических подергиваний, которые наблюдались в скелетных мышцах, потому что добавление 0,5 мМ хлорида кадмия, не -специфический блокатор каналов Ca ++ и Na + L-типа, устраняет сердечный AP [29,30], не оказывая при этом никакого эффекта на скелетные миотрубки (рис. 6C и 6E) [31,32].Точно так же как бьющиеся, так и не бьющиеся клетки сердца имеют интактный адренергический путь [33,34,35], что показано увеличением частоты АД при добавлении 25 нМ изопротеренола (рис. 6D). Ожидаемое отсутствие эффекта на скелетные мышечные трубки [36] показано на рисунке 6F. Одноядерные миобласты со спонтанными переходными процессами кальция и AP в стандартных условиях культивирования не описаны [37], и даже когда они созданы путем остановки слияния клеток, они сохраняют электрическую активность, характерную для клеток скелетных мышц, такую как отсутствие ответа на кадмий. хлорид [38].
Трансплантация клеток Spoc в модели инфаркта миокарда у мышей
Чтобы определить, приживаются ли клетки Spoc в инфаркте миокарда (MI) и дифференцируются в зрелые кардиомиоциты, была создана модель острого инфаркта у мышей C57Bl / 6J путем перевязки левой коронарной артерии. Мы вводили 1 × 10 5 GFP + общих клеток Spoc (нефракционированных для Sca-1) в периферическое кровообращение. Через 14 недель многие клетки GFP + , полученные от донора, прижились (фигура 7B).Из донорских клеток, которые мигрировали в инфаркт, 8% (63/782) превратились в кардиомиоциты (стрелки, рис. 7A), демонстрирующие фосфорилированную регуляторную легкую цепь сердечного миозина (RLCP), что показано совместным мечением с антителом против GFP ( зеленый) и RLCP (красный) [39]. Все образцы сканировались одновременно по зеленому и красному каналам. Клетки считались GFP + только в том случае, если их цитоплазма светилась зеленым, а не красным светом. Это предотвращает ошибочное принятие сигнала анти-GFP (зеленый) на рисунке 7A за автофлуоресценцию.Автофлуоресценция при инфаркте будет характерно «кровоточить» как по зеленому, так и по красному каналам в отсутствие экзогенных флуоресцентных маркеров, в результате чего вся аутофлуоресценция проявляется как обобщенный желтый цвет, то есть комбинация красного и зеленого [40]. В этом случае только миозиновые полосы, которые окрашиваются совместно, выглядят как красными, так и зелеными, что служит внутренним контролем техники. Никаких меченых клеток, дифференцированных или недифференцированных, не наблюдали в нормальной части инфаркта сердца (данные не показаны).Эти данные свидетельствуют о том, что клетки Spoc либо активно обитают, либо пассивно доставляются в область повреждения сердца, где они начинают дифференцироваться в кардиомиоциты, как это наблюдается in vitro. Чтобы определить, приживаются ли и дифференцируются ли клетки Spoc Sca-1 — внутри ИМ так же эффективно, как клетки Spoc, нефракционированные для Sca-1, использовали ту же модель острого переднего ИМ, описанную ранее. Когда 1 × 10 5 Sca-1 — / GFP + донорских клеток вводили через хвостовую вену сразу после инфаркта, наблюдался низкий уровень приживления, и только случайные кардиомиоциты донорского происхождения обнаруживались на периферии зона инфаркта (рис. 7C – 7E).Этот результат согласуется с нашими данными in vitro, описанными ранее, в которых очищенные клетки Sca-1 — оставались незрелыми, неплотно прикрепленными, круглыми клетками в течение нескольких месяцев до совместного культивирования с фидерным слоем неподвижных клеток Sca-1 + . позволили фракции Sca-1 — прилипнуть и созреть.
Рис. 7. Исследования трансплантации инфаркта миокарда in vivo
(A) GFP-меченные клетки Spoc (зеленые), нефракционированные для Sca-1, введенные в периферическую кровь модели острого инфаркта на мышах, развились через 14 недель в кардиомиоцитах ( стрелки) в области инфаркта.Кардиомиоциты GFP, полученные из донорских клеток Spoc, характеризуются единичными центральными ядрами и полосами, окрашенными на RLCP (красный).
(B) Продольный срез свежезамороженной ткани, показывающий область инфаркта, из которой была взята (A) (оранжевая рамка), и прилегающая нормальная эндогенная ткань сердца (RLCP, красный).
(C) GFP + / Sca-1 — Клетки Spoc вводили в периферический кровоток модели острого инфаркта миокарда мышей и выявляли в инфаркте через 4 недели по экспрессии GFP (зеленый).
(D) RLCP (красный) также выражен.
(E) Наложение (C) и (D).
https://doi.org/10.1371/journal.pbio.0030087.g007
Для оценки аналогичного эффекта при более старом инфаркте такое же количество клеток Spoc, нефракционированных для Sca-1, вводили через хвостовую вену в две мыши (через 8 и 14 недель после ИМ). Через две недели после инъекции в сердце модели инфаркта 8-недельной давности обнаружена совместная локализация GFP и GATA-4 в 3% (4/136) донорских клеток, которые мигрировали в периферическую область инфаркта.Через пять недель после инъекции в модель инфаркта возрастом 14 недель было очевидно повышенное количество клеток GFP + / RLCP + (7/102 клеток, происходящих от донора) в области инфаркта (данные не показаны). Клетки Spoc, которые были частично дифференцированы путем культивирования в течение 7 дней, вводили в сердца и хвостовые вены трех мышей с острым инфарктом. Меченые клетки не были идентифицированы в сердцах через 7 дней и 1 месяц, по сравнению с двумя контрольными мышами, которым вводили физиологический раствор во время инфаркта (данные не показаны).Это говорит о том, что недифференцированные клетки легче активно возвращаются домой или пассивно доставляются к сердцу.
Мы использовали систему экспрессора Cre-рекомбиназы (Cre) / репортера бета-галактозидазы, чтобы исключить слияние донорских стволовых клеток с кардиомиоцитами хозяина как объяснение очевидной дифференцировки in vivo. В случае слияния Cre из донорских клеток будет вырезать флоксированный стоп-кодон, присутствующий в ДНК хозяина, и таким образом подавлять репрессию репортерного гена бета-галактозидазы. В течение нескольких часов после возникновения острого инфаркта путем хирургического лигирования левой коронарной артерии у мышей-репортеров R26Rh выполняли инъекцию в хвостовую вену 3 × 10 5 Cre + клеток Spoc от промотора EIIa / мыши-донора Cre.Донорские клетки Cre + видны в сердце уже через 2 дня после инфаркта (данные не показаны). К 7 дню можно обнаружить изолированные гнезда донорских клеток, которые не слились с клетками-хозяевами, о чем свидетельствует отсутствие окрашивания X-gal в клетках Cre + (Фигуры 8A – 8F). Также к 7 дню, GATA-4 коэкспрессируется с Cre в некоторых клетках этих кластеров (Figure 8G-8I). Для дальнейшего выделения и отслеживания донорских клеток Spoc была создана библиотека моноклональных антител путем инокуляции крыс живыми клетками Spoc путем инъекции в периферическое кровообращение.Библиотеку проверяли на способность обнаруживать поверхностные антигены на всех клетках Spoc. Одно из таких образованных антител (MSC 21) обнаруживает живые клетки Spoc в культуре и может использоваться для выделения положительной и отрицательной субпопуляции. Разделение MACS с использованием MSC 21 дает две популяции с подмножеством 21 + , содержащим клетки, которые развиваются в бьющиеся кардиомиоциты (видео S6). У мышей с инфарктом, донором Cre / репортером R26Rh, некоторые из инъецированных клеток Cre + совместно окрашиваются MSC 21, дополнительно подтверждая донорское происхождение этих трансплантированных клеток (фиг. 8J-8L).MSC 21 не обнаруживает клетки в нормальном контроле или в сердце с инфарктом (рис. 8M).
Рис. 8. Cre Expressor / Beta-Galactosidase Reporter Исследования инфаркта миокарда
(A) Гнезда клеток Cre + (зеленые) обнаруживаются через 1 неделю после инъекции в хвостовую вену в модели острого инфаркта.
(B) Изображение Номарского (A).
(C) Объединенное изображение (A) и (B). Кластеры расположены рядом с кровеносным сосудом (стрелка).
(D) Инфарктная ткань в контрольной модели инфаркта миокарда (хирургия инфаркта, но без инъекции донорских клеток), показывающая отсутствие окрашивания на Cre (без зеленого цвета) и ГАТА-4 (не красный).
(E) Контроль окрашивания X-gal сердца мыши ROSA.
(F) В последовательной серии срезов ткани срезы с нечетными номерами были иммуноокрашены на Cre, что дало результаты, показанные на (A). Эти два кластера клеток были видны на пяти секциях (секции 1, 3, 5, 7 и 9). Срезы с четными номерами (срезы 2, 4, 6 и 8) окрашивали на X-gal. Клеток X-gal + не обнаружено. Один слайд был иммуноокрашен, показывая присутствующие клетки Cre + . Затем это предметное стекло окрашивали на X-gal, и было обнаружено, что это X-gal –.Отсутствие окрашивания серийных срезов X-gal указывает на то, что через 1 неделю в инфаркте не произошло слияния донорских и хозяйских клеток.
(G) Кластер донорских клеток Cre + , обнаруженный в инфарктной сердечной ткани модели острого инфаркта возрастом 1 нед. Стрелками указаны клетки, которые также экспрессируют GATA-4, как показано на (H).
(В) GATA-4 (красный) в основном присутствует в некоторых ячейках на краю кластера. Стрелки указывают на клетки, которые также экспрессируют Cre, как показано на (G).
(I) Объединенное изображение, показывающее совместную локализацию (стрелки) Cre (зеленый) с GATA-4 (красный) в некоторых ячейках кластера Cre + ячеек.
(J – L) Совместное окрашивание донорских клеток анти-Cre антителом (зеленый) и MSC 21 (красный) проявляется через 7 дней в модели острого инфаркта.
(M) Отсутствует окрашивание MSC 21 (без красного цвета) в поврежденной ткани мышей, которые не получали инъекции клеток Spoc.
https://doi.org/10.1371/journal.pbio.0030087.g008
Заключительные замечания
Наше выделение и описание того, что мы называем клетками Spoc, изначально было для нас неожиданным, поскольку несколько простых вариаций в обычной методике культивирования клеток скелетных мышц дали новое открытие.Эти адаптации включали отказ от трипсина, замену FGF и EGF на обычно используемые комплексные добавки, такие как экстракт куриного эмбриона, и отказ от прилипших клеток при продолжении культивирования неприлипающих клеток. Наблюдение изолированных неприлипающих бьющихся клеток в культуре скелетных мышц, вероятно, наблюдалось ранее другими в ходе экспериментов с условиями культивирования скелетных мышц, но неофициально считалось некоторым вариантом примитивных клеток скелетных мышц и никогда тщательно не исследовалось.Насколько нам известно, этот отчет является первым случаем, когда фенотип этих клеток был методически изучен с помощью записей отдельных клеток, временных записей Ca ++ , ЭМ, продольной видеомикроскопии и иммуноокрашивания для обнаружения наличия скелетных тканей. и сердечные гистологические маркеры. Отсутствие маркеров скелетных и сателлитных клеток на фоне гистологических и физиологических свидетельств сердечного фенотипа подтверждает наш вывод о том, что эти клетки ближе к истинным сердечным миоцитам, чем к некоторым вариантам клеток скелетных мышц.Прием этих свежеизолированных клеток к поврежденному сердцу и их последующая дифференцировка в кардиальный фенотип in vivo, который соответствует экспериментам in vitro, является подтверждающим доказательством.
Недавно три независимые группы выделили популяцию стволовых клеток из сердца. В двух исследованиях стволовые клетки интенсивно культивировали [15,20] перед повторным введением непосредственно в сердце, тогда как в другом исследовании свежевыделенные клетки вводили в сосудистый кровоток [14].Beltrami et al. [15] не наблюдали биение клеток in vitro, тогда как клетки, выделенные Oh et al. [14] потребовалось лечение деметилирующим агентом 5-азацитидином для получения бьющихся клеток, аналогично лечению, которое ранее использовалось для генерации линий бьющихся клеток из стромальных клеток костного мозга [41]. Мессина и др. [20] использовали кардиотропин для обработки круглых клеток, высвобожденных из 3-недельной культуры эксплантатов, создавая сферу клеток, которые остаются примитивными и пролиферируют внутри, в то время как они дифференцируются в бьющиеся кардиомиоциты по краям.Они заметили, что эта модель роста напоминает нейросферы. Все три популяции, происходящие из сердца, по-видимому, отличаются друг от друга в отношении таких параметров, как наличие c-kit или способность бить in vitro; однако различные условия затрудняют прямое сравнение.
Клетки Spoc не появляются из сердечной ткани, выращенной параллельно со скелетными культурами. Однако свежевыделенные клетки Spoc наблюдаются в инфаркте сердца в течение 2 дней после их системной инъекции мышиной модели острого ИМ.В течение 7 дней после системной инъекции клетки Spoc образуют сферическое тело на границах инфаркта вблизи кровеносных сосудов. Сигнал Cre сильно присутствует в центре этих сфер, но ослабевает на границах, где Появляется сигнал GATA-4. Вероятно, это связано с подавлением промотора EIIa в дифференцирующихся клетках. Этот образец более пролиферативных клеток в центре и дифференцирующихся клеток на границах напоминает нейросферы или культуру in vitro стволовых клеток, полученных из сердца [20].К 3 мес. Гораздо больше клеток распределяется по пограничным областям инфаркта и может быть обнаружено с помощью антител к желудочковому RLCP.
Образец Окрашивание GATA-4 в ранних клетках Spoc особенно интересно своим необычным цитоплазматическим распределением, но переход к ядерному распределению после добавления бета-адренергического агониста изопротеренола в культуру клеток иллюстрирует специфичность окрашивания. Важность бета-адренергической стимуляции для процессов дифференцировки и гипертрофии сердечных миоцитов делает эти клетки особенно полезными для изучения регуляции Akt-GSK3 beta экспрессируемых ядром GATA-4 [25], а также его бета-адренергическое взаимодействие с кальциневриновым путем [24].
Хотя биение клеток in vitro сокращается асинхронно, локальные области конфлюэнтных пластинок, по-видимому, сокращаются с разной скоростью. Этот факт в сочетании с поздней экспрессией коннексина 43 in vitro (см. Рис. 3H) указывает на возможность скоординированного биения, что является требованием для эффективного сердечного сокращения. Хотя клетки Spoc кажутся более эффективными при возвращении к сердцу в модели острого инфаркта миокарда, их способность дифференцироваться in vivo на границе старого инфаркта может помочь исследованиям, сфокусированным на хронической сердечной недостаточности или дилатационной кардиомиопатии.Генерация кардиомиоцитов из клеток Spoc, полученных из трансгенных моделей, может быть важным инструментом в изучении сердечного развития, поскольку прогрессирование от недифференцированных клеток к зрелым кардиомиоцитам можно наблюдать in vitro.
Почему эти сердечные стволовые клетки секвестрируются в скелетных мышцах и почему клинически значимое их количество обычно не используется для спасения инфаркта сердца, остается загадкой. Возможно, дополнительные клетки или факторы, присутствующие в скелетных мышцах, подавляют сердечную дифференцировку клеток Spoc in situ или ингибируют миграцию.Конечно, клетки Spoc не дифференцируются в сердечные клетки, пока они находятся в скелетных мышцах. В соответствии с этим фракционирование клеток Spoc на основе Sca-1 значительно обогащает популяцию клеток во фракции Sca-1 —, которые in vitro становятся побивающими кардиомиоцитами; однако приживление этих клеток Sca-1 — в моделях MI кажется менее эффективным, чем приживление нефракционированных клеток Spoc. Это согласуется с повышенной величиной и кинетикой дифференцировки кардиомиоцитов, наблюдаемой, когда фракция Sca-1 — помещается на монослой фракции Sca-1 + .Таким образом, фракция Sca-1 + , вероятно, играет роль в эффективности приживления с помощью любого количества механизмов, включая миграцию, тропизм и захват. Остается определить, вносят ли трансплантаты Spoc-клеток вклад в выживаемость мышей или они электрически соединяются с эндогенными сердечными миоцитами. Однако есть свидетельства того, что клетки Spoc выживают более 3 месяцев после трансплантации, в течение которых они созревают в поперечно-полосатые кардиомиоциты.
Вклад авторов
SOW, TVG, SH, HT, MAR и NDE разработали и разработали эксперименты.SOW, TVG, SH, HT, DG, MAR, KT, ZXY и YHX проводили эксперименты. SOW, TVG, SH, HT, DG, KT, ZHY, YHX и NDE проанализировали данные. SOW и NDE написали статью.
[PDF] Скачать ОТДЕЛЕНИЕ ГИСТОЛОГИИ И МЕДИЦИНСКОЙ БИОЛОГИИ №
Скачать Скачать ОТДЕЛЕНИЕ ГИСТОЛОГИИ И МЕДИЦИНСКОЙ БИОЛОГИИ …
КАФЕДРА ГИСТОЛОГИИ И МЕДИЦИНСКОЙ БИОЛОГИИ ЛЕЧЕНИЯ И МЕДИЦИНСКИХ ПРОФИЛАКТИЧЕСКИХ ФАКУЛЬТЕТОВТема лекции: «Сердечно-сосудистая система» для студентов курса лечебно-профилактического и лечебного факультетов.
Ташкент 2012
Лекция: «Сердечно-сосудистая система» — 2 часа. Цель: создать целостное представление о структуре и функционировании всей сердечно-сосудистой системы на основе формирования знаний о некоторых ее органах. Базовый уровень знаний. Анатомия и физиология сердца. Понимание артериальной и венозной системы, малого и большого кровообращения. Роль и значение капилляров и сосудов разного калибра.
1. 2. 3. 4. 5.
Развитие знаний и навыков.После прочтения текста лекций студент должен знать: общий план конструкции стенового тела, особенности строения каждого органа по функциям, роль и значение каждого органа в живом организме, важность знаний о структурных и функциональных особенностях этого органа. сердечно-сосудистая система для практической медицины и смежных дисциплин. Микроциркуляторное русло. Микроциркуляторное русло — это сложный структурно-функциональный комплекс, анастомозирующий между собой сосуды, включающий артериолы, гемокапилляры, венулы, артериолы, венулярные анастомозы, лимфатические капилляры, рыхлую соединительную ткань, обеспечивает регуляцию кровотока, транскапиллярный обмен и дренажно-депонирующую функцию, регулируют местную гомеостаз и оптимальная деятельность структурно-функциональной единицы организма.Кровеносные сосуды Артериолы — это мельчайшие (D-50 100 мм) сосуды мышечного типа, соединяющие артерии и капилляры. Так как в артериях есть три оболочки: 1) внутренняя, 2) высокая, 3) внешняя. 1. Внутренняя оболочка состоит из а) эндотелиальных клеток базальной мембраны б) субэндотелиального слоя) тонкой внутренней эластической мембраны. 2. Среда оболочки образована первым и вторым слоями гладкомышечных клеток, расположенных по спирали. По мере приближения гладкомышечные клетки капилляров располагаются индивидуально. 3.Наружная оболочка состоит из рыхлой волокнистой соединительной ткани. Капилляры — самые многочисленные и нежнейшие сосуды. Их диаметр варьируется от 4,5 до 20-30 мкм. В стенке капилляров различают и внутренний эндотелий, и б) наружный — базальную мембрану эндотелия с заключенными в нее перицитами. Наружная оболочка адвентиции очень тонкая и без границ превращается в рыхлый соединительнотканный интерстиций. В зависимости от ультраструктуры эндотелиальных клеток и базальной мембраны различают три типа капилляров:
I.Соматические: они сплющивают эндотелиальные клетки, образуя связь между типом замка, тесным контактом, сосудом под давлением. Базальная мембрана сплошная, но полупроницаемая, толщиной 30-35 нм, тонкая. Первый тип встречается в капиллярах скелетных и сердечных мышц, легких, центральной нервной системы и других органов. II. Проникают: между эндотелиальными клетками, и в них есть фенестры, сплошная базальная мембрана. Эти капилляры находятся в кишечнике, почках, эндокринных органах.III. Перфорированные: трещины (поры) есть как между эндотелиальными клетками, так и в базальной мембране. Эти капилляры находятся в селезенке, костном мозге, лимфатическом узле и печени. Венулы. Различают три типа венул: 1) посткапиллярные 2) собирательные 3) мышечные. 1) имеют диаметр посткапилляров 8-30 мкм по структуре напоминают капилляры. 2) собирающие венулы (диаметром 30-50 мкм) имеют три мембраны (внутреннюю, среднюю, внешнюю). Внутренняя оболочка состоит из эндотелия и базальной мембраны, внутри которых образуется сплошной слой перицитов.Средняя оболочка имеет единичные гладкомышечные клетки. Наружная оболочка образована тонким слоем рыхлой волокнистой соединительной ткани. 3) мышечные венулы большего диаметра также трехслойные. В середине оболочки гладкомышечные клетки образуют один — два твердых слоя. Артериоловенулярные анастомозы (АВА). Это анастомоз, при котором артериальная кровь из артериол отводится в венулы. Диаметр АВА составлял от 30 до 500 мм, длина до 4 мм. Выделяют две группы АБК: 1) истинные, которые выделяют чистую артериальную кровь, 2) атипичные, несущие смешанную кровь.Первая группа АБА делится на две подгруппы: а) простые, б) оснащенные особыми сократительными структурами. При простой истинной АВА артериола переходит в венулы, теряя в середине оболочки гладкомышечные клетки. Во второй суб-АВА имеется специальный сократительный блок в виде валиков или подушек в подендотелиальном слое. Они образованы гладкомышечными клетками. К ним также относят эпителиоидный тип АВА (простой и непрерывный). Простой эпителиоидный тип АВА характеризуется наличием в середине оболочки внутреннего продольного и наружного кольцевого слоев гладкой мускулатуры.АБК солидного эпителиоидного типа характеризуются разделением входных артериол на 2-4 ветви, которые открываются отдельно в венозный отдел. Второй тип АБК — это атипичные (полушунты), соединяющие артериолы и венулы, по которым кровь течет по короткому, но широкому (30 мм) капилляру. Вена: Классификация
1. амиозный (волокнистый) тип. 2. Тип мышц, разделенных на 3 типа: а) с низким б) средним в) с сильным развитием мышечных элементов. К венам типа I относятся вены с твердой и мягкой оболочкой, сетчатка, кость, селезенка и плацента.Стенка вены состоит из двух слоев: 1) эндотелия, который располагается на базальной мембране; 2) тонкий слой рыхлой волокнистой соединительной ткани без границ, переходящий в окружающую соединительную ткань. Венский мускулистый тип. Как и в артериях, в стенке вены мышечного типа различают 3 оболочки. По наличию гладкомышечных клеток различают их количество и расположение вен: 1 — со слабым, 2 — средним, 3 — сильным развитием мышечных элементов.1. Вена со слабым развитием мускулов, обычно мелких и средних (1-2 мм), сопутствующая артерия мышечного типа в верхней части туловища, шеи и лица, верхних конечностей. Они также включают крупную вену, такую как верхняя полая вена. В этих венах во внутренней оболочке и различают) эндотелий, расположенный на базальной мембране, и б) тонкий подендотелиальный слой, в середине оболочки содержится небольшое количество циркулярно расположенных гладкомышечных клеток, внешняя оболочка состоит из рыхлая фиброзная ткань.2. Вены со вторичным развитием гладкой мускулатуры (плечевая вена) характеризуются круговым расположением гладких мышц в середине оболочки, наружная оболочка толще средней и состоит из рыхлой волокнистой соединительной ткани и продольных пучков гладких мышц. 3. Вены с сильным развитием мышечных элементов (крупные вены нижних конечностей — бедренная вена; нижняя часть тела — нижняя полая вена), характеризующиеся развитием гладкомышечных пучков во всех трех оболочках.Во внутренней и внешней оболочках они продольные, в средней — круговое направление. В этих венах внутренняя оболочка выступает в просвет и в результате у нее имеются дублирующие клапаны, обеспечивающие ток венозной крови от нижних конечностей к сердцу. Лимфатические сосуды. Функционально лимфатические сосуды тесно связаны с кровью, особенно в области микрососудов. Классификация: Различают: 1 — лимфатические капилляры, 2 — внутри- и внеорганические лимфатические сосуды, 3 — грудной лимфатический проток, впадающий в крупные вены шеи.1 — лимфатические капилляры; Начальные отделы лимфатической системы — это выходящие из межклеточного пространства межклеточная межклеточная жидкость, содержащая продукты обмена, фрагменты мертвых клеток, инородные частицы, бактерии, раковые клетки, хиломикроны жира. Их диаметр в несколько
раз больше кровеносных капилляров, стенка состоит из крупных эндотелиальных клеток, базальная мембрана и перициты не обнаруживаются. Щелевидные промежутки между эндотелиальными клетками постоянно меняются, обеспечивая оптимальный дренаж межклеточного пространства, гемолимфатический баланс.2. Вентиляционные отверстия из лимфатических сосудов. В зависимости от диаметра делятся на малые, средние и большие. Мелкие, диаметром 30-40 мм, в основном внутриорганные, состоят из эндотелиальной и соединительнотканной оболочки. Средние и крупные лимфатические сосуды (диаметр 0,2 мм) четко различимы: 1 — внутренний, 2 — умеренный, 3 — наружная оболочка. 1. Внутренняя оболочка состоит из а) эндотелия б) где пучки продольно и наклонно направлены коллагеновые и эластические волокна. Дубликат образует внутреннюю облицовку клапанов.Участок лимфатического сосуда между двумя клапанами, называемый лимфангионом. Внутри клапана соединительной пластинки могут быть пучки гладкой мускулатуры. 2. Среда оболочки слабо развита в сосудах верхней половины тела; выражено четко — в сосудах нижней конечности. Различают круглые и косые пучки гладкой мускулатуры. 3. Наружная оболочка состоит из рыхлой волокнистой соединительной ткани. 3. Большой лимфатический сосуд. Грудной лимфатический проток имеет три четко очерченных оболочки. I внутренняя оболочка образована а) эндотелием, б) подендотелием, в) внутренней эластической мембраной.Дупликатура образует внутреннюю облицовку створок. II Средняя оболочка имеет круговой и косой пучки гладкой мускулатуры, окруженные эластичными волокнами. III Наружная оболочка в 3-4 раза толще других оболочек, содержит мощные продольные пучки гладких мышц. СЕРДЦЕ. Полый мышечный орган, обеспечивает непрерывное кровообращение по большому и малому кругу кровообращения. Имеет 3 оболочки: 1 — внутри — эндокард; 2 — средний — миокард; 3 — наружный — эпикард 1.Эндокард — выстилает относительно тонкий слой всех клеток, а также сосочковых мышц, сухожильных нитей, клапанов. Эндокард состоит из 4-х отделов: 1) эндотелий, непосредственно взаимодействующий с циркулирующей кровью, эндотелиальные клетки большие, многоугольной формы, расположены на базальной мембране, и 2) субэндотелиальный слой, состоящий из плохо дифференцированных клеток соединительной ткани, гладкомышечных и эластичных пучков. волокна; 3) мышца — эластичный слой, который по-разному развит в предсердиях и желудочках сердца и состоит из сложного взаимодействия гладких мышечных и эластических волокон; 4) соединительно-тканый слой на границе миокарда, образован пучками эластичных, коллагеновых и ретикулярных волокон, содержит многочисленные кровеносные сосуды.
Клапаны сердца — производные эндокарда. Это тонкая пластинка из плотной волокнистой соединительной ткани, выстланной эндотелием. 2. Миокард — наиболее развитый слой сердца, образованный типичными (чаще всего) и атипичными поперечно-полосатыми мышечными волокнами. Типичные кардиомиоциты — обеспечивают ритмичное сокращение, атипичные — закономерное возникновение и автоматическое возбуждение. Типичные мышечные волокна образуются сократительными кардиомиоцитами. Они имеют цилиндрическую форму (d = 17-20 мм) длиной 100 мкм, на концах образуют 3.2 отростка, анастомозируя по ходу с соседними кардиомиоцитами. В результате все кардиомиоциты под действием возбуждения сокращаются одновременно в предсердиях или желудочках за считанные секунды. Изолированного уменьшения кардиомиоцитов обычно не происходит. В зоне взаимодействия соседней сарколеммы миокарда образуется характерная вставочная пластинка. Они расположены поперек мышечных волокон. Ультраструктурные вставочные пластины имеют зигзагообразную форму (как ступеньки), где сарколемма вместе образуют контакт, состоящий из нексуса, пересечений и десмосом.К вставочного диска подошли и вплели их в миофибриллы и мембраны эндоплазматического ретикулума. Поверхность покрыта базальной мембраной кардиомиоцитов, которые сотканы на внешней стороне коллагеновых и ретикулярных волокон. Ядро кардиомиоцитов (одна чашка, реже две) располагается в центральной части клетки. На полюсах ядра мало органелл, за исключением агранулярной эндоплазматической сети и митохондрий. Миофибриллы, которые уменьшаются, упорядочены по структуре, подобной простым волокнам скелетных мышц.Митохондрии с плотно упакованными кристами расположены между пучками миофибрилл. Цитолемма на Z-линиях, перпендикулярных длине кардиомиоцитов, образует инвагинацию, называемую Т-канальцем. Мембраны Т-канальцев контактируют с мембранами гладкой эндоплазматической сети и регулируют количество кальция в цитоплазме. Между миофибриллами много миоглобина, а гликогена и липидов — умеренное количество. Напротив, сократимость кардиомиоцитов, описанная в миоцитах предсердий, имеет меньшую дендритную форму.В этих меньших миофибриллах, митохондриях. В них относительно хорошо развита гранулярная эндоплазматическая сеть, комплекс Гольджи, высокая активность ферментов, метаболизирующих гликоген. Также в цитоплазме миоцитов обнаруживаются специфические секреторные гранулы предсердий, содержащие натрийуретический гормон — атриопептин, поражающий почки, собирательные трубки, клетки клубочковой зоны надпочечников. Система сердечной проводимости. В его состав входят: 1. Сино-предсердный (синусовый) узел: 2. Предсердно-желудочковый узел: 3. Предсердно-желудочковый пучок (блокада ножек пучка Гиса):
4.Волокна Пуркинье — блоки ветвящихся ветвей пучка Гиса, которые передают импульсы сократительным кардиомиоцитам в желудочках. В различных частях системы различают три типа атипичных кардиомиоцитов, которые находятся в различном соотношении. I тип — пейсмекерные (П) клетки, расположенные в центральной части синусового узла. Они способны к самопроизвольным сокращениям, имеют небольшие размеры, многоугольную форму, миофибриллы мелкие, неправильно расположены. Митохондрии мелкие, ретикулум слабо развит, Т — система отсутствует.Тип II — переходные клетки встречаются в АВ узле, тонкие удлиненные клетки, миофибриллы больше, но нет поперечной исчерченности. Т — система практически отсутствует. Тип III — клетки в пучке волокон Гиса и Пуркинье. Отличаются более крупными размерами, практически полным отсутствием Т — системы беспорядочного расположения тонких миофибрилл, в них много гликогена. 3. Эпикард и перикард. Эпикард — висцеральный отрезок перикарда, образован тонкой соединительнотканной пластинкой, плотно срастающейся с миокардом.Он различает слои коллагеновых, эластических, коллагеновых и коллагеновых — эластических волокон. Свободная поверхность покрыта одним слоем уплощенных мезотелиальных клеток. Перикард — это соединительный каркас, развитый, чем в эпикарде, богатый эластическими волокнами. Его поверхность также покрыта мезотелием. Вопросы для домашнего задания. 1. Орган с капиллярами. 2. Функциональное значение микрососудов. 3. Развитие сердца.

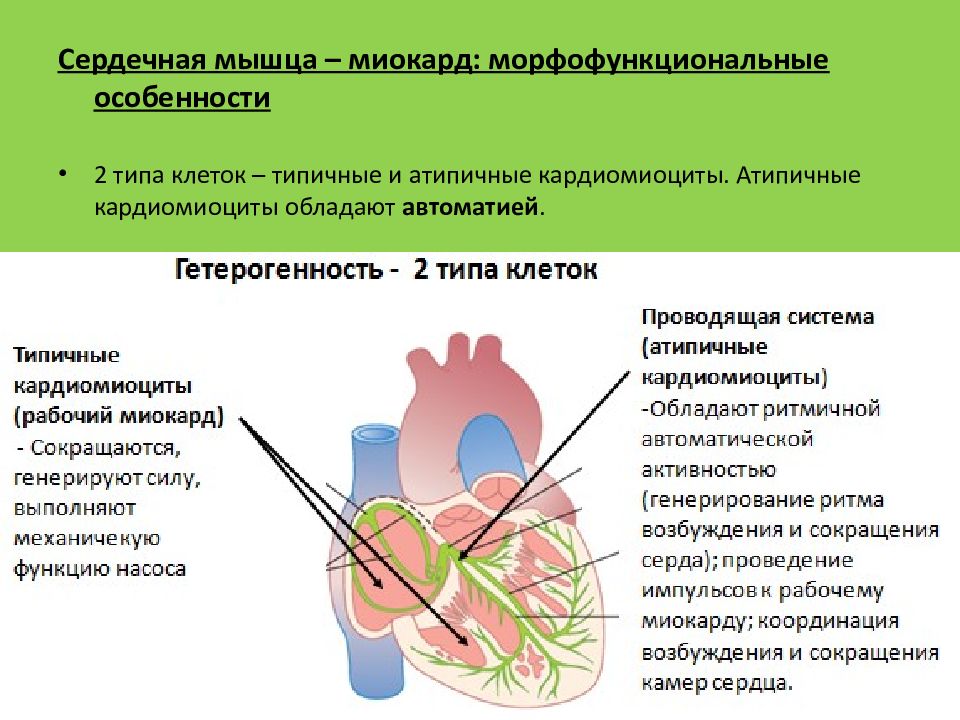
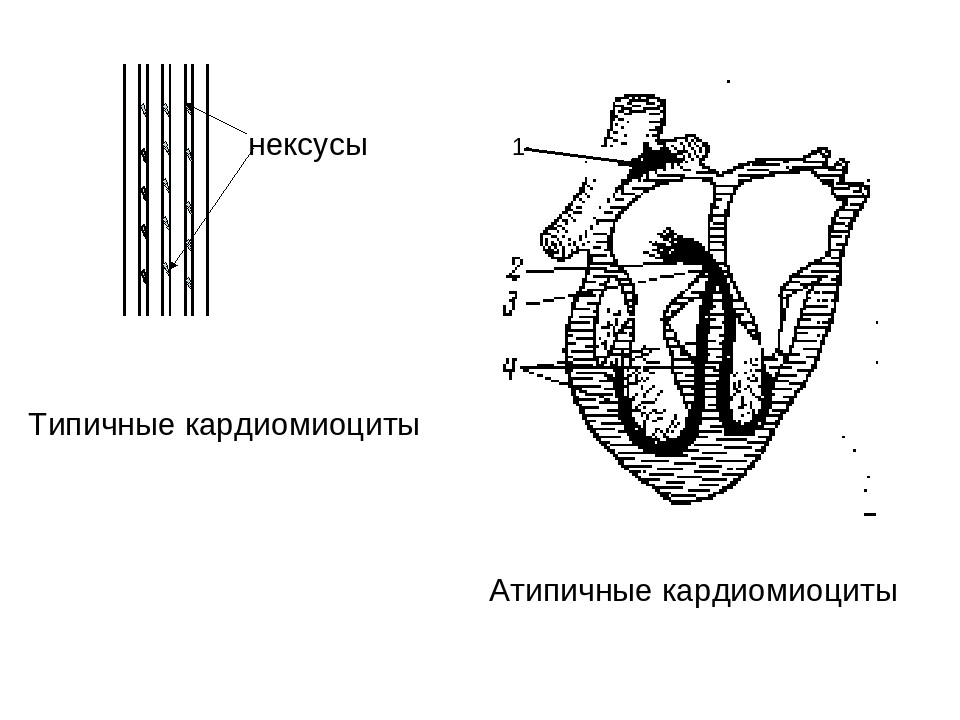
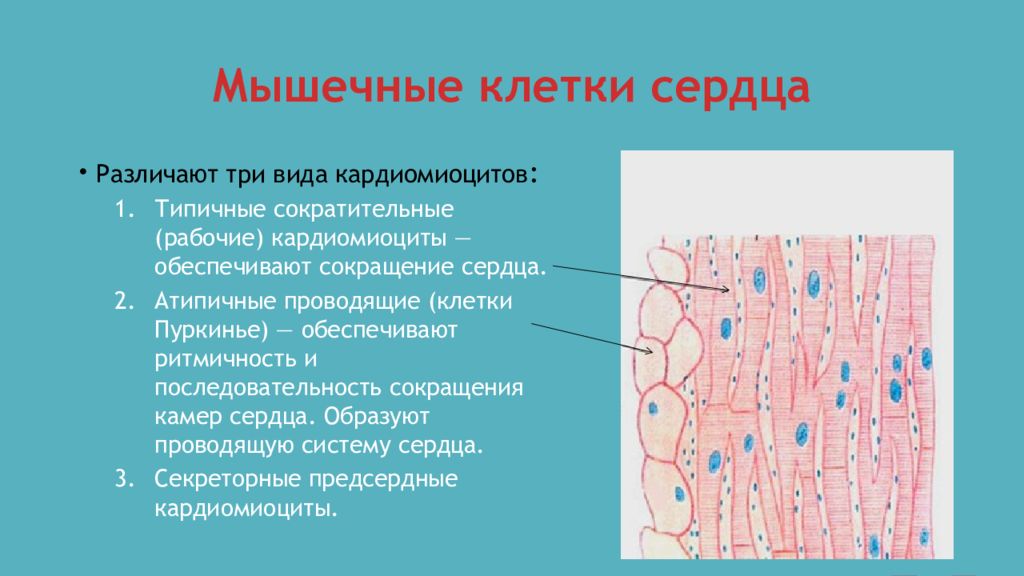
 д.)
д.) В данном случае симптомы инфаркта могут напоминать симптомы острого панкреатита.
В данном случае симптомы инфаркта могут напоминать симптомы острого панкреатита.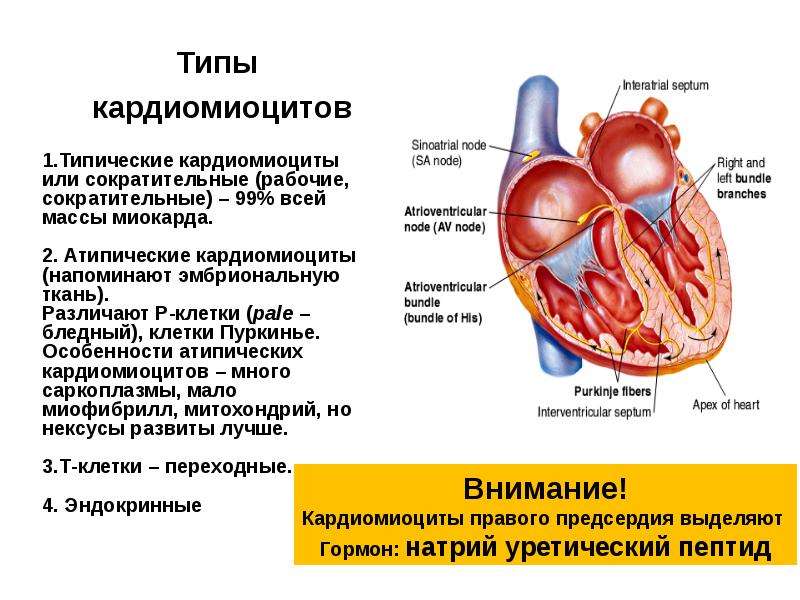
 Рекомендуется положение сидя, желательно на кресле со спинкой, или полулёжа с согнутыми коленями. Тугую мешающую одежду расстёгивают, ослабляют галстук[15].
Рекомендуется положение сидя, желательно на кресле со спинкой, или полулёжа с согнутыми коленями. Тугую мешающую одежду расстёгивают, ослабляют галстук[15]. Важно разжевать таблетки, иначе аспирин не подействует достаточно быстро[15][17].
Важно разжевать таблетки, иначе аспирин не подействует достаточно быстро[15][17].