Какой кровеносный сосуд имеет стенку из одного слоя клеток: Строение сердечно-сосудистой и лимфатической системы | Руководство по кардиологии
Искусственный кровеносный сосуд
ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к искусственным кровеносным сосудам, способным сохранять свои механические свойства и редко подвергаться закупорке тромбами при пересадке в кровеносный сосуд малого диаметра.
УРОВЕНЬ ТЕХНИКИ
[0002]
Искусственные кровеносные сосуды применяются в основном для замены патологически измененных участков кровеносных сосудов и создания обходных путей в системе кровообращения живых организмов. Следовательно, необходимо, чтобы искусственные кровеносные сосуды обладали высокой биосовместимостью с реципиентами, были нетоксичными и обладали аналогичными свойствами, медленно изнашивались, находясь в живых организмах, и, следовательно, были прочными, переносили небольшой объем утечки крови, обладали антитромбогенными свойствами, были не слишком дорогими и т.п.
[0003]
К искусственным кровеносным сосудам, относятся искусственные кровеносные сосуды, изготовленные из ткани, искусственные кровеносные сосуды, изготовленные из политетрафторэтилена, искусственные кровеносные сосуды, полученные из биоматериалов, искусственные кровеносные сосуды, изготовленные из синтетических полимерных материалов и гибридные искусственные кровеносные сосуды, применение тех или иных искусственных кровеносных сосудов зависит от цели использования.
[0004]
Долгосрочные клинические исследования в отношении искусственных кровеносных сосудов, изготовленных из тканей, показывают, что искусственные кровеносные сосуды, изготовленные из полиэфирных волокон, безопасны и имеют практическую пользу, до тех пор, пока искусственный кровеносный сосуд имеет средний или большой диаметр. Однако, в случае использования указанного искусственного кровеносного сосуда в качестве искусственного кровеносного сосуда, имеющего малый диаметр (внутренний диаметр: менее 6 мм), в искусственном кровеносном сосуде образуются тромбы, и искусственный кровеносный сосуд не способен длительное время оставаться проходимым, следовательно, практическая польза от использования искусственного кровеносного сосуда в качестве искусственного кровеносного сосуда для трансплантации все еще не достаточна.
[0005]
В целях предотвращения закупорки и обеспечения достаточной проходимости в искусственных кровеносных сосудах малого диаметра, была предложена методика формирования ворсинок и/или петлеобразных структур на внутренней поверхности стенки искусственного кровеносного сосуда (Патентный Документ 1), поскольку этот метод способен придавать антитромбогенные свойства искусственному кровеносному сосуду, то есть, обеспечивает быстрое формирование эндотелиальных клеток на внутренней поверхности стенки искусственного кровеносного сосуда.
ДОКУМЕНТ, ОПИСЫВАЮЩИЙ ПРЕДШЕСТВУЮЩЕЕ СОСТОЯНИЕ ТЕХНИКИ
ПАТЕНТНЫЙ ДОКУМЕНТ
[0006]
Патентный Документ 1: Japanese Patent Laid-open Publication No. 2005-124959
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, КОТОРЫЕ РЕШАЮТСЯ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
[0007]
При попытке применить технику, описанную в Патентном Документе 1, к искусственному кровеносному сосуду среднего или малого диаметра, оказывается, что указанная техника все еще недостаточно развита в отношении функций и свойств, необходимых для эффективной колонизации эндотелиальных клеток при трансплантации искусственного кровеносного сосуда в кровеносный сосуд среднего или малого диаметра.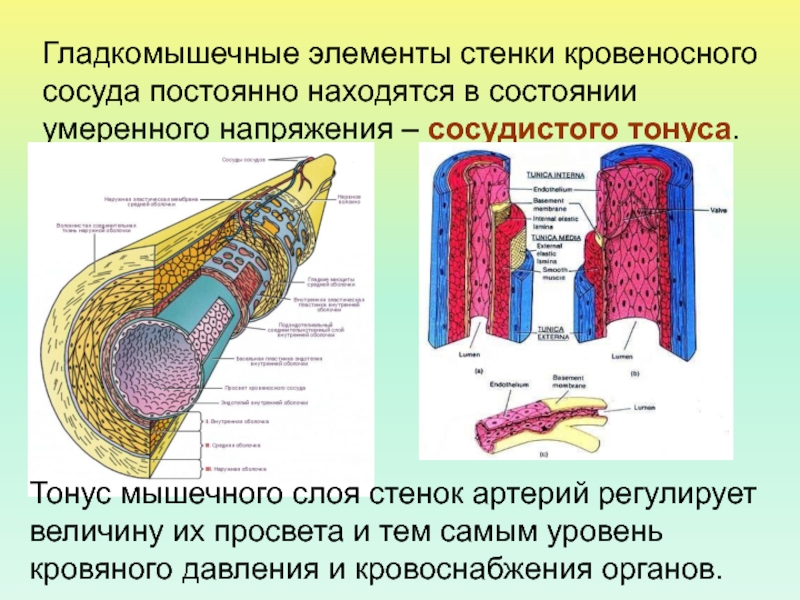
[0008]
В ситуациях, имеющих отношение к существующим искусственным кровеносным сосудам, настоящее изобретение решает задачу производства искусственного кровеносного сосуда, который способен сохранять необходимые для искусственного кровеносного сосуда механические свойства, который редко подвергается образованию тромбов и показывает высокий уровень адгезии при трансплантации искусственного кровеносного сосуда в кровеносный сосуд среднего или малого диаметра.
РЕШЕНИЕ ЗАДАЧ
[0009]
В процессе решения указанной задачи, авторами настоящего изобретения проведены обширные и тщательные исследования. В результате, авторы настоящего изобретения завершили настоящее изобретение. В данном описании раскрыты представленные ниже предпочтительные варианты осуществления изобретения.
(1) Искусственный кровеносный сосуд, представляющий собой трубчатую текстильную ткань, состоящую из по меньшей мере двух типов полиэфирных волокон, таких как комплексная нить A и комплексная нить B, и имеющую внутренний диаметр 8 мм или менее, толщину стенки от 50 мкм до 250 мкм, причем комплексная нить A имеет линейную плотность единичного волокна 1,0 дтекс или более и общую линейную плотность 33 дтекс или менее, комплексная нить B имеет линейную плотность единичного волокна 0,08 дтекс или менее и общую линейную плотность 66 дтекс или менее, при этом комплексная нить B образует петли на внутренней поверхности стенки трубчатой ткани.
[0010]
В данном описании раскрыты предпочтительные варианты осуществления изобретения, представленные ниже.
(2) Искусственный кровеносный сосуд как он описан выше, в котором число единичных волокон комплексной нити B, составляющей трубчатую ткань, составляет от 40% до 80% от числа единичных волокон, которые составляют трубчатую ткань.
(3) Искусственный кровеносный сосуд по любому описанному варианту, имеющий проницаемость для воды 500 мл/мин/см2 при приложении давлениия 120мм рт. ст. (16 кПа) или менее.
(4) Искусственный кровеносный сосуд по любому описанному варианту, в котором петли, образованные комплексной нитью B, существуют в рассеянном состоянии или нерегулярно переплетены.
(5) Искусственный кровеносный сосуд по любому описанному варианту, имеющий форму конструкции в виде гофрированной трубки.
(6) Искусственный кровеносный сосуд по любому описанному варианту, дополнительно содержащий антитромбогенный материал.
РЕЗУЛЬТАТЫ ИЗОБРЕТЕНИЯ
[0011]
Представленный в настоящем изобретении искусственный кровеносный сосуд имеет указанное выше строение, и, следовательно, становится возможным создать искусственный кровеносный сосуд, обладающий действием, описанным ниже, не подвергающийся образованию тромбов и, следовательно, не закупоривающийся, сохраняющий долговременную проходимость, пригодный для практического использования и имеющий средний или малый диаметр.
[0012]
В искусственном кровеносном сосуде, представленном настоящим изобретением, используется не менее двух типов полиэфирных волокон, таких как комплексная нить А, имеющая линейную плотность единичного волокна 1,0 дтекс и более и общую линейную плотность 33 дтекс или менее, и комплексная нить B, имеющая линейную плотность единичного волокна 0,08 дтекс или менее и общую линейную плотность 66 дтекс или менее, используемые в сочетании, что позволяет снизить износ прочности in vivo, вызываемый гидролизом.
[0013]
Когда число единичных волокон, составляющих комплексную нить B, в искусственном кровеносном сосуде, отрегулировано в пределах от 40% до 80% от числа единичных волокон, которые составляют трубчатую текстильную ткань, искусственный кровеносный сосуд обладает большей способностью к клеточной колонизации, в большей степени отвечает требованиям к свойствам сохранения прочности, имеет более удовлетворительную водопроницаемость, и, следовательно, может быть использован в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
Когда водопроницаемость искусственного кровеносного сосуда ограничена значением, находящимся в предпочтительном диапазоне, утечка крови из искусственного кровеносного сосуда может быть предотвращена более эффективно, и, следовательно, искусственный кровеносный сосуд можно использовать подходящим образом в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0015]
Когда петли в искусственном кровеносном сосуде находятся в рассеянном состоянии или нерегулярно переплетены, износ вследствие анастомоза происходит редко, и, следовательно, искусственный кровеносный сосуд, может быть использован в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0016]
Когда искусственный кровеносный сосуд имеет структуру гофрированной трубки, искусственный кровеносный сосуд обладает высокой устойчивостью формы. Таким образом, могут быть предотвращены закупорка и образование складок или перегибов в искусственном кровеносном сосуде, и, следовательно, искусственный кровеносный сосуд, может быть использован в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0017]
Когда искусственный кровеносный сосуд состоит из антитромбогенного материала, предотвращается образование тромбов, и, следовательно, искусственный кровеносный сосуд возможно использовать в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0018]
Искусственный кровеносный сосуд согласно настоящему изобретению представляет собой трубчатую текстильную ткань, состоящую из по меньшей мере двух видов полиэфирных волокон комплексной нити. Искусственный кровеносный сосуд, согласно настоящему изобретению, изготовлен по меньшей мере из: комплексной нити A, имеющей линейную плотность единичного волокна 1,0 дтекс или более и общую линейную плотность 33 дтекс или менее, и комплексной нити B, имеющей линейную плотность единичного волокна 0,08 дтекс или менее и общую линейную плотность 66 дтекс или менее.
[0019]
В качестве комплексной нити А, можно использовать нить, имеющую линейную плотность единичного волокна 1,0 дтекс или более и общую линейную плотность 33 дтекс или менее.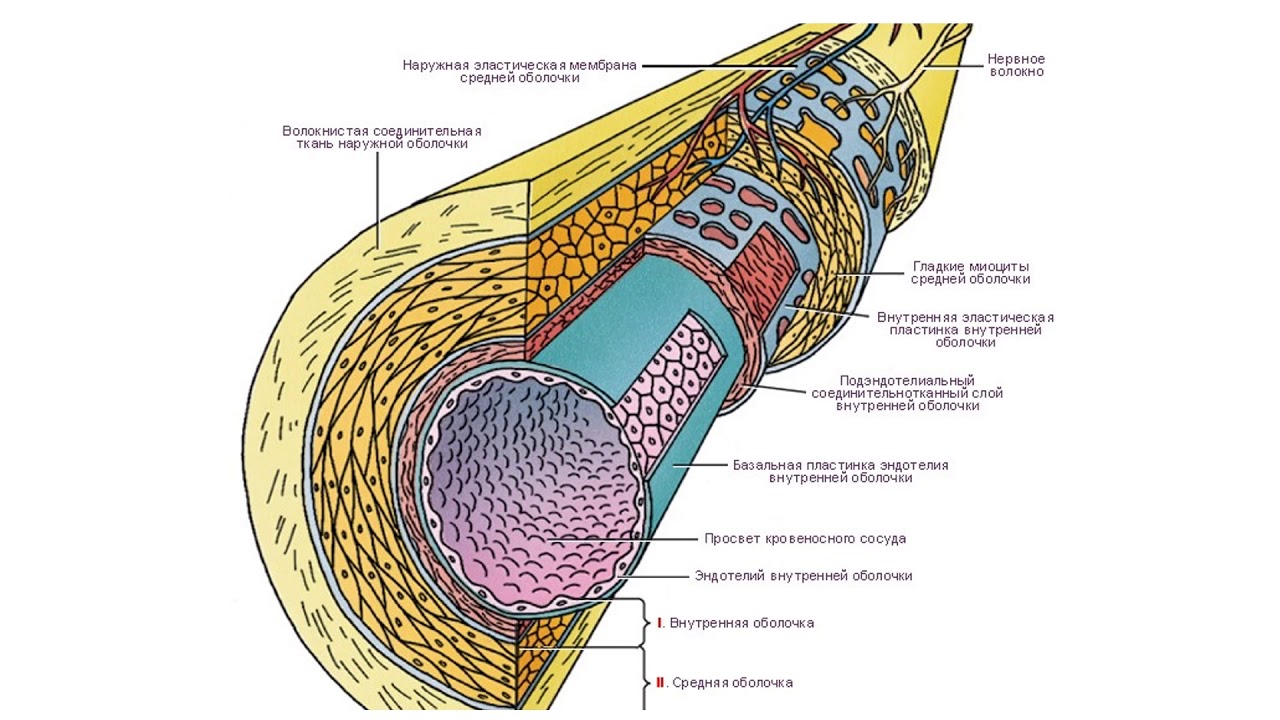 Каркас искусственного кровеносного сосуда сформирован волокнами, которые удовлетворяют вышеуказанным требованиям, и площадь поверхности в искусственном кровеносном сосуде, на которой в организме может происходить гидролиз, когда искусственный кровеносный сосуд помещен в тело реципиента на длительный период, может быть уменьшена. Таким образом решается проблема снижения прочности искусственного кровеносного сосуда.
Каркас искусственного кровеносного сосуда сформирован волокнами, которые удовлетворяют вышеуказанным требованиям, и площадь поверхности в искусственном кровеносном сосуде, на которой в организме может происходить гидролиз, когда искусственный кровеносный сосуд помещен в тело реципиента на длительный период, может быть уменьшена. Таким образом решается проблема снижения прочности искусственного кровеносного сосуда.
[0020]
Другими словами, если используется комплексная нить, состоящая из волокон, имеющих чрезмерно малую линейную плотность единичного волокна, площадь поверхности на суммарный объем волокон увеличивается, комплексная нить становится более восприимчива к гидролизу и, следовательно, сильно теряет в прочности, функция комплексной нити формировать каркас искусственных кровеносных сосудов, становится недостаточной. Если общая линейная плотность слишком велика, расстояние между волокнами чрезмерно увеличивается, водопроницаемость становится слишком высокой, и, следовательно, часто происходит утечка крови, при использовании комплексной нити в искусственном кровеносном сосуде. С точки зрения сохранения прочности и гибкости желательно, чтобы линейная плотность единичного волокна комплексной нити составляла 1,0 дтекс или более, предпочтительно находилась в диапазоне от 1,0 до 2,2 дтекс и общая линейная плотность составляла 33 дтекс или менее, предпочтительно находилась в диапазоне от 17 до 33 дтекс.
С точки зрения сохранения прочности и гибкости желательно, чтобы линейная плотность единичного волокна комплексной нити составляла 1,0 дтекс или более, предпочтительно находилась в диапазоне от 1,0 до 2,2 дтекс и общая линейная плотность составляла 33 дтекс или менее, предпочтительно находилась в диапазоне от 17 до 33 дтекс.
[0021]
В качестве комплексной нити B, используется комплексная нить, состоящая из волокон, имеющих линейную плотность единичного волокна не более 0,08 дтекс и общую линейную плотность не более 66 дтекс. Комплексная нить B формирует петли по крайней мере на внутренней поверхности стенки трубчатой ткани, таким образом, становится возможным придать поверхности конфигурацию, имеющую высокую способность к образованию колоний клеток, на внутренней поверхности стенки трубчатой ткани. В случае использования комплексной нити, состоящей из нитей, имеющих линейную плотность единичного волокна более 0,08 дтекс, расстояние между единичными волокнами имеет тенденцию увеличиваться, что приводит к снижению способности к образованию колоний клеток. В случае использования комплексной нити, имеющей слишком высокую общую линейную плотность, увеличивается толщина участка внутренней поверхности стенки, занятой петлями. В результате, возможно скопление вещества, способствующего образованию тромбов, например, фибрина, и, как следствие, повышение частоты образования тромбов. С точки зрения клеточной колонизации и способности к переплетению, необходима линейная плотность единичного волокна не более 0,08 дтекс, предпочтительно от 0,05 до 0,08 дтекс. С точки зрения антитромбогенных свойств, необходима общая линейная плотность не более 66 дтекс, предпочтительно от 44 до 66 дтекс.
В случае использования комплексной нити, имеющей слишком высокую общую линейную плотность, увеличивается толщина участка внутренней поверхности стенки, занятой петлями. В результате, возможно скопление вещества, способствующего образованию тромбов, например, фибрина, и, как следствие, повышение частоты образования тромбов. С точки зрения клеточной колонизации и способности к переплетению, необходима линейная плотность единичного волокна не более 0,08 дтекс, предпочтительно от 0,05 до 0,08 дтекс. С точки зрения антитромбогенных свойств, необходима общая линейная плотность не более 66 дтекс, предпочтительно от 44 до 66 дтекс.
[0022]
Трубчатая ткань может быть произведена, из комплексной нити А, и комплексной нити B, каждая из которых имеет линейную плотность единичного волокна и общую линейную плотность, указанную в настоящем изобретении. Альтернативно, трубчатая ткань также может быть произведена, используя комплексную нить A и комплексную нить, имеющую низкую линейную плотность единичного волокна и низкую общую линейную плотность, и может быть переработана в ультратонкое волокно, после чего полученная комплексная нить перерабатывается в ультратонкое волокно химическими или физическими средствами, с целью производства комплексной нити B, имеющей линейную плотность единичной нити и общую линейную плотность, указанную в настоящем изобретении. В настоящем изобретении выбор способа для производства ультратонких волокон не имеет конкретных ограничений. До настоящего времени ультратонкое волокно изготавливали по способу, использовавшемуся для изготовления ультратонкого волокна, обладавшего так называемой структурой «море-остров» или расщепленной структурой. В случае изготовления из структуры «море-остров», используют способ, согласно которому ультратонкие волокна служат «островами», а компонент «море» растворяется. Альтернативно можно также использовать способ, согласно которому волокна расщепляют по длине для изготовления ультратонких волокон. В этом случае полимер типа полиамида, полимер типа полиолефина, полистирол, растворимый полимер типа полиэфира и аналогичные материалы можно использовать, в качестве части «море» или расщепленной части (более подробное описание способов получения сверхтонких волокон, смотри, например, в документе (Okamoto M: Ultra-fine fiber and its application, Preprints Japan-China Bilated Symposium on Polymer Science and Technology, 256-262, Tokyo, October, 19.
В настоящем изобретении выбор способа для производства ультратонких волокон не имеет конкретных ограничений. До настоящего времени ультратонкое волокно изготавливали по способу, использовавшемуся для изготовления ультратонкого волокна, обладавшего так называемой структурой «море-остров» или расщепленной структурой. В случае изготовления из структуры «море-остров», используют способ, согласно которому ультратонкие волокна служат «островами», а компонент «море» растворяется. Альтернативно можно также использовать способ, согласно которому волокна расщепляют по длине для изготовления ультратонких волокон. В этом случае полимер типа полиамида, полимер типа полиолефина, полистирол, растворимый полимер типа полиэфира и аналогичные материалы можно использовать, в качестве части «море» или расщепленной части (более подробное описание способов получения сверхтонких волокон, смотри, например, в документе (Okamoto M: Ultra-fine fiber and its application, Preprints Japan-China Bilated Symposium on Polymer Science and Technology, 256-262, Tokyo, October, 19. ) При использовании подобных волокон, несмотря на сохранение подобными волокнами их первоначального диаметра, в процессе образования трубчатой ткани, эти волокна могут быть переработаны в ультратонкое волокно после образования трубчатой ткани, и, следовательно, возможность возникновения затруднений во время обработки, включая разрыв нити и образования ворса, может быть максимально снижена при плетении или при использовании любого из различных средств обработки нити перед плетением.
) При использовании подобных волокон, несмотря на сохранение подобными волокнами их первоначального диаметра, в процессе образования трубчатой ткани, эти волокна могут быть переработаны в ультратонкое волокно после образования трубчатой ткани, и, следовательно, возможность возникновения затруднений во время обработки, включая разрыв нити и образования ворса, может быть максимально снижена при плетении или при использовании любого из различных средств обработки нити перед плетением.
[0023]
В искусственном кровеносном сосуде, представленном в настоящем изобретении, в качестве волокон составляющих комплексную нить A и комплексную нить B используются полиэфирные волокна. К полиэфирным волокнам относятся волокна, произведенные из полиэтилентерефталата, волокна, произведенные из полибутилентерефталата и аналогичных материалов. Волокна, изготовленные из сополиэфира, производятся путем сополимеризации полиэтилентерефталата или полибутилентерефталата с такими кислотами, как изофталевая кислота, 5-сульфоизофталат натрия или алифатическая дикарбоновая кислота, также может быть использована, например, адипиновая кислота. В перечисленных выше волокнах, волокна, составляющие комплексную нить A и волокна составляющие комплексную нить В, предназначенные для комбинирования, могут быть одинаковыми или отличаться друг от друга, волокна могут быть скомбинированы подходящим образом.
В перечисленных выше волокнах, волокна, составляющие комплексную нить A и волокна составляющие комплексную нить В, предназначенные для комбинирования, могут быть одинаковыми или отличаться друг от друга, волокна могут быть скомбинированы подходящим образом.
[0024]
Искусственный кровеносный сосуд, представленный в настоящем изобретении, изготавливается из трубчатой ткани, комплексная нить B, формирует петли на внутренней поверхности стенки трубчатой ткани. Во-первых, основную нить, изготовленную из указанного материала и обладающую указанной выше линейной плотностью, наматывают на ткацкий навой и навой устанавливают на ткацком станке, после чего аналогичным способом подготавливают уточную нить. Для производства можно использовать гидравлический ткацкий станок, пневматический ткацкий станок, рапирный ткацкий станок, челночный станок и т.п. Из этих станков предпочтительно использовать челночный станок, на котором можно вырабатывать узкую трубчатую нить. В качестве структуры трубчатой ткани, состоящей из комплексных нитей A и B, можно использовать ткань, имеющую такие виды переплетения, как ткань полотняного переплетения, ткань саржевого переплетения, ткань сатинового переплетения, вариации тканей полотняного переплетения, тканей саржевого переплетения, тканей сатинового переплетения, или многослойный тканый материал. В случае выработки тканой структуры, в которой основная нить (или уточная нить) и множество уточных нитей (или основных нитей) не образуют вместе извитков, например, сатиновой тканой структуры, т.е. тканой структуры, в которой основная нить (или уточная нить) перекрещивается с множеством уточных нитей (или основных нитей), части (т.е. части, в которых нить перекрещивается с множеством нитей) отходят и имеют тенденцию ослабляться. Таким образом формируются петли. Следовательно, предпочтительно такое переплетение ткани, при котором возможно образование петель на внутренней поверхности стенки трубчатой ткани, произведенной из волокна B.
В случае выработки тканой структуры, в которой основная нить (или уточная нить) и множество уточных нитей (или основных нитей) не образуют вместе извитков, например, сатиновой тканой структуры, т.е. тканой структуры, в которой основная нить (или уточная нить) перекрещивается с множеством уточных нитей (или основных нитей), части (т.е. части, в которых нить перекрещивается с множеством нитей) отходят и имеют тенденцию ослабляться. Таким образом формируются петли. Следовательно, предпочтительно такое переплетение ткани, при котором возможно образование петель на внутренней поверхности стенки трубчатой ткани, произведенной из волокна B.
[0025]
Типичным способом, подлежащим использованию в качестве способа формирования петель, является, например, изготовление ворсовой ткани. Петли могут быть петлями, имеющими сатиновую структуру, или петлями, сформированными посредством объемообразующей обработки, или петлями, вырабатываемыми благодаря разнице в длине нити, вызванной посредством тепловой обработки или обработки химическим раствором. Также способами формирования петель может служить способ, использующий струи жидкости или газа под высоким давлением, например, струи воды, струи воздушного потока и аналогичные виды обработки.
Также способами формирования петель может служить способ, использующий струи жидкости или газа под высоким давлением, например, струи воды, струи воздушного потока и аналогичные виды обработки.
[0026]
В способе, в котором используют обработку ворсованием, например, используя ворсовальную машину, способ, согласно которому используют стригальную машину, или способ трения посредством воздействия наждачной бумагой, легко приводят к разрыву единичных волокон или образованию распушенных волокон.
[0027]
В искусственном кровеносном сосуде, представленном в настоящем изобретении, с целью достижения высоких анастомозирующих свойств, предпочтительно, чтобы петли находились в рассеянном состоянии и/или были нерегулярно переплетены. Выражение: «петли существуют в рассеянном состоянии» означает, что петли не сосредоточены на определенной области, а располагаются рассеянно, выражение: «петли нерегулярно переплетены» означает, что специфический рисунок расположения переплетающихся частей не повторяется регулярно, при этом части переплетения существуют в комплексных нитях неравномерно.
[0028]
Могут быть использованы различные способы, чтобы петли существовали в рассеянном состоянии или нерегулярно переплетались. Эффективным является способ, использующий струи жидкости высокого давления. Способ, использующий струи воды высокого давления, предпочтителен с точки зрения единообразия обработки, безопасности и обладает экономическими преимуществами.
[0029]
Комплексная нить A и комплексная нить B не ограничены в использовании их в качестве как основной, так и уточной нити и могут быть использованы должным образом. В искусственном кровеносном сосуде, представленном настоящим изобретением, с точки зрения обеспечения свойств нормальной клеточной колонизации и сохранения прочности, предпочтительно, чтобы процент единичных волокон, образующих комплексную нить В и единичных волокон, содержащихся в трубчатой ткани, составлял не менее 40%, предпочтительно не менее 50%. С позиции достижения достаточной прочности и достаточной водопроницаемости, необходимой для искусственного кровеносного сосуда, имеющего средний или малый диаметр, желательно, чтобы этот процент составлял не менее 80%, предпочтительно не более 70%.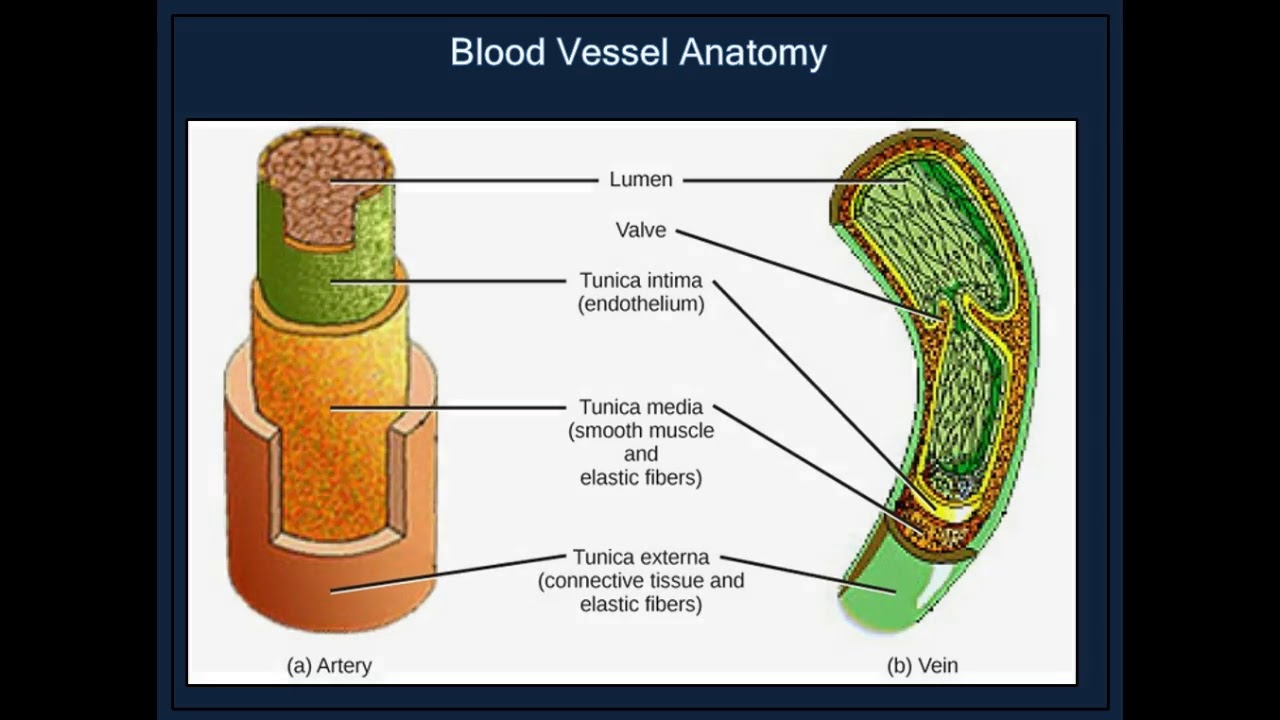
[0030]
С точки зрения свойств клеточной колонизации желательное соотношение числа волокон, составляющих комплексную нить A, с количеством волокон, составляющих комплексную нить B является таким, что соотношение числа волокон, образующих комплексную нить B составляет не менее 0,66, предпочтительно не менее 1, при том, что комплексная нить A состоит из единичного волокна. С точки зрения сохранения прочности и водопроницаемости, соотношение числа волокон В предпочтительно менее 6, предпочтительней менее 4.
[0031]
Ниже, описан способ регулировки соотношения единичных волокон, составляющих комплексную нить A, с количеством единичных волокон, составляющих комплексную нить B, до требуемого значения. Для регулирования доли основных нитей до требуемой величины, можно готовить навои основных нитей по системе двойных навоев, соответствующим образом используя комплексную нить А и комплексную нить В (или волокно, которое может обладать той же линейной плотностью, что и комплексная нить В, при переработке в ультратонкое волокно после ткачества), где каждое волокно обладает предварительно определенной линейной плотностью и предварительно определенной общей линейной плотностью волокна. Для регулирования доли уточных нитей до требуемой величины, можно готовить уточные нити соответственно, используя комплексную нить А и комплексную нить В (или волокно, которое может обладать той же линейной плотностью, что и комплексная нить В, при переработке в ультратонкое волокно после ткачества). В качестве способа ткачества, может быть использовано любое известное средство.
Для регулирования доли уточных нитей до требуемой величины, можно готовить уточные нити соответственно, используя комплексную нить А и комплексную нить В (или волокно, которое может обладать той же линейной плотностью, что и комплексная нить В, при переработке в ультратонкое волокно после ткачества). В качестве способа ткачества, может быть использовано любое известное средство.
[0032]
В искусственном кровеносном сосуде, представленном настоящим изобретением толщина стенки, составляющей трубчатую ткань, находится в диапазоне от 50 мкм до 250 мкм, с точки зрения водопроницаемости и гибкости, предпочтительно значение в диапазоне от 100 мкм до 200 мкм. При толщине стенки более 50 мкм достигается достаточная водопроницаемость и достаточная проницаемость для крови, необходимые для искусственного кровеносного сосуда, имеющего средний или малый диаметр. При толщине стенки менее 250 мкм, достигается достаточная гибкость, необходимая для искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0033]
Предпочтительно, чтобы искусственный кровеносный сосуд представленный настоящим изобретением имел водопроницаемость не более 500 мл/мин/см2 при приложении давления 120 мм рт.ст. (16 кПа). Это значение является предпочтительным, так как при таком значении эндотелиальные клетки и капиллярные сосуды способны легко проникать через отверстия между волокнами в искусственный кровеносный сосуд, и, следовательно, эндотелиальная ткань может быть легко сформирована. Желательно, чтобы водопроницаемость не превышала 400 мл/мин/см2 при приложении давления 120 мм рт.ст. (16 кПа), особенно предпочтительно, чтобы значение находилось в диапазоне от 300 до 200 мл/мин/см2 при приложении давления 120 мм рт.ст. (16 кПа). Водопроницаемость выражается количеством воды, способным просочиться между волокнами ткани размером в 1 см2 за минуту, при подаче к ткани давления 120 мм рт.ст. (16 кПа). Когда показатель водопроницаемость имеет слишком высокое значение, возможны частые утечки крови и возможны кровотечения, хотя в этом случае эндотелиальные клетки и капиллярные сосуды способны легко проникать в промежутки между волокнами.
[0034]
С целью приведения значения водопроницаемости в предел указанного выше диапазона, используется способ регулировки соотношения элементарных волокон комплексной нити А и комплексной нити B или может быть использован способ регулировки плотности плетения комплексных нитей. Другими словами, водопроницаемость трубчатой ткани в основном зависит от промежутков, образованных между комплексными нитями, и, следовательно, промежутки между комплексными нитями могут регулироваться, и трубчатая ткань с необходимой водопроницаемостью может быть изготовлена путем регулировки соотношения содержания комплексной нити A и комплексной нити B, или регулировкой плотности плетения комплексной нити.
[0035]
С целью достижения необходимых формоудерживающих свойств или предотвращения возникновения перегибов, предпочтительно, чтобы искусственный кровеносный сосуд, представленный настоящим изобретением, имел гофрированную структуру. Гофрированная структура может быть образована путем насаживания трубчатой ткани на резьбовой стержень, имеющий достаточно полированную поверхность, наматыванием нити на стержень по резьбе и затем, подвергая получающийся продукт термической обработке, без какой-либо дополнительной модификации, таким образом, термически формуя трубчатую ткань. Альтернативно, гофрированная структура может быть сформирована с помощью использования нити, обладающей высокой усадкой, в качестве уточной нити, и использованием эффекта, вызванного различием в усадочном соотношении нити.
Альтернативно, гофрированная структура может быть сформирована с помощью использования нити, обладающей высокой усадкой, в качестве уточной нити, и использованием эффекта, вызванного различием в усадочном соотношении нити.
[0036]
Искусственный кровеносный сосуд, представленный настоящим изобретением, предпочтительно должен состоять из антитромбогенного материала. Придание антитромбогенных свойств искусственному кровеносному сосуду может быть выполнено, например, путем нанесения на комплексную нить антикоагулянтного вещества, имеющего животное происхождение, такого как гепарин, гепарин с низким молекулярным весом, урокиназа и гирудин или нанесением на комплексную нить синтетического антикоагулянтного вещества или синтетического антитромбоцитарного вещества, такого как аргэтробэн, уорфэрин, ацетилсалициловая кислота и тиклопидин. Альтернативно, можно также использовать способ нанесения на комплексную нить гидрофильного полимера, такого как полиэтиленгликоль, поливиниловый спирт и поливинилпирролидон. Способ, который может быть использован для нанесения, не имеет конкретных ограничений. Например, можно упомянуть способ, заключающийся в покрытии поверхности комплексных нитей, раствором, содержащим вышеуказанное вещество или полимер. Также можно упомянуть способ, заключающийся в химическом введении реакционноспособных функциональных групп в вещество или полимер для закрепления вещества или полимера на поверхности комплексной нити посредством химической реакции, например, реакции конденсации. Также можно упомянуть способ, заключающийся в иммобилизации вещества или полимера посредством радикальной реакции, высокоэнергетическим излучением. Также можно упомянуть способ, заключающийся в пропитке коллагена, желатина, гидрогеля и аналогичных материалов веществом или полимером, и заполнении промежутков комплексной нити продуктом пропитки. В качестве способа прикрепления ионного соединения, такого как гепарин, можно упомянуть способ, заключающийся в образовании солей ионного соединения и противоиона и последующем покрытии поверхности комплексной пряжи солями.
Способ, который может быть использован для нанесения, не имеет конкретных ограничений. Например, можно упомянуть способ, заключающийся в покрытии поверхности комплексных нитей, раствором, содержащим вышеуказанное вещество или полимер. Также можно упомянуть способ, заключающийся в химическом введении реакционноспособных функциональных групп в вещество или полимер для закрепления вещества или полимера на поверхности комплексной нити посредством химической реакции, например, реакции конденсации. Также можно упомянуть способ, заключающийся в иммобилизации вещества или полимера посредством радикальной реакции, высокоэнергетическим излучением. Также можно упомянуть способ, заключающийся в пропитке коллагена, желатина, гидрогеля и аналогичных материалов веществом или полимером, и заполнении промежутков комплексной нити продуктом пропитки. В качестве способа прикрепления ионного соединения, такого как гепарин, можно упомянуть способ, заключающийся в образовании солей ионного соединения и противоиона и последующем покрытии поверхности комплексной пряжи солями.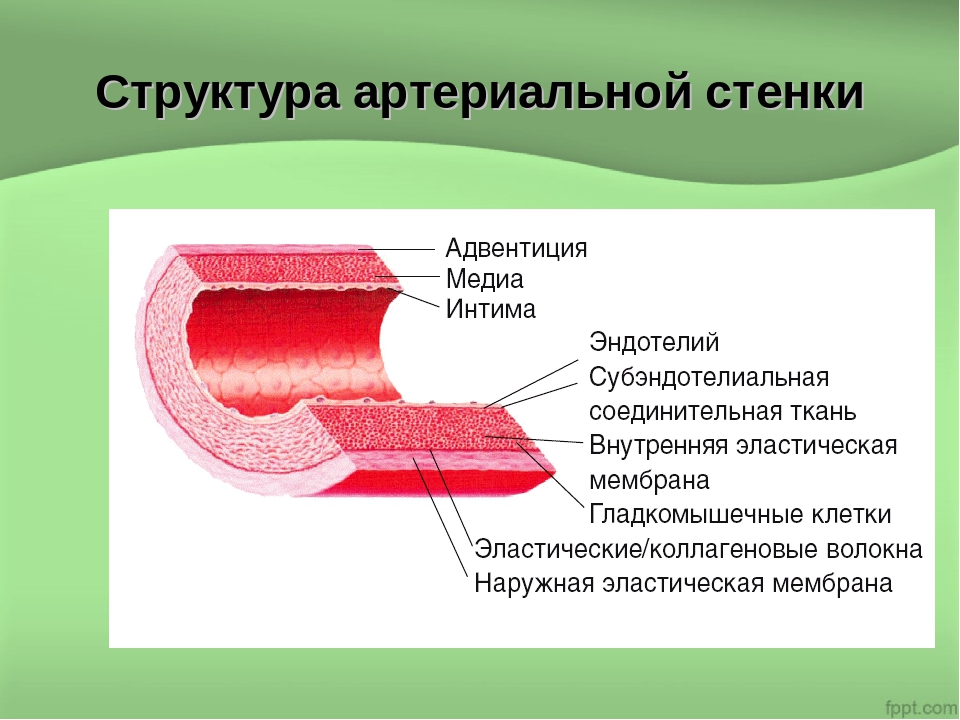 Также можно упомянуть способ, заключающийся в предварительном связывании противоиона на поверхности комплексной нити и последующим связывании ионного соединения с противоионом посредством ионной связи через ионную реакцию. Предпочтительно использовать способ, заключающийся в закреплении вещества или полимера на поверхности волокон, посредством химического введения реакционно-способной функциональной группы в вещество или полимер, или способ, заключающийся в предварительном связывании противоиона с поверхностью волокон, и последующим связывании ионного соединения с противоионом посредством ионной связи через ионную реакцию, поскольку эти способы способны придавать высокоактивные антитромбогенные свойства и способствуют сохранению стабильной и долгосрочной антитромбогенности. В случае, когда придание антитромбогенных свойств должно быть достигнуто любым из вышеуказанных способов, возможно допустить, чтобы вещество или полимер наносились на комплексную нить заранее. Тем не менее, с точки зрения производственных затрат, предпочтительней производить трубчатую ткань, а затем наносить вещество или полимер на нее.
Также можно упомянуть способ, заключающийся в предварительном связывании противоиона на поверхности комплексной нити и последующим связывании ионного соединения с противоионом посредством ионной связи через ионную реакцию. Предпочтительно использовать способ, заключающийся в закреплении вещества или полимера на поверхности волокон, посредством химического введения реакционно-способной функциональной группы в вещество или полимер, или способ, заключающийся в предварительном связывании противоиона с поверхностью волокон, и последующим связывании ионного соединения с противоионом посредством ионной связи через ионную реакцию, поскольку эти способы способны придавать высокоактивные антитромбогенные свойства и способствуют сохранению стабильной и долгосрочной антитромбогенности. В случае, когда придание антитромбогенных свойств должно быть достигнуто любым из вышеуказанных способов, возможно допустить, чтобы вещество или полимер наносились на комплексную нить заранее. Тем не менее, с точки зрения производственных затрат, предпочтительней производить трубчатую ткань, а затем наносить вещество или полимер на нее.
ПРИМЕРЫ
[0037]
Далее, настоящее изобретение будет описано более подробно с ссылками на примеры.
[0038]
[Способы измерения]
(1) Линейная плотность
[Общая линейная плотность]: При определении общей линейной плотности использовался способ, представленный в «JIS L 1013 (1999) 8.3.1 A», при котором фактическая линейная плотность измерялась под заранее определенной нагрузкой — 0,045 [кН/дтекс].
[Линейная плотность единичного волокна]: Линейная плотность единичного волокна рассчитывалась делением общей линейной плотности на количество единичных волокон.
[0039]
(2) Толщина тканого материала
Толщина тканого материала, измерялась в соответствии с «JIS L 1096:2010 8.4» следующим способом: искусственный кровеносный сосуд подвергался давлению 23,5 кПа в течение 10 секунд с целью осаждения толщины слоя стенки искусственного кровеносного сосуда, после чего производились измерения толщины слоя стенки в пяти различных точках, с помощью прибора для измерения толщины, на основании которых вычислялось среднее значение толщин, измеренных в пяти точках.
[0040]
(3) Внутренний диаметр
Внутренний диаметр образца измерялся в соответствии с указаниями, описанными в ISO7198 следующим способом: круговой конус, имеющий конусность 1/10 или менее, располагался вертикально, затем образец осторожно сбрасывался на круговой конус, таким образом, чтобы образец накрывал круговой конус, после чего измерялся диаметр той части кругового конуса, который находился в контакте с нижним концом зафиксированного остановленного образца.
[0041]
(4) Водопроницаемость
Водопроницаемость, определялась в соответствии с указаниями, описанными в ISO7198 следующим способом: на боковую стенку искусственного кровеносного сосуда подавалась вода под давлением 120 мм рт.ст. (16 кПа), после чего замерялось количество воды, просочившейся через искусственный кровеносный сосуд и количество воды выпущенной из фиксирующего устройства на площадь сегмента в минуту.
[0042]
(5) Устойчивость к перегибам
Устойчивость к перегибам определялась в соответствии с указаниями, описанными в ISO7198 следующим способом: искусственный кровеносный сосуд скручивался в петлю, после чего измерялся радиус, при котором обнаруживался очевидный перегиб (далее этот радиус именуется «радиус перегиба»). При оценке, устойчивость к перегибам при радиусе перегиба менее 20 мм определялась как «отличная», при радиусе перегиба от 21 до 40 мм определялась как «хорошая», при радиусе перегиба от 41 до 60 мм определялась как «допустимая», и при радиусе перегиба более 61 мм определялась как «недопустимая».
При оценке, устойчивость к перегибам при радиусе перегиба менее 20 мм определялась как «отличная», при радиусе перегиба от 21 до 40 мм определялась как «хорошая», при радиусе перегиба от 41 до 60 мм определялась как «допустимая», и при радиусе перегиба более 61 мм определялась как «недопустимая».
[0043]
(6) Антитромбогенные свойства
Брюшную аорту крысы отделяли приблизительно на 3 см, оба конца брюшной аорты перекрывали зажимами для прекращения циркуляции крови, после чего разрезали центральную часть аорты, оба отрезанных конца соответственно соединяли с двумя концами искусственного кровеносного сосуда, затем убирали зажимы для восстановления кровотока, искусственный кровеносный сосуд извлекали через 1 неделю, после чего проводили осмотр внутренней поверхности стенки искусственного кровеносного сосуда. Оценка осуществлялась следующим образом: незакупоренный искусственный кровеносный сосуд, определялся как «отличный», искусственный кровеносный сосуд, закупоренный тромбами, определялся как «недопустимый».
[0044]
(7) Клеточная адгезия
Из произведенного искусственного кровеносного сосуда, вырезали произвольный квадратный сегмент, или же искусственный кровеносный сосуд вскрывали, после чего квадратный сегмент или кровеносный искусственный сосуд с надрезом помещали на клеточную культуру в чашке Петри. Эндотелиальные клетки кровеносных сосудов быка высеивались на искусственный кровеносный сосуд с заранее определенной плотностью и, затем, культивировались в инкубаторе. Через 3 дня производился осмотр клеток с помощью фазово-контрастного микроскопа, и доля областей, к которым прижились клетки, измерялось с 1% интервалом. Оценка осуществлялась следующим образом: искусственный кровеносный сосуд, в котором количество прижившихся клеток составило не менее 90%, определялся как «отличный», искусственный кровеносный сосуд, в котором количество прижившихся клеток находилось в диапазоне от 70 до 89% определялся как «хороший», искусственный кровеносный сосуд, в котором количество прижившихся клеток находилось в диапазоне от 50 до 69% определялся как «приемлемый», и искусственный кровеносный сосуд, в котором количество прижившихся клеток составляло менее 49% или менее 90% определялся как «неприемлемый», где процентные значения определялись по отношению к числу клеток, которые культивировались в чашке Петри без искусственного кровеносного сосуда.
[0045]
Свойства и эффективность искусственных кровеносных сосудов, представленные в описанных ниже примерах, показаны в Таблицах 1 и 2.
[0046]
[Пример 1]
В качестве основных нитей и уточных нитей (нитей, выступающих с изнаночной стороны), использовались комплексная нить А, изготовленная из полиэфирных волокон и имеющая линейную плотность единичного волокна 1,38 дтекс, и общую линейную плотность 33,0 дтекс, и некрученая комплексная нить B’, изготовленная из композитных волокон «море-остров», в которых компонент «море» представлял полимер полиэтилентерефталат (массовое соотношение «море» и «остров» равно 20/80, где количество компонентов «остров» составляло 70) и линейная плотность единичного волокна составляла 7,3 дтекс, а общая линейная плотность — 66 дтекс. Комплексная нить B’ — это нить, которую можно преобразовать в комплексную нить B посредством переработки в ультратонкое волокно. Используя основные нити, наматывали навой A и навой B’ из комплексной нити A и комплексной нити B’, соответственно, используя сновальную машину. Используя уточные нити, готовили шпули для челноков A и B’, наматывая комплексную нить A и комплексную нить B’, соответственно, используя уточномотальную машину. Трубчатую ткань 4-х ремизного сатинового/полотняного переплетения основы и утка с двухслойной структурой вырабатывали таким образом, чтобы процент элементарных волокон, составляющих комплексную нить B в трубчатой ткани, составлял 60%, используя челночный ткацкий станок, на котором навой A и навой B’ были установлены согласно двухнавойной системе, а челноки с уточной нитью A и комплексной нитью B’ использовали согласно двухчелночной системе. Трубчатую ткань затем облагораживали, нагревая до 98°C. Полученную ткань обрабатывали в 4% водном растворе гидроксида натрия при температуре 98°C в течение 20 минут с целью полного растворения и удаления компонента «море» из упомянутых выше композитных волокон со структурой «море-остров», таким образом вырабатывая ультратонкую комплексную нить B, содержавшую элементарные волокна с линейной плотностью 0,08 дтекс, при общей ее линейной плотности 53,0 дтекс.
Используя уточные нити, готовили шпули для челноков A и B’, наматывая комплексную нить A и комплексную нить B’, соответственно, используя уточномотальную машину. Трубчатую ткань 4-х ремизного сатинового/полотняного переплетения основы и утка с двухслойной структурой вырабатывали таким образом, чтобы процент элементарных волокон, составляющих комплексную нить B в трубчатой ткани, составлял 60%, используя челночный ткацкий станок, на котором навой A и навой B’ были установлены согласно двухнавойной системе, а челноки с уточной нитью A и комплексной нитью B’ использовали согласно двухчелночной системе. Трубчатую ткань затем облагораживали, нагревая до 98°C. Полученную ткань обрабатывали в 4% водном растворе гидроксида натрия при температуре 98°C в течение 20 минут с целью полного растворения и удаления компонента «море» из упомянутых выше композитных волокон со структурой «море-остров», таким образом вырабатывая ультратонкую комплексную нить B, содержавшую элементарные волокна с линейной плотностью 0,08 дтекс, при общей ее линейной плотности 53,0 дтекс. В дальнейшем тканый материал высушивался с использованием сухого жара при температуре 120°C и затем стерилизовался. Таким образом, изготавливался искусственный кровеносный сосуд, состоящий из трубчатой ткани, где трубчатая ткань содержит 60% единичных волокон, составляющих комплексную нить В, имеющий внутренний диаметр 3 мм и толщину стенки 180 мкм.
В дальнейшем тканый материал высушивался с использованием сухого жара при температуре 120°C и затем стерилизовался. Таким образом, изготавливался искусственный кровеносный сосуд, состоящий из трубчатой ткани, где трубчатая ткань содержит 60% единичных волокон, составляющих комплексную нить В, имеющий внутренний диаметр 3 мм и толщину стенки 180 мкм.
[0047]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 250 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0048]
[Пример 2]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что процент единичных волокон, составляющих комплексную нить B, был отрегулирована до 75%. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 310 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию и высокий показатель антитромбогенных свойств.
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 310 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию и высокий показатель антитромбогенных свойств.
[0049]
[Пример 3]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что процент единичных волокон, составляющих комплексную нить B, был отрегулирован до 30%, а толщина стенок отрегулирована до 100 мкм. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии.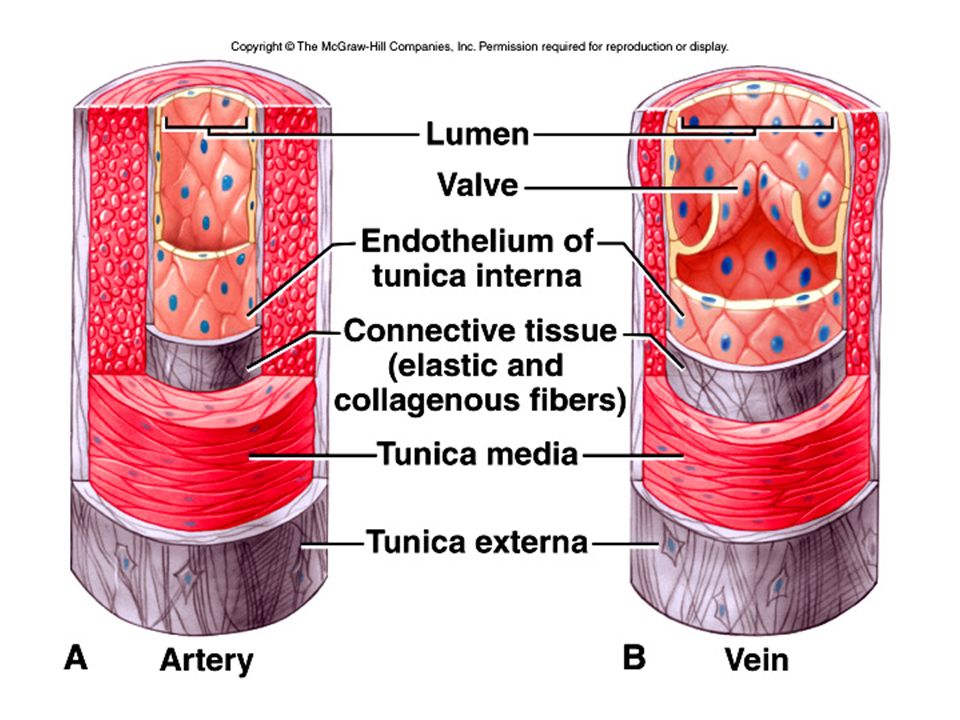 Искусственный кровеносный сосуд имеет водопроницаемость 190 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
Искусственный кровеносный сосуд имеет водопроницаемость 190 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0050]
[Пример 4]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что процент единичных волокон, составляющих комплексную нить B, был отрегулирован до 90%, а толщина стенок отрегулирована до 240 мкм. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 470 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0051]
[Пример 5]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что в качестве основной и уточной нити использовалась комплексная нить A имеющая линейную плотность единичного волокна 2,13 дтекс и общую линейную плотность 17 дтекс, а толщина стенок была отрегулирована до 50 мкм.
[0052]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 460 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[Пример 6]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что в качестве основной и уточной нити использовалась комплексная нить B имеющая линейную плотность единичного волокна 0,05 дтекс и общую толщину пряди 31 дтекс, а толщина стенок была отрегулирована до 50 мкм.
[0053]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 300 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
Искусственный кровеносный сосуд имеет водопроницаемость 300 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0054]
[Пример 7]
Трубчатую ткань изготавливали так же, как и в Примере 1, за исключением того, что основу и уток ткани образующие полотняным переплетением два тканых слоя использовали в качестве тканой структуры, а также вводили полиэтиленовую пленку шириной 4 мм и толщиной 0,12 мм, используя ее в качестве распорного материала в полученной трубчатой ткани, а затем, с целью формирования петель трубчатую ткань подвергали воздействию пробивных струй воды, где диаметр сопловых отверстий составлял 0,25 мм, шаг между сопловыми отверстиями составлял 2,5 мм, а давление воды составляло 70 кг/см2.
[0055]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли и эти петли нерегулярно переплетены. Искусственный кровеносный сосуд имеет водопроницаемость 140 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
Искусственный кровеносный сосуд имеет водопроницаемость 140 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0056]
[Пример 8]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, внутренний диаметр искусственного кровеносного сосуда был отрегулирован до 7,5 мм. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли, и эти петли существуют в рассеянном состоянии. Искусственный кровеносный сосуд имеет водопроницаемость 200 мл/мин/см2, высокую устойчивость к перегибам, высокую клеточную адгезию, высокий показатель антитромбогенных свойств.
[0057]
[Пример 9]
Трубчатая ткань, произведенная в Примере 1, подвергалась процессу гофрирования. Процесс гофрирования происходил следующим образом: винтообразный металлический стержень из нержавеющей стали, продевался сквозь трубчатую ткань, после чего обматывался нержавеющей проволокой поверх трубчатой ткани по внутренней резьбе. Находясь в подобном состоянии образец оставляли в печи на 30 минут при температуре 180°C. Образец постепенно охлаждался, затем удалялся стержень и проволока из нержавеющей стали. Таким образом трубчатая ткань приобретала гофрированную структуру.
Процесс гофрирования происходил следующим образом: винтообразный металлический стержень из нержавеющей стали, продевался сквозь трубчатую ткань, после чего обматывался нержавеющей проволокой поверх трубчатой ткани по внутренней резьбе. Находясь в подобном состоянии образец оставляли в печи на 30 минут при температуре 180°C. Образец постепенно охлаждался, затем удалялся стержень и проволока из нержавеющей стали. Таким образом трубчатая ткань приобретала гофрированную структуру.
[0058]
Искусственный кровеносный сосуд полученный из трубчатой ткани имеел водопроницаемость 250 мл/мин/см2, высокую устойчивость к перегибам, высокий уровень клеточной адгезии, высокий показатель антитромбогенных свойств.
[0059]
[Пример 10]
На трубчатую ткань, полученную в Примере 1, наносилось антитромбогенное покрытие. Получение антитромбогенного покрытия трубчатой ткани происходило следующим образом: трубчатая ткань обрабатывалась 0,5% водным раствором гидроокиси натрия и затем окислялась 5% перманганатом калия. В дальнейшем, полиэтиленимин, (молекулярный вес: 600, Wako Pure Chemical Industries, Ltd) был добавлен к обработанной трубчатой ткани в присутствии 0,1% 1-(3-диметиламинпропила)-3-этилкарбодиимида для проведения реакции волокон в трубчатом материале с полиэтиленимином. Кроме того, трубчатая ткань подвергалась реакции преобразования полиэтиленимина, закрепленного на поверхности волокон, в четвертичную соль аммония в 1% растворе этилового бромида в метаноле при температуре 50°C. В завершении, трубчатая ткань погружалась в 0,8% водный раствор гепарина натрия (Wako Pure Chemical Industries, Ltd.) при температуре 70°C, с целью связывания гепарина с трубчатой тканью посредством ионной связи. В результате получился продукт, обладающий трубчатой структурой и антитромбогенными свойствами, с возможностью его использования в качестве искусственного кровеносного сосуда. Искусственный кровеносный сосуд, созданный подобным образом, обладает лучшей антитромбогенностью по сравнению с искусственным кровеносным сосудом, произведенном в Примере 1, а также имеет водопроницаемость 240 мл/мин/см2, обладает устойчивостью к перегибам и обладает высоким уровнем клеточной адгезии.
В дальнейшем, полиэтиленимин, (молекулярный вес: 600, Wako Pure Chemical Industries, Ltd) был добавлен к обработанной трубчатой ткани в присутствии 0,1% 1-(3-диметиламинпропила)-3-этилкарбодиимида для проведения реакции волокон в трубчатом материале с полиэтиленимином. Кроме того, трубчатая ткань подвергалась реакции преобразования полиэтиленимина, закрепленного на поверхности волокон, в четвертичную соль аммония в 1% растворе этилового бромида в метаноле при температуре 50°C. В завершении, трубчатая ткань погружалась в 0,8% водный раствор гепарина натрия (Wako Pure Chemical Industries, Ltd.) при температуре 70°C, с целью связывания гепарина с трубчатой тканью посредством ионной связи. В результате получился продукт, обладающий трубчатой структурой и антитромбогенными свойствами, с возможностью его использования в качестве искусственного кровеносного сосуда. Искусственный кровеносный сосуд, созданный подобным образом, обладает лучшей антитромбогенностью по сравнению с искусственным кровеносным сосудом, произведенном в Примере 1, а также имеет водопроницаемость 240 мл/мин/см2, обладает устойчивостью к перегибам и обладает высоким уровнем клеточной адгезии.
[0060]
[Сравнительный Пример 1]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что в качестве основной и уточной нити использовалась комплексная нить A имевшая линейную плотность единичного волокна 1,50 дтекс и общую линейную плотность 84 дтекс, а толщина стенок была отрегулирована до 250 мкм.
[0061]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, водопроницаемость искусственного кровеносного сосуда имела значение 660 мл/мин/см2, что является недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0062]
[Сравнительный Пример 2]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что толщина стенки была отрегулирована до 310 мкм. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, водопроницаемость искусственного кровеносного сосуда имела значение 660 мл/мин/см2, что является недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, водопроницаемость искусственного кровеносного сосуда имела значение 660 мл/мин/см2, что является недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0063]
[Сравнительный Пример 3]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что толщина стенки была отрегулирована до 310 мкм. После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, показатель устойчивости искусственного кровеносного сосуда к перегибам являлся недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0064]
[Сравнительный Пример 4]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что в качестве основной и уточной нити использовалась комплексная нить B, имевшая линейную плотность единичного волокна 0,23 дтекс и общую линейную плотность 33 дтекс.
[0065]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, показатель клеточной адгезии являлся недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0066]
[Сравнительный Пример 5]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что толщина стенок была отрегулирована до 30 мкм.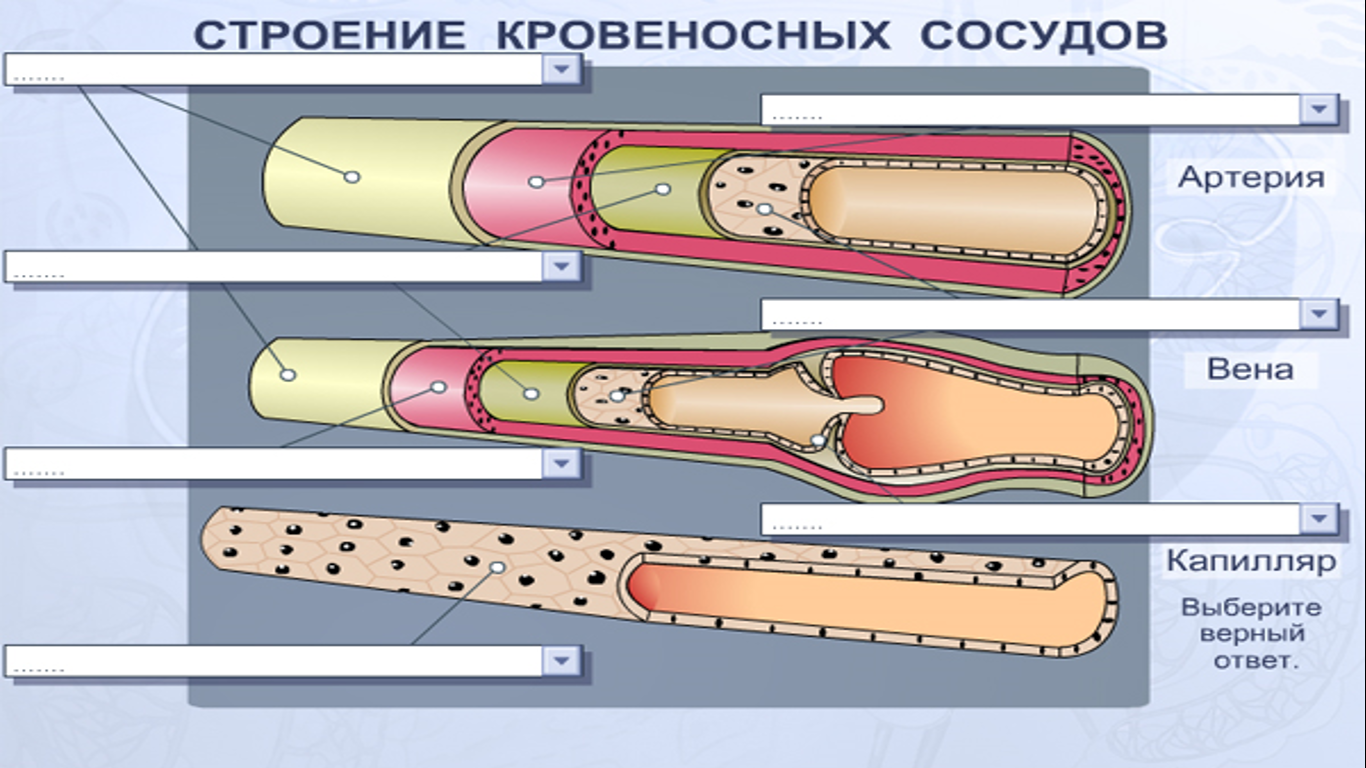 После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, водопроницаемость искусственного кровеносного сосуда имела значение 900 мл/мин/см2, что является недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, водопроницаемость искусственного кровеносного сосуда имела значение 900 мл/мин/см2, что является недопустимым для использования его в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0067]
[Сравнительный Пример 6]
Искусственный кровеносный сосуд, состоящий из трубчатой ткани, изготавливали так же, как и в Примере 1, за исключением того, что в качестве основной и уточной нити использовалась комплексная нить B, имевшая линейную плотность единичного волокна 0,08 дтекс и общую линейную плотность 84 дтекс, а толщина стенок была отрегулирована до 180 мм.
[0068]
После изучения внутренней поверхности стенки искусственного кровеносного сосуда, произведенного подобным образом, с помощью микроскопа при 100-кратном увеличении, было подтверждено, что комплексная нить B формирует петли. Однако, петли чрезмерно выступали от внутренней поверхности стенки, а также на внутренней поверхности стенки сформировались тромбы. Следовательно, такой искусственный кровеносный сосуд не пригоден для использования в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
Однако, петли чрезмерно выступали от внутренней поверхности стенки, а также на внутренней поверхности стенки сформировались тромбы. Следовательно, такой искусственный кровеносный сосуд не пригоден для использования в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0069]
[Сравнительный Пример 7]
Трубчатая ткань, произведенная в Примере 1, подвергалась обработке ворсованием, с использованием ворсовальной машины, таким образом, был изготовлен искусственный кровеносный сосуд, состоящий из трубчатой ткани.
[0070]
После изучения внутренней поверхности стенки полученного искусственного кровеносного сосуда, с помощью микроскопа, было обнаружено, что петли комплексной нити B разрушены вследствие процесса ворсования, и ворсинки образовались на внутренней поверхности стенки. После проведения тестирования на антитромбогенность и последующей оценки искусственного кровеносного сосуда, были обнаружены тромбы, образовавшиеся на внутренней поверхности стенки. Следовательно, такой искусственный кровеносный сосуд не пригоден для использования в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
Следовательно, такой искусственный кровеносный сосуд не пригоден для использования в качестве искусственного кровеносного сосуда, имеющего средний или малый диаметр.
[0071]
|
|
[0072]
|
Сердечно-сосудистая система человека — кровеносные сосуды
Путешествуйте с эритроцитом, поскольку он переносит кислород и углекислый газ через сердце, легкие и ткани тела.
В цепи через сердечно-сосудистую систему красные кровяные тельца переносят кислород из легких в ткани тела и переносят углекислый газ из тканей тела обратно в легкие.
Encyclopædia Britannica, Inc. См. Все видео к этой статье Из-за необходимости раннего развития транспортной системы внутри эмбриона органысосудистые системы одними из первых появились и взяли на себя их функциональную роль. Фактически, эта система в своей основной форме устанавливается к четвертой неделе эмбриональной жизни. Примерно на 18-й день беременности клетки начинают группироваться между внешней кожей ( эктодермой ) и внутренней кожей ( энтодермой ) эмбриона. Эти клетки вскоре перестраиваются, так что более периферические из них соединяются, образуя сплошной сплющенный лист, вмещающий более центрально расположенные клетки; эти клетки остаются взвешенными в жидкой среде как примитивные клетки крови . Затем трубки расширяются и объединяются, образуя сеть; так появляются примитивные кровеносные сосуды .
Кровеносные сосуды представляют собой замкнутую систему трубок, по которым кровь транспортируется ко всем частям тела и обратно к сердцу . Как и в любой биологической системе, структура и функция сосудов настолько тесно связаны, что одно невозможно обсуждать без учета другого.
Артерии транспортируют кровь к тканям тела под высоким давлением, создаваемым насосным действием сердца. Сердце нагнетает кровь в эти эластичные трубки, которые отскакивают, посылая кровь пульсирующими волнами. Поэтому крайне важно , чтобы сосуды обладали прочными эластичными стенками для обеспечения быстрого и эффективного кровотока к тканям.
Стенка артерии состоит из трех слоев. Вtunica intima , самый внутренний слой, состоит из внутренней поверхности гладкойэндотелий покрыт поверхностью эластичных тканей. Вtunica media , или средняя оболочка, более толстая в артериях, особенно в крупных артериях, и состоит из гладкомышечных клеток, перемешанных с эластическими волокнами. Мышечные клетки и эластичные волокна окружают сосуд. В более крупных сосудах средняя оболочка состоит в основном из эластических волокон. По мере того как артерии становятся меньше, количество эластичных волокон уменьшается, а количество гладких мышечных волокон увеличивается. Вtunica adventitia , самый внешний слой, является самым прочным из трех слоев. Он состоит из коллагеновых и эластичных волокон. ( Коллаген — это белок соединительной ткани .) Адвентициальная оболочка обеспечивает ограничивающий барьер, защищающий сосуд от чрезмерного расширения. Также для этого слоя характерно наличие мелких кровеносных сосудов, называемыхvasa vasorum, которые снабжают стенки более крупных артерий и вен . Напротив, внутренний и средний слои питаются за счет диффузии крови по мере ее транспортировки. Более толстая и эластичная стенка артерий позволяет им расширяться вместе с пульсом и возвращаться к своему первоначальному размеру.
В более крупных сосудах средняя оболочка состоит в основном из эластических волокон. По мере того как артерии становятся меньше, количество эластичных волокон уменьшается, а количество гладких мышечных волокон увеличивается. Вtunica adventitia , самый внешний слой, является самым прочным из трех слоев. Он состоит из коллагеновых и эластичных волокон. ( Коллаген — это белок соединительной ткани .) Адвентициальная оболочка обеспечивает ограничивающий барьер, защищающий сосуд от чрезмерного расширения. Также для этого слоя характерно наличие мелких кровеносных сосудов, называемыхvasa vasorum, которые снабжают стенки более крупных артерий и вен . Напротив, внутренний и средний слои питаются за счет диффузии крови по мере ее транспортировки. Более толстая и эластичная стенка артерий позволяет им расширяться вместе с пульсом и возвращаться к своему первоначальному размеру.
Переход от артерии к Артериола является постепенной, с прогрессирующим истончением стенки сосуда и уменьшением размера просвета или прохода. В артериолах внутренняя оболочка все еще присутствует в виде выстилки, покрытой слоем тонких продольных волокон; однако средняя оболочка больше не содержит эластичных волокон и состоит только из одного слоя круглых или спиральных гладкомышечных волокон. Адвентициальная оболочка состоит из соединительнотканных элементов.
В артериолах внутренняя оболочка все еще присутствует в виде выстилки, покрытой слоем тонких продольных волокон; однако средняя оболочка больше не содержит эластичных волокон и состоит только из одного слоя круглых или спиральных гладкомышечных волокон. Адвентициальная оболочка состоит из соединительнотканных элементов.
Маленькие артерии и артериолы действуют как регулирующие клапаны, через которые кровь попадает в капилляры . Сильная мышечная стенка способна закрывать проход или позволять ему расширяться в несколько раз по сравнению с нормальным размером, тем самым значительно изменяя приток крови к капиллярам. С помощью этого устройства кровоток направляется к тканям, которые в нем больше всего нуждаются.
По мере того, как артериолы становятся меньше в размерах, три слоя становятся все менее и менее определенными, причем самые маленькие артериолы состоят из немногим больше, чем эндотелий, или слизистая оболочка, окруженная слоем гладкой мускулатуры. Микроскопические капиллярные канальцы состоят из единственного слоя эндотелия, который является продолжением внутренних выстилающих клеток артерий и вен.
По мере схождения капилляров маленькие образуются венулы , функция которых заключается в сборе крови из капиллярных лож (т. е. сетей капилляров). Венулы состоят из эндотелиальной трубки, поддерживаемой небольшим количеством коллагеновой ткани, а в более крупных венулах — также несколькими гладкими мышечными волокнами. По мере того, как венулы продолжают увеличиваться в размерах, они начинают проявлять структуру стенок, характерную для артерий, хотя они становятся намного тоньше.
В Вены , которые функционируют, чтобы проводить кровь от периферических тканей к сердцу, эндотелиальная выстилка окружена средой оболочкой, которая содержит меньше мышечной и эластической ткани, чем в стенке артерии. Самый внешний слой, tunica adventitia, состоит в основном из соединительной ткани. Артериальное давление в этих сосудах чрезвычайно низкое по сравнению с артериальной системой, и кровь должна выходить при еще более низком давлении. Это создает потребность в специальном механизме, чтобы кровь продолжала двигаться по возвращении в сердце.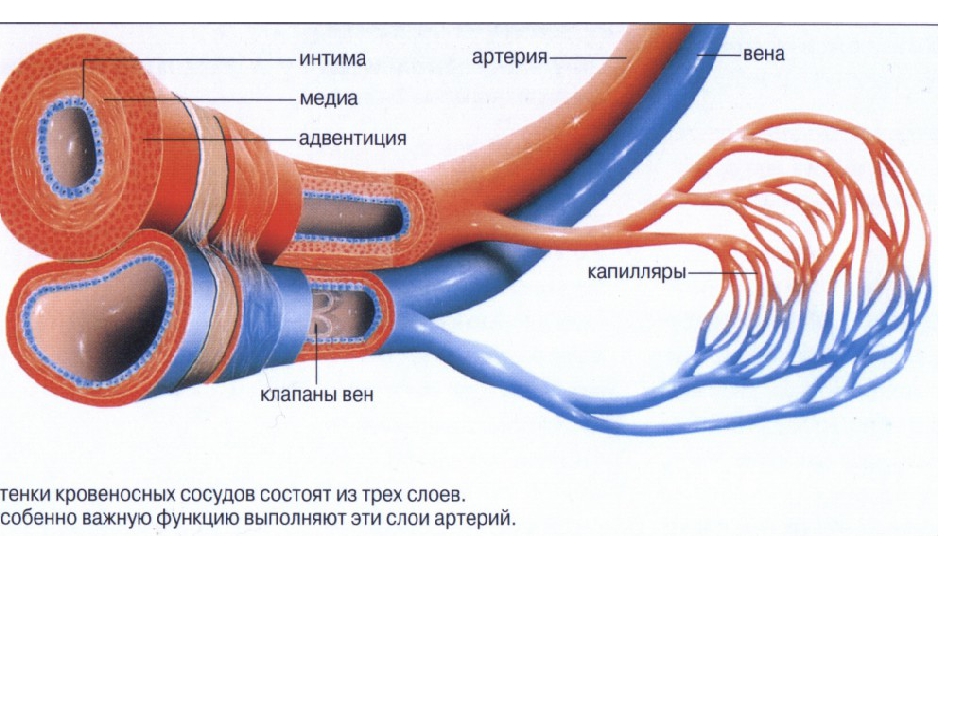
Для этого многие жилы обладают уникальной системой клапаны . Эти клапаны, образованные полулунными складками внутренней оболочки, расположены парами и служат для направления потока крови к сердцу, особенно в восходящем направлении. Когда кровь течет к сердцу, створки клапанов упираются в стенку вены; затем они вздуваются, чтобы заблокировать отверстие, когда давление крови и окружающих тканей заполняет карман клапана. Этих клапанов больше в венах конечностей, чем в любых других частях тела.
Вены более растяжимы, чем артерии, и их стенки устроены так, что позволяют им расширяться или сокращаться. Основная функция их сократимости, по-видимому, заключается в снижении емкости сердечно-сосудистой системы за счет сужения периферических сосудов в ответ на неспособность сердца перекачивать достаточное количество крови.
Вены, как правило, проходят параллельно артериям, но присутствуют в большем количестве. Их каналы больше, чем у артерий, а стенки тоньше. Около 60 процентов объема крови находится в системном кровотоке , а 40 процентов обычно находится в венах.
В легочный контур состоит из правого желудочка; выходящийлегочная артерия и ее ветви; артериолы, капилляры и венулы легких ; и легочные вены, которые впадают в левое предсердие.
Легочный ствол, общий ствол легочных артерий, берет начало от верхней поверхности правого желудочка и простирается на четыре-пять сантиметров за это начало, прежде чем делиться на правую и левую легочные артерии, которые снабжают легкие. ВЛегочный клапан , который имеет две створки или створки, защищает отверстие между правым желудочком и легочным стволом. Ствол относительно тонкостенный по сравнению с артерией, его стенки примерно вдвое превышают толщину полой вены и втрое больше толщины аорты . Правая и левая легочные артерии короткие, но имеют относительно большой диаметр. Стенки растягиваются, что позволяет сосудам принимать ударный объем правого желудочка, который является необходимой функцией, равной функции левого желудочка.
Легочный ствол проходит по диагонали вверх влево по пути аорты. Между пятым и шестым грудными позвонками (примерно на уровне основания грудины) туловище разделяется на две ветви — правую и левую легочные артерии, которые входят в легкие. После попадания в легкие ветви проходят процесс разделения, причем последние ветви являются капиллярами. Капилляры, окружающие воздушные мешочки (альвеолы) легких, собирают кислород и выделяют углекислый газ . Капилляры, несущие насыщенную кислородом кровь, соединяются все более и более крупными сосудами, пока не достигают легочных вен, по которым насыщенная кислородом кровь переносится из легких в левое предсердие сердца.
Между пятым и шестым грудными позвонками (примерно на уровне основания грудины) туловище разделяется на две ветви — правую и левую легочные артерии, которые входят в легкие. После попадания в легкие ветви проходят процесс разделения, причем последние ветви являются капиллярами. Капилляры, окружающие воздушные мешочки (альвеолы) легких, собирают кислород и выделяют углекислый газ . Капилляры, несущие насыщенную кислородом кровь, соединяются все более и более крупными сосудами, пока не достигают легочных вен, по которым насыщенная кислородом кровь переносится из легких в левое предсердие сердца.
Инвазивная аденокарцинома толстой кишки — MyPathologyReport.ca
Что такое инвазивная аденокарцинома?
Инвазивная аденокарцинома — самый распространенный тип рака толстой кишки. Опухоль возникает из-за железы обычно находится на внутренней поверхности толстой кишки. Может быть поражена любая часть толстой кишки, от слепой до прямой кишки. Во многих случаях этот рак начинается в предраковом состоянии, которое называется аденома. Общие типы аденом толстой кишки: трубчатый, трубочковый, покрытый ворсинкамии сидячий зубчатый.
Общие типы аденом толстой кишки: трубчатый, трубочковый, покрытый ворсинкамии сидячий зубчатый.
Толстая кишка
Ободочная кишка является частью желудочно-кишечного тракта, который также включает рот, пищевод, желудок, тонкий кишечник и задний проход. Ободочная кишка — это длинная полая трубка, которая начинается в тонкой кишке и заканчивается у анального канала. Ободочная кишка разделена на части, которые включают слепую кишку, восходящую ободочную кишку, поперечную ободочную кишку, нисходящую ободочную кишку, сигмовидную кишку и прямую кишку. Функции толстой кишки — поглощать воду из пищи, которую мы едим, и выводить отходы из организма.
Ободочная кишка состоит из шести слоев ткани:
- слизистая оболочка — Слизистая оболочка — это ткань, выстилающая внутреннюю поверхность толстой кишки. Слизистая оболочка включает эпителиальные клетки которые образуют структуры, называемые железы. Железы окружены и поддерживаются тканью, называемой собственной пластинкой.

- Мышечная слизистая оболочка — Это тонкий слой мышц, который находится чуть ниже слизистой оболочки.
- подслизистая основа — Подслизистая основа содержит множество толстых кровеносных сосудов и лимфатических каналов.
- Собственная мышечная мышца Собственная мышечная мышца — это толстый мышечный пучок. Мышцы собственной мышечной ткани помогают перемещать переваренную пищу и отходы по толстой кишке.
- Подсерозная жировая ткань — Это слой жира, расположенный непосредственно под собственной мышечной мышцей. Подсерозная жировая ткань находится около внешней поверхности толстой кишки.
- серозная оболочка — Серозная оболочка — это тонкий слой ткани, покрывающий подсерозную жировую ткань и внешнюю часть толстой кишки.
Как патологоанатомы ставят этот диагноз?
Диагноз инвазивной аденокарциномы обычно ставится после удаления небольшого образца опухоли с помощью процедуры, называемой биопсия. Тест называется иммуногистохимия может быть выполнено для подтверждения диагноза.
После того, как опухоль будет полностью удалена, ее отправят патологоанатому, который подготовит новый отчет о патологии. Этот отчет подтвердит или пересмотрит исходный диагноз и предоставит дополнительную важную информацию, такую как размер опухоли, распространение и распространение опухолевых клеток в лимфатический узел. Тест для поиска несоответствие ремонта также могут выполняться белки (см. ниже раздел «Белки для восстановления несоответствия»). Эта информация используется для определения стадии рака и принятия решения о необходимости дополнительного лечения.
Степень опухоли
Класс — это термин, который патологи используют для описания того, насколько рак отличается от нормальной ткани толстой кишки. Потому что нормальный эпителиальные клетки в толстой кишке соединяются вместе, чтобы сделать железы, инвазивная аденокарцинома обычно делится на четыре степени в зависимости от того, какая часть опухоли состоит из желез:
- Хорошо дифференцированный — Более 95% опухоли составляют железы.

- Умеренно дифференцированный — От 50 до 95% опухоли составляют железы.
- Слабо дифференцированный — Менее 50% опухоли составляют железы.
- недифференцированный — В опухоли нет никаких желез.
Оценка важна, потому что плохо дифференцированный и недифференцированный опухоли связаны с худшим прогноз и с большей вероятностью распространятся на отдаленные участки тела.
Несоответствие ремонта
Исправление несоответствий (MMR) — это система внутри всех нормальных здоровых клеток для исправления ошибок в нашем генетическом материале (ДНК). Система состоит из разных белков, четыре наиболее распространенных из которых называются MSh3, MSH6, MLh2 и PMS2. Потеря одного из этих белков увеличивает риск развития рака. Патологи заказывают тестирование на восстановление несоответствия, чтобы увидеть, не теряется ли какой-либо из этих белков в опухоли. Если для вашего образца ткани был заказан тест на исправление несоответствия, результаты будут описаны в вашем отчете о патологии.
Нормальное восстановление ДНК
Каждая клетка вашего тела содержит набор инструкций, которые говорят клетке, как ей себя вести. Эти инструкции написаны на языке, называемом ДНК, и они хранятся на 46 хромосомах в каждой клетке. Поскольку инструкции очень длинные, они разбиты на разделы, называемые генами, и каждый ген сообщает клетке, как производить часть машины, называемую белком.
Если ДНК будет повреждена или если ее нельзя будет точно прочитать, клетка не сможет производить белки, необходимые для нормального функционирования. Область поврежденной ДНК называется мутацией, и мутации являются одной из наиболее частых причин рака у людей. Белки восстановления несоответствия поддерживают здоровье и нормальное функционирование клеток, исправляя эти мутации, когда они происходят.
Потеря несоответствия ремонта
Четыре белка репарации ошибочного спаривания MSh3, MSH6, MLh2 и PMS2 работают парами, чтобы исправить поврежденную ДНК. В частности, MSh3 работает с MSH6, а MLh2 работает с PMS2.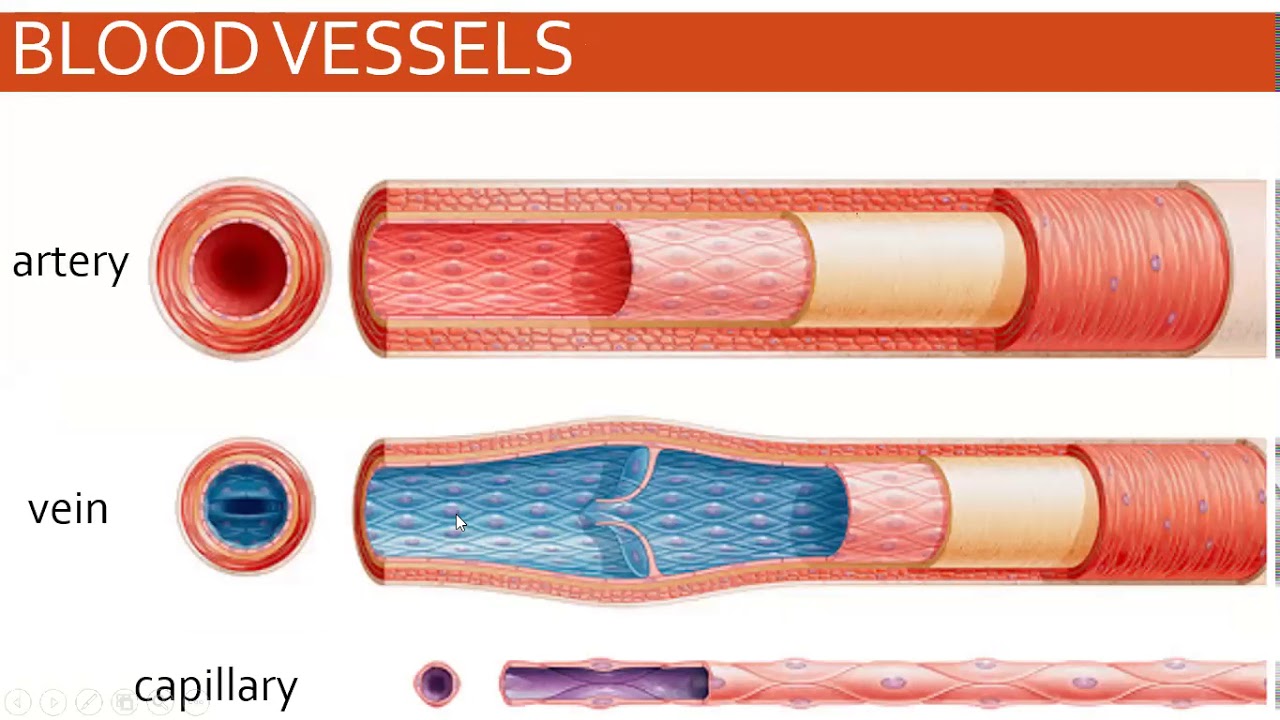 Если один белок теряется, пара не может нормально функционировать.
Если один белок теряется, пара не может нормально функционировать.
Рак, вызванный потерей исправления несоответствия
У большинства людей рак развивается в результате как факторов окружающей среды (например, курения), так и генетических факторов. Эти опухоли называют «спорадическими», потому что мы не можем точно предсказать, у каких людей они разовьются и когда. Однако некоторые люди наследуют генетические изменения, которые подвергают их гораздо более высокому риску развития рака. Говорят, что у этих людей есть синдром.
Наиболее частым синдромом, связанным с инвазивной аденокарциномой толстой кишки, является синдром Линча. Синдром Линча вызван генетическим изменением, которое приводит к потере одного из белков восстановления несоответствия. Другое название этого синдрома — наследственный неполипозный колоректальный рак (HNPCC).
Наиболее распространенные генетические изменения, связанные с синдромом Линча, связаны с генами, которые продуцируют MLh2 и MSh3. У небольшого количества людей с синдромом Линча будут обнаружены генетические изменения, связанные с MSH6 и PMS2.
У небольшого количества людей с синдромом Линча будут обнаружены генетические изменения, связанные с MSH6 и PMS2.
Люди с синдромом Линча имеют высокий риск развития аденокарциномы толстой кишки в раннем возрасте. Женщины с синдромом Линча также подвержены риску развития рака яичников и эндометрия в раннем возрасте. Другие типы рака, связанные с синдромом Линча, включают желудок, печень, мочевой пузырь, кожу и мозг.
Мьюир-Торре — это синдром, который тесно связан с синдромом Линча. Люди с болезнью Мьюир-Торре подвержены высокому риску развития рака кожи, называемого сальная карцинома. Эти люди также подвержены риску развития множественных доброкачественных опухолей кожи, называемых сальными аденомами.
Как патологи проверяют белки восстановления несоответствия?
Самый распространенный способ проверить белки восстановления несоответствия — это выполнить тест, называемый иммуногистохимия. Этот тест позволяет патологам увидеть, продуцируют ли опухолевые клетки все четыре белка восстановления несоответствия.
Если опухолевые клетки не производят один из белков, в вашем отчете этот белок будет описан как «потерянный» или «дефицитный». Поскольку белки репарации ошибочного спаривания работают парами (MSh3 + MSH6 и MLh2 + PMS2), два белка часто теряются одновременно.
Если опухолевые клетки в вашем образце ткани демонстрируют потерю одного или нескольких белков восстановления несоответствия, возможно, вы унаследовали синдром Линча, и вам следует обратиться к генетическому специалисту для дополнительных тестов и рекомендаций.
На что обращать внимание в своем отчете после удаления опухолиРазмер опухоли
После полного удаления опухоли ваш патологоанатом измеряет ее в трех измерениях, хотя в отчет обычно включается только самый большой размер. Например, если размер опухоли составляет 5.0 см на 3.2 см на 1.1 см, в отчете может быть указан размер опухоли как 5.0 см в наибольшем измерении.
Расширение опухоли
Все инвазивные аденокарциномы начинаются в слизистая оболочка на внутренней поверхности толстой кишки. Слои ткани под слизистой оболочкой включают подслизистую основу, собственную мышечную ткань, подсерозную жировую ткань и серозную оболочку. Перемещение раковых клеток из слизистой оболочки в нижнюю ткань называется вторжение.
Распространение опухоли — это способ описания того, как далеко раковые клетки продвинулись от слизистой оболочки к расположенной ниже ткани. Ваш патолог внимательно изучит вашу ткань, чтобы найти раковые клетки, которые продвинулись дальше всего от слизистой оболочки.
Раковые клетки, которые проникают глубже в стенку, с большей вероятностью вернутся в область исходной опухоли (местный рецидив) после лечения или распространятся на опухоль. лимфатический узел или отдаленный участок, такой как легкие. Расширение опухоли также используется для определения стадии опухоли (см. «Патологическая стадия» ниже).
Периневральная инвазия
Нервы похожи на длинные провода, состоящие из групп клеток, называемых нейронами. Нервы передают информацию (например, температуру, давление и боль) между мозгом и телом. Периневральная инвазия — это термин, который патологи используют для описания раковых клеток, прикрепленных к нерву.
Периневральная инвазия важна, потому что раковые клетки, прикрепившиеся к нерву, могут использовать нерв для проникновения в ткань за пределами исходной опухоли. Периневральная инвазия также связана с более высоким риском того, что опухоль вернется в ту же область тела (местный рецидив) после лечения.
Лимфоваскулярная инвазия
Кровь движется по телу по длинным тонким трубкам, называемым кровеносными сосудами. Другой тип жидкости, называемой лимфой, которая содержит отходы и иммунные клетки, перемещается по телу через лимфатические каналы.
Раковые клетки могут использовать кровеносные сосуды и лимфатические сосуды, чтобы перемещаться от опухоли к другим частям тела. Перемещение раковых клеток из опухоли в другую часть тела называется метастазирование.
Прежде чем раковые клетки могут метастазировать, они должны попасть в кровеносный или лимфатический сосуд. Это называется лимфоваскулярная инвазия. Наблюдение лимфоваскулярной инвазии увеличивает риск обнаружения раковых клеток в лимфатический узел или отдаленная часть тела, такая как легкие.
Присутствие раковых клеток внутри большой вены за пределами стенки толстой кишки (за пределами толстого мышечного пучка) связано с высоким риском того, что раковые клетки в конечном итоге будут обнаружены в печени.
Поля
В толстой кишке маржа любая ткань, разрезанная хирургом для удаления опухоли из вашего тела. Ободочная кишка представляет собой длинную трубку, и вашему хирургу нужно будет вырезать часть трубки, чтобы удалить опухоль из вашего тела. Два обрезанных конца трубки называются проксимальным и дистальным краями. Радиальный край — это любая ткань вокруг трубки, которую нужно разрезать.
В толстой кишке край считается положительным, если раковые клетки находятся на самом краю разрезанной ткани. Положительный запас связан с более высоким риском повторения опухоли на том же участке после лечения.
В вашем отчете будет описано, если есть аденомы или другие предраковые состояния наблюдались на грани. Поля будут описаны в вашем отчете только после того, как вся опухоль будет удалена.
Опухолевые отложения
Отложение опухоли — это группа раковых клеток, которые отделены от основной опухоли, но не в лимфатический узел. Отложения опухоли связаны с более высоким риском распространения опухолевых клеток на другие части тела, такие как легкие, после лечения.
Почкование опухоли
Образование опухоли — это термин, который патологи используют для описания отдельных раковых клеток или небольших групп раковых клеток, видимых на краю опухоли. Оценка присваивается: низкая, средняя или высокая в зависимости от количества почек, видимых под микроскопом. Высокий балл связан с повышенным риском распространения раковых клеток на другие части тела.
Рак, возникающий при аденоме
Иногда раковые клетки все еще содержатся в аденома что привело к опухоли. Если раковые клетки ограничены внутренней поверхностью аденомы и аденома полностью удалена, вероятность того, что рак вернется, очень мала.
Риск того, что рак вернется в будущем, увеличивается, если ваш патолог увидит под микроскопом любую из следующих особенностей:
- Раковые клетки находятся очень близко к срезанному краю полипа.
- Опухоль плохо дифференцированный or недифференцированный (см. гистологический класс выше).
- Там есть лимфоваскулярная инвазия (см. Лимфоваскулярная инвазия выше).
- Небольшие группы раковых клеток отрываются от края опухоли (патологи называют эту особенность «зарастанием опухоли высокой степени»; см. «Зарастание опухоли» выше).
Эффект лечения
Если вы прошли курс лечения рака (химиотерапия, лучевая терапия или и то, и другое) до удаления опухоли, ваш патолог внимательно изучит область ткани, в которой опухоль была ранее идентифицирована, чтобы определить, живы ли еще какие-либо раковые клетки ( жизнеспособный).
Наиболее часто используемая система описывает эффект лечения по шкале от 0 до 3, где 0 означает отсутствие жизнеспособных раковых клеток (все раковые клетки мертвы), а 3 — обширный остаточный рак без видимой регрессии опухоли (все или большая часть опухоли). раковые клетки живы).
Лимфатический узел
Лимфатический узел небольшие иммунные органы, расположенные по всему телу. Раковые клетки могут перемещаться из опухоли в лимфатический узел по лимфатическим каналам, расположенным внутри и вокруг опухоли (см. Лимфоваскулярная инвазия выше). Движение раковых клеток от опухоли к лимфатическому узлу называется метастазирование.
В большинстве отчетов указывается общее количество исследованных лимфатических узлов и количество раковых клеток, если таковые имеются. Ваш патолог внимательно осмотрит все лимфатические узлы на наличие раковых клеток. Лимфатические узлы, содержащие раковые клетки, часто называют положительными, а те, которые не содержат раковых клеток, — отрицательными.
Обнаружение раковых клеток в лимфатический узел важно, потому что это связано с более высоким риском того, что раковые клетки будут обнаружены в других лимфатических узлах или в отдаленном органе, таком как легкие. Исследование лимфатических узлов также используется для определения узловой стадии (см. Патологическая стадия ниже).
Патологическая стадия (pTNM)
Патологическая стадия инвазивной аденокарциномы основана на системе стадирования TNM, международно признанной системе, первоначально созданной Американский объединенный комитет по раку.
Эта система использует информацию о первичном опухоль (Т), лимфатический узел (N) и дальний метастатический болезнь (M) для определения полной патологической стадии (pTNM). Ваш патолог изучит представленные ткани и присвоит каждой части номер. В целом, большее число означает более запущенное заболевание и худшее. прогноз.
Патологическая стадия не сообщается биопсия образец. Сообщается только тогда, когда весь опухоль был удален в иссечение or резекция образец.
Стадия опухоли (pT) при инвазивной аденокарциноме
Инвазивной аденокарциноме назначается стадия опухоли от 1 до 4 в зависимости от расстояния, на которое раковые клетки прошли от слизистой оболочки до стенки толстой кишки или окружающих тканей (распространение опухоли).
- T1 — Опухоль находится в подслизистой оболочке чуть ниже слизистой на внутренней поверхности толстой кишки.
- T2 — Опухоль проникла в собственную мышечную оболочку толстой кишки.
- T3 — Опухоль, которая прошла через всю мышечную стенку и находится в жировой ткани около внешней поверхности толстой кишки.
- T4 — Опухоль находится в серозной оболочке на внешней поверхности толстой кишки или распространилась в окружающие органы, такие как мочевой пузырь или брюшная стенка.
Узловая стадия (pN) инвазивной аденокарциномы
Инвазивной аденокарциноме присваивается узловая стадия от 0 до 2 в зависимости от того, были ли обнаружены какие-либо раковые клетки в любом из лимфатический узел осмотрели или обнаружение опухолевых отложений. Если ни в одном из исследованных лимфатических узлов не было обнаружено раковых клеток, узловая стадия — N0. Если лимфатические узлы не были отправлены на патологическое исследование, узловая стадия не может быть определена и указывается как NX.
Метастатическая стадия (пМ) инвазивной аденокарциномы
Инвазивной аденокарциноме присваивается метастатическая стадия 0 или 1 в зависимости от наличия раковых клеток в отдаленном месте в организме (например, в печени). Стадия M может быть назначена только в том случае, если ткань из отдаленного участка отправляется на патологическое исследование. Поскольку эта ткань присутствует редко, стадия M не может быть определена и обозначена как X.
Автор: Ипшита Как, доктор медицинских наук, FRCPC (обновлено 22 июля 2021 г.)
Кровеносные сосуды и эндотелиальные клетки — молекулярная биология клетки
Из тканей, происходящих из эмбриональной эктодермы и энтодермы, мы обратимся к тканям, происходящим из мезодермы . Этот средний слой клеток, зажатый между эктодермой и энтодермой, растет и диверсифицируется, обеспечивая широкий спектр поддерживающих функций. Он дает начало соединительным тканям, клеткам крови и кровеносным сосудам, а также мышцам, почкам и многим другим структурам и типам клеток.Начнем с сосудов.
Почти все ткани зависят от кровоснабжения, а кровоснабжение зависит от эндотелиальных клеток, которые образуют оболочки кровеносных сосудов. Эндотелиальные клетки обладают замечательной способностью регулировать свое количество и расположение в соответствии с местными требованиями. Они создают адаптируемую систему жизнеобеспечения, распространяющуюся за счет миграции клеток почти во все области тела. Если бы не эндотелиальные клетки, расширяющие и модифицирующие сеть кровеносных сосудов, рост и восстановление тканей были бы невозможны.Раковая ткань так же зависит от кровоснабжения, как и нормальная ткань, и это привело к всплеску интереса к биологии эндотелиальных клеток. Есть надежда, что, блокируя образование новых кровеносных сосудов с помощью лекарств, действующих на эндотелиальные клетки, можно будет заблокировать рост опухолей (обсуждается в главе 23).
Линия эндотелиальных клеток Все кровеносные сосуды
Самыми крупными кровеносными сосудами являются артерии и вены, которые имеют толстую прочную стенку из соединительной ткани и множество слоев гладкомышечных клеток ().Стенка выстлана чрезвычайно тонким одиночным листом эндотелиальных клеток, эндотелием , отделенным от окружающих внешних слоев базальной пластинкой. Количество соединительной ткани и гладких мышц в стенке сосуда варьируется в зависимости от диаметра и функции сосуда, но эндотелиальная выстилка присутствует всегда. В самых тонких ветвях сосудистого дерева — капиллярах и синусоидах — стенки состоят только из эндотелиальных клеток и базальной пластинки () вместе с несколькими разбросанными, но функционально важными — перицитами .Это клетки семейства соединительно-тканевых, связанных с гладкомышечными клетками сосудов, которые охватывают мелкие сосуды ().
Рисунок 22-22
Поперечное сечение небольшой артерии. Эндотелиальные клетки, хотя и незаметны, являются основным компонентом. Сравните с капилляром на Рисунке 22-23.
Рисунок 22-23
Капилляры. (A) Электронная микрофотография поперечного сечения небольшого капилляра поджелудочной железы. Стенка образована единственной эндотелиальной клеткой, окруженной базальной пластинкой.Обратите внимание на маленькие «трансцитотические» везикулы, которые согласно (подробнее …)
Рисунок 22-24
Перициты. На снимке, полученном с помощью сканирующего электронного микроскопа, видны перициты, оборачивающие свои отростки вокруг небольшого кровеносного сосуда (посткапиллярная венула) в молочной железе кошки. Перициты также присутствуют вокруг капилляров, но гораздо более редко (подробнее …)
Таким образом, эндотелиальные клетки выстилают всю сосудистую систему, от сердца до мельчайших капилляров, и контролируют прохождение материалов — и прохождение белого клетки крови — в кровоток и из него.Более того, исследование эмбриона показывает, что артерии и вены развиваются из мелких сосудов, построенных исключительно из эндотелиальных клеток и базальной пластинки: перициты, соединительная ткань и гладкие мышцы добавляются позже, где это необходимо, под влиянием сигналов от эндотелиальных клеток. Рекрутирование перицитов, в частности, зависит от PDGF-B, секретируемого эндотелиальными клетками, и у мутантов, лишенных этого сигнального белка или его рецептора, перициты во многих областях отсутствуют. В результате в эмбриональных кровеносных сосудах развиваются микроаневризмы — микроскопические патологические дилатации, которые в конечном итоге разрываются, а также другие аномалии, отражающие важность сигналов, передаваемых в обоих направлениях между перицитами и эндотелиальными клетками.
После созревания сосуда сигналы от эндотелиальных клеток к окружающей соединительной ткани и гладкой мускулатуре продолжают играть решающую роль в регулировании функции и структуры сосуда. Например, у эндотелиальных клеток есть механорецепторы, которые позволяют им ощущать напряжение сдвига из-за потока крови по их поверхности; передавая эту информацию окружающим клеткам, они позволяют кровеносному сосуду адаптировать свой диаметр и толщину стенки в соответствии с кровотоком.Эндотелиальные клетки также опосредуют быстрые реакции на нервные сигналы о расширении кровеносных сосудов, высвобождая газ NO, чтобы расслабить гладкие мышцы в стенке сосуда, как описано в главе 15.
Новые эндотелиальные клетки образуются путем простого дублирования существующих эндотелиальных клеток
Во всей сосудистой системе взрослого организма эндотелиальные клетки сохраняют способность к делению и перемещению клеток. Если, например, часть стенки аорты повреждена и лишена эндотелиальных клеток, соседние эндотелиальные клетки пролиферируют и мигрируют внутрь, чтобы покрыть открытую поверхность.
Пролиферацию эндотелиальных клеток можно продемонстрировать, используя 3 H-тимидин для мечения клеток, синтезирующих ДНК. В большинстве взрослых тканей эндотелиальные клетки обновляются очень медленно, при этом время жизни клеток для мышей колеблется от пары месяцев (в печени и легких) до лет (в мозге и мышцах). Но эндотелиальные клетки не только восстанавливают и обновляют выстилку установленных кровеносных сосудов, они также создают новые кровеносные сосуды. Они должны делать это в эмбриональных тканях, чтобы идти в ногу с ростом, в нормальных тканях взрослого человека, чтобы поддерживать повторяющиеся циклы ремоделирования и реконструкции (как, например, в слизистой оболочке матки во время менструального цикла), и в поврежденных тканях взрослого человека для поддержки ремонт.В таких обстоятельствах их можно разбудить, чтобы увеличить время удвоения всего за несколько дней. Есть некоторые свидетельства того, что там, где требуется быстрый рост кровеносных сосудов, местная популяция эндотелиальных клеток также может увеличиваться за счет рекрутирования из кровотока, который, как сообщается, содержит небольшое количество эндотелиальных клеток-предшественников, происходящих из кости. костный мозг.
Новые капилляры образуются путем прорастания
Новые сосуды у взрослых людей образуются как капилляры, которые прорастают из существующих мелких сосудов.Этот процесс ангиогенеза происходит в ответ на специфические сигналы, и его можно удобно наблюдать в естественно прозрачных структурах, таких как роговица глаза. Раздражители, воздействующие на роговицу, вызывают рост новых кровеносных сосудов от края ткани, окружающей роговицу, которая имеет обильное кровоснабжение, к центру роговицы, которая обычно отсутствует. Таким образом, роговица становится васкуляризованной за счет проникновения эндотелиальных клеток в плотную ткань роговицы, упакованную коллагеном.
Наблюдения, подобные этим, показывают, что эндотелиальные клетки, которые должны сформировать новый капилляр, вырастают со стороны существующего капилляра или небольшой венулы за счет удлинения длинных псевдоподий, первыми в формировании капиллярного отростка, который расширяется, образуя трубку () . Этот процесс продолжается до тех пор, пока росток не встретит другой капилляр, с которым он соединяется, позволяя крови циркулировать. Эндотелиальные клетки на артериальной и венозной сторонах развивающейся сети сосудов различаются по своим поверхностным свойствам, по крайней мере, у эмбриона: плазматические мембраны артериальных клеток содержат трансмембранный белок эфрин-B2 (см. Главу 15), а мембраны венозные клетки содержат соответствующий рецепторный белок Eph-B4, который является рецепторной тирозинкиназой (обсуждается в главе 15).Эти молекулы опосредуют сигнал, доставляемый в места межклеточного контакта, и они необходимы для развития правильно организованной сети сосудов. Одно из предположений состоит в том, что они каким-то образом определяют правила соединения одной части растущей капиллярной трубки с другой.
Рисунок 22-25
Ангиогенез. Новый кровеносный капилляр образуется в результате прорастания эндотелиальной клетки из стенки существующего небольшого сосуда. Эта диаграмма основана на наблюдениях за клетками в прозрачном хвосте живого головастика.(По CC Speidel, Am. J. Anat. (подробнее …)
Эксперименты в культуре показывают, что эндотелиальные клетки в среде, содержащей подходящие факторы роста, спонтанно образуют капиллярные трубки, даже если они изолированы от всех других типов клеток (). Развивающиеся капиллярные трубки не содержат крови, и через них ничего не проходит, что указывает на то, что кровоток и давление не требуются для зарождения новой капиллярной сети.
Рисунок 22-26
Формирование капилляров in vitro.Эндотелиальные клетки в культуре спонтанно образуют внутренние вакуоли, которые, кажется, соединяются от клетки к клетке, давая начало сети капиллярных трубок. На этих фотографиях показаны последовательные этапы процесса. Стрелка (подробнее …)
Ангиогенез контролируется факторами, выделяемыми окружающими тканями
Почти каждая клетка почти в каждой ткани позвоночного расположена в пределах 50–100 мкм от капилляра. Какой механизм гарантирует, что система кровеносных сосудов разветвляется во все уголки и щели? Как он так идеально приспособлен к местным потребностям тканей не только во время нормального развития, но и при всевозможных патологических обстоятельствах? Ранение, например, вызывает всплеск роста капилляров в непосредственной близости от повреждения, чтобы удовлетворить высокие метаболические потребности процесса восстановления ().Местные раздражители и инфекции также вызывают разрастание новых капилляров, большинство из которых регрессируют и исчезают, когда воспаление спадает. Менее доброкачественно небольшой образец опухолевой ткани, имплантированный в роговицу, в которой обычно отсутствуют кровеносные сосуды, заставляет кровеносные сосуды быстро расти к имплантату от сосудистого края роговицы; скорость роста опухоли резко увеличивается, как только сосуды достигают ее.
Рисунок 22-27
Новое капиллярное образование в ответ на ранение.Сканирующие электронные микрофотографии слепков системы кровеносных сосудов, окружающих край роговицы, показывают реакцию на ранение. Для изготовления слепков в сосуды вводят смолу и пропускают (подробнее …)
Во всех этих случаях вторгающиеся эндотелиальные клетки реагируют на сигналы, производимые тканью, в которую они вторгаются. Сигналы сложны, но ключевую роль играет белок, известный как сосудистый эндотелиальный фактор роста ( VEGF ), дальний родственник тромбоцитарного фактора роста (PDGF).Регулирование роста кровеносных сосудов в соответствии с потребностями ткани зависит от контроля продукции VEGF за счет изменений стабильности его мРНК и скорости транскрипции. Последний контроль относительно хорошо изучен. Нехватка кислорода практически в любом типе клеток вызывает увеличение внутриклеточной концентрации активной формы генного регуляторного белка, называемого фактором, индуцируемым гипоксией 1 ( HIF-1 ). HIF стимулирует транскрипцию гена VEGF (и других генов, продукты которых необходимы при недостатке кислорода).Белок VEGF секретируется, диффундирует через ткань и действует на близлежащие эндотелиальные клетки.
Ответ эндотелиальных клеток включает по крайней мере четыре компонента. Во-первых, клетки продуцируют протеазы, чтобы переварить их через базальную пластинку родительского капилляра или венулы. Во-вторых, эндотелиальные клетки мигрируют к источнику сигнала. В-третьих, клетки размножаются. В-четвертых, клетки образуют трубочки и дифференцируются. VEGF избирательно действует на эндотелиальные клетки, стимулируя весь этот набор эффектов.(Другие факторы роста, в том числе некоторые члены семейства факторов роста фибробластов, также могут стимулировать ангиогенез, но они влияют на другие типы клеток, помимо эндотелиальных.)
По мере образования новых сосудов, доставляющих кровь в ткань, концентрация кислорода повышается, Снижается активность HIF-1, прекращается производство VEGF и прекращается ангиогенез (). Как и во всех системах сигнализации, важно не только правильно выключить сигнал, но и включить его. В нормальной хорошо насыщенной кислородом ткани концентрация HIF-1 поддерживается на низком уровне за счет постоянной деградации белка HIF-1.Эта деградация зависит от убиквитилирования HIF-1 — процесса, который требует продукта другого гена, который является дефектным при редком заболевании, называемом синдром фон Хиппеля-Линдау (VHL) . Люди с этим заболеванием рождаются только с одной функциональной копией гена VHL ; мутации, происходящие в организме случайным образом, затем приводят к образованию клеток, в которых обе копии гена являются дефектными. Эти клетки содержат большое количество HIF-1 независимо от наличия кислорода, вызывая постоянное перепроизводство VEGF.Результатом является развитие гемангиобластом , опухолей, содержащих плотные массы кровеносных сосудов. Мутантные клетки, продуцирующие VEGF, по-видимому, сами стимулируются к размножению из-за чрезмерного питания, обеспечиваемого избыточными кровеносными сосудами, создавая порочный круг, который способствует росту опухоли. Потеря продукта гена VHL также приводит к возникновению других опухолей, а также гемангиобластом по механизмам, которые могут быть независимыми от эффектов на ангиогенез.
Рисунок 22-28
Регуляторный механизм, контролирующий рост кровеносных сосудов в соответствии с потребностью ткани в кислороде.Недостаток кислорода вызывает секрецию VEGF, который стимулирует ангиогенез.
Резюме
Эндотелиальные клетки образуют единый клеточный слой, выстилающий все кровеносные сосуды и регулирующий обмен между кровотоком и окружающими тканями. Сигналы от эндотелиальных клеток организуют рост и развитие клеток соединительной ткани, которые образуют окружающие слои стенки кровеносных сосудов. Новые кровеносные сосуды могут развиваться из стенок существующих мелких сосудов за счет роста эндотелиальных клеток, которые способны образовывать полые капиллярные трубки, даже будучи изолированными в культуре.Эндотелиальные клетки развивающихся артерий и вен экспрессируют различные белки клеточной поверхности, которые могут контролировать то, как они соединяются, чтобы создать капиллярное ложе.
Гомеостатический механизм обеспечивает проникновение кровеносных сосудов во все области тела. Клетки, которым не хватает кислорода, увеличивают концентрацию индуцируемого гипоксией фактора 1 (HIF-1), который стимулирует выработку фактора роста эндотелия сосудов (VEGF). VEGF действует на эндотелиальные клетки, заставляя их размножаться и вторгаться в гипоксическую ткань, снабжая ее новыми кровеносными сосудами.
Стенка артерии — обзор
7.6.1 Модели кровотока при стенозе
Атеросклероз — это хронический воспалительный процесс в стенках артерий, приводящий к их утолщению и образованию бляшек. Атеросклеротическая бляшка состоит из пула липидов и фиброзного колпачка, встроенного в стенку пораженного сосуда. Вследствие образования бляшек просвет сосудов сужается и возникает стеноз. Последнее может вызвать резкое снижение кровотока в нижележащей части сосудистой сети либо из-за значительной окклюзии, либо из-за разрыва бляшки и связанного с ней образования сгустка и эмболизации.Тромбы, образующиеся в мозговом кровообращении, могут спровоцировать инсульт. Атеросклероз коронарных артерий вызывает недостаток кислорода в сердечной ткани, за которым следует ишемия, инфаркт миокарда, аритмия и фибрилляция. Это одна из основных причин смертности и заболеваемости.
Атеросклероз — сложное заболевание, включающее различные клеточные процессы, гемодинамические эффекты и биомеханику стенки сосуда. Модели упрощенного порядка могут имитировать нарушение кровообращения, вызванное стенозом сосудов.Обзор моделей проточного стеноза с сосредоточенным отделением (0D) можно найти в работе Ref. [306]. 0D-модель — это система ODE, происходящая из модели упругого резервуара с кровью или из ее аналогов электрических цепей, обсуждаемых в главе 6. Пример из работы. [269] такой системы ODE для потока в сосудистом отделе является следующая система:
(7,62) Cedpˆdt = qin − qout,
(7,63) Ledqˆdt + Reqˆ = pin − pout,
, где C e , L e и R e — емкость, индуктивность и сопротивление отсека электрической цепи; q in , q out , p in и p out — расход и давление на входе и выходе элемент; а pˆ, qˆ — усредненные давление и расход в сосредоточенном элементе.Если A 0 , A s , l 0 и l s обозначают площади поперечного сечения и длину нестенотических и стенозированных сосудов соответственно. стенозированной области со степенью α = As / A0 следует обновить:
Rs = Reα − 2, Cs = Ceα3 / 2, Ls = Leα − 1.
Физиологическое воздействие стеноза — это падение давления Δp в стенозированной области, что приводит к снижению скорости кровотока. Q .Эмпирические зависимости Δp от Q могут быть разными:
Δp = 288ρ2ReAs2Q2, [310] Δp = (R1 + R2) Q + (K1 + K2) Q2, [312] Δp = Kυμ2πR3Q + Ktρ2A02) (A0QAs | Q | + KuρlsA0dQdt, [222,311] dpdx = (8ρQ2B1B2π2R5) dRdx − 60μQB3πR4, [313]
, где Re — число Рейнольдса, R 12 1 9011 9011 9011 9011 9011 9011 9011 1 , K 2 , B 1 , B 2 , B 3 , K v , 12 K 9011 901 и K u — константы, а R — диаметр сосуда.Падение давления на стенозе с нерегулярной геометрической структурой требует более детальных двухуровневых 1D – 3D моделей, таких как модели, представленные в работах. [271, 311] [271] [311], хотя асимметричный просвет не дает заметной разницы в перепаде давления, как указано в ссылках. [312 313] [312] [313]. Если стеноз рассматривается как узел одномерного сосудистого графа, эти соотношения для Δp можно использовать как часть граничных условий в одномерной гемодинамической модели вместо формул. (7.17), (7.18) или (7.19).
Стенозы могут быть учтены с помощью одномерной гемодинамической модели двумя способами.Во-первых, стеноз степени α может быть включен в здоровую сосудистую сеть в виде трубчатого сегмента с измененной площадью поперечного сечения As = αA0 и длиной Ls. На входе и выходе из этого сегмента к граничным условиям добавляется условие падения давления Пуазейля Δp = RsQ с гидравлическим сопротивлением Rs∼α − 2, как это было сделано в работах [1,96]. [242 314 315] [242] [314] [315]. Во-вторых, наличие стеноза может изменить определяющее соотношение (7.44) для здорового сосуда за счет локального увеличения жесткости стенки сосуда.
Более продвинутый подход — восстановить функцию f из уравнения. (7.44) для здоровых и стенозированных сосудов, как было предложено в [8,44]. [316 317] [316] [317]. Восстановление функции f основано на представлении стенки сосуда концентрическими упругими оболочками. Предполагается, что сосуд цилиндрический, а бляшка осесимметричная, однородная и протяженная; следовательно, деформация в осевом направлении незначительна. Неоднородное распределение волокон коллагена и эластина в здоровой стенке сосуда (см. Главу 2) приводит к нелинейному (например,g., neo-Hookean) эластичный ответ на нагрузку артериальным давлением. Состояние равновесия для такой тонкой стенки (со средним радиусом R и толщиной H ), состоящей из неогуковского материала с постоянной материала μ и надутой внутренним давлением p 0 , дает нелинейное уравнение для главного радиальное растяжение λr, полученное в работе. [317]:
μ (λr − 2 − λr2) = p0 / (λrH) (R / λr − λrH / 2).
Это уравнение неявно определяет функцию f , поскольку оно связывает давление и площадь просвета.
Поскольку атеросклеротическая стенка состоит из трех слоев, она может быть представлена трехслойной круглой цилиндрической оболочкой, надутой внутренним давлением p 0 . Внутренний (стенка сосуда) и внешний слои (фиброзная крышка) представлены тонкостенными цилиндрическими оболочками. Средний слой представляет собой толстостенный цилиндр, который представляет собой липидный пул. Условия статического равновесия позволяют авторам [316,317] [316] [317] вычислить площадь просвета при заданном кровяном давлении p 0 для изотропных несжимаемых линейных эластичных материалов (гука) [316] или несжимаемых нелинейных материалов [317] стенки сосуда, липидного пула и фиброзной капсулы.На рис. 7.7 мы сравниваем функции p 0 ( S / S 0 ) для атеросклеротического сосуда с длинной осесимметричной бляшкой и просветом 10%. Поскольку S 0 обозначает площадь просвета здоровой артерии, нулевое трансмуральное давление соответствует S / S 0 = 0,1. Параметры задачи статического равновесия устанавливаются в соответствии со свойствами общей сонной артерии. Существенная разница в давлениях наблюдается при трансмуральном давлении выше 4 кПа, а также при отрицательном трансмуральном давлении.Нелинейные материалы демонстрируют более высокую чувствительность к трансмуральному давлению раздувания и более высокое удельное сопротивление к понижающему трансмуральному давлению.
Рисунок 7.7. Сравнение определяющих соотношений для материалов Гука и нео-Гука для атеросклеротической общей сонной артерии.
Автор: Ю. Василевский, С. Симаков, В. Саламатова, Ю. Иванов, Т. Добросердова, Модели стенок сосудов для моделирования атеросклеротических сосудистых сетей, Матем. Модель. Nat. Феном. 6 (7) (2011), 82–99.Вывод определяющего соотношения при несимметричности сосуда и бляшки основан на численных методах.Например, следуя Ref. [318], упругий отклик стенки трубки может быть вычислен из ее представления с помощью наборов осевых волокон, кольцевых волокон и спиральных волокон, а также вычисления реакции сбора волокон на деформацию. Реакцию атеросклеротического сосуда на раздувание можно вычислить, представив фиброзный колпачок и артериальную стенку набором линейных эластичных колец, а липидный пул — набором радиальных пружин. Реакция пружин определяется аналитически известными радиальными перемещениями несжимаемой линейной изотропной цилиндрической оболочки при приложении внешнего и внутреннего давления.Две концентрические сетки кольцевых волокон представляют собой внешний (артерия) и внутренний (фиброзный покров) слои. Эти слои и уравновешивающие силы, приложенные к этим слоям в каждой точке сетки, приводят к системе дискретных нелинейных уравнений, которые необходимо решить методом Ньютона. Для всех возможных давлений и бляшек, наблюдаемых в общей сонной артерии, такая численная модель показана в работе. [316], чтобы обеспечить ошибку для смещений менее 2% по сравнению с полуаналитическим решением, известным для осесимметричной геометрии, как показано.
Менее изучен случай нескольких последовательных стенозов. Нарушение кровообращения, вызванное последовательными стенозами, рассматривается в работах [3]. [319–322] [319] [320] [321] [322].
Стенка кровеносного сосуда — обзор
Сосудистые и нервные изменения
Повышенная площадь кровеносных сосудов стенки дыхательных путей была продемонстрирована при астме у взрослых и детей и больше, чем у контрольной группы или субъектов с ХОБЛ [180, 183, 204]. Однако неясно, происходит ли это ремоделирование сосудов в первую очередь из-за образования новых кровеносных сосудов [205] или из-за увеличения существующей микрососудистой сети.Исследование перепончатых бронхиол у пациентов с астмой и ХОБЛ позволило предположить последнее [183]. Действительно, известно, что астма со смертельным исходом связана с расширением кровеносных сосудов слизистой оболочки бронхов, застоем и отеком стенок [206]. Однако Ли и Уилсон [207] обнаружили изменения, указывающие на образование новых сосудов при легкой форме астмы, и было показано, что микросреда при астме обладает потенциалом для ангиогенеза.
Медиаторы, такие как гистамин, гепарин и триптаза, обладают ангиогенными свойствами, в то время как экспрессия фактора роста эндотелия сосудов (VEGF), мощного фактора роста сосудов, активируется такими агентами, как TGF-β, TNF-α и TGF- α, которые вовлечены в воспалительную среду астматических дыхательных путей.Особое значение имеет VEGF, который высвобождается из эпителиальных клеток, а также из широкого спектра воспалительных клеток, включая тучные клетки. Проангиогенная функция растворимого ADAM33 также имеет значение.
Имеются данные об увеличении количества нейронных сетей дыхательных путей при тяжелой астме. Скорее всего, это следствие высвобождения фактора роста нервов (и связанных с ним нейротрофинов) эпителиальными и воспалительными клетками. Уровни циркулирующего NGF сильно связаны [208] с тяжестью астмы и могут оказаться полезным биомаркером этого более тяжелого фенотипа [209].Кроме того, как при астме, так и при ХОБЛ нарушенный эпителиальный барьер позволяет в большей степени подвергать нервные окончания воздействию раздражителей окружающей среды. Таким образом, увеличивается потенциал высвобождения нейротрансмиттеров, таких как тахикинины, субстанция P и нейрокинин A. Эти агенты, помимо их воздействия на гомеостаз сосудов и гладких мышц, могут способствовать локальному воспалению с привлечением и активацией воспалительных клеток. Нейрогенное воспаление — это один из способов, которым сенсорная информация, полученная из вдыхаемой среды, может способствовать продолжающемуся воспалению, хотя это было трудно доказать при астме или ХОБЛ, но легко показать на животных моделях воспаления дыхательных путей [210].
18.1A: Структура кровеносных сосудов — Медицина LibreTexts
Кровеносные сосуды — это гибкие трубки, по которым кровь, связанный с ней кислород, питательные вещества, вода и гормоны проходят по всему телу.
Задачи обучения
- Различать структуры артерий, вен и капилляров
Ключевые моменты
- Кровеносные сосуды состоят из артерий, артериол, капилляров, венул и вен. Сети сосудов направленно и регулируемо доставляют кровь ко всем тканям.
- Артерии и вены состоят из трех слоев ткани.
- Самый толстый внешний слой сосуда (адвентициальная оболочка или внешняя оболочка) состоит из соединительной ткани.
- Средний слой (tunica media) толще и содержит больше сократительной ткани в артериях, чем в венах. Он состоит из расположенных по кругу эластичных волокон, соединительной ткани и гладкомышечных клеток.
- Внутренний слой (tunica intima) — самый тонкий слой, состоящий из одного слоя эндотелия, поддерживаемого субэндотелиальным слоем.
- Капилляры состоят из единственного слоя эндотелия и связанной соединительной ткани.
Ключевые термины
- tunica intima : Самый внутренний слой кровеносного сосуда.
- tunica externa : Самый внешний слой кровеносного сосуда.
- капилляр : Любой из мелких кровеносных сосудов, соединяющих артерии с венами.
- tunica media : Средний слой кровеносного сосуда.
- анастомоз : соединение между кровеносными сосудами.
Кровеносные сосуды — ключевые компоненты системного и легочного кровообращения, которые распределяют кровь по всему телу. Есть три основных типа кровеносных сосудов: артерии, которые несут кровь от сердца, разветвляются на более мелкие артериолы по всему телу и в конечном итоге образуют капиллярную сеть. Последний способствует эффективному химическому обмену между тканью и кровью. Капилляры, в свою очередь, сливаются в венулы, а затем в более крупные вены, ответственные за возврат крови к сердцу.Стыки между сосудами называются анастомозами.
Артерии и вены состоят из трех отдельных слоев, в то время как капилляры гораздо меньшего размера состоят из одного слоя.
Туника Intima
Внутренний слой (tunica intima) — самый тонкий слой, сформированный из единого непрерывного слоя эндотелиальных клеток и поддерживаемый субэндотелиальным слоем соединительной ткани и поддерживающих клеток. В более мелких артериолах или венулах этот субэндотелиальный слой состоит из одного слоя клеток, но может быть намного толще в более крупных сосудах, таких как аорта.Внутренняя оболочка окружена тонкой мембраной, состоящей из эластичных волокон, идущих параллельно сосуду. Капилляры состоят только из тонкого эндотелиального слоя клеток с связанным тонким слоем соединительной ткани.
Tunica Media
Внутреннюю оболочку окружает средняя оболочка, состоящая из гладкомышечных клеток, эластичных и соединительных тканей, расположенных по кругу вокруг сосуда. В артериях этот слой намного толще, чем в венах. Состав волокон также различается; вены содержат меньше эластичных волокон и контролируют калибр артерий, что является ключевым моментом в поддержании артериального давления.
Туника Экстерна
Самый внешний слой — это внешняя оболочка или адвентициальная оболочка, полностью состоящая из соединительных волокон и окруженная внешней эластичной пластиной, которая служит якорем для сосудов с окружающими тканями. Наружная оболочка часто бывает толще в венах, чтобы предотвратить коллапс кровеносного сосуда и обеспечить защиту от повреждений, поскольку вены могут располагаться поверхностно.
Структура стенки артерии : На этой схеме стенки артерии показаны гладкие мышцы, внешняя эластическая мембрана, эндотелий, внутренняя эластическая мембрана, внешняя оболочка, средняя оболочка и внутренняя оболочка.
Функция клапана
Основное структурное различие между артериями и венами — наличие клапанов. В артериях кровь перекачивается под давлением сердца, поэтому обратный ток не может возникнуть. Однако прохождение через капиллярную сеть приводит к снижению артериального давления, а это означает, что обратный ток крови возможен в венах. Чтобы противодействовать этому, в венах имеется множество однонаправленных клапанов, предотвращающих обратный ток.
жил | кровеносный сосуд | Британника
вена , в физиологии человека, любой из сосудов, которые, за четырьмя исключениями, переносят обедненную кислородом кровь в правую верхнюю камеру (предсердие) сердца.Четыре исключения — легочные вены — транспортируют насыщенную кислородом кровь из легких в левую верхнюю камеру сердца. Обедненная кислородом кровь, транспортируемая по большинству вен, собирается из сетей микроскопических сосудов, называемых капиллярами, венами размером с нитку, называемыми венулами.
Как и в артериях, стенки вен имеют три слоя, или оболочки: внутренний слой, или tunica intima; средний слой, или оболочка media; и внешний слой, или адвентициальная оболочка. Каждое пальто имеет несколько подслоев.Внутренняя оболочка артерии отличается от внутреннего слоя артерии: многие вены, особенно на руках и ногах, имеют клапаны, предотвращающие обратный ток крови, а эластичная мембрана, выстилающая артерию, отсутствует в вене, состоящей в основном из эндотелия и скудных тканей. соединительная ткань. Среда оболочки, которая в артерии состоит из мышечных и эластических волокон, тоньше в вене и содержит меньше мышечной и эластической ткани и пропорционально больше коллагеновых волокон (коллаген, волокнистый белок, является основным поддерживающим элементом в соединительной ткани) .Внешний слой (адвентициальная оболочка) состоит в основном из соединительной ткани и является самым толстым слоем вены. Как и в артериях, есть крошечные сосуды, называемые vasa vasorum, которые снабжают кровью стенки вен и другие мелкие сосуды, которые уносят кровь. Вены более многочисленны, чем артерии, и имеют более тонкие стенки из-за более низкого кровяного давления. Они имеют тенденцию проходить параллельно артериям. См. Также артерия; капиллярный.
Британская викторина
Человеческое тело
Возможно, вы знаете, что человеческий мозг состоит из двух половин, но какая часть человеческого тела состоит из крови? Проверьте обе половины своего разума в этой викторине по анатомии человека.
Эта статья была недавно отредактирована и обновлена Кара Роджерс.капилляров | анатомия | Британника
капилляр , в физиологии человека любой из мельчайших кровеносных сосудов, которые образуют сети в тканях тела; именно через капилляры происходит обмен кислородом, питательными веществами и отходами между кровью и тканями. Капиллярные сети являются конечным пунктом назначения артериальной крови из сердца и отправной точкой для потока венозной крови обратно к сердцу.Между мельчайшими артериями или артериолами и капиллярами находятся промежуточные сосуды, называемые прекапиллярами или метартериолами, которые, в отличие от капилляров, имеют мышечные волокна, позволяющие им сокращаться; таким образом, прекапилляры могут контролировать опорожнение и наполнение капилляров.
Капилляры имеют диаметр примерно от 8 до 10 микрон (микрон составляет 0,001 мм), что достаточно для того, чтобы красные кровяные тельца могли проходить через них единым целым. Единственный слой клеток, образующих их стенки, — это эндотелиальные клетки, подобные тем, которые образуют гладкую поверхность каналов более крупных сосудов.
капилляр легкихЦветная электронная сканирующая микрофотография кровеносных сосудов в легком.
Библиотека научных фотографий / штампБританская викторина
Человеческое тело: факт или вымысел?
Насколько глубоки ваши знания о внутреннем устройстве людей? Проверьте это с помощью этой викторины.
Сети капилляров имеют ячейки разного размера. В легких и сосудистой оболочке — средней оболочке глазного яблока — промежутки между капиллярами меньше, чем сами сосуды, в то время как во внешней оболочке артерий — адвентициальной оболочке — межкапиллярные пространства примерно в 10 раз больше, чем диаметр сосудов. капилляры. В целом межкапиллярные промежутки меньше в растущих частях, в железах и слизистых оболочках; крупнее в костях и связках; и почти отсутствует в сухожилиях.
Наименьшие сосуды лимфатической системы также называются капиллярами, так же как и мельчайшие каналы для желчи в печени. См. Также артерия; вена.
Последний раз редактировал и обновлял эту статью Ричард Палларди.Кровеносных сосудов
Сосуды как артериальной, так и венозной системы классифицируются на основе их размера, а также по характеру и количеству тканей, из которых состоят их оболочки. Вы должны уметь различать артерии и вены и распознавать капилляры.Помните, что эритроциты часто видны в просвете кровеносных сосудов, однако они не будут присутствовать в каждом просвете из-за подготовки слайдов. Не полагайтесь на эритроциты при определении кровеносных сосудов.
Более крупные сосуды имеют общий структурный план, состоящий из трех концентрических покрытий или туник. Это:
- Туника интима . Он состоит из эндотелиальной выстилки и ее базальной мембраны, а также тонкого слоя рыхлой субэндотелиальной соединительной ткани.Эндотелиальная выстилка является диагностической для различения кровеносных сосудов. Ядра простых клеток плоского эпителия эндотелия выступают в просвет сосуда. В артериях и артериолах внутренняя эластическая пластинка ограничивает внешний край внутренней оболочки оболочки.
- Туника СМИ . Этот слой состоит преимущественно из гладких мышц волокон, расположенных по кругу, и может быть различное количество ретикулярных и эластичных волокон.
- Адвентициальная туника . Эта оболочка состоит преимущественно из фиброэластичной соединительной ткани, волокна которой обычно расположены в продольном ряду. В более крупных мышечных артериях часто имеется внешняя эластическая мембрана , отделяющая адвентициальную оболочку от средней оболочки.
ОТЛИЧИТЕЛЬНЫЕ ХАРАКТЕРИСТИКИ
# Артерии имеют внутреннюю эластическую мембрану, которая всегда присутствует (хотя она менее характерна для крупных эластичных артерий).Медиа-оболочка — самая толстая туника. Он преимущественно мышечный в артериолах и большинстве артерий, но он преимущественно эластичен в крупнейших артериях (так называемые эластичные артерии , , такие как аорта и общая сонная артерия). Адвентициальная оболочка относительно тонкая.
- Вены не имеют внутренней эластичной мембраны. Среда туники относительно тонкая. Адвентициальная оболочка — наиболее толстая оболочка без внешней эластичной оболочки.
Артерия и вена часто сливаются, что упрощает их сравнение. Полезное обобщение состоит в том, что артерия имеет относительно толстую стенку и небольшой просвет, тогда как вена имеет относительно тонкую стенку и широкий просвет.
# Артериолы и мелкие артерии демонстрируют характерное расположение эндотелиальных клеток и гладкомышечных волокон в своих стенках. Эндотелиальные клетки ориентированы продольно, тогда как гладкие мышечные волокна в прилегающей средней оболочке обернуты вокруг этих сосудов по кругу.Это приводит к регулярному паттерну ядерной ориентации, отсутствующему в венозных сосудах. Артериола обычно имеет только один слой гладкой мускулатуры и не более двух.
# Капилляры — сосуды, которые проще всего определить (но не найти). Они состоят из эндотелиального слоя и лежащей под ним базальной пластинки. Также может быть ассоциированный перицит в базальной пластинке эндотелиальной клетки. Они классифицируются на основе их «неплотности» как непрерывные (например.g., мышцы, центральная нервная система, легкие), фенестрированные (например, эндокринные железы, кишечник, желчный пузырь) и прерывистые или синусоидальные (например, селезенка, костный мозг, печень).
Используйте электронные микрофотографии, чтобы сравнить структуру различных типов капилляров.
.

