Какие мышцы состоят из преимущественно быстрых двигательных единиц: Типы двигательных единиц
Типы двигательных единиц
С функциональной точки зрения мышца состоит из ДЕ. Двигательная единица (ДЕ) — это понятие структурно-функциональное. В состав отдельной ДЕ входит мотонейрон и иннервируемый его аксоном комплекс мышечных волокон. Мышечные волокна, объединенные в одну ДЕ, разбросаны среди других мышечных волокон, принадлежащих другим ДЕ, и изолированы от последних. Отдельные мышцы включают в себя разное количество ДЕ.
В зависимости от морфологических особенностей мотонейрона и мышечных волокон, ДЕ подразделяются на малые, средние и большие.
Малая
ДЕ состоит из нескольких мышечных волокон
и небольшого по размеру мотонейрона с
тонким аксоном — до 5 — 7 мкм и небольшим
количеством аксонных ветвлений. ДЕ этой
группы характерны для мелких мышц кисти,
предплечья, мимической и глазодвигательной
мускулатуры.
Большие ДЕ состоят из крупных мотонейронов с толстым (до 15 мкм) аксоном, и значительного числа (до нескольких тысяч) мышечных волокон. Они составляют основную долю среди ДЕ крупных мышц.
Средние, по размеру, ДЕ занимают промежуточное положение.
В целом, чем крупнее мышца и чем меньше разработаны движения, в которых она участвует, тем меньшим числом ДЕ она представлена и тем крупнее ДЕ, ее составляющие.
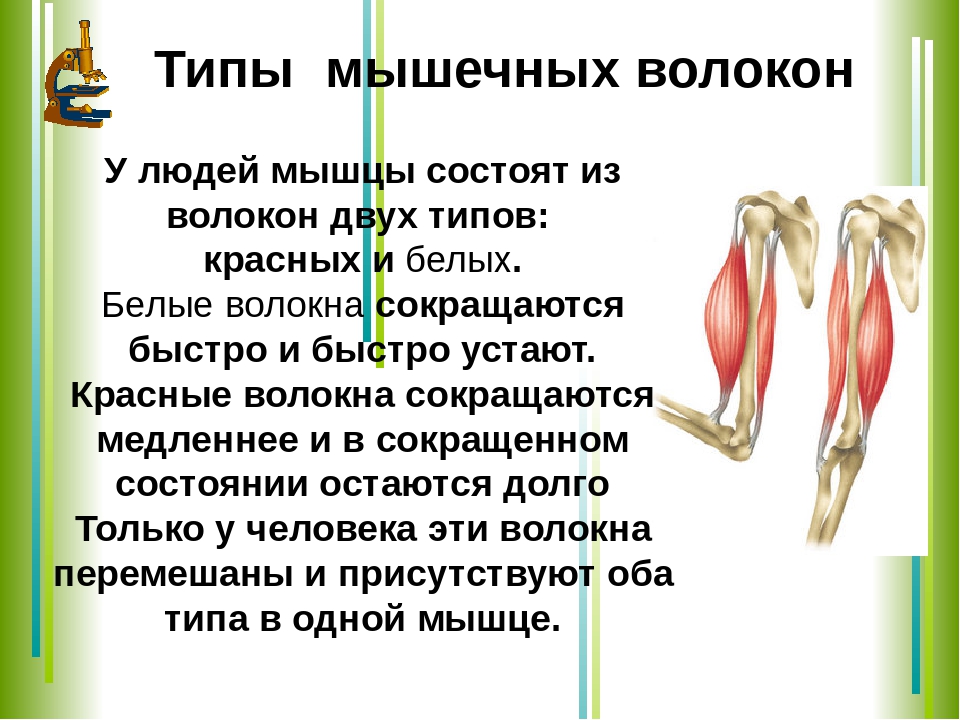
Но вот еще один важный момент. Оказывается, волокна в каждой мышце бывают двух типов – быстрые и медленные.
Медленно сокращающиеся волокна еще называют красными, потому что в них находится много красного мышечного пигмента миоглобина. Эти волокна отличаются хорошей выносливостью.
Быстрые
волокна, по сравнению с красными волокнами,
обладают небольшим содержанием
миоглобина, поэтому их называют белыми
волокнами. Они отличаются высокой
скоростью сокращений и позволяют
развивать большую силу.
Они отличаются высокой
скоростью сокращений и позволяют
развивать большую силу.
Да вы и сами видели такие волокна у курицы – ножки красные, грудка белая, Воот! Это оно самое и есть, только у человека эти волокна перемешаны и присутствуют оба типа в одной мышце.
Красные (медленные) волокна используют аэробный (с участием кислорода) путь получения энергии, поэтому к ним подходит больше капилляров, для лучшего снабжения их кислородом. Благодаря такому вот способу преобразования энергии, красные волокна являются низко утомляемыми и способны поддерживать относительно небольшое, но длительное напряжение. В основном, именно они важны для бегунов на длинные дистанции, и в других видах спорта, где требуется выносливость. Значит, и для всех желающих похудеть они имеют так же решающую роль.
 Но за высокую скорость получения энергии
белым волокнам приходится платить
быстрой утомляемостью, так как гликолиз
приводит к образованию молочной кислоты,
а ее накопление вызывает усталость
мышц и в итоге останавливает их работу.
Ну и, конечно же, без белых волокон ну
никак не могут обойтись метатели,
штангисты, бегуны на короткие дистанции…..
в общем те, кому требуются сила и скорость.
Но за высокую скорость получения энергии
белым волокнам приходится платить
быстрой утомляемостью, так как гликолиз
приводит к образованию молочной кислоты,
а ее накопление вызывает усталость
мышц и в итоге останавливает их работу.
Ну и, конечно же, без белых волокон ну
никак не могут обойтись метатели,
штангисты, бегуны на короткие дистанции…..
в общем те, кому требуются сила и скорость.Теперь придется вас немного запутать, просто потому, что по-другому ну никак не получается. Дело в том, что существует еще один, промежуточный тип волокон, который так же относиться к белым волокнам, но использует как и красные, преимущественно аэробный путь получения энергии и совмещает в себе свойства белых и красных волокон. Еще раз напомню, он относится к белым волокнам.
В
среднем человек имеет примерно 40%
медленных (красных) и 60 % быстрых (белых)
волокон. Но это средняя величина по всей
скелетной мускулатуре, что-то наподобие
средней температуры по больнице.
На самом деле, мышцы выполняют различные функции и поэтому могут значительно отличаться друг от друга составом волокон. Ну, например, мышцы, выполняющие большую статическую работу (камбаловидная, она же икроножная мышца), часто обладают большим количеством медленных волокон, а мышцы, совершающие в основном динамические движения (бицепс), имеют большое количество быстрых волокон.
Интересно то, что соотношение быстрых и медленных волокон у нас неизменно, не зависит от тренированности и определяется на генетическом уровне. Именно поэтому существует предрасположенность к тем или иным видам спорта.
Теперь давайте-ка посмотрим, как же все это работает.
 Если еще увеличивать нагрузку, то в
работу включатся так же быстрые
окислительные волокна (помните
промежуточные?). При нагрузке достигающей
20%-25% от максимальной, например, во время
подъема в гору или финального рывка,
уже и силы окислительных волокон
становится недостаточно, и вот тут как
раз включатся в работу быстрые —
гликолитические волокна. Как уже
говорилось, быстрые волокна значительно
повышают силу сокращения мышцы, но, так
же быстро и утомляются, и поэтому в
работу будет вовлекаться все большее
их количество. В итоге, если уровень
нагрузки не уменьшится, движение в
скором времени придется остановить
из-за усталости.
Если еще увеличивать нагрузку, то в
работу включатся так же быстрые
окислительные волокна (помните
промежуточные?). При нагрузке достигающей
20%-25% от максимальной, например, во время
подъема в гору или финального рывка,
уже и силы окислительных волокон
становится недостаточно, и вот тут как
раз включатся в работу быстрые —
гликолитические волокна. Как уже
говорилось, быстрые волокна значительно
повышают силу сокращения мышцы, но, так
же быстро и утомляются, и поэтому в
работу будет вовлекаться все большее
их количество. В итоге, если уровень
нагрузки не уменьшится, движение в
скором времени придется остановить
из-за усталости.Вот и получается, что при длительной нагрузке в умеренном темпе, работают в основном медленные (красные) волокна и именно благодаря их аэробному способу получения энергии и сжигаются жиры в нашем организме.
Вот
вам и ответ на вопрос, почему мы худеем
на беговой дорожке и практически не
худеем при занятиях на тренажерах.
Вообще, мышцы — самый экономичный в мире двигатель. Растут и увеличивают свою силу, мышцы исключительно за счет увеличения толщины мышечных волокон, количество же мышечных волокон не увеличивается. Поэтому, самый последний заморыш и Геракл по числу мышечных волокон не имеют друг перед другом никакого преимущества. Кстати, процесс увеличения толщины мышечных волокон называется гипертрофия, а уменьшения — атрофия.
При тренировках, имеющих целью увеличение силы, мышцы прибавляются в объеме значительно больше, чем при тренировках на выносливость, потому что сила зависит от поперечного сечения мышечных волокон, а выносливость — от добавочного количества капилляров, окружающих эти волокна. Соответственно, чем больше капилляров, тем больше кислорода с кровью будет доставлено к работающим мышам.
В
соответствии с делением мышечных волокон
и мотонейронов на медленные и быстрые
принято выделять три типа ДЕ.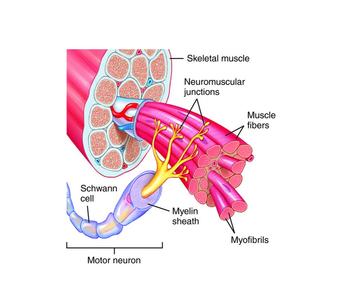
Медленные, неутомляемые двигательные единицы (ДЕ I)
мотонейронов малого размера, имеющих низкий порог возбудимости, высокое
входное сопротивление. При деполяризации мелких нейронов возникает продолжительный разряд с незначительной адаптацией. Мотонейроны с такими свойствами называются тоническими. Небольшой диаметр аксона (до 5 -7 мкм) объясняет и невысокую, по сравнению с более толстыми, скорость проведения возбуждения. Мышечные волокна, входящие в ДЕ этого типа, относятся к красным волокнам (тип I), имеющим наименьший диаметр, скорость их сокращения минимальна, максимальное напряжение слабее, чем белых волокон (тип II), они характеризуются малой утомляемостью.
Быстрые, легко утомляемые двигательные единицы (тип ДЕ II В
 к.
происходит быстрая адаптация. Крупные
мотонейроны относятся к нейронам
фазического типа. Входящие в эти ДЕ
мышечные волокна относятся ко II типу
(белые волокна). Они способны развивать
значительное напряжение, но быстро
утомляются. Как правило, ДЕ этого типа
содержат большое число мышечных волокон
(большие ДЕ). Гладкий тетанус в них
наблюдается при высокой частоте
импульсации (порядка 50 имп/с), в отличие
от ДЕ I, где это достигается при частоте
до 20 имп/с.
к.
происходит быстрая адаптация. Крупные
мотонейроны относятся к нейронам
фазического типа. Входящие в эти ДЕ
мышечные волокна относятся ко II типу
(белые волокна). Они способны развивать
значительное напряжение, но быстро
утомляются. Как правило, ДЕ этого типа
содержат большое число мышечных волокон
(большие ДЕ). Гладкий тетанус в них
наблюдается при высокой частоте
импульсации (порядка 50 имп/с), в отличие
от ДЕ I, где это достигается при частоте
до 20 имп/с.Третий тип двигательных единиц — тип ДЕ II-A относится к промежуточному типу. В их состав входят как быстрые, так и медленные мышечные волокна. Мотонейроны — среднего калибра.
Скелетные
мышцы, в зависимости от их функциональных
особенностей, состоят из различного
набора двигательных единиц. Тип ДЕ
формируется в процессе онтогенеза и в
зрелой мышце соотношение быстрых и
медленных ДЕ уже не меняется. Как уже
указывалось, в целой мышце мышечные
волокна одной ДЕ перемежаются с волокнами
нескольких других ДЕ. Перекрытие зон
ДЕ обеспечивает, как считается, плавность
сокращения мышцы, даже если каждая
отдельная ДЕ не достигает состояния
гладкого тетануса.
Перекрытие зон
ДЕ обеспечивает, как считается, плавность
сокращения мышцы, даже если каждая
отдельная ДЕ не достигает состояния
гладкого тетануса.
При выполнении мышечной работы нарастающей мощности, в активность всегда вначале включаются медленные двигательные единицы, которые развивают слабое, но тонко градуированное напряжение. Для выполнения значительных усилий, к первым подключаются крупные, сильные, но быстроутомляемые ДЕ второго типа.
16
6.2.2 Классификация двигательных единиц
По морфофункциональным свойствам двигательные единицы делятся на 3 типа:
1. Медленные
неутомляемые ДЕ. Мотонейроны имеют наиболее низкий порог
активации, способны поддерживать
устойчивую частоту разрядов в течение
десятков минут (т.е. неутомляемы). Аксоны
обладают небольшой толщиной, низкой
скоростью проведения возбуждения,
иннервируют небольшую группу мышечных
волокон. Мышечные волокна развивают
небольшую силу при сокращении в связи
с наличием в них наименьшего количества
сократительных белков – миофибрилл.
Это так называемые «красные волокна»
(цвет обусловлен хорошим развитием
капиллярной сети и небольшим количеством
миофибрилл). Скорость сокращения этих
волокон в 1,5 – 2 раза меньше, чем быстрых.
Они неутомляемы благодаря хорошо
развитой капиллярной сети, большому
количеству митохондрий и высокой
активности окислительных ферментов.
Мышечные волокна развивают
небольшую силу при сокращении в связи
с наличием в них наименьшего количества
сократительных белков – миофибрилл.
Это так называемые «красные волокна»
(цвет обусловлен хорошим развитием
капиллярной сети и небольшим количеством
миофибрилл). Скорость сокращения этих
волокон в 1,5 – 2 раза меньше, чем быстрых.
Они неутомляемы благодаря хорошо
развитой капиллярной сети, большому
количеству митохондрий и высокой
активности окислительных ферментов.
2. Быстрые, легко
утомляемые ДЕ. Имеют наиболее крупный мотонейрон,
обладающий наиболее высоким порогом
возбуждения, не способны в течение
длительного времени поддерживать
устойчивую частоту разрядов (утомляемые).
Аксоны толстые, с большой скоростью
проведения нервных импульсов, иннервирует
много мышечных волокон. Мышечные волокна
содержат большое число миофибрилл,
поэтому при сокращении развивают большую
силу. Благодаря высокой активности
ферментов скорость сокращения высокая.
Эти волокна быстро утомляются, т. к.
содержат меньше, по сравнению с медленными,
митохондрий и окружены меньшим количеством
капилляров.
к.
содержат меньше, по сравнению с медленными,
митохондрий и окружены меньшим количеством
капилляров.
3. Быстрые, устойчивые к утомлению. Сильные, быстро сокращающиеся волокна, обладающие большой выносливостью благодаря возможности использования аэробных и анаэробных процессов получения энергии. Волокна 2 и 3 типов называются «белыми волокнами» из-за большого содержания миофибрилл и низкого – миоглобина.
Сравнение медленных и быстрых мышечных волокон
Характеристика | Медленно сокращающиеся (тип I) | Быстро сокращающиеся (тип II) |
Цвет | ||
Метаболизм | ||
Митохондрии | ||
Гликогена | ||
Утомляемость | ||
Толщина |
Скелетная мышца
человека состоит из волокон 3 типов,
однако их соотношение может значительно
отличаться в зависимости от функции
мышцы, а также врожденной и приобретенной
индивидуальности. Чем больше в мышцах
белых волокон, тем лучше человек
приспособлен к выполнению работы,
требующей большой скорости и силы.
Преобладание красных волокон обеспечивает
выносливость при выполнении длительной
работы.
Чем больше в мышцах
белых волокон, тем лучше человек
приспособлен к выполнению работы,
требующей большой скорости и силы.
Преобладание красных волокон обеспечивает
выносливость при выполнении длительной
работы.
6.2.3 Строение скелетной мышцы
Скелетная мышца состоит из множества мышечных волокон, которые расположены пучками в общем соединительнотканном футляре и крепятся к сухожилиям, связанным со скелетом. Каждое мышечное волокно – это тонкое (от 10 до 100 мкм) вытянутое в длину (от 5 до 400мм) многоядерное образование – симпласт.
Мембраны мышечного
волокна сходна с нервной, но она дает
регулярные Т-образные впячивания. Внутри
мышечного волокна параллельно мембране
располагается разветвленная, но замкнутая
система трубочек – саркоплазматический
ретикулум – внутриклеточное депо Ca2+.
Т-система и прилегающий к ней СР –
аппарат передачи возбуждения с мембраны
мышечного волокна на сократительные
структуры — миофибриллы. В саркоплазме
мышечного волокна можно увидеть
поперечные чередующиеся светлые и
темные участки – соответственно, J-
(изотропные) и А-(анизотропные) диски. В
соседних миофибриллах одноименные
диски расположены на одном уровне, что
придает волокну поперечную исчерченность.
Комплекс из одного темного и двух
прилежащих к нему половин светлых
дисков, ограниченных поперечными
Z-пластинками,
называют саркомером.
В
соседних миофибриллах одноименные
диски расположены на одном уровне, что
придает волокну поперечную исчерченность.
Комплекс из одного темного и двух
прилежащих к нему половин светлых
дисков, ограниченных поперечными
Z-пластинками,
называют саркомером.
Каждая миофибрилла состоит их множества параллельно лежащих толстых (миозиновых) и тонких (актиновых) белковых нитей – миофиламентов. По сечению волокна толстые и тонкие нити располагаются высокоорганизованно в узлах гексагональной решетки. Каждая толстая нить окружена шестью тонкими, каждая из тонких нитей частично входит в окружение трех соседних толстых. Миозиновые нити имеют отходящие от них поперечные выступы с головками, состоящими примерно из 150 молекул миозина. Актиновая нить состоит из двух закрученных одна вокруг другой цепочек (подобно скрученным ниткам бус) молекул актина. На нитях актина расположены молекулы тропонина, а в желобках между двумя нитями актина лежат нити тропомиозина.
Двигательные единицы (ДЕ) и их типы
Двигательные единицы
text_fields
text_fields
arrow_upward
Мышечные волокна каждой Двигательной единицы (ДЕ) расположены на довольно значительном расстоянии друг от друга.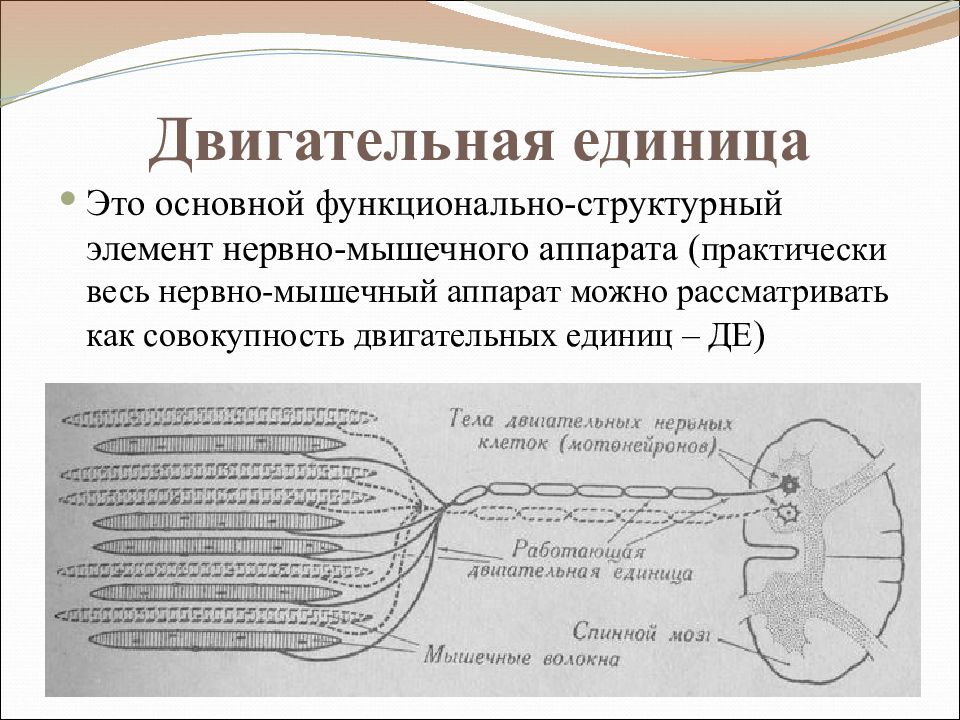 Число мышечных волокон, входящих в одну ДЕ, отличается в разных мышцах. Оно меньше в мелких мышцах, осуществляющих тонкую и плавную регуляцию двигательной функции (например, мышцы кисти, глаза) и больше в крупных, не требующих столь точного контроля (икроножная мышца, мышцы спины). Так, в частности, в глазных мышцах одна ДЕ содержит 13-20 мышечных волокон, а ДЕ внутренней головки икроножной мышцы — 1500-2500.
Число мышечных волокон, входящих в одну ДЕ, отличается в разных мышцах. Оно меньше в мелких мышцах, осуществляющих тонкую и плавную регуляцию двигательной функции (например, мышцы кисти, глаза) и больше в крупных, не требующих столь точного контроля (икроножная мышца, мышцы спины). Так, в частности, в глазных мышцах одна ДЕ содержит 13-20 мышечных волокон, а ДЕ внутренней головки икроножной мышцы — 1500-2500.
Мышечные волокна одной ДЕ имеют одинаковые морфофункциональные свойства.
По морфофункциональным свойствам ДЕ делятся на три основных типа (рис.4.8.):
I — медленные, неутомляемые;
II-А — быстрые, устойчивые к утомлению:
II-В — быстрые, легко утомляемые.
1 — медленные, слабые, неутомляемые мышечные волокна.
Низкий порог активации мотонейрона;
2 — промежуточный тип ДЕ;
3 — быстрые, сильные, быстроутомляемые мышечные
волокна. Высокий порог активаций мотонейрона.
Скелетные мышцы человека состоят из ДЕ всех трех типов. Одни из них включают преимущественно медленные ДЕ, другие — быстрые, третьи — и те, и другие.
Одни из них включают преимущественно медленные ДЕ, другие — быстрые, третьи — и те, и другие.
Медленные, неутомляемые двигательные единицы (тип I)
text_fields
text_fields
arrow_upward
По сравнению с другими типами ДЕ у этих ДЕ наименьшие величины мотонейронов и, соответственно, наиболее низкие пороги их активации, меньшие толщина аксона и скорость проведения возбуждения по нему. Аксон разветвляется на небольшое число концевых веточек и иннервирует небольшую группу мышечных волокон. У мотонейронов медленных ДЕ сравнительно низкая частота разрядов (6-10 имп/с). Они начинают функционировать уже при малых мышечных усилиях. Так, мотонейроны ДЕ камбаловидной мышцы человека при удобном стоянии работают с частотой 4 имп/с. Устойчивая частота их импульсации составляет 6- 8 имп/с. С повышением силы сокращения мышцы частота разрядов мотонейронов медленных ДЕ повышается незначительно. Мотонейроны медленных ДЕ способны поддерживать постоянную частоту разрядов в течение десятков минут.
Мотонейроны медленных ДЕ способны поддерживать постоянную частоту разрядов в течение десятков минут.
Мышечные волокна медленных ДЕ развивают небольшую силу при сокращении в связи с наличием в них меньшего, по сравнению с быстрыми волокнами, количества миофибрилл. Скорость сокращения этих волокон в 1,5-2 раза меньше, чем быстрых. Основными причинами этого являются низкая активность миозин АТФ-азы и меньшие скорость выхода ионов кальция из саркоплазматического ре-тикулума и его связывания с тропонином в процессе возбуждения волокна.
Мышечные волокна медленных ДЕ малоутомляемы. Они обладают хорошо развитой капиллярной сетью. На одно мышечное волокно, в среднем, приходится 4- 6 капилляров. Благодаря этому во время сокращения они обеспечиваются достаточным количеством кислорода. В их цитоплазме имеется большое количество митохондрий и высокая активность окислительных ферментов. Все это определяет существенную аэробную выносливость данных мышечных волокон и позволяет выполнять работу умеренной мощности длительное время без утомления.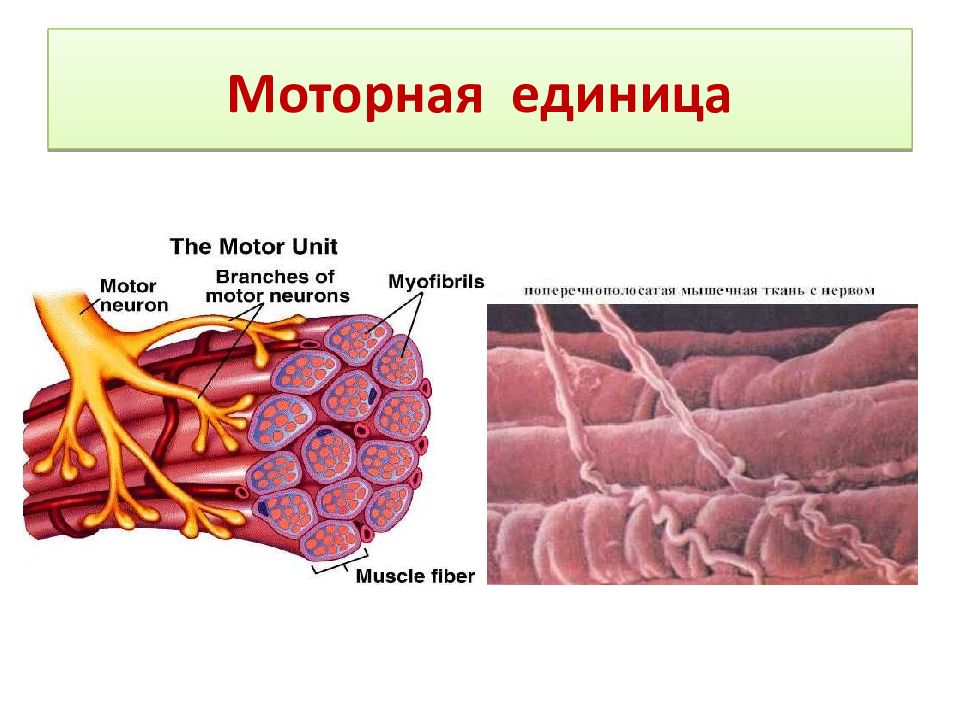
Быстрые, легко утомляемые ДЕ (тип II-В)
text_fields
text_fields
arrow_upward
Из всех типов ДЕ мотонейроны этого типа наиболее крупные, имеют толстый аксон, разветвляющийся на большое число концевых веточек и иннервирующий соответственно большую группу мышечных волокон. По сравнению с другими эти мотонейроны обладают наиболее высоким порогом возбуждения, а их аксоны — большей скоростью проведения нервных импульсов.
Частота импульсации мотонейронов возрастает с ростом силы сокращения, достигая при максимальных напряжениях мышцы 25-50 имп/с. Эти мотонейроны не способны в течение длительного времени поддерживать устойчивую частоту разрядов, то есть быстро утомляются.
Мышечные волокна быстрых ДЕ, в отличие от медленных, содержат большее число сократительных элементов — миофибрилл, поэтому при сокращении развивают большую силу. Благодаря высокой активности миозиновой АТФ-азы у них выше скорость сокращения. Волокна этого типа содержат больше гликолитических ферментов, меньше митохондрий и миоглобина, окружены меньшим, по сравнению с медленными ДЕ, количеством капилляров. Эти волокна быстро утомляются. Более всего они приспособлены для выполнения кратковременной, но мощной работы (см. главу 27).
Благодаря высокой активности миозиновой АТФ-азы у них выше скорость сокращения. Волокна этого типа содержат больше гликолитических ферментов, меньше митохондрий и миоглобина, окружены меньшим, по сравнению с медленными ДЕ, количеством капилляров. Эти волокна быстро утомляются. Более всего они приспособлены для выполнения кратковременной, но мощной работы (см. главу 27).
Быстрые, устойчивые к утомлению ДЕ (тип II-А)
text_fields
text_fields
arrow_upward
По своим морфофункциональным свойствам этот тип мышечных волокон занимает промежуточные положения между ДЕ I и II- В типов. Это сильные, быстро сокращающиеся волокна, обладающие большой аэробной выносливостью благодаря присущей им возможности использовать для получения энергии как аэробные, так и анаэробные процессы.
У разных людей соотношение числа медленных и быстрых ДЕ в одной и той же мышце определено генетически и может отличаться весьма значительно. Так, например, в четырехглавой мышце бедра человека процент медленных волокон может варьировать от 40 до 98%. Чем больше в мышце процент медленных волокон, тем более она приспособлена к работе на выносливость. И наоборот, лица с высоким процентом быстрых сильных волокон в большей мере способны к работе, требующей большой силы и скорости сокращения мышц.
Так, например, в четырехглавой мышце бедра человека процент медленных волокон может варьировать от 40 до 98%. Чем больше в мышце процент медленных волокон, тем более она приспособлена к работе на выносливость. И наоборот, лица с высоким процентом быстрых сильных волокон в большей мере способны к работе, требующей большой силы и скорости сокращения мышц.
КЛАССИФИКАЦИЯ МЫШЕЧНЫХ ВОЛОКОН!
Всем известно, что каждый человек имеет индивидуальную мышечную композицию, то есть только ему присущее сочетание мышечных клеток (волокон) разных типов во всех скелетных мышцах. Вот только классификаций этих типов волокон несколько и они не всегда совпадают. Какие же классификации сейчас приняты?Мышечные волокна делятся:
1. На белые и красные
2. На быстрые и медленные
3. На гликолитические, промежуточные и окислительные
4. На высокопороговые и низкопороговые
Разберем все подробно.
Белые и красные. На поперечном сечении мышечное волокно может иметь различный цвет.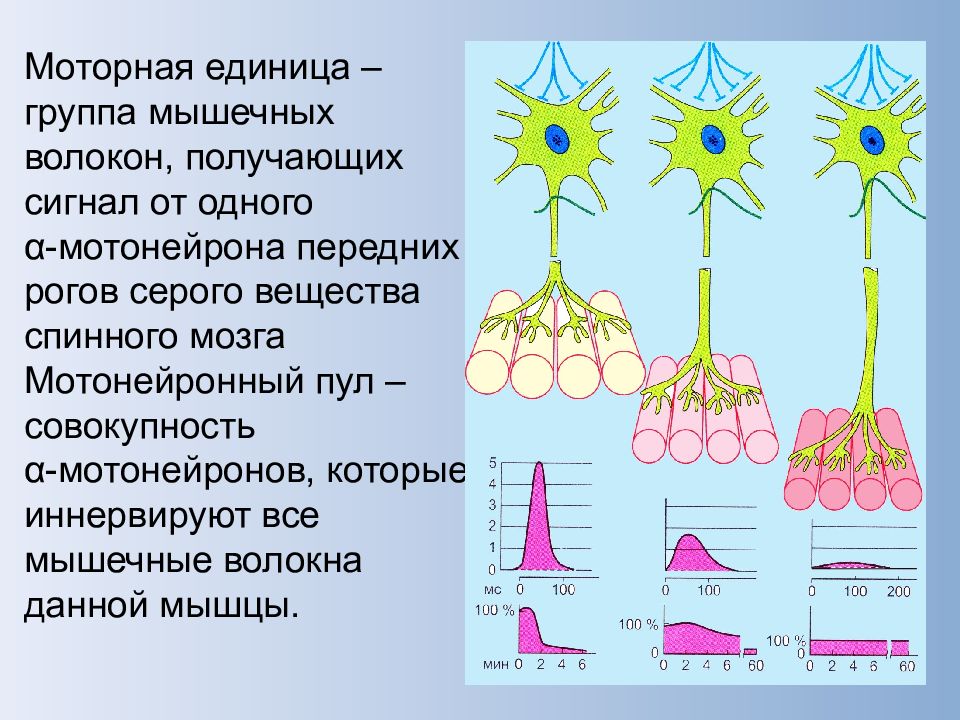 Он зависит от количества мышечного пигмента миоглобина в саркоплазме мышечного волокна. Если содержание миоглобина в мышечном волокне большое, то волокно имеет красно-бурый цвет. Если миоглобина мало, то бледно-розовый. У человека почти в каждой мышце содержатся белые и красные волокна, а так же волокна слабо пигментированные. Миоглобин используется для транспортировки кислорода внутри волокна от поверхности к митохондриям, соответственно его количество определяется количеством митохондрий. Увеличивая количество митохондрий в клетке специальными тренировками, мы увеличиваем количество миоглобина и изменяем цвет волокна.
Он зависит от количества мышечного пигмента миоглобина в саркоплазме мышечного волокна. Если содержание миоглобина в мышечном волокне большое, то волокно имеет красно-бурый цвет. Если миоглобина мало, то бледно-розовый. У человека почти в каждой мышце содержатся белые и красные волокна, а так же волокна слабо пигментированные. Миоглобин используется для транспортировки кислорода внутри волокна от поверхности к митохондриям, соответственно его количество определяется количеством митохондрий. Увеличивая количество митохондрий в клетке специальными тренировками, мы увеличиваем количество миоглобина и изменяем цвет волокна.
Быстрые и медленные. Классифицируются по активности фермента АТФ-азы и, соответственно, по скорости сокращения мышц. Активность данного фермента наследуется и тренировке не поддается. Каждое волокно имеет свою неизменную активность этого фермента. Освобождение энергии заключенной в АТФ, осуществляется благодаря АТФ-аза. Энергии одной молекулы АТФ достаточно для одного поворота (гребка) миозиновых мостиков. Мостики расцепляются с актиновым филаментом, возвращаются в исходное положение, сцепляются с новым участком актина и делают гребок. Скорость одиночного гребка одинакова у всех мышц. Энергия АТФ в основном требуется для разъединения. Для очередного гребка требуется новая молекула АТФ. В волокнах с высокой АТФ-азной активностью расщепление АТФ происходит быстрее, и за единицу времени происходит большее количество гребков мостиками, то есть мышца сокращается быстрее.
Мостики расцепляются с актиновым филаментом, возвращаются в исходное положение, сцепляются с новым участком актина и делают гребок. Скорость одиночного гребка одинакова у всех мышц. Энергия АТФ в основном требуется для разъединения. Для очередного гребка требуется новая молекула АТФ. В волокнах с высокой АТФ-азной активностью расщепление АТФ происходит быстрее, и за единицу времени происходит большее количество гребков мостиками, то есть мышца сокращается быстрее.
Гликолитические, промежуточные и окислительные. Классифицируются по окислительному потенциалу мышцы, то есть по количеству митохондрий в мышечном волокне. Напомню, что митохондрии – это клеточные органеллы, в которых глюкоза или жир расщепляется до углекислого газа и воды, ресинтезируя АТФ, необходимую для ресинтеза креатинфосфата. Креатинфосфат используется для ресинтеза миофибриллярных молекул АТФ, которые необходимы для мышечного сокращения. Вне митохондрий в мышцах также может происходить расщепление глюкозы до пирувата с ресинтезом АТФ, но при этом образуется молочная кислота, которая закисляет мышцу и вызывает ее утомление.
По этому признаку мышечные волокна подразделяются на 3 группы:
1. Окислительные мышечные волокна. В них масса митохондрий так велика, что существенной прибавки ее в ходе тренировочного процесса уже не происходит.
2. Промежуточные мышечные волокна. В них масса митохондрий значительно снижена, и в мышце в процессе работы накапливается молочная кислота, однако достаточно медленно, и утомляются они гораздо медленнее, чем гликолитические.
3. Гликолитические мышечные волокна. В них очень незначительное количество митохондрий. Поэтому в них преобладает анаэробный гликолиз с накоплением молочной кислоты, отчего они и получили свое название. (Анаэробный гликолиз – расщепление глюкозы без кислорода до молочной кислоты и АТФ; аэробный гликолиз, или окисление – расщепление глюкозы в митохондриях с участием кислорода до углекислого газа, воды и АТФ.)
У не тренирующихся людей обычно быстрые волокна – гликолитические и промежуточные, а медленные – окислительные.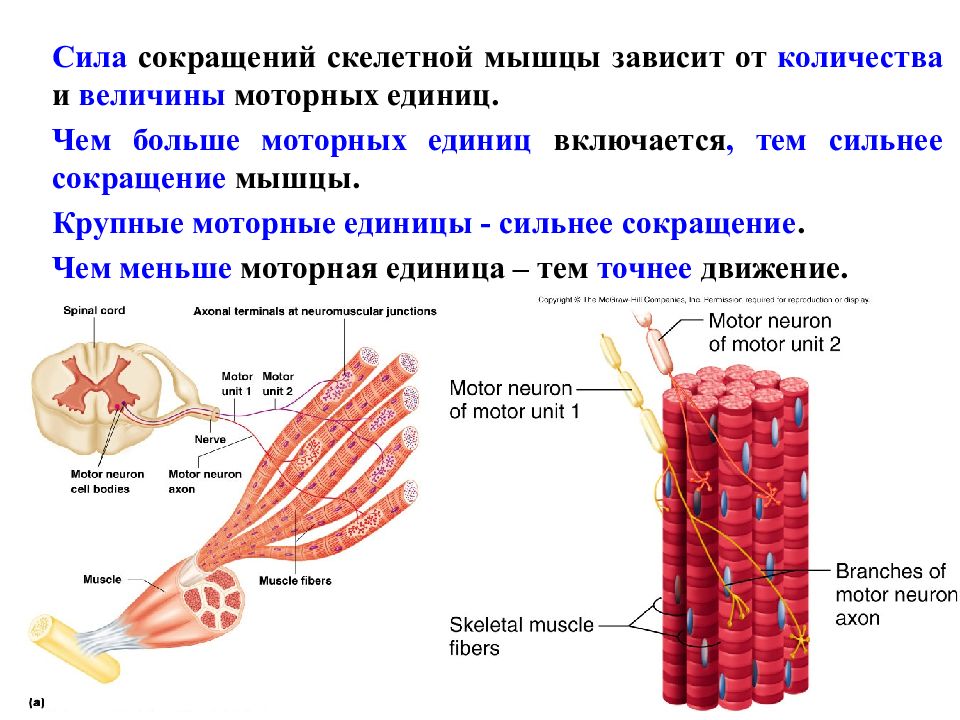 Однако при правильных тренировках на увеличение выносливости промежуточные и часть гликолитических волокон можно сделать окислительными, и тогда они, не теряя в силе, перестанут утомляться.
Однако при правильных тренировках на увеличение выносливости промежуточные и часть гликолитических волокон можно сделать окислительными, и тогда они, не теряя в силе, перестанут утомляться.
Высокопороговые и низкопороговые. Классифицируются по уровню порога возбудимости двигательных единиц. Мышца сокращается под действием нервного импульса, который имеет электрическую природу. Каждая двигательная единица (ДЕ) включает в себя мотонейрон, аксон и совокупность мышечных волокон. Количество ДЕ у человека остается неизменным на протяжении всей жизни. Двигательные единицы имеют свой порог возбудимости. Если нервный импульс, посылаемый мозгом, имеет величину ниже этого порога, ДЕ пассивна. Если нервный импульс имеет пороговую для этой ДЕ величину или превышает ее, мышечные волокна сокращаются. Низкопороговые ДЕ имеют маленькие мотонейроны, тонкий аксон и сотни иннервируемых медленных мышечных волокон. Высокопороговые ДЕ имеют крупные мотонейроны, толстый аксон и тысячи иннервируемых быстрых мышечных волокон.
Как видите, две из представленных классификаций неизменны на протяжении всей жизни человека вне зависимости от тренировок, а две напрямую зависят именно от тренировок. В отсутствии двигательного режима, например в коме, или долгом нахождении в гипсе даже медленные мышечные волокна теряют свои митохондрии и соответственно миоглобин и становятся белыми и гликолитическими.
Поэтому в настоящее в спортивной науке считается неправильно говорить: «тренировки направленные на гипертрофию быстрых мышечных волокон», или «гиперплазия миофибрилл в медленных мышечных волокнах», хотя еще 10 лет назад это считалось допустимо даже в специализированных научных изданиях. Сейчас если мы говорим о тренировочном воздействии на МВ, то используем только классификацию по окислительному потенциалу мышцы. Классификации совпадают у не тренирующихся и у представителей скоростно-силовых и силовых видов спорта, где цель поднять максимальный вес в единичном повторении. В видах спорта требующих проявления выносливости классификации совпадать не будут.
Для наглядности приведу несколько утрированный, хотя теоритически вполне возможный пример. Сразу оговорюсь, что все цифры условные, и их не надо воспринимать буквально. Представим атлета, у которого лучший результат в жиме лежа 200 кг (без экипировки), 180 кг он может пожать на 3 раза, 150 кг на 10 раз. Из результатов видно, что окислительный потенциал мышц очень низок. Соотношение волокон, предположим, следующее: 90% быстрые, 10% медленные. По окислительному потенциалу 75% гликолитические, 15% промежуточные и 10% окислительные. Наилучших успехов в увеличении мышечной массы спортсмен добивается, когда работает в жиме по 6 повторений. Вес штанги достаточно большой чтобы рекрутировать 75% гликолитических волокон, а окислительный потенциал их настолько низок, что и 6-и повторений достаточно для необходимого закисления мышцы.
Но вот по какой-то причине этот атлет решил максимально увеличить свою выносливость и два месяца по 2-3 раза в день ежедневно работал над увеличением митохондрий в гликолитических и промежуточных МВ. Подробно об этой методике вы можете прочитать в 5-м номере «ЖМ», в моей статье «Тренировка выносливости». Плюс к этому атлет еще поддерживал свой силовой потенциал, выполняя по 1-2 повторениям с околомаксимальным весом раз в 7-10 дней. Два месяца достаточно для предельного насыщения мышц митохондриями. Через два месяца спортсмен проводит тестирование. Оно показывает, что сейчас у него 5% гликолитических волокон, 70% промежуточных и 25% окислительных. То есть гликолитические стали промежуточными, кроме 5% самых высокопороговых, а промежуточные стали окислительными. По активности АТФ-азы соотношение естественно не изменилось, так же 90% быстрые и 10% медленные. 200 кг он выжал на 1 раз, миофибриллы от таких тренировок не выросли, а упасть результату он не дал, используя в тренировках ММУ. 180 кг он выжал на 8 раз, а 150 кг на 25 раз. Огромное количество новых митохондрий «съедало» молочную кислоту не давая мышцам закислиться, что значительно увеличило их функциональность.
Подробно об этой методике вы можете прочитать в 5-м номере «ЖМ», в моей статье «Тренировка выносливости». Плюс к этому атлет еще поддерживал свой силовой потенциал, выполняя по 1-2 повторениям с околомаксимальным весом раз в 7-10 дней. Два месяца достаточно для предельного насыщения мышц митохондриями. Через два месяца спортсмен проводит тестирование. Оно показывает, что сейчас у него 5% гликолитических волокон, 70% промежуточных и 25% окислительных. То есть гликолитические стали промежуточными, кроме 5% самых высокопороговых, а промежуточные стали окислительными. По активности АТФ-азы соотношение естественно не изменилось, так же 90% быстрые и 10% медленные. 200 кг он выжал на 1 раз, миофибриллы от таких тренировок не выросли, а упасть результату он не дал, используя в тренировках ММУ. 180 кг он выжал на 8 раз, а 150 кг на 25 раз. Огромное количество новых митохондрий «съедало» молочную кислоту не давая мышцам закислиться, что значительно увеличило их функциональность.
Теперь нашему атлету для увеличения мышечной массы работа на 6 повторений практически ничего не даст. Она задействует в нужном режиме только 5% оставшихся гликолитических волокон.
Она задействует в нужном режиме только 5% оставшихся гликолитических волокон.
Сейчас ему придется работать минимум по 15 повторений в подходе, чтобы добиться необходимого для роста мышечной массы закисления мышц. И, дополнительно, включить в тренировку стато-динамические упражнения, поскольку только они способствуют гипертрофии окислительных мышечных волокон, которых у него теперь 25%, и игнорировать их уже нецелесообразно.
Как мы видим, один и тот же человек вынужден использовать абсолютно разные тренировочные программы для гипертрофии своих быстрых мышечных волокон после изменения их окислительного потенциала! Вот поэтому говорить о тренировочном воздействии на типы волокон, используя классификацию по активности АТФ-зы, считается некорректным. Только классификация по окислительным способностям мышц!
Двигательные единицы (ДЕ)
Дано понятие двигательной единицы (ДЕ) и описана ее структура. Приведена классификация ДЕ и соответствие ДЕ и типов мышечных волокон.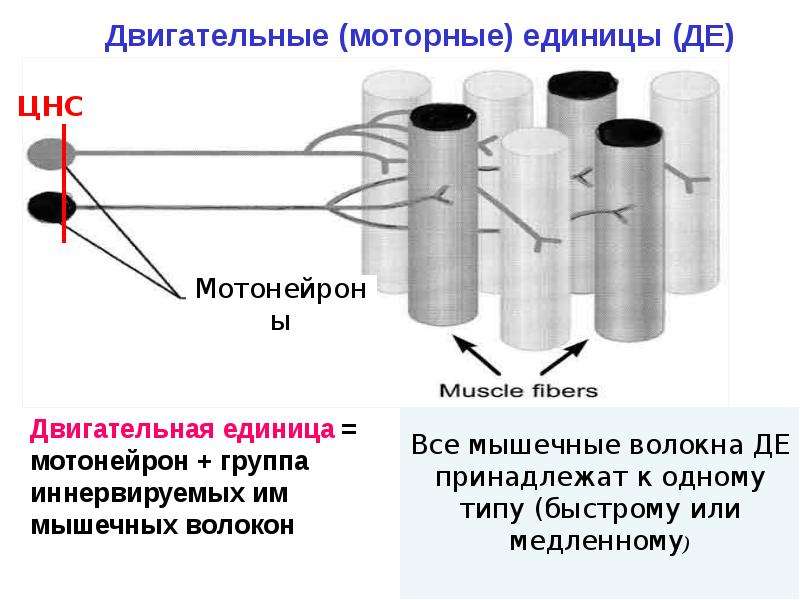 Описан принцип размера и правило Хеннемана. Приведены данные об активации ДЕ при выполнении силовых упражнений в зависимости от величины отягощения.
Описан принцип размера и правило Хеннемана. Приведены данные об активации ДЕ при выполнении силовых упражнений в зависимости от величины отягощения.
ДВИГАТЕЛЬНЫЕ ЕДИНИЦЫ (ДЕ)
Определение
Термин «двигательная единица» был предложен Е. Г. Лидделом и Ч.С. Шеррингтоном для обозначения группы мышечных волокон, иннервируемых терминалями (веточками) одного аксона.
В настоящее время под двигательной единицей (ДЕ) понимается элементарная функциональная единица мышцы, включающая в себя мотонейрон и иннервируемые им мышечные волокна.
Структура ДЕ
Войдя в мышцу, аксон мотонейрона разветвляется на множество веточек, каждая из которых иннервирует отдельное мышечное волокно. Таким образом, один мотонейрон иннервирует достаточно большое количество мышечных волокон (от нескольких единиц до нескольких тысяч), в то время как каждое мышечное волокно иннервируется только одним двигательным нейроном.
Установлено, что мышечные волокна, принадлежащие к одной ДЕ, рассредоточены по всей мышце, то есть принадлежат к разным мышечным пучкам. Такое рассредоточенное (дисперсное) распределение мышечных волокон каждой ДЕ обеспечивает равномерное сокращение мышцы, когда в работу «включается» лишь некоторая часть ДЕ. Следует отметить, что в одну ДЕ составляют мышечные волокна, обладающие одинаковыми свойствами. Посредством активации различных ДЕ центральная нервная система управляет активностью всей мышцы.
Такое рассредоточенное (дисперсное) распределение мышечных волокон каждой ДЕ обеспечивает равномерное сокращение мышцы, когда в работу «включается» лишь некоторая часть ДЕ. Следует отметить, что в одну ДЕ составляют мышечные волокна, обладающие одинаковыми свойствами. Посредством активации различных ДЕ центральная нервная система управляет активностью всей мышцы.
Размер ДЕ (иннервационное отношение, коэффициент иннервации)
Размер ДЕ — это количество мышечных волокон, которые иннервируются одним мотонейроном. Чтобы определить этот показатель определяют количество мышечных волокон в скелетной мышце и количество мотонейронов, которые инннервируют эти мышечные волокна (табл.1). Иногда в литературе размер ДЕ называют иннервационным отношением или коэффициентом иннервации.
Всякий раз, когда активируется мотонейрон, он посылает потенциалы действия ко всем мышечным волокнам, которые он иннервирует. Поэтому, чем ниже коэффициент иннервации, тем совершеннее контроль со стороны нервной системы за мышечными волокнами. По коэффициенту иннервации (размеру ДЕ) можно судить о количестве веточек, необходимых аксону мотонейрона, чтобы иннервировать все входящие в ДЕ мышечные волокна.
По коэффициенту иннервации (размеру ДЕ) можно судить о количестве веточек, необходимых аксону мотонейрона, чтобы иннервировать все входящие в ДЕ мышечные волокна.
Табл. 1 — Количество мышечных волокон, количество ДЕ (мотонейронов) и размер ДЕ в различных скелетных мышцах человека
| Мышца | Количество мышечных волокон | Количество ДЕ | Размер ДЕ |
| Передняя большеберцовая | 250090 | 445 | 562 |
| Медиальная головка икроножной мышцы | 1120365 | 1934 | 579 |
| Наружная прямая мышца глаза | 26730 | 2970 | 9 |
| Плечелучевая | 136530 | 333 | 410 |
С возрастом количество ДЕ, приходящихся на одну мышцу уменьшается. Это связано с тем, что уменьшается количество мотонейронов, которые иннервируют отдельную мышцу. Вследствие этого количество мышечных волокон по мере старения организма человека также уменьшается.
Классификации ДЕ
Существуют различные классификации ДЕ. Исходя из значимости для организма, Р. Берк с соавт. (R.E. Burke, 1973) предложил разделять ДЕ по сочетанию двух признаков – скорости сокращения и устойчивости к утомлению. По этой классификации ДЕ делятся на три типа: S (slow) – медленные, устойчивые к утомлению; FR (fast resistant) – быстрые, устойчивые к утомлению, FF (fast fatigable) – быстрые, быстроутомляемые. Этим ДЕ соответствуют различные типы мышечных волокон (табл. 1).
Таблица 1 — Соответствие типов ДЕ и мышечных волокон
Строение и функции мотонейрона соответствуют морфологическим характеристикам мышечных волокон, которые он иннервирует. Так, мотонейрон ДЕ S типа имеет небольшое клеточное тело и иннервирует от 10 до 180 мышечных волокон, а мотонейрон ДЕ FF типа имеет большое клеточное тело и иннервирует от 300 до 800 мышечных волокон (Дж.Х. Уилмор, Д.Л. Костилл, 1997) (рис.1).
Рис. 1. Гистохимические и физиологические свойства трех основных типов ДЕ и мышечных волокон (R. E. Burke, 1973)
E. Burke, 1973)
В табл. 2 представлено количество мышечных волокон и количество ДЕ в различных мышцах человека
Принцип размера или правило Хеннемана
ДЕ S типа имеют низкий порог активации, поэтому при развитии силы мышцы они включаются в работу первыми. После этого активируются ДЕ FR типа. ДЕ FF типа обладают высоким порогом активации, поэтому при развитии усилия в мышце они активируются последними.
Благодаря тому, что мышечные волокна, принадлежащие различным ДЕ, рассредоточены по всей мышце, а не находятся в одном пучке, развитие силы мышцы характеризуется плавностью. Однако из-за того, что между соседними мышечными волокнами существуют соединительнотканные связи, при сокращении одних мышечных волокон, например, входящих в состав ДЕ S типа, и расслабленном состоянии других (например, входящих в состав ДЕ FF типа) должны возникать силы трения, обусловливающие высокую вязкость мышцы. Г.В. Васюков (1967) показал, что при небольших напряжениях мышцы (30% от максимума) ее вязкость максимальна. При дальнейшем напряжении мышцы, когда одновременно возбуждено много мышечных волокон, вязкость мышцы скачкообразно уменьшается.
При дальнейшем напряжении мышцы, когда одновременно возбуждено много мышечных волокон, вязкость мышцы скачкообразно уменьшается.
Более подробно строение и функции мышц описаны в моих книгах
Активация ДЕ в зависимости от различной величины внешней нагрузки
В настоящее время установлено, что в зависимости от величины внешнего отягощения активируются разные ДЕ. Эти данные представлены в табл. 3
Таблица 33 – Активация ДЕ в зависимости от различной степени отягощения.
| Степень отягощения, % | Особенности активации ДЕ |
| 20-30% от максимального | Рекрутируются ДЕ S типа. |
| От 30 до 50% от максимального | Рекрутируются ДЕ S и FR типа |
| От 50 до 70 % от максимального | Рекрутируются ДЕ: S, FR FF типов. |
| Более 70% от максимума | Синхронизация активности ДЕ, то есть одновременное возбуждение большинства мышечных волокон. |
С уважением, А. В. Самсонова
В. Самсонова
От медленных к быстрым. Гипогравитационная перестройка миозинового фенотипа мышечных волокон Текст научной статьи по специальности «Фундаментальная медицина»
УДК 612.744.14
От медленных к быстрым. Гипогравитационная перестройка миозинового фенотипа мышечных волокон
Б. С. Шенкман
Государственный научный центр РФ — Институт медико-биологических проблем РАН,
123007, Москва, Хорошевское шоссе, 76А
E-mail: [email protected]
Поступила в редакцию 10.11.2015
Принята к печати 11.03.2016
РЕФЕРАТ Скелетные мышцы образованы волокнами разного типа, которые располагаются мозаичным образом и различаются функциональными свойствами. «Медленные» волокна отличаются высокой степенью устойчивости к утомлению и большой продолжительностью сокращения, но пониженной максимальной силой и скоростью сокращения. «Быстрые» волокна обладают высокой скоростью и силой сокращения, но высокой утомляемостью. В последние десятилетия стало известно, что все эти свойства определяются преобладанием той или иной изоформы тяжелых цепей миозина (ТЦМ), т.е. миозиновым фенотипом. При гравитационной разгрузке в космическом полете и моделируемой микрогравитации в экспериментальных условиях на Земле часть медленных волокон превращается в быстрые за счет изменений интенсивности экспрессии соответствующих генов в постуральной камбаловидной мышце m. soleus. В обзоре рассмотрены феноменология и механизмы изменений миозинового фенотипа в условиях гравитационной разгрузки, а также гипотезы об изменении нейрональных механизмов контроля мышечных волокон и молекулярных механизмах регуляции экспрессии миозиновых генов, таких, как ингибирование сигнального пути кальцинейрин/NFATd, эпигеномные изменения, работа специфических микроРНК.
«Медленные» волокна отличаются высокой степенью устойчивости к утомлению и большой продолжительностью сокращения, но пониженной максимальной силой и скоростью сокращения. «Быстрые» волокна обладают высокой скоростью и силой сокращения, но высокой утомляемостью. В последние десятилетия стало известно, что все эти свойства определяются преобладанием той или иной изоформы тяжелых цепей миозина (ТЦМ), т.е. миозиновым фенотипом. При гравитационной разгрузке в космическом полете и моделируемой микрогравитации в экспериментальных условиях на Земле часть медленных волокон превращается в быстрые за счет изменений интенсивности экспрессии соответствующих генов в постуральной камбаловидной мышце m. soleus. В обзоре рассмотрены феноменология и механизмы изменений миозинового фенотипа в условиях гравитационной разгрузки, а также гипотезы об изменении нейрональных механизмов контроля мышечных волокон и молекулярных механизмах регуляции экспрессии миозиновых генов, таких, как ингибирование сигнального пути кальцинейрин/NFATd, эпигеномные изменения, работа специфических микроРНК. В заключительной части обзора обсуждается адаптивное значение процессов трансформации миозинового фенотипа. КЛЮЧЕВЫЕ СЛОВА гравитационная разгрузка, изоформы тяжелых цепей миозина, миозиновый фенотип, регуляция экспрессии миозиновых генов, скелетная мышца, типы мышечных волокон.
В заключительной части обзора обсуждается адаптивное значение процессов трансформации миозинового фенотипа. КЛЮЧЕВЫЕ СЛОВА гравитационная разгрузка, изоформы тяжелых цепей миозина, миозиновый фенотип, регуляция экспрессии миозиновых генов, скелетная мышца, типы мышечных волокон.
Светлой памяти Ксении Бессарионовны Шаповаловой, вместе с которой автор исследовал стриопаллидар-ный контроль миозинового фенотипа
ВВЕДЕНИЕ. МИОЗИНОВЫЙ ФЕНОТИП
Типы волокон скелетных мышц исследуются физиологами с 1873 года [1], когда было установлено, что в состав мышц входят волокна с различными функциональными свойствами, которые располагаются мозаичным образом. «Медленные» волокна характеризуются высокой устойчивостью к утомлению и большей продолжительностью сокращения, но пониженной максимальной силой и скоростью сокращения. «Быстрые» волокна обладают высокой скоростью и большой силой сокращения, но быстрой утомляемостью. В последние десятилетия стало известно, что эти свойства определяются преобладающей изоформой тяжелых цепей миозина (ТЦМ). Известно четыре изоформы и соответственно четыре типа волокон: I — «медленный»; 11А — «быстрый»;
В последние десятилетия стало известно, что эти свойства определяются преобладающей изоформой тяжелых цепей миозина (ТЦМ). Известно четыре изоформы и соответственно четыре типа волокон: I — «медленный»; 11А — «быстрый»;
IId/x — «быстрый» и самый «быстрый» — IIB, представленный только в мышцах мелких млекопитающих [2] (рис. 1, таблица). Изоформы миозина, преобладающие в волокне, определяют его миозиновый фенотип, а соотношение волокон различного типа составляет композицию мышцы или ее миозиновый фенотип. Помимо волокон, в которых доминирует какой-либо определенный тип изоформ ТЦМ, в мышцах присутствуют волокна, содержащие две (или больше) разные изоформы ТЦМ. Такие волокна называют гибридными. Экспрессия каждой из изоформ миозина детерминируется иннервацией волокон. Волокна, иннервированные одним мотонейроном, составляют двигательную единицу и в подавляющем большинстве случаев характеризуются единым миозиновым фенотипом [3]. Позно-тонические, или постуральные мышцы, имеющие высокий тонус и поддерживающие позу организма в условиях нормального гравитационного поля, содержат наибольшее количество волокон медленного типа I. Согласно современным представ-
Согласно современным представ-
Совмещение меток
Рис. 1. Иммуноцитохимическое выявление мышечных волокон, экспрессирующих изоформы ТЦМ Iß, ТЦМ IIA, ТЦМ IIB, на поперечном срезе m. plantaris крысы методом тройного мечения. Показаны волокна основных типов, а также гибридные волокна
Изоформы ТЦМ и типы мышечных волокон млекопитающих
Изоформа ТЦМ ß а Iß IIA IId/x IIB
Орган Миокард Скелетная мышца
Видовая специфика Все виды млекопитающих Мелкие млекопитающие
Скорость сокращения
Устойчивость к утомлению <-
лениям мотонейрон, управляя волокнами с помощью паттерна импульсации (10 Гц для «медленных» и 5060 Гц для «быстрых» двигательных единиц) и секреции соответствующих нейротрофических агентов, влияет на экспрессию миозиновых генов, т. е. на мио-зиновый фенотип волокна [3, 4].
е. на мио-зиновый фенотип волокна [3, 4].
Миозиновый фенотип весьма стабилен, однако существуют воздействия, способные существенно изменить экспрессию миозиновых генов и обусловить тем
самым трансформацию медленных волокон в быстрые или наоборот. Например, низкочастотная электростимуляция в течение нескольких недель приводит к появлению около 30-40% волокон медленного типа в преимущественно «быстрых» мышцах [4]. Такой же эффект в «быстрой» мышце голени m. plantaris наблюдается у животного с удаленной или тенотомиро-ванной трехглавой мышцей голени, т.е. с так называемой компенсаторной перегрузкой [4]. Во всех этих
Рис. 2. Схема функционирования сигнального пути кальцинейрин/NFATcl. (По Liu и соавт. [16] с модификациями). ECC — электромеханическое сопряжение, CaN — кальцинейрин. Пояснения в тексте
случаях ведущую роль в изменении миозинового фенотипа приписывают изменению паттерна сократительной активности мышцы в результате изменения характера импульсации мотонейрона (или в случае прямой электростимуляции — ее паттерну).
МЕХАНИЗМЫ РЕГУЛЯЦИИ МИОЗИНОВОГО ФЕНОТИПА, ЗАВИСЯЩИЕ ОТ МЫШЕЧНОЙ АКТИВНОСТИ
Хроническая активность «медленных» волокон сопровождается двумя феноменами: постоянно повышенным уровнем ионов кальция в миоплазме и сниженным уровнем макроэргических фосфатов [4-6]. Поэтому поиск сигнальных механизмов, регулирующих экспрессию генов ТЦМ, сводился к выявлению путей, зависимых от концентрации ионов кальция и макроэргических фосфатов. Наиболее важным сигнальным каскадом, влияющим на экспрессию «медленных» изоформ ТЦМ (а также регулирующим экспрессию многих других генов), считают путь кальцинейрин/NFAT. Кальцинейрин — это белок,
локализованный в Z-диске саркомера. При взаимодействии с комплексом кальций-кальмодулин он проявляет фосфатазную активность и дефосфори-лирует NFATd (ядерный фактор активированных Т-клеток), который получает возможность проникновения в миоядра [6, 7] (рис. 2). В ядре этот фактор либо накапливается в гетерохроматине (откуда постепенно переносится в эухроматин) [8], либо непосредственно взаимодействует с MEF-2, транскрипционным фактором, специфически связывающим промотор гена медленных ТЦМ. Таким образом запускается интенсивная транскрипция гена «медленных» ТЦМ [7, 8]. Реакция дефосфорилирования NFAT ингибируется белками Z-диска кальсарци-нами-1 и -2, которые функционируют в медленных и быстрых волокнах соответственно. При нокауте генов этих белков наблюдается значительное перераспределение миозинового фенотипа в медленную сторону [9, 10] (рис. 2). Экспрессия генов кальсарцина (особенно кальсарцина-2) подавляется при двойном нокауте ЕЗ-убиквитинлигаз MuRf-1 и MuRf-2 [11].
2). В ядре этот фактор либо накапливается в гетерохроматине (откуда постепенно переносится в эухроматин) [8], либо непосредственно взаимодействует с MEF-2, транскрипционным фактором, специфически связывающим промотор гена медленных ТЦМ. Таким образом запускается интенсивная транскрипция гена «медленных» ТЦМ [7, 8]. Реакция дефосфорилирования NFAT ингибируется белками Z-диска кальсарци-нами-1 и -2, которые функционируют в медленных и быстрых волокнах соответственно. При нокауте генов этих белков наблюдается значительное перераспределение миозинового фенотипа в медленную сторону [9, 10] (рис. 2). Экспрессия генов кальсарцина (особенно кальсарцина-2) подавляется при двойном нокауте ЕЗ-убиквитинлигаз MuRf-1 и MuRf-2 [11].
Можно предположить, что экспрессия кальсарци-на-2 стимулируется присутствием в ядре убиквитин-лигаз семейства MuRf. Показано, что при изменении состояния титина/тайтина/коннектина киназный домен титина, локализованный в районе М-диска, ос-вобождает/дефосфорилирует MuRf-2, что приводит к его импорту в миоядра [12]. Не исключено, что изменение титина приводит в конечном счете к повышению экспрессии кальсарцина-2, способствует стабилизации быстрого миозинового фенотипа и предотвращает любую трансформацию в медленную сторону. Однако повышенной экспрессии гена каль-сарцина недостаточно для полного ингибирования фосфатазной активности кальцинейрина. Известно, что кальсарцин-2 может быть иммобилизован на ци-тоскелетных компонентах Z-диска — а-актининах-2 и -3, причем иммобилизация на а-актинине-2 оказывается более устойчивой [13]. Поэтому в отсутствие гена а-актинина-3 или при его дефиците кальсарцин устойчиво иммобилизуется, и в волокне реализуется медленный фенотип (рис. 3).
Не исключено, что изменение титина приводит в конечном счете к повышению экспрессии кальсарцина-2, способствует стабилизации быстрого миозинового фенотипа и предотвращает любую трансформацию в медленную сторону. Однако повышенной экспрессии гена каль-сарцина недостаточно для полного ингибирования фосфатазной активности кальцинейрина. Известно, что кальсарцин-2 может быть иммобилизован на ци-тоскелетных компонентах Z-диска — а-актининах-2 и -3, причем иммобилизация на а-актинине-2 оказывается более устойчивой [13]. Поэтому в отсутствие гена а-актинина-3 или при его дефиците кальсарцин устойчиво иммобилизуется, и в волокне реализуется медленный фенотип (рис. 3).
Дефосфорилирование сигнального белка GSK-3P (киназа гликогенсинтазы) способствует экспорту NFAT из ядра и сдвигает равновесие в сторону «быстрых» изоформ [14] (рис. 2). При этом ингибирую-щая активность GSK-3P может супрессироваться оксидом азота через сGMP-путь [15].
Другой механизм регуляции миозинового фенотипа, также кальций-зависимый, реализуется через киназную активность кальций-кальмодулин-киназы (СаМК). При активации комплексом кальций-каль-модулин этот фермент фосфорилирует гистонде-ацетилазу 4 (HDAC4), не позволяя ей войти в пространство миоядра [16]. При низкой концентрации комплекса кальций-кальмодулин и соответственно низкой киназной активности СаМК HDAC4 оказывается недофосфорилированной, и часть ее молекул проникает в миоядра [17]. В миоядрах HDAC4 деацетилирует не только гистон Н3, но и транскрипционный фактор MEF-2, взаимодействующий с промотором гена myf7 (т.е. гена ТЦМ 1Р) [17]. Это приводит к снижению как общей транскрипционной активности генома, так и экспрессии ТЦМ 1Р (рис. 4). Интересно, что и в этом случае существует «сдерживающий» механизм: HDAC4 может быть убиквити-нирована и разрушена. При этом сохраняется медленный характер миозинового фенотипа [18].
При активации комплексом кальций-каль-модулин этот фермент фосфорилирует гистонде-ацетилазу 4 (HDAC4), не позволяя ей войти в пространство миоядра [16]. При низкой концентрации комплекса кальций-кальмодулин и соответственно низкой киназной активности СаМК HDAC4 оказывается недофосфорилированной, и часть ее молекул проникает в миоядра [17]. В миоядрах HDAC4 деацетилирует не только гистон Н3, но и транскрипционный фактор MEF-2, взаимодействующий с промотором гена myf7 (т.е. гена ТЦМ 1Р) [17]. Это приводит к снижению как общей транскрипционной активности генома, так и экспрессии ТЦМ 1Р (рис. 4). Интересно, что и в этом случае существует «сдерживающий» механизм: HDAC4 может быть убиквити-нирована и разрушена. При этом сохраняется медленный характер миозинового фенотипа [18].
Соотношение фосфорилированных и нефосфо-рилированных макроэргических фосфатов, другой физиологический триггер сигнальных процессов, регулирует активность АМР-зависимой протеин-киназы (АМПК), контролирующей основные пути энергетического метаболизма мышечного волокна [19]. кальцинейрин (активный)
кальцинейрин (активный)
а-актинин-2
О
а-актинин-3
»
кальсарцин-2
Рис. 3. Схема депонирования кальсарцина в структуре а-актинина-2 и -3. (По Seto и соавт. в модификации [13]). Пояснения в тексте
ацетилазы HDAC4 и 5, что существенно облегчает экспрессию «медленной» изоформы ТЦМ и ряда генов, контролирующих регуляторные белки окислительного метаболизма [20, 21]. При этом активность АМПК может модулироваться (стимулироваться) оксидом азота [22].
Еще один механизм модуляции миозинового фенотипа обеспечивает регуляцию экспрессии гена ТЦМ 1Р (ген myh7) по типу положительной обратной связи с участием микроРНК.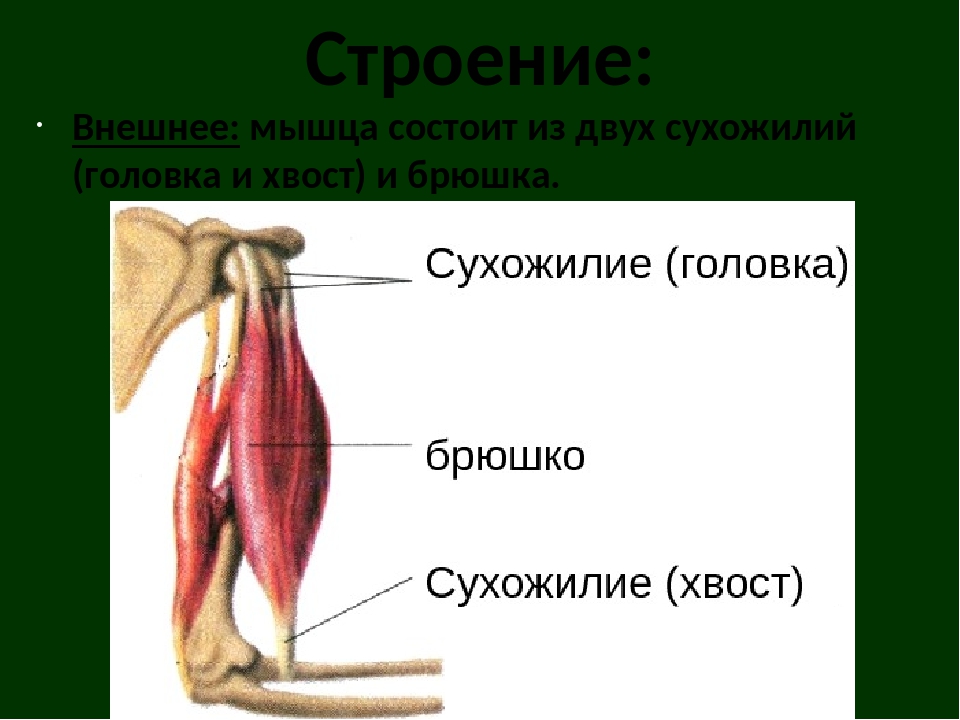 охб, Риг-Р и №гар1) [24] (рис. 5). Интересно, что экспрессия гена myh7Ъ стимулируется при сверхэкспрессии MEF-2 (основного транскрипционного стимулятора ТЦМ 1Р) [25]. Это предполагает, что при повышении концентрации комплекса кальций/кальмодулин MEF-2, который может дефосфорилироваться кальцинейри-ном [26], проникает в ядро и регулирует экспрессию myh7. Он одновременно стимулирует синтез miR-499, не допускающей блокаду экспрессии ТЦМ 1Р [25]. Таким образом, экспрессия miR-499 и miR-208b обеспечивает беспрепятственный синтез медленного миозина при наличии соответствующего физиологического стимула (ионов кальция).
охб, Риг-Р и №гар1) [24] (рис. 5). Интересно, что экспрессия гена myh7Ъ стимулируется при сверхэкспрессии MEF-2 (основного транскрипционного стимулятора ТЦМ 1Р) [25]. Это предполагает, что при повышении концентрации комплекса кальций/кальмодулин MEF-2, который может дефосфорилироваться кальцинейри-ном [26], проникает в ядро и регулирует экспрессию myh7. Он одновременно стимулирует синтез miR-499, не допускающей блокаду экспрессии ТЦМ 1Р [25]. Таким образом, экспрессия miR-499 и miR-208b обеспечивает беспрепятственный синтез медленного миозина при наличии соответствующего физиологического стимула (ионов кальция).
МИОЗИНОВЫЙ ФЕНОТИП В УСЛОВИЯХ ГРАВИТАЦИОННОЙ РАЗГРУЗКИ
Изменения миозинового фенотипа волокон при гравитационной разгрузке зарегистрированы во многих лабораториях, в частности, обнаружено, что в m. soleus задних конечностей крыс при вывешивании (рис. 6) увеличивается содержание (%) волокон типа II и уменьшается доля волокон типа I [27-30].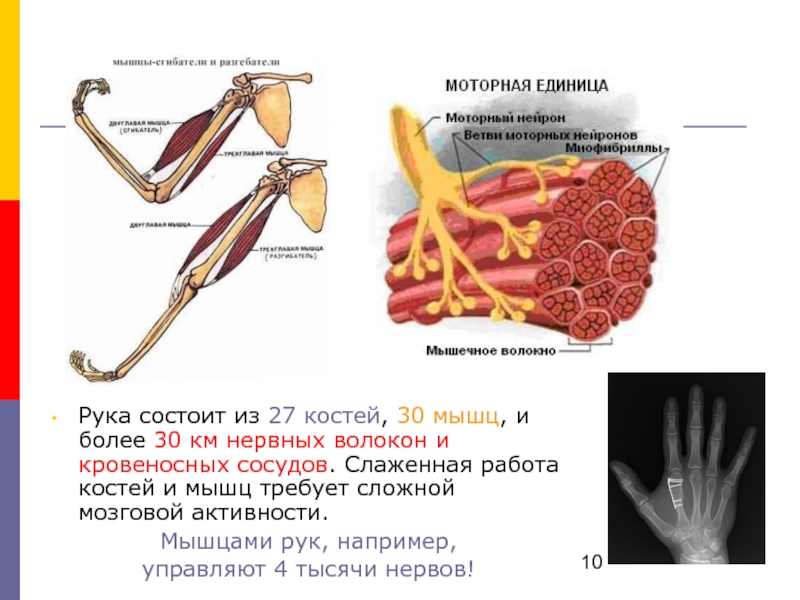
После семидневного космического полета наблюдали сдвиг соотношения типов волокон от «медленных» к «быстрым» в m. soleus и m. extensor digitorum longus крыс [31, 32]. В 12.5-14-дневном полете обнаружено снижение на 20-25% содержания волокон типа I в m. soleus и m. adductor longus [33, 34]. Нами впервые выявлено увеличение относительного содержания волокон типа II в m. soleus и m. vastus lateralis у обезьян после 12.5-суточного космического полета на биоспутнике «КОСМОС-2229» [35]. В тех случаях, когда сдвиг соотношения волокон не удавалось обнаружить с помощью окраски на миофибриллярную АТР-азу, как правило, наблюдалось увеличение ко-
Myh7 (ТЦМ Iß)
Hi l l b
I
miR-208b \
\
Myh6 (ТЦМ Ia)
IHv^ivI
I
miR-208
1
Thrap1
Sox6 U Рur-ß
miR-499
MEF-2
•N,
N
V
Myh7b
Шч/lsJ t
Рис.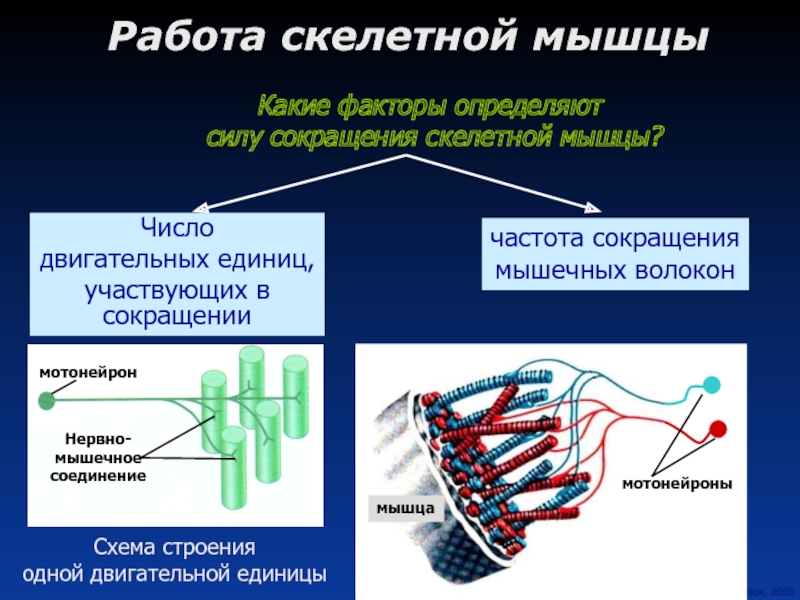 5. Участие микроРНК в регуляции экспрессии ТЦМ IP (по McCarthy и соавт. [25]). Пояснения в тексте
5. Участие микроРНК в регуляции экспрессии ТЦМ IP (по McCarthy и соавт. [25]). Пояснения в тексте
личества волокон, реагирующих с антителами против «быстрого» миозина, и уменьшение содержания волокон, реагирующих с антителами против «медленного» миозина [36-41]. С помощью электрофореза в опытах с вывешиванием обнаружено появление новой изоформы тяжелых цепей миозина — 2d, или 2x [40]. Неоднократно при вывешивании или после космического полета выявляли увеличение доли волокон, содержащих как «медленные», так и «быстрые» формы тяжелых цепей миозина [37, 41]. Уменьшение доли волокон, экспрессирующих «медленную» изо-форму ТЦМ, и увеличение доли волокон, экспресси-рующих «быстрые» изоформы, наблюдали и в пробах m. soleus, взятых у астронавтов после 6-месячного полета [42]. Сдвиг соотношения изоформ ТЦМ в «быструю» сторону обнаружен в m. vastus lateralis у астронавтов после 11-суточного полета при помощи электрофоретического анализа [43].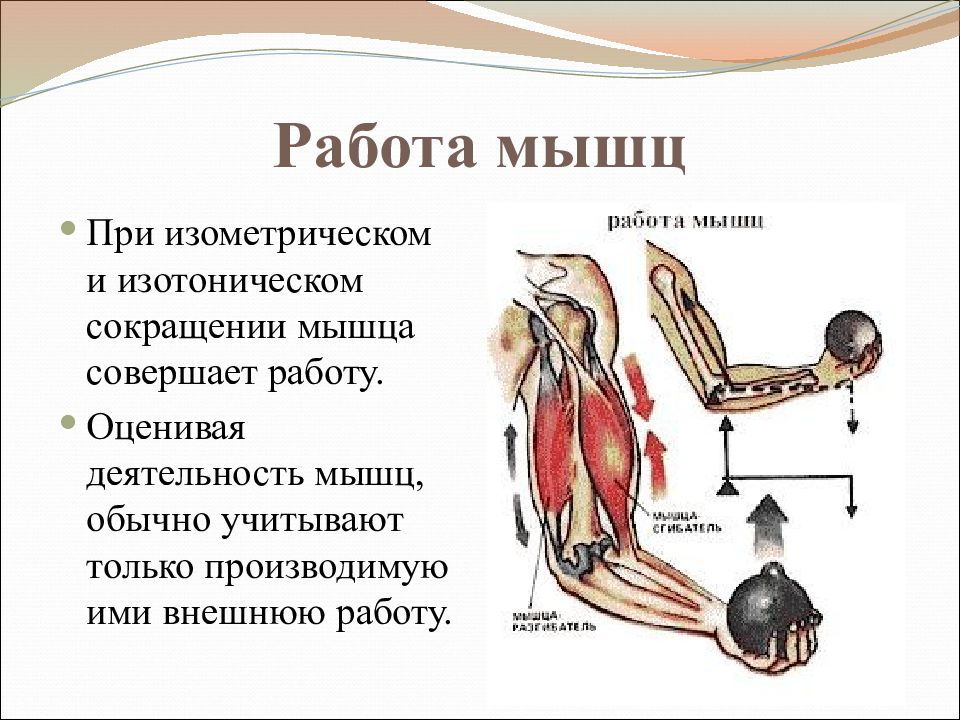 В нашей лаборатории уменьшение доли волокон с ТЦМ «медленного» типа в m. soleus наблюдали уже после 7-суточной экспозиции в условиях «сухой» иммерсии [44, 45]. Интересно, что выраженность трансформации мио-зинового фенотипа в быструю сторону, как правило, не превышает 15-20% волокон, тогда как другие эффекты мышечной разгрузки затрагивают большинство волокон данной мышцы. Этот факт заставляет предположить, что окончательная стабилизация бы-
В нашей лаборатории уменьшение доли волокон с ТЦМ «медленного» типа в m. soleus наблюдали уже после 7-суточной экспозиции в условиях «сухой» иммерсии [44, 45]. Интересно, что выраженность трансформации мио-зинового фенотипа в быструю сторону, как правило, не превышает 15-20% волокон, тогда как другие эффекты мышечной разгрузки затрагивают большинство волокон данной мышцы. Этот факт заставляет предположить, что окончательная стабилизация бы-
строго фенотипа в условиях разгрузки достигается лишь в части трансформированных волокон.
НЕЙРОНАЛЬНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ МИОЗИНОВОГО ФЕНОТИПА В УСЛОВИЯХ ГРАВИТАЦИОННОЙ РАЗГРУЗКИ
Ряд наблюдений свидетельствует о том, что устранение опорной афферентации является основным механизмом, приводящим к «отключению» электрической активности двигательных единиц постураль-ной мышцы в условиях гравитационной разгрузки (для обзора см.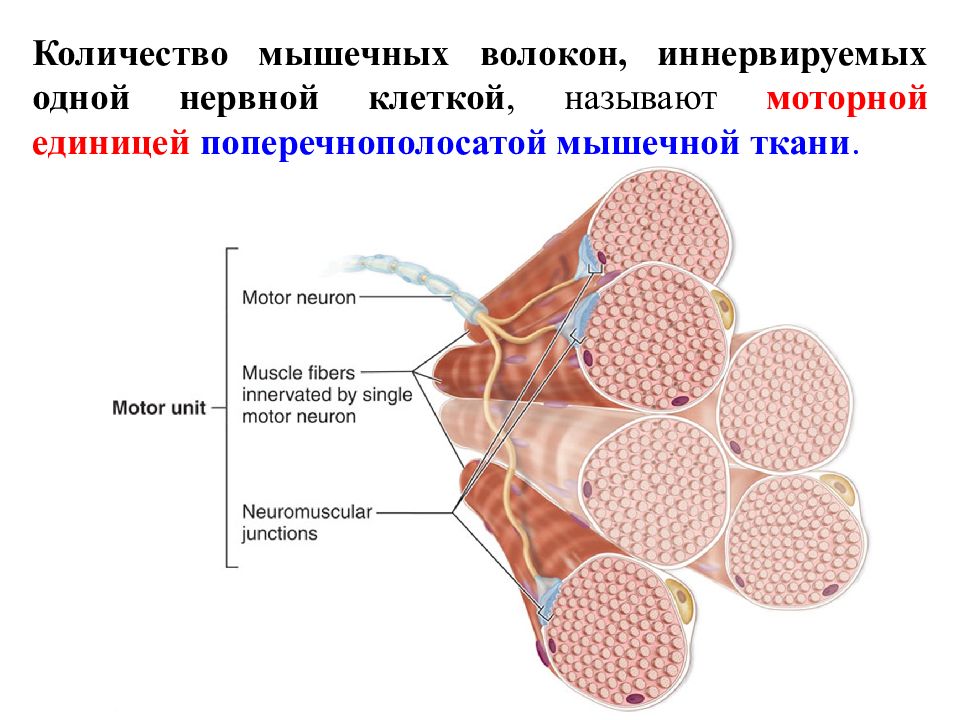 [44]). Применение механической стимуляции опорных зон стопы в этих условиях позволяет поддерживать нормальный уровень электрической активности постуральной мышцы. Интересно, что применение механической стимуляции опорных зон стопы на фоне экспозиции в условиях «сухой» иммерсии позволило избежать снижения доли «медленных» волокон [44, 45]. При вывешивании крыс, у которых подошва одной из задних ног взаимодействовала с искусственной опорой, в m. soleus этой ноги, в отличие от контралатеральной конечности, не наблюдалась трансформация миозинового фенотипа в быструю сторону [46]. Низкочастотная хроническая электростимуляция т. soleus крысы на фоне традиционной модели вывешивания также позволяет предотвратить трансформацию мио-
[44]). Применение механической стимуляции опорных зон стопы в этих условиях позволяет поддерживать нормальный уровень электрической активности постуральной мышцы. Интересно, что применение механической стимуляции опорных зон стопы на фоне экспозиции в условиях «сухой» иммерсии позволило избежать снижения доли «медленных» волокон [44, 45]. При вывешивании крыс, у которых подошва одной из задних ног взаимодействовала с искусственной опорой, в m. soleus этой ноги, в отличие от контралатеральной конечности, не наблюдалась трансформация миозинового фенотипа в быструю сторону [46]. Низкочастотная хроническая электростимуляция т. soleus крысы на фоне традиционной модели вывешивания также позволяет предотвратить трансформацию мио-
зинового фенотипа [47, 48]. Такие же эффекты наблюдали и при хроническом растяжении мышцы или при использовании резистивных упражнений на фоне гравитационной разгрузки (вывешивание или 84-суточная гипокинезия) [49-51].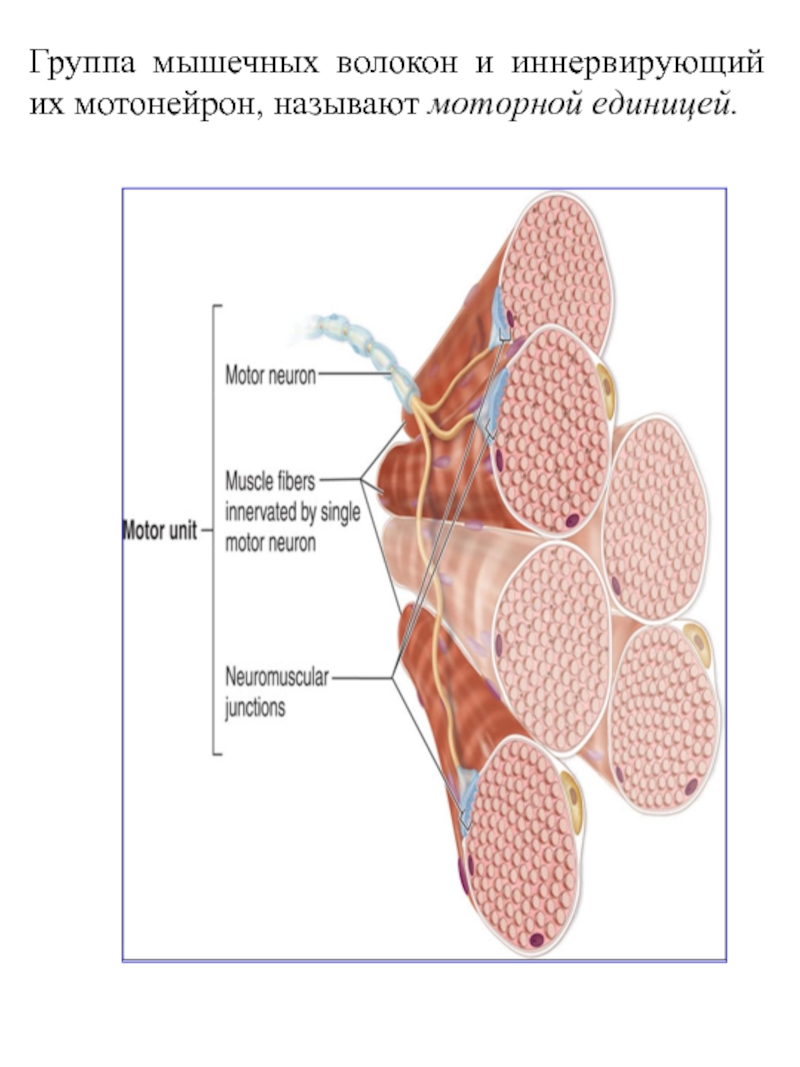 Результаты этих работ свидетельствуют о том, что низкоинтенсивная мышечная активность и резистивные воздействия предотвращают изменение миозинового фенотипа. На основе приведенных наблюдений можно предположить, что сдвиг миозинового фенотипа при гравитационной разгрузке обусловлен, в том числе, изменениями нейронального контроля активности двигательных единиц. Действительно, в экспериментах с трехсуточной сухой иммерсией у человека обнаружена инактивация двигательных единиц медленного типа [52]. Эти результаты подтверждены в экспериментах с регистрацией электрической активности m. soleus и быстрых синергистов у Macaca mulatta в космическом полете [53] и при вывешивании крыс, а также их экспозиции в условиях полета по параболе Кеплера [54]. Можно предположить, что именно «отключение» медленных двигательных единиц приводит к изменению миозинового фенотипа во всех перечисленных случаях. Подтверждением этой гипотезы могут служить результаты, полученные на модели «спинальной изоляции», при которой перерезают все афферентные и нисходящие входы в поясничный отдел спинного мозга при интакт-ных моторных окончаниях.
Результаты этих работ свидетельствуют о том, что низкоинтенсивная мышечная активность и резистивные воздействия предотвращают изменение миозинового фенотипа. На основе приведенных наблюдений можно предположить, что сдвиг миозинового фенотипа при гравитационной разгрузке обусловлен, в том числе, изменениями нейронального контроля активности двигательных единиц. Действительно, в экспериментах с трехсуточной сухой иммерсией у человека обнаружена инактивация двигательных единиц медленного типа [52]. Эти результаты подтверждены в экспериментах с регистрацией электрической активности m. soleus и быстрых синергистов у Macaca mulatta в космическом полете [53] и при вывешивании крыс, а также их экспозиции в условиях полета по параболе Кеплера [54]. Можно предположить, что именно «отключение» медленных двигательных единиц приводит к изменению миозинового фенотипа во всех перечисленных случаях. Подтверждением этой гипотезы могут служить результаты, полученные на модели «спинальной изоляции», при которой перерезают все афферентные и нисходящие входы в поясничный отдел спинного мозга при интакт-ных моторных окончаниях. В этих экспериментах при полном «отключении» спинальных мотонейронов наблюдается сдвиг миозинового фенотипа в «быструю» сторону [55]. Повышение устойчивости по-зных синергий у животных с помощью хронической подачи карбохолина в структуры стриопаллидума в условиях вывешивания сопровождалось даже увеличением доли волокон медленного типа в m. soleus [56]. Отключение афферентной активности m. tibialis anterior, антагонисте m. soleus, на фоне вывешивания с помощью тенотомии позволяло предотвратить увеличение доли волокон быстрого типа в камбало-видной мышце крысы [57]. Можно себе представить, что при гравитационной разгрузке активация m. tibialis anterior [58] или уменьшение интенсивности возбуждающих стриопаллидарных влияний [56] обусловливают снижение импульсной активности «медленных» двигательных единиц m. soleus и тем самым приводят к изменению миозинового фенотипа ее волокон.
В этих экспериментах при полном «отключении» спинальных мотонейронов наблюдается сдвиг миозинового фенотипа в «быструю» сторону [55]. Повышение устойчивости по-зных синергий у животных с помощью хронической подачи карбохолина в структуры стриопаллидума в условиях вывешивания сопровождалось даже увеличением доли волокон медленного типа в m. soleus [56]. Отключение афферентной активности m. tibialis anterior, антагонисте m. soleus, на фоне вывешивания с помощью тенотомии позволяло предотвратить увеличение доли волокон быстрого типа в камбало-видной мышце крысы [57]. Можно себе представить, что при гравитационной разгрузке активация m. tibialis anterior [58] или уменьшение интенсивности возбуждающих стриопаллидарных влияний [56] обусловливают снижение импульсной активности «медленных» двигательных единиц m. soleus и тем самым приводят к изменению миозинового фенотипа ее волокон.
Другой гипотетический нейрофизиологический механизм инактивации двигательных единиц m. so-leus в условиях микрогравитации обсуждается в связи с изучением мышечных эффектов вестибулярной деафферентации животных. С этой целью были проведены опыты с деафферентацией вестибулярных
so-leus в условиях микрогравитации обсуждается в связи с изучением мышечных эффектов вестибулярной деафферентации животных. С этой целью были проведены опыты с деафферентацией вестибулярных
ÍA
Л
Рис. 6. Метод вывешивания крыс по Ильину-Новикову в модификации Morey-Holton
рецепторов с помощью инъекции арсенилата [59]. После месячной адаптации крыс к вестибулярной деафферентации в m. soleus наблюдали уменьшение доли волокон, экспрессирующих ТЦМ IP, и площади их поперечного сечения, а также увеличение доли волокон, экспрессирующих быстрые изоформы ТЦМ. Привлекает внимание внешнее сходство обнаруженного феномена и трансформации миозинового фенотипа в космическом полете. Они указывают на возможность того, что функциональные изменения вестибулярного аппарата в условиях невесомости могут способствовать изменению характера экспрессии миозиновых изоформ. Эта точка зрения достаточно уязвима. Во-первых, трансформация миози-нового фенотипа в медленную сторону наблюдается и в наземных моделях невесомости, когда функция вестибулярного аппарата изменена незначительно (см. выше). Во-вторых, аналогичные исследования, проведенные с использованием хирургической вестибулярной деафферентации (лабиринтэктомии), привели к изменениям противоположной направленности в m. soleus животных. Обнаружен сдвиг миози-нового фенотипа m. soleus в сторону увеличения доли медленных волокон [60, 61]. К сожалению, приведенными публикациями исчерпываются наши знания о вестибулярных влияниях на миозиновый фенотип постуральной мышцы. Очевидно, вопросов остается гораздо больше, чем ответов. Дальнейшие исследования помогут ликвидировать белые пятна в этой области знания.
Эта точка зрения достаточно уязвима. Во-первых, трансформация миози-нового фенотипа в медленную сторону наблюдается и в наземных моделях невесомости, когда функция вестибулярного аппарата изменена незначительно (см. выше). Во-вторых, аналогичные исследования, проведенные с использованием хирургической вестибулярной деафферентации (лабиринтэктомии), привели к изменениям противоположной направленности в m. soleus животных. Обнаружен сдвиг миози-нового фенотипа m. soleus в сторону увеличения доли медленных волокон [60, 61]. К сожалению, приведенными публикациями исчерпываются наши знания о вестибулярных влияниях на миозиновый фенотип постуральной мышцы. Очевидно, вопросов остается гораздо больше, чем ответов. Дальнейшие исследования помогут ликвидировать белые пятна в этой области знания.
ЭКСПРЕССИЯ МИОЗИНОВЫХ ГЕНОВ В УСЛОВИЯХ ГРАВИТАЦИОННОЙ РАЗГРУЗКИ
В начале обзора сказано, что изменения миозинового фенотипа при функциональной разгрузке (disuse)
л
1. 5 -I к I и и и Ii 1.0 — m о_ Si Ii 5 =г £ 0.5 — и 0 N ¥
5 -I к I и и и Ii 1.0 — m о_ Si Ii 5 =г £ 0.5 — и 0 N ¥
1-О Л Г) — *
и.U С HS3 HS7 HS14
30
к г 25
и
11
Q. С ¥ 20
и X
Я) Q-i 15
к щ CD
X J с i
0) 1- =г 10
X 1—
О
I 5
О
0
Рис. 7. Динамика экспрессии мРНК изоформ ТЦМ в т. soleus крысы в условиях разгрузки (вывешивания) [64] №3 — 3 суток вывешивания, №7 — 7 суток вывешивания, №14-14 суток вывешивания. Данные получены методом количественной полимеразной цепной реакции в реальном времени
С HS3 HS7 HS14
определяются снижением экспрессии гена «медленной» изоформы ТЦМ и увеличением экспрессии генов «быстрых» изоформ ([4] и др.). Интересно проследить за динамикой этого процесса. Stevens и соавт. впервые показали, что уже на 4-е сутки вывешивания у крыс породы Wistar наблюдалось небольшое снижение содержания мРНК ТЦМ Iß, которое на 7-е сутки принимает форму тенденции и составляет примерно 20% [62]. Ученым из University of California, Irwin на крысах линии Sprague-Dowley удалось обнаружить статистически значимое снижение мРНК ТЦМ Iß уже после 24 ч вывешивания [63]. На крысах Wistar нами выявлено значимое снижение содержания мРНК ТЦМ Iß на 7-е сутки вывешивания, однако некоторая тенденция к этому наблюдалась уже на 3-и сутки [64] (рис. 7А). Таким образом, во всех этих работах показано снижение экспрессии мРНК медленной изоформы тяжелых це-
пей миозина, однако скорость этого процесса варьирует в разных исследованиях. Отмечен также ранний и существенный рост содержания в мышце мРНК, кодирующих изоформы тяжелых цепей миозина 11Ви IId/x (рис. 7В,Г). Интересно, что после 3-4 суток вывешивания в пулах отдельных волокон не находят ни одного «чисто» медленного волокна, т.е. в каждом волокне идет постепенное замещение ТЦМ Iß изо-формами быстрых типов [65]. По нашим данным, динамика содержания мРНК ТЦМ IIA [66] отличается как от динамики мРНК ТЦМ Iß, так и ТЦМ IId/x и IIB. Уже после 3 суток вывешивания содержание мРНК ТЦМ IIA демонстрирует снижение, которое продолжается до 7 суток. Содержание мРНК ТЦМ IIA после 14 суток вывешивания оказывается столь высоким, что не отличается от контрольных значений (рис. 7Б). Итак, изменениям миозинового фенотипа при гравитационной разгрузке предшествует
Б
В
Г
изменение паттерна экспрессии мРНК, кодирующих соответствующие изоформы ТЦМ, поэтому поиск молекулярных механизмов трансформации миозинового фенотипа в большой степени сводится к изучению механизмов регуляции экспрессии миозиновых генов.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ ИЗОФОРМ ТЯЖЕЛЫХ ЦЕПЕЙ МИОЗИНА В ПОСТУРАЛЬНОЙ МЫШЦЕ В УСЛОВИЯХ РАЗГРУЗКИ
Механизмы сдвига экспрессии генов изоформ ТЦМ в быструю сторону остаются в значительной степени неизученными. При исследовании роли сигнальной системы кальцинейрин/NFATcl на фоне гравитационной разгрузки обнаружено, что через 14 суток вывешивания крыс по Morey-Holton наблюдается интенсивный транспорт NFATd в ядра волокон т. soleus [67]. Однако содержание NFATd в миоядрах мышц человека после 60 суток постельной гипокинезии существенно уменьшено [68]. Налицо явное противоречие этих данных между собой. Вопрос об интенсивности импорта NFAT в ядро при разгрузке остается неясным. С использованием циклоспорина А, ингибитора дефосфорилирования NFATd [69, 70], в нашей лаборатории и в лаборатории K.M. Baldwin было показано, что экспрессия мРНК ТЦМ медленного типа при действии циклоспорина А, ингибитора кальцинейрина, на фоне вывешивания еще больше снижается. Это указывает на возможную компенсаторную функцию этого сигнального пути при разгрузке. При этом различия между интенсивностью снижения экспрессии мРНК ТЦМ медленного типа при разгрузке и в тех же условиях, но при введении циклоспорина А, невелики, хоть и статистически значимы. Сходство амплитуды изменений в этом эксперименте указывает на то, что снижение экспрессии ТЦМ медленного типа при разгрузке в большой степени обусловлено ингибированием сигнального пути кальцинейрин/NFATcl.
Трансформация в сторону быстрого фенотипа не происходит при вывешивании мышей с нокаутом по обеим убиквитинлигазам семейства MuRf [71]. Поэтому MuRf-зависимая экспрессия кальсарци-на-2, возможно, является важным элементом, обеспечивающим стабилизацию быстрого миозинового фенотипа при действии гипотетических механизмов, компенсаторно направленных на сохранение «медленного» фенотипа. Нами впервые обнаружена специфичная для изоформ динамика экспрессии мРНК кальсарцинов в ходе моделируемой гравитационной разгрузки (рис. 8) [66]. На 3-и сутки вывешивания уровень экспрессии кальсарцина-1 был таким же, как в контроле, затем снижался вплоть до 14 су-
ток. Уровень мРНК кальсарцина-2 уже на 3-и сутки был в 2 раза выше, чем в контроле, и продолжал расти до 14 суток.
С учетом как опубликованных, так и собственных данных можно предположить, что в той части волокон, которая содержит значительную долю быстрых изоформ ТЦМ, повышение экспрессии кальсарци-на-2 приводит к предотвращению компенсаторного усиления кальцинейринового пути и тем самым к стабилизации быстрого фенотипа в них. В других волокнах (преимущественно медленных) снижение экспрессии кальсарцина-1 может интенсифицировать кальцинейриновый путь и тем самым стабилизировать их медленный фенотип. Таким образом, к 7-м суткам формируются устойчивые популяции медленных и быстрых волокон при существенном сдвиге в сторону волокон быстрого типа. Кроме того, нам удалось обнаружить статистически значимое увеличение содержания MuRF-1 и MuRF-2 в ядерной фракции гомогената т. [11] позволяет предположить существование причинно-следственной связи между транслокацией MuRF-1 и MuRF-2 в ядра на начальном этапе разгрузки и усилением экспрессии кальсарцина-2.
Возможно, что в этих процессах важную роль играет «депонирование» кальсарцина в структуре а-актинина-2. В нашей лаборатории обнаружено снижение содержания а-актинина-2 в пробах soleus крысы после вывешивания крыс в течение 7 суток [72]. Поэтому можно представить себе освобождение связанного кальсарцина-2 вследствие деградации а-актинина-2 в условиях моделируемой гравитационной разгрузки. Деградацию цитоскелета в условиях разгрузки обычно приписывают кальций-зависимым цистеиновым протеазам — кальпаинам. Поэтому интересно, что при повышенной экспрессии кальпастатина, эндогенного ингибитора кальпаинов, у вывешенных мышей не происходит трансформации миозинового фенотипа в быструю сторону [73]. Отсутствие трансформации у таких мышей может свидетельствовать о том, что активация кальпаинов может быть одним из факторов, способствующих трансформации миозинового фенотипа при разгрузке.14 — 14 суток вывешивания. Данные получены методом количественной полимеразной цепной реакции в реальном времени и методом вестерн-блотинга (третий график)
дация а-актинина-2 окажется не столь глубокой, как при вывешивании без дополнительных воздействий, и депо кальсарцина останется полным. В этом случае снижение экспрессии ТЦМ 1Р будет полностью или частично предотвращено. В подтверждение этой гипотезы нами установлено, что при хроническом введении нифедипина не происходит трансформации мышечных волокон т. soleus крысы при вывешивании [77]. Однако механизмы участия кальпаинов в регуляции экспрессии ТЦМ изучены недостаточно.
В 2015 году в опытах с вывешиванием крыс нам удалось наблюдать активацию (т.е. уменьшение негативного фосфорилирования) другого эндогенного ингибитора сигнального пути кальцинейрин/
NFATc1 — киназы гликогенсинтазы GSK-3P, которая при отсутствии негативного фосфорилирования фосфорилирует NFATc1 и способствует его экспорту из ядра [66]. Активность этого фермента может быть подавлена при высоком содержании оксида азота в волокне, который действует через гуанилат-циклазный механизм [78]. Нами ранее было показано, что при гравитационной разгрузке содержание оксида азота в т. soleus крысы значительно снижено [79]. При этом введение Ь-аргинина, повышающего продукцию оксида азота, предотвращало снижение содержания мРНК ТЦМ 1р. По-видимому, снижение содержания оксида азота в волокне в условиях разгрузки можно рассматривать как один из факторов
стабилизации быстрого фенотипа, который действует через GSK-3P.
Salanova и соавт. [68] связывают снижение интенсивности импорта NFATcl в миоядра при функциональной разгрузке с действием другого механизма: с уменьшением экспрессии каркасного белка Homer-1, которое наблюдалось в m. soleus и m. vastus lateralis человека после длительной постельной гипокинезии. В этой работе функция Homer-1 описана как функция каркасного обеспечения сближения и взаимодействия кальцинейрина и NFATcl в пост-синаптической зоне и в зоне Z-диска. Механизмы регуляции экспрессии этого белка не установлены.
О роли соотношения макроэргических фосфатов в контроле миозинового фенотипа в условиях разгрузки можно судить лишь в том случае, если на том или ином этапе процесса наблюдается значимое изменение этого соотношения. Действительно, в ранних работах группы Ohira обнаружено, что после 10-суточного вывешивания крыс действительно повышается уровень креатинфосфата в m. soleus [80]. Оказалось, что снижение уровня фосфори-лированных макроэргических фосфатов при введении Р-гуанидинпропионовой кислоты предотвращает трансформацию миозинового фенотипа в быструю сторону у вывешенных животных [81]. Известно, что действие хронического введения Р-гуанидинпропионовой кислоты реализуется через АМПК-зависимые сигнальные механизмы [82]. Как меняется активность АМПК в условиях разгрузки не было известно до недавнего времени. Результаты двух работ в этой области явно противоречат друг другу [83, 84]. В нашей лаборатории показано, что при гравитационной разгрузке с использованием классической модели «сухой» иммерсии в течение 3 суток в m. soleus человека наблюдается глубокое снижение уровня фосфорилирования АМПК [85]. Предполагают, что основным механизмом влияния АМПК на экспрессию генов является фосфорилирование/дефосфорилирование молекул HDAC. Можно предположить, что их действие (де-ацетилирование гистона Н3 и транскрипционного фактора MEF-2) должно проявляться в условиях моделируемой гравитационной разгрузки. И действительно, при вывешивании крыс повышается аце-тилирование гистона h4 в локусе генов «быстрых» изоформ миозина [86]. Совсем недавно обнаружили, что при действии классического ингибитора HDAC на фоне вывешивания крыс в m. soleus волокна медленного типа не трансформируются в быстрые [87].
В условиях разгрузки модулируется и механизм микроРНК-зависимой регуляции экспрессии миози-нового гена (см. «Введение»). В камбаловидной мышце крыс при вывешивании снижается экспрессия
микроРНК miR-499 и miR-208b, а значит, возникают условия для работы специфических блокаторов промотора гена myh7, т.е. для снижения экспрессии медленного миозина [25]. С этими данными согласуются и результаты группы Tsika, свидетельствующие о повышении экспрессии блокаторов промотора гена myh7, Pur-a, Pur-ß и SP3 и их связывании со специфическими сайтами на промоторе в условиях вывешивания [88, 89]. Эти процессы могут быть результатом снижения экспрессии гена myh7b и miR-499. О физиологических регуляторах специфических блокаторов экспрессии гена myh7 и регуляторных miR-499 и miR-208b известно мало.
Приведенные в обзоре данные о регуляции экспрессии гена myh7, показывают, что, несмотря на изучение молекулярных механизмов, определяющих снижение экспрессии медленной изоформы ТЦМ в условиях гравитационной разгрузки, составить целостную картину о работе этих механизмов пока не удается. Можно предполагать, что функционирование сложной системы эндогенных ингибиторов сигнального пути кальцинейрин/NFATcl направлено на преодоление компенсаторных ответов мышцы и стабилизацию быстрого фенотипа. В то же время неизвестно, какие эпигеномные процессы запускают процесс инактивации гена myh7 и снижения экспрессии медленной изоформы ТЦМ на самой начальной стадии гравитационной разгрузки в течение первых 24 ч.
Еще меньше известно о том, какие механизмы стимулируют работу промоторов генов «быстрых» изоформ ТЦМ. Предполагают, что в отсутствие стимуляторов «медленной» изоформы ТЦМ связывание ДНК с транскрипционным регулятором MyoD усиливает экспрессию генов «быстрого» миозина [90]. При этом у вывешенных животных с нокаутом MyoD не происходит трансформации в быструю сторону [91]. Этот факт позволяет предположить, что MyoD существенно влияет на экспрессию генов быстрых изоформ ТЦМ при гравитационной разгрузке. Интересно, что стимулирующее действие MyoD на экспрессию «быстрых» изоформ миозина ингибируется NFATcl [92]. Другой механизм ре-ципрокной регуляции характерен для экспрессии ТЦМ IIA, с одной стороны, и IId/x и IIB, с другой. Обнаружено, что при спинальной изоляции экспрессия ТЦМ IIA снижается, а ТЦМ IId/x повышается [93]. Аналогичный феномен мы наблюдали на ранней стадии гравитационной разгрузки в экспериментах с вывешиваниием крыс [66]. Установлено, что сразу за геном ТЦМ IIA располагается промотор гена ТЦМ IId/x, транскрипция с которого осуществляется в двух направлениях. Транскрипция со смысловой цепи запускает транскрипцию гена IIx, с ком-
плементарной цепи синтезируется антисмысловая РНК, которая приводит к разрушению мРНК ТЦМ IIA [93]. Таким образом, активация экспрессии гена «быстрой» изоформы миозина вызывает снижение экспрессии гена ТЦМ IIA.
ЗАКЛЮЧЕНИЕ
Регуляция экспрессии миозиновых генов интенсивно изучается в настоящее время, однако ясное представление о давно известном и неразгаданном до сих пор феномене изменения характера экспрессии этих генов в условиях гравитационной разгрузки отсутствует. Ответы на основные вопросы, касающиеся описываемого феномена, должны быть получены в ближайшем будущем. Адаптивное значение трансформации мышечных волокон в условиях гравитационной разгрузки в многочисленных публикациях, связанных с этой проблемой, не затрагивается. В условиях гипогравитации «отключаются» преимущественно постуральные экстензоры, прежде всего m. soleus, а в ней — волокна, экспрессирующие медленную изоформу ТЦМ и, следовательно, реализующие медленный «тонический» режим сократительной активности. Изменение характера постуральных синергий в условиях реальной и моделируемой невесомости приводит к устранению «тонического» компонента двигательной функции. Поэтому сдвиг миозинового фенотипа в быструю сторону может быть составной частью таких адаптивных перестроек двигательного аппарата млекопитающих. Другой взгляд на адаптивное значение сдвига миозиново-го фенотипа основан на известных различиях трофических механизмов, т.е. механизмов поддержа-
ния структуры и метаболизма мышечных волокон медленного и быстрого типов. В элегантной работе группы Ohira [94] показано, что денервация m. so-leus у вывешенных крыс не приводит к нарастанию атрофических изменений, т.е. к редукции площади поперечного сечения волокон. При тех же условиях атрофия m. plantaris была существенно меньше, чем в m. soleus, но была намного более выраженной, если мышца при этом еще и денервировалась. Из этого следует, что нейротрофические неимпульсные влияния в быстром волокне эффективно предотвращают интенсивное развитие атрофических процессов. Эта стратегия не характерна для волокон медленного типа, поддержание структуры которых полностью определяется интенсивностью и длительностью сократительной деятельности. Можно предположить, что трансформация миозинового фенотипа медленных волокон, превращающая их в быстрые, позволяет увеличить количество волокон, сохраняющих объем миофибриллярного аппарата в условиях бездеятельности за счет нейротрофических влияний. •
Я чрезвычайно признателен своему учителю И.Б. Козловской, в совместной работе и в творческом общении с которой сформировался мой интерес к обсуждаемой здесь теме.
Хотелось бы также выразить благодарность С.А. Тыганову за помощь в подготовке рукописи к печати.
Работа поддержана грантом Российского научного фонда № 14-15-00358.
СПИСОК ЛИТЕРАТУРЫ
1. Ranvier L. // CR Acad. Sci. Paris. 1873. V. 77. P. 1030-1034.
2. Schiaffino S., Reggiani C. // Physiol. Rev. 2010. V. 91. P. 14471531.
3. Burke R.E. // J. Physiol. 1967. V. 193. № 1. P. 141-160.
4. Pette D. // Skeletal muscle plasticity in health and disease / Eds Bottinelli R., Reggiani C. Springer, 2006. P. 1-27.
5. Tavi P., Westerblad H. // J. Physiol. 2011. V. 589. Pt 21. P. 5021-5031.
6. Chin E.R. // Exerc. Sport Sci. Rev. 2010. V. 38. № 2. P. 76-85.
7. Schiaffino S.// Acta Physiol. (Oxf.). 2010. V. 199. № 4. P. 451-463.
8. Shen T., Liu Y., Contreras M., Hernandez-Ochoa E.O., Randall W.R., Schneider M.F. // Histochem. Cell Biol. 2010. V. 134. № 4. P. 387-402.
9. Frey N., Frank D., Lippl S., Kuhn C., Kögler H., Barrientos T., Rohr C., Will R., Müller O.J., Weiler H., Bassel-Duby R., Katus H.A., Olson E.N. // J. Clin. Invest. 2008. V. 118. P. 3598-3608.
10. Frey N., Richardson J.A., Olson E.N. // Proc. Natl. Acad. Sci. USA. 2000. V. 97. P. 14632-14637.
11. Moriscot A., Baptista I.L., Bogomolovas J., Krohne C., Hirner S., Granzier H., Labeit S. // J. Struct. Biol. 2010. V. 170. № 2.
P. 344-353.
12. Lange S., Xiang F., Yakovenko A., Vihola A., Hackman P., Rostkova E., Kristensen J., Brandmeier B., Franzen G., Hedberg B., et al. // Science. 2005. V. 308. P. 1599-1603.
13. Seto J.T., Quinlan K.G., Lek M., Zheng X.F., Garton F., MacArthur D.G., Hogarth M.W., Houweling P. J., Gregorevic P., Turner N., Cooney G.J., Yang N., North K.N. // J. Clin. Invest. 2013. V. 123. № 10. P. 4255-4263.
14. Shen T., Cseresnyes Z., Liu Y., Randall W.R., Schneider M.F. // J. Physiol. 2007. V. 579. № 2. P. 535-551.
15. Martins K.J., St-Louis M., Murdoch G.K., MacLean I.M., McDonald P., Dixon W.T., Putman C.T., Michel R.N. // J. Physiol. 2012. V. 590. № 6. P. 1427-1442.
16. Liu Y., Shen T., Randall W.R., Schneider M.F. // J. Muscle Res. Cell Motility. 2005. V. 26. P. 13-21.
17. Liu Y., Randall W.R., Martin F. Schneider M.F. // J. Cell Biol. 2005. V. 168. № 6. P. 887-897.
18. Potthoff M.J., Wu H., Arnold M.A., Shelton J.M., Backs J., McAnally J., Richardson J. A., Bassel-Duby R., Olson E.N. // J. Clin. Invest. 2007. V. 117. P. 2459-2467.
19. Sanchez A.M., Candau R.B., Csibi A., Pagano A.F., Raibon A., Bernardi H. // Amer. J. Physiol. Cell Physiol. 2012. V. 303. № 5. P. C475-485.
20. Röckl K.S., Hirshman M.F., Brandauer J., Fujii N.,
Witters L.A., Goodyear L.J. // Diabetes. 2007. V. 56. № 8. P. 2062-2069.
21. McGee S.L., Hargreaves M. // Clin. Sci. (London). 2010. V. 118. № 8. P. 507-518.
22. Lira V.A., Brown D.L, Lira A.K., Kavazis A.N., Soltow Q.A., Zeanah E.H., Criswell D.S. // J. Physiol. 2010. V. 588. № 18.
P. 3551-3566.
23. Rossi A.C., Mammucari C., Argentini C., Reggiani C., Schiaf-fino S. // J. Physiol. 2010. V. 588. № 2. P. 353-364.
24. Van Rooij E.,Quiat D., Johnson B.A., Sutherland L.B., Qi X., Richardson J.A., Kelm R.J.Jr., Olson E.N. // Dev. Cell. 2009. V. 17. P. 662-673.
25. McCarthy J. J., Esser K.A., Peterson C.A., Dupont-Versteeg-den E.E. // Physiol. Genomics. 2009. V. 39. № 3. P. 219-226.
26. Dunn S.E., Simard A.R., Bassel-Duby R., Williams R.S., Michel R.N. // J. Biol. Chem. 2001. V. 276. № 48. P. 45243-45254.
27. Templeton G.H., Sweeney H.L., Timson B.F., Padalino M., Dudenhoeffer G.A. // J. Appl. Physiol. (1985). 1988. V. 65. № 3. P. 1191-1195.
28. Desplanches D., Mayet M.H., Sempore B., Flandrois R. //J. Appl. Physiol. (1985). 1987. V. 63. № 2. P. 558-563.
29. Riley D.A., Slocum G.R., Bain J.L., Sedlak F.R., Sowa T.E., Mel-lender J.W. // J. Appl. Physiol. (1985). 1990. V. 69. № 1. P. 58-66.
30. Desplanches D., Kayar S.R., Sempore B., Flandrouis R., Hoppeler H. // J. Appl. Physiol. (1985). 1990. V. 69. № 2. P. 504-508.
31. Martin T.P., Edgerton V.R., Grindeland R.E. // J. Appl. Physiol. (1985). 1988. V. 65. № 5. P. 2318-2325.
32. Desplanches D., Mayet M.H., Ilyina-Kakueva E.I., Sempore B., Flandrois R. // J. Appl. Physiol. (1985). 1990. V. 68. № 1.
P. 48-52.
33. Desplanches D., Mayet M.H., Ilyina-Kakueva E.I., Frutoso J., Flandrois R. // Eur. J. Appl. Physiol. 1991. V. 63. P. 288-292.
34. Miu B., Martin T.P., Roy R.R., Oganov V.S., Ilyina-Kakueva E.I., Marini J.F., Leger J.J., Bodine-Fowler S., Edgerton V.R. // FASEB J. 1990. V. 4. P. 64-72.
35. Shenkman B.S., Kozlovskaya I.B., Kuznetsov S.L., Nemirovskaya T.L., Desplanches D. // J. Gravit. Physiol. 1994. V. 1. № 1. P. P64-P66.
36. Baldwin K.M., Herrick R., Ilyina-Kakueva E.I., Oganov V.S. // FASEB J. 1990. V. 4. P. 79-83.
37. Ohira Y., Jiang B., Roy R.R., Oganov V., Ilyina-Kakueva E., Marini J.F., Edgerton V.R. // J. Appl. Physiol. (1985). 1992. V. 73. № 2. Suppl. P. 51S-57S.
38. Guezennec C.Y., Gilson E., Serrurier B. // Eur. J. Appl. Physiol. 1990. V. 60. № 6. P. 430-435.
39. Campione M., Ausoni S., Guezennec C., Shiaffino S. // J. Appl. Physiol. 1993. V. 74. № 3. P. 1156-1160.
40. Takahashi H., Wada M., Katsuta S. // Acta Physiol. Scand. 1991. V. 143. № 1. P. 131-132.
41. Thomason D., Morrison P.R., Oganov V., Ilyina-Kakueva E.I., Booth F.W., Baldwin K.M. // J. Appl. Physiol. 1992. V. 73. № 2. Suppl. P. 90S-93S.
42. Trappe S., Costill D., Gallagher P., Creer A., Peters J.R., Evans H., Riley D.A., Fitts R.H. // J. Appl. Physiol. (1985). 2009. V. 106. № 4. P. 1159-1168.
43. Zhou M.Y., Klitgaard H., Saltin B., Roy R.R., Edgerton V.R., Gollnick P.D. // J. Appl. Physiol. (1985). 1995. V. 78. № 5.
P. 1740-1744.
44. Григорьев А.И., Козловская И.Б., Шенкман Б.С. // Рос. физиол. журн. им. И.М. Сеченова. 2004. Т. 90. № 5. С. 508-521.
45. Шенкман Б.С., Подлубная З.А., Вихлянцев И.М., Литвинова К.С., Удальцов С.Н., Немировская Т.Л., Лемешева Ю.С., Мухина А.М., Козловская И.Б. // Биофизика. 2004. Т. 49. Вып. 5. С. 881-890.
46. Nemirovskaya T.L., Shenkman B.S. // Eur. J. Appl. Physiol.
2002. V. 87. № 2. P. 120-126.
47. Leterme D., Falempin M. // Pflug. Arch. 1994. V. 426. P. 155-160.
48. Dupont E., Cieniewski-Bernard C., Bastide B., Stevens L. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2011. V. 300. P. R408-R417.
49. Falempin M., Mounier Y. // Acta Astronautics. 1998. V. 42. № l-8. P. 489-501.
50. Подлубная З.А., Вихлянцев И.М., Мухина А.М., Немиро-вская Т.Л., Шенкман Б.С. // Биофизика. 2004. Т. 49. Вып. 3. С. 424-429.
51. Gallagher P., Trappe S., Harber M., Creer A., Mazzetti S., Trappe T., Alkner B., Tesch P. //Acta Physiol. Scand. 2005. V. 185. P. 61-69.
52. Киренская А.В., Козловская И.Б., Сирота М.Г. // Физиол. человека. 1986. Т. 12. № 1. С. 617-632.
53. Roy R.R., Hodgson J.A, Aragon J., Day M.K., Kozlovskaya I., Edgerton V.R. // J. Gravit. Physiol. 1996. V. 3. № 1. P. 11-15.
54. Kawano F., Nomura T., Ishihara A., Nonaka I., Ohira Y. // Neurosci. 2002. V. 114. № 4. P. 1133-1138.
55. Huey K.A., Roy R.R., Baldwin K.M., Edgerton V.R. // Muscle Nerve. 2001. V. 24. № 4. P. 517-526.
56. Шенкман Б.С., Шаповалова К.Б., Мухина А.М., Козловская И.Б., Немировская Т.Л., Камкина Ю.В. // ДАН. 2006. Т. 407. № 6. С. 842-844.
57. Шенкман Б.С., Немировская Т.Л., Мухина А.М., Подлуб-ная З.А., Вихлянцев И.М., Ардабьевская А.В., Козловская И.Б., Григорьев А.И. // ДАН. 2005. Т. 400. № 6. С. 840-843.
58. Юганов Е.М., Касьян И.И., Черепахин М.А., Горшков А.И. // Пробл. косм. биол. 1962. Т. 2. С. 206-214.
59. Luxa N., Salanova M., Schiffl G., Gutsmann M., Besnard S., Denise P., Clarke A., Blottner D. // J. Vestib. Res. 2013. V. 23. P. 187-193.
60. Fuller Ch. // XII Conf. on space biology and aerospace medicine, Moscow. 2002. P. 449-450.
61. Kasri M., Picquet F., Falempin M. // Exp. Neurol. 2004. V. 185. № 1. P. 143-153.
62. Stevens L., Sultan K.R., Peuker H., Gohlsch B., Mounier Y., Pette D. // Am. J. Physiol. Cell Physiol. 1999. V. 46. P. 1044-1049.
63. Giger J.M., Bodell P.W., Zeng M., Baldwin K.M., Haddad F. // J. Appl. Physiol. (1985). 2009. V. 107. № 4. P. 1204-1212.
64. Шенкман Б.С., Ломоносова Ю.Н. // ДАН. 2014. Т. 459. № 6.
C. 759-761.
65. Stevens L., Gohlsch B., Mounier Y., Pette D. // FEBS Lett. 1999. V. 463. P. 15-18.
66. Lomonosova Y.N., Turtikova O.V., Shenkman B.S. // J. Muscle Res. Cell Motility. 2016. V. 37. № 1. P. 7-16. doi: 10.1007/ s10974-015-9428-y.
67. Dupont-Versteegden E.E., Knox M., Gurley C.M., Houle J.D., Peterson C.A. // Am. J. Physiol. Cell Physiol. 2002. V. 282. P. C1387-C1395.
68. Salanova M., Bortoloso E., Schiffl G., Gutsmann M., Belavy’
D.L., Felsenberg D., Sandra Furlan S., Volpe P., Blottner D. // FASEB J. 2011. V. 25. P. 4312-4325.
69. Ломоносова Ю.Н., Шенкман Б.С., Немировская Т.Л. // Рос. физиол. журн. им. И.М. Сеченова. 2009. Т. 95. № 9. С. 969-974.
70. Pandorf C.E., Jiang W.H., Qin A.X., Bodell P.W., Baldwin K.M., Haddad F. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2009. V. 297. № 4. P. R1037-R1048.
71. Labeit S., Kohl C.H., Witt C.C., Labeit D., Jung J., Granzier H. // J. Biomed. Biotechnol. 2010. V. 2010. Article 693741.
72. Мирзоев Т.М., Шенкман Б.С., Ушаков И.Б., Огнева И.В. // ДАН. 2012. Т. 44. № 2. С. 216-218.
73. Tidball J.G.., Spencer M.J. // J. Physiol. 2002. V. 545. № 3. P. 819-828.
74. Ingalls C.P., Warren G.L., Armstrong R.B. //J. Appl. Physiol. 1999. V. 87. № 1. P. 386-390.
75. Ingalls C.P., Wenke J.C., Armstrong R.B. // Aviat. Space Environ. Med. 2001. V. 72. № 5. P. 471-476.
76. Kandarian S.C., Stevenson E.J. // Exerc. Sport Sci. Rev. 2002. V. 30. № 3. P. 111-116.
77. Мухина А.М., Алтаева Э.Г., Немировская Т.Л., Шенкман Б.С. // Рос. физиол. журн. им. И.М. Сеченова. 2006. Т. 92. № 11. С. 1285-1295.
78. Drenning J. A., Lira V.A., Simmons C.G., Soltow Q.A., Sell-man J.E., Criswell D.S. // Am. J. Physiol. Cell Physiol. 2008. V. 294. P. 1088-1095.
79. Ломоносова Ю.Н., Каламкаров Г.Р., Бугрова А.Е., Шевченко Т.Ф., Карташкина Н.Л., Лысенко Е.А., Швец В.И., Немировская Т.Л. // Биохимия. 2011. Т. 76. Вып. 5. С. 699-710.
80. Wakatsuki T., Ohira Y., Yasui W., Nakamura K., Asakura T., Ohno H., Yamamoto M. // Jpn. J. Physiol. 1994. V. 44. № 2. P. 193-204.
81. Matoba T., Wakastuki T., Ohira Y. // Med. Sci. Sports Exerc. 1993. V. 25. № 5. P. S157.
82. Zong H., Ren J.M., Young L.H., Pypaert M., Mu J., Birnbaum M.J., Shulman G.I. // Proc. Natl. Acad. Sci. USA. 2002. V. 99. № 25. P. 15983-15987.
83. Han B., Zhu M.J., Ma C., Du M. // Appl. Physiol. Nutr. Metab. 2007. V. 32. P. 1115-1123.
84. Hilder T.L., Baer L.A., Fuller P.M., Fuller C.A., Grindeland
R.E., Wade C.E., Graves L.M. //J. Appl. Physiol. 2005. V. 99. P. 2181-2188.
85. Vilchinskaya N.A., Mirzoev T.M., Lomonosova Y.N., Ko-zlovskaya I.B., Shenkman B.S. // J. Musculoskelet. Neuronal Interact. 2015. V. 15. № 3. P. 286-293.
86. Pandorf C.E., Haddad F., Wright C., Bodell P.W., Baldwin K.M. // Am. J. Physiol. Cell. Physiol. 2009. V. 297. P. C6-C16.
87. Dupre-Aucouturier S., Castells J., Freyssenet D., Desplanches D. // J. Appl. Physiol. 2015. V. 119. P. 342-351.
88. Tsika G., Ji J., Tsika R. // Mol. Cell. Biol. 2004. V. 24. № 24. P. 10777-10791.
89. Ji J., Tsika G.L., Rindt H., Schreiber K.L., McCarthy J.J., Kelm R.J., Jr., Tsika R. // Mol. Cell. Biol. 2007. V. 27. № 4. P. 1531-1543.
90. Wheeler M.T., Snyder E.C., Patterson M.N., Swoap S.J. // Am. J. Physiol. 1999. V. 276. №. 5. Pt. 1. P. C1069-C1078.
91. Seward D.J., Haney J.C., Rudnicki M.A., Swoap S.J. // Am. J. Physiol. Cell. Physiol. 2001. V. 280. № 2. P. C408-C413.
92. Ehlers M.L., Celona B., Black B.L. // Cell Rep. 2014. V. 8. P. 1-10.
93. Pandorf C.E., Haddad F., Roy R.R., Qin A.X., Edgerton V.R., Baldwin K.M. // J. Biol. Chem. 2006. V. 281. № 50. P. 3833038342.
94. Ohira Y., Yoshinaga T., Ohara M., Kawano F., Wang X.D., Higo Y., Terada M., Matsuoka Y., Roy R.R., Edgerton V.R. // Cells Tissues Organs. 2006. V. 182. № 3-4. P. 129-142.
Моторная единица
6. Нарушения «принципа величины».
(Violations «the principle of value»)Изначально предполагалось, что принцип стоимости действует при увеличении изометрическое сокращение. изометрическое сокращение — сокращение мышцы без изменения ее длины. мышца сокращается изометрически при совершении статической работы. но мышц не всегда изометрический и изотонический еще auxances. даже в тех мышцах, которые вы можете изучить изометрическое сокращение, тот же двигатель может иметь различные пороговые значения для активации, привлечение по вашей ссылке на сгибание и разгибание. такие комментарии, которые часто упоминаются как «задания специфического ответа мотонейронов» Ericksson et al (Эриксоновский соавт)., 1984, описать действие жевательных мышц человека English (Английский), 1985 (И 1985) подтвердил, что не все двигательные единицы активируются во время мышечного сокращения.
Идея о том, что существуют отдельные группы нейронов, реагируют по-разному-либо направленного движения, является исключением «принципа величины» как для мышц челюсти и мышцы конечностей. до недавнего времени предполагалось, что в зависимости от типа движения активирует один или другой блок мотора, но позднее было доказано, что это на самом деле две мышцы, два двигательных нейронов бассейна, эта мышца находится в процессе разделения на два разных. очень убедительный пример была приведена Новая Зеландия невролог Дерек Денни-это Браун, который в 1949 году показали, что при «хватательном», движение кисти в мышцах flexor profundus digitorum (сгибателей digitorum profundus) моторные единицы включаются в том же порядке, и в «сгибательном» движения в разном порядке.
Также провели серию экспериментов на интактных и decerebrated кошек. первый в 1970 году группа ученых в ходе своих исследований обнаружили, что FF и FR в мотонейронах может быть возбуждена полисинаптические входы от низкопороговых кожных афферентов, и с мотонейронах, напротив могут быть те же входы тормозил. тем самым стимулируя постсинаптического потенциала ГАП-Ф мотонейронах является destinationsin, с-нейронов trisynaptic из Illert и т. д. 1976. В 1982 году было показано, что этот эффект называется моторной коры и красного ядра, увидеть. головного мозга Burke (Берк), 1982
Fast Muscle Fiber — обзор
2.2 Типы мышечных волокон
Медленно и быстро сокращающиеся мышечные волокна уже были кратко рассмотрены; здесь мы их подробно обсуждаем. Мышца состоит из разных мышечных волокон, которые различаются по внешнему виду и другим характеристикам. Например, сравнивая мышцы, выделенные у дикого и домашнего кролика, дикий кролик имеет более красноватый цвет. Также при сравнении куриной грудки и бедра последнее более красноватое, чем грудка.
Таким образом, мышца, подвергающаяся постоянной нагрузке (например, мышца дикого кролика или бедра курицы), красноватая и состоит из медленно сокращающихся мышечных волокон, тогда как мышцы, которые не подвергаются постоянной нагрузке ( мышцы домашнего кролика и куриная грудка) светлее по цвету и состоят из быстро сокращающихся мышечных волокон. Возникновение мышечных волокон зависит от напряжения, иннервации и типа иннервации. Внутри мышцы могут появляться мышечные волокна другого типа — например, ближе к костям мышцы более красноватые, чем у поверхности.Вообще говоря, разгибатели содержат больше быстро сокращающихся мышечных волокон, чем сгибатели. В человеческом теле есть мышцы, которые состоят в основном из медленно сокращающихся или быстро сокращающихся мышечных волокон. Мышечные волокна иннервируются альфа-мотонейронами. Моторный нейрон и все мышечные волокна, с которыми он соединяется, представляют собой двигательную единицу. Количество мышечных волокон, иннервируемых одним мотонейроном, может быть разным; например, в экстраокулярных мышцах 10 мышечных волокон иннервируются одним двигательным нейроном, в то время как мышцы бедра могут иметь 1000 волокон в каждой единице.Аксоны мотонейронов спинного мозга иннервируют периферические мышцы, и они могут иметь длину более 1 м (рис. 2.9).
Рис. 2.9. Моторные агрегаты. В человеческом теле есть три различных двигательных единицы. Моторная единица типа I обладает высокой устойчивостью к утомлению, имеет более низкий порог активации, содержит меньше мышечных волокон и генерирует низкую силу во время сокращения. Моторный блок типа II также устойчив к усталости, имеет более высокий порог активации и создаваемое усилие выше по сравнению с типом I.Двигательная единица типа IIb утомительна, имеет высокий порог активации, иннервирует большинство мышечных волокон и создает наибольшую силу во время сокращения.
Электродвигатели различаются по размеру и порогу срабатывания. Большие двигательные единицы имеют более высокие пороги активации и содержат более бледные быстро сокращающиеся мышечные волокна, в то время как мелкие двигательные единицы имеют более низкие пороги активации и содержат красноватые медленно сокращающиеся мышечные волокна. Различия в физиологических, биохимических, гистохимических и генетических характеристиках двигательных единиц также служат полезной основой для их различения (Таблица 2.2).
Таблица 2.2. Характеристики мышечных волокон
| Характеристики | Быстросокращающиеся волокна | Медленно сокращающиеся волокна |
|---|---|---|
| Время до максимального сокращения (мс) | 50–80 | 100–200 |
| Частота для достижения тетанического сокращения (Гц / с) | 60 | 16 |
| Плотность миоглобина и митохондрий | Низкий | Высокий |
| Доминирующий путь синтеза АТФ | Анаэробный | Аэробный |
| Гликогеносодержание 900 | Высокая | Низкая |
| Миозин-АТФазная активность | Высокая | Низкая |
| Капилляризация | Низкая | Высокая |
| Устойчивость к усталости | Плохая | Высокая |
| Размер двигательного нейрона | Большой | Маленький |
| Высокий | Низкий | |
| Генерирующая сила | Высокий | Низкий |
Исходя из физиологических характеристик мышечные волокна человека быстро утомляются, устойчивы к быстрому утомлению, быстрые промежуточные или медленные волокна; по биохимическим свойствам они представляют собой быстрые гликолитические волокна типа IIb, быстрые окислительно-гликолитические волокна типа IIa или медленные окислительные волокна типа I.Другая классификация дает другой тип волокон, волокна IIi, с характеристиками между типами IIa и IIb. Красные медленно сокращающиеся волокна содержат большое количество железа, которое связано с большим количеством митохондрий и содержанием миоглобина. Красные волокна обладают более высокой окислительной способностью; они способны потреблять большое количество кислорода и уменьшать его содержание в митохондриях. Кислород всегда связан с железосодержащими молекулами; это высокое содержание железа также способствует его красному цвету. В таблице 2.2 показаны различия между типами мышечных волокон.Различия в пороге активации определяют порядок активации сокращающихся волокон разных типов. Медленно сокращающиеся мышечные волокна с отличным уровнем потребления кислорода, высоким содержанием митохондрий и активностью окислительных ферментов являются наиболее эффективными волокнами. Они способны создавать силу в точке сжатия из-за низкого порога активации. Большинство волокон антигравитационных мышц — это медленно сокращающиеся волокна, и эти волокна задействованы во время ходьбы и движений низкой интенсивности.Один из основных законов природы — это прибыльность, которая в данном случае означает задействование в первую очередь наиболее прибыльных мышечных волокон. Быстро сокращающиеся мышечные волокна с их более высокими порогами активации и генерированием огромной силы можно использовать во время полета и выживания; однако эти волокна потребляют много энергии и производят много молочной кислоты (обсуждается позже). Они могут быть активированы только стимулами высокой интенсивности из-за более высокого порога. Если использовать аналогию, медленно сокращающиеся волокна подобны экономичным городским автомобилям, а быстро сокращающиеся мышечные волокна — мощным гоночным автомобилям.
Fast-Twitch Vs. Типы медленно сокращающихся мышечных волокон + советы по тренировкам
Хотите развить выносливость? А что насчет власти? Нужно ли разбивать мечты о том, чтобы стать звездным бомбардиром или марафонцем, если соотношение сокращений не идеальное? Не обязательно. Типы мышечных волокон, задействованные в различных программах тренировок, могут влиять на спортивные результаты.
В этой статье мы подробно исследуем два типа мышечных волокон и обсудим, как тренировать каждый тип в соответствии с спортивными целями.
Что такое мышечные волокна?
Скелетные мышцы состоят из отдельных мышечных волокон . И, как и сами мышцы, не все мышечные волокна одинаковы. Существует два типа волокон скелетных мышц, быстро сокращающиеся и медленно сокращающиеся, и каждый из них выполняет разные функции, которые важно понимать, когда дело доходит до программирования движений и упражнений.
Медленно сокращающиеся мышечные волокна устойчивы к усталости и ориентированы на постоянные, более мелкие движения и контроль осанки.Они содержат больше митохондрий и миоглобина и обладают аэробной природой по сравнению с быстро сокращающимися волокнами. Медленно сокращающиеся волокна также иногда называют типом I или красными волокнами из-за их кровоснабжения. Быстро сокращающиеся мышечные волокна обеспечивают большую и мощную силу, но на меньшую продолжительность и быстро утомляются. Они более анаэробны с меньшим кровоснабжением, поэтому их иногда называют белыми волокнами или типом II. Скелетные мышцы содержат оба типа волокон, но их соотношение может различаться в зависимости от множества факторов, включая функцию мышц, возраст и тренировку.
Скелетные мышцы содержат волокна обоих типов, но их соотношение может различаться в зависимости от множества факторов, включая функцию мышц, возраст и тренировку.
Типы мышечных волокон с медленным сокращением и с быстрым сокращением
Два типа волокон скелетных мышц: медленные (тип I) и быстро сокращающиеся (тип II). Медленно сокращающиеся мышечные волокна поддерживают упражнения на выносливость на длинные дистанции, такие как марафонский бег, в то время как быстро сокращающиеся мышечные волокна поддерживают быстрые и мощные движения, такие как спринт или поднятие тяжестей.
Сравнительная таблица типов мышечных волокон
Характеристика | Медленно-сокращающийся тип I | Быстрое переключение типа IIA | Fast-Twitch типа IIX или IIB |
Мероприятия | Марафоны, бег на длинные дистанции, плавание, велоспорт, силовая ходьба, тренировка на выносливость | Пауэрлифтинг, спринт, прыжки, силовые и ловкие тренировки | Пауэрлифтинг, спринт, прыжки, силовые и ловкие тренировки |
Размер мышечного волокна | Малый | Большой | Большой |
Производство сил | Низкая | Высокая | Очень высокий |
Устойчивость к усталости | Медленная | Быстрый | Очень быстро |
Скорость сокращения | Медленная | Быстрый | Очень быстро |
Митохондрии | Высокая | Средний | Низкая |
Капилляры | Высокая | Средний | Низкая |
| Миоглобин | Высокая | Средний | Низкая |
Уровень АТФазы | Низкая | Средний | Высокая |
Окислительная способность | Высокая | Средний | Низкая |
Медленно сокращающиеся мышечные волокна имеют высокую концентрацию митохондрий и миоглобина.Хотя они меньше, чем быстросокращающиеся волокна, они окружены большим количеством капилляров (1,2). Эта комбинация поддерживает аэробный метаболизм и устойчивость к усталости , что особенно важно при длительных субмаксимальных (аэробных) нагрузках.
Волокна типа I создают меньшее усилие и на медленнее создают максимальное напряжение (более низкая активность миозиновой АТФазы) по сравнению с волокнами типа II. Но они способны поддерживать более длительные сокращения , что имеет ключевое значение для стабилизации и контроля позы (1,2).
Помните:
- Мелкие мышечные волокна
- Низкое, медленное усилие
- Утомляемость медленнее, чем быстро сокращающийся, тип II
- Долгосрочные сокращения
- Поддерживает сопротивление усталости для аэробных нагрузок, стабилизации и контроля осанки
Fast-Twitch, тип II
Быстро сокращающиеся мышечные волокна типа II подразделяются на тип IIx и тип IIa.
Как правило, они имеют более низкие концентрации митохондрий, миоглобина и капилляров по сравнению с нашими медленно сокращающимися волокнами, что означает, что они на быстрее утомляются (1,2).
Эти волокна большего размера также создают большую и более быструю силу , что является важным соображением для силовых нагрузок (1,2).
Тип IIX (также известный как Тип IIB ) волокна производят наибольшую силу , но невероятно неэффективны из-за их высокой активности миозиновой АТФазы, низкой окислительной способности и сильной зависимости от анаэробного метаболизма (1,2 ).
Волокна типа IIA , также известные как промежуточные мышечные волокна , представляют собой смесь типа I и типа IIx с сопоставимым натяжением. может использовать как аэробную, так и анаэробную энергетические системы , эти волокна обладают более высокой окислительной способностью и утомляются медленнее, чем тип IIx (1,2).
Помните:
- Крупные мышечные волокна
- Большая и быстрая сила
- Усталость быстрее, чем у медленных I типа
- Два типа: Тип II x и Тип II a
- Тип IIx обеспечивает наибольшую силу, но неэффективен (очень быстро устает)
- Тип IIa представляет собой смесь мышечных волокон типа I и типа IIx (утомляемость медленнее, чем у типа IIx)
- Краткосрочные сокращения
- Поддерживает работу с электропитанием
Какой у вас тип мышечных волокон?
Итак, теперь, когда мы рассмотрели различные типы, вам интересно, что вы за тип? Какие мышцы есть у ваших рук, бицепсов, ног, груди и рук?
Вы и ваши мышцы не состоят из одного типа мышечных волокон. Все ваши мышцы представляют собой смесь быстро сокращающихся и медленно сокращающихся типов мышечных волокон (1).
Будет ли у вас больше типа I или типа II, зависит от вашего уровня активности и возраста .
Уровень активности
Люди, не занимающиеся спортом, имеют баланс типов волокон примерно 50/50.
Когда вы начнете смотреть на высококвалифицированных, успешных спортсменов, могут начаться некоторые различия.
Силовые атлеты имеют более высокое соотношение быстро сокращающихся волокон (например, у спринтеров 70-75% типа II), тогда как у спортсменов на выносливость больше медленно сокращающихся волокон (например, у марафонцев / бегунов на длинные дистанции 70-80% типа I) (2).
Конечно, тип мышечных волокон — не единственный фактор успеха спортсмена! Есть много других переменных, которые переводят спортсмена из хорошего в класс .
Возраст
Возраст также является фактором для наших мышечных волокон.
Старение вызывает потерю сухой мышечной массы , с уменьшением на наших быстро сокращающихся волокон , особенно типа IIx, но также наблюдается увеличение на наших медленных волокон (2-4).
Напомним, что быстросокращающиеся волокна больше по размеру, чем медленно сокращающиеся, и являются метаболически эффективными волокнами. Таким образом, потеря сухой мышечной массы может способствовать возрастным метаболическим дисфункциям , изменениям состава тела , даже увеличению риска падений (2-5).
С этим упадком можно бороться с помощью тренировок сопротивления .
Тренировка мышечных волокон типа I и типа II
Вы можете изменять типы волокон с помощью упражнений.
Мышечные волокна типа I можно развить с помощью тренировок на выносливость , например, с низким сопротивлением, частым повторением или длительными тренировками с низкой интенсивностью. (Как видно из этапов 1 и 2 OPT ™)
Мышечные волокна типа II можно развить с помощью силовых тренировок .
Тренировка с отягощениями увеличивает размер мышечных волокон как I, так и II типа. Более сильный рост (т.е. гипертрофия) происходит в волокнах типа II и увеличивает количество актиновых и миозиновых филаментов. Это приводит к повышенной способности генерировать силу (2).
Быстро сокращающиеся волокна также могут задействовать медленно сокращающиеся волокна : тренировки на выносливость с интервалами высокой интенсивности могут быть эффективными для улучшения аэробной силы (2,6).
Сужение во время тренировочных программ (уменьшение объема и интенсивности), может также улучшить силу и мощность волокон типа IIA без снижения производительности типа I (9).
В одном исследовании изучались изменения мышечных волокон при подготовке бегунов-любителей к марафону. После 13 недель увеличения пробега и трехнедельного цикла сужения не только улучшились функции волокон типа I и типа IIa, но и типа IIa продолжили значительно улучшаться во время цикла сужения (9).
Если вы заинтересованы в обучении спортсменов, в том, чтобы стать тренером по силовой и физической подготовке или получить подготовку в качестве специалиста по повышению производительности, свяжитесь с нами!
3 блога о спортивных достижениях, которые стоит посетить
Список литературыClark M, Lucett S, McGill E, Montel I и Sutton B (редакторы).(2018). NASM Essentials of Personal Fitness Training (6 th ed). Берлингтон, Массачусетс: Jones & Bartlett Publishing.
- Пауэрс С.К. и Хоули Е.Т. (2012). Физиология упражнений: теория и применение в фитнесе и производительности, (8 th Edition). Нью-Йорк, штат Нью-Йорк: Макгроу Хилл.
- Акасаки Ю., Оучи Н., Изумия Ю., Бернардо Б., ЛеБрассер Н. и Уолш К. (2013). Гликолитическое восстановление быстро сокращающихся мышечных волокон противодействует неблагоприятным возрастным изменениям в составе тела и обмене веществ.Ячейка старения 13: 80-91. DOI: 10.1111 / acel.12153
- Наричи М.В., Маффулли Н. (2010). Саркопения: характеристики, механизмы и функциональное значение. Британский медицинский бюллетень 95: 139-159. DOI: 10.1093 / bmb / ldq008
- Стюарт Калифорния, член парламента Маккарри, Марино А, Южный Массачусетс, Хауэлл МЭА, Лейн А.С., Рэмси М.В. и Стоун М.Х. (2013) Доля медленно сокращающихся волокон в скелетных мышцах коррелирует с реакцией на инсулин. Журнал клинической эндокринологии и метаболизма 98: 5, 2027-2036. DOI: http: // dx.doi.org/10.1210/jc.2012-3876
- Ванхатало А., Пул, округ Колумбия, ДиМенна Ф.Дж., Бейли С.Дж. и Джонс А.М. (2011). Рекрутмент мышечных волокон и медленный компонент поглощения O2: постоянная скорость работы или спринтерские упражнения. Американский журнал физиологии — регуляторная, интегративная и сравнительная физиология. 300 : 3, 700-707. DOI: 10.1152 / ajpregu.00761.2010
- McGill E, Montel I. (Редакторы). (2019). Основы спортивной подготовки NASM (2-е изд.). Берлингтон, Массачусетс: Jones & Bartlett Publishing.
- Barh R (редактор). (2012). Руководство МОК по спортивным травмам. Чичестер, Западный Сассекс: Wiley-Blackwell / Jophn Wiley & Sons Ltd.
- Трапп С., Харбер М., Крир А., Галлахер П., Сливка Д., Минчев К. и Уитсетт Д. (2006). Адаптация отдельных мышечных волокон при марафонских тренировках. Журнал прикладной физиологии, 101: 3, 721-727. DOI: 10.1152 / japplphysiol.01595.2005
рев. 7 / 18-1 / 15
Классификация типов волокон скелетных мышц человека | Физиотерапия
Скелетные мышцы человека состоят из разнородного набора типов мышечных волокон. 1–3 Этот диапазон типов мышечных волокон обеспечивает широкий спектр возможностей, которые демонстрируют мышцы человека. Кроме того, мышечные волокна могут адаптироваться к изменяющимся требованиям, изменяя размер или состав волокон. Эта пластичность служит физиологической основой для многочисленных физиотерапевтических вмешательств, направленных на увеличение силы или выносливости пациента. Изменения в составе волокон также могут быть частично ответственны за некоторые нарушения и инвалидность, наблюдаемые у пациентов, потерявших физическую форму из-за длительного бездействия, иммобилизации конечностей или денервации мышц. 2 За последние несколько десятилетий количество доступных методов классификации мышечных волокон увеличилось, что привело к появлению нескольких систем классификации. Цель этого обновления — предоставить базовые знания, необходимые для чтения и интерпретации исследований скелетных мышц человека.
Типы мышечных волокон можно описать с помощью гистохимических, биохимических, морфологических или физиологических характеристик; однако классификации мышечных волокон по разным методикам не всегда совпадают. 1 Следовательно, мышечные волокна, которые могут быть сгруппированы с помощью одного метода классификации, могут быть отнесены к разным категориям с использованием другого метода классификации. Для понимания методов классификации мышечных волокон необходимо базовое понимание структуры и физиологии мышц.
073″> Набор мышечных волокон
Первоначально целые мышцы классифицировались как быстрые или медленные в зависимости от скорости сокращения. 3 Это деление также соответствовало морфологическим различиям: быстрые мышцы выглядели белыми у некоторых видов, особенно птиц, а медленные — красными. Покраснение является результатом большого количества миоглобина и высокого содержания капилляров. 3 Повышенное содержание миоглобина и капилляров в красных мышцах способствует большей окислительной способности красных мышц по сравнению с белыми мышцами. Гистологический анализ показывает, что существует корреляция между активностью миозиновой АТФазы и скоростью укорачивания мышц. 6 Этот гистохимический анализ привел к первоначальному разделению мышечных волокон на тип I (медленный) и тип II (быстрый). В настоящее время типирование мышечных волокон осуществляется тремя различными методами: гистохимическим окрашиванием на миозин-АТФазу, идентификацией изоформ тяжелой цепи миозина и биохимической идентификацией метаболических ферментов.
078″> Идентификация тяжелой цепи миозина
Идентификация различных изоформ тяжелой цепи миозина также позволяет классифицировать волокна по типу (Рис. 2). 1 Различные волокна на основе миозин-АТФазы соответствуют различным изоформам тяжелой цепи миозина. 1,8 Это неудивительно, потому что тяжелые цепи миозина содержат сайт, который служит АТФазой.Тот факт, что каждое мышечное волокно может содержать более одной изоформы тяжелой цепи миозина, объясняет существование типов волокон миозин-АТФазы, отличных от чистых волокон типа I, типа IIA и типа IIB. Хотя геном человека содержит по крайней мере 10 генов тяжелых цепей миозина, только 3 из них экспрессируются в мышцах конечностей взрослого человека. 1 Изоформы тяжелой цепи миозина могут быть идентифицированы с помощью иммуногистохимического анализа с использованием антител к антимиозину или с помощью электрофоретического разделения додецилсульфат натрия и полиакриламидного геля (SDS-PAGE). 5
Три изоформы миозина, которые были первоначально идентифицированы, были MHCI, MHCIIa и MHCIIb, и они соответствовали изоформам, идентифицированным при окрашивании миозин-АТФазой как типы I, IIA и IIB, соответственно. 1,3,5 Смешанные волокна человека почти всегда содержат изоформы тяжелой цепи миозина, которые являются «соседями» (т.е. MHCI и MHCIIa или MHCIIa и MHCIIb). 2 Следовательно, волокна гистохимической миозин-АТФазы типа IC, IIC и IIAC коэкспрессируют гены MHCI и MHCIIa в разной степени, тогда как волокна типа IIAB коэкспрессируют гены MHCIIa и MHCIIb. 1 Из-за своей количественной природы идентификация изоформ тяжелой цепи миозина с помощью электрофоретического разделения отдельных волокон (метод SDS-PAGE), вероятно, представляет собой лучший метод типирования мышечных волокон. Электрофоретическое разделение позволяет определять относительные концентрации различных изоформ тяжелой цепи миозина в смешанном волокне. 5,8
Один момент, касающийся изоформ тяжелой цепи миозина человека и идентификации типа волокна, может сбить с толку кого-то, кто пытается читать исследовательскую литературу в этой области.У мелких млекопитающих присутствует четвертая изоформа тяжелой цепи миозина, MHCIIx или MHCIId, которая имеет промежуточную скорость сокращения между изоформой MHCIIa и MHCIIb. 9 Основываясь на нескольких типах доказательств, вплоть до уровня анализа ДНК, то, что первоначально было идентифицировано у людей как MHCIIb, фактически гомологично MHCIIx / d мелких млекопитающих. 2,5,9 В результате то, что у людей называется MHCIIb, на самом деле является MHCIIx / d, и люди не экспрессируют самую быструю изоформу тяжелой цепи миозина (MHCIIb). 5 Поскольку номенклатура типов волокон гистохимической миозин-АТФазы была разработана с использованием мышц человека, волокна типа IIB, которые, как мы теперь знаем, соответствуют изоформе тяжелой цепи миозина MHCIIx / d, вряд ли будут переименованы в тип IIX. 1 Следовательно, в зависимости от автора, человеческие волокна типа IIB на основе гистохимической миозин-АТФазы могут быть связаны либо с изоформами MHCIIb, либо с MHCIIx / d. Важно помнить, что в мышцах конечностей человека присутствуют только 3 изоформы тяжелой цепи миозина (от самой медленной до самой быстрой): MHCI, MHCIIa и MHCIIx / d (ранее ошибочно определялись как MHCIIb). 1 Люди не экспрессируют самую быструю изоформу тяжелой цепи миозина, MHCIIb. 9 В оставшейся части статьи мы свяжем MHCIIx / d у людей с гистохимическим волокном типа IIB на основе миозин-АТФазы.
084″> Легкие миозиновые цепи Легкие цепи молекулы миозина также существуют в различных изоформах, медленных и быстрых, которые влияют на сократительные свойства мышечного волокна. 3,11 Мышечные волокна, гомогенные для изоформы тяжелой цепи миозина (т.е. чистое волокно), могут быть гетерогенными в отношении изоформ легкой цепи миозина, хотя в целом быстрые изоформы тяжелой цепи миозина связываются с быстрой изоформы легкой цепи миозина и медленные изоформы тяжелой цепи миозина связываются с медленными изоформами легкой цепи миозина . 2,5,12 Имеются убедительные доказательства того, что дополнительные белки в мышечных волокнах экспрессируются вместе, так что различные «быстрые» белки экспрессируются друг с другом, а различные «медленные» белки экспрессируются друг с другом, что предполагает «волокно. специфическая для типа программа экспрессии генов ». 2,11,12
088″> Пластичность блока двигателя / мышечного волокна
Независимо от схемы классификации, используемой для группировки мышечных волокон, есть неопровержимые доказательства того, что мышечные волокна — и, следовательно, двигательные единицы — не только изменяются в размере в ответ на требования, но также могут преобразовываться из одного типа в другой. 2,18,19 Эта пластичность сократительных и метаболических свойств в ответ на стимулы (например, тренировка и реабилитация) позволяет адаптироваться к различным функциональным требованиям. 2 Преобразования волокон между типом IIB и типом IIA являются наиболее распространенными, но преобразования типа I в тип II возможны в случаях тяжелого разрушения или повреждения спинного мозга (SCI). 2,20
Существует меньше доказательств превращения волокон типа II в волокна типа I при тренировках или реабилитации, потому что только исследования, в которых используются денервированные мышцы, которые хронически активируются с помощью электростимуляции, последовательно демонстрируют, что такое преобразование возможно. 21
Изменения типов мышечных волокон также ответственны за некоторую потерю функции, связанную с нарушением кондиционирования. 2 Эксперименты на животных, включающие подвешивание задних конечностей, которое разгружает мышцы задних конечностей, и наблюдения за людьми и крысами после воздействия микрогравитации во время космического полета продемонстрировали переход от медленных к быстрым типам мышечных волокон. 2 Кроме того, многочисленные исследования животных и людей с ТСМ продемонстрировали переход от медленных к быстрым волокнам. 2,20 Было показано, что у людей ослабление тренированности (то есть уменьшение использования мышц по сравнению с ранее высоким уровнем активности) приводит к такому же медленному превращению в быстрое со сдвигом от MHCIIa к MHCIIx / d и, возможно, от MHCI к MHCIIa. . 2 Также наблюдается снижение уровня ферментов, связанных с аэробно-окислительным метаболизмом. 2 Таким образом, сокращение использования скелетных мышц может привести к преобразованию типов мышечных волокон из медленного в быстрое направление.
Интересно, что некоторая потеря работоспособности мышц (например, снижение выработки силы) из-за старения, по-видимому, происходит не только из-за преобразования мышечных волокон из одного типа в другой, но в основном из-за избирательной атрофии определенных групп населения. типов мышечных волокон. 22,23 С возрастом происходит прогрессирующая потеря мышечной массы и максимального потребления кислорода, что приводит к снижению работоспособности мышц и, предположительно, к некоторой потере функции (например, снижению способности выполнять повседневную деятельность), наблюдаемой в пожилые люди. 1,22,23
Потеря мышечной массы, связанная с возрастом, в первую очередь связана с уменьшением общего количества волокон как типа I, так и типа II и, во-вторых, из-за преимущественной атрофии волокон типа II. 22,24 Атрофия волокон типа II приводит к увеличению доли мышечной массы медленного типа в старых мышцах, о чем свидетельствует более медленное время сокращения и расслабления в старых мышцах. 25,26 Кроме того, потеря альфа-мотонейронов с возрастом приводит к некоторой реиннервации «покинутых» мышечных волокон соседними двигательными единицами, которые могут быть другого типа. 22,27 Это может способствовать преобразованию типа волокна, поскольку повторно иннервируемые мышечные волокна приобретают свойства новой «родительской» двигательной единицы. 3,22 Недавние данные о старых мышцах предполагают, что может происходить преобразование типа волокна, потому что у пожилых людей наблюдается гораздо большая коэкспрессия тяжелой цепи миозина по сравнению с молодыми людьми. 28 Было обнаружено, что более старые мышцы имеют больший процент волокон, которые совместно экспрессируют MHCI и MHCIIa (28,5%) по сравнению с более молодыми мышцами (5–10%). 28
К счастью, физиотерапевтические вмешательства могут повлиять на типы мышечных волокон, что приведет к улучшению работы мышц. В контексте этого обновления физиотерапевтические вмешательства можно в общих чертах разделить на те, которые предназначены для повышения устойчивости пациента к усталости, и те, которые предназначены для увеличения выработки силы пациентом.В течение некоторого времени было известно, что тренировки, которые предъявляют высокие метаболические требования к мышцам (тренировка на выносливость), увеличивают окислительную способность всех типов мышечных волокон, в основном за счет увеличения количества митохондрий, аэробных / окислительных ферментов и капилляризации тренированная мышца. 29,30 Использование системы классификации, основанной на метаболических ферментах, может привести к переходу от FG к FOG мышечным волокнам без обязательного преобразования изоформ тяжелой цепи миозина. 2
Состав тяжелой цепи миозина в мышечном волокне может измениться при тренировке на выносливость. 19 Внутри волокон типа II происходит преобразование из IIB в IIA, при этом экспрессируется больше MHCIIa за счет MHCIIx / d. 2,19 Следовательно, процентное содержание чистых волокон типа IIB уменьшается, а процентное содержание волокон типа IIAB и чистого типа IIA увеличивается. Отсутствуют доказательства того, что волокна типа II переходят в тип I при тренировке на выносливость, 19 , хотя, похоже, наблюдается увеличение популяции волокон смешанного типа I и IIA. 2 Исследователи обнаружили, что волокна типа I у людей становятся быстрее при упражнениях на выносливость и медленнее при нарушении кондиционирования. 31,32 Это изменение скорости сокращения происходит не из-за преобразования типов волокон, а скорее из-за изменений изоформ легкой цепи миозина из медленных в быстрые изоформы и из быстрых в медленные изоформы, соответственно. 31,32 Поскольку это изменение скорости мышечного сокращения не происходит за счет изменения миозиновой АТФазы, его нельзя обнаружить с помощью гистохимического типирования волокон. 2 Переход от медленных к быстрым изоформ легкой цепи миозина позволяет медленным волокнам сокращаться со скоростью, достаточно быстрой для данного упражнения (например, бега, езды на велосипеде), сохраняя при этом эффективные свойства использования энергии. 30 Таким образом, адаптация мышечных волокон к упражнениям на выносливость зависит от типа волокон, хотя окислительная способность всех волокон увеличивается. Волокна типа I могут становиться быстрее за счет преобразования легкой цепи миозина, тогда как волокна типа II превращаются в более медленные, более окислительные типы.
Высокоинтенсивная тренировка с отягощениями (например, тренировка с высокой нагрузкой и малым числом повторений) приводит к изменениям типа волокон, аналогичным тем, которые наблюдаются при тренировках на выносливость, хотя гипертрофия мышц также играет важную роль в увеличении силы. 33 Первоначальное увеличение выработки силы с помощью программ высокоинтенсивных тренировок с отягощениями в значительной степени опосредовано нервными факторами, а не видимой гипертрофией мышечных волокон у взрослых без патологии или нарушений. 34 Даже в этом случае изменения в мышечных белках, таких как тяжелые цепи миозина, действительно начинаются после нескольких тренировок, но видимая гипертрофия мышечных волокон не проявляется до тех пор, пока тренировка не будет проводиться в течение более длительного периода времени (> 8 недель). 33
Большинство исследователей обнаружили, что высокоинтенсивные тренировки с отягощениями достаточной продолжительности (> 8 недель) вызывают увеличение состава MHCIIa и соответствующее уменьшение состава MHCIIx / d. 35–37 Во многих исследованиях высокоинтенсивных тренировок с отягощениями исследователи также сообщали о сопутствующем увеличении состава MHCI, 37 , хотя некоторые исследователи не сообщают об изменениях в составе MHCI. 38,39 Как тренировки на выносливость, так и тренировки с отягощениями приводят к аналогичному снижению коэкспрессии тяжелых цепей миозина, так что присутствует большее количество «чистых» волокон. 40 Хотя тенденции преобразования типов волокон аналогичны для тренировок на выносливость и силовых тренировок, различия в физиологических изменениях, которые происходят с каждым типом упражнений, также важны. Тренировка на выносливость увеличивает окислительную способность мышц, тогда как тренировка для увеличения выработки силы достаточной интенсивности и продолжительности способствует гипертрофии мышечных волокон за счет увеличения объема сократительных белков в волокнах.
Знание различий между типами волокон скелетных мышц человека позволяет клиницистам более полно понять морфологические и физиологические основы эффективности физиотерапевтических вмешательств, таких как тренировки на выносливость и тренировки с отягощениями.Кроме того, эти знания также предлагают некоторое объяснение изменений в мышцах, которые происходят с возрастом, нарушением условий, иммобилизацией и денервацией мышц. Такие знания полезны для оптимального проектирования программ реабилитации, направленных на снижение морфологии и физиологии мышц.
Список литературы
1 Старон
RS
. Типы волокон скелетных мышц человека: описание, развитие и распределение
. Можно использовать Physiol
. 1997
; 22
: 307
— 327
,2 Петте
D
, Staron
RS
. Переходные типы волокон скелетных мышц млекопитающих
. Int Rev Cytol
. 1997
; 170
: 143
— 223
,3 МакКомас
AJ
. Скелетные мышцы: форма и функции
. Шампейн, штат Иллинойс: Human Kinetics, 1996
. 4 Пахарь
SA
, Смит
DL
. Физиология упражнений для здоровья, фитнеса и работоспособности
. Бостон, Массачусетс
: Allyn & Bacon
, 1997
: 433
,5 Петте
D
, Peuker
H
, Staron
RS
. Влияние биохимических методов на анализ отдельных мышечных волокон
. Acta Physiol Scand
. 1999
; 166
: 261
— 277
,6 Бараны
м
. АТФазная активность миозина коррелировала со скоростью укорачивания мышц
. J Gen Physiol
. 1967
; 50
: 197
— 218
.7 Тейлор
AW
, Эссен
B
, Saltin
B
. Миозин-АТФаза в скелетных мышцах здоровых мужчин
. Acta Physiol Scand
. 1974
; 91
: 568
– 570
,8 Фрай
AC
, Allemeier
CA
, Staron
RS
. Корреляция между процентом площади типа волокна и содержанием тяжелой цепи миозина в скелетных мышцах человека
. Eur J Appl Physiol Occup Physiol
. 1994
; 68
: 246
— 251
,9 Хильбер
К
, Galler
S
, Gohlsch
B
, Pette
D
. Кинетические свойства изоформ миозиновой цепи в отдельных волокнах скелетных мышц человека
. FEBS Lett
. 1999
; 455
: 267
— 270
.10 Хамалайнен
N
, Петле
D
. Паттерны изоформ миозина в волокнах скелетных мышц млекопитающих
. Microsc Res Tech
. 1995
; 30
: 381
— 389
.11 Талмадж
RJ
, Рой
РР
, Эджертон
ВР
. Типы и функции мышечных волокон
. Curr Opin Rheumatol
. 1993
; 5
: 695
— 705
.12 Jostarndt-Fogen
К
, Puntschart
A
, Hoppeler
H
, Billeter
R
. Волоконно-специфическая экспрессия быстрых и медленных мРНК незаменимых легких цепей миозина в тренированных скелетных мышцах человека
. Acta Physiol Scand
. 1998
; 164
: 299
— 308
,13 Берк
РЭ
. Комментарий о наличии моторного блока «Тип
». В кн .: Башня БД, изд. Основные нейронауки
. Нью-Йорк, Нью-Йорк: Raven Press, 1975
. Нервная система
.; том 1.
14 Берк
РЭ
. Возвращаясь к понятию «тип двигателя
.». Prog Brain Res
. 1999
; 123
: 167
— 175
.15 Берк
РЭ
, Levine
PN
, Zajac FE
III
. Двигательные единицы млекопитающих: физиолого-гистохимическая корреляция трех типов у кошек gastrocnemius
. Наука
. 1971
; 174
: 709
— 712
,16 Берк
РЭ
. Типы двигательных единиц трехглавой мышцы бедра кошки
. Дж. Физиол
. 1967
; 193
: 141
— 160
,17 Sieck
GC
, Prakash
YS
. Морфологические адаптации нервно-мышечных соединений зависят от типа волокна
. Можно использовать Physiol
. 1997
; 22
: 197
— 230
,18 Гроссман
EJ
, Рой
RR
, Talmadge
RJ
и др. . Влияние неактивности на состав тяжелой цепи миозина и размер волокон камбаловидной мышцы крысы
. Мышечный нерв
. 1998
; 21
: 375
— 389
,19 Ricoy
JR
, Encinas
AR
, Cabello
A
и др. . Гистохимическое исследование типов мышечных волокон широкой мышцы бедра у спортсменов
. Дж. Физиол Биохим
. 1998
; 54
: 41
— 47
.20 Рой
руб.
, Talmadge
RJ
, Hodgson
JA
и др. . Дифференциальная реакция быстрых мышц-разгибателей и сгибателей задних конечностей на упражнения у взрослых кошек с спинномозговой системой
. Мышечный нерв
. 1999
; 22
: 230
— 241
,21 Экен
т
, Гундерсен
К
. Электростимуляция, напоминающая нормальную активность двигательных единиц: воздействие на денервированные быстрые и медленные мышцы крысы
. Дж. Физиол
. 1988
; 402
: 651
— 669
,22 Ру
MR
, Рис
CL
, Вандервурт
AA
. Возрастные изменения функции моторного блока
. Мышечный нерв
. 1997
; 20
: 679
— 690
,23 Портер
ММ
, Вандервурт
AA
, Lexell
J
. Старение мышц человека: структура, функции и адаптивность
. Scand J Med Sci Sports
. 1995
; 5
: 129
— 142
.24 Лекселл
Дж
, Тейлор
CC
, Sjostrom
M
. В чем причина старческой атрофии
? Общее количество, размер и пропорция различных типов волокон, изученных во всей широкой латеральной мышце широкой мышцы бедра, у мужчин в возрасте от 15 до 83 лет. J Neurol Sci
. 1988
; 84
: 275
— 294
.25 Наричи
МВ
, Бордини
M
, Cerretelli
P
. Влияние старения на функцию приводящей мышцы большого пальца человека
. J Appl Physiol
. 1991
; 74
: 1227
— 1281
,26 Харридж
SD
, Крайгер
А
, Стенсгаард
А
. Сила, активация и размер разгибателей колена у очень пожилых людей после силовых тренировок
. Мышечный нерв
. 1999
; 22
: 831
— 839
,27 Камень
г
, Sison
SV
, Du
CC
, Patten
C
. Разрядка моторных единиц у пожилых людей во время сокращений с максимальным усилием
. J Appl Physiol
. 1995
; 79
: 1908
— 1913
,28 Андерсен
JL
, Terzis
G
, Kryger
A
. Повышение степени коэкспрессии изоформ тяжелой цепи миозина в волокнах скелетных мышц очень старого образца
. Мышечный нерв
. 1999
; 22
: 449
— 454
.29 Holloszy
JO
, Стенд
FW
. Биохимические адаптации мышц к упражнениям на выносливость
. Анну Рев Физиол
. 1976
; 38
: 273
— 291
,30 Фитинги
правая
, Видрик
JJ
. Мышечная механика: адаптации с тренировкой
. Exerc Sport Sci Ред.
. 1996
; 24
: 427
— 473
,31 Ларссон
л
, Li
XP
, Berg
HE
, Frontera
WR
. Влияние отмены функции опоры на сократительную способность и состав изоформ миозина в отдельных клетках скелетных мышц человека
. Арка Пфлюгерс
. 1996
; 432
: 320
— 328
.32 Видрик
JJ
, Trappe
SW
, Blaser
CA
и др. . Изометрическая сила и максимальная скорость сокращения отдельных мышечных волокон у элитных бегунов-мастеров
. Am J Physiol
. 1996
; 271
( 2 балла 1
): C666
— C675
.33 Kraemer
WJ
, Флек
SJ
, Эванс
WJ
. Силовые тренировки: физиологические механизмы адаптации
. Exerc Sport Sci Ред.
. 1996
; 24
: 363
— 397
. 34 МакАрдл
WD
, Катч
FI
, Катч
VL
. Основы физиологии упражнений
. Филадельфия, Пенсильвания: Леа и Фебигер,, 1994,
. 35 Старон
RS
, Карапондо
DL
, Kraemer
WJ
и др. . Адаптация скелетных мышц на ранней стадии тренировок с отягощениями у мужчин и женщин
. J Appl Physiol
. 1994
; 76
: 1247
— 1255
,36 Kraemer
WJ
, Patton
JF
, Gordon
SE
и др. . Совместимость высокоинтенсивных силовых тренировок и тренировок на выносливость с гормональной адаптацией и адаптацией скелетных мышц
. J Appl Physiol
. 1995
; 78
: 976
— 989
.37 Старон
RS
, Малики
ES
, Леонарди
MJ
и др. . Гипертрофия мышц и быстрое преобразование типов волокон у женщин, тренирующихся с отягощениями
. Eur J Appl Physiol Occup Physiol
. 1990
; 60
: 71
— 79
,38 Адамс
ГР
, Hather
BM
, Baldwin
KM
, Dudley
GA
. Состав тяжелых цепей миозина скелетных мышц и тренировки с отягощениями
. J Appl Physiol
. 1993
; 74
: 911
— 915
.39 Хаккинен
К
, Ньютон
RU
, Гордон
SE
и др. . Изменения морфологии мышц, электромиографической активности и характеристик производства силы во время прогрессивных силовых тренировок у молодых и пожилых мужчин
. J Gerontol A Biol Sci Med Sci
. 1998
; 53
: B415
— B423
.40 Уильямсон
DL
, Godard
MP
, Porter
DA
и др. . Прогрессивные тренировки с отягощениями снижают коэкспрессию тяжелых цепей миозина в отдельных мышечных волокнах у пожилых мужчин
. J Appl Physiol
. 2000
; 88
: 627
— 633
. © 2001 Американская ассоциация физиотерапии
типов мышечных волокон: быстрое или медленное сокращение
Если вы смотрите спортивные состязания по телевизору, в какой-то момент вы, вероятно, слышали, как комментатор говорил о спортсмене, обладающем взрывными или мощными мышцами. Например, профессиональный футболист Джей Джей Ватт получил много внимания из-за своей программы подготовки в межсезонье, которая включает в себя переворачивание покрышки большого грузовика.Спортивный комментатор недавно обсуждал методы тренировок Ватта и упомянул, что Ватт работал над своими быстро сокращающимися мышечными волокнами, чтобы стать более взрывным. Поначалу это звучит странно — быстро сокращающиеся мышечные волокна? Так ли это на самом деле, и можно ли выполнять определенные упражнения, ориентированные на один тип мышечных волокон?
Короче говоря, да и да.
Да, в организме есть разные типы мышечных волокон, которые классифицируются в зависимости от того, как они производят энергию.Да, различные мышечные волокна можно тренировать с помощью специальных упражнений, направленных на то, чтобы сосредоточиться на том, как они создают энергию или генерируют силу. Хотя было идентифицировано множество типов мышечных волокон, включая тип I, тип IC, тип IIC, тип IIAC, тип IIA и тип IIX, они обычно классифицируются как медленно сокращающиеся или быстро сокращающиеся (см. Таблицу). .
6 фактов, которые нужно знать о мышечных волокнах с медленным сокращением или типом I:
- Медленно сокращающиеся волокна содержат митохондрии, органеллы, которые используют кислород для создания аденозинтрифосфата (АТФ), который является химическим веществом, которое на самом деле способствует сокращению мышц и считается аэробным.
- Медленно сокращающиеся волокна также называют красными волокнами, потому что они содержат больше миоглобина, переносящего кровь, что создает более темный вид.
- Поскольку они могут быть собственным источником энергии, медленно сокращающиеся волокна могут выдерживать силу в течение длительного периода времени, но они не могут создавать значительную силу.
- Медленно сокращающиеся волокна имеют низкий порог активации, то есть они задействуются первыми при сокращении мышцы. Если они не могут генерировать силу, необходимую для определенной активности, задействуются быстро сокращающиеся мышечные волокна.
- Тонические мышцы, отвечающие за поддержание осанки, имеют более высокую плотность медленно сокращающихся волокон.
- Тренировка на выносливость в устойчивом состоянии может помочь увеличить плотность митохондрий, что повышает эффективность того, как организм использует кислород для производства АТФ.
Как видите, медленно сокращающиеся волокна обладают особыми характеристиками того, как они функционируют, а это означает, что их можно тренировать, чтобы они были более аэробно эффективными с помощью правильной программы упражнений.
Методы тренировки медленно сокращающихся волокон:
- Упражнения, предусматривающие длительные изометрические сокращения с минимальным или отсутствующим движением суставов, удерживают медленно сокращающиеся мышечные волокна в напряжении в течение длительного периода времени.Это может помочь улучшить их способность использовать кислород для производства энергии. Примеры включают переднюю планку, боковую планку и балансировку на одной ноге.
- Упражнения с отягощениями с использованием более легких весов с более медленным темпом движения и большим количеством повторений (т.е. более 15) могут задействовать медленно сокращающиеся волокна, чтобы использовать аэробный метаболизм для подпитки активности.
- Круговая тренировка, которая включает в себя чередование одного упражнения на другое с минимальным отдыхом или без отдыха при использовании более легких весов, может быть эффективным способом бросить вызов медленно сокращающимся волокнам.
- Упражнения с собственным весом для большего количества повторений могут быть эффективным способом бросить вызов аэробному метаболизму, который помогает повысить эффективность медленно сокращающихся волокон.
- При работе только с собственным весом или с меньшим сопротивлением используйте более короткие интервалы отдыха примерно 30 секунд между подходами, чтобы стимулировать медленно сокращающиеся волокна использовать аэробный метаболизм для подпитки тренировки.
8 фактов о быстросокращающихся мышечных волокнах или мышечных волокнах типа II:
- Быстро сокращающиеся волокна можно далее классифицировать на (1) быстро сокращающиеся IIa — быстрые окислительные гликолитические, поскольку они используют кислород для преобразования гликогена в АТФ, и (2) быстросокращающиеся волокна типа IIb — быстрые гликолитические средства, которые зависят от АТФ хранится в мышечной клетке для выработки энергии.
- Быстросокращающиеся волокна имеют высокий порог и будут задействованы или активированы только тогда, когда требуемая сила больше, чем могут удовлетворить медленно сокращающиеся волокна.
- Более крупным волокнам с быстрым сокращением требуется меньше времени для достижения максимальной силы и они могут генерировать большее количество силы, чем волокна с медленным сокращением.
- Быстро сокращающиеся волокна могут генерировать больше силы, но быстрее утомляются по сравнению с медленными волокнами.
- Фазические мышцы, ответственные за движение в теле, содержат более высокую плотность быстро сокращающихся волокон.
- Силовые и силовые тренировки могут увеличить количество быстро сокращающихся мышечных волокон, задействованных для определенного движения.
- Быстро сокращающиеся волокна отвечают за размер и определение конкретной мышцы.
- Быстро сокращающиеся волокна называются «белыми волокнами», потому что они не содержат много крови, что придает им более светлый вид, чем медленно сокращающиеся волокна.
Как видите, характеристики быстро сокращающихся волокон больше подходят для взрывных, силовых и силовых видов спорта, таких как футбол.Поэтому, когда диктор говорит о том, как программа тренировок приносит пользу определенному типу мышечных волокон, они говорят с наукой точно.
Если вы хотите задействовать больше быстро сокращающихся волокон, чтобы повысить уровень силы или стать более взрывным, вот несколько эффективных приемов.
Методы задействования быстро сокращающихся волокон:
- Тренировка с отягощениями с тяжелым весом стимулирует мышечные двигательные единицы, чтобы активировать больше мышечных волокон. Чем тяжелее вес, тем большее количество быстро сокращающихся волокон будет задействовано.
- Выполнение взрывных силовых движений, будь то штанга, гиря, набивной мяч или просто вес собственного тела, задействует большее количество быстро сокращающихся волокон.
- Быстро сокращающиеся волокна быстро утомляются, поэтому сосредоточьтесь на использовании тяжелых весов или взрывных движений только для ограниченного числа повторений (например, от двух до шести) для максимальной эффективности.
- Поскольку они быстро истощают энергию, быстросокращающиеся волокна требуют более длительных периодов отдыха, чтобы позволить моторным единицам восстановиться и заменить израсходованный АТФ.Поэтому после каждого взрывного или силового упражнения давайте отдыхать не менее 60–90 секунд.
Понимание того, как физиология тела адаптируется к упражнениям, может помочь вам разработать более эффективные программы упражнений для ваших конкретных потребностей. Генетика определяет, сколько у вас мышечных волокон каждого типа; однако, чтобы определить, являетесь ли вы доминантным — быстро или медленно, — потребуется инвазивная биопсия мышцы. Следовательно, если вы обнаружите, что вам нравится больше заниматься упражнениями на выносливость, и что они относительно легки для вас, вероятно, у вас больше медленных волокон.И наоборот, если вы действительно не любите длительные пробежки, но любите заниматься спортом, основанным на коротких сериях взрывных движений, или если вам нравятся силовые тренировки, потому что они относительно легкие, у вас, вероятно, преобладают быстрые волокна. Программа упражнений, которая применяет правильные стратегии тренировки для ваших мышечных волокон, может помочь вам добиться максимальной эффективности и получить удовольствие от тренировки.
Характеристика
Медленно сокращающийся
Быстрое сокращение IIa
Быстрое сокращение IIb
Производство сил
Низкая
Средний
Высокая
Скорость сокращения
Медленная
Быстро
Быстро
Сопротивление усталости
Высокая
Умеренная
Низкая
Гликолитическая способность
Низкая
Высокая
Высокая
Окислительная способность
Высокая
Средний
Низкая
Плотность капилляров
Высокая
Средний
Низкая
Плотность митохондрий
Высокая
Средний
Низкая
Выносливость
Высокая
Умеренная
Низкая
Какой тип мышечного волокна означает для силовых тренировок
Тип волокна в значительной степени определяет спортивную активность, для которой вы можете лучше всего подходить, учитывая, что многие виды деятельности требуют характеристик обоих типов волокон.У человека есть комбинация двух типов волокон, но один из них может преобладать.
Обзор
Скелетные мышцы человека состоят преимущественно из двух типов мышечных волокон: красного волокна и белого волокна. Красные волокна (тип 1) также известны как медленно сокращающиеся волокна, а белые (тип 2) — быстро сокращающиеся. Белые быстрые волокна также можно разделить на два типа — 2A и 2B. Волокна 2A находятся между более медленными красными волокнами и самыми быстрыми белыми волокнами 2B.
Например, у олимпийского спринтера может быть около 80% быстрых сокращений с белыми волокнами, а у хорошего марафонца — наоборот.Склонность к типу волокон также может в некоторой степени определять вашу способность поднимать тяжелые веса со скоростью и силой.
Факты о мышцах
Вот несколько простых фактов, которые вы можете использовать для сравнения двух типов мышечных волокон.
- Мышцы бывают трех типов: сердечная мышца, гладкая мышца и скелетная мышца. Скелетные мышцы — это цель силовых и кондиционных тренировок.
- Гладкая мышца состоит из кровеносных сосудов и некоторых органов.
- Скелетные мышцы составляют примерно 45% от общей массы тела.
- Скелетная мышца прикрепляется к двум костям и пересекает сустав между ними.
- Мышечные клетки имеют удлиненную цилиндрическую форму и называются волокнами. Мышечные клетки и волокна синонимичны.
- Мышцы могут сокращаться и укорачиваться, создавая тянущее усилие на кости и их прикрепления к костям (сухожилия и связки)
- Мышцы — это органы, что означает, что они состоят из более чем одного типа тканей. Мышца содержит мышечную и волокнистую соединительную ткань (фасцию).
- Мышцы также включают кровеносные сосуды и нервы.
- Нервы обрабатывают сообщения от центральной нервной системы к мышцам, вызывая сокращение. Кровеносные сосуды поставляют питательные вещества и энергию, необходимые для движения и удаления продуктов жизнедеятельности.
- Двигательная единица состоит из двигательного нейрона (нервной клетки) и мышечных волокон, которыми он управляет. Двигательные единицы часто упоминаются в связи с активацией мышц при силовых тренировках.
Типы волокон и тренировки с отягощениями
Быстро сокращающиеся волокна способствуют быстрым и силовым нагрузкам, таким как спринт и метания, которые занимают не более десятков секунд.Медленно сокращающиеся волокна отдают предпочтение участникам соревнований на выносливость, таким как марафонцы и триатлонисты. Наличие некоторых переходных волокон, таких как умеренно быстрые и умеренно прочные волокна 2А, может быть полезно для бегунов на средние дистанции, где полезны скоростные и выносливость.
При поднятии тяжестей волокна 2B помогают поднимать тяжести с большой силой. 2B, быстро сокращающиеся волокна создают взрывную силу при выполнении 1ПМ или подходов с малыми и тяжелыми повторениями. Тип 1, медленно сокращающиеся волокна, больше подходят для тренировки мышечной выносливости, например, подходы по 20-30 повторений.
Можно ли преобразовать типы волокон? Короткий ответ: нет, не могут. Однако вы можете «тренировать» имеющиеся у вас волокна определенного типа. Например, если у вас 70% медленных волокон и 30% быстрых волокон, есть некоторые свидетельства того, что тяжелые тренировки, например, с 5-8 RM теоретически увеличивают размер поперечного сечения 30% волокон типа 2B, если не номер.
Возможно и обратное. Например, спринтер, который преимущественно быстро сокращается, может подчеркнуть свои медленные волокна, регулярно бегая в течение часа или более, чтобы участвовать в забегах на длинные дистанции, или выполняя подходы с большим количеством повторений в тренажерном зале. .
Регулярные тренировки с отягощением всего тела в диапазоне от 10 до 15 повторений в подходе могут затронуть ваши промежуточные волокна типа 2А.
Таким образом, если вы тренируетесь в спортзале, то наличие белых быстрых волокон (2B и 2A), вероятно, даст вам преимущество в общем поднятии веса. Если у вас в основном медленные волокна типа 1, вы можете не выиграть соревнования по поднятию тяжестей в ближайшее время, хотя нет никаких причин, по которым вы не сможете существенно набрать массу.
Моторные агрегаты
Моторные агрегаты Блок двигателя
Альфа-мотонейрон и мышечные волокна, которые он иннервирует
Характеристика
Медленно сокращающийся
Быстрое сокращение IIa
Быстрое сокращение IIb
Производство сил
Низкая
Средний
Высокая
Скорость сокращения
Медленная
Быстро
Быстро
Сопротивление усталости
Высокая
Умеренная
Низкая
Гликолитическая способность
Низкая
Высокая
Высокая
Окислительная способность
Высокая
Средний
Низкая
Плотность капилляров
Высокая
Средний
Низкая
Плотность митохондрий
Высокая
Средний
Низкая
Выносливость
Высокая
Умеренная
Низкая
Моторные агрегаты организованы по:
- РАЗМЕР
Наименьшие двигательные единицы находятся в мышцах, которые должны производить очень тонкие градации силы:
- комочки: 100 волокон / шт.
- глазные мышцы: 5 волокон / единица
- РАСПРЕДЕЛЕНИЕ В МЫШЦЕ
Волокна, составляющие двигательную единицу, не прилегают друг к другу, но населяют одну и ту же общую область мышцы.
Состав мышц и двигательных единиц
Мышца состоит из моторных единиц, в то время как каждый моторный блок состоит из множества волокон:
| Мышца | число альфа моторных аксонов | волокон на моторную единицу |
|---|---|---|
| двуглавая мышца плеча | 774 | 750 |
| брахиорадиалис | 330 | 390 |
| первый спинной межкостный | 119 | 340 |
| первый червячный | 98 | 110 |
| opponens pollicis | 133 | 595 |
| икроножная мышца | 580 | 1720 |
| передняя большеберцовая мышца | 445 | 610 |
Волокно в большой мышце, такой как икроножная мышца.
состоит из (в среднем) 2000 саркомеровКаждый саркомер
состоит примерно из 1000 миофибрилл.Каждая миофибрилла.
содержит около 1500 миозиновых и 3000 актиновых миофиламентовИсточники:
Гайтон, А.С. (1991). Медицинская физиология. 8-е изд. Филадельфия: W.B. Сондерс.Голдспинк, Г. (1985). Податливость двигательной системы: сравнительный подход. Журнал экспериментальной биологии, 115, 375-391.
Типы мышечных волокон
| типов волокон | |||
|---|---|---|---|
| SO (I) | FR (IIa) | FF (IIb) | |
| метаболические белки | окислительный (SO) | окислительный- гликолитический (FOG) | гликолитический (FG) |
| Характеристики мотонейрона | мелкоклеточные тела малый диаметр аксона медленная скорость проводимости тонизирующая низкочастотная активность | тела крупных клеток большой диаметр аксона быстрая скорость проводимости фазовая (всплеска) высокочастотная активность | |
| мышечное волокно характеристики сокращений | длительный низкое напряжение | краткая продолжительность высокое напряжение | |
| мышечная клетка характеристики | избыточный миоглобин обильные митохондрии обильные капилляры менее обширный саркоплазматический ретикулум (SR) | меньше молекул миоглобина меньше митохондрий менее обширные капилляры обширный SR | |
Последнее обновление 12-11-00 © Dave Thompson PT
вернуться к мускулам и силовым требованиям
Мышечные волокна типа IIa: тренировка для взрывной работы
Силовой тренинг | Советы по обучению
Мышечные волокна типа IIa — тренировка скорости, силы и мощности
Для ваших более серьезных, атлетичных клиентов, тех, кто хочет выйти за рамки базовой физической подготовки и достичь более сложных силовых целей, возможно, пришло время подумать о тренировке на клавиатуре.
Типа чего? Конечно же, мышечные волокна.
Как тренер вы знаете о различных мышечных волокнах, типе I, типе IIa, медленном сокращении, быстром сокращении и так далее. Но ваши клиенты могут не знать, что тренировки могут стать более специализированными, что вы можете разрабатывать программы, специально нацеленные на мышечные волокна, которые помогут им достичь своих целей и оптимизировать производительность.Тем, кто больше заинтересован в том, чтобы стать сильнее, мощнее и быстрее, чем в марафоне или Ironman, могут пригодиться тренировки для мышечных волокон типа IIa.Вот что им — и вам — нужно знать.
Типы мышечных волокон — медленное сокращение, быстрое сокращение
Мышцы состоят из нескольких моторных единиц. Каждый содержит пучок нервов и волокон. Мышечные волокна могут быть любого сочетания трех различных типов: типа I, типа IIa и типа IIx. И они классифицируются как медленные или быстрые, в зависимости от того, насколько быстро они вызывают напряжение в мышце.
Доля каждого типа зависит от нескольких факторов, таких как то, с чем вы родились, индивидуальные мышцы, ваш возраст, а также ваш тип и уровень физической подготовки и подготовки.
Понимание различий между этими волокнами, того, что они делают, как они задействованы во время занятий, и их относительных пропорций, может помочь вам и вашим клиентам развиваться и достигать более конкретных тренировочных целей.
Медленный твич против быстрого
Медленно сокращающиеся мышечные волокна известны как волокна типа I, и название описывает тот факт, что они сокращаются медленно и неуклонно. Эти волокна используются для выполнения упражнений на выносливость и низкой интенсивности.Они могут продолжать сокращаться и работать, не утомляясь в течение длительного времени, создавая энергию за счет аэробных процессов.
С другой стороны, быстро сокращающиеся мышечные волокна сокращаются быстрее и сильнее. Они необходимы для высокоинтенсивных, но непродолжительных занятий, таких как спринт или поднятие действительно большого веса. Они быстро сокращаются и быстро утомляются. Это потому, что они в основном используют анаэробный метаболизм для получения энергии, что приводит к выработке молочной кислоты и болезненности, которая вызывает утомление мышц.
Мышечные волокна типа I
Это медленно сокращающиеся мышечные волокна. Они меньше, чем волокна типа II, медленнее создают натяжение и создают меньшую силу и мощность. Однако у них есть то преимущество, что они медленно устают. Волокна типа I полагаются на кислород для получения энергии и могут работать в течение длительного времени.
Они используются для тренировок на выносливость, и у спортсменов, занимающихся выносливостью, как правило, больше этих мышечных волокон. Бегуны на длинные дистанции, триатлонисты, пловцы и лыжники действительно полагаются на волокна типа I.
Мышечные волокна типа IIa
Мышечные волокна типа IIa быстро сокращаются, что означает, что они активнее срабатывают. Они также более мощные, чем волокна типа I, и используются для занятий, требующих большей интенсивности: спринт, поднятие тяжестей.
Эти волокна обеспечивают большую прочность, но они также быстрее устают, чем волокна типа I. Они полагаются на анаэробные процессы и вырабатывают молочную кислоту, поэтому они не могут продолжать работать, пока тип I. У силовых и силовых атлетов, таких как спринтеры и штангисты, более высокая доля волокон типа IIa в мышцах.
Мышечные волокна типа IIx
Существует второй тип быстро сокращающихся мышечных волокон, называемый типом IIx. Они даже быстрее и мощнее, чем тип IIa. К тому же они еще более неэффективны, очень быстро утомляются. Волокна типа IIx используются для очень непродолжительных занятий, требующих значительной мощности и силы.
Волокна типа IIx иногда называют мышечными волокнами «кушетки». Даже неактивным людям необходимо иметь возможность быстро бегать или что-то поднимать в экстренной ситуации.Вот здесь и пригодятся волокна диванного картофеля. В состоянии покоя они метаболически эффективны, но все же позволяют при необходимости реагировать на раздражитель.
Если вы немного потренируетесь, волокна IIx быстро превратятся в более полезные и долговечные волокна IIa. В период бездействия они возвращаются к IIx.
Принцип размера рекрутирования моторных единиц, или Как воздействовать на мышечные волокна типа IIa
Чтобы увеличить размер и количество мышечных волокон любого типа, включая мышечные волокна типа IIa, для повышения силы и мощности, вам необходимо понимать, как задействуются различные типы волокон во время сокращения мышц.
Процесс и порядок, в котором мышцы для сокращения полагаются на типы волокон, описаны в Принципе размера рекрутирования моторных единиц, который говорит нам, что:
- Двигательные единицы используются во время мышечного сокращения в порядке увеличения порога включения и скорости стрельбы.
- Сначала будут использоваться волокна с низким порогом и меньшей скоростью срабатывания. Итак, медленные сокращения, волокна I типа идут первыми.
- Двигательные единицы с мышечными волокнами, которые имеют более высокий порог и более высокую скорость активации, задействуются и используются затем.
- Только после того, как задействованы волокна типа I, волокна типа II начинают гореть, сначала типа IIa, а затем типа IIx.
- Когда вы занимаетесь какой-либо деятельностью, например, быстро бегаете, волокон типа I. Если это не так, только тогда тело будет взаимодействовать с волокнами типа II.
Другими словами, когда ваше тело пытается выполнить какой-либо вид деятельности, например, поднимать вес, оно сначала будет пытаться делать это с мышечными волокнами типа I. Если они не обеспечивают достаточной силы, ваш мозг посылает сигнал, чтобы мышечные волокна типа II завершили работу.
Что это должно сказать вам о тренировке силы и силы, так это то, что вам нужно преодолеть набор сил первого типа, чтобы получить доступ к мышечным волокнам второго типа и тренировать их.
Если вы будете заниматься только низкоинтенсивными упражнениями на выносливость, ваши мышцы никогда не дойдут до волокон типа II, и они не будут расти или увеличиваться в количестве. Сосредоточение внимания на высокоинтенсивных силовых тренировках и взрывных движениях приводит к увеличению силы и мощности за счет набора и использования волокон типа II.
Зачем тренировать мышечные волокна типа IIa
Хотя доказательства того, что тренировки для улучшения определенного типа мышечных волокон неоднозначны, они могут оказаться полезными. Вот несколько важных причин, по которым вы или ваш клиент можете сосредоточиться на мышечных волокнах типа IIa во время тренировки:
- Эти мышечные волокна действуют быстро, поэтому вы получаете преимущество в производительности, когда у вас больше и больше волокон типа II.
- Волокна типа II очень чувствительны к тренировкам. Быстро сокращающиеся мышечные волокна имеют тенденцию увеличиваться на 5–7 процентов больше в ответ на тренировку по сравнению с медленными сокращениями.
- Пиковая мощность волокон типа IIa также больше, поэтому, когда у вас их больше, вы можете поднимать более тяжелые веса и быстрее бегать.
- У силовых атлетов обычно больше мышечных волокон типа IIa, что указывает на то, что для того, чтобы заниматься поднятием тяжестей, бегом на короткие дистанции и другими подобными видами спорта, вам необходимо развивать эти волокна.
- С возрастом снижается безжировая мышечная масса, включая волокна типа I и типа II. Быстрое сокращение, или тип IIa и тип IIx, являются более крупными волокнами и способствуют метаболической эффективности.Если мы не поддерживаем эти мышечные волокна в активном состоянии, со временем мы их теряем. Это способствует возрастным нарушениям обмена веществ, повышенному риску травм, таких как падения, и менее значительным изменениям в составе тела.
Может ли тренировка действительно нацеливаться на мышечные волокна и улучшать их по типу?
Короткий ответ: возможно.
Более длинный ответ состоит в том, что данные исследований неоднозначны. Некоторые исследования показывают, что более интенсивные тренировки, например, с более тяжелыми весами, действительно увеличивают рост волокон типа II.Они также демонстрируют, что тренировки с низкой интенсивностью увеличивают количество волокон типа I в мышцах.1
Однако другие исследования не дали тех же результатов и фактически показали, что оба типа тренировок увеличивают рост волокон типа I.
Так стоит ли тренироваться специально для одного типа мышечных волокон? Наверное. Это, конечно, не повредит, если вы убедитесь, что ваш клиент получает некоторые вариации в обучении. Позвольте им сосредоточиться в основном на мощности и силе для наращивания мышечных волокон типа II, но также настаивайте на одном или двух сеансах выносливости в неделю.
Знать тип мышечного волокна
У некоторых людей от природы больше волокон типа I или типа II из-за таких факторов, как возраст или генетика. К сожалению, существует простой способ надежно определить тип волокон любого человека. Биопсия мышц может определить ваш процент каждого типа, но это довольно инвазивно для среднего человека или даже спортсмена.
Также могут быть различия в процентном соотношении типов мышечных волокон от одной мышцы вашего тела к другой.Тип тренировки, которую вы выполняете, также может помочь понять, какой тип волокон доминирует в ваших мышцах:
- Если вы занимаетесь более выносливой деятельностью, например бегом на длинные дистанции, у вас, вероятно, будет больше медленных волокон типа I, до 70–80 процентов.
- С другой стороны, если вы больше занимаетесь спринтером или бодибилдингом, у вас, вероятно, больше волокон типа II.
Вы действительно не можете точно знать, как расщепляются ваши мышечные волокна, и ваши клиенты тоже. И даже если вы это сделаете, это не должно ограничивать вас от других видов деятельности.Например, если вы обнаружите, что у вас обычно больше медленных сокращающихся волокон, вы не позволите этому помешать вам попробовать силовые и скоростные упражнения.
Если ваши клиенты хотят знать, какое у них положение по типу мышечных волокон, постарайтесь убедить их, что это не так важно. Но те, кто действительно хочет улучшить силу, мощность и скорость, могут сосредоточиться на тренировке, нацеленной на наращивание волокон типа IIa.
Итак, как мы воздействуем на волокна типа IIa во время тренировки?
Концепция довольно проста.Если вы будете выполнять больше упражнений, требующих быстрого сокращения мышечных волокон, вы разовьете эти волокна, увеличите их размер и, по сути, научите свой мозг доступу к волокнам типа II.
С другой стороны, тренировки на выносливость научат вас задействовать волокна типа I.
Итак, если вы тренируетесь на силу, чтобы максимально задействовать мышечные волокна типа IIa, вам нужно выполнять больше силовых, высокоинтенсивных и силовых тренировок и меньше тренировок на выносливость. Подумайте об интенсивности, скорости и взрывной силе, а не о длинных и медленных.
Также важно учитывать при тренировке мышечных волокон типа II движения с высокой и низкой ударной нагрузкой. Плиометрические движения с меньшей ударной нагрузкой сосредоточены на силе в спорте с преобладанием скорости. Сопротивление, которое вам необходимо преодолеть, обычно ниже.
Плиометрические упражнения с высокой ударной нагрузкой направлены на противоположное и требуют большего сопротивления. В приведенном ниже списке тренировка с низкой ударной нагрузкой включает олимпийские подъемы и спринт. Тренировки с более высокой ударной нагрузкой включают прыжки с падением и приседания с прыжком.
Вот несколько примеров упражнений, которые вы можете использовать со своим клиентом для тренировки волокон типа IIa.Подходы от 10 до 15 повторений идеальны для набора и максимизации быстро сокращающихся волокон.
- Плиометрические упражнения с отягощением, такие как приседания с прыжком.
- Скоростные приседания.
- Скоростные скамейки.
- Олимпийских подъемника.
- Падение и ловля движется.
- Прыжки с падением.
- Спринт.
Большинство людей, тренирующихся с тренером, выигрывают от комбинации силовых и выносливых тренировок. Но если у вас есть один клиент, который действительно хочет сосредоточиться на последнем, помогите ему научиться это делать.Тренируйтесь печатать, и вы действительно сможете подтолкнуть его к его целям большей мощности, силы и скорости.
ISSA предлагает сертификат силы и фитнеса, который глубже проникает в область целенаправленных тренировок. Вы можете зарегистрироваться здесь и узнать, как лучше помочь своим клиентам в достижении их фитнес-целей.
Щелкните ЗДЕСЬ, чтобы загрузить этот раздаточный материал и поделиться им со своими клиентами!
ISSA
Список литературы
- Нетреба, А.И., Попов Д. Любаева Е.В., Бравый И.Р., Простова А.Б., Лемешева И.С. Виноградова, О. (2007) Физиологические эффекты использования силовых тренировок низкой интенсивности без расслабления при односуставных и многосуставных движениях. Росс Физиол Ж Им И М Сеченова. 93 (1) 27-38
- Campos, G.E., Luecke, T.J., Wendeln, H.K., Toma, K., Hagerman, F.C., Murray T.F., Ragg, K.E., Ratamess, N.A., Kraemer, W.J., Staron, R.S. (2002). Мышечные адаптации в ответ на три различных режима тренировок с отягощениями: специфика повторных зон максимальной тренировки. Европейский журнал прикладной физиологии , 88 (1-2) 50-6
Рекомендуемый курс
Сертификат прочности и кондиционирования
Sports — это большой бизнес, приносящий прибыль спортсменам и отдельным лицам, которые готовят спортсменов к соревнованиям. Профессиональные спортсмены и спортсмены-любители на всех уровнях — от школьных клубных команд до Национальной футбольной лиги — нуждаются в помощи опытных личных тренеров, чтобы преуспеть в своих видах спорта.
Посмотреть продукткомментариев?
.