Как отреагирует фосфатная буферная система на понижение ph: Как отреагирует фосфатная буферная система на понижение рН?
Процессы в буферных системах. Основные буферные системы крови. Фосфатная буферная система
Фосфатная буферная система играет существенную роль в регуляции КЩР внутри клеток, особенно — канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках в сравнении с внеклеточной жидкостью (около 8% общей буферной ёмкости). Фосфатный буфер состоит из двух компонентов: щелочного — (Na 2 HPO 4) и кислого — (NaH 2 PO 4).
Эпителий канальцев почек содержит компоненты буфера в максимальной концентрации, что обеспечивает его высокую мощность. В крови фосфатный буфер способствует поддержанию («регенерации») гидрокарбонатной буферной системы. При увеличении уровня кислот в плазме крови (содержащей и гидрокарбонатный, и фосфатный буфер) увеличивается концентрация H 2 CO 3 и уменьшается содержание NaHCO 3:
H 2 CO 3 + Na 2 HPO 4 NaHCO 3 + NaH 2 PO 4
В результате избыток угольной кислоты устраняется, а уровень NaHCO 3 возрастает.
Белковая буферная система
Белковая буферная система — главный внутриклеточный буфер. Он составляетпримерно три четверти буферной емкости внутриклеточной жидкости.
Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белок‑COOH) и соли сильного основания (белок‑COONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми свойствами. В результате вместо сильного основания образуется слабоосновная соль.
Гемоглобиновая буферная система
Гемоглобиновая буферная система — наиболее ёмкий буфер крови — составляет более половины всей её буферной ёмкости. Гемоглобиновый буфер состоит из кислого компонента — оксигенированного Hb — HbO 2 и основного — неоксигенированного. HbO 2 примерно в 80 раз сильнее диссоциирует с отдачей в среду H + , чем Hb. Соответственно, он больше связывает катионов, главным образом K + .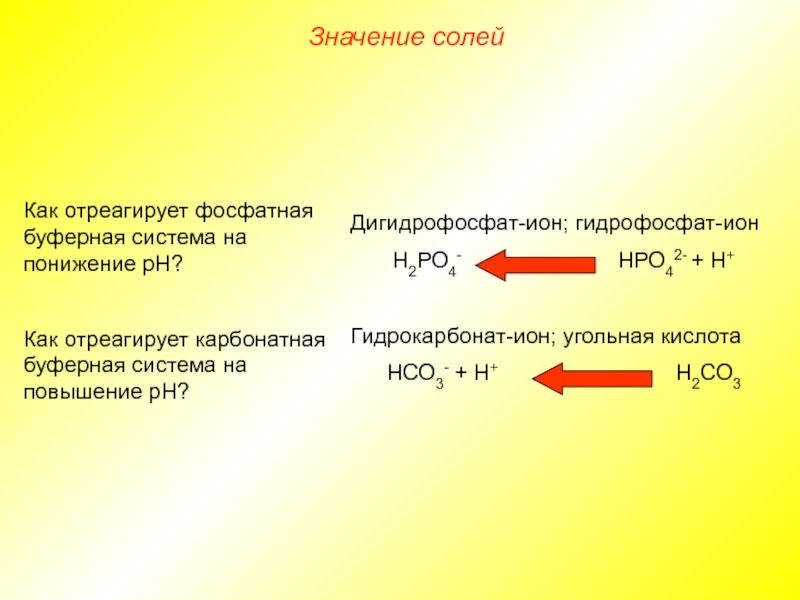
Основная роль гемоглобиновой буферной системы заключается в её участии в транспорте CO 2 от тканей к лёгким.
В капиллярах большого круга кровообращения HbO 2 отдаёт кислород. В эритроцитах CO 2 взаимодействует с H 2 O и образуется H 2 CO 3 . Эта кислота диссоциирует на HCO 3 – и H + , который соединяется с Hb. Анионы HCO 3 – из эритроцитов выходят в плазму крови, а в эритроциты поступает эквивалентное количество анионов Cl – . Остающиеся в плазме крови ионы Na + взаимодействуют с HCO 3 – и благодаря этому восстанавливают её щелочной резерв.
В капиллярах лёгких , в условиях низкого pСО 2 и высокого pО 2 , Hb присоединяет кислород с образованием HbO 2 . Карбаминовая связь разрывается, в связи с чем высвобождается CO 2 . При этом, HCO 3 – из плазмы крови поступает в эритроциты (в обмен на ионы Cl –) и взаимодействует с H + , отщепившимся от Hb в момент его оксигенации. Образующаяся H 2 CO 3 под влиянием карбоангидразы расщепляется на CO 2 и H 2 O.
Карбонаты костной ткани
Карбонаты костной ткани функционируют как депо для буферных систем организма. В костях содержится большое количество солей угольной кислоты: карбонаты кальция, натрия, калия и др. При остром увеличении содержания кислот (например, при острой сердечной, дыхательной или почечной недостаточности, шоке, коме и других состояниях) кости могут обеспечивать до 30–40% буферной ёмкости. Высвобождение карбоната кальция в плазму крови способствует эффективной нейтрализации избытка H + . В условиях хронической нагрузки кислыми соединениями (например, при хронической сердечной, печёночной, почечной, дыхательной недостаточности) кости могут обеспечивать до 50% буферной ёмкости биологических жидкостей организма.
ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ
Наряду с мощными и быстродействующими химическими системами в организме функционируют органные механизмы компенсации и устранения сдвигов КОС. Для их реализации и достижения необходимого эффекта требуется больше времени — от нескольких минут до нескольких часов. К наиболее эффективным физиологическим механизмам регуляции КОС относят процессы, протекающие в лёгких, почках, печени и ЖКТ.
Для их реализации и достижения необходимого эффекта требуется больше времени — от нескольких минут до нескольких часов. К наиболее эффективным физиологическим механизмам регуляции КОС относят процессы, протекающие в лёгких, почках, печени и ЖКТ.
Лёгкие
Причиной изменения объёма дыхания является прямое или рефлекторное изменение возбудимости нейронов дыхательного центра.
Снижение рН в жидкостях организма (плазма крови, СМЖ) является специфическим рефлекторным стимулом увеличения частоты и глубины дыхательных движений. Вследствие этого лёгкие выделяют избыток CO 2 (образующийся при диссоциации угольной кислоты). В результате содержание H + (HCO 3 – + H + = H 2 CO 3 ® H 2 O + CO 2) в плазме крови и других жидкостях организма снижается.
Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов дыхательного центра. Это приводит к уменьшению альвеолярной вентиляции и выведению из организма CO 2 , т.е. к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием H + , — показатель рН снижается.
Следовательно, система внешнего дыхания довольно быстро (в течение нескольких минут) способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вентиляции лёгких в два раза повышает рН крови примерно на 0,2; снижение вентиляции на 25% может уменьшить рН на 0,3‑0,4.
Почки
К главным механизмам уменьшения или устранения сдвигов КОС крови, реализуемых нефронами почек, относят ацидогенез, аммониогенез, секрецию фосфатов и K + ,Na + ‑обменный механизм.
Ацидогенез . Этот энергозависимый процесс, протекающий в эпителии дистальных отделов нефрона и собирательных трубочек, обеспечивает секрецию в просвет канальцев H + в обмен на реабсорбируемый Na + (рис. 14–1).
14–1).
Ы ВЁРСТКА Вставить файл « ПФ Рис 14 01 Реабсорбция HCO3‑ в клетках проксимального отдела»
Рис .14–1 .Реабсорбция HCO 3‑ в клетках проксимального отдела .
КА — карбоангидраза.
Ы ВЁРСТКА Вставить файл « ПФ Рис 14 02 Реабсорбция HCO3‑ в клетках проксимального отдела»
Рис .14–2 .Секреция H + клетками канальцев и собирательных трубочек .
КА — карбоангидраза.
Количество секретируемого H + эквивалентно его количеству, попадающему в кровь с нелетучими кислотами и H 2 CO 3 . Реабсорбированный из просвета канальцев в плазму крови Na + участвует в регенерации плазменной гидрокарбонатной буферной системы (рис. 13–2).
Аммониогенез , как и ацидогенез, реализует эпителий канальцев нефрона и собирательных трубочек. Аммониогенез осуществляется путём окислительного дезаминирования аминокислот, преимущественно (примерно 2/3) — глютаминовой, в меньшей мере — аланина, аспарагина, лейцина, гистидина. Образующийся при этом аммиак диффундирует в просвет канальцев. Там NH 3 + присоединяет ион H + с образованием иона аммония (NH 4 +). Ионы NH 4 + замещают Na + в солях и выделяются преимущественно в виде NH 4 Cl и (NH 4) 2 SO 4 . В кровь при этом поступает эквивалентное количество гидрокарбоната натрия, обеспечивающего регенерацию гидрокарбонатной буферной системы.
Образующийся при этом аммиак диффундирует в просвет канальцев. Там NH 3 + присоединяет ион H + с образованием иона аммония (NH 4 +). Ионы NH 4 + замещают Na + в солях и выделяются преимущественно в виде NH 4 Cl и (NH 4) 2 SO 4 . В кровь при этом поступает эквивалентное количество гидрокарбоната натрия, обеспечивающего регенерацию гидрокарбонатной буферной системы.
Секреция фосфатов осуществляется эпителием дистальных канальцев при участии фосфатной буферной системы:
Na 2 HPO 4 + H 2 CO 3 NaH 2 PO 4 + NaHCO 3
Образующийся гидрокарбонат натрия реабсорбируется в кровь и поддерживает гидрокарбонатный буфер, а NaH 2 PO 4 выводится из организма с мочой.
Таким образом, секреция H + эпителием канальцев при реализации трёх описанных выше механизмов (ацидогенеза, аммониогенеза, секреции фосфатов) сопряжена с образованием гидрокарбоната и поступлением его в плазму крови. Это обеспечивает постоянное поддержание одной из наиболее важных, ёмких и мобильных буферных систем — гидрокарбонатной и как следствие — эффективное устранение или уменьшение опасных для организма сдвигов КОС.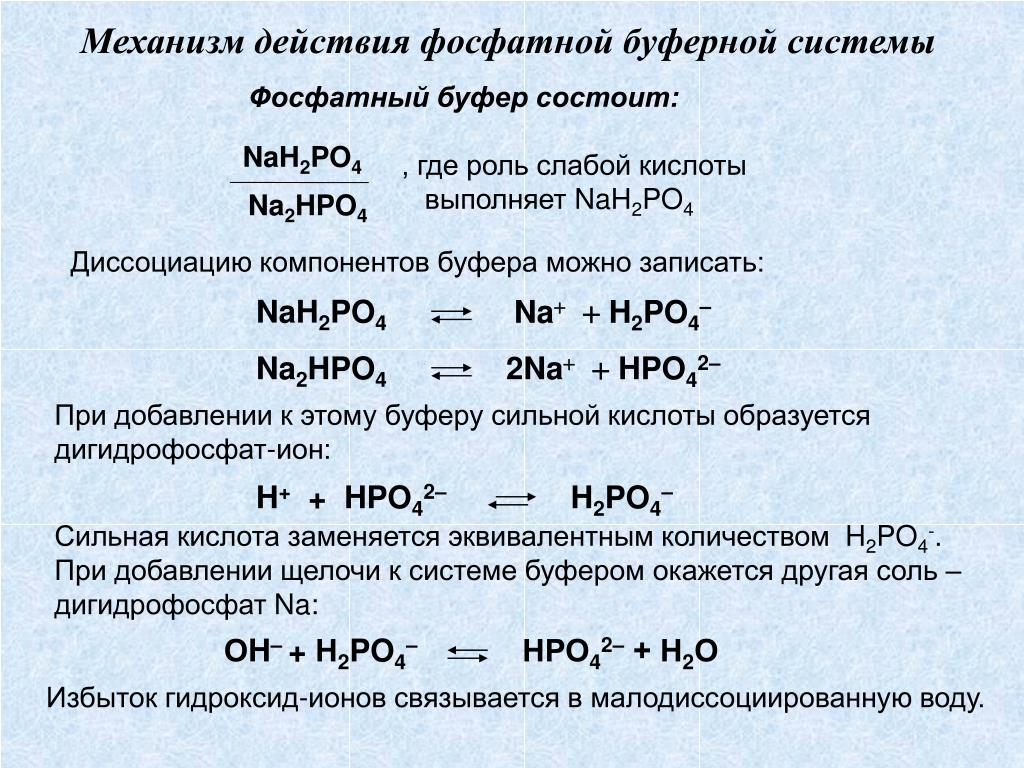
К + ,Na + ‑обменный механизм , реализуемый в дистальных отделах нефрона и начальных участках собирательных трубочек, обеспечивает обмен Na + первичной мочи на K + , выводящийся в неё эпителиальными клетками. Реабсорбированный Na + в жидких средах организма участвует в регенерации гидрокарбонатной буферной системы. K + ,Na + ‑обмен контролируется альдостероном. Кроме того, альдостерон регулирует (увеличивает) объём секреции и экскреции H + .
Таким образом, почечные механизмы устранения или уменьшения сдвигов КОС осуществляются путём экскреции H + и восстановления резерва гидрокарбонатной буферной системы в жидких средах организма.
Печень
Печень играет существенную роль в компенсации сдвигов КОС. В ней действуют, с одной стороны, общие внутри‑ и внеклеточные буферные системы (гидрокарбонатная, белковая и др.), с другой стороны, в гепатоцитах осуществляются различные реакции метаболизма, имеющие прямое отношение к устранению расстройств КОС.
Синтез белков крови , входящих в белковую буферную систему. В печени образуются все альбумины, а также фибриноген, протромбин, проконвертин, проакцелерин, гепарин, ряд глобулинов и ферментов.
Образование аммиака , способного нейтрализовать кислоты как в самих гепатоцитах, так и в плазме крови и в межклеточной жидкости.
Синтез глюкозы из неуглеводных веществ — аминокислот, глицерина, лактата, пирувата. Включение этих органических нелетучих кислот при образовании глюкозы обеспечивает снижение их содержания в клетках и биологических жидкостях. Так, МК, которую многие органы и ткани не способны метаболизировать, в гепатоцитах примерно на 80% трансформируется в H 2 O и CO 2 , а оставшееся количество ресинтезируется в глюкозу. Таким образом, лактат превращается в нейтральные продукты.
Выведение из организма нелетучих кислот — глюкуроновой и серной при детоксикации продуктов метаболизма и ксенобиотиков.
Экскреция в кишечник кислых и основных веществ с жёлчью.
Желудок и кишечник
Желудок участвует в демпфировании сдвигов КЩР, главным образом, путём изменения секреции соляной кислоты: при защелачивании жидких сред организма этот процесс тормозится, а при закислении — усиливается. Кишечник способствует уменьшению или устранению сдвигов КЩР посредством:
Секреции кишечного сока, содержащего большое количество гидрокарбоната. При этом в плазму крови поступает H + .
Изменения количества всасываемой жидкости . Это способствует нормализации водного и электролитного баланса в клетках, во внеклеточной и других биологических жидкостях и как следствие — — нормализации рН.
Реабсорбции компонентов буферных систем (Na + , K + , Ca 2+ , Cl – , HCO 3 –).
Похожая информация.
Введение
Буферные системы организма
Организм
можно определить как физико-химическую
систему, существующую в окружающей
среде в стационарном состоянии. Именно
эта способность живых систем сохранять
стационарное состояние в условиях
непрерывно меняющейся среды и обусловливает
их выживание. Для обеспечения стационарного
состояния у всех организмов – от
морфологически самых простых до наиболее
сложных – выработались разнообразные
анатомические, физиологические и
поведенческие приспособления, служащие
одной цели – сохранению постоянства
внутренней среды.
Для обеспечения стационарного
состояния у всех организмов – от
морфологически самых простых до наиболее
сложных – выработались разнообразные
анатомические, физиологические и
поведенческие приспособления, служащие
одной цели – сохранению постоянства
внутренней среды.
Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса.
Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
Н+ + буфер- Н-буфер
В
организме одновременно существует
несколько различных буферных систем. В функциональном плане их можно разделить
на бикарбонатную и небикарбонатную.
Небикарбонатная буферная система
включает гемоглобин, различные белки
и фосфаты. Она наиболее активно действует
в крови и внутри клеток.
В функциональном плане их можно разделить
на бикарбонатную и небикарбонатную.
Небикарбонатная буферная система
включает гемоглобин, различные белки
и фосфаты. Она наиболее активно действует
в крови и внутри клеток.
Биологические буферные системы
Большинство биожиткостей организма способно сохранять значение pH при незначительных внешних воздействий, так как они являются буферными растворами.
Буферный раствор – это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянное значение pH при разбавлении или при добавлении небольших количеств кислот или щелочи.
В протолитических буферных растворах компонентами являются донор протона и акцептор протона, представляющие собой сопряженную кислотно- основную пару.
По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на кислотные и основные.
Кислотными
буферными системами называются растворы,
содержащие слабую кислоту (донор
протона) и соль этой кислоты (акцептор
протона). Кислотные буферные растворы
могут содержать различные системы:
ацетатную (Ch4COO-, Ch4COOH), гидрокарбонатную
(HCO3-, h3CO3), гидрофосфатную(HPO22-, h3PO4-).
Кислотные буферные растворы
могут содержать различные системы:
ацетатную (Ch4COO-, Ch4COOH), гидрокарбонатную
(HCO3-, h3CO3), гидрофосфатную(HPO22-, h3PO4-).
Основными буферными системами называются растворы, содержащие слабые основания (акцептор протона) и соль этого основания (донор протона).
Гидрокарбонатная буферная система
Гидрокарбонатная буферная система образована оксидом углерода (IV).
СО2 + Н2О- СО2 Н2О — Н2СО3- Н+ + НСО3-
В этой системе донором протона является угольная кислота h3CO3, а акцептором протона – гидрокарбонат-ион HCO3-.С учетом физиологии условно весь CO2в организме, как просто растворенный, так и гидратированный до угольной кислоты, принято рассматривать как угольную кислоту.
Угольная
кислота при физиологическом значении
pH= 7,40 находится преимущественно в виде
моноаниона, а отношение концентраций
компонентов в гидрокарбонатной буферной
системе крови [ HCO3-]\ =20:1. Следовательно,
гидрокарбонатная система имеет буферную
емкость по кислоте значительно больше
буферной емкости по основанию. + Н2О
+ Н2О
При поступлении в кровь оснований, они связываются угольной кислотой, и равновесие смещается в сторону HCO3-.
ОН- + Н2СО3 — НСО3- + Н2О
Главное назначение гидрокарбонатного буфера заключается в нейтрализации кислот. Он является системой быстрого и эффективного реагирования, так как продукт его взаимодействия с кислотами – углекислый газ – быстро выводится через легкие. Нарушение кислотно- основного равновесия в организме прежде всего компенсируется с помощью гидрокарбонатной буферной системы (10-15 мин.)
Гидрокарбонатный буфер является основной буферной системой плазмы крови, обеспечивающей около 55% от всей буферной емкости крови. Гидрокарбонатный буфер содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
Гидрофосфатная буферная система
Гидрофосфатная буферная система содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках она представлена К2НРО4 и КН2РО4 , а в плазме крови и межклеточной жидкости
Nа2НРО4и
NаН2РО4. Роль донора протона в этой системе
играет ион Н2РО4-, а акцептора – ион
НРО42-.
Роль донора протона в этой системе
играет ион Н2РО4-, а акцептора – ион
НРО42-.
В норме отношение форм [НРО42-]\[ Н2РО4-] =4:1. Следовательно, и эта система имеет буферную емкость по кислоте больше, чем по основанию. При увеличении концентрации катионов водорода во внутриклеточной жидкости, например в результате переработки мясной пищи, происходит их нейтрализация ионами НРО42-.
Н+ + НРО42- — Н2РО4-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентраций оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4-
ОН- + Н2РО4- — НРО42-+ Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
В
отличии от гидрокарбонатной, фосфатная
система более « консервативная», так
как избыточные продукты нейтрализации
выводятся через почки и полное
восстановление отношений [НРО42-]\[
Н2РО4-] происходит только через 2-3 сут. Длительности легочной и почечной
компенсации нарушений отношения
компонентов в буферных системах
необходимо учитывать при терапевтической
коррекции нарушений кислотно- основного
равновесия организма.
Длительности легочной и почечной
компенсации нарушений отношения
компонентов в буферных системах
необходимо учитывать при терапевтической
коррекции нарушений кислотно- основного
равновесия организма.
Гемоглобиновая буферная система
гемоглобиновая буферная система является сложной буферной системой эритроцитов, которая включает в качестве донора протона две слабые кислоты: гемоглобин ННb и оксигемоглобин ННbО2. роль акцептора протона играет сопряженные этим кислотам основания, т.е. их анионы Нb- и НbО2-.
Н+ + Нb-ННb Н+ + НbО2- — ННb + О2
При добавлении кислот поглощать ионы Н+ в первую очередь будут анионы гемоглобина, которые имеют большое сродство к протону. При действии основания оксигемоглобин будет проявлять большую активность, чем гемоглобин.
ОН- + ННbО2 — НbО2- + Н2О ОН- + ННb- Нb- + Н2О
Таким
образом, гемоглобиновая система крови
играет значительную роль сразу в
нескольких важнейших физиологических
процессах организма: дыхании, транспорте
кислорода в ткани и поддержании
постоянства рН внутри эритроцитах, а
конечном итоге — в крови.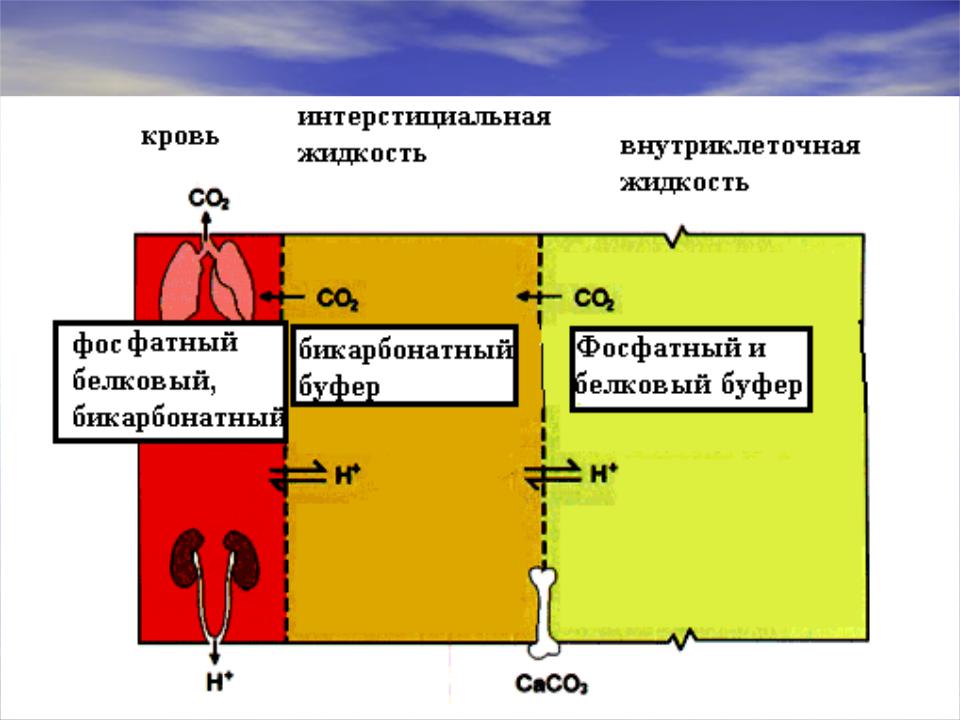 Эта система
эффективно функционирует только в
сочетании с другими буферными системами
организма.
Эта система
эффективно функционирует только в
сочетании с другими буферными системами
организма.
Белковые (протеиновые) буферные системы
Белковые буферные системы в зависимости от кислотно-основных свойств белка, характеризующиеся его изоэлектрической точкой, бывают анионного и катионного типа.
Анионный белковый буфер работает при рН>рIбелка и состоит из донора протонов – молекулы белка НРrot, имеющей биполярно- ионное строение, и акцептора протонов – анион Рrot-.
Н3N+ – Рrot – СООН — Н+ + Н3N – Рrot – СОО-
кратко Н2Рrot — Н+ + (НРrot)-
При добавлении кислоты это равновесие смещается в сторону образование молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
Катионная белковая буферная система работает при рН
Н3N+ – Рrot – СООН- Н+ + Н3N – Рrot – СОО-
кратко (Н2Рrot)+ + НРrot
Катионная буферная система НРrot, (Н2Рrot)+ обычно
поддерживает величину рН в физиологических
средах с рН 6. В крови работает анионный
белковый буфер.
В крови работает анионный
белковый буфер.
Ацидоз
Ацидоз (от лат. acidus — кислый) — cмещение кислотно-щелочного баланса организма в сторону увеличения кислотности (уменьшению рН).
Причины ацидоза
Обычно продукты окисления органических кислот быстро удаляются из организма. При лихорадочных заболеваниях, кишечных расстройствах, беременности, голодании и др. они задерживаются в организме, что проявляется в лёгких случаях появлением в моче ацетоуксусной кислоты и ацетона (т. н. ацетонурия), а в тяжёлых (например, при сахарном диабете) может привести к коме.
характеризуется абсолютным или относительным избытком кислот, т.е. веществ, отдающих ионы водорода (протоны), по отношению к основаниям, присоединяющим их.
Ацидоз
может быть компенсированным и
некомпенсированным в зависимости от
значения рН — водородного показателя
биологической среды (обычно крови),
выражающего концентрацию водородных
ионов. При компенсированном ацидозе рН
крови смещается к нижней границе
физиологической нормы (7,35). При более
выраженном сдвиге в кислую сторону (рН
менее 7,35) ацидоз считается некомпенсированным.
Такой сдвиг обусловлен значительным
избытком кислот и недостаточностью
физико-химических и физиологических
механизмов регуляции кислотно-щелочного
равновесия. (Кислотно-щелочное равновесие)
При более
выраженном сдвиге в кислую сторону (рН
менее 7,35) ацидоз считается некомпенсированным.
Такой сдвиг обусловлен значительным
избытком кислот и недостаточностью
физико-химических и физиологических
механизмов регуляции кислотно-щелочного
равновесия. (Кислотно-щелочное равновесие)
По происхождению А. может быть газовым, негазовым и смешанным. Газовый А. возникает вследствие альвеолярной гиповентиляции (недостаточного выведения СО2 из организма) либо в результате вдыхания воздуха или газовых смесей, содержащих повышенные концентрации углекислоты. При этом парциальное давление углекислого газа (рСО2) в артериальной крови превышает максимальные значения нормы (45 мм рт. ст.), т.е. имеет место гиперкапния.
Негазовый А. характеризуется избытком нелетучих кислот, первичным снижением содержания бикарбоната в крови и отсутствием гиперкапнии. Основными его формами являются метаболический, выделительный и экзогенный ацидоз.
Метаболический
А. возникает вследствие накопления
избытка кислых продуктов в тканях,
недостаточного их связывания или
разрушения; при увеличении продукции
кетоновых тел (кетоацидоз), молочной
кислоты (лактат-ацидоз) и других
органических кислот. Кетоацидоз
развивается чаще всего при сахарном
диабете, а также при голодании (особенно
углеводном), высокой лихорадке, тяжелой
инсулиновой гипогликемии, при некоторых
видах наркоза, алкогольной интоксикации,
гипоксии, обширных воспалительных
процессах, травмах, ожогах и др.
Лактат-ацидоз встречается наиболее
часто. Кратковременный лактат-ацидоз
возникает при усиленной мышечной работе,
особенно у нетренированных людей, когда
увеличивается продукция молочной
кислоты и происходит недостаточное ее
окисление вследствие относительного
дефицита кислорода. Длительный
лактат-ацидоз отмечается при тяжелых
поражениях печени (цирроз, токсическая
дистрофия), декомпенсации сердечной
деятельности, а также при уменьшении
поступления кислорода в организм
вследствие недостаточности внешнего
дыхания и при других формах кислородного
голодания. В большинстве случаев
метаболический А. развивается в результате
избытка в организме нескольких кислых
продуктов.
Кетоацидоз
развивается чаще всего при сахарном
диабете, а также при голодании (особенно
углеводном), высокой лихорадке, тяжелой
инсулиновой гипогликемии, при некоторых
видах наркоза, алкогольной интоксикации,
гипоксии, обширных воспалительных
процессах, травмах, ожогах и др.
Лактат-ацидоз встречается наиболее
часто. Кратковременный лактат-ацидоз
возникает при усиленной мышечной работе,
особенно у нетренированных людей, когда
увеличивается продукция молочной
кислоты и происходит недостаточное ее
окисление вследствие относительного
дефицита кислорода. Длительный
лактат-ацидоз отмечается при тяжелых
поражениях печени (цирроз, токсическая
дистрофия), декомпенсации сердечной
деятельности, а также при уменьшении
поступления кислорода в организм
вследствие недостаточности внешнего
дыхания и при других формах кислородного
голодания. В большинстве случаев
метаболический А. развивается в результате
избытка в организме нескольких кислых
продуктов.
Выделительный
А. в результате уменьшения выведения
из организма нелетучих кислот отмечается
при заболеваниях почек (например, при
хроническом диффузном гломерулонефрите),
приводящих к затруднению удаления
кислых фосфатов, органических кислот. Усиленное выведение с мочой ионов
натрия, обусловливающее развитие
почечного А., наблюдается в условиях
торможения процессов ацидо- и аммониогенеза,
например при длительном применении
сульфаниламидных препаратов, некоторых
мочегонных средств. Выделительный А.
(гастроэнтеральная форма) может развиться
при увеличенной потере оснований через
желудочно-кишечный тракт, например при
поносах, упорной рвоте забрасываемым
в желудок щелочным кишечным соком, а
также при длительно усиленном
слюноотделении. Экзогенный А. наступает
при введении в организм большого
количества кислых соединений, в т.ч.
некоторых лекарственных препаратов.
Усиленное выведение с мочой ионов
натрия, обусловливающее развитие
почечного А., наблюдается в условиях
торможения процессов ацидо- и аммониогенеза,
например при длительном применении
сульфаниламидных препаратов, некоторых
мочегонных средств. Выделительный А.
(гастроэнтеральная форма) может развиться
при увеличенной потере оснований через
желудочно-кишечный тракт, например при
поносах, упорной рвоте забрасываемым
в желудок щелочным кишечным соком, а
также при длительно усиленном
слюноотделении. Экзогенный А. наступает
при введении в организм большого
количества кислых соединений, в т.ч.
некоторых лекарственных препаратов.
Развитие
смешанных форм А. (сочетание газового
и различных видов негазового А.)
обусловлено, в частности, тем
обстоятельством, что СО2 диффундирует
через альвеолокапиллярные мембраны
примерно в 25 раз легче, чем О2. Поэтому
затруднение выделения СО2 из организма
вследствие недостаточного газообмена
в легких сопровождается снижением
оксигенации крови и, следовательно,
развитием кислородного голодания с
последующим накоплением недоокисленных
продуктов межуточного обмена (главным
образом молочной кислоты). Такие формы
А. наблюдаются при патологии
сердечно-сосудистой или дыхательной
систем.
Такие формы
А. наблюдаются при патологии
сердечно-сосудистой или дыхательной
систем.
Умеренный
компенсированный А. протекает практически
бессимптомно и распознается путем
исследования буферных систем крови, а
также состава мочи. При углублении А.
одним из первых клинических симптомов
является усиленное дыхание, которое
затем переходит в резкую одышку,
патологические формы дыхания.
Некомпенсированный А. характеризуется
значительными расстройствами функций
ц.н.с., сердечно-сосудистой системы,
желудочно-кишечного тракта и др. А.
приводит к повышению содержания
катехоламинов в крови, поэтому при его
появлении сначала отмечается усиление
сердечной деятельности, учащение пульса,
повышение минутного объема крови, подъем
АД. По мере углубления А. снижается
реактивность адренорецепторов, и
несмотря на повышенное содержание
катехоламинов в крови, сердечная
деятельность угнетается, АД падает. При
этом нередко возникают различные виды
сердечных аритмий, вплоть до фибрилляции
желудочков. Кроме того, А. приводит к
резкому усилению вагусных эффектов,
вызывая бронхоспазм, увеличение секреции
бронхиальных и пищеварительных желез;
нередко возникают рвота, понос. При всех
формах А. кривая диссоциации оксигемоглобина
смещается вправо, т.е. сродство гемоглобина
к кислороду и его оксигенация в легких
уменьшаются.
приводит к
резкому усилению вагусных эффектов,
вызывая бронхоспазм, увеличение секреции
бронхиальных и пищеварительных желез;
нередко возникают рвота, понос. При всех
формах А. кривая диссоциации оксигемоглобина
смещается вправо, т.е. сродство гемоглобина
к кислороду и его оксигенация в легких
уменьшаются.
В условиях А. изменяется проницаемость биологических мембран, часть ионов водорода перемещается внутрь клеток в обмен на ионы калия, которые отщепляются от белков в кислой среде. Развитие гиперкалиемии в сочетании с низким содержанием калия в миокарде приводит к изменению его чувствительности к катехоламинам, лекарственным препаратам и другим воздействиям. При некомпенсированном А. наблюдаются резкие расстройства функции ц.н.с. — головокружение, сонливость, потеря сознания и выраженные расстройства вегетативных функций.
Алкалоз
Алкало́з
(позднелат. alcali щелочь, от арабск.
al-quali) — нарушение кислотно-щелочного
равновесия организма, характеризующееся
абсолютным или относительным избытком
оснований.
Классификация
Алкалоз может быть компенсированным и некомпенсированным.
Компенсированный алкалоз — нарушение кислотно-щелочного равновесия, при котором рН крови удерживается в пределах нормальных величин (7,35-7,45) и отмечаются лишь сдвиги в буферных системах и физиологических регуляторных механизмах.
При некомпенсированном алкалозе рН превышает 7,45, что обычно связано со значительным избытком оснований и недостаточностью физико-химических и физиологических механизмов регуляции кислотно-щелочного равновесия.
Этиология
По происхождению алкалоза выделяют следующие группы.
Газовый (респирато́рный) алкалоз
Возникает
вследствие гипервентиляции лёгких,
приводящей к избыточному выведению СО2
из организма и падению парциального
напряжения двуокиси углерода в
артериальной крови ниже 35 мм рт. ст., то
есть к гипокапнии. Гипервентиляция
лёгких может наблюдаться при органических
поражениях головного мозга (энцефалиты,
опухоли и др.), действии на дыхательный
центр различных токсических и
фармакологических агентов (например,
некоторых микробных токсинов, кофеина,
коразола), при повышенной температуре
тела, острой кровопотере и др.
Негазовый алкалоз
Основными формами негазового алкалоз являются: выделительный, экзогенный и метаболический. Выделительный алкалоз может возникнуть, например, вследствие больших потерь кислого желудочного сока при желудочных свищах, неукротимой рвоте и др. Выделительный алкалоз может развиться при длительном приёме диуретиков, некоторых заболеваниях почек, а также при эндокринных расстройствах, приводящих к избыточной задержке натрия в организме. В некоторых случаях выделительный алкалоз связан с усиленным потоотделением.
Экзогенный алкалоз наиболее часто наблюдается при избыточном введении бикарбоната натрия с целью коррекции метаболического ацидоза или нейтрализации повышенной кислотности желудочного сока. Умеренный компенсированный алкалоз может быть обусловлен длительным употреблением пищи, содержащей много оснований.
Метаболический
алкалоз встречается при некоторых
патологических состояниях, сопровождающихся
нарушениями обмена электролитов. Так,
он отмечается при гемолизе, в
послеоперационном периоде после
некоторых обширных оперативных
вмешательств, у детей, страдающих
рахитом, наследственными нарушениями
регуляции электролитного обмена.
Смешанный алкалоз
Смешанный алкалоз (сочетание газового и негазового алкалоза) может наблюдаться, например, при травмах головного мозга, сопровождающихся одышкой, гипокапнией и рвотой кислым желудочным соком.
Патогенез
При алкалозе (особенно связанном с гипокапнией) происходят общие и регионарные нарушения гемодинамики: уменьшается мозговой и коронарный кровоток, снижаются АД и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для газового алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
Терапия
газового алкалоза заключается в
устранении причины, вызвавшей
гипервентиляцию, а также в непосредственной
нормализации газового состава крови
путем вдыхания смесей, содержащих
углекислый газ (например — карбогена). Терапия негазового алкалоза проводится
в зависимости от его вида. Применяют
растворы хлоридов аммония, калия,
кальция, инсулин, средства, угнетающие
карбоангидразу и способствующие
выделению почками ионов натрия и
гидрокарбоната
Терапия негазового алкалоза проводится
в зависимости от его вида. Применяют
растворы хлоридов аммония, калия,
кальция, инсулин, средства, угнетающие
карбоангидразу и способствующие
выделению почками ионов натрия и
гидрокарбоната
Заключение
В заключение следует отметить,что в организме человека вследствие процессов дыхания и пищеварения происходит постоянное образование двух противоположностей:кислот и оснований, причем преимущественно слабых, что обеспечивает равновесный характер протолитическим процессам,протекающим в организме. В то же время из организма постоянно выводятся кислотно-основные продукты, в основном через легкие и почки. За счет сбалансированности процессов поступления и выведения кислот и оснований,а также за счет равновесного характера протолитических процессов,определяющих взаимодействие этих двух противоположностей, в организме поддерживается состояние протолитического (кислотно-основного) гомеостаза.
Список используемой литературы:
В. И.Слесарев
«Химия: Основы химии живого: Учебник
для вузов»-СПб: Химиздат,2000.
И.Слесарев
«Химия: Основы химии живого: Учебник
для вузов»-СПб: Химиздат,2000.
В.А.Попков, С.А. Пузаков «Общая химия:учебник»-М.:ГЭОТАР-Медиа,2009.
Ю.А.Ершов,В.А.Попков,А.С.Берлянд и др.; Под ред. Ю.А.Ершова «Общая химия. Биофизическая химия. Химия биогенных элементов»-М.: Высш.шк.,1993
Интернет-ресурсы:
«Алкалоз» , «Ацидоз»- http://ru.wikipedia.org/wiki
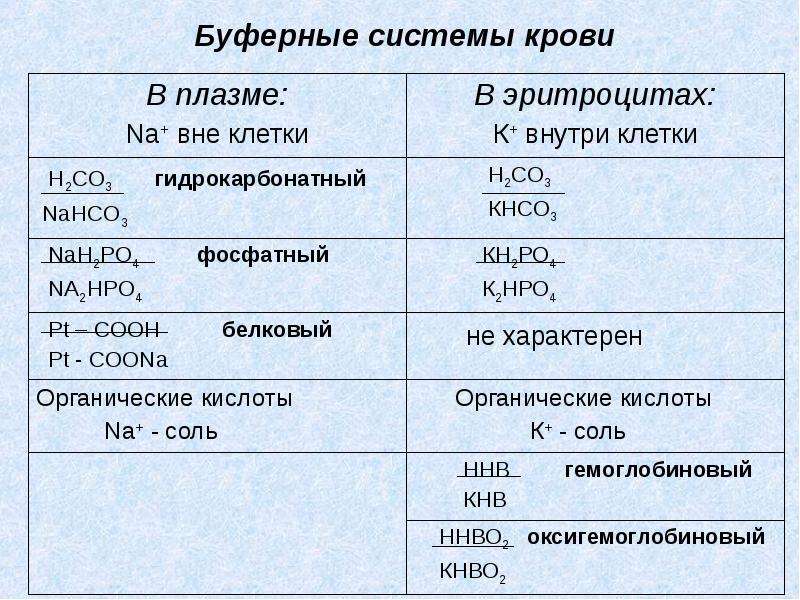
При сдвигах содержания ионов Н+ в крови и других средах организма (как при увеличении, так и при снижении их количества) сначала срабатывают быстродействующие и мощные химические буферные системы плазмы и эритроцитов (гемоглобиновая, бикарбонатная, фосфатная, белковая). Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т. е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду. Бикарбонатная (гидрокарбонатная) буферная система является основным буфером плазмы крови и внеклеточной жидкости и составляет примерно 15% общей буферной ёмкости крови. Она представлена во внеклеточной среде угольной кислотой (Н2СОз) и гидрокарбонатом натрия (NaHCO3). Концентрация водородных ионов в данном буфере равна = К [ Н2С03 / NaHC03 = 1/20, где К — константа диссоциации угольной кислоты. Эта буферная система обеспечивает, с одной стороны, образование NaHC03, с другой — образование угольной кислоты (H+ + НСОз -» Н2С03) и распад последней (Н2С03 -» Н20 + С02) под влиянием фермента карбоангидразы до Н20 и С02. Углекислый газ удаляется лёгкими при выдохе, при этом сдвига рН не происходит. Данная буферная система препятствует сдвигам рН при внесении в биологическую среду сильных кислот и оснований в результате превращения их либо в слабые кислоты, либо в слабые основания.
е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду. Бикарбонатная (гидрокарбонатная) буферная система является основным буфером плазмы крови и внеклеточной жидкости и составляет примерно 15% общей буферной ёмкости крови. Она представлена во внеклеточной среде угольной кислотой (Н2СОз) и гидрокарбонатом натрия (NaHCO3). Концентрация водородных ионов в данном буфере равна = К [ Н2С03 / NaHC03 = 1/20, где К — константа диссоциации угольной кислоты. Эта буферная система обеспечивает, с одной стороны, образование NaHC03, с другой — образование угольной кислоты (H+ + НСОз -» Н2С03) и распад последней (Н2С03 -» Н20 + С02) под влиянием фермента карбоангидразы до Н20 и С02. Углекислый газ удаляется лёгкими при выдохе, при этом сдвига рН не происходит. Данная буферная система препятствует сдвигам рН при внесении в биологическую среду сильных кислот и оснований в результате превращения их либо в слабые кислоты, либо в слабые основания. Гидрокарбонатный буферная систем — важный индикатор КОС. Это система открытого типа, которая ассоциирована с функцией как системы внешнего дыхания, так почек и кожи Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (Nah3P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с Nah3P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера. Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa).
Гидрокарбонатный буферная систем — важный индикатор КОС. Это система открытого типа, которая ассоциирована с функцией как системы внешнего дыхания, так почек и кожи Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (Nah3P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с Nah3P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера. Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Эта буферная система также способствует предупреждению сдвига рН крови. Позже (через несколько минут и часов) срабатывают физиологические (органные и системные) механизмы компенсации и устранения сдвигов КОС (осуществляемые лёгкими — с выдыхаемым воздухом, почками — с мочой, кожей — с потом, печенью и другими органами пищеварительного тракта — с калом).
Эта буферная система также способствует предупреждению сдвига рН крови. Позже (через несколько минут и часов) срабатывают физиологические (органные и системные) механизмы компенсации и устранения сдвигов КОС (осуществляемые лёгкими — с выдыхаемым воздухом, почками — с мочой, кожей — с потом, печенью и другими органами пищеварительного тракта — с калом).
Сохранение постоянства внутренней среды служит необходимым условием нормального обмена веществ. К наиболее важным показателями, характеризующим постоянство внутренней среды, относится кислотно-щелочное равновесие, то есть соотношение между количеством катионов и анионов в тканях организма, которое выражается показателями рН. У млекопитающих плазма крови имеет слабощелочную реакцию и удерживается в пределах 7,30-7,45.
На состояние кислотно-щелочного равновесия влияют поступление и образование в организме как кислых продуктов (органические кислоты образуются из белков и жиров, а также появляются как продукты межуточного обмена веществ в тканях), так и щелочные вещества (образуются из растительной пищи, богатой щелочными солями органических кислот и щелочно-земельными солями, продукты обмена веществ — аммиак, амины, основные соли фосфорной кислоты). Кислые и щелочные продукты образуются также при различных патологических процессах.
Кислые и щелочные продукты образуются также при различных патологических процессах.
Белковая буферная система представляет собой совокупность альбуминов и глобулинов — белков, составляющих основную часть плазмы крови (~90%).
Изоэлектрические точки этих белков лежат в интервале значений рН = 4,9-6,3, т. е., в слабокислой среде. Поэтому в физиологических условиях (при рН = 7,4) белки находятся преимущественно в формах «белок-основание» и соль «белка-основания».
Соответствующее кислотно-основное равновесие:
смещено в сторону преобладания формы «белок-основание».
Буферная емкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протонакцепторных групп. Эта система может нейтрали-зовать как кислые, так и основные продукты. Однако вследствие преобладания формы «белок-основание», ее буферная емкость значи-тельно выше по кислоте и составляет: для альбуминов = 10 ммоль/л, а для глобулинов = 3 ммоль/л.
4. Аминокислотная буферная система.
Буферная емкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связано с тем, что почти все аминокислоты имеют значения , заметно отличающиеся от 7,4. Поэтому при физиологическом значении рН = 7,4 их мощность мала. Практически только одна аминокислота — гистидин ( = 6,0) — обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
Таким образом, мощность буферных систем плазмы крови уменьшается в ряду:
гидрокарбонатная > белковая > фосфатная > аминокислотная
Эритроциты
Во внутренней среде эритроцитов норме соответствует рН = 7,25. Здесь также действуют гидрокарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах большую роль играет белковая система гемоглобин-оксигемоглобин , на долю которой приходится около 75% всей буферной емкости крови.
Гемоглобин является слабой кислотой ( = 8,2) и диссоци-ирует по уравнению:
HHb ⇄H + + Hb —
При физиологическом значении рН = 7,25 этот описывается уравнением Гендерсона-Гассельбаха:
,
из которого видно, что:
.
Таким образом, при рН = 7,25 кислота HHb диссоциирована только на 10% и концентрация солевой формы гемоглобина (Hb -) значительно меньше, чем концентрация кислоты (HHb).
Система HHb/Hb — может активно нейтрализовать кислые и основные продукты метаболизма, однако обладает более высокой емкостью по щелочи, чем по кислоте.
В легких гемоглобин реагирует с кислородом. При этом образуется оксигемоглобин HHbО 2:
HHb +O 2 ⇄HHbО 2 ,
который переносится артериальной кровью в капиллярные сосуды, откуда кислород попадает в ткани.
Оксигемоглобин — слабая кислота ( = 6,95), но существенно более сильная, чем гемоглобин ( = 8,2). При физиологическом значении рН = 7,25 кислотно-основному равновесию:
HHbО 2 ⇄H + + HbО 2 —
соответствует уравнение Гендерсона-Гассельбаха:
.
Отсюда можно заключить, что С(HbО 2 -)/С(HHbО 2) = 2:1 и доля продиссоциировавших молекул HHbО 2 составляет примерно 65%.
При добавлении кислот нейтрализовать ионы H + в первую очередь будут анионы гемоглобина Hb — :
Hb — + H + ⇄ HHb,
так как они имеют большее сродство к протону, чем ионы HbO 2 — .
При действии оснований в первую очередь будет реагировать более сильная кислота оксигемоглобин HHbO 2:
HHbO 2 + OH — ⇄ HbO 2 — + H 2 O,
однако и кислота гемоглобин также будет участвовать в нейтрализации поступающих в кровь ионов OH — :
HHb + OH — ⇄ Hb — + H 2 O.
Система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболического СО 2), так и в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом.
В организме человека все буферные системы взаимосвязаны. Так, в эритроцитах гемоглобин-оксигемоглобиноваябуферная система тесно связана с гидрокарбонатной буферной системой. Поскольку внутри эритроцитов рН равен 7,25, то соотношение концентраций соли (НСО 3 -) и кислоты Н 2 СО 3 здесь несколько меньше, чем в плазме крови. Действительно, из уравнения Гендерсона-Гассельбахаследует, что в эритроцитах C(НСО 3 -)/С(Н 2 СО 3) = 14:1. Тем не менее, несмотря на то, что буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН.
Тем не менее, несмотря на то, что буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН.
Фосфатная буферная система играет в клетках крови гораздо более важную роль, чем в плазме крови. Прежде всего это связано с тем, что в эритроцитах содержится большое количество неорганичес-ких фосфатов, главным образом, KH 2 PO 4 и K 2 HPO 4 . Кроме того, большую роль в поддержании постоянства рН имеют эфиры фосфорных кислот -главным образом, фосфолипиды , составляющие основу мембран эритроцитов.
Фосфолипиды являются относительно слабыми кислотами. Значения фосфатных групп находятся в пределах от 6,8 до 7,2. Следовательно, при физиологическом значении рН = 7,25 фосфолипиды мембран эритроцитов находятся как в виде неионизированных, так и в виде ионизированных форм, т.е. в виде слабой кислоты и ее соли. При этом соотношение концентраций соли и кислоты приблизительно составляет (1,5-4):1. Таким образом, сама мембрана эритроцитов обладает буферным действием и поддерживает посто-янство рН внутренней среды эритроцитов.
В случаях, когда буферная и выделительная защита организма исчерпывает свои возможности и развивается тяжелая форма ацидоза (алкалоза), прибегают к медикаментозному подавлению этих наруше-ний. Так, при газовой форме ацидоза внутривенно вводят препараты основного характера, представляющие собой соли слабых кислот: 4%-й раствор NaHCO 3 , раствор натриевой соли лимонной кислоты — цитрат натрия (Na 3 Cit) и др., которые нейтрализуют избыточную кислотность, связывая ионы H + в слабые кислоты:
H + + HCO 3 — H 2 CO 3 H 2 O + CO 2
Ликвидацию метаболической формы ацидоза также проводят пу-тем введения солей слабых кислот и других препаратов, обладающих свойством проходить через фосфолипидные мембраны.
При алкалозе вводят растворы слабых кислот, например, 4%-й раствор аскорбиновой кислоты.
Однако перечисленные методы медикаментозного вмешательства не имеют, строго говоря, лечебного эффекта: они позволяют лишь «выиграть время» для более детального установления причин возник-новения отклонений и назначения курса лечения или профилактики.
Буферные растворы (БР) сохраняют устойчивость буферных свойств в определенном интервале значений рН, то есть обладают определенной буферной емкостью. За единицу буферной емкости условно принимают емкость такого буферного раствора, для изменения рН которого на единицу требуется добавить 1 моль сильной кислоты или сильной щелочи на 1 л раствора.
Буферная емкость находится в прямой зависимости от концентрации БР: чем концентрированнее раствор, тем больше его буферная емкость; разведение БР сильно уменьшает буферную емкость и лишь незначительно изменяет рН.
Тканевая жидкость, кровь, моча и другие биологические жидкости являются буферными растворами. Благодаря действию их буферных систем поддерживается относительное постоянство водородного показателя внутренней среды, обеспечивающее полноценность метаболических процессов (см. Гомеостаз ). Наиболее важной буферной системой является бикарбонатная система крови .
Бикарбонатная буферная система
NaHCO 3 = 18
Поступающая в кровь в результате обменных процессов кислота (HA) вступает в реакцию с гидрокарбонатом натрия:
НА + NаHCO 3 NaA + H 2 CO 3 (1)
Это чисто химический
процесс, вслед за которым включаются
физиологические регуляторные механизмы.
1. Двуокись углерода возбуждает дыхательный центр, объем вентиляции увеличивается и СО 2 выводится из организма.
2. Результатом химической реакции (1) является уменьшение щелочного резерва крови, восстановление которого обеспечивается работой почек: образующаяся в результате реакции (1) соль (NаА) поступает в почечные канальцы, клетки которых непрерывно секретируют свободные водородные ионы и обменивают их на натрий:
NaА + H + HA + Na +
Образующиеся в канальцах почек нелетучие кислые продукты (HA) выводятся с мочой, а натрий реабсорбируется из просвета почечных канальцев в кровь, восстанавливая тем самым щелочной резерв (NаHCO 3).
Особенности бикарбонатного буфера
1. Самый быстродействующий.
2. Нейтрализует как органические, так и неорганические кислоты, поступающие в кровь.
3. Взаимодействуя
с физиологическими регуляторами pH,
обеспечивает выведение летучих (легкие)
и нелетучих кислот, а также восстанавливает
щелочной резерв крови (почки).
Фосфатная буферная система
Na 2 HPO 4 = 4
Эта система нейтрализует поступающие в кровь кислоты (НА) благодаря их взаимодействию с гидрофосфатом натрия.
НА + Na 2 HPO 4 NaА + NaH 2 PO 4
Образующиеся вещества в составе фильтрата поступают в почечные канальцы, где гидрофосфат натрия и натриевая соль (NaА) взаимодействуют с водородными ионами, а дигидрофосфат выделяется с мочой, освобождающийся натрий реабсорбируется в кровь и восстанавливает щелочной резерв крови:
Na 2 HPO 4 + H + NaH 2 PO 4 + Na +
NaA + H + HA + Na +
Особенности фосфатного буфера
1. Емкость фосфатной буферной системы мала в связи с небольшим количеством в плазме фосфатов.
2. Основное назначение фосфатная буферная система приобретает в почечных канальцах, участвуя в восстановлении щелочного резерва и выведении кислых продуктов.
Гемоглобиновая буферная система
KHb KHbO 2
HHb (венозная кровь) HHbO 2 (артериальная кровь)
Образующаяся в процессе обмена веществ двуокись углерода поступает в плазму, а затем в эритроцит, где под влиянием фермента карбоангидразы при взаимодействии с водой образуется угольная кислота:
СО 2 + Н 2 О Н 2 СО 3
В тканевых капиллярах гемоглобин отдает свой кислород тканям, а восстановленная слабая соль гемоглобина вступает в реакцию с еще более слабой угольной кислотой:
KНb + H 2 CO 3 KHCO 3 + HHb
Таким образом,
происходит связывание водородных ионов
гемоглобином. Проходя через капилляры
легких, гемоглобин соединяется с
кислородом и восстанавливает свои
высокие кислотные свойства, поэтому
реакция с Н 2 СО 3
протекает в обратном направлении:
Проходя через капилляры
легких, гемоглобин соединяется с
кислородом и восстанавливает свои
высокие кислотные свойства, поэтому
реакция с Н 2 СО 3
протекает в обратном направлении:
ННbO 2 + KHCO 3 KHbO 2 + H 2 CO 3
Двуокись углерода поступает в плазму, возбуждает дыхательный центр и выводится с выдыхаемым воздухом.
Особенности гемоглобинового буфера
1. Большая емкость.
2. Взаимодействие с дыхательной системой обеспечивает выведение углекислого газа из организма.
Белковая буферная система
Белки, главным образом альбумины, являются амфотерными электролитами, кислотные свойства их обусловлены содержанием кислых групп СООН, NH 2 , которые являются донорами протонов. Основные свойства обеспечиваются содержанием основных групп СОО , NH 3 + .
Поступление кислот и щелочей в кровь вызывает следующие реакции:
(NH 3 +) n (NH 3 +) n
Pt + mH + Pt
(COO ) m (COOH) m
(NH 3 +) n (NH 2) n
Pt + nOH — Pt + Н 2 О
(COO ) m (COO ) m
Особенности белкового буфера
1. Емкость
белкового буфера невелика.
Емкость
белкового буфера невелика.
2. Он не имеет прямой связи с физиологическими регуляторами pH крови.
3. В кислой среде белковый буфер связывает водородные ионы, а при изменении условий отдает их, так как его буферные свойства определяются амфотерными свойствами белка.
В эритроцитах действуют все четыре буферные системы, в плазме — три (отсутствует гемоглобиновая система), а в клетках различных тканей основная роль в поддержании рН принадлежит белковой (точнее имидазол-протеиновой) и фосфатной системам.
Буферные системы крови более устойчивы к действию кислот, чем оснований. Основные соли слабых кислот, содержащиеся в крови, образуют так называемый щелочной резерв. Величина щелочного резерва определяется по тому количеству CO 2 , которое может быть связано 100 мл крови при напряжении CO 2 , равному 40 мм рт. ст.
Кроме того, в
поддержании постоянства рН крови
участвует нервная система. Рефлекторно
через активацию хеморецепторов сосудистых
рефлексогенных зон стимулируются центры
нервной системы, включающие в реакцию
почки и легкие. За счет работы почек и
легких из крови удаляются CO 2 ,
избыток солей, кислот, оснований
(щелочей).
За счет работы почек и
легких из крови удаляются CO 2 ,
избыток солей, кислот, оснований
(щелочей).
Физиологические особенности внутренней среды
в детском возрасте
Внутренняя среда новорожденных относительно устойчива. Минеральный состав плазмы, ее осмотическая концентрация и рН мало отличаются от крови взрослого человека.
Устойчивость гомеостаза у детей достигается интеграцией трех факторов: составом плазмы, особенностями метаболизма растущего организма и деятельностью одного из основных органов, регулирующего постоянство состава плазмы почек.
Любые отклонения от хорошо сбалансированного пищевого режима несут в себе опасность нарушения гомеостаза. Например, если ребенок съедает больше пищи, чем это соответствует тканевому усвоению, то концентрация мочевины, в крови резко повышается до 1 г/л и более (в норме 0,4 г/л), так как почка еще не готова выводить повышенное количество мочевины.
Нервная и гуморальная
регуляция гомеостаза новорожденных в
связи с незрелостью ее отдельных звеньев
(рецепторов к биологически активным
веществам и гормонам, нервных центров
головного мозга и т. д.) оказывается менее
совершенной. В связи с этим одной из
особенностей гомеостаза в этот период
являются более широкие индивидуальные
колебания состава крови, ее осмотической
концентрации, рН, солевого состава и
др.
д.) оказывается менее
совершенной. В связи с этим одной из
особенностей гомеостаза в этот период
являются более широкие индивидуальные
колебания состава крови, ее осмотической
концентрации, рН, солевого состава и
др.
Вторая особенность гомеостаза новорожденных заключается в том, что возможности противодействовать сдвигам основных показателей внутренней среды у них, в несколько раз менее эффективны, чем у взрослых. Например, даже обычное кормление вызывает у ребенка снижение осмотической концентрации плазмы, в то время как у взрослых даже прием большого количества жидкой пищи (до 2% от веса тела) не вызывает никаких отклонений от этого показателя. Это происходит потому, что механизмы, которые противодействуют сдвигам основных констант внутренней среды, у новорожденных еще не сформировались, а поэтому в несколько раз менее эффективны, чем у взрослых.
Основные термины:
Гомеостаз
Гематокрит
Буферная емкость
Роль бикарбоната — Справочник химика 21
Эти реакции играют большую роль в природе. Дождевая вода растворяет углекислый газ и, просачиваясь через почву, взаимодействует с известняком, растворяя его в внде бикарбоната. Особенно энергично. эта реакция протекает в толщах известняковых пород. При выходе такой воды на поверхность и испарении ее вновь выпадает карбонат кальция. [c.135]
Дождевая вода растворяет углекислый газ и, просачиваясь через почву, взаимодействует с известняком, растворяя его в внде бикарбоната. Особенно энергично. эта реакция протекает в толщах известняковых пород. При выходе такой воды на поверхность и испарении ее вновь выпадает карбонат кальция. [c.135]Буферные растворы играют важную роль в аналитической химии и вообще в лабораторных работах, особенно в области биохимии, где равновесия и скорости реакций очень сильно зависят от pH. Кровь, молоко и другие жидкости животного происхождения содержат большое количество буфера (ионы бикарбоната и угольная кислота, а также белки). Нормальное значение pH крови человека равно примерно 7,4. Обычные колебания составляют менее 0,1 единицы pH, и повышение или понижение pH на 0,4 приводит к смертельному исходу. Скорости большинства ферментативных реакций существенно зависят от pH. [c.215]
В том случае, когда роль субстрата выполняет 0-бикарбонат, два меченых атома кислорода появляются в оксалоацетате, тогда как третий— в Р .
 Возможный механизм реакции показан на следующей схеме (атомы 0 обозначены звездочками) [c.174]
Возможный механизм реакции показан на следующей схеме (атомы 0 обозначены звездочками) [c.174] Отделение панкреатического и кишечного соков регулируется нейрогормональными факторами, которые подробно излагаются в курсе физиологии. Имеются доказательства роли соляной кислоты в качестве пускового механизма выработки в кишечнике особых гормонов. В частности, соляная кислота, попадая в двенадцатиперстную кишку, стимулирует секрецию секретина (см. главу 8) последний, стимулируя секрецию и отделение щелочного панкреатического сока, способствует оттоку желчи. Показано, что секретин быстро исчезает из кровотока, а новые порции его не вырабатываются, поскольку соляная кислота нейтрализуется щелочным панкреатическим соком. Таким образом, благодаря существованию такого механизма, действующего по типу обратной связи, осуществляется регуляция секреции и отделения поджелудочного сока. Поджелудочный сок, полученный при действии секретина, содержит незначительное количество ферментов, но богат бикарбонатами, создающими слабощелочную среду (pH 7,5—8,5), оптимальную для действия пищеварительных ферментов [c. 423]
423]
Несмотря на то, что электромагнитная активация в обоих случаях приводит к сужению линии ПМР, сужение резонансной линии природной воды сразу после активации (аналогично сужению линии для раствора бикарбоната кальция) говорит о том, что основную роль в механизме активации играет дегидратация ионов. [c.30]
Двуокись углерода, хотя и составляет всего 0,03% объема атмосферного воздуха, играет важную роль в химии воды, так как она легко реагирует с водой, образуя радикалы бикарбоната и карбоната. СО2 может абсорбироваться из воздуха или образовываться в результате бактериального распада органических соединений в воде. Находясь в растворе, она вступает в реакцию, образуя угольную кислоту [c.15]
Хотя до сих пор механизм огнетушащего действия порошков остается еще во многом не ясным, однако большинство исследователей считают, что в случае тушения наиболее эффективными порошками основную роль играет их способность ингибировать пламя.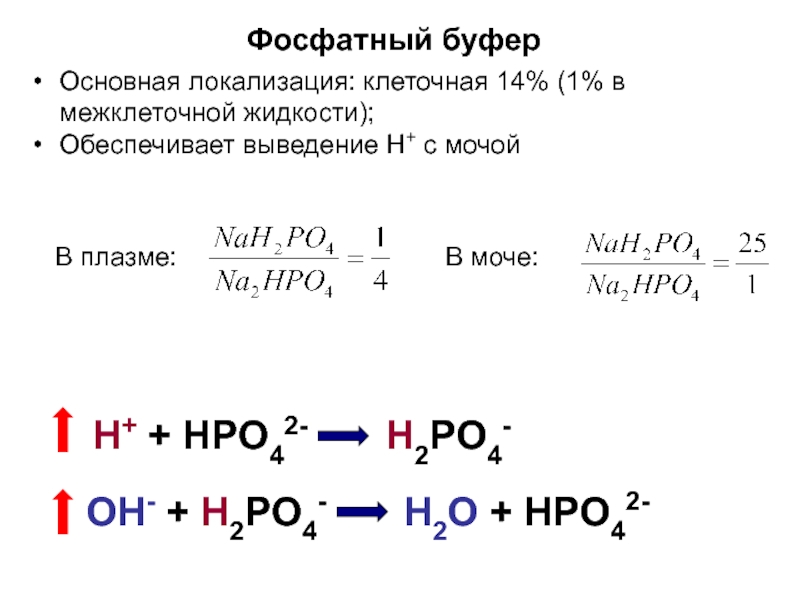 Огнетушащий эффект таких порошков значительно превышает эффект охлаждения или разбавления двуокисью углерода, выделяющийся, например, при разложении порошков на основе бикарбонатов щелочных металлов. Действительно, бензин на площади 1 м можно потушить 1 кг достаточно -мелкого порошка типа ПСБ в течение 1—2 с. Для тушения этого очага распыленной водой или двуокисью углерода требуется несколько килограммов каждого из этих средств. В то же время при полном разложении [c.113]
Огнетушащий эффект таких порошков значительно превышает эффект охлаждения или разбавления двуокисью углерода, выделяющийся, например, при разложении порошков на основе бикарбонатов щелочных металлов. Действительно, бензин на площади 1 м можно потушить 1 кг достаточно -мелкого порошка типа ПСБ в течение 1—2 с. Для тушения этого очага распыленной водой или двуокисью углерода требуется несколько килограммов каждого из этих средств. В то же время при полном разложении [c.113]
Постоянными побочными продуктами электролиза ацетата натрия являются метан и метилацетат. Как показали Гофер и Мест , электролиз в присутствии бикарбоната, сульфата или перхлората приводит к метиловому спирту вместо этана. Поэтому теория простого разряда и димеризации не может полностью объяснить механизм реакции Кольбе. Высказывалось предположение, что электролиз концентрированных водных растворов ацетатов дает перекись ацетила и перуксусную кислоту с последующим химическим окислением раствора около анода.
 Роль возможных окислителей приписывалась атомарному кислороду и перекиси водорода [c.158]
Роль возможных окислителей приписывалась атомарному кислороду и перекиси водорода [c.158]Кроме регуляции кислотно-щелочного равновесия в организме и поддержания постоянного уровня pH, способность кровяной плазмы связывать углекислоту (так называемый щелочной резерв ) играет огромную роль в дыхательной функции крови. В тканях при более высоком парциальном давлении углекислоты кровь связывает СОг в виде бикарбонатов. В легких при более низком парциальном давлении углекислоты и более высоком [c.224]
Фармери обнаружил, что для исследования механизма растрескивания алюминиевых сплавов, содержащих магний или медь, удобное ускорение растрескивания вызывается добавкой к хлористому натрию двууглекислой соды. Однако, поскольку эта добавка оказывает такое влияние не на все сплавы, ею нельзя пользоваться при проведении работ по оценке относительной склонности к растрескиванию разнотипных материалов. Роль бикарбоната в данном случае, вероятно, заключается в разрушении щелочи, образующейся на катоде в противном случае слабая кислотность, образующаяся на анодных участках, была бы нейтрализована этой щелочью. Поскольку накопление кислоты на анодных участках, как полагают, необходимо для развития коррозионного процесса, факторы, препятствующие ее нейтрализации, должны способствовать растрескиванию. Его роль такая же, как и двууглекислого кальция, применявшегося Портером и Хадденом (стр. 117) при получении коррозионных язв на алюминии но в случае глубокой и узкой трещины по сравнению с неглубокой язвой для предотвращения смешения анодного и катодного продуктов образование возвышения из пористого твердого тела над анодным участком не является необходимым. Поэтому ионы кальция не необходимы и цель достигается с помощью бикарбоната натрия. Принятый для испытания раствор был 0,5 н. по отношению к Na l и 0,005 . по отношению к НаНСОз [19]. [c.639]
Поскольку накопление кислоты на анодных участках, как полагают, необходимо для развития коррозионного процесса, факторы, препятствующие ее нейтрализации, должны способствовать растрескиванию. Его роль такая же, как и двууглекислого кальция, применявшегося Портером и Хадденом (стр. 117) при получении коррозионных язв на алюминии но в случае глубокой и узкой трещины по сравнению с неглубокой язвой для предотвращения смешения анодного и катодного продуктов образование возвышения из пористого твердого тела над анодным участком не является необходимым. Поэтому ионы кальция не необходимы и цель достигается с помощью бикарбоната натрия. Принятый для испытания раствор был 0,5 н. по отношению к Na l и 0,005 . по отношению к НаНСОз [19]. [c.639]
Проведение опыта Е. В небольшую толстостенную промывную склянку, в которой газовводная трубка обрезана чуть ниже шлифа, помещают некоторое количество бикарбоната натрия. Газовводную трубку этой склянки соединяют с U-образной манометрической трубкой со ртутью, имеющей длину колена около 70 см. Другую трубку этой склянки соединяют с газовыводной трубкой второй промывной склянки, играющей роль предохрани- [c.111]
Другую трубку этой склянки соединяют с газовыводной трубкой второй промывной склянки, играющей роль предохрани- [c.111]
Буферные смеси имеют большое практическое применение в аналитической химии, в технологии электрохимических производств при электроосаждении металлов, т. е. везде, где почему-либо возникает необходимость сохранять постоянной концентрацию водородных ионов. Особо ценными буферными смесями являются смеси бикарбоната и карбоната натрия, а также NaHaPO и Na2HP04, играющие большую роль в регулировании процессов, протекающих в живых организмах. [c.84]
Учитывая, что постоянство кислотно-щелочного равновесия в организме играет существенную роль в течение всех биохимических процессов, в клинике нри анализе крови значительный интерес представляет определение резервной щелочности крови. Для этого устанавливают в исследуемой плазме крови количество СО2, находящейся в химически связанном виде главным образом в форме бикарбонатов. Полученная величина, вы )аженная в объемных процентах (количество миллилитров СО2 в 00 мл плазмы), называется резервной щелочностью крови. В норме у человека резервная щелочность бывает равна от 50—65 об.% СО2 при ацидозе же наблюдается понижение щелочных резервов. [c.100]
Полученная величина, вы )аженная в объемных процентах (количество миллилитров СО2 в 00 мл плазмы), называется резервной щелочностью крови. В норме у человека резервная щелочность бывает равна от 50—65 об.% СО2 при ацидозе же наблюдается понижение щелочных резервов. [c.100]
В этом растворе слабое основание СНаСЮОО» и слабая кислота N11 находятся в эквимолекулярных количествах. В случае бикарбоната в растворе присутствуют два моля НСО , которые играют роль и слабой кислоты и слабого основания. Действительно, можно записать [c.265]
Восстановление железом ведут при температуре кипения, очень медленно добавляя нитросоединение к взвеси железа» в подкисленной воде, часто содержащей спирт. При этом смесь нужно сильно перемешивать, чтобы железо не оседало на дно. В некоторых случаях большую роль играет концентрация спирта. Последовательность добавления реагентов бывает очень различна. К смеси остальных реагентов добавляют или-нитросоединение, или кислоту, или попеременно железо и кислоту. Добавление небольшого количества хлористого никеля ускоряет начало реакции и ее теуение . По окончании реакции смесь осторожно подщелачивают содой или бикарбонатом натрия и отфильтровывают от железного шлама. Обычно амины в этих условиях. остаются в растворе если амин нерастворим, он переходит в осадок вместе железом, и его необходимо экстрагировать при помощи соответствующих органических растворителей. Летучие амины отгоняют из реакционной смеси с водяным паром без фильтрования. Если амин можно легко выделить из кислого раствора, кислоту применяют в таком количестве, чтобы все железо перешло в раствор В этих случаях, в противоположность мегоду Бешана, лучшие результаты получены при пользовании кузнечным железом. Аналогичным путем можно получить амины Из азосоединений. [c.496]
Добавление небольшого количества хлористого никеля ускоряет начало реакции и ее теуение . По окончании реакции смесь осторожно подщелачивают содой или бикарбонатом натрия и отфильтровывают от железного шлама. Обычно амины в этих условиях. остаются в растворе если амин нерастворим, он переходит в осадок вместе железом, и его необходимо экстрагировать при помощи соответствующих органических растворителей. Летучие амины отгоняют из реакционной смеси с водяным паром без фильтрования. Если амин можно легко выделить из кислого раствора, кислоту применяют в таком количестве, чтобы все железо перешло в раствор В этих случаях, в противоположность мегоду Бешана, лучшие результаты получены при пользовании кузнечным железом. Аналогичным путем можно получить амины Из азосоединений. [c.496]
Секретин, как и глюкагон, вазоактивный интестинальный пептид, гастрин, гастроингибирующий пептид и ряд других, относится к гормонам желудочно-кишечного тракта.
 Считается, что основная роль секретина состоит в регуляции секреции сока поджелудочной железы [219], куда он попадает с током крови и где также оказывает стимулирующий эффект на секрецию инсулина [220, 221]. Позднее был выявлен ряд других функций секретина в пищеварительной системе. Оказалось, что он стимулирует выделение пепсина желудком и бикарбонатов и воды поджелудочной железой и печенью, влияет на сокращение пилорического канала, торможение моторики желудка, приводит к ослаблению электрической активности тонких кишок, усилению кровотока в поджелудочной железе, интенсификации липолиза и гликолиза в жировой ткани, торможению реабсорбции бикарбонатов в почках и т.д. [222]. [c.372]
Считается, что основная роль секретина состоит в регуляции секреции сока поджелудочной железы [219], куда он попадает с током крови и где также оказывает стимулирующий эффект на секрецию инсулина [220, 221]. Позднее был выявлен ряд других функций секретина в пищеварительной системе. Оказалось, что он стимулирует выделение пепсина желудком и бикарбонатов и воды поджелудочной железой и печенью, влияет на сокращение пилорического канала, торможение моторики желудка, приводит к ослаблению электрической активности тонких кишок, усилению кровотока в поджелудочной железе, интенсификации липолиза и гликолиза в жировой ткани, торможению реабсорбции бикарбонатов в почках и т.д. [222]. [c.372] Процесс кристаллизации бикарбоната натрия играет большую роль при карбонизации аммонизир ванного рассола. Он определяет температурный режим карбонизации и производительность карбонизационной колонны. К качеству кристаллов предъявляются очень высокие требования они должны быть одйородными по размеру и форме. От соблюдения этих условий зависит работа отделений фильтрации и содовых печей, а также качество готового продукта — соды. Мелкие, илистые или сросшиеся кристаллы трудно фильтруются и промываются, они забивают поры фильтрующей ткани и удерживают много маточного раствора (влаги). Это ведет к перерасходу тепла на кальцинацию и повьпиению содержания СГ в готовой продукции. [c.123]
От соблюдения этих условий зависит работа отделений фильтрации и содовых печей, а также качество готового продукта — соды. Мелкие, илистые или сросшиеся кристаллы трудно фильтруются и промываются, они забивают поры фильтрующей ткани и удерживают много маточного раствора (влаги). Это ведет к перерасходу тепла на кальцинацию и повьпиению содержания СГ в готовой продукции. [c.123]
При безретурном питании содовых печей в технологической схеме отделения значительно упрощается транспортировка соды, так как отпадает необходимость в ретуре. По этой схеме сырой бикарбонат из приемника 3 идет в аппарат-забрасыватель, который смонтирован на месте смесителя. При помощи метательной лопатки сырой бикарбонат забрасьшают в глубину печи на «содовую подушку , которая играет роль ретурной соды. [c.166]
Биотин присоединяется к ферменту амидной связью, образованной карбоксильной группой биотина и аминогруппой входящего в состав фермента остатка лизина. Реакция карбоксилирования, катализируемая биотином, протекает в соответствий со схемой (8.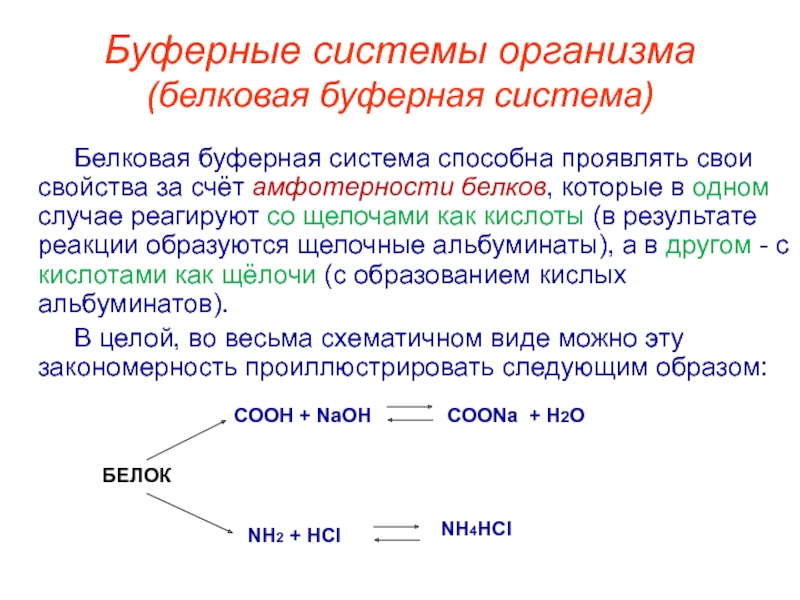 19), где в роли RH обычно выступает ацильная группа ацилированного кофермента А. Биотин-зависимое ферментативное карбоксилирование может обладать определенными-преимуществами по сравнению с прямой реакцией ацилированного кофермента А с диоксидом углерода и бикарбонатом, активированными АТР. [c.209]
19), где в роли RH обычно выступает ацильная группа ацилированного кофермента А. Биотин-зависимое ферментативное карбоксилирование может обладать определенными-преимуществами по сравнению с прямой реакцией ацилированного кофермента А с диоксидом углерода и бикарбонатом, активированными АТР. [c.209]
Гемоглобин (ННЬ), попадая в капилляры легких, превращается в оксигемоглобин (ННЬО ), что приводит к некоторому подкислению крови, вытеснению части Н,СОз из бикарбонатов и понижению щелочного резерва крови . Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система. [c.589]
Количество карбаминовой формы невелико в артериальной крови оно составляет 3 об. %, в венозной —3,8 об. % . В виде карбаминовой формы из ткани к легким переносится от 3 до 10% всего углекислого газа, поступающего из тканей в кровь.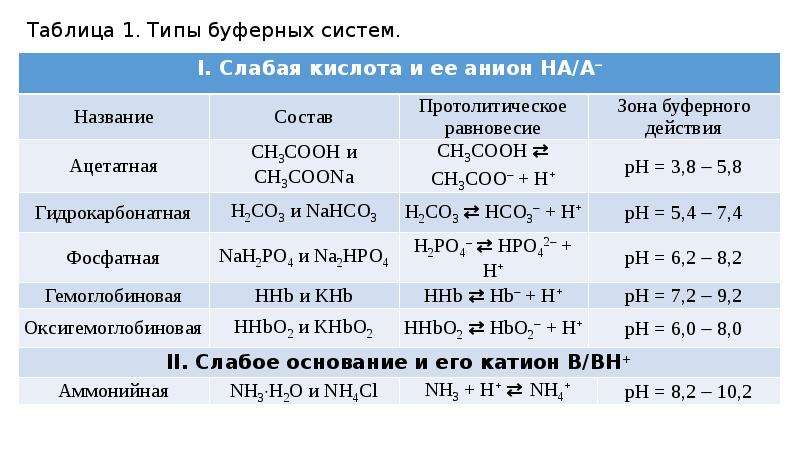 Основная масса СО, транспортируется с кровью к легким в форме бикарбоната, при этом важнейшую роль играет гемоглобин эритроцитов. [c.597]
Основная масса СО, транспортируется с кровью к легким в форме бикарбоната, при этом важнейшую роль играет гемоглобин эритроцитов. [c.597]
Ферментативный гидролиз можно проводить различными способами, один из которых состоит в следующем в пластмассовой пластинке толщиной 10—15 мм, длиной 10 см и шириной 5 см высверливается 2 ряда углублений. Объем всех, кроме одного, углублений должен быть примерно 50 мкл, а объем крайнего верхнего — в 3 раза больше. Это углубление выполняет роль реакционного сосуда обозначим его через Р, а все остальные цифрами 1, 2, 3…п. Исследуемый пептид (около 0,05 мкмоль) в 0,1 М бикарбонате аммония вносят пипеткой в углубление Р. Во все остальные углубления наливают по 10 мкл 1 н. НС1. После этого в углубление Р добавляют соответствующий фермент (например, карбоксипептидазу А, кар-боксипептидазу В или их смесь, а в случае N-концевого анализа — амино пептидазу). Количество фермента составляет часть количества пептида. Сразу после добавления фермента 10 мкл смеси из реакционного сосуда переносят в углубление 1, где уже находится НС1. [c.257]
[c.257]
При формовании нитей скорость образования ксаитогената цинка лимитируется диффузией. Это было установлено при исследовании модельных волокон [62, 63]. Лимитирующая роль диффузионных процессов особенно сильно проявляется в реальных условиях формования нитей. Как было показано в разделе 7.2.1, коэффициент диффузии 2050 в этом случае на целый порядок ниже, чем коэффициент диффузии серной кислоты. Поэтому при формовании вискозных волокон в условиях, близких к производственным, обычно наблюдают не очень высокие значения даже при большой концентрации 2п504 в осадительной ванне. Так, например, Кляре показал [64, 65], что в точке нейтрализации на расстоянии 20 см от фильеры достигается у7п=И,7 при общем значении 7 = 39,2. В присутствии модификаторов достигается еще более низкое значение степени замещения угп = 4,7. Правда, как показали более поздние исследования Вандевена [66] и Фингера [67], эти значения несколько занижены из-за неточности методики, обусловленной обратным вытеснением 2п-ионов ионами натрия при отмывке пробы буферным раствором, содержащим ацетат или бикарбонат натрия. [c.194]
[c.194]
Активизирующая роль введенного углекислого натрия очень хорошо прослеживается при сопоставлении ряда опытов, проведенных с раствором, содержащим 25 г/л N320 . При более высоком содержании в растворе бикарбоната натрия влияние введенного углекислого натрия снижается. Представленные данные убеждают в том, что при взаимодействии указанных выше растворов с гидроокисью алюминия существенное значение имеет концентрация ионов. [c.131]
Для систем aSOi—HjO и Са(НСОз)2—НаО [175—176], играющих большую роль при накипеобразовании, магнитная обработка обусловливает ускорение процесса термического разложения бикарбонатов и увеличение скорости кристаллизации нерастворимых солей, причем кристаллы, выпадающие из омагниченных растворов, имеют значительно меньшие размеры, чем выделяющиеся из обычных растворов. [c.442]
Как уже говорилось во введении к этой книге, основы химической экологии были заложены еще Лавуазье. Круговорот веществ на нашей планете, их переход из минерального царства в царство живой природы и обратно осуществляется благодаря процессам сгорания и гниения. Эти процессы — основные факторы возобновления неорганической материи. Представление о кругообороте элементов — углерода, азота, серы, фосфора и других — целиком возникло из наблюдений, показывающих непрерывность их поступления в биосферу и выхода из нее и непрерывность обмена элементами между различными частями биосферы. Во всех этих процессах первостепенную роль играет Мировой океан. Центральным моментом в круговороте углерода является автоматическое поддержание концентрации углекислого газа в атмосфере на определенном уровне. Это постоянство обеспечивается буферной системой карбонат кальция — бикарбонат кальция — углекислый газ. Углекислый газ извлекается из атмосферы в процессе фотосинтеза и возврашд-ется в нее в процессе дыхания. Но и здесь решающая роль принадлежит Мировому океану фотосинтез с участием водорослей и водных растений примерно в 8 раз интенсив- [c.147]
Эти процессы — основные факторы возобновления неорганической материи. Представление о кругообороте элементов — углерода, азота, серы, фосфора и других — целиком возникло из наблюдений, показывающих непрерывность их поступления в биосферу и выхода из нее и непрерывность обмена элементами между различными частями биосферы. Во всех этих процессах первостепенную роль играет Мировой океан. Центральным моментом в круговороте углерода является автоматическое поддержание концентрации углекислого газа в атмосфере на определенном уровне. Это постоянство обеспечивается буферной системой карбонат кальция — бикарбонат кальция — углекислый газ. Углекислый газ извлекается из атмосферы в процессе фотосинтеза и возврашд-ется в нее в процессе дыхания. Но и здесь решающая роль принадлежит Мировому океану фотосинтез с участием водорослей и водных растений примерно в 8 раз интенсив- [c.147]
В пищеварительном канале минеральные вещества хорошо всасываются в кровь и поступают в различные ткани и жидкости организма в некоторых органах и тканях они депонируются. Железо, например, больше всего депонируется в печени и селезенке, кальций, фосфор и магний — в костной ткани, хлористый натрий — в коже, фтор — в зубной тканн. йод — в щитовидной железе, хлор в виде соляной кислоты в желудке и т. д. Выделяются минеральные вещества через почки и кожу небольшая часть их выделяется через кншечннк. Мясная пища, богатая органическими соединениями фосфора и серы, способствует накоплению кислых эквивалентов, а растительная пища, содержащая много калия и магния. — щелочных. Особо важную роль играют минеральные вещества в поддержании кислотно-щелочного равновесия. В крови и тканях имеются карбонатные и фосфатные буферные системы, которые препятствуют сдвигам pH среды. Кислоты при поступлении в кровь реагируют с бикарбонатами и двузамещенными фосфатами с образованием угольной кислоты и однозамещенного фосфата. [c.215]
Железо, например, больше всего депонируется в печени и селезенке, кальций, фосфор и магний — в костной ткани, хлористый натрий — в коже, фтор — в зубной тканн. йод — в щитовидной железе, хлор в виде соляной кислоты в желудке и т. д. Выделяются минеральные вещества через почки и кожу небольшая часть их выделяется через кншечннк. Мясная пища, богатая органическими соединениями фосфора и серы, способствует накоплению кислых эквивалентов, а растительная пища, содержащая много калия и магния. — щелочных. Особо важную роль играют минеральные вещества в поддержании кислотно-щелочного равновесия. В крови и тканях имеются карбонатные и фосфатные буферные системы, которые препятствуют сдвигам pH среды. Кислоты при поступлении в кровь реагируют с бикарбонатами и двузамещенными фосфатами с образованием угольной кислоты и однозамещенного фосфата. [c.215]
Карбгемоглобин — очень нестойкое соединение. В легочных капиллярах он легко диссоциирует с отщеплением углекислоты. в переносе угольной кислоты большую роль играют и другие белковые вещества крови. При взаимодействии угольной кислоты с щелочными солями белков крови (про-теинатами) образуются бикарбонаты и свободные белки [c.234]
При взаимодействии угольной кислоты с щелочными солями белков крови (про-теинатами) образуются бикарбонаты и свободные белки [c.234]
Главным механизмом, удерживающим pH крови на практически постоянном уровне, является карбонатная буферная система другие буферные системы крови — фосфатная, оксигемоглобиновая, гемоглобиновая и белковая — играют меньшую роль. При образовании кислот в организме и попадании их в кровь кислоты вытесняют из бикарбоната углекислоту, которая, как известно, является очень слабой кислотой и сдвигает pH крови лишь незначительно. Поскольку диссоциация угольной кислоты подавляется присутствующим в крови бикарбонатом, то сдвиг pH крови в кислую сторону еще менее выражен. [c.224]
Физиология крови. Кроветворная система : Farmf
Физиология крови. Кроветворная система
- Что характерно для внутренней среды организма?
+ взаимосвязь всех параметров
– отсутствие влияний со стороны внешней среды
+ строгий контроль со стороны нейро-эндокринной системы
+ функциональная взаимосвязь компонентов
- Что характерно для внутренней среды организма?
– постоянная изменчивость
+ относительное постоянство
+ постоянная саморегуляция
+ независимость от внешних условий
– прямая зависимость от внешних условий
- Что характерно для интерстициальной жидкости?
+ является непосредственной питательной средой клеток
+ играет важную роль в межклеточных взаимодействиях
+ состав и свойства специфичны, для отдельных тканей
– образуется в результате ультрафильтрации лимфы из лимфатических капилляров
+ состав зависит от функциональной активности клеток
- Что характерно для интерстициальной жидкости?
+ заполняет межклеточное пространство
– находится в клетках
– циркулирует в кровеносных сосудах
+ является непосредственной питательной средой клеток
+ состав и свойства ее специфичны для отдельных органов
- Что характерно для лимфы в организме человека?
+ форменные элементы представлены преимущественно лимфоцитами
– содержание белка в 10 раз выше, чем в крови
+ содержит фибриноген
– содержит эритроциты
- Что характерно для лимфы в организме человека?
+ образуется в результате резорбции межклеточной жидкости в лимфатические капилляры
– образуется в результате выхода из кровеносного русла
+ содержится в лимфатических узлах
+ содержится в лимфатических сосудах
+ поддерживает постоянный состав и объем межклеточной жидкости
- Каковы функции лимфы?
+ поддержание постоянства состава и объёма тканевой жидкости
– терморегуляторная функция
+ защитная функция
+ возврат белка из тканевой жидкости в кровь
- Какие признаки характеризуют лимфу?
+ содержатся в лимфатических сосудах
+ содержится в лимфатических узлах
+ поддерживает постоянство состава межклеточной жидкости
+ поддерживает постоянство объема межклеточной жидкости
+ обеспечивает иммунные реакции
- Какой величине равен объём интерстициальной жидкости (% от массы тапа) в организме человека?
– 50,4
– 40,2
– 30,6
+ 26,5
– 15,4
- Чему равно количество лимфы в организме человека в мл на кг массы тепа?
– 10
– 20
– 30
– 40
+ 50
– 70
- Какие жидкости входят в состав внутренней среды организма?
– внутриклеточная жидкость
+ межклеточная жидкость
– желудочный сок
+ кровь
+ лимфа
- Назовите функциональные компоненты системы крови
+ периферическая кровь
+ органы кроветворения
– депо крови
+ органы кроверазрушения
- Каким величинам соответствует удельный вес крови взрослого человека в нормальных условиях?
– 1,010- 1,020
– 1,020- 1,030
+ 1,050- 1,060
– 1,080- 1,090
- Чему равна масса крови (в литрах на кг массы тела) в организме взрослого человека?
– 0,025
+ 0,065
– 0,085
– 0,090
– 0,095
- Чему равен гематокритный показатель у мужчин?
– 20 – 30%
– 36 – 42%
+ 40- 48%
– 50- 60
- Чему равен гематокритный показатель у женщин?
– 20 – 30%
+ 36 – 42%
– 40 – 48 %
– 50 – 60%
17. Чему равен гематокритный показатель в среднем?
Чему равен гематокритный показатель в среднем?
– 25%
– 30%
+ 45%
– 75%
– 96%
- Чему равна скорость оседания эритроцитов у мужчин?
– до 1 мм/час
– до 5 мм/час
+ до 10 мм/час
– до 15 мм/час
- Чему равна скорость оседания эритроцитов у женщин?
– до 1 мм/час
– до 10 мм/час
+ до 15 мм/час
- Чему равно осмотическое давление крови?
– 1,5- 3,0 атм
+ 7,6- 8,1 атм
– 9,0- 10,0 атм.
- Какой величине соответствует сахар крови?
– 1,22 – 1,55 ммоль/л
– 1,8 – 2,89 ммоль/л
+ 3,33 – 5,55 ммоль/л
– 6,66 – 8,88 ммоль/л
- Какой величине соответствует онкотическое давление крови?
– 5 – 10ммрт.ст.
– 10 – 20 мм рт. ст,
+ 25 – 30ммрт.ст.
- Чему равна вязкость крови в организме взрослого?
– 1,0 – 2,0
– 3 – 4
+ 3,8 – 4,2
- Какие известны виды гемолиза?
+ биологический
+ химический
+ осмотический
+ физический
- В каких случаях наблюдается биологический гемолиз?
+ при неправильном переливании крови
+ при укусах ядовитых змей
– изменение температуры
– механическое
- В каких растворах будет наблюдаться осмотический гемолиз?
– изотонический раствор хлорида натрия
– гипертонический раствор хлорида натрия
+ гипотонический раствор хлорида натрия
+ дистиллированная вода
– раствор соляной кислоты
- Какие изменения произойдут в клетке в гипотоническом растворе?
– сморщивание клетки
+ набухание клетки
+ гипергидратация клетки
– дегидратация клетки
- Какие изменения произойдут в клетке в гипертоническом растворе?
+ сморщивание клетки
– набухание клетки
– гиперпидратация клетки
+ дегидратация клетки
- Какова концентрация хлорида натрия в физиологическом растворе?
– 0,6%
– 0,7%
– 0,8%
+ 0,9%
– 1%
- При каких значениях осмотического давления плазмы крови возможна дегидратация (обезвоживание) эритроцитов?
– 7,3 атм
– 7,6 атм
– 7,0 атм
+ 8,0 атм
+ 9,0 атм
- При каких значениях осмотического давления плазмы крови возможно увеличение размера эритроцита?
– 7,3 атм
– 7,4 атм
+ 7,0 атм
– 7,5 аш
+ 6,9 атм
- Какие функции выполняют белки плазмы крови?
+ участие в реакциях свёртывания крови
+ участие в поддержании кислотно- щелочного равновесия
+ регуляция обмена жидкости между кровью и интерстициальным пространством
+ участие в иммунных реакциях
+ транспорт железа
- Какие функции выполняют белки плазмы крови?
+ транспортная
+ создают онкотическое давление
+ обеспечивают свертывание крови
+ поддерживают жидкое состояние крови
+ обеспечивают иммунные реакции
- Какие функции выполняют белки плазмы крови?
– проводят возбуждение в синапсах
+ обеспечивают защиту организма
+ участвуют в свертывании крови
+ обеспечивают жидкое состояние крови
+ обеспечивают иммунные реакции
- Какой параметр плазмы крови имеет наибольшее значение для обмена жидкости между кровью и интерстициальным пространством?
– содержание натрия
– содержание калия
+ содержание альбуминов
– содержание альфа-глобулинов
– содержание гамма-глобулинов
- Какой величине равно общее содержание белков плазмы крови в граммах на литр?
– 21 – 34
– 45 – 52
+ 65 – 85
- При каких значениях онкотического давления (в мм рт ст) плазмы крови будет наблюдаться обезвоживание тканей?
– 15
– 25
+ 50
+ 60
+ 70
- При каких значениях онкотического давления (в мм рт ст) плазмы крови будет наблюдаться отек тканей?
+ 10
+ 15
+ 20
– 60
- Какие системы организма обеспечивают поддержание относительного постоянства pH крови?
– скелетные мышцы
+ комплекс буферных систем
+ дыхательная система
+ выделительная система
– кислотообразующая функция желудка
- Какие функции выполняет кровь в организме?
+ дыхательная
+ питательная
+ экскреторная
+ регуляторная
+ транспортная
- Какая основная функция крови в организме?
– дыхательная
– питательная
– экскреторная
– регуляторная
+ транспортная
- Как называется постоянство внутренней среды организма?
+ гомеостаз
– гемостаз
– агрегация
– седиментация
– гомеокинез
- Как называется комплекс механизмов, направленных на поддержание постоянства внутренней среды организма?
+ гомеокинез
– седиментация
– гемостаз
– гомеостаз .
- Какие признаки характерны для метаболического алкалоза?
+ повышение pH
– снижение pH
– уменьшение напряжения углекислого газа в крови
+ увеличение напряжения углекислого газа в крови
+ гиперкапния
- Какие признаки характерны для респираторного алкалоза?
+ повышение pH
– снижение pH
– уменьшение напряжения углекислого газа в крови
– увеличение напряжения углекислого газа в крови
+ гипокапния
- Какие признаки характерны для респираторного ацидоза?
– повышение pH
+ снижение pH
уменьшение напряжения углекислого газа в крови
+ увеличение напряжения углекислого газа в крови
+ гиперкапния
- Какие признаки характерны для метаболического ацидоза?
– повышение рН
+ снижение pH
+ уменьшение напряжения углекислого газа в крови
– увеличение напряжения углекислого газа в крови
+ гипокапния
- Какие виды ацидоза известны?
+ респираторный (газовый)
+ метаболический (негазовый)
– гемотобиновый
– ферментативный.
– седиментационный
- Какие виды алкалоза известны?
+ респираторный (газовый)
+ метаболический (негазовый)
– гемотобиновый
– ферментативный
– седиментационный
- Какие буферные системы присутствуют в крови?
+ бикарбонатная
- Какие буферные системы присутствуют в крови?
+ фосфатная
+ белковая
– аммонийная
+ гемоглобиновая
- Какая буферная система первой реагирует на изменение pH крови?
– белковая
+ бикарбонатная
– гемоглобиновая
– фосфатная
- Какие компоненты входят в состав бикарбонатной буферной системы?
+ угольная кислота
– карбонат натрия
+ гидрокарбонат натрия
– карбонат магния
– гидрокарбонат магния
- Какие явления лежат в основе работы гемоглобиновой буферной системы?
+ амфотерность гемоглобина как белка
+ оксигемоглобин – более сильная кислота, чем дезоксигемоглобин
– дезоксигемоглобин – более сильная кислота, чем оксигемоглобин
+ работа системы сопряжена с работой бикарбонатного буфера
- Что характерно для бикарбонатной буферной системы?
– содержание угольной кислоты превышает содержание гидрокарбоната натрия в 20 раз
+ ра6ота системы сопряжена с газотранспортной функцией крови
+ работа системы сопряжена с работой гемоглобинового буфера
– буферная ёмкость составляет 75% общей буферной ёмкости крови
- Какая буферная система крови обладает наибольшей буферной ёмкостью?
– бикарбонатная
– фосфатная
+ гемоглобиновая
– система белков плазмы
- Какая буферная система первой реагирует на закисление плазмы крови?
+ бикарбонатная
– гемоглобиновая
– фосфатная
– аммонийная .
- Изменение содержания какого компонента плазмы крови в наибольшей степени отразится на эффективности поддержания кислотно щелочного равновесия?
+ гидрокарбоната натрия
– дигидрофосфата натрия
– альбуминов
– гемоглобина
– кислых гликозаминогликанов
- Какие значения pH крови соответствуют понятию ацидоз?
– 7,50
– 7,45
– 7,40
+ 7,30
+ 7,25
- Какие значения pH крови соответствуют понятию алкалоз?
+ 7,55
+ 7,50
– 7,45
– 7,40
– 7,35
59. Какие изменения кислотно-основного баланса будут сопутствовать гипервентиляции лёгких?
+ уменьшение напряжения углекислого газа в крови
– увеличение напряжения углекислого газа в крови
+ увеличение pH крови
– снижение pH крови
- Какие изменения кислотно-основного баланса будут сопутствовать гиповентиляции лёгких?
– уменьшение напряжения углекислого газа в крови
+ увеличение напряжения углекислого газа в крови
– увеличение pH крови
+ уменьшение pH крови
- Какова наиболее вероятная причина респираторного ацидоза?
– нарушение оксигенации крови в лёгких
+ нарушение диффузии углекислого газа через альвеолярно-капиллярную мембрану
– нарушение диссоциации карбогемоглобина в лёгочных капиллярах
- Какое значение pH крови будет соответствовать полностью компенсированному ацидозу?
+ 7,35
– 7,25
– 7,48
- Какое значение pH крови будет соответствовать полностью компенсированному алкалозу?
+ 7,44
– 7,25
– 7,5
- Какова причина респираторного алкалоза?
– нарушение проходимости дыхательных путей
+ гипервентиляция лёгк
– пребывание в среде с повышенным содержанием углекислоты
- Что является основным критерием компенсации ацидоза?
+ значение pH в пределах нормы
– увеличение содержания щелочных компонентов плазмы
– уменьшение напряжение углекислоты в крови
– нормальные величины напряжение углекислоты крови BB. SB
SB
- Какие виды ацидоза существуют?
+ компенсированный
– онкотический
+ декомпенсированный
– неметаболический
– гиперкапнический
- Какие виды алкалоза существуют?
+ компенсированный
– онкотический
+ декомпенисированный
– неметаболический
– оксигенационный
- Какой Диапазон изменения pH характерен для ацидоза?
+ 6,8 – 7,34
– 7,35 – 7,45
– 7,50 – 8,0
– 8,55 – 9,0
- Какой диапазон изменения pH характерен для алкалоза?
– 6,8 – 7,34
– 7,35 – 7,45
+ 7,46 – 7,8
– 8,55 – 9,0
- Какой диапазон соответствует нормальному содержанию эритроцитов в крови у женщин?
– 1,0 – 2,0*1012/л
– 2,0 – 3,0*1012/л
– 5,9 – 6,7*1012/л
+ 3,9 – 4,7 *1012/л
- Какой диапазон соответствует нормальному содержанию эритроцитов в крови у мужчин?
– 1,0 – 2,0*1012/л
– 2,0 – 3,0*1012/л
– 5,9 – 6,7*1012/л
+ 4,0 – 5,0 *1012/л
- Какие функции выполняют эритроциты?
– синтез биологически активных веществ
+ транспорт газов
+ участие в поддержании кислотно-основного равновесия
– участие в защите организма от инфекции
- По данным лабораторного исследования женщины М.
 содержание эритроцитов в крови составляет 5,8*1012/л. Оцените эти данные.
содержание эритроцитов в крови составляет 5,8*1012/л. Оцените эти данные.
- По данным лабораторного исследования женщины М.
– норма
+ эритроцитоз
– эритропения
– пойкилоцитоз
– макроцитоз
- По данным лабораторного исследования содержание эритроцитовв крови мужчины П. составляет 5,0*1012/л. Оцените эти данные.
+ норма
– эритроцитоз
– эритропения
– лойкилоцитоз
– макроцитоз
- Какие данные количества эритроцитов в крови у женщин соответствуют понятию “эритроцитоз”?
– 2*1012/л
– 4,5*1012/л
+ 5,9*1012 /л
+ 6,5*1012/л
- Какие данные количества эритроцитов крови у женщин соответствуют понятию “эритропения”?
+ 2*1012/л
+ 3,2*1012/л
– 4,5*1012/л
– 5,9*1012/л
– 6,5*1012/л
- Какое явление характеризует сдвиг кривой Прайс-Джонса для эритроцитов влево?
– мафоцитоэ
+ микроцитоз
– нормоцитоз
– эритроцитоз
– эритропения
- Какое явление характеризует сдвиг кривой Прайс-Джонса для эритроцитов вправо?
+ макроцитоз
– микроцитоз
– пойкилоцитоз
– эритроцитоз
– эритропения
- Что характеризует кривая Прайс-Джонса для эритроцитов?
– насыщение гемоглобина кислородом в зависимости от напряжения кислорода в крови
+ распределение эритроцитов по размерам
– распределение эритроцитов по содержанию гемоглобина
– распределение эритроцитов по осмотической устойчивости
- Что в наибольшей степени отражает осмотическая устойчивость эритроцитов?
– степень зрелости циркулирующих эритроцитов
– состояния эритропозза
+ свойства мембраны эритроцитов
- Что является непосредственной причиной увеличения осмотической устойчивости эритроцитов?
+ изменение свойств мембран эритроцитов
– усиление эритропозза
– ослабление эритропозза
– увеличение количества молодых эритроцитов
– увеличение количества зрелых эритроцитов
- Что лежит в основе снижения осмотической устойчивости эритроцитов?
+ изменение свойств мембраны эритроцитов
– изменение свойств гемоглобина
– изменение свойств карбоангидразы
- Каковы причины повышения осмотической устойчивости эритроцитов?
+ активация эритропозза
– уменьшение активности работы селезёнки
+ увеличение содержания в крови молодых эритроцитов
– увеличение продолжительности жизни эритроцитов
- Каковы причины снижения осмотической устойчивости эритроцитов?
+ уменьшение эритропоэза
– уменьшение активности работы селезёнки
+ увеличение содержания в крови старых эритроцитов
– увеличение продолжительности жизни эритроцитов
- Каким термином обозначают присутствие в крови эритроцитов различной формы?
– анизоцитоз
+ пойкилоцитоз
– олигоцитемия
– полицитемия
- Какова максимальная продолжительность жизни эритроцита?
– 10 дней
– 50 дней
+ 120 дней
– 1 год
- Что характерно для внутриклеточного гемолиза?
+ является основным путём разрушения эритроцитов
+ эритроциты поглощаются макрофагами печени и селезёнки
– гемоглобин связывается с белком гаптоглобином
– свободный гемоглобин выделяется с мочой
- Какой диапазон соответствует содержанию гемоглобина в крови у МУЖЧИН?
– 100 – 110 г/л
– 110 – 120 г/л
+ 130 – 160 г/Л
– 160 – 180 г/л
– 180 – 200 г/л
- Какой диапазон соответствует содержанию гемоглобина в крови у женщин?
– 100 – 110г/л
+ 120 – 140 г/л
– 140 – 180 г/п
– 180 – 200 г/л
- Чему равен цветной показатель взрослого человека?
+ 0,85 – 1,15
– 1,8 – 2,0
– 2,5 – 3,5
– 6,0 – 7,5
- Что характерно для фетального гемоглобина?
– содержит трёхвалентное железо
+ высокое сродство к кислороду
– не способен переносить углекислый газ
- Какие величины содержания тромбоцитов в крови соответствуют понятию “тромбоцитоз”?
– 100*109/л
– 150*109/л
– 180*109/л
– 300*109/л
+ 360*109/л
+ 380*109/л
- Какие величины недержания тромбоцитов в крови соответствуют понятию “тромбоцитопения”?
+ 100*109/л
+ 150*109/п
– 180*109/л
– 300*109/л
– 360*109/л
– 380*109/л
- Данные лабораторного исследования крови пациента А.
 : эритроциты- 4,5*1012/л; лейкоциты- 8*109/л; нейтрофилы сегментоядерные – 62%, нейтрофилы палочкоядерные – 3%, базофилы – 1%, эозинофилы – 2%, лимфоциты – 24%, моноциты – 8%. Оцените эти данные.
: эритроциты- 4,5*1012/л; лейкоциты- 8*109/л; нейтрофилы сегментоядерные – 62%, нейтрофилы палочкоядерные – 3%, базофилы – 1%, эозинофилы – 2%, лимфоциты – 24%, моноциты – 8%. Оцените эти данные.
- Данные лабораторного исследования крови пациента А.
– эритроцитоз
– эритропения
– нейтрофильный лейкоцитоз
– эозинофильный лейкоцитоз
– лейкопения
– лимфоцитоз
+ нормальная картина крови
- Какая особенность эритроцита в наибольшей мере обуславливает его участие в поддержании кислотно- основного баланса?
– наличие цитоскелета
+ наличие гемоглобина
– наличие поверхностных гликопротеинов
– двояковогнутая форма
– отсутствие митохондрий
– отсутствие возможности вырабатывать энергию аэробным путём
- Каковы функциональные свойства нейтрофилов?
+ миграция
+ фагоцитоз
+ секреция биологически активных веществ
– регуляция онкотичесто давления
- Кашке величины характеризуют содержание лейкоцитов у мужчин?
+ 3*109/л
+ 4*109/л
+ 5*109/л
– 9*109/л
– 11*109/л
- Какие величины характеризуют содержание лейкоцитов у женщин?
– 3*109/л.
+ 4*109/л
+ 5*109/л
– 9*109/п
– 11*109/л
- Какие величины концентрации лейкоцитов в крови соответствуют понятию “лейкоцитоз”?
– 3*109/л
– 4*109/л
– 9*109/л
+ 11*109/л
+ 13*109/л
- Какие величины содержания лейкоцитов в крови соответствуют понятию “лейкопения”?
+ 2*109/л
+ 3*109/л
– 4*109/л
– 5*109/л
– 6*109/л
– 7*109/л
- Какие лейкоциты относятся к гранупоцитам?
+ нейтрофилы
+ зозинофилы
– лимфоциты
– моноциты
+ базофилы
- Какие лейкоциты относятся к агранулоцитам?
– нейтрофилы
– зозинофилы
+ лимфоциты
+ моноциты
– базофилы
- Что характерно для базофилов?
+ синтез гистамина
+ синтез гепарина
– резкое снижение их количества при воспалении
– небольшое увеличение их количества при хроническом воспалении
– уменьшение при аллергических реакциях
- Что характерно для нейтрофилов?
– транспорт кислорода
- Что характерно для нейтрофилов?
+ защита организма от микробов
+ способны к активному передвижению в тканях
+ способны к фагоцитозу
+ продуцируют интерферон
- Что характерно для базофилов?
– их больше всего среди лейкоцитов
- Что характерно для базофилов?
+ их меньше всего среди лейкоцитов
+ продуцируют гистамин
+ продуцируют гепарин
– разрушают (инактивируют) гепарин
- Что характерно для моноцитов?
+ активный фагоцитоз
+ участие в процессах воспаления
+ участие в процессах регенерации
– транспорт кислорода из крови в ткани
- Какие функции выполняют зозинофилы?
– продукция токсинов
- Какие функции выполняют зозинофилы?
+ разрушение токсинов
+ нейтрализация гистамина
– продукция и выделение гистамина
- В каких случаях будет увеличиваться индекс регенерации (соотношение зрелых и молодых нейтрофилов)?
– при интенсивной мышечной работе
– при эмоциональном возбуждении
+ при инфекционных заболеваниях
+ при воспалительных процессах
+ при интоксикации
- При каком состоянии имеет место патологический лейкоцитоз?
– эмоциональное возбуждение
– приём пищи
– интенсивная мышечная нагрузка
– инфекционное заболевание
+ воспалительное заболевание
– в периоде новорождённое
- При каком состоянии имеет место физиологический лейкоцитоз?
+ эмоциональное возбуждение
+ приём пищи
+ интенсивная мышечная нагрузка
– инфекционное заболевание
– воспалительное заболевание
- Каков наиболее вероятный механизм лейкоцитоза после приёма пищи?
– активация гранулоцитопоэза
+ перераспределение лейкоцитов
– сгущение крови
– уменьшение интенсивности разрушения лейкоцитов
- Каков наиболее вероятный механизм лейкоцитоза при эмоциональном возбуждении?
– активация лейкопоэза
+ перераспределение лейкоцитов
– уменьшение интенсивности разрушения лейкоцитов
- Каковы функции нейтрофилов?
+ защита организма от инфекции
– презентация антигена
+ регуляция регенерации
+ уничтожение нежизнеспособных тканей
- Какие биологически активные вещества содержатся в гранулах базофилов?
+ гистамин
+ гепарин
– интерферон
– плазминоген
- Каковы физиологические эффекты гистамина?
+ повышение проницаемости капилляров для жидкости
+ сужение бронхов
– спазм сосудов
- Каковы функции эозинофилов?
– участие в иммунном ответе
+ защита от паразитарной инфекции
– регуляция эритропозза
+ нейтрализация некоторых биологически активных веществ
- Каковы функциональные свойства моноцитов- макрофагов?
+ миграция
- Каковы функциональные свойства моноцитов- макрофагов?
+ фагоцитоз
+ секреция биологически активных веществ
+ презентация антигена
– нейтрализация гистамина
- Каковы функции моноцитов – макрофагов?
+ регуляция иммунного ответа
+ неспецифическая защита организма от инфекции
– регуляция кислотно- основного баланса
+ регуляция регенерации
- Каковы функции лимфоцитов?
+ формирование иммунного ответа
+ регуляция иммунного ответа
+ регуляция регенерации тканей
– неспецифическая защита организма от инфекции
- Какие утверждения о Т- лимфоцитах справедливы?
– продуцируют антитела
- Какие утверждения о Т- лимфоцитах справедливы?
+ способны регулировать интенсивность иммунного ответа
– способны к фагоцитозу
+ являются важным звеном специфической защиты организма
+ способны уничтожать клетки
- Какие функции выполняет костный мозг?
+ является главным местом образования клеток крови
+ обеспечивает эритрогтоэз
+ обеспечивает гранулоцитопоэз
– обеспечивает синтез всех факторов свертывания крови
+ обеспечивает синтез гемоглобина
- Какие особенности характеризуют костный мозг?
– содержит минимальное количество стволовых кроветворных клеток
+ является главным местом образования клеток крови
+ сосредоточена основная масса стволовых кроветворных клеток
+ участвует в разрушении эритроцитов
- Что характерно для процесса кроветворения?
+ протекает постоянно
– протекает периодически
+ протекает в костном мозге
– протекает во всех органах и тканях
+ состоит из серии клеточных дифферекцировок
- Источниками эритропоэтина в организме человека являются:
+ почки
+ система фагоцитирующих мононуклеаров
– гипофиз
– базофилы
– зозинофилы
- Какие специфические дальноранговые факторы стимулируют эритропоэз?
– эритроцитарный кейлон
– тестостерон
+ продукты распада эритроцитов
+ эритропоэтин
- Какие фактору могут принимать участив в специфической дальноранговой регуляций кроветворения?
– адреналин
+ эритропоэтин
+ лейкопоэтины
– соматотропный гормон
+ продукты распада клеток крови
- Какие вещества могут принимать участие в неспецифической регуляции гемопоэза?
– эритропоэтин
- Какие вещества могут принимать участие в неспецифической регуляции гемопоэза?
– лейкопоэтины
– кейлоны
+ адреналин
+ соматотропный гормон
- Какие факторы обеспечивают жидкое состояние крови?
+ высокая скорость кровотока
+ фибринолитическая активность эндотелия
+ наличие в плазме ингибиторов свёртывания
– высокая концентрация альбуминов в плазме
- Что характерно для процесса свёртывания крови?
+ протешет по типу каскада реакций
– каждый фактор активируется независимо от других
+ протекает постоянно
+ является ферментативным процессом
+ сопряжён с фибринолизом
- Какие факторы свёртывания содержатся в тромбоцитах?
+ тромболластин
- Какие факторы свёртывания содержатся в тромбоцитах?
+ фибриноген
+ серотонин
– прекалликреин
– высокомолекулярный кининоген
- Какое событие с наибольшей вероятностью повлечёт за собой активацию тромбоцитарно-сосудистого гемостаза?
– сосудистый спазм
– разрушение тромбоцитов
+ повреждение эндотелия
– повреждение внешней оболочки сосуда
- Каковы механизмы сосудистого спазма при тромбоцитарно- сосудистом гемостаза?
+ активация симпатического отдела вегетативной нервной системы при повреждении сосуда
– высвобождение гистамина из тучных клеток
+ высвобождение серотонина из тромбоцитов
– высвобождение тромбостенина из тромбоцитов
- В Каком звана системы регуляции агрегатного состояния крови принимает участие фактор Виллебранда?
– образование протромбиназы по внешнему пути
– фибринолиз
– полимеризация фибрина
+ сосудисто-тромбоцитарный гемостаз
– антифибринолиз
- Какое звано Системы гемостаза будет нарушено в наибольшей степени при дефиците фактора Виллебранда?
– образование протромбиназы по внешнему пути
– ретракция сгустка
+ адгезия тромбоцитов к повреждённому эндотелию
– активация V плазменного фактора
- Какие биологически активные вещества стимулируют агрегацию тромбоцитов?
– АТФ
+ АДФ
– гепарин
+ тромбин
- Какие биологически активные вещества угнетают агрегацию тромбоцитов?
+ АТФ
– АДФ
+ простациклин
– гистамин
– серотонин
- Какие компоненты повреждённой сосудистой стенки способствуют адгезии тромбоцитов?
+ коллаген
+ миофибриллы
– ядра клеток
– ретикулиновые волокна
- Где находится фибриноген?
+ в плазме крови
– в сыворотке крови
+ в лимфе
+ в тромбоцитах
- Образованием какого вещества заканчивается вторая фаза коагуляционного гемостаза?
– акцелерин
– фибрин
– протромбиназа
+ тромбин
- Образованием какого вещества заканчивается третья фаза коагуляционного гемостаза?
– акцелерин ‘
+ фибрин
– протромбиназа
– тромбин
- Какие структуры являются источниками факторов свёртывания
+ печень
+ почки
+ тромбоциты
+ лейкоциты
+ эритроциты
+ эндотелий
- Какие факторы непосредственно участвуют в активации X плазменного фактора по внутреннему механизму?
+ IX активный фактор
– VII активный фактор
+ третий тромбоцитарный фактор
+ VIII активный фактор
+ ионы кальция
- Какие вещества принимают участие в активации VII фактора свёртывания?
– фактор Хагемана
+ тромбопластин
+ ионы кальция
– протромбиназа
– ионы магния
- Какие вещества принимают непосредственное участие в активации X плазменного фактора по внешнему механизму?
+ тромбопластин.
+ ионы кальция
– плазменный предшественник тромбопластина
+ конвертин
– акцелерин
- Какие вещества активируют фактор Хагемана?
– ионы кальция
– фибриноген
+ катехоламины
+ протеазы
+ коллаген
- Какие функции выполняет тромбин в системе гемостаза?
+ катализ превращения фибриногена в фибрин
+ активация V плазменного фактора
+ стимуляция агрегации тромбоцитов
+ активация XIII плазменного фактора
- Какие вещества принимают участие в III фазе коагуляционного гемостаза?
+ тромбин
– протромбин
– фактор Хагемана
+ кальций
+ ХIII плазменный фактор
– конвертин
- Какие вещества принимают участие в катализе перехода протромбина в тромбин?
+ фактор Стюарта – Прауэра
+ акцелератор – глобулин
+ ионы кальция
+ третий тромбоцитарный фактор
– фибриноген
- Какие факторы принимают участие в активации плазменного предшественника тромбопластина?
– тромбин
+ третий тромбоцитарный фактор
+ высокомолекулярный кининоген
+ фактор Хагемана
– конвертин
- Как изменится скорость свёртывания крови при сильном эмоциональном возбуждении?
+ увеличится
– уменьшится
– не изменится
- Как изменится время свёртывания крови при возбуждении симпатического отдела вегетативной нервной системы?
– не изменится
– увеличится
+ уменьшится
- Как изменяется свёртывание крови при болевом раздражении?
– не изменяется
– замедляется
+ ускоряется
- Каков наиболее вероятный механизм антикоагулянтного действия фибрина?
– угнетает синтез прокоагулянтов в печени
+ сорбирует и инактивирует ряд факторов свёртывания
– угнетает взаимодействие тромбоцитов с фактором Виллебранда
– обладает плазминоподобным действием
- Какие вещества относятся к постоянным (первичным) антикоагулянтам?
+ протеины С иБ
+ контактный ингибитор
+ антитромбин III
+ гепарин
+ антитрипсин
- Какие вещества относятся к образующимся (вторичным) антикоагулянтам?
– гепарин
– антитромбин III
+ фибрин
+ продукты расщепления фибрина
+ фибринопептиды
- Каковы компоненты системы фибринолиза?
+ плазминоген
– проконвертин
+ плазмин
+ активаторы фибринолиза
– антитромбин III
+ ингибиторы фибринолиза
- Образованием какого вещества заканчивается первая фаза фибринолиза?
– тромбина
– фибрина
+ кровяного активатора
– серотонина
– гистамина
- Образованием какого вещества заканчивается вторая фаза фибринолиза?
– тромбина фибрина
+ плазмина
– кровяного активатора
– серотонина
– гистамина
- Образованием каких веществ заканчивается третья фаза фибринолиза?
+ пептиды
+ аминокислоты
– фибрин
– серотонин
- Какова основная функция плазмина?
– активация протромбина
+ расщепление фибрина
– активация агрегации тромбоцитов
– угнетение фибринолиза - Какие вещества относятся к активаторам плазминогена?
- Какова основная функция плазмина?
+ щелочная и кислая фосфотазы
+ кровяной и тканевой активаторы
+ фактор Хагемана
+ урокиназа
+ трипсин
+ комплементС
- Каковы источники плазминогена в организме?
– надпочечники
+ почки
– базофилы
+ эозинофилы
+ печень
- Какие антигены эритроцитов не имеют естественных антител?
– А
– В
+ С
+ D
+ Е
- Для каких антигенных систем крови НЕ характерны естественные антитела?
– система АВО
+ система Резус
+ система Келл – Челлано
+ система Кидд
+ система Лютеран
- Какие антигены эритроцитов относятся к системе Резус?
– А
– Н
+ D
+ С
+ Е
- Какие антигены эритроцитов относят к системе АВО?
+ А1
+ В
– С
– D
– I
+ А2
– Е
- Какой агглютинин способствует склеиванию эритроцитов, содержащих Q (Н)- антиген?
– гамма
– бета
+ альфа – 2
– альфа – 1
- Какие агглютинины могут содержаться в крови человека, имеющего вторую (А1) группу крови?
– гамма
+ бета
+ альфа – 2
– альфа – 1
- Какие агглютиногены и агглютинины могут содержаться в крови второй (А2) группы?
– А1 – антиген
+ А2 – антиген
– В- антиген
+ бета – антитела
– альфа- 2- антитела
+ альфа – 1- антитела
- Какие антигены и антитела содержатся в крови человека, имеющего первую группу крови?
– А – антиген
– В – антиген
+ альфа – антитело
+ бета – антитело
- Какой агглютинин способствует склеиванию эритроцитов третьей группы крови?
+ бета
– альфа- 1
– альфа- 2
– каппа- 2
- Какие аплютиногены и агглютинины содержатся в крови третьей группы?
– А – антиген
+ В – антиген
+ альфа – антитело
– бета – антитело
- Для каких из указанных антигенов НЕ существует естественных антител?
– А1
– А2
+ С
+ D
– В
+ Е
176. Какие утверждения справедливы по отношению к А2 антигену?
Какие утверждения справедливы по отношению к А2 антигену?
+ антигенные свойства выражены слабо
– содержится на эритроцитах О- группы крови
– антигенные свойства выражены сильнее всех видов
- Какие компоненты содержатся в крови четвёртой группы?
+ А – антиген
- Какие компоненты содержатся в крови четвёртой группы?
+ В – антиген
– бета- антитела
– альфа- антитела
- Какое утверждение справедливо по отношению к антигену А1?
+ является самым сильным антигеном среди антигенов А
- Какое утверждение справедливо по отношению к антигену А1?
– не имеет естественного антитела
– не обладает агглютинирующей способностью
- Какая группа крови может быть у детей, родители которых имеют первую (00) и вторую (АА) группы крови?
– первая
+ вторая
– трети
– четвёртая
- Какие группы крови могут быть у детей, родители которых имеют третью (ВО) и вторую (АО) группы крови?
+ первая
+ вторая
+ третья
+ четвёртая
- Какие группы крови могут быть у детей, родители которых имеют третью (ВВ) й вторую (АО) группы крови?
– первая
– вторая
+ третья
+ четвёртая
- Какие группы крови могут быть у детей, родители которых имеют четвёртую группу крови?
– первая
+ вторая
+ третья
+ четвёртая
- Какие правила необходимо соблюдать при переливании крови?
+ определение групповой принадлежности по системе АВО
+ определение принадлежности крови по системе Резус
+ проведение пробы на индивидуальную совместимость
+ проведение пробы на биологическую совместимость - В чём суть пробы на биологическую совместимость?
- Какие правила необходимо соблюдать при переливании крови?
– определение наличия агглютинации при смешивании крови донора и реципиента в пробирке
– отслеживание состояния лабораторного животного при одновременном переливании ему крови донора и реципиента
+ отслеживание состояния реципиента при медленном дробном вливании крови донора
- Какие утверждения применимы к.
 системе АВО?
системе АВО?
- Какие утверждения применимы к.
+ являются антигенной системой, имеющей естественные антитела
+ антигены системы АВО образуются из единого предшественника гликолипидной природы
– первое переливание крови несовместимой по системе АВО, как правило заканчивается благополучно
- Какие утверждения применимы к системе Резус?
– имеет естественные антитела
– 85% людей Резус-отрицательны
+ первое переливание Резус положительной крови Резус отрицательному реципиенту может закончиться благополучно
+ самым сильным антигеном системы Резус является антиген D
– самым сильным антигеном системы Резус является антиген С
- Какой антиген из группы антигенов системы Резус определяет резус – принадлежность крови?
– С
+ D
– Е
- Что является основным действующим компонентом цоликлонов?
– эритроциты, несущие антигены системы АВО
– сыворотки, содержащие антитела системы АВО
+ моноклональные антитела к антигенам системы АВО
- При определении групповой принадлежности по системе АВО произошла агглютинация с Цоликлоном анти- А, но отсутствовала – с Цоликлоном анти- В.
 О какой группе крови идет речь?
О какой группе крови идет речь?
- При определении групповой принадлежности по системе АВО произошла агглютинация с Цоликлоном анти- А, но отсутствовала – с Цоликлоном анти- В.
– первая
+ вторая
– третья
– четвёртая
- При определении групповой принадлежности по системе АВО произошла агглютинация с Цоликлоном анти- В, но отсутствовала- с Цоликлоном анти- А. О какой группе крови идёт речь?
– первая
– вторая
+ третья
– четвёртая
- При определении групповой принадлежности по системе АВО агглютинация отсутствовала как с Цоликлоном анти- А, так и с Цоликлоном анти- В. О какой группе крови идёт речь?
+ первая
вторая
третья
четвёртая
- При определении групповой принадлежности по системе АВО произошла агглютинация как с Цоликлоном анти- А, так и с Цоликлоном анти- В.
 О какой группе крови ищет речь?
О какой группе крови ищет речь?
- При определении групповой принадлежности по системе АВО произошла агглютинация как с Цоликлоном анти- А, так и с Цоликлоном анти- В.
– первая
– вторая
– третья
+ четвёртая
- В чём главный недостаток схемы переливания крови, по которой лица первой группы считаются универсальными донорами, а лица четвёртой – универсальными реципиентами?
+ не учитываются естественные антитела плазмы донора
– не учитываются естественные антитела плазмы реципиента
– не учитываются антигенные различия в пределах одного наименования антигена
- Известно, что первое переливание резус несовместимой крови может закончиться благополучно, в то время как переливание крови, несовместимой по системе АВО всегда заканчивается осложнением. В чём причина этого явления?
– антиген Е системы Резус обладает слабой иммуногенностъю
+ система Резус не имеет естественных антител
– на мембране эритроцитов Резус положитепьных лиц как подвияло низкое содержание С- антигена
- Перечислите современные правила переливания крови?
+ переливание одногруппной (изогруппной) крови
+ определение групповой принадлежности крови по системе ABO донора и реципента
+ определение групповой принадлежности крови по системе Резус донора и реципента
+ определение индивидуальной совместимости крови донора и реципиента
+ проведение биологической пробы
- В чем заключается перекрестный метод определения групповой принадлежности крови по системе АВО?
+ определение по стандартным сывороткам и стандартным эритроцитам
+ определение по цоликлонам и стандартным эритроцитам
– определение только по системе Резус
– определение только по цоликлонам
– определение только по стандартным эритроцитам
- Какие методы используют для определения групповой принадлежности крови по системе АВО?
+ метод стандартных сывороток
+ метод стандартных эритроцитов
+ метод цоликлонов
– метод антирезусной сыворотки
+ перекрестный метод
- Какими методами определяют резус – принадлежность крови?
+ метод антирезусных сывороток
+ метод цоликлонов (анти- Д- супер)
– метод стандартных сывороток
– метод цоликлонов (анти- А и анти- В)
– метод стандартных эритроцитов
- Если при определении индивидуальной совместимости крови отмечается агглютинация, совместима ли кровь донора и реципиента?
– да
+ нет
- Какие кровезаменители относят к группе регуляторов водно- солевого обмена и кислотно- щелочного состояния?
белковые гидролизаты
смеси аминокислот
+ солевые растворы
+ осмодиуретики
– эмульсии фторуглеродов
- Какие явления несовместимости могут наблюдаться у реципиента при проведении биологической пробы?
+ жар
+ боли в животе, голове, пояснице
+ малый и частый пульс
+ моча красно-коричневого цвета
+ падение артериального давления
- Какие кровезаменители относят к группе для парентерального питания?
+ белковые гидролизаты
+ смеси аминокислот
– солевые растворы
– осмодиуретики
– эмульсии фторуглеродов
- Какие кровезаменители относятся к группе дезинтоксикационных?
– полиглюкин
– реополиглюкин
– желатиноль
+ гемодез
+ полидез
- Какие кровезаменители относятся к группе гемодинамических?
+ полиглюкин
+ реополиглюкин
+ желатиноль
– гемодез
– гидролизат казеина
- Используется ли схема Оттенберга при переливании крови в настоящее время?
– да
+ нет - Если при определении индивидуальной совместимости крови не отмечается агглютинация, совместима ли кровь донора и реципиента?
- Используется ли схема Оттенберга при переливании крови в настоящее время?
+ да
– нет
- Какие современные правила переливания крови используются в клинике?
+ переливание одногруппной крови
– переливание по схеме Оттенберга
+ определение групповой принадлежности крови донора и реципиента по системам АВО и Резус
+ определение индивидуальной совместимости крови донора и реципиента
+ проведение биологической пробы
1612728091-0a30a7783a7be2aec2f68b0436b9c3b2 (Савченков — Курс лекций по физиологии) — документ, страница 26
Фосфатная буферная система образована натрия дигидрофосфатом (NaH2PO4) и натрия гидрофосфатом (Na2HPO4). Первое соединение ведет себя как слабая кислота, второе — как соль слабой кислоты. Если в кровь попадает более сильная кислота, то она реагирует с Na2HPO4, образуя нейтральную соль, и увеличивает количество слабодиссоциируемого H2PO4— . Избыточное количество натрия дигидрофосфата при этом будет удаляться с мочой, благодаря чему соотношение NaH2PO4/Na2HPO4 не изменится.
Первое соединение ведет себя как слабая кислота, второе — как соль слабой кислоты. Если в кровь попадает более сильная кислота, то она реагирует с Na2HPO4, образуя нейтральную соль, и увеличивает количество слабодиссоциируемого H2PO4— . Избыточное количество натрия дигидрофосфата при этом будет удаляться с мочой, благодаря чему соотношение NaH2PO4/Na2HPO4 не изменится.
Белки плазмы крови играют роль буфера, так как обладают амфотерными свойствами: в кислой среде ведут себя как основания, а в основной — как кислоты.
Буферные системы крови более устойчивы к действию кислот, чем оснований. Основные соли слабых кислот, содержащиеся в крови, образует так называемый щелочной резерв крови. Его величина определяется по тому количеству СО2, которое может быть связано 100 мл крови при напряжении СО2, равному 40 мм рт. ст.
Все буферные системы крови, взятые вместе, создают в крови так называемый щелочной резерв, способный связывать кислые продукты, поступающие в кровь. Щелочной резерв плазмы крови в здоровом организме более или менее постоянен. Он может быть снижен при избыточном поступлении или образовании кислот в организме (например, при интенсивной мышечной работе, когда образуется много молочной и угольной кислот). Если это снижение щелочного резерва не привело еще к реальным изменениям рН крови, то такое состояние называют компенсированным ацидозом. При некомпенсированном ацидозе щелочной резерв расходуется полностью, что ведет к снижению рН (например, так бывает при диабетической коме).
Щелочной резерв плазмы крови в здоровом организме более или менее постоянен. Он может быть снижен при избыточном поступлении или образовании кислот в организме (например, при интенсивной мышечной работе, когда образуется много молочной и угольной кислот). Если это снижение щелочного резерва не привело еще к реальным изменениям рН крови, то такое состояние называют компенсированным ацидозом. При некомпенсированном ацидозе щелочной резерв расходуется полностью, что ведет к снижению рН (например, так бывает при диабетической коме).
Когда ацидоз связан с поступлением в кровь кислых метаболитов или других продуктов, он носит название метаболического или не газового. Когда же ацидоз возникает при накоплении в организме преимущественно углекислоты — он называется газовым. При избыточном поступлении в кровь продуктов обмена щелочного характера (чаще с пищей, так как продукты обмена в основном кислые) то щелочной резерв плазмы увеличивается (компенсированный алкалоз). Он может увеличиваться, например, при усиленной гипервентиляции легких, когда имеет место избыточное удаление углекислоты из организма (газовый алкалоз). Некомпенсированный алкалоз бывает чрезвычайно редко.
Некомпенсированный алкалоз бывает чрезвычайно редко.
Функциональная система поддержания рН крови (ФСрН) включает в себя целый ряд анатомически неоднородных органов, в комплексе позволяющих достигнуть очень важного для организма полезного результата — обеспечения постоянства рН крови и тканей.
Появление кислых метаболитов или щелочных веществ крови сразу же нейтрализуется соответствующими буферными системами и одновременно от специфических хеморецепторов, заложенных как в стенках кровеносных сосудов, так и в тканях, в ЦНС поступают сигналы о возникновении сдвига в реакциях крови (если таковой действительно произошел). В промежуточном и продолговатом отделах мозга находятся центры, регулирующие постоянство реакции крови. Оттуда по афферентным нервам и по гуморальным каналам команды поступают к исполнительным органам, способным исправить нарушение гомеостаза.
К числу таких органов относятся все органы выделения (почки, кожа, легкие), которые выбрасывают из организма как сами кислые продукты, так и продукты их реакций с буферными системами. Кроме того, в деятельности ФСрН принимают участие органы ЖКТ, которые могут быть как местом выделения кислых продуктов, так и местом, откуда всасываются необходимые для их нейтрализации вещества. Наконец, к числу исполнительных органов ФСрН относится и печень, где происходит дезинтоксикация потенциально вредных продуктов, как кислых так и щелочных. Надо отметить, что кроме этих внутренних органов, в ФСрН есть и внешнее звено — поведенческое, когда человек целенаправленно ищет во внешней среде вещества, которых ему не хватает для поддержания гомеостаза («Кисленького хочется!»). Схема этой ФС представлена на схеме.
Рис. 15. Функциональная система поддерждания РН
2. Удельный вес крови (УВ) крови зависит в основном от числа эритроцитов, содержащегося в них гемоглобина и белкового состава плазмы. У мужчин он равен 1,057, у женщин — 1,053, что объясняется различным содержанием эритроцитов. Суточные колебания не превышают 0.003. Увеличение УВ закономерно наблюдается после физического напряжения и в условиях воздействия высоких температур, что свидетельствует о некотором сгущении крови. Понижение УВ после кровепотери связано с большим притоком жидкости из тканей. Наиболее распространенный метод определения — медно-сульфатный, принцип которого заключается в помещении капли крови в ряд пробирок с растворами сульфата меди известного удельного веса. В зависимости от УВ крови капля тонет, всплывает или плавает в том месте пробирки, где ее поместили.
3. Осмотические свойства крови. Осмосом называется проникновение молекул растворителя в раствор через разделяющую их полупроницаемую перепонку, через которую не проходят растворенные вещества. Осмос совершается и в том случае, если такая перегородка разделяет растворы с разной концентрацией. При этом растворитель перемещается через мембрану в сторону раствора с большей концентрацией до тех пор, пока эти концентрации не сравняются. Мерой осмотических сил является осмотическое давление (ОД). Оно равно такому гидростатическому давлению, который над приложить к раствору чтобы прекратить в него проникновение молекул растворителя. Величина эта определяется не химической природой вещества, а числом растворенных частиц. Она прямо пропорциональна молярной концентрации вещества. Одно- молярный раствор имеет ОД 22,4 атм., так как осмотическое давление определяется давлением, которое может оказывать в равном объеме растворенное вещество в виде газа (1гМ газа занимает объем 22,4 л. Если это количество газа поместить в сосуд объемом 1л, он будет давить на стенки с силой 22,4 атм.).
В плазме содержится много осмотически активных частиц (молекул, ионов), поэтому она осмотически активна. Ионная осмолярность 1 л плазмы составляет 326 мОсм. Учитывая, что 1000 мОсм создает давление примерно в 22,4 атм, то осмотическое давление плазмы достигает 7,3 атм или 5600 мм рт. ст. (745 кПа). Раствор, имеющий ту же осмолярность, что и нормальная плазма (раствор NaCl – 0,9% или 154 ммоль/л), называется изотоническим (плазме) или физиологическим раствором. Раствор, создающий повышенное осмотическое давление (осмолярность которого выше, чем у плазмы) называют гипертоническим, пониженное (осмолярность ниже, чем у плазмы) – гипотоническим.
Среди осмотически активных веществ плазмы особо выделяются белки. Поскольку их молекулы очень велики, то, несмотря на большую массовую долю этих веществ, число молекул белков мало. Следовательно, создаваемое белками осмотическое или онкотическое давление, невелико – достигает только 30 мм рт. ст. Однако, несмотря на это, оно принципиально для регуляции объема плазмы крови, точнее соотношения между объемами плазмы и межклеточной жидкости. Причина физиологической значимости онкотического давления в том, что только белки, будучи крупными частицами, не проникают через стенку капилляров. Поскольку в межклеточной жидкости белка содержится меньше, чем в плазме крови, то различие концентраций белка создает ту разность осмотических давлений, которая определяет диффузию воды из тканевого во внутрисосудистое русло.
Осмотическое давление следует рассматривать не как свойство растворенного вещества, растворителя или раствора, а как свойство системы, состоящей из раствора, растворенного вещества и разделяющей их полупроницаемой перепонки. Кровь как раз является такой системой. Роль полупроницаемой перегородки в этой системе играют оболочки клеток крови и стенки кровеносных сосудов, растворителем служит вода, в которой находятся минеральные и органические вещества в растворенном виде. Эти вещества создают в крови среднюю молярную концентрацию около 0,3 гМ, и поэтому развивают осмотическое давление, равное для крови человека 7,7 — 8,1 атм. Почти 60% этого давления приходится на долю поваренной соли (NaCl).
Величина осмотического давления крови имеет важнейшее физиологическое значение, так как в гипертонической среде вода выходит из клеток (плазмолиз), а в гипотонической — наоборот, входит в клетки, раздувает их и даже может разрушить (гемолиз). Правда, гемолиз может наступать не только при нарушении осмотического равновесия, но и под действием химических веществ — гемолизинов. К ним относятся сапонины, желчные кислоты, кислоты и щелочи, аммиак, спирты, змеиный яд, бактериальные токсины и др. Величина осмотического давления крови определяется криоскопическим методом, т.е. по точке замерзания крови. У человека температура замерзания плазмы равна -0,56-0,58оС. Осмотическое давление крови человека соответствует давлению 94% NaCl, такой раствор носит название физиологического. В клинике, когда возникает необходимость введения в кровь жидкости, например, при обезвоживании организма, или при внутривенном введении лекарств обычно применяют этот раствор, который изотоничен плазме крови. Однако, хотя его и называют физиологическим, он таковым в строгом смысле не является, так как в нем отсутствуют остальные минеральные и органические вещества. Более физиологическими растворами являются такие, как раствор Рингера, Рингер-Локка, Тироде, Крепс-Рингера и т.п. Они приближаются к плазме крови по ионному составу (изоионичны). В ряде случаев, особенно для замены плазмы при кровепотере, применяются жидкости кровезаменители, приближающиеся к плазме не только по минеральному, но и по белковому, крупномолекулярному составу. Так как капиллярная стенка очень мало проницаема для белков и легко проходима для воды и кристаллоидов, то именно онкотическое давление белков является наиболее эффективным фактором, удерживающим воду в кровеносных сосудах. Поэтому уменьшение количества белков в плазме приводит к появлению отеков, к выходу воды из сосудов в ткани. Из белков крови наибольшее онкотическое давление развивают альбумины.
Функциональная система регуляции осмотического давления. Осмотическое давление крови млекопитающих и человека в норме держится на относительно постоянном уровне (опыт Гамбургера: введение в кровь лошади 7 л 5% раствора сернокислого натрия не привело к изменению осмотического давления). Все это происходит за счет деятельности функциональной системы регуляции осмотического давления, которая тесно увязана с функциональной системой регуляции водно-солевого гомеостаза, так как использует те же исполнительные органы. В стенках кровеносных сосудов имеются нервные окончания, реагирующие на изменения осмотического давления (осморецепторы). Раздражение их вызывает возбуждение центральных регуляторных образований в продолговатом и промежуточном мозге. Оттуда идут команды, включающие те или иные органы, например, почки, которые удаляют избыток воды или солей. Из других исполнительных органов ФСОД надо назвать органы пищеварительного тракта, в которых происходит как выведение избытка солей и воды, так и всасывание необходимых для восстановления ОД продуктов; кожу, соединительная ткань которой вбирает в себя при понижении осмотического давления избыток воды или отдает ее последней при повышении осмотического давления.
Рис. 16. Функциональная система регуляции осмотического давления
В кишечнике растворы минеральных веществ всасываются только в таких концентрациях, которые способствуют установлению нормального осмотического давления и ионного состава крови. Поэтому при приеме гипертонических растворов (английская соль, морская вода) происходит обезвоживание организма за счет выведения воды в просвет кишечника. На этом основано слабительное действие солей. Фактором, способным изменять осмотическое давление тканей, а также крови, является обмен веществ, ибо клетки тела потребляют крупномолекулярные питательные вещества, и выделяют взамен значительно большее число молекул низкомолекулярных продуктов своего обмена. Отсюда понятно, почему венозная кровь, оттекающая от печени, почек, мышц имеет большее осмотическое давление, чем артериальная. Не случайно, что в этих органах находится наибольшее количество осморецепторов. Особенно значительные сдвиги осмотического давления в целом организме вызывает мышечная работа. При очень интенсивной работе деятельность выделительных органов может оказаться недостаточной для сохранения осмотического давления крови на постоянном уровне и в итоге может наступить его увеличение. Сдвиг осмотического давления крови до 1,155% NaCl делает невозможным дальнейшее выполнение работы (один из компонентов утомления).
Суспензионные свойства крови. Кровь является устойчивой суспензией мелких клеток в жидкости (плазме), Свойство крови как устойчивой суспензии нарушается при переходе крови к статическому состоянию, что сопровождается оседанием клеток и наиболее отчетливо проявляется со стороны эритроцитов. Отмеченный феномен используется для оценки суспензионной стабильности крови при определении скорости оседания эритроцитов (СОЭ). Агрегация эритроцитов, их склеивание зависит от изменения физических свойств поверхности эритроцитов (возможно, с изменением знака суммарного заряда клетки с отрицательного на положительный), а также от характера взаимодействия эритроцитов с белками плазмы. Суспензионные свойства крови зависят преимущественно от белкового состава плазмы: увеличение содержания грубодисперсных белков при воспалении сопровождается снижением суспензионной устойчивости и ускорением СОЭ.
Величина СОЭ зависит и от количественного соотношения плазмы и эритроцитов. У новорожденных СОЭ равна 1-2 мм/час, у мужчин 4-8 мм/час, у женщин 6-10 мм/час. Ускоренной СОЭ, обусловленной изменением белков плазмы особенно при воспалении, соответствует и повышенная агрегация эритроцитов в капиллярах. Преимущественная агрегация эритроцитов в капиллярах связана с физиологическим замедлением тока крови в них. Доказано, что в условиях замедленного кровотока увеличение содержания в крови грубодисперсных белков приводит к более выраженной агрегации клеток. Агрегация эритроцитов, отражая динамичность суспензионных свойств крови, является одним из древнейших защитных механизмов. У беспозвоночных агрегация эритроцитов играет ведущую роль в процессах гемостаза; при воспалительной реакции это приводит к развитию стаза (остановки кровотока в пограничных областях), способствуя отграничению очага воспаления. В последнее время доказано, что в СОЭ имеет значение не столько заряд эритроцитов, сколько характер его взаимодействия с гидрофобными комплексами белковой молекулы. Определяют СОЭ по методу Панченкова.
Вязкость крови (реологические свойства крови). Вязкость крови, определяемая вне организма, превышает вязкость воды в 3-5 раз и зависит преимущественно от содержания эритроцитов и белков. Относительно высокая вязкость плазмы (1,9–2,6 при вязкости Н2О = 1,0) почти целиком обусловлена белками. Влияние белков определяется особенностями структуры их молекул: фибриллярные белки повышают вязкость в значительно большей степени, чем глобулярные. Выраженный эффект фибриногена связан не только с высокой внутренней вязкостью, но обусловлен и вызываемой им агрегацией эритроцитов. В физиологических условиях вязкость крови in vitro нарастает (до 70%) после напряженной физической работы и является следствием изменения коллоидных свойств крови.
13.1. Свертывание крови: понятие, ферментативная теория (Шмидт, Моравиц), факторы свертывания, роль тромбоцитов.
Сущность и значение свертывания крови. Если выпущенную из кровеносного сосуда кровь оставить на некоторое время, то из жидкости она вначале превращается в желе, а затем в крови организуется более или менее плотный сгусток, который, сокращаясь, выжимает из себя жидкость, называемую кровяной сывороткой. Это — плазма, лишенная фибрина. Описанный процесс называется свертыванием крови (гемокоагуляцией). Его сущность заключается в том, что растворенный в плазме белок фибриноген в определенных условиях переходит в нерастворимое состояние и выпадает в осадок в виде длинных нитей фибрина. В ячейках этих нитей, как в сетке, застревают клетки и коллоидное состояние крови в целом меняется. Значение этого процесса заключается в том, что свернувшаяся кровь не вытекает из раненного сосуда, предотвращая смерть организма от кровопотери.
26.4 Кислотно-щелочной баланс — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Определите самую мощную буферную систему в теле
- Определите самую быструю буферную систему в теле
- Опишите белковые буферные системы.
- Объясните, каким образом дыхательная система влияет на pH крови
- Опишите, как почки влияют на кислотно-щелочной баланс
Правильное физиологическое функционирование зависит от очень жесткого баланса между концентрациями кислот и оснований в крови.Кислотный баланс измеряется с помощью шкалы pH, как показано на рисунке 26.4.1. Различные буферные системы позволяют крови и другим биологическим жидкостям поддерживать узкий диапазон pH даже в условиях возмущений. Буфер — это химическая система, которая предотвращает радикальное изменение pH жидкости, подавляя изменение концентрации ионов водорода в случае избытка кислоты или основания. Чаще всего вещество, поглощающее ионы, представляет собой либо слабую кислоту, которая поглощает ионы гидроксила, либо слабое основание, которое поглощает ионы водорода.
Рисунок 26.4.1 — Шкала pH: На этой диаграмме показано, где на шкале pH попадают многие распространенные вещества.Буферные системы в организме человека чрезвычайно эффективны, и разные системы работают с разной скоростью. Химическим буферам в крови требуется всего несколько секунд, чтобы отрегулировать pH. Дыхательные пути могут повысить pH крови за считанные минуты, выдыхая CO 2 из тела. Почечная система также может регулировать pH крови за счет выведения ионов водорода (H + ) и сохранения бикарбоната, но для достижения эффекта этот процесс занимает от нескольких часов до нескольких дней.
Буферные системы, функционирующие в плазме крови, включают белки плазмы, фосфат, а также буферы бикарбоната и угольной кислоты. Почки помогают контролировать кислотно-щелочной баланс, выводя ионы водорода и вырабатывая бикарбонат, который помогает поддерживать pH плазмы крови в пределах нормы. Белковые буферные системы работают преимущественно внутри клеток.
Белковые буферы в плазме крови и клетках
Почти все белки могут функционировать как буферы. Белки состоят из аминокислот, которые содержат положительно заряженные аминогруппы и отрицательно заряженные карбоксильные группы.Заряженные области этих молекул могут связывать ионы водорода и гидроксила и, таким образом, действовать как буферы. Буферизация белками составляет две трети буферной способности крови и большую часть буферизации внутри клеток.
Гемоглобин как буфер
Гемоглобин — это основной белок внутри красных кровяных телец, на его долю приходится треть массы клетки. Во время превращения CO 2 в бикарбонат ионы водорода, высвобождающиеся в результате реакции, забуфериваются гемоглобином, который восстанавливается за счет диссоциации кислорода.Эта буферизация помогает поддерживать нормальный pH. В легочных капиллярах этот процесс меняется на противоположный, чтобы повторно сформировать CO 2 , который затем может диффундировать в воздушные мешочки и выдыхаться в атмосферу. Этот процесс подробно обсуждается в главе, посвященной дыхательной системе.
Фосфатный буфер
Фосфаты обнаруживаются в крови в двух формах: дигидрофосфат натрия (Na 2 H 2 PO 4 — ), который является слабой кислотой, и моногидрофосфат натрия (Na 2 HPO4 2 — ), что является слабой базой.Когда Na 2 HPO4 2- вступает в контакт с сильной кислотой, такой как HCl, основание захватывает второй ион водорода с образованием слабой кислоты Na 2 H 2 PO 4 — и хлорид натрия, NaCl. Когда Na 2 HPO4 2− (слабая кислота) вступает в контакт с сильным основанием, таким как гидроксид натрия (NaOH), слабая кислота снова превращается в слабое основание и образует воду. Кислоты и основания все еще присутствуют, но они удерживают ионы.
HCl + Na 2 HPO 4 → NaH 2 PO 4 + NaCl
(сильная кислота) + (слабое основание) → (слабая кислота) + (соль)
NaOH + NaH 2 PO 4 → Na 2 HPO 4 + H 2 O
(сильное основание) + (слабая кислота) → (слабое основание) + (вода)
Буфер на основе бикарбоната и угольной кислоты
Буфер бикарбонат-угольная кислота работает аналогично фосфатным буферам. Бикарбонат регулируется в крови натрием, как и ионы фосфата.Когда бикарбонат натрия (NaHCO 3 ) вступает в контакт с сильной кислотой, такой как HCl, образуются угольная кислота (H 2 CO 3 ), которая является слабой кислотой, и NaCl. Когда угольная кислота вступает в контакт с сильным основанием, таким как NaOH, образуются бикарбонат и вода.
NaHCO 3 + HCl → H 2 CO 3 + NaCl
(бикарбонат натрия) + (сильная кислота) → (слабая кислота) + (соль)
H 2 CO 3 + NaOH → HCO 3- + H 2 O
(слабая кислота) + (сильное основание) → (бикарбонат) + (вода)
Как и в случае фосфатного буфера, слабая кислота или слабое основание захватывает свободные ионы, что предотвращает значительное изменение pH.Ионы бикарбоната и углекислота присутствуют в крови в соотношении 20: 1, если pH крови находится в пределах нормы. Эта система захвата, содержащая в 20 раз больше бикарбоната, чем угольной кислоты, наиболее эффективна при буферных изменениях, которые могут сделать кровь более кислой. Это полезно, потому что большинство метаболических отходов организма, таких как молочная кислота и кетоны, являются кислотами. Уровень угольной кислоты в крови контролируется истечением CO 2 через легкие. В красных кровяных тельцах карбоангидраза вызывает диссоциацию кислоты, делая кровь менее кислой.Из-за этой кислотной диссоциации CO 2 выдыхается (см. Уравнения выше). Уровень бикарбоната в крови контролируется через почечную систему, где ионы бикарбоната в почечном фильтрате сохраняются и передаются обратно в кровь. Однако бикарбонатный буфер является первичной буферной системой для ПФ, окружающего клетки в тканях по всему телу.
CO 2 + H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 —
** ПРИМЕЧАНИЕ РЕДАКТОРА: добавьте цифру, подобную Marieb 26.12 из 10 издания
Дыхательная система поддерживает баланс кислот и оснований в организме, регулируя уровень угольной кислоты в крови (рис. 26.4.2). CO 2 в крови легко реагирует с водой с образованием угольной кислоты, и уровни CO 2 и угольной кислоты в крови находятся в равновесии. Когда уровень CO 2 в крови повышается (как это происходит, когда вы задерживаете дыхание), избыток CO 2 вступает в реакцию с водой с образованием дополнительной угольной кислоты, что снижает pH крови.Увеличение частоты и / или глубины дыхания (которое вы можете почувствовать «побуждение» сделать после задержки дыхания) позволяет выдохнуть больше CO 2 . Потеря CO 2 из организма снижает уровень углекислоты в крови и, таким образом, приводит к повышению pH до нормального уровня. Как вы могли догадаться, этот процесс работает и в обратном направлении. Чрезмерное глубокое и быстрое дыхание (как при гипервентиляции) выводит из крови CO 2 и снижает уровень углекислоты, делая кровь слишком щелочной.Этот кратковременный алкалоз можно вылечить, вдохнув выдыхаемый воздух в бумажный пакет. Повторное вдыхание выдыхаемого воздуха быстро снизит pH крови до нормального.
Рисунок 26.4.2 — Дыхательная регуляция крови pH: Дыхательная система может снизить pH крови, удаляя CO 2 из крови.Химические реакции, регулирующие уровни CO 2 и угольной кислоты, происходят в легких, когда кровь проходит через легочные капилляры.Незначительной корректировки дыхания обычно достаточно, чтобы отрегулировать pH крови, изменив количество выдыхаемого CO 2 . Фактически, удвоение частоты дыхания менее чем на 1 минуту, удаление «лишнего» CO 2 , увеличило бы pH крови на 0,2. Это обычная ситуация, если вы много занимаетесь спортом в течение определенного периода времени. Чтобы поддерживать необходимое производство энергии, вы будете производить избыток CO 2 (и молочную кислоту, если вы тренируетесь за пределами вашего аэробного порога).Чтобы уравновесить повышенное производство кислоты, частота дыхания увеличивается, чтобы удалить CO 2 . Это помогает предотвратить развитие ацидоза.
Организм регулирует частоту дыхания с помощью хеморецепторов, которые в основном используют CO 2 в качестве сигнала. Датчики периферической крови находятся в стенках аорты и сонных артерий. Эти датчики сигнализируют мозгу о немедленной корректировке частоты дыхания при повышении или понижении уровня CO 2 .Тем не менее, другие сенсоры находятся в самом мозгу. Изменения pH спинномозговой жидкости влияют на дыхательный центр в продолговатом мозге, который может напрямую модулировать частоту дыхания, чтобы вернуть pH в нормальный диапазон.
Гиперкапния или аномально повышенный уровень CO в крови 2 возникает в любой ситуации, которая нарушает дыхательные функции, включая пневмонию и застойную сердечную недостаточность. Снижение дыхания (гиповентиляция) из-за лекарств, таких как морфин, барбитураты или этанол (или даже просто задержка дыхания), также может привести к гиперкапнии.Гипокапния, или аномально низкий уровень CO 2 в крови, возникает при любой причине гипервентиляции, которая вызывает выброс CO 2 , такой как отравление салицилатом, повышенная температура в помещении, лихорадка или истерия.
Почечная регуляция кислотно-щелочного баланса организма направлена на метаболический компонент буферной системы. В то время как дыхательная система (вместе с дыхательными центрами в головном мозге) контролирует уровень углекислоты в крови, контролируя выдыхание CO 2 , почечная система контролирует уровень бикарбоната в крови.Снижение уровня бикарбоната в крови может быть результатом ингибирования карбоангидразы некоторыми диуретиками или чрезмерной потери бикарбоната из-за диареи. Уровни бикарбоната в крови также обычно ниже у людей с болезнью Аддисона (хроническая надпочечниковая недостаточность), у которых снижен уровень альдостерона, и у людей с поражением почек, таким как хронический нефрит. Наконец, низкий уровень бикарбоната в крови может быть результатом повышенного уровня кетонов (часто встречается при неуправляемом сахарном диабете), которые связывают бикарбонат в фильтрате и препятствуют его сохранению.
Бикарбонат-ионы, HCO 3 — , обнаруженные в фильтрате, необходимы для бикарбонатной буферной системы, однако клетки канальца не проницаемы для ионов бикарбоната. Этапы подачи бикарбонат-ионов в систему показаны на рисунке 26.4.3 и кратко изложены ниже:
- Этап 1. Ионы натрия реабсорбируются из фильтрата в обмен на H + по антипортовому механизму в апикальных мембранах клеток, выстилающих почечные канальцы.
- Шаг 2: Клетки вырабатывают ионы бикарбоната, которые можно шунтировать в перитубулярные капилляры.
- Шаг 3. Когда доступен CO 2 , реакция приводит к образованию угольной кислоты, которая диссоциирует с образованием бикарбонатного иона и иона водорода.
- Шаг 4: Ион бикарбоната проходит в перитубулярные капилляры и возвращается в кровь. Ион водорода секретируется в фильтрат, где он может стать частью новых молекул воды и реабсорбироваться как таковой или удаляться с мочой.
Также возможно, что соли в фильтрате, такие как сульфаты, фосфаты или аммиак, будут захватывать ионы водорода. Если это произойдет, ионы водорода будут недоступны для объединения с ионами бикарбоната и образования CO 2 . В таких случаях ионы бикарбоната не сохраняются из фильтрата в кровь, что также способствует дисбалансу pH и ацидозу.
Ионы водорода также конкурируют с калием за обмен с натрием в почечных канальцах. Если калия присутствует больше, чем обычно, происходит обмен калия, а не ионов водорода, и повышенное содержание калия попадает в фильтрат. Когда это происходит, меньшее количество ионов водорода в фильтрате участвует в превращении бикарбоната в CO 2 и сохраняется меньше бикарбоната. Если калия меньше, в фильтрат попадает больше ионов водорода для обмена на натрий и сохраняется больше бикарбоната.
Хлорид-ионы играют важную роль в нейтрализации зарядов положительных ионов в организме. Если хлорид теряется, организм использует ионы бикарбоната вместо потерянных ионов хлора. Таким образом, потеря хлорида приводит к повышенной реабсорбции бикарбоната почечной системой.
Заболевания…
Кислотно-щелочной баланс: кетоацидоз Диабетический ацидоз или кетоацидоз чаще всего возникает у людей с плохо контролируемым сахарным диабетом. Когда определенные ткани организма не могут получить достаточное количество глюкозы, они зависят от расщепления жирных кислот для получения энергии.Когда ацетильные группы разрывают цепи жирных кислот, ацетильные группы затем неферментативно объединяются с образованием кетоновых тел, ацетоуксусной кислоты, бета-гидроксимасляной кислоты и ацетона, которые повышают кислотность крови. В этом состоянии мозг не получает достаточного количества топлива — глюкозы — для производства всего АТФ, необходимого для функционирования.
Кетоацидоз может быть тяжелым и, если его не выявить и не лечить должным образом, может привести к диабетической коме, которая может быть фатальной. Распространенным ранним признаком кетоацидоза является глубокое учащенное дыхание, когда организм пытается избавиться от CO 2 и компенсировать ацидоз.Другой распространенный симптом — запах изо рта из-за выдоха ацетона. Другие симптомы включают сухость кожи и рта, покраснение лица, тошноту, рвоту и боль в животе. Лечение диабетической комы заключается в приеме внутрь или инъекции сахара; его профилактика — правильное ежедневное введение инсулина.
Человек, страдающий диабетом и принимающий инсулин, может вызвать кетоацидоз, если пропущена доза инсулина. Среди людей с диабетом 2 типа люди латиноамериканского и афроамериканского происхождения с большей вероятностью заболеют кетоацидозом, чем люди другого этнического происхождения, хотя причина этого неизвестна.
Обзор главы
В организме существует множество буферных систем, которые помогают поддерживать pH крови и других жидкостей в узком диапазоне — от 7,35 до 7,45. Буфер — это вещество, предотвращающее радикальное изменение pH жидкости за счет поглощения избыточных ионов водорода или гидроксила. Чаще всего вещество, поглощающее ион, представляет собой либо слабую кислоту, которая принимает гидроксильный ион (OH — ), либо слабое основание, которое поглощает ион водорода (H + ).Некоторые вещества служат в качестве буферов в организме, включая белки клеток и плазмы, гемоглобин, фосфаты, ионы бикарбоната и угольную кислоту. Бикарбонатный буфер — это первичная буферная система IF, окружающая клетки в тканях по всему телу. Дыхательная и почечная системы также играют важную роль в кислотно-основном гомеостазе, удаляя из организма соответственно CO 2 и ионы водорода.
Вопросы о критическом мышлении
1. Опишите сохранение ионов бикарбоната в почечной системе.
2. Опишите контроль уровня углекислоты в крови через дыхательную систему.
Глоссарий
- гиперкапния
- аномально повышенный уровень CO в крови 2
- гипокапния
- аномально низкий уровень CO в крови 2
Решения
Ответы на вопросы о критическом мышлении
- Ионы бикарбоната свободно фильтруются через клубочки.Они не могут свободно проходить в клетки почечных канальцев и должны преобразовываться в СО 2 в фильтрате, который может проходить через клеточную мембрану. Ионы натрия реабсорбируются на мембране, а ионы водорода вытесняются в фильтрат. Ионы водорода соединяются с бикарбонатом, образуя угольную кислоту, которая диссоциирует на газ CO 2 и воду. Газ диффундирует в почечные клетки, где карбоангидраза катализирует свое превращение обратно в бикарбонат-ион, который попадает в кровь.
- Уровень углекислоты в крови контролируется через дыхательную систему путем выброса CO 2 из легких. Формула образования бикарбонат-ионов обратима, если концентрация CO 2 уменьшается. Когда это происходит в легких, углекислота превращается в газ, и концентрация кислоты снижается. Скорость дыхания определяет количество выдыхаемого CO 2 . Если скорость увеличивается, в крови меньше кислоты; если скорость снижается, кровь может стать более кислой.
Физиология, кислотно-щелочной баланс — StatPearls
Введение
Для поддержания гомеостаза человеческий организм использует множество физиологических приспособлений. Одно из них — поддержание кислотно-щелочного баланса. При отсутствии патологических состояний pH человеческого тела колеблется от 7,35 до 7,45 при среднем значении 7,40. Почему именно этот номер? Почему бы не использовать нейтральное число 7,0 вместо слабощелочного 7,40? Такой уровень pH идеален для многих биологических процессов, одним из самых важных является насыщение крови кислородом.Кроме того, многие промежуточные продукты биохимических реакций в организме ионизируются при нейтральном pH, что затрудняет использование этих промежуточных продуктов.
pH ниже 7,35 — это ацидемия, а pH выше 7,45 — алкалиемия. Из-за важности поддержания уровня pH в необходимом узком диапазоне в организме человека есть компенсаторные механизмы. Это обсуждение призвано дать базовое понимание кислотно-щелочного баланса в организме, обеспечивая систематический подход к пациентам, которые обращаются с состояниями, вызывающими изменения pH.
Человеческое тело испытывает четыре основных типа кислотных расстройств: метаболический ацидоз, метаболический алкалоз, респираторный ацидоз и респираторный алкалоз. Если возникает одно из этих условий, человеческое тело должно вызвать противовес в виде противоположного состояния. Например, если человек страдает метаболической ацидемией, его организм будет пытаться вызвать респираторный алкалоз, чтобы это компенсировать. Компенсация редко приводит к полностью нормальному pH на уровне 7,4. При использовании терминов ацидемия или алкалиемия подразумевается, что в целом pH является кислым или щелочным, соответственно.Хотя это и не обязательно, может быть полезно использовать эту терминологию, чтобы различать отдельные процессы и общий статус pH пациента, поскольку одновременно могут возникать множественные дисбалансы. [1] [2]
Клеточный
Базовое понимание дыхания на клеточном уровне важно для понимания кислотно-щелочного равновесия в организме человека. Аэробное клеточное дыхание необходимо для жизни человека; люди — облигатные аэробы. Хотя отдельные клетки могут выполнять анаэробное дыхание, для поддержания жизни в них должен присутствовать кислород.Одним из побочных продуктов аэробного клеточного дыхания является углекислый газ. Упрощенное химическое уравнение, обозначающее аэробное клеточное дыхание:
Первая стадия клеточного дыхания — это гликолиз, который берет шестиуглеродную глюкозу и расщепляет ее на две молекулы пирувата, каждая из которых содержит три атома углерода. Гликолиз использует два АТФ и создает четыре АТФ, что означает, что он генерирует два чистых АТФ. Для этого процесса не нужен кислород. Поскольку пациенты часто испытывают дефицит, стоит отметить, что магний является кофактором двух реакций гликолиза.
В конце концов молекулы пирувата окисляются и вступают в цикл TCA. Цикл TCA генерирует NADH из NAD +, FADh3 из FAD и двух молекул АТФ. Это аэробный процесс, требующий кислорода. Пируват попадает в митохондрии и образует ацетил-КоА с потерей углекислого газа. Этот избыток углекислого газа затем выдыхается во время выдоха.
Последним этапом аэробного клеточного дыхания является цепь переноса электронов (ETC). ETC производит большую часть АТФ, образующегося при клеточном дыхании, при этом создается 34 молекулы АТФ.Чтобы произошла реакция внеземного происхождения, необходим кислород. Если кислорода недостаточно, продукты гликолиза вступают в реакцию, называемую ферментацией, с образованием АТФ. Побочный продукт брожения — молочная кислота. Во время гликолиза и цикла TCA NAD + восстанавливается до NADH, а FAD — до FADh3. Восстановление характеризуется увеличением количества электронов. Это то, что движет ETC. Для каждой отдельной молекулы глюкозы десять молекул НАД + превращаются в молекулы НАДН, которые производят по три молекулы АТФ в ETC.
Этот процесс аэробного клеточного дыхания характеризует потребность человека в кислороде. Анаэробное дыхание позволяет организму вырабатывать некоторое количество АТФ при недостатке кислорода; однако этот процесс генерирует только два АТФ, в отличие от 38 АТФ, производимых при аэробном дыхании. Двух молекул АТФ на реакцию недостаточно для поддержания жизни.
Как отмечалось выше, диоксид углерода образуется как побочный продукт цикла TCA. Этот углекислый газ играет важную роль в кислотно-щелочном балансе в организме, что демонстрируется следующей реакцией:
Углекислый газ, образующийся во время клеточного дыхания, соединяется с водой с образованием угольной кислоты.Затем угольная кислота диссоциирует на бикарбонат и ион водорода. Эта реакция — одна из многих буферных систем в организме человека; он сопротивляется резким изменениям pH, позволяя человеку оставаться в узком физиологическом диапазоне pH. Эта буферная система находится в равновесии, то есть все компоненты реакции существуют по всему телу и смещены в сторону уравнения, соответствующую окружающей среде. Эта реакция может происходить и происходит без фермента; однако карбоангидраза — это фермент, который помогает в этом процессе.Он катализирует первую реакцию, описанную выше, с образованием угольной кислоты, которая затем может свободно диссоциировать на бикарбонат и ион водорода. Карбоангидраза находится в эритроцитах, почечных канальцах, слизистой оболочке желудка и клетках поджелудочной железы.
Другие буферные системы в организме человека включают фосфатную буферную систему, белки и гемоглобин. Все они содержат основания, которые принимают ионы водорода, что предотвращает резкое падение pH. Фосфатная буферная система, хотя и присутствует во всем мире, важна для регулирования pH мочи.Белки помогают регулировать внутриклеточный pH. Красные кровяные тельца используют описанную выше реакцию для буферизации гемоглобина; углекислый газ может диффундировать через красные кровяные тельца и соединяться с водой. Уже одно это вызовет увеличение количества ионов водорода; однако гемоглобин может связывать ионы водорода. Гемоглобин также может связывать углекислый газ без этой реакции. Это зависит от количества кислорода, связанного с гемоглобином. Это называется эффектом Холдейна и эффектом Бора. Когда гемоглобин насыщен кислородом, он имеет более низкое сродство к CO2 и ионам водорода и способен его высвобождать.[3] [4]
Участвующие системы органов
Каждая система органов человеческого тела зависит от баланса pH; однако почечная система и легочная система являются двумя основными модуляторами. Легочная система регулирует pH с помощью углекислого газа; по истечении срока действия углекислый газ выбрасывается в окружающую среду. Из-за того, что углекислый газ образует угольную кислоту в организме при соединении с водой, количество выдохшего углекислого газа может вызвать повышение или понижение pH. Когда дыхательная система используется для компенсации метаболических нарушений pH, эффект проявляется в течение нескольких минут или часов.
Почечная система влияет на pH, реабсорбируя бикарбонат и выводя фиксированные кислоты. Будь то патология или необходимая компенсация, почки выводят или реабсорбируют эти вещества, влияющие на pH. Нефрон — функциональная единица почки. Кровеносные сосуды, называемые клубочками, транспортируют вещества, обнаруженные в крови, в почечные канальцы, так что некоторые из них могут быть отфильтрованы, а другие реабсорбируются в кровь и рециркулируются. Это верно для ионов водорода и бикарбоната. Если бикарбонат реабсорбируется и / или кислота выделяется с мочой, pH становится более щелочным (увеличивается).Когда бикарбонат не реабсорбируется или кислота не выводится с мочой, pH становится более кислым (снижается). Компенсация метаболизма почечной системой занимает больше времени: дни, а не минуты или часы.
Функция
Физиологический pH человеческого тела важен для многих процессов, необходимых для жизни, включая доставку кислорода к тканям, правильную структуру белка и бесчисленные биохимические реакции, которые зависят от нормального pH, чтобы быть в равновесии и полноте.
Доставка кислорода в ткани
Кривая диссоциации кислорода представляет собой график, изображающий отношение парциального давления кислорода к насыщению гемоглобина. Эта кривая относится к способности гемоглобина доставлять кислород к тканям. Если кривая смещена влево, p50 уменьшается, а это означает, что количество кислорода, необходимое для насыщения гемоглобина на 50%, уменьшается и что сродство гемоглобина к кислороду увеличивается. Этот сдвиг влево вызывает pH в алкалотическом диапазоне.Когда происходит снижение pH, кривая смещается вправо, что указывает на снижение сродства гемоглобина к кислороду.
Структура белка
Трудно переоценить важность белков в организме человека. Они составляют ионные каналы, переносят необходимые липофильные вещества по всему нашему в основном липофобному телу и участвуют в бесчисленных биологических процессах. Чтобы белки выполняли необходимые функции, они должны быть в правильной конфигурации.Заряды белков — это то, что позволяет им существовать в правильной форме. Когда pH изменяется за пределы физиологического диапазона, эти заряды изменяются. Белки денатурируются, что приводит к пагубным изменениям в архитектуре, вызывающим потерю надлежащей функции.
Биохимические процессы
В организме человека многие химические реакции находятся в равновесии. Один из наиболее важных ранее упоминался в уравнении:
Принцип Ле Шателье гласит, что при изменении переменных концентрации, давления или температуры система в равновесии соответствующим образом отреагирует, чтобы восстановить новое устойчивое состояние.Для приведенной выше реакции это означает, что если образуется больше ионов водорода, уравнение сдвинется влево, так что образуется больше реагентов, и система может оставаться в равновесии. Так работают компенсаторные механизмы pH; если имеется метаболический ацидоз, почки не выделяют достаточно ионов водорода и / или не реабсорбируют достаточное количество бикарбонатов. Дыхательная система реагирует увеличением минутной вентиляции (часто путем увеличения частоты дыхания) и выдыханием большего количества CO2 для восстановления равновесия.[5]
Сопутствующее тестирование
Отбор проб газов артериальной крови (ГКК) — это тест, который часто выполняется в стационарных условиях для оценки кислотно-щелочного статуса пациента. Для забора крови из артерии, часто лучевой, используется игла, и кровь анализируется для определения таких параметров, как pH, pC02, pO2, HCO3, сатурация кислорода и другие. Это позволяет врачу лучше понять состояние пациента. ГД особенно важны для тяжелобольных. Они являются основным инструментом, который используется для адаптации к потребностям пациента на аппарате ИВЛ.Ниже приведены наиболее важные нормальные значения для ABG:
Способность быстро и эффективно читать ABG, особенно в отношении стационарной медицины, имеет первостепенное значение для качественного ухода за пациентом.
Посмотрите на pH
Определите, является ли он ацидотическим, щелочным или находится в пределах физиологического диапазона
Уровень PaCO2 определяет респираторный вклад; высокий уровень означает, что дыхательная система снижает pH, и наоборот.
Уровень HCO3- обозначает метаболический / почечный эффект. Повышенный уровень HCO3- увеличивает pH и наоборот.
Если pH является ацидотическим, ищите число, которое соответствует более низкому pH. Если это респираторный ацидоз, уровень CO2 должен быть высоким. Если у пациента метаболическая компенсация, уровень HCO3- также должен быть высоким. Метаболический ацидоз будет обозначен низким значением HCO3-.
Если pH является щелочным, снова определите, какое значение вызывает это.Респираторный алкалоз означает низкий уровень CO2; метаболический алкалоз должен давать высокий уровень HCO3. Компенсация в любой системе будет отражена противоположным образом; при респираторном алкалозе метаболическая реакция должна быть низкой HCO3-, а при метаболическом алкалозе респираторная реакция должна быть высокой.
Если уровень pH находится в физиологическом диапазоне, но PaCO2 и / или бикарбонат не находятся в пределах нормы, вероятно, имеется смешанное заболевание. Кроме того, компенсация не всегда происходит; именно тогда клиническая информация приобретает первостепенное значение.
Иногда бывает трудно установить, есть ли у пациента смешанное заболевание. Об этом позже.
Другие тесты, которые важно выполнять при анализе кислотно-основного статуса пациента, включают те, которые измеряют уровни электролитов и функцию почек. Это помогает врачу собрать информацию, которая может быть использована для определения точного механизма кислотно-щелочного дисбаланса, а также факторов, способствующих возникновению расстройств. [6] [3]
Патофизиология
Метаболический ацидоз с увеличением анионной щели
Первичный метаболический ацидоз, то есть первичное кислотно-основное нарушение, имеет множество причин.Они разделяются на те, которые вызывают высокий анионный разрыв, и те, которые не вызывают. Анионный разрыв в плазме помогает врачам определить причину метаболического ацидоза. Когда присутствует метаболический ацидоз, измеряются определенные ионы в крови, которые помогают определить этиологию ацидемии. Анионная щель увеличивается всякий раз, когда бикарбонат теряется из-за его объединения с ионом водорода, который ранее был присоединен к основанию конъюгата. Когда бикарбонат соединяется с ионом водорода, образуется угольная кислота (h3CO3).Основанием конъюгата может быть любой отрицательно заряженный ион, не являющийся бикарбонатом или хлоридом.
Формула для анионной щели:
Люди электрически нейтральны, но все катионы и анионы не измеряются. Нормальный анионный разрыв равен 8 +/- 4. Большая часть этого числа приходится на альбумин; этот анион не учитывается в формуле, что является важной причиной того, что зазор не приближается к нулю. Альбумин обычно составляет 4 мг / дл. Из-за большого влияния альбумина на анионный разрыв, если уровень альбумина у пациента ненормальный, их ожидаемый анионный разрыв не будет точным.Это можно исправить с помощью простой математики. Нормальный анионный интервал и уровень альбумина различаются в три раза (нормальный анионный интервал 12, нормальный альбумин 4 мг / дл). Если у пациента величина анионной щели равна 24, это означает, что присутствует 12 единиц конъюгированного основания, что обычно не связано с комбинацией ионов водорода с бикарбонатом. Если у этого же пациента уровень альбумина 3 мг / дл, их ожидаемый анионный разрыв должен фактически составлять около 9. Это означает, что вместо 12 единиц присутствующего конъюгированного основания на самом деле имеется 15 единиц.
Более сложный метод анализа ионного вклада в изменение pH — это сильная ионная разница / сильная ионная щель. Этот метод подчеркивает влияние других ионов на кислотно-щелочной баланс и полезен для изучения кислотно-щелочного баланса. Однако этот подход более обременительный, чем стандартная анионная щель, и требует дополнительных расчетов. Поэтому многие считают, что его использование в клинической практике ограничено.
Мнемоника МУДПИЛЫ классически использовалась для обучения студентов причинам метаболического ацидоза с высокой анионной щелью.МУДПИЛЫ означает метанол, уремию, диабетический кетоацидоз, паральдегид, инфекцию, лактоацидоз, этиленгликоль и салицилаты. Было предложено усовершенствовать новую мнемонику GOLDMARK. GOLDMARK — это анаграмма для гликолей (этилена и пропилена), оксопролина, лактата, метанола, аспирина, почечной недостаточности и кетонов. Если у пациента наблюдается анионный разрыв более 12, эти мнемоники помогают запомнить возможные причины расстройства. [7] [8]
Метаболический ацидоз с узкой анионной щелью
Если ацидоз затрагивает нормальную анионную щель, происходит потеря бикарбоната, а не повышенное количество ионов водорода с сопутствующим увеличением ионов хлора.Чтобы сохранить физиологически нейтральное состояние, ионы хлора мигрируют из клеток во внеклеточное пространство. Это вызывает повышение уровня хлорида в сыворотке крови пациента и поддерживает нормальный уровень анионной щели. Это означает, что метаболический ацидоз без аномальной анионной щели также является гиперхлоремическим метаболическим ацидозом. Метаболический ацидоз без увеличения анионной щели является результатом многих процессов, включая тяжелую диарею, почечный канальцевый ацидоз (RTA) I типа, длительный прием ингибиторов карбоангидразы и отсасывание желудочного содержимого.Когда у пациента гиперхлоремический ацидоз с узкой ионной щелью, врач может рассчитать анионную щель мочи (UAG), чтобы определить этиологию.
Ниже приводится уравнение для анионного разрыва мочи, где Na — натрий, K — калий и Cl — хлорид:
Почечная система пытается смягчить последствия патологического метаболического ацидоза путем выделения аммония (Nh5 +) с мочой. UAG от 20 до 90 мэкв / л означает низкую или нормальную секрецию Nh5 +. От -20 мэкв / л до -50 мэкв / л предполагает, что основной причиной метаболического ацидоза является продолжительная тяжелая диарея.
Еще одна важная формула, которую можно использовать при метаболическом ацидозе, — это формула Winter. Это уравнение дает врачу ожидаемое значение PCO2. Это важно, потому что может присутствовать другое кислотно-основное нарушение.
Формула Винтера:
Если значение PCO2 находится в пределах ожидаемого PCO2, смешанного расстройства нет, только респираторная компенсация. Когда значение ниже или выше ожидаемого, наблюдается смешанный беспорядок; ниже означало бы респираторный алкалоз, а выше — респираторный ацидоз.Сокращение для формулы Winter состоит в том, что последние две цифры pH +/- 2 примерно равны ожидаемому PCO2. [9] [10]
Респираторный ацидоз
Во время выдоха углекислый газ, производимый клеточным дыханием, выбрасывается в окружающую среду. В организме человека углекислый газ соединяется с водой через карбоангидразу и образует угольную кислоту, которая диссоциирует на ион водорода и бикарбонат. Вот почему снижение частоты дыхания приведет к снижению pH; чем больше углекислого газа выдыхается, тем меньше углекислого газа присутствует в этой реакции.
Респираторный ацидоз как первичное заболевание часто вызывается гиповентиляцией. Это может быть связано с множеством причин, включая хроническую обструктивную болезнь легких, злоупотребление / передозировку опиатами, тяжелое ожирение и травму головного мозга. Когда возникает респираторный ацидоз, метаболический ответ должен заключаться в увеличении количества бикарбоната через почечную систему. Это происходит не всегда, и почечная патология может легко препятствовать соответствующему физиологическому ответу, что приводит к повышенной опасности для пациента.
Метаболический алкалоз
Метаболический алкалоз также можно разделить на две основные категории, которые помогают установить причину: чувствительный к хлоридам и нечувствительный к хлоридам. При метаболическом алкалозе, нечувствительном к хлоридам, содержание хлоридов в моче составляет <20 мэкв / л. Некоторые причины включают рвоту, гиповолемию и прием мочегонных средств.
Респираторный алкалоз
Любая патология, приводящая к повышенному выделению углекислого газа, может привести к респираторному алкалозу.Когда избыток CO2 выдыхается, pH человеческого тела увеличивается из-за того, что образуется меньше углекислоты. Физиологически подходящей компенсацией является уменьшение количества бикарбоната, вырабатываемого почечной системой. Некоторые причины респираторного алкалоза включают панические атаки с гипервентиляцией, тромбоэмболию легочной артерии, пневмонию и салицилатную интоксикацию. [11]
Клиническая значимость
Кислотно-щелочной баланс в организме человека — один из важнейших физиологических процессов.Клиническое значение кислотно-щелочного баланса трудно отрицать. Некоторые из наиболее частых госпитализаций связаны с заболеваниями, которые могут серьезно повлиять на кислотно-щелочной баланс. Вот почему клиницистам важно понимать основные принципы, которые управляют этой частью гомеостаза человека.
Список литературы
- 1.
- Цао Й, Ван М., Юань Й, Ли Ц., Бай Кью, Ли М. Газы артериальной крови и кислотно-щелочной баланс у пациентов с синдромом гипертонии, вызванной беременностью.Exp Ther Med. 2019 Янв; 17 (1): 349-353. [Бесплатная статья PMC: PMC6307481] [PubMed: 30651802]
- 2.
- Кастро Д., Патил С.М., Кинаган М. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 29 июля 2021 г. Газ артериальной крови. [PubMed: 30725604]
- 3.
- Патель С., Шарма С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 24 июня 2021 г. Респираторный ацидоз. [PubMed: 294]
- 4.
- Бринкман Дж. Э., Шарма С. StatPearls [Интернет].StatPearls Publishing; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, метаболический алкалоз. [PubMed: 294
]
- 5.
- Бринкман Дж. Э., Шарма С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 26 июля 2021 г. Респираторный алкалоз. [PubMed: 29489286]
- 6.
- Rajkumar P, Pluznick JL. Кислотно-щелочная регуляция в проксимальных канальцах почек: использование новых датчиков pH для поддержания гомеостаза. Am J Physiol Renal Physiol. 01 ноября 2018; 315 (5): F1187-F1190.[Бесплатная статья PMC: PMC62] [PubMed: 30066586]
- 7.
- Burger MK, Schaller DJ. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 26 июля 2021 г. Метаболический ацидоз. [PubMed: 29489167]
- 8.
- Марано М. [Об использовании формулы Винтерса при хроническом метаболическом ацидозе]. Преподобный Псикиатр Салуд Мент. 2015, январь-март; 8 (1): 45-6. [PubMed: 25434279]
- 9.
- Беренд К. Обзор диагностической оценки метаболического ацидоза с нормальным анионным зазором.Почки Дис (Базель). 2017 декабрь; 3 (4): 149-159. [Бесплатная статья PMC: PMC5757610] [PubMed: 209]
- 10.
- Шарма С., Хашми М.Ф., Аггарвал С. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 14 августа 2021 г. Гиперхлоремический ацидоз. [PubMed: 294]
- 11.
- Raphael KL, Ix JH. Корреляция уровня аммония в моче и осмоляльного разрыва мочи у реципиентов трансплантата почки. Clin J Am Soc Nephrol. 2018 Апрель 06; 13 (4): 638-640. [Бесплатная статья PMC: PMC5969467] [PubMed: 29519951]
pH крови — обзор
Лабораторные исследования кислотно-основных нарушений
Определение pH плазмы позволяет диагностировать некомпенсированный ацидоз или алкалоз; однако он не предоставляет информации относительно основной причины расстройства.Более того, в компенсированных ситуациях pH нормальный, и это затрудняет оценку кислотно-щелочного нарушения.
Кислотно-основные изменения характеризуются изменениями абсолютных значений HCO3- и CO 2 , что подчеркивает клиническую значимость буферной системы HCO3- / CO2.
Согласно уравнению Хендерсона – Хассельбаха:
(28,1) pH = 6,1 + log [HCO3 -] / [CO2]
Две переменные (pH и [CO 2 ]) из трех, присутствующих в уравнении. можно измерить напрямую.PH и PCO2 определяют потенциометрическими методами. [CO 2 ] в миллимолях на литр получается из произведения PCO2 (в мм рт. Ст.) И коэффициента растворимости CO 2 в плазме (α = 0,0301 мМ / л / мм рт. Ст.):
(28,2) [ CO2] = α⋅PCO2 = 0,0301⋅PCO2
Знание двух переменных в уравнении позволяет вычислить третью, в данном случае [HCO3-]:
[HCO3 -] = (0,0301⋅PCO2) ⋅антилог (pH −6,1)
Существуют объемные методы, которые в настоящее время используются редко, для измерения общего количества CO в плазме 2 .Общий CO 2 представляет собой сумму физически растворенного CO 2 и бикарбоната:
Общий CO2 = [HCO3 -] + [CO2]
откуда:
[HCO3 -] = Общий CO2 — [CO2]
, подставив значение [CO 2 ] (уравнение 28.2):
[HCO3 -] = Total CO2⋅ (0,0301 PCO2)
и подставив в уравнение. (28.1):
pH = 6,1 + logCO2 total- (0,0301⋅PCO2) (0,0301⋅PCO2)
Доступны номограммы, которые позволяют получить значение оставшейся переменной, если известны две из них.Следует отметить, что в клиниках часто бывают сложные случаи. Компенсирующие механизмы и изменения, добавленные к основной причине нарушения pH, иногда затрудняют интерпретацию патологического состояния.
Еще одним параметром, используемым для оценки нарушений pH, является оценка метаболического компонента ([HCO3-]), который обозначается как избыток оснований . Он рассчитывается на основе значений pH, PCO2 и концентрации гемоглобина с использованием уравнения, разработанного Siggaard – Andersen.Были разработаны номограммы, которые показывают величину избытка оснований непосредственно на основе значений pH, PCO2 и гемоглобина.
При нормальных условиях (pH 7,4, PCO2 40 мм рт. базовый избыток », что на самом деле означает базовый дефицит. При метаболическом ацидозе избыток основания отрицательный, а при метаболическом алкалозе избыток основания положительный. При респираторных заболеваниях избыток основания изначально равен 0.
Знание величины избытка оснований полезно для руководства лечением пациентов с кислотно-щелочными нарушениями. Следует отметить, что из-за процессов компенсации pH необходимы серийные измерения, чтобы лучше оценить избыток щелочи у пациента во время болезни.
Помимо pH и общего CO 2 , диагностика изменений pH требует определения концентраций анионов и катионов в плазме. Обычно измеряются Na + , K + и Cl — .Остальные анионы (сульфаты, фосфаты, белки) и катионы (Ca 2+ , Mg 2+ ) не измеряются в рутинных исследованиях, но оцениваются косвенно. Поскольку жидкости организма всегда сохраняют электрическую нейтральность, сумма положительных и отрицательных зарядов в плазме равна ([катион] = [анион]), даже если концентрация одного из них может изменяться.
Na + и K + в плазме составляют около 95% всех катионов, в то время как Cl — и HCO3- составляют 85% анионов.Оставшиеся отрицательные заряды, известные как плазменный анионный зазор , составляют примерно 15% от общего количества и представлены в основном фосфатами, сульфатами и белками. Концентрацию этих анионов можно оценить по следующему уравнению:
Плазменная анионная щель = ([Na +] + [K +]) — ([Cl -] + [HCO3-])
Нормальное значение для анионной щели составляет от 10 до 15 мэкв. / л. Определение плазменной анионной щели полезно для определения причины метаболического ацидоза. Его уровень повышен при метаболическом ацидозе (т.э., лактоацидоз).
4.2: Буферизация — Medicine LibreTexts
Основной буферной системой в ECF является буферная система CO 2 -бикарбонат. Это отвечает за около 80% внеклеточной буферизации. Это наиболее важный буфер ECF для метаболических кислот, но он не может буферизовать респираторные кислотно-щелочные нарушения.
Компоненты легко измерить и связаны друг с другом уравнением Хендерсона-Хассельбаха.
\ [pH = pKa + \ log_ {10} (\ frac {[HCO_ {3}]} {0.03}) \ times \: pCO_ {2} \]
Значение pKa зависит от температуры, [H + ] и концентрации ионов в растворе. Он имеет значение 6,099 при температуре 37 ° C и pH плазмы 7,4. При температуре 30 ° C и pH 7,0 он имеет значение 6,148. Для практических целей обычно принимается значение 6,1, и поправки на температуру, pH плазмы и ионную силу не используются, за исключением точных экспериментальных работ.
Примечание к терминологии: Ka — константа равновесия для реакции диссоциации кислоты.{-}]} {[CO_ {2}] \ cdot [H_ {2} O]} \]
Концентрация H 2 O настолько невероятно велика (55,5 M или 55 500 ммоль / л) по сравнению с другими компонентами, что небольшая потеря воды из-за этой реакции изменяет его концентрацию только на очень малую величину. Чтобы понять, что это означает, представьте, что у вас есть 100 миллионов долларов в банке, и вы раздаете 1 доллар. Сумма, которая изменилась на вашем банковском счете по отношению к общей сумме, настолько мала, что у вас все еще есть 100 миллионов долларов в банке.{-}]} {0.03pCO_ {2}} \]
Примечание
О различии между pKa и p’Ka обычно забывают, и уравнение Хендерсона-Хассельбаха всегда записывается как pKa
По химическим соображениям, вещество с pKa 6,1 не должно быть хорошим буфером при pH 7,4, если это простой буфер. Система более сложная, так как она открыта с обоих концов (это означает, что и [HCO 3 –], и pCO 2 могут быть отрегулированы), и это значительно увеличивает эффективность буферизации этой системы.Экскреция CO 2 через легкие является ключевым моментом из-за скорости реакции. Регулировка pCO 2 путем изменения альвеолярной вентиляции называется физиологической буферизацией .
Примечание: это использование слова буферизация в более широком смысле означает что-то, что сопротивляется изменению свойства, и отличается от определения буферизации (или «физиологической буферизации»), приведенного в верхней части этой страницы. Этот сдвиг в значении буферизации может сбивать с толку, потому что слово «буферизация» в основном используется в речи и в статьях без определения «физико-химический» или «физиологический» (или какого-либо уточняющего слова).
Бикарбонатная буферная система является эффективной буферной системой, несмотря на низкий pKa, поскольку организм также контролирует pCO
2Введение в кислотно-щелочной баланс в медицине и болезнях
Нормальный метаболизм клеток зависит от поддержания pH в крови. в очень узких пределах (7,35-7,45).
Даже относительно мягкий экскурсии за пределы этого нормального диапазона pH могут иметь вредные эффекты, в том числе снижение доставки кислорода к тканям, электролит нарушения и изменения сократимости сердечной мышцы; выживание редко, если pH крови падает ниже 6.8 или выше 7,8.
Проблема для организма в том, что нормальный обмен веществ связан с непрерывное производство ионов водорода (H +) и углекислого газа (CO 2 ), оба из которых имеют тенденцию к снижению pH. Механизм который решает эту проблему и служит для поддержания нормального pH крови (т.е. сохранение кислотно-щелочного гомеостаза) представляет собой сложную синергию действие с участием химических буферов в крови, эритроцитов (эритроциты), которые циркулируют в крови, и функция трех органы: легкие, почки и мозг.
Прежде чем объяснять, как эти пять элементы способствуют общему поддержанию pH крови, это было бы полезно быстро изучить некоторые основные концепции.
Что такое кислота, что такое основание и что такое pH?
Кислота — вещество, выделяющее ионы водорода (H + ) при диссоциации в растворе.
Например: соляная кислота (HCl) диссоциирует до водорода. ионы и хлорид-ионы
HCl H + + Cl —
Угольная кислота (H 2 CO 3 ) диссоциирует до ионы водорода и бикарбонат-ионы
H 2 CO 3 H + + HCO 3 —
Мы различаем сильные кислоты, такие как соляная кислота и слабые кислоты, такие как угольная кислота.Разница в том, что сильные кислоты диссоциируют больше, чем слабые кислоты. Следовательно, ион водорода концентрация сильной кислоты намного выше, чем у слабой кислота.
A base — это вещество, которое в растворе принимает ионы водорода.
Например, основной бикарбонат (HCO 3 — ) принимает ионы водорода с образованием угольной кислоты:
HCO 3 — + H + H 2 CO 3
pH — это шкала кислотности и щелочности от 0 до 14.Чистая вода имеет pH 7 и нейтральный (ни кислый, ни щелочной). pH выше 7 является щелочным и ниже 7 кислым. Таким образом, pH крови (7,35-7,45) составляет слабощелочной, хотя в клинической медицине термин алкалоз это, возможно, сбивает с толку, зарезервировано для pH крови выше 7,45 а термин ацидоз используется для обозначения pH крови менее 7,35.
pH — это мера концентрации ионов водорода (H + ). Эти двое связаны следующим образом уравнение:
pH = — лог 10 [H + ]
где [H + ] — концентрация ионов водорода в моль на литр (моль / л)
Из этого уравнения
pH 7.4 = H + концентрация 40 нмоль / л
pH 7,0 = H + концентрация 100 нмоль / л
pH 6,0 = H + концентрация 1000 нмоль / л
Понятно, что:
- два параметра изменяются обратно пропорционально; как ион водорода концентрация увеличивается, pH падает
- из-за логарифмической связи большое изменение Концентрация водородных ионов — это на самом деле небольшое изменение pH. Например, удвоение концентрации ионов водорода вызывает pH упасть всего на 0.3
Что такое буфер? — бикарбонатная буферная система
Буферы — это химические вещества в растворе, которые минимизируют изменение pH, которое происходит, когда кислоты добавляются путем «вытирания» ионы водорода. Буфер — это раствор слабой кислоты и ее сопряженное основание. В крови основная буферная система — слабая кислота, угольная кислота (H 2 CO 3 ) и ее конъюгат основа, бикарбонат (HCO 3 — ). Чтобы объяснить, как эта система минимизирует изменения pH, предположим, мы добавляем сильную кислоту, е.г. HCl, к бикарбонатному буферу:
Кислота диссоциирует, высвобождая ионы водорода:
HCl H + + Класс —
Затем бикарбонатный буфер «поглощает» ионы водорода, образуя угольная кислота в процессе:
HCO 3 — + H + H 2 CO 3 (угольная кислота)
Важным моментом является то, что, поскольку ионы водорода из HCl были включены в слабую угольную кислоту, которая не диссоциировать так же легко, общее количество ионов водорода в растворе и, следовательно, pH не изменится так сильно, как это могло бы произойти. при отсутствии буфера.
Хотя буфер сильно минимизирует изменение pH, это не устраняет его, потому что даже слабая кислота (например, угольная кислота) до некоторой степени диссоциирует. PH буфера раствор является функцией относительных концентраций слабых кислота и сопряженное с ней основание.
pH = 6,1 + log ([HCO 3 — ] / [H 2 CO 3 ])
Где [HCO 3 — ] = концентрация бикарбонат
[H 2 CO 3 ] = концентрация угольной кислоты
Это соотношение, известное как уравнение Хендерсона-Хассельбаха, показывает, что pH определяется соотношением оснований (HCO 3 — ) концентрация в кислоте (H 2 CO 3 ) концентрации.
По мере добавления ионов водорода в бикарбонатный буфер:
H + + HCO 3 – H 2 CO 3
бикарбоната (основания) расходуется (концентрация снижается) и образуется угольная кислота (концентрация увеличивается). Если водород ионы продолжают добавляться, весь бикарбонат в конечном итоге будет потребляется (превращается в угольную кислоту), и не будет буферный эффект — pH резко упадет, если будет больше кислоты добавлен.
Однако, если угольная кислота могла быть непрерывно удалена из система и бикарбонат постоянно регенерируются, затем буферная способность и, следовательно, pH может поддерживаться, несмотря на продолжение добавления ионов водорода.
Как станет ясно при более детальном рассмотрении физиологии кислотно-щелочной баланс, то есть, по сути, то, что происходит в организме. В сущность, легкие обеспечивают удаление угольной кислоты (в виде углерода диоксид) и почки обеспечивают постоянную регенерацию бикарбонат.
Эта роль легких зависит от единственного характеристика буферной системы бикарбоната, и это способность угольной кислоты превращаться в диоксид углерода и вода.
Следующее уравнение описывает взаимосвязь всех элементы системы буферизации бикарбоната, как она работает в кузов
H + + HCO 3 – H 2 CO 3 H 2 O + CO 2
Важно отметить, что реакции обратимы.Направление зависит от относительной концентрации каждого элемент. Так что, например, повышение углекислого газа концентрация сил реакция влево с усилением образования угольной кислоты и, наконец, ионов водорода.
Это объясняет кислотный потенциал углекислого газа и подводит нас к важному вклад легких и эритроцитов в общую кислотно-щелочную остаток средств.
Функция легких, перенос CO
2 и кислотно-щелочной балансПостоянное количество CO 2 в крови, необходимое для нормального кислотно-щелочной баланс, отражает баланс между результат метаболизма тканевых клеток и выводится из легких в выдыхаемый воздух.
Путем изменения скорости, с которой углекислый газ выводятся из организма, легкие регулируют содержание углекислого газа в крови. Последовательность событий от производства углекислого газа в удаление тканей в выдыхаемом воздухе показано на рис.1. Углекислый газ диффундирует из клеток ткани в окружающую среду. капиллярная кровь (рис. 1а). Небольшая часть растворяется в крови плазма и в неизмененном виде транспортируется в легкие.
Но наиболее распространен в эритроциты, где он соединяется с водой с образованием угольной кислоты.Кислота диссоциирует с образованием ионов водорода и бикарбонат. Ионы водорода соединяются с дезоксигенированным гемоглобином. (гемоглобин здесь действует как буфер), предотвращая опасное падает в клеточном pH, и бикарбонат диффундирует по концентрации градиент от эритроцитов к плазме.
Таким образом, большая часть углекислого газа вырабатывается в тканях, переносится в легкие в виде бикарбоната. в плазме крови.
Рис. 1а . CO 2 производится в тканях превращается в бикарбонат для переноса в легкие.
|
Рис. 1b .В легких преобразуется бикарбонат обратно к CO 2 и выводится легкими.
В альвеолах легких процесс обратный (рис. 1б). Ионы водорода вытесняются из гемоглобина, поскольку он поглощает кислород. из вдыхаемого воздуха. Ионы водорода теперь буферизированы бикарбонат, который диффундирует из плазмы обратно в эритроциты, и образуется угольная кислота. По мере того, как концентрация этого повышается, это превращается в воду и углекислый газ. Наконец, углекислый газ диффундирует вниз по градиенту концентрации от эритроцитов к альвеолам для выделение с выдыхаемым воздухом.
Респираторные хеморецепторы ствола головного мозга реагируют на изменения в концентрации углекислого газа в крови, вызывая повышенное вентиляция (дыхание) при повышении концентрации углекислого газа и снижение вентиляции при падении углекислого газа.
Почки и кислотно-щелочной баланс
Нормальный клеточный метаболизм приводит к постоянному производство ионов водорода. Мы видели это, объединив с эти ионы водорода, бикарбонатный буфер в крови сводит к минимуму их эффект.Однако буферизация полезна только в краткосрочной перспективе, и в конечном итоге ионы водорода должны быть удалены из организма. Кроме того, важно, чтобы бикарбонат, используемый для буферные ионы водорода непрерывно заменяются.
Эти две задачи, устранение ионов водорода и регенерация бикарбоната, являются осуществляется почками. Клетки почечных канальцев богаты фермент карбоангидраза, который способствует образованию углекислого газа. кислота из углекислого газа и воды. Угольная кислота диссоциирует на бикарбонат и ионы водорода.Бикарбонат реабсорбируется в кровь и ионы водорода переходят в просвет канальца и выводятся из организма с мочой.
Это выделение с мочой зависит от наличия в моче буферов, в основном ионы фосфата и аммиака.
НАРУШЕНИЯ КИСЛОТНО-ОСНОВНОГО БАЛАНСА
Большинство кислотно-щелочных нарушений возникает из-за
- заболевание или повреждение органов (почки, легкие, мозг), чьи нормальное функционирование необходимо для кислотно-щелочного гомеостаза,
- болезнь, вызывающая аномально повышенное производство метаболические кислоты такие, что гомеостатические механизмы подавлено
- медицинское вмешательство (эл.г. механическая вентиляция, некоторые наркотики)
Газы артериальной крови — это анализ крови, используемый для определения и следить за кислотно-щелочными нарушениями. Три параметра, измеренные во время анализ газов крови, pH (pH) артериальной крови, парциальное давление углекислый газ в артериальной крови ( p CO 2 (a)) и концентрация бикарбоната (HCO 3 — ) составляет решающее значение (см. Таблицу I для справочного (нормального) диапазона). Результаты этих трех позволяют классифицировать кислотно-основные нарушение одной из четырех этиологических категорий:
- Респираторный ацидоз
- Респираторный алкалоз
- Метаболический ацидоз
- Метаболический алкалоз
Взрослые | Новорожденные | |
pH | 7.35-7.45 | 7.30-7.40 |
p CO 2 (кПа) | 4,7-6,0 | 3,5-5,4 |
Бикарбонат (ммоль / л) | 22-28 | 15-25 |
ТАБЛИЦА I. Примерное эталонное (нормальное) диапазоны
Чтобы понять, как результаты pH, p CO 2 (a) и бикарбонат используются для классификации кислотно-основных нарушений в этом Кстати, мы должны вернуться к уравнению Хендерсона-Хассельбаха
pH = 6,1 + log ([HCO 3 –] / [H 2 CO 3 ])
Мы измеряем pH и уровень бикарбоната, но не угольной кислоты. (H 2 CO 3 ). Однако есть связь между p CO 2 (a) и H 2 CO 3 что позволяет переформулировать уравнение Хендерсона-Хассельбаха в условия трех параметров (pH, p CO 2 (a) и бикарбонат), измеренный во время анализа газов крови:
pH = 6.1 + журнал ([HCO 3 — ] / ( п CO 2 (а) × 0,23))
Удалив все константы из этого уравнения, соотношение между тремя измеряемыми параметрами может быть проще заявлено:
pH ∝ [HCO 3 — ] / p CO 2 (а)
Эти отношения имеют решающее значение для понимания всего этого. о нарушениях кислотно-щелочного баланса, заявляет, что артериальная pH крови пропорционален соотношению концентраций бикарбоната to p CO 2 (a).Это позволяет следующее отчисления:
- pH остается нормальным, пока соотношение [HCO 3 –]: p CO 2 (a) остается в норме
- pH увеличивается (т.е. возникает алкалоз), если либо [HCO 3 –] увеличивается или p CO 2 (а) убывает.
- pH снижается (т.е. возникает ацидоз), если либо [HCO 3 — ] уменьшается или p CO 2 (а) увеличивает
- Если и то и другое p CO 2 (a) и [HCO 3 — ] увеличиваются относительно такое же количество, соотношение и, следовательно, pH в норме
- Если оба p CO 2 (a) и [HCO 3 –] являются уменьшились примерно на такую же величину, соотношение и следовательно, pH в норме.
Кислотно-основные нарушения влияют в первую очередь p CO 2 (a), в этом случае он называется респираторное нарушение или [HCO 3 –], в этом случае он называется не респираторные или метаболические нарушение:
- Если первичная помеха — повышенная p CO 2 (a) (вызывающий ацидоз — см. выше), состояние называется респираторный ацидоз
- Если первичное возмущение уменьшается p CO 2 (a) (вызывающий алкалоз — см. выше), состояние называется респираторный алкалоз
- Если первичное нарушение связано с уменьшенным бикарбонат (который приводит к ацидозу — см. выше), состояние называется метаболический ацидоз
- Если первичное нарушение связано с повышенным бикарбонат (который приводит к алкалозу — см. выше), состояние называется метаболический алкалоз
Причины кислотно-щелочных нарушений
Респираторный ацидоз — (повышенный
p CO 2 (a), пониженный pH)Респираторный ацидоз характеризуется повышенным p CO 2 (a) из-за неадекватной альвеолярной вентиляции (гиповентиляция) и, как следствие, снижение выведения CO 2 из крови.Респираторные заболевания, такие как бронхопневмония, эмфизема, астма и хроническая обструкция дыхательных путей болезнь, все могут быть связаны с гиповентиляцией, достаточной для вызывают респираторный ацидоз.
Некоторые наркотики (например, морфин и барбитураты) могут вызывать респираторный ацидоз, подавляя дыхательный центр в головном мозге. Повреждение или травма грудной клетки и мускулатура, участвующая в механике дыхания, может снизить скорость вентиляции. Это объясняет респираторный ацидоз. которые могут осложнить течение таких заболеваний, как полиомиелит, Синдром Гийена-Барре и восстановление после тяжелой травмы грудной клетки.
Респираторный алкалоз — (сниженный
p CO 2 (а), повышенный pH)Напротив, респираторный алкалоз характеризуется уменьшением p CO 2 (a) из-за чрезмерной альвеолярной вентиляции и, как следствие, чрезмерное удаление CO 2 из крови. Заболевание, при котором из-за пониженного содержания кислорода в крови (гипоксемия) дыхательный центр стимулируется может привести к респираторному алкалоз.
Примеры включают тяжелую анемию, тромбоэмболию легочной артерии. и респираторный синдром взрослых.Гипервентиляции, достаточной для вызывать респираторный алкалоз может быть признаком приступов паники и реакция на сильную боль. Одно из наименее желанных свойств салицилат (аспирин) оказывает стимулирующее действие на дыхательные пути. центр. Этот эффект объясняет респираторный алкалоз, который возникает после передозировки салицилатом. Наконец, чрезмерный энтузиазм искусственная вентиляция легких может вызвать респираторный алкалоз.
Метаболический ацидоз — (уменьшено HCO
3 — , пониженный pH)Пониженный уровень бикарбоната всегда является признаком метаболизма. ацидоз.Это происходит по одной из двух причин: более частое использование бикарбонат для буферизации аномальной кислотной нагрузки или повышенных потерь гидрокарбоната из организма. Диабетический кетоацидоз и молочный ацидоз — это два состояния, характеризующихся перепроизводством метаболические кислоты и последующее истощение бикарбоната.
В первый случай, аномально высокая концентрация кетокислот в крови (b-гидроксимасляная кислота и ацетоуксусная кислота) отражают тяжелые метаболические нарушения, вызванные инсулином дефицит.
Все клетки производят молочную кислоту, если они испытывают недостаток кислорода, так увеличилось производство молочной кислоты и, как следствие, метаболизм ацидоз возникает в любом состоянии, при котором доставка кислорода к ткани серьезно повреждены.
Примеры включают остановку сердца. и любое состояние, связанное с гиповолемическим шоком (например, массивный потеря жидкости). Печень играет важную роль в удалении мелких количество молочной кислоты, которая вырабатывается в нормальных клетках метаболизм, так что лактоацидоз может быть особенностью печени отказ.
Аномальная потеря бикарбоната из организма может произойти во время сильный понос. Если этот параметр не отмечен, это может привести к метаболическому ацидозу. Неспособность регенерировать бикарбонат и выводить ионы водорода объясняет метаболический ацидоз, возникающий в почечной отказ.
Метаболический алкалоз — (повышенный HCO
3 — , повышенный pH)Бикарбонат всегда повышен при метаболическом алкалозе. Редко, чрезмерное введение бикарбоната или проглатывание бикарбоната в антацидном препарате может вызвать метаболический алкалоз, но это обычно преходящий.Аномальная потеря ионов водорода из организма может быть основной проблемой. Бикарбонат, который иначе был бы расходуется на буферизацию этих потерянных ионов водорода, следовательно, накапливается в крови. Желудочный сок кислый и желудочный. аспирация или любой болезненный процесс, при котором содержимое желудка потеря из организма представляет собой потерю ионов водорода.
метательная рвота желудочным соком, например, объясняет метаболический алкалоз, который может возникать у пациентов с пилорическим стеноз. Сильное истощение калия может вызвать метаболический алкалоз. из-за взаимного отношения между водородом и калием ионы.
Компенсация — следствие кислотно-щелочного нарушение
Для жизни жизненно важно, чтобы pH не уходил слишком далеко от нормы, и организм всегда будет пытаться вернуть ненормальный уровень pH в сторону в норме при нарушении кислотно-щелочного баланса. Компенсация — это имя, данное этому процессу сохранения жизни. Понять компенсации, важно помнить, что pH регулируется соотношение [HCO 3 — ]: p CO 2 (а). Пока соотношение нормальное, pH будет нормальным.
Рассмотрим пациента с метаболическим ацидозом с низким pH. потому что бикарбонат [HCO 3 — ] низкий. К компенсировать низкий [HCO 3 — ] и восстановить самое важное отношение к норме, пациент должен снизить его p CO 2 (а). Хеморецепторы в дыхательных путях центр мозга реагирует на повышение концентрации ионов водорода (низкий pH), вызывая усиленную вентиляцию (гипервентиляцию) и тем самым повышается выведение углекислого газа; в p CO 2 (а) падает и отношение [HCO 3 –]: p CO 2 (a) возврат в сторону нормального.
Компенсация метаболического алкалоза, при котором [HCO 3 –] высокий, напротив, предполагает угнетение дыхания и, как следствие, задержка углекислого газа так что p CO 2 (a) поднимается, чтобы соответствовать увеличению в [HCO 3 — ]. Однако депрессия у дыхания есть нежелательный побочный эффект, связанный с угрозой адекватного дыхания. оксигенация тканей. По этой причине респираторная компенсация метаболический алкалоз ограничен.
Первичные нарушения p CO 2 (а) (респираторный ацидоз и алкалоз) компенсируются почечной коррекцией экскреция ионов водорода, что приводит к изменению [HCO 3 –], которые надлежащим образом компенсируют первичное изменение в p CO 2 (a).Таким образом, почечная компенсация респираторного ацидоза (повышенная p CO 2 (a)) включает повышенную реабсорбцию бикарбонат и почечная компенсация респираторного алкалоза (уменьшенный p CO 2 (a)) включает восстановленный бикарбонат реабсорбция.
Понятие кислотно-щелочного баланса при компенсации визуально представлена на рис. 2. В таблице II приведены газы крови. результаты, которые характеризуют все четыре кислотно-щелочных нарушения до и после компенсации.
Фиг.2 . «Кислотно-щелочной баланс»: компенсация. восстанавливает нормальный pH
Первичный нарушение | ||||
Респираторный ацидоз первичный прибавка дюйм p CO 2 | Репираторный алкалоз первичный уменьшение дюйм p CO 2 | Метаболический ацидоз первичный уменьшение из бикарбоната. | Метаболический алкалоз первичный прибавка из бикарбоната. | |
Некоторые общий причины | Эмфизема ХОБЛ Пневмония Депрессия репираторных центр | гипер- вентиляция Беспокойство атак Стимуляция мозга респираторный центр | Почечная недостаточность Диабетик кетоацидоз Циркуляционный сбой — клинический шок (молочная ацидоз) | Бикарбонат адми- стр. Калий истощение |
Compen- сатори механизм | почечная прибавка бикарбонат | почечная уменьшение бикарбонат | РЕСПИРА- ТОРИ уменьшение p CO 2 | РЕСПИРА- ТОРИ прибавка p CO 2 но с ограничениями компенсация sation в метаболическом алкалоз |
Начальная кровь газ результаты (без компенсации насыщенный) | pH уменьшено p CO 2 увеличено Бикарбонат нормальный | pH увеличено p CO 2 уменьшено Бикарбонат нормальный | pH уменьшено p CO 2 нормальный Бикарбонат уменьшено | pH увеличено p CO 2 нормальный Бикарбонат увеличено |
Газ крови результатов после частичное компенсация станция | pH уменьшено но ближе к нормальному p CO 2 увеличено Бикарбонат увеличено | pH увеличено но ближе к нормальному p CO 2 уменьшено Бикарбонат незначительно уменьшено | pH уменьшено но ближе к нормальный p CO 2 незначительно уменьшено Бикарбонат уменьшено | Limited компенсация сация в метаболический алкалоз |
Газ крови результатов после полный компенсация станция | pH нормальный p CO 2 увеличено Бикарбонат увеличено | pH нормальный p CO 2 уменьшено Бикарбонат уменьшено | pH нормальный p CO 2 уменьшено Бикарбонат уменьшено | Limited компенсация сация в метаболический алкалоз |
Печать дружественная версия таблицы, pdf.
ТАБЛИЦА II . Газы крови вызывают нарушения кислотно-щелочной баланс
Респираторная компенсация первичного метаболического нарушения происходит гораздо быстрее, чем метаболическая (почечная) компенсация первичное респираторное нарушение. Во втором случае компенсация происходит в течение нескольких дней, а не часов.
Если компенсация приводит к возвращение pH к норме, тогда пациент считается полностью компенсировано . Но во многих случаях компенсация возвращает pH. к нормальному без реального достижения нормальности; в таких случаях пациент считается частично компенсированным .
Для по причинам, описанным выше, метаболический алкалоз очень редко полностью компенсируется.
Смешанные кислотно-щелочные возмущения
Из приведенного выше обсуждения можно было бы предположить, что все пациенты с кислотно-щелочным нарушением страдают только одним из четыре категории кислотно-щелочного баланса. Это вполне может быть так, но в определенных обстоятельствах пациенты могут иметь более одно нарушение.
Например, рассмотрим пациента с хроническим заболевание легких, такое как эмфизема, которая имеет давнюю частичную компенсированный респираторный ацидоз.Если бы этот пациент также был диабетик, который не принял нормальную дозу инсулина, и в результате находился в состоянии диабетического кетоацидоза, результаты анализа газов крови отражают комбинированный эффект респираторного ацидоза и Метаболический ацидоз.
Такие смешанные кислотно-щелочные возмущения не являются нечасто и может быть трудно распутать на основании артериального только результаты анализа газов крови.
Сводка
Поддержание нормального pH крови требует участия нескольких систем органов. и зависит от целостности кровообращения.Тогда это не удивительно что нарушение кислотно-щелочного баланса может осложнить течение широко различные заболевания, а также травмы многих частей тело. Организм обладает значительной способностью сохранять pH крови и расстройства обычно подразумевают либо тяжелое хроническое заболевание, либо острое критических заболеваний.
Результаты анализа газов артериальной крови могут выявить кислотно-щелочные нарушения и предоставить ценную информацию в виде его причине.
Некоторые предлагали дальше чтение
- Thomson WST, Адамс Дж. Ф., Коуэн, РА.Клиническая кислотно-щелочная остаток средств. Оксфорд: Oxford Medical Publications 1997
- Харрисон РА. Кислотно-щелочной баланс. Клиника Respir Care в Северной Америке 1995; 1,1: 7-21
- Woodrow P. Анализ газов артериальной крови. Стандарт сестринского дела 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Кислотно-основной физиология: «традиционный» и «современный» подход. Анестезия 2002; 57: 348-56
7. Кислотно-щелочной баланс • Функции клеток и человеческого организма
Содержание:
1.Введение в кислотно-щелочной баланс
2. Системы, отвечающие за поддержание кислотно-щелочного баланса
3. Лабораторные исследования кислотно-щелочного баланса
4. Основные нарушения кислотно-щелочного баланса и средства компенсации
_
Введение в кислотно-щелочной баланс
Поддержание внутренней среды — одна из жизненно важных функций (имеет такое же значение, как кровообращение или дыхание).В подразделе 7/6 указывается, что поддержание стабильного pH , также называемое изогидрия , является одним из основных компонентов внутренней среды: (1) изогидрия, (2) изоволюмия (стабильный объем), (3) изоосмолярность (стабильная тоничность) и (4) изоиония (стабильный ионный состав).
Концентрация протонов и pH
Поддержание стабильных концентраций анионов и катионов в плазме крови обозначается как isoionia . Поддержание постоянной концентрации протона (H + ) составляет изогидрии .pH используется для экспресс-концентрации протонов:
pH = — log c (H + )
Концентрации протонов в плазме и внеклеточном пространстве находятся в очень узком физиологическом диапазоне . Физиологически в артериальной крови содержится 40 нмоль / л протонов (обратите внимание, что концентрации других ионов плазмы, например [Na + ] = 140 ммоль / л или [HCO 3 — ] = 25 ммоль / л, на три порядка выше). pH можно легко рассчитать следующим образом:
pH = -log 40 x 10 -9 моль / л
pH = 7,4
Физиологический диапазон pH: 7,36-7,44.
Значение pH выше 7,44 в артериях обозначается как алкалиемия, pH ниже 7,36 — ацидемия . Значительные отклонения значения pH могут вызвать серьезных последствий . Например, изменение структуры белка (то есть ферментов), проницаемости мембран и распределения электролитов. Значение pH в артериальной крови выше 7,8 , соотв. ниже 6,8 несовместимы с жизнью.
Указанные выше значения относятся к артериальной крови.Значения различаются в разных частях тела, следовательно, существуют разные концентрации H + . Существует довольно вариабельных и более низкое значение pH внутриклеточного, это около 7,0 ([H + ] = 100 нмоль / л). Внутриклеточный pH по сравнению с артериальным pH дает разницу 0,4 . Это соответствует тому факту, что существует 2,5-кратная разница между внутриклеточной и артериальной концентрацией H + . Этот градиент концентрации управляет перемещением H + из клеток в кровь.Поэтому неудивительно, что pH венозной жидкости и pH интерстициальной жидкости ниже (т. Е. Более кислые), чем pH артериальной крови. Примерное значение: 7,35 .
Кислоты и основания в организме
Кислота определяется как молекула, которая может отщеплять H + (по Аррениусу) или донор H + (по Бренстеду). Основание — это противоположная молекула, которая может отщеплять ОН — (Аррениуса) или акцептор H + (Бренстед).
Источник кислот в организме в основном метаболизм , источник оснований преимущественно питательных веществ.
Кислоты и основания подвергаются либо (1) метаболическому превращению (например, лактат в глюкозу в глюконеогенезе, лактат в пируват и окисление в кардиомиоцитах), либо (2) экскреции из организма.
С точки зрения кислотно-щелочного баланса можно выделить три типа реакций. (1) протонопродуктивная , (2) протонопотребляющая , (3) протонно-нейтральная . Ниже приведены примеры:
1) Протонопродуктивные реакции
а) Анаэробный гликолиз в мышцах и эритроцитах
Глюкоза → 2 CH 3 CHOHCOO — + 2 H +
б) Кетогенез — производство кетоновых тел
Жирные кислоты → кетоновые тела + n H +
c) Липолиз
TAG → 3 FA + глицерин + 3 H +
г) Уреагенез
CO 2 + 2 NH + 4 → мочевина + H 2 O + 2 H +
2) Реакции с потреблением протонов
а) Глюконеогенез
2 лактат + 2 H + → Glc
б) Окисление нейтральных и дикарбоновых аминокислот
3) Протонно-нейтральные реакции
а) Полное окисление глюкозы
б) Липогенез из глюкозы
Человеческий организм (здоровый или нет) ежедневно производит больших количества кислот — источник протонов.Организм подкисляется этими процессами:
1) Полное окисление
Углеродный каркас → CO 2 + H 2 O → HCO 3 — + H +
2) Неполное окисление
Углеводы → глюкоза → пируват, лактат + H +
Триацилглицерин → жирные кислоты, кетоновые тела + H +
Фосфолипиды → фосфат + H +
Белки → аминокислоты → сульфат, мочевина + H +
Кислоты можно разделить на две группы: (1) летучие кислоты, (респираторные кислоты), (2) нелетучие кислоты, (метаболические кислоты).
Наиболее важной летучей кислотой является угольная кислота (H 2 CO 3 ). H 2 CO 3 образуется в результате реакции диоксида углерода (CO 2 представляет собой кислотообразующий оксид) с водой. 15 000 — 20 000 ммоль CO 2 (следовательно, такое же количество угольной кислоты) — это , производимых каждый день. Дыхательная система , однако очень эффективно ее устраняет. Это оправдывает термин «летучая кислота».
Среди нелетучих кислот различают две группы: (1) органические и (2) неорганические . 1 ммоль / кг массы тела вырабатывается каждый день . Нелетучая кислота может быть либо (1) метаболизирована , либо (2) выведена из организма (используя в основном почки).
К органическим нелетучим кислотам относятся, например: (1) молочная кислота , (2) жирные кислоты , (3) кетоновые тела (ацетоуксусная кислота , β-гидроксимасляная кислота ). Они постоянно вырабатываются метаболизмом (неполное окисление ТАГ, углеводов, белков).Поскольку органические нелетучие кислоты являются продуктами метаболизма в нормальных условиях , они полностью окисляются до CO 2 и H 2 O. Следовательно, они не влияют на общий баланс протонов.
Неорганические нелетучие кислоты: (1) H 2 SO 4 (серная кислота образуется путем окисления сульфгидрильных групп — например, в аминокислотах, содержащих серу, т.е. цистеин, метионин), (2) H 3 PO 4 (фосфорная кислота образуется при гидролизе фосфопротеинов, фосфолипидов, нуклеиновых кислот).Неорганические нелетучие кислоты выводятся преимущественно с мочой.
Теперь вы должны заметить, что производство ATP связано с производством H + . Человеческое тело эволюционно способно выдерживать кислотную нагрузку .
_
Системы поддержания кислотно-щелочного баланса
Некоторые системы поддерживают постоянный pH. Список ниже составлен по порядку поступления:
1) Химические буферные системы
Буферы реагируют немедленно — острая регулировка.Емкость буферов не бесконечна, поэтому химические буферы действуют только в кратковременных . Системы химической буферизации имеют дело с отклонениями pH в общем метаболизме.
2) Дыхательная система
Дыхание реагирует через 1-3 минуты . Дыхательная система регулирует углекислого газа . Дыхание способно изменить pCO 2 путем его удаления или удержания. Дыхательный центр находится в стволе головного мозга , .
3) Почки
Почки реагируют за час-дни .Их роль в кислотно-щелочном балансе очень сложна.
4) Печень
Печень является основным органом энергетического обмена, она также имеет важное влияние на кислотно-щелочной баланс. Печень является наиболее важной тканью, в которой аммоний детоксифицируется как в (1) цикле мочевины, так и (2) в синтезе глутамина. Какая из этих судеб аммония будет в наибольшей степени зависит от состояния кислотно-щелочного баланса:
а) NH 4 + → мочевина + 2 H + → закисление организма
CO 2 + 2 NH 4 + → CO (NH 2 ) 2 + 2 H + + H 2 O
H + + HCO 3 — → H 2 O + CO 2 ( расход бикарбоната — )
б) NH 4 + → синтез глутамина → H + не продуцируется, глутамин поглощается почками.В почках H + Выводится в виде NH 4 +
5) Миокард
Миокард влияет на кислотно-щелочной баланс за счет окисления лактатных и кетоновых тел.
Буферные системы
Буферы представляют собой вещества, способные высвобождать и , связывающие H + . Кратковременные и острые изменения кислотно-щелочного баланса могут быть уравновешены буферами .Каждый буфер поддерживает свой конкретный pH . Этот pH может быть рассчитан с помощью уравнения Хендерсона-Хассельбаха:
pH = pK + log [конъюгированное основание] / [кислота]
Уравнение Хендерсона-Хассельбаха для бикарбонатного буфера (HCO 3 — / CO 2 ):
pH = pK h3CO3 + log ([HCO 3 — ] / [H 2 CO 3 ])
pH = pK h3CO3 + log ([HCO 3 — ] / α x pCO 2 )
α — коэффициент пересчета, который используется для расчета молярной концентрации (ммоль / л) из парциального давления CO 2 (pCO 2 ).α = 0,226 для pCO 2 в кПа, α = 0,03 для pCO 2 в мм рт.
pH = pK ± 1 — диапазон, в котором буферы работают оптимально.
В приведенном выше уравнении Хендерсона-Хассельбаха вы должны заметить, что значение pH, которое поддерживают буферы, зависит в первую очередь от соотношения конъюгированного основания и кислоты (конечно, важна концентрация каждого компонента, но не настолько). Поэтому очень важно знать соотношение. Соотношение конъюгированного основания и кислоты можно рассчитать по соотношению между pH и pK.Например, бикарбонатный буфер (pH = 7,4; pK = 6,1):
pH = pK h3CO3 + log ([HCO 3 — ] / [H 2 CO 3 ])
7,4 = 6,1 + log ([HCO 3 — ] / [H 2 CO 3 ])
1,3 = журнал ([HCO 3 –] / [H 2 CO 3 ])
[HCO 3 — ] / CO 2 ≈ 20/1
Соотношение в бикарбонатном буфере составляет 20: 1 (HCO 3 — : CO 2 )
В корпусе несколько буферных систем.К наиболее важным относятся: (1) бикарбонатный буфер (HCO 3 — / CO 2 ), (2) гемоглобиновый буфер (в эритроцитах), (3) фосфатный буфер, (4) белки и (5) аммиачный буфер. Их важность различается в зависимости от локализации.
Основные буферные системы по отсекам тела.
Локализация | Буфер | Комментарий |
ISF | Бикарбонат | Буферы метаболических кислот |
| фосфат | Низкая концентрация — ограниченное значение | |
| Белки | Низкая концентрация — ограниченное значение | |
Кровь | Бикарбонат | Буферы метаболических кислот |
| Гемоглобин | Буферы CO 2 (производство углекислоты) | |
| Белки плазмы | Незначительный | |
| фосфат | Низкая концентрация — ограниченное значение | |
ICF | Белки | Буфер значительный |
| Фосфат | Буфер значительный | |
Моча | Фосфат | Отвечает за большую часть титруемой кислотности мочи |
| Аммоний | Существенно: удаление аммонийного азота и протонов; катион |
_
В следующей таблице показана буферная емкость буферов крови.
Буферы крови и их буферная емкость
Буфер | Плазма | Эритроциты | Вместе |
| HCO 3 — / CO 2 | 35% | 18% | 53% |
| Hb / Hb-H + | – | 35% | 35% |
| Белки плазмы | 7% | – | 7% |
| Неорганический фосфат | 1% | 1% | 2% |
| Органический фосфат | – | 3% | 3% |
43% | 57% | 100% |
_
Из-за того, что все буферные системы находятся в равновесии , любой вид дрейфа pH вызывает реакцию во всех буферных системах.Любое изменение концентрации любого компонента любого буфера влияет как на pH, так и на все буферные системы.
Бикарбонатный буфер (HCO
3 — / CO 2 )Бикарбонатный буфер является наиболее важной буферной системой в плазме крови (обычно во внеклеточной жидкости). Этот буфер состоит из слабой кислоты H 2 CO 3 (pK 1 = 6,1) и конъюгированного основания HCO 3 — (бикарбонат).
Концентрация бикарбоната выражена в ммоль / л (среднее значение 24 ммоль / л ).Поскольку угольная кислота очень нестабильная молекула, измерение ее концентрации очень затруднительно. H 2 CO 3 производится из CO 2 , следовательно, можно выразить концентрацию угольной кислоты как парциальное давление CO 2 (pCO 2 ) , потому что pCO 2 прямо пропорционально CO 2 концентрация. pCO 2 легко измерить (кПа, мм рт. ст.). Среднее значение в артериальной крови 5,3 кПа = 40 мм рт. Ст. . pCO 2 , умноженное на α, дает нам молярную концентрацию растворенного CO 2 (α = 0,226 для pCO 2 в кПа, α = 0,03, если pCO 2 для мм рт. Соотношение преобразования между мм рт. Ст. И кПа: 1 Па = 0,0075 мм рт. Ст. (Т. Е. 760 мм рт. Ст. ≈ 100 кПа). В норме pH плазмы составляет HCO 3 — / CO 2 соотношение 20/1 .
Уравнение Хендерсона-Хассельбаха для бикарбонатного буфера:
pH = pK + log [конъюгированное основание] / [кислота]
pH = pK + log ([HCO 3 — ] / [H 2 CO 3 ])
pH = 6,1 + log ([HCO 3 — ] / pCO 2 x α)
pH = 6,1 + log (24/40 x 0,03)
pH = 6,1 + 1,3
pH = 7,4
HCO 3 — / CO 2 — это так называемая открытая буферная система .Это означает, что организм способен активно изменять как бикарбонат, так и углекислый газ. pCO 2 регулируется дыхательными путями (посредством вентиляции — частота дыхания и глубина дыхания). HCO 3 — уровней изменяются почками и печенью. HCO 3 — может быть как синтезировано , так и исключено .
Теперь вы должны вспомнить сказанное выше: pH = pK ± 1 — это диапазон, в котором буферы работают оптимально.Это должно означать, что бикарбонатный буфер лучше всего работает в диапазоне 5,1-7,1, но при pH 7,4 он очень эффективен, потому что он открыт То есть: организм способен активно изменять оба компонента.
Мы используем статус бикарбонатного буфера для клинической оценки кислотно-щелочного баланса пациента. (измерение pH, [HCO 3 — ] a pCO2)
Белковые буферы
Белки организма (белки плазмы и внутриклеточные) являются наиболее распространенными и наиболее мощными буферными системами во всем организме .Некоторые аминокислоты имеют кислотные или основные боковые цепи (His, Lys, Arg, Glu, Asp). Среди белков крови гемоглобин является наиболее важным . Он обеспечивает 35% буферной способности крови, остальные белки обеспечивают только 7%.
Роль эритроцитов и гемоглобина в кислотно-щелочном балансе
Интенсивное изменение газов крови происходит в рабочих тканях . CO 2 диффундирует к эритроцитам . В эритроците CO 2 либо (1) связывается с гемоглобином (и образуется карбаминогемоглобин), либо (2) реагирует с водой .Эту реакцию катализирует карбоангидраза (CA, карбонатдегидратаза):
CO 2 + H 2 O ↔ H 2 CO 3
Произведено диссоциатов угольной кислоты:
H 2 CO 3 ↔ HCO 3 — + H +
Более 70% произведенных HCO 3 — покидают эритроциты с использованием специального HCO 3 — / Cl — antiport .То есть бикарбонат обменивают на Cl — . Этот процесс называется эффектом Гамбургера (сдвиг хлорида ) . При диссоциации угольной кислоты образуется H + . Генерируемые протоны буферизуются гемоглобином. Деоксигенированный гемоглобин является более сильным основанием, чем оксигенированный, поэтому деоксигенированный гемоглобин более способен поглощать протоны.
В легких HCO 3 — заменяется на CO 2 с использованием фермента CA. CO 2 выдыхается.Реакция HCO 3 — → CO 2 + H 2 O требует H + . Протоны для этого процесса берутся из гемоглобина, сродство которого к H + снизилось как раз тогда, когда он прибыл в легкие, где высокий pO 2 , и гемоглобин насыщается кислородом. Реакция, катализируемая карбоангидразой, имеет в легких обратное течение по сравнению с другими тканями:
HCO 3 — + H + → CO 2 + H 2 O
Более подробная информация представлена в главе 6.
Фосфатный буфер
Фосфатный буфер состоит из неорганического и органически связанного фосфата (т.е. сложных эфиров органических веществ, например АМФ, АДФ и АТФ). Фосфатный буфер является важным внутриклеточным буфером, а для мочи — . В крови на него приходится всего 5% буферной емкости.
Буферы для мочи
Существует два важных буфера мочи: (1) аммониевый буфер (NH 3 / NH 4 + ) и (2) фосфатный буфер . Ежедневно выводится 30-50 ммоль NH 4 + . Это важно, потому что экскреция NH 4 + в значительной степени регулируется при нарушении кислотно-щелочного баланса. То есть выведение аммония может быть значительно уменьшено или значительно увеличено. При ацидозе — это глютаминаза, , активированная в почках. Глутаминаза расщепляет глутамин на глутамат и NH 3 . Затем NH 3 выводится с мочой.Этот процесс включает также печень, где при ацидозе вырабатывается меньше мочевины и на больше глутамина, . Ежедневно выводится 20 ммоль фосфатов (т. Е. Титруемая кислотность мочи). Физиологический pH мочи составляет 4,4-8,0 .
Роль дыхательных путей в поддержании кислотно-щелочного баланса
Ежедневно дыхательной системой выдыхается примерно 15-20 моль CO 2 . CO 2 хорошо растворяется в воде, поэтому его концентрация как в альвеолах, так и в артериальной крови одинакова (т.е.е. pCO 2 = 5,33 кПа = 40 мм рт. ст.). В венозной крови pCO 2 6,13 кПа = 46 мм рт.
pCO 2 зависит, помимо прочего, от легочной вентиляции (= минутный объем дыхания). Легочная вентиляция определяется как частота дыхания (ЧД), умноженная на дыхательный объем (V T ). Для понимания следующей концепции вы должны помнить, что pH буфера зависит от соотношения его компонентов (например, HCO 3 — : pCO 2 ), и поэтому, когда соотношение изменяется, соответственно изменяется pH.Теперь вы можете легко сделать вывод, что:
1) усиленная вентиляция приводит к падению pCO 2 и, что приводит к подщелачиванию (повышенному pH)
2) снижение вентиляции приводит к накоплению CO 2 → увеличивается pCO 2 , что приводит к закислению (снижение pH)
Есть много способов контролировать дыхание. Один из них — химический контроль. Хеморецепторы проверяют как pCO 2 , так и pO 2 .Повышенный pCO 2 активизирует дыхательный центр. Чувствительность хеморецепторов снижается, когда pCO 2 составляет 8 кПа или выше . Единственным остающимся стимулом для дыхательного центра является пониженное рО 2 .
Роль почек в поддержании кислотно-щелочного баланса
Химические буферы способны остановить увеличение кислот или оснований. Однако буферы не способны удалять эти кислоты и основания из организма.Дыхательные пути могут удалять (или накапливать) летучую угольную кислоту посредством удаления CO 2 (или кумуляции его). Только почки способны очистить организм от нелетучих (метаболических) кислот (т.е. фосфорной кислоты, серной кислоты, мочевой кислоты и т. Д.). Таким образом предотвращается ацидоз. Кроме того, почки — единственный орган, способный эффективно бороться с алкалозом (дыхательная система, кстати, предлагает другой вариант, то есть прекращение дыхания).
Почки участвуют в поддержании кислотно-щелочного баланса посредством:
1) Реабсорбирует, выводит и продуцирует бикарбонат
2) Выделение или производство H +
Следует заметить, что потеря бикарбоната равна , как , приобретение H + , а производство бикарбоната составляет , так и , как потеря H + .Ниже показано, что эти процессы взаимосвязаны (например, выделение H + в проксимальном канальце связано с реабсорбцией HCO 3 — в том же месте или выделение H + в дистальном канальце связано с продукцией HCO 3 — там же). Следующей важной концепцией является то, что более высокая концентрация бикарбоната увеличивает pH, более низкая концентрация бикарбоната снижает pH.
В этом разделе подробно описаны основные процессы, такие как реабсорбция бикарбоната , производство нового бикарбоната , образование иона аммония, экскреция протонов в почках, секреция бикарбоната .
Реабсорбция бикарбоната
Реабсорбция бикарбоната происходит в клетках проксимальных канальцев. В клубочковом ультрафильтрате присутствует фильтрованный бикарбонат. К просвету проксимального канальца транспортируется H + . H + транспортируется посредством Na + / H + antiport H + реагирует с HCO 3 — и таким образом образуется H 2 CO 3 . H 2 CO 3 разделены на H 2 O и CO 2 .Вода и углекислый газ проникают через апикальную мембрану трубчатых клеток. Внутри этих ячеек снова образуется H 2 CO 3 . H 2 CO 3 распадается на HCO 3 — и H + . Теперь их судьбы меняются: (1) H + снова становится субстратом для Na + / H + антипорта и снова транспортируется в просвет проксимального канальца, где может «поймать» другую молекулу бикарбоната. (2) Бикарбонат, однако, проникает через базолатеральную мембрану в интерстициальную жидкость (а затем в кровь перитубулярных капилляров).Бикарбонат проходит через базолатеральную мембрану с использованием либо Na + /3 HCO 3 — cotransport , либо анионита (обмен Cl — / HCO 3 — ).
Вместе можно констатировать: для одного секретируемого H + резорбируются один Na + и один HCO 3 — . Na + транспортируется в кровь, среди прочего, с помощью активного транспорта , то есть Na + / K + ATPase .
Производство нового бикарбоната (связано с выделением H
+ )Производство нового бикарбоната происходит в интеркалированных клетках типа A дистального канальца и собирательного канала . Эти клетки поглощают CO 2 из крови, а внутри клеток углекислый газ реагирует с водой и образуется угольная кислота, катализируемая ферментом карбоангидраза . Угольная кислота диссоциирует до H + и HCO 3 — .H + имеет совершенно другую судьбу, чем бикарбонат: (1) H + выводится с мочой с помощью H-ATPase . Этот процесс активен, следовательно, он потребляет АТФ. Чтобы удалить как можно больше H + , необходимо накапливать H + в моче. Наиболее важными буферами в моче являются аммонийный и фосфатный буфер. (2) Произведенный бикарбонат транспортируется в кровь в перитубулярных капиллярах, обмениваясь на Cl — (обменник Cl — / HCO 3 — в базолатеральной мембране). Альдостерон стимулирует секрецию H + (и, следовательно, выведение H + ).
Экскреция ионов аммония
В этом процессе используется аммоний, образующийся при метаболизме глютамина в трубчатых клетках. На каждый метаболизированный глутамин производятся два иона аммония и два бикарбоната . Бикарбонаты переносятся в кровь, а ионы аммония выводятся в кровь.
Выведение протонов почками
Как для резорбции бикарбоната, так и для образования нового бикарбоната (оба упомянутых выше) необходим транспорт H + (протоны) к канальцам (протоны образуются в результате диссоциации угольной кислоты).Однако точный механизм совсем другой.
В клетках проксимального канальца транспорт протона в просвет основан на его обмене на Na + . На базолатеральную мембрану действуют обменник Na + / K + -АТФаза и HCO 3 — / Cl — .
В интеркалированных клетках типа A (в дистальном канальце и собирательном канале) транспорт протона в просвет основан на активном транспорте (H + -АТФаза). Альдостерон способствует (1) экскреции H + и K + в дистальных канальцах и собирательном канале и (2) реабсорбции натрия (и воды).
Результатом обоих описанных процессов является создание высокого градиента концентрации для H + , т.е. в моче концентрация протонов в тысячу раз выше, чем в клетках / крови. Однако этот тысячекратный градиент является максимальным, поэтому наименьшее достижимое значение pH мочи составляет 4,4 (40 мкмоль / л H + ) — сравните это значение со значением pH в крови: 7,4 (40 нмоль / л H + ).
Секреция бикарбоната
В условиях повышения pH (алкалоза) начинают действовать интеркалированные клетки типа B . Они выделяют бикарбонат и получают H + . Эти механизмы абсолютно обратны процессам, описанным в типе А интеркалированных клеток (см. Выше). Однако даже при алкалозе нефроны выделяют меньше бикарбоната, чем задерживают.
Можно резюмировать, что внеклеточный pH поддерживается буферными системами и задействованными органами. Эти системы поддерживают значение pH 7,36-7,44 . Дыхательная система модулирует pCO 2 и почки модулируют концентрацию бикарбоната .
_
Лабораторная оценка состояния кислотно-щелочного баланса
Лабораторная оценка состояния кислотно-щелочного баланса состоит из: (1) параметров кислотно-щелочного баланса (pH, [HCO 3 — ], pCO 2 , pO 2 a BE) и (2) исследование других веществ, способных изменить кислотно-щелочной баланс .Вот эти вещества, например:
1) Катионы : [Na + ], [K + ], [Ca 2+ ], [Mg 2+ ]
2) Анионы: [Cl — ], [лактат], альбумин
3) Метаболиты: [мочевина], [креатинин], [кетоновые тела]
Состояние кислотно-основного баланса оценивается в соответствии с состоянием бикарбонатного буфера . Это так называемая проверка параметров ABR компанией Astrup (ASTRUP).
Это исследование используется для оценки фактического состояния кислотно-щелочного баланса у конкретного пациента. Образцы измеряются в анализаторах, и именно эти образцы называются «Аструп» в честь одного из первых авторов теории кислотно-щелочного баланса. Некоторые параметры не измеряются напрямую, а рассчитываются с помощью программного обеспечения с использованием уравнения Хендерсона-Хассельбаха.
Образцы взяты из артериальной крови ( a. Radialis или a.femoralis ), иногда требуется и сбор капиллярной крови. Мы можем анализировать только несвертывающуюся кровь (для этого добавляется гепарин). Артериальная кровь не должна содержать пузырьков воздуха (поскольку присутствие воздуха может изменить pO 2 (увеличение), pCO 2 (уменьшение) и pH (увеличение)), анализ должен быть проведен как можно скорее.
Нормальная артериальная Аструп Результаты:
Непосредственно измеренных значений:
1) pH = 7,36 — 7,44
2) pCO 2 = 4,8 — 5,9 кПа (35-45 мм рт. Ст.), В среднем 5,3 кПа (40 мм рт. Ст.)
pCO 2 <4,8 кПа обозначается как гипокапния
pCO 2 > 5,9 кПа обозначается как гиперкапния
3) pO 2 = 9,9 — 13,3 кПа (80-100 мм рт. Ст.)
Вычислено:
4) [HCO 3 — ] = 22-26 ммоль / л
5) BE = 0 ± 2,5 ммоль / л
BE (базовое превышение)
Избыток основания определяется как число молей сильной кислоты , которое необходимо добавить к одному литру полностью насыщенной кислородом крови для достижения pH 7,4, когда pCO 2 составляет 5,3 кПа и температура 37 ° C.БЭ — оптимальное количество для оценки метаболической составляющей кислотно-щелочного баланса. Нормальные значения — 0 ± 2,5 ммоль / л. Отрицательное значение указывает на избыток кислот (поэтому значение отрицательное). Избыток кислот составляет метаболический ацидоз . Положительное значение указывает на избыток оснований (избыток оснований), следовательно, метаболический алкалоз .
Однако есть одна очень похожая величина — базовый дефицит (BD). Это указывает на дефицит оснований в ммоль / л.
Ионы и pH
Ионный состав внеклеточной жидкости тесно связан с кислотно-щелочными параметрами. На калемию больше всего влияет нарушение кислотно-щелочного баланса.
Ацидоз приводит к оттоку K + из клеток. Это приводит к гиперкалиемии . K + теряется с мочой. При лечении ацидоза быстрое ощелачивание организма приводит к притоку K + обратно в клетки. Это приводит к гипокалиемии .Гипокалиемия наиболее опасна для передачи сигналов через мембрану сердца.
Алкалоз приводит к оттоку H + из клеток. Для поддержания одинакового электрического заряда в ячейки входят K + , чтобы заменить H + . Таким образом, алкалоз приводит к гипокалиемии . K + выводится с мочой вместо H + .
Анионный разрыв (AG)
Анионная щель — это величина, которая почти равна сумме концентраций «неизмеримых» анионов ( альбумина — белки плазмы, фосфаты, сульфаты, органические анионы ).Неизмеримый — неточный термин, точнее , обычно неизмеримый .
AG рассчитывается следующим образом:
AG = ([Na + ] + [K + ]) — ([Cl — ] + [HCO 3 — ])
Na + (140) + K + (5) = Cl — (105) + HCO 3 — (25) + AG (15)
Нормальный AG: 14 ± 2 ммоль / л
Анионный разрыв используется для оценки причин метаболического ацидоза .Одна из причин — накопление кислот. Концентрации некоторых из них обычно не измеряются. При накоплении обычно неизмеряемых кислот неожиданный рост разности измеренных катионов и анионов. Это увеличение разницы может быть обнаружено AG. Следовательно, увеличение AG указывает на накопление неизмеряемых кислот. Они становятся частью AG. Таким образом, более высокий AG указывает на ацидоз.
Повышение AG вызвано:
1) Увеличение концентрации ионов, которые физиологически делают AG
2) Наличие новых анионов
К сожалению, этот метод зависит от точности измерений.Маленькая ошибка в больших числах ведет к еще большей ошибке в результате. Бывают особые ситуации, когда нам нужно измерить обычно неизмеряемые концентрации кислот (анионов). Затем измеряем:
1) Лактат в тканевой гипоксии
2) 3-гидроксибутират при диабетическом кетоацидозе
3) Фосфаты и сульфаты при почечной недостаточности
_
Основные нарушения кислотно-щелочного баланса и компенсация
Ацидоз — это процесс , который приводит к падению на значения pH . Алкалоз — это процесс, противоположный , который приводит к увеличению при значении pH. Параметры кислотно-щелочного баланса рассчитаны для плазмы с щелочным pH, т.е. pH = 7,4 (концентрация H + составляет 40 нмоль / л). Таким образом, вы должны заметить, что даже щелочной pH (например, 7,2) является ацидозом!
Нарушения дыхания обозначаются сдвигами pCO 2 (респираторное заболевание — гипер- или гипокапния). Нарушения обмена веществ обозначаются сдвигами в BE (или [HCO 3 — ])
Выделяют четыре основных нарушения кислотно-щелочного баланса:
1) Респираторный ацидоз (RAC) : снижение pH крови; его основная причина — повышенное pCO 2
2) Респираторный алкалоз (RAL) : повышение pH крови; его основная причина — снижение pCO 2
3) Метаболический ацидоз (MAC) : снижение pH крови; его основная причина — снижение BE ([HCO 3 — ])
4) Метаболический алкалоз (MAL) : повышение pH крови; его основная причина — повышенный BE ([HCO 3 — ])
Компенсация и коррекция кислотно-щелочных нарушений
Компенсация — это процесс, когда организм пытается поддерживать почти нормальный pH.Компенсация выполняется системой, которая работает нормально, т.е. кислотно-щелочное нарушение вызвано другой системой. Компенсация, таким образом, означает, что метаболические нарушения компенсируются дыхательной системой, а респираторные нарушения компенсируются метаболическими компонентами кислотно-щелочного баланса.
Коррекция решает кислотно-щелочную проблему в том месте, где она началась. Т.е. метаболические нарушения решаются метаболической составляющей кислотно-щелочного баланса. В организме коррекция происходит только у нарушений обмена веществ, т.е.е. нарушение обмена веществ корректируется другим компонентом метаболической составляющей кислотно-щелочного баланса.
Однако врачи могут исправить как респираторные, так и метаболические нарушения. Нарушения дыхания могут быть устранены с помощью искусственной вентиляции , нарушения обмена веществ, например, с помощью диализа .
Когда и коррекция, и компенсация выполняются самим организмом, pH никогда полностью не нормализуется. .
Нарушения кислотно-щелочного баланса дыхательных путей
Все люди (здоровые или нет) ежедневно производят большое количество кислот.Самая важная кислота — CO 2 . Двуокись углерода обычно удаляется из организма через дыхательную систему. Когда дыхательная система не способна к нормальному выведению CO 2 (углекислый газ может быть устранен слишком много или слишком мало) возникают нарушения кислотно-щелочного баланса дыхательных путей.
Нормальное значение pCO 2 составляет 4,8-5,9 кПа (35-45 мм рт. Ст.). pCO 2 ниже 4,8 указывает на респираторный алкалоз , pCO 2 выше 5,9 указывает на респираторный ацидоз.
Нарушения дыхания компенсируются почками . Почки удерживают или выводят HCO 3 — , чтобы (1) поддерживать соотношение HCO 3 — : pCO 2 и (2) приближать pH к нормальным значениям. Для полного развития почечной компенсации требуются часы или дни.
Респираторный ацидоз (RAC)
Респираторный ацидоз возникает, когда легкие выводят слишком мало CO 2 (обычно возникает при гиповентиляции ).Низкое выведение CO 2 приводит к увеличению pCO 2 в крови ( гиперкапния, ). Повышенный pCO 2 вызывает снижение pH.
Причины RAC, например:
1) Потеря функциональной паренхимы легкого (пневмония, муковисцидоз, эмфизема)
2) Обструкция дыхательных путей (потеря тонуса мышц языка)
3) Недостаточная вентиляция (например, нервно-мышечные расстройства, расстройства ЦНС, интоксикации (опиаты), астматический пароксизм)
4) Ограничение движения грудной клетки (e.г. деформации позвоночника)
Организм компенсирует RAC повышением концентрации HCO 3 — в крови за счет повышенной резорбции и увеличения продукции в канальцевых клетках почек (вырабатывается кислой мочи, ). Таким образом, pH крови приближается к нормальным значениям.
Вышеупомянутые причины RAC могут иногда вызывать снижение pO 2 . Тканевая гипоксия приводит к метаболическому ацидозу , вызванному накоплением лактата , таким образом, это называется лактат-ацидозом (см. Ниже).
Респираторный алкалоз (RAL)
Респираторный алкалоз вызывается гипервентиляцией . Гипервентиляция вызывает повышенное выведение углекислого газа, что приводит к гипокапнии (снижение pCO 2 ).
Есть один важный аспект, касающийся кальция. Одним из важных буферов крови является альбумин. Следует помнить, что альбумин связывает примерно 50% кальция плазмы. При изменении pH альбумин связывает или высвобождает H + , и, следовательно, кальциемия изменяется.Это очень важно в RAL. В этом состоянии соотношение между ионизированным и связанным кальцием изменяется. При RAL снижается уровень ионизированного кальция, следовательно, развивается гипокальциемия. Гипокальциемия может вызвать мышечные спазмы.
Причины появления RAL, например:
1) Гипервентиляция по психическим причинам (выдох углекислого газа = выдох эмоций) или гипервентиляция из-за большой высоты (то есть дыхание при недостатке кислорода).В обоих принципах pCO 2 понижено, и вы знаете, что низкий pCO 2 — это алкалоз. Что интересно, HCO 3 — тоже немного занижены. Это связано с тем, что pCO 2 снижается и, таким образом, для поддержания равновесия часть бикарбоната конвертируется в CO 2 . (HCO 3 — + H + ↔ CO 2 + H 2 O). Ионы H + , необходимые для этой реакции, поступают из небикарбонатных буферов.
2) Травма ЦНС
3) Отравление салицилатами (Аспирин) — лихорадка и т.д…
Компенсация уменьшена HCO 3 — . Это обеспечивается за счет большей экскреции HCO 3 — почками.
Метаболический ацидоз (MAC)
Метаболический ацидоз — наиболее частое нарушение кислотно-щелочного баланса . На это указывает пониженный pH, (повышенный H + ) и отрицательный BE ([HCO 3 — ]).БЭ — лучший маркер для оценки метаболической составляющей кислотно-щелочного баланса. Можно констатировать, что метаболический ацидоз — это слишком кислый pH по сравнению с заданным pCO 2 (т.е. метаболический компонент должен всегда оцениваться с учетом pCO 2 у конкретного пациента).
Общие причины MAC:
1) Накопление «метаболической» кислоты . Анион этой кислоты устраняет бикарбонат.
2) Потеря бикарбонатов (эта потеря аниона сопровождается потерей катиона, неудивительно, что наиболее распространенный катион (Na + ) теряется в основном)
3) Потеря катионов , преимущественно Na + .Это компенсируется снижением содержания бикарбоната
.Каждая кислота в организме, кроме угольной кислоты, — это , так называемая метаболическая кислота. Метаболические кислоты нелетучие, поэтому их необходимо нейтрализовать и либо метаболизировать, либо выводить почками.
Бикарбонаты чаще всего теряются из ЖКТ. Сок двенадцатиперстной кишки и поджелудочной железы содержит большое количество бикарбонатов. Обычно высокие концентрации бикарбоната в этих соках нейтрализуют низкий pH химуса из желудка. Обычно бикарбонаты резорбируются в тонком кишечнике. Однако существуют некоторые заболевания ЖКТ (диарея, синдром короткой кишки и т. Д.), При которых бикарбонаты всасываются недостаточно. Бикарбонаты могут быть потеряны в почках тоже (почечный канальцевый ацидоз, побочное действие диуретиков — ингибиторов карбоангидразы (ацетазоламид)).
Расчет AG полезен при дифференциальной диагностике MAC. Чрезмерное производство кислот приводит к высокому AG .Повышенная потеря бикарбонатов имеет , нормальный AG .
Теперь мы упоминаем некоторые конкретные состояния, которые приводят к MAC:
1) Гипоксия — недостаток кислорода в тканях. Это состояние заставляет ткани перерабатывать глюкозу при анаэробном гликолизе . Побочным продуктом анаэробного гликолиза является лактат. Таким образом, гипоксия приводит к лактат-ацидозу . Лактат-ацидоз — типичный спутник РАК, шока или передозировки бигуанидов (метформина).
2) Чрезмерное производство кетоновых тел (ацетоуксусная кислота и β-гидроксимасляная кислота).Это состояние вызвано ситуациями, когда глюкозу нельзя использовать в качестве источника энергии. Это приводит к чрезмерному использованию жирных кислот в качестве основного источника энергии. Таким образом, чрезмерное производство кетоновых тел сопровождает сахарный диабет или голодание. Это состояние называется кетоацидоз .
3) Отравление алкоголем (например, метанол, этиленгликоль). Эти спирты метаболизируются до сильных органических кислот (муравьиная кислота, щавелевая кислота). Эти кислоты выделяют много H + .Оксалаты могут привести к почечной недостаточности. Передозировка салицилатов (аспирин) также может вызвать МАК.
4) Почечная недостаточность приводит к состоянию, когда накапливаются обычно выделяемые кислоты (сульфаты, фосфаты, некоторые другие анионы). Это называется почечный ацидоз .
5) Тяжелая диарея
6) Потеря бикарбонатов почками
Во всех этих условиях сначала происходит буферизация избыточных H + (осуществляется бикарбонатными и небикарбонатными основаниями).Бикарбонат образует с угольной кислотой H + , которая образует CO 2 и воду, углекислый газ удаляется легкими.
Второй шаг — компенсация с использованием гипервентиляции . Вы должны помнить, что гипервентиляция приводит к снижению pCO 2 , а снижение pCO 2 означает более высокий pH. Это часто называют ацидотическим дыханием Куссмауля (дыхательный центр стимулируется высокой концентрацией H + ).
Третий этап — коррекция почками.Коррекция запускается в случае, если ацидоз, несмотря на компенсацию, все еще присутствует. Почки производят (1) повышенную экскрецию H + и (2) продукцию нового бикарбоната (интеркалированные клетки типа A). В результате получается кислой мочи.
Метаболический алкалоз (MAL)
Метаболический алкалоз характеризуется повышенным pH и повышением БЭ. Общие причины:
1) Потеря некоторых анионов (обычно хлоридов или белков ).Эта потеря анионов компенсируется восполнением других анионов, преимущественно бикарбонатов (и повышенное содержание бикарбонатов означает алкалоз)
2) Повышенная концентрация катионов (чаще всего Na + )
3) Повышенное потребление щелочи (например, подщелачивающий препарат — настой бикарбоната)
Теперь мы упоминаем некоторые конкретные состояния, которые приводят к MAL :
1) Рвота — потеря HCl (таким образом, потеря H + ).Развивается так называемый гипохлоремический алкалоз (он также вызывается диуретиками (например, фуросемид вызывает потерю K + и Cl — )
2) Гипопротеинемия — белки представляют собой анионы, поэтому пониженная концентрация белка компенсируется повышенной концентрацией бикарбоната (т.е. бикарбонаты восполняют недостающие анионы). Гипопротеинемия вызвана печеночной недостаточностью , нефротическим синдромом или недоеданием.
3) Гиперальдостеронизм .Высокий уровень альдостерона вызывает повышенное удерживание Na + . Эта повышенная концентрация катионов должна сопровождаться пополнением анионов, поскольку должна поддерживаться электронейтральность (т. Е. Повышается концентрация бикарбоната).
4) Доставка ятрогенных оснований (например, HCO 3 — инфузий)
Сначала происходит буферизация. Компенсация является второй, и организм использует гиповентиляцию , таким образом, меньше CO 2 выдыхается, а pCO 2 повышается, что приводит к снижению pH.Если алкалоз вызван не почками, может быть проведена почечная коррекция. Он осуществляется за счет более высокой экскреции бикарбоната (интеркалированные клетки типа B). Одним из серьезных последствий алкалоза является гипокалиемия , которая может привести к нарушениям сердечного ритма.
Смешанные нарушения кислотно-щелочного баланса
Смешанные нарушения кислотно-щелочного баланса — довольно распространенное явление. Он определяется как (1) комбинация двух или более основных нарушений кислотно-щелочного баланса, или (2) комбинация нескольких причин , которые вызывают такое же нарушение кислотно-щелочного баланса, (3) или оба .
В качестве примера мы можем использовать гиповентиляцию , которая приводит не только к респираторному ацидозу , потому что выдыхается меньше CO 2, , , но также и к метаболическому ацидозу , потому что в ткани доставляется меньше O 2 .
Авторы подразделов: Йозеф Фонтана и Петра Лаврикова
Как это влияет на ваше здоровье?
Ваше тело должно придерживаться точного баланса кислотности и щелочности, чтобы функционировать должным образом.Даже небольшое изменение этого баланса может повлиять на многие органы.
Что такое кислотно-щелочной баланс?
Кислотность и щелочность крови измеряются с помощью шкалы pH. Шкала pH варьируется от 0 (очень кислая) до 14 (очень щелочная). Кровь обычно составляет от 7,35 до 7,45.
Контроль кислотно-щелочного баланса
Каждая система органов вашего тела зависит от баланса pH. Но ваши легкие и почки работают, чтобы регулировать это.
Кислоты образуются в ходе многих химических реакций, протекающих в каждой клетке (клеточный метаболизм).Двуокись углерода постоянно вырабатывается вашими клетками, поскольку они метаболизируют кислород и питательные вещества, в которых они нуждаются.
Каждый раз, когда происходит изменение кислотно-щелочного баланса, ваше тело автоматически возвращает уровень pH крови к норме. Но если уровень pH в крови значительно меняется, эти автоматические механизмы не работают.
Легкие. Ваш мозг контролирует, насколько быстро и глубоко вы дышите. Он регулирует количество выдыхаемого углекислого газа. Когда вы дышите глубже и быстрее, вы выдыхаете больше углекислого газа и повышаете pH крови.Ваша дыхательная или респираторная система может регулировать уровень pH в крови всего за несколько минут.
Почки. Ваша почечная система также может регулировать уровень pH в крови. Ваши почки способны удалять лишние кислоты или основания. Но этот эффект может длиться часами или днями.
Химические буферные системы. В вашем организме также есть химические буферные системы — встроенные слабые кислоты и основания, — которые легко разрушаются. Они работают, регулируя пропорции кислот и оснований в вашем теле.
Другие химические системы вашего тела включают белки, гемоглобин и фосфаты. Система фосфатного буфера помогает регулировать уровень pH вашей мочи. Белки помогают регулировать pH в клетках.
Гемоглобин, основной белок в эритроцитах, помогает регулировать уровень pH.
Кислотно-основные расстройства
Возможно, в вашей крови слишком много кислоты. Это приводит к ацидозу. Когда в вашей крови слишком много щелочи (слишком щелочной), это называется алкалозом.
Ацидоз и алкалоз не являются болезнями, но они дают медицинским работникам подсказку о том, что у вас могут быть серьезные проблемы со здоровьем.
Ацидоз
Респираторный ацидоз. Это происходит, когда ваши легкие не могут удалить избыток углекислого газа, и он накапливается в вашем теле.
К причинам респираторного ацидоза относятся:
Ранние симптомы респираторного ацидоза включают:
Метаболический ацидоз. Это происходит, когда ваше тело производит слишком много кислоты или не может должным образом удалять кислоты.
Причины метаболического ацидоза включают:
- Проглатывание яда или слишком большого количества лекарства, такого как метанол, антифриз или аспирин
- Нарушение метаболизма из-за, например, плохо управляемого диабета 1 типа или продвинутая стадия шока
- Потеря слишком большого количества щелочи, например, из-за приступа диареи
- Недостаточное выведение кислоты, например, из-за того, что ваши почки не работают нормально
Если ваш метаболический ацидоз мягкий, вы можете нет никаких симптомов.В противном случае вы можете испытать:
Как ваше тело реагирует на ацидоз, вы можете почувствовать слабость, сонливость и растерянность. В тяжелых случаях могут развиться проблемы с сердцем и падение артериального давления. Это может привести к коме и смерти.
Алкалоз
Это когда ваше тело:
- Слишком много бикарбоната в крови (метаболический алкалоз)
- Теряет кислоту
- Имеет низкий уровень углекислого газа (респираторный алкалоз)
Респираторный алкалоз. Это может быть вызвано гипервентиляцией или учащенным дыханием. Такое дыхание приводит к удалению из организма слишком большого количества углекислого газа.
Гипервентиляция может быть вызвана:
- Тревожностью
- Боль
- Низкий уровень кислорода в крови
- Лихорадка
- Передозировка аспирина
Метаболический алкалоз. Это может быть вызвано:
- Сильная или продолжительная рвота, вызывающая потерю желудочного сока
- Потеря слишком большого количества жидкости или электролитов (например, калия или натрия), что влияет на контроль почками кислотно-щелочного баланса
- Гиперактивные надпочечники
- Некоторые диуретики
- Употребление слишком большого количества пищевой соды (бикарбоната соды)
Симптомы алкалоза включают:
- Покалывание в пальцах рук и ног, а также вокруг губ
- Судороги в мышцах
- Раздражительность
- Мышечные спазмы (при тяжелом алкалозе)
Иногда алкалоз может не вызывать никаких симптомов.
Диагностика кислотно-основных нарушений
Ваш врач может назначить анализы крови для измерения уровня pH и углекислого газа в вашей крови. Образец крови обычно берется из артерии запястья. Кровь из ваших вен не так надежна, как артериальная кровь при измерении pH крови.
При ацидозе врач может также измерить количество бикарбоната в крови. Чтобы выяснить причину ацидоза, могут потребоваться другие анализы крови.
При алкалозе врач может также измерить уровень электролитов в крови и моче.
Лечение кислотно-основных расстройств
Ваш врач будет работать над устранением причины вашего ацидоза или алкалоза.
Лечение метаболического ацидоза зависит от причины. Например, ваш врач может лечить ваш диабет 1 типа. Если у вас респираторный ацидоз, ваш врач будет работать над улучшением функции легких. Вам могут потребоваться препараты, открывающие дыхательные пути. Если у вас сильно нарушено дыхание, вам может понадобиться аппарат искусственной вентиляции легких, чтобы облегчить дыхание.

 содержание эритроцитов в крови составляет 5,8*1012/л. Оцените эти данные.
содержание эритроцитов в крови составляет 5,8*1012/л. Оцените эти данные. : эритроциты- 4,5*1012/л; лейкоциты- 8*109/л; нейтрофилы сегментоядерные – 62%, нейтрофилы палочкоядерные – 3%, базофилы – 1%, эозинофилы – 2%, лимфоциты – 24%, моноциты – 8%. Оцените эти данные.
: эритроциты- 4,5*1012/л; лейкоциты- 8*109/л; нейтрофилы сегментоядерные – 62%, нейтрофилы палочкоядерные – 3%, базофилы – 1%, эозинофилы – 2%, лимфоциты – 24%, моноциты – 8%. Оцените эти данные. системе АВО?
системе АВО? О какой группе крови идет речь?
О какой группе крови идет речь? О какой группе крови ищет речь?
О какой группе крови ищет речь?