К какому классу опасности относится серная кислота: В доступе на страницу отказано
N п/п | Код | Наименование вещества | Класс опасности |
1 | 0110 | диВанадий пентоксид (пыль) (Ванадия пятиокись) | 1 |
2 | 0128 | Кальций оксид (Негашеная известь) | — |
3 | 0133 | Кадмий оксид (в пересчете на кадмий) | 1 |
4 | 0134 | Кобальт (Кобальт металлический) | 2 |
5 | 0143 | Марганец и его соединения (в пересчете на марганца (IV) оксид) | 2 |
6 | 0146 | 2 | |
7 | 0163 | Никель (Никель металлический) | 2 |
8 | 0183 | Ртуть (Ртуть металлическая) | 1 |
9 | 0184 | Свинец и его неорганические соединения (в пересчете на свинец) | 1 |
10 | 0197 | Феррит марганеццинковый (в пересчете на марганец) | 2 |
11 | 0203 | Хром (Хром шестивалентный) (в пересчете на хрома (VI) оксид) | 1 |
12 | 0302 | Азотная кислота (по молекуле HNO3) | 2 |
13 | 0303 | Аммиак | 4 |
14 | 0316 | Гидрохлорид (Водород хлористый, Соляная кислота) (по молекуле HCl) | 2 |
15 | 0317 | Гидроцианид (Водород цианистый, Синильная кислота) | 2 |
16 | 0322 | Серная кислота (по молекуле H2SO4) | 2 |
17 | 0325 | Мышьяк, неорганические соединения (в пересчете на мышьяк) | 1 |
18 | 0328 | Углерод (Сажа) | 3 |
19 | 0329 | Селен диоксид (в пересчете на селен) | 1 |
20 | 0333 | Дигидросульфид (Сероводород) | 2 |
21 | 0334 | Сероуглерод | 2 |
22 | 0342 | Фтористые газообразные соединения — гидрофторид, кремний тетрафторид [Фтористые соединения газообразные (фтористый водород, четырехфтористый кремний)] (в пересчете на фтор) | 2 |
23 | 0349 | Хлор | 2 |
24 | 0402 | Бутан | 4 |
25 | 0403 | Гексан | 4 |
26 | 0404 | 1,3 — Диметилциклобутан (Диметилциклобутан, Димер аллена) | — |
27 | 0406 | Полиэтен (Полиэтилен) | |
28 | 0408 | Циклогексан | 4 |
29 | 0409 | Циклопентан (Пентаметилен) | — |
30 | 0410 | Метан | — |
31 | 0502 | Бут-1-ен (Бутилен) | 4 |
32 | 0524 | Циклопентадиены | — |
33 | 0602 | Бензол | 2 |
34 | 0616 | Диметилбензол (Ксилол) (смесь изомеров о-, м-, п-) | 3 |
35 | 0620 | Этенилбензол (Винилбензол, Стирол) | 2 |
36 | 0621 | Метилбензол (Толуол) | 3 |
37 | 0627 | Этилбензол | 3 |
38 | 0703 | Бенз/а/пирен (3,4-Бензпирен) | 1 |
39 | 0708 | Нафталин | 4 |
40 | 0713 | 1,2,3,4-Тетрагидронафталин (Тетралин) | — |
41 | 0801 | 3-Хлорпроп-1-ен (Аллил хлористый) | 2 |
42 | 0803 | Бензоилхлорид (Бензоил хлористый) | — |
43 | 0808 | Бромэтан (Бромистый этил, Этилбромид) | — |
44 | 0856 | 1,2-Дихлорэтан | 2 |
45 | 0906 | Тетрахлорметан (Углерод четыреххлористый) | 2 |
46 | 1051 | Пропан-2-ол (Изопропиловый спирт) | 3 |
47 | 1052 | Метанол (Метиловый спирт) | 3 |
48 | 1054 | Пропан-1-ол (Пропиловый спирт) | 3 |
49 | 1069 | Гидроксиметилбензол (Крезол (смесь изомеров: орто-, мета-, пара-)) | 2 |
50 | 1071 | Гидроксибензол (Фенол) | 2 |
51 | 1105 | Этоксиэтан (Диэтиловый эфир) | 4 |
52 | 1210 | Бутилацетат | 4 |
53 | 1240 | Этилацетат | 4 |
54 | 1301 | Проп-2-ен-1-аль (Акролеин) | 2 |
55 | 1325 | Формальдегид | 2 |
56 | 1401 | Пропан-2-он (Ацетон) | 4 |
57 | 1405 | Растворитель древесно-спиртовой марки А (ацетоноэфирный) (контроль по ацетону) | 4 |
58 | 1508 | Изобензофуран-1,3-дион (Ангидрид фталевый) (пары, аэрозоль) | 2 |
59 | 1512 | Проп-2-еновая кислота (Акриловая кислота) | 3 |
60 | 1530 | Гексагидро-2Н-азепин-2-он (-Капролактам) (пары, аэрозоль) | 3 |
61 | 1544 | Поли(окси-1,2-этандиилоксикарбонил-1,4-фениленкарбонил) (Полиэтилентерефталат) | — |
62 | 1551 | Бензол-1,4-дикарбоновая кислота (Кислота терефталевая) | 1 |
63 | 1555 | Этановая кислота (Уксусная кислота) | 3 |
64 | 1715 | Метантиол (Метилмеркаптан) | 4 |
65 | 1730 | Этенсульфид (Тииран, Этиленсульфид) | 1 |
66 | 1819 | Диметиламин | 2 |
67 | 1868 | 1-Амино-3-хлорбензол (3-Хлоранилин, м-Хлоранилин) | 1 |
68 | 1905 | Нитробензол | 2 |
69 | 2001 | Проп-2-еннитрил (Акрилонитрил) | 2 |
70 | 2031 | Диизоцианатметилбензол | 1 |
71 | 2034 | Формамид | 3 |
72 | 2117 | 0,0-Диэтилхлортиофосфат | 2 |
73 | 2119 | 0,0-Диметил-0-(3-метил-4-нитро-фенил) фосфат (Метилнитрофос) | 3 |
74 | 2418 | Пиридин | 2 |
75 | 2425 | Фуран-2-альдегид (Фурфурол) | 3 |
76 | 2507 | [4S-(4,4а,5а,6,12а)]-4-(Диметиламино) 1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентагидрокси-6-метил-1,11-диоксонафтацен-2-карбоксамид (Тетрациклин) | 2 |
77 | 2602 | Белково-витаминный концентрат (БВК) (по белку) | 2 |
78 | 2704 | Бензин (нефтяной, малосернистый) (в пересчете на углерод) | 4 |
79 | 2731 | Краска порошковая эпоксидная (ПЭП-971) | — |
80 | 2735 | Масло минеральное нефтяное (веретенное, машинное, цилиндровое и др. | — |
81 | 2738 | Растворитель бутилформиатный (БЭФ) (по сумме ацетатов) | 3 |
82 | 2748 | Скипидар (в пересчете на углерод) | 4 |
83 | 2753 | Флюс канифольный активированный (ФКТ) (контроль по канифоли) | 4 |
84 | 2755 | Флотореагент ФЛОКР-3 (по хлору) | 2 |
85 | 2756 | Фенольная фракция легкой смолы высокоскоростного пиролиза бурых углей | 2 |
86 | 2903 | Зола сланцевая | 3 |
87 | 2904 | Мазутная зола теплоэлектростанций (в пересчете на ванадий) | 2 |
88 | 2906 | Мелиорант (смесь: кальций карбонат, хлорид, сульфат — 79%; кремний диоксид — 10 — 13%; магний оксид — 3,5%; железо оксид — 1,6% и др. | 4 |
89 | 2907 | Пыль неорганическая, содержащая двуокись кремния выше 70% (Динас и др.) | 3 |
90 | 2908 | Пыль неорганическая: 70 — 20% двуокиси кремния (шамот, цемент, пыль цементного производства — глина, глинистый сланец, доменный шлак, песок, клинкер, зола, кремнезем и др.) | 3 |
91 | 2910 | Пыль клея карбамидного сухого | — |
92 | 2911 | Пыль комбикормовая (в пересчете на белок) | — |
93 | 2912 | Пыль костной муки (в пересчете на белок) | — |
94 | 2914 | Пыль (неорганическая) гипсового вяжущего из фосфогипса с цементом | — |
95 | 2915 | Пыль стекловолокна | — |
96 | 2916 | Пыль стеклопластика | — |
97 | 2917 | Пыль хлопковая | 3 |
98 | 2926 | Угольная зола теплоэлектростанций (с содержанием окиси кальция 35 — 40%, дисперсностью до 3 мкм и ниже не менее 97%) | 2 |
Сероводород h3S — Что такое Сероводород h3S?
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
Также является побочным продуктом нефтепереработки
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S — самое активное из серосодержащих соединений.
В нормальных условиях — бесцветный газ с неприятным запахом тухлых яиц.
Газ — потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле — 5 9 — 6 0; в керосине — 2 4 — 2 5; в легкой нефти — 1,5 — 1,75.
Взрывоопасен в смеси с воздухом в диапазоне 4 — 45% об.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки.
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Сероводород — токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Ощутимый запах — при концентрации H2S 1,4 — 2,3 мг/м3, значительный запах — 4 мг/м3, тяжелый запах — от 7 мг/м3.
Острое отравление наступает уже при концентрациях 0,2 — 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) — смертельна для человека.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне — 10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами — 3 мг/м3.
ПДК H2S в воздухе населенных мест- 0,008 мг/м3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
Получение H2S:
— реакция взаимодействия разбавленных кислот с сульфидами
— реакция взаимодействия сульфида алюминия с водой
— сплавление парафина с серой.
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
К примеру, в Черном море слои воды, расположенные глубже 150 -200 м содержат растворенный H2S.
Содержится в сырой нефти.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Кишечные газы человека и животных тоже содержат H2S. Чуть — чуть, но малоприятно.
Загрязняющие вещества 3 класса опасности — Челябинский гидрометеоцентр
Главная> Мониторинг среды> Загрязняющие вещества> Загрязняющие вещества 3 класса опасностиПыль. Взвешенные вещества.
Пыль – это вид аэрозоля, дисперсная система, состоящая из мелких твердых частиц, находящихся во взвешенном состоянии в газовой среде. Отдельные частицы или их скопления, от ультрамикроскопических до видимых невооруженным глазом, могут иметь любую форму и состав. В большинстве случаев пыль образуется в результате диспергирования твердых тел и включает частицы разных размеров, преимущественно в пределах 10-7-10-4 м. Они могут нести электрически заряд или быть электронейтральными. Концентрацию пыли (запыленность) выражают числом частиц или их общей массой в единице объема газа (воздуха). Пыль неустойчива: ее частицы соединяются в процессе броуновского движения или при оседании (седиментации).
Отдельные частицы или их скопления, от ультрамикроскопических до видимых невооруженным глазом, могут иметь любую форму и состав. В большинстве случаев пыль образуется в результате диспергирования твердых тел и включает частицы разных размеров, преимущественно в пределах 10-7-10-4 м. Они могут нести электрически заряд или быть электронейтральными. Концентрацию пыли (запыленность) выражают числом частиц или их общей массой в единице объема газа (воздуха). Пыль неустойчива: ее частицы соединяются в процессе броуновского движения или при оседании (седиментации).
Виды промышленной пыли:
1. Механическая пыль.
Промышленная пыль, образующаяся в результате измельчения продукта в ходе технологического процесса.
2. Возгоны.
Промышленная пыль, образующаяся в результате объемной конденсации паров веществ при охлаждении газа, пропускаемого через технологический аппарат, установку или агрегат.
3. Летучая зола.
Промышленная пыль в виде несгораемого остатка топлива, образующегося из его минеральных примесей при горении, содержащегося в дымовом газе во взвешенном состоянии.
4. Промышленная сажа.
Дисперсный углеродный продукт неполного сгорания или термического разложения углеводородов, состоящий из сферических частиц черного цвета. Средний размер сажевых частиц – 100-3500. Частицы сажи образованы из слоев углеродных атомов, подобных слоям в графите. Эти слои состоят из шестиугольников, в вершинах которых находятся атомы углерода, но, в отличии от графита, слои в саже не плоские, а изогнутые, что обуславливает сферическую поверхность частиц. Плотность сажевых частиц около 2 г/см3. Поверхность частиц в саже может быть шероховатой или гладкой.
Пыль и сажа относятся к 3 классу опасности.
ПДК вещества, мг/м3.
Максимальная разовая – 0,150
Среднесуточная – 0,05
Источники поступления пыли в атмосферу.
В воздухе содержатся частицы пыли и сажи, возникающей в результате выветривания горных пород, вулканических извержений, пожаров, ветровой эрозии пахотных земель, производственной деятельности человека. Пыль, как и другие виды аэрозолей, усиливает рассеяние и поглощение света атмосферой, влияет на ее тепловой режим.
Постоянные источники повышенной запыленности – отрасли металлургического, химического и текстильного производства, строительство и некоторые отрасли народного хозяйства (полеводство), многие транспортные средства.
Источниками выбросов сажи в атмосферу являются дизели, авиационные турбины, тепловые энергетические установки, лесные пожары и др. Концентрация сажевых частиц над океанами составляет 0,5 мкг/м3, а в приземном слое промышленно развитых районов она достигает 30 мкг/м3.
Сажа образуется при горении в промышленных и бытовых печах, при работе двигателей внутреннего сгорания (дизелях), выбрасывается вместе с продуктами горения в атмосферу в виде вредных дымов.
Сажевые частицы не взаимодействуют с кислородом воздуха, поэтому удаляются только за счет коагуляции и осаждения, которые идут достаточно медленно.
Основными источниками искусственных аэрозольных загрязнений воздуха являются ТЭС, которые потребляют уголь высокой зольности, обогатительные фабрики, металлургические, цементные, магнезитовые и сажевые заводы. Аэрозольные частицы от этих источников отличаются большим разнообразием химического состава. Чаще всего в их составе обнаруживаются соединения кремния, кальция и углерода, реже — оксиды металлов: железа, магния, марганца, цинка, меди, никеля, свинца, сурьмы, висмута, селена, мышьяка, бериллия, кадмия, хрома, кобальта, молибдена, а также асбест. Они содержатся в выбросах предприятий теплоэнергетики, черной и цветной металлургии, стройматериалов, а также автомобильного транспорта. Пыль, осаждающаяся в индустриальных районах, содержит до 20% оксида железа, 15% силикатов и 5% сажи, а также примеси различных металлов (свинец, ванадий, молибден, мышьяк, сурьма и т.д.).
Пыль, осаждающаяся в индустриальных районах, содержит до 20% оксида железа, 15% силикатов и 5% сажи, а также примеси различных металлов (свинец, ванадий, молибден, мышьяк, сурьма и т.д.).
Еще большее разнообразие свойственно органической пыли, включающей алифатические и ароматические углеводороды, соли кислот. Она образуется при сжигании остаточных нефтепродуктов, в процессе пиролиза на нефтеперерабатывающих, нефтехимических и других подобных предприятиях. Постоянными источниками аэрозольного загрязнения являются промышленные отвалы-искусственные насыпи из переотложенного материала, преимущественно вскрышных пород, образуемых при добыче полезных ископаемых или же из отходов предприятий перерабатываюшей промышленности, ТЭС.
Источником пыли и ядовитых газов служат массовые взрывные работы. Так, в результате одного среднего по массе взрыва (250-300 тонн взрывчатых веществ) в атмосферу выбрасывается около 2 тысяч м3 условного оксида углерода и более 150 тонн пыли.
Производство цемента и других строительных материалов также является источником загрязнения атмосферы пылью. Основные технологические процессы этих производств — измельчение и химическая обработка шихт, полуфабрикатов и получаемых продуктов в потоках горячих газов всегда сопровождается выбросами пыли и других вредных веществ в атмосферу.
Концентрация аэрозолей меняется в весьма широких пределах: от 10 мг/м3 в чистой атмосфере до 2.10 мг/м3 в индустриальных районах. Концентрация аэрозолей в индустриальных районах и крупных городах с интенсивным автомобильным движением в сотни раз выше, чем в сельской местности. Среди аэрозолей антропогенного происхождения особую опасность для биосферы представляет свинец, концентрация которого изменяется от 0,000001 мг/м3 для незаселенных районов до 0,0001 мг/м3 для селитебных территорий. В городах концентрация свинца значительно выше – от 0,001 до 0,03 мг/м3.
Влияние на живые организмы.
Пылевые частицы поглощают коротковолновую часть солнечного спектра, снижают количество достигающего земной поверхности ультрафиолета, что способствует ослаблению адаптивных свойств всех живых организмов. Они оседают на поверхности листьев растений, сокращая их способность к восприятию солнечного света.
Сажевые частицы в силу своей разветвленной поверхности способны адсорбировать значительные количества различных соединений, включая полиароматические. Таким образом, сажа играет важную роль в переносе вредных соединений в атмосфере.
Длительный контакт с сажей вызывает рак кожи, обостряются респираторные заболевания, истончается слизистая верхних дыхательных путей.
По данным Всемирной организации здравоохранения при концентрации пыли в атмосферном воздухе 0,08 мг/м3, ощущается дискомфорт у людей. При дальнейшем увеличении содержания пыли до 0,25-0,5 мг/м3 наблюдается ухудшение состояния больных с легочными заболеваниями. Постоянное пребывание людей в атмосфере с концентрацией пыли выше 0,5 мг/м3 приводит к более частым заболеваниям и возрастанию смертности.
Постоянное пребывание людей в атмосфере с концентрацией пыли выше 0,5 мг/м3 приводит к более частым заболеваниям и возрастанию смертности.
Диоксид серы.
В нормальных условиях диоксид серы – бесцветный газ с характерным резким запахом (запах загорающейся спички). Растворимость газа в воде – достаточно велика.
Диоксид серы – реакционно-способен, из-за химических превращений время его жизни в атмосфере – невелико (порядка нескольких часов). В связи с этим возможности загрязнения и опасность воздействия непосредственно диоксида серы носят локальный, а в отдельных случаях – региональный характер.
Природные и антропогенные источники поступления в окружающую среду.
К природным (естественным) источникам диоксида серы относят вулканы, лесные пожары, морская пена и микробиологические превращения серосодержащих соединений. Выделяющийся в атмосферу диоксид серы может связываться известью, в результате чего в воздухе поддерживается его постоянная концентрация около 1 млн-1.
Выделяющийся в атмосферу диоксид серы может связываться известью, в результате чего в воздухе поддерживается его постоянная концентрация около 1 млн-1.
Диоксид серы антропогенного происхождения образуется при сгорании угля и нефти, в металлургических производствах, при переработке содержащих серу руд (сульфиды), при различных химических технологических процессах. Большая часть антропогенных выбросов диоксида серы (около 87%) связана с энергетикой и металлургической промышленностью. Общее количество антропогенного диоксида серы, выбрасываемое за год превышает его естественное образование в 20-30 раз.
Ежегодное поступление сернистого газа в атмосферу только вследствие промышленных выбросов оценивается почти в 150 млн. т.
Поведение в атмосфере.
Время пребывания диоксида серы в атмосфере в среднем исчисляется двумя неделями. Этого времени мало для того, чтобы газ мог распространиться в глобальном масштабе. Поэтому, в соседних географических районах, где осуществляются как большие, так и умеренные выбросы диоксида серы, в атмосфере может наблюдаться большое различие концентраций диоксида серы.
Поэтому, в соседних географических районах, где осуществляются как большие, так и умеренные выбросы диоксида серы, в атмосфере может наблюдаться большое различие концентраций диоксида серы.
Легкорастворимый в воде, образующий кислоту газ, может разноситься мощными потоками воздуха на сотни километров (до 1500 км). При этом в облаках идет реакция образования кислот и возможно выпадение кислотных дождей.
Во время переноса диоксида серы и другие кислотные выбросы лишь в очень малой степени теряют свою активность. Нейтрализация происходит только в том случае, если в воздухе одновременно с диоксидом серы находится пыль, содержащая гидроксиды щелочных и щелочноземельных элементов. Атмосфера очищается, главным образом, при вымывании кислых газов водой и снегом, а также при их «сухом» осаждении, т.е. в виде самого газа или адсорбированного на мельчайших частицах пыли. Кроме того, диоксид серы растворяется в мельчайших капельках тумана, которые после осаждения также относят к сухой части загрязнений.
Сухая часть загрязнений обычно выпадает либо в непосредственной близости от источника выбросов, либо на незначительном удалении от него. При длительном переносе воздухом в основном выпадает связанная водой часть выбросов.
В атмосфере диоксид серы претерпевает ряд химических превращений, важнейшие из них – окисление и образование кислоты.
Окисление может проходить разными путями и в силу разных причин. Например, УФ-излучение может перевести молекулу диоксида серы в возбужденное состояние, при длине волны менее 320 нм – в синглетное возбужденное состояние, при длине волны 320-390 нм в триплетное. Молекулы диоксида серы, находящиеся в триплетном состоянии, реагируют с кислородом воздуха и через радикалы SO42- превращаются в молекулы SO3.
Большее значение все же имеет окисление с помощью радикалов ОН—. При этом возможна и реакция с озоном:
SO2 + О3 = SO3 + О2
Во влажной атмосфере образуется серная кислота.
В насыщенной парами воды фазе, например, в облаках, диоксид серы сначала образует сернистую кислоту, которая с озоном и пероксидом водорода дает серную кислоту:
Н2SО3— + О3 → SО42- + Н+ + О2
НSО3— + Н2О2 → SО42- + Н+ + Н2О
Реакционный пероксид водорода может образоваться из органических пероксидов во влажном воздухе.
Как диоксид серы, так и НSО3— в несколько промежуточных стадий могут превратиться в серную кислоту с помощью ионов металлов, которые могут присутствовать в воздухе, а также в облаках.
Сернистый газ с водой воздуха образует капельки серной кислоты. Растворы серной кислоты могут долго держаться в воздухе в виде плавающих капелек тумана или выпадать вместе с дождем на землю. Эти растворы разъедают металлы, краски, синтетические соединения, ткани, губительно действуют на растения и животных.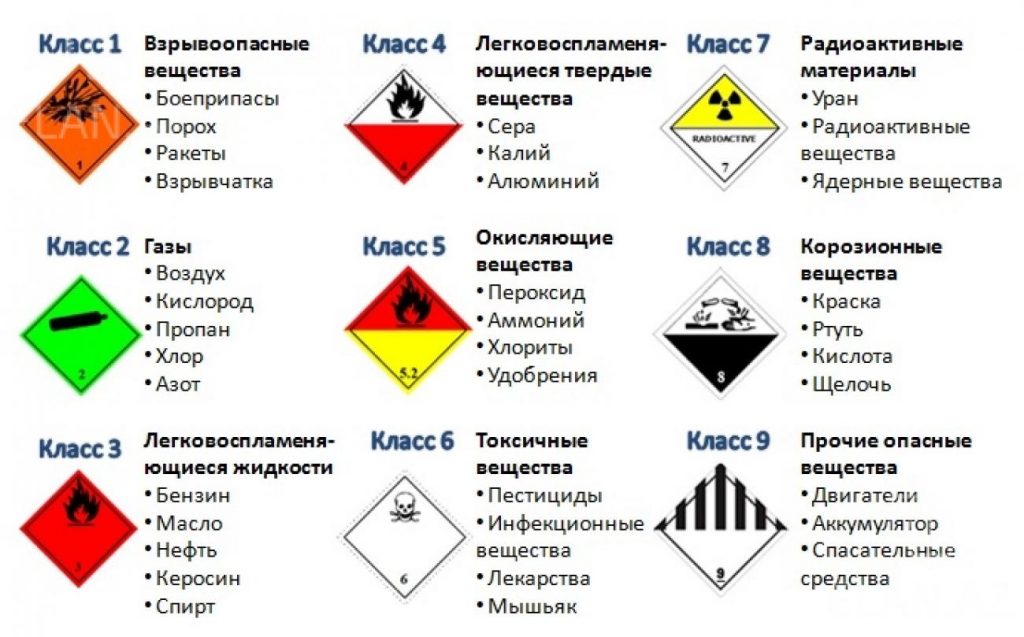 Попадая на землю, серная кислота подкисляет почвы. В результате этого сокращается почвенная фауна, что отрицательно сказывается на урожае.
Попадая на землю, серная кислота подкисляет почвы. В результате этого сокращается почвенная фауна, что отрицательно сказывается на урожае.
Воздействие на живые организмы.
Класс опасности вещества – 3.
При повышенной концентрации пыли токсическое действие диоксида серы проявляется значительно сильнее, чем в воздухе, свободном от пыли.
Комбинация диоксида серы с оксидами азота значительно увеличивает число заболеваний дыхательных путей.
При среднесуточной концентрации сернистого газа 0,1-0,2 мг/м3 у населения наблюдается обострение заболеваний верхних дыхательных путей. Резкое увеличение числа случаев заболеваемости бронхитами у людей старше 55 лет отмечается на следующий день после повышения среднесуточной концентрации сернистого газа до 0,7 мг/м3.
Повышение уровня загрязнения сернистым газом вызывает либо хроническое, либо острое кратковременное поражение листьев растений, что приводит к замедлению роста зеленой массы и снижению урожайности.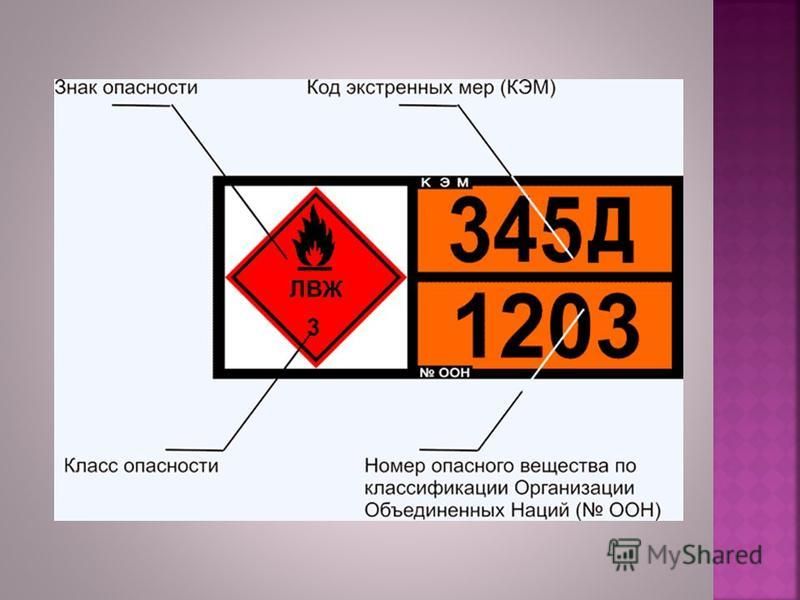 Разрушается хлорофилл растений, повреждаются листья и хвоя. Пораженные участки приобретают бронзовую окраску. На листьях также появляются бледные пятна, которые затем приобретают бронзовый цвет, затем листья опадают. Наиболее чувствительными к диоксиду серы являются хвойные деревья. Сосна погибает при среднегодовой концентрации сернистого газа 0,18-0,20 мг/м3. Лиственные деревья начинают поражаться при концентрации диоксида серы от 0,5 до 1 мг/м3.
Разрушается хлорофилл растений, повреждаются листья и хвоя. Пораженные участки приобретают бронзовую окраску. На листьях также появляются бледные пятна, которые затем приобретают бронзовый цвет, затем листья опадают. Наиболее чувствительными к диоксиду серы являются хвойные деревья. Сосна погибает при среднегодовой концентрации сернистого газа 0,18-0,20 мг/м3. Лиственные деревья начинают поражаться при концентрации диоксида серы от 0,5 до 1 мг/м3.
Оксиды серы ощутимо ускоряют в городах коррозию металлов — в 1,5-5 раз по сравнению с сельской местностью. В одном из городов США увеличение концентрации SO2 в 3 раза сопровождалось увеличением скорости коррозии цинка в 4 раза.
Особенно опасно для растений высокое содержание сернистого газа, например, при интенсивном освещении и большой относительной влажности воздуха, а также на стадиях цветения и плодоношения. Хроническое повреждение листьев растений происходит в результате постепенного накопления в их тканях избыточного количества сульфатов. Сульфаты также окисляют почву и снижают ее плодородие.
Сульфаты также окисляют почву и снижают ее плодородие.
Магний.
Магний – элемент II группы, в земной коре содержится порядка 1,87 массовой доли магния. Магний – характерный элемент мантии Земли. В магматических процессах магний – аналог железа.
Миграция в окружающей среде
В биосфере наблюдается энергичная миграция и дифференциация магния: здесь главная роль принадлежит физико-химическим процессам — растворению, осаждению солей, сорбции магния глинами. Магний слабо задерживается в круговороте веществ на континентах и с речным стоком поступает в океаны. Морская вода не насыщена магнием и осаждение его солей не происходит. При испарении морской воды магний снова попадает на континенты.
Влияние на живые организмы
Магний – постоянная и необходимая часть растительных и животных организмов, входит в состав всех органелл клеток. Магний входит в состав хлорофилла растений, активирует многие ферменты живых организмов.
Магний входит в состав хлорофилла растений, активирует многие ферменты живых организмов.
В человеческом организме накапливается в печени, затем переходит в кости и мышцы. Магний – антагонист кальция в организме, при избытке магния, при рахите он может вытеснять кальций из костей.
Соединения магния относятся к 3 классу опасности по воздействию на людей.
«назад»
«Диоксид серы может оказывать пагубное воздействие на здоровье человека»
Спутники NASA обнаружили 500 новых источников загрязнения воздуха, около 40 из них опасны диоксидом серы. Это вещество считается одним из самых рискованных для атмосферы Земли. Такие данные публикует Nature Geoscience. По данным журнала, большинство очагов расположены в России, Мексике и ближневосточных странах. Эти источники могут иметь как природное, так и техногенное происхождение, отметил руководитель программы «Климат и энергетика» Всемирного фонда дикой природы Алексей Кокорин.
«В 70-80-е годы была проблема кислотных дождей, гибель озер в Скандинавии, да и на севере России тоже, а так же лондонский смог — думали, что это такой плохой климат в Лондоне. Оказалось, нет — это при сжигании угля образуется двуокись серы и мельчайшая взвесь серной кислоты. Если это попадало в озера, там гибло все. После того, как ввели жесткие ограничения на выбросы двуокиси серы на угольных электростанциях, ситуация кардинально улучшилась, но кроме этого, конечно, есть природные источники, прежде всего, вулканы», — объяснил «Коммерсантъ FM» Кокорин.
На обнаруженные источники приходится около 10% от общего уровня загрязнения атмосферы диоксидом серы. Это от 7 до 14 млн тонн в год. Вещество приводит к сердечно-сосудистым и онкологическим заболеваниям, а также наносит непоправимый ущерб природе, сообщила руководитель проектов токсической программы Greenpeace Нина Лесихина.
«Диоксид серы — крайне токсичное вещество. При повышенных концентрациях он может оказывать пагубное воздействие на здоровье человека, приводит к закислению почвы, интоксикации животных, растений, нарушению баланса экосистемы.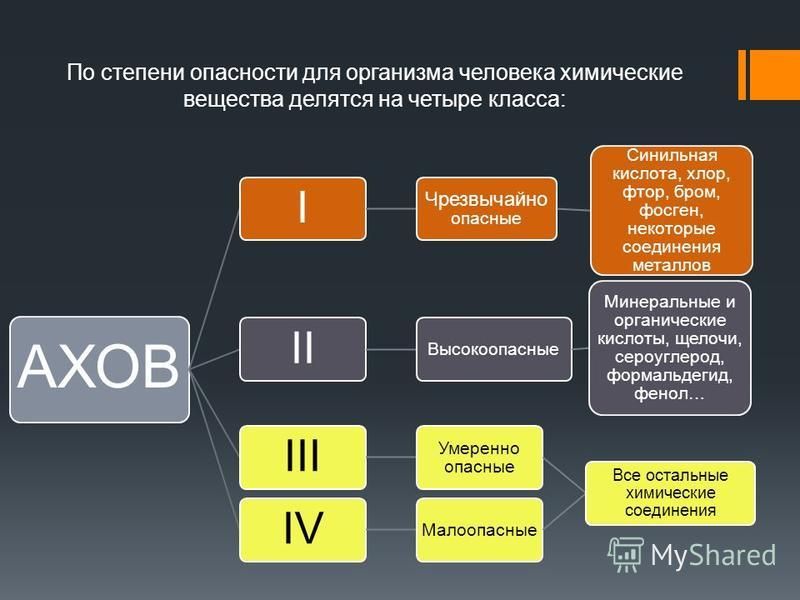 Например, предприятия «Норильского никеля» известны лунными ландшафтами, где почва, фактически, выжжена диоксидом серы и кислотными дождями. И, конечно же, если мы говорим о жителях городов, теплоэлектростанции, которые работают в пределах мегаполисов, также являются источниками выбросов диоксида серы», — подчеркнула Лесихина.
Например, предприятия «Норильского никеля» известны лунными ландшафтами, где почва, фактически, выжжена диоксидом серы и кислотными дождями. И, конечно же, если мы говорим о жителях городов, теплоэлектростанции, которые работают в пределах мегаполисов, также являются источниками выбросов диоксида серы», — подчеркнула Лесихина.
Промышленным предприятиям необходимо переходить на более экологичные виды топлива или придумывать новые способы переработки серы, это помогло бы частично решить проблему загрязнений. Так считает научный руководитель Института экономики природопользования и экологической политики Высшей школы экономики Александр Багин.
«Большие выбросы серы происходят при нефтегазовом секторе, потому что сероводород сопутствует этому, металлургических предприятиях. Это крупнейшая отраслевая проблема, связанная с тем, что экономически приемлемых технологий для обработки огромного количества серы практически не существует — ее либо в промышленных условиях перерабатывают в серную кислоту, которая сама по себе является достаточно ликвидным продуктом, либо там большое количество элементной серы, которая может использоваться в качестве удобрений, но ее слишком много, а спрос не такой, чтобы можно было сбывать это экономически приемлемо», — отметил Багин.
По данным журнала Nature Geoscience, диоксид серы задерживается в атмосфере ненадолго, всего на несколько дней, а иногда — часов. Однако из-за его огромного вреда следить за ним необходимо.
Анастасия Ройзман
Классификация опасных грузов | Полезная информация
Классы
Вещества (включая смеси и растворы) и изделия относятся к одному из девяти классов в зависимости от вида опасности или преобладающего из видов опасности, которыми они характеризуются. Некоторые из этих классов подразделяются на категории. Имеются следующие классы и категории:
Класс 1 — Взрывчатые вещества.
Категория 1.1 Вещества и изделия, которые характеризуются опасностью взрыва массой.
Категория 1.2 Вещества и изделия, которые характеризуются опасностью разбрасывания, но не создают опасности взрыва массой.
Категория 1.3 Вещества и изделия, которые характеризуются опасностью загорания, а также либо незначительной опасностью взрыва, либо незначительной опасностью разбрасывания. Либо тем или другим, но не характеризуются опасностью взрыва массой.
Категория 1.4 Вещества и изделия, которые не представляют значительной опасности.
Категория 1.5 Вещества очень низкой чувствительности, которые характеризуются опасностью взрыва массой.
Категория 1.6 Изделия чрезвычайно низкой чувствительности, которые не характеризуются опасностью взрыва массой.
К транспортировке на A319/320/321 принимается только Категория 1.4 S (RXS).
Пример. Патроны для ружей и пистолетов, некоторые фейерверки, безопасные взрыватели.
Взрывчатое вещество — этикетка
Класс 2 — Газы.
Веществам класса 2 присваивается одна из трех категорий с учетом основной опасности газа во время перевозки.
Категория 2.1 — Легковоспламеняющиеся газы — RFG.
Пример. Зажигалки.
Категория 2.2 — Невоспламеняющиеся нетоксичные газы — RNG, RCL.
Пример. Углекислый газ, кислород, огнетушители, аэрозоли.
Важно. Перевозка токсических газов на рейсах U6 запрещена!
RFG Легковоспламеняющийся газ
Невоспламеняющийся нетоксичный газ
RPG Токсичный газ
Класс 3 — Легковоспламеняющиеся жидкости.
Класс 3 RFL включает в себя следующие вещества:
- легковоспламеняющиеся жидкости;
- жидкие десенсибилизированные взрывчатые вещества.
Пример. Краски, клеи, лаки, растворители, спирты, бензин.
RFL Знак — легковоспламеняющиеся жидкости
Класс 4 — Легковоспламеняющиеся твердые вещества, вещества, подверженные самопроизвольному возгоранию, вещества, выделяющие легковоспламеняющиеся газы при взаимодействии с водой.

Категория 4.1 — Легковоспламеняющиеся твердые вещества — RFS.
Пример. Сера.
Категория 4.2 — Вещества, подверженные самопроизвольному возгоранию — RSC.
Пример. Белый и желтый фосфор.
Категория 4.3 — Вещества, выделяющие легковоспламеняющиеся газы при взаимодействии с водой — RFW.
Пример. Литий.
RFS Легковоспламеняющееся твердое вещество
RSC Самовозгорающееся вещество
Вещество, выделяющее легковоспламеняющийся газ при взаимодействии с водой
Класс 5 — Окисляющие вещества и органические перекиси.
Категория 5.1 — Окисляющие вещества — ROX.
Категория 5.2 — Органические перекиси — ROP.
ROX знак — Окисляющие вещества
ROP знак — Органические перекиси
Класс 6 — Токсические и инфекционные вещества.
Категория 6.1 Токсические вещества — RPB.
Пример. Мышьяк, никотин, цианиды, пестициды.
Категория 6.2 Инфекционные вещества — RIS.
Пример. Бактерии, вирусы, диагностические образцы.
RPB знак — Токсическое вещество
RIS знак — Инфекционное вещество
Класс 7 — Радиоактивный материал.
Категория I — Белая — RRW.
Категория II — Желтая — RRY.
Категория III — Желтая — RRY.
Пример. Кобальт, йод, цезий.
Делящийся материал.
Пример. Плутоний 239, уран 233.
При перевозке делящегося материала в дополнении к основной этикетке со знаком опасности необходимо использовать этикетку Делящийся материал.
Важно. Перевозка радиоактивных материалов на рейсах U6 временно не производится!
RRW — Категория I
RRY — Категория II
RRY — Категория III
Делящийся материал
Радиоактивный материал (на контейнер)
Класс 8 — Коррозионные вещества.

Вещества класса 8 — это вещества, которые химическим воздействием вызывают серьезное поражение живой ткани при контакте с нею или, в случае утечки, физический ущерб другим грузам или транспортным средствам либо даже вызвать их разрушение — RCM.
Пример. Кислотные батареи, ртуть, серная кислота.
RCM Знак — Коррозионное вещество
Класс 9 — Прочие опасные вещества и изделия.
- Прочие опасные грузы — RMD.
- Двуокись углерода твердая (Сухой Лед) — ICE.
- Намагниченный материал — любой материал, напряженность магнитного поля которого при упаковывании для воздушной перевозки составляет 0,159 А/м или более на расстоянии 2,1 м от любой точки на поверхности готового грузового места — MAG.
- Вспенивающаяся полимерная смола — RSB.
Примечание. Знак «прочие опасные грузы» должен быть использован для прочих опасных грузов: «сухого льда» и «полимерной смолы». Для намагниченного материала и сухого льда см. знаки в пункте 1.3.2.3.
Для намагниченного материала и сухого льда см. знаки в пункте 1.3.2.3.
RMD Знак — Прочие опасные грузы
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43
(третья
ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая
кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO хлорноватистая кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная
название
кислоты,
записываем
сначала
водород, а затем
кислотообразующий
элемент. Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Степень окисления
водорода в
кислотах
всегда +1. Степень
окисления
элемента
отрицательная.
Она равна
номеру
группы ПСЭ (в
которой
находится
элемент)
минус восемь.
Например: сероводородная кислота элемент сера, расположен в шестой группе ПСЭ. 6 — 8 = -2. Степень окисления серы 2. Записываем символы водорода и серы Н+S-2, т.к. молекула электронейтральна, то формула кислоты будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например:
метафосфорная
кислота
кислотообразующий
элемент
фосфор.
Суффикс н показывает,
что он имеет
максимальную
степень
окисления,
фосфор в
пятой группе
ПСЭ,
следовательно,
максимальная
степень
окисления +5,
она
сохраняется
и в оксиде
фосфора Р2+5О5-2.
Приставка
мета
говорит о
том, что воды
в кислоте
минимальное
количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O → H6P2O8 → 2H3PO4 ортофосфорная кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие
2. Бескислородные
Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %) 2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые
2. Нерастворимые
Растворимые
2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом. Кислоты
имеют кислый
вкус.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3 раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
серной кислоты: OSH Answers
Вдыхание: Примите меры для обеспечения собственной безопасности перед попыткой спасения (например, наденьте соответствующее защитное снаряжение). Переместите пострадавшего на свежий воздух. Сохраняйте покой в удобном для дыхания положении. Если дыхание затруднено, обученный персонал должен дать кислород в экстренной ситуации. НЕ позволяйте жертве без надобности перемещаться. Симптомы отека легких могут проявиться позже. Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу.
Контакт с кожей: Избегайте прямого контакта. При необходимости надеть химзащитную одежду. Быстро снимите зараженную одежду, обувь и изделия из кожи (например, ремешки для часов, ремни). Быстро и аккуратно промокните или смахните излишки химикатов. Немедленно промойте слегка теплой проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывание во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу. Сделайте двойной пакет, запечатайте, заклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте для безопасной утилизации.
Немедленно позвоните в токсикологический центр или к врачу.Срочно требуется лечение. Транспорт в больницу. Сделайте двойной пакет, запечатайте, заклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте для безопасной утилизации.
Контакт с глазами: Избегайте прямого контакта. При необходимости используйте перчатки химической защиты. Быстро и аккуратно промокните или смахните химические вещества с лица. Немедленно промойте загрязненный глаз (-а) теплой, слегка проточной водой в течение не менее 30 минут, удерживая веки открытыми. При наличии контактных линз НЕ откладывайте промывку и не пытайтесь снять линзу.Можно использовать нейтральный физиологический раствор, как только он станет доступен. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу. Следите за тем, чтобы не смывать загрязненную воду непораженными глазами или лицом. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Транспорт в больницу.
Проглатывание: Попросите пострадавшего прополоскать рот водой. Если рвота происходит естественным путем, попросите пострадавшего наклониться вперед, чтобы снизить риск аспирации.Попросите потерпевшего снова прополоскать рот водой. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Комментарии по оказанию первой помощи: Некоторые из рекомендуемых здесь процедур первой помощи требуют углубленного обучения навыкам оказания первой помощи. Все процедуры первой помощи следует периодически пересматривать врач, знакомый с химическим веществом и условиями его использования на рабочем месте.
12,1 Кислоты
12.1.1 Опасности кислот
Кислоты являются донорами протонов.Они разъедают глаза, кожу и слизистые оболочки. Кислотная коррозия или ожог ткани зависит как от pH, так и от способности определенных анионов соединяться с белком. В отличие от ожогов от сильных щелочей, кислотные ожоги вызывают немедленную болезненность отчасти из-за образования белкового слоя, препятствующего дальнейшему проникновению кислоты. Диапазон pH кислот составляет от 0 до 6,9 (вода = 7,0 = нейтральный).
В отличие от ожогов от сильных щелочей, кислотные ожоги вызывают немедленную болезненность отчасти из-за образования белкового слоя, препятствующего дальнейшему проникновению кислоты. Диапазон pH кислот составляет от 0 до 6,9 (вода = 7,0 = нейтральный).
Значение pH примерно от 0 до 3 соответствует сильной кислоте . Некоторые неорганические кислоты попадают в этот диапазон.Слабые кислоты (pH от 3 до 7) включают разбавленные растворы уксусной кислоты и борную кислоту. Слабые кислоты раздражают кожу при непродолжительном контакте и могут вызвать ожоги при длительном контакте. См. Раздел 12.3, Коррозионные вещества.
Хромовая, соляная, азотная, пикриновая, хлорная и серная кислоты являются опасными кислотами, которые обсуждаются отдельно в сводках по химической безопасности .
12.1.2 Порядок обращения с кислотами
При работе с сильными кислотами используйте перчатки из материала, подходящего для используемой кислоты.Для окисляющих кислот используйте 4H или неопреновые перчатки. Бутилкаучук можно использовать с большинством органических и минеральных кислот. Также необходимо использовать защитную маску, защитные очки и лабораторный халат. При работе с концентрированными кислотами поверх лабораторного халата следует надевать неопреновый фартук.
Бутилкаучук можно использовать с большинством органических и минеральных кислот. Также необходимо использовать защитную маску, защитные очки и лабораторный халат. При работе с концентрированными кислотами поверх лабораторного халата следует надевать неопреновый фартук.
12.1.3 Хранение кислот
Кислоты хранятся в двух группах:
Группа 3: Окисляющие кислоты (азотная, серная, хлорная и фосфорная кислоты), которые должны иметь двойную изоляцию и храниться в шкафу безопасности отдельно от других кислот.
Группа 4: Органические и минеральные кислоты следует хранить в шкафу безопасности отдельно от окисляющих кислот.
12.1.4 Утилизация кислот
Некоторые кислоты (например, соляная кислота, серная кислота и уксусная кислота) могут быть нейтрализованы в соответствии с процедурами, изложенными в главе VI «Директория по опасным отходам». После нейтрализации эти кислоты могут быть удалены. Другие кислоты, такие как хромовая или азотная, должны быть маркированы и собраны EH&S.
Другие кислоты, такие как хромовая или азотная, должны быть маркированы и собраны EH&S.
12.1.5 Действия в чрезвычайных ситуациях: воздействие
Кожа: Снимите пораженную одежду и промойте открытые ткани обильным количеством воды в течение 15 минут. Если место ожога, обратитесь в отделение неотложной помощи больницы для лечения.
Глаза / лицо: Промыть глаза жидкостью для глаз в течение 15 минут, держа веки открытыми. Если были открыты глаза, обратитесь к врачу для оценки.
Как можно скорее заполните форму отчета о несчастном случае и отправьте ее в EH&S по адресу J3-200.
12.1.6 Ликвидация аварийных ситуаций: разливы
Надев защитные очки, перчатки и лабораторный халат, осторожно добавьте впитывающие полотенца в небольшие пролитые органические кислоты, разбавьте водой и трижды промойте область. В случае крупных разливов (> 200 мл) обратитесь в EH&S для очистки.
Класс опасных отходов 8 — Коррозионные жидкости
Если ваша компания использует коррозионные жидкости, следует проявлять особую осторожность. Это связано с тем, что опасные отходы, коррозионные жидкости класса 8 разрушают и повреждают другие вещества, с которыми они вступают в контакт.
Это связано с тем, что опасные отходы, коррозионные жидкости класса 8 разрушают и повреждают другие вещества, с которыми они вступают в контакт.
Опасные отходы Коррозионные жидкости класса 8 обычно представляют собой сильные кислоты или сильные основания, и в зависимости от содержащихся в них соединений они могут по-разному реагировать с различными металлами и полимерами.
Однако большее беспокойство вызывает ущерб, который этот тип опасных отходов может причинить коже человека в течение определенного периода времени. Ниже мы рассмотрим некоторые из наиболее часто задаваемых вопросов, касающихся:
- Что такое жидкости класса 8,
- Как они должны быть отправлены, и
- Почему важно от них правильно утилизировать.
Кислоты и основания значительно различаются по своей силе и обычно могут быть измерены по шкале pH от 0 до 14. Чистая вода считается нейтральной при 7. Сильная кислота обычно имеет pH 2 или ниже, в то время как сильное основание с pH не ниже 12.
Сильная кислота обычно имеет pH 2 или ниже, в то время как сильное основание с pH не ниже 12.
Жидкости класса 8 обычно попадают в один из этих крайних значений pH. И кислоты, и щелочи используются в широком спектре промышленных производств и чистящих средств, а их побочные продукты остаются чрезвычайно опасными даже после разбавления.
Одним из наиболее распространенных примеров жидкости класса 8 является аккумуляторная жидкость. Другие примеры включают серную кислоту, гидроксид натрия и соляную кислоту.
Как их следует отправлять?
Свод федеральных правил США делит коррозионные вещества класса 8 на три группы упаковки в зависимости от степени опасности при транспортировке. Группа упаковки I указывает на наибольшую опасность, а Группа III указывает на незначительную опасность.
Вот определения:
Группа упаковки I — Материалы, которые вызывают полное разрушение неповрежденной кожной ткани в течение периода наблюдения продолжительностью до 60 минут, начиная с момента воздействия в течение трех минут или меньше.
Группа упаковки II — Материалы, кроме тех, которые соответствуют критериям группы упаковки I, которые вызывают полное разрушение неповрежденной кожной ткани в течение периода наблюдения продолжительностью до 14 дней, начиная с момента воздействия более трех минут, но не более 60 минут.
Группа упаковки III — Материалы, кроме тех, которые соответствуют критериям группы упаковки I или II:
- Которые вызывают разрушение неповрежденной кожной ткани на всю толщину в течение периода наблюдения продолжительностью до 14 дней, начиная с периода воздействия более 60 минут, но не более 4 часов; или
- Не вызывают полного разрушения неповрежденной кожной ткани, но демонстрируют скорость коррозии стальных или алюминиевых поверхностей, превышающую 6,25 мм (0,25 дюйма) в год при температуре испытания 55 ° C (130 ° F).
Вы можете просмотреть Таблицу коррозионных веществ класса 3 , в которой подробно описаны способы их доставки, необходимое защитное оборудование и другая техническая информация.
Также важно соблюдать любые другие требования к транспортировке при транспортировке этих опасных материалов, такие как:
- Грузовой манифест: В 2018 году Агентство по охране окружающей среды начало внедрение национальной системы электронных манифестов, которая отслеживает перевозки опасных отходов в электронном виде.В течение нескольких десятилетий EPA ввело систему манифеста, которая отслеживает опасных отходов от колыбели до могилы .
- Надлежащие этикетки для опасных отходов: DOT требует, чтобы производители опасных отходов маркировали каждую упаковку отходов перед транспортировкой за пределы объекта. На этикетке класса 8, в частности, есть символ, показывающий, что жидкость выливается из двух стеклянных сосудов и приводит к повреждению руки и куска металла. Плакат также выполнен в черно-белом цвете и имеет цифру «8».”
- Требования Калифорнии: Департамент контроля токсичных веществ Калифорнии (DTSC) также предоставляет свой собственный набор требований, которым должны следовать производители, в том числе:
- Состав и физическое состояние отходов
- Заявление, обращающее внимание на опасные свойства отходов
- Название и адрес производителя
Как упоминалось выше, законная и ответственная утилизация агрессивных жидкостей регулируется федеральными законами и законами штата. Министерство транспорта США, EPA и Калифорнийский DTSC запрещают утилизировать коррозионные жидкости как обычные отходы.
Министерство транспорта США, EPA и Калифорнийский DTSC запрещают утилизировать коррозионные жидкости как обычные отходы.
Это связано с тем, что воздействие агрессивных жидкостей может иметь катастрофические последствия для сотрудников и любого окружающего оборудования. Важно ограничить ответственность и расходы вашей организации в случае утечки опасных отходов.
В то время как большинство производителей опасных отходов осознают, что они несут ответственность за безопасную утилизацию своих отходов, многие не осознают, что существуют «полные» требования, которым они должны следовать.Чтобы соответствовать требованиям Закона о сохранении и восстановлении ресурсов (RCRA), производители несут ответственность за опасные отходы, которые они производят от первоначального образования, транспортировки и до окончательной утилизации.
Итог Если вы компания, которая использует коррозионные жидкости, важно правильно маркировать, хранить, транспортировать и утилизировать эти вещества.

 )
) ) (Пыль мелиоранта)
) (Пыль мелиоранта)