Источники контаминации мяса птицы: Микрофлора мяса птицы
Лекция 2 . Контаминация мясной туши при боенских операциях
Мясо животных и птицы, получаемое на мясокомбинатах и птицекомбинатах, содержит микроорганизмы, которые попадают в него в результате микробного обсеменения тканей животных до и после их убоя. Микроорганизмы, находящиеся в мясе, могут размножаться, поскольку этот продукт является хорошей питательной средой для их развития.
В целях сохранения качества мясо подвергают холодильному хранению, посолу, сушке и другим видам обработки. При этом изменяется состав микрофлоры мяса. Нарушение условий хранения, а, следовательно, размножение определенных групп микроорганизмов приводят к возникновению различных пороков мяса.
Микроорганизмы, как правило, не содержатся в крови, мышцах и во внутренних органах здоровых животных, имеющих высокую сопротивляемость организма. Об этом свидетельствуют данные микробиологических исследований продуктов убоя здоровых и отдохнувших животных, убитых и вскрытых с соблюдением правил стерильности. Между тем, при убое животных в условиях мясокомбинатов получают продукты убоя (мясо, внутренние органы), которые содержат сапрофитные микроорганизмы (гнилостные бактерии, бактерии группы кишечных палочек, споры плесневых грибов, актиномицеты, кокковые бактерии и др.), а в отдельных случаях сальмонеллы, палочку перфрингенс и другие патогенные микроорганизмы.
Различают, как уже говорилось, прижизненное и послеубойное обсеменение органов и тканей животных микроорганизмами.
Прижизненное
(предубойное) обсеменение.
Проникновение и нахождение микроорганизмов
во внутренних органах и тканях еще до
убоя животных (прижизненное обсеменение)
наблюдается у животных, больных
инфекционными болезнями. Возбудитель
болезни проникает в восприимчивый
организм, подавляет его защитные силы,
размножается, а затем распространяется
по организму.
У здоровых животных прижизненное эндогенное обсеменение органов и тканей микроорганизмами происходит при ослаблении естественной сопротивляемости (резистентности) организма под влиянием различных неблагоприятных (стрессовых) факторов: утомления, голодания, переохлаждения или перегревания, травм и пр. При нормальном состоянии защитных сил животных стенка кишечника представляет собой почти непреодолимое препятствие для микроорганизмов. В результате снижения сопротивляемости организма создаются благоприятные условия для проникновения микроорганизмов из кишечника через лимфатические и кровеносные сосуды в органы и ткани, в том числе в мышцы. При этом могут проникать не только сапрофиты — постоянные обитатели кишечного тракта животных, но и некоторые патогенные бактерии, например, сальмонеллы, носителями которых нередко являются сельскохозяйственные животные.
Наиболее часто эндогенное обсеменение тканей животных микроорганизмами происходит при утомлении, т. е. состоянии перенапряжения (стресса), возникающего при транспортировании или перегоне животных на мясокомбинаты. Внутренние органы и ткани животных, убитых сразу же после транспортирования по железной дороге, содержат в 3-4 раза больше микроорганизмов, чем органы и ткани животных неутомленных, получивших предубойный отдых.
Степень
эндогенного обсеменения органов и
тканей микроорганизмами зависит от
стадии утомления животных. У животных,
убиваемых в состоянии резкого утомления,
микроорганизмы содержатся почти во
всех органах и тканях. Например, в
продуктах убоя от сильно утомленного
крупного рогатого скота почти всегда
обнаруживают микроорганизмы в печени,
селезенке, почках, легких, соматических
и других лимфоузлах и довольно часто
(до 30-40 % случаев) в мышцах.
У животных,
убиваемых в состоянии резкого утомления,
микроорганизмы содержатся почти во
всех органах и тканях. Например, в
продуктах убоя от сильно утомленного
крупного рогатого скота почти всегда
обнаруживают микроорганизмы в печени,
селезенке, почках, легких, соматических
и других лимфоузлах и довольно часто
(до 30-40 % случаев) в мышцах.
У крупного рогатого скота, имеющего незначительную степень утомления, микроорганизмы обычно выделяют только из печени и портального лимфоузла, мезентериальных лимфоузлов (в 30-50 %) и легких (до 20 % случаев). У свиней, убиваемых в степени незначительного утомления, микроорганизмы обнаруживают главным образом в печени (в 30 % случаев), паховых и подчелюстных лимфоузлах (в 20 %), почках и селезенке (в 16-17 % случаев).
Мышцы и соматические лимфоузлы животных, характеризующихся незначительной степенью утомления, обычно не содержат микроорганизмов.
Степень утомления, а, следовательно, и проникновения в ткани микроорганизмов из желудочно-кишечного тракта зависит от продолжительности и условий транспортирования животных. При доставке животных автотранспортом на небольшие расстояния эндогенное обсеменение мышц и органов микроорганизмами незначительно.
После длительного транспортирования железнодорожным или водным транспортом в органах и тканях животных почти всегда содержатся в большом количестве микроорганизмы, проникшие из желудочно-кишечного тракта.
При транспортировании в жаркое время года, особенно в плохо вентилируемых, нагретых солнцем вагонах, у животных отмечается более высокая степень обсеменения тканей микроорганизмами, чем при транспортировании в прохладное время года.
Для приведения в нормальное физиологическое состояние здоровых, но утомленных в пути животных им предоставляется на мясокомбинатах предубойный отдых.
Восстановление
естественных защитных сил и постепенное
освобождение органов и тканей утомленных
животных от проникших в них из
желудочно-кишечного тракта микробов в
значительной степени зависит от
правильной организации предубойного
отдыха (уход, условия содержания,
кормления, поения).
У животных, находящихся перед убоем летом в незащищенных от солнца помещениях или зимой длительное время на холоде (что приводит к переохлаждению организма), микроорганизмы, как правило, содержатся во всех внутренних органах, в лимфоузлах и мышцах. Если животных перед убоем содержат в крытых помещениях, в нормальных температурных условиях, то микроорганизмы обнаруживают главным образом в печени и портальном лимфоузле, иногда в других внутренних органах. Мышечная ткань и соматические лимфоузлы таких животных часто оказываются стерильными. У свиней, подвергшихся перед убоем перегреву, бактерицидные свойства лимфы выражены слабо или совсем отсутствуют. Органолептические признаки порчи мяса, полученного от животных, перегретых или переохлажденных перед убоем, появляются на 1,5-2 сут. раньше, чем мяса животных, содержавшихся перед убоем в нормальных условиях.
Кормление животных незадолго до убоя приводит к некоторому эндогенному обсеменению органов и тканей микроорганизмами из кишечного тракта. Так, при микробиологическом исследовании продуктов убоя животных, убитых через 4-6 ч после кормления, во всех случаях установлено наличие микроорганизмов в печени, почках, селезенке. Кроме того, у половины исследованных туш микроорганизмы обнаружены в крови, мышцах и костном мозге.
Существует определенная зависимость между предубойным физиологическим состоянием организма животных, содержанием в их мышечной ткани гликогена и посмертным накоплением молочной кислоты (снижением рН) в процессе созревания мяса. В мышечной ткани здоровых, упитанных животных содержится значительное количество гликогена и при созревании мяса происходит интенсивное накопление молочной кислоты, что и обуславливает показания рН в 5,8-6,2.
У
животных больных, плохо упитанных,
утомленных, т. е. убитых в состоянии
резкого снижения резистентности
организма, кроме прижизненного эндогенного
микробного обсеменения органов и тканей
наблюдается уменьшение количества
гликогена в мышцах почти вдвое по
сравнению с нормой. При созревании мяса
таких животных посмертные окислительные
процессы (т. е. накопление молочной
кислоты) замедлены по сравнению с
процессами, протекающими в мясе здоровых
и отдохнувших животных, рН колеблется
в пределах 6,3-6,9.
При созревании мяса
таких животных посмертные окислительные
процессы (т. е. накопление молочной
кислоты) замедлены по сравнению с
процессами, протекающими в мясе здоровых
и отдохнувших животных, рН колеблется
в пределах 6,3-6,9.
Поскольку мясо, полученное от животных с пониженной сопротивляемостью организма, имеет после созревания более высокий рН, развитие гнилостных бактерий в нем подавляется слабо. В процессе хранения такое мясо быстрее портится.
Послеубойная контаминация. При убое животных и последующих операциях разделки туш происходит экзогенная контаминация мясных туш и органов микроорганизмами, попадающими из внешней среды, и эндогенное обсеменение внутренних тканей и органов микроорганизмами из желудочно-кишечного тракта. Источниками послеубойного микробного обсеменения продуктов убоя могут служить кожный покров животных, содержимое желудочно-кишечного тракта, воздух, оборудование, транспортные средства, инструменты, руки, одежда и обувь работников, имеющих контакт с мясом, вода, используемая для зачистки туш, и т. д.
При экзогенной контаминации попадание микроорганизмов в мышечную ткань и органы возможно во время убоя животных. При обескровливании в течение нескольких минут сердце животных продолжает работать и вытекающая из перерезанных шейных артерий кровь частично засасывается вновь через вены, находящиеся под отрицательным давлением. При этом в кровяное русло могут попадать и разноситься по всем тканям микроорганизмы с инструментов, шерстного покрова, а при несоблюдении правил перевязки пищевода — из содержимого желудка.
В процессе выполнения технологических операций разделки мясных туш экзогенное обсеменение мяса микроорганизмами происходит в основном при съемке шкур, извлечении внутренних органов и зачистке.
Съемка
шкур существенно влияет на санитарное
состояние вырабатываемого мяса. Во
время съемки шкур возможно экзогенное
обсеменение микроорганизмами поверхности
мясных туш.
В 1 г (или на 1 см) волосяного покрова крупного рогатого скота содержится до 700 млн., а в отдельных случаях — даже миллиарды микроорганизмов. Значительное количество микробов имеется также на кожном покрове свиней. Так, на 1 см поверхности кожи свиней обнаруживали в области спины 58 млн. микроорганизмов, а в области живота — до 44 млн. С поверхности кожного покрова свиней были выделены сальмонеллы (в 26,6% случаев), кишечная палочка (60%), различные кокковые бактерии (58%), бактерии рода протеус (55%), споровые гнилостные бактерии (100% случаев). Наибольшая степень микробного загрязнения кожного покрова животных отмечается осенью и весной.
Во время съемки шкур значительное загрязнение обнажаемой поверхности мясных туш микроорганизмами происходит вследствие попадания на нее пыли и грязи, стряхиваемой со шкур в момент их отрыва. При этом степень микробной контаминации поверхности туш во многом зависит от способа съемки. В настоящее время на предприятиях мясной промышленности используют несколько установок для механической съемки шкур с туш крупного рогатого скота (“Москва”, “Ленинградская”, ФАУМ и др.). Кроме того, шкуры снимают с помощью лебедки. В этом случае происходит интенсивное микробное обсеменение большой поверхности туш (в области бедренной части, боковой, грудной стенки, спинной части). Это объясняется тем, что в момент отрыва шкура находится в вертикальном положении над тушей, вследствие чего микроорганизмы со шкуры беспрепятственно попадают на тушу.
Механическая
съемка шкур на подвесных путях способствует
улучшению санитарного состояния мясных
туш. Однако не все используемые в
настоящее время установки для механической
съемки шкур в одинаковой степени отвечают
санитарным требованиям. Например, при
съемке шкур с туш крупного рогатого
скота на установке “Москва” основная
площадь поверхности туш не загрязняется
микроорганизмами, а на установках
“Ленинградская”, ФАУМ, “ВНИИМП —
Омская” микроорганизмы всегда
обнаруживают на бедренной части и в
области грудной стенки (в 33 % случаев). Иногда микроорганизмы содержатся даже
в области спины. Количество микроорганизмов
на 1 см2 поверхности туш составляет более 600
тыс.
Иногда микроорганизмы содержатся даже
в области спины. Количество микроорганизмов
на 1 см2 поверхности туш составляет более 600
тыс.
Установки для съемки шкур с туш свиней с санитарной точки зрения также не все равноценны. Установка непрерывного действия наиболее отвечает санитарным требованиям, так как при съемке поверхность туш меньше обсеменяется микроорганизмами, чем на установке периодического действия.
Обсеменение поверхности мясных туш микроорганизмами при съемке шкур происходит также с рук рабочих и используемых ими инструментов. На поверхности инструментов и рук рабочих содержится значительное количество микроорганизмов. Так, на 1 см2 поверхности рук рабочих, осуществляющих съемку шкур, количество микроорганизмов может достигать 20 млн.; на поверхности ножей — от 6 тыс. до 580 млн. на 1 см2 (в зависимости от санитарного состояния производства). Причем, с поверхности инструментов в некоторых случаях выделяют патогенные бактерии, в частности, сальмонеллы.
Для уменьшения микробного загрязнения рук и инструментов необходимо проводить их систематическую санитарную обработку.
В
процессе разделки источником загрязнения
поверхности мясных туш микроорганизмами
может служить воздух цеха убоя скота и
разделки туш мясокомбинатов. Исследования
санитарно-гигиенического состояния
воздуха этих цехов показали, что по
сравнению с другими участками цеха
наибольшее содержание микроорганизмов
наблюдается возле устройств съемки
шкур, а также около бокса на месте
подвешивания оглушенных животных на
конвейер и на линии обескровливания.
Так, вблизи от установки для механической
съемки шкур с туш крупного рогатого
скота содержится во много раз больше
микроорганизмов (стафилококки, бактерии
группы кишечных палочек и др.), чем у
отдаленных от этого участка местах
цеха. В 1 см3 воздуха на расстоянии 5-6 м от установки
для съемки шкур обнаружено около 25 тыс. микробных клеток.
микробных клеток.
Изучение группового состава микроорганизмов, выделенных из воздуха помещения, показало, что микрофлора воздуха в цехе убоя скота и разделки туш представлена, как правило, различными споровыми аэробными и анаэробными гнилостными бактериями, грамотрицательными не споровыми палочками, плесневыми грибами, актиномицетами, дрожжами, различными видами кокковых бактерий, т. е. микроорганизмами, которые постоянно присутствуют на кожном покрове животных.
Все это говорит о том, что кожный покров животных является источником значительного микробного загрязнения воздушной среды цехов мясокомбинатов. В целях улучшения санитарно-гигиенического состояния воздушной среды необходимо проводить ежедневную профилактическую дезинфекцию воздуха производственных помещений. Кроме того, для улучшения санитарного состояния кожного покрова животных следует осуществлять их санитарную обработку перед убоем.
В настоящее время применяют различные методы санитарной обработки кожного покрова животных: мойку под душем с применением или без применения механических приспособлений, обеззараживание кожного покрова различными химическими препаратами. Санитарная обработка кожного покрова животных приводит к значительному уменьшению микробного загрязнения, а, следовательно, способствует улучшению санитарного состояния вырабатываемого мяса. Например, после мойки под душем и обработки раствором химического препарата кожного покрова крупного рогатого скота содержание микроорганизмов на 1 см2 поверхности уменьшается с 2—20 млн. перед мойкой до 25-245 тыс. микробных клеток, т. е. примерно в 24-80 раз. Простая мойка кожного покрова свиней уменьшает микробное загрязнение в 10-15 раз, а обработка с применением механических щеток и воды — в 40-50 раз.
При
обработке свиней без съемки шкуры после
обескровливания проводят шпарку или
опалку. В процессе этих технологических
операций, особенно при опалке, количество
микроорганизмов на поверхности туш
свиней резко уменьшается. Степень
микробного загрязнения поверхности
туш после шпарки во многом зависит от
содержания микроорганизмов в воде
шпарильных чанов. Кроме загрязнения
микробами поверхности туш вода шпарильных
чанов может быть источником обсеменения
внутренних органов (легких) и даже
мышечной ткани. Вода попадает в тушу
через раневые отверстия. По мере
прохождения туш вода в шпарильных чанах
постепенно обсеменяется микробами.
Если перед началом работы в 1 мл воды
содержится всего несколько десятков
микробных клеток, то после шпарки 250 туш
свиней количество микроорганизмов
возрастает до 26-—27 тыс., причем преобладают
споры бактерий, устойчивые к высоким
температурам.
Степень
микробного загрязнения поверхности
туш после шпарки во многом зависит от
содержания микроорганизмов в воде
шпарильных чанов. Кроме загрязнения
микробами поверхности туш вода шпарильных
чанов может быть источником обсеменения
внутренних органов (легких) и даже
мышечной ткани. Вода попадает в тушу
через раневые отверстия. По мере
прохождения туш вода в шпарильных чанах
постепенно обсеменяется микробами.
Если перед началом работы в 1 мл воды
содержится всего несколько десятков
микробных клеток, то после шпарки 250 туш
свиней количество микроорганизмов
возрастает до 26-—27 тыс., причем преобладают
споры бактерий, устойчивые к высоким
температурам.
Улучшению санитарного состояния поверхности туш свиней в процессе их шпарки способствует применение прогрессивных методов технологии, в частности обработка туши паровоздушной смесью в установках непрерывного действия. По сравнению с общепринятым методом шпарки в чанах при обработке туш в агрегате непрерывного действия микробная контаминация поверхности туш уменьшается больше (в 250-300 раз вместо 90-100 раз при обработке в шпарильном чане). При извлечении внутренних органов из брюшной и грудной полостей (нутровка) происходит дополнительное микробное обсеменение поверхности мясных туш через загрязненные руки, одежду и инструменты рабочих. Так, при разделке туш свиней со съемкой шкур количество микроорганизмов на 1 см2 поверхности туш после нутровки увеличивается почти в три раза. В случае нарушения технологических инструкций при выполнении этой операции (неправильная заделка проходника, нарушение целостности желудочно-кишечного тракта и др.) возможно очень массивное обсеменение микроорганизмами поверхности мясных туш в результате ее загрязнения содержимым преджелудков и кишечника, богатых различными микроорганизмами. В этих случаях количество микроорганизмов резко возрастает и может достигать более миллиона микробных клеток на 1 см2 поверхности туш.
Контаминация
глубоких слоев мяса имеет место, если
во время извлечения внутренних органов
из брюшной и грудной полостей туш
животных будут сделаны проколы ножом
мышечных частей туш.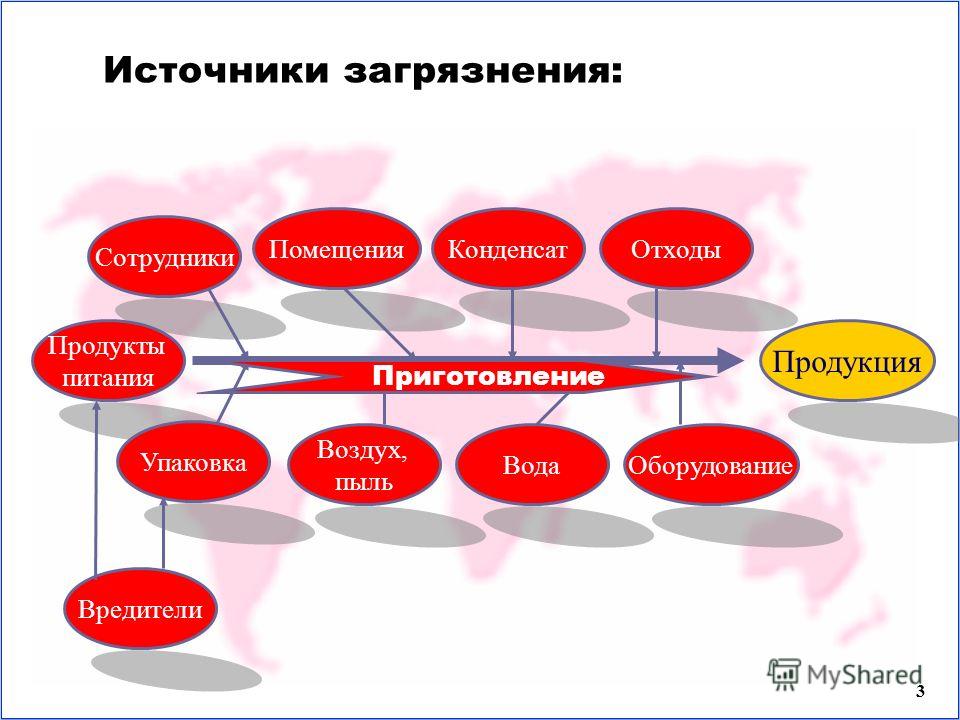 При хранении таких
туш на месте введения инструмента
отмечается интенсивное размножение
микроорганизмов, и указанные туши
быстрее подвергаются порче.
При хранении таких
туш на месте введения инструмента
отмечается интенсивное размножение
микроорганизмов, и указанные туши
быстрее подвергаются порче.
После извлечения внутренних органов для придания туше требуемого товарного вида и надлежащего санитарного состояния проводят ее зачистку: сухую (без применения воды) или мокрую (влажную).
При сухой зачистке срезают остатки внутренних органов, побитости, небольшие участки, загрязненные кровью или содержимым желудочно-кишечного тракта, зачищают бахрому и т. д. В процессе охлаждения и последующего хранения мясных туш, подвергавшихся сухой зачистке, подсыхают фасции и выступающая после снятия шкуры серозная жидкость. Поверхностные слои мышечной ткани обезвоживаются и уплотняются, что способствует образованию хорошо выраженной корочки подсыхания. Происходит фиксация микробов на поверхности туши. В пленках подсохших коллоидов создаются неблагоприятные условия для размножения микробов.
Мокрая зачистка заключается в обмывании туш струёй теплой воды или в обработке фонтанирующими щетками. При мокрой зачистке значительная часть загрязнений удаляется. Но слабый напор и невысокая температура воды (не выше 50°С) не столько способствуют удалению микроорганизмов, сколько приводят к их перераспределению с загрязненных на незагрязненные участки поверхности туш. В результате мойки туш, особенно при использовании травяных или капроновых щеток, рыхлая подкожная клетчатка еще более разрыхляется, и в нее проникают микроорганизмы. Кроме того, при мойке происходит значительное увлажнение поверхности туш. Вследствие этого замедляется образование корочки подсыхания, что способствует проникновению микроорганизмов в ткань.
Вода,
применяемая для мойки туш в процессе
их разделки, может служить причиной
дополнительного микробного обсеменения
поверхности мясных туш. Поэтому на
мясоперерабатывающих предприятиях
следует использовать воду, отвечающую
санитарным требованиям, предъявляемым
к питьевой воде.
Таким образом, мокрая зачистка имеет ряд недостатков и может отрицательно влиять на санитарное состояние вырабатываемого мяса. В настоящее время, учитывая уровень используемой техники, а также санитарно-гигиеническое состояние кожного покрова животных, поступающих на убой, нельзя полностью отказаться от мокрой зачистки. Однако необходимо строго соблюдать технологические инструкции по убою скота, которыми предусмотрена мойка только загрязненных участков туши.
При незначительном загрязнении туш следует ограничиваться сухой зачисткой.
Эндогенная контаминация органов и тканей микроорганизмами из желудочно-кишечного тракта начинается сразу после обескровливания, т. е. клинической смерти животных, так как стенка кишечника становится легкопроницаемой для микробов, содержащихся в кишечном тракте. Так, при удалении желудочно-кишечного тракта через 10-15 мин. после обескровливания в 1 г мезентериальных лимфатических узлов здоровых свиней содержится в среднем 20 тыс. бактерий, а через 1 ч и более количество микроорганизмов составляет уже свыше 300 тыс. в 1 г.
Следовательно, для предотвращения эндогенного послеубойного обсеменения мышечной ткани и внутренних органов микробами необходимо как можно быстрее удалить кишечник из брюшной полости. При извлечении внутренних органов спустя 2 ч и более с момента обескровливания животных в ткани проникают микроорганизмы, в том числе патогенные и условно-патогенные. Поэтому, в соответствии с действующими Правилами ветеринарно-санитарной экспертизы мяса и мясопродуктов, такие мясные туши подлежат обязательному микробиологическому исследованию.
10 основных признаков наличия проблем с микотоксинами в птицеводстве
Что такое микотоксины?
Микотоксины — это вторичные метаболиты плесневых грибов, которые постоянно присутствуют в природе и при благоприятных условиях могут контаминировать почти все корма, используемые в птицеводстве. Многие микотоксины не специфичны для определенных плесневых грибов, то есть разные их виды могут вырабатывать одинаковые микотоксины. При этом существует много плесеней, которые продуцируют множество типов микотоксинов. Хотя значительная концентрация всего лишь одного микотоксина может повлиять на самочувствие птицы, небольшие уровни нескольких микотоксинов зачастую приводят к возникновению более серьезных проблем.
Многие микотоксины не специфичны для определенных плесневых грибов, то есть разные их виды могут вырабатывать одинаковые микотоксины. При этом существует много плесеней, которые продуцируют множество типов микотоксинов. Хотя значительная концентрация всего лишь одного микотоксина может повлиять на самочувствие птицы, небольшие уровни нескольких микотоксинов зачастую приводят к возникновению более серьезных проблем.
Как микотоксины влияют на птицу?
Микотоксины, попадающие в организм птицы, нарушают целостность клеток и тканей. Это приводит к патологическому ухудшению работы различных физиологических систем, вызывая нарушение функций органов. В результате этого часто наблюдается снижение продуктивности, подавление иммунитета и ухудшение состояния здоровья птицы. Воздействие микотоксинов на организм птицы может быть острым или чаще хроническим. Симптомы зависят от вида, пола, возраста, уровня и длительности контаминации птицы. Однако в большинстве случаев наблюдается некоторое снижение продуктивности, связанное с контаминацией.
Как бороться с микотоксинами в птицеводстве?
Угроза контаминации микотоксинами есть всегда – даже в отсутствие признаков наличия плесени. Эффективные стратегии содержания и профилактики должны быть хорошо проработаны и применяться постоянно, поскольку уровни контаминации и воздействия постоянно меняются. Планы должны охватывать все аспекты кормления, содержания, управления хозяйством и контроля состояния здоровья птицы и разрабатываться на основании принципов HACCP, например, подробного анализа рисков и опасностей.
Раннее выявление – ключевой фактор решения проблемы подавления естественного иммунитета птицы и, следовательно, повышения рентабельности производства.
В целом существуют 10 основных признаков, о которых следует знать всем птицеводам:
1. Видимые очаги роста плесневых грибов в кормах для птицы
Рост плесневых грибов и контаминация как до, так и после уборки урожая всегда представляют угрозу для кормов. Поэтому все этапы «пути» корма (производство, транспортировка и распределение) необходимо контролировать на предмет возможной контаминации.
Поэтому все этапы «пути» корма (производство, транспортировка и распределение) необходимо контролировать на предмет возможной контаминации.
Видимые признаки плесени позволяют быстро выявить и снизить потенциальный риск. Однако микотоксины не видны невооруженным глазом, поэтому для точного определения проблемы необходимо выполнить специальные анализы.
2. Регистрация данных и результатов измерений
Признаки токсикоза в птицеводстве часто трудно обнаружить, пока они не приведут к снижению продуктивности из-за таких проблем, как ухудшение конверсии корма. Регистрация подробных, точных измерений и данных позволяет производителю понять текущую ситуацию и реализовать эффективную стратегию профилактики.
3. Снижение потребления корма у птиц
Только лишь присутствие плесневых грибов в корме для птицы может отрицательно повлиять на его вкус и/или запах. Однако микотоксины действуют еще активнее, напрямую влияя на аппетит птиц. В конечном итоге это может привести к снижению потребления корма.
Это может быстро стать серьезной проблемой, поскольку заметные потери продуктивности, особенно среднесуточного привеса, возникают даже при небольшом снижении потребления корма.
4. Энтерит и диарея
Влажный помет или диарея у птицы являются ранними признаками расстройства работы ЖКТ, которые дают производителю неоценимую информацию об общем его состоянии. Влажный помет также представляет риск для безопасности пищевых продуктов, поскольку он создает идеальную среду для роста бактерий.
Диарея – зачастую сложная проблема, поскольку это симптом множества заболеваний, в том числе воздействия как непатогенных, так и патогенных микроорганизмов. Производителю необходимо определить основную причину нарушения и как можно скорее принять корректирующие меры по восстановлению оптимального состояния ЖКТ птицы. Микотоксины могут напрямую нарушать целостность ЖКТ, что приводит к ухудшению пищеварения и усвоения питательных веществ, а также к ухудшению барьерной функции кишечника, что, в свою очередь, может привести к диарее.
Микотоксины могут напрямую нарушать целостность ЖКТ, что приводит к ухудшению пищеварения и усвоения питательных веществ, а также к ухудшению барьерной функции кишечника, что, в свою очередь, может привести к диарее.
5. Снижение репродуктивных качеств и выводимости яиц (родительское стадо)
Помимо прямого воздействия некоторых микотоксинов, потребление корма, контаминированного несколькими микотоксинами, связывают с неожиданным снижением репродуктивных качеств. Снижение репродуктивных качеств птиц или выводимости яиц может дорого обойтись предприятию.
6. Высокая заболеваемость
Растет число патогенных заболеваний (сальмонеллез, некротический энтерит и т.д.), что приводит к снижению рентабельности птицеводческого хозяйства за счет снижения продуктивности и повышения расходов на терапевтическое лечение.
Хотя мы традиционно связываем воздействие микотоксинов на домашнюю птицу с классическими симптомами – снижение потребления корма, поражение ротовой полости или снижение продуктивности, производители зачастую не осознают связи между микотоксинами и здоровьем поголовья. Кроме самых распространенных симптомов, которые мы рассмотрели выше, на необходимость более тщательного исследования микотоксинов указывают такие факторы, как снижение эффективности профилактической вакцинации, учащение вспышек инфекций, вызванных факультативными патогенами, или просто повышение расходов на лечение.
7. Снижение яйценоскости и качества яйца
Потребление контаминированных микотоксинами кормов у кур может приводить к снижению яйценоскости, как правило, вследствие нарушения процесса синтеза белка. Синтез альбумина снижается в результате дегенерации ткани печени под воздействием микотоксинов.
Качество яичной скорлупы также может ухудшаться. Тонкая хрупкая скорлупа повышает эмбриональную смертность, снижает выводимость яиц..jpg) Качество яичной скорлупы зависит от метаболизма кальция и витамина D3 в организме курицы. Их биодоступность зависит от целостности кишечника и выработки ферментов и белков-переносчиков, которые способствуют усвоению питательных веществ корма. Микотоксины отрицательно влияют на эти процессы.
Качество яичной скорлупы зависит от метаболизма кальция и витамина D3 в организме курицы. Их биодоступность зависит от целостности кишечника и выработки ферментов и белков-переносчиков, которые способствуют усвоению питательных веществ корма. Микотоксины отрицательно влияют на эти процессы.
Патологии ног возникают по множеству причин и зависят от условий содержания, генетики, окружающей среды, кормления и присутствия микотоксинов. Известно, что различные микотоксины, отдельно или вместе, отрицательно влияют на обмен веществ в костной ткани, что приводит к развитию проблем с ногами.
9. Повреждения в ротовой полости и эрозии в мышечном желудке
Повреждения в ротовой полости особенно распространены у кур-несушек и племенной птицы, их вызывают различные этиологические факторы. Некоторые типы микотоксинов, такие как трихотецены типа А, вызывают повреждение эпителия и увеличивают скорость обновления эпителиальных клеток. Ветеринары на местах часто сообщают об эрозиях или повреждениях слизистой оболочки мышечного желудка у бройлеров и товарных несушек.
В некоторых случаях эти повреждения наблюдаются у суточных цыплят еще до помещения в птичник и до начала потребления корма. Что касается молодых цыплят, в качестве возможных факторов исследования указывают на постинкубационный стресс или присутствие микотоксинов в рационе племенного стада (которые затем переносятся в яйцо).
10. Снижение показателей продуктивности птицы
Хотя микотоксины невидимы и их трудно обнаружить, они часто могут проявляться на параметрах продуктивности. Негативное воздействие на однородность птицы, суточное потребление корма, показатели роста и конверсию корма приводит к серьезным экономическим убыткам.
Высокие уровни контаминации микотоксинами могут стать причиной увеличения падежа.
Выявление и решение проблемы
Как сказано выше, полностью избежать контаминации кормов микотоксинами в птицеводческих хозяйствах невозможно. Однако можно смягчить их негативное воздействие с помощью продуманной стратегии.
Alltech предлагает комплекс современных услуг по менеджменту микотоксинов, которые помогут вам обнаружить скрытые факторы риска в корме.
Нужен глубинный анализ и рекомендации в режиме реального времени?
Производители, которым необходимо быстро определить наличие микотоксинов в хозяйствах, могут воспользоваться сервисом Alltech® RAPIREAD™. Эта платформа экспресс-анализа для количественного обнаружения семи основных микотоксинов в отдельных ингредиентах корма с помощью интегрированных онлайн-инструментов и анализатора Neogen Raptor® позволяет выполнять глубинный анализ и вырабатывать практические рекомендации в режиме реального времени на основе полученных данных.
Нужен более комплексный анализ риска контаминации микотоксинами?
Для производителей, которые хотят получить полное представление о контаминации кормов в хозяйстве, мы предлагаем программу менеджмента микотоксинов с помощью лаборатории Alltech 37+® для выявления широкого спектра скрытых угроз. Основное преимущество программы менеджмента микотоксинов компании Alltech заключается в том, что лабораторная аналитическая служба исследует образцы корма, выявляя и идентифицируя 54 отдельных микотоксина.
Хотите снизить воздействие микотоксинов на поголовье?
После подтверждения контаминации микотоксинами сырья и кормов для птицы необходимо устранить последствия их воздействия посредством введения в рацион адсорбента микотоксинов, например, Микосорба от Alltech. Микосорб предотвращает всасывание микотоксинов организмом птицы, связывая их в ЖКТ, таким образом устраняя риски для здоровья и продуктивности, связанные с их вредным воздействием. Проблемы, связанные с микотоксинами, у птицы не всегда легко выявить, но есть некоторые основные признаки, на которые следует обратить внимание.
Зарегистрируйтесь, чтобы получить протокол, разработанный нашими специалистами по микотоксинам. Он поможет вам в проведении ежедневных проверок на возможные признаки наличия проблем с микотоксинами на птицефабрике.
Заполните форму ниже, чтобы получить копию протокола.
Зарегистрироваться сейчас
Европейское Исследование нового урожая на микотоксины 2020 года
Контаминация микотоксинами начинается еще до сбора урожая в поле, и в условиях растущего спроса со стороны конечного потребителя и растущей озабоченности по поводу качества пищевых продуктов безопасность кормов для животных стала актуальной темой в сельском хозяйстве. Чтобы решить эту проблему и предоставить производителям и комбикормовым заводам возможность принимать самые эффективные управленческие решения для ее устранения, компания Alltech провела 8-ое ежегодное Исследование нового урожая на микотоксины. В ходе исследования в 2020 году были проанализированы пробы кормов и ингредиентов со всей Европы, чтобы составить обзор риска контаминации микотоксинами на всем континенте. Узнайте больше здесь.
Решение проблемы обсеменения тушек птицы
Еще один плюс в пользу «Секурола»
Решение проблемы обсеменения тушек птицы
Современные требования и нормативы жестко регламентируют качество птицы, выпускаемой птицефабриками. Соответственно, обеспечение безопасности продукции – одна из главных задач производителей.
Переработка мяса птицы на большинстве предприятий отрасли – предельно автоматизированный процесс. Но даже в таких условиях, на технологической стадии убоя птицы и ее последующей обработки возрастает степень обсеменения поверхности тушек, в том числе патогенными микроорганизмами. Наибольшую опасность представляет собой съем пера, термическая обработка (ошпаривание), а также потрошение. При снятии оперения происходит свободный обмен микрофлоры, также обсеменение возможно из-за царапин и порезов во время процесса.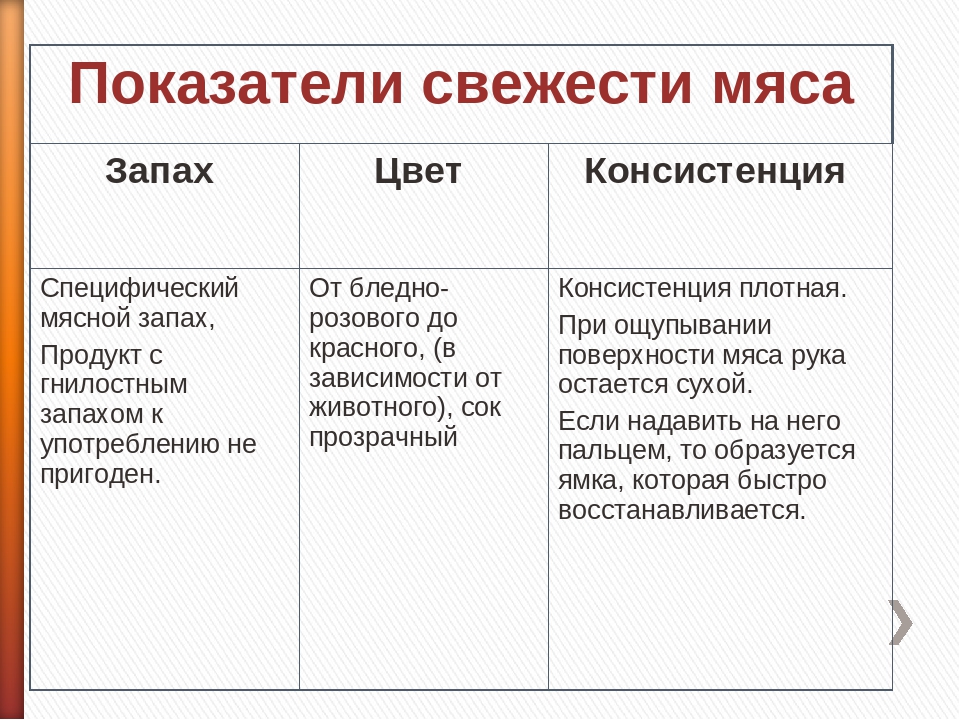 Во время шпарки вода загрязняется веществами, которые смываются с погружаемых в нее тушек птицы. А при потрошении возможна контаминация в случае разрыва ЖКТ, а также фекальная контаминация.
Во время шпарки вода загрязняется веществами, которые смываются с погружаемых в нее тушек птицы. А при потрошении возможна контаминация в случае разрыва ЖКТ, а также фекальная контаминация.
Таким образом, к моменту заключительной стадии первичной переработки тушек птицы, а именно – охлаждению, количество микрофлоры на поверхности возрастает в несколько раз. И именно на этой стадии необходимо принять меры для обеспечения микробиологической безопасности мяса птицы. Помогает в этом сам процесс охлаждения, когда часть микроорганизмов смывается с поверхности тушек. Естественно, целиком это проблему не решает. Более того, при погружном (контактном) охлаждении возникает опасность перекрестной контаминации, когда микроорганизмы с одной тушки попадают на другую. В связи с этим, многие предприятия перешли на систему воздушно-капельного охлаждения. Также толчком к модернизации производства послужил запрет Роспотребнадзора на использование хлорсодержащих веществ для обработки тушки птицы. Это же решение послужило мощным стимулом для разработки и применения альтернативных противомикробных препаратов. Среди них можно выделить вещества на основе уксусной и молочной кислоты, перекиси водорода и пр.
К сожалению, многие птицефабрики столкнулись с тем, что данные препараты далеко не так эффективны, как предполагалось, и их использование не исключает микробиологической порчи мяса.
В конце 2015 года на рынке препаратов, предназначенных для дезинфекции тушек птицы, появился новый препарат «Секурол». Это антимикробное средство широкого спектра действия в отношении как грамотрицательных, так и грамположительных бактерий, в том числе плесени, кишечной палочки, спор, сальмонелл и пр.
«Секурол» выгодно отличается от препаратов на основе перекиси водорода и надуксусной кислоты (НУК) по многим параметрам. Так, «Секурол» – это концентрат, и всего из одного литра данного препарата можно получить 10 тонн рабочего раствора. Таким образом, если в одну смену на птицефабрике используется 50 литров вещества с НУК, то «Секурола» потребуется всего 1,5 литра – это очевидная экономия.
«Секурол» предназначен для обработки тушек и при погружном, и при воздушно-капельным охлаждении. Его основное действующее вещество — цетилпиридиний хлорид, который быстро и качественно ликвидирует микроорганизмы на поверхности тушек. Стоит отметить, что аналогичный препарат, на основе того же действующего вещества, производился в США под маркой «Секур» («Cecure»), и хорошо себя зарекомендовал в птицеводческой отрасли. Однако с введением режима санкций и общим осложнением макроэкономической обстановки, он пропал с нашего рынка. Российская компания-производитель предлагает отечественный препарат, произведенный в нашей стране из российских же компонентов – и это еще один плюс в пользу «Секурола».
Кроме того, «Секурол» не влияет на органолептические свойства мяса птицы, а качественная деконтаминация тушек приводит к значительному увеличению сроков их хранения.
Эксклюзивный дистрибьютор «Секурола» – торговый дом «Униконс».
г. Белгород Дмитрий
+7(915)5735415
www.alternativa-sar.ru
(4722)37-38-55
[email protected]
www.unikons.pro
www.alternativa-sar.ru
Некоторые особенности производства продукции из мяса птицы
Первый случай
Эпизодическое появление на поверхности либо (реже) во внутренних слоях мышечной ткани разделанных частей охлажденных тушек бройлера зон, характеризующихся яркой бордово-красной пигментацией.
Также указанный дефект встречается у натуральных (филе) и рубленых (котлеты) полуфабрикатов, и даже у некоторых видов термообработанных изделий из мяса птицы в процессе их кратковременного (12-24 часов) хранения при температуре 2±2 °С и относительной влажности воздуха выше 85%.
Анализ возможных причин, рекомендации.
Анализ литературных источников, а также проведение аналитических исследований позволили прийти к заключению о том, что появление данного пигмента является результатом деятельности микроорганизмов, относящихся к семейству Enterobacteriaceae, вид Serratia Marcescens («чудесная палочка»). Serratia Marcescens может присутствовать в почве, воде, воздухе, фекалиях птиц, рыб, человека; развивается как в аэробных, так и в анаэробных условиях в температурном интервале от 5 до 40 °С и при значениях рН среды в диапазоне от 5 до 9.
Serratia Marcescens может присутствовать в почве, воде, воздухе, фекалиях птиц, рыб, человека; развивается как в аэробных, так и в анаэробных условиях в температурном интервале от 5 до 40 °С и при значениях рН среды в диапазоне от 5 до 9.
Было установлено, что наиболее вероятной причиной контаминации мяса птицы бактериями Serratia Marcescens является нарушение целостности зоба и кишечника бройлера на участке потрошения. Это приводит к загрязнению тушек содержимым пищеварительного тракта и фекалиями. Показано также, что частота повреждения заполненных кормом внутренностей в процессе их удаления зависит от продолжительности выдержки птицы перед убоем. В результате рассмотрения совокупности санитарно-микробиологических требований, технологических норм (выход тушки к живому весу) и организационно-экономических показателей рекомендовано:
- осуществлять голодную выдержку птицы (без корма, но с водой) перед убоем в течение 2-5 часов;
- усилить ветеринарно-санитарный контроль за качеством выполнения операций потрошения и промывки тушек;
- не допускать наличия у мясного сырья, направляемого на холодильное хранение либо в кулинарно-колбасное производство, сильно увлажненной поверхности.
Выполнение данных мероприятий позволило в условиях птицекомбината существенно снизить риски контаминации мяса бройлеров бактериями Serratia Marcescens.
Второй случай
Появление у рубленых полуфабрикатов из куриного мяса розового цвета, присущего мясным изделиям, изготавливаемым из мяса убойных животных и подвергаемых в ходе технологической обработки нитритному посолу.
Анализ возможных причин, рекомендации.
Как известно, формирование специфического красно-розового цвета у мясопродуктов из говядины и свинины обусловлено наличием в сырье значительного количества красящих пигментов – миоглобина и гемоглобина, которые в результате взаимодействия с вносимым нитритом натрия образуют нитрозомиоглобин и нитрозогемоглобин – соединения красно-розового цвета.
Таблица 1
|
Вид мясного сырья |
Говядина в/с |
Свинина н/ж |
Мясо бройлера |
Индейка |
Гусь |
||||
|
белое |
красное |
кожа |
МПМО |
белое |
красное |
грудка |
|||
|
Суммарное содержание мио- и гемоглобина, мг/г |
3,6-8,4 |
5,2-5,5 |
0,8-0,9 |
1,9-2,2 |
— |
2,0-2,3 |
0,2-0,6 |
1,8-3,8 |
0,3-3,7 |
Как следует из таблицы 1, белое и красное мясо бройлера значительно уступают мясу убойных животных по концентрации гемовых пигментов, в связи с чем они не могут оказывать существенного влияния на процессы цветообразования. Одновременно обращает на себя внимание факт относительно высокого содержания мио- и гемоглобина в мясе птицы механической обвалки. При этом, по мнению некоторых исследователей, приведенные в таблице усредненные данные нельзя признать абсолютно достоверными, так как:
1. Общая концентрация гемовых пигментов в мышечной ткани птицы может варьироваться в зависимости от выбранных параметров оглушения и обескровливания. Чем выше скорость конвейера и короче период обескровливания, тем больше крови (форменных элементов/гемоглобина) удерживается в тушке.
Рекомендуемая продолжительность операции обескровливания – не менее 2 минут. Сокращение этого периода неизбежно будет приводить к нежелательным изменениям цвета как у сырья, так и у готовой продукции.
2. Содержание гемовых пигментов в мясе птицы механической обвалки также не является постоянным, так как зависит от вида используемого при прессовании сырья, способа его подготовки, температуры и других факторов. Показано, что в ряде случаев концентрация мио- и гемоглобина в мясной массе превышает их содержание у мяса ручной обвалки в 2,5-3 раза.
Следовательно, при наличии в составе рецептур рубленых полуфабрикатов более 50% мяса птицы механической обвалки вероятность увеличения содержания гемовых пигментов в продукте существенно возрастает.
Таким образом, отсутствие стабильности химического состава сырья, используемого при производстве рубленых полуфабрикатов, создает предпосылки для спонтанного/неконтролируемого повышения концентрации мио- и гемоглобина в мясном продукте, которые при наличии в системе нитрита натрия потенциально способны принять участие в реакции цветообразования.
Но в технологии производства рубленых полуфабрикатов из мяса птицы не предусмотрено использование нитритной соли либо препаратов нитрита натрия.
Откуда же появляется нитрит?
Нитраты и нитриты являются естественными компонентами многих видов растительного сырья. В частности, согласно данным Института питания РАМН, содержание нитратов составляет: в укропе – 30-4074 мг/г, в луке свежем – 10-150 мг/г, в капусте свежей – 14-3465 мг/г, в чесноке сухом – 40-4500 мг/г, в петрушке – 388-2022 мг/г. В питьевой воде концентрация нитратов и нитритов нормируется соответственно на уровне 45 и 3,3 мг/г.
Таким образом, принимая во внимание наличие в составе многих современных рецептур рубленых полуфабрикатов растительных наполнителей (в количествах до 10-12%), являющихся естественными источниками природных нитратов, можно полагать, что процесс формирования розового цвета происходит по следующем схеме:
|
2NaNO3 Нитраты натрия, |
Восстановление → |
2NaNO2 |
+ О2 |
NaNO2 + H2O → кислая среда → HNo2 (азотная кислота) + NaOH
δ · HNO3 → разложение/восстановление →2NO↑ (оксид азота) + H2O + HNO3
|
Met-MB – мет-миоглобин |
+ NO → |
NO-Mb NO-Hb |
|
Met-Hb – мет-гемоглобин |
Красящие пигменты |
Интенсивность окраски зависит от концентрации мио- и гемоглобина в исходном сырье, содержания нитратов в растительных компонентах рецептуры, температуры и рН среды.
Образовавшиеся пигменты розовой части спектра относительно неустойчивы и при длительной выдержке в присутствии воздуха и света переходят в Met-форму, приобретая серо-коричневый оттенок.
Третий случай
Наличие у готовых вареных либо варено-копченых мясокостных изделий из бройлера типа «цельная ножка» (голень + бедро) либо «четвертинка тушки» (голень + бедро + половинка спины) во внутренней области соединений костей голени и бедра вязкой кровянистой жидкости – сукровицы с признаками «недовара», несмотря на то что термообработку осуществляли в соответствии с технологическим регламентом – до доведения температуры в наиболее толстой части изделия до 72-75 °С.
Анализ возможных причин, рекомендации.
С анатомической точки зрения сырьем для производства данных видов мясокостного продукта является часть системы органов движения бройлера: подвижное соединение костей голени и бедра – сустав в совокупности с мышечной тканью. При этом в структуре сустава различают соединяющиеся кости, щелевидное пространство между ними, капсулу и синовиальную жидкость. Капсула окружает полость сустава и герметично ее закрывает. Состоит капсула из двух слоев: наружного фиброзного и внутреннего синовиального. Фиброзный слой является продолжением надкостницы – тонкой соединительной оболочки, покрывающей кости, соединяющей кости голени и бедра и пронизанной кровеносными и лимфатическими сосудами. Внутренний слой капсулы – синовиальный – построен из рыхлой соединительной ткани, выделяющей в полость капсулы вязкую жидкость, выполняющую функцию своеобразной смазки суставных поверхностей. Большая часть синовиальной жидкости находится в гиалиновых хрящах сустава, которые имеют губчатую структуру.
Синовиальная жидкость состоит из двух компонентов: жидкостного, содержащего водорастворимые белки, и белково-полисахаридного (в основном – на базе гиалуроновой кислоты). По общему химическому составу синовиальная жидкость похожа на лимфу, является производной плазмы крови и характеризуется несколько меньшим содержанием белка, отсутствием гемоглобина и высоким содержанием лимфоцитов, которые, как правило, накапливаются в местах воспалений и повреждений. В норме синовиальная жидкость прозрачная либо слегка желтоватая, в случае травмирования суставов (вывихи, ушибы, переломы и т. п.), воспаления и образования опухолей синовиальная жидкость приобретает красно-коричневый цвет.
Количество синовиальной жидкости в области суставной капсулы у здоровой птицы относительно невелико, но существенно возрастает при наличии локальных повреждений кровеносных сосудов, внутренних кровоизлияний, ушибов, вывихов и переломов конечностей, а также стрессовых воздействий, которые могут являться следствием нарушения правил отлова, транспортировки, разгрузки и навешивания птицы на конвейер убоя. Степень травмирования бройлеров перед убоем главным образом зависит от профессионализма работников предприятия, при этом установлено также, что чем старше птица и больше ее масса, тем выше вероятность ее травмирования.
В производственных условиях пораженные синовитом ноги обычно зачищают, цельные тушки используют без ограничения.
Таким образом, исходя из особенностей химико-морфологического состава мясокостных изделий из бройлера, для достижения состояния полной кулинарной готовности в капсульной области сустава следует ориентироваться на необходимость обеспечения максимальной денатурации белков, формирующих структурную основу капсулы и входящих в состав соединительнотканных оболочек, хрящевой ткани, плазмы крови, лимфы, синовиальной жидкости и т.п.
С этой целью представлялось целесообразным рассмотреть особенности изменений их свойств под воздействием термообработки. В частности коллаген, преобладающий в составе соединительной ткани, нерастворим в воде, но хорошо набухает при рН 5-7. Под воздействием нагрева до 63-64 °С волокна коллагена деформируются и сжимаются, выраженный гидролиз с образованием желатов начинается при температурах выше 70 °С, особенно в средах, имеющих щелочную либо кислую реакцию.
Хрящевая ткань в основном состоит из сложных белков, хондромукоидов, мукополисахаридов, коллагена и других органических и минеральных веществ. Хондромукоиды, образующие матрицу хряща, весьма устойчивы к нагреву. В то же самое время хондроитинсерная кислота, преобладающая в составе мукополисахаридов, хорошо растворяется в воде, особенно при щелочных значениях рН и повышенных (более 70-80 °С) температурах.
Кровь характеризуется высоким (16-19%) содержанием таких соле- и водорастворимых белков, как гемоглобин, альбумины, глобулины и фибриноген, причем доля гемоглобина от общего содержания белка составляет около 60%. При рН 7,3-7,8, свойственных для крови, процесс денатурации основных белков происходит в температурном диапазоне от 45 до 75 °С, наиболее устойчив к нагреву гемоглобин, состоящий из белковой части – глобина и простетической группы – гема.
В плазме крови и лимфы, входящих в состав синовиальной жидкости, отсутствует гемоглобин, и при содержании общего белка 7-9% доля альбуминов и глобулинов составляет, соответственно, 30-50% и 40-60%. Начало денатурации отмечается при 45-47 °С, максимальная интенсивность процесса достигается при 67-68 °С.
При этом следует отметить, что кинетика и результативность процесса денатурационно-коагуляционных изменений белков существенно зависят не только от уровня конечной температуры, достигнутой при нагреве объекта, но и от таких физико-химических факторов, как продолжительность термического воздействия, значения рН и ионного состава среды, температуры греющей среды, скорости нагрева и т. п.
В частности, установлено, что:
- В диапазоне рН, близком к изоточке белков, процесс их термоденатурации протекает быстрее и более полно. Исходя их этого положения, следует, что в изделиях из мяса птицы (которое большей частью имеет рН от 6,3 до 7,2) процесс денатурации у основных мышечных белков – миозина, альбуминов и глобулинов, – изоэлектрическое состояние у которых наступает в интервале рН 4,5-5,4, – будет ингибироваться. В то же время у таких белков, как миоген, миоглобин, гемоглобин и коллаген, имеющих изоточку в диапазоне рН от 6,0 до 7,0, скорость денатурационно-коагуляционных превращений будет возрастать.
- Присутствие пищевой соли/хлорида натрия в мясных системах оказывает существенное влияние на скорость и степень денатурации белков. Наличие 2-4% NaCl снижает значения изоточки мышечных белков и уменьшает их устойчивость к нагреву. Следовательно, реализация в технологии производства мясных продуктов современного тренда по уменьшению содержания хлорида натрия в готовых изделиях до уровня 1,2-1,5% приводит к повышению термоустойчивости белков и вероятности появления «недовара».
- Значительные количества сахарозы (до 2%), глюкозы (до 1%), мальтодекстринов (до 3%) в составе современных рассольных композиций и рецептур мясных изделий замедляют ход процессов денатурационно-коагуляционных превращений белковых веществ. Аналогичный эффект вызывает присутствие в мясных системах высоких концентраций ионов кальция и других двухвалентных металлов.
Таким образом становится очевидным, что вследствие наличия множества варьируемых факторов, неадекватно влияющих на характер конформационных изменений белковых веществ, получение при стандартных параметрах термической обработки требуемого и устойчивого уровня денатурационно-коагуляционных превращений белков, соответствующего критериям кулинарной готовности, органолептических показателей и микробиологических характеристик, не может быть гарантировано.
В этих условиях, учитывая, что все физико-химические процессы развиваются во времени, наиболее простым технологическим решением для получения требуемого результата является удлинение продолжительности термического воздействия на продукт за счет его дополнительной («термостатной») выдержки после окончания основного цикла нагрева.
Согласно рекомендациям отечественных и зарубежных специалистов применительно к производству вареных и варено-копченых мясокостных изделий из птицы, имеющей признаки синовита, предлагается несколько ужесточить параметры процесса варки: нагрев осуществлять (при температуре греющей среды 75-78 °С) до достижения в наиболее толстой части продукта 76 °С, после чего провести его экспонирование/выдержку в течение 15 минут в температуре до осуществления продувки и охлаждения.
Надеемся, что проведенный анализ позволит специалистам колбасно-кулинарных производств не только расширить научно-практические представления об особенностях состава и свойств мяса птицы, но и создаст предпосылки для оптимизации приемов, способов и параметров отдельных технологических операций, обеспечивающих получение продукции высокого качества.
Журнал «Мясной ряд» №3 – 2019
Подбор фото: «Мясной Эксперт»
Литература:
1. Жаринов А. И. Современное мясное сырье: особенности состава, свойств, технологического использования // Мясная индустрия. 2017 – № 3.
2. Northcult J. K. Relationship between Feed Withdrawal and Viscera Condition of Broilers / J. K. Northcult, S. I. Savage, L. R. Vest// Pult. Sci. – 1982.
3. Сэмс Р. А. Переработка мяса птицы / Под ред. Алана Сэмса; пер. с англ. – СПб.: Профессия, 2007.
4. Жаринов А. И., Кузнецова О. В., Жукова А. Ю., Костенко Ю. Г. К вопросу контаминации мяса птицы бактериями Serratia Marcescens // Мясные технологии. 2019 – № 4.
5. Соколов А. А. Физико-химические и биохимические основы технологии мясопродуктов. – М.: Пищевая промышленность, 1965.
6. Жаринов А. И., Кузнецова О. В. Факторы, влияющие на формирование цвета мясопродуктов // Мясная индустрия. 2015 – № 7.
7. Lawrie R. H. Meat Science, copyright / R.H. Lawric. Pergamon Press, 1966.
8. Лебедева Н. А., Бобровский А. Я., Писменская В.Н. и др. Анатомия и гистология мясопромышленных животных. – М.: Агропромиздат, 1985.
9. Павловский П. Е., Пальмин В. В. Биохимия мяса. – М.: Пищевая промышленность, 1975.
10. Фейнер Г. Мясные продукты. Научные основы. Технологии. Практические рекомендации. – СПб.: Профессия, 2010.
11. Туниева Е. К., Дедерер И. Влияние посола на стабильность белков при тепловой денатурации. // Мясная индустрия. 2017 – № 2.
12. Рогов И. А., Жаринов А. И., Воякин М. П. Химия пищи. Принципы формирования качества мясопродуктов. – СПб.: изд. РАПП, 2008.
Центральная научно-методическая ветеринарная лаборатория
Эксперт ФГБУ ЦНМВЛ Нина Головина рассказала журналу «Птицепром» о микробиологическом контроле птицеводческой продукцииПтицеводство — наиболее динамично развивающаяся отрасль российского агропромышленного комплекса, обеспечивающая население биологически полноценной здоровой пищей. Продукты из мяса птицы широко востребованы. Вместе с тем они являются источником ряда рисков: физических, химических и особенно микробиологических.
Заражение продуктов из мяса птицы патогенными бактериями остается главной микробиологической проблемой для промышленности и потребителя. Несмотря на значительные усилия разных стран, направленные на снижение распространенности пищевых отравлений, птичье мясо по-прежнему остается зоной риска, носителем микроорганизмов, вызывающих всплески заболеваний, особенно некоторых серотипов сальмонелл и листерий.
В связи с увеличением числа заболеваний человека, вызванных токсигенными бактериями, контроль безопасности продуктов птицеводства по бактериологическим показателям − актуальная проблема. Одним из важнейших компонентов предотвращения вторичной контаминации микроорганизмами пищевого сырья и продуктов являются научно обоснованные профилактические мероприятия в начале «пищевой цепи», в том числе контроль производства и качества сырья и продуктов на наличие Е. coli, Salmonella spp., Campylobacter spp. и L. monocytogenes.
Для обеспечения выпуска безопасной по микробиологическим показателям продукции птицеводства необходимо осуществлять контроль на всех стадиях производственного цикла, начиная с исследований живой птицы родительского стада и продолжая в инкубаторе, а затем в птичнике для выращивания бройлеров и содержания яичной птицы, и, наконец, на предприятиях по переработке птицы и яиц.
В целях профилактики сальмонеллеза птиц на птицеводческих предприятиях необходимо проводить:
- бактериологический контроль носительства на сальмонеллы в родительских стадах и промышленных стадах несушек и мясной птицы;
- бактериологический контроль состояния инкубаториев;
- бактериологический контроль поступающих в хозяйство кормов, питьевой воды;
- микробиологический контроль каждой партии продукции на предприятиях по переработке птицы;
- контроль качества ежедневной дезинфекции после окончания рабочей смены;
- исследования на пуллороз-тиф в КРНГА племенного молодняка кур в возрасте 55 дней с последующей выбраковкой положительно реагирующих особей.
Одним из направлений деятельности подведомственного Россельхознадзору ФГБУ «Центральная научно-методическая ветеринарная лаборатория» является проведение ветеринарного лабораторного контроля:
- мониторинг безопасности и качества продукции животного происхождения и кормов;
- диагностика заразных и незаразных болезней животных и птиц, эпизоотический мониторинг.
В рамках плана государственного мониторинга качества и безопасности пищевых продуктов за 9 месяцев 2018 года учреждением проведено 6412 исследований на сальмонеллез (за 9 месяцев 2017 года — 6635 исследований), получено 93 (в 2017 году — 128) положительных результата, т.е. 1,0% (2017 год — 1,93%). Также проведено 4683 исследований на листериоз (за 9 месяцев 2017 года – 4825), получено 169 (2017 год – 240) положительных результатов, что составляет 4,0% (2017 год – 4,97%).
Из проверенных на сальмонеллез образцов пищевой продукции в 2018 году самое большое количество положительных результатов выявлено в мясе птицы (см. таблицу 1).
Таблица 1. Результаты исследования мяса птицы на сальмонеллез
|
Вид материала |
2018 |
2017 |
||||
|
Проведено исследований |
Получено положи-тельных резуль-татов |
% выяв-лений |
Проведено исследований |
Получено положительных резуль-татов |
% выявлений |
|
|
Мясо птица, субпродукты, биоматериал |
1278 |
60 |
5 |
1037 |
71 |
6,85 |
Аналогичная картина с исследованиями на листериоз. Здесь также наибольшее количество положительных результатов приходится на мясо птицы (см. таблицу 2).
Таблица 2. Результаты исследования мяса птицы на листериоз
|
Вид материала |
2018 |
2017 |
||||
|
Проведено исследований |
Получено положи-тельных резуль-татов |
% выяв-лений |
Проведено исследований |
Получено положительных результатов |
% выявлений |
|
|
Мясо птица, субпродукты, биоматериал |
1167 |
71 |
6 |
1062 |
87 |
8,19 |
Проведённый мониторинг показал, что в продуктах, субпродуктах и полуфабрикатах из мяса птицы присутствуют L. monocytogenes и различные штаммы сальмонелл. В этиологической структуре сальмонелл у людей продолжает доминировать S. Enteritidis, составляющая 80% от всех идентифицированных сальмонелл. Второе по частоте встречаемости место занимает S. Typhimurium, а третье — S. Infantis. Соответственно, требуется разработка способов предупреждения контаминации готовой продукции этими патогенами.
По данным ученых, причиной 60% отравлений, вызванных потреблением зараженной птицы, являются сальмонеллы. Сальмонеллез – острая кишечная инфекция человека или животных, которая характеризуется преимущественным поражением желудочно-кишечного тракта и интоксикацией, реже – тифоподобным течением или септикопиемией. Возбудители – Salmonella enterica, подвид enterica, сероварианты S.Typhimurium, S.Enteritidis, S.Newport и другие.
Сальмонеллезы – зооантропонозные инфекции, источник инфекции – животные, птицы, пресмыкающиеся. Механизм заражения – фекально-оральный. Основной путь передачи инфекции – пищевой, возможны также водный и контактно-бытовой. Заразиться сальмонеллезом можно и через загрязненную воду при питье или купании. Водный путь передачи возможен как способ заражения животных в животноводческих комплексах и на птицефабриках.
Продукты птицеводства, употребляемые в пищу (мясо, яйца), могут вызвать тяжелую токсикоинфекцию – пищевое отравление. Среди инфекций, общих для человека и животных, сальмонеллез не имеет себе равных по тяжести протекания болезни и сложностям ее лечения.
Еще одна микробиологическая проблема – это листерии в мясных и птицепродуктах. Листериоз — природно-очаговая инфекционная болезнь человека и животных. Листерии широко распространены во внешней среде. Встречаются в почве, воде, растениях. Значительную роль в распространении листериоза играет способность возбудителя длительно сохраняться в различных пищевых продуктах, в том числе упакованных в барьерные пленки, ограничивающие доступ кислорода (под вакуумом, в модифицированной газовой атмосфере). Заболевание людей чаще всего вызывает один из наиболее вирулентных микроорганизмов — L. monocytogenes.
Основной природный резервуар — грызуны, насекомоядные и травоядные, птицы, а также большинство сельскохозяйственных и домашних животных. Заболеваемость может носить эпизоотический характер и наиболее выражена у молодняка. У животных основными путями передачи являются алиментарный и трансмиссивный (через кровососущих насекомых и клещей).
У человека заболевание протекает в большинстве случаев с поражением нервной ткани или в ангинозно-септической форме. Непосредственный контакт с зараженными животными и птицей, уход за ними приводят к возникновению листериозного конъюнктивита или кожной форме листериоза (капулезной экзактеме кожи) у работников птицеферм, животноводческих хозяйств, скотобоен.
Данные отечественных и зарубежных исследователей последних лет свидетельствуют об исключительно широких адаптивных способностях листерий, позволяющих им размножаться в окружающей среде в различных природных субстратах (растительных, почвенных, водных). L. monocytogenes может расти на поверхности пищи или оборудования, образуя биопленку устойчивую к дезинфектантам. Листерии способны плодиться в широком диапазоне температур (4-45°С), рН (4,8-9,0) и влажности, в присутствии NaCI (20%) и СО2 (15%). Очевидно, что заражение цыплят может происходить как из окружающей среды, так и от здоровых кур-носителей на птицефабриках. Рост листерии в мясных и куриных полуфабрикатах возможен при хранении в широком диапазоне температур: от 0 до +25°С. Оптимальное значение рН>6,0.
В организации противоэпизоотических и противоэпидемических мероприятий по борьбе с листериозом и сальмонеллезом важное место отводится диагностике инфекции. Из лабораторных методов диагностики сальмонеллеза и листериоза до настоящего времени актуальными остаются бактериологический, молекулярно-генетический (ПЦР) и серологический.
В последнее время для диагностики сальмонеллеза и листериоза используют иммуноферментные и иммунохроматографические тест-системы. Эти тест-системы обладают высокой чувствительностью и специфичностью, однако требуют приборного обеспечения и занимают достаточно много времени (1,5-3 часа). Из новых методов наиболее привлекательным для лабораторной практики является реакция латекс-агглютинации (РЛА), которая отличается быстротой и простотой выполнения, а также специфичностью и чувствительностью.
Основу профилактики сальмонеллёза среди людей составляют ветеринарно-санитарные мероприятия, направленные на обеспечение надлежащих условий в процессе убоя скота и птицы, технологии обработки туш, а также соблюдение санитарного режима на предприятиях пищевой промышленности и общественного питания.
Наибольшее значение для профилактики пищевого листериоза и сальмонеллеза у людей приобретает правильное питание, исключающее или значительно снижающее риск контакта с патогенными микроорганизмами. Населению следует:
а) использовать продукты животного происхождения только после кулинарной, термической обработки;
б) тщательно мыть сырые овощи перед едой;
в) держать сырое мясо и овощи отдельно от готовых к употреблению продуктов;
г) избегать употребления сырого (непастеризованного) молока или изготовленных из него продуктов;
д) тщательно мыть руки, ножи и разделочные доски после работы с сырыми продуктами.
С точки зрения безопасности продукции первичная переработка не менее важна, чем содержание и кормление птицы. Если при содержании и кормлении птицы основная задача – свести к минимуму заражение птицы патогенами, то при первичной переработке – не допустить перекрестного заражения тушек птицы.
Проведенными исследованиями было установлено, что используемые в рационах комбикорма являются одной из наиболее вероятных причин контаминации поверхности тушек цыплят-бройлеров L. monocytogenes и бактериями рода Salmonella, в смывах с которых выделены те же штаммы, что и в комбикормах, содержимом слепых отростков, помёте, подстилке, в смывах с ног и кормушек в птичниках. Корм играет роль переносчика патогенов к животным и далее к человеку. Тип корма, процесс его переработки и условия хранения становятся важнейшими факторами, определяющими количество и тип присутствующих микроорганизмов.
Безопасность комбикормов по микробиологическим показателям обусловливается в основном качеством используемого сырья. Кормовые ингредиенты, используемые для приготовления комбикорма для птицы, часто контаминированы различными микроорганизмами. Чтобы обеспечить выработку комбикормов, отвечающих ветеринарно-санитарным требованиям, работники комбикормовых предприятий должны осуществлять входной контроль сырья по комплексу микробиологических показателей и в зависимости от результатов производить его переработку, предварительное обеззараживание или обезвреживание.
В санитарной оценке кормов особое значение имеют такие показатели, как общая бактериальная обсемененность, наличие патогенных микроорганизмов. Из патогенных видов микроорганизмов, встречающихся на кормах, наибольшую опасность для здоровья животных представляют энтеропатогенные серотипы кишечной палочки, сальмонеллы, листерии, стафилококки, бактерии группы протеус.
Обеспечение микробиологической безопасности продукции птицеводства имеет важнейшее социальное и экономическое значение, поскольку является одним из основных условий получения высококачественных и безопасных продуктов питания и продовольственного сырья и, как следствие, предотвращения заболеваний человека.
Материал подготовлен редакцией журнала «Птицепром», № 4 (41) 2018.
Посмотреть полный выпуск журнала можно здесь.
Читать также: В Самарской области проконтролирован экспорт картофеля за пределы РФ 19.05.2020 подробнее Массовая доля сырого протеина в пробе жмыха рапсового не соответствовала норме 20.12.2018 подробнее О выявлении превышения содержания индексов БГКП и энтерококков в почвах Калужской области 23.10.2017 подробнее
В мясе птицы (филе без кожи) обнаружены сальмонеллы
В рамках исполнения Плана государственного мониторинга качества и безопасности пищевых продуктов, сотрудниками лаборатории ветеринарно-санитарной экспертизы и диагностики ФГБУ «Нижегородский референтный центр Россельхознадзора» при исследовании образцов, отобранных госинспекторами ТУ Россельхознадзора, были выявлены следующие отклонения:
В одной пробе полуфабрикатов из мяса птицы (филе без кожи) обнаружены патогенные микроорганизмы рода сальмонелл.
Сальмонеллезы – широко распространенные пищевые заболевания животных и человека. У человека пищевые токсикоинфекции сопровождаются поражением желудочно-кишечного тракта и обезвоживанием организма. Загрязненные пищевые продукты и сырье, а также вода – основные источники и факторы передачи возбудителя. В пищевые продукты патоген переходит из загрязненного сырья.
Ежегодно в развитых странах, в том числе и в России регистрируются миллионы случаев заболевания сальмонеллезом. Главные виновники этого – мясо, в том числе мясо птицы, молоко и молочные продукты, рыба, майонезы, соусы. По сути, это те продукты, которые мы употребляем ежедневно и не можем от них отказаться.
Мясо птицы обсеменяется микроорганизмами прижизненно, после убоя и обработки при ошпаривании, удалении оперения, потрошении и охлаждении. Содержание микрофлоры в воде шпарильных чанов увеличивается в десятки и сотни раз через 3-4 ч работы. В процессе удаления оперения микроорганизмы через нарушенный кожный покров (порезы, ссадины) попадают в глубокие слои мышечной ткани. При потрошении в результате разрывов кишечника происходит обсеменение микрофлорой, Массивная контаминация тушек может происходить при холодильной обработке (в ваннах охлаждения).
Важную роль в профилактике сальмонеллеза играет предубойная подготовка птиц, в том числе выдержка птиц без корма, выбраковка больной и ослабленной птицы. На этапе убоя необходимо обеспечить контроль за соблюдением ветеринарно-санитарных требований, технологического режима первичной переработки (оглушение, обескровливание, температура и продолжительность шпарки, качество туалета тушек). На этапе охлаждения и упаковывания — за соблюдением технологических режимов охлаждения (температура среды охлаждения, соответствие микробиологических показателей среды охлаждения установленным требованиям, проведение исследования произведенной продукции на сальмонеллез), за отсутствием перекрестной контаминации в процессе охлаждения и после него через оборудование, руки и одежду работников.
Микробиология яиц — Студопедия
Микробиология мяса птицы
Методические указания к проведению лекционного занятия
Микробиологические показатели колбасных изделий
Таблица 6
| Вид продукта | КМАФАнМ, КОЕ/г, не более | Масса продукта, г, в которой не допускаются | |||||||
| БГКП | сульфитреду-цирующие клостридии | стафилококки | |||||||
| нор- | нор- | нор- | нор- | ||||||
| ма- | ма- | ма- | ма- | ||||||
| тив | тив | тив | тив | ||||||
| Колбасы, ва- | |||||||||
| реные, сосис- | |||||||||
| ки, сардель- | |||||||||
| ки: | |||||||||
| высшего | 1 • 103 | 0,01 | |||||||
| сорта | |||||||||
| второго сорта | 2,5 • 103 | 0,01 | |||||||
| Колбасы ва- | |||||||||
| реные с до- | |||||||||
| бавлением | 1 • 103 | 0,1 | |||||||
| антимикроб- | |||||||||
| ных добавок | |||||||||
| кровяные | 2 • 103 | 0,01 | - | ||||||
| Колбаса ли- | |||||||||
| верная выс- | |||||||||
| шего и пер- | 2 • 103 | 0,01 | - | ||||||
| вого сортов |
Контрольные вопросы:
1. …
2. …
Литература:
1. …
2. …
Тема № 2.3 Микробиология мяса птицы. Микробиология яиц и яичных продуктов.
План:
1. Микробиология мяса птицы
2. Микробиология яиц
3. Микробиология яичных продуктов
В отличие от мяса крупного рогатого скота мускульная ткань птицы состоит из более тонких волокон, клетки соединительной ткани нежнее, соединительная ткань имеет более рыхлое строение. Эти особенности строения мяса птицы делают его мягче, нежнее мяса крупного рогатого скота. Эти же особенности строения делают его более доступным для микроорганизмов, являясь благоприятной средой для их развития.
Источники контаминации мяса птицы, видовой состав микрофлоры, виды порчи мяса птицы сходны с микрофлорой мяса крупного рогатого скота. Однако у мяса птицы, особенно водоплавающей, есть одна особенность: в мясе могут встречаться сальмонеллы, возбудители пищевых токсикоинфекций.
Для развития микроорганизмов на мясе птицы имеют важное значение способы убоя и разделки птицы. По способу обработки тушки птицы делятся на полупотрошеные и потрошеные. Полупотрошеные тушки птицы обычно значительнее обсеменены микроорганизмами, чем потрошеные. При полупотрошении нередко происходит разрыв кишечника, что загрязняет полость тушки кишечными микроорганизмами. Повреждение кожи при снятии оперения также способствует инфицированию мяса микроорганизмами.
Яйцо сельскохозяйственной птицы содержит все питательные и биологически активные вещества, необходимые для роста и развития организма человека и животных. Особенно высококачественным продуктом питания человека являются яйца кур, в которых содержится белок, жиры, углеводы, незаменимые аминокислоты, микроэлементы, почти все известные витамины, биологически активные вещества.
Инфицирование яиц микроорганизмами может происходить эндогенным и экзогенным путями. При эндогенном заражении микроорганизмы проникают в яйцо в процессе его формирования в яичнике или яйцеводе больной птицы. Это могут быть вирусы, бактерии, грибы, возбудители туберкулеза, сальмонеллеза.
Особую опасность представляют яйца водоплавающей птицы, инфицированные сальмонеллами, поэтому продавать утиные и гусиные яйца в розничной торговле запрещено.
Экзогенное заражение яиц связано с заражением скорлупы пометом, почвой, подстилкой, пером и т. п. Чистота скорлупы — важный показатель качества пищевых яиц. Загрязненная скорлупа не только портит их товарный вид, но и резко сокращает продолжительность хранения. На 1 см2 поверхности свежих чистых яиц находятся десятки и сотни, редко тысячи бактерий, а загрязненных — десятки тысяч и даже миллионы микробных клеток.
В яйца через скорлупу из внешней среды могут проникать как сапрофитные, так и патогенные микроорганизмы в большинстве случаев во время сбора, хранения и транспортировки. Обсеменение яиц увеличивается при антисанитарном состоянии гнезд, тары для хранения и транспортировки при повышенной влажности воздуха, так как влажная скорлупа наиболее проницаема для микроорганизмов.
Содержимое яйца, полученного от здоровой птицы, стерильно. Несмотря на наличие пор в скорлупе, стерильность яиц может сохраняться в течение нескольких месяцев, что обусловлено главным образом бактерицидными свойствами скорлупы и яичного белка.
Скорлупа выполняет защитную функцию, предохраняя яйцо от проникновения микроорганизмов. На поверхности скорлупы при снесении яйца откладывается слой слизи, который, высыхая, образует надскорлупную пленку — кутикулу. В состав пленки входит лизоцим, действующий бактерицидно на многие микроорганизмы.
Наиболее сильным антибиотическим действием обладает белок куриных яиц. Антибиотические свойства белка обусловлены наличием бактерицидных веществ — лизоцима, овидина, кональбумина, овомукодина, овомуцина и углекислоты, которые подавляют рост микроорганизмов. Размножение микроорганизмов задерживается также из-за высокого рН и устойчивости протеинов белка к воздействию микробов. Бактерицидными свойствами обладает и скорлупа.
Яйца относятся к скоропортящимся продуктам, хранить их долгое время необходимо при условиях, обеспечивающих замедление протекающих в них физико-химических процессов и предупреждающих проникновение микроорганизмов.
При длительном хранении качество яиц может изменяться: в яйце протекают окислительные, автолитические и микробиологические процессы.
Под действием ферментов, выделяемых микроорганизмами, составные части яйца разлагаются с образованием специфических продуктов распада. Изменения, вызываемые бактериями, разнообразны и зависят от их свойств и биохимической активности.
При попадании внутрь яйца бактерий рода Pseudomonas белок становится серым, мутным, разжиженным, в дальнейшем белок и желток приобретают зеленоватый оттенок, переходящий в темно-зеленый цвет. Зеленый цвет обусловлен также развитием стафилококка.
Аэробные гнилостные бактерии придают желтку светло-желтый цвет. Желточная оболочка разрушается, происходит перемешивание белка с желтком, образуется однородная мутная жидкая масса.
Bact. prodigiosum, M. roseus, некоторые дрожжи и плесени образуют красный пигмент и окрашивают содержимое яйца в розовый цвет.
Proteus vulgaris и Е. coli и другие гнилостные бактерии окрашивают содержимое яйца в черный цвет. В яйце накапливается большое количество газов.
В результате гниения содержимого яйца, протекающего под действием анаэробных клостридий, триптофан распадается с образованием сероводорода, скатола, индола, обладающих сильным неприятным запахом.
Углеводы яйца сбраживаются бактериями с образованием молочной, уксусной и других органических кислот, повышающих кислотность яичной массы.
В пищу используют свежие, хранящиеся в холодильнике куриные яйца. Нельзя использовать гусиные, утиные и известкованные куриные яйца.
Загрязнение мяса — обзор
6.2 Происхождение и динамика микробного заражения мяса, участвующего в порче
У здоровых живых животных мышцы стерильны, а кожа, перья, шкура, пищеварительные и мочевыводящие пути — нет. Следовательно, микроорганизмы, присутствующие внутри и на животных, могут заражать туши и поверхность пореза, особенно во время потрошения и снятия шкуры. Кроме того, воздух, поверхности оборудования и вода не являются стерильными и могут вызвать дополнительное загрязнение после убоя и во время каждого из последующих этапов обработки.Микроорганизмы также могут передаваться в результате перекрестного заражения от людей, посуды и оборудования на куски мяса и обработанное мясо. Действительно, виды бактерий, встречающиеся в мясных продуктах, также описаны в микробиотах почвы, воды и животных. В обработанных мясных продуктах, таких как готовые к употреблению блюда, которые содержат обработанное мясо и несколько ингредиентов, дополнительное загрязнение может происходить в результате нескольких этапов обработки, а также из-за добавления различных ингредиентов, которые могут быть загрязнены сами.Например, недавно было зарегистрировано такое загрязнение, и было замечено их влияние на динамику микробиоты еды (Pothakhos et al., 2015b). В частности, было показано, что LAB видов Leuconostoc gelidum , вызывающих порчу, хотя и присутствует в ингредиентах в очень низком количестве, может перерасти другие виды бактерий и стать доминирующими в конце срока годности готовых к употреблению блюд. Несколько недавних исследований, в которых рассматривались бактериальные сообщества, присутствующие на различных мясных продуктах, и их динамика во время хранения или обработки, подтвердили различное происхождение загрязнения мяса и показали, что условия обработки и хранения мяса оказывают избирательное давление на исходные загрязнения (De Filippis et al., 2013; Бенсон и др., 2014; Chaillou et al., 2015; Hultman et al., 2015).
Это было продемонстрировано в бифштексах с использованием высокопроизводительного пиросеквенирования гена 16S рРНК, метода, обеспечивающего подробное описание контаминирующих видов. Образцы были собраны по всей производственной цепочке от мясоперерабатывающей среды (включая руки оператора, нож, используемый для нарезки, разделочную доску и стену холодильной камеры) до бифштексов, туш и отрубов, из которых они были получены (De Филиппис и др., 2013). Бифштексы анализировали в свежем виде (T0) и после 1 недели хранения в аэробных условиях при 4 ° C. Эти авторы показали, что популяция бактерий, наблюдаемая на бифштексах в момент T0, была аналогична популяции, обнаруженной в образцах, взятых из туш и отрубов, которые они получали, а также из среды бойни, демонстрируя важность начальных этапов заражения. Затем в конце хранения произошло резкое уменьшение бактериального разнообразия с отбором родов аэробных и психрофильных бактерий, связанных с ранее зарегистрированной порчей мяса, таких как виды Brochothrix thermosphacta и Pseudomonas .Это исследование подтвердило происхождение B. thermosphacta из перерабатывающих растений и раннее заражение отрубов мяса, как сообщалось ранее (Nychas et al., 2008; Gribble and Brightwell, 2013).
В другом отчете последовательность бактериальных сообществ отслеживалась во время хранения свежих свиных колбас в течение 80 дней при 4 ° C (Benson et al., 2014). Как наблюдали в бифштексах, первоначальная популяция бактерий была более сложной в начале процесса, а затем уменьшалась. Количество бактерий изменилось с 10 2 КОЕ / г в момент T0, достигнув 10 6 КОЕ / г после 15 дней хранения, а затем достигло плато примерно при 10 8 КОЕ / г на 30 день до конца хранения.Интересно, что данные пиросеквенирования выявили несколько волн сукцессий бактериальных популяций в течение периода хранения, со смещением одних доминирующих таксонов в пользу других, но заканчивая доминированием лишь нескольких видов. Кроме того, окончательное доминирование Lactobacillus graminis в образцах, посвященных тестированию антимикробного действия лактата и диацетата на свиные колбасы, позволило проследить происхождение L. graminis в специях, используемых для изготовления колбас.Это указывает на возможное загрязнение мясных продуктов переработанными ингредиентами.
В исследовании, опубликованном Chaillou et al. (2015) виды бактерий, присутствующие в четырех различных мясных продуктах (говяжий фарш и телятина, колбаса из птицы и нарезанный кубиками бекон), также были определены с помощью пиросеквенирования гена 16S рРНК. Анализ проводился на свежих и испорченных образцах. Данные, полученные в результате этого исследования, показали, что в свежих продуктах обнаруженные виды бактерий были аналогичны тем, которые описаны в микробиотах животных (кожа и кишечник).Более многочисленными были также виды, описанные в окружающей среде, особенно в различных водоемах. Это исследование также выявило большое разнообразие бактерий, заражающих эти четыре мясных продукта, при этом в некоторых образцах было обнаружено более 200 различных операционных таксономических единиц (OTU). Большинство этих ОТЕ можно отнести к известным видам бактерий, которые уже были описаны в пищевых продуктах. В испорченных продуктах бактериальное разнообразие значительно снизилось, так как было обнаружено гораздо меньше различных ОТЕ, но в большем количестве.Действительно, хотя количество бактерий в глобальном масштабе увеличивалось примерно на 4 log КОЕ / г до тех пор, пока не произошла порча, количество отдельных ОТЕ упало с более чем 200 до ∼10-40 в испорченных образцах. Это показало, что условия хранения и переработка мяса оказывают избирательное давление на бактериальные загрязнители, формируя бактериальные сообщества, которые развиваются в течение срока годности продуктов (Chaillou et al., 2015). Это было особенно заметно для психрофильных и психротрофных видов, которые могут сопротивляться или даже расти при хранении при низких температурах.Таким образом, не только природа первоначального загрязнения сырья, но также последующие обработки и условия хранения являются важными факторами, которые необходимо учитывать для понимания динамики микробных сообществ мяса, потенциально важных для порчи, независимо от рассматриваемого мясного продукта.
Природа и происхождение бактериального заражения также изучались на вареных колбасах в вакуумной упаковке (Hultman et al., 2015). Образцы были взяты с гладких поверхностей, где манипулировали мясным сырьем и где готовили колбасы, из эмульсий колбас и из колбас во время их хранения.Этот анализ был основан как на характеристике бактериальных изолятов, так и на секвенировании гена 16S рРНК ДНК, выделенной из образцов мяса и поверхности. Как видно из приведенных выше примеров, высокое разнообразие микробиоты, наблюдаемое в окружающей среде, уменьшается в сырье и в процессе производства, что приводит к явному преобладанию фирмикутов (в основном Leuconostoc ) в конечном продукте в результате селективное давление этапов обработки.
Эти примеры показывают, что заражение мяса происходит от животных, скотобойни и производственной среды, а также от различных ингредиентов в случае сложных пищевых продуктов на основе мяса.Среди исходных загрязнителей те, которые лучше всего адаптированы к мясному субстрату и устойчивы к условиям хранения, могут перерасти микробиоту мяса. В этих микробиотах множественные взаимодействия приведут к вытеснению одних бактериальных популяций за счет других (совместное исключение), но некоторые консорциумы также могут демонстрировать такое же поведение роста и происходить в одно и то же время (взаимодействие), как сообщается Pothakos et al. . (2015b).
Микробный риск безопасности пищевых продуктов для людей, связанный с кормом для птицы: роль облучения
Корм для животных был связан с болезнями человека через пищевую цепочку из-за пищевых бактерий и, в последнее время, риска устойчивости к антибиотикам пищевого происхождения.В этом исследовании изучалась степень, в которой радиация может использоваться в качестве средства вмешательства для повышения безопасности и качества кормов для домашней птицы с точки зрения пищевых патогенов и микробов, устойчивых к антибиотикам. Среднее количество контрольных образцов корма составило Log 10 5,98 для общего количества жизнеспособных (TVC), Log 10 4,76 для количества колиформ (CC), Log 10 2,89 для Staphylococcus aureus (STC) и Log . 10 4,57 для количества дрожжей и плесени (YMC) и Salmonella spp.(SC) не обнаружен (ND). Все подсчеты находились в пределах допустимых уровней, за исключением CC (Log 10 4,76), который был выше допустимого предела ≤ log 10 4,0. Идентифицированные изоляты бактерий: Enterobacter cloacae (54,5%), Bacillus cereus (27,3%) и Klebsiella pneumoniae (18,2%). Все (100%) изоляты проявляли множественную лекарственную устойчивость (МЛУ), причем Bacillus cereus было наиболее устойчивым (к 9 из 11 антибиотиков), за которым следовали Enterobacter cloacae / Klebsiella pneumoniae (4 из 11 антибиотиков).Наблюдалось несколько паттернов резистентности: PEN / AMP / FLX был наиболее распространенным (100%), за ним следовали ERY (90,9%), TET (72,7%), CRX (66,6%), CTX (45,4%), CHL / CTR (36,4%). %), GEN (27,3%) и COT (18,2%). Klebsiella pneumoniae продемонстрировала нулевую устойчивость к GEN / CHL / CTR / CTX / CRX, тогда как Enterobacter cloacae и Bacillus cereus продемонстрировали нулевую устойчивость к GEN и COT, соответственно. Наиболее эффективным антибиотиком против грамотрицательных бактерий ( Enterobacter cloacae и Klebsiella pneumoniae), был гентамицин, тогда как котримоксазол был наиболее эффективным против Bacillus cereus (грамположительный).Радиационная обработка 5 кГр полностью уничтожила все микробы, в том числе пищевые патогены с множественной лекарственной устойчивостью. В связи с этим мы рекомендуем обеззараживание низкими дозами радиации в качестве меры по снижению возможных рисков для безопасности пищевых продуктов и здоровья людей, связанных с кормом для птицы.
1. Общие сведения
Корм для животных, как известно, способствует увеличению бремени болезней человека через пищевую цепочку [1]. Однако озабоченность по поводу риска безопасности пищевых продуктов для людей, связанного с кормом для животных, приобрела известность только после того, как болезнь Крейтцфельдта-Якоба («коровье бешенство») была впервые описана у людей [1, 2].Загрязненные продукты из птицы в значительной степени способствуют возникновению бактериальных болезней пищевого происхождения (FBD) [3, 4], влияние которых в значительной степени связано с высокой заболеваемостью и смертностью во всем мире [5]. Было документально подтверждено экономическое воздействие вспышек болезней, связанных с безопасностью пищевых продуктов, на предприятия пищевой промышленности и влияние болезней пищевого происхождения на экономику страны (Hussain et al., 2018). Факты конкретно подтверждают, что когда животные, выращенные для мяса, становятся колонизированными сальмонеллами и другими патогенами бактерий, эти патогены могут передаваться людям через пищевую цепь [1, 6].К сожалению, риску заражения людей пищевыми бактериальными патогенами, связанным с кормом для домашней птицы, не уделялось должного внимания. Текущие факторы, влияющие на БД, такие как появление новых патогенов [7], появление устойчивых к антибиотикам бактерий, рост численности населения с ослабленным иммунитетом [5] и изменение привычек приготовления пищи, требуют большего внимания к этому риску БД, связанному с кормом для птицы.
Семьдесят процентов кормов для животных, производимых в Гане, составляют корма для птицы, которые производятся либо на коммерческих предприятиях по переработке кормов, либо на фермах, занимающихся самоизмельчением [8].Несмотря на то, что разные источники кормов представляют разные уровни риска микробного заражения, обычно заражение происходит на всех этапах производственно-сбытовой цепочки производства кормов, и производство стерильных кормов практически невозможно. Поэтому для повышения безопасности и срока годности кормов необходимы надлежащая производственная практика, постпроизводственная дезактивация и подходящие помещения для хранения.
Обычные методы, применяемые на комбикормовых заводах для устранения бактерий, загрязняющих корма, ограничены, в частности, в борьбе со спорообразователями [9]; следовательно, противомикробные препараты используются для повышения безопасности кормов и срока годности, но при этом отбираются устойчивые к противомикробным препаратам бактерии, которые затем создают дополнительный риск для людей через пищевую цепочку [10].Альтернативой традиционным методам является облучение кормов гамма-лучами от источника кобальт-60. Заранее определенные дозы облучения можно использовать в качестве альтернативы обеззараживанию пищевых продуктов и пищевых продуктов, что повысит безопасность, качество и срок хранения [11]. Облучение полностью удаляет сальмонеллы, энтеробактерии, плесень и насекомых из кормов [11] и улучшает усвояемость и усвояемость белков и углеводов, расщепляя их на легкоусвояемые формы [12, 13].
К сожалению, в большинстве развивающихся стран в целом и в Гане в частности нет всеобъемлющей программы, направленной на решение проблемы загрязнения кормов для животных в программах обеспечения безопасности пищевых продуктов, а радиационная обработка кормов для домашней птицы не изучалась в Гане, чтобы помочь птицеводству и общественному здравоохранению. сектора огромные выгоды от этого.Целью настоящего исследования было в основном изучить влияние гамма-излучения на микробиологическое качество комбикорма для птицы.
2. Материалы и методы
2.1. Отбор и подготовка проб
Комбинированный корм без антибиотиков (сделанный из кукурузы, пшеничных отрубей и соевых бобов) был собран из птицеводческого отделения Института биотехнологии и ядерного сельского хозяйства (BNARI) в стерильных полиэтиленовых пакетах на молнии и отправлен в лабораторию для анализа. .В лаборатории подвыборки из основного образца в асептических условиях взвешивались в меньшие полиэтиленовые мешки (по 100 г в каждом мешке) в двух экземплярах, помечены в соответствии с дозами облучения (0, 5, 10, 15, 20 и 25 кГр) и запечатаны на облучение.
2.2. Облучение
Дозы облучения 5, 10, 15, 20 и 25 кГр от источника кобальта-60 (SLL-02, Венгрия) были применены к образцам в Центре радиационных технологий Комиссии по атомной энергии Ганы. Поглощенная доза подтверждена дозиметрическим методом.
2.3. Микробиологический анализ
2.3.1. Определение микробной нагрузки и идентификация изолятов
Методы Международной организации по стандартизации (ISO) были модифицированы и приняты для подсчета общего количества жизнеспособных организмов (TVC), количества кишечных палочек (CC) и количества дрожжей и плесневых грибов (YMC). Для (TVC) температура инкубации ISO 4833: 2003 была изменена с 30 ° C до 35 ° C, и был использован агар для подсчета на чашках (PCA). ISO 21528-2: 2004 был изменен и применен для подсчета общих колиформ.Температуру инкубации также изменили до 35 ° C и использовали агар с эозин-метиленовым синим (EMB). Агар с окситетрациклиновым глюкозным дрожжевым экстрактом (OGYE) использовали для подсчета дрожжей и плесневых грибов при температуре инкубации 28 ° C (модификация ISO 21527-1). Агар Бэрда Паркера (Oxoid, Великобритания) использовали для подсчета Staphylococcus aureus при инкубации при 35 ° C, и репрезентативные колонии были подтверждены через 24 часа с помощью теста на коагулазу с использованием набора стафилазы (Oxoid, UK).
Все среды были приготовлены и стерилизованы в соответствии с инструкциями производителя, сохранены в расплавленном состоянии при 45 ° C на водяной бане и в асептических условиях вылиты на серийно разведенные образцы в стерильных чашках Петри (20 мл на чашку).Каждое разведение наносили в двух экземплярах. Чашки Петри осторожно встряхивали для перемешивания и среду оставляли для застывания, после чего их инкубировали крышкой чашки Петри вниз, чтобы предотвратить обратный поток влаги в культуру. Колонии подсчитывали через 48 часов с помощью счетчика колоний и рассчитывали КОЕ / г. Специфические патогены также были идентифицированы с помощью лабораторных методов посева и выделения. Наборы API 20E (bioMérieux, Франция) использовались для идентификации грамотрицательных бактерий, в то время как обычные биохимические методы, описанные в [14], использовались для идентификации грамположительных бактерий.
2.3.2. Тестирование на чувствительность к антибиотикам
Процедуры были впервые описаны в [15] и приняты CLSI [16] (2 использовались при определении чувствительности к антибиотикам). Круглосуточные чистые культуры идентифицированных изолятов были приготовлены на питательном агаре для обеспечения достаточного роста. Затем готовили инокулят изолированных штаммов, засевая в асептических условиях универсальный флакон, содержащий 9 мл 0,1% стерильной пептонной воды, с использованием проволочной петли. Концентрацию посевного материала стандартизировали, устанавливая его мутность до 0.5 стандартов МакФарланда. Инокулят наносили на поверхность подготовленного и разливали (в чашки Петри). Для агара чувствительности Мюллера-Хинтона использовали калиброванную проволочную петлю. Затем использовали стерильный ватный тампон для распределения культуры по поверхности среды. Засеянному планшету давали высохнуть в течение нескольких минут, после чего на него с помощью стерильных щипцов накладывали диски чувствительности, приобретенные в продаже (Oxoid, Великобритания). Зоны ингибирования вокруг дисков чувствительности измеряли с точностью до миллиметра с помощью штангенциркуля после 18-24 часов инкубации при 37 ° C, и результаты записывали.Критерии интерпретации (значения диаметра зоны) CLSI [16] использовались для определения чувствительных, промежуточных и устойчивых точек останова.
Использовали следующие антибиотики: бета-лактамы-пенициллины (пенициллин 10 мкл г, ампициллин 10 мкг г и флуклоксациллин 5 мкл г) и цефалоспорины (цефуроксим 30 мкл г, цефотаксим 30 мкл мкг). г и цефтриаксон 30 мк г), тетрациклины (тетрациклин 10 мк г), макролиды (эритромицин 15 мк г), аминогликозиды (гентамицин 10 мк г), сульфаниламиды (котримоксазол 25 мк г) диск) и Хлорамфеникол 30 мкМ г / диск.
2.4. Анализ данных
Количество микробов в колониеобразующих единицах (КОЕ / г) определяли по стандартным формулам и переводили в логарифмы (log10).
3. Результаты
Среднее количество жизнеспособных клеток, колиформ, стафилококков, дрожжей и плесневых грибов комбикорма составило, соответственно, 5,98, 4,76, 2,89 и 4,57 log 10 КОЕ / г. Salmonella spp. не обнаружены. Подробная информация о влиянии доз облучения на эти микробные популяции сведена в Таблицу 1.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Значения представляют собой средние значения двух повторяющихся определений, поддающихся количеству определений, TVC: общее количество 900 сопоставимых определений Количество стафилококков , SC: Количество Salmonella , YMC: количество дрожжей и плесени и неразрушающий контроль: не обнаружено Допустимые уровни загрязнения [17]. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Результаты (таблица 1) показывают, что все подсчитанные жизнеспособные клетки находились в пределах допустимых уровней контаминации, за исключением количества колиформных бактерий (log 10 4,76), которое было выше допустимого уровня ≤ log 10 4,0. Гамма-излучение 5 кГр полностью уничтожило все жизнеспособные клетки всех видов и сделало уровни загрязнения приемлемыми (Таблица 1).
В результате бактериальной идентификации было получено 11 бактериальных изолятов, которые были идентифицированы в 3 родах: Bacillus, Enterobacter и Klebsiella.Подробная информация о встречаемости родов бактерий в необлученных образцах кормов представлена в Таблице 2.
| |||||||||||
Enterobacter cloacae был наиболее частым идентифицированным видом бактерий (54,5%), за ним следовали Bacillus cereus (27,3%), а затем Klebsiella pneumoniae (18,2%) (таблица 2).
Результаты (рисунок 1) показывают, что все изоляты были МЛУ, причем B. cereus были наиболее устойчивыми (устойчивыми к 9 из 11), за ними следовали Enterobacter cloacae / Klebsiella pneumoniae (устойчивые к 4 из 11 антибиотиков). .Наиболее эффективным антибиотиком против грамотрицательных бактерий ( Enterobacter clocae, и Klebsiella pneumoniae), был гентамицин, тогда как котримоксазол был наиболее эффективным против Bacillus cereus (грамположительный) (рис. 1).
Паттерны устойчивости к антибиотикам идентифицированных изолятов бактерий из комбикормов, не содержащих антибиотиков, представлены в таблице 3
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
PEN = пенициллин, AMP = ампициллин, FLX = флуклоксациллин = цетромицин, ERYOT = эрициллин = Котримоксазол, GEN = гентамицин, CHL = хлорамфеникол, CTR = цефтриаксон, CTX = цефотаксим и CRX = цефуроксим. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Результаты (табл.9%), TET (72,7%), CRX (66,6%), CTX (45,4%), CHL / CTR (36,4%), GEN (27,3%) и COT (18,2%). Klebsiella pneumoniae продемонстрировала нулевую устойчивость к GEN / CHL / CTR / CTX / CRX, в то время как Enterobacter cloacae и Bacillus cereus продемонстрировали нулевую устойчивость к GEN и COT, соответственно (Рисунок 1).
4. Обсуждения
Текущее исследование показало, что все образцы кормов были загрязнены жизнеспособными микробами, но количество бактерий было в пределах допустимых уровней, за исключением количества бактерий группы кишечной палочки, которое было выше допустимого уровня ≤ log 10 4.0 (таблица 1). Однако использованные методы не обнаружили сальмонеллы (таблица 1). Этот вывод согласуется с общим мнением о том, что корма для домашней птицы подвержены микробному заражению по всей производственно-сбытовой цепочке, из окружающей среды, во время транспортировки и хранения на ферме, а также перекрестному заражению от диких птиц, насекомых, грызунов и т. Д. [18, 19] .
Как общее количество жизнеспособных организмов, так и количество дрожжей и плесени являются показателями качества пищевого продукта и больше связаны с определением срока годности продукта [20] Общее количество жизнеспособных организмов> 10 7 КОЕ / г) считается, что ускоряет порчу или порчу продукта [21].Допустимые уровни общего количества жизнеспособных продуктов и количества дрожжей и плесени, наблюдаемые в этом исследовании (Таблица 1), предполагают, что могли соблюдаться надлежащие производственные практики, условия обращения и хранения. Золотистый стафилококк также является индикатором гигиены продукта, поскольку этот организм является частью микрофлоры как кур, так и человека [22]. Проглатывание термостабильных энтеротоксинов, а не самой бактерии, является причиной болезней пищевого происхождения [23]. Приемлемые уровни Staphylococcus aureu s count, наблюдаемые в этом исследовании, также могли быть связаны с низким уровнем перекрестного заражения от людей, обрабатывающих корм, и от окружающей среды на ферме.
Количество колиформных бактерий (Log 10 4,76) было замечено выше допустимого предела ≤ log 10 4,0 (Таблица 1), и это было подтверждено высокой встречаемостью идентифицированных колиформных бактерий nterobacter cloacae (54,5%) и Klebsiella pneumoniae (18,25% среди изолятов (таблица 2). Этот результат свидетельствует о плохом гигиеническом статусе корма в результате возможного фекального заражения. Колиформные организмы естественным образом обитают в кишечнике животных и человека и встречаются только в пищевых продуктах. в результате фекального загрязнения из-за плохой гигиены.Таким образом, тест на колиформные фекалии является хорошим индикатором для оценки гигиены, тогда как общий тест на колиформные бактерии включает такие колиформные бактерии, как Klebsiella spp. и Enterobacter spp. которые также являются микробами окружающей среды [24]. Перекрестное заражение от рук сельскохозяйственных рабочих во время смешивания кормов, от грызунов и рептилий на ферме, от помета живых птиц, от пыли или окружающей среды, возможно, привело к недопустимому количеству колиформных бактерий, зарегистрированному в этом исследовании. Согласно [25] исходная микробная нагрузка кормов, применяемый процесс дезинфекции, климатические условия во время хранения и обработка после дезинфекции играют важную роль в безопасности и качестве конечного продукта.
Идентифицированные изоляты (таблица 2) подтверждают наличие патогена пищевого происхождения. риск, связанный с кормом, поскольку все идентифицированные организмы могут вызывать заболевания человека. Enterobacter cloacae приобретается в больнице и вызывает следующие заболевания: бактериемия, эндокардит, септический артрит, остеомиелит, инфекции кожи / мягких тканей и инфекции нижних дыхательных путей [26], в то время как Klebsiella pneumoniae вызывает инфекции мочевыводящих путей. инфекция, пневмония, внутрибрюшная инфекция, инфекция кровотока, менингит и гнойный абсцесс печени [27]. Bacillus cereus — почвенная бактерия, которая легко заражает некоторые пищевые вещества, такие как яйца, мясо, молочные и растительные продукты, и известна тем, что вызывает 25% пищевых отравлений из-за секреции рвотных токсинов, энтеротоксинов и устойчивости его споры подвергаются термической обработке [28].
Результаты теста на чувствительность к антибиотикам (рисунок 1) показали, что все идентифицированные изоляты были МЛУ, а Bacillus cereus был наиболее устойчивым изолятом (устойчивым к 9 из 11 антибиотиков), за которым следовали Enterobacter cloacae / Klebsiella pneumoniae , которые были устойчивы к 4 из 11 антибиотиков. В аналогичном исследовании Donkor et al. [29] обнаружили 97,7% МЛУ у изолятов E. coli от животных из мегаполиса Аккры. Множественная лекарственная устойчивость возникает у бактерий из-за агрегации генов устойчивости от других бактерий, каждый из которых кодирует свой антибиотик [5, 30].Данные свидетельствуют о том, что среди бактериальных сообществ «дикого типа» устойчивость к любому типу антибиотиков ниже, чем у клинических изолятов или изолятов из источника, который подвергался воздействию антибиотиков. неправильное и чрезмерное использование антибиотиков из-за отсутствия регулирования и надлежащей политики в большинстве развивающихся стран, включая Гану, особенно в сельскохозяйственном секторе, могло быть причиной такого высокого уровня МЛУ, наблюдаемого в этом исследовании (Рисунок 1).
продуцентов бета-лактамаз, таких как B.cereus по своей природе устойчивы к антибиотикам β -лактам [31]; это могло объяснить высокий уровень устойчивости к широкому спектру цефалоспоринов среди изолятов B. cereus в этом исследовании (рис. 1). Кроме того, секреция β -лактамазы отдельными бактериями в полимикробной среде также обеспечивает пассивную резистентность для всех жителей в окружающей среде [32], и это, возможно, объясняет высокий уровень МЛУ среди изолятов.
Чрезмерное или нерегулируемое использование антибиотиков в сельском хозяйстве представляет собой глобальную проблему, которая связана с устойчивостью людей к антибиотикам пищевого происхождения. Например, из всех антибиотиков, продаваемых в США, около 80% применяются в животноводстве, из которых, к сожалению, примерно 70% имеют важное значение для медицины человека [33]. Антибиотики используются специально в животноводстве для лечения заболеваний, а также в качестве стимуляторов роста для ускорения роста. Варианты лечения пациентов с МЛУ-инфекцией часто крайне ограничены, что приводит к возможной неэффективности лечения с повышением заболеваемости и смертности и высокими медицинскими расходами [34].Поэтому вызывает беспокойство высокий уровень МЛУ, наблюдаемый в этом исследовании.
Характер чувствительности к антибиотикам (таблица 3) показал, что обычные антибиотики, используемые при лечении заболеваний человека, обычно теряют свою эффективность в отношении изолятов бактерий, что вызывает серьезное беспокойство. Например, пенициллин / ампициллин / флуклоксациллин (все бета-лактамы), который является наиболее широко используемым классом антибиотиков у людей [31], не был эффективен против любого из изолятов (таблица 3). Несмотря на то, что Enterobacter cloacae и Klebsiella pneumoniae по своей природе устойчивы к некоторым бета-лактамам [16], уровень МЛУ, наблюдаемый в этом исследовании, вызывает беспокойство.
ВОЗ [35] рекомендует не использовать антибиотики, критически важные для человека (аминогликозиды, цефалоспорины поколения и макролиды), и антибиотики, очень важные для человека (цефалоспорины, пенициллины и сульфаномиды), для профилактики болезней животных или в качестве стимуляторов роста. так что эти запрещенные препараты останутся эффективными при лечении бактериальных заболеваний человека. Только тетрациклины разрешены для использования у домашней птицы для профилактики заболеваний и в качестве стимуляторов роста, поскольку они не считаются важными для человека [35].К сожалению, в этом исследовании наблюдалась множественная резистентность большинства изолятов ко многим из этих запрещенных к применению препаратов (таблица 3), что согласуется с [36] в более ранней работе в Гане и [19] в Нигерии. Этот вывод свидетельствует о том, что рекомендации ВОЗ [35] не выполняются. Недискриминационное применение антибиотиков у людей и животных приводит к снижению эффекта таких антибиотиков, когда бактерии передаются человеку от животных. Это может привести к неэффективности лечения с возможными последствиями для здоровья населения.Паттерны устойчивости к антибиотикам, показанные у человеческих изолятов в Аккре MOH / MOFA / MESTI / MFAD [36], очень похожи на паттерны, наблюдаемые в этом исследовании (Таблица 3). Это может быть подтверждением неизбирательного и нерегулируемого использования антибиотиков как для людей, так и для сельскохозяйственных целей.
Радиационная обработка при 5 кГр, однако, полностью уничтожила все микробы в образцах, сделав их микробиологическое качество приемлемым (таблица 1), что указывает на то, что радиация очень эффективна даже при более низких дозах при обеззараживании кормов для домашней птицы в соответствии с [37].Как правило, было обнаружено, что гамма-облучение способно эффективно снизить микробную нагрузку обезвоженных ингредиентов, специй и сушеных травяных продуктов без отрицательных атрибутов, таких как потеря чувствительных к нагреванию активных ингредиентов и обесцвечивание, связанное с традиционными технологиями, такими как использование химических веществ. консерванты, тепло и фумиганты [11].
В заключение, текущее исследование показало, что корма птицефабрики BNARI загрязнены колиформными бактериями, превышающими допустимые пределы, и патогенами пищевого происхождения с множественной лекарственной устойчивостью, что свидетельствует о плохом санитарном состоянии и риске для здоровья населения.Однако низкая доза радиации (5 кГр) оказалась эффективной для обеззараживания кормов для домашней птицы и устранения возможных связанных с этим рисков для безопасности пищевых продуктов.
Мы рекомендуем, основываясь на наших выводах, что корма для домашней птицы следует облучать до 5 кГр после смешивания и что необходимо провести дальнейшие исследования для определения надлежащей упаковки и хранения после облучения. Что касается устойчивости к антибиотикам, мы рекомендуем общенациональный надзор, который должен контролировать использование антибиотиков в ветеринарной практике наряду с обучением фермеров и ветеринаров, чтобы ограничить злоупотребление и чрезмерное использование антибиотиков, что в конечном итоге уменьшит количество устойчивых бактерий и остатков антибиотиков в пищевой цепи.
Доступность данных
В статью включены данные о количестве микробов (КОЕ / г), устойчивости к антибиотикам и дозе облучения (кГр), которые подтверждают выводы этого исследования.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Наиболее распространенные источники загрязнения мяса
Загрязнение пищевых продуктов посторонними частицами — это просто часть производственного процесса. И поэтому эти частицы не должны оставаться в пище или когда-либо доходить до потребителей.
Хотя загрязнение пищевых продуктов патогенами привлекает гораздо больше внимания средств массовой информации, загрязнение посторонними материалами по-прежнему вызывает больше жалоб потребителей.
Например, в 2017 году из-за физических опасностей было отозвано более девяти миллионов фунтов продуктов питания. Это возглавило список по количеству продуктов, отозванных по какой-либо другой причине.
Различные виды пищевых продуктов загрязнены из разных источников; растения и продукты часто сопровождаются камнями, деревом и грязью, в то время как другие вещи, такие как металлические болты, зажимы из нержавеющей стали, резиновые прокладки и части пластиковых компонентов внутри производственного предприятия, также могут попадать в продукты питания.
В последние годы осведомленность о безопасности пищевых продуктов значительно возросла, отчасти из-за увеличения числа инцидентов, связанных с заражением, происходящих во всем мире, а отчасти из-за того, что вокруг них широко освещается информация. Это привело к лучшему пониманию того, как происходит загрязнение посторонними частицами и как его можно предотвратить.
Там, где происходит постороннее загрязнение мясаМясо и птица могут быть заражены посторонними веществами различными способами.От фермы к вилке существует множество разных точек, где может произойти заражение, и определение типа загрязнения может быть полезно для определения его происхождения. Вот некоторые из наиболее распространенных загрязнителей и их причины.
картечь: Животные, такие как крупный рогатый скот и бизоны, которые пасутся на открытой местности, иногда могут попадать в мясо картечью из-за огнестрельного оружия, которое используется поблизости. Иногда также можно найти фрагменты пули, но они также происходят из огнестрельного оружия, которое используется в полях и в естественной среде обитания животных.
Камень: Когда индейки и курицы клюют свой корм на землю, они глотают камни и гальку, чтобы помочь пищеварению. Они могут попасть в их организм и остаться в мясе во время обработки.
Иглы, лезвия и ножи: Иглы чаще всего попадают через ароматизатор, рассол или маринад во время обработки. Лезвия и ножи, используемые на многих различных этапах процесса, от первоначального убоя до разделки и порционирования мяса, могут сломаться или попасть в продукт.
Детали машин, болты и проволока из нержавеющей стали : При таком большом количестве машин, задействованных в переработке мяса, есть много возможностей для металлических деталей загрязнять пищу. Когда металлические части трутся друг о друга, существует риск того, что металлические части упадут в мясо, а такие предметы, как ослабленные болты, могут упасть в продукт. Во время обработки есть много этапов, на которых металл может попасть в пищу, а проволока может быть введена при просеивании или резке.
Кость: Кость принадлежит к мясу и птице, поэтому неудивительно, что ее иногда можно найти в конечном продукте.Хотя FDA считает, что кости меньше 7 мм не представляют опасности, кальцинированные кости размером от 2 до 3 мм могут представлять серьезную опасность для некоторых возрастных групп или даже приводить к претензиям к стоматологам в определенных ситуациях.
Резина, пластик и дерево: Эти материалы могут применяться в мясных и птицеводческих продуктах разными способами. От резиновых прокладок и резиновых перчаток до тяжелых пластиковых инструментов, упаковки и даже ручек инструментов, деталей машин и оборудования, используемого рабочими, все потенциально может загрязнять пищу.
Каждый раз, когда человек или машина прикасаются к продуктам питания, риск заражения увеличивается, поэтому способность обнаруживать и идентифицировать контаминанты имеет решающее значение для повышения безопасности пищевых продуктов.
Выбор решения для идентификации загрязненияПоскольку существует множество различных типов физического загрязнения, типы растворов, используемых для обнаружения этих посторонних материалов, также могут различаться.
Металлоискатели и встроенные магниты могут быть полезны при обнаружении кусочков лезвий, проводов и болтов, но они не помогут, когда дело доходит до обнаружения других распространенных опасностей.Это экономичное решение для поиска нежелательных металлических предметов, но их возможности для поиска ограничены. Магниты и металлодетекторы не обнаруживают загрязняющие вещества внутри производственного помещения, такие как резина, твердый пластик, камень, дерево, стекло и нержавеющая сталь.
Встроенный рентгеновский контроль становится все более популярным, поскольку он позволяет более тщательно проверять продукт и обнаруживает как металлические, так и неметаллические вещества. Обнаруживая изменения плотности мяса, рентгеновский контроль представляет собой сложный и точный инструмент для определения наличия посторонних материалов.
Создание вашей линии защиты от зараженияПрофилактика — лучший способ избежать загрязнения пищевых продуктов посторонними материалами. Производители пищевых продуктов должны проявлять должную осмотрительность, чтобы убедиться, что у поставщиков есть надлежащие средства контроля для мониторинга процессов от начала до конца; это сократит количество посторонних материалов, сопровождающих мясо на предприятии по переработке пищевых продуктов.
Даже при самых тщательных системных проверках и стратегиях обнаружения иногда загрязнители все равно попадают в продукты питания.Вот почему производителям пищевых продуктов крайне важно иметь систему, предотвращающую заражение на каждом возможном этапе.
От проверки поставщиков и поддержания контроля качества до проведения визуальных проверок и наличия надлежащего встроенного оборудования для обнаружения посторонних материалов, современный производитель пищевых продуктов не может позволить себе принимать безопасность пищевых продуктов как должное.
И, когда обнаруживаются физические загрязнители, важно иметь стороннего рентгеновского инспектора, способного идентифицировать загрязнитель.Сторонние службы рентгеновского контроля FlexXray могут обеспечить эффективную и тщательную проверку вашего продукта в скобках. Возможность идентифицировать посторонние предметы и удалять их перед раздачей продуктов питания поддерживает безопасность и репутацию бренда. Он также обеспечивает элемент прослеживаемости и возможность определить, в какой момент процесса загрязняющие вещества попали в пищевые продукты.
Правильные политики и процедуры могут помочь защитить от загрязнения на протяжении всего жизненного цикла продукта.Проактивная позиция защищает не только здоровье и благополучие ваших клиентов, но и будущее репутации и финансового благополучия вашей компании.
В прошлом обнаружение инородного материала часто означало, что весь производственный цикл продукта в скобках будет списан. Сегодня расширенный рентгеновский контроль FlexXray позволяет обнаруживать конкретные инородные материалы. У нас есть возможность должным образом утилизировать любое зараженное мясо, позволяя при этом продолжать производство оставшейся части производственной цепочки.
Для производителя пищевых продуктов это означает минимально возможную потерю продукта без прерывания цикла распределения. И, что не менее важно, это означает уверенность в том, что вы предоставляете безопасный и безопасный продукт.
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2021.329
Влияние продолжительности хранения и температуры на суточные изменения внешнего и внутреннего качества яиц кур-несушек Dekalb White®
Ю.Мартнез * 1 , г. Н. Диас Солис 1 , г. М.А. Бехарано 1 , г. П. Пас 2 и М. Валдиви 3Опубликовано: 22.03.2021
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2021.328
Сравнение фитохимического пентадецилфенола и антикокцидиальной вакцины по эффективности, окислению, воспалению и активности поверхностных антигенов у бройлеров
ЧАС.Ши 1 , 2 , а , Л. Хан 1 , а , Ю. Луо 1 , г. Ю. Ли 3 и Н. Лю * 1Опубликовано: 15.03.2021
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2021.327
Влияние диетических эфирных масел в сочетании с бутиратом на показатели роста, кишечную микрофлору, параметры крови и мясной состав цыплят-бройлеров
А.Цора 1 , г. Э. Бонос * 2 , г. И. Янненас 3 , г. А. Карамуциос 1 , г. К. Фотоу 1 , г. Э. Сидиропулу 3 , г. О. Цифцоглоу 4 , г. Д. Лазари 4 , г. И. Стилианаки 5 , г. А. Григориаду 6 и И. Скуфос 2Опубликовано: 26.02.2021
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт.DOI: 10.1399 / eps.2021.326
Влияние породы и возраста убоя на продуктивность, качество мяса и технологические характеристики бройлеров, выращиваемых в тропических климатических условиях
I.H. Бадар 1 , 4 , M.H. Джаспал * 1 , г. М.К. Яр 1 , г. М. Ияз 2 , г. А. Халике 3 , г. Л. Чжан 4 , г. А. Манзур 1 , г. С. Али 1 , г. А.Рахман 2 и Ф. Хуснайн 5Опубликовано: 25.02.2021
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2021.325
Сигнальный путь PI3K / Akt / mTOR регулирует метаболизм липидов, опосредованный стрессом эндоплазматического ретикулума в первичных гепатоцитах гуся.
З.Я. Луо, В. Песня, X.P. Сюн, М.Абдулай, Его Святейшество Лю, Л. Ли, H.Y. Сюй, S.Q. Ху и C.C. Хан *Опубликовано: 10.02.2021
Europ.Poult.Sci., 85. 2021 г., ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2021.324
Влияние пищевых добавок аскорбиновой кислоты на продуктивность, поведение и экспрессию генов у цыплят-бройлеров, подвергшихся тепловому стрессу
М.И. Або-Самаха * 1 , г. С.Э. Эль-казаз 2 и П.Г. Редди 3Опубликовано: 29.01.2021
Europ.Poult.Sci., 84. 2020, ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2020.323
Можно ли использовать порошок сушеных помидоров и красного перца в качестве пищевой добавки для укрепления систем защиты и повышения продуктивности кур-несушек?
Д. Актаран Бала * 1 , г. Э.Matur 2 , г. Э. Ергуль Экиз 2 , г. И. Акьязи 2 , г. Э. Эрген 2 , г. М. Эрек 5 , г. Г. Атмака 3 , г. Х. Эсечели 4 и М. Кетен 5Опубликовано: 17.12.2020
Europ.Poult.Sci., 84. 2020, ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2020.322
Оценка генетического разнообразия некоторых редких пород гусей по микросателлитным маркерам
ЧАС.Абдель Монием 1 , 2 , А. Фэти 2 и Г. Чен * 1Опубликовано: 07.12.2020
Europ.Poult.Sci., 84. 2020, ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2020.321
Показатели роста, гематологические и биохимические параметры у бройлеров, получавших рационы с различными уровнями листовой муки Vernonia amygdalina
М.Б. Токофай * 1 , г. К. Идох 2 , г. E.O. Оке 1 , 3 и А. Агбонон 2Опубликовано: 24.11.2020
Europ.Poult.Sci., 84. 2020, ISSN 1612-9199, © Verlag Eugen Ulmer, Штутгарт. DOI: 10.1399 / eps.2020.320
Влияние кормления бетаина гидрохлоридом in ovo и генотипа на массу органов, энергетический статус и потерю веса у цыплят-бройлеров
Д.А. Танимово * и О.Г. ЛонжОпубликовано: 02.11.2020
Безопасное приготовление мяса и птицы
Автор: Майкл А. Дэвис
Мясо и продукты из птицы известны своим высоким содержанием белка и питательными свойствами. Также известно, что они ежегодно вызывают множество случаев заболеваний пищевого происхождения.
Переработчики мяса и птицы работают в соответствии со строгими инструкциями Министерства сельского хозяйства США по производству безопасных и полезных продуктов.Тем не менее, приготовление и обслуживающий персонал также несут часть бремени по обеспечению безопасного приготовления и подачи этих продуктов.
Рабочая зона
При приготовлении продуктов любого типа, особенно мяса и птицы, которые должны быть приготовлены, следуйте этим процедурам:
- Следите за тем, чтобы рабочее место было как можно более чистым.
- Часто мойте руки при приготовлении пищи, особенно при смене группы продуктов, например, с мяса на сырые овощи или наоборот.
- Предотвратить перекрестное заражение.Меняйте разделочные доски, ножи и другую посуду или тщательно мойте их между использованием.
- Предотвратить повторное загрязнение приготовленной пищи. Храните сырые и приготовленные продукты отдельно, пока они не будут готовы к подаче на тарелку.
В процессе приготовления уничтожаются бактерии, присутствующие в сыром мясе. Однако патогенные (болезнетворные) бактерии из нечистой посуды или контейнера будут очень хорошо расти на любом приготовленном мясе, которого они коснутся.
Немного основ микробиологии
Чтобы понять опасность, которую могут представлять продукты из мяса и птицы, нам необходимо понять некоторые основы микробиологии.Все продукты животного происхождения содержат бактерии из двух основных источников:
- Встречающиеся в природе бактерии обычно находятся на птице или животном и в их среде обитания, например, в сосновой стружке, подстилке и пыли.
- Интродуцированные бактерии происходят из источников, отличных от птиц или животных и окружающей их среды. Эти занесенные бактерии часто поступают от людей, оборудования, воды и других материалов, когда животное обрабатывается после того, как оно покидает ферму.Не все болезнетворные бактерии занесены микробами. Некоторые встречающиеся в природе микроорганизмы считаются патогенными для человека.
Типичные операции по переработке птицы сокращают количество встречающихся в природе бактерий примерно на 95 процентов за счет таких процедур, как ошпаривание, охлаждение и антимикробные обработки. На перерабатывающих предприятиях также соблюдаются строгие правила очистки и санитарии.
Однако даже самые лучшие из этих процессов не могут уничтожить все бактерии из туши или окружающей среды.Не исключено, что после обработки мясо и птица все еще могут содержать некоторые болезнетворные бактерии.
Бактерии порчи — неприятно, но не вредно
Бактерии, классифицируемые как организмы, вызывающие порчу, не вызывают заболеваний у человека. Эти бактерии часто принадлежат к классу микробов, называемых психротрофами, которые могут расти при низких температурах. Из-за этой способности многие организмы, вызывающие порчу, могут расти, даже если пища хранится в холодильнике.
Бактерии порчи вызывают «неприятный запах» и «неприятный привкус», связанный со старой или испорченной пищей.Обычно очень легко определить, начинает ли еда портиться. Если птица издает сладковатый запах от слегка сладкого до сильного, это признак того, что количество бактерий, вызывающих порчу, увеличивается. Этот запах означает, что продукт обычно считается «испорченным» в течение 24–36 часов.
Эти запахи вызваны микроорганизмами, расщепляющими углеводы, жиры и белки в продукте. Если вы обнаружите эти запахи, выбросьте продукт.
Еще одним признаком того, что пища начинает портиться, является очень слизистая консистенция сырого продукта.Это слой бактерий, указывающий на то, что еда вот-вот испортится. Хотя продукты из птицы могут казаться скользкими, на них не должно быть видимого бактериального слоя слизи.
Болезни пищевого происхождения
По сравнению с количеством бактерий порчи, обнаруживаемых на мясе и птице, часто существует лишь несколько вредных или патогенных бактерий. Однако для того, чтобы вызвать заболевание, требуется лишь минимальное количество этих организмов.
Бактериями, обычно связанными с болезнями пищевого происхождения у домашней птицы, являются Salmonella spp., Clostridium perfringens, Staphylococcus aureus и Campylobacter jejuni. Все эти организмы считаются мезофильными, что означает, что они растут при «средних температурах». Эти микробы легко растут и размножаются при температуре тела животных, домашней птицы и человека или около них.
Salmonella spp. и Campylobacter jejuni вызывают болезни у людей, фактически размножаясь и размножаясь в организме. Золотистый стафилококк и Clostridium perfringens выделяют токсин в пище. Этот токсин попадает в организм, и он, а не сами бактерии, является возбудителем болезни.
Если эти токсины присутствуют в пище, нагревание их не уничтожает. Эти организмы часто трудно обнаружить в сырых продуктах, потому что их меньше, чем бактерий порчи, и потому что они не производят такого же «неприятного запаха», как бактерии порчи.
Продукты с наибольшим риском роста бактерий — это продукты с высоким содержанием белка, такие как мясо и птица. Поскольку бактерии являются живыми организмами, необходимо выполнить несколько требований, чтобы они могли расти и воспроизводиться:
- Доступные питательные вещества
- Достаточная влажность
- Температура правильного роста
- Достаточное время
Если одно из этих требований отсутствует или нарушено, рост бактерий на пищевом продукте будет остановлен.
Как потребитель, вы можете контролировать температуру и время. При приготовлении птицы нагрейте ее до температуры глубоких мышц 165 градусов по Фаренгейту. Если эту птицу нужно подавать позже, охладите продукт до 40 градусов по Фаренгейту или ниже как можно быстрее после приготовления.
Температура подачи после приготовления должна быть 140 градусов по Фаренгейту или выше. Время, в течение которого продукты хранятся при температуре от 40 до 140 градусов по Фаренгейту, должно быть сведено к минимуму.
Следование этим рекомендациям поможет вам безопасно приготовить продукты из мяса и птицы.
Загрузите версию этого документа для печати: Безопасное приготовление мяса и птицы
Дополнительная информация о земледелии и скотоводстве »
У вас есть вопрос или вам нужно связаться со специалистом?
Свяжитесь с офисом вашего округа
переработка птицы | Оборудование, ступени и факты
Переработка птицы , подготовка мяса различных видов птицы для потребления человеком.
Птица — основной источник потребляемого животного белка. Например, потребление мяса птицы на душу населения в Соединенных Штатах увеличилось более чем в четыре раза после окончания Второй мировой войны, поскольку в отрасли была создана высокоэффективная производственная система. Куры и индейки — наиболее распространенные источники домашней птицы; однако другое коммерчески доступное мясо птицы получают из уток, гусей, голубей, перепелов, фазанов, страусов и эму.
Характеристика птицы
Птица получена из скелетных мышц различных птиц и является хорошим источником белка, жира, витаминов и минералов в рационе.
Классификация птиц
Птицы, разводимые для птицеводства, обычно выращиваются в течение определенного периода времени или до тех пор, пока они не достигнут определенного веса. Корнишские куры, в узком определении, представляют собой гибрид, специально выведенный для производства маленьких ростеров; Однако на рынке этот термин используется для обозначения маленькой птицы возрастом от пяти до шести недель, которую часто подают целиком и фаршированной. Семинедельные цыплята классифицируются как бройлеры или фритюрницы, а цыплята в возрасте 14 недель — как ростеры.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасЖирность
Содержание жира в птице несколько отличается от содержания жира в красном мясе. Птица имеет более высокую долю ненасыщенных жирных кислот по сравнению с насыщенными жирными кислотами. И индейка, и курица содержат около 30 процентов насыщенных, 43 процента мононенасыщенных и 22 процента полиненасыщенных жирных кислот. Высокий уровень ненасыщенных жирных кислот делает домашнюю птицу более восприимчивой к прогорклости из-за окисления двойных связей в ненасыщенных жирных кислотах.С другой стороны, насыщенные жирные кислоты не содержат двойных связей в своих углеводородных цепях и устойчивы к окислению. Однако такое соотношение жирных кислот привело к предположению, что птица может быть более здоровой альтернативой красному мясу.
У птиц жир в основном откладывается под кожей или в брюшной полости. Таким образом, можно удалить с птицы значительное количество жира, удалив кожу перед едой.
Микробное загрязнение
Птица обеспечивает отличную среду для роста микроорганизмов.Основные бактерии, вызывающие порчу домашней птицы, включают Pseudomonas, Staphylococcus, Micrococcus, Acinetobacter и Moraxella . Кроме того, домашняя птица часто поддерживает рост некоторых патогенных (болезнетворных) бактерий, таких как Salmonella .
Возможные причины заражения птицы во время процедур убоя и обработки включают контакт тушки с частями тела, содержащими высокую микробную нагрузку (например, перьями, лапами, содержимым кишечника), использование зараженного оборудования и физические манипуляции с мясом ( е.г., обвалка, измельчение). Предотвращение микробного заражения включает в себя тщательное регулирование и мониторинг предприятий по убою и переработке, правильное обращение и хранение, а также адекватное приготовление сырых и переработанных продуктов из птицы.
Подготовка к убою животных
Когда птицы достигают времени «урожая», их обычно прекращают кормить и поить. Это позволяет их пищеварительному тракту опорожняться и снижает вероятность загрязнения во время обработки.
Ночью птиц отлавливают специально обученные бригады и помещают в пластиковые или деревянные транспортные клетки.Затем птицу транспортируют на бойню, где грузовики часто помещаются между наборами вентиляторов для вентиляции клеток.
На следующем этапе птиц вынимают из клеток и переносят на постоянно движущиеся кандалы, где они подвешиваются за обе ноги. Перенос часто производится в темном помещении, освещенном красным светом; птицы не чувствительны к красному свету, и это помогает им сохранять спокойствие.
Обработка и перемещение птиц как на ферме, так и на бойне может вызывать стресс.Стресс может отрицательно сказаться на качестве конечного мясного продукта, поэтому постоянно прилагаются усилия для улучшения предубойных процессов.
Убой
После того, как птиц поместили на движущиеся кандалы, их обычно оглушают, пропуская голову через водяную баню, которая проводит электрический ток. Оглушение вызывает потерю сознания, но не убивает птиц. Птиц убивают вручную или с помощью механического вращающегося ножа, который перерезает яремные вены и сонные артерии на шее.Любые птицы, не убитые машиной, будут быстро убиты человеком с ножом, закрепленным за местом обескровливания. Птицам разрешается обескровливаться в течение фиксированного периода времени, в зависимости от размера и вида (например, 1 1 / 2 минут для бройлеров). Любая птица, у которой не было должным образом обескровнено, станет заметно краснее после удаления пера и будет осуждена.
Ошпаривание
После кровотечения птицы проходят через резервуары для ошпаривания. В этих резервуарах есть горячая вода, которая смягчает кожу, чтобы можно было удалить перья.Температура воды тщательно контролируется. Если желательно сохранить желтый цвет кожуры, используют средство для мягкого ошпаривания (около 50 ° C или 122 ° F). Если требуется белая птица, используется более высокая температура ожога, что приводит к удалению желтой пленки. Индюки и отработанные куры (птица-несушка, завершившая цикл яйцекладки) обычно содержатся при более высоких температурах — от 59 до 60 ° C (138 до 140 ° F).
Понимание порчи птицы
Приблизительно 9 миллиардов цыплят перерабатываются в США.S. каждый год, из которых 80% продается как свежий продукт. По оценкам, от 2% до 4% этого мяса теряется в результате порчи птицы. Поэтому порча является серьезной проблемой для птицеводства.
Основными причинами порчи продуктов из мяса птицы являются:
- Длительное распределение или хранение
- Несоответствующая температура хранения
- Высокое исходное количество бактерий
- Мясо с высоким уровнем pH после окоченения
Работа с факторами порчи
Компании могут предотвратить длительные сроки хранения, правильно меняя свои запасы.Продукт, который будет продаваться в местах, удаленных от перерабатывающего предприятия, следует транспортировать при температуре ниже нуля (т. Е. 26 F), но недостаточной для замораживания мышечной ткани (глубокий холод).
Несоответствующая температура хранения или колебания температуры хранения являются наиболее предотвратимыми причинами порчи. Злоупотребление температурой может происходить во время распределения, хранения, розничной демонстрации или обращения с продуктом потребителем. Переработчики могут определить, подвергся ли продукт температурному злоупотреблению, путем мониторинга температуры или оценки бактериальных популяций по всей системе распределения.
Первоначальный подсчет бактерий на тушах бройлеров также может иметь прямое влияние на срок годности свежего продукта. Первоначальное количество бактерий на домашней птице, как правило, зависит от процедур выращивания, методов производства, а также санитарных условий растений и производств. Повышенное количество бактерий порчи на курице сразу после обработки приводит к более быстрой порче.
Высокий уровень pH мяса после окоченения часто вызван стрессом, который испытывает птица во время выращивания или транспортировки.Это сокращает срок хранения мяса до шести дней и объясняется тем фактом, что бактерии порчи гораздо быстрее размножаются на мясе с pH 6,2, чем на мясе с нормальным pH 5,4 после окоченения. -5,6.
Бактерии, вызывающие порчу
Исследования показывают, что большое количество бактерий на туше сразу после обработки — это не те бактерии, которые растут при охлаждении и портят тушки. Напротив, бактерии, обнаруженные после порчи туш, очень трудно обнаружить на тушах во время обработки.Сразу после обработки бактерии порчи присутствуют в очень небольшом количестве, но они могут быстро размножаться, вызывая запахи порчи и слизь.
Эти бактерии, вызывающие порчу, называются психротрофными бактериями (психро = холод; трофические = способные к росту), потому что они способны размножаться в холодных условиях. Свежие продукты из птицы, хранящиеся достаточно долго при температуре холодильника, испортятся из-за роста психротрофных бактерий.
Напротив, бактерии, которые существуют в больших количествах во время обработки на коже цыплят и в их кишечных трактах, в основном являются мезофилами (мезофилы = средний; phile = любовь).Эти бактерии не размножаются в заметной степени при температуре холодильника. Salmonella, E. coli и другие бактерии, обнаруженные на цыплятах, являются мезофилами. Когда компания проводит «Аэробный подсчет на тарелке» или «Общий подсчет на тарелке» на куриной тушке, она измеряет мезофилы.
Рисунок «Рост мезофильных и психротропных бактерий при хранении в холодильнике при 4 ° C на свежей домашней птице» показывает, как эти популяции бактерий ведут себя на тушах во время охлаждения.
Происхождение бактерий порчи
Бактерии порчи на туше сразу после обработки исходят из перьев и лап живой птицы, водоснабжения перерабатывающего предприятия, охлаждающих резервуаров и технологического оборудования.Эти бактерии порчи обычно не обнаруживаются в кишечнике живой птицы. На перьях птиц были обнаружены высокие популяции Acinetobacter (108 КОЕ / г), которые могут происходить из глубокой подстилки. Другие бактерии, вызывающие порчу, такие как Cytophaga и Flavobacterium, часто встречаются в охлаждающих резервуарах, но редко встречаются на тушах.
Психротрофные бактерии, вызывающие порчу куриных туш сразу после убоя, обычно представляют собой Acinetobacter и пигментированные псевдомонады. Хотя штаммы Pseudomonas без пигментации вызывают неприятный запах и привкус у испорченной птицы, первоначально их трудно найти на тушах и P.putrefaciens ( Shewanella putrefaciens ) встречается редко.
Виды порчи
Russell et al. (1995) провели исследование для определения видов бактерий, ответственных за порчу домашней птицы из различных мест по всей территории США. Выделенные виды представлены на рисунках. Роды бактерий, наиболее изолированные в большом количестве на испорченной домашней птице, — это Pseudomonas fluorescens , putida , fragi или Shewanella (ранее Pseudomonas) putrefaciens .Идентификация рода и видов, наиболее ответственных за порчу домашней птицы, важна, потому что после идентификации легче понять механизмы, с помощью которых они вызывают порчу птицы.
Требуется большое количество (105 КОЕ / см2) психротрофных бактерий, вызывающих порчу, на поверхности птицы, прежде чем неприятный запах, неприятный запах и дефекты внешнего вида можно будет определить органолептически. Исследователи сообщили, что для образования слизи требовалось большее количество бактерий (от 3,2х107 до 1х109 КОЕ / см2), чем для того, чтобы запах стал заметным.
Причины порчи
Порча вызывается накоплением побочных продуктов метаболизма или действием внеклеточных ферментов, продуцируемых психротрофными бактериями порчи, когда они размножаются на поверхности птицы при температурах охлаждения. Некоторые из этих побочных продуктов можно обнаружить как неприятный запах и слизь, поскольку бактерии используют питательные вещества на поверхности мяса.
Неприятный запах возникает не в результате расщепления белка в коже и мышцах, как считалось ранее, а в результате прямого микробиологического использования низкомолекулярных азотистых соединений, таких как аминокислоты, которые присутствуют в коже и мышцах.
Концентрации свободных аминокислот увеличиваются по мере протеолиза в течение всего периода хранения. Было продемонстрировано, что измерение этих свободных аминокислот из-за продукции аминопептидаз и последующего расщепления белка можно использовать для быстрого определения бактериологического качества говядины.
Появление неприятного запаха и слизи
Микроорганизмы сначала появляются во влажных карманах на туше, таких как складки между передней ногой и грудкой туши, и их распространению способствует конденсация, которая возникает, когда холодная тушка подвергается воздействию тепла. , влажный воздух.
У разделанных цыплят может появиться запах сложного эфира, который был описан как запах «грязной посуды». В большинстве случаев неприятный запах предшествует образованию слизи и считается начальным признаком порчи. Сразу после обнаружения неприятного запаха на срезах и коже тушки может появиться множество небольших полупрозрачных влажных колоний. В конце концов, поверхность мяса покрывается крошечными каплевидными колониями (см. Фото), которые увеличиваются в размере и сливаются, образуя слизистую оболочку.
На заключительных стадиях порчи мясо может начать проявлять резкий аммиачный запах в дополнение к запаху грязной посуды, что может быть связано с расщеплением белка и образованием аммиака или аммиачных соединений.Различные авторы сообщают, что разложение мяса псевдомонадами приводит к образованию слизи.
Воздействие холодного хранения
При охлаждении (<5 C) популяции психротрофных бактерий могут размножаться на тушках бройлеров и вызывать дефекты порчи; однако мезофильные бактерии, преобладающие в туше, первоначально остаются такими же или их количество уменьшается. Это явление можно объяснить, изучив метаболические изменения, происходящие в этих группах бактерий, когда они подвергаются воздействию температур холодильника.
Клеточные липиды. Обычно мезофильные бактерии перестают размножаться ниже определенной температуры окружающей среды, потому что с понижением температуры также уменьшается их клеточное поглощение питательных веществ. Виды психротрофных бактерий обычно не проявляют такой разницы, вызванной температурой. Вот почему бактерии-психротрофы, вызывающие порчу, способны быстро расти при температурах холодильника.
Производство липазы. Исследования показали, что количество липазы, продуцируемой психротрофными бактериями, увеличивается в результате воздействия на них низких температур.Это означает, что Pseudomonas одинаково хорошо расщепляет жир при хранении курицы в холодильнике или при комнатной температуре. Эта способность делает его подходящим для испорченной курицы.
Протеолитическая активность. Исследования показали, что продукция протеолитических ферментов Pseudomonas fluorescens была выше, когда эта бактерия культивировалась при более низких температурах. Это означает, что, как и жир, псевдомонады способны более эффективно расщеплять белок при температуре охлаждения, чем при комнатной температуре.Опять же, это делает бактерии идеально подходящими для порчи курицы.
Срок годности: подсчет нужных бактерий
Время от времени происходит преждевременная порча. Чтобы компании могли оценить эту проблему, они часто проводят аэробный подсчет продуктов. Этот микробиологический метод не подходит для этой цели, поскольку измерение количества мезофильных бактерий на курице (подсчет APC) не показывает, что происходит с бактериями, вызывающими порчу. При подсчете APC может отсутствовать до 99,9% (3 журнала) бактерий порчи на поверхности продукта.
Для измерения бактерий, вызывающих порчу, образцы следует поместить в чашки и инкубировать при 7 ° C в течение 10 дней. Таким образом, бактерии, которые растут и образуют колонии на чашке, будут ответственны за порчу продукта.
Психротрофы против мезофилов
Психротрофные бактерии (психро = холод; трофические = способность расти) способны расти в холодных условиях и несут ответственность за порчу.
Мезофильные бактерии (meso = средний; phile = любовь) не размножаются в заметной степени при температурах холодильника и не являются фактором порчи.
Список литературы
- Алфорд, Дж. А. и Л. Е. Эллиотт, 1960. Липолитическая активность микроорганизмов при низких и промежуточных температурах. I. Действие Pseudomonas fluorescens на сало. Food Res. 25: 296-303.
- Эйрес, Дж. К., У. С. Огилви и Г. Ф. Стюарт, 1950. Посмертные изменения в хранящемся мясе. I. Микроорганизмы, связанные с образованием слизи на потрошеной разделанной домашней птице. Food Technol. 4: 199-205.
- Ayres, J. C., 1960. Температурные зависимости и некоторые другие характеристики микробной флоры, развивающейся на охлажденной говядине.Food Res. 25 (6): 1-18.
- Барнс, Э. М., 1960. Бактериологические проблемы при приготовлении и хранении бройлеров. R. Soc. Здоровье J. 80: 145-148.
- Барнс, Э. М. и К. С. Импи, 1968. Психрофильные бактерии, вызывающие порчу домашней птицы. J. Appl. Бактериол. 31: 97-107.
- Барнс, Э. М. и М. Дж. Торнли, 1966. Флора порчи потрошенных цыплят, хранящихся при различных температурах. J. Food Technol. 1: 113-119.
- Brown, A. D., 1957. Некоторые общие свойства психрофильной псевдомонады: влияние температуры на некоторые из этих свойств и использование глюкозы этим организмом и синегнойной палочкой.J. Gen. Microbiol. 17: 640-648.
- Dainty, R. H., and B. M. Mackey, 1992. Взаимосвязь между фенотипическими свойствами бактерий из мяса, хранящегося в холоде, и процессами порчи. В: Экосистемы: Микробы: Еда, ред. Борд, Р. Г., Д. Джонс, Р. Г. Кролл и Г. Л. Петтифер, Серия симпозиумов С. А. Б. Номер 21, Blackwell Scientific Publications, Оксфорд, Великобритания, стр. 103S — 114S.
- Де Кастро, Б. П., М. А. Асенсио, Б. Санз и Дж. А., Ордонез, 1988. Метод оценки содержания бактерий в охлажденном мясе.Прил. Environ. Microbiol. 54: 1462-1465.
- Эклунд, М. В., 1962. Биосинтетические реакции организмов мяса птицы в условиях стресса. Кандидат наук. Диссертация, Purdue Univ., 128 с.
- Эллиотт Р. П. и Х. Д. Миченер, 1961. Микробиологические стандарты и правила обращения с охлажденными и замороженными продуктами. Обзор. Прил. Microbiol. 9: 452-468.
- Gill, C.O., and K.G. Newton, 1978. Экология бактериальной порчи свежего мяса при низких температурах. Meat Sci. 2: 207-217.
- Ингрэхэм, Дж.L. и G. F. Bailey, 1959. Сравнительное изучение влияния температуры на метаболизм психрофильных и мезофильных бактерий. J. Bacteriol. 77: 609-613.
- Kraft, A. A. and J. C. Ayres, 1952. Посмертные изменения в хранящемся мясе. IV. Влияние упаковочных материалов на лежкость мяса самообслуживания. Food Technol. 6: 8-12.
- Lampropoulou, K., E. H. Drosinos, G-J. E. Nychas, 1996. Влияние добавок глюкозы на микрофлору порчи и химический состав фарша, хранящегося в аэробных условиях или в модифицированной атмосфере при 4 ° C.Int. J. Food Microbiol. 30: 281-291.
- Локхед А.Г. и Ландеркин Г.Б., 1935. Бактериальные исследования разделанной домашней птицы. I. Предварительные исследования действия бактерий при низких температурах. Sci. Agr. 15: 765-770.
- Nashif, S. A. и F. E. Nelson, 1953. Липаза Pseudomonas fragi. II. Факторы, влияющие на выработку липазы. J. Dairy Sci. 36: 471-480.
- Нычас, Г-Ж. Э., В. М. Диллон, Р. Г. Борд, 1988. Глюкоза, ключевой субстрат в микробиологических изменениях, происходящих в мясе и некоторых мясных продуктах.Biotechnol. Прил. Biochem. 10: 203-231.
- Петерсон, А.С. и М.Ф. Гандерсон, 1960. Некоторые характеристики протеолитических ферментов из Pseudomonas fluorescens. Прил. Microbiol. 8: 98-104.
- Pooni, G. S. и G. C. Mead, 1984. Перспективное использование интеграции температурной функции для прогнозирования срока хранения незамороженных продуктов из мяса птицы. Food Microbiol. 1: 67-78.
- Рассел С. М., Д. Л. Флетчер и Н. А. Кокс, 1992. Модель для определения дифференциального роста при 18 и 42 ° C бактерий, удаленных из тушек цыплят-бройлеров.
