Где находятся чувствительные нейроны: В. А. Михайлов, Сестринская помощь в неврологии – читать онлайн полностью – ЛитРес, страница 2
Спинной мозг — урок. Биология, Человек (8 класс).
Обрати внимание!
Центральная нервная система (ЦНС) состоит из спинного и головного мозга.
Спинной мозг человека находится в позвоночном канале. Он представляет собой цилиндрический тяж длиной \(43\)–\(45\) см и массой около \(30\) г. Спинной мозг омывается спинномозговой жидкостью, которая защищает его от толчков.
Наверху спинной мозг соединён с продолговатым мозгом (отделом головного мозга). Внизу он продолжается до поясничного отдела позвоночника. Спинной мозг разделён на две симметричные половины передней и задней продольными бороздами.
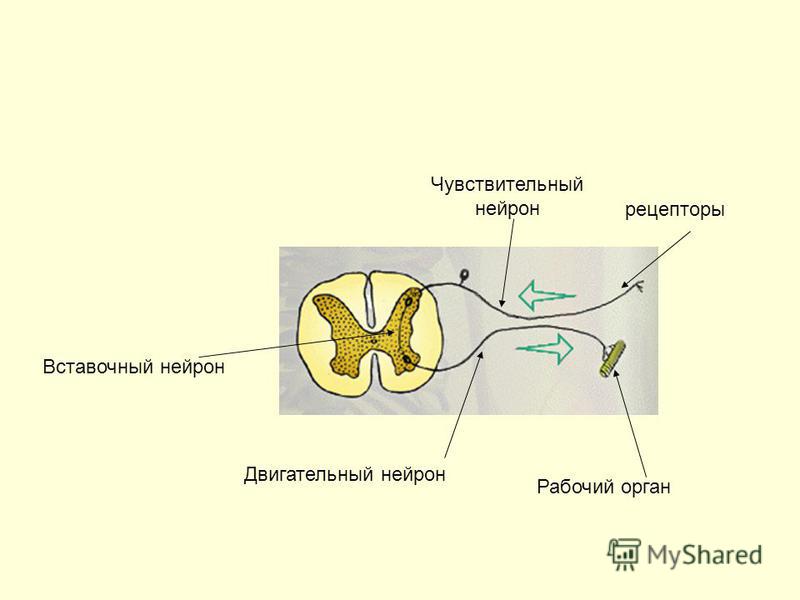
В центре спинного мозга проходит спинномозговой канал, заполненный спинномозговой жидкостью. Вокруг него сосредоточено серое вещество, образованное телами нейронов, на поперечном срезе имеющее форму бабочки. В сером веществе различают рога: передние, задние и боковые.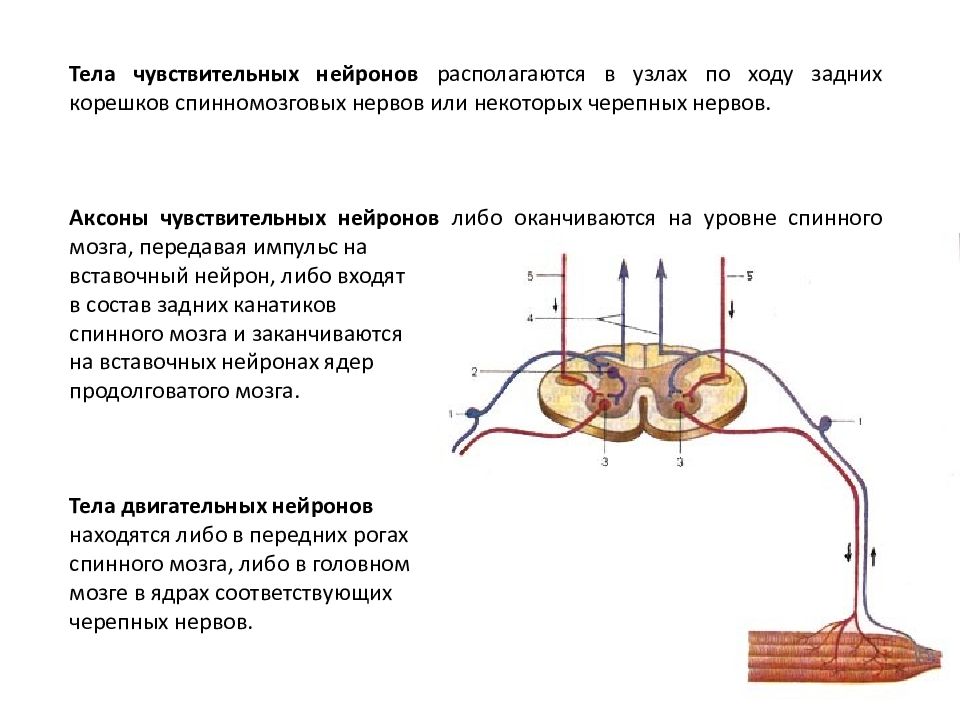
- Передние рога образованы телами двигательных нейронов (мотонейронов). Аксоны этих нейронов проводят возбуждение к скелетным мышцам туловища и конечностей.
- В задних рогах в основном находятся тела вставочных нейронов, которые передают нервные импульсы с отростков чувствительных нейронов на тела двигательных нейронов. Вставочные нейроны передают также информацию в другие отделы спинного мозга и в головной мозг.
- В боковых рогах залегают нейроны, образующие центры симпатической части вегетативной нервной системы.
Наружный слой спинного мозга образован белым веществом, состоящим из отростков нейронов, образующих проводящие пути.
Спинной мозг подразделяется на участки — сегменты. От каждого сегмента отходят спинномозговые нервы. Всего от спинного мозга отходит \(31\) пара смешанных спинномозговых нервов, каждый из которых начинается двумя корешками: передним (двигательным) и задним (чувствительным). В составе передних корешков находятся также вегетативные нервные волокна. На задних корешках расположены нервные узлы — скопления тел чувствительных нейронов. Соединяясь, корешки образуют смешанные нервы. Каждая пара спинномозговых нервов иннервирует определённый участок тела.
В составе передних корешков находятся также вегетативные нервные волокна. На задних корешках расположены нервные узлы — скопления тел чувствительных нейронов. Соединяясь, корешки образуют смешанные нервы. Каждая пара спинномозговых нервов иннервирует определённый участок тела.
Пример:
шейные и верхние грудные сегменты управляют органами грудной полости, мышцами шеи и рук органам. Нервы, отходящие от нижних грудных и верхних поясничных сегментов, иннервируют органы брюшной полости и мышцы туловища. От нижних поясничных и крестцовых сегментов отходят нервы, которые управляют органами таза и мышцами ног.
Функции спинного мозга
Основные функции спинного мозга:
- рефлекторная — осуществляется соматической и вегетативной нервными системами;
- проводниковая — осуществляется белым веществом восходящих и нисходящих проводящих путей.
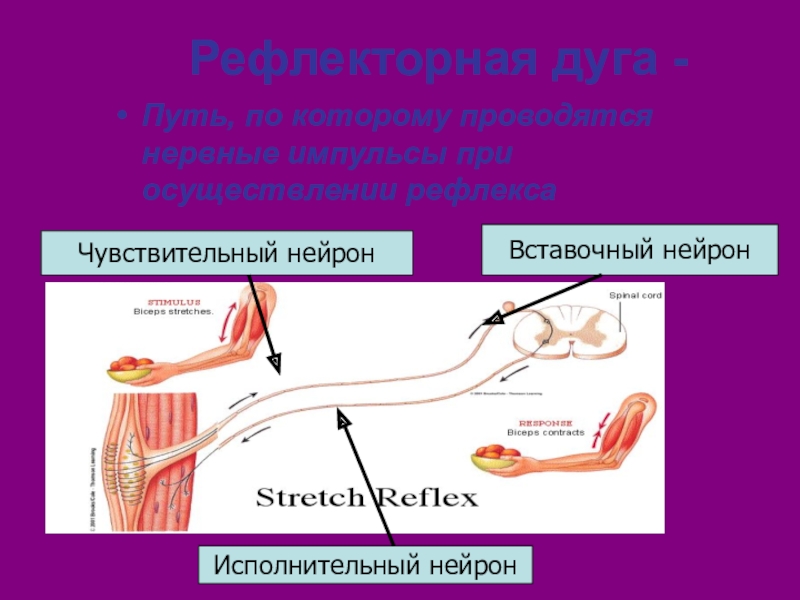
Рефлекторная функция спинного мозга заключается в том, что здесь замыкаются дуги безусловных рефлексов, которые регулируют соматические и вегетативные функции организма. Через спинной мозг проходят рефлекторные дуги, с которыми связаны сокращения всех скелетных мышц тела (кроме мышц головы).
Через спинной мозг проходят рефлекторные дуги, с которыми связаны сокращения всех скелетных мышц тела (кроме мышц головы).
Пример:
примером простейшего двигательного рефлекса может быть коленный рефлекс, который проявляется в разгибании ноги при ударе по сухожилию мышцы ниже коленной чашечки.
Проводниковая функция
По нисходящим путям нервные импульсы поступают из головного мозга к двигательным нейронам передних рогов, а от них — к органам.
Обрати внимание!
Белое вещество спинного мозга обеспечивает связь и согласованную работу всех отделов центральной нервной системы, осуществляя проводниковую функцию. Все рефлексы спинного мозга находятся под контролем головного мозга.
1 — Нервная система. Спинной мозг
Нервная система осуществляет регуляцию
всех жизненных процессов в организме
и его взаимодействие с внешним миром и
представляет собой высшую интегрирующую
систему.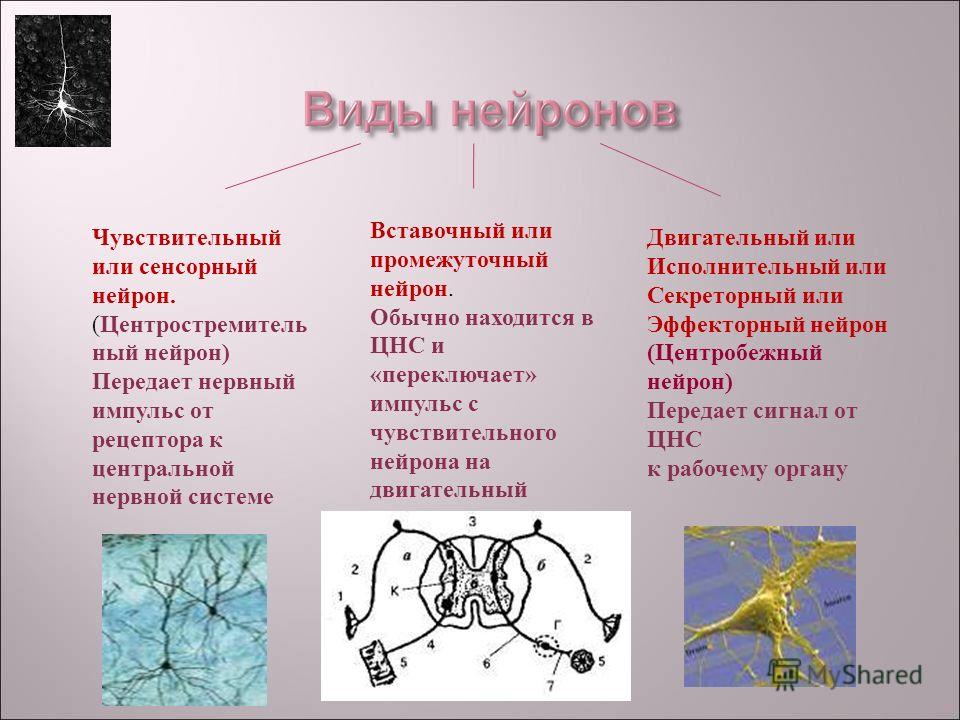 Нервная система функционирует
на основе рефлексов. Ответные реакции
организма, осуществляемых при посредстве
ЦНС. Морфологическими субстратом
рефлексов являются рефлекторные дуги,
состоящие из цепи афферентных,
ассоциативных и эффекторных нейронов.
Нервная система функционирует
на основе рефлексов. Ответные реакции
организма, осуществляемых при посредстве
ЦНС. Морфологическими субстратом
рефлексов являются рефлекторные дуги,
состоящие из цепи афферентных,
ассоциативных и эффекторных нейронов.
Нервные центры – скопления
нервных клеток в ЦНС и ПНС, в которых
между ними осуществляется синаптическая
передача. Они обладают сложной структурой,
богатством и разнообразием внутренних
и внешних связей и специализированы на
выполнения определенных функций.
— нервные центры ядерного типа,
в которых нейроны располагаются без
видимой упорядоченности (вегетативные
ганглии, ядра спинного и головного
мозга).
— нервные центры экранного
типа, в которых нейроны выполняют
однотипные функции, собранные в виде
отдельных слоев, сходных с экранами ,
на которые проецируются нервные импульсы,
кора мозжечка , кора полушарий большого
мозга, сетчатка глаза.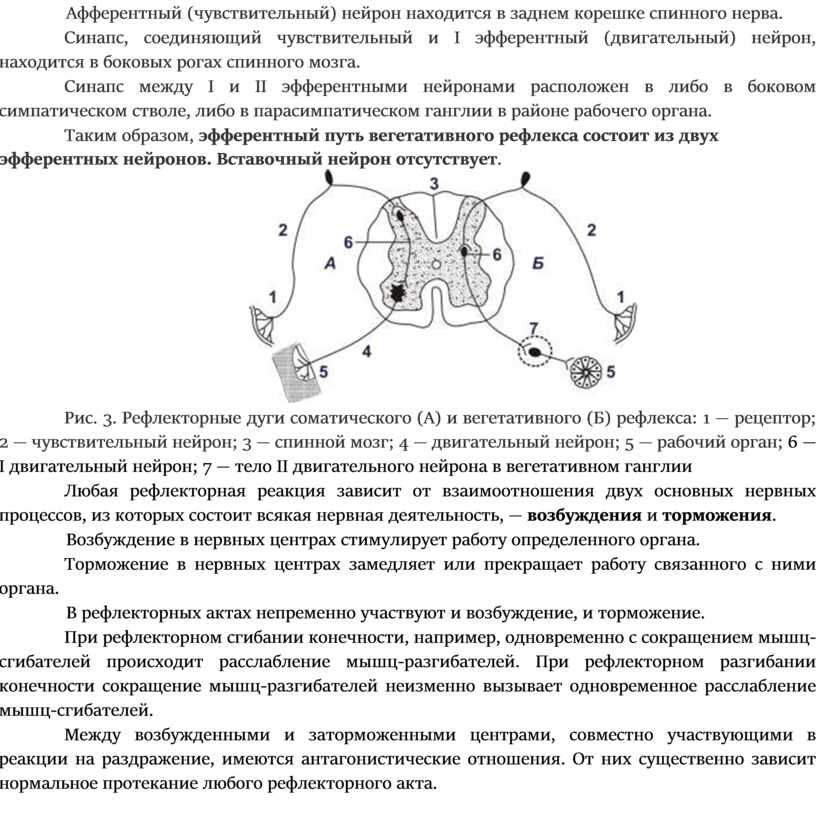 Внутри слоев и
между ними имеются многочисленные
ассоциативные связи.
Внутри слоев и
между ними имеются многочисленные
ассоциативные связи.
Нервная ткань (при участии ряда других тканей) формируют нервную систему. Последняя включает: ЦНС (головной и спинной мозг) и ПНС (нервные узлы (ганглии), нервные стволы(нервы), нервные окончания).
1.Нервные узлы (ганглии) – скопления нервных клеток , точнее их тел в нецентральной НС. Скопления нейронов в головном или спинном мозге называются ядрами.2. Нервные стволы – совокупность идущих параллельно нервных волокон. Среди последних в нерве могут одновременно присутствовать и афферентные нервные волокна (содержащие дендриты нейронов) и эфферентные волокна(содержащие аксоны нейронов).
Кроме приведенного деления, нервную систему подразделяют на соматическую и вегетативную (автономную) НС.
Вегетативная нервная система (ВНС) состоит из центральных отделов,
представленных ядрами головного и
спинного мозга. Ядра центрального отдела
ВНС находятся в среднем и продолговатом
мозге, а также в боковых рогах грудных,
поясничных и крестцовых сегментах
спинного мозга. К СНС относятся
вегетативные ядра боковых рогов грудного
и верхнепоясничного отделов спинного
мозга, к ПНС – вегетативные ядра 3, 7, 9,
10 пар черепных нервов и вегетативные
ядра крестцового отдела спинного мозга.
К СНС относятся
вегетативные ядра боковых рогов грудного
и верхнепоясничного отделов спинного
мозга, к ПНС – вегетативные ядра 3, 7, 9,
10 пар черепных нервов и вегетативные
ядра крестцового отдела спинного мозга.
Соматическая нервная система иннервирует «сому», т.е. органы, происходящие из сомитов, — кожу, поперечнополосатую скелетную мускулатуру, связки и сухожилия. Ее рефлекторная дуга обычно включает три части:
чувствительный (рецепторный) нейрон
вставочный (ассоциативный) нейрон
двигательный (эффекторный) нейрон
Чувствительные нейроны.Тела
чувствительных нейронов лежат в нервных
узлах. Узлы же располагаются по ходу
задних корешков спинного мозга и
некоторых черепно-мозговых нервов. Узел
называется спинномозговым.Чувствительные
окончания рецепторных нейронов находятся
в иннервируемых органах, а дендриты
идут обычно в составе различных, смешанных
нервов, откуда направляются в задние
корешки спинного мозга к телам своих
нейронов.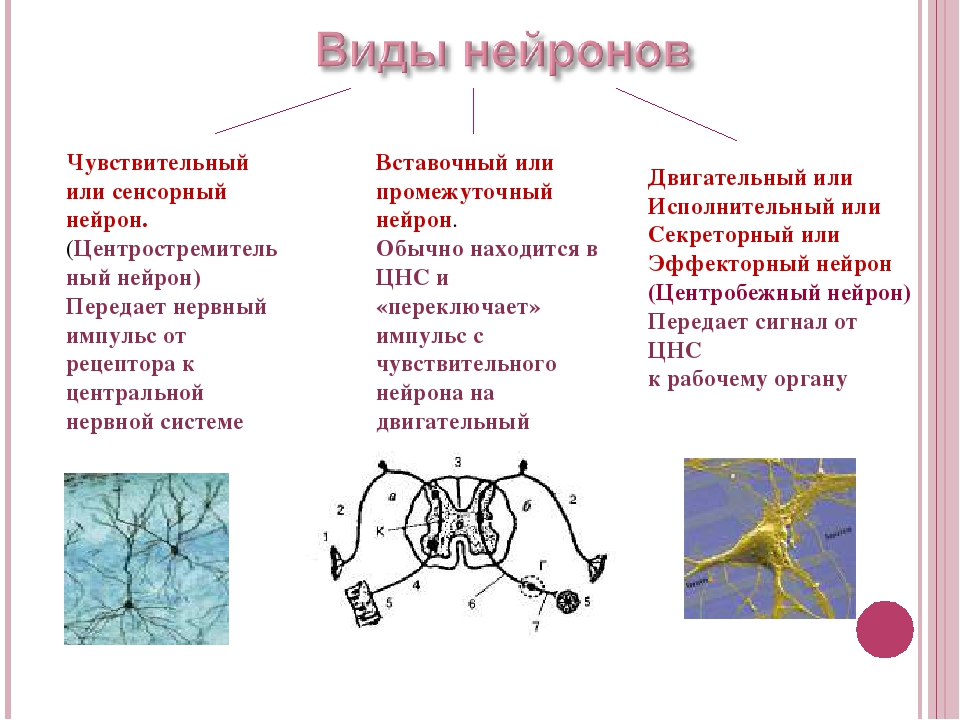
Ассоциативные нейроны. Дендриты ассоциативных нейронов обычно короткие. Аксоны же могут либо только переходить из задних рогов спинного мозга в передние ( при замыкании дуги на уровне сегмента спинного мозга), либо достигать других уровней спинного или головного мозга (как в восходящем , так и в нисходящем направлениях).
Двигательные нейроны.Дендриты,
как правило, короткие. Импульсы
ассоциативных нейронов обычно поступают
по многочисленным аксосоматическим
синапсам. Тела двигательных нейронов
находятся в передних рогах спинного
мозга и в ядрах соответствующих
черепно-мозговых нервов (в головном
мозге). Аксон двигательного нейрона
выходит из спинного мозга в составе его
переднего корешка.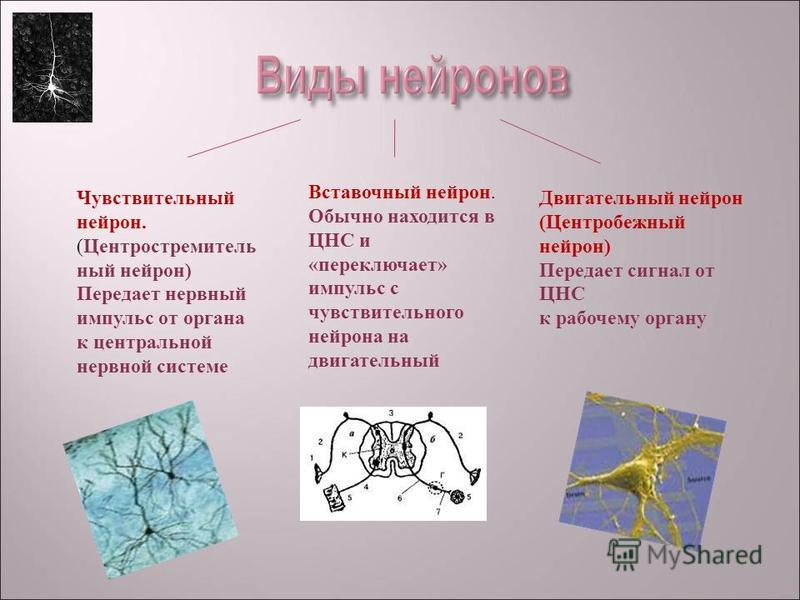 Затем оказывается
в составе того или иного смешанного
нерва и наконец участвует в образовании
моторной пластинки на скелетной мышце.
Затем оказывается
в составе того или иного смешанного
нерва и наконец участвует в образовании
моторной пластинки на скелетной мышце.
Спинномозговые узлы.Спинномозговой узел выглядит как овальное утолщение заднего корешка недалеко от бифуркации спинномозгового нерва. Чувствительные нейроны (нейроны являются псевдоуниполярными), образующие узел, располагаются группами на его периферии.
Спинной
мозг Спинной мозг, как
и головной, покрыт тремя оболочками – мягкой, паутинной и твердой. Первые
две образованы рыхлой волокнистой
соединительной тканью, А твердая оболочка
– плотной волокнистой соединительной
тканью. Мягкая оболочка непосредственно
прилегает к ткани мозга и повторяет ее
рельеф. В этой оболочке много кровеносных
сосудов. Паутинная оболочка не заходит
в углубления мозга. Поэтому между ней
и мягкой оболочкой образуется подпаутиннаое
(субарахноидальное) пространство,
заполненное соединительнотканными
трабекулами. В спинном мозге можно
различить серое и белое вещество.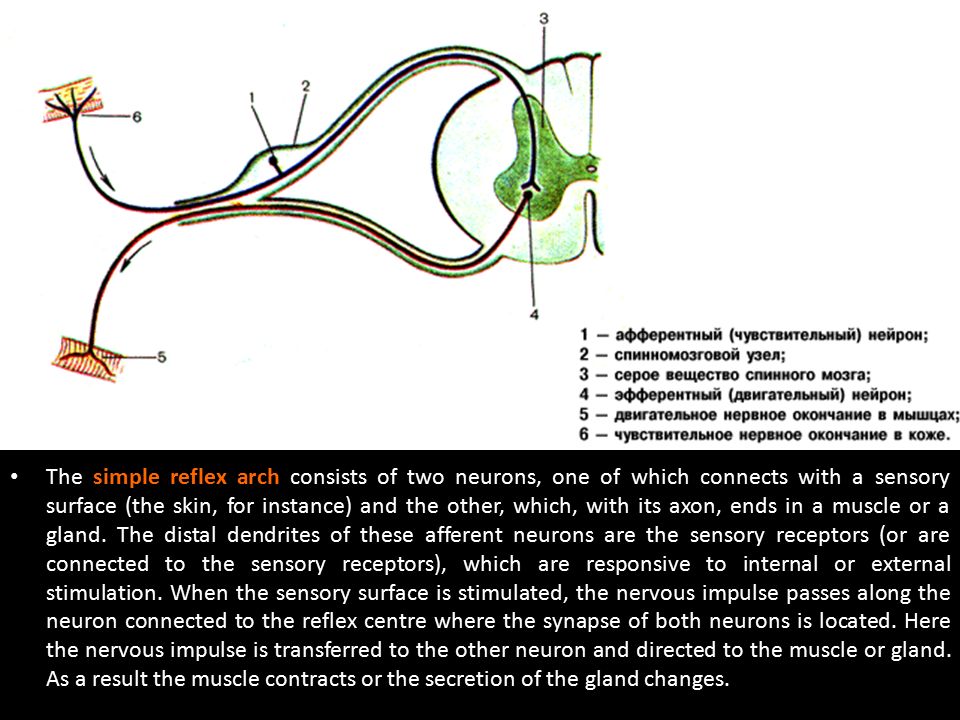
Серое вещество занимает внутреннее положение и на поперечном срезе имеет форму бабочки.Главная особенность серого вещества наличие в нем тел нейронов и окружающих глиальных элементов. Нейроны являются мультиполярными и в большинстве своем сгруппированы в ядра. Кроме них, в сером веществе имеются нервные волокна.В сером веществе выделяют следующие части: задние рога – относительно узкие и длинные выступы, расходящиеся кнаружи;передние рога – более широкие и короткие выступы, направленные вперед и немного кнутри;промежуточные зону и выдающиеся из нее боковые рога – небольшие выступы по бокам , имеющиеся лишь на уровне грудных, верхне-поясничных и крестцовых сегментов мозга.
Белое вещество – это совокупность
миелиновых волокон. Волокна идут, в
основном, вдоль длинной оси спинного
мозга и образуют различные проводящие
пути. Рогами серого вещества и глиальными
перегородками белое вещество разбивается
на канатики: задние, боковые и передние.
Задние рога.
В задних рогах содержатся вставочные нейроны , которые получают сигналы от чувствительных нейронов спинномозговых узлов. Нейроны задних рогов образуют следующие структуры:
Губчатый слой и желотенозное вещество – находятся в задней части и на периферии задних рогов (содержат мелкие нейроны). Аксоны этих нейронов идут к мотонейронам передних рогов того же сегмента спинного мозга, той же стороны и ли противоположной . В последнем случае клетки называются комисуральными . т.к. них аксоны образуют комисурыилии спайки, лежащую перед спинномозговым каналом
Собственное ядро заднего рога(находится в центре рога). Аксоны нейронов переходят на противоположную сторону в боковой канатик и идут к мозжечку или в зрительный бугор.
Грудное ядро (ядро Кларка) — в основании рога. Нейроны ядра Кларка получают информацию от рецепторов мышц , сухожилий и суставов (проприорецпторная чувствительность) по самым толстым корешковым волокнам и передают ее в мозжечок по заднему спиномозжечковому пути.

Боковые рога.
Медиальное промежуточное ядро находится в промежуточной зоне. Как и в случае грудного ядра, аксоны нейрона входят в боковой канатик той же стороны и поднимаются к мозжечку.
Латеральное промежуточное ядро находится в боковых рогах и является элементом симпатической нервной системы
Передние рога.
Несколько моторных ядер, содержат самые крупные клетки спинного мозга – мотонейроны.Передние рога образуют 2 группы ядер: 1. Медиальная группа ядер- иннервирует мышцы туловища. 2. Латеральная группа ядер хорошо выражены в области шейного и поясничного утолщения – иннервирует мышцы конечностей.
По функции среди мотонейронов передних рогов СМ различают:
Al`fa— мотонейроны большие – имеют диаметр 140 мкм. Передают импульсы на экстрафузальные мышечные волокна и обеспечивают быстрое сокращение мышц.
Al`fa –мотонейроны малые – поддерживают тонус скелетной мускулатуры.

Gamma— мотонейроны передают импульсы интрафузальным мышечным волокнам (в составе нервно-мышечного веретена).
Al`faмотонейроны – это интегративная единица СМ, они испытываются влияние возбуждающих и тормозных импульсов. До 50 процентов поверхности тела и дендритов мотонейрона покрыты синапсами. Среднее число синапсов на 1 мотнейроное СМ человека составляет 25-35 тысяч. Одномоментно на один мотонейрон могут передавать импульсы с тысячи синапсов идущие от нейронов спинального и супраспинального уровней. Возможно и возвратное торможение мотонейронов благодаря тому , что ветвь аксона мотнейрона передает на тормозные клетки Реншоу, а аксоны клеток Реншоу оканчиваются на теле мотонейрона тормозными синапсами.
В дуге соматического рефлекса тела чувствительных нейронов расположены в: а) спинно-мозговых
какой вид бактерии изображено
СРОЧНО ПЖ
Посмотрите на позвоночник туловищного отдела позвоночника
скелета птиц.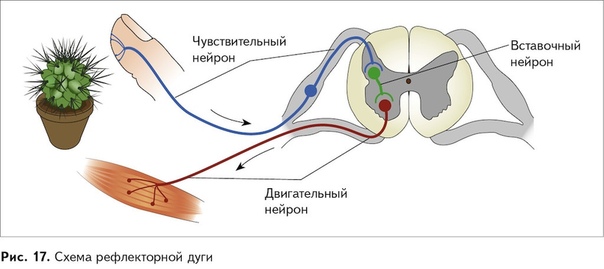 Что произошло с отдельными позвонками туловищного
отдела и сложным к
… рестцом скелета птицы? Какой вывод можно
сделать о гибкости туловища птицы?
* Сравните грудную клетку скелета рептилии и птицы. Какая
особенность есть в строении этого отдела в скелете птиц? С чем это
связано?
Отдел
Особенности строения
Значение
Череп
Шейный отдел
Передняя конечность
Задняя конечность
Туловищный отдел
Грудная клетка
Что произошло с отдельными позвонками туловищного
отдела и сложным к
… рестцом скелета птицы? Какой вывод можно
сделать о гибкости туловища птицы?
* Сравните грудную клетку скелета рептилии и птицы. Какая
особенность есть в строении этого отдела в скелете птиц? С чем это
связано?
Отдел
Особенности строения
Значение
Череп
Шейный отдел
Передняя конечность
Задняя конечность
Туловищный отдел
Грудная клетка
срочно сор по биологии
помогите срочно какое опыление изображено на этой картинке
4.1. Елизавета на уроке изучала устройство прифрового микроскопаи делала соответствующие подписи к рисунку. Какую детальмикроскопа на рисунке она обоз … начила буквой А?Ответ.4.2. Какую функцию выполняет эта часть рифрового микроскопта приработе с ним? ПОМОГИТЕ ПОМОГИТЕПОЖАЛУЙСТА
А) предок кур являетсяБ) центр одомашнивания курВ) искусственный отбор шел в направлении
Помогіте срочно! Пжпжжп
помогите пожалуйста у меня сор по биологиипечень_______головной мозг______
Английский Henry liked Spring Holidays, because he liked the weather and St.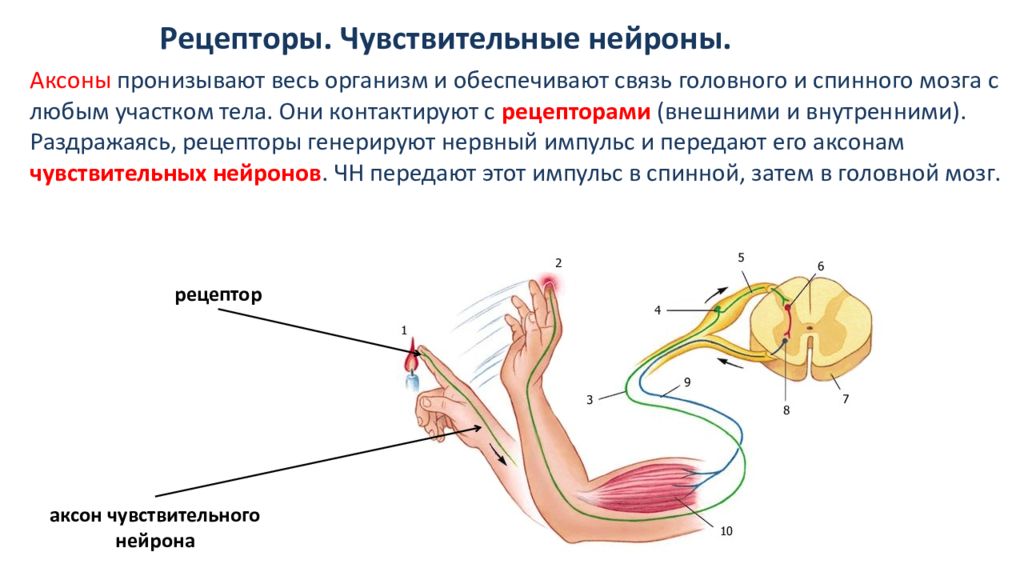 Patrick’s Day. In thatday people wear green. Easter was a good holiday, t
… oo. You could see the Easter Rabbit, hunt foreggs and find candy.Sandra liked Summer Holidays, like Independence Day. She always went to the air showto see airplanes. In the evening they’d shoot off fireworks. Mother’s Day and Father’s Day wereusually in the summer, too.Judith loved Fall holidays most. Sweetest Day wasn’t that popular, but it was a nice dayand sometimes she got candy. Halloween was such a great time. Thanksgiving was just a fewweeks later. Between Halloween’s candy and Thanksgiving’s turkey was the best food season ofthe year.Winter holidays were Thomas’ favourites. Christmas was a great time to be with family.New Year was exciting, because everyone stayed up late and cheered when the year changed,and there were often fireworks.Task 1 . Ответь на вопросы по тексту (дай полные ответы)1. What season holidays does Henry like most?2. Is Mothers’s Day in the summer? ———3. Why were winter holidays Thomas’favourites?4.
Patrick’s Day. In thatday people wear green. Easter was a good holiday, t
… oo. You could see the Easter Rabbit, hunt foreggs and find candy.Sandra liked Summer Holidays, like Independence Day. She always went to the air showto see airplanes. In the evening they’d shoot off fireworks. Mother’s Day and Father’s Day wereusually in the summer, too.Judith loved Fall holidays most. Sweetest Day wasn’t that popular, but it was a nice dayand sometimes she got candy. Halloween was such a great time. Thanksgiving was just a fewweeks later. Between Halloween’s candy and Thanksgiving’s turkey was the best food season ofthe year.Winter holidays were Thomas’ favourites. Christmas was a great time to be with family.New Year was exciting, because everyone stayed up late and cheered when the year changed,and there were often fireworks.Task 1 . Ответь на вопросы по тексту (дай полные ответы)1. What season holidays does Henry like most?2. Is Mothers’s Day in the summer? ———3. Why were winter holidays Thomas’favourites?4. What is a fall holi
What is a fall holi
6. Вставьте пропущенные слова. ….. находятся на первом трофическом уровне в цепи питания. ….. стоят на следующем трофическом уровне. ….. по спос … обу питания являются сапрофитами. …. -это ряд на живых организмов, последовательно извлекающих органические вещества и энергию друг из друга
Спинной мозг — урок. Биология, 9 класс.
Обрати внимание!
Центральная нервная система (ЦНС) состоит из спинного и головного мозга.
Наверху спинной мозг переходит в нижний отдел головного мозга — продолговатый мозг, а внизу заканчивается на уровне поясничных позвонков. Спинной мозг разделен на две симметричные половины передней и задней продольными бороздами.
В центре спинного мозга проходит спинномозговой канал, заполненный спинномозговой жидкостью. Вокруг него сосредоточено серое вещество, образованное телами нейронов, на поперечном срезе имеющее форму бабочки (в нём различают передние, задние и боковые рога).
Вокруг него сосредоточено серое вещество, образованное телами нейронов, на поперечном срезе имеющее форму бабочки (в нём различают передние, задние и боковые рога).
- В передних рогах расположены двигательные нейроны (мотонейроны), по аксонам которых возбуждение достигает скелетных мышц конечностей и туловища, заставляя их сокращаться.
- В задних рогах расположены главным образом тела вставочных нейронов. Они связывают отростки чувствительных нейронов с телами двигательных нейронов, а также передают информацию в другие отделы центральной нервной системы.
- В боковых рогах залегают нейроны, образующие центры симпатической части вегетативной нервной системы.
Наружный слой спинного мозга образован белым веществом, состоящим из отростков нейронов, образующих проводящие пути.
Спинной мозг подразделяется на участки — сегменты. От каждого сегмента отходят спинномозговые нервы.
 Всего от спинного мозга отходит 31 пара смешанных спинномозговых нервов, каждый из которых начинается двумя корешками: передним (двигательным) и задним (чувствительным). В составе передних корешков находятся также вегетативные нервные волокна. На задних корешках расположены нервные узлы — скопления тел чувствительных нейронов. Соединяясь, корешки образуют смешанные нервы. Каждая пара спинномозговых нервов иннервирует определенный участок тела.
Всего от спинного мозга отходит 31 пара смешанных спинномозговых нервов, каждый из которых начинается двумя корешками: передним (двигательным) и задним (чувствительным). В составе передних корешков находятся также вегетативные нервные волокна. На задних корешках расположены нервные узлы — скопления тел чувствительных нейронов. Соединяясь, корешки образуют смешанные нервы. Каждая пара спинномозговых нервов иннервирует определенный участок тела.Пример:
От шейных и верхних грудных сегментов отходят к мышцам шеи, верхних конечностей и органам, расположенным в грудной полости. Нижние грудные и верхние поясничные сегменты управляют мышцами туловища и органами брюшной полости. Нижние поясничные и крестцовые сегменты управляют работой мышц нижних конечностей и органами, расположенными в тазовой области.
Функции спинного мозга
Спинной мозг выполняет две основные функции: рефлекторную и проводниковую.
- рефлекторная — осуществляется соматической и вегетативной нервными системами.

- проводниковая — осуществляется белым веществом восходящих и нисходящих проводящих путей.
Рефлекторная функция спинного мозга заключается в том, что его двигательные нейроны (мотонейроны) управляют движениями мышц конечностей, туловища и отчасти шеи. Через спинной мозг проходят рефлекторные дуги, с которыми связаны сокращения всех скелетных мышц тела (кроме мышц головы).
Пример:
Примером простейшего двигательного рефлекса может быть коленный рефлекс, который проявляется в разгибании ноги при ударе по сухожилию мышцы ниже коленной чашечки.
Проводниковая функция заключается в том, что по волокнам белого вещества информация от кожных рецепторов (прикосновения, боли, температурных), рецепторов мышц конечностей и туловища, рецепторов сосудов, органов мочеполовой системы передаётся по восходящим проводящим путям в головной мозг.
И наоборот, от двигательных центров головного мозга импульсы поступают к мотонейронам передних рогов, а оттуда – к органам (к мышцам конечностей, туловища и т.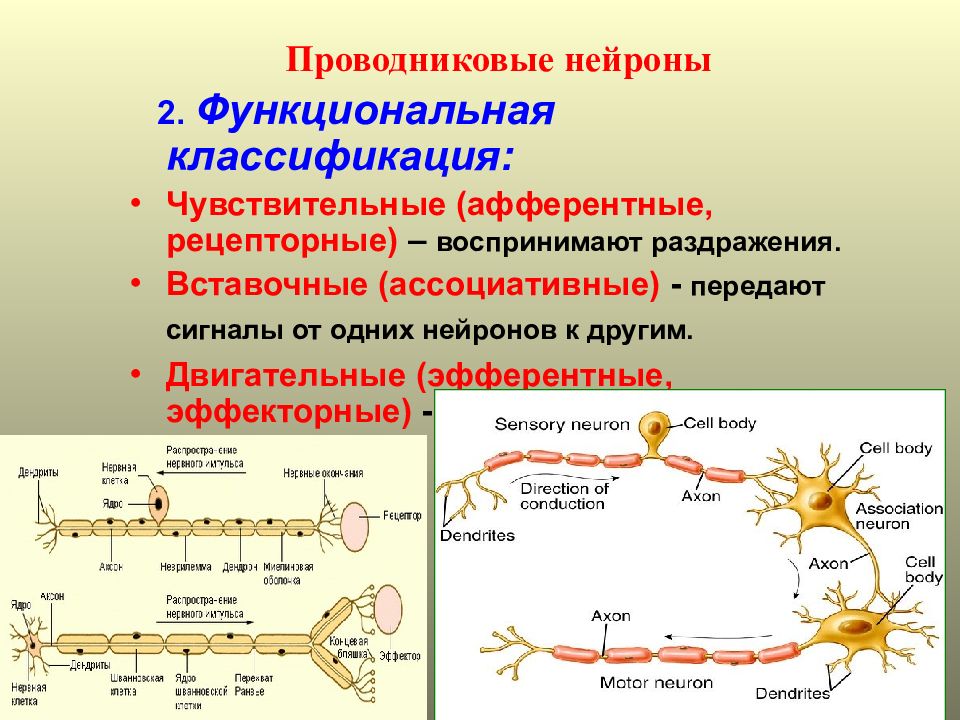 д.).
д.).
Обрати внимание!
Белое вещество спинного мозга обеспечивает связь и согласованную работу всех отделов центральной нервной системы, осуществляя проводниковую функцию. Все рефлексы спинного мозга находятся под контролем головного мозга.
Источники:
Пасечник В.В., Каменский А.А., Швецов Г.Г./Под ред. Пасечника В.В. Биология. 8 класс.– М.: Просвещение
Любимова З.В., Маринова К.В. Биология. Человек и его здоровье. 8 класс – М.: Владос
Лернер Г.И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель http://biouroki.ru/material/human/nervnaya-sistema.html
Головной мозг человека | Поликлиника «Медицинский комплекс – Елец»
Нервная система человека представлена головным мозгом, расположенном в полости черепа; спинным мозгом, расположенном в полости позвоночника, и разветвленной системой нервов, которые отходят от головного мозга (черепно-мозговые нервы) и иннервируют органы головы; системой нервов, которые ответвляются от спинного мозга и иннервируют руки, ноги, туловище, внутренние органы.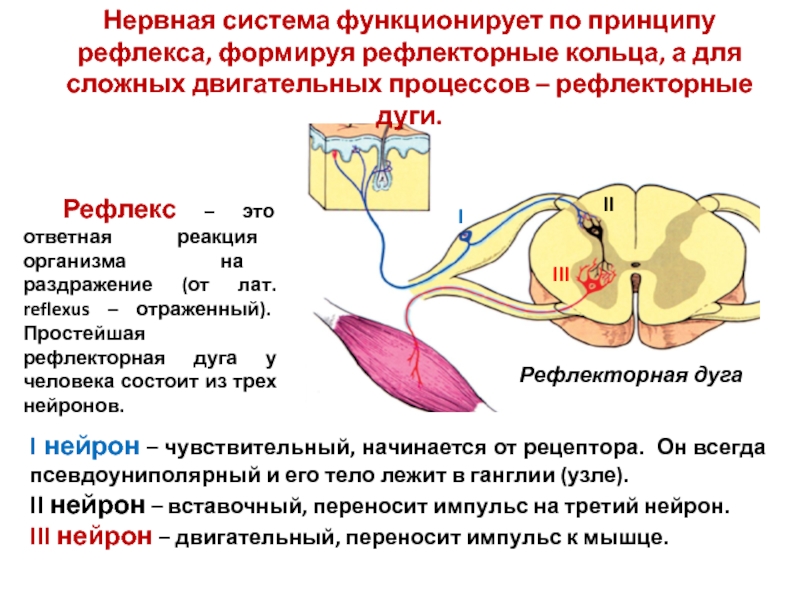 Головной и спинной мозг – представляют центральную нервную систему, а система нервов – периферическую нервную систему.
Головной и спинной мозг – представляют центральную нервную систему, а система нервов – периферическую нервную систему.
Все образования нервной системы состоят из множества нейронов (клеток нервной системы) и их отростков, по которым передаются нервные импульсы в восходящем и нисходящем направлениях за счёт многообразных связей, существующими между нейронами.
Несмотря на то, что разные нейроны выполняют различные функции, и имеют различия в строении, все они имеют тело, воспринимающая структура, и отросток, дендрит, проводящая структура.
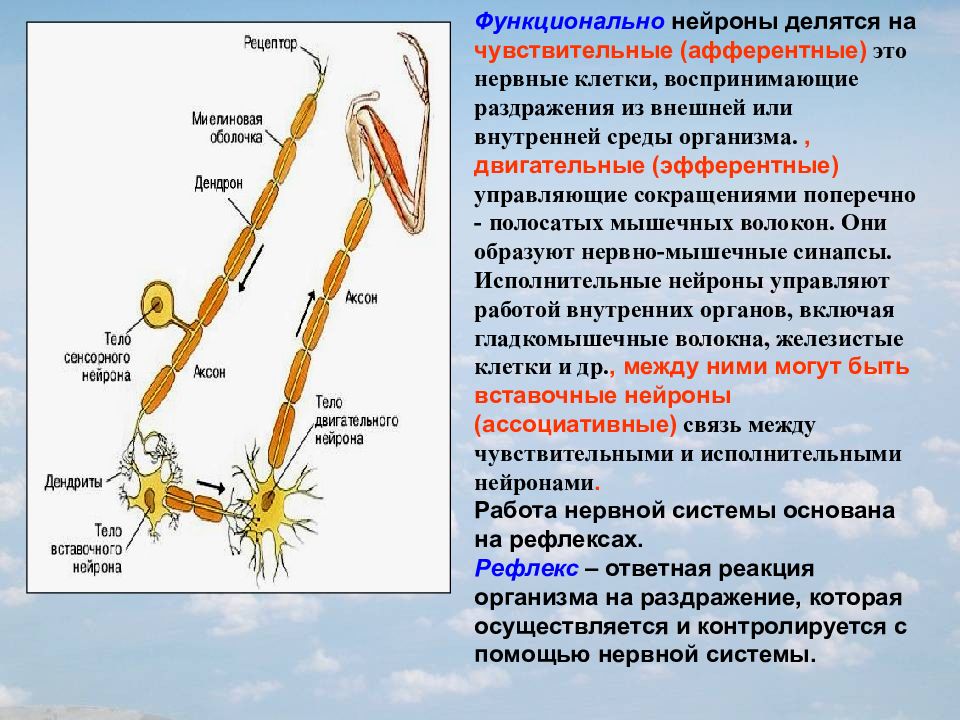
По своим функциональным характеристикам нейроны делятся на двигательные — исполнительные, и чувствительные — воспринимающие, а также интернейроны, осуществляющие взаимодействие между ними.
Нервная клетка выполняет две основные функции: 1) переработка поступающей информации, передача нервного импульса и 2) биосинтетическая, направленная на поддержание своей жизнедеятельности.
Так схематически выглядит строение нейрона.
Так выглядит головной мозг человека.
Это сложнейшая структура, состоящая из множества различных образований, находящихся в тесном взаимодействии; осуществляющая проводящую, анализирующую, регулирующую и координирующую функции. Все движения тела, чувства человека, работа внутренних органов, его разум, интеллект, память, сознание, сон, бодрствование, всё контролируется головным мозгом. Мозг человека можно сравнить со сложнейшим компьютером с заложенными в него программами, постоянно модифицирующимися в течение жизни человека.
Схематически головной мозг можно разделить на доли: лобные, затылочные, височные, теменные; мозжечок, ствол мозга. Доли мозга покрыты корой, которая представляет собой совокупность высоко дифференцированных нейронов, осуществляющих высшую интегративную деятельность.
В лобных долях находятся центры регуляции произвольных движений, при поражении которых развивается слабость в руках, ногах с одной стороны, или только руки или ноги.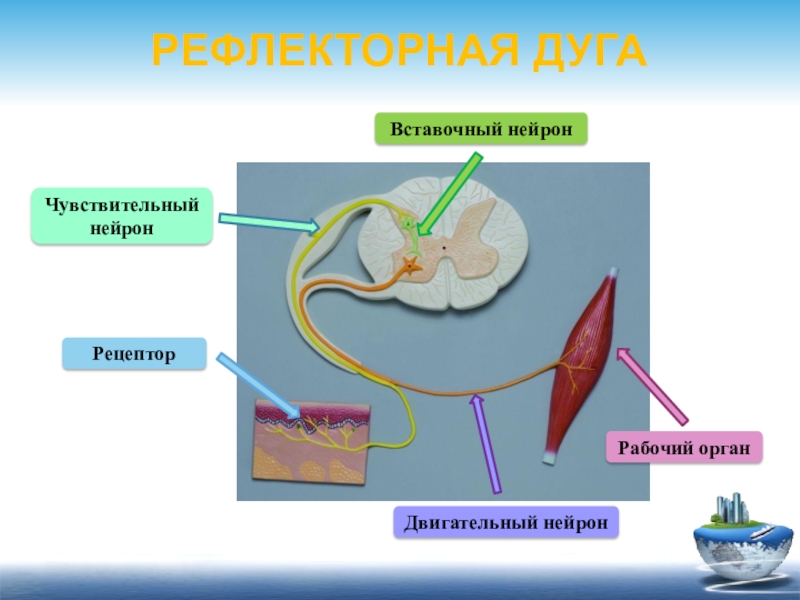 В лобных долях находятся и центры «произвольного» поворота глаз и головы, при поражении которых возникает отклонение глаз и головы в сторону патологического очага. В лобных долях находятся и центры координации движений, при поражении которых возникают нарушения стояния и ходьбы. И, наконец, при поражении коры лобных долей развиваются поведенческие и психические расстройства.
В лобных долях находятся и центры «произвольного» поворота глаз и головы, при поражении которых возникает отклонение глаз и головы в сторону патологического очага. В лобных долях находятся и центры координации движений, при поражении которых возникают нарушения стояния и ходьбы. И, наконец, при поражении коры лобных долей развиваются поведенческие и психические расстройства.
Теменные доли отвечают за способность человека узнавать предметы наощупь, способность производить сложные целенаправленные действия, способность расшифровывать письменные знаки и способность письма.
Височные доли несут слуховые, вкусовые и обонятельные центры, центры понимания и воспроизведения речи, центры координации движений.
В зрительных долях находятся центры восприятия зрительных образов, зрительной памяти. Мозжечок — это один из основных координаторных центров.
В стволе головного мозга находятся центры регуляции жизнеобеспечивающих систем органов, дыхательной, сердечно-сосудистой, промежуточные центры регуляции черепно-мозговых нервов, проводящие пути двигательной и чувствительной систем.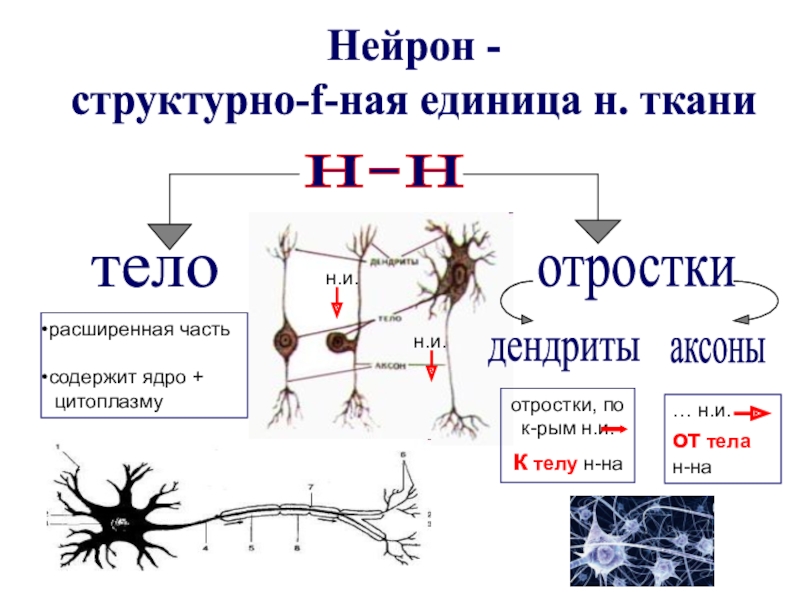
В стволе головного мозга в его покрышке располагаются ядра черепно-мозговых нервов, тела нервных клеток, ответственных за иннервацию органов головы, лица, обеспечивающих выполнение функции вкусового, слухового, зрительного, вестибулярного и обонятельного анализатора.
Различают черепно-мозговые нервы каудальной группы: 1) Добавочный нерв, 11 пара, иннервирует мышцу, поворачивающую голову в сторону. 2) Подъязычный нерв, 12 пара, иннервирующий язык. 3) Языкоглоточный нерв, 9 пара, иннервирующий глоточную мускулатуру, язык, нёбо, среднее ухо, слюнные железы. 4) Блуждающий нерв, 10 пара, иннервирующий мускулатуру глотки, мягкого нёба, гортани, гладкую мускулатуру бронхов, трахеи, пищевода, желудка, кишечника.
Далее различают черепно-мозговые нервы мосто-мозжечкового угла: 1) Лицевой нерв, 7 пара, иннервирующий мышцы лица. 2) Вестибуло-кохлеарный нерв, 8 пара, иннервирующий внутреннее ухо. 3) Тройничный нерв, 3 пара, иннервирующий кожу лица, челюсти, жевательные мышцы.
Далее следует группа глазодвигательных нервов: 3, 4, 6 пары.
И наконец, зрительный нерв, 2 пара, иннервирующий сетчатку глаза, и обонятельный нерв, 1 пара, иннервирующий слизистую носовой полости.
СПИННОЙ МОЗГ | Энциклопедия KM.RU
Спинной мозг.
Объемная реконструкция спинного мозга.
Поперечный разрез спинного мозга.
Спинной мозг является более элементарным, но не менее важным отделом центральной нервной системы, чем мозг головной. Через спинномозговые нервы он непосредственно контролирует опорно-двигательный аппарат туловища и конечностей, а также внутренние органы грудной и брюшной полостей. Как бы ни был развит головной мозг, без спинного мозга и его связей он не может влиять на их функции.
Организация спинного мозга подчиняется закономерностям конструкции самого туловища (конечности, с точки зрения развития, являются его придатками), в первую очередь, его сегментарности.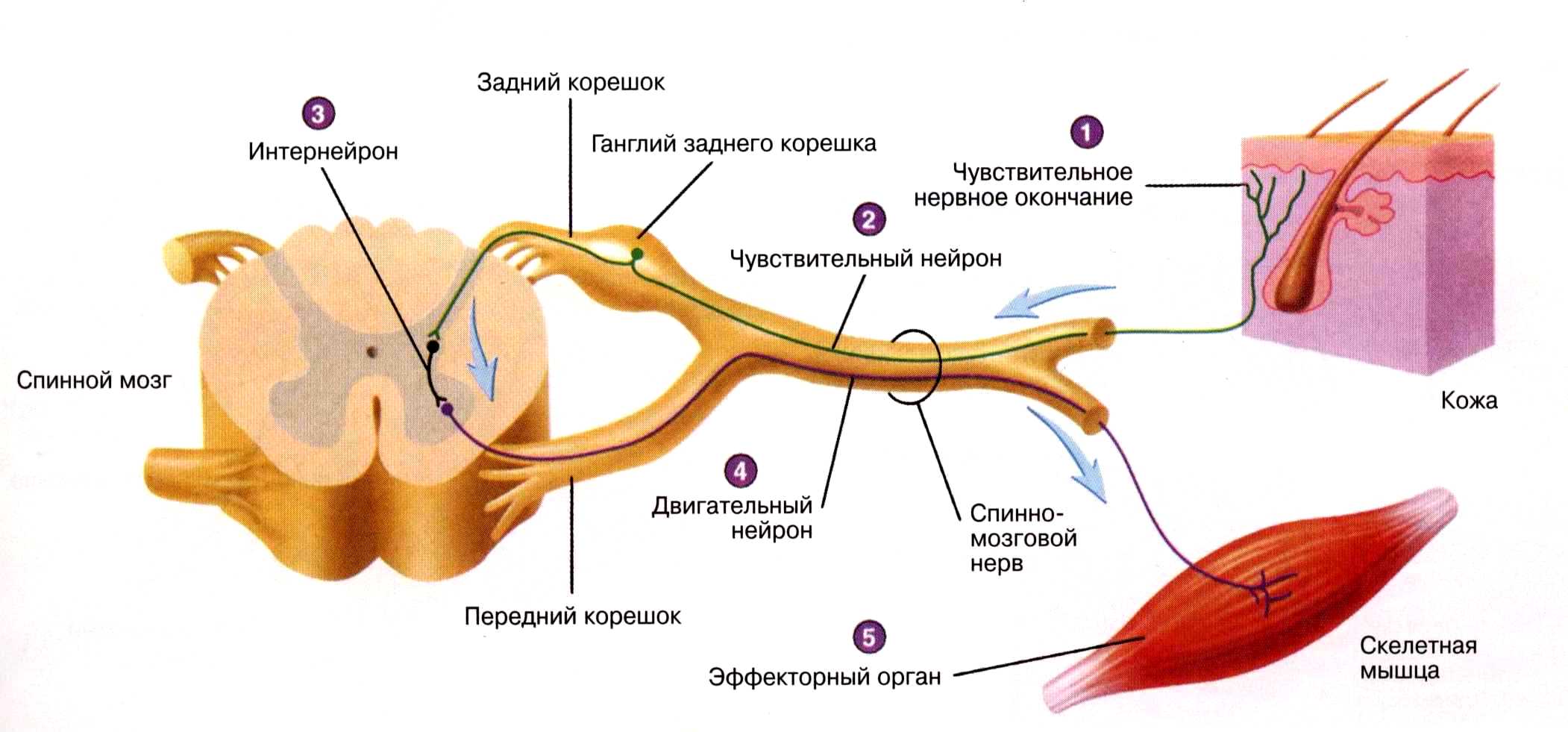 Под этим понимается построение туловища человека в вертикальном направлении из последовательного ряда принципиально сходных частей — сегментов. Таких сегментов в туловище человека 31, каждый из них включает костную основу, конечный ободок, мышечную пластинку. Признаки сегментации наиболее отчетливы у эмбрионов, позднее их внешние проявления несколько вуалируются развивающимися конечностями, но продолжают существовать, особенно в грудном отделе. Это проявляется, в частности, в чередовании позвонков, ребер, межреберных мышц.
Под этим понимается построение туловища человека в вертикальном направлении из последовательного ряда принципиально сходных частей — сегментов. Таких сегментов в туловище человека 31, каждый из них включает костную основу, конечный ободок, мышечную пластинку. Признаки сегментации наиболее отчетливы у эмбрионов, позднее их внешние проявления несколько вуалируются развивающимися конечностями, но продолжают существовать, особенно в грудном отделе. Это проявляется, в частности, в чередовании позвонков, ребер, межреберных мышц.
Каждый из таких сегментов туловища находится под контролем соответствующего участка (сегмента) спинного мозга посредством правой и левой пар корешков, которые, соединяясь, дают начало правому и левому спинномозговым нервам. Последующие разветвления этих нервов пронизывают ткани соответствующего сегмента туловища. Передний (двигательный) корешок состоит из отростков двигательных нейронов, тела которых находятся в передних рогах спинного мозга — передних расширенных участках его серого вещества. Задний (чувствительный) корешок имеет утолщение, которое составляют тела чувствительных нейронов (спинномозговой узел), остальная его часть представлена их отростками.
Задний (чувствительный) корешок имеет утолщение, которое составляют тела чувствительных нейронов (спинномозговой узел), остальная его часть представлена их отростками.
У эмбрионов спинной мозг расположен на всем протяжении позвоночника. Однако скорость их роста неодинакова, и нижний конец спинного мозга начинает «подниматься» относительно туловища. В конечном итоге он занимает положение между 1-м и 2-м поясничными позвонками, в результате часть сегментов спинного мозга оказывается значительно выше соответствующих туловищных сегментов, к которым их корешки спускаются косо или вертикально в позвоночном канале ниже окончания спинного мозга в виде так называемого «конского хвоста».
Сам спинной мозг представляет собой столб, сердцевина которого является серым веществом (тела нейронов), а наружный ободок — белым (отростки нейронов). На поперечном срезе спинного мозга серое вещество имеет вид бабочки, выросты «крыльев» составляют рога. В передних рогах (правом и левом) находятся тела двигательных нейронов, отростки которых через передний корешок, спинномозговой нерв и его разветвления пойдут к мышцам данного сегмента.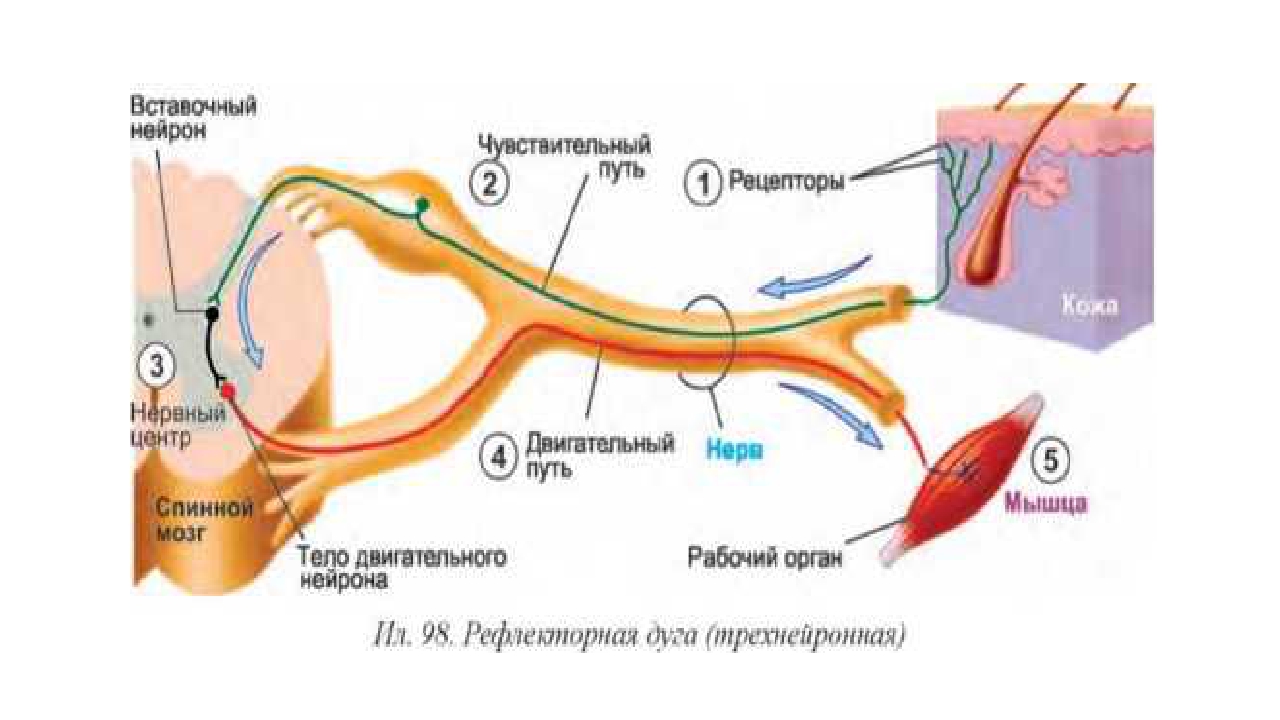 В суженых задних рогах располагаются вставочные нейроны, постоянно получающие информацию от чувствительных нейронов спинномозговых узлов и распределяющие ее посредством своих отростков в разных направлениях: к двигательным нейронам передних рогов с замыканием коротких рефлекторных дуг; к центрам мозгового ствола, промежуточного и конечного мозга, замыкающим высокие рефлекторные дуги разных уровней. Такие восходящие отростки и волокна, идущие от этих центров к нейронам спинного мозга, и составляют его белое вещество.
В суженых задних рогах располагаются вставочные нейроны, постоянно получающие информацию от чувствительных нейронов спинномозговых узлов и распределяющие ее посредством своих отростков в разных направлениях: к двигательным нейронам передних рогов с замыканием коротких рефлекторных дуг; к центрам мозгового ствола, промежуточного и конечного мозга, замыкающим высокие рефлекторные дуги разных уровней. Такие восходящие отростки и волокна, идущие от этих центров к нейронам спинного мозга, и составляют его белое вещество.
В промежуточной между передними и задними рогами зоне серого вещества расположены тела нейронов, чьи отростки входят в состав передних корешков, спинномозговых нервов, но быстро покидают нервы, направляясь в сторону внутренних органов. Они относятся к вегетативной нервной системе.
В белом веществе спинного мозга выделяют передние, боковые и задние канатики, разделенные рогами. Передние содержат преимущественно системы нисходящих волокон, задние — восходящих, боковые — те и другие.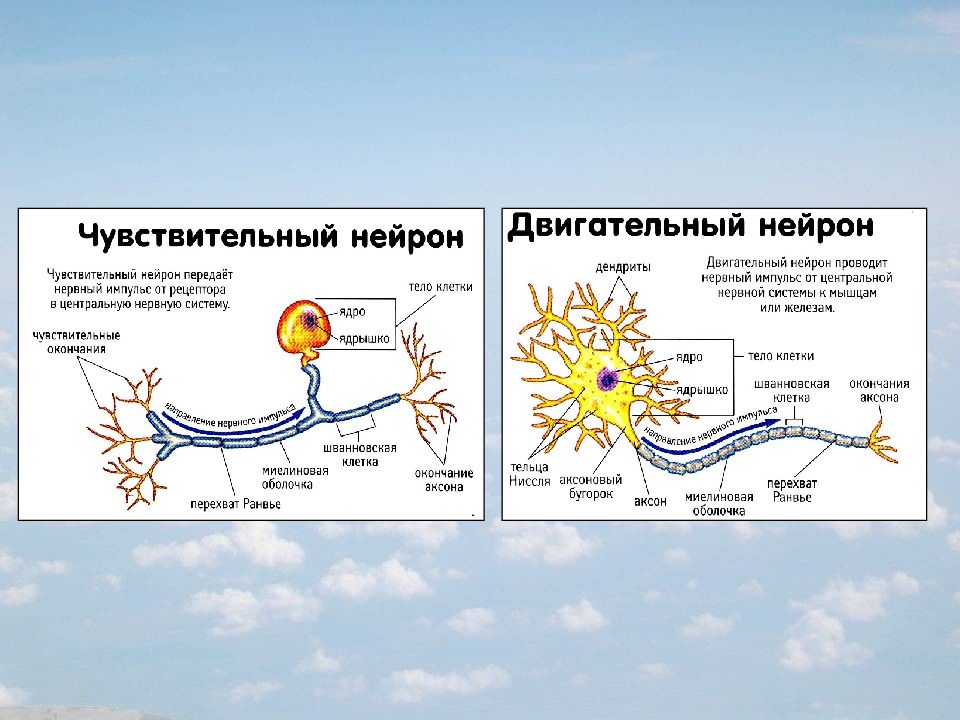
Затронутые особенности положения и функции компонентов спинного мозга позволяют врачу определять место повреждения в нервной системе.
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
https://ria.ru/20200611/1572643126.html
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как… РИА Новости, 11.06.2020
2020-06-11T08:00
2020-06-11T08:00
2020-06-11T17:00
болезнь паркинсона
наука
генетика
биология
дальний восток
здоровье
российская академия наук
воз
тайвань
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/07e4/05/0e/1571456949_0:0:1440:810_1920x0_80_0_0_67ebf7bc435b36961f201d818ef78899. jpg
jpg
МОСКВА, 11 июн — РИА Новости, Татьяна Пичугина. В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как минимум удвоится. Патология развивается незаметно долгие годы, затем быстро прогрессирует, сокращая продолжительность жизни. Этот недуг неизлечим, поэтому крайне важно диагностировать его как можно раньше.Нейроны и дофаминВ среднем мозге есть группа нейронов, богатых темным пигментом нейромеланином, — черная субстанция. Их отростки достигают других отделов мозга, в первую очередь стриатума (полосатого тела). Здесь они выделяют дофамин — сигнальную молекулу, регулирующую работу мышц. Если его синтез и обмен в норме, мышцы своевременно сокращаются и расслабляются, нет — их тонус повышен.Гибель нейронов в черной субстанции ведет к постоянной нехватке дофамина и, как следствие, тяжелому нарушению двигательной функции — болезни Паркинсона. Ее симптомы — проблемы с координацией, скованность движений, замедленность, сутулость, тремор конечностей.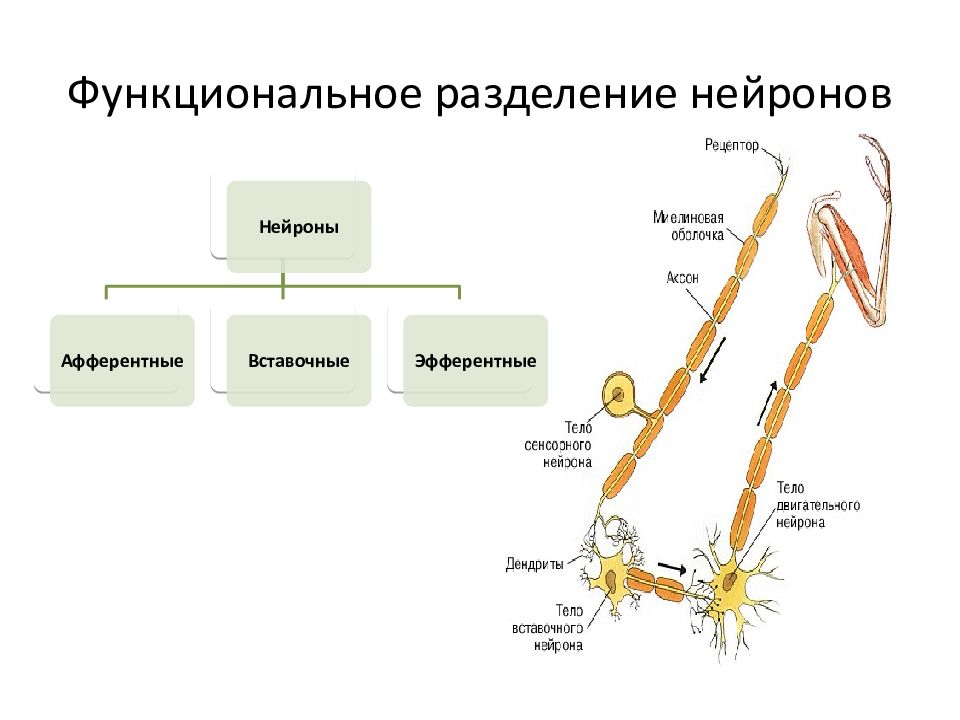 Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.Сложности ранней диагностикиНекоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.Сложности ранней диагностикиНекоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).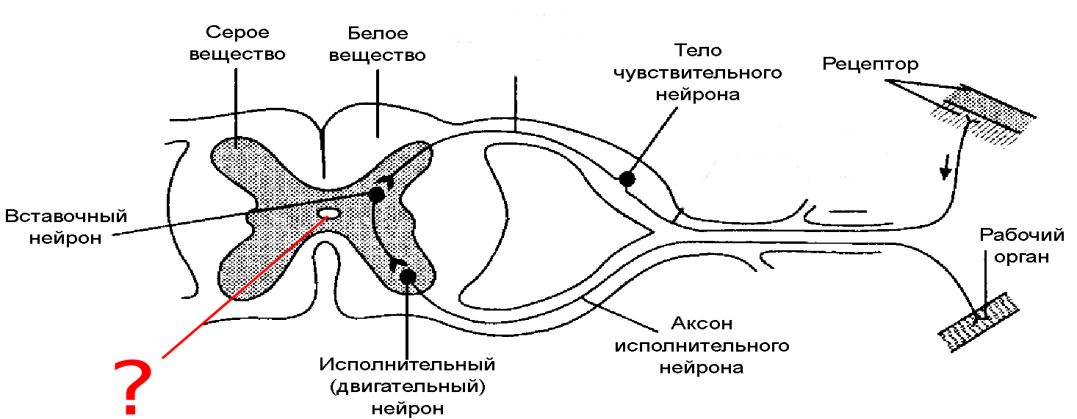 «Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений», — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.Правда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать.
«Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений», — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.Правда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать.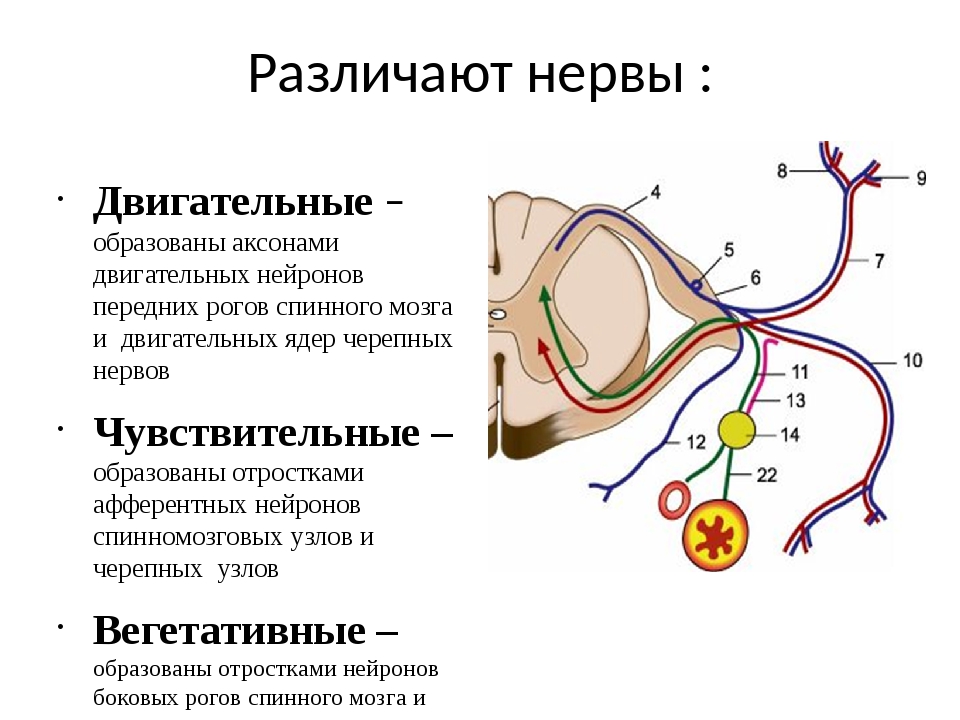 Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.»Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов», — объясняет профессор.РНК как биомаркеры «Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака», — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН.
Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.»Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов», — объясняет профессор.РНК как биомаркеры «Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака», — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН. Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.»Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина», — уточняет ученый.Расчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.»Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом «предполагаемая болезнь Паркинсона» и, через несколько месяцев, — у тех, кому диагноз подтвердили», — продолжает он.
Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.»Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина», — уточняет ученый.Расчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.»Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом «предполагаемая болезнь Паркинсона» и, через несколько месяцев, — у тех, кому диагноз подтвердили», — продолжает он.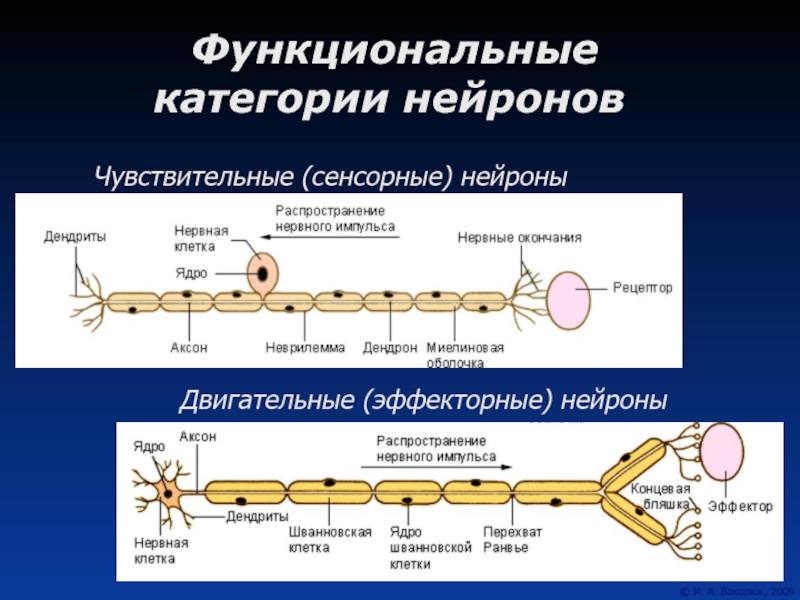 Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.Хор генетических мутацийВ мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны.
Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.Хор генетических мутацийВ мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны.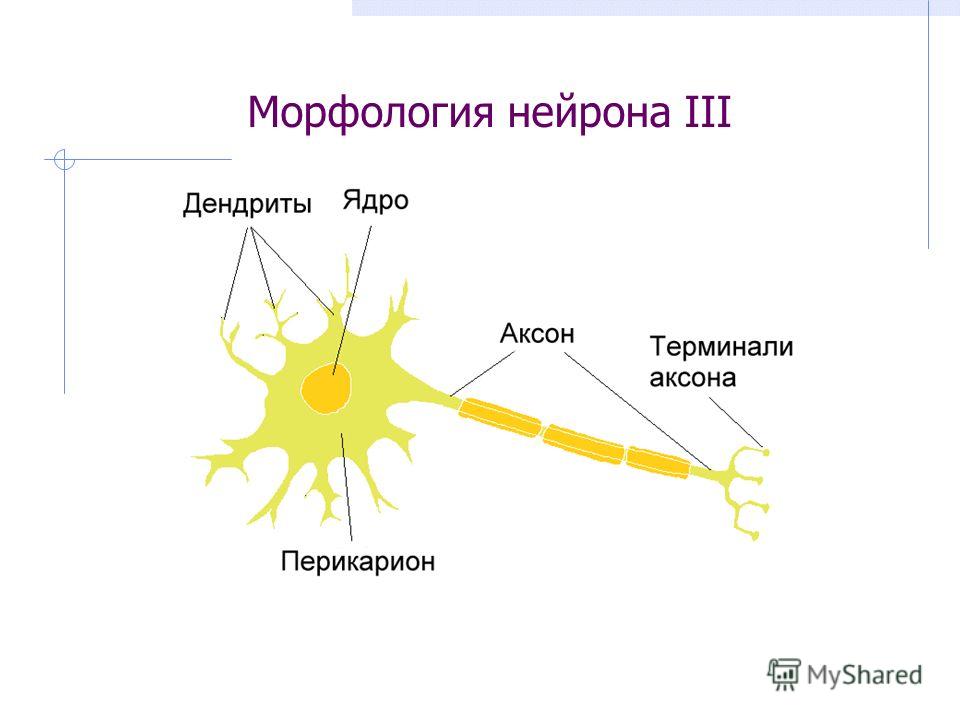 В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.»Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции».В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.»Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации», — поясняет Сломинский.Эксперимент с близнецамиСейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.»Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы», — говорит Мария Шадрина.Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.»Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть». Как растят нейроныПлюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.»Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода», — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.Нагрузочный тест»Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым», — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.»Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным», — отмечает исследователь.Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.»Есть основания считать, что эта диагностика будет специфична», — подчеркивает академик.Неудача клеточных технологийВ отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.»Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф», — вспоминает Михаил Угрюмов.На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.»Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась», — говорит ученый.В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.»Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях», — резюмирует академик.Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной. Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.»Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции».В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.»Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации», — поясняет Сломинский.Эксперимент с близнецамиСейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.»Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы», — говорит Мария Шадрина.Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.»Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть». Как растят нейроныПлюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.»Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода», — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.Нагрузочный тест»Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым», — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.»Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным», — отмечает исследователь.Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.»Есть основания считать, что эта диагностика будет специфична», — подчеркивает академик.Неудача клеточных технологийВ отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.»Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф», — вспоминает Михаил Угрюмов.На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.»Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась», — говорит ученый.В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.»Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях», — резюмирует академик.Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной. Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
https://ria.ru/20200121/1563686276.html
https://ria.ru/20180411/1518342108.html
https://ria.ru/20200605/1572536474.html
https://ria.ru/20200514/1571367164.html
https://ria.ru/20191122/1561496320.html
https://ria.ru/20200526/1572006965.html
https://ria.ru/20200112/1563266949.html
дальний восток
тайвань
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn22.img.ria.ru/images/07e4/05/0e/1571456949_180:0:1260:810_1920x0_80_0_0_abdde4f94106d6b2c6b1a05f7ecbcd11.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
болезнь паркинсона, генетика, биология, дальний восток, здоровье, российская академия наук, воз, тайвань, сша
МОСКВА, 11 июн — РИА Новости, Татьяна Пичугина. В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как минимум удвоится. Патология развивается незаметно долгие годы, затем быстро прогрессирует, сокращая продолжительность жизни. Этот недуг неизлечим, поэтому крайне важно диагностировать его как можно раньше.Нейроны и дофамин
В среднем мозге есть группа нейронов, богатых темным пигментом нейромеланином, — черная субстанция. Их отростки достигают других отделов мозга, в первую очередь стриатума (полосатого тела). Здесь они выделяют дофамин — сигнальную молекулу, регулирующую работу мышц. Если его синтез и обмен в норме, мышцы своевременно сокращаются и расслабляются, нет — их тонус повышен.
Гибель нейронов в черной субстанции ведет к постоянной нехватке дофамина и, как следствие, тяжелому нарушению двигательной функции — болезни Паркинсона. Ее симптомы — проблемы с координацией, скованность движений, замедленность, сутулость, тремор конечностей.
Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.Сложности ранней диагностики
Некоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).
Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
«Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений», — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.
21 января 2020, 18:15КультураУ Оззи Осборна диагностировали болезнь ПаркинсонаПравда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.
Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать. Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.
«Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов», — объясняет профессор.
РНК как биомаркеры
«Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака», — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН.
Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.
«Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина», — уточняет ученый.
11 апреля 2018, 08:00НаукаЛишенные «гормона счастья»: что известно о болезни ПаркинсонаРасчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.
«Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом «предполагаемая болезнь Паркинсона» и, через несколько месяцев, — у тех, кому диагноз подтвердили», — продолжает он.
Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.
Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.
5 июня 2020, 18:00НаукаУченые обосновали необходимость еще одного теста при COVID-19Хор генетических мутаций
В мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны. В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.
Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.
«Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции».
В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.
Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.
«Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации», — поясняет Сломинский.
Эксперимент с близнецами
Сейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.
«Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы», — говорит Мария Шадрина.
Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.
«Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть».
14 мая 2020, 08:00НаукаПерезагрузка организма. Как одним уколом вернуть здоровьеКак растят нейроны
Плюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.
Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.«Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода», — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.
Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.
Нагрузочный тест
«Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым», — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.
В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.
«Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным», — отмечает исследователь.
Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.
Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.
«Есть основания считать, что эта диагностика будет специфична», — подчеркивает академик.
22 ноября 2019, 23:51НаукаУченые назвали новую причину болезни ПаркинсонаНеудача клеточных технологий
В отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.
При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.
В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.
«Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф», — вспоминает Михаил Угрюмов.
На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.
26 мая 2020, 14:36НаукаУченые из стволовых клеток вырастили мозг человеческого эмбриона«Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась», — говорит ученый.
В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.
«Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях», — резюмирует академик.
Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.
Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной.
Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
12 января 2020, 08:00НаукаЕшь и умней. Какая пища нравится мозгу и от какой он страдаетХарактеристика и моделирование нейронов, чувствительных к приближению краба Neohelice
Берон де Астрада М., Томсик Д. (2002) Физиология и морфология нейронов детектора зрительного движения у краба (Decapoda: Brachyura). J Comp Physiol A 188: 539–551. https://doi.org/10.1007/s00359-002-0328-4
Артикул Google Scholar
Берон де Астрада М., Бенгочеа М., Медан В., Томсик Д. (2012) Регионализация в глазу краба-грапсида Neohelice granulata (= Chasmagnathus granulatus ): изменение разрешения и диаметров граней.J. Comp Physiol A 198: 173–180. https://doi.org/10.1007/s00359-011-0697-7
Артикул Google Scholar
Берон де Астрада М., Бенгочеа М., Штаркер Дж., Делоренси А., Томсик Д. (2013) Поведенческая нейронная пластичность в оптических долях членистоногих. Curr Biol 23: 1389–1398. https://doi.org/10.1016/j.cub.2013.05.061
Артикул PubMed Google Scholar
Borst A (1991) Зрительные интернейроны Fly, реагирующие на расширение изображения.Zool Jahrb Physiol 95: 305–313
Google Scholar
Borst A, Haag J (2002) Нейронные сети в кабине мухи. J. Comp Physiol A 188: 419–437. https://doi.org/10.1007/s00359-002-0316-8
CAS Статья Google Scholar
Dunn TW, Gebhardt C, Naumann EA, Riegler C, Ahrens MB, Engert F, Del Bene F (2016) Нейронные цепи, лежащие в основе визуально вызванных побегов у личинок рыбок данио.Нейрон 89: 613–628. https://doi.org/10.1016/j.neuron.2015.12.021
CAS Статья PubMed PubMed Central Google Scholar
Fotowat H, Gabbiani F (2011) Обнаружение столкновений как модель сенсорно-моторной интеграции. Annu Rev Neurosc 4: 1–19. https://doi.org/10.1146/annurev-neuro-061010-113632
Артикул Google Scholar
Fotowat H, Harrison R, Gabbiani F (2011) Мультиплексирование моторной информации в разряде нейрона, обнаруживающего столкновения, во время поведения побега.Нейрон 69: 147–158. https://doi.org/10.1016/j.neuron.2010.12.007
CAS Статья PubMed PubMed Central Google Scholar
Габбиани Ф., Крапп Х. Г., Лоран Дж. (1999) Вычисление приближения к объекту с помощью широкого поля, чувствительного к движению нейрона. J Neurosci 19: 1122–1141
CAS Статья PubMed Google Scholar
Gabbiani F, Krapp HG, Koch C, Laurent G (2002) Мультипликативные вычисления в визуальном нейроне, чувствительном к приближению.Природа 21: 320–324. https://doi.org/10.1038/nature01190
Артикул Google Scholar
Glantz RM (1974) Защитный рефлекс и реакция детектора движения на приближающиеся цели: детектор движения запускает путь защитного рефлекса. J Comp Physiol 95: 297–314
Статья Google Scholar
Gray JR, Blincow E, Robertson RM (2010) Пара чувствительных к движению нейронов саранчи кодирует приближение надвигающегося объекта.J. Comp Physiol A 196: 927–938. https://doi.org/10.1007/s00359-010-0576-7
Артикул Google Scholar
Хемми Дж. М., Томсик Д. (2012) Нейроэтология бегства крабов: от сенсорной экологии к нейронам и обратно. Curr Opin Neurobiol 22: 194–200. https://doi.org/10.1016/j.conb.2011.11.012
CAS Статья PubMed Google Scholar
Horseman BG, Macauley MW, Barnes WJP (2011) Нейронная обработка поступательного оптического потока в зрительной системе берегового краба Carcinus maenas .J Exp Biol 214 (9): 1586–1598
Статья PubMed Google Scholar
Jones PW, Gabbiani F (2010) Синхронизированный нейронный ввод формирует избирательность стимула в нейроне, обнаруживающем столкновения. Curr Biol 20 (22): 2052–2057
CAS Статья PubMed PubMed Central Google Scholar
Jones PW, Gabbiani F (2012) Логарифмическое сжатие сенсорных сигналов в дендритном дереве нейрона, чувствительного к столкновениям.J Neurosci 32 (14): 4923–4934
CAS Статья PubMed PubMed Central Google Scholar
Костаракос К., Хедвиг Б. (2017) Поверхностные электроды записывают и маркируют нейроны мозга у насекомых. J Neurophysiol. https://doi.org/10.1152/jn.00490.2017
PubMed Google Scholar
Krapp HG, Gabbiani F (2005) Пространственное распределение входных сигналов и свойства локального рецептивного поля широкопольного, вырисовывающегося чувствительного нейрона.J Neurophysiol 93: 2240–2253. https://doi.org/10.1152/jn.00965.2004
Артикул PubMed Google Scholar
Krapp HG, Hengstenberg R (1996) Оценка самодвижения путем обработки оптического потока в отдельных визуальных интернейронах. Nature 384: 463–466. https://doi.org/10.1038/384463a0
CAS Статья PubMed Google Scholar
Лоран Дж., Габбиани Ф. (1998) Предотвращение столкновений: множество решений природы.Nat Neurosci 1: 261–263
CAS Статья PubMed Google Scholar
Медан В., Олива Д., Томсик Д. (2007) Характеристика лобулярных гигантских нейронов, реагирующих на зрительные стимулы, которые вызывают реакции бегства у краба Chasmagnathus . J Neurophys 98: 2414–2428. https://doi.org/10.1152/jn.00803.2007
Артикул Google Scholar
Нельсон Р.К., Алоимонос Дж. (1988) Определение параметров движения из сферических полей движения (или преимущества наличия глаз на затылке).Biol Cybern 58: 261–273
CAS Статья PubMed Google Scholar
Nilsson DE, Osorio D (1998) Гомология и параллелизм в сенсорной обработке членистоногих. Отношения членистоногих. Спрингер, Нидерланды, стр. 333–347
Google Scholar
O’Shea M, Rowell CHF (1975) Защита от привыкания посредством бокового торможения. Nature 254: 53–55
Статья PubMed Google Scholar
Oliva D (2015) Модели предотвращения столкновений с визуальным управлением.В: Jaeger D, Jung R (eds) Энциклопедия вычислительной нейробиологии. Springer-Verlag, Berlin Heidelberg, стр. 626–645
Google Scholar
Олива Д., Томсик Д. (2014) Расчет приближения к объекту с помощью системы зрительных нейронов, чувствительных к движению, в крабе Neohelice . J Neurophysiol 112: 1477–1490. https://doi.org/10.1152/jn.00921.2013
Артикул PubMed Google Scholar
Олива Д., Томсик Д. (2016) Вычисление подхода к объекту гигантским нейроном и его связь со скоростью побега у краба Neohelice .J Exp Biol 219: 3339–3352. https://doi.org/10.1242/jeb.136820
Артикул PubMed Google Scholar
Олива Д., Медан В., Томсик Д. (2007) Поведение к побегу и нейронные реакции на надвигающиеся стимулы у краба Chasmagnathus granulatus (Decapoda: Grapsidae). J Exp Biol 210: 865–880. https://doi.org/10.1242/jeb.02707
Артикул PubMed Google Scholar
Перон С.П., Габбиани Ф. (2009) Адаптация частоты всплесков опосредует надвигающуюся избирательность стимула в нейроне, обнаруживающем столкновения.Nat Neurosci 12: 318–326. https://doi.org/10.1038/nn.2259
CAS Статья PubMed PubMed Central Google Scholar
Preuss T, Osei-Bonsu PE, Weiss SA, Wang C, Faber DS (2006) Нейронное представление объектного подхода в моторной схеме принятия решений. J Neurosci 26: 3454–3464. https://doi.org/10.1523/JNEUROSCI.5259-05.2006
CAS Статья PubMed Google Scholar
Quian Quiroga R (2007) Сортировка шипов.Академия наук 2 (12): 3583. https://doi.org/10.4249/scholarpedia.3583
Артикул Google Scholar
Quiroga RQ, Nadasdy Z, Ben-Shaul Y (2004) Неконтролируемое обнаружение и сортировка всплесков с помощью вейвлетов и суперпарамагнитной кластеризации. Нейронные вычисления 16: 1661–1687. https://doi.org/10.1162/089976604774201631
Артикул PubMed Google Scholar
Rind FC, Bramwell DI (1996) Нейронная сеть, основанная на входной организации идентифицированного нейрона, сигнализирующего о приближающемся столкновении.J Neurophysiol 75: 967–985
CAS Статья PubMed Google Scholar
Ринд Ф.К., Симмонс П.Дж. (1992) Нейрон ортоптерановых DCMD: переоценка ответов на движущиеся объекты. I. Выборочные реакции на приближающиеся объекты. J Neurophysiol 68: 1654–1666
CAS Статья PubMed Google Scholar
Ринд Ф.К., Симмонс П.Дж. (1999) Видя, что грядет: построение нейронов, чувствительных к столкновениям.Trends Neurosci 22: 215–20
CAS Статья PubMed Google Scholar
Rind FC, Wernitznig S, Pölt P, Zankel A, Gütl D, Sztarker J, Leitinger G (2016) Два идентифицированных надвигающихся детектора у саранчи: повсеместные боковые связи между их входами способствуют избирательной реакции на надвигающиеся объекты. Sci Rep 6: 35525. https://doi.org/10.1038/srep35525
CAS Статья PubMed PubMed Central Google Scholar
Rosner R, Homberg U (2013) Широко распространенная чувствительность к надвигающимся стимулам и небольшим движущимся объектам в центральном комплексе мозга насекомого.J Neurosci 33 (19): 8122–8133
CAS Статья PubMed Google Scholar
Роуэлл К.Ф., О’Ши М., Уильямс Дж.Л. (1977) Нейронная основа сенсорного анализатора, системы детектора движения саранчи. IV. Предпочтение стимулов небольшого поля. J Exp Biol 68: 157–185
Google Scholar
Santer RD, Yamawaki Y, Rind FC, Simmons PJ (2008) Подготовка к побегу: исследование роли нейрона DCMD в прыжках саранчи при побеге.J Comp Physiol A 194: 69–77. https://doi.org/10.1007/s00359-007-0289-8
Артикул Google Scholar
Сринивасан М.В., Чжан С. (2004) Визуальные двигательные вычисления у насекомых. Анну Рев Neurosci 27: 679–696. https://doi.org/10.1146/annurev.neuro.27.070203.144343
CAS Статья PubMed Google Scholar
Strausfeld NJ (2005) Эволюция зрительных долей ракообразных и насекомых и происхождение хиазм.Arthropod Struct Dev 34: 235–256
Статья Google Scholar
Sztarker J, Strausfeld NJ, Tomsic D (2005) Организация оптических лепестков, которые поддерживают обнаружение движения у полуземного краба. J Comp Neurol 493: 396–411. https://doi.org/10.1002/cne.20755
Артикул PubMed PubMed Central Google Scholar
Томсик Д., Штаркер Дж., Берон де Астрада М.Б., Олива Д., Ланца Э. (2017) Поведение крабов в качестве хищников и жертв: от экологии до нейронных адаптаций.J Exp Biol 220 (13): 2318–2327
Статья PubMed Google Scholar
Ван И, Фрост Б.Дж. (1992) Время до столкновения сигнализируется нейронами круглого ядра голубей. Природа 356: 236–238. https://doi.org/10.1038/356236a0
CAS Статья PubMed Google Scholar
Вассерман Л. (2004) Вся статистика: краткий курс статистических выводов.Спрингер, Нью-Йорк
Бронировать Google Scholar
Wild J, Prekopcsak Z, Sieger T, Novak D, Jech R (2012) Сравнение производительности алгоритмов внеклеточной сортировки спайков для одноканальных записей. J Neurosci Methods 203: 369–376. https://doi.org/10.1016/j.jneumeth.2011.10.013
Артикул PubMed Google Scholar
Yamawaki Y, Toh Y (2009) Ответы нисходящих нейронов на надвигающиеся стимулы у богомола Tenodera aridifolia .J Comp Physiol A 195: 253–264. https://doi.org/10.1007/s00359-008-0403-6
Артикул Google Scholar
Границы | Программирование стрессочувствительных нейронов и цепей на основе опыта ранней жизни
Введение
Истоки психических заболеваний лежат в раннем возрасте (Kessler et al., 2005; Insel, 2009). Генетические факторы и опыт ранних лет жизни, как неблагоприятные, так и благоприятные, взаимодействуют, чтобы модулировать уязвимость и сопротивляемость болезням (Insel, 2009; Bale et al., 2010; Fox et al., 2010; Гуннар, 2010; Juul et al., 2011; Бэйл, 2015). В настоящее время имеется большое количество свидетельств того, что у людей невзгоды в раннем детстве связываются с эмоциональными и когнитивными расстройствами в более позднем возрасте (например, Bremner et al., 1993; Brown et al., 1995; Kaplan et al., 2001; Eriksson et al. ., 2014). Для выяснения причинно-следственных и механистических взаимосвязей между ранним жизненным опытом и более поздним психическим здоровьем были использованы модели приматов (Koch et al., 2014; Wakeford et al., 2018) и грызунов, в частности, парадигмы неблагоприятного vs.оптимальный опыт ранней жизни, который вызывает когнитивные и эмоциональные изменения, имеющие отношение к здоровью человека (Weaver et al., 2004; Molet et al., 2014; Chen and Baram, 2016; Krugers et al., 2017; Walker et al., 2017) ; van Bodegom et al., 2017). Здесь мы обсуждаем эти модели на животных и предоставляем новую информацию о двух основных категориях изменений в развитии мозга, которые лежат в основе риска и устойчивости к психическим расстройствам: (1) развитие контуров; и (2) эпигенетические изменения, а также их механизмы.
Проблемы раннего возраста
Экспериментальные модельные исследования вместе с исследованиями на людях показали, что материнский вклад, возможно, оказывает наиболее значительное влияние на окружающую среду в процессе развития (Bowlby, 1950; Seay et al., 1962; Барам и др., 2012; Ринкон-Кортес и Салливан, 2014 г .; Кундакович и Шампанское, 2015). Таким образом, большинство животных моделей неблагоприятных условий ранней жизни манипулировали взаимодействием матери с детенышами, нарушая количество или качество материнской помощи в раннем возрасте (последние обзоры см. В Molet et al., 2014; Walker et al., 2017; van Bodegom. и др., 2017). Обычно это связано с разлучением с матерью или симулированной бедностью; в этой перспективе мы сосредоточимся на последнем. Для имитации бедности использование гнезд и подстилочных материалов в клетке ограничено (ограниченная подстилка и гнездование: LBN) в послеродовые дни (P) 2–9 (Рисунки 1A, B; Gilles et al., 1996; Molet et al., 2014; Naninck et al., 2014). Эта манипуляция надежно и воспроизводимо вызывает фрагментированное и непредсказуемое поведение матери по отношению к щенкам (Molet et al., 2016a). Примечательно, что общая продолжительность или качество ухода за плотинами изменяются минимально; нарушаются модели материнской заботы (Ivy et al., 2008; Rice et al., 2008; Molet et al., 2016a; Walker et al., 2017). Эта фрагментированная материнская забота вызывает у детенышей хронический, непредсказуемый и неконтролируемый «эмоциональный стресс» (Gilles et al., 1996; Ivy et al., 2008; Райс и др., 2008; Морисо и др., 2009; Wang et al., 2011; Molet et al., 2014; Naninck et al., 2014). Стресс проявляется в стойком повышении уровня кортикостерона в плазме и гипертрофии надпочечников и связан с эмоциональными и когнитивными проблемами во взрослом возрасте (Brunson et al., 2005; Rice et al., 2008; Molet et al., 2016b). Примечательно, что дети, которые переживают невзгоды в раннем возрасте, имеют повышенный риск развития аналогичных трудностей, таких как дефицит памяти, проблемы с самоконтролем и интернализующие расстройства (Davis et al., 2017; Glynn et al., 2018).
Рисунок 1 . Ограниченная подстилка и гнездование не вызывают переохлаждения и не изменяют термогенез коричневой жировой ткани (BAT). (A, B) Фотографии стандартных клеток (Control; A ) и клеток с ограниченной подстилкой и гнездованием (LBN) (B) . (C, D) Core (ректальные) температуры не различаются в начале опыта LBN на P2 (C) или в конце опыта LBN на P9 / 10 ( D ; t — тест, p > 0.1). Данные представляют собой среднее значение ± стандартная ошибка среднего; n = 21–33 / группа. (E) Общий влажный вес BAT (подлопаточное депо) не различается между группами, независимо от того, нормализованы ли данные по массе тела ( t -тест, p> 0,1). Данные здесь нормализованы к средней массе тела ± SEM; n = 4 / группа. (F) Температура ядра не различается в зависимости от условий клетки на исходном уровне на P9 / 10 или через 5 минут после начала холодового стресса. Холодовой стресс состоял из 5 минут при 4 ° C с последующим немедленным измерением внутренней температуры.Данные представляют собой среднее значение ± стандартная ошибка среднего; n = 10 / группа. Нет значимых межгрупповых различий по данным двухфакторного дисперсионного анализа с повторными измерениями; p > 0,1; значительный эффект времени внутри субъектов, F (1,18) = 11,01, * p <0,005. Обратите внимание, что данные по щенкам мужского и женского пола здесь объединены из-за отсутствия половых различий.
Разработка схем
В соответствии с поведенческими дефицитами, невзгоды в раннем периоде жизни связаны с нарушениями связи мозга у людей, как явствует из исследований нейровизуализации (Posner et al., 2016; Fareri et al., 2017; Копала-Сибли и др., 2018). Нейровизуализация у грызунов выявила усиление структурной связи между медиальной префронтальной корой и миндалевидным телом у подростков самцов крыс LBN в связи с поведением, подобным ангедонии (Bolton et al., 2018a). Однако функциональная связь миндалевидного тела с медиальной префронтальной корой в состоянии покоя снижена у самцов крыс LBN до отъема и во взрослом возрасте. Это было интерпретировано как предположение, что активация миндалины новорожденных может ускорять созревание миндалины до проекций префронтальной коры и влиять на функциональную целостность таких связей (Guadagno et al., 2018). Очевидно, необходимы дополнительные исследования, чтобы понять, как невзгоды в раннем периоде жизни влияют на связь миндалевидного тела и коры головного мозга.
В экспериментальных моделях, помимо нейровизуализации, можно напрямую оценить синаптические связи с помощью нейроанатомических исследований. Например, невзгоды в раннем возрасте вызывают усиление возбуждающих связей с нейронами, экспрессирующими кортикотропин-рилизинг-гормон (CRH), в паравентрикулярном ядре гипоталамуса (PVH; Gunn et al., 2013). Эти нейроны играют решающую роль в реакции на стресс (Deussing and Chen, 2018), и, таким образом, их повышенная возбуждающая иннервация может способствовать длительной реакции на стресс у животных с LBN (Gilles et al., 1996). Напротив, области гиппокампа демонстрируют сниженное дендритное разветвление и синаптические связи у крыс LBN, что было связано с дефицитом памяти, вызванным невзгодами, на протяжении всей жизни (Brunson et al., 2005; Ivy et al., 2010; Molet et al., 2016b). Таким образом, влияние неблагоприятных факторов в раннем возрасте зависит от области мозга.
Важно отметить, что специфические последствия, связанные со стрессом, никогда не возникают исключительно из-за одного-единственного нейропептида, а скорее связаны с комбинированным взаимодействием множества различных нейротрансмиттерных и / или нейропептидных систем.Например, окситоцин — это нейропептид гипоталамуса, который был задействован в качестве ключевой молекулы в регуляции страха и беспокойства, и было показано, что он влияет на другие системы нейротрансмиттеров. В частности, невзгоды в раннем возрасте могут влиять на экспрессию рецепторов окситоцина у взрослых животных (Neumann and Slattery, 2016), и было показано, что окситоцин регулирует экспрессию CRH в PVN (Jurek et al., 2015). Здесь, из-за ограниченности этой точки зрения, мы фокусируемся в первую очередь на программировании нейронов CRH на основе опыта ранней жизни.
Эпигенетические изменения
Долговременные фенотипические изменения, возникающие в результате невзгод в раннем возрасте, включают стойкие изменения в экспрессии важных нейрональных генов. Большой объем работ показал, что невзгоды в раннем возрасте связаны с транскрипционными изменениями как у людей (Heim, Binder, 2012; Suderman et al., 2014; Schwaiger et al., 2016), так и с различными моделями грызунов (McClelland et al. ., 2011; Russo et al., 2012; Lucassen et al., 2013; Nestler, 2014; Szyf et al., 2016; Деуссинг и Яковцевски, 2017; Пенья и др., 2017; Росс и др., 2017; Gray et al., 2018). Большая часть литературы сосредоточена на генах и семействах генов, непосредственно связанных со стрессом, таких как рецептор глюкокортикоидов (GR; Weaver et al., 2004; Gray et al., 2017). Неблагоприятные факторы в раннем возрасте снижают экспрессию GR в PVN и лобной коре у LBN крыс (Avishai-Eliner et al., 2001), что приводит к изменению отрицательной обратной связи по глюкокортикоидам. Сообщается об изменениях не только в GR, но и в Fkbp5.Fkbp5 — это ко-шаперонный белок, который связывается с цитозольным GR в его неактивном состоянии, тем самым ингибируя транслокацию и функцию GR. Генетический полиморфизм Fkbp5 у людей опосредует ген за счет взаимодействия окружающей среды жестокого обращения в детстве и тяжести симптомов посттравматического стрессового расстройства в более позднем возрасте (Segman et al., 2005; Binder et al., 2008; Yehuda et al., 2009). В частности, аллели, связанные с большей экспрессией или функцией Fkbp5, которые, как считается, приводят к гиперчувствительности GR, связаны с большей уязвимостью к симптомам ПТСР после жестокого обращения в детстве (Binder et al., 2008).
CRH — ключевой нейрональный ген, связанный со стрессом, который, как было показано, регулируется невзгодами раннего возраста. Сразу после неблагоприятных исходов в раннем возрасте уровни CRH в PVN снижаются у LBN крыс и мышей (Avishai-Eliner et al., 2001; Rice et al., 2008), вероятно, в результате истощения запасов CRH из-за усиленного высвобождения. пептида в неблагоприятный период (Ma and Lightman, 1998). За последнее десятилетие была установлена экспрессия и функция CRH в областях мозга за пределами PVN (Chen et al., 2001; Регев и др., 2011, 2012; Деуссинг и Чен, 2018). Примечательно, что неблагоприятные факторы в раннем возрасте влияют на экспрессию CRH в некоторых из этих регионов. CRH активируется в центральном ядре миндалины (ACe; Dubé et al., 2015) и гиппокампе крыс LBN (Brunson et al., 2001; Ivy et al., 2010). CRH необходим для нормальной обрезки и уточнения дендритных деревьев и синапсов (Chen et al., 2004). Кроме того, чрезмерные уровни CRH были связаны с аберрантной структурой и функцией нейронов (Chen et al., 2004; Ivy et al., 2010; Curran et al., 2017; Ганн и Барам, 2017).
Ранние вызванные невзгодами изменения в экспрессии генов могут длиться всю жизнь из-за эпигенетических процессов с участием главных регуляторов, таких как GR (Joëls and Baram, 2009; Schmidt et al., 2013; McEwen et al., 2016; Gray et al., 2017). ; van Bodegom et al., 2017). GR действует как фактор транскрипции вместе с несколькими взаимодействующими белками (Binder, 2009; Klengel and Binder, 2015; Xu et al., 2017; Ke et al., 2018), чтобы модулировать экспрессию генов в долгосрочной перспективе и влиять на функцию нейронов (Daskalakis et al., 2018). al., 2015). Примечательно, что недавние механистические исследования с использованием LBN (Arp et al., 2016; Lesuis et al., 2018) или материнской депривации (Loi et al., 2017) прямо подтвердили ключевую роль GR в опосредовании эффектов раннего возраста. неблагоприятное воздействие на длительную работу мозга.
В дополнение к GR, наша недавняя работа выявила неожиданный регулятор долгосрочных изменений в экспрессии генов, спровоцированный невзгодами ранней жизни, — фактор рестриктивного сайленсера нейронов репрессора транскрипции (NRSF; Schulmann et al., 2018). Давно известно, что этот фактор транскрипции регулирует экспрессию CRH (Seth and Majzoub, 2001). Недавно RNA-seq обнаружил изменения транскриптома в дорсальном гиппокампе крыс LBN; как ни удивительно, регуляция большинства генов была подавлена. Предварительный анализ обогащения мишеней выявил GR и NRSF как основные регуляторы изменений генов, и в частности, NRSF был преимущественно обогащен среди подавленных нейронных генов. Примечательно, что ингибирование связывания NRSF с хроматином через интрацеребровентрикулярное соединение (т.е.c.v.) — вводимые олигодезоксинуклеотиды-ловушки вскоре после ранних невзгод предотвращали развитие когнитивных нарушений у крыс LBN (Schulmann et al., 2018). Таким образом, эти данные указывают на участие NRSF-регулируемых генных сетей в организованных транскрипционных программах, необходимых для созревания сетей пространственной памяти, а также в неадаптивном молчании ключевых нейронных генов после невзгод раннего периода жизни.
Оптимальный опыт ранней жизни
Важные биологические явления имеют целый спектр.Если непредсказуемая материнская забота вызывает долгосрочную уязвимость, тогда весьма предсказуемые паттерны сенсорных сигналов, поступающих от матери к развивающемуся мозгу, должны способствовать долгосрочному когнитивному и эмоциональному сопротивлению. Животные модели оптимального, предсказуемого опыта ранней жизни, хотя и не так широко изучены, включают те, которые применяют парадигму манипуляции, выдвинутую Левином и его коллегами (Levine, 1957; Plotsky and Meaney, 1993; Francis and Meaney, 1999; Korosi and Baram, 2009 г.). Это включает кратковременное (15 минут) ежедневное отделение крысят от матери в течение первых недель жизни.Выбор времени для этих приступов разлуки имеет решающее значение, и кратковременные разлуки будут способствовать усилению предсказуемой сенсорной информации (например, облизывания и ухода) у щенков после воссоединения с их матерями (Liu et al., 1997; Fenoglio et al., 2006; Корози и др., 2010). Периодические предсказуемые материнские сигналы приводят к повышению устойчивости к депрессивному и тревожному поведению, а также к улучшению обучения и памяти (Weaver et al., 2004; Fenoglio et al., 2005, 2006; Champagne, 2008; Korosi and Baram, 2009; Корози и др., 2010; Сингх-Тейлор и др., 2018). Механизмы, с помощью которых манипуляция улучшает эмоциональные и когнитивные результаты, полностью не изучены. Самого по себе разлучения щенков с матерями недостаточно. Кроме того, одного дня обращения или повторного, но нерегулярного обращения недостаточно для достижения молекулярных и поведенческих результатов (Fenoglio et al., 2006). Таким образом, кажется, что повторяющиеся и предсказуемые приступы материнской заботы, происходящие после коротких разлук (обычно в той же циркадной фазе), вызывают структурные и функциональные изменения мозга, которые способствуют устойчивости (Fenoglio et al., 2006; Карстен и Барам, 2013; Davis et al., 2017).
Разработка схем
Поведенческая устойчивость может быть результатом влияния оптимального опыта в раннем возрасте на созревание цепей, связанных со стрессом. Напр., Предсказуемая материнская забота приводит к уменьшению возбуждающих синапсов на нейроны CRH в PVN — полная противоположность эффекта непредсказуемой материнской заботы, описанного выше (Korosi et al., 2010). Это снижение синаптической иннервации было связано с уменьшением частоты возбуждающих синаптических токов на нейроны CRH в PVN, что согласуется с наблюдаемым в более позднем возрасте снижением чувствительности к стрессу (Korosi et al., 2010; Сингх-Тейлор и др., 2018). Расширенная материнская забота еще больше изменила развитие других нервных систем. Например, постнатальная сборка предвегетативных эмоциональных моторных цепей, таких как кортикальные и лимбические проекции от ядра ложа концевой полоски (BNST), ACe и висцеральной коры до вегетативных ядер, была снижена у животных, испытывающих неонатальное обращение (Card et al. ., 2005). Напротив, в гиппокампе пирамидные нейроны обладали большей плотностью шипов и сложностью дендритов, а также повышенной функциональной синаптической пластичностью у крыс, которым была оказана повышенная материнская забота (Champagne et al., 2008). Этот результат контрастирует с обедненными дендритными деревьями у крыс, которые испытали фрагментированный, непредсказуемый материнский уход (Brunson et al., 2005; Ivy et al., 2010; Molet et al., 2016b).
Эпигенетические изменения
Долгосрочные изменения в экспрессии генов могут лежать в основе устойчивости, наблюдаемой после оптимального опыта в раннем возрасте. Например, в гиппокампе плотность GR была увеличена у взрослых крыс, которые пережили неонатальное манипулирование (Meaney et al., 1985; Liu et al., 1997).В PVN основным изменением, вызванным усиленной, предсказуемой заботой о матери, было снижение экспрессии CRH на P9 до изменения GR (Plotsky and Meaney, 1993; Liu et al., 1997; Fenoglio et al., 2004, 2005). Механистические исследования показали, что снижения возбуждающей нейротрансмиссии на нейроны PVN CRH достаточно для уменьшения экспрессии CRH среди других важных нейрональных генов, связанных с синаптической функцией (Singh-Taylor et al., 2018). Эти изменения в экспрессии генов после оптимального опыта в раннем возрасте могут поддерживаться в течение длительного времени с помощью эпигенетических механизмов.Крупномасштабные изменения в репрессивных модификациях гистонов нейронных генов, таких как CRH, были инициированы усилением функции репрессора транскрипции, NRSF (Singh-Taylor et al., 2018), того же фактора транскрипции, который участвует в программировании когнитивных уязвимостей, вызванных LBN. (Schulmann et al., 2018). Эти результаты обеспечивают причинную связь между неонатальным опытом, улучшением синапсов и индукцией эпигенетических процессов в определенных популяциях нейронов.
Как невзгоды в раннем возрасте влияют на созревание мозга?
Неблагоприятные исходы в раннем возрасте состоят как из физических, так и из эмоциональных компонентов.Физический стресс может включать голод или холод, тогда как эмоциональные аспекты могут включать отсутствие или плохую заботу со стороны стрессированного родителя. У людей относительная важность эмоциональных невзгод становится очевидной при сравнении результатов в развивающихся странах, где бедность почти универсальна, но структура семьи стабильна и благоприятна, с результатами в анклавах с низким социально-экономическим статусом в развитых странах (Hackman et al., 2010; Crookston et al., 2014; Agidew, Singh, 2018). Напротив, в детских домах, где физическое благополучие (т.е., питание, кров) сохраняется, но родительская забота отсутствует (и забота в целом недостаточна), эмоциональные и когнитивные результаты детей-сирот крайне недостаточны (Pollak et al., 2010; Nelson et al., 2011). Оба этих сценария указывают на то, что траектории психического здоровья формируются не физическими, а в значительной степени эмоциональными невзгодами.
В нашей животной модели невзгод в раннем возрасте мы стремились различить относительную роль физических и эмоциональных невзгод в результатах, описанных выше.Физический стресс явно присутствует в парадигме (т. Е. Повышенный уровень кортикостерона, увеличение веса надпочечников; Brunson et al., 2005; Rice et al., 2008). Однако другие возможные меры физического стресса отсутствуют. Например, холодовой стресс не проявляется: щенки не испытывают переохлаждения в клетках LBN. Внутренние температуры контрольных детенышей и детенышей LBN неотличимы во многих временных точках в течение P2-10 (Рисунки 1C, D). Чтобы рассмотреть возможность того, что детеныши LBN могут задействовать свои запасы коричневой жировой ткани (BAT) для поддержания внутренней температуры и предотвращения переохлаждения, мы оценили количество и использование коричневого жира.Данные не подтверждают эту гипотезу: тест термогенеза активации BAT (Dawkins and Hull, 1964; Himms-Hagen, 1990; Akana and Dallman, 1997) не выявил каких-либо различий между группами, а общий вес BAT не отличался от LBN. условия (рисунки 1E, F). Этот результат не был удивительным, потому что общее время, которое мать проводит со своими детенышами, сопоставимо в клетках с моделируемой бедностью (LBN) и клетках с полным комплектом подстилки и гнездового материала (Molet et al., 2016a). Напротив, структура материнской заботы изменилась, и помощь стала фрагментированной и непредсказуемой.Таким образом, вероятно, что эти хаотические материнские сенсорные сигналы развивающемуся мозгу в течение чувствительного периода провоцируют неблагоприятные исходы (Baram et al., 2012; Chen and Baram, 2016; Davis et al., 2017; Walker et al., 2017). .
Как оптимальный опыт ранней жизни влияет на созревание мозга?
Переживания, способствующие устойчивости, такие как предсказуемые, повторяющиеся материнские сенсорные сигналы, задействуют связанные с эмоциями контуры. Активация Fos ACe и BNST, расположенных перед нейронами PVN CRH, была отмечена после однократной обработки и усиленного ухода за матерью, но этого было недостаточно для подавления экспрессии CRH в PVN (Fenoglio et al., 2006). Примечательно, что в течение недели повторяющихся ежедневных приступов расширенного ухода за матерью активировались ACe и BNST, а также паравентрикулярное ядро таламуса (PVT). PVT считается центром «памяти о стрессе» мозга (Bhatnagar and Dallman, 1998; Bhatnagar et al., 2000). Этот комбинированный выход в нейроны PVN CRH в сочетании с повторяющимся обращением приводит к стойкому подавлению экспрессии CRH в этих нейронах (Fenoglio et al., 2006; Karsten and Baram, 2013). Поскольку нейроны, которые «срабатывают вместе, соединяются вместе», вполне вероятно, что эти дифференциальные паттерны активации нейронных сетей влияют на развитие цепей, связанных с эмоциями, и лежат в основе долгосрочной устойчивости в результате предсказуемых материнских сенсорных сигналов.
Хотя в этом контексте менее изучены, схемы вознаграждения / удовольствия могут быть задействованы посредством опыта, способствующего устойчивости. Примечательно, что есть свидетельства того, что предсказуемая последовательность событий активирует систему вознаграждения (Berns et al., 2001; Rutledge et al., 2014). Дофаминергическая система вознаграждения не полностью развита до третьей постнатальной недели у грызунов (Voorn et al., 1988) и чувствительна к изменениям в раннем жизненном опыте (Ventura et al., 2013; Peña et al., 2014). Таким образом, по аналогии с модуляцией развития зрительных, слуховых и моторных цепей с помощью визуальных, слуховых и сенсорных сигналов, мы предполагаем, что предсказуемые модели материнской заботы дают важные сигналы для созревания системы вознаграждения / удовольствия.И наоборот, непредсказуемая и фрагментированная материнская забота может привести к неправильному созреванию схемы вознаграждения / удовольствия. В подтверждение этого предположения было показано, что LBN провоцирует ангедонию, проявляющуюся в снижении предпочтения сахарозы, игр со сверстниками и тяги к кокаину у самцов крыс-подростков, что сопровождается аберрантной связью между областями мозга, связанными со стрессом и вознаграждением (Bolton et al., 2018а, б; рисунки 2А, Б). В свою очередь, предварительные данные предполагают, что предсказуемая периодическая забота о матери приводит к усилению игры со сверстниками у крыс-самцов-подростков (рис. 2С).Таким образом, паттерны материнских сенсорных сигналов могут оказывать двунаправленное влияние на созревание системы вознаграждения / удовольствия — гипотеза, которая требует дальнейшего изучения.
Рисунок 2 . Опыт ранней жизни двунаправленно модулирует игровое поведение сверстников. (A) Схема примерной позы крысы во время игры со сверстниками, известной как закрепление. Общая продолжительность игры, представленная на диаграмме (B, C) , состоит из суммированной продолжительности в секундах всех игровых действий, в том числе захвата, ударов, преследования / преследования, бокса и пинков, которые выполняет самец экспериментальной крысы позднего подросткового возраста под руководством к молодому сородичу того же пола во время 10-минутного теста социального взаимодействия в открытом поле. (B) Фрагментированная, непредсказуемая материнская забота (LBN) провоцирует ангедонию, показанную здесь как снижение уровня игры сверстников в тесте социального взаимодействия. Данные представляют собой среднее значение ± стандартная ошибка среднего; n = 5 / группа; t -тест с поправкой Велча на неравную дисперсию, t (4,169) = 2,879, * p <0,05. (C) Расширенный, предсказуемый уход за матерью (AUG) приводит к усилению игры со сверстниками в позднем подростковом возрасте. Данные представляют собой среднее значение ± стандартная ошибка среднего; n = 5 / группа; t -тест с поправкой Велча на неравную дисперсию, t (4.070) = 2,788, * р <0,05.
Выводы
В целом, опыт ранней жизни влияет на индивидуальный риск и устойчивость к эмоциональным и когнитивным расстройствам. Биологические процессы, лежащие в основе этих глубоких и устойчивых эффектов, включают влияние на развитие цепи, связанное с эпигенетическими изменениями. CRH-экспрессирующие клетки в неонатальном гипоталамусе являются ключевой, ранней мишенью этих зависящих от опыта механизмов. Таким образом, эти и другие, пока не обнаруженные механизмы, с помощью которых ранний жизненный опыт влияет на мозг, служат управляемыми целями для вмешательства.
Доступность данных
Все наборы данных, созданные для этого исследования, включены в рукопись.
Заявление об этике
Это исследование было проведено в соответствии с рекомендациями Национальных институтов здоровья. Протокол был одобрен Комитетом по уходу и использованию животных Калифорнийского университета в Ирвине.
Авторские взносы
ТБ разработал эксперименты. JB, KS и JD провели эксперименты и проанализировали данные. TB, JB и AS написали статью.
Финансирование
Эта работа была поддержана грантами P50 MH096889 и MH073136 Национальных институтов здравоохранения (NIH) и Фондом биомедицинских исследований Хьюитта. Спонсоры не играли никакой роли в разработке или интерпретации экспериментов.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Агидью, А.А., Сингх К. Н. (2018). Детерминанты отсутствия продовольственной безопасности в сельских фермерских домохозяйствах в зоне Южного Волло в Эфиопии: случай суб-водораздела Телеяйен. Agric. Food Econ. 6:10. DOI: 10.1186 / s40100-018-0106-4
CrossRef Полный текст | Google Scholar
Акана, С. Ф., и Даллман, М. Ф. (1997). Хроническая простуда у адреналэктомированных крыс, получавших кортикостерон (В): усиление реакции кортикотропина на острую сдержанность проявляется по мере увеличения уровня витамина В. Эндокринология 138, 3249–3258.DOI: 10.1210 / endo.138.8.5291
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арп, Дж. М., тер Хорст, Дж. П., Лой, М., ден Блаувен, Дж., Бангерт, Э., Фернандес, Г. и др. (2016). Блокирование рецепторов глюкокортикоидов в подростковом возрасте предотвращает усиленное замораживание между повторными воздействиями сигналов после условного страха у взрослых мышей, выросших в условиях хронического стресса в молодом возрасте. Neurobiol. Учить. Mem. 133, 30–38. DOI: 10.1016 / j.nlm.2016.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авишай-Елинер, С., Жиль, Э. Э., Эхбал-Ахмади, М., Бар-Эль, Й., и Барам, Т. З. (2001). Измененная регуляция экспрессии генов и белков компонентов оси гипоталамус-гипофиз-надпочечники в модели хронического стресса у неполовозрелых крыс. J. Neuroendocrinol. 13, 799–807. DOI: 10.1046 / j.1365-2826.2001.00698.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бэйл, Т. Л., Барам, Т. З., Браун, А. С., Гольдштейн, Дж. М., Инсел, Т. Р., Маккарти, М. М. и др. (2010). Программирование в раннем возрасте и нарушения развития нервной системы. Biol. Психиатрия 68, 314–319. DOI: 10.1016 / j.biopsych.2010.05.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барам, Т.З., Дэвис, Э.П., Обенаус, А., Сандман, К.А., Смолл, С.Л., Солодкин, А. и др. (2012). Фрагментация и непредсказуемость раннего опыта психических расстройств. г. J. Psychiatry 169, 907–915. DOI: 10.1176 / appi.ajp.2012.110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бернс, Г.С., МакКлюр, С. М., Паньони, Г., и Монтегю, П. Р. (2001). Предсказуемость модулирует реакцию человеческого мозга на вознаграждение. J. Neurosci. 21, 2793–2798. DOI: 10.1523 / jneurosci.21-08-02793.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхатнагар, С., и Даллман, М. (1998). Нейроанатомическая основа для облегчения гипоталамо-гипофизарно-надпочечниковых реакций на новый стрессорный фактор после хронического стресса. Неврология 84, 1025–1039. DOI: 10.1016 / s0306-4522 (97) 00577-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхатнагар, С., Виау В., Чу А., Сориано Л., Мейер О. К. и Даллман М. Ф. (2000). Опосредованный холецистокинином путь к паравентрикулярному таламусу задействуется у крыс, находящихся в хроническом стрессе, и регулирует функцию гипоталамуса, гипофиза и надпочечников. J. Neurosci. 20, 5564–5573. DOI: 10.1523 / jneurosci.20-14-05564.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Биндер, Э. Б. (2009). Роль FKBP5, ко-шаперона рецептора глюкокортикоидов в патогенезе и терапии аффективных и тревожных расстройств. Психонейроэндокринология 34, S186 – S195. DOI: 10.1016 / j.psyneuen.2009.05.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Биндер, Э. Б., Брэдли, Р. Г., Лю, В., Эпштейн, М. П., Дево, Т. К., Мерсер, К. Б. и др. (2008). Связь полиморфизма FKBP5 и жестокого обращения с детьми в детстве с риском развития симптомов посттравматического стрессового расстройства у взрослых. JAMA 299, 1291–1305. DOI: 10.1001 / jama.299.11.1291
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болтон, Дж.L., Molet, J., Regev, L., Chen, Y., Rismanchi, N., Haddad, E., et al. (2018a). Ангедония, возникшая в результате невзгод в раннем периоде жизни, включает аберрантное взаимодействие цепей вознаграждения и беспокойства и устраняется частичным подавлением гена кортикотропин-рилизинг-гормона миндалины. Biol. Психиатрия 83, 137–147. DOI: 10.1016 / j.biopsych.2017.08.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болтон, Дж. Л., Руис, К. М., Рисманчи, Н., Санчес, Г. А., Кастильо, Э., Хуанг Дж. И др. (2018b). Неблагоприятные обстоятельства в раннем возрасте облегчают приобретение самостоятельного приема кокаина и вызывают стойкую ангедонию. Neurobiol. Напряжение 8, 57–67. DOI: 10.1016 / j.ynstr.2018.01.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бремнер, Дж. Д., Саутвик, С. М., Джонсон, Д. Р., Иегуда, Р., и Чарни, Д. С. (1993). Физическое насилие в детстве и посттравматическое стрессовое расстройство, связанное с боевыми действиями, у ветеранов Вьетнама. г. J. Psychiatry 150, 235–239.DOI: 10.1176 / ajp.150.2.235
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, А.С., Сассер, Э.С., Лин, С.П., Нойгебауэр, Р., и Горман, Дж. М. (1995). Повышенный риск аффективных расстройств у мужчин после дородового воздействия голландской голодной зимы 1944–45 во втором триместре беременности. руб. J. Psychiatry 166, 601–606. DOI: 10.1192 / bjp.166.5.601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брансон, К. Л., Крамар, Э., Лин Б., Чен Ю., Колгин Л. Л., Янагихара Т. К. и др. (2005). Механизмы позднего когнитивного снижения после стресса в раннем возрасте. J. Neurosci. 25, 9328–9338. DOI: 10.1523 / JNEUROSCI.2281-05.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брансон, К. Л., Мариам, Э.-А., Бендер, Р., Чен, Ю., и Барам, Т. З. (2001). Длительная прогрессирующая потеря клеток гиппокампа и дисфункция, вызванные введением кортикотропин-рилизинг гормона в раннем возрасте, воспроизводят эффекты стресса в раннем возрасте. Proc. Natl. Акад. Sci. U S A 98, 8856–8861. DOI: 10.1073 / pnas.151224898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кард, Дж. П., Левитт, П., Глуховский, М., и Ринаман, Л. (2005). Ранний опыт изменяет постнатальную сборку автономных эмоциональных моторных цепей у крыс. J. Neurosci. 25, 9102–9111. DOI: 10.1523 / jneurosci.2345-05.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шампанское, Д.Л., Багот, Р. К., ван Хасселт, Ф., Рамакерс, Г., Мини, М. Дж., Де Клоэт, Э. Р. и др. (2008). Материнская помощь и пластичность гиппокампа: доказательства структурной пластичности, зависящей от опыта, измененного синаптического функционирования и дифференциальной реакции на глюкокортикоиды и стресс. J. Neurosci. 28, 6037–6045. DOI: 10.1523 / JNEUROSCI.0526-08.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен Ю., Барам Т. З. (2016). На пути к пониманию того, как стресс в раннем возрасте перепрограммирует когнитивные и эмоциональные сети мозга. Нейропсихофармакология 41, 197–206. DOI: 10.1038 / npp.2015.181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен Ю., Бендер Р. А., Брансон К. Л., Помпер Дж. К., Григориадис Д. Э., Вурст В. и др. (2004). Модуляция дендритной дифференцировки кортикотропин-рилизинг-фактором в развивающемся гиппокампе. Proc. Natl. Акад. Sci. U S A 101, 15782–15787. DOI: 10.1073 / pnas.0403975101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Ю., Бендер, Р.А., Фротчер, М., и Барам, Т.З. (2001). Новые и временные популяции нейронов, экспрессирующих кортикотропин-рилизинг-гормон, в развивающемся гиппокампе предполагают уникальную функциональную роль: количественный пространственно-временной анализ. J. Neurosci. 21, 7171–7181. DOI: 10.1523 / jneurosci.21-18-07171.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крукстон, Б. Т., Форст, Р., Макклеллан, К., Георгиадис, А., Хитон, Т. Б. (2014). Факторы, связанные с когнитивными достижениями в позднем детстве и подростковом возрасте: когортное исследование молодых жизней детей в Эфиопии, Индии, Перу и Вьетнаме. BMC Pediatr. 14: 253. DOI: 10.1186 / 1471-2431-14-253
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карран, М. М., Сандман, К. А., Погги Дэвис, Э., Глинн, Л. М., и Барам, Т. З. (2017). Аномальное созревание дендритов развивающихся нейронов коры, подвергшихся воздействию кортикотропин-рилизинг-гормона (CRH): понимание последствий пренатальных неблагоприятных факторов? PLoS One 12: e0180311. DOI: 10.1371 / journal.pone.0180311
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даскалакис, Н.П., Де Клоэт, Э. Р., Иегуда, Р., Маласпина, Д., и Кранц, Т. М. (2015). Влияние стресса в раннем возрасте на взаимодействие глюкокортикоидов и BDNF в гиппокампе. Фронт. Мол. Neurosci. 8:68. DOI: 10.3389 / fnmol.2015.00068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, Э. П., Стаут, С. А., Молет, Дж., Вегетабайл, Б., Глинн, Л. М., Сандман, К. А. и др. (2017). Воздействие непредсказуемых материнских сенсорных сигналов влияет на когнитивное развитие у разных видов. Proc. Natl. Акад. Sci. U S A 114, 10390–10395. DOI: 10.1073 / pnas.1703444114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дойссинг, Дж. М., Яковцевски, М. (2017). Модификации гистонов в моделях большого депрессивного расстройства и родственных грызунах. Adv. Exp. Med. Биол. 978, 169–183. DOI: 10.1007 / 978-3-319-53889-1_9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дубе, К. М., Молет, Дж., Сингх-Тейлор, А., Айви, А., Марас, П. М., и Барам, Т. З. (2015). Гипервозбудимость и эпилепсия, вызванные хроническим стрессом в раннем детстве. Neurobiol. Напряжение 2, 10–19. DOI: 10.1016 / j.ynstr.2015.03.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрикссон, М., Райкконен, К., и Эрикссон, Дж. Г. (2014). Стресс в раннем возрасте и более поздние последствия для здоровья — результаты когортного исследования в Хельсинки. г. J. Hum. Биол. 26, 111–116. DOI: 10.1002 / ajhb.22502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фарери, Д.С., Габард-Дурнам, Л., Гофф, Б., Фланнери, Дж., Джи, Д. Г., Лумиан, Д. С. и др. (2017). Измененная связь вентрального стриатума и медиальной префронтальной коры в состоянии покоя опосредует социальные проблемы подростка после раннего ухода в стационар. Dev. Psychopathol. 29, 1865–1876. DOI: 10.1017 / s0954579417001456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феноглио К. А., Брансон К. Л., Авишай-Элинер С., Чен Ю. и Барам Т. З. (2004). Регионоспецифическое начало индуцированных манипуляциями изменений в экспрессии кортикотропин-рилизинг-фактора и рецептора глюкокортикоидов. Эндокринология 145, 2702–2706. DOI: 10.1210 / en.2004-0111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феноглио, К. А., Брансон, К. Л., Авишай-Элинер, С., Стоун, Б. А., Кападиа, Б. Дж., И Барам, Т. З. (2005). Стойкое, вызванное манипуляциями усиление функции памяти гиппокампа и экспрессии рецепторов глюкокортикоидов включает активацию рецептора рилизинг-фактора кортикотропина типа 1. Эндокринология 146, 4090–4096. DOI: 10.1210 / en.2004-1285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феноглио, К. А., Чен, Ю., и Барам, Т. З. (2006). Нейропластичность гипоталамо-гипофизарно-надпочечниковой оси в раннем возрасте требует повторного задействования регулирующих стресс областей мозга. J. Neurosci. 26, 2434–2442. DOI: 10.1523 / JNEUROSCI.4080-05.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фокс, С. Э., Левитт, П., и Нельсон, К. А. III. (2010).Как время и качество раннего опыта влияют на развитие архитектуры мозга. Child Dev. 81, 28–40. DOI: 10.1111 / j.1467-8624.2009.01380.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Жиль Э. Э., Шульц Л. и Барам Т. З. (1996). Аномальная регуляция кортикостерона в модели непрерывного хронического стресса у неполовозрелых крыс. Pediatr. Neurol. 15, 114–119. DOI: 10.1016 / 0887-8994 (96) 00153-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Глинн, Л.М., Хауленд, М. А., Сандман, К. А., Дэвис, Э. П., Фелан, М., Барам, Т. З. и др. (2018). Паттерны материнского настроения в дородовой период позволяют прогнозировать темперамент ребенка и психическое здоровье подростков. J. Affect. Disord. 228, 83–90. DOI: 10.1016 / j.jad.2017.11.065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грей, Дж. Д., Коган, Дж. Ф., Маррокко, Дж. И МакИвен, Б. С. (2017). Геномные и эпигеномные механизмы глюкокортикоидов в головном мозге. Nat. Rev. Endocrinol. 13, 661–673. DOI: 10.1038 / nrendo.2017.97
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грей, Дж. Д., Рубин, Т. Г., Коган, Дж. Ф., Маррокко, Дж., Вайдманн, Дж., Линдквист, С. и др. (2018). Трансляционный профиль стресс-индуцированной нейропластичности в пирамидных нейронах CA3 мышей BDNF Val66Met. Мол. Психиатрия 23, 904–913. DOI: 10.1038 / mp.2016.219
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуаданьо, А., Канг, М.С., Девени, Г.А., Матье, А.П., Роза, П., Чакраварти, М. и др. (2018). Снижение функциональной связи базолатеральной миндалины с медиальной префронтальной корой в состоянии покоя у крыс до отъема, подвергшихся хроническому стрессу в раннем возрасте. Brain Struct. Функц. 223, 3711–3729. DOI: 10.1007 / s00429-018-1720-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ганн, Б.Г., Каннингем, Л., Купер, М.А., Кортин, Н.Л., Сейфи, М., Суинни, Дж. Д., и другие. (2013). Дисфункциональная астроцитарная и синаптическая регуляция гипоталамической глутаматергической передачи на мышиной модели невзгод в раннем возрасте: актуальность для нейростероидов и программирование реакции на стресс. J. Neurosci. 33, 19534–19554. DOI: 10.1523 / jneurosci.1337-13.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хакман, Д. А., Фара, М. Дж., И Мини, М. Дж. (2010). Социально-экономический статус и мозг: механистические выводы из исследований на людях и животных. Nat. Rev. Neurosci. 11, 651–659. DOI: 10.1038 / nrn2897
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хайм, К., Биндер, Э. Б. (2012). Текущие тенденции исследований стресса и депрессии в раннем возрасте: обзор исследований на людях чувствительных периодов, взаимодействия генов и окружающей среды и эпигенетики. Exp. Neurol. 233, 102–111. DOI: 10.1016 / j.expneurol.2011.10.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плющ, А.С.С., Брансон, К.Л.Л., Сандман, К., Барам, Т.З. З. (2008). Дисфункциональное воспитательное поведение у крыс-самок с ограниченным доступом к гнездовому материалу: клинически значимая модель стресса в раннем возрасте. Неврология 154, 1132–1142. DOI: 10.1016 / j.neuroscience.2008.04.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айви, А.С., Рекс, С.С., Чен, Ю., Дубэ, К., Марас, П.М., Григориадис, Д.Э., и др. (2010). Дисфункция гиппокампа и когнитивные нарушения, вызванные хроническим стрессом в раннем возрасте, связаны с чрезмерной активацией рецепторов CRH. J. Neurosci. 30, 13005–13015. DOI: 10.1523 / jneurosci.1784-10.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юрек Б., Слэттери Д. А., Хираока Ю., Лю Ю., Нисимори К., Агилера Г. и др. (2015). Окситоцин регулирует индуцированную стрессом транскрипцию гена Crf посредством регулируемого CREB коактиватора транскрипции 3. J. Neurosci. 35, 12248–12260. DOI: 10.1523 / jneurosci.1345-14.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юул, С.Э., Бейер, Р. П., Баммлер, Т. К., Фарин, Ф. М., и Глисон, К. А. (2011). Влияние неонатального стресса и морфина на экспрессию генов гиппокампа мышей. Pediatr. Res. 69, 285–292. DOI: 10.1203 / pdr.0b013e31820bd165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каплан, Г. А., Туррелл, Г., Линч, Дж. У., Эверсон, С. А., Хелкала, Э.-Л. Л. и Салонен Дж. Т. (2001). Социально-экономическое положение в детстве и когнитивные функции в зрелом возрасте. Int. Дж.Эпидемиол. 30, 256–263. DOI: 10.1093 / ije / 30.2.256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карстен, К. А., Барам, Т. З. (2013). Как нейрон «знает», как модулировать свой эпигенетический механизм в ответ на среду / опыт ранней жизни? Фронт. Психиатрия 4:89. DOI: 10.3389 / fpsyt.2013.00089
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэ, X., Фу, К., Маджник, А., Коэн, С., Лю, К., и Лейн, Р.(2018). Неблагоприятная среда в молодом возрасте вызывает тревожное поведение и увеличивает экспрессию вариантов сплайсинга мРНК FKBP5 в мозге мышей. Physiol. Геномика 50, 973–981. DOI: 10.1152 / Physiolgenomics.00054.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кесслер, Р. К., Демлер, О., Франк, Р. Г., Олфсон, М., Пинкус, Х. А., Уолтерс, Е. Е. и др. (2005). Распространенность и лечение психических расстройств, 1990–2003 гг. N. Engl. J. Med. 352, 2515–2523.DOI: 10.1056 / NEJMsa043266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кленгель Т., Биндер Э. Б. (2015). Эпигенетика психических расстройств, связанных со стрессом, и взаимодействия генов и окружающей среды. Нейрон 86, 1343–1357. DOI: 10.1016 / j.neuron.2015.05.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кох, Х., Маккормак, К., Санчес, М. М., и Маэстрипьери, Д. (2014). Развитие оси гипоталамус-гипофиз-надпочечники у макак-резусов: влияние возраста, пола и раннего опыта. Dev. Psychobiol. 56, 86–95. DOI: 10.1002 / dev.21093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Копала-Сибли, Д. К., Сир, М., Финсаас, М. К., Ораве, Дж., Хуанг, А., Тоттенхэм, Н. и др. (2018). Воспитание в раннем детстве предсказывает функциональную взаимосвязь мозга в позднем детстве во время восприятия эмоций и обработки вознаграждения. Child Dev. doi: 10.1111 / cdev.13126 [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корози, А., Шанаброу, М., Макклелланд, С., Лю, З.-В., Борок, Э., Гао, Х.-Б. и др. (2010). Опыт ранней жизни снижает возбуждение чувствительных к стрессу нейронов гипоталамуса и перепрограммирует экспрессию кортикотропин-рилизинг-гормона. J. Neurosci. 30, 703–713. DOI: 10.1523 / JNEUROSCI.4214-09.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кругерс, Х. Дж., Арп, Дж. М., Сюн, Х., Канацу, С., Лесуис, С. Л., Корози, А., и др. (2017). Неблагоприятные обстоятельства в ранней жизни: долгосрочные последствия для эмоционального обучения. Neurobiol. Напряжение 6, 14–21. DOI: 10.1016 / j.ynstr.2016.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lesuis, S. L., Weggen, S., Baches, S., Lucassen, P. J., and Krugers, H. J. (2018). Нацеленность на глюкокортикоидные рецепторы предотвращает влияние стресса в молодом возрасте на амилоидную патологию и когнитивные функции у мышей APP / PS1. Пер. Психиатрия 8:53. DOI: 10.1038 / s41398-018-0101-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Д., Diorio, J., Tannenbaum, B., Caldji, C., Francis, D., Freedman, A., et al. (1997). Материнская помощь, глюкокортикоидные рецепторы гиппокампа и гипоталамо-гипофизарно-надпочечниковые реакции на стресс. Наука 277, 1659–1662. DOI: 10.1126 / science.277.5332.1659
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лой, М., Сарабджитсингх, Р. А., Цули, А., Трин, С., Арп, М., Кругерс, Х. Дж. И др. (2017). Преходящее препубертатное лечение мифепристоном нормализует дефицит контекстной памяти и нейрональной активности взрослых самцов крыс, подвергшихся материнской депривации. eNeuro 4: ENEURO.0253–17.2017. DOI: 10.1523 / eneuro.0253-17.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лукассен, П. Дж., Нанинк, Э. Ф. Г. Г., ван Гудувэр, Дж. Б., Фицсимонс, К., Джоэлс, М., и Корози, А. (2013). Перинатальное программирование структуры и функции гиппокампа взрослых: новые роли стресса, питания и эпигенетики. Trends Neurosci. 36, 621–631. DOI: 10.1016 / j.tins.2013.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
млн лет назад X.-М., И Лайтман, С. Л. (1998). Ответы транскрипции генов аргинин-вазопрессина и кортикотропин-рилизинг-гормона на различные частоты повторяющегося стресса у крыс. J. Physiol. 510, 605–614. DOI: 10.1111 / j.1469-7793.1998.605bk.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макклелланд, С., Корози, А., Коуп, Дж., Айви, А., и Барам, Т. З. (2011). Новые роли эпигенетических механизмов в стойких последствиях стресса и опыта в раннем детстве на обучение и память. Neurobiol. Учить. Mem. 96, 79–88. DOI: 10.1016 / j.nlm.2011.02.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакИвен, Б.С., Наска, К., и Грей, Дж. Д. (2016). Стрессовое воздействие на нейрональную структуру: гиппокамп, миндалину и префронтальную кору. Нейропсихофармакология 41, 3–23. DOI: 10.1038 / npp.2015.171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мини, М. Дж., Эйткен, Д. Х., Боднофф, С. Р., Ини, Л.Дж., Татаревич Дж. Э. и Сапольски Р. М. (1985). Раннее постнатальное воздействие изменяет концентрацию глюкокортикоидных рецепторов в отдельных областях мозга. Behav. Neurosci. 99, 765–770. DOI: 10.1037 // 0735-7044.99.4.765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Molet, J., Heins, K., Zhuo, X., Mei, Y. T., Regev, L., Baram, T. Z., et al. (2016a). Фрагментация и высокая энтропия неонатального опыта предсказывают эмоциональный исход подростка. Пер.Психиатрия 6: e702. DOI: 10.1038 / TP.2015.200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Молет, Дж., Марас, П. М., Кинни-Ланг, Э., Харрис, Н. Г., Рашид, Ф., Айви, А. С. и др. (2016b). МРТ выявляет нарушенную микроструктуру гиппокампа, которая лежит в основе нарушений памяти после невзгод в раннем возрасте. Гиппокамп 26, 1618–1632. DOI: 10.1002 / hipo.22661
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Молет, Дж., Марас, П. М., Авишай-Элинер, С., Барам, Т. З. (2014). Натуралистические модели хронического стресса в раннем возрасте на грызунах. Dev. Psychobiol. 56, 1675–1688. DOI: 10.1002 / dev.21230
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морисо, С., Шионоя, К., Якубс, К., и Салливан, Р. М. (2009). Стресс в раннем детстве нарушает обучение привязанности: роль кортикостерона миндалины, гормона высвобождения кортикотропина голубого пятна и норадреналина обонятельной луковицы. J. Neurosci. 29, 15745–15755. DOI: 10.1523 / jneurosci.4106-09.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Naninck, E.F.G., Hoeijmakers, L., Kakava-Georgiadou, N., Meesters, A., Lazic, S.E., Lucassen, P.J., et al. (2014). Хронический стресс в раннем периоде жизни изменяет нейрогенез развития и взрослых и ухудшает когнитивные функции у мышей. Гиппокамп 25, 309–328. DOI: 10.1002 / hipo.22374
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нельсон К.А., Бос К., Гуннар М. Р. и Сонуга-Барке Э. Дж. С. (2011). Нейробиологические последствия ранних человеческих лишений. Monogr. Soc. Res. Child Dev. 76, 127–146. DOI: 10.1111 / j.1540-5834.2011.00630.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нойман, И. Д., Слэттери, Д. А. (2016). Окситоцин при общей тревоге и социальном страхе: трансляционный подход. Biol. Психиатрия 79, 213–221. DOI: 10.1016 / j.biopsych.2015.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пенья, К.Дж., Кронман, Х. Г., Уокер, Д. М., Кейтс, Х. М., Багот, Р. К., Пурушотаман, И. и др. (2017). Стресс в раннем периоде жизни придает мышам пожизненную подверженность стрессу через вентральную тегментальную область OTX2. Наука 356, 1185–1188. DOI: 10.1126 / science.aan4491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пенья, К. Дж., Нойгут, Ю. Д., Каларко, К. А., и Шампань, Ф. А. (2014). Влияние материнской заботы на развитие дофаминовых путей среднего мозга и ориентированное на вознаграждение поведение у потомства женского пола. евро. J. Neurosci. 39, 946–956. DOI: 10.1111 / ejn.12479
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плоцкий П. М., Мини М. Дж. (1993). Ранний постнатальный опыт изменяет мРНК гипоталамического кортикотропин-рилизинг фактора (CRF), среднее содержание CRF и вызванное стрессом высвобождение у взрослых крыс. Мол. Brain Res. 18, 195–200. DOI: 10.1016 / 0169-328x (93)-v
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Поллак, С.Д., Нельсон, К. А., Шлаак, М. Ф., Робер, Б. Дж., Веверка, С. С., Виик, К. Л. и др. (2010). Влияние ранней депривации на нервное развитие у детей, находящихся в стационаре. Child Dev. 81, 224–236. DOI: 10.1111 / j.1467-8624.2009.01391.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Познер, Дж., Ча, Дж., Рой, А. К., Петерсон, Б. С., Бансал, Р., Густафссон, Х. С. и др. (2016). Изменения в миндалине-префронтальной цепи у младенцев, подвергшихся пренатальной материнской депрессии. Пер. Психиатрия 6: e935. DOI: 10.1038 / TP.2016.146
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Регев, Л., Нойфельд-Коэн, А., Цури, М., Куперман, Ю., Гецельтер, Д., Гил, С., и др. (2011). Длительная и сайт-специфическая сверхэкспрессия фактора высвобождения кортикотропина выявляет различные роли расширенных ядер миндалины в эмоциональной регуляции. Мол. Психиатрия 16, 714–728. DOI: 10.1038 / mp.2010.64
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Регев, Л., Цури, М., Гил, С., и Чен, А. (2012). Сайт-специфическая генетическая манипуляция с рилизинг-фактором кортикотропина миндалины показывает его императивную роль в опосредовании поведенческой реакции на вызов. Biol. Психиатрия 71, 317–326. DOI: 10.1016 / j.biopsych.2011.05.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райс, К. Дж., Сандман, К. А., Ленджави, М. Р. и Барам, Т. З. (2008). Новая модель мышей для лечения острых и длительных последствий стресса в раннем детстве. Эндокринология 149, 4892–4900. DOI: 10.1210 / en.2008-0633
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ринкон-Кортес, М., и Салливан, Р. М. (2014). Ранняя травма и привязанность: немедленное и длительное воздействие на развитие нервно-поведенческой и стрессовой оси. Фронт. Эндокринол. 5:33. DOI: 10.3389 / fendo.2014.00033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росс, Д. А., Арбакл, М. Р., Трэвис, М.Дж., Дуайер, Дж. Б., ван Шалквик, Г. И., и Ресслер, К. Дж. (2017). Комплексный взгляд на неврологию на формулировку и планирование лечения посттравматического стрессового расстройства. JAMA Psychiatry 74, 407–415. DOI: 10.1001 / jamapsychiatry.2016.3325
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руссо, С. Дж., Мерроу, Дж. У., Хан, М.-Х. Х., Чарни Д. С., Нестлер Э. Дж. (2012). Нейробиология устойчивости. Nat. Neurosci. 15, 1475–1484.DOI: 10.1038 / nn.3234
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ратледж Р. Б., Скандали Н., Даян П. и Долан Р. Дж. (2014). Вычислительная и нейронная модель мгновенного субъективного благополучия. Proc. Natl. Акад. Sci. U S A 111, 12252–12257. DOI: 10.1073 / pnas.1407535111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шмидт, М. В., Абрахам, В. К., Марун, М., Аист, О., и Рихтер-Левин, Г. (2013). Метапластичность, вызванная стрессом: от синапсов к поведению. Неврология 250, 112–120. DOI: 10.1016 / j.neuroscience.2013.06.059
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шульман А., Болтон Дж. Л., Курран М. М., Регев Л., Камеи Н., Сингх-Тейлор А. и др. (2018). Блокирование функции NRSF восстанавливает пространственную память, нарушенную невзгодами раннего возраста, и выявляет неожиданные основные программы транскрипции. ССРН Электрон. J. doi: 10.2139 / ssrn.3284454
CrossRef Полный текст | Google Scholar
Швайгер, М., Гринберг, М., Мозер, Д., Занг, Дж. С. С., Хайнрихс, М., Хенгстлер, Дж. Г. и др. (2016). Измененная стресс-индуцированная регуляция генов в моноцитах у взрослых с историей невзгод в детстве. Нейропсихофармакология 41, 2530–2540. DOI: 10.1038 / npp.2016.57
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сегман, Р. Х., Шефи, Н., Гольцер-Дубнер, Т., Фридман, Н., Камински, Н., и Шалев, А. Я. (2005). Профили экспрессии генов мононуклеарных клеток периферической крови позволяют идентифицировать возникающее посттравматическое стрессовое расстройство у выживших после травм. Мол. Психиатрия 10, 500–513. DOI: 10.1038 / sj.mp.4001636
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сет, К. А., и Маджзуб, Дж. А. (2001). Фактор транскрипции, подавляющий репрессор / фактор подавления нейронов, может действовать как энхансер, а также как репрессор транскрипции гена кортикотропин-рилизинг-гормона. J. Biol. Chem. 276, 13917–13923. DOI: 10.1074 / jbc.m007745200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингх-Тейлор, А., Molet, J., Jiang, S., Korosi, A., Bolton, J. L., Noam, Y., et al. (2018). Эпигенетические механизмы, зависимые от NRSF, способствуют программированию чувствительных к стрессу нейронов неонатальным опытом, способствуя устойчивости. Мол. Психиатрия 23, 648–657. DOI: 10.1038 / mp.2016.240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Судерман М., Боргхол Н., Паппас Дж. Дж., Пинто Перейра С. М., Пембри М., Герцман К. и др. (2014). Жестокое обращение в детстве связано с метилированием множества локусов в ДНК взрослого человека. BMC Med. Геномика 7:13. DOI: 10.1186 / 1755-8794-7-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шиф М., Тан Й.-Й., Хилл К. Г. и Муши Р. (2016). Динамический эпигеном и его значение для поведенческих вмешательств: роль эпигенетики в профилактике расстройств и укреплении здоровья. Пер. Behav. Med. 6, 55–62. DOI: 10.1007 / s13142-016-0387-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван Бодегом, М., Хомберг, Дж. Р., и Хенкенс, М. Дж. А. Г. (2017). Модуляция гипоталамо-гипофизарно-надпочечниковой оси под воздействием стресса в раннем возрасте. Фронт. Клетка. Neurosci. 11:87. DOI: 10.3389 / fncel.2017.00087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вентура, Р., Коккурелло, Р., Андолина, Д., Латальята, Э. К., Занеттини, К., Лампис, В., и др. (2013). Послеродовой аверсивный опыт снижает чувствительность к естественным наградам и увеличивает восприимчивость к негативным событиям во взрослой жизни. Cereb. Cortex 23, 1606–1617. DOI: 10.1093 / cercor / bhs145
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Воорн, П., Калсбек, А., Йорритсма-Байхам, Б., и Гроеневеген, Х. Дж. (1988). Пре- и постнатальное развитие групп дофаминергических клеток в вентральном среднем мозге и дофаминергическая иннервация полосатого тела крысы. Неврология 25, 857–887. DOI: 10.1016 / 0306-4522 (88)-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэйкфорд, А.Г. П., Морин, Э. Л., Брамлет, С. Н., Хауэлл, Л. Л., и Санчес, М. М. (2018). Обзор нечеловеческих приматов моделей стресса в раннем периоде жизни и злоупотребления наркотиками в подростковом возрасте. Neurobiol. Напряжение 9, 188–198. DOI: 10.1016 / j.ynstr.2018.09.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уокер, К.-Д., Бат, К. Г., Джоэлс, М., Корози, А., Ларауш, М., Лукассен, П. Дж. И др. (2017). Хронический стресс в молодом возрасте, вызванный ограниченным количеством подстилок и гнездового материала (LBN) у грызунов: критические соображения методологии, результатов и трансляционного потенциала. Напряжение 20, 421–448. DOI: 10.1080 / 10253890.2017.1343296
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, X.-D., Rammes, G., Kraev, I., Wolf, M., Liebl, C., Scharf, S.H., et al. (2011). CRF 1 переднего мозга модулирует когнитивные дефициты, запрограммированные стрессом в раннем возрасте. J. Neurosci. 31, 13625–13634. DOI: 10.1523 / JNEUROSCI.2259-11.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уивер, И.К., Червони, Н., Шампань, Ф. А., Д’Алессио, А. С., Шарма, С., Секл, Дж. Р. и др. (2004). Эпигенетическое программирование по материнскому поведению. Nat. Neurosci. 7, 847–854. DOI: 10.1038 / nn1276
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Дж., Ван, Р., Лю, Ю., Лю, Д., Цзян, Х., и Пань, Ф. (2017). FKBP5 и специфические микроРНК через глюкокортикоидный рецептор в базолатеральной миндалине, участвующие в предрасположенности к депрессивному расстройству у крыс раннего подросткового возраста, подвергшихся стрессу. J. Psychiatr. Res. 95, 102–113. DOI: 10.1016 / j.jpsychires.2017.08.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иегуда, Р., Кай, Г., Гольер, Дж. А., Сарапас, К., Галеа, С., Изинг, М., и др. (2009). Паттерны экспрессии генов, связанные с посттравматическим стрессовым расстройством после воздействия нападений Всемирного торгового центра. Biol. Психиатрия 66, 708–711. DOI: 10.1016 / j.biopsych.2009.02.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нейроны касания имеют хорошее чувство направления
Образец цитирования: Робинсон Р. (2010) Сенсорные нейроны имеют хорошее чувство направления.PLoS Biol 8 (2): e1000304. https://doi.org/10.1371/journal.pbio.1000304
Опубликовано: 2 февраля 2010 г.
Авторские права: © 2010 Ричард Робинсон. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Конкурирующие интересы: Автор заявил, что конкурирующих интересов не существует.
Одна из самых известных иллюстраций во всей биологии — это соматосенсорный гомункул — маленький человечек, вытянутый вдоль поверхности мозга, каждая часть тела опухшая или сморщенная, чтобы соответствовать размеру лежащей в основе нейронной области, которая получает свои ощущения от сенсорных рецепторов. в коже. Но хотя на рисунке показано, где в мозгу регистрируются тактильные ощущения, он ничего не говорит о том, как именно. В новом исследовании в этом выпуске PLoS Biology Ю-Ченг Пей, Слиман Бенсмайя и его коллеги рассматривают часть этого недостатка и показывают, что по крайней мере в одном отношении соматосенсорная система похожа на зрительную систему — она содержит класс чувствительных к направлению нейронов, которые заботятся не о том, что движется по коже, а только о том, куда это идет.
Входящие сенсорные сигналы от кожи проходят вверх по позвоночнику через таламус в первичную соматосенсорную кору (называемую S1), область на поверхности мозга чуть выше и немного позади уха. Нейроанатомы делят S1 на четыре области, которые называются 1, 2, 3a и 3b. Предыдущие исследования показали, что области 1, 2 и 3b содержат нейроны, которые реагируют на направление движения тактильного стимула, но не было ясно, чувствительны ли эти нейроны к другим аспектам прикосновения, таким как форма объекта. .
Чтобы исследовать этот вопрос, авторы регистрировали одиночные нейроны в S1 обезьян, стимулируя подушечки их пальцев сеткой булавок на квадратный сантиметр. Каждый из 400 штырей в сетке можно было независимо поднимать или опускать. Устройство позволяло им создавать формы, контактирующие с кожей, причем каждая булавка аналогична пикселю на визуальном мониторе. Быстро поднимая и опуская соседние штифты, фигуры можно было перемещать по коже, создавая ощущение движения.
Авторы спросили, как нейроны в S1 реагируют на движение трех различных форм — полосы, регулярного паттерна из отдельных точек, движущихся вместе, и случайного набора точек, движущихся случайным образом или согласованно в одном направлении. Они обнаружили, что отдельные нейроны в области 1 были «настроены» на определенные направления движения. Например, нейрон может сильно срабатывать, когда движение идет слева направо вдоль кончика пальца, но реагировать слабо или не реагировать вообще, если та же форма перемещается справа налево.Важно отметить, что эти нейроны передают одинаковую информацию о направлении движения, независимо от «формы» движущегося объекта. Хотя некоторые нейроны в области 3b и 2 также передавали информацию о направлении движения, сила их настройки направления сильно зависела от формы стимула.
Внутри зрительной системы нейроны могут быть избирательными в отношении направления движения, ориентации или того и другого. Авторы обнаружили, что аналогично многие соматосенсорные нейроны проявляют двойную чувствительность.Изменяя ориентацию стержня относительно направления его движения, они обнаружили, что около трети нейронов были чувствительны только к направлению, около 15% — только к ориентации и около трети — к обоим. У последней группы движение перпендикулярно ориентации вызывало наиболее сильную реакцию.
Способность этих результатов объяснить чувствительность человека к движению до сих пор неизвестна. Однако степень направленной чувствительности нейронов области 1 соответствовала чувствительности людей, проходящих тест дискриминации «по часовой стрелке».Таким образом, участие этой системы в вынесении суждений о направленности тактильных ощущений у людей, вероятно, будет аналогичным.
Интригующее сходство между визуальной и соматосенсорной обработкой движения дополняет более ранние исследования, показывающие, как две системы одинаково обрабатывают информацию о форме. Обработка изображений была предметом обширных исследований, и результаты этих исследований были использованы для разработки новых плодотворных гипотез о том, как мозг интерпретирует прикосновения.
Pei Y-C, Hsiao SS, Craig JC, Bensmaia SJ (2010) Формо-инвариантное кодирование направления движения в соматосенсорной коре. DOI: 10.1371 / journal.pbio.1000305
Светочувствительные нейроны и каналы опосредуют фототаксис у C. elegans
Кандел, Э.Р. Нейробиология поведения. в Принципах неврологии (ред. Кандел, Э. Р., Шварц, Дж. Х. и Джесселл, Т. М.) 5–66 (McGraw-Hill Medical, 2000).
Google Scholar
Баргманн, К.I. Сравнительная химическая чувствительность от рецепторов к экологии. Природа 444 , 295–301 (2006).
CAS Статья PubMed Google Scholar
Fu, Y. & Yau, K.W. Фототрансдукция в палочках и колбочках мыши. Pflugers Arch. 454 , 805–819 (2007).
CAS Статья PubMed PubMed Central Google Scholar
Ван Т.И Монтелл, К. Фототрансдукция и дегенерация сетчатки у Drosophila . Pflugers Arch. 454 , 821–847 (2007).
CAS Статья PubMed Google Scholar
Berson, D.M. Фототрансдукция в фоторецепторах ганглиозных клеток. Pflugers Arch. 454 , 849–855 (2007).
CAS Статья PubMed Google Scholar
Кельбер, А., Воробьев, М., Осорио, Д. Цветовое зрение животных — поведенческие тесты и физиологические концепции. Biol. Преподобный Камб. Филос. Soc. 78 , 81–118 (2003).
Артикул PubMed Google Scholar
Bargmann, C.I. Chemosensation. в C. elegans. WormBook , 1–29 〈http://www.wormbook.org/〉 (2006).
Google Scholar
Bounoutas, A.И Чалфи М. Чувствительность к прикосновению в Caenorhabditis elegans . Pflugers Arch. 454 , 691–702 (2007).
CAS Статья PubMed Google Scholar
Бреннер С. Генетика Caenorhabditis elegans . Генетика 77 , 71–94 (1974).
CAS PubMed PubMed Central Google Scholar
Бурр, А.H. Фотодвижение Caenorhabditis elegans , нематоды, у которой отсутствуют глазки. Доказательство того, что реакция на свет, а не на лучистое отопление. Photochem. Photobiol. 41 , 577–582 (1985).
CAS Статья PubMed Google Scholar
Харрис, В.А., Старк, В.С. И Уокер, Дж. Генетическая диссекция фоторецепторной системы сложного глаза Drosophila melanogaster . J. Physiol. (Лондон) 256 , 415–439 (1976).
CAS Статья Google Scholar
Уайт, Дж. Г., Саутгейт, Э., Томсон, Дж. И Бреннер, С. Строение нервной системы нематоды Caenorhabditis elegans . Phil. Пер. R. Soc. Лондон. B 314 , 1–340 (1986).
CAS Статья Google Scholar
Габель, К.V. et al. Нейронные цепи опосредуют электросенсорное поведение у Caenorhabditis elegans . J. Neurosci. 27 , 7586–7596 (2007).
CAS Статья PubMed Google Scholar
Kaupp, U.B. И Зейферт, Р. Циклические нуклеотидно-управляемые ионные каналы. Physiol. Ред. 82 , 769–824 (2002).
CAS Статья PubMed Google Scholar
Чо, С.W., Cho, J.H., Song, H.O. & Park, C.S. Идентификация и характеристика предполагаемого циклического нуклеотид-зависимого канала, CNG-1, в C. elegans . Мол. Ячейки 19 , 149–154 (2005).
CAS PubMed Google Scholar
Komatsu, H. et al. Функциональная реконструкция гетеромерного циклического нуклеотид-зависимого канала Caenorhabditis elegans в культивируемых клетках. Brain Res. 821 , 160–168 (1999).
CAS Статья PubMed Google Scholar
Coburn, C.M. И Баргманн, К. Предполагаемый cyclic nucleotide-gated канал необходим для сенсорного развития и функционирования у C. elegans . Нейрон 17 , 695–706 (1996).
CAS Статья PubMed Google Scholar
Финн, Дж.Т., Solessio, E.C. & Yau, K.W. ЦГМФ-управляемый катионный канал в деполяризующих фоторецепторах теменного глаза ящерицы. Nature 385 , 815–819 (1997).
CAS Статья PubMed Google Scholar
Stern, J.H., Kaupp, U.B. & MacLeish, P.R. Контроль светорегулируемого тока в фоторецепторах палочек с помощью циклического GMP, кальция и l– цис -дилтиазема. Proc. Natl. Акад. Sci.USA 83 , 1163–1167 (1986).
CAS Статья PubMed Google Scholar
Yu, S., Avery, L., Baude, E. & Garbers, D.L. Экспрессия гуанилилциклазы в определенных сенсорных нейронах: новое семейство хемосенсорных рецепторов. Proc. Natl. Акад. Sci. USA 94 , 3384–3387 (1997).
CAS Статья PubMed Google Scholar
Мульш, А., Luckhoff, A., Pohl, U., Busse, R. & Bassenge, E. LY 83583 (6-анилино-5,8-хинолиндион) блокирует индуцированное нитровазодилататорами повышение циклического GMP и ингибирование активации тромбоцитов. Арка Наунин Шмидебергс. Pharmacol. 340 , 119–125 (1989).
CAS PubMed Google Scholar
Данцигер, Р.С. и другие. Характеристика растворимой гуанилилциклазы в трансформированных непигментированных эпителиальных клетках человека. Biochem. Биофиз. Res. Commun. 195 , 958–962 (1993).
CAS Статья PubMed Google Scholar
Bargmann, C.I., Hartwieg, E. & Horvitz, H.R. Гены и нейроны, селективные к одорантам, опосредуют обоняние у C. elegans . Cell 74 , 515–527 (1993).
CAS Статья PubMed Google Scholar
Уорд, С.Хемотаксис нематодой Caenorhabditis elegans : идентификация аттрактантов и анализ реакции с использованием мутантов. Proc. Natl. Акад. Sci. США 70 , 817–821 (1973).
CAS Статья PubMed Google Scholar
Gray, J.M. et al. Ощущение кислорода и социальное питание опосредуются гомологом гуанилатциклазы C. elegans . Nature 430 , 317–322 (2004).
CAS Статья PubMed Google Scholar
Chalfie, M. et al. Нейронная цепь сенсорной чувствительности в Caenorhabditis elegans . J. Neurosci. 5 , 956–964 (1985).
CAS Статья PubMed Google Scholar
Kaplan, J.M. & Horvitz, H.R. Двойной механосенсорный и хемосенсорный нейрон в Caenorhabditis elegans . Proc. Natl. Акад. Sci. USA 90 , 2227–2231 (1993).
CAS Статья PubMed Google Scholar
Cheung, B.H., Cohen, M., Rogers, C., Albayram, O. & de Bono, M. Зависимая от опыта модуляция поведения C. elegans кислородом окружающей среды. Curr. Биол. 15 , 905–917 (2005).
CAS Статья PubMed Google Scholar
Сальвини-Плавен, Л.И Майр, Э. Об эволюции фоторецепторов и глаз. в Evolutionary Biology (ред. Hecht, M.K., Steere, W.C. & Wallace, B.) 207–273 (Plenum Press, New York, 1961).
Google Scholar
Геринг, У. Дж. И Икео, К. Пакс 6: овладение морфогенезом и эволюцией глаза. Trends Genet. 15 , 371–377 (1999).
CAS Статья PubMed Google Scholar
Геринг, W.J. Новые взгляды на развитие глаз и эволюцию глаз и фоторецепторов. J. Hered. 96 , 171–184 (2005).
CAS Статья PubMed Google Scholar
Arendt, D., Tessmar, K., de Campos-Baptista, MI, Dorresteijn, A. & Wittbrodt, J. Развитие глаз пигментных чашек у полихеты Platynereis dumerilii и эволюционная консервация глаз личинок в Bilateria . Разработка 129 , 1143–1154 (2002).
CAS PubMed Google Scholar
Читвуд, Б.Г. И Мерфи, Д. Наблюдения за двумя морскими монистеридами: их классификация, выращивание и поведение. Пер. Являюсь. Microsc. Soc. 83 , 311–329 (1964).
Артикул Google Scholar
Croll, N.A. Фототактический отклик и спектральная чувствительность Chromadorina viridis (Nematoda, Chromadorida ) с примечанием о природе парных пигментных пятен. Nematologica 12 , 610–614 (1966).
CAS Статья Google Scholar
Montell, C. Визуальная трансдукция у Drosophila . Annu. Rev. Cell Dev. Биол. 15 , 231–268 (1999).
CAS Статья PubMed Google Scholar
Adoutte, A., Balavoine, G., Lartillot, N. & de Rosa, R.Эволюция животных. Конец промежуточных таксонов? Trends Genet. 15 , 104–108 (1999).
CAS Статья PubMed Google Scholar
Грей, Дж. М., Хилл, Дж. Дж. И Баргманн, К. Схема для навигации в Caenorhabditis elegans . Proc. Natl. Акад. Sci. США 102 , 3184–3191 (2005).
CAS Статья PubMed Google Scholar
Li, W., Фенг, З., Штернберг, П.В. И Сюй, X.Z.S.A. C. elegans рецептор растяжения нейрона, выявленный гомологом механочувствительного TRP-канала. Природа 440 , 684–687 (2006).
CAS Статья PubMed PubMed Central Google Scholar
Feng, Z. et al. Модель никотин-зависимого поведения C. elegans : регуляция с помощью каналов семейства TRP. Cell 127 , 621–633 (2006).
CAS Статья PubMed PubMed Central Google Scholar
Bargmann, C.I. И Эйвери, Л. Лазерное уничтожение клеток в Caenorhabditis elegans . Methods Cell Biol. 48 , 225–250 (1995).
CAS Статья PubMed PubMed Central Google Scholar
Troemel, E.R., Chou, J.H., Dwyer, N.D., Кольбер, Х.А. И Баргманн, К. Семь расходящихся трансмембранных рецепторов являются кандидатами на хемосенсорные рецепторы в C. elegans . Cell 83 , 207–218 (1995).
CAS Статья PubMed Google Scholar
Miranda-Vizuete, A. et al. Уменьшение продолжительности жизни у мутанта Caenorhabditis elegans , лишенного TRX-1, тиоредоксина, экспрессируемого в сенсорных нейронах ASJ. FEBS Lett. 580 , 484–490 (2006).
CAS Статья PubMed Google Scholar
Richmond, J.E. & Jorgensen, E.M. Один рецептор ГАМК и два рецептора ацетилхолина функционируют в нервно-мышечном соединении C. elegans. Nat. Neurosci. 2 , 791–797 (1999).
CAS Статья PubMed PubMed Central Google Scholar
Брокки П.Дж., Меллем Дж.Э., Хиллс, Т., Мэдсен, Д.М. И Марик, А. Субъединица NMR-1 рецептора глутамата C. elegans требуется для медленных активируемых NMDA токов, которые регулируют частоту реверсирования во время передвижения. Нейрон 31 , 617–630 (2001).
CAS Статья PubMed Google Scholar
Идентификация теплочувствительных нейронов в преоптической области гипоталамуса как мощных регуляторов гомеостаза глюкозы
Abstract
Было высказано предположение, что ингибирование теплочувствительных нейронов (WSN) в преоптической области гипоталамуса (POA) играет ключевую роль в термогенная реакция на воздействие холода.Поскольку этот ответ обеспечивается заметным увеличением чувствительности к инсулину в термогенных тканях, мы предположили, что ингибирование WSN опосредует метаболический, а также термогенный ответ, и, следовательно, активация WSN будет иметь противоположные эффекты. Чтобы проверить эту гипотезу, мы использовали фармакогенетическую технологию для активации или ингибирования недавно идентифицированной субпопуляции POA WSN, определяемой их экспрессией нейропептида Pacap, с использованием препарата клозапин-N-оксид (CNO). Мы сообщаем, что, как и предполагалось, фармакогенетическая активация этой популяции POA WSN снижает расход энергии (EE) (Sal vs.CNO: 0,32 ± 0,10 против 0,21 ± 0,02 ккал / час; p <0,05) и внутренней температуры (Tc) (Sal против CNO: 35,4 ± 0,1 против 30,4 ± 0,1 ° C; p = 0,0001), в то время как ингибирование имело противоположный эффект (EE: Sal против CNO: 0,25 ± 0,03 против 0,26 ± 0,03 ккал / час; Tc: Sal по сравнению с CNO: 35,8 ± 0,1 по сравнению с 36,4 ± 0,2 ° C; p <0,05). Ответ на фармакогенетическую активацию нейронов POA Pacap + был довольно долгоживущим (~ 2-3 дня) и сопровождался тяжелой непереносимостью глюкозы как через 1 час, так и через 24 часа после лечения CNO по сравнению с обработкой носителем (AUC глюкозы: 3610 ± 1216 для физиологического раствора против .23985 ± 2742 за 1 час CNO против 28459 ± 2411 за 24 часа CNO а.е.; р <0,05 по сравнению с физиологическим раствором). Более того, это заметное нарушение толерантности к глюкозе происходило даже после компенсаторного увеличения индуцированной глюкозой секреции инсулина в 24-часовой временной точке (инсулин в плазме (t = 30): 0,42 ± 0,10 для физиологического раствора против 0,45 ± 0,10 нг / мл для 1 мг / мл). CNO в час против 1,05 ± 0,20 нг / мл в течение 24 часов CNO; p = нс). Однако, несмотря на значительное увеличение Tc, острое ингибирование нейронов POA Pacap + не улучшало толерантность к глюкозе, возможно, из-за компенсации другими популяциями WSN, активированными термогенным ответом.Мы пришли к выводу, что нейроны POA Pacap + составляют подмножество WSN, которые оказывают глубокое, ранее неизвестное влияние на гомеостаз глюкозы.
Раскрытие информации J.D. Deem: Нет. К. Огимото: Нет. K.R. Веласко: Нет. В. Дамиан: Нет. Z. Knight: Нет. M.W. Schwartz: Консультант; Себя; Ново Нордиск А / С. Поддержка исследований; Себя; Ново Нордиск А / С. G.J. Мортон: Нет.
- © 2018 Американская диабетическая ассоциация.
Сверхчувствительный белок активирует нейроны в ответ на внешний свет | Спектр
Датчик света: Разработанные мыши экспрессируют высокочувствительный белок в нейронах головного мозга (красный), который можно стимулировать без имплантированного источника света.
Новый минимально инвазивный метод позволяет исследователям активировать нейроны в мозгу мышей и обезьян с помощью источника света, расположенного за пределами головы. 1 .
Этот метод включает в себя оптогенетику — технику, при которой светочувствительные белки, называемые опсинами, встраиваются в нейроны.Затем исследователи могут использовать световые импульсы разной длины волны, чтобы активировать или заставить замолчать клетки 2 . Ученые использовали оптогенетику для изучения аутизма, манипулируя цепями мозга на животных моделях этого состояния.
Оптогенетические эксперименты обычно включают в себя хирургическую имплантацию оптического волокна в мозг животного, чтобы направить свет на нейроны. Но эта процедура может повредить ткани и изменить активность нейронов; у молодых мышей это может привести к аномальному развитию мозга. Имплантированное волокно также обычно стимулирует только около 10 кубических миллиметров ткани мозга, потому что свет не проходит легко через ткань 3 .
В новом методе используется новый тип высокочувствительного опсина, называемый «ступенчатый опсин со сверхвысокой светочувствительностью» или SOUL, для активации нейронов без имплантации оптических волокон. Используя SOUL, ученые могут управлять цепями в любой части мозга мыши и в больших участках коры головного мозга макаки, направляя свет на поверхность мозга или черепа.
SOUL является улучшением по сравнению с другим семейством опсинов, называемых стабилизированными опсинами ступенчатой функции, которые разработаны, чтобы оставаться активными в течение 30 минут после воздействия света.Исследователи сконструировали генетический код опсина SOUL, чтобы включить мутацию, которая, как известно, увеличивает светочувствительность в другом типе опсина, канале родопсине-2. Затем они ввели вирусы, несущие ген, кодирующий опсин SOUL, в мозг мышей и макак.
Сияющий свет за пределами черепа активирует экспрессирующие ДУШУ нейроны глубоко в мозгу мыши, сообщили исследователи в апреле в Neuron . Окрашивание белков, продуцируемых активными нейронами, маркерами антител выявило активацию нейронов в боковом гипоталамусе, одной из самых глубоких областей мозга, примерно на шесть миллиметров ниже поверхности черепа.Эта глубина предполагает, что нейроны в любой части мозга мыши можно модулировать, говорят исследователи.
Нервная активация в боковом гипоталамусе также была достаточно сильной, чтобы изменить поведение животных. Мыши, лишенные пищи, снизили потребление пищи на 10 минут после воздействия синего света, который активирует ДУШУ, сообщают исследователи. После импульса оранжевого света, который деактивирует SOUL, мыши вернулись к своему обычному режиму питания.
Мозг обезьяны :У макак команда также использовала зонды для измерения нейрональной активности в коре головного мозга после световой стимуляции.
Луч синего света, расположенный над твердой мозговой оболочкой, толстой мембраной, окружающей мозг, увеличивает скорость возбуждения нейронов на любой глубине коры, сообщают исследователи.
Команда вызвала экспрессию SOUL в 140 кубических миллиметрах мозга, но, увеличив количество вирусных инъекций и размер светового луча, ученые смогут активировать гораздо больший объем коры головного мозга, говорят исследователи.
Активация нейронов макак с помощью SOUL также генерирует синхронизированную нервную активность или колебания, которые, как считается, нарушаются при аутизме.Это говорит о том, что SOUL можно использовать для изучения роли колебаний в работе мозга.
Новый метод может показать, как определенные типы клеток или мозговые цепи способствуют развитию аутизма, говорят исследователи. Его также можно использовать для манипулирования мозговыми цепями на протяжении всего развития, чтобы определить, чем они могут отличаться при аутизме и когда эти различия возникают.
Светочувствительные нейроны и прозрачный мозг: как провидец навсегда изменил нейробиологию
Стэндфордский нейробиолог Карл Дейссерот обсуждает разработанные им методы исследования мозга.Предоставлено: Эмилиано Родригес Мега
.Родриго Перес Ортега
SAN JOSE, CA — В последние годы Карл Дейссерот произвел революцию в исследованиях в области нейробиологии. Благодаря разработке оригинальных методов он приблизил исследователей к пониманию того, как работает мозг и как нейроны определяют поведение. Во время пленарного выступления на недавнем ежегодном собрании Американской ассоциации содействия развитию науки в Сан-Хосе, штат Калифорния, он поделился некоторыми моментами своего исследовательского путешествия.
Намеки на то, куда могут привести исследования Дайссерота, профессора Стэнфордского университета и исследователя Медицинского института Говарда Хьюза, и других ученых, датируются почти 40 годами. Именно тогда лауреат Нобелевской премии Фрэнсис Крик предположил, что главной проблемой нейробиологии является необходимость контролировать только один тип нейронных клеток в мозге, оставляя другие нетронутыми. Крик предложил использовать свет как способ добиться этого, но ученые в то время не знали, как это можно сделать. Более поздние исследования Дейсерота докажут, что Крик был на правильном пути.
С миллионами нейронов, участвующих в одном конкретном поведении, нелегко выяснить, какие нейроны что делают. Нейроанатомия может дать нам некоторые подсказки, но Дейссерот уверен, что ключ к пониманию того, как работает мозг, — это проанализировать, как отдельные нейроны соединяются и взаимодействуют друг с другом. Такая работа в конечном итоге проливает свет на конкретные нейронные сети или нейронные карты.
Один из методов — использовать неинвазивную визуализацию мозга, чтобы увидеть активность мозга в целом. Это ключ, но разрешение не очень хорошее.«Хотя исследователи много знают о нейронах в чашках Петри, они гораздо меньше знают о том, как нейроны ведут себя естественным образом в этих нейронных картах», — говорит Джек Галлант из Калифорнийского университета в Беркли.
По этой причине Дейссерот и его команда пришли к нетрадиционной идее работы с опсинами бактерий или водорослей — белками, встроенными в клеточные мембраны, которые при стимуляции светом могут вызывать возбуждение нейронов. Он предположил, что эти опсины могут контролировать определенные нейроны вместе с оптическими волокнами.«Маловероятно, что это сработает. Были проблемы, но мы смогли их преодолеть », — сказал Дейссерот во время выступления на AAAS. Проверочный эксперимент был проведен в 2007 году, когда они смогли контролировать двигательную активность мыши с помощью синего света. Они назвали эту новую технику оптогенетикой.
С тех пор этот метод широко используется нейробиологами во всем мире для понимания нейронных карт, связанных с депрессией, злоупотреблением наркотиками, социальной дисфункцией, памятью о страхе и болезнью Паркинсона, среди других состояний.Например, тревога — это психическое состояние, которое включает в себя несколько поведенческих и физиологических результатов, таких как избегание риска и респираторные изменения. В 2013 году Дейссерот и его команда смогли проанализировать, как конкретная субрегион мозга может управлять этими выходными сигналами, согласовывая работу различных частей мозга в унисон, вызывая некоторые из классических симптомов тревоги.
Чтобы выйти за рамки контроля отдельных нейронов и сделать возможным наблюдение естественных паттернов мозговой активности, в 2014 году Дейссерот разработал новую технику, называемую волоконной фотометрией.Это включает в себя установку датчика кальция в определенные нейроны, что позволяет определять, какие клетки активизируются в реальном времени, чтобы расшифровать, какие нейроны реагируют на какие стимулы.
Последней частью головоломки было понимание проводки, лежащей в основе поведения. Еще два года назад единственным способом отследить связи для одного нейрона было разрезать мозг, отобразить его, а затем восстановить все полученные изображения. Даже при тщательном выполнении этого метода было недостаточно для картирования очень маленьких структур.Деиссерот решил эту проблему, разработав ЯСНОСТЬ, которая включает химическую обработку, которая делает ткани мозга прозрачными. Это пропускает свет от микроскопа, позволяя получать трехмерные изображения нейронов с высоким разрешением. Лаборатории в других частях мира использовали эту технику для изучения широкого спектра заболеваний, включая болезнь Альцгеймера и рассеянный склероз.
Методы, которые Дейсерот помог разработать, привели к ответам на многочисленные вопросы, которые нейробиологи пытались решить в течение многих лет, например, как воспоминания хранятся и вызываются в мозгу и как некоторые нейроны вызывают кокаиновую зависимость.
В конце концов, оптогенетика может даже быть лечением некоторых психических расстройств, позволяя контролировать ошибочные нейронные карты. «Я думаю, у нас есть еще кое-что, — говорит Дейссерот, — нам нужно немного лучше понять схему проводки … но более важным является понимание фундаментальной науки, потому что это может позволить создать любое новое лечение: лучшие лекарства, лучший мозг.