Фізіологія скелетних м язів: ФІЗІОЛОГІЯ М’ЯЗІВ
ФІЗІОЛОГІЯ М’ЯЗІВ
Розділ 12. Фізіологія м’язів та нервів
трансформується, зрівноважується в силі, внаслідок чого скорочення м’яза будуть майже однакові.
Удругій, парадоксальній, стадії відбувається дальше зниження лабільності. При цьому слабкі або поодинокі подразнення, що збігаються у часі з закінченням відносної рефрактерної фази або початком екзальтаційної, викликають значне скорочення м’яза. Часті або сильні подразнення, збігаючись із закінченням абсолютної рефрактерності або початком відносної, поєднуючись з впливом наркотичної речовини, дають мінімальне скорочення м’яза.
Угальмівній стадії лабільність нерва знижена настільки, що подразнення будь-якої сили або частоти збігаються з абсолютною рефрактерною фазою і не викликають скорочення м’яза. Припинення провідності пов’язане з дією наркотичної речовини, що є хімічним подразником. Діючи безперервно, цей подразник перешкоджає процесам відновлення.
Парабіоз можна викликати також хімічними або фізичними подразниками — кислотою, лугом, розчинами солей, холодом, теплом тощо.
Аналізуючи результати власних досліджень, М. Є. Введенський дійшов висновку, що природа збудження та гальмування одна й та сама. Якщо подразнення відповідає лабільності, тобто функціональній рухливості тканини, настає збудження. Подразнення, що не відповідає функціональній рухливості тканини, викликає гальмування. Таким чином, гальмування — це місцеве, стійке, непоширене збудження.
На думку М. Є. Введенського, загальна властивість нервової та м’язової тканини — рефрактерність є процесом гальмування. Повторні подразнення, що потрапляють на нерв, коли він перебуває в стані збудження, викликаного .першим подразненням, посилюють місцеве збудження настільки, що настає гальмування.
Песимум також слід розглядати як фізіологічний парабіоз.
Організми тварин здатні до активних рухів — цитоплазматичних, війчастих, джгутикових і м’язових.
У хребетних тварин розпізнають скелетну (поперечносмугасту), гладеньку та серцеву м’язову тканини. .
431
Фізіологія сільськогосподарських тварин
Особливості будови м’язів. Скелетні м’язи складаються з великої кількості окремих клітин — м’язових волокон діаметром 10–100 мкм, укритих загальною сполучнотканинною оболонкою. З допомогою цих м’язів відбуваються всі довільні рухи організму тварини.
Скелетні м’язи складаються з великої кількості окремих клітин — м’язових волокон діаметром 10–100 мкм, укритих загальною сполучнотканинною оболонкою. З допомогою цих м’язів відбуваються всі довільні рухи організму тварини.
Кожне волокно, довжина якого залежить від розмірів та форми м’яза, являє собою багатоядерне циліндричне утворення. У середній частині волокна є хімічно чутливе місце — кінцева пластинка, де закінчується рухливий аксон, створюючи моторну бляшку, або нервово- м’язовий синапс (рис. 124). При збудженні аксон мотонейрона виділяє ацетилхолін, у результаті чого відбувається деполяризація м’язового волокна і генерація електричного імпульсу. Останній, поширюючись
вобидва боки до кінців волокна, викликає скорочення м’яза.
Ум’язовому волокні є неспеціалізована цитоплазма — саркоплазма та спеціалізована — кіноплазма, що складається з поздовжньо розміщених міофібрил, діаметр яких дорівнює 1–2 мкм. Сарколема — оболонка м’язової клітини, зв’язана з сухожилком і переходить у сполучну тканину міжм’язових волокон.
До складу саркоплазми входять білки (міоген, глобулін X та міоглобін), які, з’єднуючись з киснем крові, утворюють оксиміоглобін, що забезпечує постачання м’язів киснем. Найбільше міоглобіну знаходиться в м’язах тварин, здатних тривалий час знаходитись під водою: у дельфіна — 14%, кита — 16, тюленя — 20–40% від сухого залишку м’язової тканини.
Рис. 124. Закінчення аксона (1) рухливого нейрона на кінцевих пластинках (2) двох поперечносмугастих м’язових волокон (3)
Рис. 125. Схема (за Сафоновим): 1 — електронно-мікроскопічної фотографії міофібрили; 2 — будова саркомера; Z — мембрана Z, М — мембрана М, А — анізотропна ділянка, J — ізотропна ділянка, а — актинові і m — міозинові протофібрили
432
Розділ 12. Фізіологія м’язів та нервів
Міофібрили містять мільйони товстих (діаметр 110–140 c ) і тонких (діаметр — 40 c ) ниток — протофібрил, або філаментів (рис. 125). Товсті протофібрили складаються з білка міозину, відносна молекулярна маса якого становить близько 420000.
Поперечна смугастість міофібрил залежить від правильного чергування темних анізотропних (А) і світлих, ізотропних (J) ділянок. Анізотропні ділянки мають сильне, а ізотропні — слабке подвійне променезаломлення. Світлі ділянки розподіляються мембраною Z,
до якої прикріплені активові про- |
|
тофібрили. Ділянка між двома Z |
|
називається саркомером. У темних |
|
ділянках розміщені товсті міози- |
|
нові протофібрили, що утворюють |
|
мембрану М. |
|
Скелетні м’язи добре забезпе- |
|
чені рухливими і чутливими нер- |
|
вами (рис. |
|
іннервує групу м’язових волокон. |
|
Чутливі нервові закінчення роз- |
|
міщуються не на звичайних екcт- |
|
рафузальних, а на дуже тонких |
|
інтрафузальних м’язових волок- |
|
нах в середині м’язового веретена. |
|
М’язові веретена розкидані по всіх |
|
скелетних м’язах. |
|
Гладенькі м’язи є в усіх па- | Рис. 126. Схема іннервації попере- |
ренхіматозних органах, у судинах, | |
кишках, сечовому міхурі, молочній | чносмугастого м’яза рухливими та |
залозі, шкірі і т.п. Вони являють | чутливими волокнами (за Денні- |
собою веретеноподібні клітини, що | Брауном): |
1 — рухливі нерви; 2 — чутливі нер- | |
не мають поперечної смугастості, | пи; 3 — м’язове веретено; 4 — екстра- |
довжиною 20–500 та діаметром | фузальне м’язове веретено; 5 — чут- |
4–5 мкм. | ливі закінчення; 6 — сухожилковий |
безліч прото-фібрил. | орган Гольджі |
433
Фізіологія сільськогосподарських тварин
Серцевий м’яз хребетних складається з поперечносмугастих волокон. Старе уявлення про те, що синтицій м’яза серця може розглядатись як одне м’язове волокно, не відповідає дійсності. Установлено, що в серцевому м’язі є вставні двомембранні диски, що порушують безперервність волокон.
Скелетні м’язи відзначаються збудливістю, провідністю, скоротливістю, еластичністю, розтягненням, пластичністю та тонічністю.
Про збудливість м’яза свідчать виникнення потенціалу дії, підвищення обміну речовин та його скорочення.
Збудливість скелетного м’яза менша порівняно з нервом. Визначають її прямим подразненням електричним струмом. З метою виключення нервового волокна м’яз заздалегідь піддають дії отрути кураре, що порушує передачу збудження з нерва на’ м’язову клітину.
Подразнення у м’язах не передаються з одного волокна на інше. Отже, у м’язових волокнах, як і в нервових, спостерігається ізольова-
не проведення збудження.
Швидкість поширення збудження залежить від будови м’язових волокон. У білих волокнах з великою кількістю міофібрил вона становить 12–15, а в червоних — 3–4 м/с.
Активність м’яза виявляється у його скороченні, при якому відбувається укорочення і потовщення без зміни об’єму. Розрізняють ізотонічне та ізометричне скорочення м’язів. Якщо без підняття вантажу м’яз скорочується, не напружуючись, таке скорочення називають ізотонічним (грец. isos — однаковий, tonos — напруга).
Максимальне напруження м’яза без укорочення, коли обидва його кінці зафіксовані, є ізометричним скороченням. Уся енергія, що утворюється при цьому, повністю перетворюється в тепло. В організмі не буває ні чисто ізотонічних, ні чисто ізометричних скорочень м’язів, тому що, піднімаючи вантаж (наприклад, при виносі передньої кінцівки), м’яз одночасно і скорочується, і напружується.
Еластичність, або пружність, м’яза — це властивість повертатися до первісного стану після усунення деформуючої сили. Вивчають її розтягненням. Найбільшу еластичність мають білі волокна.
434
Розділ 12. Фізіологія м’язів та нервів
Подовження м’яза під впливом вантажу називається розтяжністю. Чим більше навантаження м’яза, тим більше його розтягнення. Властивість розтяжності особливо добре виражена в червоних волокнах і м’язах з паралельно розміщеними волокнами» М’яз не володіє абсолютною еластичністю, тому після усунення вантажу завдяки своїй пластичності він деякий час залишається подовженим.
Під пластичністю слід розуміти властивість тіла зберігати форму або довжину після припинення дії на нього зовнішньої деформуючої сили.
Сарколемі та міофібрилам однаковою мірою властиві еластичність і пластичність, саркоплазмі — лише пластичність. Серед м’я- зових волокон пластичність виявляється більше у червоних волокнах, ніж у білих.
Однією з властивостей скелетних м’язів є їх тонічність (тривале напруження та незначне укорочення). Тонічні скорочення м’язів пов’язані з червоними волокнами, особливістю яких є повільне скорочення та розслаблення. Під впливом рідких імпульсів центральної нервової системи відбувається перебудова колоїдної структури м’язової клітини, скручування протофібрил, зміцнення їх молекулярних зв’язків без зміни поперечної смугастості. Перерізування еферентних нервів призводить до різкого зниження м’язового тонусу, що вказує на його рефлекторну природу.
Тонічні скорочення м’язів пов’язані з червоними волокнами, особливістю яких є повільне скорочення та розслаблення. Під впливом рідких імпульсів центральної нервової системи відбувається перебудова колоїдної структури м’язової клітини, скручування протофібрил, зміцнення їх молекулярних зв’язків без зміни поперечної смугастості. Перерізування еферентних нервів призводить до різкого зниження м’язового тонусу, що вказує на його рефлекторну природу.
Тонічні скорочення м’яза не потребують великих енергетичних затрат, тому, перебуваючи в стані тонусу, м’язи довго не втомлюються.
Тонус скелетних м’язів забезпечує пересування тварини в просторі, підтримує позу та положення тіла при стоянні.
Поодиноке і тетанічне скорочення м’яза. Залежно від частоти подразнення, можна одержати поодиноке і тетанічне скорочення м’яза.
У лабораторних умовах на короткочасне поодиноке подразнення електричним струмом достатньої сили м’яз відповідає поодиноким скороченням (рис. 127).
Аналізуючи криву скорочення литкового м’яза жаби на кімографі, відмічають три періоди: прихований, або латентний, — час від моменту подразнення до початку скорочення, періоди скорочення та розслаблення.
435
Фізіологія сільськогосподарських тварин
Увесь цикл поодинокого скорочення м’яза триває 0,1 с. З цього часу на латентний період припадає 0,01 с, на період скорочення — 0,04 та період розслаблення — 0,05 с.
Латентний період включає час, коли відбуваються енергетичні процеси, що забезпечують скорочення м’яза. Чим сильніше подразнення, тим коротший латентний період. Пік потенціалу дії в часі збігається з латентним періодом.
Уссавців тривалість поодинокого скорочення скелетних м’язів коливається від 0,04 до 0,1 с. Найбільша швидкість скорочення відмічена у поперечносмугастих м’язах крилець комах — 0,003–0,005 с.
Тривалість різних фаз поодинокого скорочення м’яза залежить від його функціональних властивостей, утоми, охолодження тощо.
При стомленні латентний період, а також скорочення і розслаблення м’яза значно подовжуються.
Сила поодинокого скорочення м’яза великою мірою залежить від сили подразнення. Із збільшенням сили подразнення скорочення м’яза посилюється. При подразненні струмом порогової сили скорочується невелика кількість найбільш збудливих м’язових клітин. З посиленням подразнення починають реагувати інші м’язові клітини.
При подразненні струмом порогової сили скорочується невелика кількість найбільш збудливих м’язових клітин. З посиленням подразнення починають реагувати інші м’язові клітини.
Уприроднихумовахпоодинокіскороченням’язанеспостерігаються. Центральна нервова система посилає до м’яза не поодинокі імпульси, а цілий вибух з частотою 50–70 імпульсів у секунду. У відповідь на часті ритмічні скорочення м’яз переходить у стан тривалого безперервного скорочення, що одержало назву тетанічного, або тетанусу.
Рис. 127. Поодиноке скорочення | Рис. 128. Скорочення м’яза: |
м’яза: | 1 — поодиноке; 2 — зубчастий те- |
а — момент подразнення м’яза; | танус; 3 — прямий тетанус |
а–б — латентний період; б–в — |
|
скорочення м’яза; в–г — розсла- |
|
блення м’яза; г — додаткові елас- |
|
тичні коливання |
|
436
Розділ 12. Фізіологія м’язів та нервів
Фізіологія м’язів та нервів
При рідких подразненнях, найбільше 10 у секунду, виникає ряд поодиноких скорочень — чергові подразнення застають м’яз у розслабленому стані. З прискоренням подразнення (з 10 до 25 в секунду) кожний імпульс буде впливати на м’яз у момент його розслаблення. Виникає неповний, або зубчастий тетанус. Коли ж частота подразнень перевищує 25 у секунду, настає повний, або гладкий, тетанус (рис. 128). Це пояснюється тим, що новий імпульс надходить до м’яза до початку його розслаблення. На подразнення вище 300 у секунду м’яз взагалі не відповідає, тому що чергові подразнення припадають на фазу абсолютної рефрактерності.
Висота тетанусу залежить від ритму подразнення, збудливості та лабільності, що змінюються у процесі діяльності м’яза.
Оптимум скорочення його буває в тому випадку, коли чергові імпульси діють на м’яз у фазі екзальтації — період максимального збудження.
Джерелом енергії при роботі м’язів є біохімічні процеси, що відбуваються у дві фази: анаеробну (без кисню) та аеробну (з участю кисню). В анаеробній фазі відбувається інтенсивний розпад аденозинтрифосфорної кислоти (АТФ) з утворенням аденозиндифосфорної (АДФ), фосфорної та аденілової кислот. При розпаді АТФ виділяється енергія, що використовується для роботи м’язів.
В анаеробній фазі відбувається інтенсивний розпад аденозинтрифосфорної кислоти (АТФ) з утворенням аденозиндифосфорної (АДФ), фосфорної та аденілової кислот. При розпаді АТФ виділяється енергія, що використовується для роботи м’язів.
Аеробна фаза характеризується окисленням молочної кислоти та інших органічних сполук до СО2 і Н2О. Створювана при цьому енергія йде на ресинтез залишків молочної кислоти до глікогену та ресинтез АТФ і креатинофосфорної кислоти (фосфагену).
При скороченні м’язів більша частина потенціальної енергії хімічних речовин перетворюється в теплову і лише 25–30% її в механічну, що і становить коефіцієнт корисної дії (ККД) — відношення кінетичної енергії скорочення м’язів до всієї енергії, виробленої м’язами під час роботи.
ККД м’язів тварини визначається в результаті прямої чи непрямої калориметрії, з урахуванням тепла, що виділяється під час спокою та роботи. Наприклад, у стані спокою тварина виділила Q тепла, а при роботі W віддача тепла становила Q1 ККД К буде дорівнювати:
K W . Q1 Q
Q1 Q
437
Фізіологія м’язів — презентация онлайн
1. Тема лекції: “Фізіологія м’язів”
2. Типи м’язових волокон
3. Нейро-моторні одиниці
Аксон рухового нейрона інервує багатом’язових волокон. Група м’язових
волокон, які інервуються одним
мотонейроном утворюють рухову або
нейромоторну одиницю. Кількість
м’язових волокон у такій одиниці може
бути різною. Рухові одиниці, які
контролюють точні рухи, як правило,
складаються з невеликої кількості
м’язових волокон. До них відносяться
м’язи пальців рук. Сила скорочення
м’яза регулюється кількістю збуджених
рухових одиниць.
Всі рухові одиниці скелетних
м’язів ділять на дві групи: фазні або
швидкі і тонічні або повільні. У фазних
нейромоторних одиницях поодинокий
тип інервації (мал. а), а в тонічних множинний (мал. б).
4. Електрофізіологічні особливості скелетного м’яза
У фазних м’язових волокнахвеличина мембранного
потенціалу спокою становить
-80-90 мВ.
 Створює цей
Створює цейпотенціал дифузія іонів
К+ і Cl- , але основна роль
належить іонам Cl-. У генерації
потенціалу дії фазних м’язових
волокон, основну участь
приймають іони Na+ і K+. У
потенціалі дії розрізняють пік,
який складається з висхідної
(деполяризація) і низхідної
(реполяризація) частини. У
кінці потенціалу дії є слідовий
негативний потенціал.
Слідового позитивного
потенціалу і гіперполяризації
немає.
5. Будова скелетного м’яза
М’яз складається із багатьох м’язовихволокон, покритих збудливою мембраною.
У саркоплазмі м’язового волокна
розташовані міофібрили, які відокремлені
одна від одної саркоплазматичним
ретикулумом (СР). CP — це мережа,
утворена зі з’єднаних між собою цистерн,
трубочок та пухирців. На мембранах CP
працює кальцієва помпа, яка накачує іони
кальцію із саркоплазми у порожнину
ретикулума, в результаті чого створюється
градієнт їх концентрації між саркоплазмою
і CP.
 До цистерн CP тісно прилягають так
До цистерн CP тісно прилягають такзвані Т-трубочки, поверхневі мембрани
яких втискуються перпендикулярно у
м’язове волокно. Вони оточують кожну
міофібрилу і таким чином сполучаються
своїми порожнинами з міжклітинним
середовищем.
6. Ультраструктура скелетного м’за
М’язове волокно скелетних м’язів маєпоперечну посмугованість — регулярно
чергуються світлі і темні ділянки. Це
зумовлено взаєморозташуванням актинових
і міозинових ниток. Відстань між двома
сусідніми
Z-мембранами
називається
саркомером. Н-смуга — ділянка, де в
розслабленому
стані
м’яза
тонкі
міофіламенти не накладаються на товсті; Асмуга — анізотропний диск, утворений
сукупністю міозинових філаментів; І-смуга ізотропний диск, утворений сукупністю
актинових філаментів; Z-пластинка — тонка
мембрана, яку видно на поперечному зрізі
як темну лінію в центрі І-диску; служить
для
розмежування
саркомерів
посмугованого м’яза.

7. Будова і фізіологічна роль актину
Актинова нитка складається зглобулярних молекул білка актину,
об’єднаних у два ланцюжки і
закручених у подвійну спіраль. У
борозенках цієї спіралі через рівні
проміжки розташований інший білок тропонін, що складається з трьох
субодиниць, одна з яких, кальмодулін, у
спокої закриває активний центр актину,
тому міозинові містки не можуть
приєднатися до нього. Кальмодулін має
підвищену спорідненість до іонів
кальцію, у разі з’єднування з яким
змінює свою просторову конфігурацію і
відкриває активний центр актину під
час м’язового скорочення.
8. Будова і фізіологічна роль міозину
Молекула міозину складається з двохвеликих поліпептидів (важких ланцюгів)
і чотирьох менших (легких ланцюгів). Ці
поліпептиди складають молекулу з
двома глобулярними «головками», які
містять обидва види ланцюгів, і довгим
стрижнем
(«хвостом»)
з
двох
переплетених важких ланцюгів, їх
інакше
називають
поперечними
містками.
 На кожній глобулярної голівці
На кожній глобулярної голівцізнаходяться по дві ділянки зв’язування:
для актину і для АТФ. Ділянки
зв’язування з АТФ володіють також
властивостями ферменту АТФ-ази, який
гідролізує молекулу АТФ.
9. Співвідношення збудження і скорочення скелетного м’яза
•У нормальних умовахпотенціал дії фазного
м’язового волокна
супроводжується одиноким
скороченням. Це скорочення
починається після закінчення
пікової частини потенціалу
дії і триває 200-300 мс при
тривалості потенціалу дії 3-5
мс. Час від початку
виникнення потенціалу дії до
початку появи скорочення
називається латентним
періодом скорочення.
10. Спряження процесів збудження і скорочення в скелетному м’язі
• Генерація ПД мотонейроном• Вивільнення ацетилхоліну в
кінцевій пластинці
• Зв’язування ацетилхоліну з
ацетилхоліновими рецепторами
постсинаптичної мембрани
• Збільшення проникності
постсинаптичної мембрани
(мембрана м’язового волокна) до
Na+ і К+
• Утворення потенціалу кінцевої
пластинки
• Утворення ПД м’язового
волокна
• Поширення деполяризації у Ттрубочках.

• Вихід іонів кальцію в міоплазму.
11. Механізм скорочення скелетних м’язів
Іони кальцію із цистер СР за градієнтом концентрації надходятьусередину міофібрил і розподіляються між актиновими та
міозиновими нитками. Тут іони кальцію зв’язуються з
тропоніном С, внаслідок чого відкривається активний центр
актину, з яким тут же вступає в реакцію міозиновий місток.
Одночасно іде розщеплення АТФ, енергія якої витрачається на
поворот містка, який уже зв’язаний з актином і він від’єднується
від актину. На їх місце приєднується нова молекула АТФ, що
призводить до розриву зв’язку міозину з активним центром
актину, — відбувається ковзання ниток актину і міозину одна
відносно іншої (на «один крок»). Водночас інший місток
приєднується до наступного актинового центру і т.д. У
результаті скорочується кожен саркомер окремо і все м’язове
волокно в цілому.
12. Механізм розслаблення скелетних м’язів
• Розслаблення м’яза наступає після фазиреполяризації.
 Під час цього активується
Під час цього активуєтьсякальцієва помпа на мембранах CP, яка
активно перекачує туди іони кальцію.
Актоміозинові зв’язки розриваються і м’яз
завдяки своїй пружності та еластичності
видовжується. Оскільки робота помпи
вимагає затрат енергії, очевидно, що процес
м’язового розслаблення супроводжується
розпадом АТФ.
13. Механізм скорочення і рослаблення скелетних м’язів
Таким чином, енергіяАТФ під час м’язового
скорочення і
розслаблення
витрачається на роботу
Na-K-помпи на поверхні Черевце
мембрани м’язового
волокна, на забезпечення
роботи кальцієвої помпи
на мембранах CP
Сухожилля
(створення надлишку
іонів кальцію у
порожнинах CP) і на саме
м’язове скорочення
(поворот міозинового
містка і ковзання
протофібрил).
Фасція
М’язове волокно
Міофібрила
14. Типи скорочення м’язів
•Ізотонічними називаютьсяскорочення, під час яких
довжина м’яза зменшується, а
напруга не змінюється.
 Чисто
Чистоізотонічних скорочень за
звичайних умов не існує.
•У разі ізометричних скорочень
довжина м’яза не змінюється, а
напруга його зростає (наприклад,
скорочення м’яза, у якого
нерухомо закріплено обидва
кінці).
•Концентричними називаються
скорочення, за яких м’яз
скорочується, і ексцентричними,
якщо м’яз подовжується
(наприклад, у разі опускання
вантажу).
15. Сумація скороченнь м’язів
Зубчастий тетанус виникає при такій частоті, коли кожен наступний імпульсзастає м’яз у періоді розслаблення. Суцільний тетанус спостерігається, коли
нова хвиля скорочення починається до початку розслаблення. У природних
умовах від рухових нейронів до м’яза надходить серія імпульсів. Тому
тетанічний режим для скелетних м’язів є фізіологічним. Надзвичайно висока
частота подразнень викликає зниження сили скорочень м’яза.
16. Електрофізіологічні особливості гладких м’язів
• Потенціал спокою гладких м’язів, по-перше,може бути стабільним у межах від -50 мВ до -60
мВ (наприклад, у судинах), по-друге, у вигляді
повільних хвиль спонтанного коливання
деполяризації (наприклад, у клітинах травного
тракту).
 Коливання здійснюється практично в
Коливання здійснюється практично вмежах від -30 до -60 мВ. Потенціал спокою в
гладких м’язах формується іонами К+, Na+, Cl- .
Особливістю іонного складу є велика
внутрішньоклітинна концентрація іонів Na+ і Cl-.
17. Електрофізіологічні особливості гладких м’язів
• Потенціали дії гладкихфазних м’язових волокон
тривають від 29-50 мс до 1 с
і більше. Отже тривалість
потенціалу дії гладких
м’язів більша за потенціал
дії скелетних м’язів. Проте
його амплітуда менша, ніж у
скелетних м’язів.
Закінчується потенціал дії
гладких м’язів слідовою
гіперполяризацією.
18. Електрофізіологічні особливості гладких м’язів
У розвитку потенціалу дії гладких м’язів основна рольналежить іонам кальцію. Іони калію зменшують амплітуду і
тривалість потенціалу дії гладких м’язів. Потенціал дії
гладких м’язових волокон за причиною виникнення може бути:
стимульованим (нейрогенним) або спонтанним (міогенним).
Спонтанні потенціали виникають, як правило, в травному
каналі.
 Виділяють два типи спонтанної активності: перший
Виділяють два типи спонтанної активності: першийтип нерегулярний — потенціали дії виникають нерегулярно з
різною частотою і другий тип регулярний – потенціали дії
виникають регулярно. Спонтанна активність виникає у
м’язових клітинах, які виконують функцію водія ритму. У цих
клітинах локальний потенціал досягає критичного рівня
деполяризації і переходить у потенціал дії. Після реполяризації
мембрани спонтанно виникає наступний потенціал дії і так
далі. Потенціал дії поширюється через нексуси на сусідні
м’язові клітини, охоплює увесь м’яз, спричиняючи його
скорочення.
19. Механізм скорочення гладких м’язів
•У цитоплазмі гладких м’язових волоконтакож присутні міозин і актин. Актин
кріпиться або до плазматичної
мембрани, або до так званих щільних
тілець. У розслабленому гладкому
м’язовому волокні актин і міозин
орієнтовані під косим кутом до довгої
осі клітини. Під час вкорочення волокна
ділянки плазматичної мембрани, що
знаходяться між точками прикріплення
актину, вибухають.
м’язів відбувається також за допомогою
механізму ковзних ниток. У гладких
м’язів немає тропоніну С. Замість цього
цикл поперечних містків у гладких
м’язах контролюється Са2+ регульованим ферментом, який
фосфорилює міозин.
20. Еластичність, пластичність і розтяжність гладких м’язів
• При розтягненні гладкі м’язи функціонують як в’язкоеластичні іпластичні утвори. Під еластичністю розуміють властивість,
суть якої зводиться до здатності відповідати на розтягнення
підвищенням напруження. Важливою властивістю гладкого
м’яза є і пластичність, тобто здатність зберігати надану
розтягненням довжину без зміни напруження. Так от, на
початку розтягування спостерігається деяке підвищення
напруги, зумовлене еластичними властивостями міоцитів, а далі
відбувається пластична податливість — напруження падає.
Завдяки пластичній податливості непосмугована м’язова
тканина може бути розслабленою як у розтягнутому, так і в
скороченому стані.
 Внаслідок цієї властивості не відчувається
Внаслідок цієї властивості не відчуваєтьсятиску при наповненні шлунка або сечового міхура. Тобто
завдяки пластичності гладких м’язів стінок порожнистих
органів, тиск всередині них мало змінюється при різному
ступені їх наповнення. Однак сильне розтягнення веде до
активування клітин водіїв ритму, внаслідок чого виникає
скорочення гладких м’язів.
21. Електрофізіологічні особливості кардіоміоцитів
• У склад серцевого м’яза входять клітини скоротливогоміокарда і провідної системи. Величина потенціалу
спокою клітин скоротливого міокарда складає — 90-95
мВ. Ця величина є стабільною. Потенціал спокою
клітин скоротливого міокарда створюється іонами
К+, Cl, проте на відміну від фазних смугастих м’язів
хлорна проникність мембрани, порівняно з
калієм, дуже мала. Потенціал спокою клітин провідної
системи нижчий і складає близько — 60 мВ, проявляє
спонтанні коливання і називається повільною
спонтанною діастолічною деполяризацією.
 Це пов’язано
Це пов’язаноз великою натрієвою проникністю мембран клітин
провідної системи.
22. Електрофізіологічні особливості кардіоміоцитів
Серце здатне генерувати і двапринципово різних потенціали
дії: швидкий потенціал дії
скоротливого міокарда і
повільний потенціал дії клітин
провідної системи. Швидкий
потенціал дії триває більше 200
мс. Умовно його поділяють на
швидку деполяризацію (фаза 0),
швидку початкову
реполяризацію (фаза 1),
повільну реполяризацію (плато)
(фаза 2), швидку кінцеву
деполяризацію (фаза 3), фазу
спокою (фаза 4).
0 – фаза швидкої деполяризації; 1 –
фаза швидкої початкової
реполяризації; 2 – фаза повільної
реполяризації; 3 – фаза швидкої
кінцевої реполяризації; 4 – фаза
спокою
23. Електроміографія
Електроміографія — це метод реєстрації потенціалів дії,що виникають у м’язах.
Електроміографія двохголового м’яза плеча при
статичному напруженні різної сили
24.
 Типи електроміограм Перший тип — характерний для нормального м’яза і виникає при
Типи електроміограм Перший тип — характерний для нормального м’яза і виникає прийого довільних скороченнях. Цей тип електроміограми характеризується
ритмічністю і високою частотою виникнення потенціалів дії — більше 50
за секунду.
Другий тип електроміограми характеризується ритмічністю
виникнення потенціалів дії з частотою від 6 до 50 за секунду. Причому
другий тип електроміограми має два підтипи: ІІа і ІІб. Підтип ІІа при
довільних скороченнях м’язів характеризується частотою виникнення
потенціалів від 6 до 20 за секунду, а підтип Пб – від 21 до 50 за
секунду. Цей тип електроміограми спостерігається деколи при
зменшенні кількості функціонуючих м’язових волокон та в основному
при ураженні рухових нейронів спинного мозку.
Третій тип електроміограми характеризується появою групових
ритмічних і неритмічних розрядів при довільних м’язових скороченнях.
Такий тип електроміограми спостерігається при ураженні
супраспинальних рухових центрів.
 Наприклад, при паркінсонізмі.
Наприклад, при паркінсонізмі.Четвертий тип електроміограми характеризується електричним
мовчанням м’яза при спробі довільного м’язового скорочення. Такий тип
електроміограми відмічається при паралічах, повній атрофії м’язів,
руйнуванні нервів.
Скелетные осложнения у онкологических больных с костной тканью метастазы
1. Pond GR, Sonpavde G, de Wit R, Eisenberger MA, Tannock IF, Armstrong AJ. Прогностическое значение места метастазирования у мужчин с метастатический резистентный к кастрации рак предстательной железы. Евр Урол. 2014;65:3–6. [PubMed] [Google Scholar]
2. Кристофори Г. Новые сигналы с инвазивного фронта. Природа. 2006; 441:444–50. [PubMed] [Google Scholar]
3. Sleeman JP. Метастатическая ниша и стромальная прогрессия. Метастаз рака, ред. 2012; 31:429.–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Мургай М., Джайлз А., Каплан Р. Физиологические, опухолевые и метастатические ниши: возможности и
Проблемы при нацеливании на микроокружение опухоли. Критический преподобный Онког. 2015;20:301–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Критический преподобный Онког. 2015;20:301–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Olechnowicz SW, Edwards CM. Вклад микроокружения хозяина в развитие рака кости болезнь. Рак Рез. 2014;74:1625–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Shiozawa Y, Pedersen EA, Havens AM, et al. Метастазы рака предстательной железы человека нацелены на гемопоэтический ствол клеточная ниша, чтобы закрепиться в костном мозге мыши. Джей Клин Инвест. 2011;121:1298–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Wang H, Yu C, Gao X, et al. Остеогенная ниша способствует ранней стадии колонизации костной ткани. диссеминированные клетки рака молочной железы. Раковая клетка. 2015;27:193–210. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Clines GA, Guise TA. Гиперкальциемия злокачественных новообразований и фундаментальные исследования механизмов
ответственны за остеолитические и остеобластные метастазы в
кость. Endocr Relat Рак. 2005; 12: 549–83. [PubMed] [Академия Google]
[PubMed] [Академия Google]
9. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J. Здоровье костей у больных раком: клиническая практика ESMO. Методические рекомендации. Энн Онкол. 2014;25(Приложение 3):iii124–37. [PubMed] [Google Scholar]
10. van den Beuken-van Everdingen MH, de Rijke JM, Kessels AG, Schouten HC, van Kleef M, Patijn J. Распространенность боли у больных раком: систематический обзор за последние 40 лет. Энн Онкол. 2007; 18:1437–49. [PubMed] [Google Scholar]
11. Coleman RE. Скелетные осложнения злокачественных новообразований. Рак. 1997;80:1588–94. [PubMed] [Google Scholar]
12. Jimenez-Andrade JM, Mantyh WG, Bloom AP, Ferng AS, Geffre CP, Mantyh PW. Боль при раке кости. Энн Н.Ю. Академия наук. 2010;1198:173–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Liao J, McCauley LK. Скелетные метастазы: установленные и новые роли белок, родственный гормону паращитовидной железы (PTHrP) Cancer Metastasis Rev. 2006;25:559–71. [PubMed] [Google Scholar]
14. Peters CM, Ghilardi JR, Keyser CP, et al. Индуцированное опухолью повреждение первичных афферентных чувствительных нервных волокон в
боль при раке кости. Опыт Нейрол. 2005;193:85–100. [PubMed] [Google Scholar]
Peters CM, Ghilardi JR, Keyser CP, et al. Индуцированное опухолью повреждение первичных афферентных чувствительных нервных волокон в
боль при раке кости. Опыт Нейрол. 2005;193:85–100. [PubMed] [Google Scholar]
15. Yoneda T, Hiasa M, Nagata Y, Okui T, White F. Вклад кислой внеклеточной микросреды колонизированная раком кость к боли в костях. Биохим Биофиз Акта. 2015; 1848: 2677–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Ghilardi JR, Rohrich H, Lindsay TH, et al. Селективная блокада рецептора капсаицина TRPV1 ослабляет боль при раке кости. Дж. Нейроски. 2005; 25:3126–31. [бесплатная статья PMC] [PubMed] [Google Scholar]
17. Mantyh PW. Боль при раке кости: от механизма к терапии. Curr Opin Support Palliat Care. 2014; 8: 83–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. McGrath PA. Разработка рекомендаций Всемирной организации здравоохранения по раку
Обезболивание и паллиативная помощь детям. J Управление симптомами боли. 1996; 12:87–92. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
19. Burton AW, Cleeland CS. Боль при раке: прогресс после рекомендаций ВОЗ. Практика боли. 2001; 1: 236–42. [PubMed] [Google Scholar]
20. Pergolizzi JV, Zampogna G, Taylor R, Gonima E, Posada J, Raffa RB. Руководство по лечению боли в сообществах с низким и средним уровнем дохода. Управление риском злоупотребления опиоидами у больных раком Боль. Фронт Фармакол. 2016;7:42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Набал М., Либрада С., Редондо М.Дж., Пигни А., Брунелли С., Карачени А. Роль парацетамола и нестероидных противовоспалительных препаратов в дополнение к опиоидам ступени III ВОЗ в контроле боли на поздних стадиях рак. Систематический обзор литературы. Паллиат Мед. 2012;26:305–12. [PubMed] [Google Scholar]
22. Chow E, Harris K, Fan G, Tsao M, Sze WM. Испытания паллиативной лучевой терапии при метастазах в кости: систематический обзор. Дж. Клин Онкол. 2007; 25:1423–36. [PubMed] [Академия Google]
23. Лутц С., Берк Л., Чанг Э. и др. Паллиативная лучевая терапия метастазов в кости: ASTRO
доказательное руководство. Int J Radiat Oncol Biol Phys. 2011;79:965–76. [PubMed] [Google Scholar]
Лутц С., Берк Л., Чанг Э. и др. Паллиативная лучевая терапия метастазов в кости: ASTRO
доказательное руководство. Int J Radiat Oncol Biol Phys. 2011;79:965–76. [PubMed] [Google Scholar]
24. Ripamonti CI, Santini D, Maranzano E, Berti M, Roila F. Лечение боли при раке: клиническая практика ESMO Методические рекомендации. Энн Онкол. 2012;23(Приложение 7):vii139–54. [PubMed] [Google Scholar]
25. van der Linden MW, Gaugris S, Kuipers EJ, et al. Ингибиторы ЦОГ-2: сложная ассоциация с более низким риском госпитализация по поводу желудочно-кишечных осложнений по сравнению с традиционными НПВП Плюс ингибиторы протонной помпы. Фармакоэпидемиол Препарат Саф. 2009 г.;18:880–90. [PubMed] [Google Scholar]
26. Джулиус Д., Басбаум А.И. Молекулярные механизмы ноцицепции. Природа. 2001; 413: 203–10. [PubMed] [Google Scholar]
27. Sabino MA, Ghilardi JR, Jongen JL, et al. Одновременное уменьшение боли при раке, разрушения костей и
рост опухоли путем селективного ингибирования циклооксигеназы-2. Рак Рез. 2002;62:7343–9. [PubMed] [Google Scholar]
Рак Рез. 2002;62:7343–9. [PubMed] [Google Scholar]
28. Hirose M, Kuroda Y, Murata E. Сигнализация NGF/TrkA как терапевтическая мишень для Боль. Практика боли. 2016;16:175–82. [PubMed] [Академия Google]
29. Левин Г.Р., Риттер А.М., Менделл Л.М. Гипералгезия, вызванная фактором роста нервов, у новорожденных и новорожденных. взрослая крыса. Дж. Нейроски. 1993; 13:2136–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Thacker MA, Clark AK, Marchand F, McMahon SB. Патофизиология периферической нейропатической боли: иммунные клетки и молекулы. Анест Анальг. 2007; 105: 838–47. [PubMed] [Google Scholar]
31. Basbaum AI, Bautista DM, Scherrer G, Julius D. Клеточные и молекулярные механизмы боли. Клетка. 2009 г.;139:267–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Petty BG, Cornblath DR, Adornato BT, et al. Эффект системно введенного рекомбинантного человеческого нерва фактора роста у здоровых людей. Энн Нейрол. 1994; 36: 244–6. [PubMed] [Google Scholar]
33. Dyck PJ, Peroutka S, Rask C, et al. Внутрикожный рекомбинантный фактор роста нервов человека индуцирует
аллодиния давления и снижение теплоболевого порога у человека. Неврология. 1997; 48: 501–5. [PubMed] [Академия Google]
Dyck PJ, Peroutka S, Rask C, et al. Внутрикожный рекомбинантный фактор роста нервов человека индуцирует
аллодиния давления и снижение теплоболевого порога у человека. Неврология. 1997; 48: 501–5. [PubMed] [Академия Google]
34. Halvorson KG, Kubota K, Sevcik MA, et al. Блокирующие антитела к фактору роста нервов ослабляют скелетные боль, вызванная клетками опухоли предстательной железы, разрастающимися в костях. Рак Рез. 2005; 65: 9426–35. [PubMed] [Google Scholar]
35. Bloom AP, Jimenez-Andrade JM, Taylor RN, et al. Вызванное раком молочной железы ремоделирование кости, скелетная боль и разрастание чувствительных нервных волокон. Джей Пейн. 2011;12:698–711. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Adriaenssens E, Vanhecke E, Saule P, et al. Фактор роста нервов является потенциальной терапевтической мишенью в молочной железе. рак. Рак Рез. 2008; 68: 346–51. [PubMed] [Академия Google]
37. Lane NE, Schnitzer TJ, Birbara CA, et al. Танезумаб для лечения боли при остеоартрите
колено.![]() N Engl J Med. 2010; 363:1521–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
N Engl J Med. 2010; 363:1521–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Brown MT, Murphy FT, Radin DM, Davignon I, Smith MD, West CR. Танезумаб уменьшает боль в колене при остеоартрите: результаты исследования рандомизированное двойное слепое плацебо-контролируемое исследование III фазы. Джей Пейн. 2012;13:790–8. [PubMed] [Google Scholar]
39. Brown MT, Murphy FT, Radin DM, Davignon I, Smith MD, West CR. Танезумаб уменьшает боль в бедре при остеоартрите: результаты исследования рандомизированное двойное слепое плацебо-контролируемое исследование III фазы. Ревмирующий артрит. 2013;65:1795–803. [PubMed] [Google Scholar]
40. Katz N, Borenstein DG, Birbara C, et al. Эффективность и безопасность танезумаба при лечении хронических боль в спине. Боль. 2011; 152:2248–58. [PubMed] [Google Scholar]
41. Sopata M, Katz N, Carey W, et al. Эффективность и безопасность танезумаба при лечении боли от костные метастазы. Боль. 2015; 156:1703–13. [PubMed] [Google Scholar]
42. Пинто А., Мерино М., Самора П., Редондо А., Каштело Б., Эспиноса Е. Ориентация на ось эндотелина в простате
карцинома. Опухоль биол. 2012;33:421–6. [PubMed] [Академия Google]
Пинто А., Мерино М., Самора П., Редондо А., Каштело Б., Эспиноса Е. Ориентация на ось эндотелина в простате
карцинома. Опухоль биол. 2012;33:421–6. [PubMed] [Академия Google]
43. Нельсон Дж.Б., Кардуччи М.А. Роль эндотелина-1 и антагонистов эндотелиновых рецепторов в рак простаты. БЖУ Интерн. 2000; 85 (Приложение 2): 45–8. [PubMed] [Google Scholar]
44. Peters CM, Lindsay TH, Pomonis JD, et al. Эндотелин и туморогенный компонент рака кости боль. Неврология. 2004; 126:1043–52. [PubMed] [Google Scholar]
45. Pomonis JD, Rogers SD, Peters CM, Ghilardi JR, Mantyh PW. Экспрессия и локализация эндотелиновых рецепторов: последствия участия периферической глии в ноцицепции. Дж. Нейроски. 2001;21:999–1006. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Wacnik PW, Eikmeier LJ, Ruggles TR, et al. Функциональные взаимодействия между опухолью и периферическим нервом:
морфология, идентификация алгогена и поведенческая характеристика нового
мышиная модель раковой боли. Дж. Нейроски. 2001; 21:9355–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Нейроски. 2001; 21:9355–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Yin JJ, Mohammad KS, Kakonen SM, et al. Причинная роль эндотелина-1 в патогенезе остеобластические метастазы в костях. Proc Natl Acad Sci U S A. 2003; 100:10954–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Qiao L, Liang Y, Li N, et al. Антагонисты рецептора эндотелина-А в лечении рака предстательной железы метаанализ. Int J Clin Exp Med. 2015;8:3465–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Nelson JB, Fizazi K, Miller K, et al. Фаза 3, рандомизированное, плацебо-контролируемое исследование зиботентана (ZD4054) у пациентов с резистентным к кастрации раком предстательной железы с метастазами в кость. Рак. 2012; 118:5709–18. [PubMed] [Академия Google]
50. Carducci MA, Saad F, Abrahamsson PA, et al. Рандомизированное контролируемое исследование 3 фазы эффективности и безопасности
Применение атрасентана у мужчин с метастатической гормонорезистентной простатой
рак. Рак. 2007; 110: 1959–66. [PubMed] [Google Scholar]
Рак. 2007; 110: 1959–66. [PubMed] [Google Scholar]
51. Патил Дж., Шваб А., Нуссбергер Дж., Шаффнер Т., Сааведра Дж. М., Имбоден Х. Внутринейронная ангиотензинергическая система крысы и спины человека. корневые ганглии. Регул Пепт. 2010;162:90–8. [Статья бесплатно PMC] [PubMed] [Google Scholar]
52. Smith MT, Woodruff TM, Wyse BD, Muralidharan A, Walther T. Низкомолекулярный рецептор ангиотензина II типа 2 (AT(2)R) антагонист вызывает анальгезию в крысиной модели невропатической боли путем ингибирование митоген-активируемой протеинкиназы p38 (MAPK) и p44/p42 MAPK активация спинномозговых ганглиев. Боль Мед. 2013; 14:1557–68. [PubMed] [Академия Google]
53. Anand U, Facer P, Yiangou Y, et al. Локализация рецептора ангиотензина II типа 2 (AT2 R) и опосредованное антагонистами ингибирование реакций капсаицина и роста нейритов в сенсорных нейронах человека и крысы. Евр Джей Пейн. 2013;17:1012–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Муралидхаран А. , Вайс Б.Д., Смит М.Т. Анальгетическая эффективность и механизм действия селективного небольшого
молекула антагонист рецептора ангиотензина II типа 2 в крысиной модели
боли в костях, вызванные раком предстательной железы. Боль Мед. 2014;15:93–110. [PubMed] [Google Scholar]
, Вайс Б.Д., Смит М.Т. Анальгетическая эффективность и механизм действия селективного небольшого
молекула антагонист рецептора ангиотензина II типа 2 в крысиной модели
боли в костях, вызванные раком предстательной железы. Боль Мед. 2014;15:93–110. [PubMed] [Google Scholar]
55. Smith MT, Wyse BD, Edwards SR. Низкомолекулярный рецептор ангиотензина II типа 2 (AT(2)R) антагонисты как новые анальгетики при невропатической боли: сравнительный анализ фармакокинетика, связывание радиолиганда и эффективность у крыс. Боль Мед. 2013; 14: 692–705. [PubMed] [Google Scholar]
56. Blair HC. Как остеокласты разрушают кость. Биоэссе. 1998; 20: 837–46. [PubMed] [Google Scholar]
57. Reeh PW, Kress M. Молекулярная физиология протонной трансдукции в ноцицепторы. Курр Опин Фармакол. 2001; 1:45–51. [PubMed] [Академия Google]
58. Nagae M, Hiraga T, Yoneda T. Кислая микросреда, создаваемая остеокластами, вызывает боль в костях
связаны с колонизацией опухоли. J Bone Miner Метаб. 2007; 25:99–104. [PubMed] [Google Scholar]
2007; 25:99–104. [PubMed] [Google Scholar]
59. Родан Г.А., Мартин Т.Дж. Терапевтические подходы к заболеваниям костей. Наука. 2000; 289:1508–14. [PubMed] [Google Scholar]
60. Coxon FP, Helfrich MH, Van’t Hof R, et al. Геранилгеранилирование белка необходимо для образования остеокластов. функция и выживание: ингибирование бисфосфонатами и ГГТИ-298. J Bone Miner Res. 2000; 15:1467–76. [PubMed] [Google Scholar]
61. Saad F, Gleason DM, Murray R, et al. Рандомизированное плацебо-контролируемое исследование золедроновой кислоты в пациенты с гормонорефрактерными метастазами простаты карцинома. J Natl Cancer Inst. 2002; 94: 1458–68. [PubMed] [Google Scholar]
62. Smith JA., Jr. Смягчение болезненных костных метастазов рака предстательной железы с использованием этидронат натрия: результаты рандомизированного, проспективного, двойного слепого, плацебо-контролируемое исследование. Дж Урол. 1989;141:85–87. [PubMed] [Google Scholar]
63. Strang P, Nilsson S, Brandstedt S, et al.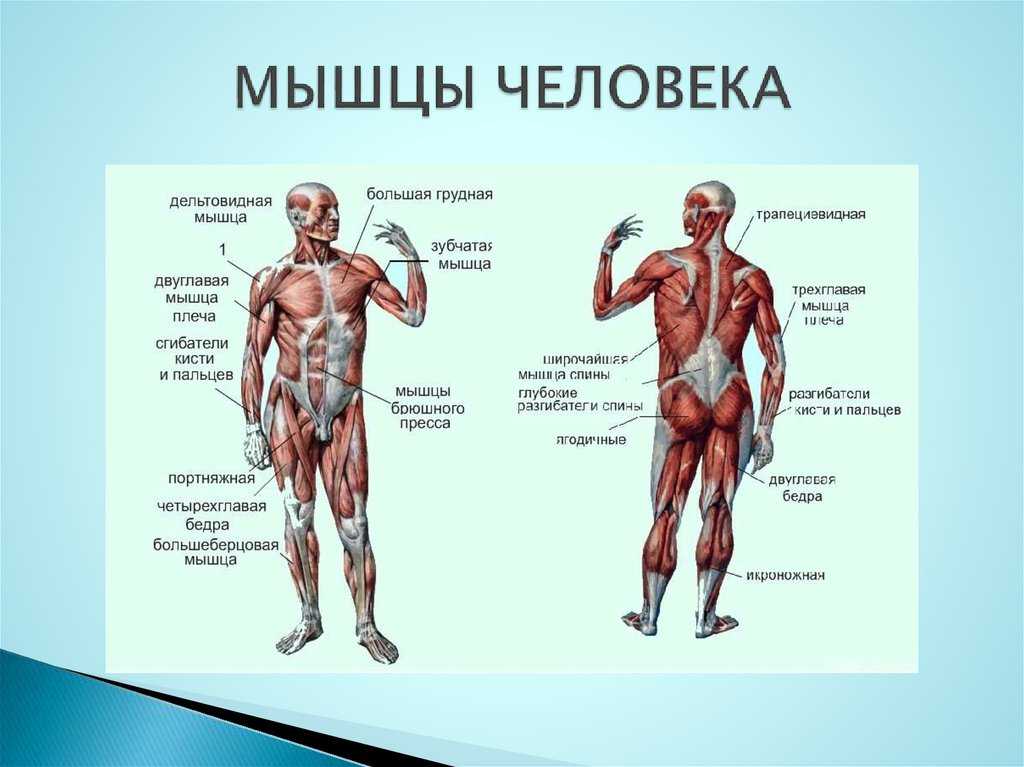 Анальгетическая эффективность клодроната по сравнению с плацебо в
пациенты с болезненными костными метастазами рака предстательной железы. Противораковый Рез. 1997; 17:4717–21. [PubMed] [Google Scholar]
Анальгетическая эффективность клодроната по сравнению с плацебо в
пациенты с болезненными костными метастазами рака предстательной железы. Противораковый Рез. 1997; 17:4717–21. [PubMed] [Google Scholar]
64. Кылмала Т., Таубе Т., Таммела Т.Л., Ристели Л., Ристели Дж., Эломаа И. Сопутствующее внутривенное введение. и пероральный клодронат в рельефе кости боль — двойное слепое плацебо-контролируемое исследование у пациентов с простатитом рак. Бр Дж Рак. 1997;76:939–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Luger NM, Honore P, Sabino MA, et al. Остеопротегерин уменьшает прогрессирующий рак кости боль. Рак Рез. 2001;61:4038–47. [PubMed] [Google Scholar]
66. Dougall WC. Молекулярные пути: остеокласт-зависимый и независимая от остеокластов роль пути RANKL/RANK/OPG в онкогенезе и метастазы. Клин Рак Рез. 2012;18:326–35. [PubMed] [Google Scholar]
67. Fizazi K, Carducci M, Smith M, et al. Деносумаб по сравнению с золедроновой кислотой для лечения метастазов в кости
у мужчин с кастрационно-резистентным раком предстательной железы: рандомизированное двойное слепое исследование
исследование.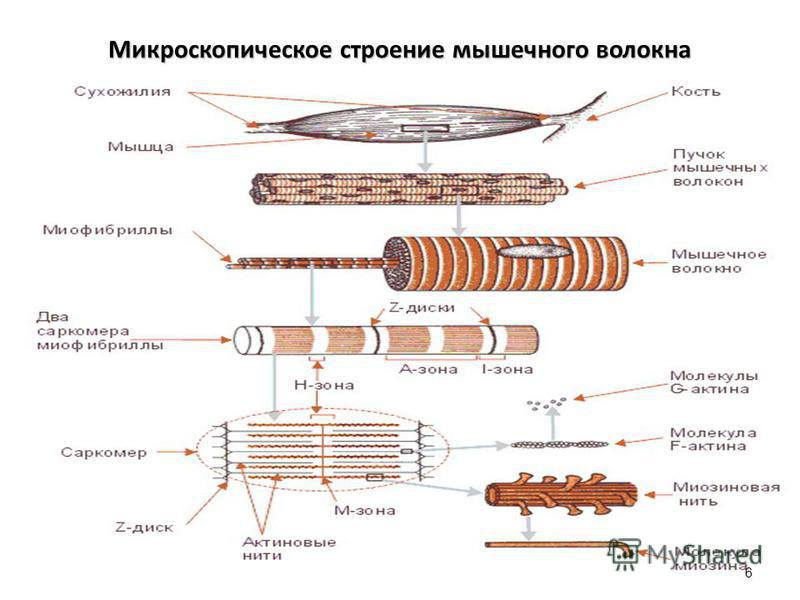 Ланцет. 2011; 377:813–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет. 2011; 377:813–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Stopeck AT, Lipton A, Body JJ, et al. Деносумаб по сравнению с золедроновой кислотой для лечения костей метастазы у пациентов с распространенным раком молочной железы: рандомизированное, двойное слепое исследование. Дж. Клин Онкол. 2010;28:5132–9. [PubMed] [Google Scholar]
69. Cleeland CS, Body JJ, Stopeck A, et al. Исходы боли у пациентов с распространенным раком молочной железы и костей метастазы: результаты рандомизированного двойного слепого исследования деносумаба и золедроновая кислота. Рак. 2013; 119:832–8. [PubMed] [Академия Google]
70. Saftig P, Hunziker E, Wehmeyer O, et al. Нарушение резорбции костной ткани остеокластами приводит к остеопетрозу. катепсин-К-дефицитных мышей. Proc Natl Acad Sci U S A. 1998; 95:13453–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Le Gall C, Bellahcene A, Bonnelye E, et al. Ингибитор катепсина К уменьшает остеолиз, вызванный раком молочной железы. и опухолевой массой скелета. Рак Рез. 2007; 67: 9894–902. [PubMed] [Google Scholar]
и опухолевой массой скелета. Рак Рез. 2007; 67: 9894–902. [PubMed] [Google Scholar]
72. Jensen AB, Wynne C, Ramirez G, et al. Ингибитор катепсина К оданакатиб подавляет резорбцию кости. у женщин с раком молочной железы и установленными метастазами в кости: результаты 4-недельное двойное слепое рандомизированное контролируемое исследование. Клин Рак молочной железы. 2010;10:452–8. [PubMed] [Академия Google]
73. Bone HG, Dempster DW, Eisman JA, et al. Оданакатиб для лечения постменопаузального остеопороза: история развития и дизайн и характеристики участников LOFT, Долгосрочное испытание перелома оданакатиба. Остеопорос Инт. 2015;26:699–712. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Stewart AF. Клиническая практика. Гиперкальциемия, связанная с рак. N Engl J Med. 2005; 352: 373–9. [PubMed] [Google Scholar]
75. Гесек Ф.А., Фридман П.А. О механизме стимуляции паратиреоидным гормоном кальция
поглощение клетками дистальных извитых канальцев мышей. Джей Клин Инвест. 1992;90:749–58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 1992;90:749–58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Pfister MF, Lederer E, Forgo J, et al. Зависимая от паратиреоидного гормона деградация II типа Котранспортеры Na+/Pi. Дж. Биол. Хим. 1997; 272:20125–30. [PubMed] [Google Scholar]
77. Horiuchi N, Caulfield MP, Fisher JE, et al. Сходство синтетического пептида опухоли человека с паращитовидной железой гормона in vivo и in vitro. Наука. 1987; 238:1566–8. [PubMed] [Google Scholar]
78. Abou-Samra AB, Juppner H, Force T, et al. Экспрессионное клонирование общего рецептора паратгормона и родственный паратгормону пептид из остеобластоподобных клеток крысы: один рецептор стимулирует внутриклеточное накопление как цАМФ, так и инозитолтрифосфатов и увеличивает внутриклеточное свободное кальций. Proc Natl Acad Sci U S A. 1992;89:2732–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Clines GA. Механизмы и лечение гиперкальциемии
злокачественность. Curr Opin Endocrinol Diabetes Obes. 2011;18:339–46. [PubMed] [Google Scholar]
2011;18:339–46. [PubMed] [Google Scholar]
80. Ralston SH, Gallacher SJ, Patel U, Campbell J, Boyle IT. Гиперкальциемия, связанная с раком: заболеваемость и смертность. Клинический опыт у 126 пролеченных пациентов. Энн Интерн Мед. 1990; 112: 499–504. [PubMed] [Google Scholar]
81. Hosking DJ, Cowley A, Bucknall CA. Регидратация при лечении тяжелых гиперкальциемия. Кью Мед. 1981;50:473–81. [PubMed] [Google Scholar]
82. Тосани С., Ху М.И. Деносумаб: новый препарат для лечения гиперкальциемии злокачественность. Онкол будущего. 2015;11:2865–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Hu MI, Glezerman IG, Leboulleux S, et al. Деносумаб для лечения гиперкальциемии злокачественность. J Clin Endocrinol Metab. 2014;99:3144–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Sternlicht H, Glezerman IG. Гиперкальциемия злокачественных новообразований и новое лечение опции. Ther Clin Risk Manag. 2015;11:1779–88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Purdue BW, Tilakaratne N, Sexton PM. Молекулярная фармакология рецептора кальцитонина. Рецепторные каналы. 2002; 8: 243–55. [PubMed] [Google Scholar]
Purdue BW, Tilakaratne N, Sexton PM. Молекулярная фармакология рецептора кальцитонина. Рецепторные каналы. 2002; 8: 243–55. [PubMed] [Google Scholar]
86. Аарон А.Д. Лечение метастатической аденокарциномы малого таза и конечности. J Bone Joint Surg Am. 1997; 79: 917–32. [PubMed] [Google Scholar]
87. Bohm P, Huber J. Хирургическое лечение костных метастазов позвоночника и конечности. J Bone Joint Surg Br. 2002; 84: 521–9.. [PubMed] [Google Scholar]
88. Sarahrudi K, Hora K, Heinz T, Millington S, Vecsei V. Результаты лечения патологических переломов длинных костей: a ретроспективный анализ 88 пациентов. Инт Ортоп. 2006; 30: 519–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Bryson DJ, Wicks L, Ashford RU. Расследование и ведение пациентов с подозрением на злокачественное патологические переломы: обзор общего ортопедического хирург. Рана. 2015; 46:1891–9. [PubMed] [Академия Google]
90. Пэрриш Ф.Ф., Мюррей Дж.А. Хирургическое лечение вторичных неопластических переломов. А
ретроспективное исследование девяноста шести пациентов. J Bone Joint Surg Am. 1970; 52: 665–86. [PubMed] [Google Scholar]
А
ретроспективное исследование девяноста шести пациентов. J Bone Joint Surg Am. 1970; 52: 665–86. [PubMed] [Google Scholar]
91. Snell W, Beals RK. Бедренные метастазы и переломы молочной железы Рак. Хирургический гинекологический акушер. 1964; 119: 22–4. [PubMed] [Google Scholar]
92. Yazawa Y, Frassica FJ, Chao EY, Pritchard DJ, Sim FH, Shives TC. Метастатическое заболевание костей. Исследование хирургического лечения 166 патологические переломы плечевой и бедренной кости. Clin Orthop Relat Relat Res. 1990:213–9. [PubMed] [Google Scholar]
93. Menck H, Schulze S, Larsen E. Размер метастазов при патологических переломах бедренной кости. Акта Ортоп Сканд. 1988; 59: 151–4. [PubMed] [Google Scholar]
94. Van der Linden YM, Dijkstra PD, Kroon HM, et al. Сравнительный анализ факторов риска патологического перелома с метастазами в бедро. J Bone Joint Surg Br. 2004; 86: 566–73. [PubMed] [Google Scholar]
95. Ristevski B, Jenkinson RJ, Stephen DJ, et al. Смертность и осложнения после стабилизации бедренной кости
метастатические поражения: популяционное исследование региональных вариаций и
исход. Может J Surg. 2009 г.;52:302–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Смертность и осложнения после стабилизации бедренной кости
метастатические поражения: популяционное исследование региональных вариаций и
исход. Может J Surg. 2009 г.;52:302–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Frassica DA. Общие принципы дистанционной лучевой терапии при скелетные метастазы. Clin Orthop Relat Relat Res. 2003: С158–64. [PubMed] [Google Scholar]
97. Воланчик М.Ю., Фахриан К., Адамец И.А. Лучевая терапия, бисфосфонаты и хирургическая стабилизация Полные или угрожающие патологические переломы у пациентов с метастазами в костях Болезнь. Дж Рак. 2016;7:121–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Прасад Д., Шифф Д. Злокачественная компрессия спинного мозга. Ланцет Онкол. 2005; 6: 15–24. [PubMed] [Google Scholar]
99. Cole JS, Patchell RA. Метастатическая эпидуральная компрессия спинного мозга. Ланцет Нейрол. 2008; 7: 459–66. [PubMed] [Google Scholar]
100. Ушио Ю., Познер Р., Познер Дж. Б., Шапиро В. Р. Экспериментальная компрессия спинного мозга эпидуральной анестезией.
новообразование. Неврология. 1977; 27: 422–9. [PubMed] [Google Scholar]
Р. Экспериментальная компрессия спинного мозга эпидуральной анестезией.
новообразование. Неврология. 1977; 27: 422–9. [PubMed] [Google Scholar]
101. Ramsey R, Doppman JL. Влияние эпидуральных образований на кровоток в спинном мозге. Ан экспериментальное исследование на обезьянах. Радиология. 1973;107:99–103. [PubMed] [Google Scholar]
102. Като А., Ушио Ю., Хаякава Т., Ямада К., Икеда Х., Могами Х. Нарушение кровообращения в спинном мозге с эпидуральным новообразованием. у крыс. Дж Нейрохирург. 1985; 63: 260–5. [PubMed] [Google Scholar]
103. Fawzy M, El-Beltagy M, Shafei ME, et al. Интраспинальная нейробластома: варианты лечения и неврологические Результат компрессии спинного мозга. Онкол Летт. 2015; 9: 907–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Sorensen S, Helweg-Larsen S, Mouridsen H, Hansen HH. Эффект высоких доз дексаметазона при карциноматозном метастазировании
компрессия спинного мозга, леченная лучевой терапией: рандомизированный
пробный.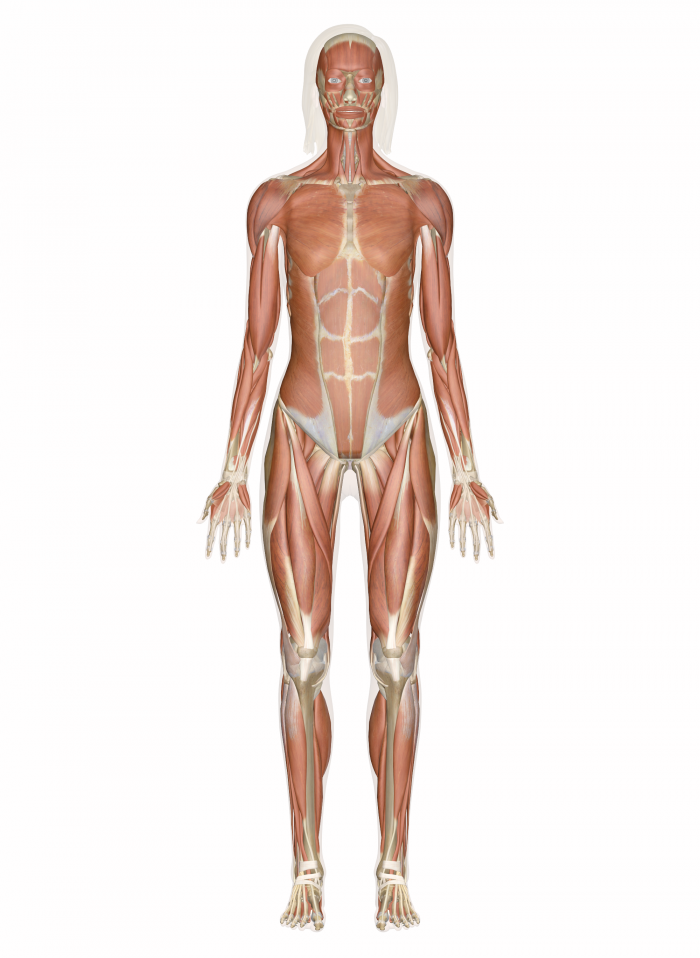 Евр Джей Рак. 1994;30А:22–7. [PubMed] [Google Scholar]
Евр Джей Рак. 1994;30А:22–7. [PubMed] [Google Scholar]
105. Patchell RA, Tibbs PA, Regine WF, et al. Прямая декомпрессивная хирургическая резекция в лечении компрессия спинного мозга, вызванная метастатическим раком: рандомизированный пробный. Ланцет. 2005; 366: 643–8. [PubMed] [Google Scholar]
106. Андреев Х.Дж., Норман А.Р., Оутс Дж., Каннингем Д. Почему пациенты с потерей веса имеют худший результат, когда проходите химиотерапию по поводу злокачественных новообразований желудочно-кишечного тракта? Евр Джей Рак. 1998; 34: 503–9. [PubMed] [Академия Google]
107. Сакаи Р., Это Ю. Участие активина в регуляции костной ткани. метаболизм. Мол Селл Эндокринол. 2001; 180:183–8. [PubMed] [Google Scholar]
108. Вильдеманн Б., Кадоу-Ромакер А., Хаас Н.П., Шмидмайер Г. Количественная оценка различных факторов роста в различных деминерализованные препараты костного матрикса. J Biomed Mater Res A. 2007; 81: 437–42. [PubMed] [Google Scholar]
109. Lee SJ, Reed LA, Davies MV, et al. Регуляция мышечного роста с помощью передачи сигналов несколькими лигандами через
Рецепторы активина II типа. Proc Natl Acad Sci U S A. 2005; 102:18117–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Регуляция мышечного роста с помощью передачи сигналов несколькими лигандами через
Рецепторы активина II типа. Proc Natl Acad Sci U S A. 2005; 102:18117–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Waning DL, Mohammad KS, Reiken S, et al. Избыток ТФР-бета опосредует мышечную слабость, связанную с костями. метастазы у мышей. Нат Мед. 2015;21:1262–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Анатомия, физиология и функция костей
Rosenberg AE, Roth SI (2007) Bone. В: Mills SE (ред.) Гистология для гистопатологов, 3-е изд. Липпинкот Уильямс, Филадельфия, Пенсильвания
Google ученый
Shea JE, Miller SC (2005) Скелетная функция и структура: последствия для терапии, направленной на ткани. Adv Drug Del Rev 57: 945–957
CrossRef КАС Google ученый
Аллен М. Р., Хок Дж.М., Берр Д.Б. (2004) Надкостница: биология, регуляция и реакция на терапию остеопороза. Кость 35: 1003–1012
Р., Хок Дж.М., Берр Д.Б. (2004) Надкостница: биология, регуляция и реакция на терапию остеопороза. Кость 35: 1003–1012
CrossRef пабмед КАС Google ученый
Уолш В.Р., Уолтон М., Брюс В. и др. (2003) Клеточная структура и биология кости и хряща. В: An YH, Martin KL (ред.) Справочник по методам гистологии кости и хряща. Humana Press, Тотова, Нью-Джерси
Google ученый
Weiner S, Traub W, Wagner HD (1999) Пластинчатая кость: структурно-функциональные отношения. J Struct Biol 126: 241–255
CrossRef пабмед КАС Google ученый
Cohen MM Jr. (2006) Новая биология кости: патологические, молекулярные и клинические корреляты. Am J Med Genet A 140A: 2646–2706
CrossRef КАС Google ученый
Harada S-I, Rodan GA (2003) Контроль функции остеобластов и регуляция костной массы. Nature 243: 349–355
CrossRef КАС Google ученый
Franz-Odendaal TA, Hall BK, Witten PE (2006). Похоронен заживо: как остеобласты становятся остеоцитами. Дев Дин 235: 176–190
Перекрестная ссылка пабмед КАС Google ученый
Stains JP, Civitelli R (2005) Межклеточные взаимодействия в регуляции остеогенеза и функции остеобластов. Birth Def Res C 75: 72–80
CrossRef КАС Google ученый
Пятна JP, Civitelli R (2005) Щелевые соединения в развитии и функционировании скелета. Biochem Biophys Acta 1719: 69–81
перекрестная ссылка пабмед КАС Google ученый
Knothe Tate ML, Adamson JR, Tami AE, et al. (2004) Остеоцит. Int J Biochem Cell Biol 36: 1–8
CrossRef пабмед КАС Google ученый
Iqbal J, Zaidi M (2005) Молекулярная регуляция механотрансдукции. Biochem Biophys Res Commun 328: 751–755.
Перекрёстная ссылка пабмед КАС Google ученый
Cullinane DM (2002) Роль остеоцитов в регуляции костной ткани: минеральный гомеостаз в сравнении с механорецепцией. J Musculoskelet Neuronal Interact 2: 242–244
PubMed КАС Google ученый
Чемберс TJ (2000) Регуляция дифференцировки и функции остеокластов. J Pathol 192: 4–13
CrossRef пабмед КАС Google ученый
Teitelbaum SL (2000) Резорбция кости остеокластами. Science 289: 1504–1508
Science 289: 1504–1508
CrossRef пабмед КАС Google ученый
Teitelbaum SL (2000)Остеокласты, интегрины и остеопороз. J Bone Miner Metab 18: 344–349
CrossRef пабмед КАС Google ученый
Walker DG (1972) Врожденный остеопетроз у мышей, вылеченный путем парабиотического союза с нормальными братьями и сестрами. Эндокринология 91: 916–920
Перекрестная ссылка пабмед КАС Google ученый
Walker DG (1973) Лечение остеопетроза временным парабиозом. Наука 180:875
CrossRef пабмед КАС Google ученый
Walker DG (1975) Резорбция костей восстановлена у мышей с остеопетрозом путем трансплантации нормальных клеток костного мозга и селезенки. Science 190: 784–785
Science 190: 784–785
CrossRef пабмед КАС Google ученый
Walker DG (1975) Клетки селезенки передают остеопетроз у мышей. Science 190: 785–787
CrossRef пабмед КАС Google ученый
Bar-Shavit Z (2007) Остеокласт: многоядерная костно-резорбирующая остеоиммунная клетка теплопоэтического происхождения. J Cell Biochem 102: 1130–1139
CrossRef пабмед КАС Google ученый
Coccia PF, Krivit W, Cervenka J, et al. (1980) Успешная трансплантация костного мозга по поводу детского злокачественного остеопетроза. N Engl J Med 302: 701–708
PubMed КАС Google ученый
Blair HC, Robinson LJ, Zaidi M (2005)Сигнальные пути остеокластов. Biochem Biophys Res Commun 328: 728–738
CrossRef пабмед КАС Google ученый
Clark EA, Brugge JS (1995)Интегрины и пути передачи сигнала: пройденный путь. Наука 268: 233–239
Перекрёстная ссылка пабмед КАС Google ученый
Макхью К.П., Ходивала-Дилке К., Чжэн М.Х. и др. (2000) Мыши, лишенные α v β 3 интегринов, страдают остеосклеротическими изменениями из-за дисфункции остеокластов. J Clin Invest 104: 433–440
CrossRef Google ученый
Engleman VW, Nickols GA, Ross FP, et al. (1997) Пептидомиметический антагонист интегрина avâ3 ингибирует резорбцию кости in vitro и предотвращает остеопороз in vivo. Джей Клин Инвест 99: 2284–2292
Перекрёстная ссылка пабмед КАС Google ученый
Ваананен Х.К., Чжао Х., Мулари М. и др. (2000) Клеточная биология функции остеокластов. J Cell Sci 113: 377–381
J Cell Sci 113: 377–381
PubMed КАС Google ученый
Родан Г.А. (2003) Развитие и функция скелета и метастазирование в кости. Рак 97: 726–732
CrossRef пабмед Google ученый
Молодой МФ (2003). Белки костного матрикса: их функция, регуляция и связь с остеопорозом. Остеопороз Int 14: S35–S42
CAS Google ученый
Steiniche T, Hauge EM (2003) Cell Нормальная структура и функция кости. В: An YH, Martin KL (ред.) Справочник по методам гистологии кости и хряща. Humana Press, Тотова, Нью-Джерси
Google ученый
Alford AI, Hankenson KD (2006) Матрицеллюлярные белки: внеклеточные модуляторы развития, ремоделирования и регенерации костей. Кость 38: 749–757
CrossRef пабмед КАС Google ученый
Доддс Р.А., Коннор Дж.Р., Джеймс И.Е. и др. (1995) Остеокласты человека, а не остеобласты, откладывают остеопонтин на поверхности резорбции: исследование ремоделирования кости in vitro и ex vivo. J Bone Miner Res 10: 1666–1680
Перекрёстная ссылка пабмед КАС Google ученый
Asou Y, Rittling SR, Yoshitake H, et al. (2001) Остеопонтин способствует ангиогенезу, накоплению остеокластов и резорбции в эктопической кости. Endocrinology 142: 1325–1332
CrossRef пабмед КАС Google ученый
Bellahcene A, Castronovo V (1997)Экспрессия белков костного матрикса при раке молочной железы человека: потенциальная роль в формировании микрокальцификации и в генезе костных метастазов. Бык Рак 84: 17–24
ПабМед КАС Google ученый
Валтреньи Д. , Белласен А., Ван Рит И. и др. (1998) Прогностическое значение экспрессии костного сиалопротеина при клинически локализованном раке предстательной железы человека. J Natl Cancer Inst 90: 1000–1008
, Белласен А., Ван Рит И. и др. (1998) Прогностическое значение экспрессии костного сиалопротеина при клинически локализованном раке предстательной железы человека. J Natl Cancer Inst 90: 1000–1008
CrossRef пабмед КАС Google ученый
Джайн А., Карадаг А., Фор Б. и др. (2002) Три SIBLING усиливают активность кофактора фактора H, позволяя MCP подобно клеточному уклонению от атаки, опосредованной комплементом. J Biol Chem 277: 13700–13708
Перекрёстная ссылка пабмед КАС Google ученый
Немото Х., Риттлинг С.Р., Йошитаке Х. и др. (2001) Дефицит остеопонтина уменьшает экспериментальные метастазы опухолевых клеток в кости и мягкие ткани. J Bone Miner Res 16: 652–659
CrossRef пабмед КАС Google ученый
Wickramasinghe SN (2007) Костный мозг. В: Mills SE (ред.) Гистология для гистопатологов, 3-е изд. Липпинкот Уильямс, Филадельфия, Пенсильвания
В: Mills SE (ред.) Гистология для гистопатологов, 3-е изд. Липпинкот Уильямс, Филадельфия, Пенсильвания
Google ученый
Rauch F (2005) Рост костей в длину и ширину: инь и ян стабильности костей. J Mucoskelet Neuronal Interact 5: 194–201
CAS Google ученый
Forriol F, Shapiro F (2005) Развитие костей. Взаимодействие молекулярных компонентов и физических сил. Clin Orthop Relat Res 432: 14–33
Google ученый
Адамс С.Л., Коэн А.Дж., Лассова Л. (2007)Интеграция сигнальных путей, регулирующих дифференцировку хондроцитов во время формирования эндохондральной кости. J Cell Physiol 213: 635–641
CrossRef пабмед КАС Google ученый
Ballock RT, O’Keefe RJ (2003) Физиология и патофизиология пластинки роста. Birth Def Res C 69: 123–143
Birth Def Res C 69: 123–143
CrossRef КАС Google ученый
Frost H (2004) Обновление 2003 г. по физиологии костей и закону Вольфа для клиницистов. Angle Orthod 74: 3–15
PubMed Google ученый
Раис Л.Г. (1999) Физиология и патофизиология костного ремоделирования. Clin Chem 45: 1353–1358
PubMed КАС Google ученый
Kropp HG, Avecilla ST, Hooper AT и др. (2005)Сосудистая ниша костного мозга: место дифференцировки и мобилизации HSC. Физиология (Bethesda) 20: 349–356
Google ученый
Frost H (2001) От закона Вольфа к парадигме Юты: взгляды на физиологию кости и ее клиническое применение. Anat Rec 262: 398–319
CrossRef пабмед КАС Google ученый
Poole KES, Reeve J (2005) Гормон паращитовидной железы – анаболический и катаболический агент костей. Curr Opin Pharmacol 5: 612–617
CrossRef пабмед КАС Google ученый
Guise TA, Mohammad KS, Clines G, et al. (2006)Основные механизмы, ответственные за остеолитические и остеобластические метастазы в кости. Clin Cancer Res 12: 6213–6216
CrossRef Google ученый
Каконен С.М., Манди Г.Р. (2003) Механизмы остеолитических метастазов в кости при карциноме молочной железы. Рак 97: S834–S839
CrossRef Google ученый
Guise TA, Yin JJ, Mohammand KS (2003)Роль эндотелина-1 в остеобластическом метастазировании костей. Рак 97: 779–784
CrossRef пабмед Google ученый
Burger EH, Klein-Nuled J (1999). Механотрансдукция в костной роли лакуноканаликулярной сети. FASEB J 13: S101–S112
PubMed КАС Google ученый
Chattopadhyay N, Brown EM (2006) Роль рецептора, чувствительного к кальцию, в метаболизме минеральных ионов и наследственных нарушениях восприятия кальция. Мол Ген Метаб 89: 189–202
КАС Google ученый
Суда Т., Уэно Ю., Фуджи К. и др. (2003)Витамин D и кости. J Cell Biochem 88: 259–266
CrossRef пабмед КАС Google ученый
Swarthout JT, D’Alonzo RC, Selvamutugan N, et al. (2002) Зависимые от паратиреоидного гормона сигнальные пути, регулирующие гены в костных клетках. Гена 282: 1–17
ПабМед КАС Google ученый

 126). Чутливий нейрон
126). Чутливий нейрон У клітині є одне ядро та
У клітині є одне ядро та