Для чего нужна мембрана в клетке: Клеточная мембрана функции – какие выполняет?
Общая характеристика. Плазматическая (цитоплазматическая) мембрана — обязательный компонент любой клетки. Она отграничивает клетку и обеспечивает сохранение существующих различий между клеточным содержимым и окружающей средой. Мембрана служит высокоизбирательным «входным» селективным фильтром и отвечает за активный транспорт веществ в клетку и из нее. Цитоплазматическую мембрану растительной клетки обычно называют плазмалеммой. Как и любая биологическая мембрана, она представляет собой липидный бислой с большим количеством белков. Основу липидного бислоя составляют фосфолипиды. Помимо них в состав липидного слоя входят гликолипиды и стерины. Липиды достаточно активно перемещаются в пределах своего монослоя, но возможны и их переходы из одного монослоя в другой. Такой переход, называемый «флип-флоп» (от англ. flip-flop), осуществляется ферментом флипазой. Как минимум один из доменов интегрального белка встроен в гидрофобную часть бислоя мембраны, поэтому интегральный белок, как правило, не может быть удален из мембраны без ее разрушения. В последнее время показано существование третьей группы белков, так называемых «заякоренных» в мембране белков). Особенностью липидного состава плазмалеммы по сравнению с другими мембранами растительной клетки является высокое содержание стеринов, но в отличие от плазматической мембраны животной клетки для плазмалеммы характерна высокая вариабельность их состава в зависимости от вида растения, органа и ткани. Например, у ячменя (Hordeum vulgaris) в клетках корня количество свободных стеринов превышает количество фосфолипидов более чем в два раза, тогда как в листьях фосфолипидов больше, чем стеринов почти в 1,5 раза. В листьях шпината (Spinacia oleracia) соотношение фосфолипиды: свободные стерины почти на порядок выше — 9:1. Структурные особенности плазмалеммы. Помимо высокой степени вариабельности плазматическая мембрана растительной клетки имеет ряд структурных особенностей, отличающих ее от других эукариотических клеток. Жирнокислотный состав. Основными жирными кислотами плазмалеммы являются пальмитиновая (16:0), олеиновая (18:1; Δ9), линолевая (18 : 2; Δ9,12) и линоленовая (18 :3; Δ9,12,15). Практически отсутствует стеариновая кислота (18:0) и полностью — арахидоновая (20:4; Δ5’8,11,14), характерные для мембран клеток животных и грибов. Известно, что арахидоновая кислота в очень низких концентрациях является мощным стимулятором фитоиммунитета для некоторых видов растений (например, обеспечивает устойчивость картофеля к фитофторе). Набор стероидов. В плазмалемме, как и во всех мембранах растительной клетки, почти нет холестерина. Его заменяют фитостерины, которые являются С-24-замещенными стеринами. Основные фитостерины — ситостерин, стигмастерин и кампестерин. Помимо свободных фитостеринов присутствуют значительные количества эфиров, гликозидов и ацилгликозидов стеринов, что не характерно для клеток животных. Набор белков. Наличие специфических белков, прежде всего арабиногалактанов (AGPs), обеспечивающих структурное и функциональное взаимодействие плазмалеммы с клеточной стенкой. |
Цитоплазматическая мембрана | справочник Пестициды.ru
Структура цитоплазматической мембраныСтруктура цитоплазматической мембраны
1. Фосфолипиды; 2. Гликолепиды; 3. Интегральные белки; 4. Периферические белки; 5. Олигосахариды
Бактериальная клетка, как и любая другая клетка прокариот, имеет цитоплазму, окруженную цитоплазмотической мембраной. Цитоплазма и цитоплазматическая мембрана составляют протопласт. Снаружи от него располагаются поверхностные структуры. К ним относятся: клеточная стенка, капсулы, чехлы, слизистые слои, жгутики, ворсинки и прочие структуры[1].
Состав ЦПМ
Толщина цитоплазматической мембраны бактериальной клетки обычно составляет около 6–8 нм. На ее долю приходится до 15% сухой массы клетки[3].
Состоит ЦПМ из липидов (15–45%), белков (45–60%) и незначительного количества углеводов (около 10%)[3].
Липиды представлены фосфолипидами – до 30% сухой массы самой мембраны. Преобладают фосфатидилглицерин и дифосфатидилглицерин. В меньшем количестве представлены фосфатидилинозит и фосфатидилэтаноламин. Кроме того, обнаружены гликолипиды, каротиноиды, хиноны[3].
В составе липидов присутствуют нетипичные жирные кислоты (ненасыщенные и мононасыщенные), циклопропановые и разветвленные жирные кислоты. Набор жирных кислот и состоящих из них липидов для прокариот является видоспецифичным признаком[3].
Белки составляют половину и более сухой массы мембран. Их насчитывается более 20 типов. Они подразделяются на интегральные (погружены в гидрофобную область мембраны) и периферические (локализованы на поверхности гидрофильного слоя и часто прикреплены к интегральным белкам)
Углеводы в мембране взаимосвязаны с белками и липидами. Они обычно локализованы только на наружной поверхности и выполняют функции рецепторов опознавания факторов внешней среды[3].
Структура ЦПМ
Цитоплазматическая мембрана бактерий, как и все прочие биологические мембраны, является асимметричной жидкокристаллической структурой. Ее асимметрия обусловлена химическим строением молекул белка и их расположением в липидном слое. Одни белки располагаются на поверхности, другие – погружены в него, третьи проходят насквозь от внутренней до внешней поверхности бислоя. Строго определенная ориентация мембранных белков обусловлена их синтезом и асимметричным включением в мембрану
Наружная и внутренняя поверхности ЦПМ различаются по ферментативной активности[3].
В зависимости от условий окружающей среды, в частности от температуры, ЦПМ находится в различных фазовых состояниях: разжиженном или кристаллическом. При переходе из одной фазы в другую меняется подвижность компонентов мембраны, плотность ее упаковки.
Функции ЦПМ
Цитоплазматическая мембрана выполняет ряд существенных для клетки функций:
- Поддержание внутреннего постоянства цитоплазмы клетки, что достигается за счет полупроницаемости ЦПМ. Она проницаема для воды и низкомолекулярных веществ, но не проницаема для ионизированных соединений[1].
- Транспорт ионизированных веществ внутрь клетки и выход их наружу. Это осуществляется за счет специальных транспортных систем, локализирующихся в мембране. Такие системы функционируют за счет механизмов активного транспорта и системы специфических ферментов пермеаз[1]
- Транспорт веществ в клетку и вывод их наружу, что так же связано с полупроницаемостью ЦПМ[1].
- Локализация электротранспортной цепи и ферментов окислительного фосфорилирования[1].
- Синтез клеточной стенки и капсулы, что происходит за счет наличия в ЦПМ специфических переносчиков для образующихся молекул[1].

- Закрепление и энергетическое обеспечение работы жгутиков[1].
Суперкомпьютеры и клеточные мембраны / Хабр
В 1944 году физик Эрвин Шредингер, один из основателей современной квантовой механики, опубликовал небольшую книгу, которая изменила ход современной биологии. «Что такое Жизнь?» – лихо вопрошает заголовок. Могут ли события внутри живого организма быть объяснены исключительно физикой и химией? – Да, могут, – отвечает Шредингер. «Неспособность современной физики и химии объяснить такие события вовсе не дает оснований сомневаться в том, что они могут быть объяснены этими науками в будущем.»
Эта мысль привлекла поколения ученых-физиков к биологии и стала поводом создания таких коллабораций как Theoretical and Computational Biophysics Group под шефством Клауса Шультена. Это объединение экспериментальных биологов и кафедр физики, химии, биохимии, клеточной и молекулярной биологии из Иллинойского университета в Урбана-Шампейне с лабораториями по всему миру. Особую роль в группе занимают профессиональные программисты – ПО разработанное группой используется научными сотрудниками по всему миру.
Особую роль в группе занимают профессиональные программисты – ПО разработанное группой используется научными сотрудниками по всему миру.
Даже здание в котором обосновалась коллаборация спроектировано с заделом на сотрудничество. TCBG разместилась в крыле Института Бекмана, привлекательного шестиэтажного здания из известняка и кирпича, окруженного ухоженной зеленью. Исследователи собираются в конференц-залах, ночуют в кафе на первом этаже в просторном атриуме или встречаются для мозгового штурма в холлах и закутках с диванчиками и маркерными досками.
Это история об исследователях, которые пытаются понять таинства жизни, воспроизводя их силами компьютерного моделирования и о становлении вычислительной биологии как таковой.
Оглавление
Мембранные белки: всегда на горизонте
Красная селедка
Бравые в Баварии
Безобразные вычисления
Рискуя всем
Подойдет ли компьютер для мембраны?
В каждой трудности кроется возможность.
А. Эйнштейн
Клаус Шультен раскрывает тайны биологии, работая в области вычислений чрезвычайно молодой по сравнению с устоявшимися и многовековыми областями теории и эксперимента. «На все новое смотрят с большим скептицизмом, даже если это абсолютно необходимо и действительно очень успешно в биологии.» (примечание) Его путь в вычислительных науках не всегда был гладким. Он объясняет, что согласно утверждениям теоретиков, люди, занимающиеся вычислениями, не так умны, как люди теории, а экспериментаторы заявляют, что то, что делает Шультен, – это просто виртуальная реальность. Таким образом, вычисления – это новая отрасль науки, которая с трудом набирала обороты. Шультен объясняет это тем, что наука чрезвычайно консервативна; ей приходится быть такой, чтобы убедиться, что все тщательно проверено. Поэтому принятие новой ветви неизбежно идет медленно.
Поэтому принятие новой ветви неизбежно идет медленно.
Но почему Шультен готов мириться с необоснованным презрением? Очень просто: то, чем он сейчас зарабатывает на жизнь, – это то, о чем он всегда мечтал. Он был ребенком, который любил природу, любил живые системы, но в то же время был склонен к математике. Он всегда хотел изучать живые системы, но теоретически – используя математику. И тогда, в самом начале своей карьеры профессионального ученого, он понял, что для того, чтобы объяснить биологию и захватывающий мир живых клеток, ему нужно использовать компьютер. «Биология – это детали, а считать детали на самом деле удобней с помощью компьютера.» Сложность и важность такой биологической системы, как клеточная мембрана, делают ее главным кандидатом для вычислительных исследований. Структура мембраны постоянно меняется с течением времени, и такие быстрые колебания структуры очень трудно уловить и увидеть экспериментам. Но не для компьютера – он может прояснить детали структуры по мере ее изменения с течением времени. «Так что это действительно одно из лучших применений компьютера в моделировании – иметь дело с мембранами, в которые встраиваются белки.»
«Так что это действительно одно из лучших применений компьютера в моделировании – иметь дело с мембранами, в которые встраиваются белки.»
Мембрана – это место, где происходит целый ряд захватывающих вещей: импорт, экспорт, передача сигналов. Даже некоторые химические реакции происходят на мембране. У высших форм жизни, например у человека, мембрана не только окружает клетку снаружи, но и внутри клетка также разделена мембранами. «Это как небоскреб с тысячами комнат. Многие комнаты должны отличаться друг от друга, в них должны быть двери, а некоторые комнаты даже должны быть мобильными отсеками, которые регулярно перемещаются.» И боже упаси вас спросить Шультена о нервных клетках. В то время как мембраны состоят из молекул, называемых липидами, можно наивно ожидать, что составлять мембраны сложных клеток нервной системы будут десятки видов липидов. Но нет, в мозге их будет около 300 000 видов! Шультен сравнивает нервные клетки с замысловатым бумажником с монументальным массивом разделительных листов, отличающихся друг от друга. Этот тип клеток с их бесчисленными липидами является лишь одной из многих причин, которые привлекают Шультена к изучению мембран и белков входящих в их состав.
Этот тип клеток с их бесчисленными липидами является лишь одной из многих причин, которые привлекают Шультена к изучению мембран и белков входящих в их состав.
Для того, чтобы прочувствовать, предлагаю посмотреть превьюшку. — ком. перев.
Еще одна причина, по которой эти системы соблазняют Шультена, заключается в том, что он видит в них возможность делать открытия с помощью компьютера. Живая клетка очень сложна. В отличие от физической системы, такой как кристалл, в котором элементарная ячейка повторяется до бесконечности, в биологической клетке нет симметрии. Это больше похоже на страну, в которой есть общества, кварталы, деревни, города и регионы. «Но единственный способ, которым я могу это сделать, из-за всей этой сложности и неоднородности – это компьютер.» Мембранные белки являются особенно плодородной почвой для Шультена и его любви к открытиям. Многие экспериментальные методы изучения белка в мембране требуют, чтобы белок находился вне мембраны, то есть вне своей естественной среды, например в кристалле. Но при компьютерном моделировании белок встроен в мембрану, чтобы более естественно имитировать исходную среду белка. Это дает компьютеру преимущество. Кроме того, определение структуры с помощью рентгеновской кристаллографии часто не может захватить белок в его функциональном состоянии, и поэтому компьютер является одним из инструментов, используемых для выявления структуры активного состояния мембранного белка. И, наконец, поскольку компьютерное моделирование отображает поведение с течением времени, Шультен часто может видеть белок в действии, то есть наблюдать, как белок выполняет свою функцию, например, как каналы избирательно пропускают воду, исключая протоны, или как мембранные белки на самом деле лепят свою мембрану в желаемую форму.
Но при компьютерном моделировании белок встроен в мембрану, чтобы более естественно имитировать исходную среду белка. Это дает компьютеру преимущество. Кроме того, определение структуры с помощью рентгеновской кристаллографии часто не может захватить белок в его функциональном состоянии, и поэтому компьютер является одним из инструментов, используемых для выявления структуры активного состояния мембранного белка. И, наконец, поскольку компьютерное моделирование отображает поведение с течением времени, Шультен часто может видеть белок в действии, то есть наблюдать, как белок выполняет свою функцию, например, как каналы избирательно пропускают воду, исключая протоны, или как мембранные белки на самом деле лепят свою мембрану в желаемую форму.
Клаус Шультен начал свою научную карьеру в 1970 году, но ему буквально пришлось ждать почти тридцать лет, прежде чем приступить к мембранным белкам, хотя они всегда были у него на уме в ранние годы. Он нуждался в фактической структуре белка, чтобы сделать какие-либо значительные открытия, и ему нужно было отточить компьютер до такой степени, чтобы он был уверен, что этот инструмент достаточно сложен, чтобы справиться с белком + мембраной. Никто не мог кристаллизовать мембранные белки, чтобы получить структуру до 1984 года, и только затем начали медленно появляться новые структуры. Теперь, во втором десятилетии двадцать первого века, у Шультена есть множество мембранных белковых структур для работы, и это стало своего рода горячей областью. И не зря. По оценкам, около четверти человеческих белков, кодируемых геномом, являются мембранными белками; и более пятидесяти процентов фармацевтических мишеней являются мембранными белками.
Он нуждался в фактической структуре белка, чтобы сделать какие-либо значительные открытия, и ему нужно было отточить компьютер до такой степени, чтобы он был уверен, что этот инструмент достаточно сложен, чтобы справиться с белком + мембраной. Никто не мог кристаллизовать мембранные белки, чтобы получить структуру до 1984 года, и только затем начали медленно появляться новые структуры. Теперь, во втором десятилетии двадцать первого века, у Шультена есть множество мембранных белковых структур для работы, и это стало своего рода горячей областью. И не зря. По оценкам, около четверти человеческих белков, кодируемых геномом, являются мембранными белками; и более пятидесяти процентов фармацевтических мишеней являются мембранными белками.
Но путь Шультена в этой области не всегда был легким. Он очень рано понял, что компьютеры станут незаменимыми, но не мог заставить никого работать с собой, молодым профессором, в вычислительной биологии. Результатом стал ошеломляющий и возмутительный план, который он составил, чтобы самому убедиться, подходит ли компьютер для характеристики мембран. Он должен был найти лучший способ использовать параллельные вычисления в своих исследованиях, когда параллельные вычисления были в зачаточном состоянии, что требовало еще одного бесстрашного плана действий. И его новаторская работа над одной из крупнейших систем того времени подвергалась сомнению на каждом шагу.
Он должен был найти лучший способ использовать параллельные вычисления в своих исследованиях, когда параллельные вычисления были в зачаточном состоянии, что требовало еще одного бесстрашного плана действий. И его новаторская работа над одной из крупнейших систем того времени подвергалась сомнению на каждом шагу.
Однако такие невзгоды сочетались с упорством, и Шультен все лучше и лучше использовал компьютер для биологических систем. Цель таких затратных вычислений для Шультена состоит в том, чтобы описать биологическую организацию, объяснить белковые клеточные общества с целью совершения открытий. Когда Шультен был молодым ученым, он никогда и не мечтал о том, каких успехов он и другие добьются в области мембранных белков. «Если бы кто-то сказал мне, что вы никогда не сможете описать мембрану и белок, я бы сказал, дескать, очень жаль, может быть, я должен переключиться, но я нахожу это таким интересным, поэтому, буду продолжать». К счастью для Шультена, его настойчивость окупилась и дала ему много возможностей для открытий. Шультен говорит, что его профессия постоянно вынуждает «переворачивать камень и смотреть, что под ним, открывать новую дверь и заглядывать в новую комнату». Слияние мембранных процессов с компьютером, несомненно, дало Шультену много новых комнат для просмотра, как мы увидим ниже.
Шультен говорит, что его профессия постоянно вынуждает «переворачивать камень и смотреть, что под ним, открывать новую дверь и заглядывать в новую комнату». Слияние мембранных процессов с компьютером, несомненно, дало Шультену много новых комнат для просмотра, как мы увидим ниже.
Мембранные белки: всегда на горизонте
К середине 1970-х годов у Клауса Шультена был целый ряд интересов в области биологических систем, которые он, к сожалению, не мог изучать с какой-либо определенностью. И он даже не был уверен, будет ли возможно в дальнейшем исследовать белок, естественным домом которого является мембранная среда. «Таким образом, никто не мог реально предвидеть, как далеко это продвинется». Тем не менее, он был очарован процессами, зависящими от белков в мембранах: фотосинтезом, зрением и биоэнергетикой на основе бактериородопсина. Для такого рода исследований, Шультену нужна была структура мембранных белков. В то время даже в учебниках утверждалось, что невозможно сделать кристаллы из мембранных белков, что было бы необходимым первым шагом в рентгеновской кристаллографии для открытия структуры с высоким разрешением.
Увлечение Шультена зрением и фотосинтезом можно проследить даже с детства. Когда он был еще маленьким мальчиком, он читал серию научных книг для детей с такими названиями, как «Ты и математика» или «Ты и химия». Но больше всего поразила его воображение детская книга известного австрийского этолога Карла фон Фриша, озаглавленная «Du und das Leben» [Ты и жизнь]. Хотя Шультен, скорее всего, читал эту книгу более 50 лет назад, он все еще живо помнит главу о том, как жизненные формы производят АТФ посредством фотосинтеза или потребления пищи. «Я чувствовал, что это мое призвание. Я хотел понять, как жизненные формы используют энергию для производства АТФ, а затем запускают с ней многие процессы». На самом деле, он сформировал для себя главную мысль состоящую в том, что для понимания жизни необходимо исследовать лежащие в основе молекулы, которые образуют живые клетки, как подчеркивал фон Фриш в своей книге. В начале 1960-х годов, когда Шультен впервые прочитал эту книгу, молекулярное изучение форм жизни находилось в зачаточном состоянии, но оно пробудило в нем интерес настолько, что он поставил перед собой цель: прояснить интеллектуально, а не экспериментально мир атомов и молекул лежащий в основе жизни. Примечательно, что именно этим он и занимается сегодня.
Примечательно, что именно этим он и занимается сегодня.
Школьные годы Шультена, очевидно, были заполнены внеурочным чтением, потому что ему были очень скучны темы, которые пытались преподавать учителя. На самом деле, он регулярно бросал им вызов, и за это другие ученики прозвали его «Профессором»; они никогда не называли его Клаусом. Как-то раз, учитель призвал Шультена сделать презентацию из учебника о линзах в глазу, так как никто другой не поднял бы руку. Было ясно, что учитель выбрал Шультена из безысходности. После того, как мальчик изложил информацию о поведении хрусталика, он начал рассказывать классу, как воспринимается свет в глазу, и о родопсине (кстати, мембранном белке). Учитель был в ярости, потому что этого слова уж точно не было в учебнике. Шультен получил словесный выговор, но он уже привык к этому, так что особо не беспокоился.
Хотя зрение и фотосинтез, возможно, увлекли подростка Клауса Шультена, его понимание зрения стало намного глубже, когда он поступил в Гарвардский университет в аспирантуру по физике в 1969 году. Там, в Кембридже, он присутствовал на групповых собраниях Джорджа Уолда, получившего в 1967 году Нобелевскую премию за исследования зрительных процессов. От Уолда Шультен узнал о передовых разработках родопсина.
Там, в Кембридже, он присутствовал на групповых собраниях Джорджа Уолда, получившего в 1967 году Нобелевскую премию за исследования зрительных процессов. От Уолда Шультен узнал о передовых разработках родопсина.
В человеческом глазу фотопигменты, поглощающие свет, находятся в палочках и колбочках. Эти фотопигменты состоят из белков, которые связывают ретиналь, визуальный хромофор, недавно описанный Уолдом. В палочках, например, ретиналь связана с белком родопсином, а в колбочках – с белком фотопсином. Палочки и колбочки функционируют одинаково, за исключением того, что длины волн поглощения различны, но и те и те зависят от основной молекулы ретиналя. Одна сторона длинного стержня или конуса состоит из ряда плоских дисков, уложенных друг на друга, причем в мембране этих дисков находится ретинальный белок. В стержне, когда свет попадает на фотопигмент, ретиналь меняет форму, а затем следует ряд шагов преобразования изменения формы в нервный импульс. В то время как палочки поглощают в одинаковой области спектра, колбочки поглощают красную, зеленую, либо синюю область; небольшие изменения в белках опсина определяют различные пики поглощения в колбочках – опять же, ретиналь остается одинаковой в трех различных зрительных рецепторах колбочек.
Ретиналь удивительна тем, что она является основной молекулой зрения у зрячих видов, хотя глаза эволюционировали независимо у разных видов насекомых, моллюсков и хордовых. Джордж Уолд открыл, что комплекс ретинал + опсин был фотопигментом, ответственным за зрение, и понял, что ретинал – это форма витамина А. На самом деле он был центральной фигурой в изучении молекулярного аспекта зрения – аспекта, заинтриговавшего молодого Шультена, который хотел сам изучить молекулы жизни. И Шультен по сей день помнит все захватывающие подробности, которыми Уолд поделился о ретинали; Шультен вспоминает, что Уолд объяснял, что у лягушек-быков есть два вида ретиналя, причем один работает больше, когда животное смотрит на голубое небо, а другой – на воду, красноватую сцену. В этом случае длина ретиналя сильно отличается, так что она поглощает либо синий (небо), либо красный (вода) в зависимости от потребностей животного. Лягушке-быку, возможно, нужно смотреть в небо, чтобы увидеть кружащих хищных птиц, или смотреть вниз на воду, чтобы выслеживать насекомых. «Для меня это было захватывающе, потому что я уже знал о ретинали и было здорово узнать, что она бывает двух видов, и что одна поглощает немного больше красного. И оказалось природа действительно использует это.»
Лягушке-быку, возможно, нужно смотреть в небо, чтобы увидеть кружащих хищных птиц, или смотреть вниз на воду, чтобы выслеживать насекомых. «Для меня это было захватывающе, потому что я уже знал о ретинали и было здорово узнать, что она бывает двух видов, и что одна поглощает немного больше красного. И оказалось природа действительно использует это.»
(видеоролики для понимания: раз, два, три — прим. перев.)
В то время как зрение и фотосинтез всегда были на радаре Клауса Шультена, когда он был аспирантом, он получил шанс в публикации 1978 года действительно поработать над фотосинтезом. Хотя это укрепило в нем пожизненную любовь к фотосинтезу, он будет ждать десять лет следующей возможности изучить эту тему, поскольку ключевые белки, участвующие в этом процессе, являются мембранными белками. В 1978 году, когда еще не была определена структура мембранных белков, а тем более белков, участвующих в фотосинтезе, Шультен не мог по-настоящему углубиться в эту тему до такой степени, чтобы чувствовать себя комфортно. Но наблюдение, которое он сделал в своей статье 1978 года, было полезным вкладом в эту область.
Но наблюдение, которое он сделал в своей статье 1978 года, было полезным вкладом в эту область.
К 1974 году Шультен закончил аспирантуру в Гарварде и получил свою первую работу в Германии, в Институте биофизической химии Макса Планка. Он был буквально единственным теоретиком в экспериментальной группе, руководимой Альбертом Веллером, директором в Геттингене. Веллер немедленно поставил перед своим новым теоретиком задачу: выяснить, почему продукт в стандартной реакции переноса электронов появляется намного быстрее, чем ожидалось. Продукт представлял собой возбужденную молекулу с двумя электронами, спины которых были параллельны; этот продукт был назван «быстрым триплетом», поскольку на языке квантовой механики два электрона с параллельными спинами известны как триплеты. Шультен принялся за работу и разгадал, почему в любимой реакции Альберта Веллера возникают такие эффекты.
Один из ключевых аспектов заключается в том, что магнитное поле может влиять на химическую реакцию. Шультен понял, что для доказательства этого утверждения экспериментаторы могут запустить реакцию как с присутствующим магнитным полем, так и без него и подтвердить его теоретическое открытие. Предположив, что магнитное поле может изменить химическую реакцию, Шультен был посмешищем лаборатории, пока некоторые экспериментальные данные от члена группы и хорошего друга Хьюберта Стаерка не подтвердили, что Шультен не был сумасшедшим.
Одна из важных вещей, которую постулировал Шультен, работая над загадкой быстрых триплетов, заключалась в том, что он понял, что определенный вид молекулы (способной образовывать радикальные пары) может действовать как компас в птице для обнаружения магнитного поля. Эта история, в которой Шультен постулирует, что определенная молекула может объяснить магниторецепцию птиц, более подробно рассказана в другой статье. Достаточно сказать, что дилемма Веллера предоставила Шультену плодородную почву для дальнейших изысканий.
На самом деле именно наблюдение Шультена о влиянии магнитного поля на химическую реакцию на короткое время привело его в область фотосинтеза, когда он был в Геттингене. Группа Веллера была сосредоточена на реакциях переноса электронов. Игрушечная система Веллера представляла собой пирен и диметиланилин, но Шультен говорит, что все в группе, включая его самого, знали, что реакции переноса электронов также происходят в биологических системах, а именно в фотосинтезе. Но точные детали переноса электронов в белках, ответственных за фотосинтез, не были точно известны – чтобы узнать это, нужно было бы разметить структуру фотосинтетических мембранных белков с высоким разрешением. «Таким образом, люди понимали, что существует особая пара хлорофиллов, которая поглощает свет и затем поэтапно переносит электрон через эти белки, которые сидят в мембране, и тем самым заряжают мембрану.» В то время как другие ученые, включая некоторых из группы Веллера, собрали воедино модели для ключевых групп хлорофиллов, а также некоторые детали о феофитинах и хинонах, никто не мог быть уверен, как все точно работает без структуры. В это время неопределенности Шультен говорит, что каждое дополнительное наблюдение о фотосинтезе и сопутствующих ему реакциях переноса электронов было бы полезно.
В это время неопределенности Шультен говорит, что каждое дополнительное наблюдение о фотосинтезе и сопутствующих ему реакциях переноса электронов было бы полезно.
Первая в истории публикация Шультена о фотосинтезе была в основном предложением научному сообществу, что эксперимент, проведенный как с магнитным полем, так и без него, даст наблюдаемое, которое можно измерить – триплеты. Экспериментаторы могли бы заметить разницу в результатах, основанную на наличии или отсутствии магнитного поля. Шультен говорит, что все в группе Веллера знали о биологических системах, испытывающих перенос электронов, поэтому предположение о том, что эксперименты могут измерять триплеты в фотосинтетическом переносе электронов, было очевидным. Он опубликовал это предложение в 1978 году, работая со студентом Гансом-Иоахимом Вернером, который позже стал мировым лидером в области квантовой химии.
Красная селедка
«Она все время была у нас под носом», – говорит Шультен о бактериальной системе, которая очаровала его в 1970-х годах, когда был открыт один из ее важнейших мембранных белков. В то время как Шультен был заинтригован зрительным рецептором родопсином, по крайней мере, еще в средней школе, а затем стал более глубоко ценить его роль с подачи Джорджа Уолда, все известные в то время родопсины принадлежали к животному царству. Может ли быть так, что бактерия тоже обладает родопсином, как предполагалось согласно новому открытию в 1971 году? У бактерий нет сенсорных белков. Что делает в их мембранах родопсиноподобный белок?
В то время как Шультен был заинтригован зрительным рецептором родопсином, по крайней мере, еще в средней школе, а затем стал более глубоко ценить его роль с подачи Джорджа Уолда, все известные в то время родопсины принадлежали к животному царству. Может ли быть так, что бактерия тоже обладает родопсином, как предполагалось согласно новому открытию в 1971 году? У бактерий нет сенсорных белков. Что делает в их мембранах родопсиноподобный белок?
Шультен рассказывает, что рассматриваемая бактерия, названная в то время Halobacterium halobium, существовала в различных средах, но ученые долгое время ее не замечали. «Одна из сред обитания на самом деле является пресловутой красной селедкой. Красная сельдь – это рыба, кишащая бактериями.» В прежние времена люди регулярно солили рыбу, чтобы сохранить ее, потому что бактериальные загрязнители не могут размножаться в соленой среде. Что же это за бактерия, которая живет в консервированной рыбе, буквально в соленой сельди? Оказывается, это вовсе не бактерия. Это разновидность экстремофилов, называемых галофилами (по-гречески солелюбивыми), которые принадлежат к царству жизни, называемому археями. Но когда в начале 1970-х годов Шультен впервые услышал о том, что в Halobacterium обнаружен белок родопсин, все решили, что эти солелюбивые организмы – бактерии. На самом деле, чтобы еще больше запутать дело, белок родопсина был назван «бактериородопсином», название, которое сохранилось даже по сей день. (В 1971 году он был обнаружен в Н. halobium, которые позже были отнесены к археям, а в 2000 году группа ученых действительно обнаружила бактерию, которая содержала белок родопсин, так что эти белки есть не только у архей. Все области жизни теперь могут претендовать на наличие собственного комплекса ретиналь + опсин.)
Это разновидность экстремофилов, называемых галофилами (по-гречески солелюбивыми), которые принадлежат к царству жизни, называемому археями. Но когда в начале 1970-х годов Шультен впервые услышал о том, что в Halobacterium обнаружен белок родопсин, все решили, что эти солелюбивые организмы – бактерии. На самом деле, чтобы еще больше запутать дело, белок родопсина был назван «бактериородопсином», название, которое сохранилось даже по сей день. (В 1971 году он был обнаружен в Н. halobium, которые позже были отнесены к археям, а в 2000 году группа ученых действительно обнаружила бактерию, которая содержала белок родопсин, так что эти белки есть не только у архей. Все области жизни теперь могут претендовать на наличие собственного комплекса ретиналь + опсин.)
Причина, по которой Halobacterium считались принадлежащими бактериям, заключалась в том, что революция, потрясшая древо жизни, произошла только в 1977 году. Эта революция заменила две области на таксономическом дереве пересмотром трех ветвей. Карл Везе, в то время ученый с кафедры микробиологии Иллинойского университета в Урбана-Шампейне, понял, что уникальные организмы, которые он изучал, метаногены, не принадлежали к бактериям. В течение многих лет Везе пытался классифицировать бактерии по последовательности их рибосомальной РНК, а не по физическим признакам. Когда коллега в коридоре обсуждал микробы, которые он изучал, Везе решил секвенировать эти организмы, которые пришли прямо из коровьего кишечника и коровьего навоза. Везе сразу же понял, что их последовательности не похожи ни на какие другие бактерии, которые он изучал, а он изучал их довольно много. Хотя затем он предложил новую область жизни, архею, в 1977 году его открытие было встречено со скепсисом. Эта история о Везе и последующем принятии его идеи рассказывается во многих других источниках. Достаточно сказать, что когда Клаус Шультен услышал о бактериородопсине в середине 1970-х годов, у всех сложилось впечатление, что он обитается в бактериях. До 1990-х годов идея Уэза не получила широкого распространения, и даже сегодня некоторые ученые не принимают три сферы жизни: бактерии, эукариоты и археи.
Карл Везе, в то время ученый с кафедры микробиологии Иллинойского университета в Урбана-Шампейне, понял, что уникальные организмы, которые он изучал, метаногены, не принадлежали к бактериям. В течение многих лет Везе пытался классифицировать бактерии по последовательности их рибосомальной РНК, а не по физическим признакам. Когда коллега в коридоре обсуждал микробы, которые он изучал, Везе решил секвенировать эти организмы, которые пришли прямо из коровьего кишечника и коровьего навоза. Везе сразу же понял, что их последовательности не похожи ни на какие другие бактерии, которые он изучал, а он изучал их довольно много. Хотя затем он предложил новую область жизни, архею, в 1977 году его открытие было встречено со скепсисом. Эта история о Везе и последующем принятии его идеи рассказывается во многих других источниках. Достаточно сказать, что когда Клаус Шультен услышал о бактериородопсине в середине 1970-х годов, у всех сложилось впечатление, что он обитается в бактериях. До 1990-х годов идея Уэза не получила широкого распространения, и даже сегодня некоторые ученые не принимают три сферы жизни: бактерии, эукариоты и археи.
Ученые, изучавшие солелюбивую Halobacterium halobium в конце 1960-х годов, а именно усилиями под руководством Вальтера Штеккениуса, поняли из лабораторных экспериментов, что клеточная мембрана этого организма может быть разбита на фрагменты, и что изучение фрагментов будет легче, чем изучение целой мембраны. Они обнаружили, что фрагменты естественным образом разделяются на функциональные участки в зависимости от содержания белка. Самый интригующий фрагмент был фиолетовым и получил название «пурпурная мембрана». Это было убедительным для ученых по многим причинам. Во-первых, белки пурпурной мембраны расположены в правильном порядке. Физики твердого тела назвали бы объекты, имеющие повторяющиеся идентичные единицы, кристаллическими. Действительно, Штеккениус обнаружил, что пурпурная мембрана имеет вид двумерной гексагональной кристаллической решетки. Во-вторых, в пурпурной мембране существует только один тип белка. Такая базовая система всегда находится на радаре ученых, поскольку простые системы позволяют им охарактеризовать процессы, иначе недостижимые в более сложных формах жизни, которые подвергаются тем же процессам. Таким образом, за годы накопилось огромное количество данных о пурпурной мембране, которая стала золотым дном для ученых из разных областей. И, наконец, единственный белок в пурпурной мембране – бактериородопсин. Опять же, что делает сенсорный белок в бактерии?
Такая базовая система всегда находится на радаре ученых, поскольку простые системы позволяют им охарактеризовать процессы, иначе недостижимые в более сложных формах жизни, которые подвергаются тем же процессам. Таким образом, за годы накопилось огромное количество данных о пурпурной мембране, которая стала золотым дном для ученых из разных областей. И, наконец, единственный белок в пурпурной мембране – бактериородопсин. Опять же, что делает сенсорный белок в бактерии?
Вальтер Штеккениус написал в 1976 году статью в Scientific American, в которой подробно описал открытие пурпурной мембраны и бактериородопсина. Хотя он не уверен в точной причине, по которой его группа решила посмотреть, есть ли у этого галофила родопсиноподобный белок, он указывает на две возможные причины. Во-первых, другой член группы ранее изучал мембраны фоторецепторов в глазу, и вся группа Штеккениуса была осведомлена об этом предыдущем исследовании. И, во-вторых, Штеккениус заметил нечто уникальное в ходе своих многочисленных исследований; клетки в растворе меняли направление миграции при уменьшении интенсивности красного света. Используя установленную процедуру изучения родопсина, член группы Дитер Эстерхельт действительно нашел ретиналь, и они назвали фоторецептор бактериородопсином. Результат был опубликован в 1971 году. Затем Штеккениус описывает в «Scientific American», что ему и Эстерхельту пришлось проделать, чтобы узнать, что бактериородопсин функционирует как протонный насос. Итак, тайна была раскрыта. Бактериородопсин создавал электрохимический градиент между внутренним и внешним пространством клетки. Затем Штеккениус доказал, что этот протонный градиент используется для синтеза АТФ.
Используя установленную процедуру изучения родопсина, член группы Дитер Эстерхельт действительно нашел ретиналь, и они назвали фоторецептор бактериородопсином. Результат был опубликован в 1971 году. Затем Штеккениус описывает в «Scientific American», что ему и Эстерхельту пришлось проделать, чтобы узнать, что бактериородопсин функционирует как протонный насос. Итак, тайна была раскрыта. Бактериородопсин создавал электрохимический градиент между внутренним и внешним пространством клетки. Затем Штеккениус доказал, что этот протонный градиент используется для синтеза АТФ.
Кажется очевидным, почему открытие бактериородопсина в пурпурной мембране заинтриговало Клауса Шультена в 1970-х годах. Это был примитивный организм, бактерия – по крайней мере, так представлялось в то время, – обладающая сенсорным белком. Тот факт, что она была более примитивной, чем человеческий глаз, означал, что это была простая система для моделирования; как было сказано выше, ученые любят простые, модельные системы. Но, возможно, самым интригующим для Шультена было бы то, что бактериородопсин был центральным в производстве АТФ. В конце концов, Шультен чувствовал, что одно из его призваний в жизни состояло в понимании работы АТФ. Он уже знал, что в процессе фотосинтеза энергия света преобразуется сначала в перенос электронов, а затем в перенос протонов. Протонный перенос в фотосинтезе использовался для образования АТФ, так же как протонный перенос в бактериородопсине приводил к образованию АТФ в галофиле. Таким образом, три мембранные системы: родопсин, бактериородопсин и фотосинтетические белки – все это занимало Клауса Шультена в 1970-х годах. Он бы с удовольствием изучал их все дальше, но ни для одного из них не существовало структуры с высоким разрешением. И не похоже было, что хоть одна из них будет определена в ближайшее время. Например, в обзорной статье 1977 года о пурпурной мембране Ричард Хендерсон сетует на оставшиеся без ответа вопросы,
Но, возможно, самым интригующим для Шультена было бы то, что бактериородопсин был центральным в производстве АТФ. В конце концов, Шультен чувствовал, что одно из его призваний в жизни состояло в понимании работы АТФ. Он уже знал, что в процессе фотосинтеза энергия света преобразуется сначала в перенос электронов, а затем в перенос протонов. Протонный перенос в фотосинтезе использовался для образования АТФ, так же как протонный перенос в бактериородопсине приводил к образованию АТФ в галофиле. Таким образом, три мембранные системы: родопсин, бактериородопсин и фотосинтетические белки – все это занимало Клауса Шультена в 1970-х годах. Он бы с удовольствием изучал их все дальше, но ни для одного из них не существовало структуры с высоким разрешением. И не похоже было, что хоть одна из них будет определена в ближайшее время. Например, в обзорной статье 1977 года о пурпурной мембране Ричард Хендерсон сетует на оставшиеся без ответа вопросы,
Клеточная мембрана диффузия — Справочник химика 21
Стехиометрические соотношения в натрий-калиевом насосе весьма своеобразны. При распаде каждой молекулы АТР из клетки выкачиваются 3 иона натрия, а извне в клетку накачиваются 2 иона калия. Поскольку из клетки выкачивается больше положительно заряженных ионов, чем пО падает в нее, внутри клетки создается избыточный отрицательный заряд. Наличие отрицательного заряда внутри клетки было установлено уже давно путем измерения электрического мембранного потенциала (разд. Б.З). Поскольку клеточная мембрана все же проницаема для ионов К+, возникновение мембранного потенциала приводит к диффузии этих ионов через мембрану внутрь клетки, что обусловливает частичную нейтрализацию отрицательно-го заряда на мембране. Когда скорость пассивной диффузии уравновешивает мем бран- [c.363]
При распаде каждой молекулы АТР из клетки выкачиваются 3 иона натрия, а извне в клетку накачиваются 2 иона калия. Поскольку из клетки выкачивается больше положительно заряженных ионов, чем пО падает в нее, внутри клетки создается избыточный отрицательный заряд. Наличие отрицательного заряда внутри клетки было установлено уже давно путем измерения электрического мембранного потенциала (разд. Б.З). Поскольку клеточная мембрана все же проницаема для ионов К+, возникновение мембранного потенциала приводит к диффузии этих ионов через мембрану внутрь клетки, что обусловливает частичную нейтрализацию отрицательно-го заряда на мембране. Когда скорость пассивной диффузии уравновешивает мем бран- [c.363]
Все эти примеры служат иллюстрацией пассивного, но стереоселективного переноса, когда органические модельные системы осуществляют асимметричное узнавание. Однако можно провести аналогию между этими результатами и процессом опосредованного переноса через биологические мембраны.
 Все липидные мембраны практически непроницаемы для внутриклеточных белков и высокозаряженных органических и неорганических ионов, находящихся с обеих сторон мембраны. Диффузия Na+ через клеточную мембрану из клетки и К+ в клетку происходит в направлении отрицательного градиента химического потенциала и называется пассивным переносом. Пассивный перенос ионов через мембраны может быть вызван ионофорами [см. разд. 5.1.3]. К счастью, концентрации катионов по обе стороны мембраны различные, и такое состояние поддерживается активным переносом, который зависит от метаболической энергии. Механизм этого процесса известен под названием натриевый насос, функция которого сводится к поддержанию высокой внутриклеточной концентрации К+ и низкой концентрации Na+. Кальций, по-внднмому, также активно выводится из клеток. В этих случаях энергия для переноса обеспечивается за счет гидролиза АТР. Однако диффузия сахаров и аминокислот к важнейшим клеточным объектам — пример простого опосредованного пассивного переноса.
Все липидные мембраны практически непроницаемы для внутриклеточных белков и высокозаряженных органических и неорганических ионов, находящихся с обеих сторон мембраны. Диффузия Na+ через клеточную мембрану из клетки и К+ в клетку происходит в направлении отрицательного градиента химического потенциала и называется пассивным переносом. Пассивный перенос ионов через мембраны может быть вызван ионофорами [см. разд. 5.1.3]. К счастью, концентрации катионов по обе стороны мембраны различные, и такое состояние поддерживается активным переносом, который зависит от метаболической энергии. Механизм этого процесса известен под названием натриевый насос, функция которого сводится к поддержанию высокой внутриклеточной концентрации К+ и низкой концентрации Na+. Кальций, по-внднмому, также активно выводится из клеток. В этих случаях энергия для переноса обеспечивается за счет гидролиза АТР. Однако диффузия сахаров и аминокислот к важнейшим клеточным объектам — пример простого опосредованного пассивного переноса. [c.282]
[c.282]Разность концентраций калия и натрия внутри и вне клетки возникает в результате избирательной проницаемости клеточной мембраны по отношению к катионам К+ и Ма+. Перенос ионов через мембрану осуществляется двумя способами 1) облегченной диффузией 2) активным транспортом. [c.277]
До сих пор мы рассматривали только статические методы определения формы и размеров макромолекул. Динамические методы, охарактеризованные в общих чертах в гл. VI, основаны на изучении диффузии. (Исключение составляют методы, в которых используются данные вискозиметрии.) Диффузией называют процесс спонтанного уменьшения градиентов концентраций в растворе, приводящий в конце концов к равномерному распределению молекул. Молекулы жидкости находятся в непрерывном броуновском движении, обусловленном их тепловой энергией. Поэтому подчеркнем, что термин диффузия применяется именно для описания макроскопического потока отдельных компонентов раствора под влиянием разности концентраций, а не для описания движения отдельных молекул в растворе, продолжающегося и после достижения макроскопической однородности.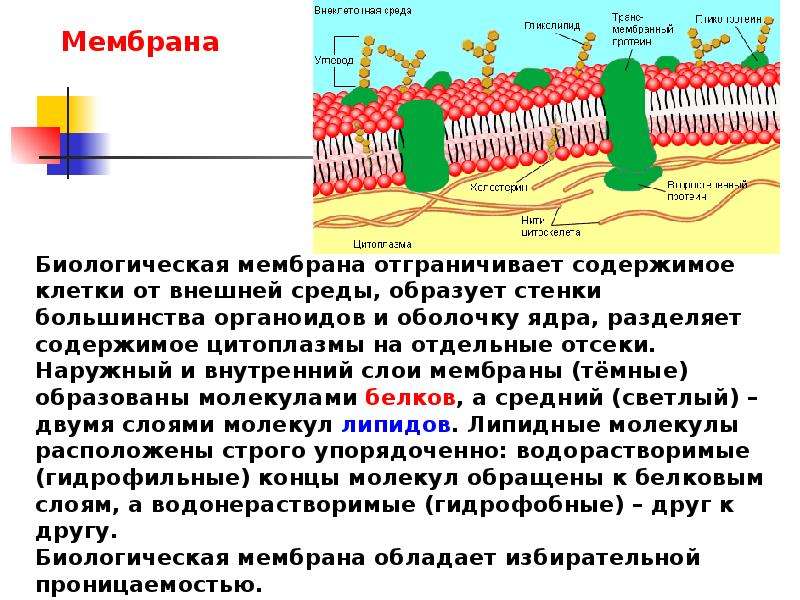 Знакомство с законами, которым подчиняется диффузия, совершенно необходимо для понимания процессов переноса веществ внутри клеток и через клеточные мембраны. Мы начнем с рассмотрения поступательной диффузии, затем перейдем к вращательной диффузии и времени релаксации. [c.163]
Знакомство с законами, которым подчиняется диффузия, совершенно необходимо для понимания процессов переноса веществ внутри клеток и через клеточные мембраны. Мы начнем с рассмотрения поступательной диффузии, затем перейдем к вращательной диффузии и времени релаксации. [c.163]
Существует четыре основных механизма транспорта веществ, которые обеспечивают движение молекул в биологических жидкостях и через клеточные мембраны. Это диффузия, осмос, активный транспорт, экзоцитоз и эндоцитоз (рис. 26). Диффузия и осмос — пассивный транспорт, так как движение веществ осуществляется без использования энергии два последних механизма — активный транспорт, так как движение веществ осуществляется за счет энергии АТФ. [c.75]
Проницаемость клеточной мембраны — важный фактор, который необходимо учитывать при исследовании ростовых процессов и обмена веществ вообще. Этот фактор, однако, исключительно трудно измерить с достаточной степенью достоверности прежде всего потому, что на самом деле существуют два независимых коэффициента проводимости.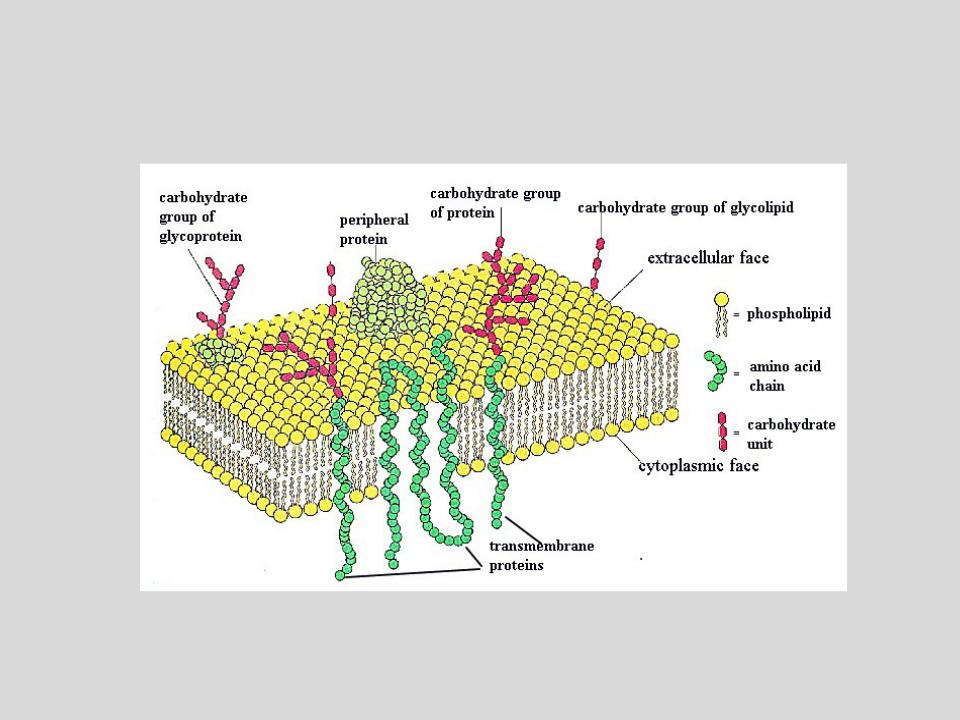 Один — это коэффициент самодиффузии, т. е. скорость диффузии воды через мембрану в отсутствие градиента потенциала воды. Измеряется эта величина, например, с помощью дейтерированной воды и обозначается через Вт- Другой — это коэффициент скорости движения воды через мембрану нод влиянием градиента потенциала воды [величина Въ в уравнении (7)]. [c.515]
Один — это коэффициент самодиффузии, т. е. скорость диффузии воды через мембрану в отсутствие градиента потенциала воды. Измеряется эта величина, например, с помощью дейтерированной воды и обозначается через Вт- Другой — это коэффициент скорости движения воды через мембрану нод влиянием градиента потенциала воды [величина Въ в уравнении (7)]. [c.515]
Клеточные мембраны способствуют значительному уменьшению скорости диффузии. [c.49]
Ионный состав живой клетки в общем значительно отличается от состава окружающей жидкости. Действительно, живые клетки находятся в осмотическом равновесии с жидкостями, находящимися в контакте с ними, но распределение отдельных ионов обычно далеко от равновесного. Это различие в ионном составе поддерживается или благодаря постоянному обмену веществ клетки, или благодаря избирательной проницаемости клеточной мембраны. Эритроциты млекопитающих, например, обладают очень ограниченной проницаемостью для катионов. Если живая клетка повреждена, причем разрушена мембрана или нарушен обмен клетки, то электролит диффундирует в клетку или из нее, в зависимости от направления градиента концентрации. Эта диффузия ионов обусловливает потенциал повреждения. Найдено, что поврежденная ткань вообще заряжена отрицательно по отношению к неповрежденной ткани, хотя если раствор, который обмывает ткань, имеет соответствующий состав, то может быть получен положительный потенциал повреждения. [c.123]
Если живая клетка повреждена, причем разрушена мембрана или нарушен обмен клетки, то электролит диффундирует в клетку или из нее, в зависимости от направления градиента концентрации. Эта диффузия ионов обусловливает потенциал повреждения. Найдено, что поврежденная ткань вообще заряжена отрицательно по отношению к неповрежденной ткани, хотя если раствор, который обмывает ткань, имеет соответствующий состав, то может быть получен положительный потенциал повреждения. [c.123]
Еще одним важным обстоятельством, накладывающим определенный отпечаток не только на энергетический обмен, но и на многие другие стороны метаболизма нервной ткани, является совершенно необычное для большинства других типов клеток соотношение между поверхностью и объемом центральной ч. к ти клетки. Например, для мотонейронов коры кошки средние размеры тела клетки составляют около 50мкм,вто время как длина аксона — до 10 —10 мкм. Подобные особенности структуры клеток нервной системы объясняют причины отмеченных многими исследователями значительных энергетических затрат на транспортные нужды клетки. В первую очередь необходимо упомянуть трансмембранный перенос субстратов, медиаторов, различных предшественников под действием специфических транслоказ или в результате конформационных перестроек клеточной мембраны. Например, установлено, что на долю пассивной диффузии такого важного энергетического субстрата, как глюкоза, приходится не более 57о, подавляющая масса ее переносится через гемато-энцефалический барьер со значительными затратами энергии и с участием К Na+-ATФaзы. [c.73]
В первую очередь необходимо упомянуть трансмембранный перенос субстратов, медиаторов, различных предшественников под действием специфических транслоказ или в результате конформационных перестроек клеточной мембраны. Например, установлено, что на долю пассивной диффузии такого важного энергетического субстрата, как глюкоза, приходится не более 57о, подавляющая масса ее переносится через гемато-энцефалический барьер со значительными затратами энергии и с участием К Na+-ATФaзы. [c.73]
Различают два вида диффузии веществ через клеточные мембраны — пасочную (без переносчика) и облегченную (с участием вещества- переносчика). При пассивной диффузии происходит произвольное движение веществ через поры (отверстия) в мембранах клеток или через липиды мембран. Через поры диффундируют многие продукты обмена (НдО, СО2, МНз и др ) также кислород. Поры имеются не только в плазматических мембранах клетки, но и в ядерных мембранах (рис. 28). Через эти поры внутрь ядра проходят белки, из которых образуются рибосомы, а также нуклеотиды, из которых синтезируются нуклеиновые кислоты. Из ядра в цитозоль клетки выходят рибосомы и отдельные виды нуклеиновых кислот. Жиры и жирорастворимые вещества, например витамины, проникают через клеточные мембраны благодаря их растворению в липидном слое этих мембран. При облегченной диффузии движение вещества через мембрану обеспечивается веществом-пере-носчиком. Переносчик либо вращается в мембране, либо образует канал только для определенного вещества, что создает возможность его диффузии по градиенту концентрации. Так транспортируются небольшие молекулы веществ, например ионы металлов и глюкоза, через клеточную мембрану в цитозоль. [c.75]
Из ядра в цитозоль клетки выходят рибосомы и отдельные виды нуклеиновых кислот. Жиры и жирорастворимые вещества, например витамины, проникают через клеточные мембраны благодаря их растворению в липидном слое этих мембран. При облегченной диффузии движение вещества через мембрану обеспечивается веществом-пере-носчиком. Переносчик либо вращается в мембране, либо образует канал только для определенного вещества, что создает возможность его диффузии по градиенту концентрации. Так транспортируются небольшие молекулы веществ, например ионы металлов и глюкоза, через клеточную мембрану в цитозоль. [c.75]
Однако содержание промежуточных продуктов обмена в крови зависит от скорости их образования в клетках, диффузии через клеточные мембраны, а также от потребления их различными тканями. Поэтому один и тот же показатель изменения в мышечных клетках, измеренный в крови или печени, будет отражать изменения в тканях с разной степенью точности. Так, о скорости мобилизации углеводных запасов печени свидетельствует [c.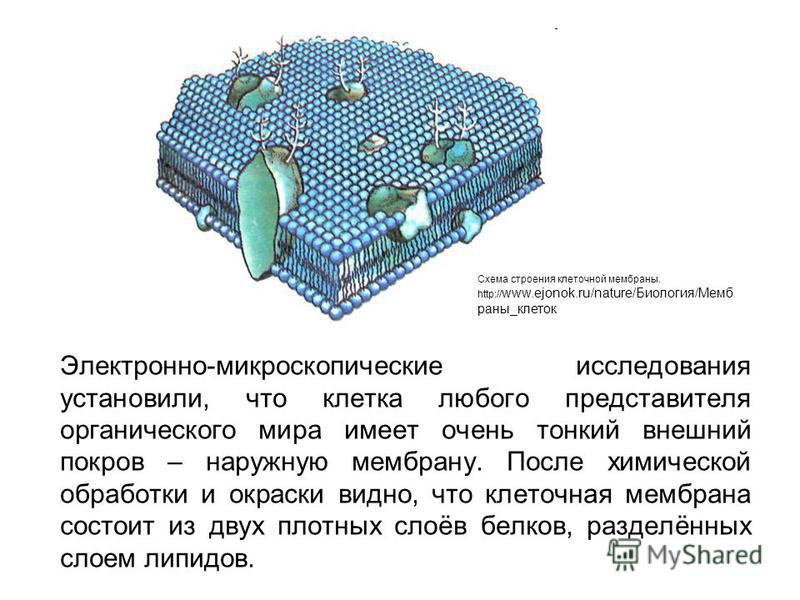 341]
341]
Различная скорость диффузии ионов через клеточные мембраны—один из физических факторов, влияющих на избирательное проникновение и накопление элементов в растительных клетках, Диффузионное движение отдельных частиц из мест с высокой концентрацией в места с меньшей концентрацией образует диффузионный поток ] (в м7с), который пропорционален градиенту концентрации ДС (уменьшению концентрации на единицу длины Ах). Эта зависимость подчиняется закону Фика и выражается уравнением [c.95]
Транспорт веществ через клеточные мембраны осуществляется тремя способами простой диффузией, облегченным или активным транспортом. [c.444]
Итак, химическая теория торжествовала. Некоторые медиаторы, которые вначале были столь же гипотетичны, как клеточная мембрана, были выделены в чистом виде и их химическое строение было определено. С помощью микроэлектродов, введенных в клетку и аксон, было выяснено, что время, затрачиваемое на выделение медиатора из терминали и его диффузию через щель, составляет примерно 0,6—0,8 мс у теплокровных животных. [c.158]
[c.158]
Все виды ионного транспорта через клеточные мембраны подразделяются на 4 группы пассивная диффузия, облегченная диффузия, первично-активный транспорт и вторично-активный транспорт. [c.101]
Небольшая группа веществ может поступать в клетку в результате пассивной диффузии, когда концентрация их в среде выше, чем концентрация в клетке. При этом они, видимо, не взаимодействуют со специфическими компонентами клеточной мембраны. Таким путем поступают в клетку вода, неполярные и малополярные молекулы газов (Ог, Нг, N2) и углеводороды. [c.58]
Массоперенос веществ через пористые клеточные стенки внутри растительного сырья состоит из процессов свободной молекулярной диффузии в клеточном соке (растворе) и внутренней диффузии через клеточные мембраны. Скорость массопереноса через мембрану при этом зависит от толщины и количества слоев мембраны, числа и диаметра пор, которые колеблются в широких пределах в зависимости от вида сырья. [c.76]
[c.76]
Значительная конкуренция соединений за места действия не ограничивается течением параллельных или последовательных химических реакций. Здесь играют роль и процессы физического транспортирования соедине ния — диффузия через кутикулу клетки и клеточные мембраны, перенос с кровью, лимфой, соком или по сосудистой системе растений. Если разложение происходит во время транспорта, то доля внесепного препарата, которая без изменения достигнет цели, будет зависеть от сравнительных скоростей транспорта и реакции разложения. [c.96]
Однако применительно к живым биологическим объектам вряд ли можно говорить лишь о пассивной (простой) диффузии кислорода. На разных этапах транспорта кислорода в организме можно встретить многочисленные примеры облегченной диффузии. Следует отметить, что диффузионный перенос кислорода через биологические мембраны изучен хуже по сравнению с другими веществами. Тем не менее можно привести примеры диффузии растворенного кислорода через поры гистогематических мембран (мочевой пузырь жабы) и через каналы в клеточной мембране [564, 9]. Возможен перенос кислорода с плазмой через капиллярную стенку за счет гидростатического давления [369]. Хорошо известны роль межклеточной жидкости в транспорте растворенных в ней веществ к клеткам, а также движение гиалоплазмы, ускоряющей не менее чем на порядок поступление кислорода к удаленным от клеточной мембраны частям клетки с низким рОг сравнительно с простой диффузией. Такие потоки показаны не только для крупных растительных клеток [25, 184], но и для клеток млекопитающих [24, 521]. [c.15]
Возможен перенос кислорода с плазмой через капиллярную стенку за счет гидростатического давления [369]. Хорошо известны роль межклеточной жидкости в транспорте растворенных в ней веществ к клеткам, а также движение гиалоплазмы, ускоряющей не менее чем на порядок поступление кислорода к удаленным от клеточной мембраны частям клетки с низким рОг сравнительно с простой диффузией. Такие потоки показаны не только для крупных растительных клеток [25, 184], но и для клеток млекопитающих [24, 521]. [c.15]
Клеточные мембраны создают существенные ограничения для перемещения веществ, причем основным препятствием является гидрофобная зона мембраны. Однако мембраны не являются наглухо закрытыми перегородками. Одна из главных функций мембран — регуляция переноса веществ. Например, плазматическая мембрана должна впустить в клетку и удержать вещества, которые нужны клетке, и освободиться от ненужных. Через мембраны клетки в одно и то же время в обоих направлениях проходят сотни разных веществ. Различают три способа переноса веществ через мембраны простая диффузия, облегченная диффузия и активный транспорт. [c.207]
Различают три способа переноса веществ через мембраны простая диффузия, облегченная диффузия и активный транспорт. [c.207]
При всасывании из кишечника в кровь моносахариды проникают через клеточные мембраны путем облегченной диффузии, с участием специальных переносчиков. Кроме того, для переноса глюкозы и галактозы существует еще и другой способ — активный транспорт по механизму симпорта за счет градиента концентрации ионов натрия, который создается Ка,К-АТФазой (см. рис. 7.16). Этот [c.250]
Неионизированный аммиак проникает через клеточные мембраны путем простой диффузии, в то время как для иона аммония мембрана непроницаема. [c.349]
Амеба — одноклеточный организм, принадлежащий к подцарству простейших (Protozoa). Форма ее тела непостоянна и при движении меняется. Диаметр ее обычно меньше 1 мм, так что отношение поверхности тела к объему достаточно велико, что вообще характерно для одноклеточных организмов. Дыхательной поверхностью амебе служит наружная клеточная мембрана. Диффузия газов осуществляется через всю поверхность тела с достаточно большой скоростью, чтобы удовлетворить все метаболические нужды этого животного. Кислород поступает в клетку, а СО2 выходит из клетки по своим собственным диф- [c.359]
Дыхательной поверхностью амебе служит наружная клеточная мембрана. Диффузия газов осуществляется через всю поверхность тела с достаточно большой скоростью, чтобы удовлетворить все метаболические нужды этого животного. Кислород поступает в клетку, а СО2 выходит из клетки по своим собственным диф- [c.359]
Самые ранние стадии развития дрозофилы, когда устанавливаются так называемые пространственные координаты эмбрионов, определяющие передний и задний или брюшной и спинной отделы, контролируются группой генов матери. Эти гены функционируют-на стадии образования яйца, и их продукты неравномерно распределяются по яйцеклетке. Предполагается, что материнские гены и нх продукты обеспечивают позиционную информацию, которая воспринимается генами, работающими после оплодотворения, в зиготе. Представление о наличии в цитоплазме яйца позиционной информации, определяющей направление развития групп эмбриональных клеток, подчеркивает роль взаимного влияния частей будущего эмбриона в развитии, но никак не вскрывает природы этих взаимодействий.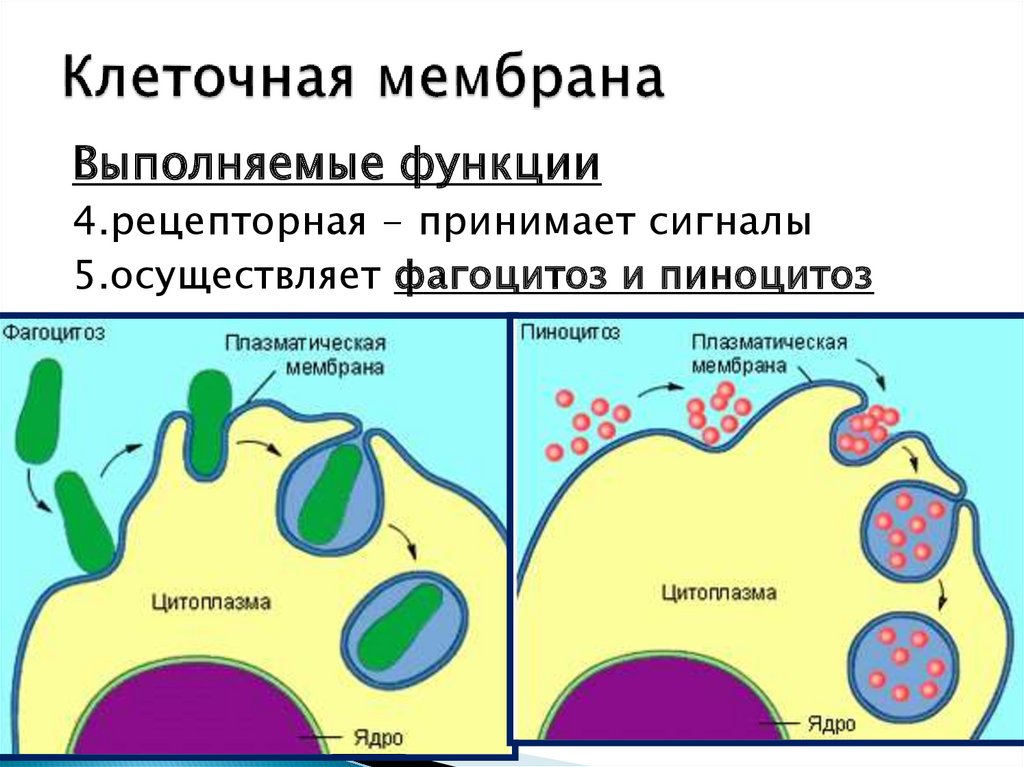 Мутации в генах, определяющих структуру неоп-лодотворенного яйца, оказывают так называемый материнский эффект, нарушая развитие эмбриона. Например, структуры, свойственные данному району, заменяются иными, характерными для других районов развивающегося организма. Вероятно, такие материнские гены оказывают свое действие на стадии ядерного синцития, до образования клеток бластодермы, когда диффузия продуктов генов затрудняется в результате образования клеточной мембраны. Транскрипты таких генов локализуются в соответствующих отделах (например, переднем или заднем) неоплодотворенного яйца или развивающегося эмбриона. [c.214]
Мутации в генах, определяющих структуру неоп-лодотворенного яйца, оказывают так называемый материнский эффект, нарушая развитие эмбриона. Например, структуры, свойственные данному району, заменяются иными, характерными для других районов развивающегося организма. Вероятно, такие материнские гены оказывают свое действие на стадии ядерного синцития, до образования клеток бластодермы, когда диффузия продуктов генов затрудняется в результате образования клеточной мембраны. Транскрипты таких генов локализуются в соответствующих отделах (например, переднем или заднем) неоплодотворенного яйца или развивающегося эмбриона. [c.214]
Гормональные пептиды и белки после биосинтеза в клетках эндокринных желез должны проникнуть через клеточную мембрану, чтобы выйти в русло крови и достигнуть соответствующей мишени. Однако клеточные мембраны являются непреодолимым барьером для свободной диффузии белков. Каким же образом клетка выводит а кроаь белкоаые молекулы, предназначенные на экспорт [c.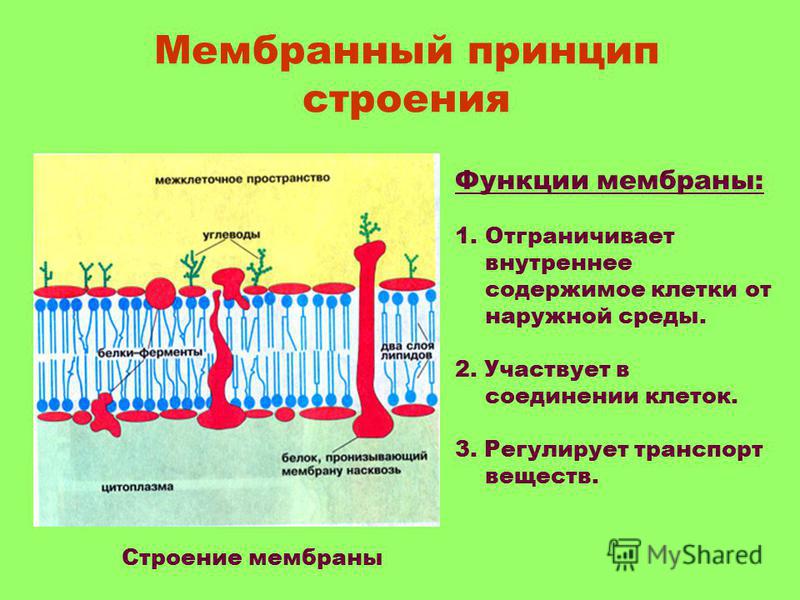 245]
245]
Можно справедливо сказать, что диффузия веществ через клеточные мембраны в процессе обмена веществ клетки является фундаментальной биологической проблемой. Этот вопрос мы специально рассмотрим в гл. XVII. Однако помимо значения для физиологии, измерения диффузии дают ценные сведения о молекулах. В данной главе мы рассмотрим вопрос именно с этой точки зрения. [c.318]
Через мембраны живых организмов происходит непрерывный перенос как ионов, так и нейтральных веществ. Этот перенос может представлять собой обычную диффузию, диффузию с переносом или механическое перекачивание за счет энергии, запасенной в АТФ. Если соединить водные растворы по обе стороны клеточной мембраны микросолевыми мостиками, контактирующими с электродами сравнения, то можно обнаружить небольшую разность потенциалов, называемую мембранным потенциалом. Пренебрегая вкладом очень небольших потенциалов на жидкостных границах, а также потенциалов, которые могут возникать в неперемешиваемых слоях раствора, близко прилегающих к поверхностям мембран, рассмотрим главное интересующее нас явление, а именно потенциал, возникающий за счет различий в характере распределения ионов и за счет различий в активностях растворенных веществ. [c.313]
[c.313]
Все перечисленные свойства фосфолипидов обусловливают эффект снижения пограничного натяжения на внутренних стенках альвеол, что облегчает диффузию молекулярного кислорода и способствует его проникновению через клеточные мембраны и последующему присоединению к гемоглобину. Альвеолы клетки синтезируют и продуцируют специфическую слизь, которая состоит из 10 % белков и 90 % фосфолипидов, гидратированных водой. Эту смесь называют легочный сурфактант (от англ. surfa e a tive agent— поверхностно-активный агент). [c.256]
Активный транспорт обеспечивает перенос моносахарвдов против градиента концентраций и осуществляется при низких концентрациях глюкозы или галактозы в кишечнике. Моносахариды способны также проникать через клеточные мембраны путем облегченной диффузии с участием специальных транспортных систем. Процессы транспорта биомолекул через клеточные мембраны рассмотрены в главе 15. [c.398]
Второй подход к решению уравнения Нернста—Планка, известный как приближение постоянного поля, основан на предположении о линейности изменения электрического потенциала или постоянства напряженности поля по всей толщине мембраны d(f/dx = onst). Это условие выполняется для тонких мембран, в которых концентрация носителей зарядов мала, а толщина двойного электрического слоя очень велика (см. 4 гл. XVIII), т.е. в случае диффузии ионов через липидные бислои и клеточные мембраны. [c.98]
Это условие выполняется для тонких мембран, в которых концентрация носителей зарядов мала, а толщина двойного электрического слоя очень велика (см. 4 гл. XVIII), т.е. в случае диффузии ионов через липидные бислои и клеточные мембраны. [c.98]
Клеточные мембраны, так же как и искусственные липидные бислои, способны пропускать воду и неполярные молекулы за счет простой физической диффузии. Олнако клеточные мембраны пропинаемы и для различных полярных молекул, таких, как сахара, аминокислоты, нуклеотиды и многие другие метаболиты, которые проходят через синтетические бислои чрезвычайно медленно. За перенос подобных растворенных веществ через клеточные мембраны ответственны специфические белки, называемые мембранными транспортными белками. Они обнаруживаются во всех типах биологических мембран и могут сильно отличаться друг от друга. Каждый конкретный белок предназначен для определенного класса молекул (например, неорганических ионов, Сахаров или аминокислот), а нередко лищь какой-то разновидности молекул из этих классов.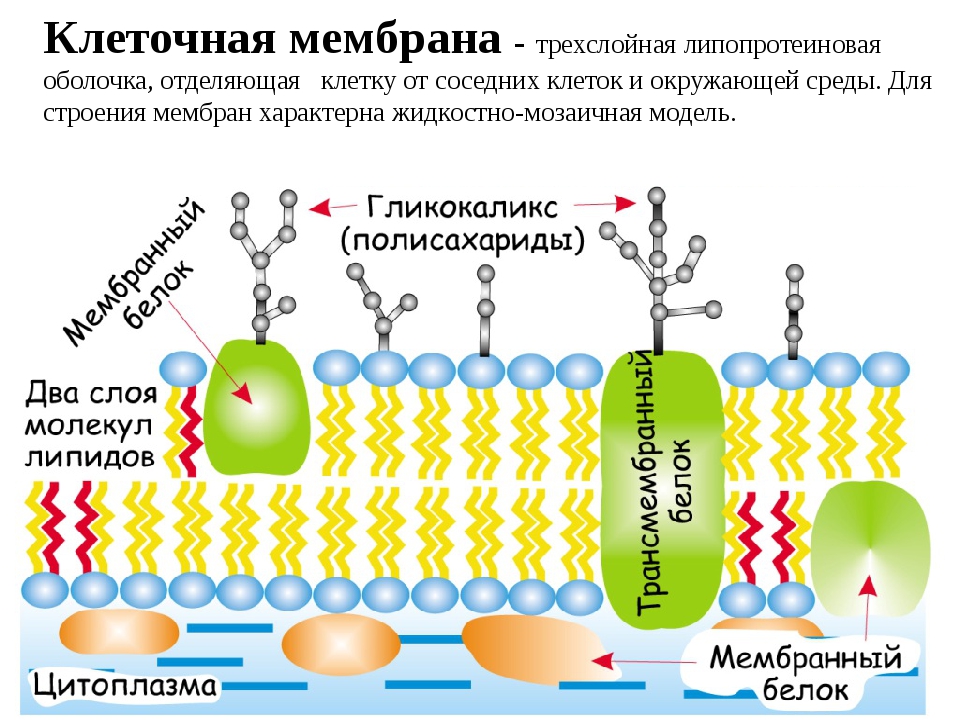 Специфичность транспортных белков была впервые показана, когда обнаружилось, что мутации в олном-единственном гене приводят к исчезновению у бактерий способности гранспортировать определенные сахара через плазматическую мембрану. Аналогичные мутации теперь известны и у людей, страдающих различными наследственными болезнями, при которых нарушается транспорт тех или иных веществ в почках или кишечнике. Например, у индивидуумов с наследственной болезнью цистинурией отсутствует способность транспортировать определенные аминокислоты (включая цистин — связанный дисульфидной связью димер цистеина) из мочи или кишечника в кровь. В результате происходит накопление цистина в моче, что приводит к образованию цистиновых камней в почках. [c.381]
Специфичность транспортных белков была впервые показана, когда обнаружилось, что мутации в олном-единственном гене приводят к исчезновению у бактерий способности гранспортировать определенные сахара через плазматическую мембрану. Аналогичные мутации теперь известны и у людей, страдающих различными наследственными болезнями, при которых нарушается транспорт тех или иных веществ в почках или кишечнике. Например, у индивидуумов с наследственной болезнью цистинурией отсутствует способность транспортировать определенные аминокислоты (включая цистин — связанный дисульфидной связью димер цистеина) из мочи или кишечника в кровь. В результате происходит накопление цистина в моче, что приводит к образованию цистиновых камней в почках. [c.381]
Транспорт в клетку. Нейтральные мо 1екулы и гидрофобные соеди нения, подобные н-алканам, ПАУ, ПХБ, галогенированным бензолам, проникают в липофильные клеточные мембраны. Скорость диффузии этих веществ в мембранах в несколько раз выше, чем в воде, поэтому для гидрофобных ксенобиотиков транспорт через мембраны не является лимитирующим.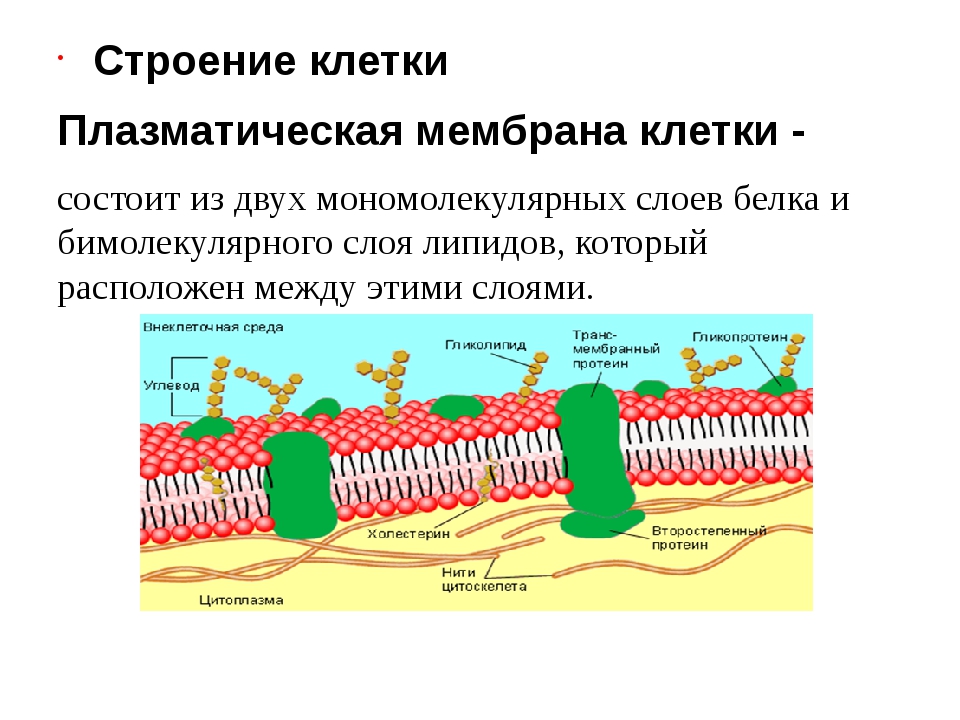 Проникающая способность органических молекул через липофильные мембраны возрастает с увеличением углеродной цепи, числа ме-тильных, этильных и фенильных групп и резко снижается при наличии в молекулах гидроксильных, карбоксильных и аминогрупп. [c.312]
Проникающая способность органических молекул через липофильные мембраны возрастает с увеличением углеродной цепи, числа ме-тильных, этильных и фенильных групп и резко снижается при наличии в молекулах гидроксильных, карбоксильных и аминогрупп. [c.312]
Цитоз — уникальный способ поглощения клеткой крупных веществ и частиц и их выделения с помощью изменения структуры, формы и размеров плазмалеммы (клеточной мембраны). Этот способ отличен от диффузии, пассивного и активного транспорта индивидуальных низкомолекулярных веществ через мембраны. Во внеклеточной среде (в большинстве случаев в низкой концентрации) содержится масса веществ среди них строительный материал для клеток, питательные вещества, физиол гиче-ски активные соединения, отходы метаболизма, а также топлаз-.малеммы захватывает из среды нужные ей компоненть. Такой захват осуществляется при помощи эндоцитоза. [c.7]
Клетку можно представить как систему взаимосвязанных мембран, так как имеются небезосновательные предположения, что наружная мембрана клетки, эндоплазматический ретикулум, митохондриальная, лизосомная, ядернея мембраны и аппарат Гольджи тесно связаны между собой.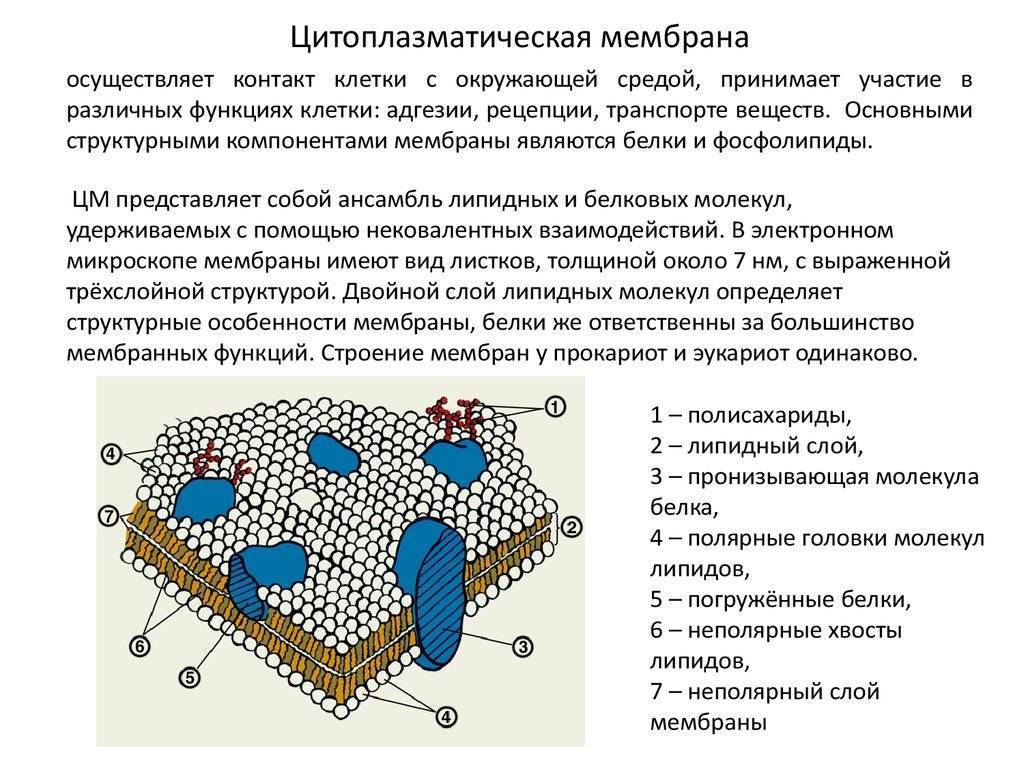 Одна из функций наружной клеточной мембраны — регуляция обмена веществ между внутриклеточным пространством и внешней средой. Тем не менее еще мало известно о динамике и функции клеточных мембран или о деталях той регулирующей роли, которую они могут играть. Описано несколько случаев, когда облучение влияло на внешние клеточные мембраны. Например, облучение в дозах в диапазоне несколько десятков грей вызывает уменьшение проводимости нервного импульса в изолированных периферических нервах взрослых животных. Как известно, передача нервного импульса — результат избирательной диффузии ионов натрия и калия через мембрану аксона. Такие изменения электрической активности нервов, вызванные облучением, указывают на увеличение у аксона пассивной проницаемости для ионов. Изменения поведения и функции центральной нервной системы взрослых животных обнаруживаются после облучения в такой низкой дозе, как 0,5 Гр. Неизвестно, являются ли эти эффекты результатом первичных радиационных повреждений нервной ткани или же они обусловлены косвенным эффектом токсинов, освобождающихся из других поврежденных облучением тканей органов и систем.
Одна из функций наружной клеточной мембраны — регуляция обмена веществ между внутриклеточным пространством и внешней средой. Тем не менее еще мало известно о динамике и функции клеточных мембран или о деталях той регулирующей роли, которую они могут играть. Описано несколько случаев, когда облучение влияло на внешние клеточные мембраны. Например, облучение в дозах в диапазоне несколько десятков грей вызывает уменьшение проводимости нервного импульса в изолированных периферических нервах взрослых животных. Как известно, передача нервного импульса — результат избирательной диффузии ионов натрия и калия через мембрану аксона. Такие изменения электрической активности нервов, вызванные облучением, указывают на увеличение у аксона пассивной проницаемости для ионов. Изменения поведения и функции центральной нервной системы взрослых животных обнаруживаются после облучения в такой низкой дозе, как 0,5 Гр. Неизвестно, являются ли эти эффекты результатом первичных радиационных повреждений нервной ткани или же они обусловлены косвенным эффектом токсинов, освобождающихся из других поврежденных облучением тканей органов и систем. [c.44]
[c.44]
Процесс диффузии через клеточную мембрану сложнее, чем свободная молекулярная диффузия. Массоперенос веществ, растю-ренньк в клеточном соке, осуществляется через клеточные стенки в межклеточное пространство путем внутретей диффузии. Молекулы диффундирующего вещества сорбируются материалом клеточной мембраны, диффундируют через нее и десорбируются с другой ее стороны. Скорость диффузии вещества через мембрану определяется при этом градиентом концентрации по обе стороны клеточной стенки и свойствами самой мембраны. После выноса вещества из клетки их диффузия становится свободной молекулярной. [c.77]
Показано [188—191], что поликатионы — сополимеры винилпирролидона с аминоалкиловыми эфирами ненасыщенных карбоновых кислот — обладают значительной антибактериальной активностью (более высокой, чем у низкомолекулярных аналогов с низшими алкильными заместителями) в результате кооперативного взаимодействия с бактериальными клетками, которое сопровождается увеличением проницаемости клеточных мембран. С помощью электронной микроскопии было обнаружено, что под действием поликатионов происходит разрыхление стенки клетки и растяжение цитоплазматической мембраны. Катионные центры электростатически взаимодействуют с фосфолипидами, нейтрализуя их отрицательный заряд и, судя по нашим данным, вызывая их латеральную диффузию, вследствие чего мембрана дестабилизируется и ее проницаемость повышается. Хотя гомополимеры катионов достаточно токсичны, их сополимеры с винилпирролидоном, содержащие 10— 15 % (мол.) катионных остатков, имеют меньшую токсичность. Мембранной активностью обладают также комплексоны. Так, сополимер винилпирролидона с метакрилоилацетоном извлекает ионы металлов из клеточной мембраны и тем самым дестабилизирует ее. [c.138]
С помощью электронной микроскопии было обнаружено, что под действием поликатионов происходит разрыхление стенки клетки и растяжение цитоплазматической мембраны. Катионные центры электростатически взаимодействуют с фосфолипидами, нейтрализуя их отрицательный заряд и, судя по нашим данным, вызывая их латеральную диффузию, вследствие чего мембрана дестабилизируется и ее проницаемость повышается. Хотя гомополимеры катионов достаточно токсичны, их сополимеры с винилпирролидоном, содержащие 10— 15 % (мол.) катионных остатков, имеют меньшую токсичность. Мембранной активностью обладают также комплексоны. Так, сополимер винилпирролидона с метакрилоилацетоном извлекает ионы металлов из клеточной мембраны и тем самым дестабилизирует ее. [c.138]
Ю1угамин является транспортной формой аммиака, так как представляет собой нейтральную аминокислоту, способную легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутаминовой кислоты, требующей механизмов активного транспорта). Из многих органов глутамин поступает в кровь, в наибольшем количестве — из мышц и мозга (рис. 9.5). [c.236]
Из многих органов глутамин поступает в кровь, в наибольшем количестве — из мышц и мозга (рис. 9.5). [c.236]
Выяснено, что практически все немакромолекулярные органические и неорганические вещества способны проникать в клетку и покидать ее. Использование радиоактивных изотопов позволило установить, что, если даже концентрация веществ в клетке и окружающей среде одинакова, все-таки происходит непрерывный обмен ионов между клеткой и средой. При этом ряд веществ проникает путем диффузии через клеточную мембрану (пассивный перенос). К числу, таких веществ относятся органические молекулы, обладающие хорошей способностью растворяться в жирах чем растворимость выше, тем проникновение происходит быстрее. Молекулы воды и ионы низкомолекулярных неэлектролитов, плохо растворимых в жирах, проникают в клетку через специальные участки клеточной мембраны— поры. Диаметр пор колеблется в пределах от 7 до 16 А, а общая площадь их составляет доли процента к общей поверхности клетки (в эритроците, например, 0,06% поверхности клетки).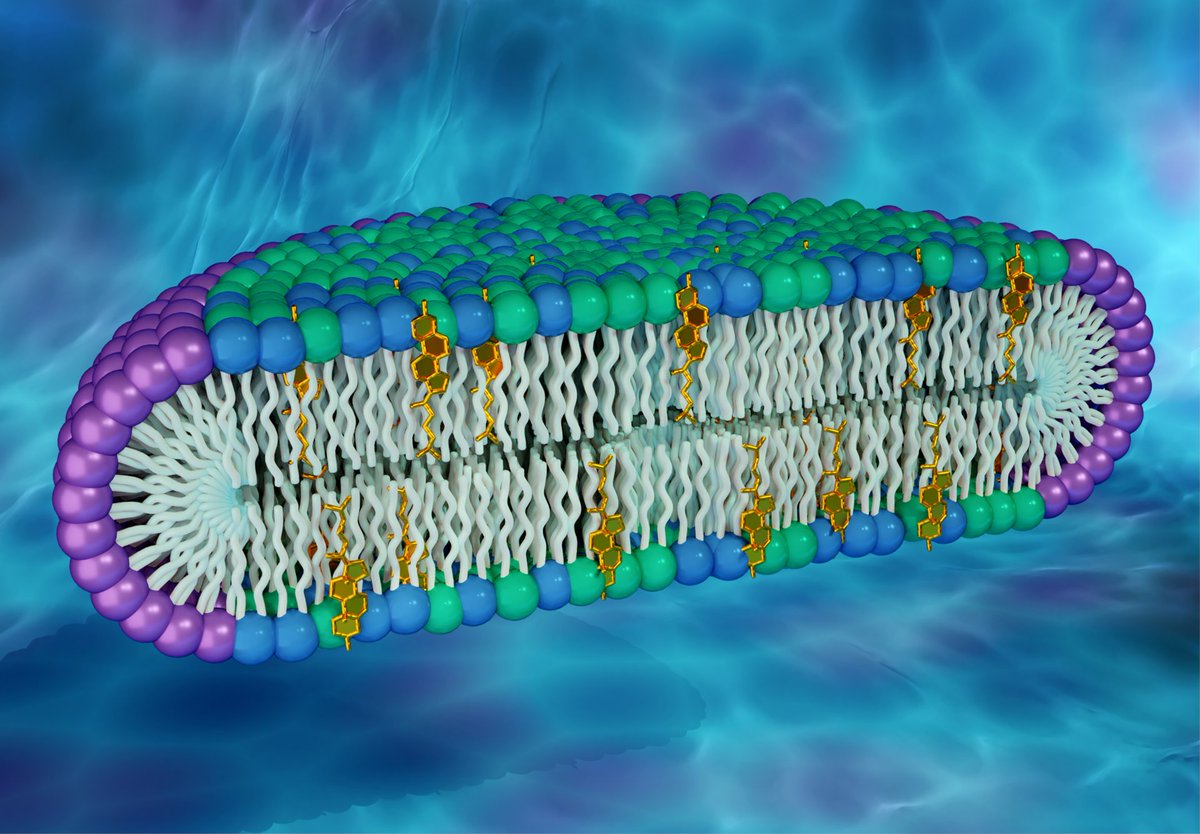 Проникновение в клетку аминокислот и сахаров осуществляется вследствие соединения их с компонентами мембраны, называемыми переносчиками. [c.55]
Проникновение в клетку аминокислот и сахаров осуществляется вследствие соединения их с компонентами мембраны, называемыми переносчиками. [c.55]
Еще одной принципиальной особенностью живой системы является то, что транспорт кислорода к клетке на всех его этапах, включая и диффузионный,—регулируемый процесс. Диффузия кислорода к клетке определяется прежде всего потребностями кислород — зависимых метаболических систем (регуляция на клеточном уровне). Главной среди них является система митохондриального окисления. Экспериментально установлено, что последний наиболее количественно значимый каскад напряжения кислорода находится на участке внеклеточная жидкость-митохондрии [155, 316]. В то же время потребности клетки в кислороде, а следовательно, и его перенос тесно связаны с функциональным состоднием организма. Об этом свидетельствует зависимость коэффициента диффузии кислорода не только от чисто физических факторов, таких, как температура и содержание воды в тканях, но и от типа ткани, особенностей структуры клеточной мембраны, и, наконец, самое главное, от функционального состояния ткани [12, 30,172, 257, 417, 525, 542, 596]. [c.17]
[c.17]
Поскольку подобная диффузия не сопряжена с каким-либо энергозависимым транспортным механизмом, она может быть только пассивной. Вещества, транспортируемые через эпителий с помощью активных механизмов, перемещаются по клеточным путям при участии клеточной мембраны. Они должны пересечь клеточну1р мембрану дважды — входя в клетку с одной стороны и выходя — с другой. Для реализации активного транспорта в таком случае необходимо, чтобы часть клеточной мембраны, [c.48]
Иная ситуация имеет место на мукозной стороне. Клеточная. мембрана здесь слабопроницаема для калия. Более того, суммарная направленная внутрь диффузия ионов натрия через мембрану, облегчаемая переносчиками или происходящая через каналы в мембране, возмещает утрату N3″ , [c.49]
При всасывании происходит как пассивный, так и активный энергозависимый транспорт. Для переноса веществ в ЖКТ особое значение имеют большая площадь поверхности кишечника и влияние постоянного кровотока в слизистой оболочке на градиенты концентрации между просветом кишечника и кровью. Путем диффузии и осмоса через слизистую оболочку кишечника переносятся, в частности, вода, С1, а также такие вещества, как аскорбиновая кислота, пиридоксин и рибофлавин. Поскольку клеточные мембраны содержат большое количество липидов, для диффузии через мембрану вещества должны быть в какой-то степени жирорастворимыми. Согласно теории неионной диффузии, указанным путем переносятся главным образом недиссоциированные соли слабых кислот пли слабых оснований. Это необходимо учитывать при назначении лекарств, большая часть которых всасывается путем диффузии Для переноса какого-либо вещества в соответствии с уравнением Гендерсона — Гассельбаха особое значение имеет рК этого вещества и pH в просвете кишечника. [c.81]
Путем диффузии и осмоса через слизистую оболочку кишечника переносятся, в частности, вода, С1, а также такие вещества, как аскорбиновая кислота, пиридоксин и рибофлавин. Поскольку клеточные мембраны содержат большое количество липидов, для диффузии через мембрану вещества должны быть в какой-то степени жирорастворимыми. Согласно теории неионной диффузии, указанным путем переносятся главным образом недиссоциированные соли слабых кислот пли слабых оснований. Это необходимо учитывать при назначении лекарств, большая часть которых всасывается путем диффузии Для переноса какого-либо вещества в соответствии с уравнением Гендерсона — Гассельбаха особое значение имеет рК этого вещества и pH в просвете кишечника. [c.81]
Большинство антибиотиков в отличие от веществ, которые клетка узнает как источники питания (сахара, аминокислоты и т. д.), поступает в клетку путем диффузии со скоростью, пропорциональной градиентам концентрации между наружной и внутренней средой клетки и зависящей от физико-химической природы барьера Барье ром являются клеточная мембрана и клеточная стенка Клеточные мембраны различных бактерий очень близки по структуре и составу, тогда как клеточные стенки у разных групп бактерий существенно различаются. [c.128]
[c.128]
Диффузия играет большую роль на многих стадиях процесса фотосинтети-ческого включения углерода СОг в углеводы. При этом углекислый газ диффундирует из атмосферы, достигая поверхности листа, а затем проходит через усть-ичные отверстия. Войдя в лист, СО2 диффундирует по межклеточным воздухоносным пространствам, а затем через клеточные оболочки и плазму клеток ме.зо-филла листа. Далее углекислый газ, по-виднмому, в форме НСОг диффундирует через цитоплазму и достигает хлоропластов. Затем СО2 оказывается в хлоропласте и попадает в зону действия ферментов, участвующих в образовании углеводов. Как видно, одну только эту сторону фотосинтеза можно расчленить на много стадий, в каждой из которых важную роль играет диффузия. Если бы с помощью ферментов фиксировался весь углекислый газ, находящийся в сфере их действия, и не происходила бы диффузия новых количеств углекислого газа из атмосферы, окружающей растение, процесс фотосинтеза прекратился бы. Диффузия важна также для многих других аспектов физиологии растений, особенно для проникновения веществ через мембраны.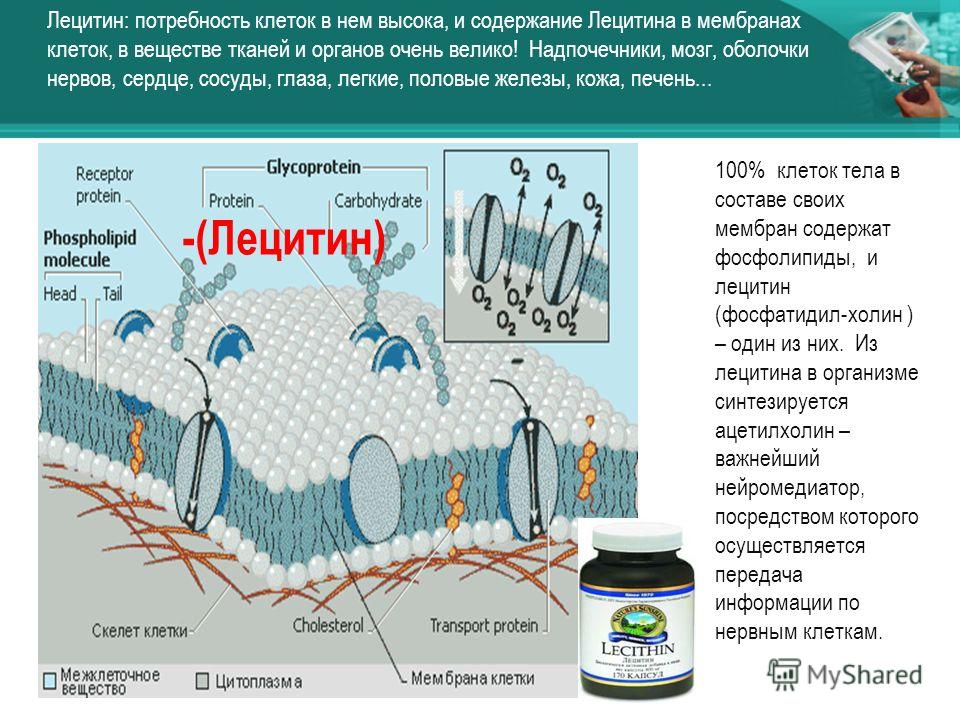 [c.17]
[c.17]
Питание микроорганизмов осуществляется через поверхность их тела путем диффузии в результате разных концентраций веществ внутри и вне организма. Движение растворенных веществ лод действием осмотического давления происходит в сторону мень-щих концентраций, воды — в сторону больших. Так как поступающие в клетку вещества вовлекаются в биохимические процессы и усваиваются микроорганизмом, равновесия их внутри клетки и. вне ее практически не наступает. Однако проникновение вещества -В клетку не всегда объяснимо осмосом. Цитоплазматическая мембрана обладает избирательной способностью отличать нужные вещества от ненужных и извлекать их из растворов с малой концентрацией, не пропуская вредные для клетки вещества, содержащиеся в среде в значительных концентрациях (до определенных лределов). Так как поверхность клеток на единицу их массы лредставляет громадную величину, то процессы обмена и размножения микроорганизмов происходят с большими скоростями, и этим объясняются интенсивные биоповреждения некоторых материалов, на которых идут такие процессы. Давление в клетке создается поступившими в нее веществами, продуктами обмена и веществами клеточного синтеза. В связи с высоким осмотическим давлением внутри клетки создается постоянный приток в нее воды. Этим можно объяснить способность микроорганизмов развиваться на сравнительно сухих средах. Так, микрогрибы способны повреждать материалы, имеющие влажность 15…20 % и ниже. [c.15]
Давление в клетке создается поступившими в нее веществами, продуктами обмена и веществами клеточного синтеза. В связи с высоким осмотическим давлением внутри клетки создается постоянный приток в нее воды. Этим можно объяснить способность микроорганизмов развиваться на сравнительно сухих средах. Так, микрогрибы способны повреждать материалы, имеющие влажность 15…20 % и ниже. [c.15]
Липосомальные наносистемы на основе соевых фосфолипидов как контейнер для лекарственных средств
А.И. Шанская, С.М. Пучкова
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии ФМБА» г. Санкт-Петербург
Трансфузиология №2, 2013
Резюме
Разработан универсальный липосомальный контейнер для инкапсулирования различных фармацевтических внутривенных препаратов на основе нанофосфолипидной системы. Результаты представленных исследований могут быть использованы как в научных экспериментах, так и при освоении технологии получения новых липосомальных форм лекарств.
Ключевые слова: фосфолипиды сои, липосомы, наночастицы, альфа-токоферол.
Развитие науки и технологии в настоящее время наряду с поиском и синтезом новых лекарственных препаратов позволяет совершенствовать лекарственные формы уже используемых средств, повышая их терапевтическую эффективность и снижая частоту и степень побочных реакций. Одним из таких способов совершенствования является создание липидсодержащих систем – липосом. Липосомы — это микроскопические жировые частицы, заполненные жидкостью, оболочка которых состоит из молекул тех же природных фосфолипидов (ФЛ), что входят в состав клеточных мембран. Согласно классификации липидов, ФЛ относятся к группе водорастворимых набухающих амфифилов. Амфифильность ФЛ, обусловленная наличием в молекуле гидрофильной части – фосфорилированного спирта (так называемая «полярная головка») и липофильной части – цепи жирных кислот (так называемый «жирнокислотный хвост»), определяет их уникальные свойства – способность к эмульгированию и диспергированию в водных системах с образованием в определённых условиях мембранных структур (ламелл, липосом, мицелл). Именно это свойство ФЛ взято природой в качестве основы для конструирования всех без исключения клеточных мембран. Оно же, при направленном использовании и специальном подборе, позволяет использовать ФЛ в качестве поверхностно-активного вещества (сурфактанта) при получении эмульсий или в виде наночастиц (липосом, мицелл) как транспортное средство для доставки лекарственных соединений и биологически активных веществ. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство липосом, а жирорастворимые (гидрофобные) включаются в липидный бислой.
Именно это свойство ФЛ взято природой в качестве основы для конструирования всех без исключения клеточных мембран. Оно же, при направленном использовании и специальном подборе, позволяет использовать ФЛ в качестве поверхностно-активного вещества (сурфактанта) при получении эмульсий или в виде наночастиц (липосом, мицелл) как транспортное средство для доставки лекарственных соединений и биологически активных веществ. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство липосом, а жирорастворимые (гидрофобные) включаются в липидный бислой.
Как известно, мембраны играют главную роль в системе биологической коммуникации, благодаря специфическим рецепторам, воспринимающим внешние стимулы. Фосфолипиды – основной класс мембранных липидов. Фосфатидилхолин (ФХ), максимально представленный в мембранах различных клеток тканей (35-50% от всех ФЛ), фосфатидилинозит (ФИ), относящийся к минорным метаболически значимым ФЛ, и мажорный, структурирующий мембраны фосфатидилэтаноламин (ФЭА), участвуют во многих процессах жизнедеятельности клетки.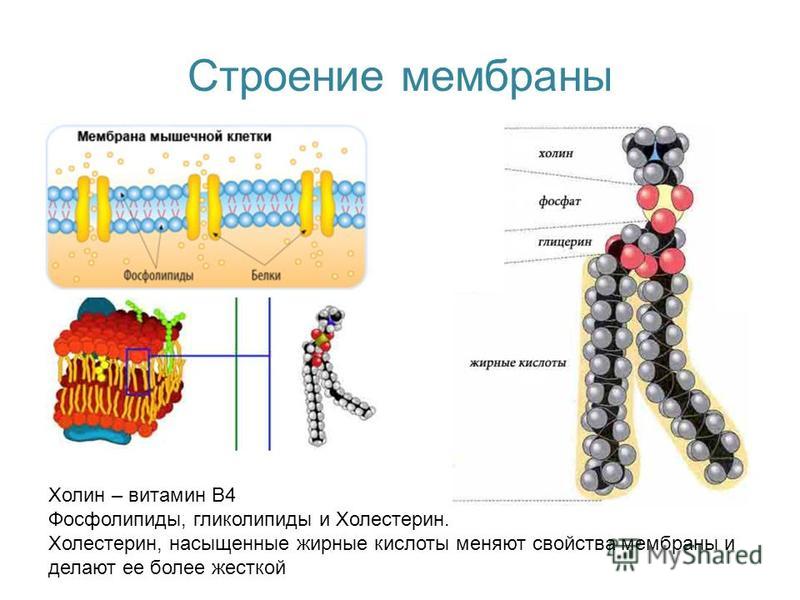 Природные ФЛ обычно отличаются высокой физиологической толерантностью и легко метаболизируются. Чтобы проследить путь экзогенных ФЛ, введенных в организм, проведены исследования с использованием радиоактивных изотопов. Для этой цели чаще всего использовали высокоочищенные ФХ и ФИ, выделенные из фосфолипидной смеси соевых бобов. Установлено, что у крыс, собак и человека из кишечника в течение суток всасывается 90% поступившего ФХ. Максимальная концентрация его в крови обнаруживается уже через 6 часов после поступления в организм. Аналогично метаболизируется и ФИ [1]. При применении препаратов из природных, высококонцентрированных фосфолипидов, полученных из генетически немодифицированных бобов сои, содержащих более 75% ненасыщенных жирных кислот, было установлено снижение активности ферментов крови (АлАТ, АсАТ) и величины показателей пигментного обмена, улучшение УЗИ-структуры паренхимы печени. Пациенты отмечали исчезновение дискомфорта в правом подреберье, улучшение переносимости жирной пищи [2].
Природные ФЛ обычно отличаются высокой физиологической толерантностью и легко метаболизируются. Чтобы проследить путь экзогенных ФЛ, введенных в организм, проведены исследования с использованием радиоактивных изотопов. Для этой цели чаще всего использовали высокоочищенные ФХ и ФИ, выделенные из фосфолипидной смеси соевых бобов. Установлено, что у крыс, собак и человека из кишечника в течение суток всасывается 90% поступившего ФХ. Максимальная концентрация его в крови обнаруживается уже через 6 часов после поступления в организм. Аналогично метаболизируется и ФИ [1]. При применении препаратов из природных, высококонцентрированных фосфолипидов, полученных из генетически немодифицированных бобов сои, содержащих более 75% ненасыщенных жирных кислот, было установлено снижение активности ферментов крови (АлАТ, АсАТ) и величины показателей пигментного обмена, улучшение УЗИ-структуры паренхимы печени. Пациенты отмечали исчезновение дискомфорта в правом подреберье, улучшение переносимости жирной пищи [2].
В основе дезинтоксикационного и антирадиационного эффектов препаратов такого механизма действия лежит свойство полиненасыщенных жирных кислот, входящих в состав фосфолипидов, связывать токсины и активные химические радикалы. Фосфолипиды являются важным компонентом неферментативной антиоксидантной защиты природных липидов.
В настоящее время в отечественной и зарубежной литературе большое внимание уделяется разработке фосфолипидных транспортных систем. Фосфолипидные наночастицы (мицеллы/липосомы) имеют ряд преимуществ перед другими, например, полимерными наночастицами. Они нетоксичны, биодеградируемы, не вызывают аллергических реакций, благодаря своему строению и составу, имеют высокое сродство к мембранам клеток, что позволяет доставлять лекарство внутрь клетки. В настоящее время в мире существует 10-15 сертифицированных наносис- тем, используемых в качестве переносчиков лекарств, а на фармацевтическом рынке – несколько десятков, в основном, противоопухолевых препаратов, снабженных фосфолипидной системой транспорта (липосомы).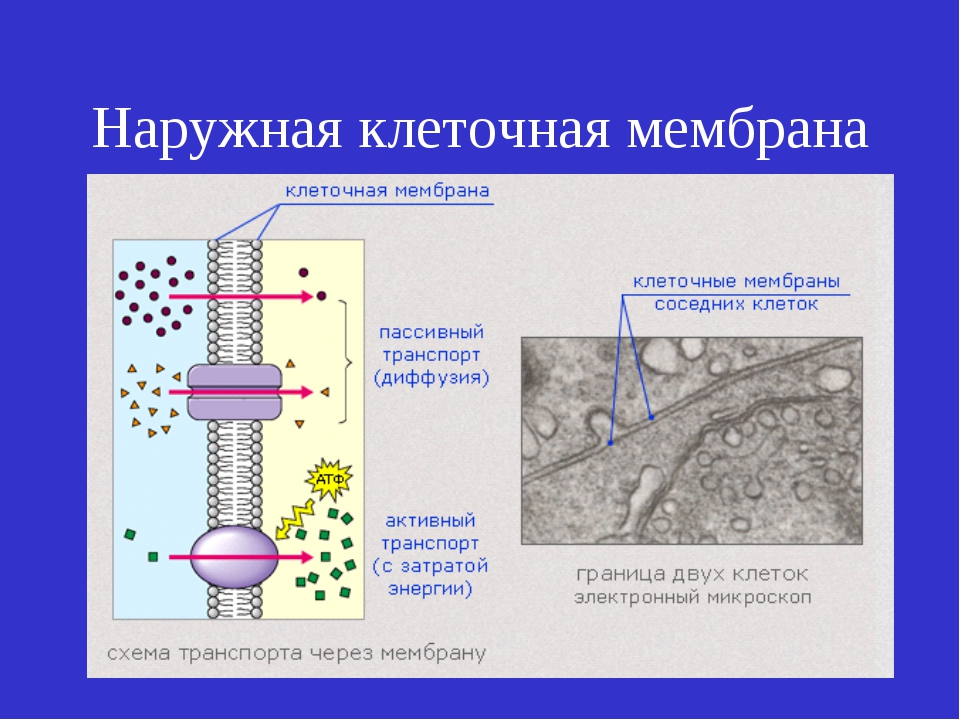 Большинство препаратов находятся на последних стадиях клинических испытаний.
Большинство препаратов находятся на последних стадиях клинических испытаний.
Одним из многообещающих направлений в развитии фармакологии являются нанотехнологии. На смену технологическим процессам с применением микрочастиц (препараты жировых эмульсий) пришли технологии, позволяющие работать с нано- частицами. Свойства таких частиц дают возможность создать нанокомпозиции, способные коренным образом изменить диагностику и лечение многих заболеваний [3].
В практическом аспекте нанотехнологии – это технологии, которые манипулируют единичными объектами размером не более 100 нм и используют их уникальные свойства, возникающие вследствие того, что в наночастицах, благодаря их малым размерам, существенно изменяются физико-химические свойства вещества. В области медицины возможности нанотехнологий нацелены на управление с помощью наноматериалов и наночастиц физическими, химическими и биологическими процессами, протекающими в живых организмах на молекулярном уровне [4].
Основное фармакологическое применение существующих в настоящее время наночастиц состоит в использовании их как носителей лекарственных веществ (ЛВ). Такие частицы могут облегчать всасывание и прохождение их через биологические мембраны, защищать от метаболизма, улучшать профиль тканевого распределения и усиливать проницаемость в клетку. Вследствие этого существенно повышается безопасность применения лекарств, уменьшаются их токсичность и риск развития побочных эффектов [5].
Такие частицы могут облегчать всасывание и прохождение их через биологические мембраны, защищать от метаболизма, улучшать профиль тканевого распределения и усиливать проницаемость в клетку. Вследствие этого существенно повышается безопасность применения лекарств, уменьшаются их токсичность и риск развития побочных эффектов [5].
Несмотря на общее название, наночастицы существенно различаются по размеру, форме и составу входящих в них веществ. По форме они могут иметь вид шара, сферы, трубки, мицеллы и др. Преимущественно наночастицы – это сложные много- компонентные структуры, порой имеющие несколько слоев, различных по физико-химическим свойствам.
Наиболее изученными, с нашей точки зрения, наночастицами являются липосомы – наносферы водной субстанции, заключенные в фосфолипидную оболочку, размер их может варьироваться от нескольких десятков нанометров до десятка микрометров. Толщина липидного бислоя определяется, прежде всего, длиной углеводородных цепей и равна приблизительно 4–5 нм.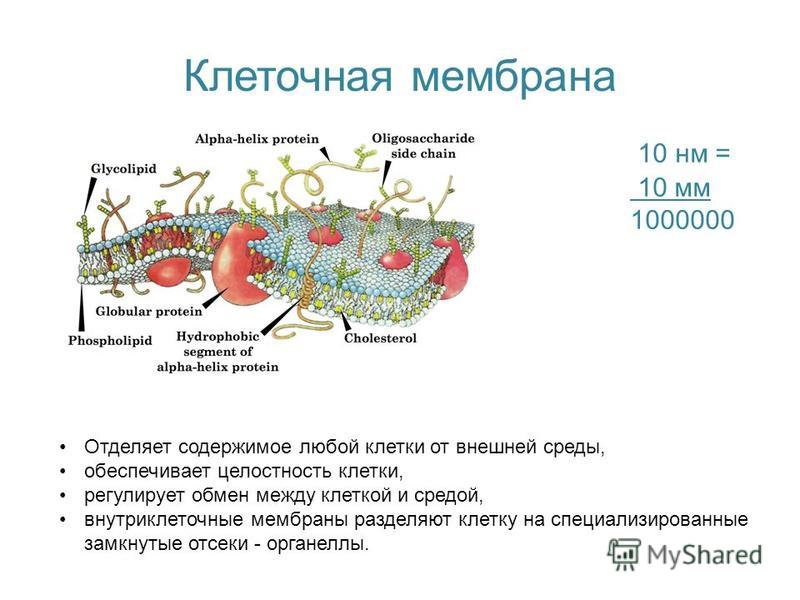 Расстояние между бислоями 2–3 нм и может возрастать до 20 нм в зависимости от величины заряда бислоя. Липосомы являются уникальными носителями лекарств, поскольку обеспечивают не только направленную доставку, но и регуляцию скорости высвобождения лекарства в месте патологического процесса. Искусственные мембраны, построенные на основе липидного бислоя, позволяют воспроизвести в модельных системах (липосомах) многие функции и характеристики биологических мембран. Способность липосом включать в себя вещества различной химической природы без каких-либо ограничений даёт поистине уникальные возможности для решения некоторых медицинских проблем. Включение лекарственных веществ (ЛВ) в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен её мембраной от действия неблагоприятных факторов, а с другой – та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма.
Расстояние между бислоями 2–3 нм и может возрастать до 20 нм в зависимости от величины заряда бислоя. Липосомы являются уникальными носителями лекарств, поскольку обеспечивают не только направленную доставку, но и регуляцию скорости высвобождения лекарства в месте патологического процесса. Искусственные мембраны, построенные на основе липидного бислоя, позволяют воспроизвести в модельных системах (липосомах) многие функции и характеристики биологических мембран. Способность липосом включать в себя вещества различной химической природы без каких-либо ограничений даёт поистине уникальные возможности для решения некоторых медицинских проблем. Включение лекарственных веществ (ЛВ) в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен её мембраной от действия неблагоприятных факторов, а с другой – та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого ЛВ высвобождается постепенно, в нужных дозах в течение требуемого промежутка времени [6, 7, 8].
Липосома в данном случае выполняет роль хранилища, из которого ЛВ высвобождается постепенно, в нужных дозах в течение требуемого промежутка времени [6, 7, 8].
Свойства липосом в большой степени определяются химическим составом липидного бислоя. Рядом авторов было показано, что включение в состав липидного бислоя липосом анионных ФЛ (фосфатидилэтаноламина, инозит-фосфатида) увеличивает стабильность липосомальной везикулы. Введение отрицательно заряженного компонента придаёт мембране отрицательный заряд, предотвращающий агрегирование везикул и их прилипание к стенкам сосудов.
Так, в работе М.В. Жуковой с соавторами [9, 10], посвященной инкапсулированию доксорубицина в липосомы, для формирования липосомальных везикул использовался отрицательно заряженный фосфатидилэтаноламин (ФЭА) в сочетании с антиоксидантной составляющей – α-токоферолом. Липидный бислой содержит ФХ, ФЭА и α-токоферол в высоком соотношении 60:40:1. Применение такого состава является примером того, что фосфолипиды являясь благоприятным субстратом окисления, в то же время участвуют в синергическом увеличении эффективности действия токоферола.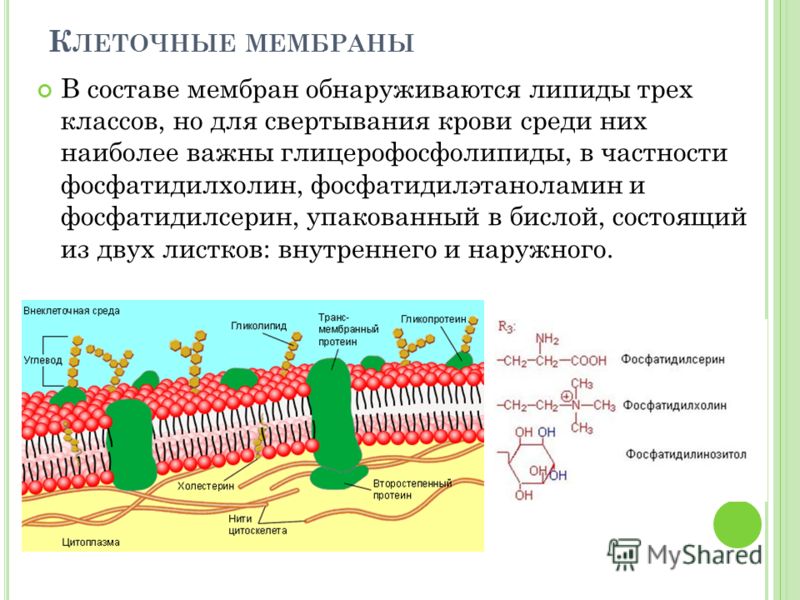 Таким образом, профилактика повреждения мембран и дезактивация процесса свободнорадикального окисления может быть обеспечена с помощью композиции фосфолипидов и полифенолов (α-токоферол).
Таким образом, профилактика повреждения мембран и дезактивация процесса свободнорадикального окисления может быть обеспечена с помощью композиции фосфолипидов и полифенолов (α-токоферол).
Показано, что степень синергизма зависит не только от соотношения ФЛ и полифенолов, но и от относительной доли ФХ и ФЭА в ФЛ-комплексе. Хотелось бы отметить, что ФХ получали из лецитина соевых бобов Epikuron 200 (Lucas Meyer, США), содержащего 92% ФХ. Этими же авторами показано, как измерение состава бислоя липосом влияет на их свойства.
Многие авторы предпочитают в качестве составляющей бислоя использовать не соевый, а яичный ФХ. Так, в работе сотрудников института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН [11], в составе бислоя ЛС используется яичный ФХ и ФИ в соотношении (8:1) моль. Показана большая эффективность липосомальной формы диглицеридного производного метотрексата по сравнению с исходным лекарством, в том числе пониженная системная токсичность, а также преодоление явления множественной лекарственной устойчивости. Следует отметить, что в последние годы предпочтение всё же отдается ФЛ, выделенным из соевого сырья. Вышеприведенные немногочисленные примеры свидетельствуют о том, что важным условием сохранения стабильности липосомальной субстанции является наличие в составе липосом антиоксиданта α-токоферола (α-ТФ). Способность α-токоферола растворяться только в жирах и органических растворителях затрудняет его доступ в клетку. Решающим фактором доставки α-ТФ в клетку через её мембрану является включение его в бислои липосом. В литературе [12] описан способ получения липосомальной формы α-ТФ, который позволяет получать липосомы с высокой биологической активностью и стабильностью при хранении. Проведение циклической гомогенизации обеспечивает получение липосомального размера 50-400 нм. Заданное значение размера липосом достигается путём выбора давления и количества циклов гомогенизации. Соотношение α-ТФ и фосфолипидов составляет 1:6 по массе соответственно. Полученный препарат может быть использован в медицинской промышленности, в ветеринарии в качестве кормовых добавок и инъекций животным, а также в косметической промышленности.
Следует отметить, что в последние годы предпочтение всё же отдается ФЛ, выделенным из соевого сырья. Вышеприведенные немногочисленные примеры свидетельствуют о том, что важным условием сохранения стабильности липосомальной субстанции является наличие в составе липосом антиоксиданта α-токоферола (α-ТФ). Способность α-токоферола растворяться только в жирах и органических растворителях затрудняет его доступ в клетку. Решающим фактором доставки α-ТФ в клетку через её мембрану является включение его в бислои липосом. В литературе [12] описан способ получения липосомальной формы α-ТФ, который позволяет получать липосомы с высокой биологической активностью и стабильностью при хранении. Проведение циклической гомогенизации обеспечивает получение липосомального размера 50-400 нм. Заданное значение размера липосом достигается путём выбора давления и количества циклов гомогенизации. Соотношение α-ТФ и фосфолипидов составляет 1:6 по массе соответственно. Полученный препарат может быть использован в медицинской промышленности, в ветеринарии в качестве кормовых добавок и инъекций животным, а также в косметической промышленности. Применение нескольких антиоксидантов в составе одного препарата имеет важные преимущества, но не лишено недостатков. Преимущества заключаются в том, что некоторые антиоксиданты, например, токоферол-аскорбиновая кислота могут усиливать действие друг друга. В то же время в зависимости от соотношения между ними возможно взаимное ослабление действия. Это было показано напримере пары токоферол-каротиноиды в модельных системах [13].
Применение нескольких антиоксидантов в составе одного препарата имеет важные преимущества, но не лишено недостатков. Преимущества заключаются в том, что некоторые антиоксиданты, например, токоферол-аскорбиновая кислота могут усиливать действие друг друга. В то же время в зависимости от соотношения между ними возможно взаимное ослабление действия. Это было показано напримере пары токоферол-каротиноиды в модельных системах [13].
Мембранопротекторный эффект витамина Е связан с проявлением антиоксидантных свойств и с его участием в организации структуры мембран за счет прямого взаимодействия его боковой изодентальной цепи с полиненасыщенными жирными кислотами фосфолипидных мембран. Такое взаимодействие приводит к более плотной упаковке мембран митохондрий. Вследствие этого у них появляется повышенная устойчивость к действию процессов ПОЛ.
Дефицит α-ТФ сопровождается интенсификацией процессов ПОЛ, заключающейся в повышении концентрации малонового диальдегида и снижении активности ферментативного звена антиоксидантной защиты (супероксиддисмутазы и каталазы). Данные последних лет свидетельствуют, что реакции свободнорадикального окисления играют важную роль в патогенезе последствий экстремальных состояний. Использование антиоксидантных лекарственных средств в этих случаях представляется вполне оправданным.
Данные последних лет свидетельствуют, что реакции свободнорадикального окисления играют важную роль в патогенезе последствий экстремальных состояний. Использование антиоксидантных лекарственных средств в этих случаях представляется вполне оправданным.
В литературе большое количество работ посвящено α-ТФ, как важнейшему витамину и антиоксиданту [14]. Широко обсуждаются вопросы биологической роли, метаболизма, дефицита витамина Е (клиническое проявление гиповитаминоза Е), его потребность для организма. Подчеркивается широкий спектр действия этого активного вещества и необходимость применения его при различных патологиях. Особо хочется отметить, что витамин Е обладает онкопрофилактическими свойствами, поглощает радикалы, обезвреживает канцерогены, повышает защитную способность Т-лимфоцитов, смягчает внутреннее воспаление и не дает перейти в хроническое, а главное, подавляет рост опухоли. Однако работы посвященные созданию липосомальной формы α-ТФ, встречаются редко и до настоящего времени препараты с α-ТФ для внутривенного введения отсутствуют.
В результате проведённых исследований в Российском НИИ гематологии и трансфузиологии в лаборатории жировых эмульсий создан универсальный для инкапсулирования различных фармацевтических препаратов липосомальный контейнер для внутривенного введения, липидные компоненты которого выделяются из отечественного сырья – фосфолипидов сои. Нами получены липосомы на основе фосфолипидов сои, содержащие α-токоферол.
В опытах на крысах изучалось терапевтическое действие α-ТФ и липосом с α-ТФ при синдроме длительного сдавливания [15]. Изучение содержания малонового диальдегида, активности каталазы и супероксиддисмутазы в тканях печени, почек, миокарда и мозга позволило судить о степени перекисного окисления липидов. Результаты исследований показали выраженное антиоксидантное действие липосом с α-ТФ, терапевтическая эффективность которых в 1,5–2 раза превышала эффективность обычной формы α-ТФ. Разработан способ получения ли- посом с цитохромом С для внутривенного введения. Оболочка липосом состояла из соевого лецитина, холестерина и компонента, содержащего отрицательно заряженные фосфолипиды.
Проведена работа по изучению противоишемической защиты миокарда с помощью липосом, содержащих цитохром С [16]. Изучение терапевтической эффективности проводили на модели ишемии у крыс. Установлено, что введение животным после острой ишемии миокарда липосом с цитохромом С препятствовало развитию тяжёлых нарушений энергетического обмена в сердце и тормозило активацию перекисного окисления липидов. У животных, которым вводили липосомы с цитохромом С, содержание в сердце фосфокреатина и АТФ было значительно выше, чем у крыс, которым вводили его обычную форму, а структурные повреждении миокарда менее выражены. Более высокие противоишемические свойства липосом с цитохромом С, очевидно, связаны с пролонгацией его терапевтического действия. Наличие липосомальной оболочки у цитохрома С способствует его удержанию в деструктивных участках. Результаты исследований позволяют рекомендовать липосомы с цитохромом С для экспериментального изучения как кардиопротекторного средства.
Также были проведены исследования по включению в липосомальный контейнер гемоглобина [17]. Из литературы известно, что гемоглобин и другие гемсодержащие белки катализируют перекисное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов, продукты окисления которых в свою очередь окисляют гемоглобин. Везикулы же, состоящие из лецитина, содержащего фосфатидилхолин с насыщенными жирнокислотными остатками, оказывают стабилизирующее влияние на гемоглобин. Кроме того, они более инертны в отношении процессов свёртывания крови. Нами получены образцы соевого лецитина различной степени гидрогенизации (40, 50 и 60%) . В качестве катализатора использовали Ni-Ренея. На основе образцов гидрированного соевого лецитина были получены 9 серий липосом, изучение физико-химических характеристик которых показало возможность получения мелкодисперсного, нетоксичного, апирогенного липосомального препарата не влияющего на осмотическую резистентность эритроцитов. При разработке метода получения гемосом мы использовали два состава бислоя липосомальных везикул. Первый состав в качестве основного компонента содержал лецитинобогащённую фракцию соевых фосфолипидов, второй – гидрированный на 50% соевый лецитин с иодным числом 63.
Из литературы известно, что гемоглобин и другие гемсодержащие белки катализируют перекисное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов, продукты окисления которых в свою очередь окисляют гемоглобин. Везикулы же, состоящие из лецитина, содержащего фосфатидилхолин с насыщенными жирнокислотными остатками, оказывают стабилизирующее влияние на гемоглобин. Кроме того, они более инертны в отношении процессов свёртывания крови. Нами получены образцы соевого лецитина различной степени гидрогенизации (40, 50 и 60%) . В качестве катализатора использовали Ni-Ренея. На основе образцов гидрированного соевого лецитина были получены 9 серий липосом, изучение физико-химических характеристик которых показало возможность получения мелкодисперсного, нетоксичного, апирогенного липосомального препарата не влияющего на осмотическую резистентность эритроцитов. При разработке метода получения гемосом мы использовали два состава бислоя липосомальных везикул. Первый состав в качестве основного компонента содержал лецитинобогащённую фракцию соевых фосфолипидов, второй – гидрированный на 50% соевый лецитин с иодным числом 63.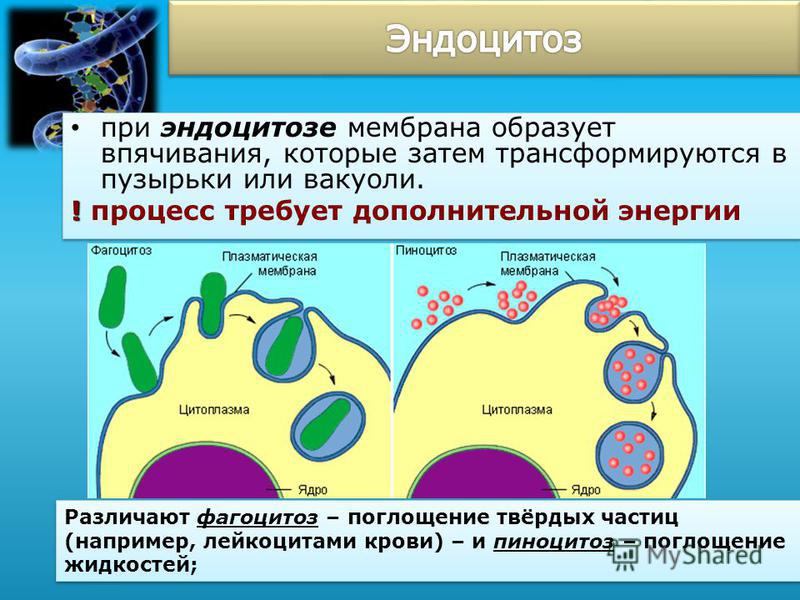 0. Оба состава дополнительно содержали холестерин, кислые фосфолипиды и α-токоферол. Отделение неинкапсулированного гемоглобина осуществляли центрифугированием при 3500 об/мин при 4°С. Средний размер везикул составлял 1,0–1,1 мкм, рН = 7,1–7,3. Концентрация гемоглобина составляла 120 мг/мл. Показано преимущество состава бислоя на основе гидрированного соевого лецитина в процессе инкапсулирования легкоокисляемого гемоглобина. Значения малонового диальдегида и коэффициента окисленности были в два раза ниже, чем у гемосом на основе соевого лецитина. Та же закономерность наблюдалась и в содержании метформы в гемосомах.
0. Оба состава дополнительно содержали холестерин, кислые фосфолипиды и α-токоферол. Отделение неинкапсулированного гемоглобина осуществляли центрифугированием при 3500 об/мин при 4°С. Средний размер везикул составлял 1,0–1,1 мкм, рН = 7,1–7,3. Концентрация гемоглобина составляла 120 мг/мл. Показано преимущество состава бислоя на основе гидрированного соевого лецитина в процессе инкапсулирования легкоокисляемого гемоглобина. Значения малонового диальдегида и коэффициента окисленности были в два раза ниже, чем у гемосом на основе соевого лецитина. Та же закономерность наблюдалась и в содержании метформы в гемосомах.
При введении животным гемосомы на основе как первого, так и второго состава, были нетоксичны. К сожалению, работы по включению в липосомы цитохрома и гемоглобина не вышли за рамки эксперимента. Отработана технология введения α-ТФ в бислой путём получения тонкой пленки с последующим ресуспензированием и измельчением «грубой» дисперсии липосом на гомогенизаторе высокого давления. В результате проведённых исследований был определён оптимальный липидный состав бислоя везикулы и создан оригинальный, не имеющий аналогов, липосомальный препарат для внутривенного введения Липоферол, являющийся наносистемой, содержащей везикулы диаметром не более 100 нм. Известно, что снижение отрицательного заряда эритроцитов является фактором, способствующим их агрегации и снижению суспензионной стабильности клеточной взвеси. Для устойчивости дисперсных систем и взвесей необходимо наличие стабилизатора, который обеспечивает стабильность и динамическую пластичность всей системы.
В результате проведённых исследований был определён оптимальный липидный состав бислоя везикулы и создан оригинальный, не имеющий аналогов, липосомальный препарат для внутривенного введения Липоферол, являющийся наносистемой, содержащей везикулы диаметром не более 100 нм. Известно, что снижение отрицательного заряда эритроцитов является фактором, способствующим их агрегации и снижению суспензионной стабильности клеточной взвеси. Для устойчивости дисперсных систем и взвесей необходимо наличие стабилизатора, который обеспечивает стабильность и динамическую пластичность всей системы.
Совместно с сотрудниками лаборатории консервирования крови института проведено изучение влияния липосом на такие свойства эритроцитов крови как электрофоретическая подвижность, СОЭ, число осмотически неустойчивых эритроцитов, гемолиз, вязкость, деформируемость и другие [18].
Было установлено, что инкубирование консервированной крови доноров с липосомами в дозе моделирующей терапевтическую (2:6 мг фосфолипидов на 1 мл крови доноров) приводит к увеличению отрицательного значения дзета-потенциала эритроцитов.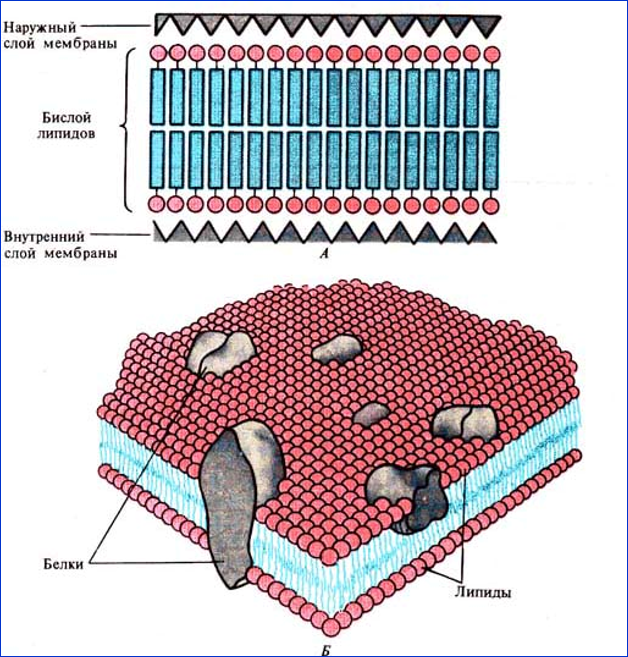 Дальнейшее изучение взаимодействия липосом с эритроцитами крови доноров выявило увеличение суспензионной стабильности крови при хранении в присутствии липосом в течение 14 суток. Наблюдалось снижение СОЭ, уменьшение процесса накопления микросгустков и числа осмотически неустойчивых эритроцитов по сравнению с контролем.
Дальнейшее изучение взаимодействия липосом с эритроцитами крови доноров выявило увеличение суспензионной стабильности крови при хранении в присутствии липосом в течение 14 суток. Наблюдалось снижение СОЭ, уменьшение процесса накопления микросгустков и числа осмотически неустойчивых эритроцитов по сравнению с контролем.
При изучении лечебной эффективности липосомального препарата с α-ТФ Липоферол на модели повреждения печени у животных при острой интоксикации четырёххлористым углеродом было установлено, что препарат обладает более высоким гепатопротекторным эффектом и оказывает выраженный лечебный эффект, по сравнению с α-ТФ per se. Эффективность Липоферола была показана и при инфузионной терапии ожогового шока. Отмечали значительное улучшение системой гемодинамики и кислородного режима организма, снижение явления токсемии в крови обожжённых животных. О повышении лечебной эффективности свидетельствует и большая, по сравнению с контролем, выживаемость животных.
Многофункциональность липосом, выявленная при разной экспериментальной патологии, позволяет рассчитывать на их успешное включение в схемы медикаментозного лечения, применяемого при инфузионной терапии в клинике. Отсутствие промышленного выпуска липосомальных препаратов, особенно для внутривенного введения, вызвано особенностями и сложностями технологии их получения. Создание липосомальных лекарственных препаратов для внутривенного введения для широкого клинического применения – актуальная задача отечественной медицины.
Отсутствие промышленного выпуска липосомальных препаратов, особенно для внутривенного введения, вызвано особенностями и сложностями технологии их получения. Создание липосомальных лекарственных препаратов для внутривенного введения для широкого клинического применения – актуальная задача отечественной медицины.
Органоиды клетки, подготовка к ЕГЭ по биологии
Органоиды (органеллы) клетки — специализированные структуры клетки, выполняющие различные жизненно необходимые функции. Особенно сложно устроены клетки простейших, где одна клетка составляет весь организм и выполняет функции дыхания, выделения, пищеварения и многие другие.
Органоиды клетки подразделяются на:
- Немембранные — рибосомы, клеточный центр, микротрубочки, органоиды движения (жгутики, реснички)
- Одномембранные — ЭПС, комплекс (аппарат) Гольджи, лизосомы и вакуоли
- Двумембранные — ядро, пластиды, митохондрии
Прежде чем говорить об органоидах клетки, без которых невозможна ее жизнедеятельность, необходимо
упомянуть о том, без чего вообще не существует клетки — о клеточной мембране. Клеточная мембрана ограничивает клетку
от окружающего мира и формирует ее внутреннюю среду.
Клеточная мембрана ограничивает клетку
от окружающего мира и формирует ее внутреннюю среду.
Клеточная мембрана (оболочка)
Запомните, что в отличие от клеточной стенки, которая есть только у растительных клеток и у клеток грибов (она придает им плотную, жесткую форму) клеточная мембрана есть у всех клеток без исключения! Этот важный момент объясню еще раз 🙂 У клеток животных имеется только клеточная мембрана, а у клеток растений и грибов есть и клеточная стенка, и клеточная мембрана.
Клеточная мембрана представляет собой билипидный слой (лат. bi — двойной + греч. lipos — жир), который пронизывают молекулы белков.
Билипидный слой представлен двумя слоями фосфолипидов. Обратите внимание, что их гидрофобные концы обращены внутрь мембраны, а
гидрофильные «головки» смотрят наружу.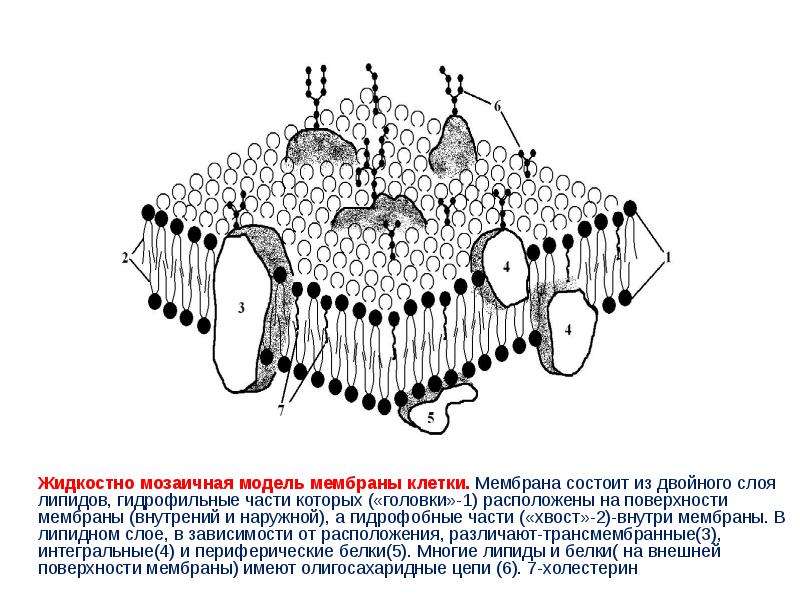 Билипидный слой насквозь пронизывают интегральные белки, частично — погруженные белки,
имеются также поверхностно лежащие белки — периферические.
Билипидный слой насквозь пронизывают интегральные белки, частично — погруженные белки,
имеются также поверхностно лежащие белки — периферические.
Белки принимают участие в:
- Поддержании постоянства структуры мембраны
- Рецепции сигналов из окружающей среды (химического раздражения)
- Транспорте веществ через мембрану
- Ускорении (катализе) реакций, которые ассоциированы с мембраной
Интегральные (пронизывающие) белки образуют каналы, по которым молекулы различных веществ могут поступать в клетку или удаляться из нее. «Заякоренные» молекулы олигосахаридов на поверхности клетки образуют гликокаликс, который выполняет рецепторную функцию, участвует в избирательном транспорте веществ через мембрану.
Теперь вы знаете, что гликокаликс — надмембранный комплекс, совокупность клеточных рецепторов, которые нужны клетке для восприятия регуляторных
сигналов биологически активных веществ (гормонов, гормоноподобных веществ). Гормон избирателен, специфичен и присоединяется
только к своему рецептору: меняется конформация молекулы рецептора и обмен веществ в клетке. Так гормоны
регулируют жизнедеятельность клеток.
Гормон избирателен, специфичен и присоединяется
только к своему рецептору: меняется конформация молекулы рецептора и обмен веществ в клетке. Так гормоны
регулируют жизнедеятельность клеток.
Вирусы и бактерии не являются исключением: они взаимодействуют только с теми клетками, на которых есть подходящие к ним рецепторы. Так, вирус гриппа поражает преимущественно клетки слизистой верхних дыхательных путей. Однако, если рецепторов нет, то вирус не может проникнуть в клетку, и организм приобретает невосприимчивость к инфекции. Вспомните врожденный иммунитет: именно по причине отсутствия рецепторов человек не восприимчив ко многим болезням животных.
Итак, вернемся к клеточной мембране. Ее можно сравнить со стенами помещения, в котором, вероятно, вы находитесь. Стены дома защищают
его от ветра, дождя, снега и прочих факторов внешней среды.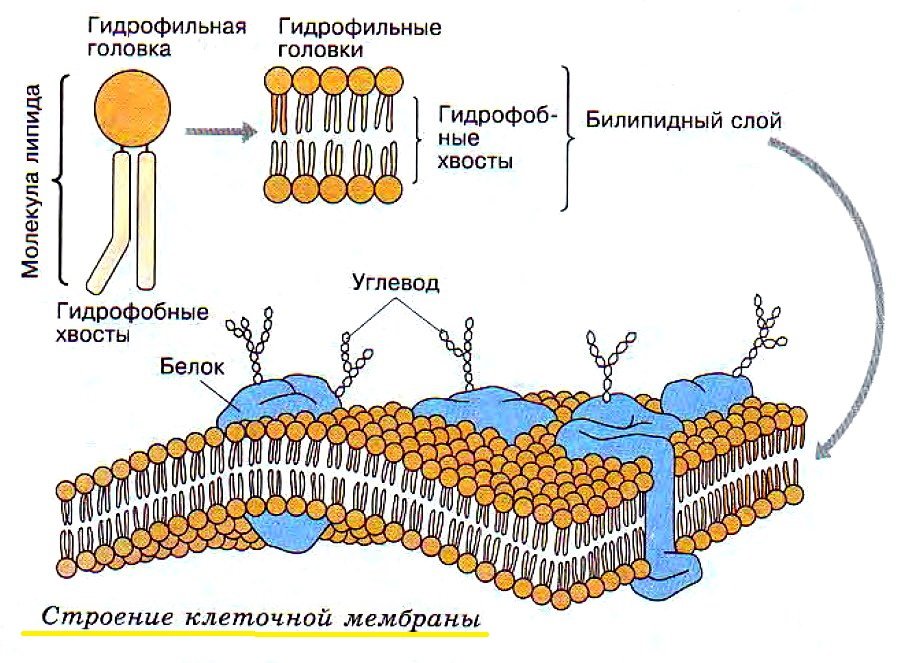 Рискну предположить, что в вашем доме есть окна и двери, которые
по мере необходимости открываются и закрываются 🙂 Так и клеточная мембрана может сообщать внутреннюю среду клетки с внешней средой:
через мембрану вещества поступают в клетку и удаляются из нее.
Рискну предположить, что в вашем доме есть окна и двери, которые
по мере необходимости открываются и закрываются 🙂 Так и клеточная мембрана может сообщать внутреннюю среду клетки с внешней средой:
через мембрану вещества поступают в клетку и удаляются из нее.
Подведем итоги. Клеточная мембрана выполняет ряд важнейших функций:
- Разделительная (барьерная) — образует барьер между внешней средой и внутренней средой клетки (цитоплазмой с органоидами)
- Поддержание обмена веществ между внешней средой и цитоплазмой
- Транспортная
- Пассивный — часто идет по градиенту концентрации, без затрат АТФ (энергии). Возможен путем осмоса, простой диффузии или облегченной (с участием белка-переносчика) диффузии.
- Активный
Через мембрану по каналам кислород и питательные вещества поступают в клетку, а продукты жизнедеятельности — мочевина — удаляются из клетки во внешнюю среду.
Тесно связана с обменом веществ, однако здесь мне особенно хочется подчеркнуть варианты транспорта веществ через клетку.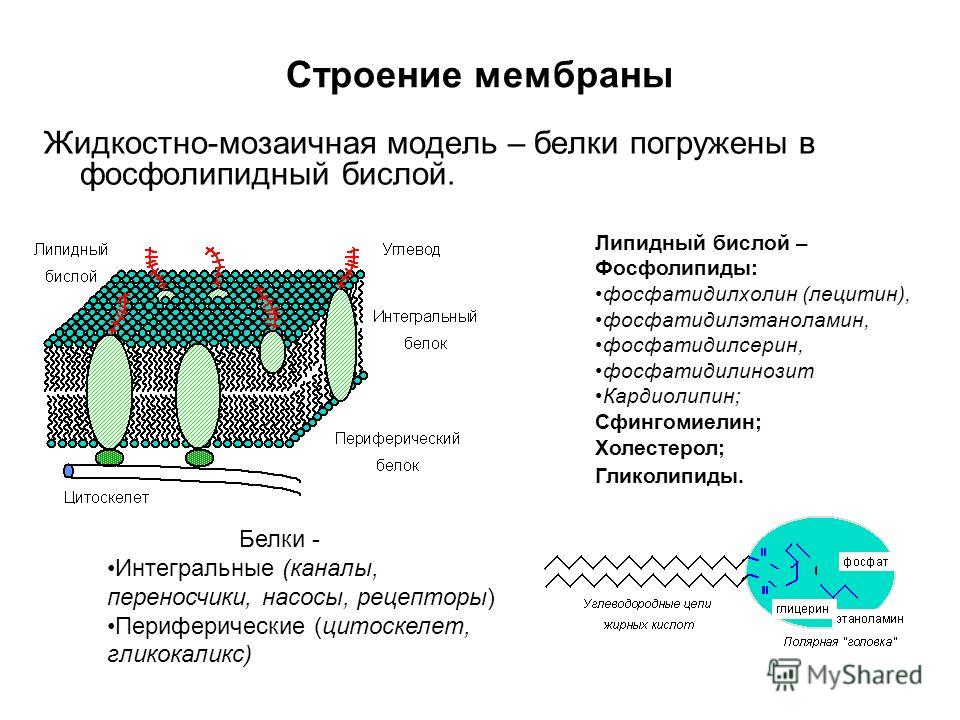 Выделяется два вида транспорта:
Выделяется два вида транспорта:
Внутрь клетки с помощью осмоса поступает вода. Путем простой диффузии в клетку попадают O2, H2O, CO2, мочевина. Облегченная диффузия характерна для транспорта глюкозы, аминокислот.
Активный транспорт чаще происходит против градиента концентрации, в ходе него используются белки-переносчики и
энергия АТФ. Ярким примером является натрий-калиевый насос, который накачивает ионы калия внутрь клетки, а ионы
натрия выводит наружу. Это происходит против градиента концентрации, поэтому без затрат энергии (АТФ) не обойтись.
Внутрь клетки крупные молекулы попадают путем эндоцитоза (греч. endo — внутрь) двумя путями:
- Фагоцитоз (греч. phago — ем + cytos — клетка) — поглощение твердых пищевых частиц и бактерий фагоцитами
- Пиноцитоз (греч. pino — пью) — поглощение клеткой жидкости, захват жидкости клеточной поверхностью
Фагоцитоз был открыт И.И. Мечниковым, который создал фагоцитарную теорию иммунитета. Это теория гласит, что в основе иммунной системы нашего организма лежит явление фагоцитоза: попавшие в организм бактерии уничтожаются фагоцитами (T-лимфоцитами), которые переваривают их.
В ходе эндоцитоза мембрана сильно прогибается внутрь клетки, ее края смыкаются, захватывая бактерию, пищевые частицы или жидкость внутрь
клетки. Образуется везикула (пузырек), который движется к пищеварительной вакуоли или лизосоме, где происходит внутриклеточное
пищеварение.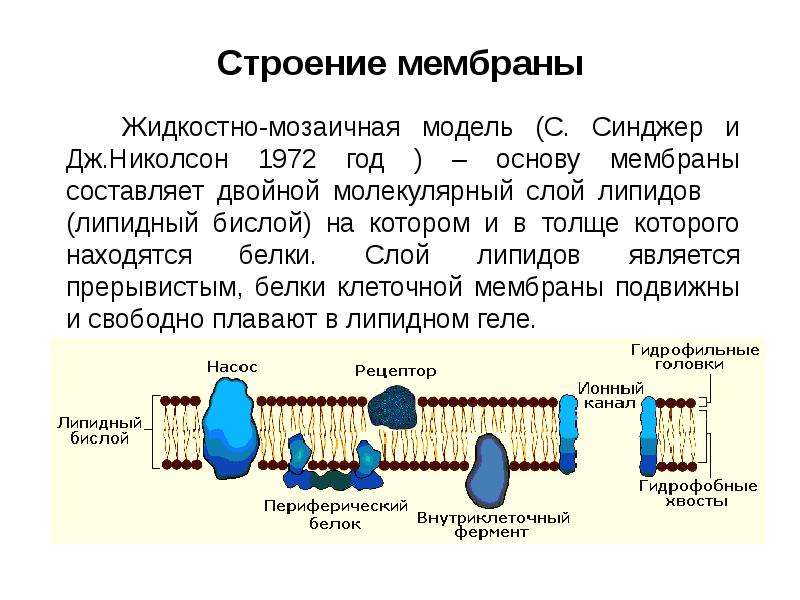
Клетки многих органов, к частности эндокринных желез, которые выделяют в кровь гормоны, транспортируют синтезированные вещества к мембране и удаляют их из клетки с помощью экзоцитоза (от др.-греч. ἔξω — вне, снаружи). Таким образом, процессы экзоцитоза и эндоцитоза противоположны.
Клеточная стенка
Расположена снаружи клеточной мембраны. Присутствует только в клетках бактерий, растений и грибов, у животных отсутствует. Придает клетке определенную форму, направляет ее рост, придавая характерное строение всему организму. Клеточная стенка бактерий состоит из полимера муреина, у грибов — из хитина, у растений — из целлюлозы.
Цитоплазма
Органоиды клетки расположены в цитоплазме, которая состоит из воды, питательных веществ и продуктов обмена. В цитоплазме
происходит постоянный ток веществ: поступившие в клетку вещества для расщепления необходимо доставить к органоидам, а побочные продукты — удалить из клетки.
Постоянное движение цитоплазмы поддерживает связь между органоидами клетки и обеспечивает ее целостность.
Прокариоты и эукариоты
Прокариоты (греч. πρό — перед и κάρυον — ядро) или доядерные — одноклеточные организмы, не обладающие в отличие от эукариот оформленным ядром и мембранными органоидами. У прокариот могут обнаруживаться только немембранные органоиды. Их генетический материал представлен в виде кольцевой молекулы ДНК — нуклеоида (нуклеоид — ДНК–содержащая зона клетки прокариот). К прокариотам относятся бактерии, в их числе цианобактерии (цианобактерий по-другому называют — сине-зеленые водоросли).
Эукариоты (греч. εὖ — хорошо + κάρυον — ядро) или ядерные — домен живых организмов, клетки которых содержат оформленное ядро. Растения, животные, грибы — относятся к эукариотам.
Немембранные органоиды
- Рибосома
- Микротрубочки и микрофиламенты
- Клеточный центр (центросома, от греч. soma — тело)
- Реснички и жгутики
Очень мелкая органелла (около 20 нм), которая была открыта после появления электронного микроскопа. Состоит из двух субъединиц: большой и малой, в состав которых входят белки и рРНК (рибосомальная РНК), синтезируемая
в ядрышке.
Состоит из двух субъединиц: большой и малой, в состав которых входят белки и рРНК (рибосомальная РНК), синтезируемая
в ядрышке.
Запомните ассоциацию: «Рибосома — фабрика белка». Именно здесь в ходе матричного биосинтеза — трансляции, с которой подробнее мы познакомимся в следующих статьях, на базе иРНК (информационной РНК) синтезируется белок — последовательность соединенных аминокислот в заданном иРНК порядке.
Микротрубочки являются внутриклеточными белковыми производными, входящими в состав цитоскелета. Они поддерживают
определенную форму клетки, участвуют во внутриклеточном транспорте и процессе деления путем образования нитей веретена деления. Микротрубочки
также образуют основу органоидов движения: жгутиков (у бактерий жгутик состоит из сократительного белка — флагеллина) и ресничек.
Микрофиламенты — тонкие длинные нитевидные структуры, состоящие из белка актина. Встречаются во всей цитоплазме, служат для создания тока цитоплазмы, принимают участие в движении клетки, в процессах эндо- и экзоцитоза.
Этот органоид характерен только для животной клетки, в клетках грибов и высших растений отсутствует. Клеточный центр состоит из 9 триплетов микротрубочек (триплет — три соединенных вместе). Участвует в образовании нитей веретена деления, располагается на полюсах клетки.
Это органоиды движения, которые выступают над поверхностью клетки и имеют в основе пучок микротрубочек.
Реснички встречаются только в клетках животных, жгутики можно обнаружить у животных, растений и бактерий.
Одномембранные органоиды
- Эндоплазматическая сеть (ЭПС), эндоплазматический ретикулум (лат. reticulum — сеть)
- Комплекс (аппарат) Гольджи
- Лизосома (греч. lisis — растворение + soma — тело)
- Пероксисомы (лат. per — сверх, греч. oxys — кислый и soma — тело)
- Вакуоли
ЭПС представляет собой систему мембран, пронизывающих всю клетку и разделяющих ее на отдельные изолированные части (компартменты). Это крайне важно, так как в разных частях клетки идут реакции, которые могут помешать друг другу, что нарушит процессы жизнедеятельности.
Выделяют гладкую ЭПС и шероховатую ЭПС. Обе они выполняют функцию внутриклеточного транспорта веществ, однако между ними имеются различия. На мембранах гладкой ЭПС происходит синтез липидов, обезвреживаются вредные вещества. Шероховатая ЭПС синтезирует белок, так как имеет на мембранах многочисленные рибосомы (потому и называется шероховатой).
Комплекс Гольджи состоит из трубочек, сети уплощенных канальцев (цистерн) и связанных с ними пузырьков. Располагается
вокруг ядра клетки, внешне напоминает стопку блинов. Это — «клеточный склад». В нем запасаются жиры и углеводы, с
которыми здесь происходят химические видоизменения.
Располагается
вокруг ядра клетки, внешне напоминает стопку блинов. Это — «клеточный склад». В нем запасаются жиры и углеводы, с
которыми здесь происходят химические видоизменения.
Модифицированные вещества упаковываются в пузырьки и могут перемещаться к мембране клетки, соединяясь с ней, они изливают свое содержимое во внешнюю среду. Можно догадаться, что комплекс Гольджи хорошо развит в клетках эндокринных желез, которые в большом количестве синтезируют и выделяют в кровь гормоны.
В комплексе Гольджи появляются первичные лизосомы, которые содержат ферменты в неактивном состоянии.
Представляет собой мембранный пузырек, содержащий внутри ферменты (энзимы) — липазы, протеазы, фосфатазы.
Лизосому можно ассоциировать с «клеточным желудком».
Лизосома участвует во внутриклеточном пищеварении поступивших в клетку веществ. Сливаясь с фагосомой, первичная лизосома превращается во вторичную, ферменты активируются. После расщепления веществ образуется остаточное тельце — вторичная лизосома с непереваренными остатками, которые удаляются из клетки.
Лизосома может переварить содержимое фагосомы (самое безобидное), переварить часть клетки или всю клетку целиком. В норме у каждой клетки жизненный цикл заканчивается апоптозом — запрограммированным процессом клеточной гибели.
В ходе апоптоза ферменты лизосомы изливаются внутрь клетки, ее содержимое переваривается. Предполагают, что нарушение апоптоза в раковых клетках ведет к бесконтрольному росту опухоли.
Пероксисомы (микротельца) содержат окислительно-восстановительные ферменты, которые разлагают H2O2
(пероксид водорода) на воду и кислород. Если бы пероксид водорода оставался неразрушенными, это приводило бы
к серьезным повреждениям клетки.
Если бы пероксид водорода оставался неразрушенными, это приводило бы
к серьезным повреждениям клетки.
Вакуоли характерны для растительных клеток, однако встречаются и у животных (у одноклеточных — сократительные вакуоли). У растений вакуоли выполняют другие функции и имеют иное строение: они заполняются клеточным соком, в котором содержится запас питательных веществ. Снаружи вакуоль окружена тонопластом.
Трудно переоценить значение вакуолей в жизнедеятельности растительной клетки. Вакуоли создают осмотическое давление, придают клетке форму.
Примечательно, что по размеру вакуолей можно судить о возрасте клетки: молодые клетки имеют
вакуоли небольшого размера, а в старых клетках вакуоли могут настолько увеличиваться, что оттесняют ядро и остальные
органоиды на периферию.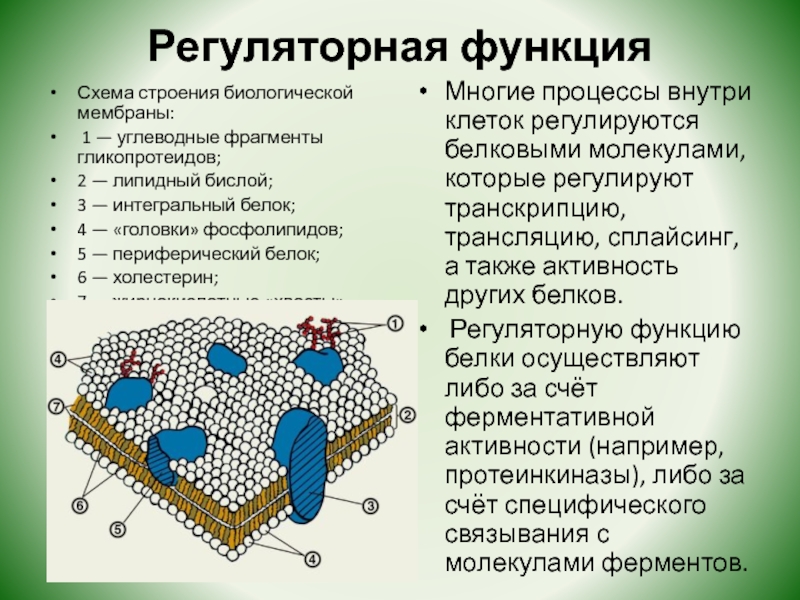
Двумембранные органоиды
- Ядро («ядро» по лат. — nucleus, по греч. — karyon)
- Митохондрия
- Пластиды (др.-греч. πλαστός — вылепленный)
- Хлоропласт (греч. chlōros — зелёный)
- Хромопласты (греч. chromos – краска)
- Лейкопласты (др.-греч. λευκός — белый )
Важнейший компонент эукариотической клетки — оформленное ядро, которое у прокариот отсутствует. Внутренняя часть ядра представлена кариоплазмой, в которой расположен хроматин — комплекс ДНК, РНК и белков, и одно или несколько ядрышек.
Ядрышко — место в ядре, где активно идет процесс матричного биосинтеза — транскрипция, с которым мы познакомимся подробнее в следующих статьях. В течение дня, наблюдая за одной и той же клеткой, можно увидеть разное количество ядрышек или не найти ни одного.
Оболочка ядра состоит из двух мембран и пронизана большим количеством ядерных пор, через которые происходит сообщение
между кариоплазмой и цитоплазмой. Главными функциями ядра является хранение, защита и передача наследственного материала
дочерним клеткам.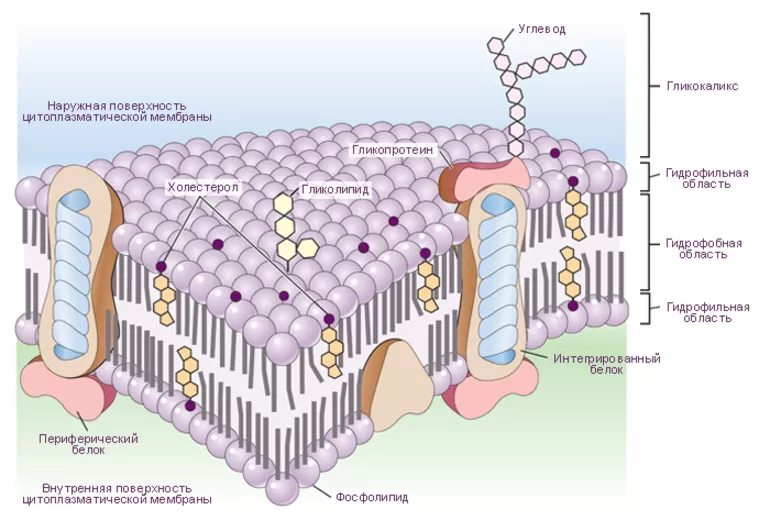
Замечу, что хромосомы видны только в момент деления клетки. Хромосомы представляют собой сильно спирализованные молекулы ДНК, связанные с белками.
Я всегда рекомендую ученикам ассоциировать хромосому с мотком ниток: если все нитки обмотать вокруг одной оси, то они становятся мотком и хорошо видны (хромосомы — во время деления, спирализованное ДНК), если же клетка не делится, то нитки размотаны и разбросаны в один слой, хромосом не видно (хроматин — деспирализованное ДНК).
Хромосомы отличаются друг от друга по строению, форме, размерам. Совокупность всех признаков (форма, число, размер) хромосом называется кариотип. Кариотип может быть представлен по-разному: существует кариотип вида, особи, клетки.
Изучая кариотип человека, врач-генетик может обнаружить различные наследственные заболевания, к примеру, синдром Дауна — трисомия по 21-ой паре хромосом (должно быть 2 хромосомы, однако при синдроме Дауна их три).
Органоид палочковидной формы. Митохондрию можно сравнить с «энергетической станцией». Если в цитоплазме происходит анаэробный этап дыхания (бескислородный), то в митохондрии идет более совершенный — аэробный этап (кислородный). В результате кислородного этапа (цикла Кребса) из двух молекул пировиноградной кислоты (образовавшихся из 1 глюкозы) получаются 36 молекул АТФ.
Митохондрия окружена двумя мембранами. Внутренняя ее мембрана образует выпячивания внутрь — кристы, на которых имеется большое скопление окислительных ферментов, участвующих в кислородном этапе дыхания. Внутри митохондрия заполнена матриксом.
Запомните, что особенностью этого органоида является наличие кольцевой молекулы ДНК — нуклеоида (ДНК–содержащая зона клетки прокариот), и рибосом. То есть
митохондрия обладает собственным генетическим материалом и возможностью синтеза белка, почти как отдельный организм.
То есть
митохондрия обладает собственным генетическим материалом и возможностью синтеза белка, почти как отдельный организм.
В связи с этим, митохондрия считается полуавтономным органоидом. Вероятнее всего, изначально митохондрии были самостоятельными организмами, однако со временем вступили в симбиоз с эукариотами и стали частью клетки.
Митохондрий особенно много в клетках мышц, в том числе — в сердечной мышечной ткани. Эти клетки выполняют активную работу и нуждаются в большом количестве энергии.
Двумембранные органоиды, встречающиеся только в клетках высших растений, водорослей и некоторых простейших. У подавляющего большинства животных пластиды отсутствуют. Подразделяются на три типа:
Получил свое название за счет содержащегося в нем зеленого пигмента — хлорофилла (греч. chloros — зеленый
и phyllon — лист). Под двойной мембраной расположены тилакоиды, которые собраны в стопки — граны. Внутреннее
пространство между тилакоидами и мембраной называется стромой.
chloros — зеленый
и phyllon — лист). Под двойной мембраной расположены тилакоиды, которые собраны в стопки — граны. Внутреннее
пространство между тилакоидами и мембраной называется стромой.
Запомните, что светозависимая (световая) фаза фотосинтеза происходит на мембранах тилакоидов, а темновая (светонезависимая) фаза — в строме хлоропласта за счет цикла Кальвина. Это очень пригодится при изучении фотосинтеза в дальнейшем.
Так же, как и митохондрии, пластиды относятся к полуавтономным органоидам: в них имеется кольцевидная ДНК (находится в нуклеоиде), рибосомы.
Пластиды, которые содержат пигменты каратиноиды в различных сочетаниях. Сочетание пигментов обуславливает
красную, оранжевую или желтую окраску. Находятся в плодах, листьях, лепестках цветков.
Находятся в плодах, листьях, лепестках цветков.
Хромопласты могут развиваться из хлоропластов: во время созревания плодов хлоропласты теряют хлорофилл и крахмал, в них активируется биосинтез каротиноидов.
Не содержат пигментов, образуются в запасающих частях растения (клубни, корневища). В лейкопластах накапливается крахмал, липиды (жиры), пептиды (белки). На свету лейкопласты могут превращаться в хлоропласты и запускать процесс фотосинтеза.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону.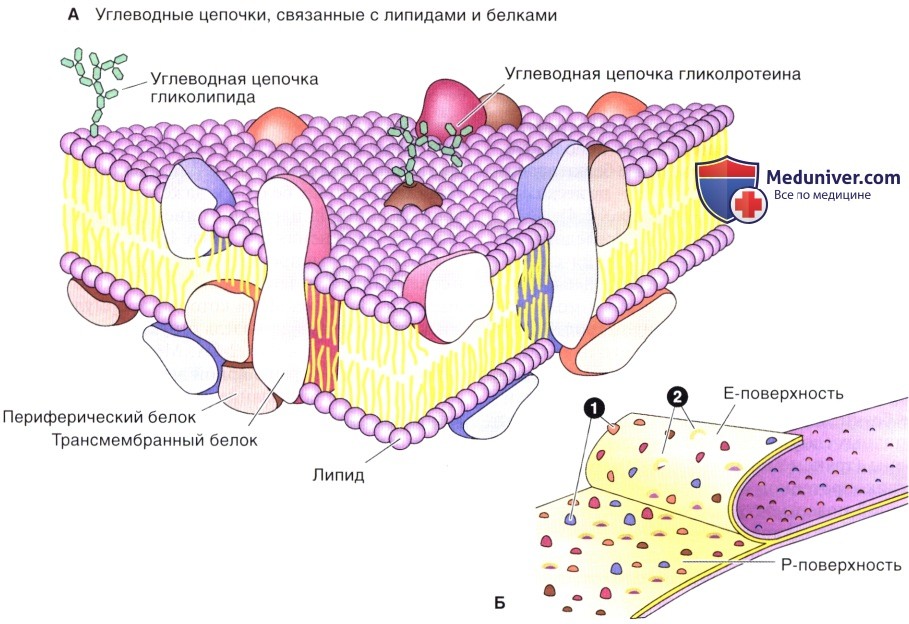 Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как люди чувствуют боль и для чего она нужна организму
Как работает механизм восприятия боли, почему некоторые люди вообще ее не чувствуют, а также как организм защищает себя от болевых ощущений, рассказывает отдел науки «Газеты.Ru».
Мы чувствуем боль каждый день. Она контролирует наше поведение, формирует наши привычки и помогает нам выжить. Благодаря боли мы вовремя накладываем гипс, берем больничный, отдергиваем руку от горячего утюга, боимся стоматологов, убегаем от осы, сочувствуем персонажам фильма «Пила» и сторонимся банды хулиганов.
Рыбы — первые организмы на Земле, которые почувствовали боль. Живые существа эволюционировали, становились все сложнее, и их образ жизни тоже. И чтобы предостерегать их об опасности, появился простой механизм для выживания — боль.
Почему мы чувствуем боль?
Наше тело состоит из огромного количества клеток. Для того чтобы они могли взаимодействовать, существуют специальные белки в клеточной мембране — ионные каналы. С помощью них клетка обменивается ионами с другой клеткой и контактирует с внешней средой. Растворы внутри клеток богаты калием, но бедны натрием. Определенные концентрации этих ионов поддерживаются калий-натриевым насосом, который выкачивает избыточные ионы натрия из клетки и заменяет их на калий.
Для того чтобы они могли взаимодействовать, существуют специальные белки в клеточной мембране — ионные каналы. С помощью них клетка обменивается ионами с другой клеткой и контактирует с внешней средой. Растворы внутри клеток богаты калием, но бедны натрием. Определенные концентрации этих ионов поддерживаются калий-натриевым насосом, который выкачивает избыточные ионы натрия из клетки и заменяет их на калий.
Работа калий-натриевых насосов настолько важна, что половина съеденной еды и около трети вдыхаемого кислорода идет на обеспечение их энергией.
Ионные каналы — это настоящие врата чувств, благодаря которым мы можем ощущать тепло и холод, аромат роз и вкус любимого блюда, а еще — испытывать боль.
Когда на мембрану клетки что-то воздействует, структура натриевого канала деформируется и он открывается. Вследствие изменения ионного состава возникают электрические импульсы, которые распространяются по нервным клеткам. Нейроны состоят из клеточного тела, дендритов и аксона — самого длинного отростка, по которому и движется импульс. На конце аксона находятся пузырьки с нейромедиатором — химическим веществом, участвующим в передаче этого импульса от нервной клетки к мышечной или к другой нервной клетке. Например, сигнал от нерва к мышце передает ацетилхолин, а между нейронами в мозге много других медиаторов, например глутамат и «гормон радости» серотонин.
Порезать палец во время приготовления салата — такое было почти с каждым. Но вы не продолжаете резать палец, а отдергиваете руку. Это происходит потому, что нервный импульс бежит по нейронам от чувствительных клеток, детекторов боли, до спинного мозга, где уже двигательный нерв передает команду мышцам: убери руку! Вот вы залепили палец пластырем, но по-прежнему чувствуете боль: ионные каналы и нейромедиаторы шлют сигналы в головной мозг.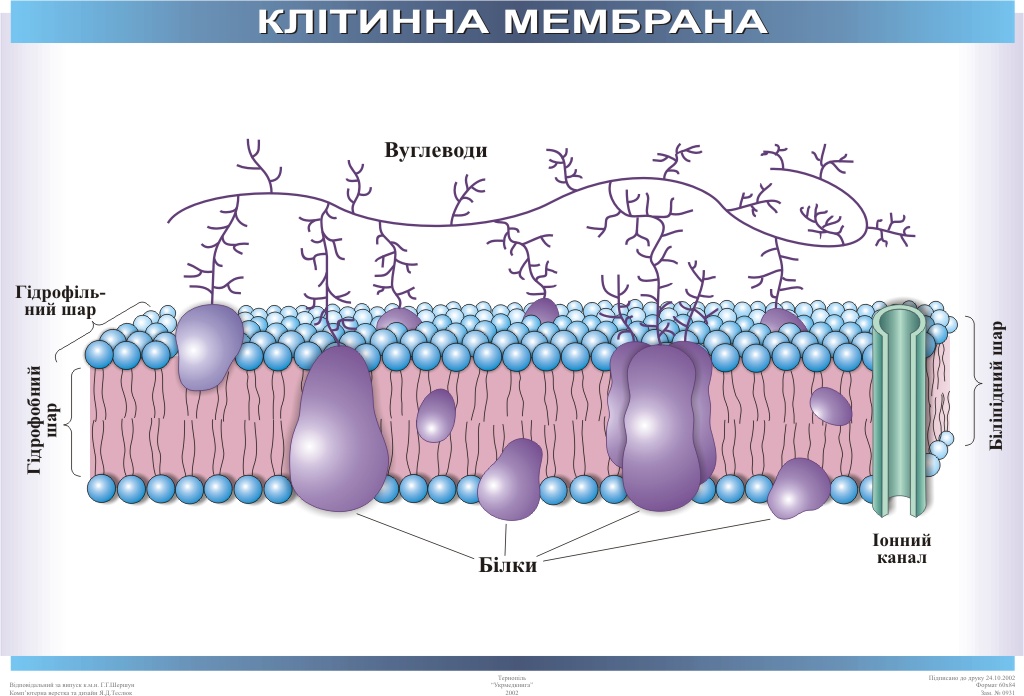 Болевой сигнал проходит через таламус, гипоталамус, ретикулярную формацию, участки среднего и продолговатого мозга.
Болевой сигнал проходит через таламус, гипоталамус, ретикулярную формацию, участки среднего и продолговатого мозга.
И наконец, боль достигает пункта назначения — чувствительных участков мозговой коры, где мы осознаем ее в полной мере.
Жизнь без боли
Жизнь без боли — мечта многих людей: ни страданий, ни страха. Это вполне реально, и среди нас живут люди, которые не чувствуют боли. Например, в 1981 году в США родился Стивен Пит, и, когда у него прорезались зубы, он стал жевать свой язык. К счастью, его родители вовремя это заметили и отвели мальчика в больницу. Там им сказали, что у Стивена врожденная нечувствительность к боли. Вскоре родился брат Стива Кристофер, и у него обнаружили то же самое.
Мама всегда говорила мальчикам: инфекция — тихий убийца. Не зная боли, они не могли увидеть у себя симптомы заболеваний. Частые медицинские обследования были необходимы. Не представляя, что такое боль, парни могли драться до полусмерти или, получив открытый перелом, ковылять с торчащей костью, даже не заметив этого.
Не зная боли, они не могли увидеть у себя симптомы заболеваний. Частые медицинские обследования были необходимы. Не представляя, что такое боль, парни могли драться до полусмерти или, получив открытый перелом, ковылять с торчащей костью, даже не заметив этого.
Один раз, работая с электропилой, Стив распорол себе руку от кисти до локтя, но зашил ее самостоятельно, поленившись идти к врачу.
«Мы часто пропускали школу, потому что оказывались на больничной койке с очередной травмой. Мы провели там не одно рождественское утро и день рождения», — говорит Стивен. Жизнь без боли — это не жизнь без страданий. У Стива тяжелый артрит и больное колено — это грозит ему ампутацией. Его младший брат Крис покончил с собой, узнав, что может оказаться в инвалидном кресле.
Оказывается, у братьев дефект гена SCN9A, который кодирует белок Nav1.7 — натриевый канал, участвующий в восприятии боли. Такие люди отличают холодное от горячего и чувствуют прикосновения, но вот болевой сигнал не проходит. Эта сенсационная новость была опубликована в журнале Nature в 2006 году. Ученые установили это в процессе исследования шестерых пакистанских детей. Среди них был фокусник, который развлекал толпу, прохаживаясь по раскаленным углям.
Эта сенсационная новость была опубликована в журнале Nature в 2006 году. Ученые установили это в процессе исследования шестерых пакистанских детей. Среди них был фокусник, который развлекал толпу, прохаживаясь по раскаленным углям.
В 2013 году в Nature было опубликовано другое исследование, объектом которого стала маленькая девочка, незнакомая с чувством боли. Немецкие ученые Йенского университета обнаружили у нее мутацию гена SCN11A, который кодирует белок Nav1.9 — еще один натриевый канал, ответственный за боль. Гиперэкспрессия этого гена предотвращает накопление зарядов ионов, и электрический импульс не проходит по нейронам — боли мы не чувствуем.
Выходит, что свою «суперспособность» наши герои получили из-за сбоя работы натриевых каналов, которые участвуют в передаче болевого сигнала.
Что позволяет нам чувствовать боль меньше?
Когда нам больно, организм вырабатывает особые «внутренние наркотики» — эндорфины, которые связываются с опиоидными рецепторами в мозге, притупляя боль. Морфин, выделенный в 1806 году и завоевавший славу эффективного болеутоляющего вещества, действует подобно эндорфинам — присоединяется к опиоидным рецепторам и подавляет выделение нейромедиаторов и активность нейронов. При подкожном введении действие морфина начинается через 15–20 минут и может длиться до шести часов. Только не следует увлекаться таким «лечением», это может плохо кончиться, как в рассказе Булгакова «Морфий». После нескольких недель применения морфина организм перестает вырабатывать эндорфины в достаточном количестве, появляется зависимость. И когда действие наркотика заканчивается, множество тактильных сигналов, которые поступают в мозг, уже не защищенный антиболевой системой, причиняют страдания — возникает ломка.
Морфин, выделенный в 1806 году и завоевавший славу эффективного болеутоляющего вещества, действует подобно эндорфинам — присоединяется к опиоидным рецепторам и подавляет выделение нейромедиаторов и активность нейронов. При подкожном введении действие морфина начинается через 15–20 минут и может длиться до шести часов. Только не следует увлекаться таким «лечением», это может плохо кончиться, как в рассказе Булгакова «Морфий». После нескольких недель применения морфина организм перестает вырабатывать эндорфины в достаточном количестве, появляется зависимость. И когда действие наркотика заканчивается, множество тактильных сигналов, которые поступают в мозг, уже не защищенный антиболевой системой, причиняют страдания — возникает ломка.
Спиртные напитки тоже воздействует на эндорфиновую систему и повышают порог болевой чувствительности. Алкоголь в небольших дозах, как и эндорфины, вызывает эйфорию и позволяет нам быть менее восприимчивым к удару кулаком по лицу после свадебного застолья. Дело в том, что алкоголь стимулирует синтез эндорфинов и подавляет систему обратного захвата этих нейромедиаторов.
Дело в том, что алкоголь стимулирует синтез эндорфинов и подавляет систему обратного захвата этих нейромедиаторов.
Однако после выведения алкоголя из организма пороги болевой чувствительности снижаются за счет угнетения синтеза эндорфинов и повышения активности их захвата, что не облегчает похмелье, типичное для следующего утра.
Кому больнее: мужчинам или женщинам?
Женщины и мужчины ощущают боль по-разному — об этом говорит исследование ученых из Университета Макгилла, которые обнаружили, что восприятие боли у самок и самцов мышей начинается с разных клеток. На сегодняшний момент проведено много исследований о природе женской и мужской боли, и большинство из них указывает на то, что женщины страдают от нее больше, чем мужчины.
В ходе масштабной работы 2012 года, когда ученые анализировали записи более чем об 11 тыс. пациентов больниц Калифорнии, ученые выяснили, что женщины переносят боль хуже и сталкиваются с ней чаще, чем мужчины. А пластические хирурги из США установили, что у женщин на коже лица в два раза больше нервных рецепторов на один квадратный сантиметр, чем у мужчин. Девушки уже с рождения такие чувствительные — согласно исследованию, опубликованному в журнале Pain, у новорожденных девочек мимические реакции на уколы в стопу были выражены сильнее, чем у мальчиков. Также известно, что женщины чаще жалуются на боль после операции и хуже чувствуют себя в кресле у стоматолога.
пациентов больниц Калифорнии, ученые выяснили, что женщины переносят боль хуже и сталкиваются с ней чаще, чем мужчины. А пластические хирурги из США установили, что у женщин на коже лица в два раза больше нервных рецепторов на один квадратный сантиметр, чем у мужчин. Девушки уже с рождения такие чувствительные — согласно исследованию, опубликованному в журнале Pain, у новорожденных девочек мимические реакции на уколы в стопу были выражены сильнее, чем у мальчиков. Также известно, что женщины чаще жалуются на боль после операции и хуже чувствуют себя в кресле у стоматолога.
На помощь бедным женщинам приходят гормоны.
Например, один из половых женских гормонов, эстрадиол, уменьшает активность болевых рецепторов и помогает женщинам легче переносить высокие уровни боли.
Например, уровень эстрадиола резко возрастает перед родами и действует как своего рода обезболивающее. К сожалению, после менопаузы уровень этого гормона в организме становится меньше, и женщины переносят боль тяжелее.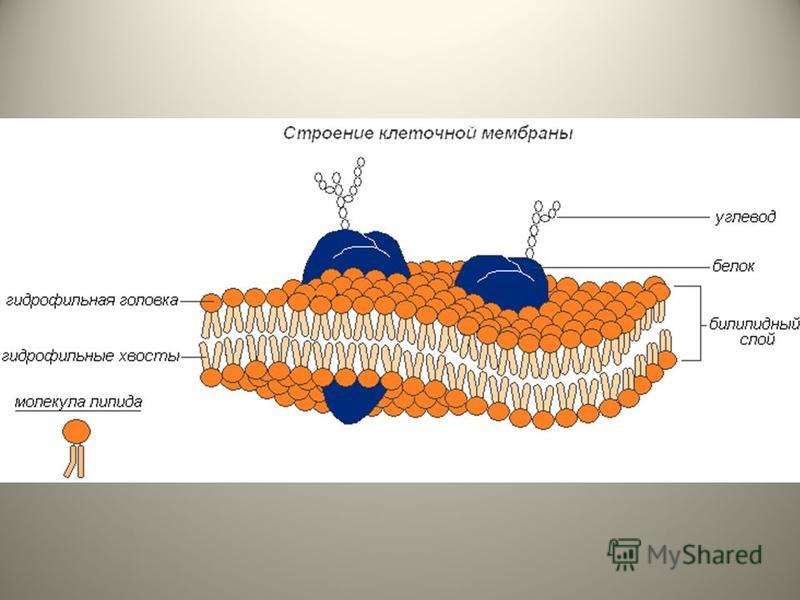 Кстати, у мужчин похожая ситуация с тестостероном. Уровень этого мужского полового гормона снижается с возрастом, и некоторые болевые симптомы становятся более выраженными.
Кстати, у мужчин похожая ситуация с тестостероном. Уровень этого мужского полового гормона снижается с возрастом, и некоторые болевые симптомы становятся более выраженными.
Но боль — это не только передача нервных импульсов в головной мозг, это также психологическое восприятие болевых ощущений. К примеру, у участников одного интересного исследования в три раза повышался болевой порог после того, как им показывали, как другой участник спокойно переносил такое же болевое воздействие. Мальчиков с рождения учат быть мужественными: «мальчики не плачут», «ты должен терпеть», «плакать стыдно». И это вносит свой существенный вклад: мужчины стойко терпят боль, и мозг «думает», что им не так уж и больно.
Ознакомиться с другими материалами отдела науки можно на страницах нашей официальной группы «ВКонтакте».
Клеточная мембрана – обзор
II Бимолекулярная липидная мембрана
Термин плазматическая мембрана происходит от немецкого Plasmamembran, слово, придуманное Карлом Вильгельмом Негели (1817–1891) для описания твердой пленки, которая образуется, когда белковый сок поврежденной клетки контактирует с водой. Физиолог Л.В. Хайльбрунн называл это и подобные явления «реакцией осаждения на поверхности», как описано в его книге «Динамика живой протоплазмы » (1956).«Протоплазма» был старым термином для вещества внутри клеток и широко использовался до того, как методы электронной микроскопии и дифференциального центрифугирования помогли выяснить подробные структуры и специфические функции отдельных клеточных органелл. Участие того, что мы знаем сегодня как клеточная мембрана, и биохимия образования поверхностной пленки в ответ на повреждение клетки впоследствии не были объяснены. Таким образом, первоначальное использование термина «плазматическая мембрана» имеет неясное отношение к его нынешнему значению.
Физиолог Л.В. Хайльбрунн называл это и подобные явления «реакцией осаждения на поверхности», как описано в его книге «Динамика живой протоплазмы » (1956).«Протоплазма» был старым термином для вещества внутри клеток и широко использовался до того, как методы электронной микроскопии и дифференциального центрифугирования помогли выяснить подробные структуры и специфические функции отдельных клеточных органелл. Участие того, что мы знаем сегодня как клеточная мембрана, и биохимия образования поверхностной пленки в ответ на повреждение клетки впоследствии не были объяснены. Таким образом, первоначальное использование термина «плазматическая мембрана» имеет неясное отношение к его нынешнему значению.
Значительная часть знаний о структуре и функциях мембран получена в результате исследований эритроцитов, как показано на микрофотографии, полученной с помощью сканирующего электронного микроскопа, на рис. 3.1. Эритроциты высоко дифференцированы и специализируются на транспорте кислорода и углекислого газа в крови.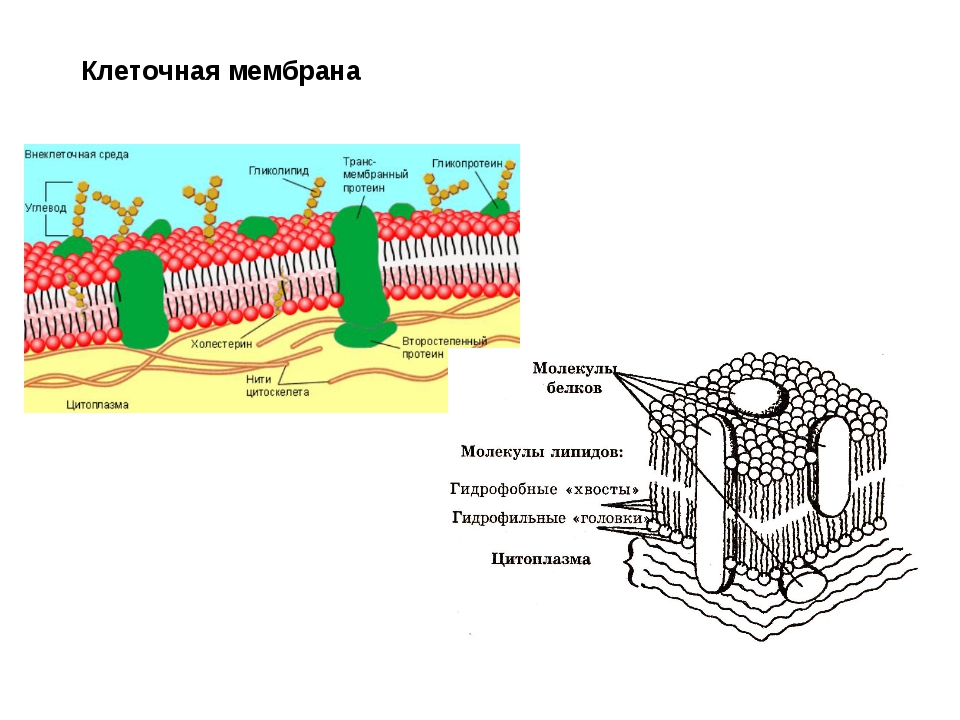 Они состоят в основном из плазматической мембраны, окружающей концентрированный раствор гемоглобина, и лишены ядра, митохондрий, эндоплазматического ретикулума, рибосом, аппарата Гольджи и лизосом. Более 100 лет назад обширные исследования осмотического давления и проницаемости эритроцитов, проведенные Гамбургером, растительных клеток, проведенные де Фрисом, и многих живых клеток, проведенные Овертоном, показали, что клетки окружает липоидная мембрана.Жирорастворимые вещества, которые являются липофильными и легко растворяются в липидах, легко проникают в клетки, тогда как водорастворимые вещества проникают в клетки медленнее, если вообще проникают. Овертон обнаружил корреляцию между коэффициентом распределения нефти и воды и проницаемостью мембраны; тем не менее, ни в одном из этих ранних исследований мембрана не постулировалась как отдельная структурная единица для объяснения результатов (см. Jacobs, 1962).
Они состоят в основном из плазматической мембраны, окружающей концентрированный раствор гемоглобина, и лишены ядра, митохондрий, эндоплазматического ретикулума, рибосом, аппарата Гольджи и лизосом. Более 100 лет назад обширные исследования осмотического давления и проницаемости эритроцитов, проведенные Гамбургером, растительных клеток, проведенные де Фрисом, и многих живых клеток, проведенные Овертоном, показали, что клетки окружает липоидная мембрана.Жирорастворимые вещества, которые являются липофильными и легко растворяются в липидах, легко проникают в клетки, тогда как водорастворимые вещества проникают в клетки медленнее, если вообще проникают. Овертон обнаружил корреляцию между коэффициентом распределения нефти и воды и проницаемостью мембраны; тем не менее, ни в одном из этих ранних исследований мембрана не постулировалась как отдельная структурная единица для объяснения результатов (см. Jacobs, 1962).
РИСУНОК 3.1. Сканирующая электронная микрофотография эритроцитов человека. Двояковогнутые дискоидные клетки имеют диаметр 8 мкм и 2.Толщина 4 мкм по краю и толщина 1,0 мкм в центре.
Двояковогнутые дискоидные клетки имеют диаметр 8 мкм и 2.Толщина 4 мкм по краю и толщина 1,0 мкм в центре.
В 1925 году Гортер и Грендель использовали ацетон для экстракции липидов из известного количества эритроцитов и после выпаривания растворителя измеряли площадь, которую экстрагированные липиды занимали в виде мономолекулярной пленки на границе раздела воздух-вода, используя желоб Ленгмюра. По площади пленки экстрагированных липидов и по площади поверхности эритроцитов, оцененной с помощью световой микроскопии, они пришли к выводу, что: «Ясно, что все наши результаты хорошо согласуются с предположением, что хромоциты покрыты слоем жирных веществ толщиной в две молекулы» (Гортер и Грендель, 1925, с.443). Однако примерно 40 лет спустя было указано, что площадь поверхности эритроцитов фактически на 50% больше; кроме того, экстракция ацетоном оставила около 30% липидов в тени. К счастью, эти две ошибки имели тенденцию компенсировать друг друга (Bar et al., 1966), показывая, что в редких случаях в науке вы можете быть правы по неправильным причинам. Бимолекулярный липидный листок толщиной 75–100 Å, впервые предложенный Гортером и Гренделем в качестве модели клеточной мембраны (рис. 3.2), до сих пор составляет основу современных представлений о структуре клеточных мембран.Суть этой модели заключается в том, что мембранные фосфолипиды располагаются параллельными листами, образующими два полулистка, полярные головные группы которых обращены к водным внутриклеточным и внеклеточным растворам, а их неполярные цепи жирных кислот взаимодействуют латерально внутри гидрофобного ядра мембраны.
К счастью, эти две ошибки имели тенденцию компенсировать друг друга (Bar et al., 1966), показывая, что в редких случаях в науке вы можете быть правы по неправильным причинам. Бимолекулярный липидный листок толщиной 75–100 Å, впервые предложенный Гортером и Гренделем в качестве модели клеточной мембраны (рис. 3.2), до сих пор составляет основу современных представлений о структуре клеточных мембран.Суть этой модели заключается в том, что мембранные фосфолипиды располагаются параллельными листами, образующими два полулистка, полярные головные группы которых обращены к водным внутриклеточным и внеклеточным растворам, а их неполярные цепи жирных кислот взаимодействуют латерально внутри гидрофобного ядра мембраны.
РИСУНОК 3.2. Модель бимолекулярной фосфолипидной мембраны, предложенная Гортером и Гренделем (1925).
Для чистых липидов ожидаемое поверхностное натяжение , измеренное в желобе Ленгмюра, составляет около 9 дин/см, но поверхностное натяжение морских яиц и других типов клеток примерно в 50–100 раз меньше при всего лишь 0. 1–0,2 дин/см. Поверхностное натяжение можно представить как силу, необходимую для закрытия щели на поверхности мембраны. Даниэлли и Харви обнаружили, что яичный белок может снизить поверхностное натяжение поверхности раздела масло-вода примерно до 0,6 дин/см, что привело Давсона и Даниэлли (1943) к предположению о наличии двух белковых пленок, связанных с полярными головными группами на каждой стороне. бимолекулярной липидной пластинки, модель, которая стала известна как маломолекулярная мембрана Дэвсона-Даниелли (рис.3.3). Предположительно, белок функционировал для укрепления и стабилизации тонкой липидной пленки. Пауцимолекулярный означает, что эта модель включала всего несколько молекул: бимолекулярный липидный листок с прилипшими белковыми пленками на внутренней и внешней поверхностях.
1–0,2 дин/см. Поверхностное натяжение можно представить как силу, необходимую для закрытия щели на поверхности мембраны. Даниэлли и Харви обнаружили, что яичный белок может снизить поверхностное натяжение поверхности раздела масло-вода примерно до 0,6 дин/см, что привело Давсона и Даниэлли (1943) к предположению о наличии двух белковых пленок, связанных с полярными головными группами на каждой стороне. бимолекулярной липидной пластинки, модель, которая стала известна как маломолекулярная мембрана Дэвсона-Даниелли (рис.3.3). Предположительно, белок функционировал для укрепления и стабилизации тонкой липидной пленки. Пауцимолекулярный означает, что эта модель включала всего несколько молекул: бимолекулярный липидный листок с прилипшими белковыми пленками на внутренней и внешней поверхностях.
РИСУНОК 3.3. Маломолекулярная модель строения мембран.
(Из Danielli, J.F. and Davson, HA (1935). Вклад в теорию проницаемости тонких пленок. J Cell Comp Physiol. 5, 495–508, стр. 498, перепечатано с разрешения Wiley-Liss, Inc., дочерняя компания John Wiley and Sons, Inc.)
498, перепечатано с разрешения Wiley-Liss, Inc., дочерняя компания John Wiley and Sons, Inc.) С помощью электрофизиологических методов было измерено электрическое сопротивление клеточных мембран, которое оказалось очень высоким, что также согласуется с предположением об изолирующей липидной мембране, окружающей клетки. В других исследованиях мембран было определено их двойное лучепреломление . Двулучепреломление — это оптическое свойство некоторых ориентированных материалов, которое можно определить, поместив образец между двумя скрещенными поляроидами на предметном столике микроскопа.Пленка Polaroid пропускает только свет, электрический вектор которого параллелен оси пленки Polaroid; две полароидные пленки, скрещенные под прямым углом и поднесенные к свету, кажутся черными. Но если между скрещенными поляроидами поместить кристалл или какое-либо другое вещество, в котором сами молекулы ориентированы, проходящий свет будет поляризован по кругу, и образец будет выглядеть ослепительно ярким. Образец, который кажется ярким, если его поместить между скрещенными поляроидами, называется двулучепреломляющим. Внутреннее двойное лучепреломление связано с ориентированной природой отдельных молекул, таких как нитевидные белки, тогда как формирует двойное лучепреломление из-за ориентированного расположения молекул в виде массива, например, при параллельной упаковке актиновых и миозиновых нитей в мышцах. саркомеры. Когда мембраны эритроцитов рассматривались с помощью поляризационного микроскопа, липиды вносили свой вклад в двойное лучепреломление, как и лежащий в основе цитоскелет, что согласуется с маломолекулярной моделью структуры мембраны.
Образец, который кажется ярким, если его поместить между скрещенными поляроидами, называется двулучепреломляющим. Внутреннее двойное лучепреломление связано с ориентированной природой отдельных молекул, таких как нитевидные белки, тогда как формирует двойное лучепреломление из-за ориентированного расположения молекул в виде массива, например, при параллельной упаковке актиновых и миозиновых нитей в мышцах. саркомеры. Когда мембраны эритроцитов рассматривались с помощью поляризационного микроскопа, липиды вносили свой вклад в двойное лучепреломление, как и лежащий в основе цитоскелет, что согласуется с маломолекулярной моделью структуры мембраны.
Электронные микрофотографии с высоким разрешением мембраны единиц также подтверждают маломолекулярную модель Дэвсона-Даниэлли. Термин единиц мембраны относится к вездесущей трехслойной структуре толщиной 75–100 Å, видимой на электронных микрофотографиях тонких срезов клеток и органелл. Изображение выглядит как две темные линии толщиной около 25–30 Å каждая, между которыми находится более светлая зона, и особенно хорошо разрешается в образцах, зафиксированных перманганатом калия. Электронная микрофотография тонкого среза плазматической мембраны эритроцитов человека показана на рис.3.4. Практически такая же трехслойная структура наблюдалась не только на поверхности эритроцитов, но и в мышечных, нервных, эпителиальных, растительных, бактериальных клетках и почти во всех исследованных мембранных клеточных органеллах. В ситуациях, когда две клетки плотно прилегали друг к другу, две трехслойные структуры составляли двойную мембрану . В миелиновой оболочке, окружающей нервные клетки, был виден ряд трехслойных структур в виде спирали, что соответствует оболочке нервных аксонов мембраной шванновских клеток, как показано на рис.3,5А. Поскольку подробные химические реакции перманганата калия с тканью не совсем понятны, оставалась некоторая неопределенность в отношении основы изображения, наблюдаемого на шлифах. Однако повсеместное распространение единичной мембраны было воспринято как убедительное доказательство в поддержку маломолекулярной модели Дэвсона-Даниэлли.
Электронная микрофотография тонкого среза плазматической мембраны эритроцитов человека показана на рис.3.4. Практически такая же трехслойная структура наблюдалась не только на поверхности эритроцитов, но и в мышечных, нервных, эпителиальных, растительных, бактериальных клетках и почти во всех исследованных мембранных клеточных органеллах. В ситуациях, когда две клетки плотно прилегали друг к другу, две трехслойные структуры составляли двойную мембрану . В миелиновой оболочке, окружающей нервные клетки, был виден ряд трехслойных структур в виде спирали, что соответствует оболочке нервных аксонов мембраной шванновских клеток, как показано на рис.3,5А. Поскольку подробные химические реакции перманганата калия с тканью не совсем понятны, оставалась некоторая неопределенность в отношении основы изображения, наблюдаемого на шлифах. Однако повсеместное распространение единичной мембраны было воспринято как убедительное доказательство в поддержку маломолекулярной модели Дэвсона-Даниэлли. Дальнейшие исследования мультиламеллярной миелиновой оболочки нервных аксонов с помощью рентгеновской дифракции центрифугированных неокрашенных и неокрашенных мембран дали профили электронной плотности, которые также согласовывались с маломолекулярной моделью Дэвсона-Даниелли (Worthington and McIntosh, 1973).Как видно на рис. 3.5В, электронная плотность низкая в гидрофобном ядре мембраны и высокая в полярных областях фосфатных групп. Более того, толщина мембраны, определенная по этим рассчитанным профилям электронной плотности неокрашенной миелиновой оболочки, количественно согласуется с толщиной единичной мембраны в тонких срезах, зафиксированных перманганатом калия, — наблюдение, являющееся убедительным доказательством в поддержку предположения о бимолекулярном фосфолипиде. листочек как основу структуры клеточных мембран.Таким образом, доказательства в пользу маломолекулярной мембранной модели состояли из исследований проницаемости, электрического сопротивления и микроскопических наблюдений двойного лучепреломления с помощью светового микроскопа, а также изображений окрашенных и неокрашенных клеток с высоким разрешением с помощью электронного микроскопа.
Дальнейшие исследования мультиламеллярной миелиновой оболочки нервных аксонов с помощью рентгеновской дифракции центрифугированных неокрашенных и неокрашенных мембран дали профили электронной плотности, которые также согласовывались с маломолекулярной моделью Дэвсона-Даниелли (Worthington and McIntosh, 1973).Как видно на рис. 3.5В, электронная плотность низкая в гидрофобном ядре мембраны и высокая в полярных областях фосфатных групп. Более того, толщина мембраны, определенная по этим рассчитанным профилям электронной плотности неокрашенной миелиновой оболочки, количественно согласуется с толщиной единичной мембраны в тонких срезах, зафиксированных перманганатом калия, — наблюдение, являющееся убедительным доказательством в поддержку предположения о бимолекулярном фосфолипиде. листочек как основу структуры клеточных мембран.Таким образом, доказательства в пользу маломолекулярной мембранной модели состояли из исследований проницаемости, электрического сопротивления и микроскопических наблюдений двойного лучепреломления с помощью светового микроскопа, а также изображений окрашенных и неокрашенных клеток с высоким разрешением с помощью электронного микроскопа. Эти убедительные аргументы были резюмированы в классической монографии под названием «Проницаемость природных мембран» , написанной Дэвсоном и Даниэлли (1943), книге, которая сильно повлияла на последующее развитие клеточной и мембранной физиологии.
Эти убедительные аргументы были резюмированы в классической монографии под названием «Проницаемость природных мембран» , написанной Дэвсоном и Даниэлли (1943), книге, которая сильно повлияла на последующее развитие клеточной и мембранной физиологии.
РИСУНОК 3.4. Электронная микрофотография тонкого среза единичной мембраны эритроцита.
(Микрофотография Дж. Д. Робертсона из Dyson, RD (1974). Cell Biology. A Molecular Approach. Allyn and Bacon, Boston, с разрешения.)РИСУНОК 3.5. (A) Миелиновая оболочка аксона спинного мозга (любезно предоставлено доктором Седриком Рейном). (B) Профиль электронной плотности седалищного нерва лягушки.
(Worthington, C.R. and McIntosh, T.J. (1973). Прямое определение профиля электронной плотности нервного миелина.Природа-новая биология. 245, 97–99, с. 99. Перепечатано с разрешения Nature Copyright 1973 Macmillan Magazines Ltd.)Cell Membranes — The Cell
Структура и функция клеток критически зависят от мембран, которые не только отделяют внутреннюю часть клетки от окружающей среды, но и определяют внутренние отделы эукариотических клеток, включая ядро и цитоплазматические органеллы.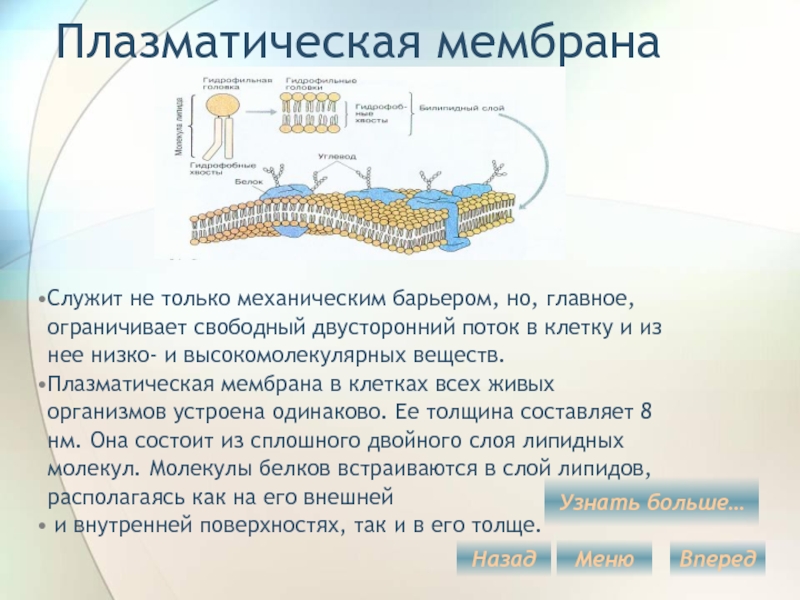 Формирование биологических мембран основано на свойствах липидов, и все клеточные мембраны имеют общую структурную организацию: бислои фосфолипидов с ассоциированными белками.Эти мембранные белки отвечают за множество специализированных функций; некоторые действуют как рецепторы, позволяющие клетке реагировать на внешние сигналы, некоторые отвечают за избирательный транспорт молекул через мембрану, а другие участвуют в транспорте электронов и окислительном фосфорилировании. Кроме того, мембранные белки контролируют взаимодействия между клетками многоклеточных организмов. Таким образом, общая структурная организация мембран лежит в основе множества биологических процессов и специализированных мембранных функций, которые будут подробно обсуждаться в последующих главах.
Формирование биологических мембран основано на свойствах липидов, и все клеточные мембраны имеют общую структурную организацию: бислои фосфолипидов с ассоциированными белками.Эти мембранные белки отвечают за множество специализированных функций; некоторые действуют как рецепторы, позволяющие клетке реагировать на внешние сигналы, некоторые отвечают за избирательный транспорт молекул через мембрану, а другие участвуют в транспорте электронов и окислительном фосфорилировании. Кроме того, мембранные белки контролируют взаимодействия между клетками многоклеточных организмов. Таким образом, общая структурная организация мембран лежит в основе множества биологических процессов и специализированных мембранных функций, которые будут подробно обсуждаться в последующих главах.
Мембранные липиды
Основными строительными блоками всех клеточных мембран являются фосфолипиды, представляющие собой амфипатические молекулы, состоящие из двух гидрофобных цепей жирных кислот, связанных с фосфатсодержащей гидрофильной головной группой (см. ). Поскольку их жирнокислотные хвосты плохо растворимы в воде, фосфолипиды спонтанно образуют бислои в водных растворах, при этом гидрофобные хвосты погружены внутрь мембраны, а полярные концевые группы открыты с обеих сторон при контакте с водой.Такие бислои фосфолипидов образуют стабильный барьер между двумя водными компартментами и представляют собой основную структуру всех биологических мембран.
). Поскольку их жирнокислотные хвосты плохо растворимы в воде, фосфолипиды спонтанно образуют бислои в водных растворах, при этом гидрофобные хвосты погружены внутрь мембраны, а полярные концевые группы открыты с обеих сторон при контакте с водой.Такие бислои фосфолипидов образуют стабильный барьер между двумя водными компартментами и представляют собой основную структуру всех биологических мембран.
Рисунок 2.45
Двойной слой фосфолипидов. Фосфолипиды спонтанно образуют стабильные бислои, при этом их полярные головные группы подвергаются воздействию воды, а их гидрофобные хвосты погружены внутрь мембраны.
Липиды составляют примерно 50% массы большинства клеточных мембран, хотя эта пропорция варьируется в зависимости от типа мембраны.Плазматические мембраны, например, примерно на 50% состоят из липидов и на 50% из белков. С другой стороны, внутренняя мембрана митохондрий содержит необычно высокую долю (около 75%) белка, что отражает обилие белковых комплексов, участвующих в транспорте электронов и окислительном фосфорилировании. Липидный состав различных клеточных мембран также различается (). Плазматическая мембрана E. coli состоит преимущественно из фосфатидилэтаноламина, который составляет 80% от общего количества липидов. Плазматические мембраны млекопитающих более сложны и содержат четыре основных фосфолипида — фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин и сфингомиелин, которые вместе составляют от 50 до 60% общего количества липидов мембраны.В дополнение к фосфолипидам плазматические мембраны животных клеток содержат гликолипиды и холестерин, которые обычно составляют около 40% от всех молекул липидов.
Липидный состав различных клеточных мембран также различается (). Плазматическая мембрана E. coli состоит преимущественно из фосфатидилэтаноламина, который составляет 80% от общего количества липидов. Плазматические мембраны млекопитающих более сложны и содержат четыре основных фосфолипида — фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин и сфингомиелин, которые вместе составляют от 50 до 60% общего количества липидов мембраны.В дополнение к фосфолипидам плазматические мембраны животных клеток содержат гликолипиды и холестерин, которые обычно составляют около 40% от всех молекул липидов.
Таблица 2.3
Липидный состав клеточных мембран a .
Важным свойством липидных бислоев является то, что они ведут себя как двумерные жидкости, в которых отдельные молекулы (как липиды, так и белки) могут свободно вращаться и двигаться в латеральных направлениях (). Такая текучесть является важным свойством мембран и определяется как температурой, так и липидным составом. Например, взаимодействие между более короткими цепями жирных кислот слабее, чем между более длинными цепями, поэтому мембраны, содержащие более короткие цепи жирных кислот, менее жесткие и остаются жидкими при более низких температурах. Липиды, содержащие ненасыщенные жирные кислоты, также увеличивают текучесть мембраны, потому что наличие двойных связей приводит к изгибам в цепях жирных кислот, что затрудняет их объединение.
Например, взаимодействие между более короткими цепями жирных кислот слабее, чем между более длинными цепями, поэтому мембраны, содержащие более короткие цепи жирных кислот, менее жесткие и остаются жидкими при более низких температурах. Липиды, содержащие ненасыщенные жирные кислоты, также увеличивают текучесть мембраны, потому что наличие двойных связей приводит к изгибам в цепях жирных кислот, что затрудняет их объединение.
Рис. 2.46
Подвижность фосфолипидов в мембране. Отдельные фосфолипиды могут вращаться и перемещаться латерально внутри двойного слоя.
Из-за своей структуры углеводородного кольца (см. Ресурсы) холестерин играет особую роль в определении текучести мембран. Молекулы холестерина внедряются в бислой своими полярными гидроксильными группами, близкими к гидрофильным головным группам фосфолипидов. Таким образом, жесткие углеводородные кольца холестерина взаимодействуют с областями цепей жирных кислот, прилегающими к головным группам фосфолипидов. Это взаимодействие уменьшает подвижность внешних частей цепей жирных кислот, делая эту часть мембраны более жесткой.С другой стороны, введение холестерина препятствует взаимодействию между цепями жирных кислот, тем самым поддерживая текучесть мембраны при более низких температурах.
Это взаимодействие уменьшает подвижность внешних частей цепей жирных кислот, делая эту часть мембраны более жесткой.С другой стороны, введение холестерина препятствует взаимодействию между цепями жирных кислот, тем самым поддерживая текучесть мембраны при более низких температурах.
Рисунок 2.47
Вставка холестерина в мембрану. Холестерин внедряется в мембрану своей полярной гидроксильной группой, близкой к полярным головным группам фосфолипидов.
Мембранные белки
Белки являются другим основным компонентом клеточных мембран, составляющим от 25 до 75% массы различных мембран клетки.Текущая модель структуры мембран, предложенная Джонатаном Сингером и Гартом Николсоном в 1972 г., рассматривает мембраны как жидкостную мозаику , в которой белки встроены в липидный бислой (). В то время как фосфолипиды обеспечивают основную структурную организацию мембран, мембранные белки выполняют специфические функции различных мембран клетки. Эти белки делятся на два основных класса в зависимости от характера их связи с мембраной.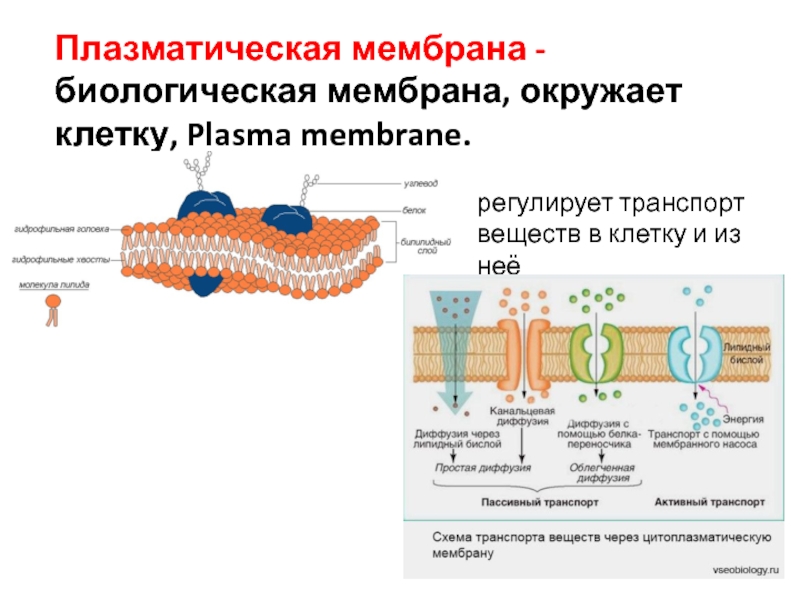 Интегральные мембранные белки встроены непосредственно в липидный бислой.Периферические мембранные белки не встраиваются в липидный бислой, а связаны с мембраной опосредованно, обычно путем взаимодействия с интегральными мембранными белками.
Интегральные мембранные белки встроены непосредственно в липидный бислой.Периферические мембранные белки не встраиваются в липидный бислой, а связаны с мембраной опосредованно, обычно путем взаимодействия с интегральными мембранными белками.
Рис. 2.48
Жидкостно-мозаичная модель строения мембраны. Биологические мембраны состоят из белков, встроенных в липидный бислой. Интегральные мембранные белки встроены в мембрану, обычно через α-спиральные участки из 20–25 гидрофобных аминокислот. Некоторые (подробнее…)
Многие интегральные мембранные белки (называемые трансмембранными белками) охватывают липидный бислой, при этом его части открыты с обеих сторон мембраны.Проходящие через мембрану части этих белков обычно представляют собой α-спиральные участки из 20–25 неполярных аминокислот. Гидрофобные боковые цепи этих аминокислот взаимодействуют с цепями жирных кислот мембранных липидов, а образование α-спирали нейтрализует полярный характер пептидных связей, как обсуждалось ранее в этой главе в отношении фолдинга белков. Подобно фосфолипидам, трансмембранные белки представляют собой амфипатические молекулы, причем их гидрофильные части экспонируются в водной среде по обе стороны мембраны.Некоторые трансмембранные белки пересекают мембрану только один раз; другие имеют несколько трансмембранных областей. Большинство трансмембранных белков плазматических мембран эукариот были модифицированы добавлением углеводов, которые экспонируются на поверхности клетки и могут участвовать в межклеточных взаимодействиях.
Подобно фосфолипидам, трансмембранные белки представляют собой амфипатические молекулы, причем их гидрофильные части экспонируются в водной среде по обе стороны мембраны.Некоторые трансмембранные белки пересекают мембрану только один раз; другие имеют несколько трансмембранных областей. Большинство трансмембранных белков плазматических мембран эукариот были модифицированы добавлением углеводов, которые экспонируются на поверхности клетки и могут участвовать в межклеточных взаимодействиях.
Белки также могут быть закреплены в мембранах липидами, которые ковалентно присоединены к полипептидной цепи (см. главу 7). Различные модификации липидов прикрепляют белки к цитозольной и внеклеточной поверхностям плазматической мембраны.Белки могут быть закреплены на цитозольной поверхности мембраны либо добавлением 14-углеродной жирной кислоты (миристиновой кислоты) к их амино-концу, либо добавлением либо 16-углеродной жирной кислоты (пальмитиновой кислоты), либо 15- или 20-углеродные пренильные группы к боковым цепям остатков цистеина.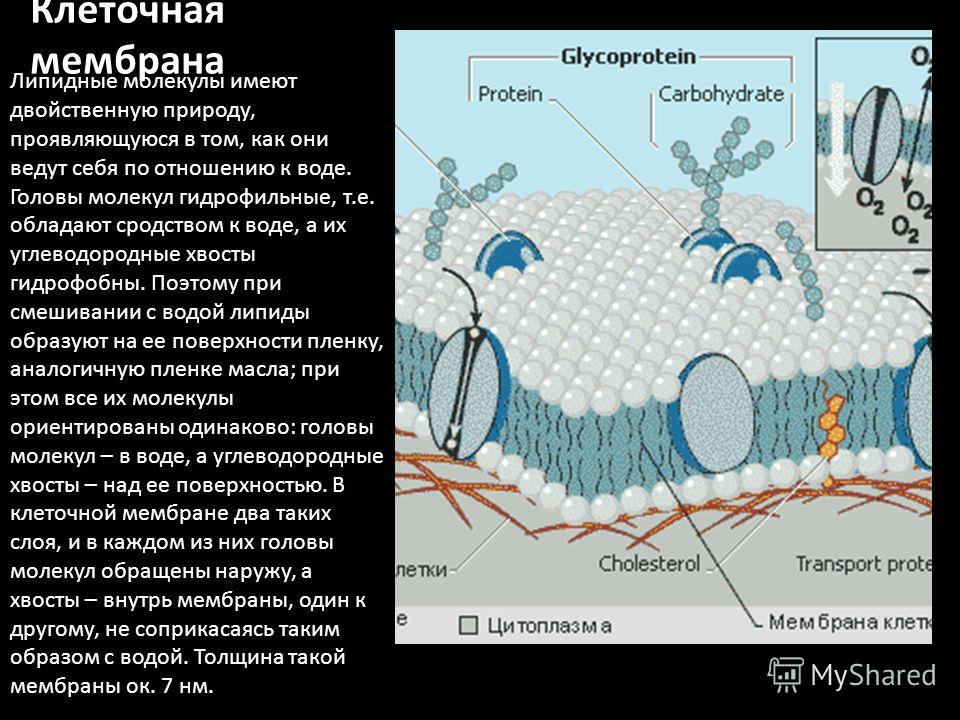 Альтернативно, белки закрепляются на внеклеточной поверхности плазматической мембраны путем добавления гликолипидов к их карбокси-концу.
Альтернативно, белки закрепляются на внеклеточной поверхности плазматической мембраны путем добавления гликолипидов к их карбокси-концу.
Транспорт через клеточные мембраны
Избирательная проницаемость биологических мембран для малых молекул позволяет клетке контролировать и поддерживать свой внутренний состав.Только небольшие незаряженные молекулы могут свободно диффундировать через двойные слои фосфолипидов. Небольшие неполярные молекулы, такие как O 2 и CO 2 , растворимы в липидном бислое и поэтому могут легко пересекать клеточные мембраны. Небольшие незаряженные полярные молекулы, такие как H 2 O, также могут диффундировать через мембраны, но более крупные незаряженные полярные молекулы, такие как глюкоза, не могут. Заряженные молекулы, такие как ионы, не могут диффундировать через бислой фосфолипидов независимо от размера; даже ионы H + не могут пересечь липидный бислой путем свободной диффузии.
Рис. 2.49
Проницаемость фосфолипидных бислоев. Небольшие незаряженные молекулы могут свободно диффундировать через бислой фосфолипидов. Однако бислой непроницаем для более крупных полярных молекул (таких как глюкоза и аминокислоты) и для ионов.
Хотя ионы и большинство полярных молекул не могут диффундировать через липидный бислой, многие такие молекулы (такие как глюкоза) способны пересекать клеточные мембраны. Эти молекулы проходят через мембраны под действием специфических трансмембранных белков, которые действуют как переносчики.Такие транспортные белки определяют избирательную проницаемость клеточных мембран и, таким образом, играют критическую роль в функционировании мембран. Они содержат несколько трансмембранных областей, которые образуют проход через липидный бислой, позволяя полярным или заряженным молекулам пересекать мембрану через белковую пору, не взаимодействуя с гидрофобными цепями жирных кислот мембранных фосфолипидов.
Как подробно обсуждалось в главе 12, существует два основных класса мембранных транспортных белков (4).Канальные белки образуют через мембрану открытые поры, позволяющие свободно проходить любой молекуле соответствующего размера. Ионные каналы, например, обеспечивают прохождение неорганических ионов, таких как Na + , K + , Ca 2+ и Cl —, через плазматическую мембрану. Открываясь, белки каналов образуют небольшие поры, через которые ионы соответствующего размера и заряда могут проходить через мембрану путем свободной диффузии. Поры, образованные этими белковыми каналами, не открыты постоянно; скорее, они могут избирательно открываться и закрываться в ответ на внеклеточные сигналы, позволяя клетке контролировать движение ионов через мембрану.Такие регулируемые ионные каналы особенно хорошо изучены в нервных и мышечных клетках, где они опосредуют передачу электрохимических сигналов.
Рис. 2.50
Канальные белки и белки-носители. (А) Канальные белки образуют открытые поры, через которые молекулы соответствующего размера (например, ионы) могут пересекать мембрану. (B) Белки-носители избирательно связывают транспортируемые малые молекулы, а затем подвергаются конформации (подробнее…)
В отличие от белков-каналов, белки-носители избирательно связывают и транспортируют специфические малые молекулы, такие как глюкоза.Вместо того, чтобы образовывать открытые каналы, белки-переносчики действуют как ферменты, облегчая прохождение определенных молекул через мембраны. В частности, белки-переносчики связывают определенные молекулы, а затем претерпевают конформационные изменения, которые открывают каналы, по которым транспортируемая молекула может проходить через мембрану и высвобождаться на другой стороне.
Как описано выше, молекулы, транспортируемые либо каналом, либо белками-переносчиками, пересекают мембраны в энергетически благоприятном направлении, что определяется концентрацией и электрохимическими градиентами — процесс, известный как пассивный транспорт.Однако белки-переносчики также обеспечивают механизм, с помощью которого изменения энергии, связанные с транспортом молекул через мембрану, могут быть связаны с использованием или производством других форм метаболической энергии, точно так же, как ферментативные реакции могут быть связаны с гидролизом или синтезом АТФ. Например, молекулы могут транспортироваться в энергетически невыгодном направлении через мембрану (например, против градиента концентрации), если их транспорт в этом направлении связан с гидролизом АТФ как источника энергии — процесс, называемый активным транспортом (1).Таким образом, свободная энергия, хранящаяся в виде АТФ, может использоваться для контроля внутреннего состава клетки, а также для управления биосинтезом компонентов клетки.
Рисунок 2.51
Модель активного транспорта. Модель активного транспорта Энергия, полученная в результате гидролиза АТФ, используется для транспорта H + против электрохимического градиента (от низкой концентрации H + до высокой). Связывание Н + сопровождается фосфорилированием носителя (подробнее…)
.
Границы | Введение мембранного заряда и мембранного потенциала в передачу сигналов Т-клеток
Введение
Существует много обзоров о порядке мембран/липидных рафтов и о том, как это свойство плазматической мембраны влияет на передачу сигналов Т-клеточного рецептора (TCR) [см. (1, 2) для недавних примеров], но важность заряда мембраны для передачи сигналов TCR стала осознаваться только недавно. Цель этого обзора — служить праймером в области мембранного заряда для тех, кто интересуется, как это относится к передаче сигналов TCR.Поскольку эти биофизические концепции традиционно не были связаны с иммунологией, мы начнем с изучения соответствующих концепций из электрофизиологии и биофизики мембран, чтобы обеспечить контекст для недавних достижений в нашем понимании передачи сигналов TCR.
Клеточная плазматическая мембрана состоит из двух слоев фосфолипидов с гидрофильными головными группами, обращенными к водной внутри- и внеклеточной среде, в то время как гидрофобная ацильная цепь выстраивается латерально, образуя гидрофобное ядро бислоя.Плазматическая мембрана действует не только как первичный барьер, отделяющий клетку от внешней среды, но и как интерфейс, на котором происходят многие события трансмембранной передачи сигнала. Это в основном передается через трансмембранные белки и белки периферических мембран, которые связаны с внутренним листком плазматической мембраны. Отличительной чертой трансмембранной передачи сигналов, включая передачу сигналов TCR, является то, что реакции передачи сигналов (i) очень специфичны; например, будучи инициированным только антигенами, (ii) высокочувствительным, так что вовлечения нескольких рецепторов достаточно, чтобы вызвать ответы активации, и (iii) должны быть хорошо скоординированы, чтобы предотвратить базальную передачу сигналов в отсутствие лигандов.В то время как основное внимание уделялось структуре и конформационным изменениям мембранных белков, становится все более очевидным, что состав и распределение мембранных липидов могут влиять на конформацию и функцию мембранных белков.
Ранние модели клеточных мембран просто изображали мембранные липиды как жидкие образования внутри гомогенного матрикса, при этом их основной функцией было размещение мембранных белков. Более поздние модели включают гетерогенное распределение липидов как между двумя листочками, так и латерально внутри мембраны.Большинство фосфолипидов имеют асимметричное распределение между внешними и внутренними листками клеточной плазматической мембраны. В то время как нейтральные фосфолипиды, такие как сфингомиелин и цвиттер-ионный фосфатидилхолин, локализованы в основном во внешнем листке плазматической мембраны, большинство анионных фосфолипидов, таких как фосфатидная кислота (PA), фосфатидилсерин (PS), фосфатидилэтаноламин (PE) и фосфатидилинозитол (PI), виды, такие как фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) и фосфатидилинозитол (3,4,5)-трифосфат (PIP 3 ), в основном расположены на внутренней створке (3).Низкие значения констант кислотной диссоциации (pKa) фосфатных групп головной группы липидов ответственны за отрицательный заряд этих липидов при физиологических значениях pH (3).
Плазматическая мембрана имеет два листочка с различным зарядом
Асимметричное распределение фосфолипидов, особенно ФС, имеет несколько биологических последствий и высоко консервативно в эукариотических клетках (4, 5). В то время как латеральная диффузия липидов внутри монослоя является термодинамически благоприятной, трансмембранная транслокация липидов между двумя листочками является термодинамически сложной и, таким образом, в основном является зависимым от аденозинтрифосфата (АТФ) процессом (5).Асимметричное распределение PS устанавливается и поддерживается ферментами флиппазы и флоппазы, которые перемещают липиды внутрь и наружу двух листков в противоположных направлениях. Ca 2+ -зависимая скрамблаза перемещает липиды двунаправленным образом, что уравновешивает асимметричное распределение липидов (5). Асимметричное расположение PS обеспечивает большую механическую стабильность мембраны за счет взаимодействия липидов внутри цитозольного листка с нижележащими белками цитоскелета (4).Кроме того, более высокая концентрация PS конической формы может вызывать отрицательную кривизну клеточной мембраны (6). Нарушение липидной асимметрии имеет прямые биологические последствия. Например, воздействие ФС является медиатором свертывания крови в тромбоцитах и активатором рецепторов-мусорщиков на макрофагах для апоптоза (7). Дефицит экспрессии скрамблазы TMEM16F приводит к дефектам транслокации ФС к внешнему листку и нарушению свертывания крови, впервые идентифицированным у пациентов, страдающих синдромом Скотта (8).С другой стороны, неапоптотическое транзиторное воздействие PS на листок наружной мембраны также наблюдалось в различных других клеточных событиях, в том числе во время активации Т-клеток (9, 10).
Другим важным аспектом асимметрии липидов в плазматической мембране является обогащение отрицательно заряженными фосфолипидами внутреннего листка. Плазматическая мембрана состоит примерно на 30% из PS и на 0,3% из PIP 2 , находящихся преимущественно во внутреннем листке, что создает статический отрицательный поверхностный потенциал -25 мВ (3, 11–13).Этот электростатический потенциал притягивает положительно заряженные молекулы из цитоплазмы и отталкивает молекулы с отрицательным зарядом, как описано законом Кулона (12, 14). Многие белки периферических мембран содержат положительно заряженные мотивы и, таким образом, могут электростатически связываться с плазматической мембраной из-за отрицательного поверхностного заряда внутреннего листка (рис. 1). Например, было показано, что истощение PS и PIP 2 во время фагоцитоза вызывает снижение заряда мембран на фагосомной чашечке и диссоциацию полиосновных мембранных белков, таких как K-ras, Rac1 и c-Src ( 15).Точно так же многовалентные заряды PIP 2 и PIP 3 при физиологических значениях pH способствуют мембранной ассоциации многих белков с многоосновным зарядом синергетическим образом, когда истощение PIP 2 или PIP 3 по отдельности недостаточно. вызвать диссоциацию мембраны (16). Такие электростатические белок-липидные взаимодействия могут обратно модулировать эффективную концентрацию PIP 2 на цитоплазматическом листке плазматической мембраны. PIP 2 является источником для трех важных мобильных мессенджеров.PIP 2 может гидролизоваться до диацилглицерина (DAG) и инозитол-1,4,5-трифосфата (Ins(1,4,5)P 3 ), что приводит к активации пути протеинкиназы C (PKC) и внутриклеточный выход Ca 2+ из эндоплазматического ретикулума (ЭР) соответственно. PIP 2 также может фосфорилироваться до PIP 3 , что приводит к рекрутированию нижестоящих эффекторных белков, таких как протеинкиназа Akt (17). Хорошо изученным мембранным липид-белковым взаимодействием является конститутивное связывание PIP 2 с положительно заряженным белком, миристоилированным субстратом C-киназы, богатым аланином (MARCKS) (18).Предполагается, что это взаимодействие действует как приемник PIP 2 , который изолирует и высвобождает PIP 2 при связывании и диссоциации с мембраной (13). Отсоединение MARCKS от мембраны может быть вызвано повышенным внутриклеточным содержанием Ca 2+ , поскольку вновь образованный комплекс Ca 2+ /кальмодулин заряжен отрицательно и конкурирует за связывание с положительно заряженными MARCKS.
Рисунок 1 . Трансмембранный потенциал возникает как из потенциала Нернста, так и из потенциала поверхностного заряда.Внутренняя часть клетки содержит более высокие концентрации K + и отрицательно заряженных белков и молекул ДНК, в то время как внешняя часть клетки более обогащена Ca 2+ и Na + . Ионы K + вытекают из клетки по этому градиенту концентрации через калиевые каналы, что приводит к суммарному отрицательному заряду внутри клетки. Это вызывает установление потенциала Нернста через мембрану (ТМ на графике), который измеряется в электрофизиологических исследованиях патч-клэмп.В меньшем масштабе накопление отрицательно заряженных фосфолипидов в листовке внутренней мембраны создает дзета-потенциал с эффективным диапазоном ~ 1 нм (дзета на графике). Положительно заряженные ионы притягиваются к анионной поверхности, что особенно заметно на внутреннем листке плазматической мембраны. Поверхностный потенциал внутреннего листка значительно отличается от потенциала наружного листка, и различие между двумя поверхностными потенциалами можно рассматривать как альтернативный локальный трансмембранный потенциал, который может непосредственно влиять на активность трансмембранных белков.
Мембранный потенциал: уроки электрофизиологии
Учитывая, что внутренний и внешний листки плазматической мембраны несут преимущественно отрицательно и положительно заряженные липиды соответственно, создается трансмембранный потенциал — явление, хорошо известное в электрофизиологии. Традиционно трансмембранный потенциал определяется как разница в концентрации солевых ионов по обе стороны мембраны (19, 20). Транспортеры, обменники, насосы и ионные каналы внутри мембраны, таким образом, поддерживают этот трансмембранный потенциал (21).Например, концентрация ионов K + выше в цитоплазме по сравнению с внеклеточным пространством, тогда как ионы Na + , Ca 2+ и Cl — обнаруживаются в более высоких концентрациях внеклеточно (22). Чем выше проницаемость иона, тем сильнее влияние на трансмембранный потенциал (19). Например, из-за своей проницаемости потенциал покоя K + близок к потенциалу Нернста, что приводит к более отрицательному заряду внутренней части клетки по сравнению с внеклеточной средой (22).
Изменения трансмембранного потенциала традиционно изучались с использованием электрофизиологических методов (23). Эксперименты с фиксацией напряжения предоставляют средства для управления трансмембранным потенциалом при одновременном мониторинге активности ионных каналов, а режим фиксации тока позволяет измерять изменения напряжения мембраны, возникающие в результате потока ионов через ионных каналов. Хотя такие методы являются мощными, они не исследуют непосредственно локальное распределение заряда на плазматической мембране и не фиксируют изменения в распределении ионов вблизи заряженной поверхности мембраны (3, 14, 24–26).И наоборот, локализованный поток ионов, опосредованный активностью канала, может привести к флуктуациям в распределении заряда на мембране. Активность ионных каналов может опосредовать спектр сигнальных путей, поскольку отдельные семейства ионных каналов закрываются или активируются разными сигналами. Кроме того, ионные каналы могут проявлять селективность к определенным видам ионов, что приводит либо к деполяризации мембраны (сдвигу в сторону более положительных мембранных потенциалов), либо к гиперполяризации. В возбудимых клетках эти сдвиги в мембранном потенциале регулируют генерацию потенциала действия через активацию потенциалзависимых каналов.В невозбудимых клетках, таких как Т-лимфоциты, механизм, с помощью которого изменения мембранного потенциала регулируют передачу сигналов вниз по течению, менее ясен.
В Т-лимфоцитах идентифицирован ряд классов ионных каналов, которые обладают различными механизмами ворот и ионной селективностью. Потенциалзависимые и/или Ca 2+ -активируемые каналы K + функционируют для гиперполяризации мембраны при активации (27). Потенциалзависимый канал K + , K v 1.3, закрывается в ответ на сдвиг от мембранного потенциала покоя к более положительным потенциалам, таким образом, активация этого канала напрямую зависит от изменений напряжения на плазматической мембране.Электрохимический градиент K + диктует, что при открытии селективных каналов K + ионы K + будут диффундировать из клетки, что приведет к гиперполяризации мембраны (27). Такой сдвиг в сторону более отрицательных мембранных потенциалов может иметь множественные последующие эффекты, включая увеличение электрохимической движущей силы, которая способствует притоку Ca 2+ или Na + , когда активируются каналы, селективные для этих ионов. Считается, что деполяризующие токи опосредованы в Т-лимфоцитах каналами TRPM4, Ca 2+ -активируемым, Na + проницаемым каналом (28).Однако любой поток катионов внутрь будет деполяризовать мембрану. Ряд Ca 2+ -проводящих ионных каналов был идентифицирован в Т-лимфоцитах, включая рецептор P2X7 и каналы L-типа Ca 2+ (9, 29). Канал Са 2+ L-типа принадлежит к семейству потенциалзависимых каналов Са 2+ , однако в Т-лимфоцитах эти каналы не активируются деполяризацией мембраны (29, 30), и точный механизм активации неизвестен. .
Различные типы трансмембранных потенциалов
Как указывалось выше, традиционный электрофизиологический трансмембранный потенциал плазматической мембраны определяется как разность электростатических потенциалов диффундирующих ионов по обе стороны мембраны (19, 20).Это приводит к эффектам дальнего действия, глобально воздействующим на трансмембранные белки, такие как ионные каналы и обменники. Можно также рассматривать трансмембранный потенциал более локально. То есть каждая граница раздела мембрана-раствор имеет свой собственный поверхностный потенциал, который определяется заряженными липидами в мембране и противоионами в растворе (рис. 1). Этот поверхностный потенциал часто называют дзета-потенциалом с характерной дебаевской длиной, при которой расстояние, на котором находится потенциал, уменьшается до 1/е своего максимума (3, 14, 26).Поскольку внутренние и внешние листки плазматической мембраны несут липиды с разным зарядом, дзета-потенциал на внеклеточной и внутриклеточной стороне также различается (24, 26). Альтернативным определением трансмембранного потенциала является разница этих двух поверхностных потенциалов (25). В этом случае асимметричное распределение заряда липидов может влиять на трансмембранный потенциал несколькими путями. Во-первых, отрицательный дзета-потенциал может притягивать положительно заряженные ионы к поверхности мембраны, образуя двойной ионный слой, как описано McLaughlin и его коллегами (3, 12–14).В результате ионный градиент, непосредственно прилегающий к мембране, может существенно отличаться от градиента, измеренного в нерасфасованных растворах, например, в экспериментах с пэтч-клампом на целых клетках (21, 23) (рис. 1). Вполне вероятно, что каналы, например, более чувствительны к ионному окружению, непосредственно прилегающему к мембране, а не к дистальным массовым концентрациям ионов. Второй вклад заряженных липидов в этот альтернативный локально определенный трансмембранный потенциал возникает из-за взаимодействий внутри бислоя.Теоретические расчеты и молекулярно-динамическое моделирование показали, что трансмембранный потенциал может быть создан исключительно за счет разницы поверхностных потенциалов между двумя листками, независимо от различий концентраций ионов в объемных растворах по обе стороны мембраны (25, 31). В плазматической мембране, где заряженные липиды асимметрично распределены между двумя листочками, наблюдаемый трансмембранный потенциал может быть описан исключительно разностью поверхностных потенциалов (25).Действительно, динамическое молекулярное моделирование показало, что трансмембранный потенциал 70–100 мВ возникает либо из-за асимметричного распределения цвиттер-ионных липидов между двумя листками мембраны, либо из-за предпочтительного связывания ионов Na + с одним листком бислоя, несмотря на ионную силу. объемного раствора по обе стороны от бислоя одинаковы (32, 33). Экспериментально было показано, что АТФ-управляемый катионный канал P2X7 чувствителен к перемещению ФС из внутреннего листка во внешний, другими словами, чувствителен к изменениям разности двух поверхностных потенциалов, но не к изменениям в объеме. трансмембранный потенциал (9).
Электростатические дзета-потенциалы также могут быть непосредственно связаны с функцией трансмембранных каналов и других белков. Заряженные головные группы липидов создают кулоновские силы, которые напрямую изменяют локальное электростатическое окружение ионных каналов и, следовательно, могут напрямую влиять на их механизм открытия (34–37). Например, многоосновный заряженный мотив на цитозольной стороне многих ионных каналов, таких как потенциалзависимые каналы K + , связывает полианионный PIP 2 посредством электростатических взаимодействий, так что открытие и закрытие этих ионных каналов непосредственно регулируется локальной концентрацией заряженных липидов во внутреннем листке плазматической мембраны (35, 37).В действительности вполне вероятно, что большинство трансмембранных белков чувствительны как к локальным, так и к глобальным электростатическим силам.
Латеральные неоднородности в мембране приводят к возникновению заряженных мембранных доменов
В настоящее время хорошо известно, что латеральное распределение мембранных липидов дает начало мембранным доменам. Напр., модели липидного плота и частокола предполагают, что мембранные домены формируются посредством липид-липидных взаимодействий и/или мембранных взаимодействий с расположенным ниже цитоскелетом (38).Недавно было высказано предположение, что анионные фосфолипиды во внутреннем листке мембраны также могут латерально собираться в нанокластеры и что это происходит заряд-зависимым образом (39-41). Эти мембранные домены, вероятно, влияют на мембранные белки. Например, совместная кластеризация липидов и белков отвечает за активацию киназы K-Ras, а также за активацию так называемых комплексов растворимых рецепторов белка прикрепления NSF (SNARE) во время слияния везикул нейросинаптической мембраны.В случае K-Ras деполяризация мембраны, вызванная высокими внеклеточными концентрациями K + , приводит к совместной кластеризации PS и K-Ras, чему способствуют электростатические взаимодействия между многоосновным заряженным мотивом на С-конце K- Ras и отрицательно заряженные липиды PS. Эти домены K-Ras/PS активируют сигнальный путь митоген-активируемой протеинкиназы (MAPK) (39). Интересно, что количество PS во внутреннем листке не изменяется при деполяризации мембраны, что подчеркивает важность локальных изменений мембранного дзета-потенциала в отличие от глобального трансмембранного потенциала.
Подобно PS, как теоретические, так и экспериментальные данные показали, что двухвалентно заряженные ионы, такие как Ca 2+ , могут напрямую связывать и латерально сшивать PIP 2 с образованием обогащенных PIP 2 нанодоменов (рис. 2). Четырехвалентный заряд PIP 2 создает сильные кулоновские силы, которые могут расширить диапазон локальной длины Дебая на внутренней пластине (3, 12). В результате PIP 2 взаимодействует с различными положительно заряженными молекулами, включая катионы, посредством множественных электростатических взаимодействий, что может привести к латеральной кластеризации белка и липидов (рис. 2В).Например, привлечение двухвалентных ионов Ca 2+ не только снижает эффект электростатического отталкивания отрицательно заряженных липидов PIP 2 , но также может образовывать внутримолекулярные и межмолекулярные водородные связи с PIP 2 посредством взаимодействий заряд-заряд (42). ). Интересно, что хотя и Ca 2+ , и Mg 2+ несут двухвалентные положительные заряды, электростатические взаимодействия с PIP 2 , по-видимому, специфичны для Ca 2+ . Молекулярное моделирование предполагает, что, хотя Mg 2+ имеет аналогичный заряд, его больший гидродинамический радиус не позволяет ему образовывать сильные электростатические взаимодействия, такие как водородные связи с PIP 2 (42, 43).Было обнаружено, что многие мембранные и даже цитозольные белки, содержащие положительно заряженные пептидные мотивы, совместно локализуются с нанокластерами PIP 2 (41, 44–46). Одно из возможных объяснений состоит в том, что положительный заряд Ca 2+ недостаточен для нейтрализации многовалентного и отрицательного заряда PIP 2 . Таким образом, даже при повышении внутриклеточного уровня Ca 2+ нанодомены Ca 2+ и PIP 2 могут оставаться сильно отрицательно заряженными. В результате белки с поливалентными положительно заряженными мотивами будут притягиваться к этим доменам и, таким образом, сами образовывать нанокластеры.Например, было обнаружено, что поликатионный белок SNARE синтаксин-1А образует нанокластеры с PIP 2 при повышении внутриклеточной концентрации Ca 2+ (40, 45). Такие нанокластеры ответственны за стыковку и слияние синаптических пузырьков во время нейротрансмиссии. Другим примером является полилизиновый мотив вируса Эбола VP40, который усиливает кластеризацию PIP 2 . Кластеризация PIP 2 , в свою очередь, отвечает за формирование гексамерной структуры VP40 на листочке внутренней мембраны, что необходимо для почкования вируса (47).В этом случае образование мембранных доменов является Са 2+ независимым, но напрямую опосредуется электростатическими взаимодействиями между PIP 2 и вирусным белком.
Рисунок 2 . Высокие локальные плотности поверхностного заряда могут вызывать мембранную ассоциацию и кластеризацию мембранных белков. (A) Одновалентный заряд фосфатидилсерина (PS) и фосфатидной кислоты (PA) может способствовать мембранной ассоциации катионных молекул и может действовать в сочетании с гидрофобными взаимодействиями через группы пальмитоилирования, миристоилирования и фарнезилирования (черные хвосты).Спаривание отрицательно заряженных липидов (оранжевая головка) с положительно заряженными остатками (синие кружки) нейтрализует изменение мембраны и предотвращает дополнительные взаимодействия. (B) Напротив, поливалентные взаимодействия между фосфатидилинозитол-4,5-бисфосфатом (PIP 2 )/фосфатидилинозитол-(3,4,5)-трифосфатом (PIP 3 ) (красные головные группы) и Ca 2+ (маленькие бирюзовые кружки) вызывают кластеризацию PIP 2 /PIP 3 , но не полностью нейтрализуют отрицательный заряд, позволяя рекрутировать белки, содержащие мотивы с многоосновным зарядом (синие фигуры).Такие мультивалентные взаимодействия часто могут приводить к латеральной кокластеризации PIP 2 /PIP 3 с заряженными белками, образуя нанодомены на внутреннем листке клеточной мембраны, которые могут запускать активацию сигнальных процессов.
Роль заряженных липидов в активации Т-клеток
Когда TCR взаимодействует с родственным пептидом, представленным в главном комплексе гистосовместимости (pMHC), он инициирует сигнальный каскад, кульминацией которого является активация Т-клеток.В течение последнего десятилетия становится все более очевидным, что локальная заряженная липидная среда вокруг TCR играет важную роль в этом процессе.
Комплекс TCR состоит из альфа- и бета-субъединиц, которые опосредуют взаимодействия с молекулами pMHC, а также гомо- и гетеродимеров CD3 (CD3γ, CD3δ, CD3ε и CD3ζ), которые придают сигнальный потенциал. После лигирования TCR киназа семейства Src, Lck, фосфорилирует тирозины в мотивах активации на основе иммунотирозина (ITAM) цепей CD3, которые становятся сайтами стыковки для протеинкиназы 70, ассоциированной с дзета-цепью (ZAP70).Рекрутированный мембраной ZAP70 затем фосфорилирует линкер для активированных Т-клеток (LAT), который рекрутирует несколько адаптеров, которые передают сигналы и приводят к клеточным эффекторным функциям, таким как секреция цитокинов.
Последовательности, богатые основным основанием (BRS) в неструктурированных цитоплазматических хвостах субъединиц CD3ε (48) и CD3ζ (49, 50), а также коактивирующий рецептор CD28 (51), вызывают ассоциацию хвостов с отрицательно заряженными фосфолипидами в внутренний листок плазматической мембраны. ЯМР-исследования реконструированных фосфолипидных бицелл, состоящих из отрицательно заряженных фосфолипидов, показывают, что тирозиновые боковые цепи CD3ε ITAM скрыты в гидрофобном ядре (48, 52).Фосфорилирование остатков тирозина ITAM предотвращает ассоциацию цепей CD3 с мембраной, по-видимому, за счет предотвращения переплетения остатков тирозина в гидрофобном ядре и уменьшения общего заряда хвоста.
Первоначальное наблюдение, что цитоплазматический хвост CD3ε связывается с отрицательно заряженными фосфолипидами, привело к предположению о механизме запуска TCR «Safety On» (48, 53) (рис. 3А). В этой гипотезе сигнальные мотивы TCR остаются изолированными от Lck до тех пор, пока взаимодействие между TCR и родственным pMHC не вызовет диссоциацию хвостов CD3ε и CD3ζ от мембраны, позволяя Lck получить доступ к ITAM и фосфорилировать их (рис. 3А).В соответствии с гипотезой безопасности, мы недавно показали, что снижение электростатического потенциала внутреннего листка плазматической мембраны (за счет включения положительно заряженных липидов) приводит к спонтанному фосфорилированию CD3ζ (54). Хотя мы не можем исключить возможность повышенной активности Lck в этих экспериментах, кажется вероятным, что повышенное фосфорилирование было результатом отсоединения хвостов CD3 от мембраны, что позволило Lck получить доступ к мотивам ITAM.
Рисунок 3 .Модель Safety On срабатывания Т-клеточного рецептора (TCR). (A) В покоящихся Т-клетках комплекс TCR (желтый) не может спонтанно передавать сигналы за счет электростатических взаимодействий между богатыми основаниями последовательностями в цитоплазматических доменах CD3ε и CD3ζ и отрицательно заряженными фосфолипидами (красный цвет). Это взаимодействие скрывает критические остатки тирозина в мотивах активации на основе иммунотирозина (ITAM) CD3ε и CD3ζ в гидрофобном ядре мембраны, тем самым физически изолируя их от Lck (зеленый), предотвращая фосфорилирование и инициацию нижестоящей передачи сигналов.Когда TCR взаимодействует с родственным пептидом, представленным в главном комплексе гистосовместимости (pMHC, пурпурный), хвосты CD3 высвобождаются из мембраны посредством неизвестного механизма, что позволяет им фосфорилироваться с помощью Lck и инициировать нижестоящую передачу сигналов. (B) Нулевая гипотеза для модели «Безопасность включена», которая также согласуется с текущими данными. Цитоплазматические хвосты CD3 находятся в динамическом равновесии между погружением в мембрану и свободным от нее. Агонист pMHC-индуцированное рекрутирование Lck и/или сегрегация фосфатаз [см. van der Merwe and Dushek (55) для обзора альтернативных триггерных механизмов] делает возможным фосфорилирование цепей CD3, что предотвращает повторную ассоциацию с мембраной. (C) Местное высвобождение Ca 2+ (синие кружки) после начальной активации (первая панель) также может играть определенную роль, нейтрализуя отрицательно заряженные липиды путем высвобождения хвостов CD3 в близлежащих нелигированных TCR и позволяя им стать фосфорилированные (вторая и третья панели). Это может быть важно для усиления исходных сигнальных событий.
Два механистических вопроса возникают из гипотезы «Safety On» и остаются неясными: (1) является ли диссоциация хвоста CD3 причиной или следствием фосфорилирования, и (2) если ассоциация хвоста действительно блокирует фосфорилирование, каков механизм, связывающий связывание лиганда TCR с Диссоциация хвоста CD3?
Фосфорилированные хвосты CD3ε и CD3ζ не связываются с мембраной, но еще предстоит окончательно доказать, требуется ли для этого полная диссоциация или это просто следствие фосфорилирования.Недавние результаты предполагают, что ассоциация хвостов CD3ε с мембраной является динамическим процессом, существующим в множественных конформационных состояниях, связанных с мембраной, и что ITAM CD3, вероятно, будут свободны по крайней мере часть времени (52). Это оставляет открытой возможность того, что отделение хвоста CD3 от мембраны не регулируется вовлечением лиганда, а скорее является следствием опосредованного лигандом фосфорилирования, которое препятствует реассоциации хвоста с внутренним листком (Рис. 3В). До сих пор результаты экспериментов in vitro не продемонстрировали окончательно, что мембранная ассоциация препятствует фосфорилированию, при плохом фосфорилировании пептидов цитоплазматического домена CD3ε и CD3ζ в присутствии отрицательно заряженных фосфолипидных везикул, о которых сообщают некоторые (48, 50), в то время как другие наблюдали спонтанное фосфорилирование CD3ζ в липосомах, содержащих физиологические уровни ФС (56).
Напротив, результаты мутации последовательностей BRS хвоста CD3 последовательно показывают снижение фосфорилирования и потерю активации Т-клеток (49, 57, 58). Хотя результаты исследований мутаций BRS предполагают прямо противоположное тому, что предсказывает механизм «Safety On», Shah et al. (59) дают убедительное альтернативное объяснение. Их результаты демонстрируют, что Lck специфически распознает тирозиновые остатки с богатыми основаниями последовательностями вверх и вниз по течению, например, в хвостах CD3ε и CD3ζ, тогда как ZAP70 распознает тирозиновые остатки, фланкированные отрицательно заряженными остатками, такими как в LAT.Т.о., мутация BRS для нейтрализации заряда и уменьшения ассоциации с мембраной также, вероятно, приводит к дефектному фосфорилированию из-за плохого распознавания с помощью Lck, что заставляет пересмотреть результаты, основанные на этой стратегии. Эти результаты были недавно подтверждены Li et al. (60), которые показали, что мотив BRS является центральным для эффективного связывания Lck с CD3ε, что, в свою очередь, рекрутирует киназу в комплекс TCR и делает возможным фосфорилирование других цепей CD3.
В цитоплазматических доменах субъединиц CD3δ и CD3γ отсутствуют последовательности BRS, и нет доказательств того, что они связаны с мембраной.Первоначальная модель «Safety On» предсказывала, что это может привести к конститутивному фосфорилированию ITAM в этих цепях, поскольку они подвергаются воздействию Lck. Результаты Shah et al. (59) и Li et al. (60) также дают объяснение, почему это не так. Хотя цитоплазматические домены CD3δ и CD3γ не связываются с мембраной, отсутствие основных областей, вероятно, делает их плохими субстратами для Lck, и им может потребоваться индуцированная близость, опосредованная взаимодействием CD3ε-Lck, чтобы стать эффективным фосфорилированием (60).
Подводя итог, представляется вероятным, что функция последовательностей BRS в неструктурированных цитоплазматических хвостах иммунорецепторов, содержащих сигнальные мотивы на основе иммунотирозина, двояка: во-первых, чтобы позволить хвостам рецептора быть лучшими субстратами для Lck (59), и, во-вторых, позволить для зависимой от заряда ассоциации с внутренним листком, что делает фосфорилирование чувствительным к механизмам, регулирующим эту ассоциацию (48-50). Кроме того, вместо бинарной причинно-следственной связи между ассоциацией хвоста мембраны CD3 и фосфорилированием мы предполагаем, что реальность лежит где-то между крайностями, показанными на рисунках 3A, B, и что условия, используемые для запуска Т-клетки, могут влиять на то, насколько сильно фосфорилирование зависит от диссоциация хвоста.Напр., условия, приводящие к сильной сегрегации фосфатазы и колокализации Lck/TCR, могут управлять фосфорилированием без необходимости сдвигать равновесие ассоциации хвостов CD3ε и CD3ζ с мембраной (61). Наоборот, сдвиг в этом равновесии хвостов CD3ε и CD3ζ также сдвигает чувствительность TCR к фосфорилированию, вплоть до спонтанного, независимого от лиганда фосфорилирования в полностью диссоциированных хвостах (54).
Мембранные заряды, Ca
2+ и сигнализация TCRОстается открытым вопрос о том, что регулирует взаимодействие хвостов CD3ε и CD3ζ с мембраной.Хотя было предложено индуцированное лигандом конформационное изменение в комплексе TCR (52), убедительных доказательств, непосредственно связывающих это с диссоциацией хвоста, не было продемонстрировано. Одним механизмом, который действительно эффективно регулирует взаимодействие хвостов CD3ε и CD3ζ с мембраной, является внутриклеточная передача сигналов Ca 2+ (62). Это происходит за счет прямой ассоциации Ca 2+ с головными группами PS, что нейтрализует заряд. Фосфорилирование CD3ε и CD3ζ значительно снижается, но не устраняется, когда клетки стимулируют анти-CD3 в отсутствие Ca 2+ или когда клетки нагружают кальциевым хелатором BAPTA-AM (62).Следует отметить, что передача сигналов Ca 2+ происходит ниже по течению от активации TCR, и, таким образом, трудно представить, как эти эффекты могут представлять собой начальное запускающее событие. Вместо этого любые опосредованные Са 2+ эффекты могут функционировать как механизм прямой связи, повышающий чувствительность и/или усиливающий передачу сигналов во время активации Т-клеток (рис. 3С).
В дополнение к диссоциации хвоста CD3 от мембраны, Ca 2+ также вызывает кластеризацию Т-клеток (63), что может дополнительно усиливать активацию Т-клеток (64).Механизм, с помощью которого Ca 2+ вызывает кластеризацию TCR, в настоящее время неясен. В наших экспериментах спонтанное фосфорилирование CD3ζ, которому способствует снижение электростатических взаимодействий с внутренним листком, было недостаточным для индукции кластеризации TCR (54), указывая на то, что кластеризация не обязательно зависит от фосфорилирования. Как указано в разделах выше, многочисленные белки, содержащие положительно заряженные пептидные мотивы, совместно локализуются с нанокластерами Ca 2+ /PIP 2 (41, 44–46), что предполагает, что это также может происходить с TCR.
Дополнительный механизм прямой связи может иметь форму привязки ZAP70 к PIP 2 /PIP 3 . С-концевой домен Sh3 ZAP70 специфически взаимодействует с PIP 2 и PIP 3 через сайт , который отличается от сайта связывания фосфотирозина ITAM (65). Взаимодействие PIP 2 /PIP 3 не мешает связыванию фосфотирозина с ITAM и, по-видимому, играет важную вспомогательную роль во время активации Т-клеток, приводя к более сильным потокам Ca 2+ и продукции IL-2 (65).Генерация PIP 2 /PIP 3 происходит после передачи сигналов TCR и костимулирующего рецептора CD28 [рассмотрено в Ref. (66, 67)], и, таким образом, этот механизм может обеспечить пролонгированное мембранное рекрутирование ZAP70 и устойчивую передачу сигналов в местах микрокластеров TCR/PIP 2 /PIP 3 . Интересно, что этот механизм стабилизации мембранных взаимодействий белков, содержащих Sh3 домены, может применяться к широкому кругу сигнальных белков, многие из которых, как известно, взаимодействуют с PIP 2 /PIP 3 (65).Заманчиво предположить, что это общий механизм, обеспечивающий большую пространственную специфичность рекрутирования Sh3-содержащих белков к фосфорилированным белкам внутри заряженных липидных микродоменов.
В настоящее время известно, что пространственное распределение заряда мембраны неоднородно по всему иммунологическому синапсу, что привело к предположению, что участки мембраны с различным зарядом ответственны за пространственное расположение TCR и родственных сигнальных белков во время активации Т-клеток (54, 68). –70).Например, приток Ca 2+ во время активации Т-клеток происходит в основном в центре или синапсе, возможно, потому, что высвобождение Ca 2+ активирует каналы Ca 2+ в плазматической мембране и сенсор Ca 2+ . STIM1 в ER в основном локализуется в центре иммунологического синапса (71). Более высокая локальная концентрация Ca 2+ может вызывать множественные эффекты. Во-первых, двухвалентные ионы связывают отрицательно заряженные липиды во внутреннем листке плазматической мембраны, так что эффективная плотность локального поверхностного заряда снижается (62) (рис. 4).Было продемонстрировано, что Ca 2+ , посредством скрининга заряда может напрямую диссоциировать хвосты CD3ε от внутреннего листка плазматической мембраны (62). Во-вторых, повышенные уровни Ca 2+ могут изменять активность других ферментов, что дополнительно снижает локальный дзета-потенциал мембраны. Это включает активацию фосфолипазы Cγ (PLCγ) и подавление активности мембранных флиппаз. PLCγ гидролизует полианионный липид PIP 2 в DAG и IP 3 , и в то время как нейтрально заряженный DAG остается на плазматической мембране, отрицательно заряженный IP 3 высвобождается из мембраны и связывается с рецептором IP 3 в ER, чтобы вызвать высвобождение Ca 2+ из ER.В результате поверхностный заряд мембраны в центре синапса снижается. Локальное накопление ДАГ в центре синапса отвечает за активацию членов семейства протеинкиназ С (ПКС), что приводит к рекрутированию центра организации микротрубочек и установлению клеточной полярности и направленной секреции цитотоксических гранул (70). , 72).
Рисунок 4 . Распределение заряда мембраны в иммунологическом синапсе. (A) анфас схематический вид внутреннего листка Т-клетки, сталкивающейся с поверхностью, представляющей родственный пептид, представленный на лигандах главного комплекса гистосовместимости, демонстрирующий значительное ремоделирование распределения фосфолипидов в зрелом иммунологическом синапсе.Кластеры фосфатидилинозитол-4,5-бисфосфата (PIP 2 )/фосфатидилинозитол-(3,4,5)-трифосфата (PIP 3 ) и Ca 2+ (красные шестиугольники и синие кружки, соответственно, в верхнем левом углу) в регионе) формируются вблизи периферии контактного интерфейса, тогда как в центре иммунологического синапса PIP 2 /PIP 3 истощаются за счет действия PLCγ. Повышенный уровень Ca 2+ в центре иммунного синапса вызывает экстернализацию фосфатидилсерина (PS, оранжевые фосфолипиды) на внешний листок (показан в увеличенном масштабе в правом верхнем углу), которые также здесь обогащены. (B) Графики содержания PS, PIP 2 /PIP 3 и Ca 2+ , а также дзета-потенциала по профилям линий через иммунологический синапс [пунктирная линия в (A) ]. Дзета-потенциал теряется в центре синапса из-за экстернализации PS и экранирования заряда Ca 2+ .
УровниCa 2+ также регулируют активность флиппазы, которая отвечает за конститутивную транслокацию ФС из наружного листка во внутренний листок плазматической мембраны и, таким образом, за асимметричное накопление ФС на цитоплазматической стороне.Мембрана иммунного синапса в активированных Т-клетках обогащена PS (73), однако PS-специфический биосенсор демонстрирует, что PS исключен из микрокластеров TCR (74). Причина этого кажущегося несоответствия заключается в том, что рост внутриклеточного Ca 2+ в центре синапса подавляет активность флиппазы, так что транслокация PS наружу с помощью floppases является доминирующей и подавляет транслокацию внутрь (75). В результате, PS в основном экстернализуется в центре и Ca 2+ -обогащенных областях синапса (Fig. 4A), а отрицательный локальный дзета-потенциал, генерируемый на внутренней створке, снижается (74).Также было замечено, что CD45 является негативным регулятором экстернализации ФС (9), который в основном исключен из иммунологического синапса из-за большого размера его эктодомена (76). Таким образом, исключение CD45 из центра синапса может также способствовать установлению градиента PS от центра к краю синапса (рис. 4В).
В отличие от центра синапса заряд мембраны в периферических областях синапса намного выше (54). Предыдущие исследования показали, что поливалентный отрицательно заряженный липид PIP 3 в основном располагался в периферической области синапса.PIP -3- отвечает за рекрутирование Dock2 и последующую активацию Rac1, что приводит к полимеризации актина и образованию плотного актинового кольца, окружающего периферическую область синапса (69). Актиновое кольцо необходимо для клеточной адгезии и направленной секреции цитотоксических гранул и цитокинов (69). PIP 3 также может быть ответственным за формирование кластеров TCR за счет многовалентного электростатического взаимодействия с катионами Ca 2+ и многоосновными заряженными цепями CD3ε и CD3ζ комплекса TCR (рис. 4А).Недавно мы картировали заряды мембран в иммунологических синапсах, используя наш датчик заряда мембраны с резонансной передачей энергии Фёрстера, и показали, что заряды мембран были в основном однородно распределены в покоящихся Т-клетках (54). При активации TCR заряд резко снижался в центре, но сохранялся в периферической области синапса. Интересно, что глобальное снижение заряда мембран за счет включения положительно заряженных липидов в Т-клетки не изменяет относительное распределение заряда в синапсе (54).Это говорит о том, что локальные заряды мембран внутри иммунологического синапса регулируются отдельно от общего состава липидов. Весьма вероятно, что эта локальная регуляция включает взаимодействие заряженных липидов, ионов в растворе и специфических сигнальных белков Т-клеток.
Резюме
В заключение, асимметричное распределение заряженных липидов между двумя листками плазматической мембраны и латерально внутри листков играет важную роль во многих клеточных процессах, включая передачу сигналов TCR.Заряженные липиды, в частности, создают электростатический дзета-потенциал, который не только различается на границе внеклеточной и внутриклеточной мембраны, но также может приводить к различным паттернам заряда мембраны, как в случае иммунологического синапса. Электростатический потенциал внутреннего листка плазматической мембраны локально регулирует преходящие взаимодействия цитозольных белков и ассоциацию цитозольных хвостов трансмембранных комплексов. Это, вероятно, контролирует фосфорилирование комплекса TCR-CD3 в Т-клетках.Поверхностные заряды также притягивают ионы из раствора, а локально ограниченные взаимодействия между заряженными липидами с мультивалентными белками и ионами, такими как Ca 2+ , могут привести к образованию заряженных мембранных доменов или нанокластеров. Электростатическое притяжение ионов к заряженным мембранам эффективно изменяет ионную силу вблизи мембраны по сравнению с объемом раствора. Этого эффекта достаточно, чтобы установить трансмембранный потенциал, который сильно отличается от того, который традиционно изучается с помощью электрофизиологии.Кроме того, дзета-потенциалы могут напрямую контролировать открытие трансмембранных каналов, что может приводить к потокам ионов, которые, в свою очередь, влияют на электростатические взаимодействия белков и заряженных мембран. Таким образом, возникает сложная и целостная картина, в которой заряженные липиды, ионы в растворе и переходные взаимодействия белков находятся в динамическом равновесии. Мы только сейчас начинаем понимать, как проксимальная передача сигналов Т-клеток вписывается в эту картину, но даже с нашим неполным пониманием кажется ясным, что локальный, наноразмерный заряд мембраны имеет важные последствия для функции TCR.
Вклад авторов
KG определил объем обзора. YM и JG разработали и изготовили фигурки. Все авторы написали и рецензировали рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Финансирование
KG также выражает благодарность Центру передового опыта ARC в области усовершенствованной молекулярной визуализации (CE140100011).
Ссылки
3. Маклафлин С. Электростатические свойства мембран. Annu Rev Biophys Biophys Chem (1989) 18:113–36. doi:10.1146/annurev.bb.18.060189.000553
Полнотекстовая перекрестная ссылка | Google Scholar
4. Manno S, Takakuwa Y, Mohandas N. Идентификация функциональной роли липидной асимметрии в биологических мембранах: взаимодействия фосфатидилсерин-скелетный белок модулируют стабильность мембраны. Proc Natl Acad Sci USA (2002) 99(4):1943–8.doi:10.1073/pnas.042688399
Реферат PubMed | CrossRef Полный текст | Google Scholar
5. Fadeel B, Xue D. Плюсы и минусы асимметрии фосфолипидов в плазматической мембране: роль в здоровье и болезни. Crit Rev Biochem Mol Biol (2009) 44(5):264–77. дои: 10.1080/104092303307
Реферат PubMed | CrossRef Полный текст | Google Scholar
6. Сюй П., Болдридж Р.Д., Чи Р.Дж., Берд К.Г., Грэм Т.Р. Флиппинг фосфатидилсерина увеличивает кривизну мембраны и отрицательный заряд, необходимый для везикулярного транспорта. J Cell Biol (2013) 202(6):875–86. дои: 10.1083/jcb.201305094
Реферат PubMed | CrossRef Полный текст | Google Scholar
8. Kunzelmann K, Nilius B, Owsianik G, Schreiber R, Ousingsawat J, Sirianant L, et al. Молекулярные функции аноктамина 6 (TMEM16F): хлоридный канал, катионный канал или фосфолипидная скрамблаза? Pflugers Arch (2014) 466(3):407–14. doi: 10.1007/s00424-013-1305-1
Реферат PubMed | CrossRef Полный текст | Google Scholar
9.Elliott JI, Surprenant A, Marelli-Berg FM, Cooper JC, Cassady-Cain RL, Wooding C, et al. Мембранное распределение фосфатидилсерина как неапоптотический сигнальный механизм в лимфоцитах. Nat Cell Biol (2005) 7(8):808–16. дои: 10.1038/ncb1279
Реферат PubMed | CrossRef Полный текст | Google Scholar
10. Рысави Н.М., Шимода Л.М., Диксон А.М., Спек М., Стоукс А.Дж., Тернер Х. и соавт. Помимо апоптоза: механизм и функция фосфатидилсериновой асимметрии в мембране активирующих тучных клеток. Биоархитектура (2014) 4 (4–5): 127–37. дои: 10.1080/194
.2014.995516
Реферат PubMed | CrossRef Полный текст | Google Scholar
11. Левентис П.А., Гринштейн С. Распределение и функция фосфатидилсерина в клеточных мембранах. Annu Rev Biophys (2010) 39: 407–27. doi:10.1146/annurev.biophys.093008.131234
Полнотекстовая перекрестная ссылка | Google Scholar
12. Лангнер М., Кафизо Д., Марселья С., Маклафлин С. Электростатика фосфоинозитидных двухслойных мембран.Теоретические и экспериментальные результаты. Biophys J (1990) 57(2):335–49. дои: 10.1016/S0006-3495(90)82535-2
Реферат PubMed | CrossRef Полный текст | Google Scholar
14. Маклафлин С. Электростатические потенциалы на границе мембрана-раствор. Curr Top Membr Transp (1977) 9:71–144. дои: 10.1016/S0070-2161(08)60677-2
Полнотекстовая перекрестная ссылка | Google Scholar
15. Йенг Т., Теребизник М., Ю Л., Сильвиус Дж., Абиди В.М., Филипс М. и соавт.Активация рецептора изменяет потенциал внутренней поверхности во время фагоцитоза. Science (2006) 313(5785):347–51. doi:10.1126/наука.1129551
Полнотекстовая перекрестная ссылка | Google Scholar
16. Heo WD, Inoue T, Park WS, Kim ML, Park BO, Wandless TJ, et al. Липиды PI(3,4,5)P3 и PI(4,5)P2 нацеливают белки с многоосновными кластерами на плазматическую мембрану. Science (2006) 314(5804):1458–61. doi:10.1126/наука.1134389
Реферат PubMed | CrossRef Полный текст | Google Scholar
17.Саламон Р.С., Бэкер Дж.М. PIP3: средство выбора для PI 3-киназ класса I. Bioessays (2013) 35(7):602–11. doi:10.1002/bies.201200176
Полнотекстовая перекрестная ссылка | Google Scholar
18. Kim J, Shishido T, Jiang X, Aderem A, McLaughlin S. Фосфорилирование, высокая ионная сила и кальмодулин изменяют связывание MARCKS с фосфолипидными везикулами. J Biol Chem (1994) 269(45):28214–9.
Реферат PubMed | Google Scholar
20. Ходжкин А.Л., Хаксли А.Ф.Количественное описание мембранного тока и его приложение к проводимости и возбуждению в нерве. J Physiol (1952) 117(4):500–44. doi:10.1113/jphysiol.1952.sp004764
Полнотекстовая перекрестная ссылка | Google Scholar
22. Раз А., Перуанский М. Глава 7 – Физиология центральной нервной системы: нейрофизиология. В: Hemmings HC, Egan TD, редакторы. Фармакология и физиология анестезии . Филадельфия: W.B. Сондерс (2013). п. 103–22.
Академия Google
23.Хэмилл О.П., Марти А., Неэр Э., Сакманн Б., Сигуорт Ф.Дж. Усовершенствованные методики «заплатки-зажима» для записи тока с высоким разрешением от клеток и бесклеточных мембранных заплат. Pflugers Arch (1981) 391 (2): 85–100. дои: 10.1007/BF00656997
Реферат PubMed | CrossRef Полный текст | Google Scholar
24. Аоно О., Оки С. Происхождение потенциала покоя мембраны аксона. J Theor Biol (1972) 37(2):273–82. дои: 10.1016/0022-5193(72)-7
Полнотекстовая перекрестная ссылка | Google Scholar
25.Оки С. Мембранный потенциал, поверхностный потенциал и ионная проницаемость. Phys Lett A (1979) 75(1):149–52. дои: 10.1016/0375-9601(79)-4
Полнотекстовая перекрестная ссылка | Google Scholar
27. Льюис Р.С., Кахалан, М.Д. Подмножественная экспрессия калиевых каналов в развивающихся мышиных Т-лимфоцитах. Science (1988) 239 (4841 Pt 1): 771–5. doi:10.1126/наука.2448877
Полнотекстовая перекрестная ссылка | Google Scholar
28. Лоней П., Ченг Х., Сриватсан С., Пеннер Р., Флейг А., Кинет Дж. П.TRPM4 регулирует колебания кальция после активации Т-клеток. Science (2004) 306 (5700): 1374–7. doi:10.1126/наука.1098845
Реферат PubMed | CrossRef Полный текст | Google Scholar
30. Badou A, Jha MK, Matza D, Mehal WZ, Freichel M, Flockerzi V, et al. Критическая роль β-регуляторных субъединиц Cav-каналов в функции Т-лимфоцитов. Proc Natl Acad Sci U S A (2006) 103(42):15529–34. doi:10.1073/pnas.0607262103
Полнотекстовая перекрестная ссылка | Google Scholar
31.Сюй С, Лоу Л.М. Влияние асимметричных поверхностных потенциалов на внутримембранное электрическое поле, измеренное с помощью чувствительных к напряжению красителей. Biophys J (2003) 84(4):2768–80. дои: 10.1016/S0006-3495(03)75081-4
Реферат PubMed | CrossRef Полный текст | Google Scholar
32. Lee S-J, Song Y, Baker NA. Моделирование молекулярной динамики асимметричных растворов NaCl и KCl, разделенных двойными слоями фосфатидилхолина: падение потенциала и структурные изменения, вызванные сильными взаимодействиями Na+-липид и эффектами конечного размера. Biophys J (2008) 94(9):3565–76. doi:10.1529/biophysj.107.116335
Реферат PubMed | CrossRef Полный текст | Google Scholar
33. Гуртовенко А.А., Ваттулайнен И. Липидная трансмембранная асимметрия и собственный мембранный потенциал: две стороны одной медали. J Am Chem Soc (2007) 129(17):5358–9. дои: 10.1021/ja070949m
Полнотекстовая перекрестная ссылка | Google Scholar
35. Zaydman MA, Silva JR, Delaloye K, Li Y, Liang H, Larsson HP, et al. Кв7.1 ионные каналы нуждаются в липидах, чтобы связать определение напряжения с открытием пор. Proc Natl Acad Sci U S A (2013) 110(32):13180–5. doi:10.1073/pnas.1305167110
Реферат PubMed | CrossRef Полный текст | Google Scholar
36. Зайдман М.А., Цуй Дж. Регуляция PIP2 каналов KCNQ: биофизические и молекулярные механизмы липидной модуляции потенциал-зависимого стробирования. Фронт Физиол (2014) 5:195. doi:10.3389/fphys.2014.00195
Реферат PubMed | CrossRef Полный текст | Google Scholar
37.Лонг С.Б., Тао X, Кэмпбелл Э.Б., Маккиннон Р. Атомная структура потенциалзависимого канала К+ в среде, подобной липидной мембране. Природа (2007) 450 (7168): 376–82. дои: 10.1038/природа06265
Реферат PubMed | CrossRef Полный текст | Google Scholar
39. Zhou Y, Wong CO, Cho KJ, van der Hoeven D, Liang H, Thakur DP, et al. Трансдукция сигнала. Мембранный потенциал модулирует динамику фосфолипидов плазматической мембраны и передачу сигналов K-Ras. Наука (2015) 349(6250):873–6.doi:10.1126/science.aaa5619
Полнотекстовая перекрестная ссылка | Google Scholar
40. Zilly FE, Halemani ND, Walrafen D, Spitta L, Schreiber A, Jahn R, et al. Ca2+ индуцирует кластеризацию мембранных белков в плазматической мембране посредством электростатических взаимодействий. EMBO J (2011) 30(7):1209–20. doi:10.1038/emboj.2011.53
Реферат PubMed | CrossRef Полный текст | Google Scholar
41. Honigmann A, van den Bogaart G, Iraheta E, Risselada HJ, Milovanovic D, Mueller V, et al.Фосфатидилинозитол-4,5-бисфосфатные кластеры действуют как молекулярные маяки для рекрутирования везикул. Nat Struct Mol Biol (2013) 20(6):679–86. doi:10.1038/nsmb.2570
Реферат PubMed | CrossRef Полный текст | Google Scholar
43. Wang YH, Collins A, Guo L, Smith-Dupont KB, Gai F, Svitkina T, et al. Индуцированное двухвалентными катионами образование кластеров полифосфоинозитидами в модельных мембранах. J Am Chem Soc (2012) 134(7):3387–95. дои: 10.1021/ja208640t
Реферат PubMed | CrossRef Полный текст | Google Scholar
45.Милованович Д., Платен М., Юниус М., Дидерихсен У., Шаап И.А., Хонигманн А. и соавт. Кальций способствует образованию мезомасштабных доменов синтаксин-1 через фосфатидилинозитол-4,5-бисфосфат. J Biol Chem (2016) 291(15):7868–76. дои: 10.1074/jbc.M116.716225
Реферат PubMed | CrossRef Полный текст | Google Scholar
46. Perez-Lara A, Thapa A, Nyenhuis SB, Nyenhuis DA, Halder P, Tietzel M, et al. PtdInsP2 и PtdSer совместно захватывают синаптотагмин-1 на плазматической мембране в присутствии кальция. Элиф (2016) 5:e15886. doi:10.7554/eLife.15886
Реферат PubMed | CrossRef Полный текст | Google Scholar
47. Гк Ю.Б., Герстман Б.С., Стахелин Р.В., Чапагаин П.П. Гексамер белка VP40 вируса Эбола усиливает кластеризацию липидов PI(4,5)P2 в плазматической мембране. Phys Chem Chem Phys (2016) 18(41):28409–17. дои: 10.1039/C6CP03776C
Реферат PubMed | CrossRef Полный текст | Google Scholar
48. Xu C, Gagnon E, Call ME, Schnell JR, Schwieters CD, Carman CV, et al.Регуляция активации Т-клеточного рецептора за счет динамического мембранного связывания цитоплазматического мотива на основе тирозина CD3-эпсилон. Cell (2008) 135(4):702–13. doi:10.1016/j.cell.2008.09.044
Реферат PubMed | CrossRef Полный текст | Google Scholar
49. Чжан Х., Кордоба С.П., Душек О., ван дер Мерве П.А. Основные остатки в цитоплазматическом домене дзета Т-клеточного рецептора опосредуют ассоциацию с мембраной и модулируют передачу сигналов. Proc Natl Acad Sci U S A (2011) 108(48):19323–8.doi:10.1073/pnas.1108052108
Полнотекстовая перекрестная ссылка | Google Scholar
51. Dobbins J, Gagnon E, Godec J, Pyrdol J, Vignali DA, Sharpe AH, et al. Связывание цитоплазматического домена CD28 с плазматической мембраной ингибирует рекрутирование Lck и передачу сигналов. Sci Signal (2016) 9 (438): ra75. doi:10.1126/scisignal.aaf0626
Реферат PubMed | CrossRef Полный текст | Google Scholar
52. Guo X, Yan C, Li H, Huang W, Shi X, Huang M, et al. Липидзависимая конформационная динамика лежит в основе функциональной универсальности Т-клеточного рецептора. Cell Res (2017) 27(4):505–25. doi:10.1038/cr.2017.42
Реферат PubMed | CrossRef Полный текст | Google Scholar
54. Ma Y, Yamamoto Y, Nicovich PR, Goyette J, Rossy J, Gooding JJ, et al. Датчик FRET позволяет проводить количественные измерения заряда мембран в живых клетках. Nat Biotechnol (2017) 35(5):481. doi: 10.1038/nbt0517-481e
Полнотекстовая перекрестная ссылка | Google Scholar
57. Bettini ML, Guy C, Dash P, Vignali KM, Hamm DE, Dobbins J, et al.Мембранная ассоциация сигнального домена CD3-эпсилон необходима для оптимального развития и функционирования Т-клеток. J Immunol (2014) 193(1):258–67. doi:10.4049/jиммунол.1400322
Полнотекстовая перекрестная ссылка | Google Scholar
58. Фернандес Р.А., Ю.С., Кармо А.М., Эванс Э.Дж., Ван дер Мерве П.А., Дэвис С.Дж. Что контролирует фосфорилирование Т-клеточных рецепторов? Cell (2010) 142(5):668–9. doi:10.1016/j.cell.2010.08.018
Полнотекстовая перекрестная ссылка | Google Scholar
59.Шах Н.Х., Ван К., Ян К., Карандур Д., Кадлечек Т.А., Фаллахи И.Р. и др. Механизм электростатической селекции контролирует последовательную передачу сигналов киназы ниже Т-клеточного рецептора. Элайф (2016) 5:e20105. doi:10.7554/eLife.20105
Реферат PubMed | CrossRef Полный текст | Google Scholar
60. Li L, Guo X, Shi X, Li C, Wu W, Yan C, et al. Ионное взаимодействие CD3-Lck регулирует инициацию передачи сигналов Т-клеточного рецептора. Proc Natl Acad Sci U S A (2017) 114(29):E5891–9.doi:10.1073/pnas.17019
Полнотекстовая перекрестная ссылка | Google Scholar
61. Chang VT, Fernandes RA, Ganzinger KA, Lee SF, Siebold C, McColl J, et al. Инициация передачи сигналов Т-клетками сегрегацией CD45 при «близких контактах». Nat Immunol (2016) 17(5):574–82. дои: 10.1038/ni.3392
Полнотекстовая перекрестная ссылка | Google Scholar
62. Shi X, Bi Y, Yang W, Guo X, Jiang Y, Wan C, et al. Ca2+ регулирует активацию рецепторов Т-клеток, модулируя свойства заряда липидов. Природа (2013) 493(7430):111–5. дои: 10.1038/природа11699
Реферат PubMed | CrossRef Полный текст | Google Scholar
63. Ma Y, Pandzic E, Nicovich PR, Yamamoto Y, Kwiatek J, Pageon SV, et al. Межмолекулярный датчик FRET определяет динамику кластеризации Т-клеточных рецепторов. Nat Commun (2017) 8:15100. дои: 10.1038/ncomms15100
Реферат PubMed | CrossRef Полный текст | Google Scholar
64. Pageon SV, Tabarin T, Yamamoto Y, Ma Y, Bridgeman JS, Cohnen A, et al.Функциональная роль нанокластеров Т-клеточных рецепторов в инициации сигнала и дискриминации антигена. Proc Natl Acad Sci USA (2016) 113(37):E5454–63. doi:10.1073/pnas.1607436113
Реферат PubMed | CrossRef Полный текст | Google Scholar
65. Park MJ, Sheng R, Silkov A, Jung DJ, Wang ZG, Xin Y, et al. Домены Sh3 служат липид-связывающими модулями для pTyr-сигнальных белков. Mol Cell (2016) 62(1):7–20. doi:10.1016/j.molcel.2016.01.027
Реферат PubMed | CrossRef Полный текст | Google Scholar
66.Акуто О., Мишель Ф. Ко-стимуляция, опосредованная CD28: количественная поддержка передачи сигналов TCR. Nat Rev Immunol (2003) 3(12):939–51. дои: 10.1038/nri1248
Полнотекстовая перекрестная ссылка | Google Scholar
69. Le Floc’h A, Tanaka Y, Bantilan NS, Voisinne G, Altan-Bonnet G, Fukui Y, et al. Кольцевое накопление PIP3 контролирует архитектуру актина и модулирует цитотоксичность в иммунологическом синапсе. J Exp Med (2013) 210(12):2721–37. doi:10.1084/jem.20131324
Реферат PubMed | CrossRef Полный текст | Google Scholar
70.Quann EJ, Merino E, Furuta T, Huse M. Локализованный диацилглицерин управляет поляризацией центра организации микротрубочек в Т-клетках. Nat Immunol (2009) 10(6):627–35. дои: 10.1038/ni.1734
Полнотекстовая перекрестная ссылка | Google Scholar
71. Hartzell CA, Jankowska KI, Burkhardt JK, Lewis RS. Приток кальция через каналы CRAC контролирует организацию и динамику актина в иммунном синапсе. Элайф (2016) 5:e14850. doi:10.7554/eLife.14850
Реферат PubMed | CrossRef Полный текст | Google Scholar
72.Quann EJ, Liu X, Altan-Bonnet G, Huse M. Каскад изоферментов протеинкиназы C способствует поляризации цитоскелета в Т-клетках. Nat Immunol (2011) 12(7):647–54. дои: 10.1038/ni.2033
Полнотекстовая перекрестная ссылка | Google Scholar
73. Zech T, Ejsing CS, Gaus K, de Wet B, Shevchenko A, Simons K, et al. Накопление плотных липидов в доменах плазматической мембраны Т-клеток, участвующих в передаче сигналов TCR. EMBO J (2009) 28(5):466–76. doi:10.1038/emboj.2009.6
Реферат PubMed | CrossRef Полный текст | Google Scholar
74.Ганьон Э., Шуберт Д.А., Гордо С., Чу Х.Х., Вухерпфенниг К.В. Локальные изменения липидного окружения микрокластеров TCR регулируют связывание мембран цитоплазматическим доменом CD3-эпсилон. J Exp Med (2012) 209(13):2423–39. doi:10.1084/jem.20120790
Полнотекстовая перекрестная ссылка | Google Scholar
75. Fischer K, Voelkl S, Berger J, Andreesen R, Pomorski T, Mackensen A. Распознавание антигена вызывает воздействие фосфатидилсерина на клеточную поверхность CD8+ T-клеток человека. Кровь (2006) 108(13):4094–101.дои: 10.1182/кровь-2006-03-011742
Реферат PubMed | CrossRef Полный текст | Google Scholar
Клеточная мембрана: функции, роль и структура — видео и расшифровка урока
Фосфолипиды
Фосфолипиды составляют основную структуру клеточной мембраны. Одна молекула фосфолипида имеет два разных конца: головной и хвостовой. Головной конец содержит фосфатную группу и является гидрофильным . Это означает, что ему нравятся или привлекают молекулы воды.
Хвостовой конец состоит из двух цепочек атомов водорода и углерода, называемых цепочками жирных кислот . Эти цепи гидрофобны или не любят смешиваться с молекулами воды. Это похоже на то, что происходит, когда вы наливаете растительное масло в воду. Растительное масло не смешивается с водой.
Фосфолипиды клеточной мембраны расположены в виде двойного слоя, называемого липидным бислоем .Гидрофильные фосфатные головки всегда располагаются так, чтобы они находились вблизи воды. Водянистые жидкости находятся как внутри клетки ( внутриклеточная жидкость ), так и вне клетки ( внеклеточная жидкость ). Гидрофобные хвосты мембранных фосфолипидов организованы таким образом, что защищают их от воды.
Холестерин, белки и углеводы
Когда вы слышите слово «холестерол», первое, что вы, вероятно, думаете, это то, что это плохо. Однако на самом деле холестерин является очень важным компонентом клеточных мембран.Молекулы холестерина состоят из четырех колец из атомов водорода и углерода. Они гидрофобны и находятся среди гидрофобных хвостов в липидном бислое.
Молекулы холестерина важны для поддержания консистенции клеточной мембраны. Они укрепляют мембрану, предотвращая пересечение ее небольшими молекулами. Молекулы холестерина также препятствуют контакту и затвердеванию хвостов фосфолипидов. Это гарантирует, что клеточная мембрана остается жидкой и гибкой.
Некоторые белки плазматической мембраны расположены в липидном бислое и называются интегральными белками . Другие белки, называемые периферическими белками , находятся вне липидного двойного слоя. Периферические белки могут быть обнаружены по обе стороны липидного двойного слоя: внутри клетки или вне клетки. Мембранные белки могут функционировать как ферменты для ускорения химических реакций, действовать как рецепторы для определенных молекул или транспортировать материалы через клеточную мембрану.
Иногда обнаруживают, что углеводы или сахара присоединены к белкам или липидам снаружи клеточной мембраны.То есть они находятся только на внеклеточной стороне клеточной мембраны. Вместе эти углеводы образуют гликокаликс.
Гликокаликс клетки выполняет множество функций. Он обеспечивает амортизацию и защиту плазматической мембраны, а также важен для распознавания клеток. Основываясь на структуре и типах углеводов в гликокаликсе, ваше тело может распознавать клетки и определять, должны они там быть или нет. Гликокаликс также может действовать как клей для соединения клеток.
Функции клеточной мембраны
Плазматическая мембрана клетки выполняет две основные функции:
- Является физическим барьером.
- Регулирует обмен материалами с окружающей средой.
Клеточная мембрана важна, поскольку она отделяет и защищает клетку от окружающей среды. Это позволяет внутриклеточным условиям клетки сильно отличаться от внеклеточных условий.Например, нервные клетки в вашем теле будут поддерживать высокую концентрацию калия внутри. Снаружи, во внеклеточной жидкости, очень мало калия и много натрия. Эти различия в концентрации абсолютно необходимы для функции нервных клеток, которая должна посылать сигналы или нервные импульсы.
Структура и свойства клеточной мембраны, такие как наличие гидрофильных внешних областей и гидрофобных внутренних областей, предотвращают попадание многих веществ в клетку или выход из нее. Это хорошо, потому что это означает, что нежелательные материалы случайно не попадут внутрь клетки.Однако многие материалы, такие как питательная глюкоза, должны пересекать клеточную мембрану. Кроме того, отработанные вещества должны выйти из клетки. В противном случае отходы накапливались бы и становились токсичными для клетки.
Клеточная мембрана способна регулировать то, что входит и выходит из клетки. Это называется селективной проницаемостью . Только очень маленькие молекулы, такие как вода, кислород или углекислый газ, могут легко проходить через липидный бислой клеточной мембраны. Любые другие вещества, которые должны пересечь клеточную мембрану, должны пройти через транспортные белки.Эти белки очень специфичны в отношении того, что они транспортируют. Например, в ваших клеточных мембранах есть транспортеры, которые позволяют перемещать только молекулы глюкозы. Есть другие с другой структурой, которые транспортируют только натрий.
Резюме урока
Клеточная мембрана , или плазматическая мембрана, окружает и защищает внутреннюю среду клетки; однако это не единственная его функция.Клеточная мембрана также определяет, какие материалы входят или выходят из клетки. Это гарантирует, что клетки смогут избавиться от отходов и принять важные питательные вещества и газы.
Плазматическая мембрана представляет собой жидкостную мозаику . Это означает, что он гибкий и состоит из множества различных типов молекул. Фосфолипиды образуют основную структуру клеточной мембраны, называемую липидным бислоем. В липидном бислое разбросаны молекулы холестерина , которые помогают поддерживать однородность мембранной жидкости.Мембранные белки важны для транспорта веществ через клеточную мембрану. Они также могут функционировать как ферменты или рецепторы. На стороне внеклеточной жидкости клеточной мембраны вы найдете углеводов . Они помогают клетке распознаваться как определенный тип клетки и важны для удержания клеток вместе.
Результаты обучения
По окончании этого урока вы сможете:
- Определять функции клеточной мембраны
- Опишите четыре типа молекул, из которых состоит клеточная мембрана
- Объясните жидкостно-мозаичную модель клеточной мембраны
Первый взгляд на мембрану живой клетки
Рассеяние нейтронов является ценным методом изучения клеточных мембран, но сигналы от других компонентов клетки, таких как белки, РНК, ДНК и углеводы, могут мешать (слева).Команда из Окриджской национальной лаборатории сделала эти другие компоненты практически невидимыми для нейтронов, объединив определенные уровни тяжелого водорода (дейтерия) с обычным водородом внутри клетки (справа).
The Science
Клеточная мембрана, тонкий двойной слой липидных молекул со встроенными белками, защищает клетку от внешней среды и контролирует перемещение веществ внутрь и наружу клетки. Однако многое в этом тонком двойном слое липидных молекул осталось загадкой, несмотря на обширные исследования.Это произошло из-за сложности наблюдения за живой клеточной мембраной; предыдущие методы, используемые для исследования структуры мембран, такие как рентгеновские лучи и электронные лучи, повреждали мембраны. Впервые используя холодные нейтроны, исследователи непосредственно исследовали мембрану живой клетки в наномасштабе.
The Impact
Используя изотопы для создания внутреннего контраста в живых клетках, ученые определили структуру и толщину мембраны бактерии Bacillus subtilis .Команда также подтвердила существование длинных гипотетических липидных рафтов. Эти плотно упакованные свободно плавающие мембранные липиды и белки считаются жизненно важными для клеточной передачи сигналов. Также считается, что плоты облегчают движение основных биомолекул внутрь и наружу клетки, а также выполняют другие функции. Разработанные методы могут оказаться полезными в производстве сырья для биомассы и биотоплива, где важную роль играют бактерии.
Резюме
Исследование живой клеточной мембраны до сих пор оставалось нерешенной задачей из-за динамической, химически разнообразной и хрупкой природы живых клеток.Слишком маленькие, чтобы их можно было увидеть в традиционный оптический микроскоп, нейтроны появились как решение для изучения живого двойного слоя липидов в наномасштабе без повреждения клетки. Нейтроны можно использовать в качестве зонда для характеристики биологических материалов, потому что пучок нейтронов, рассеянный биологическим образцом, создает структуру, которая зависит от изотопного состава материала и отражает структурное устройство материала. Дейтерий — это изотоп широко распространенного в биологическом веществе атома водорода.Он содержит нейтрон и протон, в отличие от водорода, который содержит один протон, но не содержит нейтрона. Эта, казалось бы, небольшая разница делает замену водорода дейтерием идеальным подходом к изучению мембран и других наноразмерных биологических систем. Клетки воспринимают небольшую разницу между водородом и его изотопом, дейтерием, в то время как изотопы выглядят совершенно по-разному при использовании метода рассеяния нейтронов. Группа исследователей из Окриджской национальной лаборатории (ORNL) ввела достаточное количество дейтерия в мембрану бактерии B.subtilis , чтобы дифференцировать его от других клеточных компонентов. Кроме того, команда настроила определенные пропорции дейтерия и водорода, введя в клетку два типа жирных кислот (молекул, которые составляют мембранные липиды) с уникальным соотношением изотопов. Клетка включала в свою мембрану специфическую смесь жирных кислот, меченных изотопами, и наблюдалось неравномерное распределение липидов, что подтверждало гипотезу липидного рафта. Эти эксперименты отвечают на некоторые из самых давних вопросов биологии, согласуясь с U.Миссия Управления науки Министерства энергетики США по проведению фундаментальных научных исследований для решения некоторых из наиболее насущных проблем нашего времени.
Контакт
PM Контакт
Эми Суэйн, доктор философии.
Менеджер программы
Отдел биологических системных наук
Управление биологических и экологических исследований
Управление науки
Министерство энергетики США
[email protected]
Контактное лицо PI
John Katsaras
katsarasj@orgov
Финансирование
Это исследование спонсировалось Программой направленных исследований и разработок (грант 6988) Окриджской национальной лаборатории (ORNL), управляемой UT-Battelle, LLC, для Министерства энергетики США (DOE) по контракту DE-AC05-00OR22725. Поддержка Дж.К. был предоставлен Управлением науки, фундаментальных энергетических наук, Отделом научных пользовательских объектов Министерства энергетики США, а для RFS — Управлением науки, биологических исследований и исследований окружающей среды Министерства энергетики (грант ERKP-851).В этом исследовании использовались ресурсы вычислительного центра Oak Ridge Leadership Computing Facility в ORNL при поддержке Управления науки Министерства энергетики США, Управления перспективных научных вычислительных исследований, Отдела оборудования. Малоугловое рассеяние нейтронов было выполнено в ORNL с использованием прибора Bio-SANS на высокопоточном изотопном реакторе при поддержке Управления науки Министерства энергетики, Управления биологических и экологических исследований, Отдела биологических систем, через Центр структурной молекулярной биологии ORNL. , а также дифрактометр малоуглового рассеяния нейтронов с расширенным Q-диапазоном на источнике нейтронов расщепления, поддерживаемый Управлением науки Министерства энергетики, фундаментальными энергетическими науками, научным отделом пользователей (грант ERKP-SNX).
Публикации
Дж. Д. Никелс, С. Чаттерджи, С. Б. Стэнли, С. Цянь, С. Ченг, Д.А.А. Майлз, Р.Ф. Стандарт, Дж.Г. Элкинс и Дж. Катсарас, «Структура биологических мембран in vivo и доказательства существования липидных доменов». PLoS Biology 5, 15 (2017). [DOI: 10.1371/journal.pbio.2002214]
Ссылки по теме
Пресс-релиз Окриджской национальной лаборатории: Нейтроны дают первый наноразмерный взгляд на мембрану живой клетки Исполнитель/объект: Лаборатория DOE, Пользовательские объекты SC, Пользовательские объекты ASCR, OLCF, Пользовательские объекты BES, HFIR, SNS
мембран
мембран МембраныНапомним, что фосфолипиды имеют гидрофобный конец и гидрофильный конец и что при помещении в воду они будут ориентироваться соответственно (5.11 стр. 79). Это основа плазматической мембраны клетка. Клеточная мембрана состоит из двойного слоя фосфолипидов с внедренными белки. Мы ссылаемся на современную концептуальную модель клеточной мембраны. как модель «жидкой мозаики», поскольку фосфолипиды могут перемещаться по поверхности мембраны (жидкости) и белков много и разнообразный (мозаичный) (5.12).
присоединены к некоторым белкам и некоторым фосфолипидам являются олигосахаридами (короткими полисахаридами). Когда белок содержит олигосахарид присоединенный к нему называется гликопротеином.Гликолипиды – это фосфолипиды с добавлены сахарные цепочки. Эти олигосахариды находятся снаружи мембраны и используются в межклеточном распознавании. Они различаются среди видов, среди особей и внутри особей.
Мембранные белки могут выполнять ряд функций, таких как как транспортные белки, ферменты (подробнее об этом позже), рецепторы, адгезия клеток, прикрепление к цитоскелету. (5.13)
Самое главное в мембранах то, что они регулируют то, что входит и выходит из клетки.Мембрана избирательно проницаема потому что вещества не пересекают его без разбора.
Некоторые молекулы, такие как углеводороды и кислород, могут пересекать мембрана. Многие большие молекулы (такие как глюкоза и другие сахара) не могут. Вода может проходить между липидами. Ионы, такие как H+ или Na+, не могут.
Транспортные белки обеспечивают прохождение молекул и ионы, которые не смогли бы пройти через простой бислой фосфолипидов. Некоторые транспортные белки имеют гидрофильный туннель, который позволяет полярная молекула или ионы для прохождения.Другие на самом деле связываются с молекулами и перемещать их по мембране. В любом случае транспортные белки очень конкретный.
Пассивный транспорт
Диффузия и осмос
Диффузия – это тенденция молекул любого вещества развернуться на доступном пространстве. Хотя каждая молекула движется случайным образом распространение часто бывает направленным, поскольку молекулы движутся от области с высокой концентрацией в область с меньшей концентрацией. Это называется переезд вдоль (или вниз) градиента концентрации.Это не требует затрат энергии и когда это происходит через клеточную мембрану, это называется пассивным транспортом. Многие вещества перемещаются через клеточные мембраны до тех пор, пока не будет достигнута равная концентрация по обе стороны. (5.14)
Осмос является частным случаем диффузии. (5.15) Во-первых, представьте себе полупроницаемую мембрану, пропускающую воду но сохраняется в растворенных молекулах (называемых растворенными веществами). Во-вторых, представьте, что концентрация растворенных веществ в воде больше на одной стороне этой мембраны, чем на другой.Растворенные вещества не могут перемещаться с одной стороны на другой из-за мембраны. А вода может.
Помните, что молекулы, как правило, выходят из областей с высокой концентрации в области с низкой концентрацией самостоятельно. Рассмотрим воду по обе стороны от мембраны. Одна сторона мембраны имеет много растворенных веществ и меньше воды по сравнению с другими сторона, которая имеет несколько растворенных веществ и больше воды. Вода будет двигаться вниз по его градиент концентрации. Он будет двигаться со стороны мембраны с с низким содержанием растворенных веществ (относительно более высокая концентрация воды) в область с высоким растворенные вещества (относительно более низкая концентрация воды).Это известно как осмос.Немного терминологии:
— Раствор с высокой концентрацией растворенных веществ считается ГИПЕРТОНИЧНЫМ по отношению к раствору с низкой концентрацией растворенных веществ. (в классе я использовал аналогичный термин гиперосмотический. То же самое.)— ГИПОТОНИЧНЫЙ раствор имеет относительно более низкую концентрацию растворов.
—Растворы равных концентраций называются изотоническими. Эти термины являются относительными терминами.
Пара тонкостей. 1) Хотя это легко представить что области с высокой концентрацией растворенных веществ являются областями с низкой концентрацией воды, растворенные вещества не так сильно влияют на концентрацию воды.Они делают, однако влияет на количество «свободной» воды, которая не плотно сгруппирована вокруг растворенные вещества. Я думаю, что на рис. 5.15b это довольно хорошо показано. 2) Это не независимо от того, какие типы растворенных веществ находятся по обе стороны мембраны. Мы обеспокоены с концентрацией воды, в конце концов. Это то, что движется.Осморегуляция
Осморегуляция – контроль водного баланса (5.16). Клетке в изоосмотической среде не о чем беспокоиться, вода входит и уходит вода с одинаковой скоростью.Но предположим, что эта ячейка находится в гиперосмотический раствор. Вода выйдет из клетки, оставив после себя сморщенный ячейка вверх. Это не хорошо для клетки. В растительных клетках плазматическая мембрана фактически сжимается от стенки (так называемый плазмолиз) и клетка умирает. Если клетку поместить в гипоосмотический раствор, вода хочет получить внутри. Это тоже нехорошо, по крайней мере, для животных клеток. Растительные клетки имеют клеточные стенки, которые сдерживают давление поступающей воды. Они используют это давление, чтобы клетки оставались набухшими, что помогает обеспечить механическую поддержку завода.
Облегченная диффузия.
Облегченная диффузия – это процесс, посредством которого растворенные вещества диффундируют через мембраны, через которые они обычно не проходят сами по себе. Они проходят с помощью транспортных белков. (5.17) Транспортные белки являются «субстрат-специфичными», что означает, что они = ре настроены для транспортировки только определенных молекул или ионов и блокирования остальных. Как и при «обычной» диффузии, растворенные вещества движутся по градиенту концентрации.
Диффузия, осмос и облегченная диффузия являются пассивными означает получить вещи через мембрану.Есть энергоемкие средства также. Они подпадают под рубрику активного транспорта.
Активный транспорт
Активный транспорт использует энергию клетки для перемещения веществ против их градиентов концентрации. Содержимое клетки обычно отличается из окрестностей. Активный транспорт является средством, с помощью которого это поддерживается. Транспортные белки выполняют эту работу. Например, натриево-калиевый насос. используется для передачи нервных импульсов. Используя АТФ в качестве источника энергии, специальные транспортные белки перемещают Na+ из клетки и K+ внутрь клетки.(5.18 показывает гипотетический пример и роль фосфата из АТФ)
Экзоцитоз и эндоцитоз
Действительно большие вещества (например, белки и полисахариды) не входит и не выходит из клетки, проходя через мембрану. экзоцитоз процесс, при котором большие молекулы покидают клетку. Везикулы изнутри сливаются с плазматической мембраной и освобождают свое содержимое. В эндоцитозе плазматическая мембрана образует везикулу вокруг частицы. Примеры экзоцитоза: Секреторные клетки поджелудочной железы экспортируют инсулин, нервные клетки выделяют химический сигналы через синапс, растения образуют клеточные стенки.
Эндоцитоз можно разделить на три типа. Фагоцитоз, пиноцитоз и эндоцитоз, опосредованный рецепторами. Фагоцитоз – это поглощение процесс, о котором мы уже говорили. При пиноцитозе клетка «глотает» по капле окружающей жидкости. (5.19 а и б) Опосредованный рецептором эндоцитоз (часть 3 5.19c) аналогична, за исключением внешней части ячейки, которая получает втягивается имеет специфические рецепторы, которые связываются только с определенными веществами. Это позволяет клетке вводить только то вещество, которое она хочет, часто в гораздо более высокой концентрации, чем окружающая жидкость.(сравните это с пиноцитоз).
Плазменная мембрана-клеточная стенка Контакты1 | Физиология растений
В простейшем смысле клеточные стенки представляют собой углеводные и белковые структуры, окружающие и разделяющие клетки. Возможно, наиболее знакомыми структурами клеточных стенок являются пробка и дерево, где клеточная стенка остается после деградации клеток внутри. Хлопок, волокно, которое удерживает некоторых из нас в нашем сложном мире, также является типом клеточной стенки. Это специализированные примеры, и ясно, что живые клетки динамически взаимодействуют с окружающей их стенкой и друг с другом, возможно, через стенку.Этот внеклеточный матрикс (ECM) может влиять почти на все аспекты клеточной функции просто из-за его положения и физических свойств. По этой причине многие размышляли о его роли в развитии растений и реакции на внешний мир. Рост клеток может происходить во многих измерениях, таких как поляризованное расширение кончика пыльцевой трубки, создание удлиненных клеток, характерных для многих вегетативных тканей, или даже расположение клеток на поверхности листа в виде пилы.Поскольку эти клетки расширяются регулируемым образом, они обязательно должны модифицировать и увеличивать свой внеклеточный матрикс, чтобы обеспечить последующее увеличение объема, но считается, что клеточная стенка, заложенная той же самой или соседней клеткой, также может влиять на этот процесс. В настоящее время наше понимание этих процессов весьма ограничено.
Хотя до сих пор нет прямых ответов на вопрос о том, как функционирует клеточная стенка в развитии и реакциях растений, в последнее время были достигнуты некоторые успехи в понимании того, какие молекулы могут быть задействованы и как они могут взаимодействовать друг с другом и с клетками.Для того чтобы клеточные стенки и клетки могли влиять друг на друга, обязательно должен быть контакт, и, хотя существуют многочисленные потенциальные взаимодействия на границе раздела плазматическая мембрана-клеточная стенка, это эссе будет сосредоточено на прямых физических связях, которые, как известно, происходят между плазматической мембраной. и ECM у покрытосеменных растений. Недавние обзоры описывают другие компоненты клеточных стенок и их роль в размножении и развитии растений, а также роль химических модификаций в ответ на воздействие окружающей среды (Carpita and Gibeaut, 1993; Showalter, 1993; Reiter, 1994; Cosgrove, 1997).Возникает идея, что клеточная стенка покрытосеменных — это больше, чем экзоскелет; это также динамический субстрат для взаимодействующих клеток.
ЧТО ТАКОЕ КЛЕТОЧНАЯ СТЕНКА?
Клеточная стенка была описана как комплекс углеводов и белков, который секретируется клеткой и, по-видимому, представляет собой непрерывный матрикс, образующий каркас и субстрат для клеток внутри ткани (Roberts, 1990). Простейшая интерпретация многих исследований стенки предсказывает наличие упорядоченного массива микрофибрилл целлюлозы, покрытых гемицеллюлозой.Эта матрица заключена в гель пектина, и каким-то образом внутри этого устройства находятся белки с различным количеством связанных углеводов (Reiter, 1994; Cosgrove, 1997; рис. 1). На эту матрицу можно наносить лигнины и другие органические соединения для придания механической прочности и жесткости (Reiter, 1994).Рис. 1.
Схематическое изображение сборки первичной клеточной стенки и структуры между двумя соседними клетками. Целлюлоза синтезируется и секретируется комплексом целлюлозсинтаз (CSA) на плазматической мембране и образует пучок кристаллических микрофибрилл (черные нити; целлюлоза).Синтаза целлюлозы может быть связана с цитоплазматической синтазой сахарозы (SUSY), которая обеспечивает сахара для синтеза полимера. Пектин (красные столбики) и гемицеллюлоза (оранжевые кружочки) синтезируются и секретируются через эндомембранную систему и образуют комплексы с целлюлозой в ВКМ. Как координируется синтез стенки между двумя соседними клетками и между целлюлозосинтазой и эндомембранной системой, неизвестно.
Рис. 1.
Схематическое изображение сборки первичной клеточной стенки и структуры между двумя соседними клетками.Целлюлоза синтезируется и секретируется комплексом целлюлозсинтаз (CSA) на плазматической мембране и образует пучок кристаллических микрофибрилл (черные нити; целлюлоза). Синтаза целлюлозы может быть связана с цитоплазматической синтазой сахарозы (SUSY), которая обеспечивает сахара для синтеза полимера. Пектин (красные столбики) и гемицеллюлоза (оранжевые кружочки) синтезируются и секретируются через эндомембранную систему и образуют комплексы с целлюлозой в ВКМ. Как координируется синтез стенки между двумя соседними клетками и между целлюлозосинтазой и эндомембранной системой, неизвестно.
Клеточные стенки подразделяются на первичные и вторичные. Первичная стенка закладывается во время деления и расширения клеток, а материал, откладывающийся на первичной стенке после прекращения роста, называется вторичной стенкой (Cosgrove, 1997). Для простоты и поскольку многие динамические взаимодействия обнаруживаются в расширяющихся клетках, обсуждение интерфейса плазматическая мембрана-стенка будет ограничено первичной клеточной стенкой.
Многие отождествляют клеточную стенку растений с ВКМ многоклеточных животных, и действительно, эти термины часто используются взаимозаменяемо (Roberts, 1990; Carpita and Gibeaut, 1993).Хотя клеточная стенка имеет радикально отличный состав от внеклеточного матрикса многоклеточных животных, они играют сходные роли; с одной стороны можно было бы приравнять древесину к хрящам, а первичные клеточные стенки к базальным мембранам. Определение клеточной стенки представляет собой битву с семантикой и поднимает некоторые важные вопросы. До недавнего времени клеточная стенка считалась по большей части экзоскелетом из белков и углеводов, который секретируется собственной клеткой или соседней клеткой. Таким образом, клетка определяет свое непосредственное окружение и форму.К ВКМ многоклеточных животных больше подходят с точки зрения того, что ВКМ представляет собой углеводный субстрат, который влияет на поведение окружающей среды через рецепторы и модифицирующие белки (Bissell and Nelson, 1999). Возможно, наиболее экономный взгляд на клеточную стенку будет охватывать оба взгляда (Roberts, 1990). В простом рабочем определении клеточной стенки можно было бы рассматривать ее как углеводную матрицу, обеспечивающую динамический каркас, с которым ассоциируется множество других углеводов и белков. Являются ли эти углеводы и белки компонентами «клеточной стенки» — это только вопрос определения, и часто трудно различить, являются ли они структурными или регуляторными, или и тем, и другим.
КОМПОНЕНТЫ КЛЕТОЧНОЙ СТЕНКИ
Углеводы
Первичная клеточная стенка покрытосеменных растений частично формируется за счет упорядоченной секреции 1-4-связанных полимеров β-d-глюкозы ассоциированными с плазматической мембраной целлюлозосинтазами (Amor et al., 1995; Pear et al., 1996). . Эти полимеры сплетены вместе в линейные пучки целлюлозных волокон, которые имеют средний диаметр 7 нм и, как считается, образуют жидкокристаллический массив.
Гемицеллюлоза — это термин, используемый для описания семейства полимеров с высоким содержанием глюкозы, ксилозы или арабинозы, которые, в отличие от целлюлозы, имеют обширные боковые цепи, часто включающие ксилозу, галактозу и фукозу.Двудольные и однодольные существенно различаются по составу гемицеллюлозы, и подробные описания можно найти в ряде обзоров (Carpita and Gibeaut, 1993; Reiter, 1994; Cosgrove, 1997). Структура гемицеллюлозы позволяет этим сложным сахарам лежать вдоль поверхности и, возможно, интеркалировать внутри пучков целлюлозы, обеспечивая связанную матрицу. Гемицеллюлозы секретируются через эндомембранную систему (рис. 1). Как координируются секреция гемицеллюлозы и синтез целлюлозы, неизвестно, но это может быть важно для определения локализованной архитектуры стенки и ее взаимодействия с клеткой.
Пектины представляют собой семейство полигалактуроновых кислот, которые могут различаться по своим боковым цепям, обычно арабинозе, галактозе или сложному разветвленному расположению моносахаридов (Cosgrove, 1997). Пектины также секретируются через эндомембранную систему, так что они могут образовывать желеобразную матрицу, интеркалированную структурой целлюлозы/гемицеллюлозы (Carpita and Gibeaut, 1993). Обилие отрицательных зарядов на пектинах делает возможной опосредованную Са 2+ сшивку, которую можно регулировать путем маскирования отрицательных зарядов пектина путем добавления метиловых эфиров.Антитела, направленные либо на пектин, либо на метилэтерифицированный пектин, обнаруживают эпитопы, которые неравномерно распределены в различных тканях, включая пыльцевые трубки, что свидетельствует о том, что эта модификация может иметь регуляторную функцию (Knox, 1997). Когда пыльца контактирует с рыльцем, происходит быстрое расширение мембраны на кончике пыльцы, и продолжающийся рост кончика коррелирует с деэстерификацией и перекрестным связыванием Ca 2+ пектинов по периферии растущего кончика. Сшивание приводит к увеличению жесткости латеральной пектиновой матрицы пыльцевой трубки, что позволяет расширять только кончик (Yang, 1999).Аналогичные модели предлагаются для роста корневых волосков (Wen et al., 1999). Ничего не известно о том, как координируются синтез целлюлозы и секреция пектинов, хотя их соответствующие матрицы могут существовать независимо (Roberts, 1990).
Белки
Традиционно белки «клеточной стенки» классифицируют по их связи с одним или несколькими сложными углеводами, секретируемыми растительными клетками. К ним относятся обильные гидрокси-Pro-богатые гликопротеины (HRGPs; Showalter, 1993), Pro-богатые белки (Showalter, 1993), Gly-богатые белки (GRPs, Keller 1993), арабиногалактановые белки (AGPs; Oxley and Bacic, 1999; Majewska-Sawka and Nothnagel, 2000), ассоциированные со стенкой киназы (WAKs; He et al., 1996, 1999), лектины (Herve et al., 1999) и экспансины (Cosgrove, 1997). Но список гораздо шире и включает в себя пероксидазы, метилтрансферазы, галактозидазы, гликаназы и протеазы, и это лишь некоторые из них (Showalter, 1993). Анализ информации о геноме и детальный анализ геля (Robertson et al., 1997), вероятно, дадут исчерпывающий список дополнительных белков клеточной стенки. Возможно, не будет полезным присвоить белку честь быть компонентом «клеточной стенки», а скорее иметь дело с этим большим классом секретируемых белков с функциональной точки зрения.В самом деле, возможно, лучшим примером является белок-лиганд SCR для рецепторных киназ, которые регулируют самонесовместимость у Brassica sp. (Шопфер и др., 1999). SCR секретируется пыльцевым зерном и находится на его поверхности, чтобы представить его рецептору на плазматической мембране стигмальных клеток. SCR находится на поверхности пыльцы и, таким образом, находится в непосредственном контакте с клеточной стенкой пыльцы и является ее частью, но является ли он белком «клеточной стенки»? Также важно помнить, что недавние методы быстрого замораживания показывают, что расстояния между плазматической мембраной и внеклеточным матриксом на самом деле меньше, чем наблюдалось ранее (Roberts, 1990), так что белки могут хорошо проникать в углеводную матрицу и, возможно, даже связываться с белками или углеводами на другой клеточной поверхности.Можно также включить в обсуждение клеточных стенок многочисленные рецепторные киназы на плазматической мембране (Kohorn, 1999). Примером может служить рецептор CLAVATA 1 (Trotochaud et al., 1999) в нижнем слое меристемы, который влияет на идентичность и пролиферацию клеток. Белок CLAVATA 3 секретируется самым верхним слоем меристемы (Fletcher et al., 1999) и постулируется, что он связывает CLAVATA 1 и служит лигандом.
Чтобы избежать исключения многих интересных белков, было бы лучше называть углеводы клеточной стенкой и рассматривать белки как влиятельных посетителей.Похоже, именно такой точки зрения придерживаются при изучении большинства других царств (Bissell and Nelson, 1999). Тогда уместным здесь становится вопрос, какие посетители имеют влияние, которое требует контакта как с плазматической мембраной, так и с внеклеточным углеводом.
ПЛАЗМЕННО-МЕМБРАННЫЙ ИНТЕРФЕЙС
Физические связи между клеточной стенкой и плазматической мембраной наблюдались несколькими способами. Большинство электронных микрофотографий показывают, что плазматическая мембрана прижата к внеклеточному материалу, и, таким образом, они, по-видимому, находятся в прямом контакте (Roberts, 1990).Предполагается, что за эту апрессию ответственно тургорное давление, поскольку нарушение тургора осмотическим шоком вызывает плазмолиз и приводит к отделению мембраны от клеточной стенки. В большинстве клеток это разделение достаточно полное, хотя репрессированные области остаются, и их частота может увеличиваться в адаптированных к соли культивируемых клетках (Carpita and Gibeaut, 1993). Плазмолизированные клетки имеют тонкие остаточные тяжи мембраны, которые простираются от спавшейся плазматической мембраны до клеточной стенки, которые были названы гехтовскими тяжами (Roberts, 1990).Остается определить, действительно ли это участки плазмодесм, образующих цитоплазматические проходы между клетками (см. ниже; Crawford and Zambryski, 1999), но тот факт, что они встречаются на наружных стенках эпидермиса, делает это менее вероятным. Природа контактных участков ни в гехтианских нитях, ни в контактах, индуцированных солью, неизвестна, хотя они были названы «сайтами адгезии». Термин адгезия вызывает гомологию со сходными сайтами в клетках многоклеточных животных, где интегрины и сходные рецепторы связываются с ECM.Эти сайты адгезии сгруппированы в островки, которые связаны с регуляторными киназами, их лигандами и цитоскелетом (Bissell and Nelson, 1999). У покрытосеменных до сих пор нет убедительных доказательств наличия таких островков, несмотря на многочисленные попытки идентифицировать такие участки (Carpita, Gibeaut, 1993; Canut et al., 1998; Laval et al., 1999). Парадоксально и, возможно, наиболее уместно то, что их численность у многоклеточных животных сильно преувеличена в культивируемых клетках и весьма диффузна, если не редка, в реальных тканях (Bissell and Nelson, 1999).Растительный цитоскелет может играть роль в определении мест контакта между плазматической мембраной и клеточной стенкой, поскольку ясно, что и актин, и тубулин играют существенную роль в морфогенезе растений (Kost et al., 1999). Однако еще предстоит установить, имеют ли клетки покрытосеменных истинные сайты адгезии в том смысле, что на мембране есть места, основная роль которых заключается в закреплении клетки на клеточной стенке.
Если участки адгезии не требуются для поддержания формы клетки, они могут выполнять функцию удержания клетки от вращения внутри каркаса клеточной стенки.В большинстве клеток в этом нет необходимости из-за наличия плазмодесм. Плазмодесмы представляют собой заполненные мембраной каналы, которые соединяют соседние клетки в определенных местах, откладываются во время клеточного деления и действительно могут обеспечивать достаточную структурную силу для фиксации клеток в положении (Crawford and Zambryski, 1999). Если у растений нет сильных участков адгезии, у них могут быть участки более слабого контакта, которые имеют достаточно низкое сродство, чтобы не обнаруживаться в изобилии во время плазмолиза; они могут быть вовлечены в передачу сигналов и синтез клеточной стенки.Это, по-видимому, новый принцип при изучении известных белков, которые находятся как в плазматической мембране, так и в клеточной стенке, как обсуждается ниже.
БЕЛКИ НА ГРАНИЦЕ РАЗДЕЛА
Существует несколько классов белков, определяющих или регулирующих интерфейс клеточной стенки и плазматической мембраны, и они включают AGPs (Oxley and Bacic, 1999; Majewska-Sawka and Nothnagel, 2000), синтазы целлюлозы (Pear et al. ., 1996), гидролитический фермент (Nicol et al., 1998) и WAK (He et al., 1996, 1999; рис. 2). Все эти белки связаны как с плазматической мембраной, так и с внеклеточным углеводом. Другие семейства белков, такие как HRGP (Showalter, 1993), экспансины, которые способствуют ослаблению клеточной стенки во время клеточной экспансии (Cosgrove, 1997), и белки, которые полностью секретируются клеткой полярным или регулируемым во времени образом и которые модифицируют стенку. Cosgrove, 1997) не будут здесь рассматриваться, несмотря на их важность.Рис. 2.
Умозрительное представление белков, которые, как известно, контактируют как с плазматической мембраной, так и с внеклеточным углеводом.Синтаза целлюлозы (CSA) образует розеточный комплекс в мембране и секретирует целлюлозу. Сигналы, которые направляют расширение и рост клеток, влияют на цитоплазматические микротрубочки (МТ, выделенные синим цветом) и микрофибриллы целлюлозы сходным образом, так что они имеют сходную ориентацию. Белок амбиногабактуса (AGP) состоит в основном из углеводов, связанных с меньшим белковым ядром. Некоторые типы AGP (красные завихрения) могут быть обнаружены прикрепленными к мембране через карбоксиконцевой GPI, который может быть расщеплен на поверхности клетки с образованием полностью секретируемой формы.Некоторые AGP секретируются напрямую в отсутствие якоря мембраны (фиолетовый завиток). Было обнаружено, что как связанная с мембраной форма, так и секретируемые AGP ассоциированы с различными компонентами клеточной стенки, и предполагается, что они обеспечивают адгезивные или, возможно, позиционные сигналы. Некоторые ферменты (например, глюканаза, выделенная синим цветом), которые модифицируют или расщепляют углеводы, также связаны с мембраной и могут способствовать модификации матрикса после его отложения. Семейство киназ, ассоциированных с клеточной стенкой (WAK), имеет цитоплазматические домены Ser/Thr киназы и охватывает мембрану, чтобы иметь внеклеточный домен в ECM.Их деятельность связана с развитием, заражением возбудителя и ранением. Небольшая популяция WAK не связана с ECM, но большая часть ковалентно связана с пектином. WAK1 также связан с секретируемым GRP. WAK, связанный как с пектином, так и с GRP, фосфорилирован, что указывает на функциональную взаимосвязь. Эти белки в сочетании с полностью секретируемыми белками, такими как HRGPs, лектиноподобными белками, экспансинами и, вероятно, набором еще не идентифицированных белков, каким-то образом формируют и взаимодействуют с внеклеточным матриксом, чтобы влиять на рост клеток и определять программы развития и реакции на окружающую среду.
Рис. 2.
Умозрительное представление белков, которые, как известно, контактируют как с плазматической мембраной, так и с внеклеточным углеводом. Синтаза целлюлозы (CSA) образует розеточный комплекс в мембране и секретирует целлюлозу. Сигналы, которые направляют расширение и рост клеток, влияют на цитоплазматические микротрубочки (МТ, выделенные синим цветом) и микрофибриллы целлюлозы сходным образом, так что они имеют сходную ориентацию. Белок амбиногабактуса (AGP) состоит в основном из углеводов, связанных с меньшим белковым ядром.Некоторые типы AGP (красные завихрения) могут быть обнаружены прикрепленными к мембране через карбоксиконцевой GPI, который может быть расщеплен на поверхности клетки с образованием полностью секретируемой формы. Некоторые AGP секретируются напрямую в отсутствие якоря мембраны (фиолетовый завиток). Было обнаружено, что как связанная с мембраной форма, так и секретируемые AGP ассоциированы с различными компонентами клеточной стенки, и предполагается, что они обеспечивают адгезивные или, возможно, позиционные сигналы. Некоторые ферменты (например, глюканаза, выделенная синим цветом), которые модифицируют или расщепляют углеводы, также связаны с мембраной и могут способствовать модификации матрикса после его отложения.Семейство киназ, ассоциированных с клеточной стенкой (WAK), имеет цитоплазматические домены Ser/Thr киназы и охватывает мембрану, чтобы иметь внеклеточный домен в ECM. Их деятельность связана с развитием, заражением возбудителя и ранением. Небольшая популяция WAK не связана с ECM, но большая часть ковалентно связана с пектином. WAK1 также связан с секретируемым GRP. WAK, связанный как с пектином, так и с GRP, фосфорилирован, что указывает на функциональную взаимосвязь. Эти белки в сочетании с полностью секретируемыми белками, такими как HRGPs, лектиноподобными белками, экспансинами и, вероятно, набором еще не идентифицированных белков, каким-то образом формируют и взаимодействуют с внеклеточным матриксом, чтобы влиять на рост клеток и определять программы развития и реакции на окружающую среду.
Синтазы целлюлозы
Нельзя игнорировать, что наиболее очевидной связью между плазматической мембраной и клеточной стенкой является фермент, синтезирующий целлюлозу. Синтаза целлюлозы может образовывать розетку из нескольких белковых субъединиц в плазматической мембране и, как полагают, связана с синтазой сахарозы (Susy) на цитоплазматической поверхности плазматической мембраны (Amor et al., 1995; Pear et al., 1996). Ассоциация розетки с Susy может обеспечить перенос глюкозы из сахарозы (через UDP-глюкозу) в растущую цепь целлюлозы.Поскольку ферментный комплекс связан с Susy, это позволяет связать цитоплазматический метаболизм с установлением архитектуры клеточной стенки. Синтаза целлюлозы кодируется большим семейством генов у покрытосеменных, и возможно, что различные кодируемые изоформы имеют различные функции. Нулевая мутация, rsw1, у Arabidopsis связана с одной изоформой синтазы и ведет к уменьшению количества кристаллической целлюлозы и элиминации розеточных структур клеточной поверхности (Arioli et al., 1998). Тем не менее, целлюлоза все еще синтезируется, поэтому вполне вероятно, что розетка участвует в связывании волокон целлюлозы, а другие синтазы все еще могут экструдировать 1-4-связанные полимеры β-d-Glc в отсутствие розетки плазматической мембраны.Вполне возможно, что сама розетка состоит из множества изоформ, представление которых внутри мембраны может быть изменено, чтобы модулировать состав целлюлозы в клеточной стенке. Другие мутации, такие как irx3 (Taylor et al., 1999), описывают гены, подобные целлюлозосинтазе, участвующие в отложении в существующих первичных клеточных стенках (отсюда и образование вторичной стенки), предоставляя больше доказательств того, что семейство генов целлюлозосинтазы кодирует белки с разнообразными функциями, чья исследование может показать, как локализованный синтез на плазматической мембране может контролировать архитектуру стенки.
Мало того, что состав комплекса розетки целлюлозосинтазы может оказывать глубокое влияние на синтез и состав целлюлозного матрикса, но также ясно, что розетка каким-то образом связана с цитоскелетом. Давно замечено, что микротрубочки, выстилающие плазматическую мембрану, и фибриллы целлюлозы расположены поперек направления удлинения клетки. Это привело к широко распространенной идее о том, что розетки следуют за цитоскелетными массивами на цитоплазматической поверхности плазматической мембраны, поскольку розетки перемещаются в мембране во время синтеза целлюлозы (Kost et al., 1999). В подтверждение этого ряд ингибиторов микротрубочек изменяет ориентацию фибрилл целлюлозы. Однако в некоторых сообщениях вместо этого предполагается, что именно процесс, который управляет расширением клеток, определяет ориентацию как микротрубочек, так и фибрилл целлюлозы независимо, но в одном и том же направлении. Генетический анализ, отделяющий удлинение от отложения целлюлозы, поддерживает последнюю модель, хотя существуют разные интерпретации (Baskin et al., 1999; Fisher and Cyr, 1998).Существует потенциал в любом сценарии клеточных процессов, будь то ориентация цитоскелета или механизмы удлинения, влиять на архитектуру клеточной стенки, и этот механизм может основываться на контактах плазматической мембраны с клеточной стенкой. В отличие от многих типов вегетативных клеток, корневые волоски (Kost et al., 1999) и пыльцевые трубки (Yang, 1998) растут за счет удлинения кончика. В этих специализированных клетках ясно, что цитоскелет и активность малых ГТФаз координируются с отложением нового внеклеточного углевода, и будет интересно посмотреть, можно ли распространить парадигмы, полученные из корней и пыльцевых трубок, на другие типы клеток. .
Другие ферменты, связанные с плазматической мембраной
Эндо-1-4-β-d-глюканазы (EGases) гидролизуют β-1,4-связи по незамещенным остаткам глюкозы и кодируются большим семейством покрытосеменных растений. Многие EGases полностью секретируются из клетки для модификации углеводного матрикса. Один класс EGase встроен в плазматическую мембрану, и мутация в одном из них, кодируемом геном Korrigan, нарушает правильную сборку целлюлозно-гемицеллюлозного матрикса и рост клеток в клетках, не растущих на кончике (Nicol et al., 1998). Размещение этой ЭГазы в мембране может обеспечить координацию ее активности со сборкой комплекса целлюлозосинтазы и, возможно, обеспечить прямую связь с клеточной физиологией. Вполне вероятно, что по мере того, как будут анализироваться новые секвенированные геномы и идентифицированы белки, появится ряд связанных с мембраной гидролитических и синтетических ферментов, и наше представление о том, как поверхность клетки действует как организующая поверхность для клеточной стенки, созреет.
АГП
AGP представлены большим семейством генов у различных покрытосеменных растений.AGP сильно гликозилированы в эндомембранной системе, а некоторые содержат сигналы для добавления карбоксиконцевого гликозилфосфатидилинозитолового (GPI) якоря, так что после секреции AGP остаются на плазматической мембране, экспонированной к клеточной стенке (Majewska-Sawka and Nothnagel, 2000; Оксли и Бачич, 1999). До 90% массы отдельного АГП может составлять углевод, который добавляется в эндомембранную систему. Структура обладает большим потенциалом для связывания с компонентами клеточной стенки, и многочисленные сообщения демонстрируют, что AGP очищаются препаратами клеточной стенки (Showalter, 1993; Cosgrove, 1997).Различные члены семейства могут проявляться в тканевых специфических паттернах, что заставляет многих предположить, что AGPs играют решающую роль в росте и развитии растений. Якорь GPI может быть расщеплен на клеточной поверхности (Oxley and Bacic, 1999), как и в дрожжевых клетках, где состав клеточной стенки модулируется ферментативным высвобождением липидно-заякоренных гликопротеинов (Kapteyn et al., 1999). Легко предположить, что AGP могут обратимо связывать углевод клеточной стенки с клеткой.
Реактив Yariv, который специфически связывает углевод AGP, использовался для анализа функции AGP.Реактив Ярива явно оказывает сильное ингибирующее действие на развитие растений (Willats and Knox, 1996), размножение клеток в корнях (Yang, 1998), рост кончиков пыльцевых трубок (Roy et al., 1998) и рост клеток в культуре тканей (Gao and Шоуолтер, 1999). Имеются также доказательства того, что AGP может направлять рост пыльцевых трубок (Wu et al., 1995). Неясно, какова взаимосвязь между заякоренными в липидах AGP и полностью секретируемыми, и какой AGP больше всего подвергается воздействию реагента Ярива. Поскольку разные AGP имеют разный состав и, следовательно, возможно, разную способность связываться со стенками, а также поскольку они экспрессируются в различных клетках, возникает соблазн предположить, что AGP помогают определить расположение клеток (Roberts, 1990; Showalter, 1993; Oxley and Bacic, 1999).Эту модель еще предстоит протестировать, хотя она обеспечивает контекст, в котором клеточная стенка должна рассматриваться как субстрат для определенных в процессе развития клеточных поверхностей.
WAK
У Arabidopsis и представителей других семейств покрытосеменных имеется пять WAK клеток. Каждый WAK имеет цитоплазматический домен протеинкиназы Ser/Thr, охватывает плазматическую мембрану и расширяет домен в клеточную стенку (He et al., 1996, 1999). WAK, как и GPI-заякоренные AGP, физически связывают плазматическую мембрану с углеводным матриксом, но WAK уникальны тем, что они могут напрямую сигнализировать о клеточных событиях через свой киназный домен.Внеклеточный домен WAK варьирует между пятью изоформами, и в совокупности это семейство экспрессируется во всех органах. WAK1 и WAK2 являются наиболее повсеместно и обильно экспрессируемыми из пяти тандемно расположенных генов, и их сообщения присутствуют в вегетативных меристемах, соединениях типов органов и областях экспансии клеток. Они также индуцируются патогенной инфекцией и ранением (Wagner et al., 1999).
Мутации в WAK демонстрируют, что они необходимы для развития растений и необходимы во время реакции патогенов (He et al., 1998,1999; Wagner et al., 1999) Домен клеточной стенки WAK1, но не WAK2, связывается с GRP клеточной стенки в анализах in vitro. WAK1 и GRP могут быть совместно иммунопреципитированы из экстрактов листьев или проростков, и этот WAK фосфорилирован (AR Park, U. Yun, SK Cho, YS Kim, MY Jin, SH Lee, B. Oh, G. Sachetto-Martins, BD Kohorn и OK Park, неопубликованные данные). Большое количество WAK также ковалентно связано с пектином, и большая часть WAK, которая связана с пектином, также фосфорилирована. Существует небольшая популяция WAK, которая не связана с пектином или каким-либо углеводом клеточной стенки, и ее можно экстрагировать детергентом.Данные подтверждают модель, в которой WAK1 связывается с GRP как фосфорилированная киназа, а затем связывается с пектином (Fig. 2). То, как WAK участвуют в передаче сигналов от пектинового матрикса в координации с GRPs, будет ключом к нашему пониманию роли клеточной стенки в расширении и развитии клеток.
Metazoan-подобные рецепторы ECM?
Попытки идентифицировать многоклеточные рецепторы плазматической мембраны ECM не дали убедительных доказательств того, что эти молекулы существуют у покрытосеменных растений.Интегрины связывают мотив белка RGD фибронектина, который связан с ECM многоклеточных животных (Bissell and Nelson, 1999). Ряд исследований идентифицировал активность связывания RGD в плазматической мембране покрытосеменных растений, но ни одно из них не предоставило доказательств наличия белков с аминокислотным сходством с интегринами (Canut et al., 1998; Laval et al., 1999). Антисыворотка к ряду многоклеточных белков, которые, как известно, связывают внеклеточный матрикс с клеткой, идентифицировала перекрестно-реактивный материал у покрытосеменных (для обзора см. Canut et al., 1998). Однако сообщения, которые идентифицируют эти белки или описывают их гены, демонстрируют, что идентифицированные растительные эпитопы не присутствуют в белках, участвующих во внеклеточных связях (Wang et al., 1996). Это может быть неудивительно, учитывая различия в углеводах между двумя царствами, и более вероятное сходство можно искать в цитоплазматических доменах рецепторов ECM, где клеточные процессы имеют большую вероятность сохранения.
РАЗВИВАЮЩИЕСЯ СОЕДИНЕНИЯ
Объем наших знаний о границе между плазматической мембраной и клеточной стенкой явно увеличивается с большой скоростью.С появлением все большего количества примеров белков, которые, по-видимому, находятся в плазматической мембране и прямо или косвенно контактируют с внеклеточным углеводом, интерфейс становится более сложным. Этот обзор сконцентрирован только на тех компонентах, присутствие которых в плазматической мембране и клеточной стенке было четко продемонстрировано, но при этом были проигнорированы некоторые чрезвычайно важные области, которые, возможно, вскоре потребуется включить. Например, можно предсказать, что контакты мембрана-клеточная стенка будут важны в формировании, регуляции времени и ориентации клеточной пластинки во время клеточного деления.Некоторые из упомянутых здесь белков могут быть вовлечены в этот процесс, и генетический анализ клеточного деления (Kost et al., 1999) позволит идентифицировать дополнительные компоненты, которые могут лежать на границе раздела стенки и плазматической мембраны. Изучение роста пыльцевых трубок может также дать представление о связях клеточной стенки и мембраны.
ЛТП
Пыльцевые трубки прикрепляются к внеклеточным матриксам стилуса у лилий с помощью белков, которые имеют сходство последовательности с белками-переносчиками липидов растений (LTP; Park et al., 2000). Название этих пептидов вводит в заблуждение, поскольку LTP растений, вероятно, не участвуют в переносе липидов так, как LTP животных. Адгезия, опосредованная ЛТБ у лилий, требует для своей активности большого углевода, который также содержится в внеклеточном матриксе столбика, и будет важно определить, связывается ли этот комплекс ЛТБ с плазматической мембраной или компонентами стенок пыльцевой трубки, чтобы сигнализировать цитоплазме о соответствующей адгезии. событие. Растительные LTP кодируются разнообразным семейством генов, которые экспрессируются в различных тканях и, таким образом, могут определять пространственно различные субстраты для других типов клеток.
Другие кандидаты
Существует множество других белков клеточной стенки, которые также обладают большим потенциалом для обеспечения взаимодействия с мембраной, но пока нет четких доказательств, подтверждающих это. Они включают разнообразное семейство HRGPs (Showalter, 1993) и кДНК, которые предсказывают связанные с мембраной лектин-связывающие белки (Herve et al., 1999). Многие считают, что эти белки важны для аспектов развития.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
В этом обзоре клеточная стенка была разделена на два компонента; крупные структурные углеводные комплексы и регуляторные белки.Хотя это разделение помогло в организации, эта классификация может быть слишком жесткой, поскольку мы слишком мало знаем, чтобы провести четкое различие между структурными и регулирующими компонентами. Действительно, некоторые более мелкие углеводы участвуют в передаче сигналов (Cosgrove, 1997), а секретируемые белки могут образовывать структурные внеклеточные матриксы (Keller, 1993). Тем не менее ясно, что матрикс целлюлоза/гемицеллюлоза/пектин не только обеспечивает структурную целостность, но также служит субстратом для клеток, чтобы маркировать свое местоположение и идентичность посредством взаимодействия с белками.
В этом эссе выделены AGP, WAK и целлюлозосинтаза, поскольку известно, что эти белки напрямую контактируют с липидным бислоем и углеводным комплексом. Есть предположение, что AGP и, возможно, WAK определяют местоположение и архитектуру сигнальных клеточных стенок. Наряду с синтазой целлюлозы их регулируемая и специфическая ассоциация с углеводной матрицей может также придавать генерализованное низкоаффинное связывание, которое в сочетании с тургором фиксирует клетку в положении.
Мы знаем лишь о нескольких контактах клеточной стенки с мембраной, как описано здесь, но, вероятно, их еще предстоит обнаружить.Из тех, что были определены, таких как WAKs и AGPs, еще предстоит определить, как эти молекулы, среди прочих, достигают взаимодействия, которое определяет форму, размер и форму клетки.
Хотя некоторые взаимодействия между стенкой и клеткой могут быть динамическими, существует обширный резервуар внеклеточных белков и углеводов, которые перекрестно связаны в нерастворимый, биохимически не поддающийся обработке матрикс (Cosgrove, 1997). Весьма вероятно, что эта матрица выполняет структурную роль, и ее целостность может регулироваться как с точки зрения развития, так и с точки зрения окружающей среды.Действительно, патогены и ранения могут вызывать обширные поперечные связи между углеводами и белками в этой матрице. Комплексы, которые выделяют активные формы кислорода во внеклеточном пространстве, вероятно, ответственны за некоторые наблюдаемые перекрестные связи, и понимание того, как регулируются эти белки, может быть ключом к определению того, как клетки модулируют свою внешнюю среду. Но следует также задаться вопросом о взаимосвязи между этим обширным перекрестно-сшитым материалом и мембранными белками, такими как AGP, WAK и синтаза целлюлозы, которые в определенные моменты времени динамически взаимодействуют с клеточной стенкой.Хотя эта взаимосвязь не ясна, возможно, что компоненты, активные на поверхности раздела мембрана-стенка во время клеточной экспансии, вполне могут утратить свою первоначальную функцию после того, как будет синтезирована первичная стенка, и будут перенесены на сшитое внеклеточное кладбище, чтобы служить структурными элементами. системы, непрерывной в пределах данного органа растения. В этом смысле белки на поверхности раздела стенка-мембрана могут выполнять две функции, сначала в коммуникации, а затем в структурной и, возможно, менее специфической роли.
Наконец, важно включить в нашу концепцию клеточной стенки механическую силу, которую она обеспечивает. Ряд исследований демонстрирует, что векторы силы, генерируемые стенкой, играют роль в определении развития и судьбы клеток (Lynch and Lintilhac, 1997). Передаются ли эти сигналы непосредственно на цитоскелет или через рецепторы клеточной поверхности, еще предстоит установить.
Вполне вероятно, что в ближайшие несколько лет небольшое пространство, отделяющее плазматическую мембрану от углеводного матрикса, будет заполнено дополнительными интересными молекулами, взаимодействие которых ответит на некоторые из вопросов, поднятых в этом эссе.
БЛАГОДАРНОСТЬ
Я хотел бы поблагодарить Кэти Андерсон и Таню Вагнер за обсуждение, которое привело к этому обзору. Бетти Лорд, Джим Сидоу и Тай-Пинг Сун были конструктивны и полезны при чтении рукописи.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1Ассоциированная с мембраной форма сахарозосинтазы и ее потенциальная роль в синтезе целлюлозы и каллозы в растениях.
Proc Natl Acad Sci USA
92
1995
9353
9357
2Молекулярный анализ биосинтеза целлюлозы у арабидопсиса.
Наука
279
1998
717
720
3Регулирование анизотропии роста хорошо орошаемых и подверженных водному стрессу корнеплодов кукурузы: II.Роль кортикальных микротрубочек и микрофибрилл целлюлозы.
Завод Физиол
119
1999
681
692
4Межклеточный контакт и внеклеточный матрикс. Интеграция формы и функции: центральная роль молекул адгезии.
Curr Opin Cell Biol
11
1999
523
640
5Высокоаффинные сайты связывания RGD на плазматической мембране Arabidopsis thaliana связывают клеточную стенку.
Завод J
16
1998
63
71
6Структурные модели первичных клеточных стенок цветковых растений: соответствие молекулярной структуры физическим свойствам стенок во время роста.
Завод J
3
1993
1
30
7Сборка и увеличение первичной клеточной стенки у растений.
Annu Rev Cell Dev Biol
13
1997
171
201
8Сигнализация Plasmodesmata: множество ролей, сложные законы.
Curr Opin Plant Biol
2
1999
382
387
9Расширение парадигмы микротрубочек/микрофибрилл: синтез целлюлозы необходим для нормального выравнивания кортикальных микротрубочек в удлиняющихся клетках.
Завод Физиол
116
1998
1043
1051
10Передача сигналов CLAVATA3 о решениях клеточных судеб в меристемах побегов арабидопсиса.
Наука
283
1999
1911
1914
11Обработка реагентом Ярив вызывает запрограммированную гибель клеток в клеточных культурах арабидопсиса и вовлекает белок арабиногалактан.
Завод J
19
1999
321
331
12Кластер из пяти генов рецепторных киназ, ассоциированных с клеточной стенкой, Wak1–5, экспрессируется в определенных органах арабидопсиса.
Растение Мол Биол
39
1999
1189
1196
13Ассоциированная с клеточной стенкой рецептороподобная протеинкиназа.
J Биол Хим
271
1996
19789
19793
14Требование индуцированной экспрессии рецепторной киназы, ассоциированной с клеточной стенкой, для выживания во время ответа патогена.
Завод J
14
1998
55
63
15Характеристика генов lecRK-a арабидопсиса: члены суперсемейства, кодирующие предполагаемые рецепторы с внеклеточным доменом, гомологичным лектинам бобовых.
Растение Мол Биол
39
1999
671
682
16Вклад белков клеточной стенки в организацию клеточной стенки дрожжей.
Биохим Биофиз Акта
1426
1999
373
383
17Структурные белки клеточной стенки.
Завод Физиол
101
1993
1127
1130
18Использование антител для изучения архитектуры и регуляции развития клеточных стенок растений.
Int Rev Cytol
171
1997
79
120
19Перетасовка колоды: завод сигнальщиков играет трефой.
Trends Cell Biol
10
1999
381
383
20Цитоскелет в развитии растений.
Curr Opin Plant Biol
2
1999
462
470
21Семейство рецепторов плазматической мембраны арабидопсиса, содержащих домены бета-интегрина животных.
Биохим Биофиз Акта
1435
1999
61
70
22Механические сигналы в развитии растений: новый метод исследования отдельных клеток.
Дев Биол
181
1997
246
256
23Многочисленные роли белков арабиногалактана в развитии растений.
Завод Физиол
122
2000
3
9
24Связанная с плазматической мембраной предполагаемая эндо-1,4-β-d-глюканаза необходима для нормальной сборки стенок и удлинения клеток арабидопсиса.
ЭМБО J
17
1998
5563
5576
25Структура гликозилфосфатидилинозитолового якоря арабиногалактанового белка из клеток Pyrus communis , культивируемых в суспензии.
Proc Natl Acad Sci USA
25
1999
14246
14251
26Белок, подобный переносчику липидов, необходим для адгезии пыльцевых трубок лилий к матриксу стиляра in vitro.
Растительная клетка
12
2000
151
164
27Высшие растения содержат гомологи бактериальных генов celA, кодирующих каталитическую субъединицу синтазы целлюлозы.
Proc Natl Acad Sci USA
93
1996
12637
12642
28Структура, синтез и функция клеточной стенки растений.
Арабидопсис.
1994
955
988
Лабораторный пресс Колд-Спринг-Харбор
Колд-Спринг-Харбор, Нью-Йорк
29Структуры на поверхности растительных клеток.
Curr Opin Cell Biol
2
1990
920
928
30Дифференциальная экстракция и секвенирование белков выявили основные различия в структурах белков первичной клеточной стенки растений.
J Биол Хим
272
1997
15841
15848
31Roy S, Jauh GY, Hepler PK, Lord EM (1998) Влияние фенилгликозида Yariv на сборку клеточной стенки в пыльцевой трубке лилии. 4: 450–458
32Мужской детерминант самонесовместимости в Brassica .
Наука
286
1999
1697
1700
33Структура и функция белков клеточной стенки растений.
Растительная клетка
5
1993
9
23
34Нерегулярный локус xylem3 арабидопсиса кодирует синтазу целлюлозы, необходимую для синтеза вторичной клеточной стенки.
Растительная клетка
11
1999
769
780
35Киназа, подобная рецептору CLAVATA1, требует CLAVATA3 для сборки в сигнальный комплекс, который включает KAPP и родственный Rho белок.
Растительная клетка
11
1999
393
406
36Пристеночные рецепторные киназы: динамика ECM растений.
Инст Хуан Марч де Эстудиос и Инвест
101
1999
17
18
37Независимая от кофактора Lily фосфоглицератмутаза: очистка, частичное секвенирование и иммунолокализация.
Планта
200
1996
343
352
38Влияние экспрессии гена пектинметилэстеразы на развитие корня гороха.
Растительная клетка
6
1999
1129
1140
39Роль арабиногалактана-белков в размножении растительных клеток: данные исследований взаимодействия реагента бета-глюкозила Ярива с проростками Arabidopsis thaliana .
Завод J
9
1996
919
925
40Гликопротеин, стимулирующий рост пыльцевых трубок, дегликозилируется пыльцевыми трубками и демонстрирует градиент гликозилирования в цветке.
Сотовый
82
1995
395
403
41Сигнализация роста кончиков растений.
Curr Opin Plant Biol
6
1998
525
530
Примечания автора
Copyright © 2000 Американское общество физиологов растений
Эта статья публикуется и распространяется на условиях издательства Оксфордского университета, модель публикации стандартных журналов (https://academic.

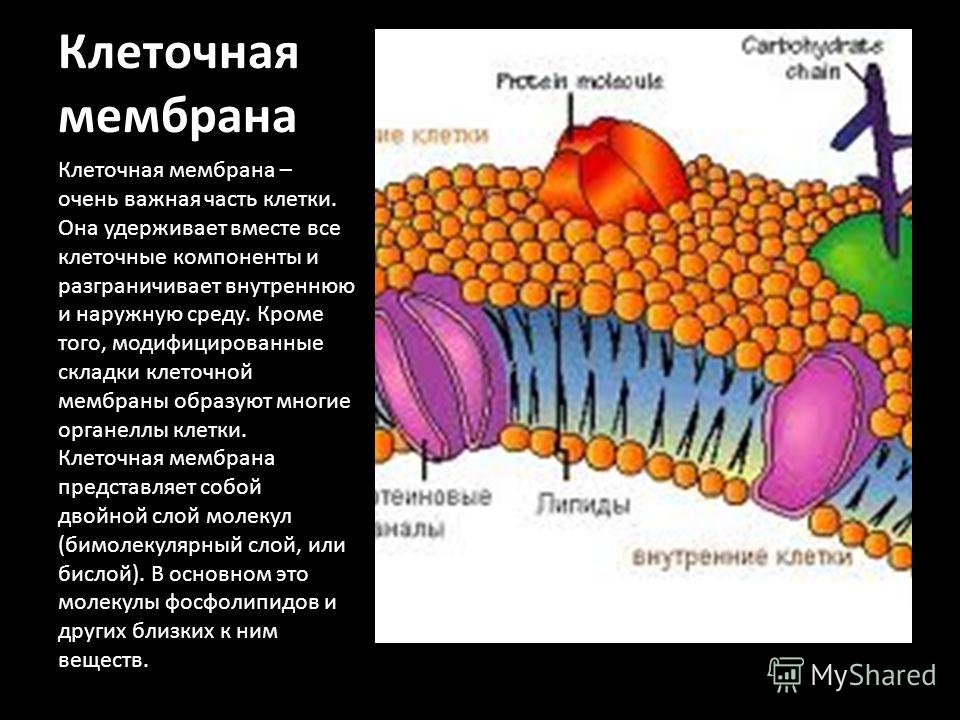
 Эти белки фиксируются в мембране за счет специальной молекулы, в качестве которой могут выступать жирная кислота (ЖК), стерин, изопреноид или фосфатидилинозитол. Белки, связанные с изопреноидами (пренилированные белки) или жирной кислотой, обратимо соединяются с эндоплазматической (внутренней) поверхностью мембраны. Из жирных кислот чаще используется миристиновая (С14) или пальмитиновая (C16). В первом случае образуется амидная связь с терминальной аминогруппой глицина. К остаткам пальмитиновой кислоты белки присоединяются за счет тиоэфирных связей с цистеинами в С-конце полипептидной цепи. Для пренилирования белков обычно используется фарнезил или геранилгеранил, которые также присоединяются к остаткам цистеина в карбоксильном конце полипептида. В отличие от этих двух групп белков фосфати-дилинозитолсвязанные белки находятся с внешней (экстрацеллюлярной, или люменальной) стороны мембраны. Подобным образом, по-видимому, связаны с плазматической мембраной большинство арабиногалактановых белков.
Эти белки фиксируются в мембране за счет специальной молекулы, в качестве которой могут выступать жирная кислота (ЖК), стерин, изопреноид или фосфатидилинозитол. Белки, связанные с изопреноидами (пренилированные белки) или жирной кислотой, обратимо соединяются с эндоплазматической (внутренней) поверхностью мембраны. Из жирных кислот чаще используется миристиновая (С14) или пальмитиновая (C16). В первом случае образуется амидная связь с терминальной аминогруппой глицина. К остаткам пальмитиновой кислоты белки присоединяются за счет тиоэфирных связей с цистеинами в С-конце полипептидной цепи. Для пренилирования белков обычно используется фарнезил или геранилгеранил, которые также присоединяются к остаткам цистеина в карбоксильном конце полипептида. В отличие от этих двух групп белков фосфати-дилинозитолсвязанные белки находятся с внешней (экстрацеллюлярной, или люменальной) стороны мембраны. Подобным образом, по-видимому, связаны с плазматической мембраной большинство арабиногалактановых белков.
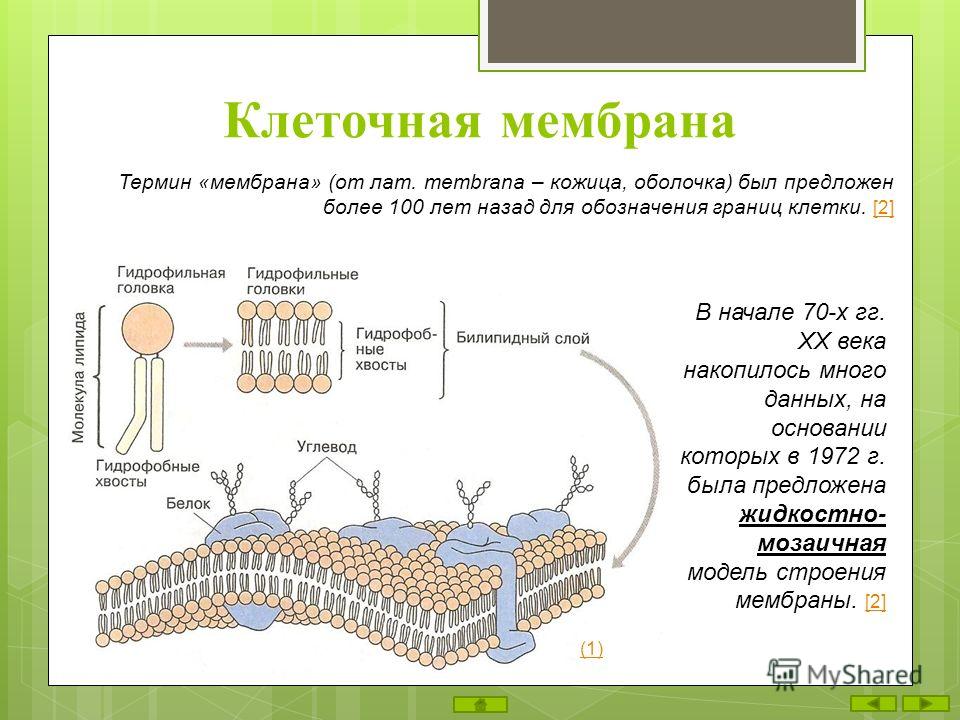


 А. Эйнштейн
А. Эйнштейн